Sirukumab при ревматоидном артрите: Фаза III SIRROUND-D исследование
Август 2017 г Расширенный отчет
Комментарий:
Получены результаты исследования препарата сирукумаб от ревматоидного атрита
Британская фармацевтическая компания ГлаксоСмитКляйн сообщила о том, что ею получены положительные результаты исследовательской программы III Фазы по изучению препарата сирукумаб (sirukumab) для лечения ревматоидного артрита, который разрабатывается в партнерстве с компанией Янссен Биолоджикс (Janssen Biologics), Ирландия.
Препарат сирукумаб является человеческим моноклональным антителом, которое блокируют интерлейкин (IL)-6 и предназначено для лечения пациентов с умеренной и тяжелой формой активного ревматоидного артрита. В рамках исследований у пациентов не было отмечено неожиданных проблем по безопасности использования препарата, связанных с эффектами применения ингибиторов IL-6. В настоящее время данные по безопасности и эффективности долгосрочного применения сирукумаба оцениваются в продленной стадии исследований III Фазы.
Ожидается, что регуляторные заявки на регистрацию препарата сирукумаба для лечения ревматоидного артрита будут поданы в 2016 году. Полные результаты трех базовых клинических испытаний будут представлены на предстоящих научных конференциях и переданы для публикации в рецензируемых научных изданиях. На данный момент ни в одной из стран препарат сирукумаб не утвержден в качестве лекарственного средства по какому-либо из показаний.
В рамках глобальной клинической программы III Фазы среди пациентов с активным ревматоидным артритом было проведено пять исследований. В этих испытаниях изучалось применение препарата сирукумаб в дозировке 50 мг и 100 мг, вводимого подкожно, в комбинации с традиционными базисными препаратами для лечения ревматоидного артрита или в качестве средства монотерапии один раз в четыре или две недели, соответственно. В число указанных исследований входят испытание SIRROUND-M с участием пациентов из Японии, у которых нет ответа на лечение метотрексатом (methotrexate) или сульфасалазином (sulfasalazine); испытание SIRROUND-D, проведенное среди пациентов, у которых нет ответа на лечение базисными препаратами; в исследовании SIRROUND-H монотерапия сирукумабом сравнилась с применением адалимумаба (adalimumab) у пациентов, которые еще не получали биологические препараты и у них отмечено отсутствие ответа на лечение базисными средствами; пациенты без ответа на лечение анти-ФНО средствами и другими биосредствами участвовали в исследовании SIRROUND-T. Испытание SIRROUND-LTE является продленной фазой для SIRROUND-D и SIRROUND-T.
Консультативный комитет при Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) почти единодушно проголосовал ПРОТИВ утверждения препарата «Пливенсиа» (Plivensia, сирукумаб) для терапии ревматоидного артрита.
А ведь сирукумаб считался одним из наиболее перспективных препаратов для лечения ревматоидного артрита…
Эффективность «Пливенсиа» для ведения умеренной степени и тяжелого ревматоидного артрита под сомнение никем не ставится. Если бы лекарство было прорывным, тогда, не исключено, что эксперты его отрекомендовали бы. Но на рынке уже есть два блокатора интерлейкина-6 (пусть даже с несколько иным механизмом действия): «Кевзара» (Kevzara, сарилумаб) и «Актемра» (Actemra, тоцилизумаб), продвигаемые «Санофи» (Sanofi)/» Реджинерон фармасьютикалс» (Regeneron Pharmaceuticals) и «Рош» (Roche)/» Шугай фармасьютикал» (Chugai Pharmaceutical). Вот почему специалисты не взяли на себя риски рекомендовать потенциально небезопасный препарат.Негативное отношение к этому экспериментальному препарату связано с профилем его безопасности: из 35 смертельных случаев 34 пришлось на пациентов в группе препарата. Летальность проистекает из-за иммуносупрессивного эффекта сирукумаба: ослабление иммунной системы приводит к развитию сердечно-сосудистых осложнений и серьезных инфекций.
Авторы:
Tsutomu Takeuchi1, Carter Thorne2, George Karpouzas3, Shihong Sheng4, Weichun Xu4, Ravi Rao5, Kaiyin Fei4, Benjamin Hsu4, Paul P Tak6
Медицинские учреждения:
1Division of Rheumatology, Keio University School of Medicine, Tokyo, Japan
2University of Toronto and Southlake Regional Health Centre, Newmarket, Canada
3Division of Rheumatology, Harbor-UCLA Medical Center, Torrance, California, USA
4Janssen Research & Development, Spring House, Pennsylvania, USA
5GSK Medicines Research Centre, Hertfordshire, UK
6GlaxoSmithKline Research and Development, Stevenage, Hertfordshire, UK
Для связи: Correspondence to Dr Paul P Tak, GlaxoSmithKline Research and Development, Stevenage SG1 2NY, UK; Paul-peter.x.tak@gsk.com
Аннотация
Цели Интерлейкин-6 (IL-6) включен в патофизиологию ревматоидного артрита (РА). В отличие от ингибиторов рецепторов ИЛ-6 sirukumab является человеческим моноклональным антителом, селективно связывается с цитокинов ИЛ-6. Фаза III, мультицентровое рандомизированное, двойное слепое, плацебо контролируемые, параллель группа SIRROUND-D исследование (ClinicalTrials.gov идентификатор
NCT01604343) оценить эффективность и безопасность sirukumab в больных с активной РА рефрактерным к Болезнь модифицирующие противоревматические препараты.
Методы Пациенты были рандомизированные 1:1:1 до лечения с sirukumab 100 мг каждые 2 недели, 50 мг каждые 4 недели или плацебо каждые 2 недели подкожно. Результаты подводились через 52 недели.
Результаты Из 1670 рандомизированных пациентов, значительно больше пациентов достигли американского колледжа ревматологии 20% (ACR20) ответ к неделе 16 (coprimary(ко-первичная) точка ) с sirukumab 100 мг каждые 2 недели (53,5%) или 50 мг каждые 4 недели (54,8%), по сравнению с плацебо (26,4%; оба p < 0,001). Изменения означают (SD) от базовой линии в модифицированных Sharp/ван дер Хейде Оценка на неделе 52 (coprimary конечной точки) был значительно ниже, с sirukumab (100 мг каждые 2 недели: 0.46 (3.26); 50 мг каждые 4 недели: 0.50 (2,96)) по сравнению с плацебо (3.69 (9,25); оба p <0,001). Все основные вторичные конечных точек (неделя 24 вопросника – инвалидности индекс здоровья оценки изменения от базовой линии, ACR50 ответ, 28-совместная оценка активности болезни на основе C-реактивного белка и основных клинической реакции (ACR70 (Health Assessment Questionnaire–Disability Index change from baseline, ACR50 response, 28-joint Disease Activity Score based on C reactive protein and major clinical response (ACR70) для шести месяцев непрерывной неделю 52)) были выполнены. Наиболее распространенными неблагоприятные события с sirukumab были повышенные ферменты печени, инфекции верхних дыхательных путей, эритема на месте инъекции и назофарингит.
Выводы Sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели привели к значительным сокращениям РА симптомы, ингибирование структурные повреждения прогрессии и физические функции и качества жизни улучшений, с профилем ожидаемой безопасности.
Это статья открытого доступа, распределяются в соответствии с Creative Commons Attribution некоммерческого (CC BY-NC 4.0), которая позволяет другим распространять, адаптировать, ремикс, а также опираться на эту работу не коммерчески, лицензий и их производные работы на различные термины, предоставили оригинальные работы должным образом цитируется и использования некоммерческих. См.:
http://creativecommons.org/licenses/by-nc/4.0/http://DX.DOI.org/10.1136/annrheumdis-2017-211328
Введение
Пациентов с ревматоидным артритом (РА) часто имеют повышенный уровень интерлейкина -6 (IL) в сыворотке и синовиальной полости, где ее уровни связаны с локальной активностью заболевания. При РА синовиальной оболочка, оба- фактор некроза опухоли (ФНО) и IL-1, может стимулировать производство ИЛ-6, несколькими типами клеток. Локальная концентрация ИЛ-6 может стимулировать привлечение лейкоцитов в сустав, содействовать созревания остеокластов и активации, подавить хондроцитов и стимулировать синовиальной распространения, суммарно внося вклад в повреждения суставов. Системно, повышенные уровни IL-6 в больных с РА может вызвать печеночное производство белков острой фазы и вероятно увеличение hepcidin и развитие анемии хронического воспаления. Повышенных ИЛ-6 также может нести ответственность за аутоиммунные возможности в РА, такие как аутореактивная активация Т-клеток и hypergammaglobulinaemia. поэтому, Ил-6 является привлекательной мишенью для лечения РА.
У больных с активной РА и неадекватной реакции на Болезнь модифицирующие противоревматические препарат (DMARD) терапии, ингибирование рецептора ИЛ-6 с моноклональных антител ((mAb) tocilizumab сокращение совместных отек и болезненность, улучшение физической функции и уменьшена скорость радиографический прогрессирования. Еще один антиИЛ-6 рецепторов mAb, sarilumab, продемонстрировали аналогичные эффективность у пациентов с РА и неадекватной реакции на метотрексата (MTX). Хотя клиническое значение другого механизма таргетирования ИЛ-6 пути не поняты, sirukumab является человеческим mAb, который селективно связывается цитокинов ИЛ-6 с высоким сродством. Sirukumab было показано, значительно улучшить признаки и симптомы (например, американского колледжа ревматологии 20% (ACR20) ответ на 16 неделе), функциональность и качество жизни по сравнению с плацебо в популяции трудных для лечения РА пациентов рефрактерных для анти ФНО и другие биопрепараты. Два других антител к IL-6, clazakizumab и olokizumab, продемонстрировали активность в стадии II исследования больных РА с неадекватной реакции на MTX или неспособность анти ФНО терапии, соответственно. SIRROUND-D исследование (ClinicalTrials.gov идентификатор
NCT01604343) был призван оценить эффективность и безопасность подкожной (SC) sirukumab в больных с активной РА несмотря на DMARD терапию более 52 недель.
Методы
Пациенты
Пациенты из 18 стран (США, Канада, Мексика, Колумбия, Чили, Южная Африка, Литва, Польша, Россия, Украина, Сербия, Хорватия, Болгария, Румыния, Япония, Южная Корея, Тайвань и Малайзия) были зачислены и контроль между июля 2012 года и сентябрь 2015. Отвечающие требованиям пациенты были лет возрасте ≥18, имели от умеренной до высокой активности РА и были рефрактерны для моно- или комбинированная терапия DMARD, включая MTX или сульфасалазин, на основании отсутствия эффекта после ≥12 недель. Пациенты имели ≥6/68 болезненных суставов и припухших суставов ≥6/66 при скрининге и исходных данных; C-реактивный белок (СРБ) ≥8.0 мг/Л; и ≥1 следующих трех критериев, чтобы быть выполнены до начала лечения: () anticitrullinated пептида антитела позитивные (измеряется anticyclic citrullinated тест на антитела пептида) при скрининге; (B) ревматоидный фактор положительный в скрининга; или (C) документально истории рентгенологические доказательства эрозивный РА рук или ног. Больных с использованием небиологических DMARDs должны были иметь стабильную дозу ≥4 недель до получения изучаемых лекарств. Пациенты, не регулярно использующих DMARDs не должны получать DMARDs ≥4 недель до получения исследуемых лекарств. Пациентов, которые ранее лечились биопрепаратами так же допускались, если они не провалили терапию анти ФНО или tocilizumab по безопасности или по причинам эффективности и не получали биологических препаратов в течение последних 3 месяцев (6 недель для этанерцепт или yisaipu и 4 недели Анакинра). Пациентов с анамнезом или текущими серьезные инфекции (включая туберкулез), были исключены.
Дизайн исследования
Этот глобальный, этап III, многоцентровое, рандомизированное, двойное слепое, плацебо контролируемое, параллельно Группа исследования рандомизированных пациентов 1:1:1 в неделю 0 sirukumab 100 мг SC каждые 2 недели, sirukumab 50 мг SC каждые 4 недели или плацебо SC каждые 2 недели (см. онлайн
дополнительная цифра S1). Эти дозы были ранее изучались в фазе IIb исследования подбора начальной дозы. Больных были стратифицированы по базовой MTX использования (не принимали, до 12,5 мг/неделю или ≥12.5 мг/неделю). Пациенты на плацебо демонстрации <улучшение 20% от базовой линии в припухших и болезненность суставного счета к 18 недели (ранний выход early escape (EE)) или к 40 недели (поздний выход late escape (LE)), или еще остающихся на исследование лечения к 52 неделе (перешедшие crossover ), были рандомизированы 1:1 для получения слепого лечения одной или двумя дозами sirukumab до 104 недели. 16-недельный этап безопасности последовал после окончательной дозы, делая общее исследование продолжительность 120 недель, за исключением периода отбора до 6 недель. Протокол исследования был одобрен соответствующего ведомственным обзором или этики комитетов, и все пациенты дал письменное информированное согласие. Данные были собраны исследователями и проанализированы спонсором исследования.
Оценки
Все анализы были предварительно, если не указано иное; в резюме населения и эффективности анализа были включены все рандомизированные пациенты, и всех пациентов, получавшие ≥1 дозы исследуемого агента, были включены в анализ безопасности. Конечные точки ко первичной эффективности была доля пациентов, которые достигли ACR20 ответ на 16 неделе и изменения от базовой линии в модифицированных Sharp/van der Heijde score (SHS) счет (SHS) к 52 недели. Рентгенограммы, руки и ноги были выполнены в начале, неделя 18 (для пациентов, отвечающих критериям EE), неделя 24 (для пациентов, которые не отвечают критериям EE) и к 52 недели. Основные вторичные конечные точки включены изменения от исходной линии по вопросник – in Health Assessment Questionnaire–Disability Index (HAQ-DI) score показатель на неделе 24, доля пациентов, достижения ACR50 ответ на неделю 24, доля пациентов с заболеванием 28-joint Disease Activity Score based on CRP (DAS28 (CRP)) < 2.6 на неделю 24 и доля пациентов, достижение основных клинического ответа (определяется как ACR70 ответ для шести непрерывной месяцев) 52 недели. Дополнительные конечные точки включали суммарный физическое самочувствие physical component summary (PCS) и суммарного психическое mental component summary (MCS) сообщил пациенты по 36-item Short Form survey (SF-36) и пропорции больных достижения клинического заболевания активности индексу clinical disease activity index (CDAI) низкая болезни активности ( ≤10.0) на неделю 24 и CDAI ремиссии (≤2.8) на 24 и 52 недель (анализ деятельности CDAI низкой болезни и ремиссии были post hoc). Со временем также оценивались эффективность конечные точки. Безопасность оценки включали мониторинг побочных эффектов (AEs), стандартных клинических лабораторных тестов, жизненно важные признаки и физикальные осмотры. Образцы сыворотки были проанализированы на антитела к sirukumab, с помощью метода иммуноферментного анализа на платформе Meso Scale Discovery.
Статистические методы
Подборка размером 550 пациентов в группе лечения будет обеспечивать около 98-99% достоверности, чтобы обнаружить лечения разницу из 11 – 17% доли пациентов, которые достигли ACR20 ответ на 16 неделе и около 98% достоверности, чтобы обнаружить разницу лечения 1.0 при отклонении от базовых SHS на 52 недели.
Конечные точки эффективность coprimary были протестированы в следующих предопределенных порядке: (1) sirukumab 100 мг каждые две недели по сравнению с плацебо к 16 неделю ACR20 ответ; (2) sirukumab 100 мг каждые две недели по сравнению с плацебо к52 неделю SHS отклонение от базовой линии; (3) sirukumab 50 мг каждые 4 недели по сравнению с плацебо к 16неделю ACR20 ответ; (4) sirukumab 50 мг каждые 4 недели по сравнению с плацебо к 52 неделю SHS отклонения от базовой линии. Если данный сравнение не было значимым при α = 0,05 (двухсторонний), остальные группы сравнения лечения были следует рассматривать как поддержку анализа. За неделю 16 ACR20, Cochran-Mantel-Haenszel тесты стратифицированная по базовой использование MTX (нет, до 12,5 или ≥12.5 мг/неделю) были использованы для сравнений лечения. Последнее наблюдение переносятся что метод использовался для исчисления недостающие компоненты ACR, если пациент имел данных для компонента ≥1 ACR к 16 неделе. Пациенты были рассмотрены как ACR20 не ответчиков, если они не имеют данных по любому компонента ACR на 16 неделе или если они имели любого из следующих критериев недостаточности лечение к недели 16: начато лечение DMARDs, системных иммуносупрессоры или Биопрепараты для РА; увеличение их доза MTX; начало или увеличение оральных кортикостероидов лечение или полученных внутривенное или внутримышечное введение кортикостероидов для РА; или прекращено агентом исследования. К неделе 52 SHS изменить базовый анализ дисперсионный анализ тестов, стратифицированная по базовым показателям, усилителем MTX использовать на обычной оценки van der Waerden были использованы для сравнения лечения. Отсутствующие значения SHS на 52 недели были условно по линейной экстраполяции значений не хватает до 52 недели. Для пациентов, которые отвечают критериям EE в группе плацебо лечения SHS значение на 52 недели был заменен оценочной стоимости от линейной экстраполяции-недостающие значения перед выходом.
Результаты
Пациенты
В целом 1670 пациентов были рандомизированы на 185 площадок , ведении ≥1 дозы исследования агента и включены в эффективности (не радиографический) и анализа безопасности (
рис. 1). Радиографические эффективность анализа включены 1654 больных без потери исходных SHS. Демографические и базовые характеристики были в целом сбалансированный во всех группах лечения (
Таблица 1). Следует отметить, 583 (34,9%) пациентов, зачисленных ранее полученных ≥1 биологической терапии (Смотри онлайн
Дополнительная таблица S1).
Рисунок 1
Распределение пациентов через 52 недели. EE, ранние выход; LE, поздний выход; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели. A включает в себя плацебо пациентам выход (EE/LE) для sirukumab 50 мг q4w или 100 мг q2w.
 Таблица 1
Таблица 1
Демографические и базовые характеристики
| Характеристика |
Плацебо
(n = 556) |
Sirukumab |
Всего
(n = 1670) |
| 50 мг q4w
(n = 557) |
100 мг q2w
(n = 557) |
| Женского пола, n (%) |
436 (78,4) |
447 (80,3) |
452 (81,1) |
1335 (79,9) |
| Возраст, лет |
52,9 (11,9) |
52,9 (11,8) |
53,0 (11,3) |
52,9 (11,7) |
| Раса, n (%) |
| Белый |
403 (72,5) |
397 (71,3) |
408 (73.2) |
1208 (72.3) |
| Азиаты |
88 (15,8) |
89 (16,0) |
95 (17,1) |
272 (16,3) |
| Черный или афроамериканцы |
16 (2.9) |
15 (2.7) |
10 (1,8) |
41 (2.5) |
| Американских индейцев или Аляски |
6 (1.1) |
4 (0,7) |
4 (0,7) |
14 (0,8) |
| Другие * |
39 (7.0) |
49 (8,8) |
38 (6,8) |
126 (7.5) |
| Не сообщили/неизвестные |
4 (0,7) |
3 (0,5) |
2 (0,4) |
9 (0,5) |
| Регион, n (%) |
| Восточная Европа |
271 (48,7) |
263 (47,2) |
273 (49,0) |
807 (48,3) |
| Северная Америка |
85 (15,3) |
96 (17,2) |
91 (16,3) |
272 (16,3) |
| Азиатско-Тихоокеанского региона |
87 (15,6) |
89 (16,0) |
91 (16,3) |
267 (16,0) |
| Латинская Америка |
73 (13,1) |
75 (13,5) |
76 (13,6) |
224 (13,4) |
| Южная Африка |
40 (7,2) |
34 (6.1) |
26 (4,7) |
100 (6.0) |
| Вес, кг |
72,7 (17,4) |
72,3 (18,6) |
71,6 (17,1) |
72.2 (17,7) |
| Продолжительность болезни, лет |
8.3 (7.0) |
8.7 (7.5) |
8.8 (7,6) |
8.6 (7,4) |
| ИМТ, кг/м2 |
27.4 (6.0) |
27.3 (6,4) |
27.2 (6.0) |
27.3 (6.2) |
| CRP, мг/Л |
25 (34) |
24 (26) |
24 (26) |
24 (29) |
| РФ положительный, n (%) |
444 (79,9) |
433 (77,7) |
468 (84,0) † |
1345 (80,5) |
| Anti-ЦПП позитивные, n (%) |
467 (84,0) |
476 (85,5) |
484 (86,9) |
1427 (85.4) |
| SHS |
41,9 (46.7) |
41,8 (45,4) |
42,5 (49,3) |
42,1 (47,1) |
| Оценка HAQ-DI, диапазон: 0 – 3 |
1.6 (0,7) |
1.5 (0,6) |
1.5 (0,7) |
1.5 (0,6) |
| DAS28 (СРБ) |
5.9 (0,9) |
5.9 (0,9) |
5.8 (0,9) ‡ |
5.9 (0,9) |
| Ранее лечение use§ |
| 1 DMARD |
183 (32,9) |
179 (32,1) |
173 (31,1) |
535 (32,0) |
| ≥2 DMARDs |
373 (67.1) |
378 (67,9) |
384 (68,9) |
1135 (68.0) |
| MTX |
547 (98,4) |
550 (98,7) |
548 (98,4) |
1645 (98,5) |
| Сульфасалазин |
174 (31,4) |
167 (30,0) |
152 (27,3) |
493 (29.5) |
| Системные кортикостероиды |
422 (75,9) |
407 (73,1) |
418 (75.0) |
1247 (74,7) |
| Использование базовых лекарств, n (%) |
| DMARDs |
508 (91,4) |
517 (92,8) |
511 (91,7) |
1536 (92,0) |
| НПВП |
434 (78,1) |
420 (75,4) |
454 (81,5) ¶ |
1308 (78.3) |
| Кортикостероиды |
341 (61,3) |
331 (59,4) |
360 (64,6) |
1032 (61,8) |
Значения являются среднее (SD), если не указано иное.
Различий в демографических и базовые характеристики среди групп не были значительными, если не указано иное.
* Не коренные гавайцы и другие жители тихоокеанских островов были зарегистрированы в любой группе лечения.
†p = 0.01 против sirukumab 50 мг q4w на основе χ2 испытания.
‡p = 0,02 по сравнению с плацебо, основанный на t теста.
- ALL рандомизированные пациенты принимали ≥1 DMARD.
¶p = 0.01 против sirukumab 50 мг q4w на основе χ2 испытания.
q2w, каждые 2 недели; q4w, каждые 4 недели; BMI, индекс массы тела; CCP, cyclic citrullinated peptide циклический цитрулиновый пептид; CRP, C-реактивного белка; DAS28 (CRP), 28-joint Disease Activity Score based on C reactive protein , 28-совместная оценка активности болезни на основе C-реактивного белка; DMARD, Болезнь модифицирующие противоревматические препарат; HAQ-DI, Health Assessment Questionnaire–Disability Index индекс здоровья оценки вопросник – инвалидности; MTX, метотрексата; НПВП, нестероидные противовоспалительные препараты; РФ, , rheumatoid factor ревматоидный фактор; SHS, Sharp/van der Heijde score., Sharp/ван дер Хейде счет.
Эффективность
Обе конечные точки coprimary были выполнены. Доля больных с ACR20 ответов было значительно больше для обеих дозах sirukumab, по сравнению с плацебо на 16 неделе (оба p < 0,001;
рисунок 2A). Различия в соотношении числа пациентов, достижение ACR20 были отмечены как уже 2 недели и были устойчивы к 52 недели (обе дозы p < 0,001 против плацебо на недели 24 и 52). ACR20 ответов в обеих группах sirukumab были выше по сравнению с плацебо, независимо от исходных MTX использования (см. онлайн
Дополнительная таблица S2). Краткая информация о % улучшения в ACR компонентов на 16 неделе предоставляется (см онлайн
Дополнительная таблица S3). Значительное торможение радиографический прогрессии (SHS означает изменения от базовой линии) была достигнута на 52неделе (coprimary конечной точки), с различиями, наблюдается уже неделю 24 для sirukumab по сравнению с плацебо (обе дозы p < 0,001 против плацебо на обоих timepoints;
Рисунок 2B). Значительно выше доли пациентов с sirukumab не показывать радиографический прогрессии (оценка изменения ≤0 от базовой линии в SHS всего, эрозии и сужение просвета суставов счет) по сравнению с плацебо на 52 недели (обе дозы p < 0,001 против плацебо;
Рисунок 2 C). Маленькие SHS, к 52недели, изменения от базовой линии в обеих группах sirukumab по сравнению с плацебо, означают независимость от исходных MTX использования. Участок вероятности изменения SHS от базовой линии к 52 недели ясно показывает разделение между sirukumab группами и группой плацебо и никакого разделения между sirukumab группами, (Смотри онлайн
дополнительная цифра S2).
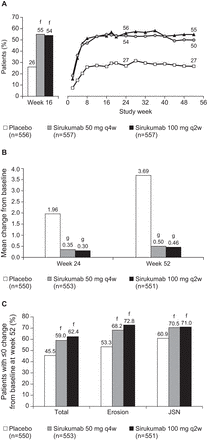 Рисунок 2
Рисунок 2
(А) пропорции больных с ACR20 ответ на 16 неделе «a» и ответ ACR20 с течением времени. «b, c, d» (B)
Изменение от базовой линии в SHS результаты недели 24 и 52. «e»
(C) пропорции больных без радиографической прогрессии от базовой линии к 52 недели. «e»
EE, EE, early escape ранний выход; JSN, joint space narrowing сужение суставной щели; LE, late escape, поздний выход; NR, non-responder не ответчик; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели; SHS, Sharp/van der Heijde score Sharp/ван дер Хейде счет; TF, treatment failure неэффективности лечения.
«а» На основе вмененных значений отсутствующих данных (NR)/TF(NR).
«в» На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR). cp <0,001 для обеих дозах sirukumab по сравнению с плацебо во всех timepoints на основе Cochran-камин-Haenszel испытания.
«d» Не существенные для sirukumab 50 мг q4w против sirukumab 100 мг q2w во всех timepoints на основе Cochran-камин-Haenszel тест.
«e» На основе вмененных значений EE правил и затем отсутствующих данных правил. fp <0,001 по сравнению с плацебо основанные на Cochran-камин-Haenszel тест. gp <0,001 по сравнению с плацебо, основанные на дисперсионный анализ van der Waerden.
Все основные вторичные конечные точки эффективности продемонстрировал значительные улучшения для обеих sirukumab дозы по сравнению с плацебо (все p≤0.001;
Таблица 2). Кроме того, больше пациентов на sirukumab достичь ACR70 уже как неделю 8, с различиями в лечении сохраняются к 52 неделю (обе дозы p < 0,001 против плацебо на недели 16, 24 и 52;
Таблица 2). ACR90 ответы были достигнуты у значительно большей доли больных на обоих sirukumab дозы по сравнению с плацебо в 16, 24 и 52 недель (все p <0,05; не показано). Доля пациентов, достижение CDAI низкой активности болезни (≤10.0) для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели в неделю 24 были 30,2% и 29,4%, соответственно, по сравнению с 15,5% плацебо (оба p < 0,001 против плацебо); на 52 недели, пропорции были 32,0% и 32,5%, соответственно, по сравнению с 15,3% плацебо (оба p < 0,001 против плацебо). Доля больных в ремиссии (≤2.8) CDAI на неделю 24 для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,4% и 7,0%, соответственно, по сравнению с 3,1% плацебо (оба p≤0.003 против плацебо). На 52недели, пропорции больных в стадии ремиссии CDAI для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,3% и 10,1%, соответственно, по сравнению с 3,8% плацебо (оба p≤0.002 против плацебо).
Таблица 2
Результаты важнейших и других ключевых вторичных конечных точек
| Конечная точка |
Плацебо
(n = 556) |
Sirukumab |
| 50 мг q4w
(n = 557) |
100 мг q2w
(n = 557) |
| HAQ-DI изменения от базовой линии к 24 недели, означает (SD) * |
–0.22 (0.53) |
–0.43 (0.58) † |
–0.46 (0,57) † |
| ACR50 к 16 неделе, ‡ n (%) |
60 (10,8) |
167 (30,0) § |
146 (26,2) § |
| ACR50 к 24 неделе, n (%) ¶ |
69 (12,4) |
168 (30.2) § |
185 (33,2) § |
| ACR50 к неделе 52, n (%) ** |
77 (13,8) |
169 (30,3) § |
198 (35,5) § |
| ACR70 к неделе 16, ‡ n (%) |
22 (4,0%) |
|
|
| ACR70 к неделе, 24, n (%) ¶ |
19 (3,4%) |
|
|
| ACR70 к неделе 52, n (%) ** |
30 (5,4%) |
|
|
| DAS28 (СРБ) <2.6 к неделе 24, n (%) ¶ |
31 (5,6) |
145 (26,0) § |
142 (25,5) § |
| Основные клинические ответ к 52 неделе, n (%) ** |
10 (1,8) |
30 (5.4) § |
50 (9.0) § |
| SF-36 PCS изменения от базовой линии к неделе, 52, среднее (SD) †† |
2.42 (6,81) |
5.66 (7,74) ‡‡ |
6.16 (7.23) ‡‡ |
| SF-36 изменения от базовой линии к неделе, 52, среднее (SD) †† |
2.69 (9,57) |
5.35 (9.64) ‡‡ |
4.77 (9,80) ‡‡ |
* На основе вмененных значений отсутствующих данных (LOCF)/EE(LOCF).
†p≤0.001 по сравнению с плацебо, основанный на анализе ковариации.
‡Основано на вмененных значений, отсутствующих данных (NR)/TF(NR).
- p≤0.01 по сравнению с плацебо, основанный на Cochran- Mantel -Haenszel тест.
¶ Основано на вмененных значений, отсутствующих данных (NR)/TF(NR)/EE(NR).
** На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR).
†† Основано на вмененных значений, отсутствующих данных (LOCF)/EE(LOCF)/LE(LOCF).
‡‡p≤0.001 по сравнению с плацебо, основанный на дисперсионный анализ.
ACR50/70, American College of Rheumatology 50/70%; DAS28 (CRP), 28-joint Disease Activity Score based on C reactive protein; EE, early escape; HAQ-DI, Health Assessment Questionnaire–Disability Index;; LE, late escape; LOCF, last observation carried forward перенесенные последние наблюдения; MCS, mental component summary эмоциональное самочувствие; NR, non-responder не ответчик ; PCS, physical component summary, физическое самочувствие; q2w, каждые 2 недели; q4w, каждые 4 недели; SF-36, короткие формы-36; TF, , treatment failure неэффективность лечения.
Значительно большее улучшение от исходного уровня в области физического и эмоционального самочувствия с sirukumab пациента сообщили SF-36 шт и MCS оценки к 52 недели (p < 0,001 для PCS и MCS, обе sirukumab доз против плацебо;
Таблица 2). К недели 24 и 52, больше по всем восьми отдельных показателей SF-36 домена улучшились с sirukumab, по сравнению с плацебо (все p≤0.006), и значительно больше леченых sirukumab больных достигли клинически значимых улучшений (≥5-точки увеличение) от базовой линии по PCS и MCS баллам, по сравнению с плацебо (все p≤0.009).
Безопасность
Безопасность результаты были кратко изложены в «чистой» плацебо контролируемый период до EE (неделя 18; см. онлайн
Дополнительная таблица S4) и в конце плацебо контролируемого периода (52 недели) для всех AEs (
Таблица 3) и для конкретных AEs (см. онлайн
Дополнительная таблица S5). Через 52 недели не было отмечено непропорциональное увеличение от 18 недели частоты AE, и общий профиль AE был похож на что наблюдается на 18недели. Наиболее распространенными AEs (≥5%) через 52 недели sirukumab были повышенные ферменты печени, инфекции верхних дыхательных путей, бронхит, назофарингит, на месте инъекции эритема и зуд, лейкопения, нейтропенией, головная боль и гипертонии (
Таблица 3 ). Нет дозозависмого проявляется между sirukumab доз и типом или частотой AEs помимо реакций на месте инъекции injection site reactions (ISRs) и повышенной активности печеночных ферментов, которые были более частыми с sirukumab 100 мг каждые 2 недели чем при 50 мг каждые 4 недели. Не было ISRs тяжелой интенсивности, и четверо пациентов (по два в каждой группе доза sirukumab) прекратили исследования из-за легкой или умеренной ISRs.
Таблица 3
Резюме общей безопасности в течении 52 недель
| Переменная |
Плацебо
(n = 556) |
Sirukumab * † |
| 50 мг q4w
(n = 663) |
100 мг q2w
(n = 662) |
Комбинированный
(n = 1325) |
| Означает продолжительность наблюдения, в неделях |
36,18 |
45,76 |
45.12 |
45.44 |
| Среднее количество назначений исследуемого препарата |
17.45 |
21.88 |
21,56 |
21.72 |
| Больные с AE ≥1, n (%)
p значение по сравнению с плацебо |
364 (65,5) |
528 (79,6)
< 0,001 |
531 (80,2)
< 0,001 |
1059 (79,9)
< 0,001 |
| Пациенты с SAE ≥1, n (%)
p значение по сравнению с плацебо |
38 (6,8) |
73 (11,0)
0,012 |
65 (9,8)
НС |
138 (10,4)
0,015 |
| Пациенты с AE ≥1, вызвавшего прекращение использования изучаемого препарата, n (%)
p значение по сравнению с плацебо |
18 (3.2) |
53 (8.0)
< 0,001 |
51 (7,7)
< 0,001 |
104 (7,8)
< 0,001 |
| Пациентам с серьезной инфекцией ≥1, n (%)
p значение по сравнению с плацебо |
10 (1,8) |
27 (4.1)
0,021 |
22 (3.3)
НС |
49 (3,7)
0,031 |
| Пациенты с ≥1с реакции на месте инъекции, n (%)
p значение по сравнению с плацебо |
14 (2.5) |
71 (10,7)
< 0,001 |
108 (16,3)
< 0,001 |
179 (13,5)
< 0,001 |
| Пациенты с MACE ≥1, n (%)
значение p против placebo‡ |
2 (0,4) |
8 (1.2)
НС |
3 (0,5)
НС |
11 (0,8)
НС |
| Больных злокачественными опухолями ≥1, n (%)
значение p против placebo‡ |
2 (0,4) |
2 (0,3)
НС |
5 (0,8)
НС |
7 (0,5)
НС |
| Больных с перфорацией GI ≥1, n (%)
значение p против placebo‡ |
1 (0,2) |
1 (0.2)
НС |
0
НС |
1 (0.1)
НС |
| Смерть, n (%)
значение p против placebo‡ |
1 (0,2) |
7 (1.1)
НС |
3 (0,5)
НС |
10 (0,8)
НС |
| События ≥5% частоты в любой группе, sirukumab, n (%) |
| Аланинаминотрансфераза повышение
p значение по сравнению с плацебо |
25 (4.5) |
102 (15,4)
< 0,001 |
124 (18,7)
< 0,001 |
226 (17.1)
< 0,001 |
| Аспартатаминотрансфераза повышение
p значение по сравнению с плацебо |
19 (3.4) |
58 (8,7)
< 0,001 |
82 (12,4)
< 0,001 |
140 (10.6)
< 0,001 |
| Инфекции верхних дыхательных путей
p значение по сравнению с плацебо |
63 (11,3) |
65 (9,8)
НС |
66 (10.0)
НС |
131 (9,9)
НС |
| Эритема на месте инъекции
p значение по сравнению с плацебо |
6 (1.1) |
50 (7.5)
< 0,001 |
80 (12,1)
< 0,001 |
130 (9,8)
< 0,001 |
| Назофарингит
p значение по сравнению с плацебо |
57 (10,3) |
62 (9,4)
НС |
56 (8.5)
НС |
118 (8,9)
НС |
| Лейкопения
p значение по сравнению с плацебо |
7 (1.3) |
37 (5.6)
< 0,001 |
37 (5.6)
< 0,001 |
74 (5.6)
< 0,001 |
| Бронхит
p значение по сравнению с плацебо |
27 (4.9) |
39 (5,9)
НС |
31 (4,7)
НС |
70 (5.3)
НС |
| Нейтропения
p значение по сравнению с плацебо |
5 (0,9) |
38 (5,7)
< 0,001 |
29 (4.4)
< 0,001 |
67 (5.1)
< 0,001 |
| Гипертензия
p значение по сравнению с плацебо |
21 (3,8) |
28 (4.2)
НС |
33 (5.0)
НС |
61 (4.6)
НС |
| Головная боль
p значение по сравнению с плацебо |
22 (4.0) |
33 (5.0)
НС |
26 (3.9)
НС |
59 (4.5)
НС |
| Зуд на месте инъекции
p значение по сравнению с плацебо |
1 (0,2) |
11 (1.7)
0.009 |
41 (6.2)
< 0,001 |
52 (3.9)
< 0,001 |
* Включает пациентов из группы плацебо, rerandomised для лечения с sirukumab; таким образом, пациенты могут быть представлены в >1 группы лечения.
†p значения номинальных и от χ2 тесты, если не указано иное.
‡p значения номинальных и точных тестов Фишера.
AE, adverse event неблагоприятных событий; GI, желудочно-кишечный тракт; MACE major adverse cardiovascular event, большие неблагоприятные сердечно-сосудистые события ; NS, not significant, не значиемые ; q2w, каждые 2 недели; q4w, каждые 4 недели; SAE, , serious adverse event серьезные неблагоприятные события.
Через 18 недель о серьезных AEs (SAEs) сообщалось в 4,7%, 2,9% и 3,1% больных в sirukumab 100 мг каждые 2 недели, 50 мг каждые 4 недели и плацебо групп, соответственно; через 52 недели SAEs сообщалось в 9,8%, 11,0% и 6,8% пациентов, соответственно. Серьезные инфекции были зарегистрированы в 0,9%, 0,7% и 0,9% пациентов, соответственно, через 18 недель и были численно больше, в sirukumab 100 мг каждые 2 недели, комбинированные (3,3%) и 50 мг каждые 4 недели комбинированного (4,1%) групп (включая EE пациентов) по сравнению с в группе плацебо (1,8%) через 52 недели. Было зарегистрировано два желудочно-кишечного тракта (ЖКТ) перфорацией: одна верхняя ЖКТ. (желудок) перфорация в группе плацебо и один нижний ЖКТ перфорации (перфорированные аппендицит) у пациентов, рандомизированных плацебо с EE для sirukumab 50 мг каждые 4 недели. В период 18-неделю до EE, частота смертности были такой же в группах лечения, с одной смертью в трех группах. Через 52 недель был численный дисбаланс в экспозиции скорректирована смертности (
Дополнительная таблица S5); Тем не менее интерпретация этих результатов опровергается потерей рандомизации как пациентов в группе плацебо перешедших на sirukumab EE и LE контрольных точках.
Лабораторные аномалии были одинаковы для обоих sirukumab доз и были численно больше, чем плацебо; распространённость частоты 3/4 лабораторных аномалии с sirukumab был низким при снижении тромбоцитов (0,2% класс 3; 0% 4 класс), снижение нейтрофилов (4,1% класс 3; 4 класс 0,2%), увеличение Аланинаминотрансфераза (ALT; 3.2% , 3, класс 3, 0% 4 класс) и увеличение аспартатаминотрансфераза (АСТ; 0,7% класс 3; 0% 4 класс). Подсчет снижение нейтрофилов и тромбоцитов и повышения гемоглобина, АЛТ и АСТ началось на 2 недели лечения sirukumab и были длительными до 52 недели (Смотри онлайн
дополнительная цифра S3). Общий холестерин и липопротеиды низкой плотности увеличилось при обеих дозах sirukumab по сравнению с плацебо; однако общий холестерин: высокой плотности липопротеиды оставалась ниже 4.0 для всех групп лечения к 52 недели.
Общая встречаемость антител к sirukumab через неделю 52 был 2,4% (16/654), появляющихся в 1,2% (4/328) пациентов, получающих sirukumab 100 мг каждые 2 недели и 3,7% (12/326) пациентов, получающих sirukumab 50 мг каждые 4 недели. Только один из этих 16 пациентов (по 50 мг каждые 4 недели группа) был позитивным для нейтрализующих антител к sirukumab. У пациентов, оказались позитивными на антилекарственные антитела не было никакой очевидной связи между антител к sirukumab и клинической реакции или ISRs.
Обсуждение
Этот этап III, двойное слепое, рандомизированное клиническое испытание оценить безопасность и эффективность sirukumab, антитело ИЛ-6 цитокинов, ведении как 100 мг каждые 2 недели или 50 мг каждые 4 недели для пациентов с умеренной и тяжелой активных рефрактерным РА с обычными DMARDs, включая MTX. Примерно одна треть зарегистрированных пациентов в данном крупном, глобальном исследовании ранее получали биологическую терапию DMARD (отмечая, что эти пациенты не могут быть провальными из соображений безопасности или эффективности) и более двух третей имеют предварительное лечение с ≥2 обычными DMARDs.
Все клиническая эффективность конечные точки продемонстрировал, что sirukumab было эффективным средством снижения признаки и симптомы активного РА в надежной и быстрой манере через 52 недель. Улучшения произошли еще в первые 2 недели в пациентов с sirukumab, которые продемонстрировали ACR20 ответ; ответы перестала расти на 12 неделе и поддерживались через 52 недели. Клинические результаты были подтверждены надежным замедлением воздействия на структурные повреждения к 52 недели. Значительное торможение рентгенологической прогрессии было отмечено с sirukumab уже к неделе 24 (первая timepoint оценку) и значительно большей доли пациентов с sirukumab, показал отсутствие прогрессии, по сравнению с плацебо на 52 недели. Положительные клинические и рентгенологические эффекты были неизменно связаны с значительных улучшений, пациент сообщили физическое и эмоциональное здоровье и функциональное состояние. В фазе IIb исследования и в исследовании текущей фазы III клиническая эффективность во многом аналогичен между 100 мг каждые 2 недели и дозы 50 мг каждые 4 недели sirukumab, предполагая, что две дозы не отличаются в их эффективности.
Профиль безопасности sirukumab не вызвал каких-либо новых проблем и согласуется с теми, кто сообщил для агентов, воздействующих на рецепторы ИЛ-6, например tocilizumab и sarilumab. Доля пациентов, которые испытывают AEs и SAEs относительно схожи между группами лечения, и типы AEs и SAEs были похожи через период 52-недельного исследования. Наиболее распространенными AEs были повышение ферменты печени и эритема на месте инъекции, который был только AE, который был более часто с sirukumab 100 мг каждые 2 недели, по сравнению с 50 мг каждые 4 недели. ISR были легкой или умеренной тяжести и привело к нескольким прекращениям. Серьезных инфекций не было зарегистрировано. Лаборатория аномалий включали нейтропенией, тромбоцитопению и повышением уровня трансаминаз печени и липидов, все из которых были зарегистрированы как класс эффекты терапии антиИЛ-6. Нет никаких доказательств дозы ответ для sirukumab в этих лабораторных аномалий, за исключением трансаминазы печени.
Это исследование включает популяцию. пациентов с РА, которые были рефрактерны к DMARDs и которые могут или не получили предварительного биологической терапии. Результаты этого исследования, таким образом, не применимы к всему спектру пациентов с РА, но обеспечивают важную информацию об использовании антиИЛ-6 терапии в качестве возможного первой линии или альтернативной биологической терапии у пациентов, которые не реагируют на обычные DMARDs. Было продемонстрировано использование sirukumab у больных, которые не могут переносить или больше не реагируют на биологические DMARDs в исследовании SIRROUND-Т. Текущий дизайн исследования привели к потере рандомизации после 18-недельный период чистой плацебо контролируемые и, следовательно, больше всего воздействие пациент-лет sirukumab по сравнению с плацебо, которые запутывают толкование безопасности сравнения между sirukumab лечение и плацебо только пациентов до 18 недели. Безопасность sirukumab по-прежнему оцениваться в рамках долгосрочного расширенного исследования.
В заключение, у больных с активной РА рефрактерных для DMARDs, sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели привели к значительным сокращениям признаки и симптомы РА, улучшение физической функции, замедление прогрессирования повреждения и улучшение качества жизни. Обе схемы sirukumab дозы были аналогичным образом эффективным, и sirukumab также продемонстрировал приемлемый безопасности профиля.

 Таблица 1
Демографические и базовые характеристики
Таблица 1
Демографические и базовые характеристики
 Рисунок 2
(А) пропорции больных с ACR20 ответ на 16 неделе «a» и ответ ACR20 с течением времени. «b, c, d» (B)
Изменение от базовой линии в SHS результаты недели 24 и 52. «e»
(C) пропорции больных без радиографической прогрессии от базовой линии к 52 недели. «e»
EE, EE, early escape ранний выход; JSN, joint space narrowing сужение суставной щели; LE, late escape, поздний выход; NR, non-responder не ответчик; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели; SHS, Sharp/van der Heijde score Sharp/ван дер Хейде счет; TF, treatment failure неэффективности лечения.
«а» На основе вмененных значений отсутствующих данных (NR)/TF(NR).
«в» На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR). cp <0,001 для обеих дозах sirukumab по сравнению с плацебо во всех timepoints на основе Cochran-камин-Haenszel испытания.
«d» Не существенные для sirukumab 50 мг q4w против sirukumab 100 мг q2w во всех timepoints на основе Cochran-камин-Haenszel тест.
«e» На основе вмененных значений EE правил и затем отсутствующих данных правил. fp <0,001 по сравнению с плацебо основанные на Cochran-камин-Haenszel тест. gp <0,001 по сравнению с плацебо, основанные на дисперсионный анализ van der Waerden.
Все основные вторичные конечные точки эффективности продемонстрировал значительные улучшения для обеих sirukumab дозы по сравнению с плацебо (все p≤0.001; Таблица 2). Кроме того, больше пациентов на sirukumab достичь ACR70 уже как неделю 8, с различиями в лечении сохраняются к 52 неделю (обе дозы p < 0,001 против плацебо на недели 16, 24 и 52; Таблица 2). ACR90 ответы были достигнуты у значительно большей доли больных на обоих sirukumab дозы по сравнению с плацебо в 16, 24 и 52 недель (все p <0,05; не показано). Доля пациентов, достижение CDAI низкой активности болезни (≤10.0) для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели в неделю 24 были 30,2% и 29,4%, соответственно, по сравнению с 15,5% плацебо (оба p < 0,001 против плацебо); на 52 недели, пропорции были 32,0% и 32,5%, соответственно, по сравнению с 15,3% плацебо (оба p < 0,001 против плацебо). Доля больных в ремиссии (≤2.8) CDAI на неделю 24 для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,4% и 7,0%, соответственно, по сравнению с 3,1% плацебо (оба p≤0.003 против плацебо). На 52недели, пропорции больных в стадии ремиссии CDAI для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,3% и 10,1%, соответственно, по сравнению с 3,8% плацебо (оба p≤0.002 против плацебо).
Таблица 2
Результаты важнейших и других ключевых вторичных конечных точек
Рисунок 2
(А) пропорции больных с ACR20 ответ на 16 неделе «a» и ответ ACR20 с течением времени. «b, c, d» (B)
Изменение от базовой линии в SHS результаты недели 24 и 52. «e»
(C) пропорции больных без радиографической прогрессии от базовой линии к 52 недели. «e»
EE, EE, early escape ранний выход; JSN, joint space narrowing сужение суставной щели; LE, late escape, поздний выход; NR, non-responder не ответчик; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели; SHS, Sharp/van der Heijde score Sharp/ван дер Хейде счет; TF, treatment failure неэффективности лечения.
«а» На основе вмененных значений отсутствующих данных (NR)/TF(NR).
«в» На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR). cp <0,001 для обеих дозах sirukumab по сравнению с плацебо во всех timepoints на основе Cochran-камин-Haenszel испытания.
«d» Не существенные для sirukumab 50 мг q4w против sirukumab 100 мг q2w во всех timepoints на основе Cochran-камин-Haenszel тест.
«e» На основе вмененных значений EE правил и затем отсутствующих данных правил. fp <0,001 по сравнению с плацебо основанные на Cochran-камин-Haenszel тест. gp <0,001 по сравнению с плацебо, основанные на дисперсионный анализ van der Waerden.
Все основные вторичные конечные точки эффективности продемонстрировал значительные улучшения для обеих sirukumab дозы по сравнению с плацебо (все p≤0.001; Таблица 2). Кроме того, больше пациентов на sirukumab достичь ACR70 уже как неделю 8, с различиями в лечении сохраняются к 52 неделю (обе дозы p < 0,001 против плацебо на недели 16, 24 и 52; Таблица 2). ACR90 ответы были достигнуты у значительно большей доли больных на обоих sirukumab дозы по сравнению с плацебо в 16, 24 и 52 недель (все p <0,05; не показано). Доля пациентов, достижение CDAI низкой активности болезни (≤10.0) для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели в неделю 24 были 30,2% и 29,4%, соответственно, по сравнению с 15,5% плацебо (оба p < 0,001 против плацебо); на 52 недели, пропорции были 32,0% и 32,5%, соответственно, по сравнению с 15,3% плацебо (оба p < 0,001 против плацебо). Доля больных в ремиссии (≤2.8) CDAI на неделю 24 для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,4% и 7,0%, соответственно, по сравнению с 3,1% плацебо (оба p≤0.003 против плацебо). На 52недели, пропорции больных в стадии ремиссии CDAI для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,3% и 10,1%, соответственно, по сравнению с 3,8% плацебо (оба p≤0.002 против плацебо).
Таблица 2
Результаты важнейших и других ключевых вторичных конечных точек

 Таблица 1
Демографические и базовые характеристики
Таблица 1
Демографические и базовые характеристики
 Рисунок 2
(А) пропорции больных с ACR20 ответ на 16 неделе «a» и ответ ACR20 с течением времени. «b, c, d» (B)
Изменение от базовой линии в SHS результаты недели 24 и 52. «e»
(C) пропорции больных без радиографической прогрессии от базовой линии к 52 недели. «e»
EE, EE, early escape ранний выход; JSN, joint space narrowing сужение суставной щели; LE, late escape, поздний выход; NR, non-responder не ответчик; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели; SHS, Sharp/van der Heijde score Sharp/ван дер Хейде счет; TF, treatment failure неэффективности лечения.
«а» На основе вмененных значений отсутствующих данных (NR)/TF(NR).
«в» На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR). cp <0,001 для обеих дозах sirukumab по сравнению с плацебо во всех timepoints на основе Cochran-камин-Haenszel испытания.
«d» Не существенные для sirukumab 50 мг q4w против sirukumab 100 мг q2w во всех timepoints на основе Cochran-камин-Haenszel тест.
«e» На основе вмененных значений EE правил и затем отсутствующих данных правил. fp <0,001 по сравнению с плацебо основанные на Cochran-камин-Haenszel тест. gp <0,001 по сравнению с плацебо, основанные на дисперсионный анализ van der Waerden.
Все основные вторичные конечные точки эффективности продемонстрировал значительные улучшения для обеих sirukumab дозы по сравнению с плацебо (все p≤0.001; Таблица 2). Кроме того, больше пациентов на sirukumab достичь ACR70 уже как неделю 8, с различиями в лечении сохраняются к 52 неделю (обе дозы p < 0,001 против плацебо на недели 16, 24 и 52; Таблица 2). ACR90 ответы были достигнуты у значительно большей доли больных на обоих sirukumab дозы по сравнению с плацебо в 16, 24 и 52 недель (все p <0,05; не показано). Доля пациентов, достижение CDAI низкой активности болезни (≤10.0) для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели в неделю 24 были 30,2% и 29,4%, соответственно, по сравнению с 15,5% плацебо (оба p < 0,001 против плацебо); на 52 недели, пропорции были 32,0% и 32,5%, соответственно, по сравнению с 15,3% плацебо (оба p < 0,001 против плацебо). Доля больных в ремиссии (≤2.8) CDAI на неделю 24 для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,4% и 7,0%, соответственно, по сравнению с 3,1% плацебо (оба p≤0.003 против плацебо). На 52недели, пропорции больных в стадии ремиссии CDAI для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,3% и 10,1%, соответственно, по сравнению с 3,8% плацебо (оба p≤0.002 против плацебо).
Таблица 2
Результаты важнейших и других ключевых вторичных конечных точек
Рисунок 2
(А) пропорции больных с ACR20 ответ на 16 неделе «a» и ответ ACR20 с течением времени. «b, c, d» (B)
Изменение от базовой линии в SHS результаты недели 24 и 52. «e»
(C) пропорции больных без радиографической прогрессии от базовой линии к 52 недели. «e»
EE, EE, early escape ранний выход; JSN, joint space narrowing сужение суставной щели; LE, late escape, поздний выход; NR, non-responder не ответчик; q2w, every 2 weeks каждые 2 недели; q4w, every 4 weeks каждые 4 недели; SHS, Sharp/van der Heijde score Sharp/ван дер Хейде счет; TF, treatment failure неэффективности лечения.
«а» На основе вмененных значений отсутствующих данных (NR)/TF(NR).
«в» На основе вмененных значений отсутствующих данных (NR)/TF(NR)/EE(NR)/LE(NR). cp <0,001 для обеих дозах sirukumab по сравнению с плацебо во всех timepoints на основе Cochran-камин-Haenszel испытания.
«d» Не существенные для sirukumab 50 мг q4w против sirukumab 100 мг q2w во всех timepoints на основе Cochran-камин-Haenszel тест.
«e» На основе вмененных значений EE правил и затем отсутствующих данных правил. fp <0,001 по сравнению с плацебо основанные на Cochran-камин-Haenszel тест. gp <0,001 по сравнению с плацебо, основанные на дисперсионный анализ van der Waerden.
Все основные вторичные конечные точки эффективности продемонстрировал значительные улучшения для обеих sirukumab дозы по сравнению с плацебо (все p≤0.001; Таблица 2). Кроме того, больше пациентов на sirukumab достичь ACR70 уже как неделю 8, с различиями в лечении сохраняются к 52 неделю (обе дозы p < 0,001 против плацебо на недели 16, 24 и 52; Таблица 2). ACR90 ответы были достигнуты у значительно большей доли больных на обоих sirukumab дозы по сравнению с плацебо в 16, 24 и 52 недель (все p <0,05; не показано). Доля пациентов, достижение CDAI низкой активности болезни (≤10.0) для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели в неделю 24 были 30,2% и 29,4%, соответственно, по сравнению с 15,5% плацебо (оба p < 0,001 против плацебо); на 52 недели, пропорции были 32,0% и 32,5%, соответственно, по сравнению с 15,3% плацебо (оба p < 0,001 против плацебо). Доля больных в ремиссии (≤2.8) CDAI на неделю 24 для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,4% и 7,0%, соответственно, по сравнению с 3,1% плацебо (оба p≤0.003 против плацебо). На 52недели, пропорции больных в стадии ремиссии CDAI для sirukumab 100 мг каждые 2 недели и 50 мг каждые 4 недели были 8,3% и 10,1%, соответственно, по сравнению с 3,8% плацебо (оба p≤0.002 против плацебо).
Таблица 2
Результаты важнейших и других ключевых вторичных конечных точек



