Просмотров: 15 224
Периодическая болезнь
Клинико-морфологический анализ случая периодической болезни
Синельник Е.А., Ханов А.Г.
Периодическая болезнь (ПБ) или семейная средиземноморская лихорадка — наследственное аутосомно-рецессивное заболевание, связанное с точечной мутацией в гене белка пирина. Этот ген носит название MEFV (MEditerranean FeVer) и расположен в коротком плече 16-й хромосомы. Носителями мутаций этого гена являются определенные этнические группы – народы, предки которых являются выходцами Средиземноморского региона – евреи-сефарды, армяне, арабы, греки, турки, народы Кавказа. Этот ген функционирует только в гранулоцитах. В настоящее время выявлено 29 вариантов мутаций MEFV. Эти мутации представлены точечными аминокислотными заменами. Около 90% случаев ПБ это мутация М680I (замена изолейцина на метионин), которая встречается в основном у армян, М694V (замена валина на метионин) и V726А (замена аланина на валин), которая отмечается у всех этнических групп. В связи с таким разнообразием мутаций имеет смысл изучать зависимость фенотипа ПБ от генотипа.
ПБ болеют как мужчины, так и женщины, встречаются семейные случаи заболевания.
Клинически ПБ проявляется возникающими через определенные интервалы времени (дни — недели — месяцы) стереотипными приступами лихорадки, полисерозита, абдоминального и суставного болевых синдромов. При этом вместе с лихорадкой, могут сочетаться один или несколько вышеперечисленных синдромов. Приступ сопровождается лейкоцитозом, увеличением СОЭ и других воспалительных белков, повышением a- и b-фракции глобулинов, снижением активности миелопероксидазы нейтрофилов, повышением активности кислой и щелочной фосфатазы. В межприступный период состояние больных удовлетворительное, лабораторные изменения постепенно исчезают.
Лихорадка при ПБ больше 38С, сопровождается ознобом и не проходит после применения антибиотиков и антипиретиков.
Абдоминальный болевой синдром, связан с асептическим перитонитом, отмечается у 91% случаев и симптомы мало отличаются от септического. Длительность лихорадочного и абдоминального вариантов ПБ обычно составляет от 1 до 3 дней, реже до 1–2 недели.
Суставной синдром наблюдаются в 35–80% случаев, в 17–30% он является первыми признаками заболевания и характеризуется артралгией, воспалением с отеком, гиперемией и гипертермией одного или нескольких крупных суставов, чаще тазобедренных и коленных. Продолжительность суставного приступа ПБ – от 4 дней до 1 мес. В отличие от лихорадки и абдоминального синдромов, артралгии часто сохраняются после приступа и постепенно стихают в течение нескольких месяцев.
Встречаются так же более редкие синдромы – изолированный или сочетанный торакальный плевральный и перикардиальный синдромы со стерильным выпотом от 8 до 40% случаев. Длительность этого синдрома — 3–7 дней. Кожные изменения во время приступа ПБ встречаются в 20–30% случаев. Самые характерные – рожеподобная сыпь, пурпурные высыпания, везикулы, узелки, ангионевротические отеки, реже – отек Квинке и крапивница. Другими проявлениями ПБ могут быть головная боль, асептический менингит, миалгия, гепатолиенальный синдром, острый орхит.
При этом, несмотря на достаточно явные симптомы ПБ, часто остается нераспознанной или имеет место её поздняя диагностика. Кроме того, молекулярно-генетические исследования очень дороги, высокотехнологичны и могут проводиться только в специализированных медицинских центрах. В связи с этим для постановки диагноза ПБ чаще всего приходится выделять ведущие синдромы, учитывать этническую принадлежность пациентов и семейный анамнез.
ПБ все еще мало изучена, однако обращает на себя внимание исследователей развитием характерного для неё смертельного проявления – амилоидоза. Амилоидоз – тяжелый стромально-сосудистый диспротеиноз при котором в межуточном веществе и стенках сосудов откладывается аномальный фибриллярный белок – амилоид, который синтезируется генетически запрограммированными амилоидобластами путем извращенного синтеза.
Патогенез клинической картины ПБ связан с дефектом белка пирина. Это белок первичных гранул нейтрофилов, который является основным регулятором воспалительного ответа, проходящего с участием нейтрофилов. Пирин стимулирует выработку противовоспалительных медиаторов, позволяет контролировать хемотаксис, стабилизирует мембрану гранулоцитов. Его дефект приводит к повышению выработки цитокинов в лейкоцитах, дефициту ингибитора фактора хемотаксиса С5, активации молекул адгезии на поверхности нейтрофилов, активации их микротубулярного аппарата, дегрануляции первичных гранул. При приступе ПБ происходит спонтанная или спровоцированная дегрануляция нейтрофилов с выбросом медиаторов и развитием асептического воспаления преимущественно в серозных и синовиальных оболочках. Триггеры дегрануляции по сей день не известны. При этом в периферической крови появляются признаки воспаления. Раздражение медиаторами воспаления рецепторов приводит к развитию болевого синдрома. Воздействие большого количества эндогенных пирогенов на центр терморегуляции — к развитию лихорадки. Избыточная концентрация белка острой фазы воспаления SAA во время приступа ПБ обуславливает развитие ведущего смертельного проявления ПБ – амилоза.
Ведущими звеньями в патогенезе амилоидоза при ПБ являются наличие избыточного количества острофазового белка SAA и синтез из него компонентов амилоида. Клетки, синтезирующие амилоид называются амилоидобласты. Чаще всего это макрофаги, реже – плазматические клетки, фибробласты, ретикулоциты, мезангий почек и эндотелиоциты. Белок SАА является плазменным предшественником фибриллярного компонента амилоида синтезируется нейтрофилами, фибробластами и гепатоцитами. Усиленный синтез SАА происходит под действием интерлейкина 1, интерлейкина 6 и фактора некроза опухоли. В преамилоидной стадии содержание SАА в крови резко увеличено, поэтому макрофаги неспособны разрушить этот белок полностью и начинают собирать из него фибриллы амилоида и откладывают их в межуточной ткани. Поэтому наибольшее накопление амилоида при ПБ отмечается в органах, где макрофаги занимают фиксированное положение: почки, печень, селезенка. Фибриллярный компонент при различных типах амилоидоза различный и то, из каких белков он синтезируется и будет определять тип амилоидоза. Так как амилоид при ПБ строится из белка SAA, амилоидоз при ПБ носит характер АА-амилоидоза. У человека выделено несколько типов SAA, и только фрагменты некоторых из них входят в состав амилоидных фибрилл. Это, возможно, и объясняет развитие амилоидоза, по различным данным у 10–40% больных ПБ. Стимулирует синтез амилоида амилоидстимулирующий фактор, вырабатываемый в печени и селезенке. Синтезированный фибриллярный компонент амилоида соединяется с плазменным компонентом (гликопротеидами плазмы), затем с хондроитинсульфатами ткани с участием гематогенных добавок, среди которых основными являются фибрин и иммунные комплексы. После этого образуется плотное нерастворимое белковое соединение, имбибирующее ткани.
Наряду с синтезом идет и резорбция амилоида амилоидокластами. Роль амилоидокластов выполняют в печени звездчатые ретикулоэндотелиоциты, в селезенке – макрофаги. Вследствие генетического дефекта амилоидокластов и снижения их ферментативной активности резорбция амилоида резко снижается и амилоид в неограниченном количестве откладывается в тканях.
При этом амилоид может откладываться вокруг коллагеновых или ретикулярных волокон. При периретикулярном амилоидозе амилоид выпадает по ходу мембран сосудов и желез, а так же ретикулярной стром паренхиматозных органов. Для него характерно поражение селезенки, печени, почек, надпочечников, кишечника, интимы сосудов мелкого и среднего калибров. При периколлагеновом амилоидозе амилоид выпадает по ходу коллагеновых волокон. Для него характерно поражение адвентиции сосудов среднего и крупного калибра, миокарда, поперечно-полосатой и гладкой мускулатуры, нервов, кожи. В поздних стадиях разграничение периретикулярного и периколлагенового амилоидоза сложно, однако преимущественная локализация поражений остается отчетливой.
После отложения плотного нерастворимого белка в тканях развивается их атрофия и склероз.
При ПБ с АА-амилоидозом почки поражаются во всех случаях. Поэтому амилоидоз при ПБ еще носит название нефропатического и он и является одной из самых частых причин госпитализации. Смертельные осложнения связаны с нефрогенной артериальной гипертензией (инфаркты и кровоизлияния головного мозга), иммунодефицитом (рожа, пневмония), острой и хронической почечной недостаточностью, очень редко встречается тромбоз почечных вен.
В почках роль амилоидобластов выполняют мезангиальные и эндотелиальные клетки. Амилоидные массы откладываются в клубочках (в мезангии, субэпителиальном пространстве, могут полностью облитерировать капиллярные петли), базальных мембранных канальцев, стенках сосудов и собственно интерстиции.
Выделяют 4 стадии амилоидоза почек: латентную (диспротеинемическую), протеинурическую, нефротическую и уремическую. Чаще больные при амилоидозе почек умирают в стадии уремии.
В латентную стадию отмечаются отложения амилоида по ходу прямых сосудов и собирательных трубок, в почечных клубочках отмечается очаговое утолщение, двухконтурность мембраны, аневризматическое расширение капилляров, в эпителии канальцев – гиалиново-капельная дистрофия. Ведущим в патогенезе этой стадии амилоидоза является значительный синтез и повышение в плазме крови концентрации белков-предшественников амилоидоза. Клинически на фоне приступов ПБ может развиваться гипохромная железодефицитная анемия, отмечаются незначительные диспротеинемия с увеличением глобулинов α2, β и γ, гиперфибриногенемия и увеличение концентрации сиалопротеинов в крови, транзиторная протеинурия, микрогематурия и цилиндрурия. Со временем протеинурия становится постоянной и более выраженной.
Появление постоянной протеинурии характеризует переход во вторую, протеинурическую, стадию. В протеинурической стадии амилоид появляется в половине клубочков почек в виде небольших отложений в мезангии, отдельных капиллярных петлях, артериолах. Отмечается склероз и амилоидоз стромы, сосудов, пирамид и интермедиарной зоны, что приводит к атрофии многих глубокорасположенных нефронов. Клинически появляется значительная протеинурия и диспротеинемия, гиперфибриногенемия, гиперкоагуляция. Дальнейшее отложение амилоида в почечной ткани и нарастающая протеинурия приводят к развитию отечного синдрома, появление которого свидетельствует о переходе заболевания в третью, нефротическую, стадию.
В нефротическую стадию амилоид обнаруживается более чем в ¾ всех клубочков, артериолах, артериях, по ходу базальной мембраны канальцев. Выраженный склероз коры отсутствует, в пирамидах и интрамедиарной зоне склероз и амилоидоз имеют выраженный диффузный характер. В канальцах отмечаются цилиндры, в эпителии – гиалиново-капельная жировая дистрофия, развивается амилоидно-липоидный нефроз. Клинически эта стадия амилоидоза представлена нефротическим синдромом, иногда отмечается незначительная гематурия. Нарастают гепатоспленомегалия, гипопротеинемия, усиливаются диспротеинемия с дальнейшим повышением уровня α1-, α2-, и γ-глобулинов, гиперфибриногенемия, гиперлипидемия. Со временем появляется артериальная гипертензия, нарастает азотемия, прогрессирует почечная недостаточность.
Уремическая стадия развивается в финале заболевания. В связи с нарастающим амилоидозом и склерозом наблюдаются атрофия нефронов и нефросклероз, развивается прогрессирующая уремия.
Особенностью амилоидоза почек является сохранение нефротического синдрома и, в большинстве случаев, больших размеров почек при развитии ХПН.
Изучение ПБ, особенно сопровождающейся амилоидозом, актуально, поскольку частота заболевания за последние десятилетия растет, а исследования морфогенетических, клинико-морфологических особенностей ПБ и амилоидоза при ней, малочисленны.
Нами был проведен клинико-морфологический анализ летального случая периодической болезни с нефропатическим амилоидозом, у мужчины 31 года армянской национальности.
С двух лет у пациента отмечались частые приступообразные боли в животе, тогда же была диагностирована абдоминально-суставная форма периодической болезни. Генетическое исследование не проводилось, колхицин не получал. В 24 года появился нефротический синдром и был выставлен амилоидоз почек, начата терапия колхицином по 1 мг в сутки. В 28 лет была диагностирована хроническая почечная недостаточность. В 31 год появились эпизоды повышения артериального давления до 200/120 мм рт ст, одышка и наросли отеки. В этот же период времени был стационарно пролечен по поводу двухсторонней нижнедолевой пневмонии. Через четыре дня после выписки пациент вновь был госпитализирован в тяжелом состоянии за счет развития уремического отека легких, анасарки, повышения АД до 200/100 мм рт ст. При объективном осмотре отмечались субиктеричность склер, бледность, анасарка, экспираторная одышка с ЧДД 22 дд/мин, ослабление дыхания до IV ребра, расширение границ сердца влево на 1,5 см, глухость тонов, акцент II тона на аорте, никтурия. На ЭКГ – ЧСС 80 уд/мин, нарушения реполяризации боковой и нижней стенки левого желудочка. На УЗИ почек слева 103х50 мм, справа 115х55 мм, паренхима повышенной эхогенности, дифференциация по структурам и от окружающих тканей затруднена. На УЗИ сердца уплотнение аорты, дилатация левого предсердия, начальная дилатация левого желудочка, относительная недостаточность митрального клапана 1 степени и трикуспидального клапана 1-2 степени, гипертрофия миокарда левого желудочка. В стационаре нарастали явления отека легких, анасарка, снижался диурез, отмечались гипертонические кризы. В лабораторных анализах отмечались выраженная протеинурия с суточной потерей белка до 9900 мг/сут, гипопротеинемия – общий белок крови 40 г/л, альбумины 26 г/л, повышение азотистых шлаков – мочевина 44,6 ммоль/л, креатинин 1164,2 ммоль/л, лейкоцитоз до 40х109/л со сдвигом лейкоцитарной формулы влево, выраженная анемия – эритроциты 2,06х1012/л, Нв 58 г/л, гиперфосфатемия (2,98 ммоль/л), выраженная гиперкалиемия (6,7 ммоль/л), транзиторная гипонатриемия (135 ммоль/л), гипокальциемия (1,609 ммоль/л), гиперфибриногенемия (8,59 г/л).
Гиперкалиемия, гипергидратация, уремическая интоксикация, головная боль, гипертонические кризы и проявления отека легких купировались лишь проведением гемодиализа. Для проведения программного гемодиализа было необходимо сформировать артерио-венозную фистулу. Во время операции наложения фистулы отмечались эмоциональная лабильность, постепенное нарастание тахикардии и гипертензии от 160/100 до 260/120 мм рт ст, появились парестезии и тяжесть в левой руке, на высоте криза развилась судороги, подергивания мимической мускулатуры, снижение сатурации О2 до 78%. Подъем АД, сменился брадикардией, гипотонией и отсутствием пульса. Спустя 5 минут сердечная деятельность была восстановлена, больной был переведен в реанимационное отделение. На ЭКГ – ритм синусовый, ускоренный, ЧСС 130 уд/мин, полная блокада левой ножки пучка Гиса, признаки перегрузки правого желудочка, левого предсердия.
В реанимационном отделении состояние оставалось крайне тяжелым, сохранялись нарушения сознания от оглушения до комы, периодически возникало психомоторное возбуждение, гипертонические кризы с подъемом артериального давления до 200/120, проводилась продленная ИВЛ. После проведенной санации ФТБС из лево носового хода появилось обильное кровотечение с затеканием крови в желудок и трахею, в связи с чем пациента вновь интубировали. На ЭКГ в динамике – ухудшение коронарного кровоснабжения нижне-боковой стенки и области верхушки возможно до степени повреждения. На 8 день от начала искусственной вентиляции легких была диагностирована левосторонняя тотальная пневмония, сепсис. Были проведены микробиологические посевы мокроты и сыворотки крови. В мокроте были обнаружены E. Faecalis в концентрации 106 КОЕ, в сыворотке крови – повышенные концентрации мананового антигена и антител к манановому антигену Сandida spp, повышенный коэфициент галактомананового антигена Aspergillus spp. Согласно микробиологическим посевам была назначена этиотропная терапия, проводились неоднократные сеансы гемодиализа. Несмотря на интенсивную терапию, больной умер от нарастающей полиорганной недостаточности.
После патологоанатомического исследования была подтверждена периодическая болезнь с амилоидозом. Амилоидоз у пациента протекал с поражением почек, надпочечников, щитовидной железы, поджелудочной железы, селезенки, печени, аорты, желудочно-кишечного тракта, сердца. При этом отложения амилоида наблюдались преимущественно в адвентиции и медии мелких артерий и вен, в меньшей степени – в строме паренхиматозных органов.
Амилоидоз был подтвержден специфическим окрашиванием гистологических препаратов внутренних органов Конго-красным с последующей поляризационной микроскопией и PAS реакцией.
Наиболее массивные отложения амилоида были отмечены в почках, надпочечниках и селезенке, строме и сосудах желез внутренней секреции.
Ведущей патологией у данного пациента был амилоидоз почек, так как привел к нефросклерозу и носил характер терминальной уремической стадии. Макроскопически почки были умеренно уменьшены в размерах, массой по 140 г, плотные, поверхность по снятии капсулы и корковое вещество бледно-бурые с желтыми вкраплениями и сальным блеском, неравномернозернистые, с множественными мелкими западающими звездчатыми рубцами и кистами. На разрезе граница слоев четкая, паренхима умеренно истончена и атрофична. При гистологическом исследовании амилоид в больших количествах был обнаружен во всех клубочках почек, в базальных мембранах канальцев, в стенках сосудов и почечном интерстиции.
Рисунок №1. Уремическая стадия амилоидоза почек. Бледно-бурая зернистая поверхность почки с множественными звездчатыми рубчиками и желтоватыми вкраплениями.
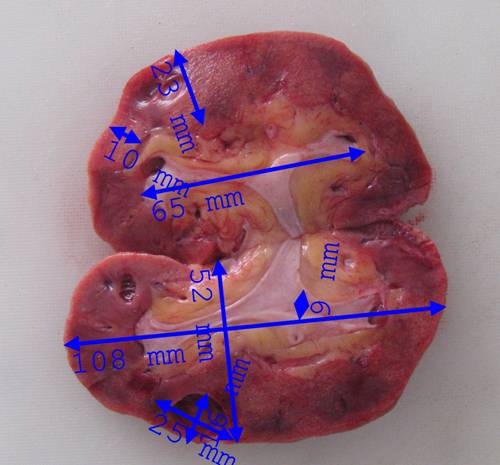 Рисунок №2. Уремическая стадия амилоидоза почек. На разрезе – истонченная паренхима с желтоватыми вкраплениями, большое количество жировой клетчатки в области почечного синуса.
Рисунок №2. Уремическая стадия амилоидоза почек. На разрезе – истонченная паренхима с желтоватыми вкраплениями, большое количество жировой клетчатки в области почечного синуса.
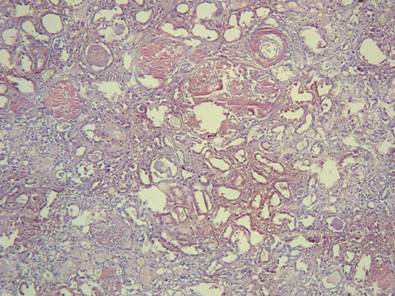 Рисунок №3. Уремическая стадия амилоидоза почек. Паренхима деформирована за счет склероза, диффузной лимфогистиоцитарной инфильтрации интерстиция. В кирпично-красный цвет окрашены стенки сосудов, преимущественно медия и адвентиция, базальные мембраны канальцев и протоков нефронов, очагово – сам интерстиций, массивные белковые отложения в утолщенных и практически бесклеточных капиллярных петлях клубочков. В просвете канальцев большое число белковых цилиндров. Местами нефротелий трансофрмирован в ксантомные клетки. Окраска Конго-Рот. Х10
Рисунок №3. Уремическая стадия амилоидоза почек. Паренхима деформирована за счет склероза, диффузной лимфогистиоцитарной инфильтрации интерстиция. В кирпично-красный цвет окрашены стенки сосудов, преимущественно медия и адвентиция, базальные мембраны канальцев и протоков нефронов, очагово – сам интерстиций, массивные белковые отложения в утолщенных и практически бесклеточных капиллярных петлях клубочков. В просвете канальцев большое число белковых цилиндров. Местами нефротелий трансофрмирован в ксантомные клетки. Окраска Конго-Рот. Х10
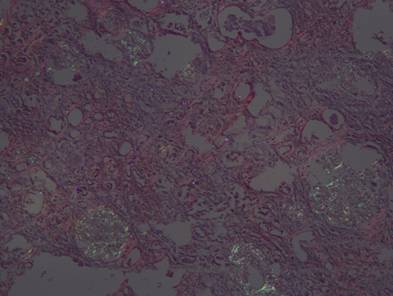 Рисунок №4. Уремическая стадия амилоидоза почек. Зеленоватое свечение в поляризованном свете амилоидных масс в клубочках почки, стенках артерий и базальной мембране нефронов. Окраска Конго-Рот. Х10
Рисунок №4. Уремическая стадия амилоидоза почек. Зеленоватое свечение в поляризованном свете амилоидных масс в клубочках почки, стенках артерий и базальной мембране нефронов. Окраска Конго-Рот. Х10
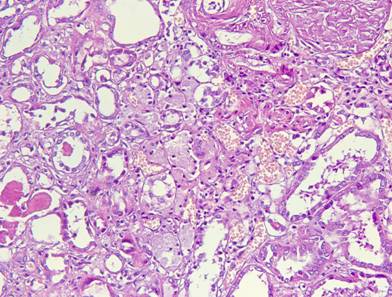 Рисунок №5. Жировая дистрофия эпителия канальцев почки. Цилиндры в просветах атрофированных почечных канальцев. Окраска гематоксилин-эозин. Х20
Рисунок №5. Жировая дистрофия эпителия канальцев почки. Цилиндры в просветах атрофированных почечных канальцев. Окраска гематоксилин-эозин. Х20
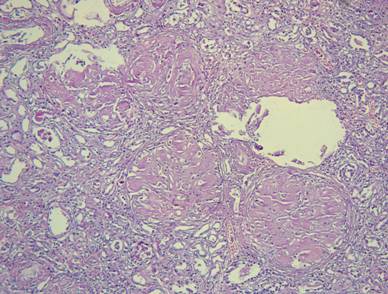 Рисунок №6. Уремическая стадия амилоидоза почек. Отложения гомогенных масс амилоида розового цвета в клубочках. Окраска гематоксилин-эозин. Х10
Амилоидоз надпочечников привел к атрофии коры и мозгового вещества. При этом надпочечники уменьшены в размерах до 2х1,5х0,3 см плотные, с сальным блеском, граница слоев различима, кора желтая, зернистая, мозговое вещество серовато-коричневое, малокровное. При гистологическом исследовании отложение масс амилоида наблюдалось в строме всех слоев коры и мозгового вещества, стенках сосудов.
Рисунок №6. Уремическая стадия амилоидоза почек. Отложения гомогенных масс амилоида розового цвета в клубочках. Окраска гематоксилин-эозин. Х10
Амилоидоз надпочечников привел к атрофии коры и мозгового вещества. При этом надпочечники уменьшены в размерах до 2х1,5х0,3 см плотные, с сальным блеском, граница слоев различима, кора желтая, зернистая, мозговое вещество серовато-коричневое, малокровное. При гистологическом исследовании отложение масс амилоида наблюдалось в строме всех слоев коры и мозгового вещества, стенках сосудов.
 Рисунок №7. Амилоидоз надпочечника. В строме всех слоев коры и мозгового вещества, стенках сосудов массивные отложения масс гомогенного белка кирпично-красного цвета с атрофией и делипоидизацией адренокортикоцитов. Окраска Конго Рот. Х5
Рисунок №7. Амилоидоз надпочечника. В строме всех слоев коры и мозгового вещества, стенках сосудов массивные отложения масс гомогенного белка кирпично-красного цвета с атрофией и делипоидизацией адренокортикоцитов. Окраска Конго Рот. Х5
 Рисунок №8. Амилоидоз надпочечника. Зеленовато-желтоватое свечение в поляризованном свете отложений белка в строме и сосудах надпочечника и сосудах окружающих тканей. Окраска Конго Рот. Х20
Так же у пациента отмечались умеренная гепатоспленомегалия.
Селезенка была увеличена незначительно, массой 218 г, плотная, пульпа селезенки малокровная, бледно-коричневая, с сальным блеском. При гистологическом исследовании отмечалось отложение амилоида в стенках сосудов и в небольшом количестве – в строме с вторичной атрофией лимфоидной ткани.
Рисунок №8. Амилоидоз надпочечника. Зеленовато-желтоватое свечение в поляризованном свете отложений белка в строме и сосудах надпочечника и сосудах окружающих тканей. Окраска Конго Рот. Х20
Так же у пациента отмечались умеренная гепатоспленомегалия.
Селезенка была увеличена незначительно, массой 218 г, плотная, пульпа селезенки малокровная, бледно-коричневая, с сальным блеском. При гистологическом исследовании отмечалось отложение амилоида в стенках сосудов и в небольшом количестве – в строме с вторичной атрофией лимфоидной ткани.
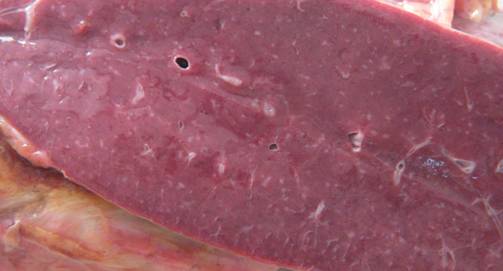 Рисунок №9. Амилоидоз селезенки. Малокровная строма селезенки с сальным блеском.
Рисунок №9. Амилоидоз селезенки. Малокровная строма селезенки с сальным блеском.
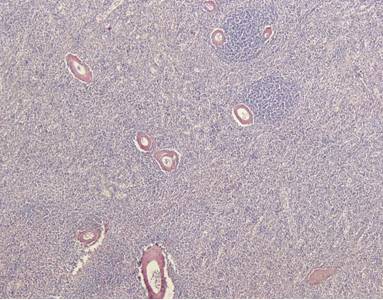 Рисунок №10. Амилоидоз селезенки. Отложения масс амилоида в стенках артерий, строме селезенки, окрашенные в кирпично-красный цвет. Красная пульпа малокровная, синусы пусты, четко просматриваются, местами содержат скопления амилоидного белка. Рисунок белой пульпы стерт, фолликулы атрофичные, мелкие, малоклеточные, с трудом различимые. Окраска Конго Рот. Х10
Рисунок №10. Амилоидоз селезенки. Отложения масс амилоида в стенках артерий, строме селезенки, окрашенные в кирпично-красный цвет. Красная пульпа малокровная, синусы пусты, четко просматриваются, местами содержат скопления амилоидного белка. Рисунок белой пульпы стерт, фолликулы атрофичные, мелкие, малоклеточные, с трудом различимые. Окраска Конго Рот. Х10
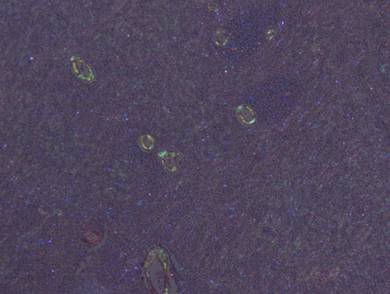 Рисунок №11. Амилоидоз селезенки. Зеленовато-желтоватое свечение в поляризованном свете стенок артерий и в меньшей степени – стромы. Окраска Конго Рот. Х10
В печени отложение масс амилоида отмечалось в стенках сосудов триад и синусоидах, при этом гепатомегалия так же была умеренной – масса печени составила 1870 г, на разрезе ткань печени так же была малокровной и имела сальный блеск.
Рисунок №11. Амилоидоз селезенки. Зеленовато-желтоватое свечение в поляризованном свете стенок артерий и в меньшей степени – стромы. Окраска Конго Рот. Х10
В печени отложение масс амилоида отмечалось в стенках сосудов триад и синусоидах, при этом гепатомегалия так же была умеренной – масса печени составила 1870 г, на разрезе ткань печени так же была малокровной и имела сальный блеск.
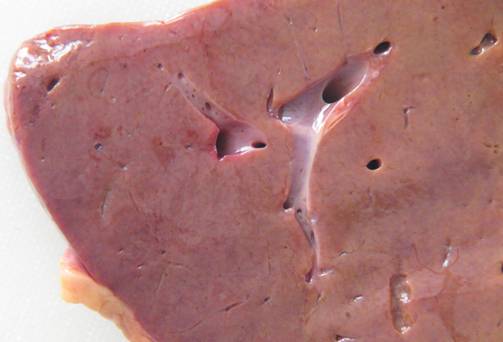 Рисунок № 12. Амилоидоз печени. Увеличенная малокровная печень с сальным блеском.
Рисунок № 12. Амилоидоз печени. Увеличенная малокровная печень с сальным блеском.
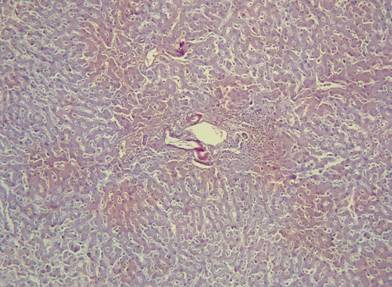 Рисунок №13. Амилоидоз печени. Стенки артерий триад утолщены, просвет не сужен, окрашены в кирпично-красный цвет. Окраска Конго Рот. Х10
Отложения амилоида в прочих внутренних органах клинически практически не проявлялось. При этом амилоид откладывался преимущественно в стенках сосудов мелкого калибра, что существенно не нарушало трофики и потому не привело к их атрофии.
Поджелудочная железа макроскопически изменена не была. При гистологическом исследовании дольки, островки и ацинусы были обычного строения. В окружающей клетчатке обнаружены жировые некрозы, связанные с септицемией. В строме отек и умеренный фиброз, слабо выраженный липоматоз, скудная лимфоидная инфильтрация. Эпителий междольковых протоков десквамирован, содержит слизь. Стенки артерий однородные, розовые, утолщены, просвет не сужен.
Рисунок №13. Амилоидоз печени. Стенки артерий триад утолщены, просвет не сужен, окрашены в кирпично-красный цвет. Окраска Конго Рот. Х10
Отложения амилоида в прочих внутренних органах клинически практически не проявлялось. При этом амилоид откладывался преимущественно в стенках сосудов мелкого калибра, что существенно не нарушало трофики и потому не привело к их атрофии.
Поджелудочная железа макроскопически изменена не была. При гистологическом исследовании дольки, островки и ацинусы были обычного строения. В окружающей клетчатке обнаружены жировые некрозы, связанные с септицемией. В строме отек и умеренный фиброз, слабо выраженный липоматоз, скудная лимфоидная инфильтрация. Эпителий междольковых протоков десквамирован, содержит слизь. Стенки артерий однородные, розовые, утолщены, просвет не сужен.
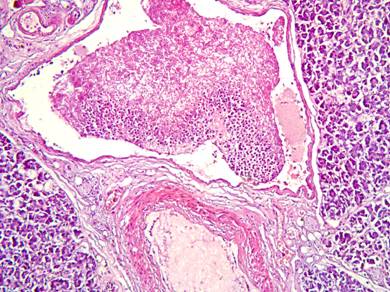 Рисунок №14. Поджелудочная железа. Скопления мицелия грибов в просветах крупных междольковых вен. Окраска гематоксилин-эозин. Х20
Рисунок №14. Поджелудочная железа. Скопления мицелия грибов в просветах крупных междольковых вен. Окраска гематоксилин-эозин. Х20
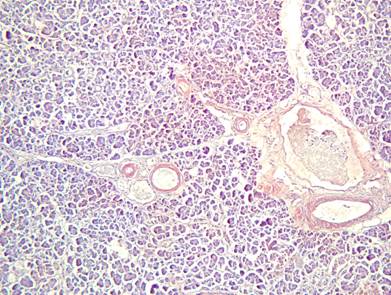 Рисунок №15. Амилоидоз поджелудочной железы. Стенки артерий и мелких вен утолщены, окрашены в кирпично-красный цвет, просветы не сужены. Окраска Конго Рот. Х10
Рисунок №15. Амилоидоз поджелудочной железы. Стенки артерий и мелких вен утолщены, окрашены в кирпично-красный цвет, просветы не сужены. Окраска Конго Рот. Х10
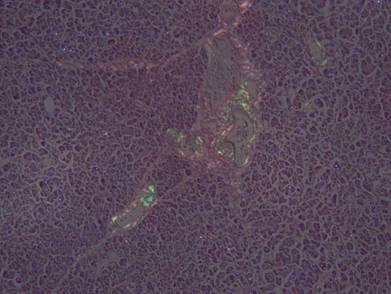 Рисунок №16. Амилоидоз поджелудочной железы. Зеленоватое свечение амилоидных масс в поляризованном свете в стенках артерий и вен поджелудочной железы. Окраска Конго Рот. Х10.
В пищеводе, желудке, тонкой и толстой кишка отложения амилоида наблюдались в стенках сосудов подслизистой оболочки и в меньшей степени, в некоторых волокнах стромы подслизистой оболочки. Атрофии слизистых оболочек при этом не наблюдалось.
Рисунок №16. Амилоидоз поджелудочной железы. Зеленоватое свечение амилоидных масс в поляризованном свете в стенках артерий и вен поджелудочной железы. Окраска Конго Рот. Х10.
В пищеводе, желудке, тонкой и толстой кишка отложения амилоида наблюдались в стенках сосудов подслизистой оболочки и в меньшей степени, в некоторых волокнах стромы подслизистой оболочки. Атрофии слизистых оболочек при этом не наблюдалось.
 Рисунок №17. Амилоидоз подвздошной кишки. В подслизистой оболочке стенки сосудов с зеленовато-желтоватым свечением в поляризованном свете. Окраска Конго-Рот.Х20
В щитовидной железе амилоид откладывался в строме и стенках сосудов, так же не вызывая атрофии её паренхимы.
Рисунок №17. Амилоидоз подвздошной кишки. В подслизистой оболочке стенки сосудов с зеленовато-желтоватым свечением в поляризованном свете. Окраска Конго-Рот.Х20
В щитовидной железе амилоид откладывался в строме и стенках сосудов, так же не вызывая атрофии её паренхимы.
 Рисунок №18. Амилоидоз щитовидной железы. Стенки сосудов стромы утолщены, гомогенные кирпично-красные, просветы не сужены. В строме отложения белка кирпично-красного цвета. Окраска Конго-рот. Х10
Рисунок №18. Амилоидоз щитовидной железы. Стенки сосудов стромы утолщены, гомогенные кирпично-красные, просветы не сужены. В строме отложения белка кирпично-красного цвета. Окраска Конго-рот. Х10
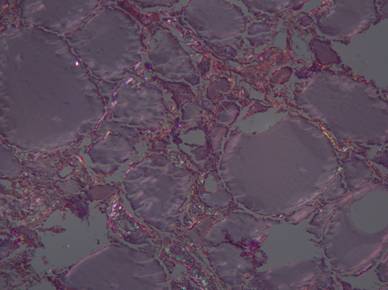 Рисунок №19. Амилоидоз щитовидной железы. Зеленоватое и оранжевое свечение в поляризованном свете стенок сосудов и стромы. Окраска Конго-рот. Х10
Кардиомегалия с увеличением массы сердца до 600 г была в данном случае связана с гипертрофией миокарда левого желудочка с его утолщением до 1,9 см. гипертрофия левого желудочка была связана с тяжелой вторичной артериальной гипертензией с кризовым течением и привела к застою в малом круге кровообращения – бурой индурации легких. Макроскопически миокард был тусклый, бледно-бурый, плотный, малокровный.
Рисунок №19. Амилоидоз щитовидной железы. Зеленоватое и оранжевое свечение в поляризованном свете стенок сосудов и стромы. Окраска Конго-рот. Х10
Кардиомегалия с увеличением массы сердца до 600 г была в данном случае связана с гипертрофией миокарда левого желудочка с его утолщением до 1,9 см. гипертрофия левого желудочка была связана с тяжелой вторичной артериальной гипертензией с кризовым течением и привела к застою в малом круге кровообращения – бурой индурации легких. Макроскопически миокард был тусклый, бледно-бурый, плотный, малокровный.
 Рисунок №17. Гипертрофия миокарда. Верхушка сердца в области межжелудочковой перегородки. Кардиомиоциты резко гипертрофированы, в субэндокардиальной и интрамуральной зоне отмечаются поля фрагментации кардиомиоцитов и миокардиальных волокон. В строме миокарда отек, малокровие. В перикарде диффузная умеренно выраженная инфильтрация нейтрофилами, макрофагами, одиночными лимфоцитами и плазмоцитами, отек, в сосудах микроциркуляторного русла лейкостазы. Окраска гематоксилин-эозин. Х 5
Так же были выявлены диссеминированные очаги некроза и фрагментации кардиомиоцитов, которые явились отражением водно-электролитного дисбаланса и гипоксии, связанных с уремией, анемией и субтотальной деструктивной пневмонией.
Несмотря на то, что поражение миокарда носило преимущественно гипертензивный характер, при гистологическом исследовании отложения амилоида все-ткани были выявлены в небольшом количестве в стенках сосудов всех слоев миокарда и в пристеночном и клапанном эндокарде.
Рисунок №17. Гипертрофия миокарда. Верхушка сердца в области межжелудочковой перегородки. Кардиомиоциты резко гипертрофированы, в субэндокардиальной и интрамуральной зоне отмечаются поля фрагментации кардиомиоцитов и миокардиальных волокон. В строме миокарда отек, малокровие. В перикарде диффузная умеренно выраженная инфильтрация нейтрофилами, макрофагами, одиночными лимфоцитами и плазмоцитами, отек, в сосудах микроциркуляторного русла лейкостазы. Окраска гематоксилин-эозин. Х 5
Так же были выявлены диссеминированные очаги некроза и фрагментации кардиомиоцитов, которые явились отражением водно-электролитного дисбаланса и гипоксии, связанных с уремией, анемией и субтотальной деструктивной пневмонией.
Несмотря на то, что поражение миокарда носило преимущественно гипертензивный характер, при гистологическом исследовании отложения амилоида все-ткани были выявлены в небольшом количестве в стенках сосудов всех слоев миокарда и в пристеночном и клапанном эндокарде.
 Рисунок №18. Амилоидоз сердца. В кирпично-красный цвет окрашены стенки мелких артерий и артериол. Окраска Конго-Рот. Х 10
Рисунок №18. Амилоидоз сердца. В кирпично-красный цвет окрашены стенки мелких артерий и артериол. Окраска Конго-Рот. Х 10
 Рисунок №19. Слабо выраженное зеленоватое и оранжевое свечение в поляризованном свете стенок мелких артерий и артериол, волокон стромы. Окраска Конго-Рот. Х10
Рисунок №19. Слабо выраженное зеленоватое и оранжевое свечение в поляризованном свете стенок мелких артерий и артериол, волокон стромы. Окраска Конго-Рот. Х10
 Рисунок №20. Амилоидоз митрального клапана. В основании и свободной части клапана фиброз, диффузная лимфогистиоцитарная инфильтрация, отложения масс белка кирпично-красного цвета. Окраска Конго-Рот. Х 10
Рисунок №20. Амилоидоз митрального клапана. В основании и свободной части клапана фиброз, диффузная лимфогистиоцитарная инфильтрация, отложения масс белка кирпично-красного цвета. Окраска Конго-Рот. Х 10
 Рисунок №21. Амилоидоз митрального клапана. Зеленоватое и оранжевое свечение в поляризованном свете белковых масс в строме клапана и стенках мелких артерий. Окраска Конго-Рот. Х10
Таким образом, пусковым звеном танатогенеза был нефросклероз с терминальной уремией и вторичной артериальной гипертензией с кризовым течение. Уремия осложнилась уремическим гастроэнтероколитом, диффузным уремическим бронхитом, вторичной анемией, тяжелыми нарушениями водно-электролитного баланса. Нефросклероз так же привел и к тяжелой вторичной артериальной гипертензии с кризовым течением. Ведущий механизм развития артериальной гипертензии в данном случае, вероятнее всего – увеличение объема циркулирующей крови. В пользу этого факта свидетельствует то, что гипотензивный эффект у пациента достигался не комплексной медикаментозной терапией, а гемодиализом. Кроме того, выраженный амилоидоз и атрофия надпочечников исключали их участие в генезе артериальной гипертензии.
В головном мозге были обнаружены признаки перенесенного гипертонического криза и постаноксические подоболочечные очаги энцефалолисиса.
Рисунок №21. Амилоидоз митрального клапана. Зеленоватое и оранжевое свечение в поляризованном свете белковых масс в строме клапана и стенках мелких артерий. Окраска Конго-Рот. Х10
Таким образом, пусковым звеном танатогенеза был нефросклероз с терминальной уремией и вторичной артериальной гипертензией с кризовым течение. Уремия осложнилась уремическим гастроэнтероколитом, диффузным уремическим бронхитом, вторичной анемией, тяжелыми нарушениями водно-электролитного баланса. Нефросклероз так же привел и к тяжелой вторичной артериальной гипертензии с кризовым течением. Ведущий механизм развития артериальной гипертензии в данном случае, вероятнее всего – увеличение объема циркулирующей крови. В пользу этого факта свидетельствует то, что гипотензивный эффект у пациента достигался не комплексной медикаментозной терапией, а гемодиализом. Кроме того, выраженный амилоидоз и атрофия надпочечников исключали их участие в генезе артериальной гипертензии.
В головном мозге были обнаружены признаки перенесенного гипертонического криза и постаноксические подоболочечные очаги энцефалолисиса.
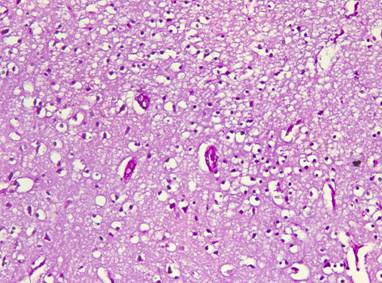 Рисунок №22. Признаки перенесенного гипертонического криза в теменной доле справа. Выраженный периваскулярный и перицеллюлярный отек, диффузный микроглиоз, сморщивание нейронов. Стенки мелких артериол дают PAS положительную реакцию – ярко малинового цвета, что указывает на фибриноидный некроз, однородные, с расширением периваскулярного пространства. PAS реакция. Х20
Рисунок №22. Признаки перенесенного гипертонического криза в теменной доле справа. Выраженный периваскулярный и перицеллюлярный отек, диффузный микроглиоз, сморщивание нейронов. Стенки мелких артериол дают PAS положительную реакцию – ярко малинового цвета, что указывает на фибриноидный некроз, однородные, с расширением периваскулярного пространства. PAS реакция. Х20
 Рисунок №23. Теменная доля справа, подоболочечная зона. В просветах мелких артерий мягкой мозговой оболочки эритроцитарные и лейкоцитарные стазы и сладжи. В сером веществе подоболочечные очаги энцефалолизиса. Окраска гематоксилин-эозин Х10.
Так же клинически, на фоне гипертонического криза при постановке АВфистулы произошла остановка сердца. К сожалению, достоверно судить о причинах развития остановки сердца на тот момент сложно из-за недостатка некоторых клинических данных (например, уровня калия и магния крови перед операцией) и давности относительно дня смерти.
Смертельным осложнением в нашем случае выступила деструктивная двухсторонняя пневмония с фибринозно-гнойным плевритом, приведшая к сепсису и усугубившая интоксикацию и полиорганную недостаточность. Пневмония и связанный с ней сепсис носили бактериально-грибковый характер, что было подтверждено дополнительными гистохимическими окрасками гистологических препаратов и прижизненными лабораторными исследованиями сыворотки крови и мокроты. Ведущим звеном в генезе пневмонии была искусственная вентиляция легких, приведшая так же к острому язвенному трахеобронхиту. Искусственная вентиляция легких проводилась в связи с постаноксической энцефалопатией с глубокими нарушениями сознания. Так же развитию и тяжести течения пневмонии способствовали иммунодефицит, вследствие атрофии периферических органов иммунной защиты и надпочечников, и нарушения микроциркуляции легких вследствие хронической левожелудочковой сердечной недостаточности.
Макроскопически легкие были резко увеличены в размерах и утяжелены. Ткань левого и правого легкого безвоздушная, уплотнена, светло красная, в нижних отделах рыхлая, с западающими бесструктурными сероватыми участками неправильной формы от 0,5 до 1,5 см, с неровными шероховатыми стенками.
При гистологическом исследовании в легких выявлена субтотальная бронхопневмония, напоминающая крупозную в стадии серого опеченения с развитием острых абсцессов. В инфильтрате и в просвете бронхов среди гнойных пробок было обнаружено большое число мицелия грибов рода Candida. Давность пневмонии около 4 суток.
Рисунок №23. Теменная доля справа, подоболочечная зона. В просветах мелких артерий мягкой мозговой оболочки эритроцитарные и лейкоцитарные стазы и сладжи. В сером веществе подоболочечные очаги энцефалолизиса. Окраска гематоксилин-эозин Х10.
Так же клинически, на фоне гипертонического криза при постановке АВфистулы произошла остановка сердца. К сожалению, достоверно судить о причинах развития остановки сердца на тот момент сложно из-за недостатка некоторых клинических данных (например, уровня калия и магния крови перед операцией) и давности относительно дня смерти.
Смертельным осложнением в нашем случае выступила деструктивная двухсторонняя пневмония с фибринозно-гнойным плевритом, приведшая к сепсису и усугубившая интоксикацию и полиорганную недостаточность. Пневмония и связанный с ней сепсис носили бактериально-грибковый характер, что было подтверждено дополнительными гистохимическими окрасками гистологических препаратов и прижизненными лабораторными исследованиями сыворотки крови и мокроты. Ведущим звеном в генезе пневмонии была искусственная вентиляция легких, приведшая так же к острому язвенному трахеобронхиту. Искусственная вентиляция легких проводилась в связи с постаноксической энцефалопатией с глубокими нарушениями сознания. Так же развитию и тяжести течения пневмонии способствовали иммунодефицит, вследствие атрофии периферических органов иммунной защиты и надпочечников, и нарушения микроциркуляции легких вследствие хронической левожелудочковой сердечной недостаточности.
Макроскопически легкие были резко увеличены в размерах и утяжелены. Ткань левого и правого легкого безвоздушная, уплотнена, светло красная, в нижних отделах рыхлая, с западающими бесструктурными сероватыми участками неправильной формы от 0,5 до 1,5 см, с неровными шероховатыми стенками.
При гистологическом исследовании в легких выявлена субтотальная бронхопневмония, напоминающая крупозную в стадии серого опеченения с развитием острых абсцессов. В инфильтрате и в просвете бронхов среди гнойных пробок было обнаружено большое число мицелия грибов рода Candida. Давность пневмонии около 4 суток.
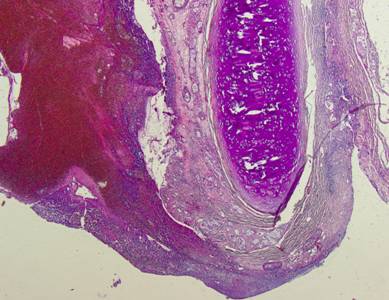 Рисунок №24. Отверстие трахеостомы. На поверхности слизистой оболочки трахеи изъязвления, большое количество кровяных свертков и гнойное воспаление, переходящее на края отверстия и подлежащую клетчатку. Окраска гематоксилин-эозин. Х5
Рисунок №24. Отверстие трахеостомы. На поверхности слизистой оболочки трахеи изъязвления, большое количество кровяных свертков и гнойное воспаление, переходящее на края отверстия и подлежащую клетчатку. Окраска гематоксилин-эозин. Х5
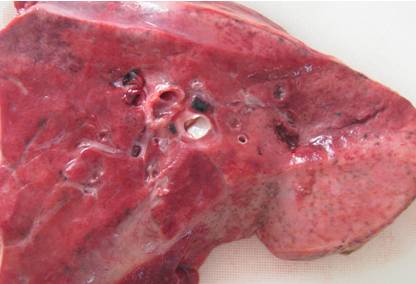 Рисунок №25. Левое легкое с плеврой. Тотальная деструктивная пневмония, острые абсцессы и фибринозно-гнойный плеврит.
Рисунок №25. Левое легкое с плеврой. Тотальная деструктивная пневмония, острые абсцессы и фибринозно-гнойный плеврит.
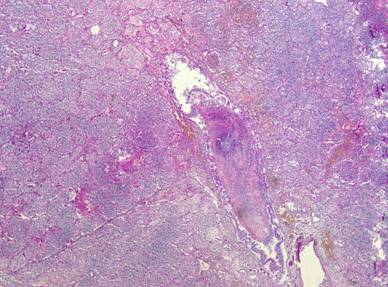 Рисунок №26. Деструктивная бронхопневмония с наличием гнойных «пробок» в просветах бронхов. Окраска гематоксилин-эозин. Х5
Рисунок №26. Деструктивная бронхопневмония с наличием гнойных «пробок» в просветах бронхов. Окраска гематоксилин-эозин. Х5
 Рисунок №27. Верхняя доля правого легкого. В просветах альвеол небольшое количество отечной жидкости, эритроцитов, фибрина, нейтрофилов и гемосидерофагов. Обширные скопления мицелия грибов рода Candida в просветах альвеол. В межальвеолярных перегородках диффузная выраженная инфильтрация лимфоцитами, нейтрофилами и макрофагами. Окраска гематоксилин-эозин. Х10
Рисунок №27. Верхняя доля правого легкого. В просветах альвеол небольшое количество отечной жидкости, эритроцитов, фибрина, нейтрофилов и гемосидерофагов. Обширные скопления мицелия грибов рода Candida в просветах альвеол. В межальвеолярных перегородках диффузная выраженная инфильтрация лимфоцитами, нейтрофилами и макрофагами. Окраска гематоксилин-эозин. Х10
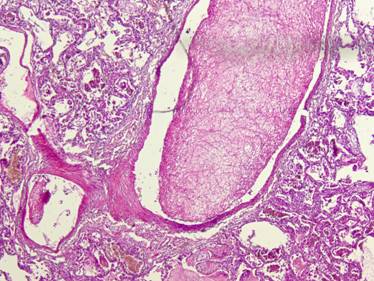 Рисунок №28. Мицелий грибов рода Candida в просветах сосудов легкого. Окраска гематоксилин-эозин. Х10
Таким образом, определены особенности амилоидоза при ПБ. Во-первых, он является основным и наиболее грозным проявлением ПБ, возникающим вне зависимости от её клинического варианта или длительности и тяжести течения. Во-вторых, амилоид при ПБ в большей степени откладывается по ходу ретикулярных волокон с преимущественным поражением почек. Исходя из преимущественно нефропатического характера амилоидоза и меньшей концентрации амилоидного белка в других, доступных для биопсии, органах при ПБ, биопсия почки будет наиболее информативным методом обнаружения амилоида.
На примере данного случая обращает на себя внимание необходимость ранней диагностики и, соответственно, своевременное начало лечения ПБ с целью максимально возможного предотвращения развития её смертельного проявления – амилоидоза.
Важно так же подтверждать диагноз генетическим исследованием и выявлять какая конкретно мутация имеется у пациента. Это позволит в дальнейшем изучить особенности клинического течения каждой из формы мутации и выяснить есть ли зависимость между генотипом при ПБ и развитием амилоидоза.
Так же перспективным направлением для лечения уже развившегося амилоидоза было бы изучение конкретных генетических причин ферментативной и иммунной недостаточности клеток моноцитарно-макрофагальной системы, резорбирующих амилоид.
Список использованной литературы:
1. Айвазян А.А. Периодическая болезнь. Ереван: Айастан, 1982. -216с.
2. Айрапетян А.С. Генетические аспекты периодической болезни у армян: Диссертация доктора медицинских наук. Ереван, 2002. -201с.
3. Виноградова О.М., Потекаева М.А. Клинико-анатомическая характеристика абдоминального синдрома ПБ//Терапевтический архив. 1968. – №2. – С.71-76.
4. Киракосян Б.Е., Наумова В.И., Туманова JI.A. Современные представления о периодической болезни//Российский вестник перинатологии и педиатрии. 1994. – Т.39. – №3. – С.36-38.
5. Козловская Л.В. Амилоидоз//Терапевтический архив. 1998.- №6. С.62-70.
6. Окороков А. Н. Диагностика болезней внутренних органов: Т. 5. Диагностика болезней системы крови. Диагностика болезней почек.: – М.: Мед. лит., 2007. – 512 с.
7. Пальцев М. А., Аничков Н. М. Патологическая аномия: Учебник. – в 2-х т. – Из. 2-е перераб. – Т. 2, ч II. – М.: ОАО «Издательство «Медицина», 2005. – 504 с.
8. Серов В. В., Шамов И. А. Амилоидоз. М.: Медицина, 1977 г., 291 с.
9. Струков А. И., Серов В. В. Патологическая анатомия: Учебник. – 3-е изд., перераб. И доп. – М.: Медицина, 1993. – 688 с.
10. Тареев Е.М., Виноградова О.М., Мухин Н.А. Амилоидоз: некоторые аспекты изучения клиники и патогенеза//Терапевтический архив. 1977. – Т.49. – №10. -С.119-125.
10. Тевосян Т.Г. Клинико-морфологические особенности нефропатии при периодической болезни: Автореферат диссертации кандидата медицинских наук. Ереван, 1986. – 25с.
11. Щербакова М.Ю., Ярошевская О. И., Гуревич О. Е., Высоцкая Т. А., Долгина Е. Н., Пронина Л. А. Случай периодической болезни с исходом в амилоидоз у мальчика 15 лет//Педиатрия. 2006. – №4. – С.111-114.
Рисунок №28. Мицелий грибов рода Candida в просветах сосудов легкого. Окраска гематоксилин-эозин. Х10
Таким образом, определены особенности амилоидоза при ПБ. Во-первых, он является основным и наиболее грозным проявлением ПБ, возникающим вне зависимости от её клинического варианта или длительности и тяжести течения. Во-вторых, амилоид при ПБ в большей степени откладывается по ходу ретикулярных волокон с преимущественным поражением почек. Исходя из преимущественно нефропатического характера амилоидоза и меньшей концентрации амилоидного белка в других, доступных для биопсии, органах при ПБ, биопсия почки будет наиболее информативным методом обнаружения амилоида.
На примере данного случая обращает на себя внимание необходимость ранней диагностики и, соответственно, своевременное начало лечения ПБ с целью максимально возможного предотвращения развития её смертельного проявления – амилоидоза.
Важно так же подтверждать диагноз генетическим исследованием и выявлять какая конкретно мутация имеется у пациента. Это позволит в дальнейшем изучить особенности клинического течения каждой из формы мутации и выяснить есть ли зависимость между генотипом при ПБ и развитием амилоидоза.
Так же перспективным направлением для лечения уже развившегося амилоидоза было бы изучение конкретных генетических причин ферментативной и иммунной недостаточности клеток моноцитарно-макрофагальной системы, резорбирующих амилоид.
Список использованной литературы:
1. Айвазян А.А. Периодическая болезнь. Ереван: Айастан, 1982. -216с.
2. Айрапетян А.С. Генетические аспекты периодической болезни у армян: Диссертация доктора медицинских наук. Ереван, 2002. -201с.
3. Виноградова О.М., Потекаева М.А. Клинико-анатомическая характеристика абдоминального синдрома ПБ//Терапевтический архив. 1968. – №2. – С.71-76.
4. Киракосян Б.Е., Наумова В.И., Туманова JI.A. Современные представления о периодической болезни//Российский вестник перинатологии и педиатрии. 1994. – Т.39. – №3. – С.36-38.
5. Козловская Л.В. Амилоидоз//Терапевтический архив. 1998.- №6. С.62-70.
6. Окороков А. Н. Диагностика болезней внутренних органов: Т. 5. Диагностика болезней системы крови. Диагностика болезней почек.: – М.: Мед. лит., 2007. – 512 с.
7. Пальцев М. А., Аничков Н. М. Патологическая аномия: Учебник. – в 2-х т. – Из. 2-е перераб. – Т. 2, ч II. – М.: ОАО «Издательство «Медицина», 2005. – 504 с.
8. Серов В. В., Шамов И. А. Амилоидоз. М.: Медицина, 1977 г., 291 с.
9. Струков А. И., Серов В. В. Патологическая анатомия: Учебник. – 3-е изд., перераб. И доп. – М.: Медицина, 1993. – 688 с.
10. Тареев Е.М., Виноградова О.М., Мухин Н.А. Амилоидоз: некоторые аспекты изучения клиники и патогенеза//Терапевтический архив. 1977. – Т.49. – №10. -С.119-125.
10. Тевосян Т.Г. Клинико-морфологические особенности нефропатии при периодической болезни: Автореферат диссертации кандидата медицинских наук. Ереван, 1986. – 25с.
11. Щербакова М.Ю., Ярошевская О. И., Гуревич О. Е., Высоцкая Т. А., Долгина Е. Н., Пронина Л. А. Случай периодической болезни с исходом в амилоидоз у мальчика 15 лет//Педиатрия. 2006. – №4. – С.111-114.
 Рисунок №2. Уремическая стадия амилоидоза почек. На разрезе – истонченная паренхима с желтоватыми вкраплениями, большое количество жировой клетчатки в области почечного синуса.
Рисунок №2. Уремическая стадия амилоидоза почек. На разрезе – истонченная паренхима с желтоватыми вкраплениями, большое количество жировой клетчатки в области почечного синуса.
 Рисунок №3. Уремическая стадия амилоидоза почек. Паренхима деформирована за счет склероза, диффузной лимфогистиоцитарной инфильтрации интерстиция. В кирпично-красный цвет окрашены стенки сосудов, преимущественно медия и адвентиция, базальные мембраны канальцев и протоков нефронов, очагово – сам интерстиций, массивные белковые отложения в утолщенных и практически бесклеточных капиллярных петлях клубочков. В просвете канальцев большое число белковых цилиндров. Местами нефротелий трансофрмирован в ксантомные клетки. Окраска Конго-Рот. Х10
Рисунок №3. Уремическая стадия амилоидоза почек. Паренхима деформирована за счет склероза, диффузной лимфогистиоцитарной инфильтрации интерстиция. В кирпично-красный цвет окрашены стенки сосудов, преимущественно медия и адвентиция, базальные мембраны канальцев и протоков нефронов, очагово – сам интерстиций, массивные белковые отложения в утолщенных и практически бесклеточных капиллярных петлях клубочков. В просвете канальцев большое число белковых цилиндров. Местами нефротелий трансофрмирован в ксантомные клетки. Окраска Конго-Рот. Х10
 Рисунок №4. Уремическая стадия амилоидоза почек. Зеленоватое свечение в поляризованном свете амилоидных масс в клубочках почки, стенках артерий и базальной мембране нефронов. Окраска Конго-Рот. Х10
Рисунок №4. Уремическая стадия амилоидоза почек. Зеленоватое свечение в поляризованном свете амилоидных масс в клубочках почки, стенках артерий и базальной мембране нефронов. Окраска Конго-Рот. Х10
 Рисунок №5. Жировая дистрофия эпителия канальцев почки. Цилиндры в просветах атрофированных почечных канальцев. Окраска гематоксилин-эозин. Х20
Рисунок №5. Жировая дистрофия эпителия канальцев почки. Цилиндры в просветах атрофированных почечных канальцев. Окраска гематоксилин-эозин. Х20
 Рисунок №6. Уремическая стадия амилоидоза почек. Отложения гомогенных масс амилоида розового цвета в клубочках. Окраска гематоксилин-эозин. Х10
Амилоидоз надпочечников привел к атрофии коры и мозгового вещества. При этом надпочечники уменьшены в размерах до 2х1,5х0,3 см плотные, с сальным блеском, граница слоев различима, кора желтая, зернистая, мозговое вещество серовато-коричневое, малокровное. При гистологическом исследовании отложение масс амилоида наблюдалось в строме всех слоев коры и мозгового вещества, стенках сосудов.
Рисунок №6. Уремическая стадия амилоидоза почек. Отложения гомогенных масс амилоида розового цвета в клубочках. Окраска гематоксилин-эозин. Х10
Амилоидоз надпочечников привел к атрофии коры и мозгового вещества. При этом надпочечники уменьшены в размерах до 2х1,5х0,3 см плотные, с сальным блеском, граница слоев различима, кора желтая, зернистая, мозговое вещество серовато-коричневое, малокровное. При гистологическом исследовании отложение масс амилоида наблюдалось в строме всех слоев коры и мозгового вещества, стенках сосудов.
 Рисунок №7. Амилоидоз надпочечника. В строме всех слоев коры и мозгового вещества, стенках сосудов массивные отложения масс гомогенного белка кирпично-красного цвета с атрофией и делипоидизацией адренокортикоцитов. Окраска Конго Рот. Х5
Рисунок №7. Амилоидоз надпочечника. В строме всех слоев коры и мозгового вещества, стенках сосудов массивные отложения масс гомогенного белка кирпично-красного цвета с атрофией и делипоидизацией адренокортикоцитов. Окраска Конго Рот. Х5
 Рисунок №8. Амилоидоз надпочечника. Зеленовато-желтоватое свечение в поляризованном свете отложений белка в строме и сосудах надпочечника и сосудах окружающих тканей. Окраска Конго Рот. Х20
Так же у пациента отмечались умеренная гепатоспленомегалия.
Селезенка была увеличена незначительно, массой 218 г, плотная, пульпа селезенки малокровная, бледно-коричневая, с сальным блеском. При гистологическом исследовании отмечалось отложение амилоида в стенках сосудов и в небольшом количестве – в строме с вторичной атрофией лимфоидной ткани.
Рисунок №8. Амилоидоз надпочечника. Зеленовато-желтоватое свечение в поляризованном свете отложений белка в строме и сосудах надпочечника и сосудах окружающих тканей. Окраска Конго Рот. Х20
Так же у пациента отмечались умеренная гепатоспленомегалия.
Селезенка была увеличена незначительно, массой 218 г, плотная, пульпа селезенки малокровная, бледно-коричневая, с сальным блеском. При гистологическом исследовании отмечалось отложение амилоида в стенках сосудов и в небольшом количестве – в строме с вторичной атрофией лимфоидной ткани.
 Рисунок №9. Амилоидоз селезенки. Малокровная строма селезенки с сальным блеском.
Рисунок №9. Амилоидоз селезенки. Малокровная строма селезенки с сальным блеском.
 Рисунок №10. Амилоидоз селезенки. Отложения масс амилоида в стенках артерий, строме селезенки, окрашенные в кирпично-красный цвет. Красная пульпа малокровная, синусы пусты, четко просматриваются, местами содержат скопления амилоидного белка. Рисунок белой пульпы стерт, фолликулы атрофичные, мелкие, малоклеточные, с трудом различимые. Окраска Конго Рот. Х10
Рисунок №10. Амилоидоз селезенки. Отложения масс амилоида в стенках артерий, строме селезенки, окрашенные в кирпично-красный цвет. Красная пульпа малокровная, синусы пусты, четко просматриваются, местами содержат скопления амилоидного белка. Рисунок белой пульпы стерт, фолликулы атрофичные, мелкие, малоклеточные, с трудом различимые. Окраска Конго Рот. Х10
 Рисунок №11. Амилоидоз селезенки. Зеленовато-желтоватое свечение в поляризованном свете стенок артерий и в меньшей степени – стромы. Окраска Конго Рот. Х10
В печени отложение масс амилоида отмечалось в стенках сосудов триад и синусоидах, при этом гепатомегалия так же была умеренной – масса печени составила 1870 г, на разрезе ткань печени так же была малокровной и имела сальный блеск.
Рисунок №11. Амилоидоз селезенки. Зеленовато-желтоватое свечение в поляризованном свете стенок артерий и в меньшей степени – стромы. Окраска Конго Рот. Х10
В печени отложение масс амилоида отмечалось в стенках сосудов триад и синусоидах, при этом гепатомегалия так же была умеренной – масса печени составила 1870 г, на разрезе ткань печени так же была малокровной и имела сальный блеск.
 Рисунок № 12. Амилоидоз печени. Увеличенная малокровная печень с сальным блеском.
Рисунок № 12. Амилоидоз печени. Увеличенная малокровная печень с сальным блеском.
 Рисунок №13. Амилоидоз печени. Стенки артерий триад утолщены, просвет не сужен, окрашены в кирпично-красный цвет. Окраска Конго Рот. Х10
Отложения амилоида в прочих внутренних органах клинически практически не проявлялось. При этом амилоид откладывался преимущественно в стенках сосудов мелкого калибра, что существенно не нарушало трофики и потому не привело к их атрофии.
Поджелудочная железа макроскопически изменена не была. При гистологическом исследовании дольки, островки и ацинусы были обычного строения. В окружающей клетчатке обнаружены жировые некрозы, связанные с септицемией. В строме отек и умеренный фиброз, слабо выраженный липоматоз, скудная лимфоидная инфильтрация. Эпителий междольковых протоков десквамирован, содержит слизь. Стенки артерий однородные, розовые, утолщены, просвет не сужен.
Рисунок №13. Амилоидоз печени. Стенки артерий триад утолщены, просвет не сужен, окрашены в кирпично-красный цвет. Окраска Конго Рот. Х10
Отложения амилоида в прочих внутренних органах клинически практически не проявлялось. При этом амилоид откладывался преимущественно в стенках сосудов мелкого калибра, что существенно не нарушало трофики и потому не привело к их атрофии.
Поджелудочная железа макроскопически изменена не была. При гистологическом исследовании дольки, островки и ацинусы были обычного строения. В окружающей клетчатке обнаружены жировые некрозы, связанные с септицемией. В строме отек и умеренный фиброз, слабо выраженный липоматоз, скудная лимфоидная инфильтрация. Эпителий междольковых протоков десквамирован, содержит слизь. Стенки артерий однородные, розовые, утолщены, просвет не сужен.
 Рисунок №14. Поджелудочная железа. Скопления мицелия грибов в просветах крупных междольковых вен. Окраска гематоксилин-эозин. Х20
Рисунок №14. Поджелудочная железа. Скопления мицелия грибов в просветах крупных междольковых вен. Окраска гематоксилин-эозин. Х20
 Рисунок №15. Амилоидоз поджелудочной железы. Стенки артерий и мелких вен утолщены, окрашены в кирпично-красный цвет, просветы не сужены. Окраска Конго Рот. Х10
Рисунок №15. Амилоидоз поджелудочной железы. Стенки артерий и мелких вен утолщены, окрашены в кирпично-красный цвет, просветы не сужены. Окраска Конго Рот. Х10
 Рисунок №16. Амилоидоз поджелудочной железы. Зеленоватое свечение амилоидных масс в поляризованном свете в стенках артерий и вен поджелудочной железы. Окраска Конго Рот. Х10.
В пищеводе, желудке, тонкой и толстой кишка отложения амилоида наблюдались в стенках сосудов подслизистой оболочки и в меньшей степени, в некоторых волокнах стромы подслизистой оболочки. Атрофии слизистых оболочек при этом не наблюдалось.
Рисунок №16. Амилоидоз поджелудочной железы. Зеленоватое свечение амилоидных масс в поляризованном свете в стенках артерий и вен поджелудочной железы. Окраска Конго Рот. Х10.
В пищеводе, желудке, тонкой и толстой кишка отложения амилоида наблюдались в стенках сосудов подслизистой оболочки и в меньшей степени, в некоторых волокнах стромы подслизистой оболочки. Атрофии слизистых оболочек при этом не наблюдалось.
 Рисунок №17. Амилоидоз подвздошной кишки. В подслизистой оболочке стенки сосудов с зеленовато-желтоватым свечением в поляризованном свете. Окраска Конго-Рот.Х20
В щитовидной железе амилоид откладывался в строме и стенках сосудов, так же не вызывая атрофии её паренхимы.
Рисунок №17. Амилоидоз подвздошной кишки. В подслизистой оболочке стенки сосудов с зеленовато-желтоватым свечением в поляризованном свете. Окраска Конго-Рот.Х20
В щитовидной железе амилоид откладывался в строме и стенках сосудов, так же не вызывая атрофии её паренхимы.
 Рисунок №18. Амилоидоз щитовидной железы. Стенки сосудов стромы утолщены, гомогенные кирпично-красные, просветы не сужены. В строме отложения белка кирпично-красного цвета. Окраска Конго-рот. Х10
Рисунок №18. Амилоидоз щитовидной железы. Стенки сосудов стромы утолщены, гомогенные кирпично-красные, просветы не сужены. В строме отложения белка кирпично-красного цвета. Окраска Конго-рот. Х10
 Рисунок №19. Амилоидоз щитовидной железы. Зеленоватое и оранжевое свечение в поляризованном свете стенок сосудов и стромы. Окраска Конго-рот. Х10
Кардиомегалия с увеличением массы сердца до 600 г была в данном случае связана с гипертрофией миокарда левого желудочка с его утолщением до 1,9 см. гипертрофия левого желудочка была связана с тяжелой вторичной артериальной гипертензией с кризовым течением и привела к застою в малом круге кровообращения – бурой индурации легких. Макроскопически миокард был тусклый, бледно-бурый, плотный, малокровный.
Рисунок №19. Амилоидоз щитовидной железы. Зеленоватое и оранжевое свечение в поляризованном свете стенок сосудов и стромы. Окраска Конго-рот. Х10
Кардиомегалия с увеличением массы сердца до 600 г была в данном случае связана с гипертрофией миокарда левого желудочка с его утолщением до 1,9 см. гипертрофия левого желудочка была связана с тяжелой вторичной артериальной гипертензией с кризовым течением и привела к застою в малом круге кровообращения – бурой индурации легких. Макроскопически миокард был тусклый, бледно-бурый, плотный, малокровный.
 Рисунок №17. Гипертрофия миокарда. Верхушка сердца в области межжелудочковой перегородки. Кардиомиоциты резко гипертрофированы, в субэндокардиальной и интрамуральной зоне отмечаются поля фрагментации кардиомиоцитов и миокардиальных волокон. В строме миокарда отек, малокровие. В перикарде диффузная умеренно выраженная инфильтрация нейтрофилами, макрофагами, одиночными лимфоцитами и плазмоцитами, отек, в сосудах микроциркуляторного русла лейкостазы. Окраска гематоксилин-эозин. Х 5
Так же были выявлены диссеминированные очаги некроза и фрагментации кардиомиоцитов, которые явились отражением водно-электролитного дисбаланса и гипоксии, связанных с уремией, анемией и субтотальной деструктивной пневмонией.
Несмотря на то, что поражение миокарда носило преимущественно гипертензивный характер, при гистологическом исследовании отложения амилоида все-ткани были выявлены в небольшом количестве в стенках сосудов всех слоев миокарда и в пристеночном и клапанном эндокарде.
Рисунок №17. Гипертрофия миокарда. Верхушка сердца в области межжелудочковой перегородки. Кардиомиоциты резко гипертрофированы, в субэндокардиальной и интрамуральной зоне отмечаются поля фрагментации кардиомиоцитов и миокардиальных волокон. В строме миокарда отек, малокровие. В перикарде диффузная умеренно выраженная инфильтрация нейтрофилами, макрофагами, одиночными лимфоцитами и плазмоцитами, отек, в сосудах микроциркуляторного русла лейкостазы. Окраска гематоксилин-эозин. Х 5
Так же были выявлены диссеминированные очаги некроза и фрагментации кардиомиоцитов, которые явились отражением водно-электролитного дисбаланса и гипоксии, связанных с уремией, анемией и субтотальной деструктивной пневмонией.
Несмотря на то, что поражение миокарда носило преимущественно гипертензивный характер, при гистологическом исследовании отложения амилоида все-ткани были выявлены в небольшом количестве в стенках сосудов всех слоев миокарда и в пристеночном и клапанном эндокарде.
 Рисунок №18. Амилоидоз сердца. В кирпично-красный цвет окрашены стенки мелких артерий и артериол. Окраска Конго-Рот. Х 10
Рисунок №18. Амилоидоз сердца. В кирпично-красный цвет окрашены стенки мелких артерий и артериол. Окраска Конго-Рот. Х 10
 Рисунок №19. Слабо выраженное зеленоватое и оранжевое свечение в поляризованном свете стенок мелких артерий и артериол, волокон стромы. Окраска Конго-Рот. Х10
Рисунок №19. Слабо выраженное зеленоватое и оранжевое свечение в поляризованном свете стенок мелких артерий и артериол, волокон стромы. Окраска Конго-Рот. Х10
 Рисунок №20. Амилоидоз митрального клапана. В основании и свободной части клапана фиброз, диффузная лимфогистиоцитарная инфильтрация, отложения масс белка кирпично-красного цвета. Окраска Конго-Рот. Х 10
Рисунок №20. Амилоидоз митрального клапана. В основании и свободной части клапана фиброз, диффузная лимфогистиоцитарная инфильтрация, отложения масс белка кирпично-красного цвета. Окраска Конго-Рот. Х 10
 Рисунок №21. Амилоидоз митрального клапана. Зеленоватое и оранжевое свечение в поляризованном свете белковых масс в строме клапана и стенках мелких артерий. Окраска Конго-Рот. Х10
Таким образом, пусковым звеном танатогенеза был нефросклероз с терминальной уремией и вторичной артериальной гипертензией с кризовым течение. Уремия осложнилась уремическим гастроэнтероколитом, диффузным уремическим бронхитом, вторичной анемией, тяжелыми нарушениями водно-электролитного баланса. Нефросклероз так же привел и к тяжелой вторичной артериальной гипертензии с кризовым течением. Ведущий механизм развития артериальной гипертензии в данном случае, вероятнее всего – увеличение объема циркулирующей крови. В пользу этого факта свидетельствует то, что гипотензивный эффект у пациента достигался не комплексной медикаментозной терапией, а гемодиализом. Кроме того, выраженный амилоидоз и атрофия надпочечников исключали их участие в генезе артериальной гипертензии.
В головном мозге были обнаружены признаки перенесенного гипертонического криза и постаноксические подоболочечные очаги энцефалолисиса.
Рисунок №21. Амилоидоз митрального клапана. Зеленоватое и оранжевое свечение в поляризованном свете белковых масс в строме клапана и стенках мелких артерий. Окраска Конго-Рот. Х10
Таким образом, пусковым звеном танатогенеза был нефросклероз с терминальной уремией и вторичной артериальной гипертензией с кризовым течение. Уремия осложнилась уремическим гастроэнтероколитом, диффузным уремическим бронхитом, вторичной анемией, тяжелыми нарушениями водно-электролитного баланса. Нефросклероз так же привел и к тяжелой вторичной артериальной гипертензии с кризовым течением. Ведущий механизм развития артериальной гипертензии в данном случае, вероятнее всего – увеличение объема циркулирующей крови. В пользу этого факта свидетельствует то, что гипотензивный эффект у пациента достигался не комплексной медикаментозной терапией, а гемодиализом. Кроме того, выраженный амилоидоз и атрофия надпочечников исключали их участие в генезе артериальной гипертензии.
В головном мозге были обнаружены признаки перенесенного гипертонического криза и постаноксические подоболочечные очаги энцефалолисиса.
 Рисунок №22. Признаки перенесенного гипертонического криза в теменной доле справа. Выраженный периваскулярный и перицеллюлярный отек, диффузный микроглиоз, сморщивание нейронов. Стенки мелких артериол дают PAS положительную реакцию – ярко малинового цвета, что указывает на фибриноидный некроз, однородные, с расширением периваскулярного пространства. PAS реакция. Х20
Рисунок №22. Признаки перенесенного гипертонического криза в теменной доле справа. Выраженный периваскулярный и перицеллюлярный отек, диффузный микроглиоз, сморщивание нейронов. Стенки мелких артериол дают PAS положительную реакцию – ярко малинового цвета, что указывает на фибриноидный некроз, однородные, с расширением периваскулярного пространства. PAS реакция. Х20
 Рисунок №23. Теменная доля справа, подоболочечная зона. В просветах мелких артерий мягкой мозговой оболочки эритроцитарные и лейкоцитарные стазы и сладжи. В сером веществе подоболочечные очаги энцефалолизиса. Окраска гематоксилин-эозин Х10.
Так же клинически, на фоне гипертонического криза при постановке АВфистулы произошла остановка сердца. К сожалению, достоверно судить о причинах развития остановки сердца на тот момент сложно из-за недостатка некоторых клинических данных (например, уровня калия и магния крови перед операцией) и давности относительно дня смерти.
Смертельным осложнением в нашем случае выступила деструктивная двухсторонняя пневмония с фибринозно-гнойным плевритом, приведшая к сепсису и усугубившая интоксикацию и полиорганную недостаточность. Пневмония и связанный с ней сепсис носили бактериально-грибковый характер, что было подтверждено дополнительными гистохимическими окрасками гистологических препаратов и прижизненными лабораторными исследованиями сыворотки крови и мокроты. Ведущим звеном в генезе пневмонии была искусственная вентиляция легких, приведшая так же к острому язвенному трахеобронхиту. Искусственная вентиляция легких проводилась в связи с постаноксической энцефалопатией с глубокими нарушениями сознания. Так же развитию и тяжести течения пневмонии способствовали иммунодефицит, вследствие атрофии периферических органов иммунной защиты и надпочечников, и нарушения микроциркуляции легких вследствие хронической левожелудочковой сердечной недостаточности.
Макроскопически легкие были резко увеличены в размерах и утяжелены. Ткань левого и правого легкого безвоздушная, уплотнена, светло красная, в нижних отделах рыхлая, с западающими бесструктурными сероватыми участками неправильной формы от 0,5 до 1,5 см, с неровными шероховатыми стенками.
При гистологическом исследовании в легких выявлена субтотальная бронхопневмония, напоминающая крупозную в стадии серого опеченения с развитием острых абсцессов. В инфильтрате и в просвете бронхов среди гнойных пробок было обнаружено большое число мицелия грибов рода Candida. Давность пневмонии около 4 суток.
Рисунок №23. Теменная доля справа, подоболочечная зона. В просветах мелких артерий мягкой мозговой оболочки эритроцитарные и лейкоцитарные стазы и сладжи. В сером веществе подоболочечные очаги энцефалолизиса. Окраска гематоксилин-эозин Х10.
Так же клинически, на фоне гипертонического криза при постановке АВфистулы произошла остановка сердца. К сожалению, достоверно судить о причинах развития остановки сердца на тот момент сложно из-за недостатка некоторых клинических данных (например, уровня калия и магния крови перед операцией) и давности относительно дня смерти.
Смертельным осложнением в нашем случае выступила деструктивная двухсторонняя пневмония с фибринозно-гнойным плевритом, приведшая к сепсису и усугубившая интоксикацию и полиорганную недостаточность. Пневмония и связанный с ней сепсис носили бактериально-грибковый характер, что было подтверждено дополнительными гистохимическими окрасками гистологических препаратов и прижизненными лабораторными исследованиями сыворотки крови и мокроты. Ведущим звеном в генезе пневмонии была искусственная вентиляция легких, приведшая так же к острому язвенному трахеобронхиту. Искусственная вентиляция легких проводилась в связи с постаноксической энцефалопатией с глубокими нарушениями сознания. Так же развитию и тяжести течения пневмонии способствовали иммунодефицит, вследствие атрофии периферических органов иммунной защиты и надпочечников, и нарушения микроциркуляции легких вследствие хронической левожелудочковой сердечной недостаточности.
Макроскопически легкие были резко увеличены в размерах и утяжелены. Ткань левого и правого легкого безвоздушная, уплотнена, светло красная, в нижних отделах рыхлая, с западающими бесструктурными сероватыми участками неправильной формы от 0,5 до 1,5 см, с неровными шероховатыми стенками.
При гистологическом исследовании в легких выявлена субтотальная бронхопневмония, напоминающая крупозную в стадии серого опеченения с развитием острых абсцессов. В инфильтрате и в просвете бронхов среди гнойных пробок было обнаружено большое число мицелия грибов рода Candida. Давность пневмонии около 4 суток.
 Рисунок №24. Отверстие трахеостомы. На поверхности слизистой оболочки трахеи изъязвления, большое количество кровяных свертков и гнойное воспаление, переходящее на края отверстия и подлежащую клетчатку. Окраска гематоксилин-эозин. Х5
Рисунок №24. Отверстие трахеостомы. На поверхности слизистой оболочки трахеи изъязвления, большое количество кровяных свертков и гнойное воспаление, переходящее на края отверстия и подлежащую клетчатку. Окраска гематоксилин-эозин. Х5
 Рисунок №25. Левое легкое с плеврой. Тотальная деструктивная пневмония, острые абсцессы и фибринозно-гнойный плеврит.
Рисунок №25. Левое легкое с плеврой. Тотальная деструктивная пневмония, острые абсцессы и фибринозно-гнойный плеврит.
 Рисунок №26. Деструктивная бронхопневмония с наличием гнойных «пробок» в просветах бронхов. Окраска гематоксилин-эозин. Х5
Рисунок №26. Деструктивная бронхопневмония с наличием гнойных «пробок» в просветах бронхов. Окраска гематоксилин-эозин. Х5
 Рисунок №27. Верхняя доля правого легкого. В просветах альвеол небольшое количество отечной жидкости, эритроцитов, фибрина, нейтрофилов и гемосидерофагов. Обширные скопления мицелия грибов рода Candida в просветах альвеол. В межальвеолярных перегородках диффузная выраженная инфильтрация лимфоцитами, нейтрофилами и макрофагами. Окраска гематоксилин-эозин. Х10
Рисунок №27. Верхняя доля правого легкого. В просветах альвеол небольшое количество отечной жидкости, эритроцитов, фибрина, нейтрофилов и гемосидерофагов. Обширные скопления мицелия грибов рода Candida в просветах альвеол. В межальвеолярных перегородках диффузная выраженная инфильтрация лимфоцитами, нейтрофилами и макрофагами. Окраска гематоксилин-эозин. Х10
 Рисунок №28. Мицелий грибов рода Candida в просветах сосудов легкого. Окраска гематоксилин-эозин. Х10
Таким образом, определены особенности амилоидоза при ПБ. Во-первых, он является основным и наиболее грозным проявлением ПБ, возникающим вне зависимости от её клинического варианта или длительности и тяжести течения. Во-вторых, амилоид при ПБ в большей степени откладывается по ходу ретикулярных волокон с преимущественным поражением почек. Исходя из преимущественно нефропатического характера амилоидоза и меньшей концентрации амилоидного белка в других, доступных для биопсии, органах при ПБ, биопсия почки будет наиболее информативным методом обнаружения амилоида.
На примере данного случая обращает на себя внимание необходимость ранней диагностики и, соответственно, своевременное начало лечения ПБ с целью максимально возможного предотвращения развития её смертельного проявления – амилоидоза.
Важно так же подтверждать диагноз генетическим исследованием и выявлять какая конкретно мутация имеется у пациента. Это позволит в дальнейшем изучить особенности клинического течения каждой из формы мутации и выяснить есть ли зависимость между генотипом при ПБ и развитием амилоидоза.
Так же перспективным направлением для лечения уже развившегося амилоидоза было бы изучение конкретных генетических причин ферментативной и иммунной недостаточности клеток моноцитарно-макрофагальной системы, резорбирующих амилоид.
Список использованной литературы:
1. Айвазян А.А. Периодическая болезнь. Ереван: Айастан, 1982. -216с.
2. Айрапетян А.С. Генетические аспекты периодической болезни у армян: Диссертация доктора медицинских наук. Ереван, 2002. -201с.
3. Виноградова О.М., Потекаева М.А. Клинико-анатомическая характеристика абдоминального синдрома ПБ//Терапевтический архив. 1968. – №2. – С.71-76.
4. Киракосян Б.Е., Наумова В.И., Туманова JI.A. Современные представления о периодической болезни//Российский вестник перинатологии и педиатрии. 1994. – Т.39. – №3. – С.36-38.
5. Козловская Л.В. Амилоидоз//Терапевтический архив. 1998.- №6. С.62-70.
6. Окороков А. Н. Диагностика болезней внутренних органов: Т. 5. Диагностика болезней системы крови. Диагностика болезней почек.: – М.: Мед. лит., 2007. – 512 с.
7. Пальцев М. А., Аничков Н. М. Патологическая аномия: Учебник. – в 2-х т. – Из. 2-е перераб. – Т. 2, ч II. – М.: ОАО «Издательство «Медицина», 2005. – 504 с.
8. Серов В. В., Шамов И. А. Амилоидоз. М.: Медицина, 1977 г., 291 с.
9. Струков А. И., Серов В. В. Патологическая анатомия: Учебник. – 3-е изд., перераб. И доп. – М.: Медицина, 1993. – 688 с.
10. Тареев Е.М., Виноградова О.М., Мухин Н.А. Амилоидоз: некоторые аспекты изучения клиники и патогенеза//Терапевтический архив. 1977. – Т.49. – №10. -С.119-125.
10. Тевосян Т.Г. Клинико-морфологические особенности нефропатии при периодической болезни: Автореферат диссертации кандидата медицинских наук. Ереван, 1986. – 25с.
11. Щербакова М.Ю., Ярошевская О. И., Гуревич О. Е., Высоцкая Т. А., Долгина Е. Н., Пронина Л. А. Случай периодической болезни с исходом в амилоидоз у мальчика 15 лет//Педиатрия. 2006. – №4. – С.111-114.
Рисунок №28. Мицелий грибов рода Candida в просветах сосудов легкого. Окраска гематоксилин-эозин. Х10
Таким образом, определены особенности амилоидоза при ПБ. Во-первых, он является основным и наиболее грозным проявлением ПБ, возникающим вне зависимости от её клинического варианта или длительности и тяжести течения. Во-вторых, амилоид при ПБ в большей степени откладывается по ходу ретикулярных волокон с преимущественным поражением почек. Исходя из преимущественно нефропатического характера амилоидоза и меньшей концентрации амилоидного белка в других, доступных для биопсии, органах при ПБ, биопсия почки будет наиболее информативным методом обнаружения амилоида.
На примере данного случая обращает на себя внимание необходимость ранней диагностики и, соответственно, своевременное начало лечения ПБ с целью максимально возможного предотвращения развития её смертельного проявления – амилоидоза.
Важно так же подтверждать диагноз генетическим исследованием и выявлять какая конкретно мутация имеется у пациента. Это позволит в дальнейшем изучить особенности клинического течения каждой из формы мутации и выяснить есть ли зависимость между генотипом при ПБ и развитием амилоидоза.
Так же перспективным направлением для лечения уже развившегося амилоидоза было бы изучение конкретных генетических причин ферментативной и иммунной недостаточности клеток моноцитарно-макрофагальной системы, резорбирующих амилоид.
Список использованной литературы:
1. Айвазян А.А. Периодическая болезнь. Ереван: Айастан, 1982. -216с.
2. Айрапетян А.С. Генетические аспекты периодической болезни у армян: Диссертация доктора медицинских наук. Ереван, 2002. -201с.
3. Виноградова О.М., Потекаева М.А. Клинико-анатомическая характеристика абдоминального синдрома ПБ//Терапевтический архив. 1968. – №2. – С.71-76.
4. Киракосян Б.Е., Наумова В.И., Туманова JI.A. Современные представления о периодической болезни//Российский вестник перинатологии и педиатрии. 1994. – Т.39. – №3. – С.36-38.
5. Козловская Л.В. Амилоидоз//Терапевтический архив. 1998.- №6. С.62-70.
6. Окороков А. Н. Диагностика болезней внутренних органов: Т. 5. Диагностика болезней системы крови. Диагностика болезней почек.: – М.: Мед. лит., 2007. – 512 с.
7. Пальцев М. А., Аничков Н. М. Патологическая аномия: Учебник. – в 2-х т. – Из. 2-е перераб. – Т. 2, ч II. – М.: ОАО «Издательство «Медицина», 2005. – 504 с.
8. Серов В. В., Шамов И. А. Амилоидоз. М.: Медицина, 1977 г., 291 с.
9. Струков А. И., Серов В. В. Патологическая анатомия: Учебник. – 3-е изд., перераб. И доп. – М.: Медицина, 1993. – 688 с.
10. Тареев Е.М., Виноградова О.М., Мухин Н.А. Амилоидоз: некоторые аспекты изучения клиники и патогенеза//Терапевтический архив. 1977. – Т.49. – №10. -С.119-125.
10. Тевосян Т.Г. Клинико-морфологические особенности нефропатии при периодической болезни: Автореферат диссертации кандидата медицинских наук. Ереван, 1986. – 25с.
11. Щербакова М.Ю., Ярошевская О. И., Гуревич О. Е., Высоцкая Т. А., Долгина Е. Н., Пронина Л. А. Случай периодической болезни с исходом в амилоидоз у мальчика 15 лет//Педиатрия. 2006. – №4. – С.111-114. 

