Просмотров: 30 509
ДЕРМАТОМИОЗИТ-ПОЛИМИОЗИТ
Ирина Александровна Зборовская – д.м.н., профессор, профессор кафедры госпитальной терапии с курсом клинической ревматологии факультета усовершенствования врачей Волгоградского государственного медицинского университета, директор Федерального Бюджетного Государственного Учреждения «Научно-исследовательский институт клинической и экспериментальной ревматологии» РАМН, руководитель регионального Центра по проблемам остеопороза, член президиума Ассоциации ревматологов России, член редакционных советов журналов «Научно – практическая ревматология» и «Современная ревматология»
Определение
Дерматомиозит – это заболевание, характеризующееся системным поражением поперечно-полосатой мускулатуры и своеобразным поражением кожных покровов. Относится к группе системных заболеваний соединительной ткани. Если поражение кожи отсутствует, применяется термин “полимиозит”. Эпидемиология
1. Заболевание встречается в любом возрасте. Ежегодно диагностируется 5 новых случаев на 1 млн. населения.
2. Болеют чаще женщины. Соотношение женщин и мужчин при этом заболевании достигает 3:1.
При опухолевом миозите и ювенильном ДМ в соотношении 1:1, а при миозите, ассоциирующемся с ДБСТ, в соотношении 10:1. Миозит с включениями развивается в 3 раза чаще у мужчин, чем у женщин.
Отмечено два возрастных пика заболевания: 11 —17 и 35—60 лет.
3. Полимиозит у взрослых часто сопровождает онкологическое заболевание. Опухолевый ДМ составляет 20-30% всех случаев заболевания особенно в возрастной группе старше 50 лет.
Как вы видите, причин воспалительных миопатий достаточно много.
Эпидемиология
1. Заболевание встречается в любом возрасте. Ежегодно диагностируется 5 новых случаев на 1 млн. населения.
2. Болеют чаще женщины. Соотношение женщин и мужчин при этом заболевании достигает 3:1.
При опухолевом миозите и ювенильном ДМ в соотношении 1:1, а при миозите, ассоциирующемся с ДБСТ, в соотношении 10:1. Миозит с включениями развивается в 3 раза чаще у мужчин, чем у женщин.
Отмечено два возрастных пика заболевания: 11 —17 и 35—60 лет.
3. Полимиозит у взрослых часто сопровождает онкологическое заболевание. Опухолевый ДМ составляет 20-30% всех случаев заболевания особенно в возрастной группе старше 50 лет.
Как вы видите, причин воспалительных миопатий достаточно много.
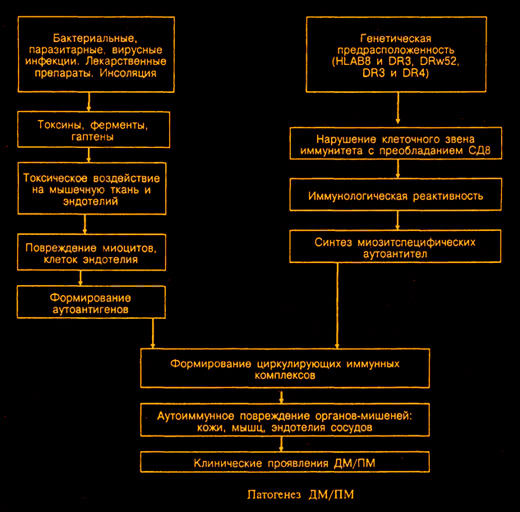 Этиопатогенез
I. В связи с тем, что этиология этих заболеваний неизвестна, а ведущими клиническими проявлениями являются мышечные изменения воспалительного генеза, ДМ и ПМ, а также некоторые другие заболевания часто обозначают более широким термином — идиопатические воспалительные миопатии (ИВМ), однако только первые два рассматриваются как прототипы аутоиммунной патологии скелетной мускулатуры человека.
Причина возникновения дерматомиозита неизвестна.
Не исключается вирусная природа заболевания (пикорнавирусы, вирус Коксаки В2, А9), а также участие бактериальных, паразитарных (риккетсиоз, шистоматоз, трихинеллез и др.) инфекций. Описаны случаи развития ДМ и ПМ после перенесенной краснухи, герпетической инфекции, введения вакцин и сывороток, приема лекарственных препаратов. Провоцирующими факторами могут явиться переохлаждение, инсоляция, избыточная физическая нагрузка и др.
1. Повышенные титры антител к пикорнавирусам обнаружены в крови больных дерматомиозитом детей, а высокие титры антител к Toxoplasma gondii найдены в крови больных полимиозитом взрослых. У некоторых больных в мышечных волокнах были обнаружены вирусоподобные частицы.
2. До настоящего времени не удалось выделить вирусы из мышц больных.
Результаты вирусологических и серологических исследований, а также неудачные попытки воспроизвести миозит у экспериментальных животных путем введения им экстрактов мышечной ткани больных не позволяют подтвердить вирусную природу этих заболеваний. Тем не менее, нельзя исключить, что образование аутоантител к цитоплазматическим белкам связано с иммунным ответом на измененные вирусы, антигены которых напоминают собственные антигены организма.
В последние годы нашла подтверждение и наследственная предрасположенность к развитию ДМ и ПМ. Описаны случаи заболевания у кровных родственников., а также частая выявляемость у больных ассоциации маркеров HLAB8 и DR3
II. Аутоиммунитет.
Роль наследственности и иммунных механизмов в патогенезе подтверждается наличием семейных случаев и частым выявлением HLA-DR3 и HLA-DRW52 у больных.
1. Гуморальный.
1) У большинства больных при воспалительных миопатиях находят аутоантитела при использовании культуры эпителиальных клеток человека (Нер-2). Некрозу мышечных волокон при ДМ предшествует поражение сосудов, опосредованное антителами.
Одним из вероятных механизмов аутоиммунизации у больных ДМ и ПМ является перекрестная реакция между инфекционными антигенами и аутоантигенами, к которым формируются аутоантитела.
2) Поэтому, важная роль может принадлежать феномену молекулярной мимикрии, так как антитела к синтетазам транспортных РНК, выявляемые у некоторых больных, могут быть следствием молекулярной мимикрии вируса и антигенных детерминант внутриклеточных ферментов.
Образующиеся циркулирующие иммунные комплексы (ЦИК) откладываются в тканях (мышцах, коже, сосудах и др.) и ведут к развитию иммунокомплексного воспаления.
3) Развитие опухолевого ДМ связывается как с возможностью прямого токсического действия на мышцы опухолевых субстанций, так и с развитием аутоиммунной реакции вследствие общности антигенов опухолевой и мышечной ткани.
4) Внутрисосудистые отложения иммунных комплексов при дерматомиозите, особенно ювенильном, связывают с повреждением эндотелиальных клеток и последующей обструкцией мелких сосудов.
2. Клеточный.
Многочисленные данные свидетельствуют о роли клеточных иммунных нарушений в развитии данных заболеваний. Предполагается, что поражение мышц при ПМ связано с развитием Т-клеточной цитотоксичности против мышечных клеток, экспрессирующих антигены класса I главного комплекса гистосовместимости.
Центральным патогенетическим фактором болезни считают деградацию мышечных элементов и инфильтрацию сенсибилизированными лимфоцитами и макрофагами.
1) Полимиозит
При полимиозите лимфоциты периферической крови продуцируют лимфотоксины, направленные против мышечных элементов (перфорин и гранзим).
В воспалительных мышечных инфильтратах находят цитотоксические CD8+ -Т-лимфоциты.
2) Дерматомиозит.
При дерматомиозите доминирующие клетки в инфильтратах- CD4+-Т-клетки и В-лимфоциты, что связывают с большим, чем при полимиозите, значением гуморальных факторов аутоиммунитета, приводящим к комплемент-зависимому повреждению микрососудов.
Патоморфология
I. Основные очаги воспаления – скелетная мускулатура, иногда миокард. Поражения кожи встречают реже.
II. В воспалительных инфильтратах преобладают лимфоциты и плазматические клетки, также присутствуют макрофаги, эозинофилы и нейтрофилы.
1. При полимиозите CD8+-клетки инфильтруют мышечные волокна.
2. При дерматомиозите вокруг мелких сосудов накапливаются CD4+-клетки и В-лимфоциты.
III. Повреждение мышечных волокон.
1. Основные изменения – очаговый некроз, дегенерация мышечных волокон и потеря поперечной исчерченности.
2. Признаки регенерации в скелетных мышцах проявляются увеличением числа мышечных ядер, базофилией мышечных элементов.
3. При хроническом течении возникают интерстициальные фиброзные инфильтраты.
4. При длительном течении мышцы атрофируются и замещаются плотной соединительной тканью. Развиваются фиброзные контрактуры, которые необратимы.
IV. Повреждение кожи.
Атрофия сосочков, истончение эпидермиса, утолщение и изменение структуры коллагеновых волокон.
Этиопатогенез
I. В связи с тем, что этиология этих заболеваний неизвестна, а ведущими клиническими проявлениями являются мышечные изменения воспалительного генеза, ДМ и ПМ, а также некоторые другие заболевания часто обозначают более широким термином — идиопатические воспалительные миопатии (ИВМ), однако только первые два рассматриваются как прототипы аутоиммунной патологии скелетной мускулатуры человека.
Причина возникновения дерматомиозита неизвестна.
Не исключается вирусная природа заболевания (пикорнавирусы, вирус Коксаки В2, А9), а также участие бактериальных, паразитарных (риккетсиоз, шистоматоз, трихинеллез и др.) инфекций. Описаны случаи развития ДМ и ПМ после перенесенной краснухи, герпетической инфекции, введения вакцин и сывороток, приема лекарственных препаратов. Провоцирующими факторами могут явиться переохлаждение, инсоляция, избыточная физическая нагрузка и др.
1. Повышенные титры антител к пикорнавирусам обнаружены в крови больных дерматомиозитом детей, а высокие титры антител к Toxoplasma gondii найдены в крови больных полимиозитом взрослых. У некоторых больных в мышечных волокнах были обнаружены вирусоподобные частицы.
2. До настоящего времени не удалось выделить вирусы из мышц больных.
Результаты вирусологических и серологических исследований, а также неудачные попытки воспроизвести миозит у экспериментальных животных путем введения им экстрактов мышечной ткани больных не позволяют подтвердить вирусную природу этих заболеваний. Тем не менее, нельзя исключить, что образование аутоантител к цитоплазматическим белкам связано с иммунным ответом на измененные вирусы, антигены которых напоминают собственные антигены организма.
В последние годы нашла подтверждение и наследственная предрасположенность к развитию ДМ и ПМ. Описаны случаи заболевания у кровных родственников., а также частая выявляемость у больных ассоциации маркеров HLAB8 и DR3
II. Аутоиммунитет.
Роль наследственности и иммунных механизмов в патогенезе подтверждается наличием семейных случаев и частым выявлением HLA-DR3 и HLA-DRW52 у больных.
1. Гуморальный.
1) У большинства больных при воспалительных миопатиях находят аутоантитела при использовании культуры эпителиальных клеток человека (Нер-2). Некрозу мышечных волокон при ДМ предшествует поражение сосудов, опосредованное антителами.
Одним из вероятных механизмов аутоиммунизации у больных ДМ и ПМ является перекрестная реакция между инфекционными антигенами и аутоантигенами, к которым формируются аутоантитела.
2) Поэтому, важная роль может принадлежать феномену молекулярной мимикрии, так как антитела к синтетазам транспортных РНК, выявляемые у некоторых больных, могут быть следствием молекулярной мимикрии вируса и антигенных детерминант внутриклеточных ферментов.
Образующиеся циркулирующие иммунные комплексы (ЦИК) откладываются в тканях (мышцах, коже, сосудах и др.) и ведут к развитию иммунокомплексного воспаления.
3) Развитие опухолевого ДМ связывается как с возможностью прямого токсического действия на мышцы опухолевых субстанций, так и с развитием аутоиммунной реакции вследствие общности антигенов опухолевой и мышечной ткани.
4) Внутрисосудистые отложения иммунных комплексов при дерматомиозите, особенно ювенильном, связывают с повреждением эндотелиальных клеток и последующей обструкцией мелких сосудов.
2. Клеточный.
Многочисленные данные свидетельствуют о роли клеточных иммунных нарушений в развитии данных заболеваний. Предполагается, что поражение мышц при ПМ связано с развитием Т-клеточной цитотоксичности против мышечных клеток, экспрессирующих антигены класса I главного комплекса гистосовместимости.
Центральным патогенетическим фактором болезни считают деградацию мышечных элементов и инфильтрацию сенсибилизированными лимфоцитами и макрофагами.
1) Полимиозит
При полимиозите лимфоциты периферической крови продуцируют лимфотоксины, направленные против мышечных элементов (перфорин и гранзим).
В воспалительных мышечных инфильтратах находят цитотоксические CD8+ -Т-лимфоциты.
2) Дерматомиозит.
При дерматомиозите доминирующие клетки в инфильтратах- CD4+-Т-клетки и В-лимфоциты, что связывают с большим, чем при полимиозите, значением гуморальных факторов аутоиммунитета, приводящим к комплемент-зависимому повреждению микрососудов.
Патоморфология
I. Основные очаги воспаления – скелетная мускулатура, иногда миокард. Поражения кожи встречают реже.
II. В воспалительных инфильтратах преобладают лимфоциты и плазматические клетки, также присутствуют макрофаги, эозинофилы и нейтрофилы.
1. При полимиозите CD8+-клетки инфильтруют мышечные волокна.
2. При дерматомиозите вокруг мелких сосудов накапливаются CD4+-клетки и В-лимфоциты.
III. Повреждение мышечных волокон.
1. Основные изменения – очаговый некроз, дегенерация мышечных волокон и потеря поперечной исчерченности.
2. Признаки регенерации в скелетных мышцах проявляются увеличением числа мышечных ядер, базофилией мышечных элементов.
3. При хроническом течении возникают интерстициальные фиброзные инфильтраты.
4. При длительном течении мышцы атрофируются и замещаются плотной соединительной тканью. Развиваются фиброзные контрактуры, которые необратимы.
IV. Повреждение кожи.
Атрофия сосочков, истончение эпидермиса, утолщение и изменение структуры коллагеновых волокон.

Классификация
I. Клинические синдромы. Данное заболевание может проявляться следующими клиническими синдромами: 1. Полимиозит. 1. Основные проявления – мышечная слабость в проксимальных отделах верхних конечностей и повышение активности мышечных ферментов. Возможны поражения внутренних органов. Поражения кожи отсутствуют. 2. Заболевание плохо поддаётся лечению, особенно, если обнаружены антитела к распознающим сигналы частицам. У таких больных наблюдают тяжёлое течение болезни с частым поражением миокарда.2. Дерматомиозит
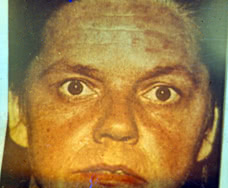
1. От полимиозита его отличают кожные поражения. 2. Обычно дерматомиозит хорошо поддаётся лечению. 3. Существует 2 варианта течения болезни, различающиеся клиническими признаками и прогнозом. Они отличаются по степени выраженности симптомов. Кроме классических вариантов ДМ и ПМ, можно выделить несколько клинико-иммунологических подтипов, развитие которых ассоциируется с синтезом различных типов антител. Эти подтипы различаются не только по спектру клинических проявлений, но и по иммуногенетическим маркерам, прогнозу, ответу на применение глюкокортикостероидов (ГКС). 1-й вариант с антителами к синтетазам. Синтез антител к аминоацил-тРНК-синтетазам ассоциируется с развитием так называемого антисинтетазного синдрома, для которого характерны следующие основные признаки: Для этого варианта характерны: острое начало миозита, интерстициальное поражение лёгких, симметричный полиартрит и “руки мастерового”, возможны лихорадка и феномен Рейно. Дебют заболевания – преимущественно в весеннее время. Характерным проявлением антисинтетазного синдрома является интерстициальное поражение легких, которое выявляется у 50—70% больных с наличием антител Jо-1. Развитие артрита чаще наблюдается у больных с наличием антител Jо-1 (57—100%), чем при других формах миозита. Артрит, как правило, не эрозивный, характеризуется наиболее частым вовлечением в процесс мелких суставов кистей и лучезапястных суставов. Феномен Рейно при антисинтетазном синдроме наблюдается в 60% случаев. Лечение эффективно на ранних этапах, но часто возникают обострения, особенно на снижение дозы, а тяжелое интерстициальное поражение легких может привести к смерти больного. 2-й вариант с антителами к Mi-2 Этот вариант считают проностически благоприятным. У больных при этом варианте встречают симптомы:- Гелиотропных век (солнечных век) – фиолетовое окрашивание и припухлость глазных век.
- Готтрона – это возвышающиеся над кожей эритематозные папулы вокруг пястно-фаланговых и проксимальных межфаланговых суставов.
- Симптом “шали” – это эритема на шее и верхней части спины.
 3. Полимиозиты или дерматомиозиты, сочетающиеся с онкопатологией.
1) Онкологические заболевания находят у 10-25 % лиц с воспалительными миопатиями, особенно, если они развиваются у взрослых. Чаще онкологические заболевания связаны с дерматомиозитом. Хотя характер поражения кожи и мышц при этом такой же, данную форму рассматривают как самостоятельную и относят к паранеопластическим синдромам.
2) К типичным злокачественным процессам, сопровождающимися миопатиями, относят рак лёгкого, ЖКТ, молочной железы, матки и яичников.
Терапия опухоли приводит к улучшению клинической симптоматики миопатии, но прогноз остается неблагоприятным.
4. Ювенильный дерматомиозит.
1) В 1975 году зарубежные исследователи выделили ДМ (ПМ) у детей как особую форму в связи с выраженностью и частотой васкулита в этой группе.
Дети страдают дерматомиозитом чаще, чем взрослые.
2) На поздних стадиях заболевания могут развиться контрактуры вследствие кальцификации (в 5 раз чаще, чем у взрослых) хронически воспаленных мышц.
3) У большинства больных генерализованное поражение мелких сосудов по типу васкулита приводит к ишемическим повреждениям кожи, мышц и кишечника. Часто обнаруживают очаги некроза кожи и ишемические инфаркты почек и ЖКТ, изредка – ишемические инфаркты головного мозга. Отсутствие сочетаний с опухолевым процессом. Прогноз такой же. Как у взрослых.
5. Перекрестные синдромы.
1) Поражение мышц, идентичное полимиозиту, может иметь место при СКВ, ССД, РА и синдроме Шегрена.
Существуют практически 3 варианта сочетания ПМ с другими заболеваниями соединительной ткани.
Первый, когда к картине ДМ (ПМ) присоединяется отдельный(ые) признак(и) другого заболевания, например СКВ или ССД.
Второй вариант, когда имеются одновременно признаки ДМ (ПМ) и другого (или других) ревматического заболевания, образуя смешанное заболевание соединительной ткани или overlap-синдром.
Третий — развитие ПМ на фоне других диффузных болезней соединительной ткани, например ССД или СКВ, когда ПМ является синдромом основного заболевания. В каждом из таких наблюдений необходимо исключать сходную с другими ревматическими заболеваниями симптоматику. Так, кожные изменения, особенно при выраженной эритеме и трофических нарушениях, близки наблюдающимся при хронической красной волчанке, а при наличии отека и маскообразности являются склеродермоподобными. Мышечный синдром (без кожных изменений) нередко трактуется как ревматическая полимиалгия, первичная фибромиалгия, а в последнее время и как диффузный фасциит. Общая картина заболевания, наблюдение и использование диагностических критериев позволяют, как правило, правильно диагностировать ДМ (ПМ).
В основе наблюдающегося полиморфизма ДМ (ПМ), особенно его сочетаний с диффузными болезнями соединительной ткани, лежат, по-видимому, иммуногенетические особенности, что проявляется «неравновесным сцеплением» и комбинацией не только определенных генов, ответственных за заболевание, но и связанных с ними клинических симптомокомплексов, формирующих overlap-синдром. Этим можно, очевидно, объяснить и наличие признаков иногда трех и даже четырех ревматических заболеваний, включая ПМ у одного больного.
2) Характерно, что миопатия при этих заболеваниях легче поддаётся терапевтическому воздействию, а прогноз определяет основное заболевание, а не поражение мышц.
3) Итак, для перекрестных синдромов характерны:
3. Полимиозиты или дерматомиозиты, сочетающиеся с онкопатологией.
1) Онкологические заболевания находят у 10-25 % лиц с воспалительными миопатиями, особенно, если они развиваются у взрослых. Чаще онкологические заболевания связаны с дерматомиозитом. Хотя характер поражения кожи и мышц при этом такой же, данную форму рассматривают как самостоятельную и относят к паранеопластическим синдромам.
2) К типичным злокачественным процессам, сопровождающимися миопатиями, относят рак лёгкого, ЖКТ, молочной железы, матки и яичников.
Терапия опухоли приводит к улучшению клинической симптоматики миопатии, но прогноз остается неблагоприятным.
4. Ювенильный дерматомиозит.
1) В 1975 году зарубежные исследователи выделили ДМ (ПМ) у детей как особую форму в связи с выраженностью и частотой васкулита в этой группе.
Дети страдают дерматомиозитом чаще, чем взрослые.
2) На поздних стадиях заболевания могут развиться контрактуры вследствие кальцификации (в 5 раз чаще, чем у взрослых) хронически воспаленных мышц.
3) У большинства больных генерализованное поражение мелких сосудов по типу васкулита приводит к ишемическим повреждениям кожи, мышц и кишечника. Часто обнаруживают очаги некроза кожи и ишемические инфаркты почек и ЖКТ, изредка – ишемические инфаркты головного мозга. Отсутствие сочетаний с опухолевым процессом. Прогноз такой же. Как у взрослых.
5. Перекрестные синдромы.
1) Поражение мышц, идентичное полимиозиту, может иметь место при СКВ, ССД, РА и синдроме Шегрена.
Существуют практически 3 варианта сочетания ПМ с другими заболеваниями соединительной ткани.
Первый, когда к картине ДМ (ПМ) присоединяется отдельный(ые) признак(и) другого заболевания, например СКВ или ССД.
Второй вариант, когда имеются одновременно признаки ДМ (ПМ) и другого (или других) ревматического заболевания, образуя смешанное заболевание соединительной ткани или overlap-синдром.
Третий — развитие ПМ на фоне других диффузных болезней соединительной ткани, например ССД или СКВ, когда ПМ является синдромом основного заболевания. В каждом из таких наблюдений необходимо исключать сходную с другими ревматическими заболеваниями симптоматику. Так, кожные изменения, особенно при выраженной эритеме и трофических нарушениях, близки наблюдающимся при хронической красной волчанке, а при наличии отека и маскообразности являются склеродермоподобными. Мышечный синдром (без кожных изменений) нередко трактуется как ревматическая полимиалгия, первичная фибромиалгия, а в последнее время и как диффузный фасциит. Общая картина заболевания, наблюдение и использование диагностических критериев позволяют, как правило, правильно диагностировать ДМ (ПМ).
В основе наблюдающегося полиморфизма ДМ (ПМ), особенно его сочетаний с диффузными болезнями соединительной ткани, лежат, по-видимому, иммуногенетические особенности, что проявляется «неравновесным сцеплением» и комбинацией не только определенных генов, ответственных за заболевание, но и связанных с ними клинических симптомокомплексов, формирующих overlap-синдром. Этим можно, очевидно, объяснить и наличие признаков иногда трех и даже четырех ревматических заболеваний, включая ПМ у одного больного.
2) Характерно, что миопатия при этих заболеваниях легче поддаётся терапевтическому воздействию, а прогноз определяет основное заболевание, а не поражение мышц.
3) Итак, для перекрестных синдромов характерны:
- высокая частота феномена Рейно и полиартрита;
- очень высокие титры АНФ (при отсутствии “миозит-специфических” аутоантител);
- хороший ответ на ГК;
- увеличение КФК (в той же степени, что и при идиопатическом ПМ/ДМ);
- такие же гистологические изменения в мышцах, как и при идиопатических формах заболевания.
 6. Миозиты с тельцами включения.
1) По клиническим проявлениям они напоминают первичный полимиозит. Данный синдром расценивают как вариант воспалительных миопатий, так как для него характерно наличие цитотоксических CD8+-клеток. Состав воспалительных инфильтратов и механизм повреждения мышечных волокон сходны с таковыми при полимиозите.
2) Болезнь поражает пожилых мужчин, имеет медленно прогрессирующий характер, отмечается мышечная слабость, часто – ассиметричность поражения, умеренное или минимальное повышение активности КФК и изменения на ЭМГ (электромиограмме).
3) Характерны поражение как проксимальных, так и дистальных мышц, отсутствие аутоантител и типичные результаты биопсии (вакуолизация мышечных волокон). Некроз и регенерация – в них обнаруживают амилоидоз. Характерно раннее появление резкой слабости 4-х главных мышц бедра, сгибателей пальцев рук и запястья.
4) Заболевание плохо поддается иммуносупрессивной терапии. Некоторым больным помогает нормальный иммуноглобулин для в/в введения. При хроническом прогрессирующем течении болезни через 5-10 лет больные утрачивают способность самостоятельно передвигаться.
Характерна редкая ассоциация с ДБСТ и злокачественными новообразованиями.
II. Первичный и вторичный дерматомиозит
1. При диагностике дерматомиозита необходимо детальное обследование больного для исключения вторичного характера заболевания.
2. Вторичный дерматомиозит развивается на фоне какого-либо основного заболевания, чаще всего злокачественной опухоли, иногда – трихинеллеза.
3. Вторичный дерматомиозит отличается резистентностью к лечению, но в то же время может полностью исчезнуть на фоне радикального лечения основного заболевания (удаление опухоли, излечение трихинеллеза).
4. Признаки дерматомиозита могут появиться за несколько лет до клинических симптомов злокачественной опухоли, и, в случае ее полного удаления, полностью исчезнуть.
III. По течению
6. Миозиты с тельцами включения.
1) По клиническим проявлениям они напоминают первичный полимиозит. Данный синдром расценивают как вариант воспалительных миопатий, так как для него характерно наличие цитотоксических CD8+-клеток. Состав воспалительных инфильтратов и механизм повреждения мышечных волокон сходны с таковыми при полимиозите.
2) Болезнь поражает пожилых мужчин, имеет медленно прогрессирующий характер, отмечается мышечная слабость, часто – ассиметричность поражения, умеренное или минимальное повышение активности КФК и изменения на ЭМГ (электромиограмме).
3) Характерны поражение как проксимальных, так и дистальных мышц, отсутствие аутоантител и типичные результаты биопсии (вакуолизация мышечных волокон). Некроз и регенерация – в них обнаруживают амилоидоз. Характерно раннее появление резкой слабости 4-х главных мышц бедра, сгибателей пальцев рук и запястья.
4) Заболевание плохо поддается иммуносупрессивной терапии. Некоторым больным помогает нормальный иммуноглобулин для в/в введения. При хроническом прогрессирующем течении болезни через 5-10 лет больные утрачивают способность самостоятельно передвигаться.
Характерна редкая ассоциация с ДБСТ и злокачественными новообразованиями.
II. Первичный и вторичный дерматомиозит
1. При диагностике дерматомиозита необходимо детальное обследование больного для исключения вторичного характера заболевания.
2. Вторичный дерматомиозит развивается на фоне какого-либо основного заболевания, чаще всего злокачественной опухоли, иногда – трихинеллеза.
3. Вторичный дерматомиозит отличается резистентностью к лечению, но в то же время может полностью исчезнуть на фоне радикального лечения основного заболевания (удаление опухоли, излечение трихинеллеза).
4. Признаки дерматомиозита могут появиться за несколько лет до клинических симптомов злокачественной опухоли, и, в случае ее полного удаления, полностью исчезнуть.
III. По течению
- Острое
- Подострое
- Хроническое
- Низкая (активность I)
- Средняя (активность II)
- Высокая (активность III)
- Ремиссия
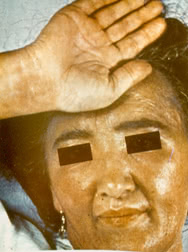
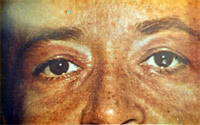 Вокруг глаз эритема образует «очки», которые считают характерным признаком дерматомиозита, подобно «бабочке» при СКВ.
Вокруг глаз эритема образует «очки», которые считают характерным признаком дерматомиозита, подобно «бабочке» при СКВ.
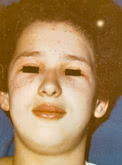 7. Другие важные признаки: «руки мастерового», (грубая эритематозная кожа и гипертрофические изменения ладоней и пальцев), симптом «шали» (эритема на шее в зоне декольте и верхней части спины).
8. Эритема и отёк позднее распространяются и на другие участки тела: бёдра, голени.
9. В последующем нарастают атрофия и пигментация кожи, встречаются участки депигментации, ее сухость.
7. Другие важные признаки: «руки мастерового», (грубая эритематозная кожа и гипертрофические изменения ладоней и пальцев), симптом «шали» (эритема на шее в зоне декольте и верхней части спины).
8. Эритема и отёк позднее распространяются и на другие участки тела: бёдра, голени.
9. В последующем нарастают атрофия и пигментация кожи, встречаются участки депигментации, ее сухость.
 10. Ногти трофически изменены, волосы выпадают.
11. Нередко в процесс вовлекаются слизистые оболочки, развиваются конъюнктивит, стоматит, отёк зева, истинных голосовых связок.
12. Необходимо отметить, что поражение кожи иногда значительно опережает развитие мышечных поражений, но может и отсутствовать вовсе.
13. Иногда (20%) встречается синдром Рейно, который имеет чаще 2-х фазный характер и не приводит к трофическим язвам, хотя описаны инфаркты околоногтевого ложа, петехии, сетчатое ливедо.
II. Поражение мышц.
1. Мышечный синдром – решающий в клинической диагностике дерматомиозита. Характерно развитие тяжелого, нередко некротического миозита мышц проксимальных отделов конечностей.
10. Ногти трофически изменены, волосы выпадают.
11. Нередко в процесс вовлекаются слизистые оболочки, развиваются конъюнктивит, стоматит, отёк зева, истинных голосовых связок.
12. Необходимо отметить, что поражение кожи иногда значительно опережает развитие мышечных поражений, но может и отсутствовать вовсе.
13. Иногда (20%) встречается синдром Рейно, который имеет чаще 2-х фазный характер и не приводит к трофическим язвам, хотя описаны инфаркты околоногтевого ложа, петехии, сетчатое ливедо.
II. Поражение мышц.
1. Мышечный синдром – решающий в клинической диагностике дерматомиозита. Характерно развитие тяжелого, нередко некротического миозита мышц проксимальных отделов конечностей.
 2. В основном характерно медленно прогрессирующее развитие мышечной слабости. Однако в ряде случаев заболевание может носить острый характер, быстро развивается острая дыхательная и почечная (миоглобинурическая) недостаточность.
2. В основном характерно медленно прогрессирующее развитие мышечной слабости. Однако в ряде случаев заболевание может носить острый характер, быстро развивается острая дыхательная и почечная (миоглобинурическая) недостаточность.
 3. Первым проявлением болезни считают слабость скелетной мускулатуры, особенно тазового пояса и бедер. Однако самыми ранними признаками заболевания может быть дисфагия и слабость мышц и шеи.
3. Первым проявлением болезни считают слабость скелетной мускулатуры, особенно тазового пояса и бедер. Однако самыми ранними признаками заболевания может быть дисфагия и слабость мышц и шеи.
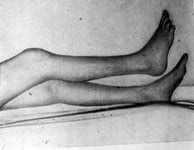 – Характерна симметричная слабость в проксимальных отделах верхних и нижних конечностей. Больные не могут поднять руки, причесаться (“симптом расчески”), одеться (“симптом рубашки”), поднять ногу на ступеньку (“симптом автобуса”), легко падают при ходьбе, им трудно самостоятельно встать со стула, кровати поднять голову (это требует постоянного ухода за ними), хотя движения в кистях, пальцах и стопах могут не нарушаться. Там сохраняются удовлетворительная сила и полный объем движений.
– При поражении мышц гортани и глотки развивается дисфагия, гнусавость, иногда афония, охриплость, поперхивание при глотании, возможна аспирация пищи в трахею. В отличии от дисфагии при ССД, у больных ДМ затруднено глотание как твердой, так и жидкой пищи, которая иногда выливается через нос. При ДМ в отличие от ССД поражаются преимущественно верхние отделы пищевода, мышцы мягкого неба, языка. Развивающаяся псевдобульбарная симптоматика имитирует неврологическое заболевание.
– При вовлечении в процесс глазодвигательных мышц – диплопия, птоз век.
– Мимической мускулатуры – маскообразность лица.
– Сфинктеров – недержание кала и мочи.
– При поражении межреберных мышц и диафрагмы, ограничении подвижности и снижение ЖЕЛ – расстройства дыхания, приводящие к развитию пневмонии, сильнейшему болевому синдрому, особенно при дыхании.
4. Мышцы болезненны при пальпации, отёчны, тестоваты на ощупь, в дальнейшем они уплотняются, нередко в них откладывается кальций (оссифицирующий миозит), что отчётливо выявляется при рентгенологическом исследовании мышц плечевого и тазового пояса.
1) Кальциноз при дерматомиозите является вторичным и носит “репаративный” характер. Чаще локализуется в виде отдельных бляшек или массивных отложений в области наиболее поражённых мышц плечевого и тазового пояса и подкожно. Кальцинируются обычно участки фасции, п/к клетчатки, прилежащие к пораженным мышцам. Расположенные поверхностно очаги кальциноза могут вскрываться с отделением крошковатой полужидкой известковой массы, приводя к изъязвлениям и иногда нагноениям.
2) Кальцинаты чаще развиваются в молодом возрасте при стихании острого процесса, могут достигать костной плотности, иногда выражены резко – нарушают функцию мышц, а их распространение на периартикулярные ткани приводит к обездвиженности больных, что требует их хирургического удаления.
III. Суставной синдром.
1. Менее характерен.
2. Выражается обычно в виде артралгий или поражения периартикулярных тканей.
3. Артриты редки, обычно симметричны, но они редко имеют деструктивный характер: нарушение функций суставов и контрактуры чаще связаны с поражением мышц, а не самих суставов.
4. При рентгенологическом исследовании иногда выявляется умеренный остеопороз костей.
Поражение внутренних органов встречается у большинства больных ДМ, но не превалирует в картине болезни, как наприер, при ССД и СКВ.
IV. Поражение легких.
1. Антитела к синтетазам транспортных РНК опосредуют хронические интерстициальные поражения лёгких.
Мышечная слабость, распространяющаяся на дыхательные мышцы, включая диафрагму, может быть причиной снижения вентиляционной функции легких. Клинически отмечается частое и поверхностное дыхание, инспираторная одышка, развивается гипостатическая пневмония, выраженный болевой синдром.
2. Поражение лёгких может проявляться в виде типичной сосудистой или интерстициальной пневмонии (пневмонит, альвеолит) и аспирационной пневмонии, усугубляющейся поражением дыхательных мышц.
3. Возможно развитие фиброза с признаками лёгочной гипертензии, дыхательной недостаточности (фибризирующий альвеолит).
Легочный фиброз, обусловленный интерстициальным поражением ткани легких, легочным васкулитом и развитием базального септально-альвеолярного склероза, отмечается у 5—10% больных. Он характеризуется нарастающей инспираторной одышкой, сухим кашлем, крепитирующими хрипами в нижних отделах легких, нарастающей дыхательной недостаточностью.
4. Необходимо, однако, подчеркнуть, что выраженная одышка без отчётливых изменений в лёгких может быть связана и с поражением диафрагмы.
5. Следует также иметь в виду и возможность опухолевого, чаще метастатического процесса в лёгких.
V. Поражение сердца.
1. Наиболее часто отмечаются поражения миокарда, значительно реже – перикарда и эндокарда.
2. Развиваются очаговый или диффузный миокардит, дистрофические изменения миокарда, явления кардиосклероза, кардиофиброза с нарушением ритма, что подтверждается данными ЭКГ-исследования (изменения зубца Т, снижение сегмента S-Т и др.) и рентгенологического (увеличение размеров сердца, сглаженность дуг и др.)
3. При ЭХО – кардиографическом исследовании чаще обнаруживают гиперкинетическое сердце, у отдельных больных – пролапс митрального клапана. Описаны случаи дилятационной кардиомиопатии. При высокой клинико – лабораторной активности наблюдается развитие констриктивного перикардита.
VI. Поражение почек.
При дерматомиозите бывает сравнительно редко и варьирует от очагового гломерулонефрита и преходящей протеинурии до тяжёлого диффузного гломерулонефрита и миоглобинурической почки с явлениями почечной недостаточности.
VII. Изменения желудочно-кишечного тракта.
1. Отмечаются нередко и проявляются нарастающей дисфагией (вследствие поражения мышц глоточного кольца и верхнего отдела пищевода), отсутствием аппетита, иногда болями в животе и симптомами гастроэнтероколита.
Дисфагия развивается вследствие снижения контрактильной силы фарингеальных мышц и мышц верхнего отдела пищевода, нарушения перистальтики, слабости мышц мягкого неба и языка.
Иногда дисфагия может быть первым симптомом заболевания.
2. Тяжёлая форма прогрессирующей дисфагии, когда твёрдая пища срыгивается, а жидкая выливается через нос, представляет непосредственную угрозу жизни больного и является прямым показанием к срочной терапии максимальными дозами кортикостероидов и (или) цитостатиков. При вовлечении в процесс пищеводного сфинктера возможно развитие рефлюкс-эзофагита.
3. Описаны случаи дерматомиозита, при которых отмечались желудочно-кишечные кровотечения, перфорация желудка вследствие васкулита и некроза по ходу пищеварительного тракта.
VIII. Увеличение печени и селезёнки.
1. Умеренное увеличение печени с изменением функциональных проб наблюдается примерно у 1/3 больных.
2. Реже наблюдается при дерматомиозите гепатолиенальный и железисто-селезёночный синдромы, увеличиваются лимфоузлы.
IX. Неврологические нарушения.
1. Наблюдаются нечасто и выражаются различными изменениями чувствительности – гиперестезией периферического или корешкового характера, гипералгезией, парестезией и арефлексией. Иногда развивается псевдоневрологическая симптоматика, возможно развитие не резко выраженного полиневрита и даже поражение ЦНС за счет васкулита.
2. Отсутствие рефлексов на поражённых конечностях чаще обусловлено тяжёлой мышечной патологией.
3. Для уточнения природы наблюдающихся изменений используют метод электромиографии.
X. Эндокринные нарушения.
Эндокринные нарушения редки.
1. При остром течении дерматомиозита может развиться аменорея.
2. Может быть нарушение функции гипофизарно-надпочечниковой системы. Они могут быть связаны как с тяжестью заболевания и васкулитом, так и с проводимой стероидной терапией.
XI. Поражение сосудов (васкулиты).
1. Васкулиты составляют основу поражения кожи, некоторых висцеритов, особенно характерных для дерматомиозита в детском возрасте.
2. Характерен синдром Рейно.
3. У отдельных больных наблюдается поражение сосудов глазного дна.
4. Нередко у больных дерматомиозитом обнаруживается склонность к артериальной гипотензии.
XII. Общие симптомы.
1. Из общих симптомов дерматомиозита наиболее частым является потеря массы тела, иногда значительная (10-20 кг).
2. Лихорадка отмечается при остром течении или обострении, чаще регистрируется лишь умеренный субфебрилитет.
Лабораторные исследования
Характеризуют общую активность дерматомиозита.
– Характерна симметричная слабость в проксимальных отделах верхних и нижних конечностей. Больные не могут поднять руки, причесаться (“симптом расчески”), одеться (“симптом рубашки”), поднять ногу на ступеньку (“симптом автобуса”), легко падают при ходьбе, им трудно самостоятельно встать со стула, кровати поднять голову (это требует постоянного ухода за ними), хотя движения в кистях, пальцах и стопах могут не нарушаться. Там сохраняются удовлетворительная сила и полный объем движений.
– При поражении мышц гортани и глотки развивается дисфагия, гнусавость, иногда афония, охриплость, поперхивание при глотании, возможна аспирация пищи в трахею. В отличии от дисфагии при ССД, у больных ДМ затруднено глотание как твердой, так и жидкой пищи, которая иногда выливается через нос. При ДМ в отличие от ССД поражаются преимущественно верхние отделы пищевода, мышцы мягкого неба, языка. Развивающаяся псевдобульбарная симптоматика имитирует неврологическое заболевание.
– При вовлечении в процесс глазодвигательных мышц – диплопия, птоз век.
– Мимической мускулатуры – маскообразность лица.
– Сфинктеров – недержание кала и мочи.
– При поражении межреберных мышц и диафрагмы, ограничении подвижности и снижение ЖЕЛ – расстройства дыхания, приводящие к развитию пневмонии, сильнейшему болевому синдрому, особенно при дыхании.
4. Мышцы болезненны при пальпации, отёчны, тестоваты на ощупь, в дальнейшем они уплотняются, нередко в них откладывается кальций (оссифицирующий миозит), что отчётливо выявляется при рентгенологическом исследовании мышц плечевого и тазового пояса.
1) Кальциноз при дерматомиозите является вторичным и носит “репаративный” характер. Чаще локализуется в виде отдельных бляшек или массивных отложений в области наиболее поражённых мышц плечевого и тазового пояса и подкожно. Кальцинируются обычно участки фасции, п/к клетчатки, прилежащие к пораженным мышцам. Расположенные поверхностно очаги кальциноза могут вскрываться с отделением крошковатой полужидкой известковой массы, приводя к изъязвлениям и иногда нагноениям.
2) Кальцинаты чаще развиваются в молодом возрасте при стихании острого процесса, могут достигать костной плотности, иногда выражены резко – нарушают функцию мышц, а их распространение на периартикулярные ткани приводит к обездвиженности больных, что требует их хирургического удаления.
III. Суставной синдром.
1. Менее характерен.
2. Выражается обычно в виде артралгий или поражения периартикулярных тканей.
3. Артриты редки, обычно симметричны, но они редко имеют деструктивный характер: нарушение функций суставов и контрактуры чаще связаны с поражением мышц, а не самих суставов.
4. При рентгенологическом исследовании иногда выявляется умеренный остеопороз костей.
Поражение внутренних органов встречается у большинства больных ДМ, но не превалирует в картине болезни, как наприер, при ССД и СКВ.
IV. Поражение легких.
1. Антитела к синтетазам транспортных РНК опосредуют хронические интерстициальные поражения лёгких.
Мышечная слабость, распространяющаяся на дыхательные мышцы, включая диафрагму, может быть причиной снижения вентиляционной функции легких. Клинически отмечается частое и поверхностное дыхание, инспираторная одышка, развивается гипостатическая пневмония, выраженный болевой синдром.
2. Поражение лёгких может проявляться в виде типичной сосудистой или интерстициальной пневмонии (пневмонит, альвеолит) и аспирационной пневмонии, усугубляющейся поражением дыхательных мышц.
3. Возможно развитие фиброза с признаками лёгочной гипертензии, дыхательной недостаточности (фибризирующий альвеолит).
Легочный фиброз, обусловленный интерстициальным поражением ткани легких, легочным васкулитом и развитием базального септально-альвеолярного склероза, отмечается у 5—10% больных. Он характеризуется нарастающей инспираторной одышкой, сухим кашлем, крепитирующими хрипами в нижних отделах легких, нарастающей дыхательной недостаточностью.
4. Необходимо, однако, подчеркнуть, что выраженная одышка без отчётливых изменений в лёгких может быть связана и с поражением диафрагмы.
5. Следует также иметь в виду и возможность опухолевого, чаще метастатического процесса в лёгких.
V. Поражение сердца.
1. Наиболее часто отмечаются поражения миокарда, значительно реже – перикарда и эндокарда.
2. Развиваются очаговый или диффузный миокардит, дистрофические изменения миокарда, явления кардиосклероза, кардиофиброза с нарушением ритма, что подтверждается данными ЭКГ-исследования (изменения зубца Т, снижение сегмента S-Т и др.) и рентгенологического (увеличение размеров сердца, сглаженность дуг и др.)
3. При ЭХО – кардиографическом исследовании чаще обнаруживают гиперкинетическое сердце, у отдельных больных – пролапс митрального клапана. Описаны случаи дилятационной кардиомиопатии. При высокой клинико – лабораторной активности наблюдается развитие констриктивного перикардита.
VI. Поражение почек.
При дерматомиозите бывает сравнительно редко и варьирует от очагового гломерулонефрита и преходящей протеинурии до тяжёлого диффузного гломерулонефрита и миоглобинурической почки с явлениями почечной недостаточности.
VII. Изменения желудочно-кишечного тракта.
1. Отмечаются нередко и проявляются нарастающей дисфагией (вследствие поражения мышц глоточного кольца и верхнего отдела пищевода), отсутствием аппетита, иногда болями в животе и симптомами гастроэнтероколита.
Дисфагия развивается вследствие снижения контрактильной силы фарингеальных мышц и мышц верхнего отдела пищевода, нарушения перистальтики, слабости мышц мягкого неба и языка.
Иногда дисфагия может быть первым симптомом заболевания.
2. Тяжёлая форма прогрессирующей дисфагии, когда твёрдая пища срыгивается, а жидкая выливается через нос, представляет непосредственную угрозу жизни больного и является прямым показанием к срочной терапии максимальными дозами кортикостероидов и (или) цитостатиков. При вовлечении в процесс пищеводного сфинктера возможно развитие рефлюкс-эзофагита.
3. Описаны случаи дерматомиозита, при которых отмечались желудочно-кишечные кровотечения, перфорация желудка вследствие васкулита и некроза по ходу пищеварительного тракта.
VIII. Увеличение печени и селезёнки.
1. Умеренное увеличение печени с изменением функциональных проб наблюдается примерно у 1/3 больных.
2. Реже наблюдается при дерматомиозите гепатолиенальный и железисто-селезёночный синдромы, увеличиваются лимфоузлы.
IX. Неврологические нарушения.
1. Наблюдаются нечасто и выражаются различными изменениями чувствительности – гиперестезией периферического или корешкового характера, гипералгезией, парестезией и арефлексией. Иногда развивается псевдоневрологическая симптоматика, возможно развитие не резко выраженного полиневрита и даже поражение ЦНС за счет васкулита.
2. Отсутствие рефлексов на поражённых конечностях чаще обусловлено тяжёлой мышечной патологией.
3. Для уточнения природы наблюдающихся изменений используют метод электромиографии.
X. Эндокринные нарушения.
Эндокринные нарушения редки.
1. При остром течении дерматомиозита может развиться аменорея.
2. Может быть нарушение функции гипофизарно-надпочечниковой системы. Они могут быть связаны как с тяжестью заболевания и васкулитом, так и с проводимой стероидной терапией.
XI. Поражение сосудов (васкулиты).
1. Васкулиты составляют основу поражения кожи, некоторых висцеритов, особенно характерных для дерматомиозита в детском возрасте.
2. Характерен синдром Рейно.
3. У отдельных больных наблюдается поражение сосудов глазного дна.
4. Нередко у больных дерматомиозитом обнаруживается склонность к артериальной гипотензии.
XII. Общие симптомы.
1. Из общих симптомов дерматомиозита наиболее частым является потеря массы тела, иногда значительная (10-20 кг).
2. Лихорадка отмечается при остром течении или обострении, чаще регистрируется лишь умеренный субфебрилитет.
Лабораторные исследования
Характеризуют общую активность дерматомиозита.
- Умеренная анемия.
- Лейкоцитоз, реже лейкопения.
- Эозинофилия
- Увеличенная СОЭ
- Повышение содержания альфа-2 и гамма-глобулинов, серомукоида, церулоплазмина, СРБ.
- Обнаружение (чаще в небольшом титре) ревматоидного и волчаночного факторов. При сочетании с неоплазмой и особенно при overlap-синдроме – диспротеинемия.
- Мышечные ферменты.
Течение
Течение дерматомиозита может быть волнообразным, прогрессирующим и весьма вариабельным. Начало может быть острым с лихорадкой до 38°-39° С, проливными потами, похуданием. Но чаще симптоматика развивается постепенно, характеризуясь преимущественно кожными и мышечными проявлениями. Выделяют 3 основные формы: острое, подострое и хроническое. 1. Острое течение. 1) Выраженный лихорадочный синдром. 2) Катастрофически нарастающее генерализованное поражение поперечно-полосатой мускулатуры, вплоть до полной обездвиженности, явления прогрессирующей дисфагии, дизартрии, поражение сердца и других органов с летальным исходом через 2-6 месяцев от начала заболевания. 3) Причинами смерти этих больных являются аспирационная пневмония, легко возникающая и быстро распространяющаяся в условиях гиповентиляции лёгких, лёгочно-сердечная и почечная недостаточность. 4) При своевременном назначении массивной подавляющей терапии кортикостероидами возможны переход к подострому и хроническому течению, и даже глубокая клиническая ремиссия. 5) Чаще острый вариант встречается у детей и подростков. 2) Подострое течение. Подострое течение дерматомиозита отличается более медленным, постепенным нарастанием симптомов, но через 1-2 года от начала болезни обычно наблюдается развёрнутая картина болезни с тяжёлым поражением мышц, висцеритами, возможна кальцификация. 3) Хроническое течение. 1) Поражение кожи и мышц выражено значительно слабее, заболевание протекает волнообразно. Развиваются кожные изменения по типу пойкилодермии. Наблюдаются явления гиперкератоза, гиперпигментации, депигментации, телеангиэктазии, истончение, сухость кожи. 2) Преобладают процессы атрофии и склероза; возможно локальное поражение мышц, в том числе мышц дистальных отделов конечностей, висцеральные проявления редки. 3) Этот вариант чаще наблюдается у лиц пожилого возраста, у женщин в климактерическом периоде. Однако необходимо отметить, что на фоне лечения, а также под влиянием различных факторов характер течения заболевания может изменяться. Остро начавшись, дерматомиозит при активном лечении может принять подострое или хроническое течение. В то же время, хронический вариант течения процесса может смениться резким обострением. Диагноз Диагностические критерии дерматомиозита подразделяют на основные и дополнительные. 1. Основные критерии.
Официально принятых международных критериев ДМ нет, но, исходя из наиболее часто используемых диагностических критериев А. Воhаn и J.B. Реttеr (1975) и классификационных критериев Т. Меdsger и А. Маsi (1985), можно выделить 7 основных диагностических критериев ДМ (ПМ):
1. Основные критерии.
Официально принятых международных критериев ДМ нет, но, исходя из наиболее часто используемых диагностических критериев А. Воhаn и J.B. Реttеr (1975) и классификационных критериев Т. Меdsger и А. Маsi (1985), можно выделить 7 основных диагностических критериев ДМ (ПМ):
- Типичные кожные изменения.
- Прогрессирующая слабость в симметричных отделах проксимальных мышц конечностей по данным анамнеза и при обследовании.
- Повышение концентрации одного или более сывороточных мышечных ферментов.
- Миопатические изменения при электромиографии.
- Типичная картина полимиозита при биопсии мышц.
- Увеличение креатинурии.
- Объективные признаки уменьшения мышечной слабости при лечении кортикостероидами.
 Постановке диагноза ДМ (ПМ), как правило, предшествуют ошибочные диагнозы, причем при кожной симптоматике преобладают «дерматологические», а при мышечной – «неврологические» диагнозы. Наиболее типичны среди них дерматит, аллергический отек, рожистое воспаление, нейродермит, эритродермия, инфекционный миозит, полиневрит, полиомиелит, псевдобульбарный синдром, myasthenia gravis и др. Нередки также диагнозы аллергических и инфекционных заболеваний, других системных заболеваний соединительной ткани, чаще – СКВ.
Важно не только установить диагноз ДМ (ПМ), но и определить его клиническую форму, провести нередко трудную дифференциальную диагностику первичного (идиопатического) и вторичного (опухолевого) ДМ (ПМ), дифференцировать и исключить другие состояния, сопровождающиеся распространенным поражением скелетных мышц.
Итак, при диагностике воспалительных миопатий необходимо исключить ряд других заболеваний.
I. Эндокринные нарушения.
1. Гипотиреоз.
Может сопровождаться слабостью проксимальных отделов мышц и незначительным повышением активности ферментов.
2. Тиреотоксикоз.
1) Необходимо дифференцировать настоящую мышечную слабость и общую слабость.
2) Тиреотоксикоз способен вызывать общую слабость, но гиперферментемии нет.
3. Синдром Кушинга.
1) Больные часто предъявляют жалобы на слабость, преимущественно в нижних конечностях.
2) Активность ферментов у них не изменена
II. Влияние медикаментов.
1. Различные лекарственные препараты способны вызывать мышечную слабость, повышение активности ферментов, миоглобинурию, рабдомиолиз. Обычно эти изменения исчезают при отмене препарата.
2. Наиболее часто такие признаки вызывают алкоголь, гиполипидемические средства (клофибрат, гемфиброзил, ловастатин), кортикостероиды, Д-пеницилламин и зидовудин, амфотерицин-В, аминокапроновая кислота, фенфлурамин, героин, фенциклидин, при длительном применении диуретиков, азатиоприна, карбимазол, кетоконазол, колхицин, правастатин, соматропин, фенитоин, хлорохин, циклоспорин, циметидин.
Для стероидной миопатии характерны нормальный уровень КФК, увеличение мышечной силы на фоне снижения дозы глюкокортикостероидов, отсутствие признаков мышечного воспаления при мышечной биопсии.
III. Заболевания мышц.
Данные анамнеза больных и отсутствие характерных воспалительных изменений, в том числе по данным биопсии и электронной микроскопии, позволяют отдифференцировать мышечные дистрофии и метаболические поражения мышц.
IV. Неврологические заболевания.
1. На ранних стадиях такие заболевания, как Myasthenia gravis и боковой амиотрофический склероз могут напоминать воспалительные миопатии.
a) Myasthenia gravis обычно начинается с поражения мышц лица, атрофии мышц не происходит. Здесь наблюдается патология нервно-мышечной передачи как результат выработки антител против L-субъединицы рецепторов ацетилхолина. Поэтому в дифференциальной диагностике в некоторых случаях обращают внимание на возможное вовлечение глазных мышц, характерные изменения на электромиограмме и скорость проведения нервного возбуждения.
б) В отличие от полимиозита при боковом амиотрофическом склерозе наряду с мышечной слабостью наблюдаются признаки поражения корковых мотонейронов. Миопатии Дюшенна и Беккера, наследственные мышечные заболевания, тазово-плечевая и плече-лопаточно-лицевая миопатии также могут напоминать полимиозит. Однако в отличие от полимиозита эти заболевания прогрессируют годами, а не в течение недель или месяцев, обычно начинаются до 30 лет и поражают мышцы глотки, задние мышцы шеи и дельтовидную мышцу лишь на поздних стадиях, а вначале могут проявляться изолированным поражением других мышц, например двуглавой или плечелучевой. Тем не менее, в редких случаях хронический полимиозит бывает трудно отличить от быстро прогрессирующих миопатий даже с помощью биопсии.
2. Особенно сложно дифференцировать полимиозит с плече-лопаточно-лицевой миопатией: на ранних стадиях этой болезни в мышечной ткани появляются интерстициальные воспалительные инфильтраты. Во всех сомнительных случаях прибегают к пробному лечению глюкокортикоидами.
3. Основные проявления атрофической миотонии — птоз, слабость мимических и атрофия височных мышц, придающие лицу своеобразное выражение, а также замедленное расслабление мышц после их сокращения.
4. Некоторые метаболические миопатии, например дефицит карнитина либо недостаточность карнитинпальмитоилтрансферазы I или II, проявляются болезненными мышечными спазмами при физической нагрузке, рабдомиолизом и мышечной слабостью. Диагноз этих заболеваний и миопатии при гликогенозе типа II подтверждают с помощью биохимического исследования биоптатов мышц.
5. Эпизодическая мышечная слабость в сочетании с утомляемостью при физической нагрузке. Причиной подобной картины может быть нарушение нервно-мышечной передачи, например, при миастении или синдроме Итона—Ламберта. Отличить эти заболевания от полимиозита помогают ЭМГ с ритмической электростимуляцией двигательного нерва или ЭМГ отдельных мышечных волокон.
6. Острая мышечная слабость.
1) Быстрое развитие мышечной слабости может быть обусловлено острой нейропатией, например, при синдроме Гийена—Барре или воздействии нейротоксичных веществ.
2) Острая мышечная слабость в сочетании с болезненными мышечными спазмами, рабдомиолизом и миоглобинурией наблюдается при некоторых болезнях обмена веществ, в том числе при гликогенозе типа V, недостаточности карнитинпальмитоилтрансферазы I или II и АМФ-дезаминазы
3) Иногда похожие симптомы сопровождают острые вирусные инфекции.
4) У больных алкоголизмом после тяжелого запоя могут возникнуть мышечная слабость с миалгией и миоглобинурией или бессимптомное повышение активности КФК и миоглобинемия. Кроме того, на фоне гипокалиемии у них может развиться преходящая мышечная слабость в отсутствие миалгии. Тяжелая и длительная гипокалиемия, обусловленная потерей калия или гипофосфатемией либо гипомагниемией, часто наблюдаемыми при алкоголизме или парентеральном питании с аспирацией желудочного содержимого через назогастральный зонд, также может приводить к острой мышечной слабости с миоглобинурией. Гипер- и гипонатриемия также изредка приводят к острой мышечной слабости с рабдомиолизом и миоглобинурией.
2. Полиневриты.
1) Нарастающие слабость, адинамия, арефлексия и нарушения глотания, которые иногда рассматриваются как бульбарный или псевдобульбарный синдром, обусловливают нередкую госпитализацию больных с острой формой дерматомиозита в неврологические стационары с диагнозом “полиневрит”, “полирадикулоэнцефалоневрит”, “полимиелит” и др.
2) Уточнение генеза и характера наблюдающихся поражений позволяет дифференцировать ложно – неврологическую симптоматику от истинной.
Атрофия белых мышечных волокон – единственное изменение в биоптатах мышц при этих заболеваниях.
V. Дерматомиозит-полимиозит в сочетании с ревматическими болезнями.
На долю этой формы дерматомиозита-полимиозита приходится около 20% всех перекрестных синдромов. Чаще всего дерматомиозит-полимиозит бывает компонентом смешанного заболевания соединительной ткани или сочетается с системной склеродермией, ревматоидным артритом или СКВ, реже — с узелковым периартериитом и ревматизмом. Диагноз этой формы полимиозита ставят при наличии клинических и лабораторных признаков миозита и еще одного или нескольких заболеваний соединительной ткани.
1. Системная склеродермия.
1) Сходство дерматомиозита с системной склеродермией (плотный отёк кожи, нарушение глотания и др.) чаще только внешнее, так как каждый из наблюдающихся “общих” симптомов имеет свои особенности и иную природу. При ДМ – поражение верхней трети пищевода (при ССД поражается нижняя треть).
2) Однако, следует иметь в виду и возможность сочетания дерматомиозита (чаще полимиозита) с системной склеродермией (overlap syndrome). Дисфагия при этом сочетании часто бывает обусловлена поражением не верхней, а нижней трети пищевода.
2. СКВ.
В отличие от СКВ при дерматомиозите имеются:
1) Более редкая и обычно не столь выраженная висцеральная патология.
2) Несколько иной характер кожных изменений.
3) Менее значительны изменения показателей лабораторных исследований.
4) Преобладающее в картине болезни поражение мышц.
3. РА.
Дифференциальный диагноз с РА также основывается на преобладающей локализации патологического процесса и лабораторных тестах.
VI. Инфекции.
При остром начале дерматомиозите, когда имеются лихорадка, ознобы, увеличенная СОЭ и т.д., важно исключить диагноз инфекционного заболевания.
1. Бактериальные инфекции.
Болезнь Лайма протекает с признаками миопатии. При гнойном миозите, вызванном стафилококками или стрептококками в мышцах, появляются инфильтраты, склонные к абсцедированию. В последнее время они отличаются у больных СПИДом.
2. Вирусные инфекции.
Признаки миопатии могут наблюдаться при инфицировании вирусами Коксаки, ЕСНО, гриппа и ВИЧ.
СПИД нередко сопровождается полимиозитом и другими поражениями мышц. Они могут быть как проявлением ВИЧ-инфекции, так и осложнением лечения. Для них характерны повышение активности КФК и миопатическая триада на ЭМГ. При биопсии мышц выявляют некроз мышечных волокон и в ряде случаев — воспалительную инфильтрацию. В макрофагах, инфильтрирующих мышцы, можно обнаружить антигены ВИЧ; в мышечных волокнах их не бывает. Иногда на ранних стадиях ВИЧ-инфекции развивается полимиозит, который обычно поддается лечению глюкокортикоидами. Миопатия, обусловленная действием ВИЧ – одна из причин ВИЧ-кахексии, проявляющейся мышечной слабостью, потерей более 10% веса и хроническим поносом. У некоторых ВИЧ- инфицированных развивается рабдомиолиз, который может быть обусловлен побочным действием лекарственных средств (диданозина, сульфаниламидов), оппортунистическими инфекциями с поражением мышц (например, вызванными Staphylococcus aureus), интоксикацией и тяжелыми электролитными нарушениями.
3. Паразитарные инфекции.
Серологические исследования позволяют дифференцировать токсоплазмоз или трихинеллез и полимиозит. Имеются анамнестические сведения об употреблении в пищу полусырой свинины. Трихинеллез: субфебрильная структура, слабость, миалгия, хелоз и периорбитальный отек. Мышечная слабость выражена незначительно. При попадании большого количества трахинелл часто возникают симптомы поражения ЦНС: спутанность сознания, кома, очаговые неврологические симптомы. Часто миокардит, выраженная эозинофилия, положительные результаты кожных проб.
VII. Онкопатология.
1. Возможная онкопатология подлежит исключению у больных полимиозитом среднего и пожилого возраста, а также при дерматомиозите.
2. Так, очаговые изменения в легких следует дифференцировать с первичным или метастатическим раком и т.д.
3. Риск злокачественных новообразований выше при наличии:
Постановке диагноза ДМ (ПМ), как правило, предшествуют ошибочные диагнозы, причем при кожной симптоматике преобладают «дерматологические», а при мышечной – «неврологические» диагнозы. Наиболее типичны среди них дерматит, аллергический отек, рожистое воспаление, нейродермит, эритродермия, инфекционный миозит, полиневрит, полиомиелит, псевдобульбарный синдром, myasthenia gravis и др. Нередки также диагнозы аллергических и инфекционных заболеваний, других системных заболеваний соединительной ткани, чаще – СКВ.
Важно не только установить диагноз ДМ (ПМ), но и определить его клиническую форму, провести нередко трудную дифференциальную диагностику первичного (идиопатического) и вторичного (опухолевого) ДМ (ПМ), дифференцировать и исключить другие состояния, сопровождающиеся распространенным поражением скелетных мышц.
Итак, при диагностике воспалительных миопатий необходимо исключить ряд других заболеваний.
I. Эндокринные нарушения.
1. Гипотиреоз.
Может сопровождаться слабостью проксимальных отделов мышц и незначительным повышением активности ферментов.
2. Тиреотоксикоз.
1) Необходимо дифференцировать настоящую мышечную слабость и общую слабость.
2) Тиреотоксикоз способен вызывать общую слабость, но гиперферментемии нет.
3. Синдром Кушинга.
1) Больные часто предъявляют жалобы на слабость, преимущественно в нижних конечностях.
2) Активность ферментов у них не изменена
II. Влияние медикаментов.
1. Различные лекарственные препараты способны вызывать мышечную слабость, повышение активности ферментов, миоглобинурию, рабдомиолиз. Обычно эти изменения исчезают при отмене препарата.
2. Наиболее часто такие признаки вызывают алкоголь, гиполипидемические средства (клофибрат, гемфиброзил, ловастатин), кортикостероиды, Д-пеницилламин и зидовудин, амфотерицин-В, аминокапроновая кислота, фенфлурамин, героин, фенциклидин, при длительном применении диуретиков, азатиоприна, карбимазол, кетоконазол, колхицин, правастатин, соматропин, фенитоин, хлорохин, циклоспорин, циметидин.
Для стероидной миопатии характерны нормальный уровень КФК, увеличение мышечной силы на фоне снижения дозы глюкокортикостероидов, отсутствие признаков мышечного воспаления при мышечной биопсии.
III. Заболевания мышц.
Данные анамнеза больных и отсутствие характерных воспалительных изменений, в том числе по данным биопсии и электронной микроскопии, позволяют отдифференцировать мышечные дистрофии и метаболические поражения мышц.
IV. Неврологические заболевания.
1. На ранних стадиях такие заболевания, как Myasthenia gravis и боковой амиотрофический склероз могут напоминать воспалительные миопатии.
a) Myasthenia gravis обычно начинается с поражения мышц лица, атрофии мышц не происходит. Здесь наблюдается патология нервно-мышечной передачи как результат выработки антител против L-субъединицы рецепторов ацетилхолина. Поэтому в дифференциальной диагностике в некоторых случаях обращают внимание на возможное вовлечение глазных мышц, характерные изменения на электромиограмме и скорость проведения нервного возбуждения.
б) В отличие от полимиозита при боковом амиотрофическом склерозе наряду с мышечной слабостью наблюдаются признаки поражения корковых мотонейронов. Миопатии Дюшенна и Беккера, наследственные мышечные заболевания, тазово-плечевая и плече-лопаточно-лицевая миопатии также могут напоминать полимиозит. Однако в отличие от полимиозита эти заболевания прогрессируют годами, а не в течение недель или месяцев, обычно начинаются до 30 лет и поражают мышцы глотки, задние мышцы шеи и дельтовидную мышцу лишь на поздних стадиях, а вначале могут проявляться изолированным поражением других мышц, например двуглавой или плечелучевой. Тем не менее, в редких случаях хронический полимиозит бывает трудно отличить от быстро прогрессирующих миопатий даже с помощью биопсии.
2. Особенно сложно дифференцировать полимиозит с плече-лопаточно-лицевой миопатией: на ранних стадиях этой болезни в мышечной ткани появляются интерстициальные воспалительные инфильтраты. Во всех сомнительных случаях прибегают к пробному лечению глюкокортикоидами.
3. Основные проявления атрофической миотонии — птоз, слабость мимических и атрофия височных мышц, придающие лицу своеобразное выражение, а также замедленное расслабление мышц после их сокращения.
4. Некоторые метаболические миопатии, например дефицит карнитина либо недостаточность карнитинпальмитоилтрансферазы I или II, проявляются болезненными мышечными спазмами при физической нагрузке, рабдомиолизом и мышечной слабостью. Диагноз этих заболеваний и миопатии при гликогенозе типа II подтверждают с помощью биохимического исследования биоптатов мышц.
5. Эпизодическая мышечная слабость в сочетании с утомляемостью при физической нагрузке. Причиной подобной картины может быть нарушение нервно-мышечной передачи, например, при миастении или синдроме Итона—Ламберта. Отличить эти заболевания от полимиозита помогают ЭМГ с ритмической электростимуляцией двигательного нерва или ЭМГ отдельных мышечных волокон.
6. Острая мышечная слабость.
1) Быстрое развитие мышечной слабости может быть обусловлено острой нейропатией, например, при синдроме Гийена—Барре или воздействии нейротоксичных веществ.
2) Острая мышечная слабость в сочетании с болезненными мышечными спазмами, рабдомиолизом и миоглобинурией наблюдается при некоторых болезнях обмена веществ, в том числе при гликогенозе типа V, недостаточности карнитинпальмитоилтрансферазы I или II и АМФ-дезаминазы
3) Иногда похожие симптомы сопровождают острые вирусные инфекции.
4) У больных алкоголизмом после тяжелого запоя могут возникнуть мышечная слабость с миалгией и миоглобинурией или бессимптомное повышение активности КФК и миоглобинемия. Кроме того, на фоне гипокалиемии у них может развиться преходящая мышечная слабость в отсутствие миалгии. Тяжелая и длительная гипокалиемия, обусловленная потерей калия или гипофосфатемией либо гипомагниемией, часто наблюдаемыми при алкоголизме или парентеральном питании с аспирацией желудочного содержимого через назогастральный зонд, также может приводить к острой мышечной слабости с миоглобинурией. Гипер- и гипонатриемия также изредка приводят к острой мышечной слабости с рабдомиолизом и миоглобинурией.
2. Полиневриты.
1) Нарастающие слабость, адинамия, арефлексия и нарушения глотания, которые иногда рассматриваются как бульбарный или псевдобульбарный синдром, обусловливают нередкую госпитализацию больных с острой формой дерматомиозита в неврологические стационары с диагнозом “полиневрит”, “полирадикулоэнцефалоневрит”, “полимиелит” и др.
2) Уточнение генеза и характера наблюдающихся поражений позволяет дифференцировать ложно – неврологическую симптоматику от истинной.
Атрофия белых мышечных волокон – единственное изменение в биоптатах мышц при этих заболеваниях.
V. Дерматомиозит-полимиозит в сочетании с ревматическими болезнями.
На долю этой формы дерматомиозита-полимиозита приходится около 20% всех перекрестных синдромов. Чаще всего дерматомиозит-полимиозит бывает компонентом смешанного заболевания соединительной ткани или сочетается с системной склеродермией, ревматоидным артритом или СКВ, реже — с узелковым периартериитом и ревматизмом. Диагноз этой формы полимиозита ставят при наличии клинических и лабораторных признаков миозита и еще одного или нескольких заболеваний соединительной ткани.
1. Системная склеродермия.
1) Сходство дерматомиозита с системной склеродермией (плотный отёк кожи, нарушение глотания и др.) чаще только внешнее, так как каждый из наблюдающихся “общих” симптомов имеет свои особенности и иную природу. При ДМ – поражение верхней трети пищевода (при ССД поражается нижняя треть).
2) Однако, следует иметь в виду и возможность сочетания дерматомиозита (чаще полимиозита) с системной склеродермией (overlap syndrome). Дисфагия при этом сочетании часто бывает обусловлена поражением не верхней, а нижней трети пищевода.
2. СКВ.
В отличие от СКВ при дерматомиозите имеются:
1) Более редкая и обычно не столь выраженная висцеральная патология.
2) Несколько иной характер кожных изменений.
3) Менее значительны изменения показателей лабораторных исследований.
4) Преобладающее в картине болезни поражение мышц.
3. РА.
Дифференциальный диагноз с РА также основывается на преобладающей локализации патологического процесса и лабораторных тестах.
VI. Инфекции.
При остром начале дерматомиозите, когда имеются лихорадка, ознобы, увеличенная СОЭ и т.д., важно исключить диагноз инфекционного заболевания.
1. Бактериальные инфекции.
Болезнь Лайма протекает с признаками миопатии. При гнойном миозите, вызванном стафилококками или стрептококками в мышцах, появляются инфильтраты, склонные к абсцедированию. В последнее время они отличаются у больных СПИДом.
2. Вирусные инфекции.
Признаки миопатии могут наблюдаться при инфицировании вирусами Коксаки, ЕСНО, гриппа и ВИЧ.
СПИД нередко сопровождается полимиозитом и другими поражениями мышц. Они могут быть как проявлением ВИЧ-инфекции, так и осложнением лечения. Для них характерны повышение активности КФК и миопатическая триада на ЭМГ. При биопсии мышц выявляют некроз мышечных волокон и в ряде случаев — воспалительную инфильтрацию. В макрофагах, инфильтрирующих мышцы, можно обнаружить антигены ВИЧ; в мышечных волокнах их не бывает. Иногда на ранних стадиях ВИЧ-инфекции развивается полимиозит, который обычно поддается лечению глюкокортикоидами. Миопатия, обусловленная действием ВИЧ – одна из причин ВИЧ-кахексии, проявляющейся мышечной слабостью, потерей более 10% веса и хроническим поносом. У некоторых ВИЧ- инфицированных развивается рабдомиолиз, который может быть обусловлен побочным действием лекарственных средств (диданозина, сульфаниламидов), оппортунистическими инфекциями с поражением мышц (например, вызванными Staphylococcus aureus), интоксикацией и тяжелыми электролитными нарушениями.
3. Паразитарные инфекции.
Серологические исследования позволяют дифференцировать токсоплазмоз или трихинеллез и полимиозит. Имеются анамнестические сведения об употреблении в пищу полусырой свинины. Трихинеллез: субфебрильная структура, слабость, миалгия, хелоз и периорбитальный отек. Мышечная слабость выражена незначительно. При попадании большого количества трахинелл часто возникают симптомы поражения ЦНС: спутанность сознания, кома, очаговые неврологические симптомы. Часто миокардит, выраженная эозинофилия, положительные результаты кожных проб.
VII. Онкопатология.
1. Возможная онкопатология подлежит исключению у больных полимиозитом среднего и пожилого возраста, а также при дерматомиозите.
2. Так, очаговые изменения в легких следует дифференцировать с первичным или метастатическим раком и т.д.
3. Риск злокачественных новообразований выше при наличии:
- васкулита
- некроза кожи
- амиотрофического дерматомиозита
- легочного фиброза
- “миозит-специфических” аутоантител
- других системных проявлениях СЗСТ.
- определение простат-специфического антигена;
- СА-125;
- сканирование легких.
 Лечение дерматомиозита
1. Кортикостероиды
1) Кортикостероиды в адекватных, как правило, больших дозах помогают контролировать поражение мышц у значительной части больных.
2) Предпочтителен преднизолон или другие кортикостероиды, за исключением триамцинолона, усиливающего мышечную слабость.
По данным ряда авторов, полный или частичный ответ на ГКС в адекватной дозе удается достигнуть у 75—90% больных. В настоящее время доказано, что минимальная эффективная доза ГКС при ПМ/ДМ составляет около 1 мг/кг массы тела как для взрослых, так и детей. Причем, чем раньше начато лечение, тем более вероятно, что оно будет эффективным
3) При остром течении заболевания примерные дозы преднизолона 80-100 мг внутрь, при подостром – 50-60 мг, при обострении хронического течения – 30-40 мг/сут. В первые недели ГКС следует назначать в несколько приемов, а затем переводить больного на однократный прием всей дозы в утренние часы.
4) Преднизолон в высоких дозах применяют 2-3 месяца до отчётливых клинических признаков улучшения (уменьшение мышечной слабости, отёка лица, улучшение фонации, глотания, появление пигментации на месте эритемы) и положительной динамики лабораторных показателей и активности ферментов. Однако активность КФК не позволяет судить об эффективности преднизолона в начале лечения, т.к. преднизолон снижает активность КФК, даже не влияя на патологический процесс.
5) Надо отметить, что улучшение состояния больных ПМ/ДМ при лечении высокими дозами ГКС происходит, не так быстро, как при других диффузных болезнях соединительной ткани (в среднем через 2—4 мес.). Отсутствие эффекта может быть констатировано только к 4-му месяцу монотерапии ГКС в дозе не менее 1 мг/кг.
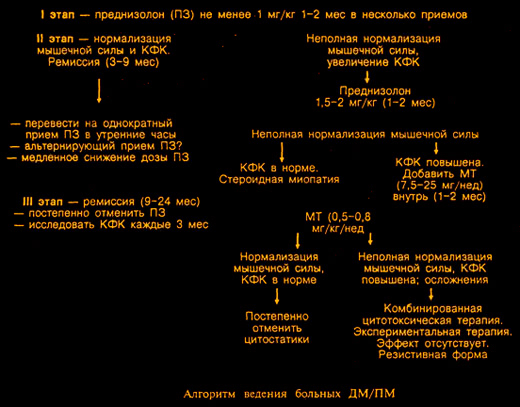
6) Лечение кортикостероидами улучшает состояние практически каждого больного ДМ, радикально – при первичном ДМ и частично — при вторичном (паранеопластическом), где решающим остается эффективное оперативное вмешательство и иные виды терапии. Оказывая противовоспалительное и иммунодепрессивное действие, кортикостероиды в достаточно больших дозах способны подавить воспалительный и иммунный (аутоиммунный) процесс в мышечной ткани, препятствуя развитию некроза и последующих фиброзно-атрофических и дистрофических изменений. Для восстановления (регенерации) мышечных волокон необходим длительный период (не менее 6 мес.), что следует учитывать при наблюдении за больными и общей оценке эффективности терапии. Возможна также альтернативная терапия с приемом кортикостероидов через день. При хронических формах ДМ рекомендуются значительно меньшие дозы преднизолона (20—30 мг/сут) с постепенным снижением их до поддерживающих (10—5 мг/сут) или курсовое лечение в период обострения заболевания. Эффективность лечения контролируют с помощью клинических и лабораторных тестов, включая исследования креатинфосфокиназы; используют электромиографические, иногда морфологические данные.
7) Нередко уже в первые недели лечения улучшается самочувствие больных, уменьшаются эритема, отеки, боли в мышцах или приостанавливается дальнейшее прогрессирование процесса. При отсутствии тенденции к улучшению в течение 4-х месяцев первоначальная доза преднизолона должна быть увеличена. Через 1,5—2 мес. адекватной терапии эффект лечения становится очевидным, после чего можно начать постепенное снижение дозы преднизолона.
8 Наблюдения показали, что при остром и подостром ДМ эффективность терапии выше, если в течение всего первого года заболевания больной получает большие дозы преднизолона, которые снижают до 40 мг при остром и до 30 мг при подостром течении ДМ, а поддерживающие дозы (20—15—10—5 мг) «отрабатываются» уже во второй и последующие годы лечения. Такая дозировка сохраняется в течение ряда лет, подбирается индивидуально и должна увеличиваться при обострении, что делает необходимым тщательное диспансерное наблюдение больных. При форсированном снижении дозы кортикостероидов обычно наступает обострение процесса, и тогда неизбежно повышение дозы до исходной, а иногда и более высокой.
Лечение дерматомиозита
1. Кортикостероиды
1) Кортикостероиды в адекватных, как правило, больших дозах помогают контролировать поражение мышц у значительной части больных.
2) Предпочтителен преднизолон или другие кортикостероиды, за исключением триамцинолона, усиливающего мышечную слабость.
По данным ряда авторов, полный или частичный ответ на ГКС в адекватной дозе удается достигнуть у 75—90% больных. В настоящее время доказано, что минимальная эффективная доза ГКС при ПМ/ДМ составляет около 1 мг/кг массы тела как для взрослых, так и детей. Причем, чем раньше начато лечение, тем более вероятно, что оно будет эффективным
3) При остром течении заболевания примерные дозы преднизолона 80-100 мг внутрь, при подостром – 50-60 мг, при обострении хронического течения – 30-40 мг/сут. В первые недели ГКС следует назначать в несколько приемов, а затем переводить больного на однократный прием всей дозы в утренние часы.
4) Преднизолон в высоких дозах применяют 2-3 месяца до отчётливых клинических признаков улучшения (уменьшение мышечной слабости, отёка лица, улучшение фонации, глотания, появление пигментации на месте эритемы) и положительной динамики лабораторных показателей и активности ферментов. Однако активность КФК не позволяет судить об эффективности преднизолона в начале лечения, т.к. преднизолон снижает активность КФК, даже не влияя на патологический процесс.
5) Надо отметить, что улучшение состояния больных ПМ/ДМ при лечении высокими дозами ГКС происходит, не так быстро, как при других диффузных болезнях соединительной ткани (в среднем через 2—4 мес.). Отсутствие эффекта может быть констатировано только к 4-му месяцу монотерапии ГКС в дозе не менее 1 мг/кг.
6) Лечение кортикостероидами улучшает состояние практически каждого больного ДМ, радикально – при первичном ДМ и частично — при вторичном (паранеопластическом), где решающим остается эффективное оперативное вмешательство и иные виды терапии. Оказывая противовоспалительное и иммунодепрессивное действие, кортикостероиды в достаточно больших дозах способны подавить воспалительный и иммунный (аутоиммунный) процесс в мышечной ткани, препятствуя развитию некроза и последующих фиброзно-атрофических и дистрофических изменений. Для восстановления (регенерации) мышечных волокон необходим длительный период (не менее 6 мес.), что следует учитывать при наблюдении за больными и общей оценке эффективности терапии. Возможна также альтернативная терапия с приемом кортикостероидов через день. При хронических формах ДМ рекомендуются значительно меньшие дозы преднизолона (20—30 мг/сут) с постепенным снижением их до поддерживающих (10—5 мг/сут) или курсовое лечение в период обострения заболевания. Эффективность лечения контролируют с помощью клинических и лабораторных тестов, включая исследования креатинфосфокиназы; используют электромиографические, иногда морфологические данные.
7) Нередко уже в первые недели лечения улучшается самочувствие больных, уменьшаются эритема, отеки, боли в мышцах или приостанавливается дальнейшее прогрессирование процесса. При отсутствии тенденции к улучшению в течение 4-х месяцев первоначальная доза преднизолона должна быть увеличена. Через 1,5—2 мес. адекватной терапии эффект лечения становится очевидным, после чего можно начать постепенное снижение дозы преднизолона.
8 Наблюдения показали, что при остром и подостром ДМ эффективность терапии выше, если в течение всего первого года заболевания больной получает большие дозы преднизолона, которые снижают до 40 мг при остром и до 30 мг при подостром течении ДМ, а поддерживающие дозы (20—15—10—5 мг) «отрабатываются» уже во второй и последующие годы лечения. Такая дозировка сохраняется в течение ряда лет, подбирается индивидуально и должна увеличиваться при обострении, что делает необходимым тщательное диспансерное наблюдение больных. При форсированном снижении дозы кортикостероидов обычно наступает обострение процесса, и тогда неизбежно повышение дозы до исходной, а иногда и более высокой.
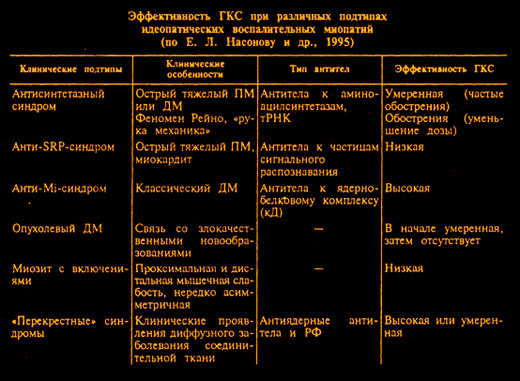 9) Существуют различные схемы терапии и снижения доз препарата, которые можно учитывать, но решающим всегда остается индивидуальный подход с оценкой исходного состояния больного, контроля эффективности лечения, толерантности выбранного препарата(ов), осложнений и др. Дозу преднизолона уменьшают всегда постепенно с сохранением общего правила: чем меньше доза, тем больше интервал перед следующим ступенеобразным снижением ее. Так, при дозе 100—80 мг преднизолона в день возможно снижение ее по 1/2 таблетки каждые 3-5 дней, при 70-40 мг — по 1/2 таблетки в 5-10 дней или по 1/4 таблетки в 3—4 дня, при 30 мг — по 1/4 таблетки в 7—10 дней, при 20 мг – по 1 /4 таблетки в 3 нед; далее еще медленнее.
Таким образом, в процессе длительной терапии происходит подбор индивидуальной поддерживающей дозы, которую принимают годами, но при стойкой клинической ремиссии она может быть далее снижена и даже отменена. Больные ДМ обычно хорошо переносят высокие дозы преднизолона, но в процессе длительной терапии могут возникнуть осложнения — синдром Иценко—Кушинга (ожирение, стрии и др.), остеопороз и стероидная спондилопатия, иногда с компрессионным переломом позвоночника, стероидный диабет, желудочно-кишечные кровотечения, инфекционные осложнения, миокардиопатии и др. Иногда на фоне приема высоких доз кортикостероидов появляются сердцебиение, гастралгии, повышается АД, возбудимость, нарушается психика, что требует симптоматической терапии, а иногда снижения дозы и комбинации с другими препаратами (иммунодепрессанты, НПВП и др.).
Избежать или снизить опасность осложнений позволяет альтернативный вариант лечения (обычно прием одноразовой дозы кортикостероидов через день утром), который можно рекомендовать при достижении определенного эффекта на классической терапии и при появлении начальных признаков кушингоида, что иногда трактуется как дополнительный аргумент в пользу эффективности лечения.
Существовавшие ранее попытки лечения ДМ отдельными курсами или сравнительно малыми дозами кортикостероидов не увенчались успехом: прогноз этих больных значительно хуже, чем при использовании высоких доз.
10) При высокой клинико-лабораторной активности процесса, наличии висцеральных проявлений, прогрессирующей миопатии используется пульс-терапия высокими дозами метилпреднизолона (по 1000 мг), вводимыми внутривенно капельно на 0,9% изотоническом растворе натрия хлорида (500 мл) или 5% растворе глюкозы медленно в течение трех дней подряд.
В целом кортикостероидная терапия сохраняет свое ведущее место в лечении больных ДМ (ПМ).
11) При приеме преднизолона необходимо соблюдать диету с ограничением поваренной соли и углеводов, с увеличением белков, витаминов, продуктов, богатых калием.
а) Дополнительный прием кальция (0,5 г в день) и витамина D (50000 ЕД 1—2 раза в неделю), анаболических стероидов может замедлить развитие остеопороза. При наличии очагов инфекции и туберкулезе в анамнезе рекомендуют антибиотики, нистатин., противотуберкулезные средства и т д.
б) Для профилактики ульцерогенного действия преднизолона сочетают его прием со щелочами (альмагель, фосфальгель, викалин).
– Принимают препарат после еды, большую часть дозы после завтрака, меньшую – после ужина.
– Целесообразен периодический эндоскопический контроль за состоянием желудка и двенадцатиперстной кишки.
– В случае появления медикаментозных язв увеличивают прием щелочей, добавляют Н2 – гистаминоблокаторы (циметидин, тагамет, беломет), что позволяет продолжить прием преднизолона.
в) При повышении АД назначают гипотензивные средства, при задержке жидкости – диуретики. Не стоит забывать, что у большинства больных, в том числе страдающих злокачественными новообразованиями, ДМ поддается лечению ГК.
Может быть стероидная миопатия.
2. Иммунодепрессанты.
Вторая группа препаратов, активно используемых при ДМ – цитостатические препараты, которые применяют самостоятельно или в сочетании с кортикостероидами. Большинство клиницистов считают, что цитостатические препараты без адекватной терапии ГКС не в состоянии контролировать течение ПМ/ДМ. При сочетанном применении с ГКС роль цитостатиков сводится к так называемому «стероидсберегающему» действию (возможность достигнуть клинический эффект в ответ на меньшую дозу ГКС). При ПМ/ДМ применяют метотрексат, азатиоприн, циклофосфамид, хлорбутин.
9) Существуют различные схемы терапии и снижения доз препарата, которые можно учитывать, но решающим всегда остается индивидуальный подход с оценкой исходного состояния больного, контроля эффективности лечения, толерантности выбранного препарата(ов), осложнений и др. Дозу преднизолона уменьшают всегда постепенно с сохранением общего правила: чем меньше доза, тем больше интервал перед следующим ступенеобразным снижением ее. Так, при дозе 100—80 мг преднизолона в день возможно снижение ее по 1/2 таблетки каждые 3-5 дней, при 70-40 мг — по 1/2 таблетки в 5-10 дней или по 1/4 таблетки в 3—4 дня, при 30 мг — по 1/4 таблетки в 7—10 дней, при 20 мг – по 1 /4 таблетки в 3 нед; далее еще медленнее.
Таким образом, в процессе длительной терапии происходит подбор индивидуальной поддерживающей дозы, которую принимают годами, но при стойкой клинической ремиссии она может быть далее снижена и даже отменена. Больные ДМ обычно хорошо переносят высокие дозы преднизолона, но в процессе длительной терапии могут возникнуть осложнения — синдром Иценко—Кушинга (ожирение, стрии и др.), остеопороз и стероидная спондилопатия, иногда с компрессионным переломом позвоночника, стероидный диабет, желудочно-кишечные кровотечения, инфекционные осложнения, миокардиопатии и др. Иногда на фоне приема высоких доз кортикостероидов появляются сердцебиение, гастралгии, повышается АД, возбудимость, нарушается психика, что требует симптоматической терапии, а иногда снижения дозы и комбинации с другими препаратами (иммунодепрессанты, НПВП и др.).
Избежать или снизить опасность осложнений позволяет альтернативный вариант лечения (обычно прием одноразовой дозы кортикостероидов через день утром), который можно рекомендовать при достижении определенного эффекта на классической терапии и при появлении начальных признаков кушингоида, что иногда трактуется как дополнительный аргумент в пользу эффективности лечения.
Существовавшие ранее попытки лечения ДМ отдельными курсами или сравнительно малыми дозами кортикостероидов не увенчались успехом: прогноз этих больных значительно хуже, чем при использовании высоких доз.
10) При высокой клинико-лабораторной активности процесса, наличии висцеральных проявлений, прогрессирующей миопатии используется пульс-терапия высокими дозами метилпреднизолона (по 1000 мг), вводимыми внутривенно капельно на 0,9% изотоническом растворе натрия хлорида (500 мл) или 5% растворе глюкозы медленно в течение трех дней подряд.
В целом кортикостероидная терапия сохраняет свое ведущее место в лечении больных ДМ (ПМ).
11) При приеме преднизолона необходимо соблюдать диету с ограничением поваренной соли и углеводов, с увеличением белков, витаминов, продуктов, богатых калием.
а) Дополнительный прием кальция (0,5 г в день) и витамина D (50000 ЕД 1—2 раза в неделю), анаболических стероидов может замедлить развитие остеопороза. При наличии очагов инфекции и туберкулезе в анамнезе рекомендуют антибиотики, нистатин., противотуберкулезные средства и т д.
б) Для профилактики ульцерогенного действия преднизолона сочетают его прием со щелочами (альмагель, фосфальгель, викалин).
– Принимают препарат после еды, большую часть дозы после завтрака, меньшую – после ужина.
– Целесообразен периодический эндоскопический контроль за состоянием желудка и двенадцатиперстной кишки.
– В случае появления медикаментозных язв увеличивают прием щелочей, добавляют Н2 – гистаминоблокаторы (циметидин, тагамет, беломет), что позволяет продолжить прием преднизолона.
в) При повышении АД назначают гипотензивные средства, при задержке жидкости – диуретики. Не стоит забывать, что у большинства больных, в том числе страдающих злокачественными новообразованиями, ДМ поддается лечению ГК.
Может быть стероидная миопатия.
2. Иммунодепрессанты.
Вторая группа препаратов, активно используемых при ДМ – цитостатические препараты, которые применяют самостоятельно или в сочетании с кортикостероидами. Большинство клиницистов считают, что цитостатические препараты без адекватной терапии ГКС не в состоянии контролировать течение ПМ/ДМ. При сочетанном применении с ГКС роль цитостатиков сводится к так называемому «стероидсберегающему» действию (возможность достигнуть клинический эффект в ответ на меньшую дозу ГКС). При ПМ/ДМ применяют метотрексат, азатиоприн, циклофосфамид, хлорбутин.
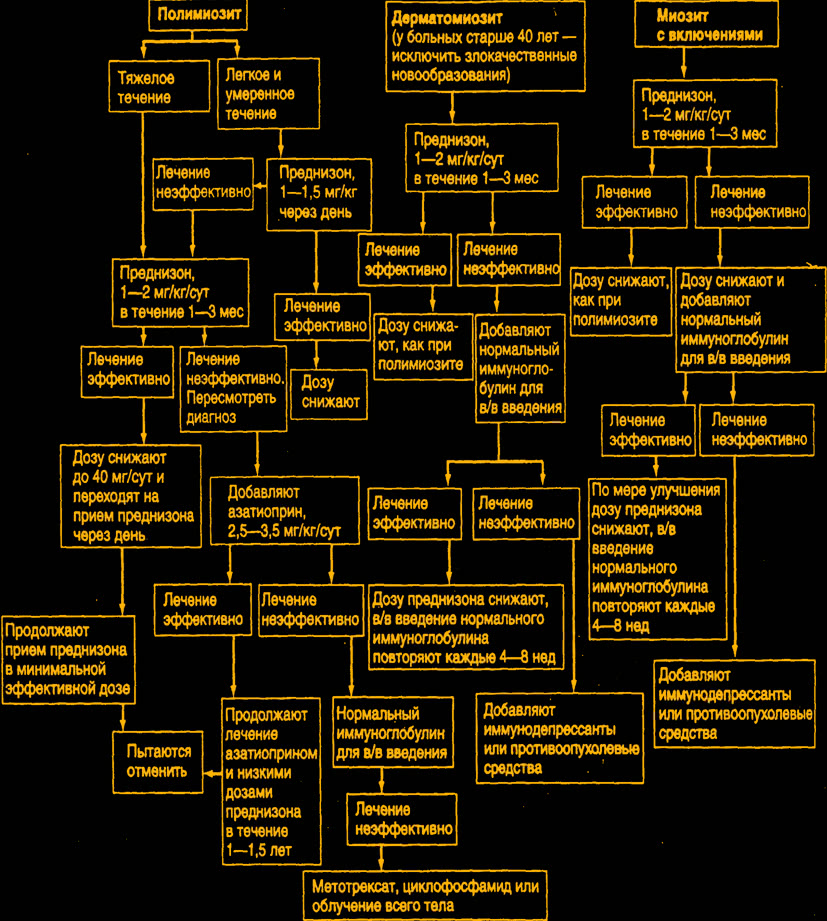 1) Показаниями для назначения цитостатиков являются:
1) Показаниями для назначения цитостатиков являются:
- резистентные к максимально высоким дозам ГКС формы ПМ/ДМ;
- наличие сопутствующих заболеваний или побочных эффектов, ограничивающих возможность адекватной терапии ГКС;
- принадлежность больных ПМ/ДМ к определенным клинико-иммунологическим подтипам, особенностью которых является плохой ответ на ГКС.


