Просмотров: 9 803
Актуальные проблемы современной ревматологии. Сборник научных трудов. Выпуск XXXI
 скачать в pdf
скачать в pdf
 Каратеев А. Е.
АМТОЛМЕТИН ГУАЦИЛ – МОЖНО ЛИ СОЗДАТЬ«УЛУЧШЕННЫЙ» НПВП?
ФГБУ «НИИР им. В.А. Насоновой» РАМН, Москва, Россия
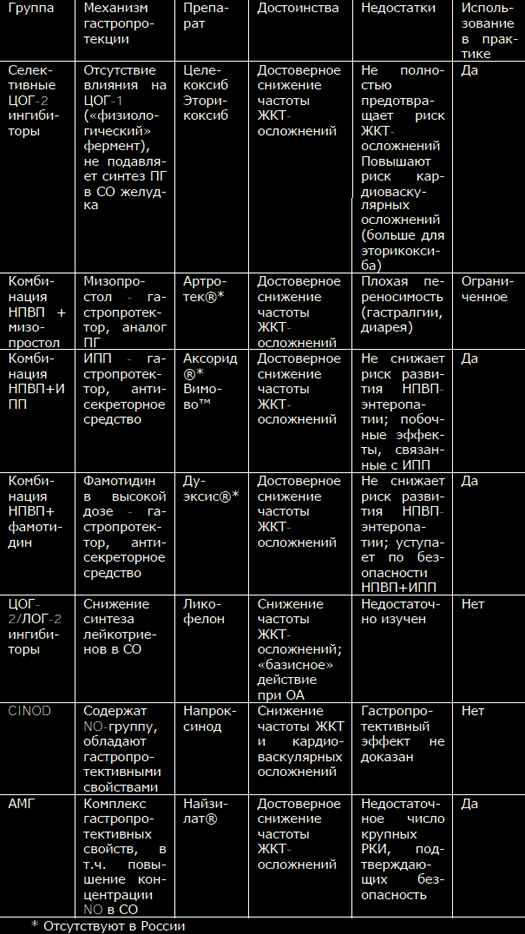
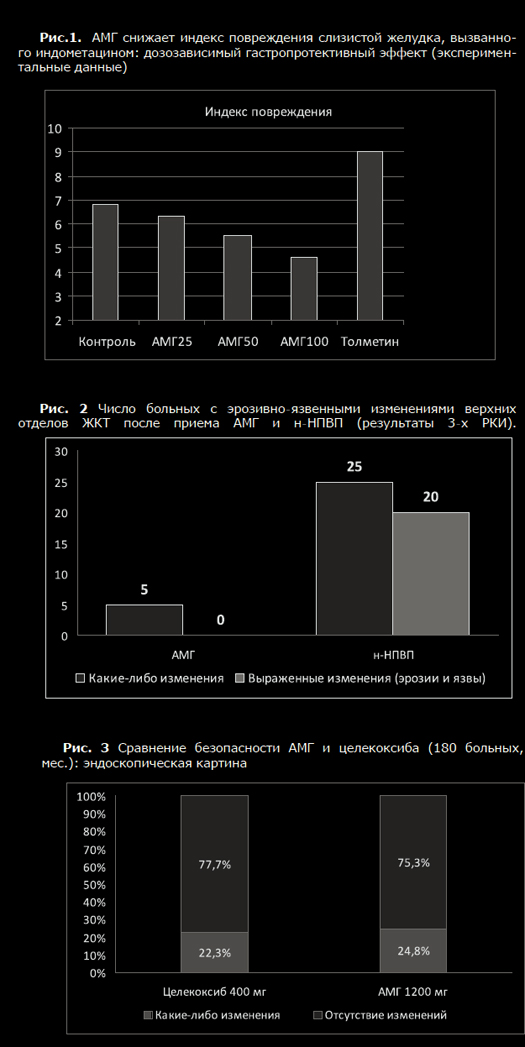
Нестероидные противовоспалительные препараты (НПВП) – действенныйи надежный инструмент анальгетической терапии, широко используемыйврачами самых разных медицинских специальностей. Комбинация обезболи-вающего, противовоспалительного и жаропонижающего эффектов определя-ет преимущество НПВП в сравнении с другими анальгетиками, такими какпарацетамол и опиоиды, и делает их средством выбора для купированияболи, связанной с травмами, острыми и хроническими заболеваниями опор-но-двигательного аппарата. К сожалению, НПВП могут вызывать осложнениясо стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой си-стемы (ССС), что существенно ограничивает их терапевтический потенциал[1,2]. Хорошо известно, что побочные эффекты НПВП являются «класс-специфичными», характерными для всех представителей этой лекарственнойгруппы, и определяются их основным фармакологическим действием – бло-кадой фермента циклооксигеназы (ЦОГ). Анальгетическое и противовоспа-лительное действие НПВП связано с подавлением функции «индуцируемой»формы данного фермента ЦОГ-2, который отвечает за гиперпродукцию про-стагландинов (ПГ), важнейших медиаторов боли и воспаления, в областипатологического процесса. Однако при этом НПВП могут блокировать «кон-ститутивную» разновидность ЦОГ – ЦОГ-1; синтезируемые при помощи этогофермента ПГ играют важную физиологическую роль во многих органах итканях, и в частности, ЖКТ. НПВП, таким образом, существенно снижаютзащитный потенциал слизистой оболочки (СО) ЖКТ, и провоцируют ее по-вреждение под влиянием внешних факторов агрессии – соляной кислоты ипепсина в желудке и двенадцатиперстной кишке, условно патогенной мик-рофлоры в более дистальных отделах пищеварительной трубки [1,2].С другой стороны, регулярный прием НПВП может нарушать баланс меж-ду ЦОГ-1 зависимым синтезом тромбоксана А2, и образованием простацик-лина (синтез которого, при наличии атеросклероза сосудов, определяетсяактивностью ЦОГ-2); это может приводить к повышению риска развития со-судистого тромбоза и, соответственно, кардиоваскулярных катастроф [1-4].Фармакологи в течение длительного времени предпринимают попытки со-здать «улучшенный» НПВП, обладающий эффективностью традиционныхпредставителей этой лекарственной группы, но при этом лишенный их спе-цифических недостатков (таб. 1). Однако ни одно из предложенных на сего-дняшний день решений проблемы безопасности НПВП не оказалось идеаль-ным [5].Большие надежды были связаны с созданием высокоселективных ЦОГ-2ингибиторов, т.н. «коксибов». Предполагалось, что эти препараты, обладающие минимальным действием на «хороший» фермент ЦОГ-1, не должнывызвать повреждения СО ЖКТ. Хотя в целом это положение подтверждено,результаты ряда клинические испытания, и опыт реальной работы показы-вают, что считать «коксибы» полным решением проблемы ЖКТ – осложненийНПВП, к сожалению, нельзя. Так, наиболее селективным НПВП на сегодняш-ний день является эторикоксиб, для которого соотношение ингибирующихконцентраций ЦОГ-1/ЦОГ-2 приближается к 100. Ярким подтверждением егопреимущества стали два масштабных 12-ти недельных исследования, в кото-рых безопасность эторикоксиба в дозе 120 мг сравнивалась с напроксеном,ибупрофеном и плацебо (суммарно 1422 больных) на основании результа-тов динамического эндоскопического контроля ЖКТ. Число язв желудка идвенадцатиперстной кишки (ДПК), возникших на фоне приема лекарств, со-ставило 7.4% vs. 25.3%, и 8.1 % vs 17.0% соответственно, т.е. «коксиб»вызывал серьезные осложнения в 3 и 2 раза реже, чем «традиционные»НПВП. Такой результат мог бы считаться идеальным, но в группах плацебоязвы возникли лишь у 1.9% и 1.4% больных – явно меньше, чем в группахэторикоксиба [6].Как оказалось, активность ЦОГ-2 не всегда связана с развитием патоло-гии; в ряде случаев работа этого фермента необходима как раз для восста-новления поврежденной ткани. Поэтому высокая концентрация этого фер-мента определяется в СО, окружающей эрозии и язвы желудка, ведь синте-зируемые благодаря ЦОГ-2 ПГ и простациклин необходимы для их нормаль-ного заживления. Парадоксально, но «коксибы», блокируя ЦОГ-2, способнызамедлять процессы репарации и тем самым способствовать развитию серь-езных ЖКТ-осложнений. Возможно, именно с этим патогенетическим меха-низмом связано выявление язв ЖКТ у большего числа больных, получавшихэторикоксиб, в сравнении с плацебо.Главным ударом по репутации «коксибов» стали результаты самогобольшого на сегодняшний день исследования безопасности НПВП – програм-мы MEDAL. В ходе этой работе 34700 больных с РА и ОА в течение не менее1.5 лет получали эторикоксиб 60 или 90 мг, а в качестве контроля – дикло-фенак в дозе 150 мг/сутки. Конечно, общее число побочных эффектов состороны ЖКТ у больных, получавших эторикоксиб, оказалось значительноменьшим. Но серьезные осложнения, такие как кровотечения, были отмече-ны у равного числа больных, получавших «безопасный» ЦОГ-2 ингибитор инеселективный препарат: 0.3 и 0.32 на 100 пациентов/лет [7].Другим недостатком «коксибов» является негативное влияние на ССС.Следует напомнить, что именно «благодаря» одному из представителей этойлекарственной группы, рофекоксибу (использование которого было запре-щено из-за опасности развития инфаркта миокарда), мировое сообществоосознало кардиоваскулярные осложнения НПВП в качестве глобальной про-блемы здравоохранения. Хотя сегодня доказано, что все НПВП способныповышать риск кардиоваскулярных катастроф, причем некоторые н-НПВП(диклофенак) даже в большей степени, чем «коксибы», последние традици-онно воспринимаются многими врачами как лекарства, небезопасные дляССС [1-4]. В качестве другого метода улучшения НПВП стало создание комбинаций«традиционных» НПВП и гастропротективных средств. В 90-х годах прошло-го века широкое распространение получал комбинированный препарат, со-держащий диклофенак и синтетический аналог ПГ мизопрастол (Артротек®).Следует отметить, что мизопрастол доказал свою высокую эффективность вкачестве средства для профилактики развития НПВП – ассоциированной па-тологии ЖКТ [8,9]. Однако он имеет серьезный недостаток – его использова-ние нередко сопровождается неприятными побочными эффектами, преждевсего, гастралгиями и диареей. После широкого внедрения в клиническуюпрактику с-НПВП и ингибиторов протонной помпы (ИПП), Артротек утратилсвое значение и в настоящее время практически не используется.Значительно больший интерес в качестве гастропротективного компонен-та комбинированных лекарств могут представлять антисекреторные противо-язвенные средства, прежде всего, ИПП – они весьма эффективны для защи-ты верхних отделов ЖКТ и в целом хорошо переносятся. Так, в настоящеевремя появились препараты, содержащий напроксен и эзомепразол (Вимо-во™), а также кетопрофен и омепразол (Аксорид®). Кроме этого, в США за-регистрировано лекарство, содержащие ибупрофен и Н2-блокатор фамоти-дин (Дуэксис®); при условии 3-х кратного приема, доза последнего состав-ляет 80 мг/сутки, что позволяет добиться удовлетворительного гастропро-тективного эффекта [10-12].Хотя клинические испытания показали хорошую переносимость комбина-ции НПВП и антисекреторных средств, тем не менее, они не лишены недо-статков. Так, ИПП и Н2-блокаторы защищают лишь верхние отделы ЖКТ, ноне предохраняют от повреждения нижележащие отделы; в тоже время хоро-шо известно, что НПВП могут вызывать осложнения со стороны тонкой киш-ки (т.н. «НПВП-энтеропатия»), клиническое значение которых очень суще-ственно. Кроме этого, антисекреторные средства сами могут вызывать серь-езные побочные эффекты – длительный прием ИПП ассоциируется с повы-шением риска развития кишечных инфекций (включая псевдомембранозныйколит), прогрессированием остеопороза, негативным фармакологическимвзаимодействием с рядом важных лекарств и др.Иной подход к повышению безопасности НПВП был реализован при со-здании ликофелона. Этот своеобразный представить НПВП обладает способ-ностью блокировать не только ЦОГ-2, но и 5-липооксигеназу, фермент, отве-чающий за синтез лейкотриенов, играющих важную роль в развитии воспа-ления и повреждения слизистой ЖКТ. Некоторые эксперты считают, что ли-кофелон обладает заметным преимуществом по переносимости, в сравнениис «традиционными» НПВП – прежде всего, в отношении ЖКТ [13]. Однакоограниченный опыт применения этого препарата и отсутствие крупных кли-нических исследований его безопасности определяет необходимость даль-нейшей оценки его реальных достоинств.Еще одним направлением по улучшению НПВП стало создание молекулдействующих веществ, содержащих NO-группу (т.н. CINOD) [14,15].NO (окись азота) является одним из важнейших «передатчиков» биологи-ческих сигналов, который принимает участие в регуляции разнообразных физиологических функций. С действием NO связывают такие процессы, какзамедление агрегации тромбоцитов и миграции нейтрофилов через сосуди-стую стенку, расслабление гладкомышечных клеток интимы сосудов, неоан-гиогенез, неонейрогенез и др. Подобно простагландинам, в области воспале-ния и повреждения ткани NO способен выступать в «негативной» роли меди-атора боли, вызывающего сенситизацию и прямую стимуляцию ноцицепто-ров. Синтез этой маленькой молекулы происходит при помощи фермента NO-синтетазы (NOS), которая отщепляет NO от аминокислоты L-аргинина с обра-зованием L-цитруллина. Известны несколько NOS: одни из них являютсяконститутивными (эндотелиальная, e-NOS и нейрональная, n-NOS); синтезже NO в области патологического процесса определяется индуцируемойизоформой данного фермента, i-NOS [14,15].В слизистой ЖКТ NO выполняет защитную функцию, усиливая кровоток,репарацию эпителиоцитов, препятствуя развитию воспаления (во многомблагодаря подавления хемотаксиса нейтрофилов) и блокируя свободноради-кальные процессы. При этом основное количество этого вещества образуетсяпри участии iNOS, экспрессируемой в ответ на повреждение эпителиальныхклеток, вызванным различными факторами агрессии, такими как H.pylori,НПВП и соляная кислота [14,15].Насыщение СО ЖКТ NO «извне», таким образом, может оказаться удач-ным способом повысить ее устойчивость к повреждению. Имеются весьмалюбопытные популяционные данные, подтверждающие это предположение.Так, испанские исследователи Lanas A. и сотр. провели анализ влиянияНПВП и различенных гастропротективных препаратов на риск развития ЖКТ-кровотечений; исследуемой группой стали 2777 больных, развивших данноеосложнение, а 5532 лиц, не имевших подобных проблем, составили соответ-ствующий контроль. Прием НПВП сам по себе резко повышал опасность кро-вотечения – соотношение шансов (ОШ) составило 5.6. В тоже время, сопут-ствующий прием ИПП и Н2-блокаторов снижал данный риск: ОШ 0.33 и 0.65соответственно. Такое же уменьшение риска осложнений со стороны ЖКТотмечалось, если больные регулярно использовали нитропрепараты (длялечения заболеваний ССС): ОШ составило 0.48 [16].В начале 21 века был разработан напроксинод, представлявший собойнапроксен с донатором NJ-группы. Его создатели надеялись добиться суще-ственного повышения безопасности препарата – причем как ЖКТ, так и кар-диоваскулярной. К сожалению, эти надежды в полной мере не оправдались.В 200 г. были опубликованы результаты 6-ти месячного РКИ, в котором про-водилось сравнение напроксинода 1500 мг/сутки и обычного напроксена1000 мг/сутки у 970 больных ОА. Число язв верхних отделов ЖКТ, возник-ших на фоне приема напроксинода, было несколько меньшим, чем в кон-трольной группе – 9.7% и 13.7%, однако различие это оказалось статисти-чески незначимым [17]. Поскольку результаты клинических испытаний непоказали явного преимущества напроксинода, эта перспективная разработкатак и не вошла в широкую терапевтическую практику.Однако CINOD, наиболее известным представителем которых былнапроксинод – не единственный подход к использованию протективныхсвойств NO для повышения безопасности НПВП. В настоящее время на фармакологический рынок России выходит новый «защищенный» НПВП, амтол-метин гуацил, АМГ (Найзилат®), фармакологические преимущества которогоопределяются повышением активности NO в слизистой ЖКТ.Новый препарат создан на основе хорошо известного на Западе «тради-ционного» НПВП толметина, используемого в клинической практике более 40лет. Это проверенный временем, эффективный анальгетик с выраженнымипротивовоспалительными свойствами, доказавший хороший терапевтическийпотенциал как для купирования острой боли, так и лечения хроническихревматических заболеваний. Любопытно, что в США толметин может исполь-зоваться в педиатрической практике у детей с 2-х летнего возраста [18,19].АМГ получен путем добавления к молекуле толметина аминокислоты ва-нилина, что привело к существенному изменению его фармакологическихсвойств. В отличие от своего «прародителя» он приобрел отчетливые гастро-протективные свойства, связанные, в первую очередь, с подавлением актив-ности ингибиторов iNOS, что приводит к существенному повышению концен-трации NO в СО ЖКТ [20,21]. В работе Coruzzi G. и сотр. было показано мно-гократное нарастание активности iNOS в СО лабораторных животных, полу-чавших АМГ; ни плацебо, ни толметин такого эффекта не оказывали [20].Кроме этого, новый препарат стимулирует рецепторы капсаицина, усили-вает синтез кальцитонин-ген связанного пептида, подавляет перикисноеокисление липидов, что приводит к снижению секреции соляной кислоты иускорению репарации эпителиоцитов [20,21].Лабораторные исследования четко подтвердили гастропротективный по-тенциал АМГ. Так, в работе Tubaro E. и сотр. для этого препарата было пока-зано дозозависимое подавление стимулированной желудочной секреции,т.е., по сути, он оказался достаточно эффективным антисекреторным сред-ством (рис.1). Кроме этого, АМГ отчетливо усиливал секрецию бикарбоната,являющегося основой щелочного «буфера» СО желудка. Самое интересное,что АМГ, будучи НПВП, снижал повреждающее действие других НПВП. Так, всравнении с плацебо или толметином, на фоне введения АМГ у лаборатор-ных животных было выявлено достоверное дозозависимое уменьшение вы-раженности ульцерации, вызванной приемом индометацина [21].Любопытные данные были получены Morini G. и сотр., изучавших морфо-логическую картину СО желудка крыс, получавших АМГ, толметин и целе-коксиб. Оказалось, что в группе животных, получавших АМГ, не было отме-чено повреждения эндотелиальных клеток и провоспалительных измененийв стенке желудка, в отличии от препаратов сравнения; особенно интересно,что элементы воспаления возникали даже при использовании целекоксиба,считающегося на сегодняшний деь одним из наиболее безопасных НПВП[22].У здоровых добровольцев, получивших в качестве «провокатора» ЖКТ-осложнений 40-80 мг чистого этилового спирта, прием АМГ устранял функ-циональные расстройства пищеварения. В этом плане он оказался столь жеэффективен, как известный гастропротектор мизопростол. В тоже время,прием диклофенака и плацебо однозначно усиливал расстройства ЖКТ, связанные с приемом алкоголя [23]. Было проведено несколько хорошо организованных РКИ, в которых срав-нивалась эффективность и безопасность АМГ и ряда других НПВП, включаяцелекоксиб.Так, Tavella A. и Ursini G. сравнили эффективность нового препарата идиклофенака у 50 больных с выраженной мышечно-скелетной болью. Выра-женность боли оценивалась по 5-ти бальной шкале (от 0 до 4). Оказалось,что АМГ не уступал, а по ряду параметров даже превосходил препарат кон-троля. Так, боль в покое, при движении и выраженность нарушения функциичерез 4 недели терапии составила в исследуемых группах 0.5 и 1.2, 0.7 и0.8, 0.4 и 1.1 баллов соответственно [24].В 1999 г. был опубликован мета-анализ серии 18 РКИ (n=780), продол-жительностью от 4 недель до 6 мес., в которых изучалась частота развитияпобочных эффектов при использовании АМГ и «традиционных» НПВП (дик-лофенак, толметин, пирокскам, индометацин). Какие-либо осложнения нафоне приема нового препарата возникали гораздо реже, чем в контрольныхгруппах – ОШ для их развития составило 0.2 (0.1-0.3); риск появленияосложнений со стороны ЖКТ был меньше более чем в 3 раза – ОШ 0.3 (0.1-0.7). В трех РКИ (суммарно 92 больных), безопасность АМГ оценивалась порезультатам оценки эндоскопической картины верхних отделов ЖКТ. Препа-ратами сравнения здесь были индометацин, толметин и диклофенак (рис.2).Как видно, лишь у нескольких больных, получавших АМГ, развились не-большие изменения СО – единичные геморрагии или эрозии, в то время какприем обычных НПВП вызвал появление эрозий и язв почти у половиныучастников исследований [25].Серьезной проверкой АМГ стало его сравнение с целекоксибом, который,как было отмечено выше, среди всех современных НПВП по праву считаетсянаиболее безопасным для ЖКТ. Это исследование было проведено группойхорватских ученых, причем продолжительность его составила 6 месяцев, аисследуемая группа – 180 больных РА. Пациенты получали АМГ в дозе 1200мг или целекоксиб в дозе 400 мг, причем всем до- и после курса леченияпроводилось эндоскопическое исследование ЖКТ. Результаты работы пока-заны на рис. 3. Как видно, у подавляющего большинства пациентов не былоотмечено развития каких-либо изменений СО, причем АМГ по уровню ЖКТ -переносимости нисколько не уступал целекоксибу [26].Важным доказательством преимуществ АМГ стала работа Belisari A. иMantovani L., сравнивших финансовые затраты при лечении этим препаратоми популярными «традиционными» НПВП. Как известно, стоимость лекар-ственной терапии определяется не только номинальной ценой препарата;она включает оплату диагностических и лечебных мероприятий, связанных спредупреждением и терапией возможных побочных эффектов. Исходя изэтого, суммарные экономические потери, связанные с применением НПВП,могут в десятки раз превышать затраты на покупку препарата. Как показалипроведенные расчеты, АМГ суммарно обходился значительно дешевле, чем«традиционные» НПВП, которые гораздо чаще вызывали те или иные ослож-нения. Так, лечение пироксикамом (на 100 человек/лет) оказалось дорожена 150-1077 €, диклофенаком 380-1705 €, толметином на 410-2190 €, а ин-дометацином – 1046-3132 € [27]. Таким образом, терапевтический арсенал российских врачей пополнилсяоригинальным представителем группы НПВП, обладающим серьезными пре-имуществами – по крайней мере, по сравнению с неселективными НПВП.Толметин, ставший основой для создания нового препарата, хорошо изве-стен западным врачам как эффективное обезболивающее и противовоспали-тельное средство; АМГ нисколько не уступает по терапевтическому потенци-алу своему предшественнику, что было доказано в ходе серии клиническихиспытаний. АМГ обладает собственными гастропротективными свойствами,повышая концентрацию NO в слизистой оболочке ЖКТ. Имеются доказатель-ства большей безопасности АМГ для ЖКТ, в сравнении со многими н-НПВП, вчастности, диклофенаком. По данным одного РКИ, АМГ не уступает целекок-сибу по своей переносимости и низкой ульцерогенности. Правда, размерыисследований, подтверждающих преимущества АМГ, относительно невелики;не все параметры его безопасности – в частности, влияние на сердечно-сосудистую систему, изучены достаточно глубоко. Несомненно, требуютсядальнейшие исследования достоинств этого интересного препарата. Тем неменее, имеющаяся на сегодняшний день информация позволяют рекомендо-вать АМГ как удачную альтернативу традиционным НПВП для купированияострой и контроля хронической боли, связанной с заболеваниями опорно-двигательного аппарата.Резюме: НПВП – важнейший инструмент лечения острой и контроля хро-нической боли. Однако НПВП могут вызывать серьезные осложнения со сто-роны ЖКТ и сердечно-сосудистой системы. Фармакологи неоднократно пред-принимали попытки создать «улучшенные» НПВП, не оказывающие повре-ждающего действия на ЖКТ. К таким препаратам относятся «коксибы», НПВПв комбинации с гастропротекторами (мизопрастол, Н2-блокаторы, ИПП),ЦОГ-2/ЛОГ-2 ингибиторы, CINOD. Все эти препараты имеют свои недостатки,некоторые из них используются в практике, другие остались на уровненаучных разработок или уже вышли из клинической практики. Амтолметингуацил – новый «улучшенный» НПВП, созданный на основе неселективногоНПВП толметина и обладающий комплексом гастропротективных свойств.Главным из них является повышение концентрации NO в слизистой ЖКТ. Встатье рассмотрен механизм действия нового препарата, представлены дан-ные его лабораторных и клинических испытаний.
Таблица 1. «Улучшенные» НПВП: достоинства и недостатки
Каратеев А. Е.
АМТОЛМЕТИН ГУАЦИЛ – МОЖНО ЛИ СОЗДАТЬ«УЛУЧШЕННЫЙ» НПВП?
ФГБУ «НИИР им. В.А. Насоновой» РАМН, Москва, Россия
Нестероидные противовоспалительные препараты (НПВП) – действенныйи надежный инструмент анальгетической терапии, широко используемыйврачами самых разных медицинских специальностей. Комбинация обезболи-вающего, противовоспалительного и жаропонижающего эффектов определя-ет преимущество НПВП в сравнении с другими анальгетиками, такими какпарацетамол и опиоиды, и делает их средством выбора для купированияболи, связанной с травмами, острыми и хроническими заболеваниями опор-но-двигательного аппарата. К сожалению, НПВП могут вызывать осложнениясо стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой си-стемы (ССС), что существенно ограничивает их терапевтический потенциал[1,2]. Хорошо известно, что побочные эффекты НПВП являются «класс-специфичными», характерными для всех представителей этой лекарственнойгруппы, и определяются их основным фармакологическим действием – бло-кадой фермента циклооксигеназы (ЦОГ). Анальгетическое и противовоспа-лительное действие НПВП связано с подавлением функции «индуцируемой»формы данного фермента ЦОГ-2, который отвечает за гиперпродукцию про-стагландинов (ПГ), важнейших медиаторов боли и воспаления, в областипатологического процесса. Однако при этом НПВП могут блокировать «кон-ститутивную» разновидность ЦОГ – ЦОГ-1; синтезируемые при помощи этогофермента ПГ играют важную физиологическую роль во многих органах итканях, и в частности, ЖКТ. НПВП, таким образом, существенно снижаютзащитный потенциал слизистой оболочки (СО) ЖКТ, и провоцируют ее по-вреждение под влиянием внешних факторов агрессии – соляной кислоты ипепсина в желудке и двенадцатиперстной кишке, условно патогенной мик-рофлоры в более дистальных отделах пищеварительной трубки [1,2].С другой стороны, регулярный прием НПВП может нарушать баланс меж-ду ЦОГ-1 зависимым синтезом тромбоксана А2, и образованием простацик-лина (синтез которого, при наличии атеросклероза сосудов, определяетсяактивностью ЦОГ-2); это может приводить к повышению риска развития со-судистого тромбоза и, соответственно, кардиоваскулярных катастроф [1-4].Фармакологи в течение длительного времени предпринимают попытки со-здать «улучшенный» НПВП, обладающий эффективностью традиционныхпредставителей этой лекарственной группы, но при этом лишенный их спе-цифических недостатков (таб. 1). Однако ни одно из предложенных на сего-дняшний день решений проблемы безопасности НПВП не оказалось идеаль-ным [5].Большие надежды были связаны с созданием высокоселективных ЦОГ-2ингибиторов, т.н. «коксибов». Предполагалось, что эти препараты, обладающие минимальным действием на «хороший» фермент ЦОГ-1, не должнывызвать повреждения СО ЖКТ. Хотя в целом это положение подтверждено,результаты ряда клинические испытания, и опыт реальной работы показы-вают, что считать «коксибы» полным решением проблемы ЖКТ – осложненийНПВП, к сожалению, нельзя. Так, наиболее селективным НПВП на сегодняш-ний день является эторикоксиб, для которого соотношение ингибирующихконцентраций ЦОГ-1/ЦОГ-2 приближается к 100. Ярким подтверждением егопреимущества стали два масштабных 12-ти недельных исследования, в кото-рых безопасность эторикоксиба в дозе 120 мг сравнивалась с напроксеном,ибупрофеном и плацебо (суммарно 1422 больных) на основании результа-тов динамического эндоскопического контроля ЖКТ. Число язв желудка идвенадцатиперстной кишки (ДПК), возникших на фоне приема лекарств, со-ставило 7.4% vs. 25.3%, и 8.1 % vs 17.0% соответственно, т.е. «коксиб»вызывал серьезные осложнения в 3 и 2 раза реже, чем «традиционные»НПВП. Такой результат мог бы считаться идеальным, но в группах плацебоязвы возникли лишь у 1.9% и 1.4% больных – явно меньше, чем в группахэторикоксиба [6].Как оказалось, активность ЦОГ-2 не всегда связана с развитием патоло-гии; в ряде случаев работа этого фермента необходима как раз для восста-новления поврежденной ткани. Поэтому высокая концентрация этого фер-мента определяется в СО, окружающей эрозии и язвы желудка, ведь синте-зируемые благодаря ЦОГ-2 ПГ и простациклин необходимы для их нормаль-ного заживления. Парадоксально, но «коксибы», блокируя ЦОГ-2, способнызамедлять процессы репарации и тем самым способствовать развитию серь-езных ЖКТ-осложнений. Возможно, именно с этим патогенетическим меха-низмом связано выявление язв ЖКТ у большего числа больных, получавшихэторикоксиб, в сравнении с плацебо.Главным ударом по репутации «коксибов» стали результаты самогобольшого на сегодняшний день исследования безопасности НПВП – програм-мы MEDAL. В ходе этой работе 34700 больных с РА и ОА в течение не менее1.5 лет получали эторикоксиб 60 или 90 мг, а в качестве контроля – дикло-фенак в дозе 150 мг/сутки. Конечно, общее число побочных эффектов состороны ЖКТ у больных, получавших эторикоксиб, оказалось значительноменьшим. Но серьезные осложнения, такие как кровотечения, были отмече-ны у равного числа больных, получавших «безопасный» ЦОГ-2 ингибитор инеселективный препарат: 0.3 и 0.32 на 100 пациентов/лет [7].Другим недостатком «коксибов» является негативное влияние на ССС.Следует напомнить, что именно «благодаря» одному из представителей этойлекарственной группы, рофекоксибу (использование которого было запре-щено из-за опасности развития инфаркта миокарда), мировое сообществоосознало кардиоваскулярные осложнения НПВП в качестве глобальной про-блемы здравоохранения. Хотя сегодня доказано, что все НПВП способныповышать риск кардиоваскулярных катастроф, причем некоторые н-НПВП(диклофенак) даже в большей степени, чем «коксибы», последние традици-онно воспринимаются многими врачами как лекарства, небезопасные дляССС [1-4]. В качестве другого метода улучшения НПВП стало создание комбинаций«традиционных» НПВП и гастропротективных средств. В 90-х годах прошло-го века широкое распространение получал комбинированный препарат, со-держащий диклофенак и синтетический аналог ПГ мизопрастол (Артротек®).Следует отметить, что мизопрастол доказал свою высокую эффективность вкачестве средства для профилактики развития НПВП – ассоциированной па-тологии ЖКТ [8,9]. Однако он имеет серьезный недостаток – его использова-ние нередко сопровождается неприятными побочными эффектами, преждевсего, гастралгиями и диареей. После широкого внедрения в клиническуюпрактику с-НПВП и ингибиторов протонной помпы (ИПП), Артротек утратилсвое значение и в настоящее время практически не используется.Значительно больший интерес в качестве гастропротективного компонен-та комбинированных лекарств могут представлять антисекреторные противо-язвенные средства, прежде всего, ИПП – они весьма эффективны для защи-ты верхних отделов ЖКТ и в целом хорошо переносятся. Так, в настоящеевремя появились препараты, содержащий напроксен и эзомепразол (Вимо-во™), а также кетопрофен и омепразол (Аксорид®). Кроме этого, в США за-регистрировано лекарство, содержащие ибупрофен и Н2-блокатор фамоти-дин (Дуэксис®); при условии 3-х кратного приема, доза последнего состав-ляет 80 мг/сутки, что позволяет добиться удовлетворительного гастропро-тективного эффекта [10-12].Хотя клинические испытания показали хорошую переносимость комбина-ции НПВП и антисекреторных средств, тем не менее, они не лишены недо-статков. Так, ИПП и Н2-блокаторы защищают лишь верхние отделы ЖКТ, ноне предохраняют от повреждения нижележащие отделы; в тоже время хоро-шо известно, что НПВП могут вызывать осложнения со стороны тонкой киш-ки (т.н. «НПВП-энтеропатия»), клиническое значение которых очень суще-ственно. Кроме этого, антисекреторные средства сами могут вызывать серь-езные побочные эффекты – длительный прием ИПП ассоциируется с повы-шением риска развития кишечных инфекций (включая псевдомембранозныйколит), прогрессированием остеопороза, негативным фармакологическимвзаимодействием с рядом важных лекарств и др.Иной подход к повышению безопасности НПВП был реализован при со-здании ликофелона. Этот своеобразный представить НПВП обладает способ-ностью блокировать не только ЦОГ-2, но и 5-липооксигеназу, фермент, отве-чающий за синтез лейкотриенов, играющих важную роль в развитии воспа-ления и повреждения слизистой ЖКТ. Некоторые эксперты считают, что ли-кофелон обладает заметным преимуществом по переносимости, в сравнениис «традиционными» НПВП – прежде всего, в отношении ЖКТ [13]. Однакоограниченный опыт применения этого препарата и отсутствие крупных кли-нических исследований его безопасности определяет необходимость даль-нейшей оценки его реальных достоинств.Еще одним направлением по улучшению НПВП стало создание молекулдействующих веществ, содержащих NO-группу (т.н. CINOD) [14,15].NO (окись азота) является одним из важнейших «передатчиков» биологи-ческих сигналов, который принимает участие в регуляции разнообразных физиологических функций. С действием NO связывают такие процессы, какзамедление агрегации тромбоцитов и миграции нейтрофилов через сосуди-стую стенку, расслабление гладкомышечных клеток интимы сосудов, неоан-гиогенез, неонейрогенез и др. Подобно простагландинам, в области воспале-ния и повреждения ткани NO способен выступать в «негативной» роли меди-атора боли, вызывающего сенситизацию и прямую стимуляцию ноцицепто-ров. Синтез этой маленькой молекулы происходит при помощи фермента NO-синтетазы (NOS), которая отщепляет NO от аминокислоты L-аргинина с обра-зованием L-цитруллина. Известны несколько NOS: одни из них являютсяконститутивными (эндотелиальная, e-NOS и нейрональная, n-NOS); синтезже NO в области патологического процесса определяется индуцируемойизоформой данного фермента, i-NOS [14,15].В слизистой ЖКТ NO выполняет защитную функцию, усиливая кровоток,репарацию эпителиоцитов, препятствуя развитию воспаления (во многомблагодаря подавления хемотаксиса нейтрофилов) и блокируя свободноради-кальные процессы. При этом основное количество этого вещества образуетсяпри участии iNOS, экспрессируемой в ответ на повреждение эпителиальныхклеток, вызванным различными факторами агрессии, такими как H.pylori,НПВП и соляная кислота [14,15].Насыщение СО ЖКТ NO «извне», таким образом, может оказаться удач-ным способом повысить ее устойчивость к повреждению. Имеются весьмалюбопытные популяционные данные, подтверждающие это предположение.Так, испанские исследователи Lanas A. и сотр. провели анализ влиянияНПВП и различенных гастропротективных препаратов на риск развития ЖКТ-кровотечений; исследуемой группой стали 2777 больных, развивших данноеосложнение, а 5532 лиц, не имевших подобных проблем, составили соответ-ствующий контроль. Прием НПВП сам по себе резко повышал опасность кро-вотечения – соотношение шансов (ОШ) составило 5.6. В тоже время, сопут-ствующий прием ИПП и Н2-блокаторов снижал данный риск: ОШ 0.33 и 0.65соответственно. Такое же уменьшение риска осложнений со стороны ЖКТотмечалось, если больные регулярно использовали нитропрепараты (длялечения заболеваний ССС): ОШ составило 0.48 [16].В начале 21 века был разработан напроксинод, представлявший собойнапроксен с донатором NJ-группы. Его создатели надеялись добиться суще-ственного повышения безопасности препарата – причем как ЖКТ, так и кар-диоваскулярной. К сожалению, эти надежды в полной мере не оправдались.В 200 г. были опубликованы результаты 6-ти месячного РКИ, в котором про-водилось сравнение напроксинода 1500 мг/сутки и обычного напроксена1000 мг/сутки у 970 больных ОА. Число язв верхних отделов ЖКТ, возник-ших на фоне приема напроксинода, было несколько меньшим, чем в кон-трольной группе – 9.7% и 13.7%, однако различие это оказалось статисти-чески незначимым [17]. Поскольку результаты клинических испытаний непоказали явного преимущества напроксинода, эта перспективная разработкатак и не вошла в широкую терапевтическую практику.Однако CINOD, наиболее известным представителем которых былнапроксинод – не единственный подход к использованию протективныхсвойств NO для повышения безопасности НПВП. В настоящее время на фармакологический рынок России выходит новый «защищенный» НПВП, амтол-метин гуацил, АМГ (Найзилат®), фармакологические преимущества которогоопределяются повышением активности NO в слизистой ЖКТ.Новый препарат создан на основе хорошо известного на Западе «тради-ционного» НПВП толметина, используемого в клинической практике более 40лет. Это проверенный временем, эффективный анальгетик с выраженнымипротивовоспалительными свойствами, доказавший хороший терапевтическийпотенциал как для купирования острой боли, так и лечения хроническихревматических заболеваний. Любопытно, что в США толметин может исполь-зоваться в педиатрической практике у детей с 2-х летнего возраста [18,19].АМГ получен путем добавления к молекуле толметина аминокислоты ва-нилина, что привело к существенному изменению его фармакологическихсвойств. В отличие от своего «прародителя» он приобрел отчетливые гастро-протективные свойства, связанные, в первую очередь, с подавлением актив-ности ингибиторов iNOS, что приводит к существенному повышению концен-трации NO в СО ЖКТ [20,21]. В работе Coruzzi G. и сотр. было показано мно-гократное нарастание активности iNOS в СО лабораторных животных, полу-чавших АМГ; ни плацебо, ни толметин такого эффекта не оказывали [20].Кроме этого, новый препарат стимулирует рецепторы капсаицина, усили-вает синтез кальцитонин-ген связанного пептида, подавляет перикисноеокисление липидов, что приводит к снижению секреции соляной кислоты иускорению репарации эпителиоцитов [20,21].Лабораторные исследования четко подтвердили гастропротективный по-тенциал АМГ. Так, в работе Tubaro E. и сотр. для этого препарата было пока-зано дозозависимое подавление стимулированной желудочной секреции,т.е., по сути, он оказался достаточно эффективным антисекреторным сред-ством (рис.1). Кроме этого, АМГ отчетливо усиливал секрецию бикарбоната,являющегося основой щелочного «буфера» СО желудка. Самое интересное,что АМГ, будучи НПВП, снижал повреждающее действие других НПВП. Так, всравнении с плацебо или толметином, на фоне введения АМГ у лаборатор-ных животных было выявлено достоверное дозозависимое уменьшение вы-раженности ульцерации, вызванной приемом индометацина [21].Любопытные данные были получены Morini G. и сотр., изучавших морфо-логическую картину СО желудка крыс, получавших АМГ, толметин и целе-коксиб. Оказалось, что в группе животных, получавших АМГ, не было отме-чено повреждения эндотелиальных клеток и провоспалительных измененийв стенке желудка, в отличии от препаратов сравнения; особенно интересно,что элементы воспаления возникали даже при использовании целекоксиба,считающегося на сегодняшний деь одним из наиболее безопасных НПВП[22].У здоровых добровольцев, получивших в качестве «провокатора» ЖКТ-осложнений 40-80 мг чистого этилового спирта, прием АМГ устранял функ-циональные расстройства пищеварения. В этом плане он оказался столь жеэффективен, как известный гастропротектор мизопростол. В тоже время,прием диклофенака и плацебо однозначно усиливал расстройства ЖКТ, связанные с приемом алкоголя [23]. Было проведено несколько хорошо организованных РКИ, в которых срав-нивалась эффективность и безопасность АМГ и ряда других НПВП, включаяцелекоксиб.Так, Tavella A. и Ursini G. сравнили эффективность нового препарата идиклофенака у 50 больных с выраженной мышечно-скелетной болью. Выра-женность боли оценивалась по 5-ти бальной шкале (от 0 до 4). Оказалось,что АМГ не уступал, а по ряду параметров даже превосходил препарат кон-троля. Так, боль в покое, при движении и выраженность нарушения функциичерез 4 недели терапии составила в исследуемых группах 0.5 и 1.2, 0.7 и0.8, 0.4 и 1.1 баллов соответственно [24].В 1999 г. был опубликован мета-анализ серии 18 РКИ (n=780), продол-жительностью от 4 недель до 6 мес., в которых изучалась частота развитияпобочных эффектов при использовании АМГ и «традиционных» НПВП (дик-лофенак, толметин, пирокскам, индометацин). Какие-либо осложнения нафоне приема нового препарата возникали гораздо реже, чем в контрольныхгруппах – ОШ для их развития составило 0.2 (0.1-0.3); риск появленияосложнений со стороны ЖКТ был меньше более чем в 3 раза – ОШ 0.3 (0.1-0.7). В трех РКИ (суммарно 92 больных), безопасность АМГ оценивалась порезультатам оценки эндоскопической картины верхних отделов ЖКТ. Препа-ратами сравнения здесь были индометацин, толметин и диклофенак (рис.2).Как видно, лишь у нескольких больных, получавших АМГ, развились не-большие изменения СО – единичные геморрагии или эрозии, в то время какприем обычных НПВП вызвал появление эрозий и язв почти у половиныучастников исследований [25].Серьезной проверкой АМГ стало его сравнение с целекоксибом, который,как было отмечено выше, среди всех современных НПВП по праву считаетсянаиболее безопасным для ЖКТ. Это исследование было проведено группойхорватских ученых, причем продолжительность его составила 6 месяцев, аисследуемая группа – 180 больных РА. Пациенты получали АМГ в дозе 1200мг или целекоксиб в дозе 400 мг, причем всем до- и после курса леченияпроводилось эндоскопическое исследование ЖКТ. Результаты работы пока-заны на рис. 3. Как видно, у подавляющего большинства пациентов не былоотмечено развития каких-либо изменений СО, причем АМГ по уровню ЖКТ -переносимости нисколько не уступал целекоксибу [26].Важным доказательством преимуществ АМГ стала работа Belisari A. иMantovani L., сравнивших финансовые затраты при лечении этим препаратоми популярными «традиционными» НПВП. Как известно, стоимость лекар-ственной терапии определяется не только номинальной ценой препарата;она включает оплату диагностических и лечебных мероприятий, связанных спредупреждением и терапией возможных побочных эффектов. Исходя изэтого, суммарные экономические потери, связанные с применением НПВП,могут в десятки раз превышать затраты на покупку препарата. Как показалипроведенные расчеты, АМГ суммарно обходился значительно дешевле, чем«традиционные» НПВП, которые гораздо чаще вызывали те или иные ослож-нения. Так, лечение пироксикамом (на 100 человек/лет) оказалось дорожена 150-1077 €, диклофенаком 380-1705 €, толметином на 410-2190 €, а ин-дометацином – 1046-3132 € [27]. Таким образом, терапевтический арсенал российских врачей пополнилсяоригинальным представителем группы НПВП, обладающим серьезными пре-имуществами – по крайней мере, по сравнению с неселективными НПВП.Толметин, ставший основой для создания нового препарата, хорошо изве-стен западным врачам как эффективное обезболивающее и противовоспали-тельное средство; АМГ нисколько не уступает по терапевтическому потенци-алу своему предшественнику, что было доказано в ходе серии клиническихиспытаний. АМГ обладает собственными гастропротективными свойствами,повышая концентрацию NO в слизистой оболочке ЖКТ. Имеются доказатель-ства большей безопасности АМГ для ЖКТ, в сравнении со многими н-НПВП, вчастности, диклофенаком. По данным одного РКИ, АМГ не уступает целекок-сибу по своей переносимости и низкой ульцерогенности. Правда, размерыисследований, подтверждающих преимущества АМГ, относительно невелики;не все параметры его безопасности – в частности, влияние на сердечно-сосудистую систему, изучены достаточно глубоко. Несомненно, требуютсядальнейшие исследования достоинств этого интересного препарата. Тем неменее, имеющаяся на сегодняшний день информация позволяют рекомендо-вать АМГ как удачную альтернативу традиционным НПВП для купированияострой и контроля хронической боли, связанной с заболеваниями опорно-двигательного аппарата.Резюме: НПВП – важнейший инструмент лечения острой и контроля хро-нической боли. Однако НПВП могут вызывать серьезные осложнения со сто-роны ЖКТ и сердечно-сосудистой системы. Фармакологи неоднократно пред-принимали попытки создать «улучшенные» НПВП, не оказывающие повре-ждающего действия на ЖКТ. К таким препаратам относятся «коксибы», НПВПв комбинации с гастропротекторами (мизопрастол, Н2-блокаторы, ИПП),ЦОГ-2/ЛОГ-2 ингибиторы, CINOD. Все эти препараты имеют свои недостатки,некоторые из них используются в практике, другие остались на уровненаучных разработок или уже вышли из клинической практики. Амтолметингуацил – новый «улучшенный» НПВП, созданный на основе неселективногоНПВП толметина и обладающий комплексом гастропротективных свойств.Главным из них является повышение концентрации NO в слизистой ЖКТ. Встатье рассмотрен механизм действия нового препарата, представлены дан-ные его лабораторных и клинических испытаний.
Таблица 1. «Улучшенные» НПВП: достоинства и недостатки
 Литература: Какие-либо изменения Отсутствие изменений1. Насонов Е.Л. Анальгетическая терапия в ревматологии: путешествиемежду Сциллой и Харибдой. Клин. Фармакол. Терапия 2003; 12(1): 64-69.2. Боль (практическое руководство для врачей). Под ред. Яхно Н.Н., Ку-кушкина М.Л., Москва, Издательство РАМН, 2012, 512 c.3. Lee Y. Effect and treatment of chronic pain in inflammatory arthritis. CurrRheumatol Rep. 2013; 15(1): 300.4. van de Laar M. Pergolizzi J., Mellinghoff H., et al. Pain Treatment in Arthritis-Related Pain: Beyond NSAIDs. The Open Rheumatology Journal, 2012,6, 320-3305. Fiorucci S, Distrutti E. COXIBs, CINODs and H₂S-releasing NSAIDs: currentperspectives in the development of safer non steroidal anti-inflammatorydrugs. Curr Med Chem. 2011;18(23): 3494-505.6. Hunt R., Harper S., Watson D., et al. The gastrointestinal safety of theCOX-2 selective inhibitor etoricoxib assessed by both endoscopy and analysisof upper gastrointestinal events. Am J Gastroenterol. 2003, 98(8):1725-1733.7. Laine L., Curtis S.P., Cryer B. et al. Assessment of upper gastrointestinalsafety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Longterm(MEDAL) programme: a randomised comparison. Lancet, 2007; 369:465–4738. Silverstein F. New strategies for the prevention of serious upper GIcomplication from NSAIDs: lessons from the MUCOSA trial. New stand.Arth. Care, 1996, 5, 2-6.9. Acevedo E., Castaneda O., Ugaz M. et al. Tolerability profiles of rofecoxib(Vioxx) and Arthrotec. A comparison of six weeks treatment in patients withosteoarthritis. Scand. J. Rheumatol., 2001, 30, 19-24.10. Roberts D., Miner P. Safety aspects and rational use of a naproxen +esomeprazole combination in the treatment of rheumatoid disease. DrugHealthc Patient Saf. 2011; 3: 1-8.11. Gigante A., Tagarro I. Non-steroidal anti-inflammatory drugs andgastroprotection with proton pump inhibitors: a focus onketoprofen/omeprazole. Clin Drug Investig. 2012; 32(4): 221-233.12. Bello A. DUEXIS® (ibuprofen 800 mg, famotidine 26.6 mg): a new approachto gastroprotection for patients with chronic pain and inflammationwho require treatment with a nonsteroidal anti-inflammatory drug. TherAdv Musculoskelet Dis. 2012; 4(5): 327-339.13. Kulkarni SK, Singh VP. Licofelone: the answer to unmet needs in osteoarthritistherapy? Curr Rheumatol Rep. 2008 Jan;10(1):43-8.14. Lanas A. Role of nitric oxide in the gastrointestinal tract. Arthritis Research& Therapy 2008, 10(Suppl 2):S4 doi:10.1186/ar246515. Keeble J, Moore P. Pharmacology and potential therapeutic applications ofnitric oxide-releasing non-steroidal anti-inflammatory and related nitric oxide-donating drugs. British Journal of Pharmacology, 2002, 137, 295-31016. Lanas A, García-Rodríguez LA, Arroyo MT.,et al. Effect of antisecretorydrugs and nitrates on the risk of ulcer bleeding associated with nonsteroidalanti-inflammatory drugs, antiplatelet agents, and anticoagulants. Am J Gastroenterol.2007;102(3):507-15.17. Lohmander LS, McKeith D, Svensson O, et al. A randomised, placebo controlled,comparative trial of the gastrointestinal safety and efficacy ofAZD3582 versus naproxen in osteoarthritis. Ann Rheum Dis 2005, 64:449-456.18. Cordrey L J. Tolmetin sodium, a new anti-arthritis drug: double-blind andlong-term studies. Journal of the American Geriatrics Society, 1976, 24(10): 440–44619. AHFS Drug Information 2007. McEvoy GK, ed. Tolmetin. Bethesda, MD:American Society of Health-System Pharmacists; 2007: 2118-2122.20. Coruzzi G., Coppelli G., Spaggiari S., et al. Gastroprotective effects ofamtolmetin guacyl: a new non-steroidal anti-inflammatory drug that acti-vates inducible aastric nitric oxide svnthase. Dig Liver Dis. 2002;34(6):403-10.21. Tubaro E., Belogi L., Mezzadri CM. The mechanism of action of amtolmetinguacyl, a new gastroprotective nonsteroidal anti-inflammatory drug. EuropeanJournal of Pharmacology 2000, 387, 233–24422. Morini G, Guaita E, Lazzaretti M., et al. Morphological features of rat gastricmucosa after acute and chronic treatment with amtolmetin guacyl: comparisonwith non-selective and COX-2-selective NSAIDs. Digestion. 2003;68(2-3):124-32.23. Riezzo G, Chiloiro M, Montanaro S. Protective effect of amtolmetin guacylversus placebo diclofenac and misoprostol in healthy volunteers evaluatedas gastric electrical activity in alcohol-induced stomach damage. Dig DisSci. 2001; 46(8):1797-804.24. Tavella A, Ursini G. [A clinical study on the anti-inflammatory activity andgastrointestinal tolerability of amtolmetin guacyl, a new NSAID, comparedwith diclofenac in aged patients with osteoarticular diseases].[Article in Italian]Clin Ter. 1997 Nov;148(11):543-8.25. Marcolongo R, Frediani B, Biasi G., et al. A Meta-Analysis of the Tolerabilityof Amtolmetin Guacil, a Novel, Effective Nonsteroidal Anti-InflammatoryDrug, Compared with Established Agents. Clin Drug Invest 1999; 17 (2):89-9626. Jajić Z, Malaise M, Nekam K., et al. Gastrointestinal safety of amtolmetinguacyl in comparison with celecoxib in patients with rheumatoid arthritis.Clin Exp Rheumatol. 2005, 23(6): 809-18.27. Belisari A, Mantovani L. Cost-Benefit Analysis of Amtolmetin-GuacilClinDrug Invest 2001; 21 (1): 47-58.
Александров А.В., Герусова Н.М., Зборовская И.А.
РИСК РАЗВИТИЯ И ВОЗМОЖОСТИ КЛИНИКО-ЛАБОРАТОРНОЙ ДИАГНОСТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХЮВЕНИЛЬНЫМ РЕВМАТОИДНЫМ АРТРИТОМ
ФГБУ «НИИ КиЭР» РАМН; 2 ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Цель исследования. Совершенствование иммунологических методовлабораторной диагностики поражения сердца и сосудов при ювенильномревматоидном артрите (ЮРА) с помощью иммобилизированных антигенныхнаносистем (АНС). Материалы и методы. В исследование было включено 56 пациентов (38девочек и 18 мальчиков; средний возраст 8,2±5,9 лет) с различными вари-антами ЮРА: системным – 10, полиартикулярным – 21, олигоартикулярным –25 человек. Возраст больных ЮРА составил от 1,9 года до 16,8 лет (среднийвозраст – 8,04±4,86 лет). Диагноз ЮРА предусматривал наличие артритадлительностью 3 и более месяцев. Регистрировались клинические и лабора-торные характеристики пациентов. Выраженность системных проявленийоценивали по данным физикального обследования и инструментальных ме-тодов исследования (ЭКГ, Эхо-КГ, УЗИ). Иммунологические методы включалиопределение антител к основным ферментам антиоксидантной системы(АОС) – церулоплазмину (ЦП), супероксиддисмутазе (СОД) и ксантиноксида-зе (КО), а также антител к ферментам пуринового метаболизма (ПМ) – 5′-нуклеотидазе (5′-НТ), пуриннуклеозидфосфорилазе (ПНФ) и аденозиндез-аминазе (АДА). Антитела к данным ферментам определяли в сыворотке кро-ви больных ЮРА с помощью разработанной модификации ELISA-теста с ис-пользованием АНС на основе соответствующего фермента в качестве анти-генной матрицы. Статистический анализ экспериментальных данных выпол-нялся с помощью программных пакетов «STATISTICA 6.0 FOR WINDOWS»(StatSoft Inc., USA). Результат считался достоверным при р<0,05.Результаты исследования. Семейный анамнез по кардиоваскулярнойпатологии был отягощён у 47 (84%) детей, принявших участие в исследова-нии. Аутоантитела (Ат) к церулоплазмину у больных ЮРА были выявлены в51,8% случаев (у 29 человек) и их уровень достоверно зависел от активно-сти заболевания (p=0,035) и поражения сердечно-сосудистой системы (ССС)(р=0,029). Известно, что одной из функций ЦП является ингибирование ми-елопероксидазы, принимающей участие в повреждении сосудистой стенки засчет синтеза активных форм кислорода (АФК). Ат к ЦП, по аналогии с дей-ствием анти-миелопероксидазных антител, могут препятствовать образова-нию связи миелопероксидазы с ЦП. Как следствие, активная миелоперокси-даза продолжает оказывать повреждающее действие на стенки сосудов.При ЮРА выраженность аутоантителогенеза к СОД и КО зависела от ак-тивности патологического процесса (p=0,036 и p=0,045, соответственно) ипоражения ССС (р=0,028 и p=0,031, соответственно). При системном вари-анте ЮРА по типу миоперикардита (3 случая) отмечены наиболее высокиеуровни Ат к КО (р=0,024). Роль Ат к КО у больных воспалительными РЗ мо-жет быть связана с усилением процессов трансформации D-формы ферментав О-форму, что в итоге ведет к существенному увеличению генерации супе-роксидных радикалов.Проведение дисперсионного анализа позволило выявить зависимостьуровней антител к 5′-НТ и антител к ПНФ от тяжести поражения органов ССС(р=0,042, р=0,027, соответственно). Статистически значимых результатовпри изучении зависимости антител к АДА и системных проявлений ЮРА об-наружено не было. При наличии ревматоидного воспаления Ат к ферментамАОС и ПМ могут способствовать развитию иммуннокомплексного процесса засчет снижения клиренса циркулирующих иммунных комплексов и числа ре-цепторов в результате их модификации под влиянием АФК. Заключение. Внедрение инновационных методов лабораторной диагно-стики на основе АНС может быть использовано для определения специфиче-ских маркеров поражения сосудов микроциркуляторного русла, внутреннихорганов и систем при ЮРА, что позволит проводить у детей с данной патоло-гии своевременную адекватную дифференцированную противоревматиче-скую терапию, направленную в том числе и на профилактику сердечно-сосудистых осложнений при данном заболевании.
Алехина И.Ю., Бенедицкая Е.В., Александрова Н.В., Курбанова Р.Д., Некрасова С.П., Александров А.В.
АНТИТЕЛА К ФЕРМЕНТАМ: СОВРЕМЕННЫЕБИОМЕДИЦИНСКИЕ ТЕХНОЛОГИИ В ЛАБОРАТОРНОЙДИАГНОСТИКЕ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
ФГБУ «НИИ КиЭР» РАМН, Волгоград; 2 ГБОУ ВПО ВолгГМУ Минздрава России
Прогрессирующее поражение органов и систем у больных системнойкрасной волчанкой (СКВ) в значительной степени определяет жизненный исоциальный прогноз. На этом фоне не теряет свою актуальность проблемасвоевременной диагностики начальных проявлений активации и прогресси-рования патологического процесса у больных СКВ. Расширение спектра им-мунологических методов диагностики может быть обеспечено внедрением влабораторную практику иммуноферментного метода на основе иммобилизи-рованных ферментов.Целью работы явилась разработка дополнительных критериев лабора-торной диагностики СКВ с использованием иммобилизированных антигенныхнаносистем (АНС) на основе ферментов антиоксидантной системы (АОС) ипуринового метаболизма (ПМ) – церулоплазмина (ЦП), ксантиноксидазы(КО), пуриннуклеозидфосфорилазы (ПНФ), гуаниндезаминазы (ГДА), адено-зиндезаминазы (АДА) и аденозинкиназы (АДК).Методы исследования. Исследовалась сыворотка крови 30 практическиздоровых лиц – доноров Областной станции переливания крови (контроль-ная группа; 17 женщин и 13 мужчин в возрасте от 25 до 47 лет), а также 46больных СКВ (основная группа; 43 женщины и 3 мужчин; средний возраст –36,28±15,33 лет; продолжительность заболевания – 7,85±7,04 лет) с раз-личной активностью патологического процесса (минимальная – 16 человек,умеренная – 27 человек, высокая – 3 человека). Показатели активностиSLEDAI (8,9±5,7 баллов) и ECLAM (5,3±2,7 баллов) демонстрировали не-большое число больных СКВ, имеющих неактивную фазу заболевания. Объ-ектом исследований служила сыворотка крови. Антитела к ЦП (анти-ЦП), КО(анти-КО), ПНФ (анти-ПНФ), ГДА (анти-ГДА), АДА (анти-АДА) и АДК (анти-АДК) выявляли твердофазным иммуноферментным анализом с использова-нием АНС, для получения которых применяли метод эмульсионной полиме-ризации в потоке газообразного азота с включением магнитного материала исоответствующей антигенной матрицы (Гонтарь И.П., 2005). Результаты. При исследовании сыворотки крови здоровых лиц на со-держание антител (Ат) к ферментам АОС и ПМ с помощью иммуноферментно-го метода на основе АНС были получены следующие Результаты: уровеньанти-ЦП (M±m) составил 0,022 0,014 Ед, анти-КО – 0,032 0,013 Ед, анти-ПНФ – 0,067 0,019 Ед, анти-ГДА – 0,06 0,022 Ед, анти-АДА – 0,07 0,021Ед и анти-АДК – 0,208 0,131 Ед.Динамика показателей ферментативной активности и уровней антител кизучаемым энзимам у больных СКВ в зависимости от активности патологиче-ского процесса характеризовалась снижением активности ЦП (p=0,024), ГДА(p=0,033) и сопровождалась ростом уровня антител к данным ферментам(p<0,002). Следует отметить, что в группе больных СКВ с наличием антителк ЦП активность ЦП была существенно ниже, чем у больных без данных ан-тител (p<0,001). В группе больных СКВ с наличием анти-КО отмечено увели-чение активности фермента в сыворотке крови (p=0,041). Была отмеченаположительная корреляция уровня анти-ГДА со значениями индекса SLEDAI(r=0,36) и отрицательная корреляция с биохимической активностью ГДА всыворотке крови (r= -0,34). Наиболее высокие уровни анти-ГДА отмечалисьу больных СКВ с поражением печени (р=0,024) и у больных с выраженнымцитопеническим синдромом (р=0,039).Уровень анти-ПНФ коррелировал с увеличением индекса SLEDAI(p=0,012), а также со снижением ферментативной активности сывороточнойПНФ (p=0,007). Анти-ПНФ были выявлены у 19 (41,3%) больных СКВ (в кон-трольной группе – ни у одного обследованного) и их уровень коррелировал сувеличением индекса SLEDAI (p=0,012), индекса повреждения SLICC/ACR(р=0,29) и активностью ПНФ в сыворотке крови (r= -0,72; p<0,001). В груп-пе больных СКВ, имеющих повышенные уровни анти-ПНФ, наблюдалось досто-верно более частое поражение почек (хи квадрат с поправкой Йетса = 7,34,р=0,006) и сердечно-сосудистой системы (хи квадрат с поправкой Йетса = 3,78,р=0,048). Более частое обнаружение анти-ПНФ у больных СКВ с поражениемпочек, а также положительная корреляционная связь с величиной протеинуриипри этом заболевании могут служить косвенными доказательствами важной ролиданных антител в патогенезе нефропатии при СКВ.У больных СКВ с наличием «васкулопатии» (n=16, 34,8%; были объеди-нены клинические проявления, характерные как для васкулита, так и для невоспалительного поражения сосудов – тромбозы сосудов мелкого и среднегокалибра, капилляриты ногтевого ложа, некротизирующие поражения кожныхпокровов, сетчатое ливедо) Ат к АДА были выявлены в 41,3% случаев(р=0,041), Ат к АДК – в 56,5% (р=0,023). Основным фактором, приводящимк развитию сосудистой патологии при СКВ, является накопление активныхформ кислорода, стимулирующих апоптоз клеток и оказывающих поврежда-ющее действие на компоненты сосудистой стенки, в результате чего ониприобретают свойства аутоантигенов и стимулируют выработку различныхАт, имеющих вторичное повреждающее действие. Повышение уровней анти-тел к АДК у больных СКВ с признаками поражения сосудов предполагаетвозможное участие данных Ат в изменении энзиматической активности фер-мента с последующим накоплением токсических концентраций аденозина. При проведении процедуры ингибирования (инкубирование нативногофермента с сыворотками больных с высоким уровнем соответствующих анти-тел) не удалось обнаружить значимого снижения связывающих свойств анти-тел, что позволяет сделать предположение о направленности образованияданных антиферментных антител к скрытым, недоступным в нативном состо-янии, эпитопам молекулы соответствующего фермента АОС и ПМ.Выводы. Показатели содержания антител к ферментам АОС и ПМ могутиспользоваться в диагностике клинических проявлений СКВ, в частности дляопределения степени поражения сосудов. Наличие антител к ферментам ПМв сыворотке крови больных СКВ может свидетельствовать о глубине наруше-ния анаболических и деструктивных процессов при данном заболевании.Изучение процессов образования антител к ферментам пуринового метабо-лизма (ПМ) может быть использовано для составления более полной картиныиммунологических нарушений, составляющих основу системных заболеванийсоединительной ткани.
Апаркина А.В., Акулова А.И., Ребров А.П., Гайдукова И.З.
НЕКОТОРЫЕ ОСОБЕННОСТИ АНКИЛОЗИРУЮЩЕГО СПОНДИЛИТА У ПАЦИЕНТОВ РАЗНОГО ПОЛА С НАЛИЧИЕМ УВЕИТА
ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России
Введение. Увеит – это воспаление сосудистой оболочки глаза, частовстречающееся при системных заболеваниях соединительной ткани – анки-лозирующем спондилите (АС), псориатическом артрите, воспалительных за-болеваниях кишечника (болезнь Крона, язвенный колит), болезни Бехчета,ювенильных артритах. У больных АС он является самым распространеннымиз внесуставных проявлений болезни (встречается в 20-40 % случаев).Цель настоящего исследования – изучение особенностей анкилози-рующего спондилита у женщин и мужчин с увеитом.Материалы и методы. В исследование включили 94 пациента с анкило-зирующим спондилитом, диагностированным на основании модифицирован-ных Нью-Йоркских критериев, госпитализированных в Областную клиниче-скую больницу в 2010 г. Анализировали возраст появления увеита (первыйэпизод), возраст появления клинических проявлений анкилозирующегоспондилита (воспалительная боль в спине, артрит, энтезит), возраст поста-новки диагноза. Статистический анализ выполняли с применением ПППSPSS17. Исследование одобрено этическим комитетом ГБОУ ВПО Саратов-ский ГМУ им. В.И.Разумовского Минздрава России.Результаты. Среди пациентов, включенных в исследование, было 15(15,96%) женщин и 79 (84,04%) мужчин. 18 (19%) пациентов имели в анамнезе увеит, подтвержденный офтальмологом. Увеит у мужчин встречал-ся в 15,8% (n=12) случаев, у женщин – в 40% (n=6), p<0,01.Возраст начала увеита у женщин и мужчин одинаков, составил 28±10,2лет для мужчин и 28±9,8 лет для женщин, p>0,05. У 3-х больных (у 2-хмужчин и у 1-ой женщины) явления увеита опередили развитие другихсимптомов болезни, у 5 больных (у 3 мужчин и у 2 женщин) дебют увеитасовпал по времени с появлением симптомов поражения опорно-двигательного аппарата.При отсутствии увеита длительность АС у женщин составила 8,88 [2,1;12,6] лет, у мужчин – 15,1 [2,2; 18,6] лет, при наличии увеита – у женщин18,5 [4,2; 21,1] лет, у мужчин – 16,6 [3,3; 4,6] лет (различия в продолжи-тельности болезни у лиц одного пола p<0,05). При отсутствии увеита воз-раст женщин при появлении симптомов заболевания составил 38,7 [33,3;42,4] лет, а при наличии увеита – 22 [18,2; 28,3] года, p<0,05. Возрастмужчин при дебюте заболевания без увеита и с увеитом примерно одинакови составляет соответствено 19,6 [16,4; 26,6] лет и 21,5 [17,3; 24,4] год. Приотсутствии увеита диагноз АС у мужчин и женщин устанавливался в воз-расте 37 [28; 44] и 45 [34; 48] лет, соответственно, p<0,05. При наличииувеита диагноз АС мужчинам устанавливали в возрасте 30 [24; 36] лет,женщинам – в возрасте 34 [25; 34] лет. Таким образом, разница между воз-растом пациентов при появления симптомов и возрастом пациентов приустановлении диагноза АС без увеита составляла 5 ± 4,1 лет для женщин и17 ± 8 лет для мужчин. У пациентов с увеитом диагноз АС устанавливалсячерез 12 ± 7 лет у женщин и через 8,5 ± 5 лет у мужчин после появленияпервых проявлений заболевания. До установления диагноза АС клиникаувеита имелась у 11 (11,7%) пациентов: у 8 (11,5%) мужчин и у 3 (20%)женщин.Выводы:Увеит как внепозвоночное проявление анкилозирующего спондилита уженщин встречается чаще (40%), чем у мужчин (15,8%). Возраст женщин имужчин в момент дебюта увеита сопоставим.Наличие увеита у женщин ассоциируется с ранним дебютом анкилозиру-ющего спондилита по сравнению с пациентками без увеита. При этом уста-новление диагноза АС у женщин с увеитом происходило на 7 лет позже, чемустановление диагноза АС у женщин без увеита.У пятой части больных женщин увеит дебютирует до появления симпто-мов поражения опорно-двигательного аппарата или одновременно с ними.
Ахвердян Ю. Р., Сивордова Л. Е., Полякова Ю. В.,Заводовский Б.В., Чернов А.С.
УРОВЕНЬ АДИПОНЕКТИНА В СЫВОРОТКЕ КРОВИ УБОЛЬНЫХ ОСТЕОАРТРОЗОМ В ЗАВИСИМОСТИ ОТ КЛИНИЧЕСКОЙ КАРТИНЫ ЗАБОЛЕВАНИЯ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград
Цель работы: Изучить уровень адипонектина в сыворотке крови боль-ных остеоартрозом (ОА) в зависимости от клинической картины заболева-ния.Материалы и методы Под нашим наблюдением находилось 130 больныхОА в возрасте от 34 до 77 лет, из которых 78 женщин (60%) и 52 мужчин(40%). Средний возраст женщин с ОА составил 49,263,89 лет, мужчин -51,314,03 лет. При рентгенологическом исследовании суставов по критери-ям Kellgren J.H. и Lawrence J.S. у больных ОА установлены следующие ста-дии поражения суставов: I стадия – у 14 (10,8%), II стадия – у 76 (58,5%),III стадия – у 30 (23%), IV стадия – у 10 (7,7%) пациентов. Контрольнуюгруппу составили 45 практически здоровых лиц, в которую вошли 25(55,6%) женщин и 20 (44,4%) мужчин в возрасте от 36 до 67 лет.Определение адипонектина проводилось с помощью набора BioVendor(cat № RD195023100). Для оценки тазобедренных и коленных суставов приОА использовались функциональные индексы WOMAC, Lequesne. Всем паци-ентах проводилось ультразвуковое исследование пораженных суставов нааппарате Medison Co., Ltd, республики Корея, модель Sonoace PICO, с ис-пользованием линейного датчика в диапазоне частот 5-12 МГц с применени-ем В-режима и энергетического допплерографического режима.Полученные Результаты/Обсуждение Средний уровень адипонектинау больных с ОА составил 3,3±1,4 мкг/мл, что достоверно ниже показателейздоровых лиц. Пониженный уровень адипонектина в сыворотке крови боль-ных остеоартрозом был обнаружен у 46 пациентов из 130 (35,4% случаев,что было достоверно чаще, чем у здоровых лиц). Средний уровеньадипонектина у женщин с ОА составил 3,1±1,4 мкг/мл, что достоверно нижепоказателей здоровых лиц женского пола. Пониженный уровень адипонек-тина в сыворотке крови был обнаружен у 31 женщины с ОА из 78 (39,7%случаев), что было достоверно чаще, чем у здоровых женщин.Средний уровень адипонектина у мужчин с ОА составил 3,4±1,5 мкг/мл.Пониженный уровень адипонектина в сыворотке крови был обнаружен у 15мужчин с ОА из 52, что составило 28,8% случаев, и было достоверно чаще,чем у здоровых мужчин. Достоверной разницы уровня адипонектина с поломпациентов не было (t=1,42, p>0,05). Таким образом, для больных остеоарт-розом в целом были характерны более низкие уровни адипонектина в сыво-ротке крови, чем в группе здоровых лиц. Пациенты с низким уровнем адипонектина в сыворотке крови, достоверночаще имели следующий симптомокомплекс: полиостеоартроз, с наличиемвторичного синовита, с продолжительностью заболевания более 10 лет,рентгенологической стадией III и IV, функциональной недостаточностьюсуставов III. Вероятнее всего, снижение уровня адипонектина у больных состеоартрозом связано с прогрессированием заболевания.Также были выявлены корреляционные связи между уровнем адипонек-тина в сыворотке крови больных ОА и индексом WOMAC, альгофункциональ-ным индексом Лекена для гонартроза, альгофункциональным индексом Ле-кена для коксартроза (р<0,05).Выводы/заключение Таким образом, пониженный уровень адипонек-тина в сыворотке крови был обнаружен у 35,4% пациентов с ОА. Для боль-ных, имеющих низкий уровень адипонектина, был характерен следующийсимптомокомплекс: полиостеоартроз, наличие вторичного синовита, с про-должительностью заболевания более 10 лет, рентгенологической стадией IIIи IV, функциональной недостаточностью суставов.
Ахунова Р.Р., Ахунова Г.Р.
ЛИЧНОСТНЫЕ ОСОБЕННОСТИ ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ ВО ВЗАИМОСВЯЗИ С ПОГРАНИЧНЫМИ ПСИХИЧЕСКИМИ РАССТРОЙСТВАМИ
ГБОУ ДПО КГМА Минздрава России, г. Казань, Россия
Цель. Изучить индивидуально-типологические особенности личностибольных ревматоидным артритом (РА) во взаимосвязи с пограничными пси-хическими расстройствами (ППР).Материалы и методы. В исследование было включено 176 больных сдостоверным диагнозом РА. Всем пациентам проведены клиническое, лабо-раторное и рентгенологическое обследования. Пациенты обследовалиськлиническим опросником для оценки и выявления невротических состояний(Яхин К.К., Менделевич Д.М., 1978). В качестве метода исследования инди-видуально – типологических свойств личности использовался Индивидуально- типологический опросник (ИТО) (Собчик Л.Н., 2002).Среди обследованных больных было 151 (85,8%) женщина и 25 (14,2%)мужчин в возрасте 50[43;58] лет. Минимальная степень активности РА быладиагностирована у 3 (1,7%) больных, средняя – у 34 (19,3%) и высокая – у139 (79,0%) больных. I –II рентгенологическая стадия РА установлена у 61(34,7%) пациентов, III-IV – у 115 (65,3%) пациентов. Серопозитивный РАбыл диагностирован у 115 (65,3%) пациентов с РА.Результаты и Обсуждение. У 64,2% (113) пациентов с РА были ППР. На рисунке 1 представлен усредненный профиль личности больных РА сППР (n=124) и пациентов без ППР (n=64). И у пациентов с ППР, и у пациен-тов без ППР показатели по всем шкалам основных личностных свойств, кро-ме стеничности превышали норму. Наиболее высокие показатели полученыпо шкалам интроверсии, сензитивности и тревожности.Интроверсия проявляется в крайнем субъективизме, склонностью к ухо-ду во внутренний идеализированный мир, замкнутости. Другая характероло-гическая особенность, как сензитивность, проявляется в ранимости, неуве-ренности в себе, в снижении уровня притязаний, повышенной чувствитель-ности к происходящим событиям, с боязнью новых ситуаций, людей, всякогорода испытаний.Для больных РА с ППР и без ППР характерно выраженное (>5 баллов) со-четание таких противоположных качеств личности, как ригидность и сензи-тивность, ригидность и лабильность. Ригидность проявляется в тугоподвиж-ной перестройке системы мотивов, требующих от субъекта гибкости и быст-рого изменения характера поведения. Она обусловливается уровнем взаимо-действия личностных особенностей с характером экстремальной среды ипроявляется в тугоподвижной перестройке системы мотивов, требующих отсубъекта гибкости и быстрого изменения характера поведения. Такое соче-тание разнонаправленных свойств личности свидетельствует об изначальнойпсихосоматической предиспозиции у больных РА.
Рисунок 1. Усредненный профиль личности пациентов с ППР и пациентовбез ППР (в баллах).
Литература: Какие-либо изменения Отсутствие изменений1. Насонов Е.Л. Анальгетическая терапия в ревматологии: путешествиемежду Сциллой и Харибдой. Клин. Фармакол. Терапия 2003; 12(1): 64-69.2. Боль (практическое руководство для врачей). Под ред. Яхно Н.Н., Ку-кушкина М.Л., Москва, Издательство РАМН, 2012, 512 c.3. Lee Y. Effect and treatment of chronic pain in inflammatory arthritis. CurrRheumatol Rep. 2013; 15(1): 300.4. van de Laar M. Pergolizzi J., Mellinghoff H., et al. Pain Treatment in Arthritis-Related Pain: Beyond NSAIDs. The Open Rheumatology Journal, 2012,6, 320-3305. Fiorucci S, Distrutti E. COXIBs, CINODs and H₂S-releasing NSAIDs: currentperspectives in the development of safer non steroidal anti-inflammatorydrugs. Curr Med Chem. 2011;18(23): 3494-505.6. Hunt R., Harper S., Watson D., et al. The gastrointestinal safety of theCOX-2 selective inhibitor etoricoxib assessed by both endoscopy and analysisof upper gastrointestinal events. Am J Gastroenterol. 2003, 98(8):1725-1733.7. Laine L., Curtis S.P., Cryer B. et al. Assessment of upper gastrointestinalsafety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Longterm(MEDAL) programme: a randomised comparison. Lancet, 2007; 369:465–4738. Silverstein F. New strategies for the prevention of serious upper GIcomplication from NSAIDs: lessons from the MUCOSA trial. New stand.Arth. Care, 1996, 5, 2-6.9. Acevedo E., Castaneda O., Ugaz M. et al. Tolerability profiles of rofecoxib(Vioxx) and Arthrotec. A comparison of six weeks treatment in patients withosteoarthritis. Scand. J. Rheumatol., 2001, 30, 19-24.10. Roberts D., Miner P. Safety aspects and rational use of a naproxen +esomeprazole combination in the treatment of rheumatoid disease. DrugHealthc Patient Saf. 2011; 3: 1-8.11. Gigante A., Tagarro I. Non-steroidal anti-inflammatory drugs andgastroprotection with proton pump inhibitors: a focus onketoprofen/omeprazole. Clin Drug Investig. 2012; 32(4): 221-233.12. Bello A. DUEXIS® (ibuprofen 800 mg, famotidine 26.6 mg): a new approachto gastroprotection for patients with chronic pain and inflammationwho require treatment with a nonsteroidal anti-inflammatory drug. TherAdv Musculoskelet Dis. 2012; 4(5): 327-339.13. Kulkarni SK, Singh VP. Licofelone: the answer to unmet needs in osteoarthritistherapy? Curr Rheumatol Rep. 2008 Jan;10(1):43-8.14. Lanas A. Role of nitric oxide in the gastrointestinal tract. Arthritis Research& Therapy 2008, 10(Suppl 2):S4 doi:10.1186/ar246515. Keeble J, Moore P. Pharmacology and potential therapeutic applications ofnitric oxide-releasing non-steroidal anti-inflammatory and related nitric oxide-donating drugs. British Journal of Pharmacology, 2002, 137, 295-31016. Lanas A, García-Rodríguez LA, Arroyo MT.,et al. Effect of antisecretorydrugs and nitrates on the risk of ulcer bleeding associated with nonsteroidalanti-inflammatory drugs, antiplatelet agents, and anticoagulants. Am J Gastroenterol.2007;102(3):507-15.17. Lohmander LS, McKeith D, Svensson O, et al. A randomised, placebo controlled,comparative trial of the gastrointestinal safety and efficacy ofAZD3582 versus naproxen in osteoarthritis. Ann Rheum Dis 2005, 64:449-456.18. Cordrey L J. Tolmetin sodium, a new anti-arthritis drug: double-blind andlong-term studies. Journal of the American Geriatrics Society, 1976, 24(10): 440–44619. AHFS Drug Information 2007. McEvoy GK, ed. Tolmetin. Bethesda, MD:American Society of Health-System Pharmacists; 2007: 2118-2122.20. Coruzzi G., Coppelli G., Spaggiari S., et al. Gastroprotective effects ofamtolmetin guacyl: a new non-steroidal anti-inflammatory drug that acti-vates inducible aastric nitric oxide svnthase. Dig Liver Dis. 2002;34(6):403-10.21. Tubaro E., Belogi L., Mezzadri CM. The mechanism of action of amtolmetinguacyl, a new gastroprotective nonsteroidal anti-inflammatory drug. EuropeanJournal of Pharmacology 2000, 387, 233–24422. Morini G, Guaita E, Lazzaretti M., et al. Morphological features of rat gastricmucosa after acute and chronic treatment with amtolmetin guacyl: comparisonwith non-selective and COX-2-selective NSAIDs. Digestion. 2003;68(2-3):124-32.23. Riezzo G, Chiloiro M, Montanaro S. Protective effect of amtolmetin guacylversus placebo diclofenac and misoprostol in healthy volunteers evaluatedas gastric electrical activity in alcohol-induced stomach damage. Dig DisSci. 2001; 46(8):1797-804.24. Tavella A, Ursini G. [A clinical study on the anti-inflammatory activity andgastrointestinal tolerability of amtolmetin guacyl, a new NSAID, comparedwith diclofenac in aged patients with osteoarticular diseases].[Article in Italian]Clin Ter. 1997 Nov;148(11):543-8.25. Marcolongo R, Frediani B, Biasi G., et al. A Meta-Analysis of the Tolerabilityof Amtolmetin Guacil, a Novel, Effective Nonsteroidal Anti-InflammatoryDrug, Compared with Established Agents. Clin Drug Invest 1999; 17 (2):89-9626. Jajić Z, Malaise M, Nekam K., et al. Gastrointestinal safety of amtolmetinguacyl in comparison with celecoxib in patients with rheumatoid arthritis.Clin Exp Rheumatol. 2005, 23(6): 809-18.27. Belisari A, Mantovani L. Cost-Benefit Analysis of Amtolmetin-GuacilClinDrug Invest 2001; 21 (1): 47-58.
Александров А.В., Герусова Н.М., Зборовская И.А.
РИСК РАЗВИТИЯ И ВОЗМОЖОСТИ КЛИНИКО-ЛАБОРАТОРНОЙ ДИАГНОСТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХЮВЕНИЛЬНЫМ РЕВМАТОИДНЫМ АРТРИТОМ
ФГБУ «НИИ КиЭР» РАМН; 2 ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Цель исследования. Совершенствование иммунологических методовлабораторной диагностики поражения сердца и сосудов при ювенильномревматоидном артрите (ЮРА) с помощью иммобилизированных антигенныхнаносистем (АНС). Материалы и методы. В исследование было включено 56 пациентов (38девочек и 18 мальчиков; средний возраст 8,2±5,9 лет) с различными вари-антами ЮРА: системным – 10, полиартикулярным – 21, олигоартикулярным –25 человек. Возраст больных ЮРА составил от 1,9 года до 16,8 лет (среднийвозраст – 8,04±4,86 лет). Диагноз ЮРА предусматривал наличие артритадлительностью 3 и более месяцев. Регистрировались клинические и лабора-торные характеристики пациентов. Выраженность системных проявленийоценивали по данным физикального обследования и инструментальных ме-тодов исследования (ЭКГ, Эхо-КГ, УЗИ). Иммунологические методы включалиопределение антител к основным ферментам антиоксидантной системы(АОС) – церулоплазмину (ЦП), супероксиддисмутазе (СОД) и ксантиноксида-зе (КО), а также антител к ферментам пуринового метаболизма (ПМ) – 5′-нуклеотидазе (5′-НТ), пуриннуклеозидфосфорилазе (ПНФ) и аденозиндез-аминазе (АДА). Антитела к данным ферментам определяли в сыворотке кро-ви больных ЮРА с помощью разработанной модификации ELISA-теста с ис-пользованием АНС на основе соответствующего фермента в качестве анти-генной матрицы. Статистический анализ экспериментальных данных выпол-нялся с помощью программных пакетов «STATISTICA 6.0 FOR WINDOWS»(StatSoft Inc., USA). Результат считался достоверным при р<0,05.Результаты исследования. Семейный анамнез по кардиоваскулярнойпатологии был отягощён у 47 (84%) детей, принявших участие в исследова-нии. Аутоантитела (Ат) к церулоплазмину у больных ЮРА были выявлены в51,8% случаев (у 29 человек) и их уровень достоверно зависел от активно-сти заболевания (p=0,035) и поражения сердечно-сосудистой системы (ССС)(р=0,029). Известно, что одной из функций ЦП является ингибирование ми-елопероксидазы, принимающей участие в повреждении сосудистой стенки засчет синтеза активных форм кислорода (АФК). Ат к ЦП, по аналогии с дей-ствием анти-миелопероксидазных антител, могут препятствовать образова-нию связи миелопероксидазы с ЦП. Как следствие, активная миелоперокси-даза продолжает оказывать повреждающее действие на стенки сосудов.При ЮРА выраженность аутоантителогенеза к СОД и КО зависела от ак-тивности патологического процесса (p=0,036 и p=0,045, соответственно) ипоражения ССС (р=0,028 и p=0,031, соответственно). При системном вари-анте ЮРА по типу миоперикардита (3 случая) отмечены наиболее высокиеуровни Ат к КО (р=0,024). Роль Ат к КО у больных воспалительными РЗ мо-жет быть связана с усилением процессов трансформации D-формы ферментав О-форму, что в итоге ведет к существенному увеличению генерации супе-роксидных радикалов.Проведение дисперсионного анализа позволило выявить зависимостьуровней антител к 5′-НТ и антител к ПНФ от тяжести поражения органов ССС(р=0,042, р=0,027, соответственно). Статистически значимых результатовпри изучении зависимости антител к АДА и системных проявлений ЮРА об-наружено не было. При наличии ревматоидного воспаления Ат к ферментамАОС и ПМ могут способствовать развитию иммуннокомплексного процесса засчет снижения клиренса циркулирующих иммунных комплексов и числа ре-цепторов в результате их модификации под влиянием АФК. Заключение. Внедрение инновационных методов лабораторной диагно-стики на основе АНС может быть использовано для определения специфиче-ских маркеров поражения сосудов микроциркуляторного русла, внутреннихорганов и систем при ЮРА, что позволит проводить у детей с данной патоло-гии своевременную адекватную дифференцированную противоревматиче-скую терапию, направленную в том числе и на профилактику сердечно-сосудистых осложнений при данном заболевании.
Алехина И.Ю., Бенедицкая Е.В., Александрова Н.В., Курбанова Р.Д., Некрасова С.П., Александров А.В.
АНТИТЕЛА К ФЕРМЕНТАМ: СОВРЕМЕННЫЕБИОМЕДИЦИНСКИЕ ТЕХНОЛОГИИ В ЛАБОРАТОРНОЙДИАГНОСТИКЕ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
ФГБУ «НИИ КиЭР» РАМН, Волгоград; 2 ГБОУ ВПО ВолгГМУ Минздрава России
Прогрессирующее поражение органов и систем у больных системнойкрасной волчанкой (СКВ) в значительной степени определяет жизненный исоциальный прогноз. На этом фоне не теряет свою актуальность проблемасвоевременной диагностики начальных проявлений активации и прогресси-рования патологического процесса у больных СКВ. Расширение спектра им-мунологических методов диагностики может быть обеспечено внедрением влабораторную практику иммуноферментного метода на основе иммобилизи-рованных ферментов.Целью работы явилась разработка дополнительных критериев лабора-торной диагностики СКВ с использованием иммобилизированных антигенныхнаносистем (АНС) на основе ферментов антиоксидантной системы (АОС) ипуринового метаболизма (ПМ) – церулоплазмина (ЦП), ксантиноксидазы(КО), пуриннуклеозидфосфорилазы (ПНФ), гуаниндезаминазы (ГДА), адено-зиндезаминазы (АДА) и аденозинкиназы (АДК).Методы исследования. Исследовалась сыворотка крови 30 практическиздоровых лиц – доноров Областной станции переливания крови (контроль-ная группа; 17 женщин и 13 мужчин в возрасте от 25 до 47 лет), а также 46больных СКВ (основная группа; 43 женщины и 3 мужчин; средний возраст –36,28±15,33 лет; продолжительность заболевания – 7,85±7,04 лет) с раз-личной активностью патологического процесса (минимальная – 16 человек,умеренная – 27 человек, высокая – 3 человека). Показатели активностиSLEDAI (8,9±5,7 баллов) и ECLAM (5,3±2,7 баллов) демонстрировали не-большое число больных СКВ, имеющих неактивную фазу заболевания. Объ-ектом исследований служила сыворотка крови. Антитела к ЦП (анти-ЦП), КО(анти-КО), ПНФ (анти-ПНФ), ГДА (анти-ГДА), АДА (анти-АДА) и АДК (анти-АДК) выявляли твердофазным иммуноферментным анализом с использова-нием АНС, для получения которых применяли метод эмульсионной полиме-ризации в потоке газообразного азота с включением магнитного материала исоответствующей антигенной матрицы (Гонтарь И.П., 2005). Результаты. При исследовании сыворотки крови здоровых лиц на со-держание антител (Ат) к ферментам АОС и ПМ с помощью иммуноферментно-го метода на основе АНС были получены следующие Результаты: уровеньанти-ЦП (M±m) составил 0,022 0,014 Ед, анти-КО – 0,032 0,013 Ед, анти-ПНФ – 0,067 0,019 Ед, анти-ГДА – 0,06 0,022 Ед, анти-АДА – 0,07 0,021Ед и анти-АДК – 0,208 0,131 Ед.Динамика показателей ферментативной активности и уровней антител кизучаемым энзимам у больных СКВ в зависимости от активности патологиче-ского процесса характеризовалась снижением активности ЦП (p=0,024), ГДА(p=0,033) и сопровождалась ростом уровня антител к данным ферментам(p<0,002). Следует отметить, что в группе больных СКВ с наличием антителк ЦП активность ЦП была существенно ниже, чем у больных без данных ан-тител (p<0,001). В группе больных СКВ с наличием анти-КО отмечено увели-чение активности фермента в сыворотке крови (p=0,041). Была отмеченаположительная корреляция уровня анти-ГДА со значениями индекса SLEDAI(r=0,36) и отрицательная корреляция с биохимической активностью ГДА всыворотке крови (r= -0,34). Наиболее высокие уровни анти-ГДА отмечалисьу больных СКВ с поражением печени (р=0,024) и у больных с выраженнымцитопеническим синдромом (р=0,039).Уровень анти-ПНФ коррелировал с увеличением индекса SLEDAI(p=0,012), а также со снижением ферментативной активности сывороточнойПНФ (p=0,007). Анти-ПНФ были выявлены у 19 (41,3%) больных СКВ (в кон-трольной группе – ни у одного обследованного) и их уровень коррелировал сувеличением индекса SLEDAI (p=0,012), индекса повреждения SLICC/ACR(р=0,29) и активностью ПНФ в сыворотке крови (r= -0,72; p<0,001). В груп-пе больных СКВ, имеющих повышенные уровни анти-ПНФ, наблюдалось досто-верно более частое поражение почек (хи квадрат с поправкой Йетса = 7,34,р=0,006) и сердечно-сосудистой системы (хи квадрат с поправкой Йетса = 3,78,р=0,048). Более частое обнаружение анти-ПНФ у больных СКВ с поражениемпочек, а также положительная корреляционная связь с величиной протеинуриипри этом заболевании могут служить косвенными доказательствами важной ролиданных антител в патогенезе нефропатии при СКВ.У больных СКВ с наличием «васкулопатии» (n=16, 34,8%; были объеди-нены клинические проявления, характерные как для васкулита, так и для невоспалительного поражения сосудов – тромбозы сосудов мелкого и среднегокалибра, капилляриты ногтевого ложа, некротизирующие поражения кожныхпокровов, сетчатое ливедо) Ат к АДА были выявлены в 41,3% случаев(р=0,041), Ат к АДК – в 56,5% (р=0,023). Основным фактором, приводящимк развитию сосудистой патологии при СКВ, является накопление активныхформ кислорода, стимулирующих апоптоз клеток и оказывающих поврежда-ющее действие на компоненты сосудистой стенки, в результате чего ониприобретают свойства аутоантигенов и стимулируют выработку различныхАт, имеющих вторичное повреждающее действие. Повышение уровней анти-тел к АДК у больных СКВ с признаками поражения сосудов предполагаетвозможное участие данных Ат в изменении энзиматической активности фер-мента с последующим накоплением токсических концентраций аденозина. При проведении процедуры ингибирования (инкубирование нативногофермента с сыворотками больных с высоким уровнем соответствующих анти-тел) не удалось обнаружить значимого снижения связывающих свойств анти-тел, что позволяет сделать предположение о направленности образованияданных антиферментных антител к скрытым, недоступным в нативном состо-янии, эпитопам молекулы соответствующего фермента АОС и ПМ.Выводы. Показатели содержания антител к ферментам АОС и ПМ могутиспользоваться в диагностике клинических проявлений СКВ, в частности дляопределения степени поражения сосудов. Наличие антител к ферментам ПМв сыворотке крови больных СКВ может свидетельствовать о глубине наруше-ния анаболических и деструктивных процессов при данном заболевании.Изучение процессов образования антител к ферментам пуринового метабо-лизма (ПМ) может быть использовано для составления более полной картиныиммунологических нарушений, составляющих основу системных заболеванийсоединительной ткани.
Апаркина А.В., Акулова А.И., Ребров А.П., Гайдукова И.З.
НЕКОТОРЫЕ ОСОБЕННОСТИ АНКИЛОЗИРУЮЩЕГО СПОНДИЛИТА У ПАЦИЕНТОВ РАЗНОГО ПОЛА С НАЛИЧИЕМ УВЕИТА
ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России
Введение. Увеит – это воспаление сосудистой оболочки глаза, частовстречающееся при системных заболеваниях соединительной ткани – анки-лозирующем спондилите (АС), псориатическом артрите, воспалительных за-болеваниях кишечника (болезнь Крона, язвенный колит), болезни Бехчета,ювенильных артритах. У больных АС он является самым распространеннымиз внесуставных проявлений болезни (встречается в 20-40 % случаев).Цель настоящего исследования – изучение особенностей анкилози-рующего спондилита у женщин и мужчин с увеитом.Материалы и методы. В исследование включили 94 пациента с анкило-зирующим спондилитом, диагностированным на основании модифицирован-ных Нью-Йоркских критериев, госпитализированных в Областную клиниче-скую больницу в 2010 г. Анализировали возраст появления увеита (первыйэпизод), возраст появления клинических проявлений анкилозирующегоспондилита (воспалительная боль в спине, артрит, энтезит), возраст поста-новки диагноза. Статистический анализ выполняли с применением ПППSPSS17. Исследование одобрено этическим комитетом ГБОУ ВПО Саратов-ский ГМУ им. В.И.Разумовского Минздрава России.Результаты. Среди пациентов, включенных в исследование, было 15(15,96%) женщин и 79 (84,04%) мужчин. 18 (19%) пациентов имели в анамнезе увеит, подтвержденный офтальмологом. Увеит у мужчин встречал-ся в 15,8% (n=12) случаев, у женщин – в 40% (n=6), p<0,01.Возраст начала увеита у женщин и мужчин одинаков, составил 28±10,2лет для мужчин и 28±9,8 лет для женщин, p>0,05. У 3-х больных (у 2-хмужчин и у 1-ой женщины) явления увеита опередили развитие другихсимптомов болезни, у 5 больных (у 3 мужчин и у 2 женщин) дебют увеитасовпал по времени с появлением симптомов поражения опорно-двигательного аппарата.При отсутствии увеита длительность АС у женщин составила 8,88 [2,1;12,6] лет, у мужчин – 15,1 [2,2; 18,6] лет, при наличии увеита – у женщин18,5 [4,2; 21,1] лет, у мужчин – 16,6 [3,3; 4,6] лет (различия в продолжи-тельности болезни у лиц одного пола p<0,05). При отсутствии увеита воз-раст женщин при появлении симптомов заболевания составил 38,7 [33,3;42,4] лет, а при наличии увеита – 22 [18,2; 28,3] года, p<0,05. Возрастмужчин при дебюте заболевания без увеита и с увеитом примерно одинакови составляет соответствено 19,6 [16,4; 26,6] лет и 21,5 [17,3; 24,4] год. Приотсутствии увеита диагноз АС у мужчин и женщин устанавливался в воз-расте 37 [28; 44] и 45 [34; 48] лет, соответственно, p<0,05. При наличииувеита диагноз АС мужчинам устанавливали в возрасте 30 [24; 36] лет,женщинам – в возрасте 34 [25; 34] лет. Таким образом, разница между воз-растом пациентов при появления симптомов и возрастом пациентов приустановлении диагноза АС без увеита составляла 5 ± 4,1 лет для женщин и17 ± 8 лет для мужчин. У пациентов с увеитом диагноз АС устанавливалсячерез 12 ± 7 лет у женщин и через 8,5 ± 5 лет у мужчин после появленияпервых проявлений заболевания. До установления диагноза АС клиникаувеита имелась у 11 (11,7%) пациентов: у 8 (11,5%) мужчин и у 3 (20%)женщин.Выводы:Увеит как внепозвоночное проявление анкилозирующего спондилита уженщин встречается чаще (40%), чем у мужчин (15,8%). Возраст женщин имужчин в момент дебюта увеита сопоставим.Наличие увеита у женщин ассоциируется с ранним дебютом анкилозиру-ющего спондилита по сравнению с пациентками без увеита. При этом уста-новление диагноза АС у женщин с увеитом происходило на 7 лет позже, чемустановление диагноза АС у женщин без увеита.У пятой части больных женщин увеит дебютирует до появления симпто-мов поражения опорно-двигательного аппарата или одновременно с ними.
Ахвердян Ю. Р., Сивордова Л. Е., Полякова Ю. В.,Заводовский Б.В., Чернов А.С.
УРОВЕНЬ АДИПОНЕКТИНА В СЫВОРОТКЕ КРОВИ УБОЛЬНЫХ ОСТЕОАРТРОЗОМ В ЗАВИСИМОСТИ ОТ КЛИНИЧЕСКОЙ КАРТИНЫ ЗАБОЛЕВАНИЯ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград
Цель работы: Изучить уровень адипонектина в сыворотке крови боль-ных остеоартрозом (ОА) в зависимости от клинической картины заболева-ния.Материалы и методы Под нашим наблюдением находилось 130 больныхОА в возрасте от 34 до 77 лет, из которых 78 женщин (60%) и 52 мужчин(40%). Средний возраст женщин с ОА составил 49,263,89 лет, мужчин -51,314,03 лет. При рентгенологическом исследовании суставов по критери-ям Kellgren J.H. и Lawrence J.S. у больных ОА установлены следующие ста-дии поражения суставов: I стадия – у 14 (10,8%), II стадия – у 76 (58,5%),III стадия – у 30 (23%), IV стадия – у 10 (7,7%) пациентов. Контрольнуюгруппу составили 45 практически здоровых лиц, в которую вошли 25(55,6%) женщин и 20 (44,4%) мужчин в возрасте от 36 до 67 лет.Определение адипонектина проводилось с помощью набора BioVendor(cat № RD195023100). Для оценки тазобедренных и коленных суставов приОА использовались функциональные индексы WOMAC, Lequesne. Всем паци-ентах проводилось ультразвуковое исследование пораженных суставов нааппарате Medison Co., Ltd, республики Корея, модель Sonoace PICO, с ис-пользованием линейного датчика в диапазоне частот 5-12 МГц с применени-ем В-режима и энергетического допплерографического режима.Полученные Результаты/Обсуждение Средний уровень адипонектинау больных с ОА составил 3,3±1,4 мкг/мл, что достоверно ниже показателейздоровых лиц. Пониженный уровень адипонектина в сыворотке крови боль-ных остеоартрозом был обнаружен у 46 пациентов из 130 (35,4% случаев,что было достоверно чаще, чем у здоровых лиц). Средний уровеньадипонектина у женщин с ОА составил 3,1±1,4 мкг/мл, что достоверно нижепоказателей здоровых лиц женского пола. Пониженный уровень адипонек-тина в сыворотке крови был обнаружен у 31 женщины с ОА из 78 (39,7%случаев), что было достоверно чаще, чем у здоровых женщин.Средний уровень адипонектина у мужчин с ОА составил 3,4±1,5 мкг/мл.Пониженный уровень адипонектина в сыворотке крови был обнаружен у 15мужчин с ОА из 52, что составило 28,8% случаев, и было достоверно чаще,чем у здоровых мужчин. Достоверной разницы уровня адипонектина с поломпациентов не было (t=1,42, p>0,05). Таким образом, для больных остеоарт-розом в целом были характерны более низкие уровни адипонектина в сыво-ротке крови, чем в группе здоровых лиц. Пациенты с низким уровнем адипонектина в сыворотке крови, достоверночаще имели следующий симптомокомплекс: полиостеоартроз, с наличиемвторичного синовита, с продолжительностью заболевания более 10 лет,рентгенологической стадией III и IV, функциональной недостаточностьюсуставов III. Вероятнее всего, снижение уровня адипонектина у больных состеоартрозом связано с прогрессированием заболевания.Также были выявлены корреляционные связи между уровнем адипонек-тина в сыворотке крови больных ОА и индексом WOMAC, альгофункциональ-ным индексом Лекена для гонартроза, альгофункциональным индексом Ле-кена для коксартроза (р<0,05).Выводы/заключение Таким образом, пониженный уровень адипонек-тина в сыворотке крови был обнаружен у 35,4% пациентов с ОА. Для боль-ных, имеющих низкий уровень адипонектина, был характерен следующийсимптомокомплекс: полиостеоартроз, наличие вторичного синовита, с про-должительностью заболевания более 10 лет, рентгенологической стадией IIIи IV, функциональной недостаточностью суставов.
Ахунова Р.Р., Ахунова Г.Р.
ЛИЧНОСТНЫЕ ОСОБЕННОСТИ ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ ВО ВЗАИМОСВЯЗИ С ПОГРАНИЧНЫМИ ПСИХИЧЕСКИМИ РАССТРОЙСТВАМИ
ГБОУ ДПО КГМА Минздрава России, г. Казань, Россия
Цель. Изучить индивидуально-типологические особенности личностибольных ревматоидным артритом (РА) во взаимосвязи с пограничными пси-хическими расстройствами (ППР).Материалы и методы. В исследование было включено 176 больных сдостоверным диагнозом РА. Всем пациентам проведены клиническое, лабо-раторное и рентгенологическое обследования. Пациенты обследовалиськлиническим опросником для оценки и выявления невротических состояний(Яхин К.К., Менделевич Д.М., 1978). В качестве метода исследования инди-видуально – типологических свойств личности использовался Индивидуально- типологический опросник (ИТО) (Собчик Л.Н., 2002).Среди обследованных больных было 151 (85,8%) женщина и 25 (14,2%)мужчин в возрасте 50[43;58] лет. Минимальная степень активности РА быладиагностирована у 3 (1,7%) больных, средняя – у 34 (19,3%) и высокая – у139 (79,0%) больных. I –II рентгенологическая стадия РА установлена у 61(34,7%) пациентов, III-IV – у 115 (65,3%) пациентов. Серопозитивный РАбыл диагностирован у 115 (65,3%) пациентов с РА.Результаты и Обсуждение. У 64,2% (113) пациентов с РА были ППР. На рисунке 1 представлен усредненный профиль личности больных РА сППР (n=124) и пациентов без ППР (n=64). И у пациентов с ППР, и у пациен-тов без ППР показатели по всем шкалам основных личностных свойств, кро-ме стеничности превышали норму. Наиболее высокие показатели полученыпо шкалам интроверсии, сензитивности и тревожности.Интроверсия проявляется в крайнем субъективизме, склонностью к ухо-ду во внутренний идеализированный мир, замкнутости. Другая характероло-гическая особенность, как сензитивность, проявляется в ранимости, неуве-ренности в себе, в снижении уровня притязаний, повышенной чувствитель-ности к происходящим событиям, с боязнью новых ситуаций, людей, всякогорода испытаний.Для больных РА с ППР и без ППР характерно выраженное (>5 баллов) со-четание таких противоположных качеств личности, как ригидность и сензи-тивность, ригидность и лабильность. Ригидность проявляется в тугоподвиж-ной перестройке системы мотивов, требующих от субъекта гибкости и быст-рого изменения характера поведения. Она обусловливается уровнем взаимо-действия личностных особенностей с характером экстремальной среды ипроявляется в тугоподвижной перестройке системы мотивов, требующих отсубъекта гибкости и быстрого изменения характера поведения. Такое соче-тание разнонаправленных свойств личности свидетельствует об изначальнойпсихосоматической предиспозиции у больных РА.
Рисунок 1. Усредненный профиль личности пациентов с ППР и пациентовбез ППР (в баллах).
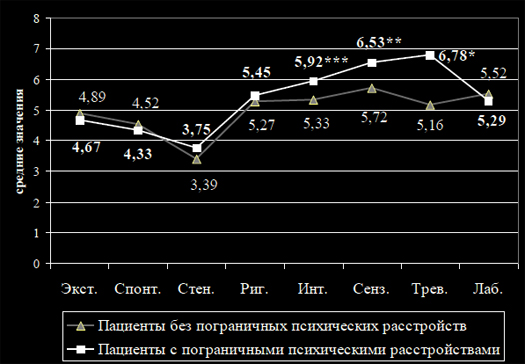 Примечание: Экст. — экстраверсия, Спонт. — спонтанность, Стен. — сте-ничность, Риг. — ригидность, Инт. — интроверсия, Сенз. — сензитивность,Трев. — тревожность, Лаб. – лабильность. * p=0,00001, ** р=0,001, ***р=0,045.Кроме того, для пациентов с РА характерно сочетание спонтанности и ри-гидности. Это значит, что преобладание возбудимых свойств нервной систе-мы, отсутствие самоконтроля и импульсивность реакций сочетается с недо-статочной пластичностью, склонностью к застреванию аффекта и «приобре-тенной» беспомощностью, что становится почвой для избыточной эмоцио-нальной напряженности.Пациенты с ППР были более интровертированы (p=0,045), сензитивны(p=0,001) и тревожны (p=0,00001) по сравнению с пациентами без ППР.Возможно, этот контингент больных РА более чувствителен к происходящимсобытиям, склонен испытывать беспричинное и беспредметное волнение вбольшинстве жизненных ситуаций, менее пластичен. Такие личности мо-гут реагировать на неблагоприятные обстоятельства и ситуации депрессив-но-тревожными реакциями, фиксированным страхом, склонностью к форми-рованию аутоагрессивного (суицидального) поведения.С Целью изучения частоты отдельных синдромов ППР у больных РА сразными индивидуально-типологическими особенностями личности всебольные были разделены на 3 группы по степени выраженности отдельныхиндивидуально-типологических свойств личности (экстраверсии, спонтанно-сти, агрессивности, ригидности, интроверсии, сензитивности, тревожности,лабильности): 1) пациенты, у которых показатели в пределах нормы, 2) па-циенты с акцентуированными свойствами личности, 3) пациенты с избыточновыраженными свойствами личности (дезадаптирующими свойствами) (табл.).
Таблица. Степень выраженности отдельных индивидуально – типологиче-ских свойств у больных РА (n=176).
Примечание: Экст. — экстраверсия, Спонт. — спонтанность, Стен. — сте-ничность, Риг. — ригидность, Инт. — интроверсия, Сенз. — сензитивность,Трев. — тревожность, Лаб. – лабильность. * p=0,00001, ** р=0,001, ***р=0,045.Кроме того, для пациентов с РА характерно сочетание спонтанности и ри-гидности. Это значит, что преобладание возбудимых свойств нервной систе-мы, отсутствие самоконтроля и импульсивность реакций сочетается с недо-статочной пластичностью, склонностью к застреванию аффекта и «приобре-тенной» беспомощностью, что становится почвой для избыточной эмоцио-нальной напряженности.Пациенты с ППР были более интровертированы (p=0,045), сензитивны(p=0,001) и тревожны (p=0,00001) по сравнению с пациентами без ППР.Возможно, этот контингент больных РА более чувствителен к происходящимсобытиям, склонен испытывать беспричинное и беспредметное волнение вбольшинстве жизненных ситуаций, менее пластичен. Такие личности мо-гут реагировать на неблагоприятные обстоятельства и ситуации депрессив-но-тревожными реакциями, фиксированным страхом, склонностью к форми-рованию аутоагрессивного (суицидального) поведения.С Целью изучения частоты отдельных синдромов ППР у больных РА сразными индивидуально-типологическими особенностями личности всебольные были разделены на 3 группы по степени выраженности отдельныхиндивидуально-типологических свойств личности (экстраверсии, спонтанно-сти, агрессивности, ригидности, интроверсии, сензитивности, тревожности,лабильности): 1) пациенты, у которых показатели в пределах нормы, 2) па-циенты с акцентуированными свойствами личности, 3) пациенты с избыточновыраженными свойствами личности (дезадаптирующими свойствами) (табл.).
Таблица. Степень выраженности отдельных индивидуально – типологиче-ских свойств у больных РА (n=176).
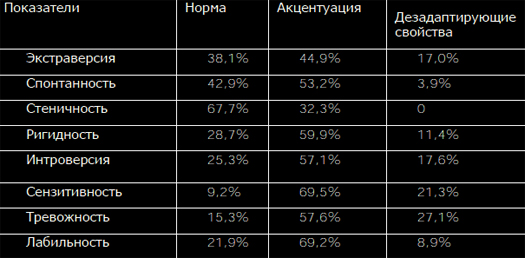 В группе пациентов распределенных по степени интравертированности(рис. 2) депрессивные расстройства (р=0,001) достоверно чаще диагности-ровались у пациентов с избыточно выраженной интроверсией (дезадаптаци-ей), по сравнению с акцентуантами и пациентами с нормальным свойствомличности. Остальные синдромы ППР имели тенденцию к росту с усилениемстепени выраженности интроверсии.
Рис. 2. Частота отдельных синдромов ППР в группе пациентов с разнойстепенью выраженности интроверсии: норма, акцентуация, избыточная вы-раженность (дезадаптирующие свойства).
В группе пациентов распределенных по степени интравертированности(рис. 2) депрессивные расстройства (р=0,001) достоверно чаще диагности-ровались у пациентов с избыточно выраженной интроверсией (дезадаптаци-ей), по сравнению с акцентуантами и пациентами с нормальным свойствомличности. Остальные синдромы ППР имели тенденцию к росту с усилениемстепени выраженности интроверсии.
Рис. 2. Частота отдельных синдромов ППР в группе пациентов с разнойстепенью выраженности интроверсии: норма, акцентуация, избыточная вы-раженность (дезадаптирующие свойства).
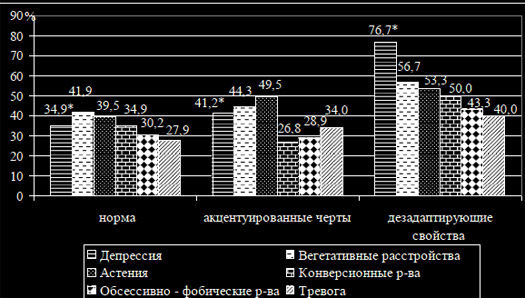 Примечание: * р=0,001В группе пациентов распределенных (рис. 3) по степени выраженностисензитивности депрессивные расстройства (р=0,002) и астения (р=0,008)достоверно чаще диагностировались у пациентов с избыточно выраженнойсензитивностью, по сравнению с акцентуантами и пациентами с нормальнымсвойством личности. Остальные синдромы ППР имели только тенденцию кросту с усилением степени выраженности сензитивности (p>0,05).
Примечание: * р=0,001В группе пациентов распределенных (рис. 3) по степени выраженностисензитивности депрессивные расстройства (р=0,002) и астения (р=0,008)достоверно чаще диагностировались у пациентов с избыточно выраженнойсензитивностью, по сравнению с акцентуантами и пациентами с нормальнымсвойством личности. Остальные синдромы ППР имели только тенденцию кросту с усилением степени выраженности сензитивности (p>0,05).
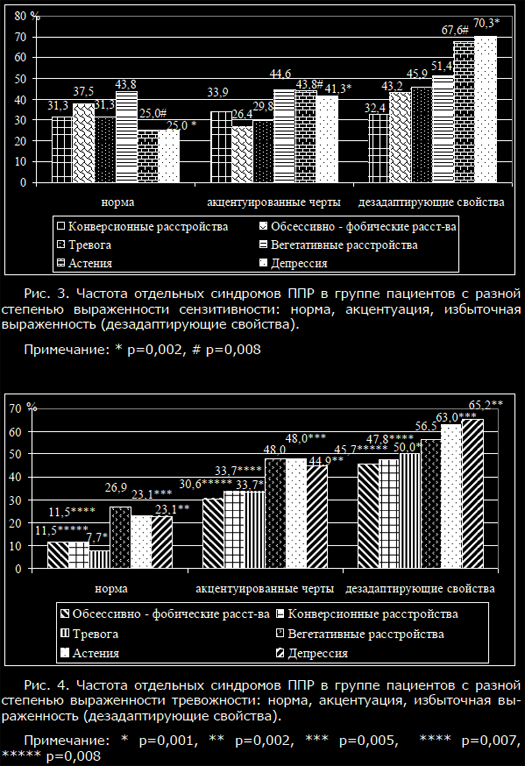 В группе пациентов распределенных по степени тревожности (рис. 4),тревога (р=0,001), депрессивные расстройства (р=0,002), астения(р=0,005), конверсионные расстройства (р=0,007) и обсессивно – фобиче-ские расстройства (р=0,008) достоверно чаще диагностировались у пациен-тов с избыточно выраженной тревожностью, по сравнению с акцентуантамии пациентами с нормальным свойством личности. Тенденцию к росту с уси-лением степени выраженности тревожности имели вегетативные расстрой-ства (p>0,05).Частота всех синдромов ППР достоверно не различалась в группах паци-ентов с разной степенью выраженности экстраверсии, спонтанности, стенич-ности, ригидности и лабильности (p>0,05).Заключение: Пациенты с РА – люди с повышенной чувствительностью кпроисходящим событиям, замкнутые, неуверенные в себе, большинство изних склонны испытывать беспричинное и беспредметное волнение в боль-шинстве жизненных ситуаций. Как правило, они ориентируются на авторитетболее сильной личности, предпочитающего уход от конфликта и поиск ща-дящей общественной среды.Пациенты с РА имеют высокую частоту ППР (64,2%). ППР взаимосвязаныс индивидуально-типологическими особенностями личности такими, как сен-зитивностью, тревожностью и интровертированностью (p<0,05). Так, наформирование депрессивных расстройств оказывают влияние такие лич-ностные характеристики больных РА, как интраверсия, сензитивность, тре-вожность. Формирование астении ассоциируется с сензитивностью. Тревож-ность оказывает влияние на формирование астении, тревоги, конверсионныхрасстройств и обсессивно-фобических расстройств.
Ахунова Р.Р., Ахунова Г.Р.
ОЦЕНКА ФАКТОРОВ РИСКА РАЗВИТИЯ ПСИХИЧЕСКИХ РАССТРОЙСТВ НЕПСИХОТИЧЕСКОГО УРОВНЯ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБОУ ДПО КГМА Минздрава России, г. Казань, Россия
Ревматоидный артрит — распространенное аутоиммунное ревматическоезаболевание, приводящее к нарушению образа жизни больных, смене инте-ресов, снижению материального и социального положения, а такжек формированию психических расстройств. Неотъемлемой частью диагности-ки и лечения пациентов с ревматоидным артритом является оценка факторовриска возникновения психических расстройств непсихотического уровня убольных с разными социальными и клиническими характеристиками.Цель исследования. Оценить факторы риска возникновения психиче-ских расстройств непсихотического уровня у больных ревматоидным артри-том с разными социальными и клиническими характеристиками. ревматоидным артритом старше 18 лет без органической патологии голов-ного мозга и психических заболеваний психотического регистра. Всем паци-ентам проведено клиническое, лабораторное и рентгенологическое обследо-вания, а также всеми пациентами заполнены опросники для оценкии выявления невротических состояний (Яхин К.К., Менделевич Д.М., 1978)и Health Assessment Questionnaire (HAQ).Оценка факторов риска возникновения психических расстройств непси-хотического уровня у больных ревматоидным артритом с разными социаль-ными и клиническими характеристиками осуществлялась на основании раз-работанной в ходе исследования прогностической таблицы (табл.), позволя-ющей оценить вклад каждого из выявленных факторов рискав возникновение психических расстройств непсихотического уровня. Дляучета «веса» признака, его диагностической ценности был применен методпоследовательной статистической процедуры.Результаты и обсуждение. У 123-х (64,1 %) пациентовс ревматоидным артритом были диагностированы психические расстройстванепсихотического уровня. Наиболее часто диагностировались астения — 92(48,0 %), вегетативные — 91 (47,4 %) и депрессивные расстройства — 89(46,4 %), реже тревога — 63 (32,8 %), обсессивно-фобические — 63(32,8 %) и конверсионные — 65 (33,9 %) расстройства.В ходе исследования психических расстройств непсихотического уровняу больных ревматоидным артритом была разработана прогностическая таб-лица. Таблица позволяет оценить риск возникновения психических рас-стройств непсихотического уровня у конкретного пациента с ревматоиднымартритом в зависимости от социальных и клинических характеристик. Порогдля отсутствия психических расстройств непсихотического уровня составля-ет (+13), для развития психических расстройств непсихотического уровня —(-13) (достоверность результатов — 95 %). Сумма диагностических коэффи-циентов у обследуемых лиц, попадающих в промежуток между (+13) и (-13)указывает на неопределенность полученных результатов, что может свиде-тельствовать о недостаточности информации или же о том, что имеющиесяпсихические нарушения не достигли степени болезненного состояния.Факторами риска развития тревоги, согласно прогностической таблице,являются женский пол, неполное/полное среднее образование, учащиеся ирабочие, отсутствие близких друзей, стратегия воспитания детей «безуслов-ное подчинение взрослым», умеренный/выраженный болевой синдром иумеренные/выраженные функциональные нарушения по индексу HAQ.Факторами риска развития депрессивных расстройств, согласно прогно-стической таблице, являются женский пол, одинокое проживание, отсутствиеподдержки членов семьи, отсутствие близких друзей, конфликтные взаимо-отношения в семье; серопозитивный вариант ревматоидного артрита, дли-тельность заболевания более 2 лет.Факторами риска развития конверсионных расстройств, согласно прогно-стической таблице, являются женский пол, конфликтные взаимоотношения всемье, наличие приоритетных жизненных ценностей. Факторами риска развития обсессивно-фобических расстройств, согласнопрогностической таблице, являются женский пол, неполное/полное среднееобразование, отсутствие поддержки членов семьи, конфликтные взаимоот-ношения с детьми, наличие приоритетных жизненных ценностей; серопози-тивный вариант ревматоидного артрита.Заключение. Результаты изучения частоты и структуры психическихрасстройств непсихотического уровня во взаимосвязи с клиническими харак-теристиками больных ревматоидным артритом позволили выделить факторыриска развития психических расстройств непсихотического уровня средибольных ревматоидным артритом.Факторами риска психических расстройств непсихотического уровня, со-гласно прогностической таблице, явились женский пол, неполное/полноесреднее образование, рабочие, материальное положение ниже среднего,отсутствие поддержки членов семьи, отсутствие близких друзей, конфликт-ные взаимоотношения в семье; серонегативный вариант ревматоидного арт-рита, длительность заболевания более двух лет, умеренный/выраженныйболевой синдром и умеренные/выраженные функциональные нарушенияпо индексу HAQ.Таблица. Прогностическая таблица для оценки риска возникновения пси-хических расстройств непсихотического уровня в зависимости от социальныхи клинических характеристик пациентов с ревматоидным артритом (РА).
В группе пациентов распределенных по степени тревожности (рис. 4),тревога (р=0,001), депрессивные расстройства (р=0,002), астения(р=0,005), конверсионные расстройства (р=0,007) и обсессивно – фобиче-ские расстройства (р=0,008) достоверно чаще диагностировались у пациен-тов с избыточно выраженной тревожностью, по сравнению с акцентуантамии пациентами с нормальным свойством личности. Тенденцию к росту с уси-лением степени выраженности тревожности имели вегетативные расстрой-ства (p>0,05).Частота всех синдромов ППР достоверно не различалась в группах паци-ентов с разной степенью выраженности экстраверсии, спонтанности, стенич-ности, ригидности и лабильности (p>0,05).Заключение: Пациенты с РА – люди с повышенной чувствительностью кпроисходящим событиям, замкнутые, неуверенные в себе, большинство изних склонны испытывать беспричинное и беспредметное волнение в боль-шинстве жизненных ситуаций. Как правило, они ориентируются на авторитетболее сильной личности, предпочитающего уход от конфликта и поиск ща-дящей общественной среды.Пациенты с РА имеют высокую частоту ППР (64,2%). ППР взаимосвязаныс индивидуально-типологическими особенностями личности такими, как сен-зитивностью, тревожностью и интровертированностью (p<0,05). Так, наформирование депрессивных расстройств оказывают влияние такие лич-ностные характеристики больных РА, как интраверсия, сензитивность, тре-вожность. Формирование астении ассоциируется с сензитивностью. Тревож-ность оказывает влияние на формирование астении, тревоги, конверсионныхрасстройств и обсессивно-фобических расстройств.
Ахунова Р.Р., Ахунова Г.Р.
ОЦЕНКА ФАКТОРОВ РИСКА РАЗВИТИЯ ПСИХИЧЕСКИХ РАССТРОЙСТВ НЕПСИХОТИЧЕСКОГО УРОВНЯ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБОУ ДПО КГМА Минздрава России, г. Казань, Россия
Ревматоидный артрит — распространенное аутоиммунное ревматическоезаболевание, приводящее к нарушению образа жизни больных, смене инте-ресов, снижению материального и социального положения, а такжек формированию психических расстройств. Неотъемлемой частью диагности-ки и лечения пациентов с ревматоидным артритом является оценка факторовриска возникновения психических расстройств непсихотического уровня убольных с разными социальными и клиническими характеристиками.Цель исследования. Оценить факторы риска возникновения психиче-ских расстройств непсихотического уровня у больных ревматоидным артри-том с разными социальными и клиническими характеристиками. ревматоидным артритом старше 18 лет без органической патологии голов-ного мозга и психических заболеваний психотического регистра. Всем паци-ентам проведено клиническое, лабораторное и рентгенологическое обследо-вания, а также всеми пациентами заполнены опросники для оценкии выявления невротических состояний (Яхин К.К., Менделевич Д.М., 1978)и Health Assessment Questionnaire (HAQ).Оценка факторов риска возникновения психических расстройств непси-хотического уровня у больных ревматоидным артритом с разными социаль-ными и клиническими характеристиками осуществлялась на основании раз-работанной в ходе исследования прогностической таблицы (табл.), позволя-ющей оценить вклад каждого из выявленных факторов рискав возникновение психических расстройств непсихотического уровня. Дляучета «веса» признака, его диагностической ценности был применен методпоследовательной статистической процедуры.Результаты и обсуждение. У 123-х (64,1 %) пациентовс ревматоидным артритом были диагностированы психические расстройстванепсихотического уровня. Наиболее часто диагностировались астения — 92(48,0 %), вегетативные — 91 (47,4 %) и депрессивные расстройства — 89(46,4 %), реже тревога — 63 (32,8 %), обсессивно-фобические — 63(32,8 %) и конверсионные — 65 (33,9 %) расстройства.В ходе исследования психических расстройств непсихотического уровняу больных ревматоидным артритом была разработана прогностическая таб-лица. Таблица позволяет оценить риск возникновения психических рас-стройств непсихотического уровня у конкретного пациента с ревматоиднымартритом в зависимости от социальных и клинических характеристик. Порогдля отсутствия психических расстройств непсихотического уровня составля-ет (+13), для развития психических расстройств непсихотического уровня —(-13) (достоверность результатов — 95 %). Сумма диагностических коэффи-циентов у обследуемых лиц, попадающих в промежуток между (+13) и (-13)указывает на неопределенность полученных результатов, что может свиде-тельствовать о недостаточности информации или же о том, что имеющиесяпсихические нарушения не достигли степени болезненного состояния.Факторами риска развития тревоги, согласно прогностической таблице,являются женский пол, неполное/полное среднее образование, учащиеся ирабочие, отсутствие близких друзей, стратегия воспитания детей «безуслов-ное подчинение взрослым», умеренный/выраженный болевой синдром иумеренные/выраженные функциональные нарушения по индексу HAQ.Факторами риска развития депрессивных расстройств, согласно прогно-стической таблице, являются женский пол, одинокое проживание, отсутствиеподдержки членов семьи, отсутствие близких друзей, конфликтные взаимо-отношения в семье; серопозитивный вариант ревматоидного артрита, дли-тельность заболевания более 2 лет.Факторами риска развития конверсионных расстройств, согласно прогно-стической таблице, являются женский пол, конфликтные взаимоотношения всемье, наличие приоритетных жизненных ценностей. Факторами риска развития обсессивно-фобических расстройств, согласнопрогностической таблице, являются женский пол, неполное/полное среднееобразование, отсутствие поддержки членов семьи, конфликтные взаимоот-ношения с детьми, наличие приоритетных жизненных ценностей; серопози-тивный вариант ревматоидного артрита.Заключение. Результаты изучения частоты и структуры психическихрасстройств непсихотического уровня во взаимосвязи с клиническими харак-теристиками больных ревматоидным артритом позволили выделить факторыриска развития психических расстройств непсихотического уровня средибольных ревматоидным артритом.Факторами риска психических расстройств непсихотического уровня, со-гласно прогностической таблице, явились женский пол, неполное/полноесреднее образование, рабочие, материальное положение ниже среднего,отсутствие поддержки членов семьи, отсутствие близких друзей, конфликт-ные взаимоотношения в семье; серонегативный вариант ревматоидного арт-рита, длительность заболевания более двух лет, умеренный/выраженныйболевой синдром и умеренные/выраженные функциональные нарушенияпо индексу HAQ.Таблица. Прогностическая таблица для оценки риска возникновения пси-хических расстройств непсихотического уровня в зависимости от социальныхи клинических характеристик пациентов с ревматоидным артритом (РА).
 Баранов Е.В., Маслакова Л.А., Гонтарь И.П., Трубенко Ю.А.,Емельянов Н.И.
ИЗУЧЕНИЕ АНТИТЕЛООБРАЗОВАНИЯ К ОСНОВНОМУ БЕЛКУ МИЕЛИНА И К БЕЛКУ S-100 У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград, Россия
Патология нервной системы при ревматических заболеваниях нередкоопределяет прогноз, клиническую картину заболевания и качество жизнибольных, а также требует обязательного сочетанного применения базиснойпротивовоспалительной терапии, ангио- и нейропротекторов. В связи с этим,нам кажется интересным изучение антителообразования к основным антиге-нам нервной ткани. Миелиновая оболочка – существенный элемент нервнойткани. Она окружает аксоны и дендриты периферической нервной системы,клеточные тела в нервных ганглиях, нервные волокна белого вещества цен-тральной нервной системы. В связи с вышеизложенным возникает вопрос, неявляются ли антитела к основному белку миелина и белку S-100 одним изпусковых механизмов развития неврологической симптоматики при ревмато-идном артрите.Цель исследования заключалась в изучении образования антител к об-щему белку миелина (ОБМ) и белку S-100 в сыворотке крови больных рев-матоидным артритом.Материалы и методы. Исследовалась сыворотка 36 практически здоро-вых лиц (доноров Областной станции переливания крови), 94 больных рев-матоидным артритом (РА). Обследованные нами больные являлись пациен-тами ревматологических отделений МУЗ ГБ № 25 г. Волгограда и МУЗ ГБ № 1г. Волжского. По степени активности больные распределились следующимобразом: I степень активности выявлена у 13 пациентов; II ст.– у 51, а IIIст. – у 8. ФНС I наблюдалось у 8 больных, ФНС II – у 65, а ФНС III – у 22.Антитела к ОБМ и белку S-100 в обеих группах определяли методом непря-мого иммуноферментного анализа с использованием магнитосорбентов. По-лученные значения выражали в единицах оптической плотности (е.о.п.) исчитали положительными при превышении величин экстинции, найденныхдля здоровых лиц, более чем на 2. Обработка данных проводилась с ис-пользованием программного пакета STATISTICA FOR WINDOWS.Результаты и Обсуждение. При исследовании сывороток крови здоро-вых лиц уровень АТ к основному белку миелина составил 0,03±0,01 е.о.п.,белку S-100 0,02±0,01 е.о.п. У больных РА повышенные уровни АТ к основ-ному белку миелина при применении ELISA-теста с использованием иммоби-лизированных магнитосорбентов выявлены у 37 (39,4%) пациентов; к белкуS-100 – у 11 (32,4%). При этом во всех случаях исследуемые показателикоррелировали со степенью активности заболевания (р<0,05). В связи сэтим АТ к ОБМ и S-100 можно рассматривать как своеобразный серологиче-ский маркер РЗ и использовать их в качестве дополнительных индикаторов тяжести патологического процесса. Была установлена связь между концен-трацией АТ к ОБМ, белку S-100 и некоторыми клиническими проявлениямиуказанных заболеваний. Так, при РА максимальные АТ к белку S-100 выяв-лялись у пациентов с периферическим поражением нервной системы(р<0,01), а при исследовании АТ к ОБМ повышенные значения выявлялиськак при поражении периферической, так и при поражении центральнойнервной системы. Данный факт подтверждает то, что антителообразование кОБМ и S-100 может являться одним из пусковых механизмов развитияневрологической симптоматики при РА.Поражение нервной системы при ревматоидном артрите по литературнымданным и по результатам нашего исследования проявляется чаще всего ввиде периферической полинейропатии. У больных развиваются парестезии,чувство жжения в области нижних и верхних конечностей, снижается так-тильная и болевая чувствительность, появляются двигательные расстрой-ства. При активном течении ревматоидного артрита иногда наблюдаютсясимптомы полиневрита с сильными болями в конечностях, чувствительнымиили двигательными нарушениями, атрофией мышц. Возможны нарушениявегетативной нервной системы, проявляющиеся гипер- или гипотермией,повышенным потоотделением, трофическими расстройствами.При РА наиболее угрожающие центральные неврологические осложненияв виде шейной миелопатии, гидроцефалии и вертебробазиллярной окклюзиис нарушением функции стволовых структур возникают в результате атланто-аксиального смещения артритически пораженного одноименного сустава,причем степень подвывиха атлантоосевых суставов более выражена у боль-ных РА, получающих кортикостероиды. Одним из механизмов повреждениянервной системы возможно образование аутоантител и циркулирующих им-мунных комплексов к этим структурам. Подобные механизмы играют роль вэкспериментальном энцефаломиелите.Выводы1. Полученные данные свидетельствуют о том, что обнаруженные зако-номерности поражения периферической и центральной нервной системы убольных РА с повышенными титрами АТ к ОБМ и к белку S-100 дают возмож-ность прогнозировать клинический вариант заболевания и проводить свое-временную коррекцию начинающихся нарушений.2. Изучение антителообразования к ОБМ и белку S-100 расширяет имею-щиеся представления о патогенезе РА и намечает направления для даль-нейших научных изысканий.
Бедина С.А., Мартемьянов В.Ф., Чернов А.С.,Стажаров М.Ю., Мозговая Е.Э., Левкина М.В.,Хортиева С.С.
ЭНЗИМОДИАГНОСТИКА МИНИМАЛЬНОЙ АКТИВНОСТИ РЕВМАТОИДНОГО ПРОЦЕССА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Диагностика фазы обострения патологического процесса у больных рев-матоидным артритом (РА), протекающего с минимальной активностью, до-вольно затруднительна в клинической практике, так как при этом клиниче-ские проявления обострения имеют мало различий с фазой клинической ре-миссии, а общепринятые острофазовые параклинические показатели (СОЭ,СРБ и др.) в большинстве случаев оказываются в пределах нормы. Поэтомупоиск новых параклинических показателей, способствующих распознаваниюминимальной активации ревматоидного процесса, является актуальной про-блемой в ревматологии.Цель исследования. Оценить возможность использования показателейактивности некоторых ферментов пуринового метаболизма в лизатах лимфо-цитов для повышения качества диагностики минимальной активности ревма-тоидного процесса.Материал и методы. Под наблюдением в условиях стационара находи-лись 20 больных РА с I минимальной активностью патологического процесса.Диагностика РА проводилась на основании диагностических критериев Аме-риканской коллегии ревматологов и Европейской лиги ревматологов (AletahaD. et al., 2010). Контингент больных был представлен 6 (30%) мужчинами и14 (70%) женщинами. Средний возраст больных – 46,8±0,9 лет, длитель-ность заболевания – 9,2±0,8 лет. Серопозитивная форма (по РФ) определя-лась у 12 (60%) больных, I стадия поражения суставов (по Штейнброккеру)– у 3 (15%), II стадия – у 10 (50%), III – у 5 (25%) и IV стадия – у 1 (5%)больного, функциональный класс 2 степени (ФК-2) – у 12 (60%), ФК-3 – у 7(35%) и ФК-4 – у 1 (5%) больного. Системные поражения выявлены у 8(40%) больных. Интермиттирующее течение установлено у 16 (80%), про-грессирующее – у 4 (20%) больных. Контрольную группу составили 30 прак-тически здоровых людей.Выделение лимфоцитов из венозной крови проводилось по модифициро-ванной методике Böyum (1980) с использованием лимфосепа с градиентомплотности 1,075-1,077 г/л. Лизаты лимфоцитов готовили трехкратным замо-раживанием-оттаиванием, центрифугированием. В лизатах лимфоцитов пооригинальным методикам определяли активность гуаниндезаминазы (ГДА),гуанозиндезаминазы (ГЗДА), гуанозинфосфорилазы (ГФ), пуриннуклео-зидфосфорилазы (ПНФ), ксантиноксидазы (КО) и ксантиндегидрогеназы(КДГ). Активность энзимов выражали в нмоль/мин/мл, содержащим 1×10. программу ”Статистика 6.0”.Результаты исследований. Активность ферментов у здоровых людей независела от пола и возраста и при исследовании ферментов у больных РАэти факторы не учитывались. За референтные величины активности фермен-тов у здоровых использовалась формула М±2σ.При поступлении на лечение, по сравнению со здоровыми, у больных РАс I степенью активности процесса в лизатах лимфоцитов выше активностьГДА, ПНФ, ГФ (все р<0,001), ниже активность ГЗДА (р<0,01), КО и КДГ (всер<0,001). Если же учитывать не среднестатистические велиины активностиферментов, а индивидуальные энзимные показатели, то у больных РА заверхние референтные пределы показатели активности ГФ выходят у всехбольных (100%), ГДА и ПНФ – у 18 (90%) больных, за нижние референтныепределы здоровых выходят показатели активности КДГ у 18 (90%) больных,КО – у 12 (60%), ГЗДА – у 5 (25%) больных. В то же время у этих же боль-ных из острофазовых показателей наиболее лучше отражали минимальнуюактивность процесса СОЭ и альфа-2-глобулины у 8 (40%) больных, сиало-вые кислоты – у 7 (35%) больных. Через 7-8 дней лечения снизилась актив-ность ГДА (все р<0,05), ПНФ и ГФ (все р<0,001), повысилась активность КДГ(все р<0,01). По окончании курса лечения отмечалась положительная дина-мика активности всех ферментов: не имели отличий от уровня здоровых по-казатели активности КО, КДГ, ГЗДА, ПНФ, но остались повышенными актив-ность ГДА и ГФ. Но, тем не менее, все энзимные показатели при выписке, встадии начинающейся клинической ремиссии не выходили за референтныепределы. Определенное влияние на энзимную активность оказывали стадиипоражения суставов, ФК суставов, характер течения.Заключение. В индикации минимальной активности ревматоидного про-цесса показатели активности ГФ, ГДА, ПНФ, КДГ в лизатах лимфоцитов име-ют существенное преимущество перед показателями СОЭ, СРБ, альфа-2-глобулинами, сиаловых кислот. Вышеизученные энзимные показатели спо-собствуют объективизации контроля эффективности проводимой терапии,разграничению фаз клинической ремиссии и обострения патологическогопроцесса.
Бледнова А.Ю., Елисеева Л.Н., Давыдова А.Ф.,Бочарникова М.И.
АНАЛИЗ КОМОРБИДНОСТИ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ В УСЛОВИЯХ СТАЦИОНАРА
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Проблема коморбидных состояний у пациентов с ревматоидным артритом(РА) является актуальной для современной ревматологии, поскольку влияние сопутствующих заболеваний на клиническое течение основного, эффектив-ность медикаментозной терапии, ближайший и отдаленный прогноз больныхостаются недостаточно изученными.Цель работы: проанализировать коморбидность и характер проводимойтерапии у больных ревматоидным артритом в условиях профильного отде-ления стационара.Материалы и методы: Проведен анализ случайной выборки из 60 исто-рий болезни пациентов РА, находившихся на лечении в ревматологическомотделении Краевой клиническуой больницы им. проф. С.В.Очаповского впериод с января по апрель 2014 года. Возраст больных колебался от 29 до75 лет (средний возраст 58,3±4,5 лет), среди них было 83,3% женщин и16,7% мужчин. Давность заболевания от 2 до 23 лет (в среднем 8,3 ±1,23года). Все больные имели полиартрит. У 1 пациента диагностирована ран-няя, у 24 – развернутая и у 35 поздняя стадия РА. 55% обследованных име-ли III-IV рентгенологическую стадию заболевания, 31% – II и 6% – I (боль-ные с ранней и развернутой стадией РА). Индекс DAS-28 в среднем по груп-пе составил 4,84± 0,92. Серонегативный РА диагностирован у 16%, серопо-зитивный – у 84% пациентов. Во всех случаях определения антител к цик-лическому цитруллинированному пептиду (30% больных) установлен поло-жительный результат. У 53,3% пациентов РА был расценен как эрозивный.Активность I степени диагностирована – у 1, II – у 15, III – у 11 больных.Нарушение функции суставов соответствовало I – у 4-х, II – у 23-х и III-муфункциональному классу – у 3 пациентов соответственно.Анализ медицинской документации позволил выявить высокий уровенькоморбидности у пациентов с РА в условиях стационара, что может быть обу-словлено не только широкой распространенностью сопутствующей патоло-гии, но и необходимостью госпитализации наиболее сложного контингентабольных. Количество хронических заболеваний варьировало от 1 до 5 у од-ного пациента и в среднем составило 2,96±0,72. В соответствии с классифи-кацией возраста по ВОЗ, все больные были разделены на 3 группы: в 1-ю(18-44 года) было включено 5, во 2-ю (45-60 года) – 14, в 3-ю (60-75 лет) –11 человек соответственно. Согласно полученным данным отмечалась тен-денция к возрастанию среднего числа хронических заболеваний при увели-чении возраста больных (с 2,4±0,7 в 1-й до 3,07±0,5 и 3,36±0,63 во 2-й и 3-ей группах). В анализируемой группе пациентов РА частота коморбидностисоставила 93,3%, при этом наиболее часто встречались заболевания сердеч-но-сосудистой, эндокринной системы и опорно-двигательного аппарата, чтосоответствует литературным данным. Сопутствующая патология была пред-ставлена следующим образом: заболевания сердечно-сосудистой системы33,3%, в том числе 23, 3% – гипертоническая болезнь; заболевания опорно-двигательного аппарата (дефоримирующий остеоартроз, остеохондроз по-звоночника) – 33,3%; заболевания почек (МКБ, кисты почек, АРМС) – 30%,эндокринные и метаболические заболевания (сахарный диабет 2 типа, забо-левания щитовидной железы, ожирение) – 23,3% Значительно реже встре-чались заболевания желудочно-кишечного тракта (хронический гастрит,хронический вирусный гепатит «С») – 13,3%, заболевания нервной системы(полинейропатия, дисциркуляторная энцефалопатия) – 10%, органов дыха-ния и вторичные иммуннодефицитные состояния – по 6,6%. При определе нии уровня холестерина у 75% обследованных выявлена гиперхолестерине-мия, Интересно, что часть заболеваний указаны в анамнезе, но не включа-ются в клинический диагноз, хотя полагающееся при этом лечение прово-дится.Медикаментозная терапия РА в проводилась следующими препаратами:нестероидные противовоспалительные средства в условиях стационара былиназначены 80% пациентов, из них 66,7% – кетонал, омепразол -100%, глю-кокортикоиды – 76,7%, сосудистые препараты – 20%. Базисную терапию ванализируемой группе получали 90% пациентов: метотрексат в дозе 10-15мг в неделю 66,7% больных, лефлюномид – 13,3%, сульфасалазин – 6,7%.При этом 13,3% пациентов находились на программной терапии биологиче-скими препаратами (ритуксимаб). С Целью лечения сопутствующих заболе-ваний использовались преимущественно антигипертензивные препараты(ангибиторы АПФ, бета-адреноблокаторы), сахароснижающие средства, L-тироксин, миорелаксанты.Таким образом, пациенты РА имеют высокий уровень коморбидности ас-социированной с возрастом, при этом наиболее часто сопутствующая патоло-гия представлена заболеваниями сердечно-сосудистой, эндокринной системи опорно-двигательного аппарата. В условиях стационара больные получаюткомплексное лечение в соответствии с современными национальными имеждународными рекомендациями с широким использованием средств ба-зисной терапии и необходимой коррекцией сопутствующих заболеваний.
Бурлай О.С., Грехов Р.А., Сулейманова Г.П., Харченко С.А.,Рогаткина Т.Ф.
ИЗУЧЕНИЕ ПОКАЗАТЕЛЕЙ И ФОРМ АГРЕССИВНОСТИ У ПАЦИЕНТОВ С РЕВМАТОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЕМИ
ФГБУ «НИИ КИЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Введение. Ревматические заболевания относятся к заболеваниям с не-достаточно изученным патогенезом. В связи с этим актуальным остаётся изу-чение не только иммунобиологических, но и психосоматических предпосы-лок развития данных заболеваний. Большое значение в формировании пси-хосоматических симптомов отводит психодинамике эмоций, в частности глу-бине подавления аффекта и аффективного конфликта. Эмоция становитсяпатогенной, если она не находит выражения в открытом поведении, т.е. еслиона не отреагирована. Одной из базовых эмоций человека является агрес-сия, подавление и вытеснение которой может выступать, как важный симп-томообразующий фактор.Целью настоящего исследования явилось изучение показателей и формагрессивности у ревматологических больных. Материалы и методы исследования. Было обследовано 37 пациентовревматологического отделения ГУЗ ГКБСМП №25 с диагнозами ревматоидно-го артрита (27 пациентов) и системной красной волчанки (10 пациентов). Изних большинство (32 человека) были женщинами. Средний возраст пациен-тов составил 44,01±12,23 года. Средняя длительность заболевания 6,68±5,4лет. Исследование проводилось с использованием методики диагностикипоказателей и форм агрессии А. Басса и А. Дарки (1957г).Результаты и их обсуждение. В результате исследования было выяв-лено, что индекс агрессивности, включающий в себя показатели физиче-ской, вербальной агрессии и раздражения, у 56,75% обследуемых оказалсяниже нормы, у 40,55% была выявлена норма агрессивности и только 2,7%продемонстрировали высокие показатели агрессивности. Индекс враждебно-сти, учитывающий показатели обиды и подозрительности, у 59,45% обсле-дуемых в пределах нормы, у 32,43% была выявлена высокая враждебность,у 8,1% обследуемых враждебность оказалась низкой. Полученные данныеуказывают на то, что пациенты данной группы более склонны к проявлениямвраждебности, нежели непосредственной агрессивности, т.е. враждебныетенденции у данной группы больных остаются неотреагированными.При анализе показателей отдельных форм агрессивности, привлекаетвнимание тот факт, что наиболее характерной для больных формой прояв-ления агрессии является чувство вины (в среднем 76,1±21,12 баллов). Эточувство, когда человек считает себя плохим, недостойны и часто испытываетмуки совести, фактически представляет собой проявление аутоагрессии.Данные факты позволяют провести аналогию между психическими и сомати-ческими аутоиммунными механизмами развития заболевания, в основе кото-рых лежит как психологическое (посредством чувства вины), так иммунноесаморазрушение. Психосоматические симптомы, в том числе, могут выпол-нять роль и бессознательного самонаказания, призванного облегчить чув-ство вины.Также высокими оказались показатели косвенной агрессии (в среднем59,7±22,81 баллов) – агрессии, проявляемой в скрытой, замаскированной,более безопасной форме: сплетни, шутки, направленные против других лю-дей, и ненаправленные взрывы ярости. Среднее значение по показателямобиды составило 55,2±22,81 баллов, что говорит о свойственном для даннойгруппы больных сочетании чувства гнева к обидчику и жалости к самомусебе. Чувство обиды не способствует конструктивному отреагированиюагрессивных импульсов, а скорее ведёт к их подавлению и накоплению, что,по мнению ряда авторов, также является значимой предпосылкой развитияпсихосоматических заболеваний.Менее выраженными оказались показатели вербальной агрессии и раз-дражения – в среднем 49,3±22,35 и 47,2±21,12 баллов соответственно.Наименее склонны пациенты данной выборки к проявлениям подозрительно-сти (в среднем 44,9±27,97 балла), физической агрессии (41,6±25,02 балла)и негативизма (34±23,97 балла).Значимых корреляций между показателями агрессивности и возрастомбольных не обнаружено, однако показатели чувства вины, косвенной агрессии, а также раздражения значимо отрицательно (р<0,05) коррелируют сдлительностью заболевания. Данный факт подтверждает предположение отом, что само заболевание представляет собой специфическую бессозна-тельную форму отреагирования агрессивных импульсов, направленных про-тив собственного организма, и по мере возрастания длительности заболева-ния снижается потребность как в аутоагрессии, так и отчасти в выраженииагрессии во внешний мир.Выводы. Результаты исследования свидетельствуют о том, что для рев-матических больных свойственна определённая специфика агрессивныхпроявлений, которые можно точнее охарактеризовать, как аутоагрессивные.Само заболевание также можно расценивать как специфическую бессозна-тельную форму выражения агрессии. Выражать агрессию данным пациентампроще косвенно, замещая опасные объекты и формы проявления агрессиина более безопасные. Данные Выводы свидетельствуют о необходимостиоказания ревматическим больным не только медикаментозной, но и психоло-гической помощи. Психологическая коррекция должна быть направлена напреодоление тенденций к саморазрушению, чувства вины и обиды, на сни-жение враждебности и развитие чувства безопасности, а также на развитиенавыков конструктивного отреагирования агрессивных импульсов.
Бычков И.Н., Ханов А.Г., Паневкина И.В.
ОСОБЕННОСТИ ПИТАНИЯ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБОУ ВПО РостГМУ Минздрава России, ГБУ РО «ОКБ №2», МБУЗ ГБСМП им.В.И.Ленина, г. Ростов-на-Дону, г. Шахты Ростовской области, Россия
В настоящее время статус питания больных ревматоидным артритом (РА)не изучен в полном объёме, хотя дефицит некоторых нутриентов может вно-сить негативные элементы в течение и прогноз заболевания. Избыточноепотребление омега-6 жирных кислот, равно как и недостаток в питании оме-га-9 жирных кислот может способствовать усиление воспалительной реак-ции.Материалы и методы: Были исследованы больные РА в количестве 15человек, не принимающих постоянно кортикостероиды (диагностическиекритерии РА ACR, 1987г.). Группа сравнения – 10 человек без патологиисуставов. Среди больных РА 12 человек – женщины, 3 – мужчины. В группесравнения – все женщины. Для исследования состояния питания была ис-пользована компьютерная программа «Анализ питания человека» версия1.2.4 ГУ НИИ питания РАМН 2003-2006гг.Результаты исследования: В обеих группах имело место превышениеиндекса массы тела, свидетельствующее о легкой степени ожирения, кото-рое в дальнейшем объясняется несбалансированным характером питания.Обращает внимание превышение потребления общего жира. В дальнейшемпревышение потребление жиров в питании способствует увеличению массы тела и развитию метаболического синдрома. При этом среди потребляемыхполиненасыщенных жиров абсолютное лидерство занимают Ώ-6 жирныекислоты, что способствует поддержанию воспалительного процесса, так какиз Ώ-6-ЖК в организме синтезируются провоспалительные простагландины илейкотриены. Большое место в структуре питания больных РА занимают уг-леводы, при этом количество пищевых волокон в питании не превышает30% от нормы потребления. Количество потребляемого кальция ниже сред-нестатистической нормы в обеих группах, но несколько более выражено вгруппе больных РА. Обращает на себя внимание резкий недостаток в раци-оне магния, следствием чего может быть снижение метаболических реакцийорганизма. Недостаток в питании витаминов группы В и аскорбиновой кисло-ты присутствует в обеих группах, но у больных РА является более выражен-ным.
Баранов Е.В., Маслакова Л.А., Гонтарь И.П., Трубенко Ю.А.,Емельянов Н.И.
ИЗУЧЕНИЕ АНТИТЕЛООБРАЗОВАНИЯ К ОСНОВНОМУ БЕЛКУ МИЕЛИНА И К БЕЛКУ S-100 У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград, Россия
Патология нервной системы при ревматических заболеваниях нередкоопределяет прогноз, клиническую картину заболевания и качество жизнибольных, а также требует обязательного сочетанного применения базиснойпротивовоспалительной терапии, ангио- и нейропротекторов. В связи с этим,нам кажется интересным изучение антителообразования к основным антиге-нам нервной ткани. Миелиновая оболочка – существенный элемент нервнойткани. Она окружает аксоны и дендриты периферической нервной системы,клеточные тела в нервных ганглиях, нервные волокна белого вещества цен-тральной нервной системы. В связи с вышеизложенным возникает вопрос, неявляются ли антитела к основному белку миелина и белку S-100 одним изпусковых механизмов развития неврологической симптоматики при ревмато-идном артрите.Цель исследования заключалась в изучении образования антител к об-щему белку миелина (ОБМ) и белку S-100 в сыворотке крови больных рев-матоидным артритом.Материалы и методы. Исследовалась сыворотка 36 практически здоро-вых лиц (доноров Областной станции переливания крови), 94 больных рев-матоидным артритом (РА). Обследованные нами больные являлись пациен-тами ревматологических отделений МУЗ ГБ № 25 г. Волгограда и МУЗ ГБ № 1г. Волжского. По степени активности больные распределились следующимобразом: I степень активности выявлена у 13 пациентов; II ст.– у 51, а IIIст. – у 8. ФНС I наблюдалось у 8 больных, ФНС II – у 65, а ФНС III – у 22.Антитела к ОБМ и белку S-100 в обеих группах определяли методом непря-мого иммуноферментного анализа с использованием магнитосорбентов. По-лученные значения выражали в единицах оптической плотности (е.о.п.) исчитали положительными при превышении величин экстинции, найденныхдля здоровых лиц, более чем на 2. Обработка данных проводилась с ис-пользованием программного пакета STATISTICA FOR WINDOWS.Результаты и Обсуждение. При исследовании сывороток крови здоро-вых лиц уровень АТ к основному белку миелина составил 0,03±0,01 е.о.п.,белку S-100 0,02±0,01 е.о.п. У больных РА повышенные уровни АТ к основ-ному белку миелина при применении ELISA-теста с использованием иммоби-лизированных магнитосорбентов выявлены у 37 (39,4%) пациентов; к белкуS-100 – у 11 (32,4%). При этом во всех случаях исследуемые показателикоррелировали со степенью активности заболевания (р<0,05). В связи сэтим АТ к ОБМ и S-100 можно рассматривать как своеобразный серологиче-ский маркер РЗ и использовать их в качестве дополнительных индикаторов тяжести патологического процесса. Была установлена связь между концен-трацией АТ к ОБМ, белку S-100 и некоторыми клиническими проявлениямиуказанных заболеваний. Так, при РА максимальные АТ к белку S-100 выяв-лялись у пациентов с периферическим поражением нервной системы(р<0,01), а при исследовании АТ к ОБМ повышенные значения выявлялиськак при поражении периферической, так и при поражении центральнойнервной системы. Данный факт подтверждает то, что антителообразование кОБМ и S-100 может являться одним из пусковых механизмов развитияневрологической симптоматики при РА.Поражение нервной системы при ревматоидном артрите по литературнымданным и по результатам нашего исследования проявляется чаще всего ввиде периферической полинейропатии. У больных развиваются парестезии,чувство жжения в области нижних и верхних конечностей, снижается так-тильная и болевая чувствительность, появляются двигательные расстрой-ства. При активном течении ревматоидного артрита иногда наблюдаютсясимптомы полиневрита с сильными болями в конечностях, чувствительнымиили двигательными нарушениями, атрофией мышц. Возможны нарушениявегетативной нервной системы, проявляющиеся гипер- или гипотермией,повышенным потоотделением, трофическими расстройствами.При РА наиболее угрожающие центральные неврологические осложненияв виде шейной миелопатии, гидроцефалии и вертебробазиллярной окклюзиис нарушением функции стволовых структур возникают в результате атланто-аксиального смещения артритически пораженного одноименного сустава,причем степень подвывиха атлантоосевых суставов более выражена у боль-ных РА, получающих кортикостероиды. Одним из механизмов повреждениянервной системы возможно образование аутоантител и циркулирующих им-мунных комплексов к этим структурам. Подобные механизмы играют роль вэкспериментальном энцефаломиелите.Выводы1. Полученные данные свидетельствуют о том, что обнаруженные зако-номерности поражения периферической и центральной нервной системы убольных РА с повышенными титрами АТ к ОБМ и к белку S-100 дают возмож-ность прогнозировать клинический вариант заболевания и проводить свое-временную коррекцию начинающихся нарушений.2. Изучение антителообразования к ОБМ и белку S-100 расширяет имею-щиеся представления о патогенезе РА и намечает направления для даль-нейших научных изысканий.
Бедина С.А., Мартемьянов В.Ф., Чернов А.С.,Стажаров М.Ю., Мозговая Е.Э., Левкина М.В.,Хортиева С.С.
ЭНЗИМОДИАГНОСТИКА МИНИМАЛЬНОЙ АКТИВНОСТИ РЕВМАТОИДНОГО ПРОЦЕССА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Диагностика фазы обострения патологического процесса у больных рев-матоидным артритом (РА), протекающего с минимальной активностью, до-вольно затруднительна в клинической практике, так как при этом клиниче-ские проявления обострения имеют мало различий с фазой клинической ре-миссии, а общепринятые острофазовые параклинические показатели (СОЭ,СРБ и др.) в большинстве случаев оказываются в пределах нормы. Поэтомупоиск новых параклинических показателей, способствующих распознаваниюминимальной активации ревматоидного процесса, является актуальной про-блемой в ревматологии.Цель исследования. Оценить возможность использования показателейактивности некоторых ферментов пуринового метаболизма в лизатах лимфо-цитов для повышения качества диагностики минимальной активности ревма-тоидного процесса.Материал и методы. Под наблюдением в условиях стационара находи-лись 20 больных РА с I минимальной активностью патологического процесса.Диагностика РА проводилась на основании диагностических критериев Аме-риканской коллегии ревматологов и Европейской лиги ревматологов (AletahaD. et al., 2010). Контингент больных был представлен 6 (30%) мужчинами и14 (70%) женщинами. Средний возраст больных – 46,8±0,9 лет, длитель-ность заболевания – 9,2±0,8 лет. Серопозитивная форма (по РФ) определя-лась у 12 (60%) больных, I стадия поражения суставов (по Штейнброккеру)– у 3 (15%), II стадия – у 10 (50%), III – у 5 (25%) и IV стадия – у 1 (5%)больного, функциональный класс 2 степени (ФК-2) – у 12 (60%), ФК-3 – у 7(35%) и ФК-4 – у 1 (5%) больного. Системные поражения выявлены у 8(40%) больных. Интермиттирующее течение установлено у 16 (80%), про-грессирующее – у 4 (20%) больных. Контрольную группу составили 30 прак-тически здоровых людей.Выделение лимфоцитов из венозной крови проводилось по модифициро-ванной методике Böyum (1980) с использованием лимфосепа с градиентомплотности 1,075-1,077 г/л. Лизаты лимфоцитов готовили трехкратным замо-раживанием-оттаиванием, центрифугированием. В лизатах лимфоцитов пооригинальным методикам определяли активность гуаниндезаминазы (ГДА),гуанозиндезаминазы (ГЗДА), гуанозинфосфорилазы (ГФ), пуриннуклео-зидфосфорилазы (ПНФ), ксантиноксидазы (КО) и ксантиндегидрогеназы(КДГ). Активность энзимов выражали в нмоль/мин/мл, содержащим 1×10. программу ”Статистика 6.0”.Результаты исследований. Активность ферментов у здоровых людей независела от пола и возраста и при исследовании ферментов у больных РАэти факторы не учитывались. За референтные величины активности фермен-тов у здоровых использовалась формула М±2σ.При поступлении на лечение, по сравнению со здоровыми, у больных РАс I степенью активности процесса в лизатах лимфоцитов выше активностьГДА, ПНФ, ГФ (все р<0,001), ниже активность ГЗДА (р<0,01), КО и КДГ (всер<0,001). Если же учитывать не среднестатистические велиины активностиферментов, а индивидуальные энзимные показатели, то у больных РА заверхние референтные пределы показатели активности ГФ выходят у всехбольных (100%), ГДА и ПНФ – у 18 (90%) больных, за нижние референтныепределы здоровых выходят показатели активности КДГ у 18 (90%) больных,КО – у 12 (60%), ГЗДА – у 5 (25%) больных. В то же время у этих же боль-ных из острофазовых показателей наиболее лучше отражали минимальнуюактивность процесса СОЭ и альфа-2-глобулины у 8 (40%) больных, сиало-вые кислоты – у 7 (35%) больных. Через 7-8 дней лечения снизилась актив-ность ГДА (все р<0,05), ПНФ и ГФ (все р<0,001), повысилась активность КДГ(все р<0,01). По окончании курса лечения отмечалась положительная дина-мика активности всех ферментов: не имели отличий от уровня здоровых по-казатели активности КО, КДГ, ГЗДА, ПНФ, но остались повышенными актив-ность ГДА и ГФ. Но, тем не менее, все энзимные показатели при выписке, встадии начинающейся клинической ремиссии не выходили за референтныепределы. Определенное влияние на энзимную активность оказывали стадиипоражения суставов, ФК суставов, характер течения.Заключение. В индикации минимальной активности ревматоидного про-цесса показатели активности ГФ, ГДА, ПНФ, КДГ в лизатах лимфоцитов име-ют существенное преимущество перед показателями СОЭ, СРБ, альфа-2-глобулинами, сиаловых кислот. Вышеизученные энзимные показатели спо-собствуют объективизации контроля эффективности проводимой терапии,разграничению фаз клинической ремиссии и обострения патологическогопроцесса.
Бледнова А.Ю., Елисеева Л.Н., Давыдова А.Ф.,Бочарникова М.И.
АНАЛИЗ КОМОРБИДНОСТИ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ В УСЛОВИЯХ СТАЦИОНАРА
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Проблема коморбидных состояний у пациентов с ревматоидным артритом(РА) является актуальной для современной ревматологии, поскольку влияние сопутствующих заболеваний на клиническое течение основного, эффектив-ность медикаментозной терапии, ближайший и отдаленный прогноз больныхостаются недостаточно изученными.Цель работы: проанализировать коморбидность и характер проводимойтерапии у больных ревматоидным артритом в условиях профильного отде-ления стационара.Материалы и методы: Проведен анализ случайной выборки из 60 исто-рий болезни пациентов РА, находившихся на лечении в ревматологическомотделении Краевой клиническуой больницы им. проф. С.В.Очаповского впериод с января по апрель 2014 года. Возраст больных колебался от 29 до75 лет (средний возраст 58,3±4,5 лет), среди них было 83,3% женщин и16,7% мужчин. Давность заболевания от 2 до 23 лет (в среднем 8,3 ±1,23года). Все больные имели полиартрит. У 1 пациента диагностирована ран-няя, у 24 – развернутая и у 35 поздняя стадия РА. 55% обследованных име-ли III-IV рентгенологическую стадию заболевания, 31% – II и 6% – I (боль-ные с ранней и развернутой стадией РА). Индекс DAS-28 в среднем по груп-пе составил 4,84± 0,92. Серонегативный РА диагностирован у 16%, серопо-зитивный – у 84% пациентов. Во всех случаях определения антител к цик-лическому цитруллинированному пептиду (30% больных) установлен поло-жительный результат. У 53,3% пациентов РА был расценен как эрозивный.Активность I степени диагностирована – у 1, II – у 15, III – у 11 больных.Нарушение функции суставов соответствовало I – у 4-х, II – у 23-х и III-муфункциональному классу – у 3 пациентов соответственно.Анализ медицинской документации позволил выявить высокий уровенькоморбидности у пациентов с РА в условиях стационара, что может быть обу-словлено не только широкой распространенностью сопутствующей патоло-гии, но и необходимостью госпитализации наиболее сложного контингентабольных. Количество хронических заболеваний варьировало от 1 до 5 у од-ного пациента и в среднем составило 2,96±0,72. В соответствии с классифи-кацией возраста по ВОЗ, все больные были разделены на 3 группы: в 1-ю(18-44 года) было включено 5, во 2-ю (45-60 года) – 14, в 3-ю (60-75 лет) –11 человек соответственно. Согласно полученным данным отмечалась тен-денция к возрастанию среднего числа хронических заболеваний при увели-чении возраста больных (с 2,4±0,7 в 1-й до 3,07±0,5 и 3,36±0,63 во 2-й и 3-ей группах). В анализируемой группе пациентов РА частота коморбидностисоставила 93,3%, при этом наиболее часто встречались заболевания сердеч-но-сосудистой, эндокринной системы и опорно-двигательного аппарата, чтосоответствует литературным данным. Сопутствующая патология была пред-ставлена следующим образом: заболевания сердечно-сосудистой системы33,3%, в том числе 23, 3% – гипертоническая болезнь; заболевания опорно-двигательного аппарата (дефоримирующий остеоартроз, остеохондроз по-звоночника) – 33,3%; заболевания почек (МКБ, кисты почек, АРМС) – 30%,эндокринные и метаболические заболевания (сахарный диабет 2 типа, забо-левания щитовидной железы, ожирение) – 23,3% Значительно реже встре-чались заболевания желудочно-кишечного тракта (хронический гастрит,хронический вирусный гепатит «С») – 13,3%, заболевания нервной системы(полинейропатия, дисциркуляторная энцефалопатия) – 10%, органов дыха-ния и вторичные иммуннодефицитные состояния – по 6,6%. При определе нии уровня холестерина у 75% обследованных выявлена гиперхолестерине-мия, Интересно, что часть заболеваний указаны в анамнезе, но не включа-ются в клинический диагноз, хотя полагающееся при этом лечение прово-дится.Медикаментозная терапия РА в проводилась следующими препаратами:нестероидные противовоспалительные средства в условиях стационара былиназначены 80% пациентов, из них 66,7% – кетонал, омепразол -100%, глю-кокортикоиды – 76,7%, сосудистые препараты – 20%. Базисную терапию ванализируемой группе получали 90% пациентов: метотрексат в дозе 10-15мг в неделю 66,7% больных, лефлюномид – 13,3%, сульфасалазин – 6,7%.При этом 13,3% пациентов находились на программной терапии биологиче-скими препаратами (ритуксимаб). С Целью лечения сопутствующих заболе-ваний использовались преимущественно антигипертензивные препараты(ангибиторы АПФ, бета-адреноблокаторы), сахароснижающие средства, L-тироксин, миорелаксанты.Таким образом, пациенты РА имеют высокий уровень коморбидности ас-социированной с возрастом, при этом наиболее часто сопутствующая патоло-гия представлена заболеваниями сердечно-сосудистой, эндокринной системи опорно-двигательного аппарата. В условиях стационара больные получаюткомплексное лечение в соответствии с современными национальными имеждународными рекомендациями с широким использованием средств ба-зисной терапии и необходимой коррекцией сопутствующих заболеваний.
Бурлай О.С., Грехов Р.А., Сулейманова Г.П., Харченко С.А.,Рогаткина Т.Ф.
ИЗУЧЕНИЕ ПОКАЗАТЕЛЕЙ И ФОРМ АГРЕССИВНОСТИ У ПАЦИЕНТОВ С РЕВМАТОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЕМИ
ФГБУ «НИИ КИЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Введение. Ревматические заболевания относятся к заболеваниям с не-достаточно изученным патогенезом. В связи с этим актуальным остаётся изу-чение не только иммунобиологических, но и психосоматических предпосы-лок развития данных заболеваний. Большое значение в формировании пси-хосоматических симптомов отводит психодинамике эмоций, в частности глу-бине подавления аффекта и аффективного конфликта. Эмоция становитсяпатогенной, если она не находит выражения в открытом поведении, т.е. еслиона не отреагирована. Одной из базовых эмоций человека является агрес-сия, подавление и вытеснение которой может выступать, как важный симп-томообразующий фактор.Целью настоящего исследования явилось изучение показателей и формагрессивности у ревматологических больных. Материалы и методы исследования. Было обследовано 37 пациентовревматологического отделения ГУЗ ГКБСМП №25 с диагнозами ревматоидно-го артрита (27 пациентов) и системной красной волчанки (10 пациентов). Изних большинство (32 человека) были женщинами. Средний возраст пациен-тов составил 44,01±12,23 года. Средняя длительность заболевания 6,68±5,4лет. Исследование проводилось с использованием методики диагностикипоказателей и форм агрессии А. Басса и А. Дарки (1957г).Результаты и их обсуждение. В результате исследования было выяв-лено, что индекс агрессивности, включающий в себя показатели физиче-ской, вербальной агрессии и раздражения, у 56,75% обследуемых оказалсяниже нормы, у 40,55% была выявлена норма агрессивности и только 2,7%продемонстрировали высокие показатели агрессивности. Индекс враждебно-сти, учитывающий показатели обиды и подозрительности, у 59,45% обсле-дуемых в пределах нормы, у 32,43% была выявлена высокая враждебность,у 8,1% обследуемых враждебность оказалась низкой. Полученные данныеуказывают на то, что пациенты данной группы более склонны к проявлениямвраждебности, нежели непосредственной агрессивности, т.е. враждебныетенденции у данной группы больных остаются неотреагированными.При анализе показателей отдельных форм агрессивности, привлекаетвнимание тот факт, что наиболее характерной для больных формой прояв-ления агрессии является чувство вины (в среднем 76,1±21,12 баллов). Эточувство, когда человек считает себя плохим, недостойны и часто испытываетмуки совести, фактически представляет собой проявление аутоагрессии.Данные факты позволяют провести аналогию между психическими и сомати-ческими аутоиммунными механизмами развития заболевания, в основе кото-рых лежит как психологическое (посредством чувства вины), так иммунноесаморазрушение. Психосоматические симптомы, в том числе, могут выпол-нять роль и бессознательного самонаказания, призванного облегчить чув-ство вины.Также высокими оказались показатели косвенной агрессии (в среднем59,7±22,81 баллов) – агрессии, проявляемой в скрытой, замаскированной,более безопасной форме: сплетни, шутки, направленные против других лю-дей, и ненаправленные взрывы ярости. Среднее значение по показателямобиды составило 55,2±22,81 баллов, что говорит о свойственном для даннойгруппы больных сочетании чувства гнева к обидчику и жалости к самомусебе. Чувство обиды не способствует конструктивному отреагированиюагрессивных импульсов, а скорее ведёт к их подавлению и накоплению, что,по мнению ряда авторов, также является значимой предпосылкой развитияпсихосоматических заболеваний.Менее выраженными оказались показатели вербальной агрессии и раз-дражения – в среднем 49,3±22,35 и 47,2±21,12 баллов соответственно.Наименее склонны пациенты данной выборки к проявлениям подозрительно-сти (в среднем 44,9±27,97 балла), физической агрессии (41,6±25,02 балла)и негативизма (34±23,97 балла).Значимых корреляций между показателями агрессивности и возрастомбольных не обнаружено, однако показатели чувства вины, косвенной агрессии, а также раздражения значимо отрицательно (р<0,05) коррелируют сдлительностью заболевания. Данный факт подтверждает предположение отом, что само заболевание представляет собой специфическую бессозна-тельную форму отреагирования агрессивных импульсов, направленных про-тив собственного организма, и по мере возрастания длительности заболева-ния снижается потребность как в аутоагрессии, так и отчасти в выраженииагрессии во внешний мир.Выводы. Результаты исследования свидетельствуют о том, что для рев-матических больных свойственна определённая специфика агрессивныхпроявлений, которые можно точнее охарактеризовать, как аутоагрессивные.Само заболевание также можно расценивать как специфическую бессозна-тельную форму выражения агрессии. Выражать агрессию данным пациентампроще косвенно, замещая опасные объекты и формы проявления агрессиина более безопасные. Данные Выводы свидетельствуют о необходимостиоказания ревматическим больным не только медикаментозной, но и психоло-гической помощи. Психологическая коррекция должна быть направлена напреодоление тенденций к саморазрушению, чувства вины и обиды, на сни-жение враждебности и развитие чувства безопасности, а также на развитиенавыков конструктивного отреагирования агрессивных импульсов.
Бычков И.Н., Ханов А.Г., Паневкина И.В.
ОСОБЕННОСТИ ПИТАНИЯ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБОУ ВПО РостГМУ Минздрава России, ГБУ РО «ОКБ №2», МБУЗ ГБСМП им.В.И.Ленина, г. Ростов-на-Дону, г. Шахты Ростовской области, Россия
В настоящее время статус питания больных ревматоидным артритом (РА)не изучен в полном объёме, хотя дефицит некоторых нутриентов может вно-сить негативные элементы в течение и прогноз заболевания. Избыточноепотребление омега-6 жирных кислот, равно как и недостаток в питании оме-га-9 жирных кислот может способствовать усиление воспалительной реак-ции.Материалы и методы: Были исследованы больные РА в количестве 15человек, не принимающих постоянно кортикостероиды (диагностическиекритерии РА ACR, 1987г.). Группа сравнения – 10 человек без патологиисуставов. Среди больных РА 12 человек – женщины, 3 – мужчины. В группесравнения – все женщины. Для исследования состояния питания была ис-пользована компьютерная программа «Анализ питания человека» версия1.2.4 ГУ НИИ питания РАМН 2003-2006гг.Результаты исследования: В обеих группах имело место превышениеиндекса массы тела, свидетельствующее о легкой степени ожирения, кото-рое в дальнейшем объясняется несбалансированным характером питания.Обращает внимание превышение потребления общего жира. В дальнейшемпревышение потребление жиров в питании способствует увеличению массы тела и развитию метаболического синдрома. При этом среди потребляемыхполиненасыщенных жиров абсолютное лидерство занимают Ώ-6 жирныекислоты, что способствует поддержанию воспалительного процесса, так какиз Ώ-6-ЖК в организме синтезируются провоспалительные простагландины илейкотриены. Большое место в структуре питания больных РА занимают уг-леводы, при этом количество пищевых волокон в питании не превышает30% от нормы потребления. Количество потребляемого кальция ниже сред-нестатистической нормы в обеих группах, но несколько более выражено вгруппе больных РА. Обращает на себя внимание резкий недостаток в раци-оне магния, следствием чего может быть снижение метаболических реакцийорганизма. Недостаток в питании витаминов группы В и аскорбиновой кисло-ты присутствует в обеих группах, но у больных РА является более выражен-ным.
 Выводы: У больных РА отмечается несбалансированное питание с повы-шенным потреблением жиров и углеводов, диспропорции в структуре поли-ненасыщенных жиров, абсолютный недостаток в питании витаминов группыВ и аскорбиновой кислоты. В диетологических рекомендациях необходимомотивировать больных РА увеличит потребление рыбьего жира (1 ч.л. вдень), витаминов группы В (В-комплекс 1 таблетке в день), обогащать раци-он пищевыми волокнами (овсяные отруби) и аскорбиновой кислотой в по-рошке по 0,5 г в день.
Войналович-Ханова Ю.А.
СИНДРОМ РЕМОДЕЛИРОВАНИЯ МИОКАРДА-8(КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ)
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Современная терапевтическая практика строится на выполнении соот-ветствующих протоколов и стандартов лечения, регламентирующих выпол-нения тех или иных лечебно-диагностических мероприятий при соответству-ющих нозологиях, но выбор и принятие решений по лечебному процессу уконкретного больного остается за лечащим врачом, которому необходимы«ключевые» данные характеризующие патологический процесс и его тече-ние. Таким показателем в кардиологии, по нашему мнению, может быть кон-троль ремоделирования миокарда, особенно в динамике, на протяженииряда лет.Под нашим наблюдением 10-й год находится мужчина, 66 лет, продол-жающий выполнять работу служащего в полном объеме с удовлетворитель-ным качеством повседневной жизни. В анамнезе у него длительное течениеГБ с развитием кардиологического континуума с цепью кардиологическихсобытий:2003 г – 2 трансмуральных инфаркта в течение 4 месяцев с формирова-нием аневризмы сердца, преходящими нарушениями ритма (желудочковаяэкстрасистолия), застойной сердечной недостаточностью ХСН IIA ФК III, ста-бильной стенокардией II-III ФК с периодическими ухудшениями.2011г – 3 ИМ, по поводу, которого проводился системный тромболизис,КАГ и операция: Прямая реваскуляризация миокарда в условиях ИК (АКШаутовеной с ВТК ОВ ЛКА, ЗМЖ МКШ-ПМЖВ). В клинической картине заболе-вания присоединились явления легочной гипертензии и застоя в большомкруге кровообращения.Плановые госпитализации два раза в год в течение 2012 – 2013гг позво-лили стабилизировать гемодинамику. Легочная гипертензия исчезла, умень-шились явления сердечной недостаточности.Эхокардиография во время «Д» осмотра в марте 2014г показала продол-жение постинфарктного ремоделирования миокарда. Состояние после АКШ. Имеется аневризма верхушки ЛЖ. Дилатация левых отделов сердца. Атеро-склеротическое поражение АК и МК с краевым утолщением и фиброзом ство-рок, недостаточностью АК 1степени, МК 2-ой. Эксцентрическая гипертрофиямиокарда ЛЖ. ДДЛЖ I типа. Акинезия передних, переднеперегородочных иперегородочных сегментов с их рубцовыми изменениями. Фракция выбросасоставила 23%.Подробное описание клинического наблюдения за 2014 год представленопо адресу: http://visualrheumatology.ru/sindrom-remodelirovaniya-miokarda-8-klinicheskoe-nablyudenie.html. Больной направлен на стационарное лечениев связи с нарастанием явлений сердечной недостаточности.Обсуждение. Приверженность пациента к лечению и выполнение лечеб-но-диагностических стандартов в рамках национальных кардиологическихрекомендаций с персонифицируемой терапией конкретного больного поз-воляет реально продлить жизнь и сохранить ее качество для пациента. Регу-лярный, плановый УЗИ – контроль ремоделирования миокарда дает возмож-ность выбрать оптимальную терапию до появления выраженных клиническихпроявлений или осложнений основного заболевания. Полученные элекро-кардиографические данные могут служить основанием превентивной госпи-тализации пациента.
Выставкина Е.А., Неделько Г.Н.
ФАКТОРЫ РИСКА РАЗВИТИЯ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБУ РО «Областная клиническая больница №2», г. Ростов-на-Дону, Россия
Ревматоидный артрит (РА) является аутоиммунным заболеванием, харак-теризующимся развитием хронического деструктивного полиартрита с во-влечением в патологический процесс висцеральных систем организма. Фор-мирование внесуставных системных поражений при РА во многом определяеттяжесть и прогноз заболевания. Поражение почек при РА встречается с вы-сокой частотой — от 57 до 73%. Формирование нефропатии при РА носитмногофакторный характер, что представлено многообразием клинических иморфологических вариантов патологии при незначительных, неспецифиче-ских изменениях в анализах мочи. Несмотря на современные достижениянефрологии и ревматологии, при РА не все звенья патогенеза, а также фак-торы риска, модификация которых позволила бы снизить темпы прогресси-рования почечной патологии, хорошо изучены. В связи с вышеизложенным,Целью работы явилось разработать систему факторов риска нефропатии убольных РА с учетом ее значимости для прогрессирования патологии почек.Были обследованы 100 больных РА в возрасте от 20 до 78 лет (среднийвозраст 53,71,1 лет). Проведенное исследование представляло собой от-крытое сравнительное рандомизированное. Исходно при формировании кли-нической группы учитывали следующие критерии: возраст 18 лет и старше,верифицированный диагноз РА в соответствии с критериями Американской коллегии ревматологов (EULAR/ACR, 2010). Критериями исключения явилиськлинически значимые заболевания внутренних органов – умеренная и тяже-лая формы хронической недостаточности кровообращения, органическаяпатология почек, не связанная с РА, печеночная недостаточность, сахарныйдиабет, хроническая болезнь почек (ХБП) 4-5 стадии (СКФ ≤29мл/мин/1,73м2). Пациенты клинической группы были разделены на двегруппы на основании результатов комплексного клинического, лабораторно-го и инструментального исследования почек. В 1-ю группу объединили 64(64,0%) пациентов, у которых почечная дисфункция отсутствовала, а 2-югруппу составили 36 (36,0%) больных, у которых по результатам обследова-ния была выявлена почечная дисфункция. Сравнительную характеристикупоказателей пациентов клинической группы проводили в зависимости отуровня снижения скорости клубочковой фильтрации (СКФ) (СКФ≥90мл/мин/1,73м2, СКФ 60-89 мл/мин/1,73 м2 и СКФ 30-59 мл/мин/1,73м2),наличия или отсутствия микроальбуминурии (МАУ), протеинурии.Исследование функций почек включало выполнение общего анализа мо-чи, пробы Зимницкого, Нечипоренко; определение скорости клубочковойфильтрации по формулам Кокрофта-Гаулта и MDRD (Modification of Diet inRenal Disease Study), ультразвукового исследования почек. Кроме того, про-водили оценку наличия и выраженности МАУ, протеинурии. Биохимическоеисследование крови включало в себя определение общего белка, альбумина,преальбумина, креатинина, мочевой кислоты, соотношения альбу-мин/креатинин, общего холестерина, липопротеидов низкой плотности, вы-сокой плотности, триглицеридов, глюкозы.Частота ХБП среди больных РА составила 36% (n=36). Во 2-й группесреди пациентов с почечной дисфункцией 1-я стадия ХБП выявлялась у 5(13,9%), 2-я стадия – у 21 (58,3%) и 3-я стадия ХБП – у 10 (27,8%) боль-ных. В общем по группе МАУ наблюдали в 24% (n=24), а протеинурия выяв-лялась в 11% (n=11). У пациентов с РА снижение СКФ было сопряжено сповышением возраста, продолжительности РА, частотой высокой активностиРА, дозой глюкокортикоидов, развитием артериальной гипертензии, пульсо-вым АД, повышением С-реактивного белка, повышением индекса массы тела,холестерина крови и в некоторых пределах варьирования СКФ и глюкозыкрови.У больных РА трансрегрессионный анализ показателей в пределах 2 сигмпозволил выявить критические уровни величин, при достижении которыхриск почечной дисфункции при хроническом воспалительном заболеваниисуставов повышался. В результате было установлено, что снижение СКФ упациентов с РА происходило при превышении возраста более 53 лет, общегохолестерина крови более 5,4 ммоль/л, пульсового давления более 58 ммрт.ст. Построение таблиц сопряженности и расчет критерия согласия 2 поз-волил к факторам риска почечной дисфункции отнести также артериальнуюгипертензию (2=6,14, р<0,01) и высокую активность заболевания(2=5,05, р<0,01). Встречаемость факторов риска в зависимости от выра-женности снижения СКФ (более или менее 60 мл/мин/1,73 м2 ) у пациентовс РА отражена в табл. 2. Все факторы риска достоверно чаще встречались убольных при снижении СКФ ниже 60 мл/мин/1,73 м2. Наибольшая прогностическая значимость снижения СКФ у больных РАбыла отмечена в отношении повышения уровня холестерина крови более 5,4ммоль/л, продолжительности основного заболевания свыше 12 лет и нали-чия артериальной гипертензии (табл. 1).Развитие МАУ у больных РА было ассоциировано с повышением возраста(F=6,02, p<0,001), длительности основного заболевания (F=7,02, p<0,001),наличием III степени активности заболевания (F=5,04, p<0,01), артериаль-ной гипертензии (F=7,24, p<0,001, дозой глюкокортикоидов (F=5,37,p<0,05), повышением пульсового АД (F=7,24, p<0,001), общего холестерина(F=5,67, p<0,05) и глюкозы крови (F=4,03, p<0,05). Наиболее тесная зави-симость прослеживалась между выраженностью МАУ и возрастом больных,уровнем глюкозы крови, пульсовым давлением и продолжительностью РА.Развитие протеинурии у больных РА было сопряжено с длительностьюосновного заболевания (F=7,35, p<0,001), степенью активности процесса(F=6,13, p<0,001), встречаемостью приема глюкокортикоидов (F=5,97,p<0,001) и их дозой (F=5,93, p<0,001), наличием артериальной гипертензии(F=7,24, p<0,001), повышением пульсового давления (F=7,24, p<0,001),общего холестерина (F=6,05, p<0,05) и глюкозы крови (F=4,17, p<0,05).Таким образом, профиль факторов, способствующих развитию МАУ, был схо-ден со структурой факторов, обусловливающих протеинурию при РА. Одна-ко их влияние на потерю белка с мочой было более выраженным.Таким образом, у больных РА кроме исследования функционального со-стояния почек, необходимо с профилактической Целью проводить оценкутаких факторов риска как общий холестерин крови, системное артериальноедавление. При наличии факторов риска у пациентов с РА проведение свое-временных корректирующих схем позволит снизить риск развития почечнойпатологии.Изучение факторов риска почечной дисфункции у больных РА позволилозаключить, что развитие ХБП у пациентов было ассоциировано с целой си-стемой факторов риска, включающей возраст, продолжительность и актив-ность РА, наличие артериальной гипертензии, повышение пульсового АД иуровней холестерина и глюкозы крови.Таким образом, у больных РА, кроме исследования функционального со-стояния почек, необходимо учитывать анамнез основного заболевания,уровни общего холестерина крови, системного АД. Учитывая вышеуказан-ное, необходимо формировать группы повышенного риска почечной дис-функции при РА и наибольшую прогностическую значимость в этом отно-шении имеет высокая активность РА, его продолжительность, прием глюко-кортикоидов, артериальная гипертензия и ассоциация с атерогеннымидислипидемиями. У больных РА развитие ХБП и степень выраженности еепроявлений определяется длительностью и активностью основного заболе-вания, возрастом, наличием артериальной гипертензии, дислипидемией иповышением глюкозы крови. Факторами риска патологии почек при РА яв-ляются III степень активности заболевания, длительность РА более 12 лет,возраст более 53 лет, наличие артериальной гипертензии, гипергликемии, повышение пульсового давления выше 58 мм рт.ст., общего холестеринаболее 5,4 ммоль/л.
Гонтарь И.П., Парамонова О.В., Емельянова О.И.,Красильников А.Н., Зборовский А.Б.ХИМИЧЕСКИЕ СВОЙСТВА МОЛЕКУЛ ЛИПИДОВ – КАКОСНОВА ПОЛУЧЕНИЯ СТАБИЛЬНЫХ АНТИГЕННЫХНАНООБЪЕКТОВФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Современный этап развития науки характеризуется высоким темпом ро-ста нанотехнологий с использованием веществ и материалов размером отнескольких десятков до сотен нанометров. Правительством Российской Фе-дерации были утверждены (распоряжением от 7 июля 2011г № 1192-р) про-дукции наноиндустрии в случае, если она содержит составляющие характе-ристики и размер которых хотя бы в одном измерении находится в пределахот 1 до 100 нанометров (верхний предел определяется размерами белков,ДНК, биологических молекул и иных органических соединений). Одной изтаких сфер применения нанотехнологической продукции и является созда-ние медицинских препаратов, предназначенных для диагностики и леченияревматических заболеваний.Ревматические заболевания представляют собой хронический вялотеку-щий процесс, для которых характерно большое разнообразие форм и вариа-бельность темпов прогрессирования, в связи с чем и возникает необходи-мость изучения множества патогенетических иммунологических показателей.Обнаружение в сыворотке крови различных аутоантител может иметь боль-шое диагностическое значение. Кроме того, такие антитела обладают значи-тельным патогенным действием, и их удаление из организма оказывает бла-гоприятное лечебное воздействие на течение основного заболевания.На основе интеграции антигенных нанообъектов, нами были созданы иапробированы иммобилизированные магнитоуправляемые антигенные нано-системы (АНС). Они представляют собой полиакриламидные гранулы свключенным в их структуру антигеном. Нанообъектами мы называем химиче-ские группы, которые формируют активные центры ферментов, антигенныедетерминанты, клеточные рецепторы и.т.д. Наиболее интересным в этом от-ношении нам представляется, как модель, антигенный препарат – кардиоли-пин. Кардиолипин – фосфолипид, структурный компонент внутренней мем-браны клетки и митохондрий, построенный на основе глицерола и остатковфосфатидной кислоты. Кардиолипин может обладать антигенными свойства-ми. Они заключены в гидрофильной, а не в гидрофобной части молекулы.Формула кардиолипина С81Н152О17Р2. Схема его структурной формулыможет быть представлена в виде параллелепипеда. Учитывая длины связей С – С-0,154нм; C = C – 0,133нм; С – Н – 0,112; С = О – 0,123нм (Н.А. Тюкав-кина, Ю.И. Баюков, 1985) можно примерно вычислить объем молекулы кар-диолипина, представленной по первичной структуре, размер которого V=а хв х с, V= 2,772 х 0,154 х 1,034 = 0,4414 нм3, что соответствует определе-нию нанообъектов, как частиц, размерами менее 100нм.Для получения стабильных иммобилизированных биопрепаратов много-кратного применения с заданными свойствами (формой, диаметром частиц,размером пор, плотностью) мы использовали метод эмульсионной полимери-зации в наших модификациях с использованием полиакриламидного геля вкачестве носителя. Данный метод позволил существенно увеличить сорбци-онную емкость, сохранить антиген в максимально нативном состоянии и от-крыл возможности контролируемого модифицирования.Существует несколько методических подходов для использования кар-диолипина в качестве антигена в иммунологических реакциях, от хаотичнойиммобилизации до пространственно-ориентированной. Один из способоввключения кардиолипинового антигена на основе ИГАП заключается в том,что предварительно полученные, высушенные, обезвоженные полиакрила-мидные гранулы с включенными ферромагнитными материалами помещали вспиртовой раствор кардиолипинового антигена. После инкубации, получен-ные гранулы приобретали шаровидную форму и переносили в гидрофильнуюфазу. Полученный, таким образом, кардиолипиновый антиген находился всвободном состоянии и его фиксация в гранулах была только за счет элек-тростатических Вандервальсовских сил и т.п. Концентрацию антигена (липи-дов) определяли по Лазарову (табл1).Существует еще один из способов получения кардиолипинового иммуно-сорбента путем связывания полиакриламидного носителя с антигеном, сме-шанным с раствором полиметилметакрилата в хлороформе в соотношении1:1 и выделения целевого продукта, отличающейся тем, что в качестве носи-теля используют гранулированный полиакриламидный гель с концентрациейпоперечносшивающего агента 25% и с включением в него 10%-ным оксидомжелеза. Концентрированный кардиолипиновый антиген получали из коммер-ческого препарата «Кардиолипиновый антиген для реакции микропреципи-тации» (Харьков, сер.2951-5К-122, годность 3,88 лет). Три ампулы по 2 млраствора кардиолипина в абсолютном этаноле концентрировали до полногоиспарения в термостате при 37Со в течении 48ч. Приготовленный концен-трированный кардиолипиновый антиген в количестве 28 мг, вносили в 2 мл0,5%-ного раствора полиметилметакрилата в хлороформе, доводя концен-трацию липидов до 14 мг/мл, т.е. по сравнению с исходной концентрациейпроизошло концентрирование липидов в три раза. Полученный раствор сме-шивали с полиакриламидными гранулами в соотношении 1:1. Суспензиюинкубировали в течение 3 ч на магнитной мешалке в термостате при 37Со.После инкубации пропитанные в растворе антигена полиариламидные гра-нулы вносили в 10 мл воды и энергично встряхивали для получения эмуль-сии вода/хлороформ. В пробирку с суспензией подавали газообразный азотпод давлением 0,5 атмосфер по трубке с сечением 0,5 мл. таким образом,чтобы создать интенсивное перемешивание в течение 15 мин. Пробирку по-степенно нагревали на водяной бане до температуры кипения хлороформа(60 Со) до его полного испарения. После исчезновения запаха хлороформа в растворе определялась концентрация несвязанных липидов, которая соста-вила 5 мг/мл., т.е. в носитель включалось 23 мг кардиолипина (табл 2).
Выводы: У больных РА отмечается несбалансированное питание с повы-шенным потреблением жиров и углеводов, диспропорции в структуре поли-ненасыщенных жиров, абсолютный недостаток в питании витаминов группыВ и аскорбиновой кислоты. В диетологических рекомендациях необходимомотивировать больных РА увеличит потребление рыбьего жира (1 ч.л. вдень), витаминов группы В (В-комплекс 1 таблетке в день), обогащать раци-он пищевыми волокнами (овсяные отруби) и аскорбиновой кислотой в по-рошке по 0,5 г в день.
Войналович-Ханова Ю.А.
СИНДРОМ РЕМОДЕЛИРОВАНИЯ МИОКАРДА-8(КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ)
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Современная терапевтическая практика строится на выполнении соот-ветствующих протоколов и стандартов лечения, регламентирующих выпол-нения тех или иных лечебно-диагностических мероприятий при соответству-ющих нозологиях, но выбор и принятие решений по лечебному процессу уконкретного больного остается за лечащим врачом, которому необходимы«ключевые» данные характеризующие патологический процесс и его тече-ние. Таким показателем в кардиологии, по нашему мнению, может быть кон-троль ремоделирования миокарда, особенно в динамике, на протяженииряда лет.Под нашим наблюдением 10-й год находится мужчина, 66 лет, продол-жающий выполнять работу служащего в полном объеме с удовлетворитель-ным качеством повседневной жизни. В анамнезе у него длительное течениеГБ с развитием кардиологического континуума с цепью кардиологическихсобытий:2003 г – 2 трансмуральных инфаркта в течение 4 месяцев с формирова-нием аневризмы сердца, преходящими нарушениями ритма (желудочковаяэкстрасистолия), застойной сердечной недостаточностью ХСН IIA ФК III, ста-бильной стенокардией II-III ФК с периодическими ухудшениями.2011г – 3 ИМ, по поводу, которого проводился системный тромболизис,КАГ и операция: Прямая реваскуляризация миокарда в условиях ИК (АКШаутовеной с ВТК ОВ ЛКА, ЗМЖ МКШ-ПМЖВ). В клинической картине заболе-вания присоединились явления легочной гипертензии и застоя в большомкруге кровообращения.Плановые госпитализации два раза в год в течение 2012 – 2013гг позво-лили стабилизировать гемодинамику. Легочная гипертензия исчезла, умень-шились явления сердечной недостаточности.Эхокардиография во время «Д» осмотра в марте 2014г показала продол-жение постинфарктного ремоделирования миокарда. Состояние после АКШ. Имеется аневризма верхушки ЛЖ. Дилатация левых отделов сердца. Атеро-склеротическое поражение АК и МК с краевым утолщением и фиброзом ство-рок, недостаточностью АК 1степени, МК 2-ой. Эксцентрическая гипертрофиямиокарда ЛЖ. ДДЛЖ I типа. Акинезия передних, переднеперегородочных иперегородочных сегментов с их рубцовыми изменениями. Фракция выбросасоставила 23%.Подробное описание клинического наблюдения за 2014 год представленопо адресу: http://visualrheumatology.ru/sindrom-remodelirovaniya-miokarda-8-klinicheskoe-nablyudenie.html. Больной направлен на стационарное лечениев связи с нарастанием явлений сердечной недостаточности.Обсуждение. Приверженность пациента к лечению и выполнение лечеб-но-диагностических стандартов в рамках национальных кардиологическихрекомендаций с персонифицируемой терапией конкретного больного поз-воляет реально продлить жизнь и сохранить ее качество для пациента. Регу-лярный, плановый УЗИ – контроль ремоделирования миокарда дает возмож-ность выбрать оптимальную терапию до появления выраженных клиническихпроявлений или осложнений основного заболевания. Полученные элекро-кардиографические данные могут служить основанием превентивной госпи-тализации пациента.
Выставкина Е.А., Неделько Г.Н.
ФАКТОРЫ РИСКА РАЗВИТИЯ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
ГБУ РО «Областная клиническая больница №2», г. Ростов-на-Дону, Россия
Ревматоидный артрит (РА) является аутоиммунным заболеванием, харак-теризующимся развитием хронического деструктивного полиартрита с во-влечением в патологический процесс висцеральных систем организма. Фор-мирование внесуставных системных поражений при РА во многом определяеттяжесть и прогноз заболевания. Поражение почек при РА встречается с вы-сокой частотой — от 57 до 73%. Формирование нефропатии при РА носитмногофакторный характер, что представлено многообразием клинических иморфологических вариантов патологии при незначительных, неспецифиче-ских изменениях в анализах мочи. Несмотря на современные достижениянефрологии и ревматологии, при РА не все звенья патогенеза, а также фак-торы риска, модификация которых позволила бы снизить темпы прогресси-рования почечной патологии, хорошо изучены. В связи с вышеизложенным,Целью работы явилось разработать систему факторов риска нефропатии убольных РА с учетом ее значимости для прогрессирования патологии почек.Были обследованы 100 больных РА в возрасте от 20 до 78 лет (среднийвозраст 53,71,1 лет). Проведенное исследование представляло собой от-крытое сравнительное рандомизированное. Исходно при формировании кли-нической группы учитывали следующие критерии: возраст 18 лет и старше,верифицированный диагноз РА в соответствии с критериями Американской коллегии ревматологов (EULAR/ACR, 2010). Критериями исключения явилиськлинически значимые заболевания внутренних органов – умеренная и тяже-лая формы хронической недостаточности кровообращения, органическаяпатология почек, не связанная с РА, печеночная недостаточность, сахарныйдиабет, хроническая болезнь почек (ХБП) 4-5 стадии (СКФ ≤29мл/мин/1,73м2). Пациенты клинической группы были разделены на двегруппы на основании результатов комплексного клинического, лабораторно-го и инструментального исследования почек. В 1-ю группу объединили 64(64,0%) пациентов, у которых почечная дисфункция отсутствовала, а 2-югруппу составили 36 (36,0%) больных, у которых по результатам обследова-ния была выявлена почечная дисфункция. Сравнительную характеристикупоказателей пациентов клинической группы проводили в зависимости отуровня снижения скорости клубочковой фильтрации (СКФ) (СКФ≥90мл/мин/1,73м2, СКФ 60-89 мл/мин/1,73 м2 и СКФ 30-59 мл/мин/1,73м2),наличия или отсутствия микроальбуминурии (МАУ), протеинурии.Исследование функций почек включало выполнение общего анализа мо-чи, пробы Зимницкого, Нечипоренко; определение скорости клубочковойфильтрации по формулам Кокрофта-Гаулта и MDRD (Modification of Diet inRenal Disease Study), ультразвукового исследования почек. Кроме того, про-водили оценку наличия и выраженности МАУ, протеинурии. Биохимическоеисследование крови включало в себя определение общего белка, альбумина,преальбумина, креатинина, мочевой кислоты, соотношения альбу-мин/креатинин, общего холестерина, липопротеидов низкой плотности, вы-сокой плотности, триглицеридов, глюкозы.Частота ХБП среди больных РА составила 36% (n=36). Во 2-й группесреди пациентов с почечной дисфункцией 1-я стадия ХБП выявлялась у 5(13,9%), 2-я стадия – у 21 (58,3%) и 3-я стадия ХБП – у 10 (27,8%) боль-ных. В общем по группе МАУ наблюдали в 24% (n=24), а протеинурия выяв-лялась в 11% (n=11). У пациентов с РА снижение СКФ было сопряжено сповышением возраста, продолжительности РА, частотой высокой активностиРА, дозой глюкокортикоидов, развитием артериальной гипертензии, пульсо-вым АД, повышением С-реактивного белка, повышением индекса массы тела,холестерина крови и в некоторых пределах варьирования СКФ и глюкозыкрови.У больных РА трансрегрессионный анализ показателей в пределах 2 сигмпозволил выявить критические уровни величин, при достижении которыхриск почечной дисфункции при хроническом воспалительном заболеваниисуставов повышался. В результате было установлено, что снижение СКФ упациентов с РА происходило при превышении возраста более 53 лет, общегохолестерина крови более 5,4 ммоль/л, пульсового давления более 58 ммрт.ст. Построение таблиц сопряженности и расчет критерия согласия 2 поз-волил к факторам риска почечной дисфункции отнести также артериальнуюгипертензию (2=6,14, р<0,01) и высокую активность заболевания(2=5,05, р<0,01). Встречаемость факторов риска в зависимости от выра-женности снижения СКФ (более или менее 60 мл/мин/1,73 м2 ) у пациентовс РА отражена в табл. 2. Все факторы риска достоверно чаще встречались убольных при снижении СКФ ниже 60 мл/мин/1,73 м2. Наибольшая прогностическая значимость снижения СКФ у больных РАбыла отмечена в отношении повышения уровня холестерина крови более 5,4ммоль/л, продолжительности основного заболевания свыше 12 лет и нали-чия артериальной гипертензии (табл. 1).Развитие МАУ у больных РА было ассоциировано с повышением возраста(F=6,02, p<0,001), длительности основного заболевания (F=7,02, p<0,001),наличием III степени активности заболевания (F=5,04, p<0,01), артериаль-ной гипертензии (F=7,24, p<0,001, дозой глюкокортикоидов (F=5,37,p<0,05), повышением пульсового АД (F=7,24, p<0,001), общего холестерина(F=5,67, p<0,05) и глюкозы крови (F=4,03, p<0,05). Наиболее тесная зави-симость прослеживалась между выраженностью МАУ и возрастом больных,уровнем глюкозы крови, пульсовым давлением и продолжительностью РА.Развитие протеинурии у больных РА было сопряжено с длительностьюосновного заболевания (F=7,35, p<0,001), степенью активности процесса(F=6,13, p<0,001), встречаемостью приема глюкокортикоидов (F=5,97,p<0,001) и их дозой (F=5,93, p<0,001), наличием артериальной гипертензии(F=7,24, p<0,001), повышением пульсового давления (F=7,24, p<0,001),общего холестерина (F=6,05, p<0,05) и глюкозы крови (F=4,17, p<0,05).Таким образом, профиль факторов, способствующих развитию МАУ, был схо-ден со структурой факторов, обусловливающих протеинурию при РА. Одна-ко их влияние на потерю белка с мочой было более выраженным.Таким образом, у больных РА кроме исследования функционального со-стояния почек, необходимо с профилактической Целью проводить оценкутаких факторов риска как общий холестерин крови, системное артериальноедавление. При наличии факторов риска у пациентов с РА проведение свое-временных корректирующих схем позволит снизить риск развития почечнойпатологии.Изучение факторов риска почечной дисфункции у больных РА позволилозаключить, что развитие ХБП у пациентов было ассоциировано с целой си-стемой факторов риска, включающей возраст, продолжительность и актив-ность РА, наличие артериальной гипертензии, повышение пульсового АД иуровней холестерина и глюкозы крови.Таким образом, у больных РА, кроме исследования функционального со-стояния почек, необходимо учитывать анамнез основного заболевания,уровни общего холестерина крови, системного АД. Учитывая вышеуказан-ное, необходимо формировать группы повышенного риска почечной дис-функции при РА и наибольшую прогностическую значимость в этом отно-шении имеет высокая активность РА, его продолжительность, прием глюко-кортикоидов, артериальная гипертензия и ассоциация с атерогеннымидислипидемиями. У больных РА развитие ХБП и степень выраженности еепроявлений определяется длительностью и активностью основного заболе-вания, возрастом, наличием артериальной гипертензии, дислипидемией иповышением глюкозы крови. Факторами риска патологии почек при РА яв-ляются III степень активности заболевания, длительность РА более 12 лет,возраст более 53 лет, наличие артериальной гипертензии, гипергликемии, повышение пульсового давления выше 58 мм рт.ст., общего холестеринаболее 5,4 ммоль/л.
Гонтарь И.П., Парамонова О.В., Емельянова О.И.,Красильников А.Н., Зборовский А.Б.ХИМИЧЕСКИЕ СВОЙСТВА МОЛЕКУЛ ЛИПИДОВ – КАКОСНОВА ПОЛУЧЕНИЯ СТАБИЛЬНЫХ АНТИГЕННЫХНАНООБЪЕКТОВФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Современный этап развития науки характеризуется высоким темпом ро-ста нанотехнологий с использованием веществ и материалов размером отнескольких десятков до сотен нанометров. Правительством Российской Фе-дерации были утверждены (распоряжением от 7 июля 2011г № 1192-р) про-дукции наноиндустрии в случае, если она содержит составляющие характе-ристики и размер которых хотя бы в одном измерении находится в пределахот 1 до 100 нанометров (верхний предел определяется размерами белков,ДНК, биологических молекул и иных органических соединений). Одной изтаких сфер применения нанотехнологической продукции и является созда-ние медицинских препаратов, предназначенных для диагностики и леченияревматических заболеваний.Ревматические заболевания представляют собой хронический вялотеку-щий процесс, для которых характерно большое разнообразие форм и вариа-бельность темпов прогрессирования, в связи с чем и возникает необходи-мость изучения множества патогенетических иммунологических показателей.Обнаружение в сыворотке крови различных аутоантител может иметь боль-шое диагностическое значение. Кроме того, такие антитела обладают значи-тельным патогенным действием, и их удаление из организма оказывает бла-гоприятное лечебное воздействие на течение основного заболевания.На основе интеграции антигенных нанообъектов, нами были созданы иапробированы иммобилизированные магнитоуправляемые антигенные нано-системы (АНС). Они представляют собой полиакриламидные гранулы свключенным в их структуру антигеном. Нанообъектами мы называем химиче-ские группы, которые формируют активные центры ферментов, антигенныедетерминанты, клеточные рецепторы и.т.д. Наиболее интересным в этом от-ношении нам представляется, как модель, антигенный препарат – кардиоли-пин. Кардиолипин – фосфолипид, структурный компонент внутренней мем-браны клетки и митохондрий, построенный на основе глицерола и остатковфосфатидной кислоты. Кардиолипин может обладать антигенными свойства-ми. Они заключены в гидрофильной, а не в гидрофобной части молекулы.Формула кардиолипина С81Н152О17Р2. Схема его структурной формулыможет быть представлена в виде параллелепипеда. Учитывая длины связей С – С-0,154нм; C = C – 0,133нм; С – Н – 0,112; С = О – 0,123нм (Н.А. Тюкав-кина, Ю.И. Баюков, 1985) можно примерно вычислить объем молекулы кар-диолипина, представленной по первичной структуре, размер которого V=а хв х с, V= 2,772 х 0,154 х 1,034 = 0,4414 нм3, что соответствует определе-нию нанообъектов, как частиц, размерами менее 100нм.Для получения стабильных иммобилизированных биопрепаратов много-кратного применения с заданными свойствами (формой, диаметром частиц,размером пор, плотностью) мы использовали метод эмульсионной полимери-зации в наших модификациях с использованием полиакриламидного геля вкачестве носителя. Данный метод позволил существенно увеличить сорбци-онную емкость, сохранить антиген в максимально нативном состоянии и от-крыл возможности контролируемого модифицирования.Существует несколько методических подходов для использования кар-диолипина в качестве антигена в иммунологических реакциях, от хаотичнойиммобилизации до пространственно-ориентированной. Один из способоввключения кардиолипинового антигена на основе ИГАП заключается в том,что предварительно полученные, высушенные, обезвоженные полиакрила-мидные гранулы с включенными ферромагнитными материалами помещали вспиртовой раствор кардиолипинового антигена. После инкубации, получен-ные гранулы приобретали шаровидную форму и переносили в гидрофильнуюфазу. Полученный, таким образом, кардиолипиновый антиген находился всвободном состоянии и его фиксация в гранулах была только за счет элек-тростатических Вандервальсовских сил и т.п. Концентрацию антигена (липи-дов) определяли по Лазарову (табл1).Существует еще один из способов получения кардиолипинового иммуно-сорбента путем связывания полиакриламидного носителя с антигеном, сме-шанным с раствором полиметилметакрилата в хлороформе в соотношении1:1 и выделения целевого продукта, отличающейся тем, что в качестве носи-теля используют гранулированный полиакриламидный гель с концентрациейпоперечносшивающего агента 25% и с включением в него 10%-ным оксидомжелеза. Концентрированный кардиолипиновый антиген получали из коммер-ческого препарата «Кардиолипиновый антиген для реакции микропреципи-тации» (Харьков, сер.2951-5К-122, годность 3,88 лет). Три ампулы по 2 млраствора кардиолипина в абсолютном этаноле концентрировали до полногоиспарения в термостате при 37Со в течении 48ч. Приготовленный концен-трированный кардиолипиновый антиген в количестве 28 мг, вносили в 2 мл0,5%-ного раствора полиметилметакрилата в хлороформе, доводя концен-трацию липидов до 14 мг/мл, т.е. по сравнению с исходной концентрациейпроизошло концентрирование липидов в три раза. Полученный раствор сме-шивали с полиакриламидными гранулами в соотношении 1:1. Суспензиюинкубировали в течение 3 ч на магнитной мешалке в термостате при 37Со.После инкубации пропитанные в растворе антигена полиариламидные гра-нулы вносили в 10 мл воды и энергично встряхивали для получения эмуль-сии вода/хлороформ. В пробирку с суспензией подавали газообразный азотпод давлением 0,5 атмосфер по трубке с сечением 0,5 мл. таким образом,чтобы создать интенсивное перемешивание в течение 15 мин. Пробирку по-степенно нагревали на водяной бане до температуры кипения хлороформа(60 Со) до его полного испарения. После исчезновения запаха хлороформа в растворе определялась концентрация несвязанных липидов, которая соста-вила 5 мг/мл., т.е. в носитель включалось 23 мг кардиолипина (табл 2).
 Выводы. Используя различия гидрофобных и гидрофильных частей мо-лекулы кардиолипина и новый метод иммобилизации с использованием по-лиакриламидного геля в качестве носителя, можно получать стабильные,пространственно-ориентированные, гранулированные с магнитными свой-ствами нанообъекты с последующим применением их в диагностике и лече-нии больных ревматическими заболеваниями.
Гонтарь И.П., Трофименко А.С., Красильников А.Н.,Симакова Е.С., Зборовский А.Б.
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ЭКСТРАКОРПОРАЛЬНОЙ СОРБЦИИ ФАКТОРА НЕКРОЗА ОПУХОЛИ С ПОМОЩЬЮ МАГНИТОУПРАВЛЯЕМЫХ ГРАНУЛ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград
Известно, что ведущим звеном патогенеза многих аутоиммунных заболе-ваний, включая ревматоидный артрит (РА), является активация клеточногоиммунитета с поляризацией по Th1-типу. Одним из главных механизмов про-грессирования РА считается гиперпродукция антигенпрезентирующими клет-ками и активированными лимфоцитами большого числа провоспалительныхцитокинов, которые, в свою очередь, инициируют каскад иммунопатологиче-ских реакций, приводящих к воспалению и костной деструкции. Среди этихцитокинов центральную роль в процессе усиления провоспалительного ци-токинового сигнала и, тем самым, в прогрессировании РА, в настоящее времяотводят фактору некроза опухоли (ФНО), также называемому ФНО-. Онсинтезируется в организме в двух биологически активных гомотримерныхформах – трансмембранной и растворимой, образующейся из первой поддействием ФНО-конвертазы. Трансмембранный ФНО экспрессируется на Т- иВ-лимфоцитах, а также на антигенпрезентирующих клетках. Связываниеобеих активных форм ФНО с рецептором инициирует высвобождение другихпровоспалительных медиаторов и молекул адгезии.В настоящее время для лечения РА широко используется введение инги-биторов ФНО: моноклональных антител к ФНО либо химерных молекул наоснове анти-ФНО-Fc-фрагментов IgG или рецепторов ФНО. Для всех этихпрепаратов убедительно показан выраженный положительный лечебныйэффект: быстрое снижение активности заболевания, а также значительноезамедление деструкции суставов. Несмотря на то, что препараты этого клас-са существенно отличаются по степени ингибирования трансмембранногоФНО и по комплементзависимой цитотоксичности в отношении иммуноцитовпериферической крови, показано, что клиническая эффективность у нихсходная. Однако существующие ингибиторы ФНО обладают большим количе-ством побочных эффектов, связанных с введением иммуногенных молекул ворганизм пациента (синтез антител к ингибиторам ФНО, частые аллергиче-ские и инфузионные реакции). Кроме того, высокая стоимость имеющихся внастоящее время препаратов значительно ограничивает их применение.Вследствие этого удобным инструментом подавления активности ФНО приаутоиммунных заболеваниях является сорбция растворимого ФНО и ФНО-экспрессирующих клеток крови с помощью антительных магнитоуправляе-мых гранул.Целью исследования являлось определение эффективности сорбциирастворимой формы ФНО из изолированной крови больных РА in vitro, используя в качестве сорбента антитела к ФНО, иммобилизированные на маг-нитоуправляемых полиакриламидных гранулах (МПГ).Методы: МПГ получали по методу эмульсионной полимеризации в потокегазообразного азота в модификации И.П. Гонтаря и соавт. (2008). Для МПГ симмобилизированными антителами к ФНО, полученных согласно примеру 1,определяли удельную сорбционную емкость. С этой Целью через мини-колонку с объемом рабочей камеры 0,2 мл, заполненную МПГ, пропускалирастворы ФНО (1 мл) с возрастающими концентрациями, после перфузиикаждого раствора МПГ заменяли, контур промывали 1 М глицин-HCl буфе-ром, рН 2,2 и стандартным фосфатно-солевым буферным раствором. Концен-трацию ФНО в пропущенных через МПГ растворах определяли методом ИФАс использованием коммерческих наборов (Вектор-Бест, Россия).Нативную гепaринизированную кровь для перфузии получали от 10больных ревматоидным артритом различной степени активности, которым втечение последних 12 месяцев не проводилось парентеральное введениеингибиторов ФНО, при наличии информированного согласия. В колонку объ-емом 10 мл, оборудованную электромагнитом, вносили МПГ с иммобилизиро-ванными антителами к ФНО. Через колонку перфузировали 20 мл крови соскоростью 10 мл/ч. В качестве контроля выступала кровь 10 здоровых доно-ров, процедура перфузии была аналогичной. После ее окончания МПГ отмы-вали от несвязавшихся белков забуференным физиологическим растворомрН 7,4 и проводили регенерацию 1 М глицин-HCl буфером рН 2,2 двукратнопо 10 мин. Концентрацию ФНО плазмы крови определяли методом ИФА сиспользованием коммерческих наборов (Вектор-Бест, Россия), также оцени-вали содержание форменных элементов крови (эритроцитов, лейкоцитов,тромбоцитов). Значения всех исследуемых показателей для каждого образцаизмеряли двукратно – до и после перфузии. Центральную тенденцию и ва-риабельность рассчитывали как среднее арифметическое (95% доверитель-ный интервал), различия считали статистически значимыми при p < 0,05.Результаты: При изучении растворов ФНО с исходными концентрациями0.5, 1, 5, 10, 25, 50, 75 пг/мл после перфузии через МПГ ФНО не определял-ся. В растворе ФНО с исходной концентрацией 100 пг/мл конечная концен-трация ФНО составила 3,4 пг/мл. Следовательно, сорбционная емкость МПГсоставила 483 пг ФНО/мл сорбента.В результате перфузии концентрация ФНО плазмы крови здоровых лицуменьшилась с 1,06 (0,0-2,95) пг/мл до 0,02 (0,00-0,05) пг/мл (р < 0,001;парный критерий Стьюдента), у больных РА – с 21,40 (9,92-32,88) пг/мл до0,03 (0,00-0,06) пг/мл (р < 0,001; парный критерий Стьюдента). Из указан-ных значений следует, что при перфузии через комбинированный сорбентдостигается статистически значимое снижение содержания ФНО на 98,1%(для здоровых лиц) и на 99,9% (для больных РА) от исходного. Содержаниеформенных элементов крови изменялось незначительно: для эритроцитов – с3,7 (2,5-4,9) до 3,8 (2,3-5,3) , 1012 л-1 (р = 0,940; парный критерий Стью-дента), для лейкоцитов – с 4,7 (2,8-6,6) до 4,0 (1,9-6,1) , 109 л-1 (р =0,303; парный критерий Стьюдента), для тромбоцитов – с 270,9 (184,4-357,4) до 252,0 (200,6-303,4) , 109 л-1 (р = 0,281; парный критерий Стью-дента) После использования МПГ регенерировали 1 М глицин-HCl буфером, рН2,2. После первой регенерации потеря сорбционной емкости составила 14%.При последующих повторных регенерациях (9 раз) статистически значимыхизменений удельной сорбционной емкости не происходило.Обсуждение: Предложенный нами метод имеет значительные преиму-щества перед существующими способами экстракорпоральной сорбции ФНО,лигандом которого служат либо 2-макроглобулин, обработанный протеоли-тическими ферментами или первичными аминами [Бондарев И.Э. с соавт..1995], либо полистиролсульфоновая кислота [Hirai F. et al., 1996]. В обоихслучаях используется ковалентная иммобилизация, которая, как правило,препятствует получению сорбентов с высокой емкостью. Кроме того, носите-ли не является магнитоуправляемыми, что затрудняет удержание сорбента всорбционной колонке без специальных фильтров, а применение последнихобычно приводит к травматизации форменных элементов. Наконец, ввидунестабильности третичной структуры 2-макроглобулина регенерация такогосорбента обычно затруднена, а весьма высокая стоимость очищенного чело-веческого 2-макроглобулина приводит к нерентабельности использованияодноразового сорбента.Выводы: таким образом, предложенный нами метод способен эффектив-но и практически полностью сорбировать растворимую форму ФНО, что яв-ляется одним из важнейших условий обеспечения противовоспалительногоэффекта. При этом признаков травматизации форменных элементов кровипри перфузии in vitro выявлено не было.
Горбанёв Е.А., Левитан Б.Н.
АРТИКУЛЯРНЫЕ МАНИФЕСТАЦИИ ДИСЛИПИДЕМИЙ ИКСАНТОМАТОЗА
ГБОУ ВПО Астраханская государственная медицинская академия, Астрахань
азделе XII выделены «артропатии при неревматических заболеваниях (дру-гих заболеваниях)» как метаболические нарушения, связанные с гиперлипи-демией. «Артропатии при других заболеваниях», как показывает название,являются вторичными по отношению к основным болезням, перечисленным вразделе XII, которые диагностируются и лечатся специалистами соответ-ствующего профиля при участии ревматологов, осуществляющих лишь диа-гностику и лечение вторичного суставного синдрома. Однако ревматологнередко впервые сталкивается с таким больным и должен правильно опре-делить диагностическую и терапевтическую тактику (Руководство по клини-ческой ревматологии).Малая осведомленность практикующих врачей и научных сотрудников овзаимосвязи артикулярных изменений с эссенциальной ГЛП (гипербеталипо-протеидемией) служит причиной ошибочной диагностики острой ревматической лихорадки, ревматического артрита и порока сердца, ревматоидного иподагрического артрита (вторичная подагра, гиперурикемия).Целью данного сообщения явился анализ причин диагностических оши-бок у больных с артропатиями при эссенциальной гиперлипидемии (ЭГЛ) иксантоматозе. Материалом послужил анализ литературных и собственныхклинических описаний случаев гипердиагностики ревматической лихорадкипри дислипидемии и ксантоматозе.Локализация суставных изменений при дислипидемии по частоте: колен-ные суставы (гонартрит), локтевые, мелкие периферические суставы, голе-ностопные суставы. Суставные проявления дислипидемий могут характери-зоваться: артралгиями, артритом (моно- олигоартрит). Рецидивирующим ми-грирующим, острым или хроническим полиартритом (периартритом), тенди-нитом ахиллова сухожилия, синовитом, сухожильными и туберозными (бу-горчатыми) ксантомами. Бугорчатые ксантомные изменения суставов наибо-лее часто принимают за «ревматические», или связанные с деформирующимартрозом. Туберозные (бугорчатые) ксантомы представляют собой узлы жел-товатого цвета с гладкой поверхностью размером до нескольких сантимет-ров, плотной консистенции, иногда напоминающие хондромы. Они распола-гаются изолированно или группами на разгибательной поверхности кистейрук, стоп, в области локтевых суставов, на задней поверхности коленныхсуставов, на ягодицах. Туберозные ксантомы часты при 2,3 типе дислипиде-мии, имеют хроническое течение, не всегда обратимы при лечении.Дифференциальный диагноз изолированных туберозных ксантом можнопроводить с суставными изменениями при остеоартрозе, при локализации намежфаланговых суставах кистей рук – с узелками Гебердена, Бушара; сфиброзным диатезом (подушки Гаррода); с хондромами (хрящевыми образо-ваниями); с кистами, содержащими фиброзную ткань (фибромы). Суставныеизменения у некоторых больных сопровождаются лихорадкой, повышениемСОЭ, увеличением концентрации фибриногена в крови, возрастанием титраАСЛ «О» (связано с инактивацией стрептолизина бета- ЛП), положительнымлатекс-тестом (взаимодействие между ЛП и гамма-глобулинами приводит кагглютинации частиц латекса). По данным литературы, «ревматические»изменения длительно сохраняются при дислипидемии и способствуют псев-додиагностике ревматизма (острой ревматической лихорадке) до тех пор,пока не будет обнаружен высокий уровень общего холестерина в плазмекрови (300-600 мг% – 8-16 мм/л и выше) или ХС ЛПНП, триглицеридов.Синовиальная жидкость обнаруживается в небольшом количестве, чащеимеет механический не воспалительный характер, концентрация холестери-на в ней не повышена (по другим данным – повышена). По данным литера-туры в синовиальной жидкости обнаруживаются крупные липофаги, ксан-томные клетки (с многочисленными ядрами) – синовиальный ксантоматоз.При морфологическом исследовании синовиальной оболочки обнаружи-вали (не всегда) отложения кристаллов мочевой кислоты, а при электронно-микроскопическом исследовании – не только инфильтрацию липидами, но имикрокристаллы, напоминающие апатитные, в митохондриях синовиоцитов.Патогенез отложения микрокристаллов в митохондриях остается неясным. Подобные отложения описаны при липидных тезаурисмозах (болезнях Гоше,Фабри). В ряде случаев суставные проявления могли иметь мочекислую при-роду. Это сближает дислипидемию 2 типа с 4 типом, при которой часты по-дагрические проявления. Микрокристаллическая гипотеза объединяет этиполиартриты: отложения липидов способствуют преципитации апатитов вмитохондриях.Наиболее часто суставные проявления наблюдаются при гомозиготнойформе семейного гиперхолестеринемичекого сухожильного ксантоматоза(СГСК) с дислипидемией 2 типа. При гомозиготной форме мигрирующий по-лиартрит поражает большие суставы – является одним из часто встречаемыхклинических проявлений. Суставные приступы имеют непостоянную продол-жительность и интенсивность, по несколько дней, объективные измененияпочти незаметны, или теплота, покраснение, припухлость и боль сустававызывают нарушение функции, которая продолжается около месяца. В неко-торых случаях, суставная припухлость симметрична, захватывая сустав ипериартикулярную ткань, а в других случаях наблюдается только односто-роннее поражение сустава. Частота приступов от 4- до 12 раз в год, иногдаих разделяют целые годы. Повторяющиеся приступы не вызывают деформа-ции или анкилозирования сустава. Иногда суставные атаки локализуются наахилловом сухожилии, или теносиновитами с различной локализацией. Ар-тикулярные приступы не сопровождаются лихорадкой, лейкоцитозом илисистемными проявлениями, проходят самопроизвольно, в течение 48-72 ча-сов, без лечения, в других случаях тянутся долго, до 30 дней. Взаимосвязи суровнем холестерина плазмы крови не отмечается и между артритами. Се-мейный анамнез позволяет правильно определить характер данного сустав-ного синдрома. Липидограмма уточняет диагноз, тип дислипидемии.При гетерозиготной форме СГСК, частота суставных проявлений значи-тельно ниже, ксантоматоз непостоянный, суставные изменения возникаютредко и позже, чаще в виде ахиллотендинита и гонартрита.Результаты. По материалам отечественных и зарубежных публикацийобобщены случаи ошибочной диагностики ревматического полиартрита, по-рока сердца при эссенциальной гиперлипидемии (ЭГЛ) и ксантоматозе, про-ведены клинические параллели с собственными наблюдениями. Из 206 опи-саний больных с ЭГЛ и ксантоматозом по данным литературы, у 25 из нихбыла обнаружена гиперлипидемическая артропатия (в 12,2% клиническихнаблюдений), послужившая гипердиагностике ревматизма.По материалам наших наблюдений из 26 лиц с семейной и 9 больных ЭГЛв сочетании с ксантоматозом, в 38,4% случаев (10 пациентов) наблюдаласьГЛП артропатия, причем одновременное повышение уровня мочевой кислотыв крови имелось лишь в одном наблюдении. Возраст больных составил от 2-хдо 60 лет (в 79% случаев до 45 лет), среди них женщин – 62%, мужчин –35%, детей до 14 лет – 3%. Длительность диспансерного наблюдения в по-ликлинике и «безуспешного противорецидивного лечения подозреваемогоревматизма» составила от 2-х до 15 лет. Наиболее частой диагностическойошибкой была артропатия, встречающаяся при 2 типе дислипидемии. Суставной синдром был нетипичным для ревматической лихорадки: ми-грирующий характер боли, отсутствие или небольшая припухлость ассимет-ричных суставов без нарушения их функции, обострения моно- полиартрита(коленные суставы, бугорчатые ксантомы кистей рук), не связанные с се-зонностью, спонтанное исчезновение артралгии, отсутствие рентгенологиче-ских изменений суставов. В редких случаях обнаруживались остеолитиче-ские поражения фаланг, обусловленные давлением ксантом.Систолический шум, связанный с отложением холестерина на клапанахэндокарда, симулировал приобретенный порок сердца при ЭГЛ. В 1/3 случа-ев систолический шум определялся в проекции митрального клапана, в 2/3случаев – в проекции аортального клапана.Клиническая картина, симулирующая ревматический процесс, наблюда-лась при выраженной гиперхолестеринемии (более 400 мг%). При этом от-мечался длительный субфебрилитет, неадекватно общему состоянию ускоря-лось СОЭ (более 30 мм в час), наблюдалась положительная активностьострофазовых протеинов, возрастала концентрация иммуноглобулина G,фибриногена, альфа-2-глобулина, снижалась активность антитромбина-III.Выводы. Правильному проведению дифференциального диагноза остройревматической лихорадки с ЭГЛ на поликлиническом и госпитальном этапебудет способствовать оценка характера течения и проявления суставногосиндрома, обнаружение ксантом, ксантелазм, определение общего ХС, ТГ,типа дислипидемии. Мы наблюдали два случая комбинированной дислипи-демии, сопровождавшейся туберозными ксантомами у больных, лечившихсяпо поводу предполагаемого хронического «ревматизма» в течении 14 и 12лет. Артикулярные проявления дислипидемий и ксантоматоза кодируются поМКБ10 шифром М14.5 – артропатии при нарушениях обмена веществ.
Гулиева Г. И., Гулиева Л. А.
ПАРАНЕОПЛАСТИЧЕСКИЙ СИНДРОМ В ПРАКТИКЕ ИНТЕРНИСТА
ГБОУ ВПО «Ставропольский государственный медицинский университет»Министерства здравоохранения Российской Федерации, ГБУЗ Ставропольско-го края «Ставропольский краевой клинический онкологический диспансер»,Ставрополь, Россия
Паранеопластический синдром – комплекс паранеопластических ревма-тических реакций, обусловленных злокачественными новообразованиями.Считается, что в основе паранеопластических ревматических реакций лежитгиперергический ответ аутоиммунного типа на «чужеродные» опухолевыеантигены («неоантигены»), перекрестно реагирующие с антигенами неизме-ненной ткани с участием в развитии иммунокомплексного воспаления. Ха-рактер паранеопластических ревматических реакций определяется антиген-ными свойствами опухоли и индивидуальной иммунной реакцией больного генетически детерминированным или приобретенным дисбалансом звеньевиммунной системы.Цель работы. Изучить клинические и лабораторные проявления па-ранеопластических ревматических реакций у больных с онкопатологией.Материал и методы. Под наблюдением находилось 118 пациентов,женщин – 75 в среднем возрасте 57,4±1,2 г., мужчин – 43 в возрасте64,1±4,2 г. Первичное обращение к онкологу зафиксировано у 68% пациен-тов с последующей консультацией ревматолога. 32% пациентов наблюда-лись у ревматолога с необходимостью консультации у онколога в дальней-шем. Исследуемые пациенты были условно разделены на 3 группы. Первуюсоставили пациенты с клиническими проявлениями заболеваний суставов(42%), вторую – пациенты с признаками системных заболеваний соедини-тельной ткани (35%), третью – пациенты с признаками васкулита, лихорад-кой «неясного генеза», лимфаденопатией (23%).Результаты и Обсуждение. Ревматоидноподобный артрит был у3пациентов (2,5%), характерными проявлениями были: утренняя скован-ность более часа, боль, ограничение движений, плотный отек кистей по типу«боксерских перчаток», ускоренная скорость оседания эритроцитов, повы-шенный уровень С – реактивного белка, реже – ревматоидного фактора кро-ви; на рентгенограммах – кистовидная перестройка костной ткани, сужениесуставных щелей без деструкции. Моноартрит плечевого, тазобедренного иголеностопного сустава был выявлен у 3пациентов (2,5%) за 2 года до обна-ружения онкопатологии. Гипертрофическая остеоартропатия с утолщениемдистальных фаланг по типу «барабанных палочек» с «часовыми стеклами» -у 2пациентов (2,5%) с потерей веса, лихорадкой, лейкоцитозом и ускорен-ной СОЭ более 70мм/ч. Итак, в первой группе выявлено 11пациентов с до-стоверной онкопатологией: рак простаты – 3пациента, кишечника –3пациента, молочной железы – 2 женщины, рак легкого – 1женщина,2мужчин. Нужно сказать, что «острое начало» с прострелами по позвоноч-нику и болью в пояснице и в грудной клетке наблюдалось у 1мужчины 57лет с подозрением на анкилозирующий спондилит. Выявлен перифериче-ский рак верхней доли левого легкого. «Начало конца» – 8недель. Во 2 и 3группах с подозрением на онкопатологию было: со склероподобным синдро-мом (плотный отек, контрактура Дюпюитрена, фасциит, гипер – и депиг-ментация кожи, амимичность лица, «кисет») 5женщин (4,2%), с клиникойдермато/полимиозита – 4женщины (3,3%), узловатая эритема 3пациента(2,5%), геморрагический васкулит – 2пациента (1,6%). Все пациентынаблюдались не менее 1,5 – 3 лет. Больные не получали цитостатики, принеобходимости большие дозы глюкокортикоидов, ежегодно проходили об-следование по онкопрограмме, так как известен вторичный генез в старшихвозрастных группах. Злокачественные опухоли: рак яичников с метастази-рованием – у 3женщин (2,5%), рак яичка – 1пациент в возрасте 26лет(0,8%), рак поджелудочной железы – 2 (1,6%), молочной железы – 1(0,8%), легкого – 1 (0,8%), лимфопролиферативное заболевание у 3(2,5%); у 2 (1,6%) – опухоли головного мозга. У одной пациентки (0,8%)ревматоидный артрит сочетался с лимфомой. Выводы. Паранеопластический синдром в виде паранеопластическихревматических реакций встречается достаточно часто (21,1%), может бытьпервым клиническим проявлением злокачественной опухоли. 2. Паранеопла-стические ревматические реакции сопутствуют опухолям любой локализа-ции, а не вызываются ими. 3. Связи симптомов ревматического заболеванияс локализацией опухоли, возрастом, полом не обнаружено. Встречаются пе-рекрестные синдромы с клинической картиной заболеваний суставов и си-стемными заболеваниями соединительной ткани.
Гулиева Г. И., Ягода А. В.
ЭФФЕКТИВНОСТЬ ЛЕФЛУНОМИДА ПРИ ЛЕЧЕНИИ РАННЕГО РЕВМАТОИДНОГО АРТРИТА
ГБОУ ВПО Ставропольский государственный медицинский университет Министерства здравоохранения РФ, Ставрополь, Россия
Принцип «лечение до достижения цели» особенно актуален при раннемревматоидном артрите (РРА), когда скорость прогрессирования заболеваниянаиболее высока, что объясняется мощным иммунным воспалением в раннейстадии болезни. Происходит выработка каскада провоспалительных цитоки-нов, образование аутоантител и иммунных комплексов. Активизируетсяфункция эндотелиальных клеток, наблюдается экспрессия молекул адгезии,активация системы комплемента, матриксных металлопротеиназ, приводя-щих к синтезу аномального коллагена и необратимым изменениям костнойструктуры, образованию паннуса. Для достижения ремиссии при РРА необ-ходима своевременная диагностика, адекватное лечение с использованиемпрепарата с мощным антидеструктивным, противовоспалительным и иммуно-модулирующим эффектом. Нами был выбран лефлуномид (Лф) – Арава, пре-парат первого ряда в рекомендациях Американской ревматологической ас-социации.Цель исследования. Оценить эффективность Лф при РРА в ближайшиеи отдаленные (более 5 лет) сроки лечения.Материал и методы. В исследование включено 64 пациентки с серопо-зитивным по ревматоидному фактору и антител к циклическому цитрулино-вому пептиду РРА с II и IIIстепенью активности. Длительность заболеваниясоставляла в среднем 4,9±1,4мес. Средний возраст – 34,0±1,9 лет. В иссле-довании оценивались, помимо общеклинического обследования, параметрыболи по шкале ВАШ, число болезненных и воспаленных суставов (индексDAS 28), критерии ACR, индекс Лекена и т.д. Рентгенологическое исследова-ние суставов по методу Шарпа, УЗИ и МРТ суставов. Мониторинг основныхпоказателей иммуно – воспалительного процесса проводился с интервалом 4недели – 3 – 6 – 12 – 15 месяцев, в среднем 5,5±2,6 лет. Лефлуномидназначался в дозе 20 мг/сут. Однозначно исследовались трансаминазы кро-ви, рентгенография легких, динамика рентгенографии, МРТ, УЗИ суставов.Результаты. У 49пациентов (76,5%) из 64 положительная динамиканаблюдалась на 5 – 7 неделе лечения: уменьшилась скованность, число бо-лезненных и припухших суставов, исчезли ревматоидные узелки, нормали-зовались показатели С – реактивного белка и скорости оседания эритроци-тов. Рентгенологические признаки РА (присуставной остеопороз, сужениесуставных щелей, единичные узуры) без дальнейшего прогрессированиябыли у 36пациентов (73,4%) из 49. Динамика МРТ данных с исчезновениемкостного отека запястья отмечена у 13(20,3%) через 3,2±1,1 г. Клиническаяремиссия отмечена у 26 пациенов (40,6%), что позволило перейти на под-держивающую дозу Лф – 10мг/сут. в течение 8 – 12мес. У 15 пациентов(23,4%) с высокой иммунологической активностью с прогрессирующимидеструктивными изменениями в костной ткани, с клиническими признакамиупорного синовита, высоким уровнем показателей ВАШ и DAS 28, анемией I– II ст. тяжести, гипертромбоцитозом, длительность приема Лф в дозе20мг/сут пролонгирована до 4,8±1,6 г., несмотря на достигнутую клиниче-скую ремиссию прием Лф в дозе 20мг через день или 10мг/сут продолжалсяв среднем 2,1±0,5г.Обсуждение. Главным принципом лечения было активное наблюдениеза пациентками с датами визитов не реже одного в месяц с контролем СОЭ,тромбоцитов, гемоглобина, трансаминаз и контроля рентгенологических, УЗИи МРТ – данных в 1 – 2 года.Выводы. 1. Лефлуномид (Арава) обладает антидеструктивными свовй-ствами, не оказывая иммунносупрессивного действия. 2. Часто встречаю-щимся побочным эффектом был транзиторный подъем трансаминаз (18%). 3.Монотерапия Лефлуномидом позволяет достичь стойкой ремиссии через 1,5– 2 г. лечения. 4. «Поддерживающая» терапия Лефлуномидом удлиняет ре-миссию, оправдывая принцип «лечение до достижения цели».
Гульнева М.Ю., Носков С.М., Малафеева Э.В.
ЭТИОЛОГИЧЕСКАЯ СТРУКТУРА КОМОРБИДНЫХ ИНФЕКЦИЙ У БОЛЬНЫХ ОСТЕОАРТРИТОМ
ГБОУ ВПО Ярославская государственная медицинская академия, г.Ярославль
Наличие аутоиммунного ревматического заболевания, необходимостьприменения препаратов с иммуносупрессивным действием, внедрение в кли-ническую практику биологических агентов нередко обусловливают развитиеКИ разнообразной локализации у ревматических больных.Цель: Изучение коморбидных инфекций у больных остеоартритом иопределение участия в их развитии условно-патогенных микроорганизмов.Материалы и методы: Проведено изучение коморбидных инфекций(КИ) у 70 больных остеоартритом (ОА) на основании анкетирования, клини-ческого и бактериологического обследования. Группу обследованных боль-ных составили женщины в возрасте 61,56 ± 8,65 лет. Диагностику ОА проводили согласно критериям ACR (American College of Rheumatology). Обсле-дованы больные с моно- или олигоартикулярными пораженими, стажем за-болевания более 5 лет. Средняя длительность заболевания составила 9,89 ±6,31 лет. У 64,3% больных преобладало поражение коленных, у 35,7% –тазобедренных суставов. II рентгенологическая стадия ОА диагностированау 62,9%, III=IV стадия у 37,1% больных, II функциональный класс – у25,7% и III функциональный класс – у 74,3% обследованных больных. Бак-териологическое обследование больных включало забор материала из оча-гов инфекции, выделение чистых культур и их идентификацию по морфоло-гическим, культуральным и биохимическим свойствам согласно определите-лю бактерий Берджи. Определяли частоту выделения отдельных видов мик-роорганизмов в %. Статистический анализ проводили с помощью пакетаприкладных программ Statistica 10.0 (StatSoft Inc.).Полученные результаты. На момент обследования КИ были установле-ны у 32,8% больных и характеризовались разнообразием. У 7,1% больныхОА были диагностированы инфекции верхних дыхательных путей (ВДП), у2,8% больных наблюдались фурункулы на коже и у 5,7% больных отмеченыинфекции со стороны желудочно-кишечного тракта.(ЖКТ). В наибольшемпроценте случаев отмечались инфекции мочевыводящей системы (МВС), ко-торые диагностированы у 17,1% больных. В анамнезе у больных ОА отмече-ны инфекции ВДП (67,1%), МВС (34,3%) и ЖКТ (в 24,3% случаев). Бакте-риологическое обследование больных с поражением слизистых ВДП показа-ло, что КИ характеризовались выделением со слизистых оболочек носа бак-терии рода Klebsiella в 60% случаев. Наряду с этим. этиологически значимы-ми были S. aureus и S. haemolyticus. На слизистой оболочке носа больных, укоторых инфекции ВДП отмечались в анамнезе, существенно чаще высевал-ся золотистый стафилококк (p < 0,05). У 35,3% больных выделены микроор-ганизмы рода Klebsiella. S. haemolyticus, Pseudomonas aeruginosa, а грибырода Candida выделены у 11,8% больных. Инфекции МВС в 100% случаевсопровождалась бактериурией. Микроорганизмы были выделены в моно-культуре и у 1 больного получена ассоциация Morganella morganii и бактерийрода Klebsiella. С одинаковой частотой (33,3%) были выделены бактерийрода Klebsiella и кишечная палочка. У 16,7% больных бактериурия характе-ризовалась выделением энтерококков и сапрофитического стафилококка. КИу больных ОА в анамнезе характеризовались наличием бактериурии в87,5% случаев с преимущественным выделением E. coli (у 58,3% больных) ибактерий рода Klebsiella (у 29,2% больных). При определении этиологиче-ской значимости условно-патогенных микроорганизмов при инфекциях МВПимеет значение изучение количества микроорганизмов в моче. ИнфекцияМВП сопровождалась обнаружением в моче микроорганизмов в количествеlg 6,76 ± 1,69 КОЕ/мл, а при КИ в анамнезе число микроорганизмов в мочебыло ниже в пределах lg 4,92 ± 2,93 КОЕ/мл, однако эти различия не носилисущественного характера (p>0,05). Гнойно-воспалительные процессы накоже у больных ОА были обусловлены S. aureus. У больных ОА, у которыхдиагностированы кишечные инфекция, проведено исследование характерамикрофлоры толстого кишечника. Изучение качественного и количествен-ного состава микрофлоры показало, что развитие КИ характеризовалось100% частотой выделения условно-патогенных микроорганизмов семействаEnterobacteriaceae. Наряду с этим при КИ у 100% больных обнаруживались микроорганизмы, обладающие гемолитической активностью, и в 50% случа-ев выделялся S. aureus. Наличие КИ в анамнезе сопровождалось сохранени-ем высокой частоты выделения условно-патогенных микроорганизмов семей-ства Enterobacteriaceae в пределах 93,12%. Микроорганизмы, имеющие ге-молитическую активность, выделялись у 52,94%, а S. aureus – у 29,41%больных.Обсуждение. Хронический, аутоиммунной природы процесс у пациен-тов при ОА проявляется прямо или косвенно практически во всех органах исистемах, КИ наблюдаются со стороны дыхательных и мочевыводящих путей,кожи и желудочно-кишечного тракта. У больных ОА развитие КИ характери-зовалось повышением частоты выделения условно-патогенных микроорга-низмов, и прежде всего бактерий семейства Enterobacteriaceae. В материалеиз очагов инфекции отмечалась высокая частота выделения бактерий родаKlebsiella. При КИ у больных ОА этиологически значимыми также являютсястафилококки и их вид S. aureus. Перенесенные инфекции у больных ОАхарактеризуются сохранением носительства условно-патогенных микроорга-низмов семейства Enterobacteriaceae, стафилококков и бактерий, обладаю-щих гемолитической активностью. Колонизация организма больных ОАусловно-патогенными микроорганизмами может определять возможностьразвития рецидивирующей эндогенной коморбидной инфекции различнойлокализации.
Давыдова А.Ф., Елисеева Л.Н., Семизарова И.В.,Кисьян Ж.А., Рассовская Т.А.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ХОНДРОИТИНСУЛЬФАТА (АРТРАДОЛ) У ПАЦИНТОВ С ГОНАРТРОЗОМ
Краснодарская краевая клиническая больница №1, 2 ГБОУ ВПО КубГМУМинздрава России, Краснодар, Россия
В настоящее время в медицинских кругах не вызывает сомнения эффек-тивность длительного применения хондроитин сульфата в лечении остеоарт-рита. Вместе с тем, использование инъекционных форм, особенно произве-денных в России, недостаточно изучено.Цель исследования. Анализ клинической эффективности хондроитинсульфата (артрадола) у пациентов с остеоартрозом коленных суставов.Материалы. В исследование включали мужчин и женщин в возрасте 45 –75 лет с установленным диагнозом первичного тибиофеморального остеоарт-роза согласно критериям АРА при II и III стадии по Kellgren-Lawrence, вы-раженностью боли при ходьбе более 40 мм по визуальной аналоговой шкале.Были выбраны пациенты, у которых отмечалась необходимость приема НПВПне менее 30 дней за 3 месяца предшествующие наблюдению. Все пациентыподписывали информированное согласие. Обследовано 30 больных (6 мужчин и 24 женщины). Длительность иссле-дования составляла 4 месяца, включая период лечения (2 месяца) и периоднаблюдения (2 месяца). Препарат Chondroitin sulfate «Артрадол» (Курскаябиофабрика – Фирма “БИОК” ФГУП (Россия) по заказу ИНКАМФАРМ ООО(Россия) назначался внутримышечно в дозе 1мл (100мг) через день первыетри инъекции, четвёртая и последующие по 2 мл (200мг). На курс 30 инъек-ций на протяжении 2-х месяцев. Первые инъекции проводились в условияхстационара. Исследование включало 6 визитов (4 визита в период лечения и2 визита в период наблюдения). Визиты №1, №2 были совмещены. Из иссле-дования исключались пациенты с индексом массы тела более 40 кг/м2, вто-ричным гонартрозом, четвертой рентгенологической стадией остеоартрита,имевшие внутрисуставные введения любых препаратов в течение 6 недельдо начала исследования.Методы. Оценивали клинические (гемоглобин, лейкоциты, СОЭ) и био-химические (АСТ, АЛТ) анализы крови, анализ мочи, рассчитывали индексыWOMAC и Лекена для артроза коленных суставов, тест «встань и иди». Накаждом этапе наблюдения контролировали состояние пациентов, переноси-мость препарата, соблюдение режима лечения, наличие нежелательных яв-лений, оценивалась эффективность и безопасность препарата, потребность вНПВП. Рентгенологическую стадию заболевания определяли по Kellgren-Lawrence.Полученные результаты. Средний возраст включенных в обследованиепациентов составил 56,3±6,3 года. Масса тела у всех пациентов не превы-шала 95 кг (средний вес 78,5 кг), при этом индекс массы тела (ИМТ) соста-вил 29,8 кг/м2 (интервал от 23 до 38 кг/м2). Длительность заболевания со-ставляла в среднем 8,4±4,3 года (от 3 до 18 лет). Рентгенологическая стадиязаболевания по Kellgren-Lawrence была представлена 2 стадией у 15 чело-век, 3 стадией – у 15 больных. Продолжительность последнего обострения унаших пациентов колебалась от 3 недель до 5 месяцев, в среднем 2 месяца.Среди сопутствующих заболеваний отмечалась гипертоническая болезнь (9человек), сахарный диабет 2 типа (1 человек), спондилез позвоночника (2человека), хронический гастрит (1 больной). Все пациенты до начала иссле-дования получали препараты из группы НПВП в средней дозе 116 мг/сутки(в пересчете на диклофенак). Терапия артродолом сопровождалась умень-шением потребности в НПВП начиная со второй недели лечения и к концунаблюдения 40% больных полностью отказались от НПВП. Остальные – сни-зили суточную дозировку на 56%. Достоверным было улучшение по клини-ческим показателям: болевого синдрома по ВАШ, функциональных тестов,индекса Лекена, показателям шкал анкеты WOMAC. При общей оценке эф-фективности лечения установлен высокий эффект терапии – у 82% больныхотмечалось значительное улучшение или улучшение. Не было выявлено по-бочных или нежелательных явлений. Необходимости изменять объем тера-пии сопутствующих заболеваний не потребовалось ни у одного пациента.Наиболее быстрые и стойкие положительные сдвиги установлены у пациен-тов со 2 рентгенологической стадией конартроза.Обсуждение. Проведенные нами исследования показали положительноевлияние хондроитин сульфата в препарате артрадол на клиническое течениеи показатели функциональной активности у пациентов с гонартрозом, более выраженные при его второй рентгенологической стадии. Клинический эф-фект у большинства больных сохранялся в течение 2 месяцев после прекра-щения терапии.Выводы. Инъекционная форма хондроитин сульфата в виде препаратаартрадол хорошо переносится пациентами с оастеартрозом коленных суста-вов, обладает способностью снижать болевые проявления, улучшать функ-циональные показатели. Курсовое использование артрадола позволяет зна-чительно снизить дозы нестероидных противовоспалительных препаратовили даже отказаться от их применения. Артрадол может быть рекомендованв качестве симптоммодифицирующего средства для лечения дегенератвныхпоражений коленных суставов.
Евдокимова Е.В., Зборовский А.Б., Мартемьянов В.Ф.,Мозговая Е.Э., Стажаров М.Ю., Бедина С.А.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЭНЗИМНЫХ ИССЛЕДОВАНИЙ В ПЛАЗМЕ КРОВИ БОЛЬНЫХ РЕАКТИВНЫМ АРТРИТОМ И ПСОРИАТИЧЕСКИМ СПОНДИЛОАРТРИТОМ
ФГБУ«НИИ КиЭР» РАМН, г. Волгоград, Россия
Дифференциальная диагностика спондилоартропатий на ранних этапахимеет сложности, связанные со сходными чертами в клинической картинезаболеваний.Цель: выявить особенности активности ферментов гуаниловой ветви пу-ринового метаболизма в плазме крови, способствующие дифференциацииреактивного артрита (РеА) и псориатического спондилоартрита (ПСА).Материалы и методы: под наблюдением находились 54 больных РеА,из них 17 с сакроилеитом. Больные РеА были представлены 36 (66,7%) муж-чинами и 18 (33,3%) женщинами, средний возраст больных всей группы –31,9±1,0 (σ=7,6) лет, а также 21 пациент ПСА, из которых 12 (57,1%) муж-чин и 9 (42,9%) женщин, возраст всех больных – 41,9±3,5 (σ=13,6) лет. Всебольные с псориатическим артритом имели спондилоартритический вариантзаболевания. Диагноз РеА устанавливался на основании критериев, приня-тых на IV международном совещании по диагностике РеА (Берлин, 1999).Диагноз псориатического спондилоартрита выставлялся с учетом критериевCASPAR (2006). Исходя из клинико-лабораторных особенностей и классифи-кации РеА, I степень активности патологического процесса установлена у 21(38,9%) больного, II степень – у 22 (40,7%) и III степень – у 11 (20,4%)больных; I стадия поражения суставов с учетом критериев Штейнброккера иКеллгрена определялась у 28 (51,9%) и II стадия – у 10 (18,5%) больных. Убольных ПСА I степень активности процесса определялась у 12 (57,1%), IIстепень – у 9 (42,9%) больных, а также II стадия установлена у 5 (23,8%),III стадия – у 4 (19%) и IV стадия – у 9 (42,9%) больных. В плазме по ори-гинальным методикам определялись активности гуаниндезаминазы (ГДА), гуанозиндезаминазы (ГЗДА), пуриннуклеозидфосфорилазы (ПНФ), гуаноз-инфосфорилазы (ГФ). Контрольную группу составили 30 практически здоро-вых людей.Результаты: В плазме здоровых людей зависимости энзимных показате-лей от пола и возраста не выявлено, и в дальнейшем исследовании эти фак-торы не учитывались. По сравнению со здоровыми, у больных РеА с сакрои-леитом в плазме выше активность ГДА (р<0,001), ПНФ (р<0,001), ниже ак-тивность ГЗДА (р>0,05) и нет различий по ГФ (р>0,05), в лимфоцитах вышеактивность ГЗДА (р<0,01), ГФ (р<0,01), незначительно выше ПНФ и нижеГДА (все р>0,05) в эритроцитах выше активность ГДА (р<0,001), ниже ГЗДА(р<0,001), незначительно выше активность ПНФ (р>0,05) и ниже ГФ(р>0,05). У больных РеА без сакроилеита, по сравнению со здоровыми, вплазме выше активность ГДА (р<0,001), ПНФ (р<0,001), ниже активностьГЗДА (р<0,001) и ГФ (р<0,001), в лимфоцитах статистически значимых эн-зимных различий не определялось (р>0,05), в эритроцитах выше активностьГДА (р>0,05), ниже ГЗДА (р<0,001) и ГФ (р<0,001).У больных ПСА (все группы), по сравнению со здоровыми, в плазме вышеактивность всех ферментов: ГДА (р<0,001), ГЗДА (р<0,01), ПНФ (р<0,001) иГФ (р<0,01). Результаты исследования показали, что у больных РеА с сакро-илеитом по сравнению с больными ПСА в плазме ниже активность ГДА(р˂0,001), ГЗДА (р˂0,001), ПНФ (р˂0,05) и ГФ (р˂0,01), а у больных РеА безсакроилеита по сравнению с больными ПСА ниже активность всех ферментов(р˂0,001).Заключение: выявленные энзимные различия способствуют дифферен-циации РеА и ПСА.
Елисеева Л.Н., Сирунянц А.А., Малхасян И.Г.,Бледнова А.Ю., Самородская Н.А.
ЛОКАЛЬНАЯ ТЕРАПИЯ ГЛЮКОЗАМИНСУЛЬФАТОМ (ХОНДРОКСИД МАКСИМУМ) У ПАЦИЕНТОВС ОСТЕОАРТРИТОМ ПЕРИФЕРИЧЕСКИХ СУСТАВОВ
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Использование гликозаминогликанов в лечении клинических проявленийостеоартрита рекомендуется ревматологическими сообществами практическивсех стран. Между тем использование локальных форм вызывает скепсиснекоторых врачей.Цель исследования. Изучить клиническую эффективность локальнойтерапии пациентов с деформирующим артрозом мелких суставов кистей истоп на фоне применения хондроксида максимум.Материалы. В исследование включено 25 пациентов в возрасте 25-42года (средний возраст 28,3±4,2 года) с I-II рентгенологическими стадиями остеоартрита мелких суставов кистей и стоп. Среди обследованных 16 боль-ных имели признаки недифференцированной дисплазии соединительнойткани в виде синдрома гипермобильности. Крем хондроксид максимум(STADA) рекомендовали наносить на кожу над местом поражения суставов 2-3 раза в день полоской длиной 2-3 см и втирать до полного всасывания вкожу. Длительность лечения составила 3 недели с последующим наблюдени-ем в течение 4 недель.Методы. Стадию заболевания устанавливали при рентгенологическомисследовании кистей и стоп. Оценивали уровень болевых ощущений по ви-зуальной аналоговой шкале (ВАШ), отечность и болезненность суставов вбаллах от 0 до 3, потребность в пероральном применении нестероидных про-тивовоспалительных препаратов (НПВП), функциональную активность паци-ентов по ВАШ, удовлетворенность больных результатами лечения. Учитыва-ли приверженность к лечению, развитие побочных и нежелательных прояв-лений.Полученные результаты. Использование крема хондроксид максимум,содержащего 8% крем глюкозамина сульфат калия хлорид в локальной те-рапии остеоартроза периферических суставов показало его достаточнуюанальгетическую и противовоспалительную активность. Практически всепациенты в нашем наблюдении отметили раннее проявление анальгетиче-ских эффектов. Достоверное уменьшение болевых ощущений фиксировалосьчерез 30-40 минут. Степень снижения выраженности боли достигала 30% впервые дни и увеличивалась до 53% к концу второй недели. У 18 больныхстойкое уменьшение боли сохранялось до конца наблюдения и сопровожда-лось отказом от применения пероральных форм НПВП. Особенный эффектмы наблюдали у больных с гипермобильным синдромом. «Хороший» и«очень хороший» ответ на локальную терапию отметили 9 больных, удовле-творительный – 5 человек. Одновременно снижались отечность и болезнен-ность суставов.Обсуждение. В предшествующих исследованиях показано, что глюкоза-мина сульфат обладает хондропротекторными свойствами, снижает дефицитгликозаминогликанов в организме, является специфическим субстратом истимулятором синтеза гиалуроновой кислоты и протеогликанов. Глюкозами-на сульфат способствует восстановлению хрящевых поверхностей перифе-рических суставов и суставов позвоночника. Обладает противовоспалитель-ными и аналгезирующими свойствами. Уменьшает боль и потребность в при-еме нестероидных противовоспалительных препаратов, угнетает образова-ние супероксидных радикалов и ферментов, повреждающих хрящевую ткань(коллагеназы и фосфолипазы). Наши наблюдения показали, что применениеглюкозамина сульфата в виде патентованной технологии трансдермальнгопереноса GLUCOTEC с глюкозамином внутри микронизированных капсулобладает симптоммодифицирующим эффектом у пациентов с начальнымипризнаками дегенеративных нарушений в мелких суставах кистей и стоп. Уобследованных нами больных препарат не вызвал побочных и нежелатель-ных эффектов. В связи с достаточным анальгетическим и противовоспали-тельным действием приверженность больных к терапии достаточно высока.Локальная терапия позволила отказаться от перорального применения НПВП. Выводы. Крем Хондроксид максимум может использоваться для локаль-ной терапии периферических суставов у больных с начальными стадиямиостеоартрита в виде монотерапии. Наиболее эффективна указанная терапияу пациентов с синдромом гипермобильности суставов.
Еремеева И.К., Куликов А.И., Ханов А.Г.
РЕАЛЬНАЯ НЕПРЕРЫВНАЯ РЕВМАТОЛОГИЧЕСКАЯ ПОМОЩЬ В УСЛОВИЯХ ОМС
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Под нашим наблюдением, с ноября 2008г, 6 лет, находится Б., мужчи-на 60 лет, страдающий РА. Дебют РА проявился в виде гонартроза и болей вспине, что вызвало определенные трудности в диагностике. Первоначальнобольной обследовался с подозрением на ББ. При отсутствии убедительныхрентгенологических данных, отрицательным РФ и высокими показателямилабораторных острофазовых реакций и наличии очага инфекции в почках,состояние было расценено как «рабочий» диагноз РеА с рекомендациямисанации очага инфекции и динамическим наблюдением. Кроме того, у боль-ного имел место метаболический синдром с абдоминальным ожирением икардиологический континуум с АГ2ст, степень АГ2, Риск4 с ИБС, ХСНI, ФК2(NYHA). При повторной госпитализации, через полгода, был установлендиагноз РА, серопозитивного по РФ, 2 степени активности, 2 R-стадии, ФК 2-3. Одновременно имела место железодефицитная анемия легкой степени ивыраженные иммунологические нарушения, LE феномен, антитела к ДНК иантитела к циклическому цитрулинсодержащему пептиду (повышение в 50раз). При рентгенологическом исследовании также был обнаружен 2-х сто-ронний сакроилеит. При выборе базисной терапии было проведено углуб-ленное обследование ЖКТ, которое выявило: Острый эрозивный гастрит спониженной секреторной функцией желудка. Гепатоз. Хрон. панкреатит встадии ремиссии. Хрон. геморрой вне обострения. Полипы прямой кишки.Начата базисная терапия сульфасалазином. Также назначен курс вобензима.Следующая госпитализация через 4 месяца, в апреле 2009 года, показалахорошую переносимость и клиническую эффективность базисной терапии.Произошло снижение активности заболевания до I степени. При обследова-нии ССС, на УЗИ сердца появились признаки атеросклеротического пораже-ния АК и МК, дилатация ЛП, ДДЛЖ I типа, КГЛЖ с толщиной миокарда 12 -14мм при незначительном увеличении на 11% конечного диастолического объ-ема ЛЖ. Следующая госпитализация в феврале 2010г, через 8 месяцев, по-казала хорошую переносимость и результативность базисной терапии суль-фасалазином. В связи с вовлечением в процесс коленных суставов и нару-шением функции ходьбы, в формулировку диагноза добавлено упоминание осочетанном остеоартрозе с преимущественным поражением коленных суста-вов. В плане кардиологической патологии, при УЗИ контроле, отмеченодальнейшее увеличение ЛЖ и появление нарушения возбудимости по типусинусовой брадикардии. Профилактика НПВП – гастропатии проводиласьнексиумом. Липидные нарушения корригировались приемом инеджи. Через 6 месяцев, в августе 2010г, повторная госпитализация в виду присоединенияпоражения тазобедренных суставов, при сохранении минимальной лабора-торной активности РА. Для усиления противовоспалительного эффекта тера-пии и снижения вероятности побочного действия, проведена смена базисно-го препарата на салофальк в дозе 500мг/сут. Последующая госпитализация вянваре 2011г, через 5 месяцев, показала хорошую переносимость проводи-мой терапии. В клинической и рентгенологической картине, на первый план,стали выступать явлении деформирующего артроза с деформацией суставови краевыми экзостозами. В анализах мочи впервые появилась оксалатурия.Показатели липидограммы нормализовались. Больному рекомендовано вы-полнение рентгенологической остеоденситометрии. Обнаружены признакиначальной остеопении в области Варда левой бедренной кости. Повторнаягоспитализация в апреле 2011г, через 3 месяца, была вызвана нарушениемазотовыделительной функции почек до ХПН I А степени. Проведена коррек-ция базисной терапии со снижением дозы салофалька до 250мг/сут. Одно-временно регистрировались процессы дилатации ЛЖ (увеличение размеровна 54%). 3-ья госпитализация в 2011 году была вызвана появлением в кли-нике внесуставных проявлений – полисерозитов с явлениями экссудативногоплеврита и перикардита. Доза базисного препарата увеличена до 500мг/сут.Вновь обнаружен LE феномен. Проведенное иммунологическое обследованиепоказало высокий уровень антител к цитрулину (в 100 раз), но при отсут-ствии антител к ДНК и антинуклеарных антител. 4-ая госпитализация в2011г, через 3 месяца, была вызвана необходимостью контроля результатовлечения в связи с системными проявлениями РА. Проведенное обследованиепоказало отсутствие выпота в плевральных полостях и перикарде. Одновре-менно в клинике метаболического синдрома появилось нарушение толерант-ности к углеводам. Больному даны рекомендации по НК диете, разгрузочнымдням и контролю массы тела. Базисная терапия оставлена в той же дозе. В2012 году госпитализация, через 6 месяцев после предыдущей, была вызва-на необходимостью контроля терапии. В плане воспаления отмечалосьнаступление лабораторной ремиссии (отрицательные ревмопробы), серокон-версия по РФ. Нарушения толерантности к глюкозе сохранялись. Липидныенарушения контролировались трайкором. Базисная терапия проводилась втой же дозе. Повторная госпитализация в 2012 году, через 5 месяцев, в свя-зи с болевым суставным синдромом при минимальной степени активности. Вдекабре этого года больной амбулаторно выполняет рентгенологическуюостеоденситометрию, где впервые обнаруживаются признаки остеопороза вобласти Варда с Т критерием -2,7 и начальной остеопенией в поясничномотделе позвоночника в L1 с Т критерием -1,1. В заключительный диагноздополнительно вынесен вторичный остеопороз сочетанного генеза без пере-ломов. Начато программное лечение бисфосфонатами (в/в резокластин).В январе 2013 года (через 3месяца после предыдущей госпитализа-ции) больной госпитализирован связи с нарушением ходьбы, которое, какоказалось при обследовании, было вызвано тендовагинитом с частичныминтрамуральным разрывом левого Ахиллова сухожилия. Больному рекомен-довано использование ортезов.Через 4 месяца повторная госпитализация в ревматологическое отделе-ние в связи с обострением суставного синдрома и нарушение функции ходь-бы в связи с остаточными явлениями частичного разрыва левого Ахилловогосухожилия. Кроме того, клиническая ситуация осложнилась постиньекцион-ным инфильтратом правой ягодицы, образовавшимся во время амбулаторно-го лечения. Базисная терапия не прекращалась, но рекомендовано снижениедозы салофалька до 250мг/сут. Одновременно сохранялись явления метабо-лического синдрома и кардиологического континуума, которые требовалимедикаментозной терапии.Через 5 месяцев, третья в 2013г, госпитализация в ревматологическоеотделение в связи с обострением суставного синдрома. Одновременно, приобследовании, на ЭКГ впервые обнаружены рубцовые изменения в миокар-де, а в лабораторных анализах резкое (больше 10 раз ) повышение КФК иКФК МВ, при отрицательном тропониновом тесте. Проведен курс антианги-нальной и кардиотонической терапии с улучшением общего самочувствия,но с сохранением повышенного уровня лабораторных показателей повре-ждения миокарда. Этапная рентгенологическая денситометрия показала по-ложительную динамику по Т критерию в области бедра с показателя от -2,7до -1,2 и исчезновением признаков остеопении в поясничном отделе позво-ночника за год наблюдения. Программное лечение бисфосфонатами решенопродолжить. Через месяц, уже 4 -ый раз в текущем году, пациент госпитали-зируется для проведения программного лечения бисфосфонатами. Послепредшествующей медикаментозной подготовки, введен препарат Акласта,без каких либо побочных эффектов. В клинической картине РА вновь появи-лись системные проявления, теперь в виде лимфаденопатии. В лаборатор-ных анализах сохранялись стойкие показатели повреждения миокарда с по-вышением КФК до 15 раз. Клиническая ситуация расценена как проявлениямиокардита в рамках системных проявлений РА, пока без нарастания явле-ний ХСН. Длительное повышение уровня ферментов, характеризующих по-вреждение мышц, в том числе и миокарда, требует динамического наблюде-ния для исключения ДМ, эндокринологической патологии (гипотиреоз), воз-можного нарастания ХСН или опасности острых коронарных событий. Вплане коморбидных состояний, также необходимо отметить наличие у боль-ного дисциркуляторной энцефалопатии сочетанного генеза выраженной сте-пени с первых годов нашего наблюдения. Больному рекомендована плановаягоспитализация для подбора новой базисной терапии.Подводя итоги 6-летнего наблюдения больного в рамках ревматологиче-ского континуума, необходимо отметить основные клинические события:Дебют РА под «маской» РеА; Установление достоверного диагноза РА че-рез 6 мес: РА со стойкими, выраженными иммунологическими нарушениями(антитела к цитрулину, антитела к ДНК, антинуклеарные антитела), LE фе-номен.Подбор базисной терапии с хорошим клиническим эффектом контроля ак-тивности заболевания; Проведение терапии РА на фоне патологии ЖКТ, ме-таболического синдрома и сопутствующей кардиологической и церебральнойпатологии; Обнаружение рубцовых изменений миокарда;Эпизоды системных проявлений РА в виде анемии, полисерозитов и лим-фаденопатии: Ранняя (до возникновения патологических переломов) диа-гностика системного остеопороза:Программное лечение остеопороза в/в бисфосфонатами с положительнымэффектом по Т критерию за год наблюдения и контролем безопасности лече-ния; Тендинит Ахиллова сухожилия с частичным разрывом; Постинъекцион-ный абсцесс ягодицы после в/м введения НПВП в амбулаторных условияхРазвитие вторичного остеоартроза «корневых» суставов и наличие рент-генологических признаков 2-х стороннего сакроилеита; Появление в течениепоследних 3-х месяцев стойких, высоких лабораторных показателей повре-ждения сердечной мышцы, требующих уточнения; Сохранение функцииходьбы, продолжение активной трудовой деятельности в полном объеме,кратковременные (до 16 дней) случаи ВН без признаков стойкой утраты тру-доспособности.Во время плановой проверки экспертами страховой компании данныйслучай привлек внимание в связи с повторным обращением застрахованноголица за медицинской помощью по поводу того же заболевания в течение 90дней со дня завершения лечения в стационаре.
Журавлева М.О., Савельева Н.В.
ОЦЕНКА УДОВЛЕТВОРЕННОСТИ КАЧЕСТВОМ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ПАЦИЕНТАМИ С РЕАКТИВНЫМ АРТРИТОМ
ГБОУ ВПО «Оренбургская государственная медицинская академия» Мин-здрава России, г.Оренбург, Россия
Проблема оценки качества медицинских услуг по мере развития меди-цинских технологий и изменения характера заболеваний все время усложня-ется. Сегодня превалируют хронические болезни, при которых эффект лече-ния крайне разнообразный, а, следовательно, оценка качества медицинскихуслуг стала делом значительно более сложным. При этом оценка качествапомощи будет зависеть от предпочтений потребителей и удовлетворенностипациента от взаимодействия с медицинской подсистемой.Качество медицинской помощи рассматривается как совокупностьсвойств процесса оказания медицинской помощи, способствующих формиро-ванию у пациентов чувства удовлетворенности в ходе взаимодействия смедицинскими работниками, при достаточном ресурсном квалификационноми технологическом обеспечении. В свою очередь, удовлетворенность – этосостояние согласия, совпадения ожидаемого пациентом результата взаимо-действия и полученного в действительности.Для обеспечения удовлетворенности пациентов оказанием медицинскойпомощи необходимо максимально полно изучить их ожидания и потребности. Для уменьшения риска развития осложнений и предотвращения переходаострого течения реактивного артрита (РеА) в хроническое необходимо свое-временное и адекватное лечение, что требует постоянного наблюдения врача – ревматолога и поддержания качества оказания медицинской помощи надолжном уровне. Цель работы – оценить степень удовлетворенности качеством оказаниямедицинской помощи пациентами с реактивными артритами.Материалы и методы. Было проанкетировано 20 больных с РеА через2-5 лет после лечения во взрослой поликлинике №2 ГАУЗ “ГКБ им. Н. И. Пи-рогова” г. Оренбурга. Средний возраст опрошенных составил 47 ± 2,4 лет.Полное выздоровление отмечало 2 мужчин (10%), значительное улучше-ние состояния – 8 человек (40%), ухудшение – 1 женщина (5%). Не замети-ли перемен через 5 лет 45% (9 человек). 50% опрошенных, не отмечающихположительную динамику в течение заболевания суставов, указывают наотсутствие у них повышения температуры кожи над суставами и ее покрас-нение, припухлости, но жалуются на боли, возникающие преимущественновечером, после физической нагрузки. Что позволяет говорить об отсутствииу них реактивного артрита, а наличии остеоартроза. При проведении рентге-нологического исследования диагноз остеоартроза подтвердился у 90%.Обострения данные пациенты отмечали 4 раза в год и более. У 30%опрошенных не было обострений, у 20% они отмечались 2 раза в год, но замедицинской помощью они не обращались. При этом на диспансерном учетепо месту жительства по поводу заболевания суставов состоят всего 5 чело-век (25%). Трудоспособными полностью себя считают 11 больных РеА(55%), снижение трудоспособности у себя отмечают 7 пациентов (35%).Инвалидность III группы имеют 2 человека (10%) не по болезням суставов, апо поводу ишемической болезни сердца и дисциркуляторной энцефалопа-тии.Из числа опрошенных считают медицинскую помощь материально до-ступной 50%. Не достаточно доступной медицинскую помощь отметили 40%пациентов РеА, у них с трудом хватает денег на лекарственные препаратыили приходится ограничивать свои затраты в других сферах жизнедеятель-ности. Не доступна медицинская помощь для 10% опрошенных, им не хва-тает денег на лекарственные средства, они не могут пройти платные обсле-дования (рис.1)
Выводы. Используя различия гидрофобных и гидрофильных частей мо-лекулы кардиолипина и новый метод иммобилизации с использованием по-лиакриламидного геля в качестве носителя, можно получать стабильные,пространственно-ориентированные, гранулированные с магнитными свой-ствами нанообъекты с последующим применением их в диагностике и лече-нии больных ревматическими заболеваниями.
Гонтарь И.П., Трофименко А.С., Красильников А.Н.,Симакова Е.С., Зборовский А.Б.
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ЭКСТРАКОРПОРАЛЬНОЙ СОРБЦИИ ФАКТОРА НЕКРОЗА ОПУХОЛИ С ПОМОЩЬЮ МАГНИТОУПРАВЛЯЕМЫХ ГРАНУЛ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград
Известно, что ведущим звеном патогенеза многих аутоиммунных заболе-ваний, включая ревматоидный артрит (РА), является активация клеточногоиммунитета с поляризацией по Th1-типу. Одним из главных механизмов про-грессирования РА считается гиперпродукция антигенпрезентирующими клет-ками и активированными лимфоцитами большого числа провоспалительныхцитокинов, которые, в свою очередь, инициируют каскад иммунопатологиче-ских реакций, приводящих к воспалению и костной деструкции. Среди этихцитокинов центральную роль в процессе усиления провоспалительного ци-токинового сигнала и, тем самым, в прогрессировании РА, в настоящее времяотводят фактору некроза опухоли (ФНО), также называемому ФНО-. Онсинтезируется в организме в двух биологически активных гомотримерныхформах – трансмембранной и растворимой, образующейся из первой поддействием ФНО-конвертазы. Трансмембранный ФНО экспрессируется на Т- иВ-лимфоцитах, а также на антигенпрезентирующих клетках. Связываниеобеих активных форм ФНО с рецептором инициирует высвобождение другихпровоспалительных медиаторов и молекул адгезии.В настоящее время для лечения РА широко используется введение инги-биторов ФНО: моноклональных антител к ФНО либо химерных молекул наоснове анти-ФНО-Fc-фрагментов IgG или рецепторов ФНО. Для всех этихпрепаратов убедительно показан выраженный положительный лечебныйэффект: быстрое снижение активности заболевания, а также значительноезамедление деструкции суставов. Несмотря на то, что препараты этого клас-са существенно отличаются по степени ингибирования трансмембранногоФНО и по комплементзависимой цитотоксичности в отношении иммуноцитовпериферической крови, показано, что клиническая эффективность у нихсходная. Однако существующие ингибиторы ФНО обладают большим количе-ством побочных эффектов, связанных с введением иммуногенных молекул ворганизм пациента (синтез антител к ингибиторам ФНО, частые аллергиче-ские и инфузионные реакции). Кроме того, высокая стоимость имеющихся внастоящее время препаратов значительно ограничивает их применение.Вследствие этого удобным инструментом подавления активности ФНО приаутоиммунных заболеваниях является сорбция растворимого ФНО и ФНО-экспрессирующих клеток крови с помощью антительных магнитоуправляе-мых гранул.Целью исследования являлось определение эффективности сорбциирастворимой формы ФНО из изолированной крови больных РА in vitro, используя в качестве сорбента антитела к ФНО, иммобилизированные на маг-нитоуправляемых полиакриламидных гранулах (МПГ).Методы: МПГ получали по методу эмульсионной полимеризации в потокегазообразного азота в модификации И.П. Гонтаря и соавт. (2008). Для МПГ симмобилизированными антителами к ФНО, полученных согласно примеру 1,определяли удельную сорбционную емкость. С этой Целью через мини-колонку с объемом рабочей камеры 0,2 мл, заполненную МПГ, пропускалирастворы ФНО (1 мл) с возрастающими концентрациями, после перфузиикаждого раствора МПГ заменяли, контур промывали 1 М глицин-HCl буфе-ром, рН 2,2 и стандартным фосфатно-солевым буферным раствором. Концен-трацию ФНО в пропущенных через МПГ растворах определяли методом ИФАс использованием коммерческих наборов (Вектор-Бест, Россия).Нативную гепaринизированную кровь для перфузии получали от 10больных ревматоидным артритом различной степени активности, которым втечение последних 12 месяцев не проводилось парентеральное введениеингибиторов ФНО, при наличии информированного согласия. В колонку объ-емом 10 мл, оборудованную электромагнитом, вносили МПГ с иммобилизиро-ванными антителами к ФНО. Через колонку перфузировали 20 мл крови соскоростью 10 мл/ч. В качестве контроля выступала кровь 10 здоровых доно-ров, процедура перфузии была аналогичной. После ее окончания МПГ отмы-вали от несвязавшихся белков забуференным физиологическим растворомрН 7,4 и проводили регенерацию 1 М глицин-HCl буфером рН 2,2 двукратнопо 10 мин. Концентрацию ФНО плазмы крови определяли методом ИФА сиспользованием коммерческих наборов (Вектор-Бест, Россия), также оцени-вали содержание форменных элементов крови (эритроцитов, лейкоцитов,тромбоцитов). Значения всех исследуемых показателей для каждого образцаизмеряли двукратно – до и после перфузии. Центральную тенденцию и ва-риабельность рассчитывали как среднее арифметическое (95% доверитель-ный интервал), различия считали статистически значимыми при p < 0,05.Результаты: При изучении растворов ФНО с исходными концентрациями0.5, 1, 5, 10, 25, 50, 75 пг/мл после перфузии через МПГ ФНО не определял-ся. В растворе ФНО с исходной концентрацией 100 пг/мл конечная концен-трация ФНО составила 3,4 пг/мл. Следовательно, сорбционная емкость МПГсоставила 483 пг ФНО/мл сорбента.В результате перфузии концентрация ФНО плазмы крови здоровых лицуменьшилась с 1,06 (0,0-2,95) пг/мл до 0,02 (0,00-0,05) пг/мл (р < 0,001;парный критерий Стьюдента), у больных РА – с 21,40 (9,92-32,88) пг/мл до0,03 (0,00-0,06) пг/мл (р < 0,001; парный критерий Стьюдента). Из указан-ных значений следует, что при перфузии через комбинированный сорбентдостигается статистически значимое снижение содержания ФНО на 98,1%(для здоровых лиц) и на 99,9% (для больных РА) от исходного. Содержаниеформенных элементов крови изменялось незначительно: для эритроцитов – с3,7 (2,5-4,9) до 3,8 (2,3-5,3) , 1012 л-1 (р = 0,940; парный критерий Стью-дента), для лейкоцитов – с 4,7 (2,8-6,6) до 4,0 (1,9-6,1) , 109 л-1 (р =0,303; парный критерий Стьюдента), для тромбоцитов – с 270,9 (184,4-357,4) до 252,0 (200,6-303,4) , 109 л-1 (р = 0,281; парный критерий Стью-дента) После использования МПГ регенерировали 1 М глицин-HCl буфером, рН2,2. После первой регенерации потеря сорбционной емкости составила 14%.При последующих повторных регенерациях (9 раз) статистически значимыхизменений удельной сорбционной емкости не происходило.Обсуждение: Предложенный нами метод имеет значительные преиму-щества перед существующими способами экстракорпоральной сорбции ФНО,лигандом которого служат либо 2-макроглобулин, обработанный протеоли-тическими ферментами или первичными аминами [Бондарев И.Э. с соавт..1995], либо полистиролсульфоновая кислота [Hirai F. et al., 1996]. В обоихслучаях используется ковалентная иммобилизация, которая, как правило,препятствует получению сорбентов с высокой емкостью. Кроме того, носите-ли не является магнитоуправляемыми, что затрудняет удержание сорбента всорбционной колонке без специальных фильтров, а применение последнихобычно приводит к травматизации форменных элементов. Наконец, ввидунестабильности третичной структуры 2-макроглобулина регенерация такогосорбента обычно затруднена, а весьма высокая стоимость очищенного чело-веческого 2-макроглобулина приводит к нерентабельности использованияодноразового сорбента.Выводы: таким образом, предложенный нами метод способен эффектив-но и практически полностью сорбировать растворимую форму ФНО, что яв-ляется одним из важнейших условий обеспечения противовоспалительногоэффекта. При этом признаков травматизации форменных элементов кровипри перфузии in vitro выявлено не было.
Горбанёв Е.А., Левитан Б.Н.
АРТИКУЛЯРНЫЕ МАНИФЕСТАЦИИ ДИСЛИПИДЕМИЙ ИКСАНТОМАТОЗА
ГБОУ ВПО Астраханская государственная медицинская академия, Астрахань
азделе XII выделены «артропатии при неревматических заболеваниях (дру-гих заболеваниях)» как метаболические нарушения, связанные с гиперлипи-демией. «Артропатии при других заболеваниях», как показывает название,являются вторичными по отношению к основным болезням, перечисленным вразделе XII, которые диагностируются и лечатся специалистами соответ-ствующего профиля при участии ревматологов, осуществляющих лишь диа-гностику и лечение вторичного суставного синдрома. Однако ревматологнередко впервые сталкивается с таким больным и должен правильно опре-делить диагностическую и терапевтическую тактику (Руководство по клини-ческой ревматологии).Малая осведомленность практикующих врачей и научных сотрудников овзаимосвязи артикулярных изменений с эссенциальной ГЛП (гипербеталипо-протеидемией) служит причиной ошибочной диагностики острой ревматической лихорадки, ревматического артрита и порока сердца, ревматоидного иподагрического артрита (вторичная подагра, гиперурикемия).Целью данного сообщения явился анализ причин диагностических оши-бок у больных с артропатиями при эссенциальной гиперлипидемии (ЭГЛ) иксантоматозе. Материалом послужил анализ литературных и собственныхклинических описаний случаев гипердиагностики ревматической лихорадкипри дислипидемии и ксантоматозе.Локализация суставных изменений при дислипидемии по частоте: колен-ные суставы (гонартрит), локтевые, мелкие периферические суставы, голе-ностопные суставы. Суставные проявления дислипидемий могут характери-зоваться: артралгиями, артритом (моно- олигоартрит). Рецидивирующим ми-грирующим, острым или хроническим полиартритом (периартритом), тенди-нитом ахиллова сухожилия, синовитом, сухожильными и туберозными (бу-горчатыми) ксантомами. Бугорчатые ксантомные изменения суставов наибо-лее часто принимают за «ревматические», или связанные с деформирующимартрозом. Туберозные (бугорчатые) ксантомы представляют собой узлы жел-товатого цвета с гладкой поверхностью размером до нескольких сантимет-ров, плотной консистенции, иногда напоминающие хондромы. Они распола-гаются изолированно или группами на разгибательной поверхности кистейрук, стоп, в области локтевых суставов, на задней поверхности коленныхсуставов, на ягодицах. Туберозные ксантомы часты при 2,3 типе дислипиде-мии, имеют хроническое течение, не всегда обратимы при лечении.Дифференциальный диагноз изолированных туберозных ксантом можнопроводить с суставными изменениями при остеоартрозе, при локализации намежфаланговых суставах кистей рук – с узелками Гебердена, Бушара; сфиброзным диатезом (подушки Гаррода); с хондромами (хрящевыми образо-ваниями); с кистами, содержащими фиброзную ткань (фибромы). Суставныеизменения у некоторых больных сопровождаются лихорадкой, повышениемСОЭ, увеличением концентрации фибриногена в крови, возрастанием титраАСЛ «О» (связано с инактивацией стрептолизина бета- ЛП), положительнымлатекс-тестом (взаимодействие между ЛП и гамма-глобулинами приводит кагглютинации частиц латекса). По данным литературы, «ревматические»изменения длительно сохраняются при дислипидемии и способствуют псев-додиагностике ревматизма (острой ревматической лихорадке) до тех пор,пока не будет обнаружен высокий уровень общего холестерина в плазмекрови (300-600 мг% – 8-16 мм/л и выше) или ХС ЛПНП, триглицеридов.Синовиальная жидкость обнаруживается в небольшом количестве, чащеимеет механический не воспалительный характер, концентрация холестери-на в ней не повышена (по другим данным – повышена). По данным литера-туры в синовиальной жидкости обнаруживаются крупные липофаги, ксан-томные клетки (с многочисленными ядрами) – синовиальный ксантоматоз.При морфологическом исследовании синовиальной оболочки обнаружи-вали (не всегда) отложения кристаллов мочевой кислоты, а при электронно-микроскопическом исследовании – не только инфильтрацию липидами, но имикрокристаллы, напоминающие апатитные, в митохондриях синовиоцитов.Патогенез отложения микрокристаллов в митохондриях остается неясным. Подобные отложения описаны при липидных тезаурисмозах (болезнях Гоше,Фабри). В ряде случаев суставные проявления могли иметь мочекислую при-роду. Это сближает дислипидемию 2 типа с 4 типом, при которой часты по-дагрические проявления. Микрокристаллическая гипотеза объединяет этиполиартриты: отложения липидов способствуют преципитации апатитов вмитохондриях.Наиболее часто суставные проявления наблюдаются при гомозиготнойформе семейного гиперхолестеринемичекого сухожильного ксантоматоза(СГСК) с дислипидемией 2 типа. При гомозиготной форме мигрирующий по-лиартрит поражает большие суставы – является одним из часто встречаемыхклинических проявлений. Суставные приступы имеют непостоянную продол-жительность и интенсивность, по несколько дней, объективные измененияпочти незаметны, или теплота, покраснение, припухлость и боль сустававызывают нарушение функции, которая продолжается около месяца. В неко-торых случаях, суставная припухлость симметрична, захватывая сустав ипериартикулярную ткань, а в других случаях наблюдается только односто-роннее поражение сустава. Частота приступов от 4- до 12 раз в год, иногдаих разделяют целые годы. Повторяющиеся приступы не вызывают деформа-ции или анкилозирования сустава. Иногда суставные атаки локализуются наахилловом сухожилии, или теносиновитами с различной локализацией. Ар-тикулярные приступы не сопровождаются лихорадкой, лейкоцитозом илисистемными проявлениями, проходят самопроизвольно, в течение 48-72 ча-сов, без лечения, в других случаях тянутся долго, до 30 дней. Взаимосвязи суровнем холестерина плазмы крови не отмечается и между артритами. Се-мейный анамнез позволяет правильно определить характер данного сустав-ного синдрома. Липидограмма уточняет диагноз, тип дислипидемии.При гетерозиготной форме СГСК, частота суставных проявлений значи-тельно ниже, ксантоматоз непостоянный, суставные изменения возникаютредко и позже, чаще в виде ахиллотендинита и гонартрита.Результаты. По материалам отечественных и зарубежных публикацийобобщены случаи ошибочной диагностики ревматического полиартрита, по-рока сердца при эссенциальной гиперлипидемии (ЭГЛ) и ксантоматозе, про-ведены клинические параллели с собственными наблюдениями. Из 206 опи-саний больных с ЭГЛ и ксантоматозом по данным литературы, у 25 из нихбыла обнаружена гиперлипидемическая артропатия (в 12,2% клиническихнаблюдений), послужившая гипердиагностике ревматизма.По материалам наших наблюдений из 26 лиц с семейной и 9 больных ЭГЛв сочетании с ксантоматозом, в 38,4% случаев (10 пациентов) наблюдаласьГЛП артропатия, причем одновременное повышение уровня мочевой кислотыв крови имелось лишь в одном наблюдении. Возраст больных составил от 2-хдо 60 лет (в 79% случаев до 45 лет), среди них женщин – 62%, мужчин –35%, детей до 14 лет – 3%. Длительность диспансерного наблюдения в по-ликлинике и «безуспешного противорецидивного лечения подозреваемогоревматизма» составила от 2-х до 15 лет. Наиболее частой диагностическойошибкой была артропатия, встречающаяся при 2 типе дислипидемии. Суставной синдром был нетипичным для ревматической лихорадки: ми-грирующий характер боли, отсутствие или небольшая припухлость ассимет-ричных суставов без нарушения их функции, обострения моно- полиартрита(коленные суставы, бугорчатые ксантомы кистей рук), не связанные с се-зонностью, спонтанное исчезновение артралгии, отсутствие рентгенологиче-ских изменений суставов. В редких случаях обнаруживались остеолитиче-ские поражения фаланг, обусловленные давлением ксантом.Систолический шум, связанный с отложением холестерина на клапанахэндокарда, симулировал приобретенный порок сердца при ЭГЛ. В 1/3 случа-ев систолический шум определялся в проекции митрального клапана, в 2/3случаев – в проекции аортального клапана.Клиническая картина, симулирующая ревматический процесс, наблюда-лась при выраженной гиперхолестеринемии (более 400 мг%). При этом от-мечался длительный субфебрилитет, неадекватно общему состоянию ускоря-лось СОЭ (более 30 мм в час), наблюдалась положительная активностьострофазовых протеинов, возрастала концентрация иммуноглобулина G,фибриногена, альфа-2-глобулина, снижалась активность антитромбина-III.Выводы. Правильному проведению дифференциального диагноза остройревматической лихорадки с ЭГЛ на поликлиническом и госпитальном этапебудет способствовать оценка характера течения и проявления суставногосиндрома, обнаружение ксантом, ксантелазм, определение общего ХС, ТГ,типа дислипидемии. Мы наблюдали два случая комбинированной дислипи-демии, сопровождавшейся туберозными ксантомами у больных, лечившихсяпо поводу предполагаемого хронического «ревматизма» в течении 14 и 12лет. Артикулярные проявления дислипидемий и ксантоматоза кодируются поМКБ10 шифром М14.5 – артропатии при нарушениях обмена веществ.
Гулиева Г. И., Гулиева Л. А.
ПАРАНЕОПЛАСТИЧЕСКИЙ СИНДРОМ В ПРАКТИКЕ ИНТЕРНИСТА
ГБОУ ВПО «Ставропольский государственный медицинский университет»Министерства здравоохранения Российской Федерации, ГБУЗ Ставропольско-го края «Ставропольский краевой клинический онкологический диспансер»,Ставрополь, Россия
Паранеопластический синдром – комплекс паранеопластических ревма-тических реакций, обусловленных злокачественными новообразованиями.Считается, что в основе паранеопластических ревматических реакций лежитгиперергический ответ аутоиммунного типа на «чужеродные» опухолевыеантигены («неоантигены»), перекрестно реагирующие с антигенами неизме-ненной ткани с участием в развитии иммунокомплексного воспаления. Ха-рактер паранеопластических ревматических реакций определяется антиген-ными свойствами опухоли и индивидуальной иммунной реакцией больного генетически детерминированным или приобретенным дисбалансом звеньевиммунной системы.Цель работы. Изучить клинические и лабораторные проявления па-ранеопластических ревматических реакций у больных с онкопатологией.Материал и методы. Под наблюдением находилось 118 пациентов,женщин – 75 в среднем возрасте 57,4±1,2 г., мужчин – 43 в возрасте64,1±4,2 г. Первичное обращение к онкологу зафиксировано у 68% пациен-тов с последующей консультацией ревматолога. 32% пациентов наблюда-лись у ревматолога с необходимостью консультации у онколога в дальней-шем. Исследуемые пациенты были условно разделены на 3 группы. Первуюсоставили пациенты с клиническими проявлениями заболеваний суставов(42%), вторую – пациенты с признаками системных заболеваний соедини-тельной ткани (35%), третью – пациенты с признаками васкулита, лихорад-кой «неясного генеза», лимфаденопатией (23%).Результаты и Обсуждение. Ревматоидноподобный артрит был у3пациентов (2,5%), характерными проявлениями были: утренняя скован-ность более часа, боль, ограничение движений, плотный отек кистей по типу«боксерских перчаток», ускоренная скорость оседания эритроцитов, повы-шенный уровень С – реактивного белка, реже – ревматоидного фактора кро-ви; на рентгенограммах – кистовидная перестройка костной ткани, сужениесуставных щелей без деструкции. Моноартрит плечевого, тазобедренного иголеностопного сустава был выявлен у 3пациентов (2,5%) за 2 года до обна-ружения онкопатологии. Гипертрофическая остеоартропатия с утолщениемдистальных фаланг по типу «барабанных палочек» с «часовыми стеклами» -у 2пациентов (2,5%) с потерей веса, лихорадкой, лейкоцитозом и ускорен-ной СОЭ более 70мм/ч. Итак, в первой группе выявлено 11пациентов с до-стоверной онкопатологией: рак простаты – 3пациента, кишечника –3пациента, молочной железы – 2 женщины, рак легкого – 1женщина,2мужчин. Нужно сказать, что «острое начало» с прострелами по позвоноч-нику и болью в пояснице и в грудной клетке наблюдалось у 1мужчины 57лет с подозрением на анкилозирующий спондилит. Выявлен перифериче-ский рак верхней доли левого легкого. «Начало конца» – 8недель. Во 2 и 3группах с подозрением на онкопатологию было: со склероподобным синдро-мом (плотный отек, контрактура Дюпюитрена, фасциит, гипер – и депиг-ментация кожи, амимичность лица, «кисет») 5женщин (4,2%), с клиникойдермато/полимиозита – 4женщины (3,3%), узловатая эритема 3пациента(2,5%), геморрагический васкулит – 2пациента (1,6%). Все пациентынаблюдались не менее 1,5 – 3 лет. Больные не получали цитостатики, принеобходимости большие дозы глюкокортикоидов, ежегодно проходили об-следование по онкопрограмме, так как известен вторичный генез в старшихвозрастных группах. Злокачественные опухоли: рак яичников с метастази-рованием – у 3женщин (2,5%), рак яичка – 1пациент в возрасте 26лет(0,8%), рак поджелудочной железы – 2 (1,6%), молочной железы – 1(0,8%), легкого – 1 (0,8%), лимфопролиферативное заболевание у 3(2,5%); у 2 (1,6%) – опухоли головного мозга. У одной пациентки (0,8%)ревматоидный артрит сочетался с лимфомой. Выводы. Паранеопластический синдром в виде паранеопластическихревматических реакций встречается достаточно часто (21,1%), может бытьпервым клиническим проявлением злокачественной опухоли. 2. Паранеопла-стические ревматические реакции сопутствуют опухолям любой локализа-ции, а не вызываются ими. 3. Связи симптомов ревматического заболеванияс локализацией опухоли, возрастом, полом не обнаружено. Встречаются пе-рекрестные синдромы с клинической картиной заболеваний суставов и си-стемными заболеваниями соединительной ткани.
Гулиева Г. И., Ягода А. В.
ЭФФЕКТИВНОСТЬ ЛЕФЛУНОМИДА ПРИ ЛЕЧЕНИИ РАННЕГО РЕВМАТОИДНОГО АРТРИТА
ГБОУ ВПО Ставропольский государственный медицинский университет Министерства здравоохранения РФ, Ставрополь, Россия
Принцип «лечение до достижения цели» особенно актуален при раннемревматоидном артрите (РРА), когда скорость прогрессирования заболеваниянаиболее высока, что объясняется мощным иммунным воспалением в раннейстадии болезни. Происходит выработка каскада провоспалительных цитоки-нов, образование аутоантител и иммунных комплексов. Активизируетсяфункция эндотелиальных клеток, наблюдается экспрессия молекул адгезии,активация системы комплемента, матриксных металлопротеиназ, приводя-щих к синтезу аномального коллагена и необратимым изменениям костнойструктуры, образованию паннуса. Для достижения ремиссии при РРА необ-ходима своевременная диагностика, адекватное лечение с использованиемпрепарата с мощным антидеструктивным, противовоспалительным и иммуно-модулирующим эффектом. Нами был выбран лефлуномид (Лф) – Арава, пре-парат первого ряда в рекомендациях Американской ревматологической ас-социации.Цель исследования. Оценить эффективность Лф при РРА в ближайшиеи отдаленные (более 5 лет) сроки лечения.Материал и методы. В исследование включено 64 пациентки с серопо-зитивным по ревматоидному фактору и антител к циклическому цитрулино-вому пептиду РРА с II и IIIстепенью активности. Длительность заболеваниясоставляла в среднем 4,9±1,4мес. Средний возраст – 34,0±1,9 лет. В иссле-довании оценивались, помимо общеклинического обследования, параметрыболи по шкале ВАШ, число болезненных и воспаленных суставов (индексDAS 28), критерии ACR, индекс Лекена и т.д. Рентгенологическое исследова-ние суставов по методу Шарпа, УЗИ и МРТ суставов. Мониторинг основныхпоказателей иммуно – воспалительного процесса проводился с интервалом 4недели – 3 – 6 – 12 – 15 месяцев, в среднем 5,5±2,6 лет. Лефлуномидназначался в дозе 20 мг/сут. Однозначно исследовались трансаминазы кро-ви, рентгенография легких, динамика рентгенографии, МРТ, УЗИ суставов.Результаты. У 49пациентов (76,5%) из 64 положительная динамиканаблюдалась на 5 – 7 неделе лечения: уменьшилась скованность, число бо-лезненных и припухших суставов, исчезли ревматоидные узелки, нормали-зовались показатели С – реактивного белка и скорости оседания эритроци-тов. Рентгенологические признаки РА (присуставной остеопороз, сужениесуставных щелей, единичные узуры) без дальнейшего прогрессированиябыли у 36пациентов (73,4%) из 49. Динамика МРТ данных с исчезновениемкостного отека запястья отмечена у 13(20,3%) через 3,2±1,1 г. Клиническаяремиссия отмечена у 26 пациенов (40,6%), что позволило перейти на под-держивающую дозу Лф – 10мг/сут. в течение 8 – 12мес. У 15 пациентов(23,4%) с высокой иммунологической активностью с прогрессирующимидеструктивными изменениями в костной ткани, с клиническими признакамиупорного синовита, высоким уровнем показателей ВАШ и DAS 28, анемией I– II ст. тяжести, гипертромбоцитозом, длительность приема Лф в дозе20мг/сут пролонгирована до 4,8±1,6 г., несмотря на достигнутую клиниче-скую ремиссию прием Лф в дозе 20мг через день или 10мг/сут продолжалсяв среднем 2,1±0,5г.Обсуждение. Главным принципом лечения было активное наблюдениеза пациентками с датами визитов не реже одного в месяц с контролем СОЭ,тромбоцитов, гемоглобина, трансаминаз и контроля рентгенологических, УЗИи МРТ – данных в 1 – 2 года.Выводы. 1. Лефлуномид (Арава) обладает антидеструктивными свовй-ствами, не оказывая иммунносупрессивного действия. 2. Часто встречаю-щимся побочным эффектом был транзиторный подъем трансаминаз (18%). 3.Монотерапия Лефлуномидом позволяет достичь стойкой ремиссии через 1,5– 2 г. лечения. 4. «Поддерживающая» терапия Лефлуномидом удлиняет ре-миссию, оправдывая принцип «лечение до достижения цели».
Гульнева М.Ю., Носков С.М., Малафеева Э.В.
ЭТИОЛОГИЧЕСКАЯ СТРУКТУРА КОМОРБИДНЫХ ИНФЕКЦИЙ У БОЛЬНЫХ ОСТЕОАРТРИТОМ
ГБОУ ВПО Ярославская государственная медицинская академия, г.Ярославль
Наличие аутоиммунного ревматического заболевания, необходимостьприменения препаратов с иммуносупрессивным действием, внедрение в кли-ническую практику биологических агентов нередко обусловливают развитиеКИ разнообразной локализации у ревматических больных.Цель: Изучение коморбидных инфекций у больных остеоартритом иопределение участия в их развитии условно-патогенных микроорганизмов.Материалы и методы: Проведено изучение коморбидных инфекций(КИ) у 70 больных остеоартритом (ОА) на основании анкетирования, клини-ческого и бактериологического обследования. Группу обследованных боль-ных составили женщины в возрасте 61,56 ± 8,65 лет. Диагностику ОА проводили согласно критериям ACR (American College of Rheumatology). Обсле-дованы больные с моно- или олигоартикулярными пораженими, стажем за-болевания более 5 лет. Средняя длительность заболевания составила 9,89 ±6,31 лет. У 64,3% больных преобладало поражение коленных, у 35,7% –тазобедренных суставов. II рентгенологическая стадия ОА диагностированау 62,9%, III=IV стадия у 37,1% больных, II функциональный класс – у25,7% и III функциональный класс – у 74,3% обследованных больных. Бак-териологическое обследование больных включало забор материала из оча-гов инфекции, выделение чистых культур и их идентификацию по морфоло-гическим, культуральным и биохимическим свойствам согласно определите-лю бактерий Берджи. Определяли частоту выделения отдельных видов мик-роорганизмов в %. Статистический анализ проводили с помощью пакетаприкладных программ Statistica 10.0 (StatSoft Inc.).Полученные результаты. На момент обследования КИ были установле-ны у 32,8% больных и характеризовались разнообразием. У 7,1% больныхОА были диагностированы инфекции верхних дыхательных путей (ВДП), у2,8% больных наблюдались фурункулы на коже и у 5,7% больных отмеченыинфекции со стороны желудочно-кишечного тракта.(ЖКТ). В наибольшемпроценте случаев отмечались инфекции мочевыводящей системы (МВС), ко-торые диагностированы у 17,1% больных. В анамнезе у больных ОА отмече-ны инфекции ВДП (67,1%), МВС (34,3%) и ЖКТ (в 24,3% случаев). Бакте-риологическое обследование больных с поражением слизистых ВДП показа-ло, что КИ характеризовались выделением со слизистых оболочек носа бак-терии рода Klebsiella в 60% случаев. Наряду с этим. этиологически значимы-ми были S. aureus и S. haemolyticus. На слизистой оболочке носа больных, укоторых инфекции ВДП отмечались в анамнезе, существенно чаще высевал-ся золотистый стафилококк (p < 0,05). У 35,3% больных выделены микроор-ганизмы рода Klebsiella. S. haemolyticus, Pseudomonas aeruginosa, а грибырода Candida выделены у 11,8% больных. Инфекции МВС в 100% случаевсопровождалась бактериурией. Микроорганизмы были выделены в моно-культуре и у 1 больного получена ассоциация Morganella morganii и бактерийрода Klebsiella. С одинаковой частотой (33,3%) были выделены бактерийрода Klebsiella и кишечная палочка. У 16,7% больных бактериурия характе-ризовалась выделением энтерококков и сапрофитического стафилококка. КИу больных ОА в анамнезе характеризовались наличием бактериурии в87,5% случаев с преимущественным выделением E. coli (у 58,3% больных) ибактерий рода Klebsiella (у 29,2% больных). При определении этиологиче-ской значимости условно-патогенных микроорганизмов при инфекциях МВПимеет значение изучение количества микроорганизмов в моче. ИнфекцияМВП сопровождалась обнаружением в моче микроорганизмов в количествеlg 6,76 ± 1,69 КОЕ/мл, а при КИ в анамнезе число микроорганизмов в мочебыло ниже в пределах lg 4,92 ± 2,93 КОЕ/мл, однако эти различия не носилисущественного характера (p>0,05). Гнойно-воспалительные процессы накоже у больных ОА были обусловлены S. aureus. У больных ОА, у которыхдиагностированы кишечные инфекция, проведено исследование характерамикрофлоры толстого кишечника. Изучение качественного и количествен-ного состава микрофлоры показало, что развитие КИ характеризовалось100% частотой выделения условно-патогенных микроорганизмов семействаEnterobacteriaceae. Наряду с этим при КИ у 100% больных обнаруживались микроорганизмы, обладающие гемолитической активностью, и в 50% случа-ев выделялся S. aureus. Наличие КИ в анамнезе сопровождалось сохранени-ем высокой частоты выделения условно-патогенных микроорганизмов семей-ства Enterobacteriaceae в пределах 93,12%. Микроорганизмы, имеющие ге-молитическую активность, выделялись у 52,94%, а S. aureus – у 29,41%больных.Обсуждение. Хронический, аутоиммунной природы процесс у пациен-тов при ОА проявляется прямо или косвенно практически во всех органах исистемах, КИ наблюдаются со стороны дыхательных и мочевыводящих путей,кожи и желудочно-кишечного тракта. У больных ОА развитие КИ характери-зовалось повышением частоты выделения условно-патогенных микроорга-низмов, и прежде всего бактерий семейства Enterobacteriaceae. В материалеиз очагов инфекции отмечалась высокая частота выделения бактерий родаKlebsiella. При КИ у больных ОА этиологически значимыми также являютсястафилококки и их вид S. aureus. Перенесенные инфекции у больных ОАхарактеризуются сохранением носительства условно-патогенных микроорга-низмов семейства Enterobacteriaceae, стафилококков и бактерий, обладаю-щих гемолитической активностью. Колонизация организма больных ОАусловно-патогенными микроорганизмами может определять возможностьразвития рецидивирующей эндогенной коморбидной инфекции различнойлокализации.
Давыдова А.Ф., Елисеева Л.Н., Семизарова И.В.,Кисьян Ж.А., Рассовская Т.А.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ХОНДРОИТИНСУЛЬФАТА (АРТРАДОЛ) У ПАЦИНТОВ С ГОНАРТРОЗОМ
Краснодарская краевая клиническая больница №1, 2 ГБОУ ВПО КубГМУМинздрава России, Краснодар, Россия
В настоящее время в медицинских кругах не вызывает сомнения эффек-тивность длительного применения хондроитин сульфата в лечении остеоарт-рита. Вместе с тем, использование инъекционных форм, особенно произве-денных в России, недостаточно изучено.Цель исследования. Анализ клинической эффективности хондроитинсульфата (артрадола) у пациентов с остеоартрозом коленных суставов.Материалы. В исследование включали мужчин и женщин в возрасте 45 –75 лет с установленным диагнозом первичного тибиофеморального остеоарт-роза согласно критериям АРА при II и III стадии по Kellgren-Lawrence, вы-раженностью боли при ходьбе более 40 мм по визуальной аналоговой шкале.Были выбраны пациенты, у которых отмечалась необходимость приема НПВПне менее 30 дней за 3 месяца предшествующие наблюдению. Все пациентыподписывали информированное согласие. Обследовано 30 больных (6 мужчин и 24 женщины). Длительность иссле-дования составляла 4 месяца, включая период лечения (2 месяца) и периоднаблюдения (2 месяца). Препарат Chondroitin sulfate «Артрадол» (Курскаябиофабрика – Фирма “БИОК” ФГУП (Россия) по заказу ИНКАМФАРМ ООО(Россия) назначался внутримышечно в дозе 1мл (100мг) через день первыетри инъекции, четвёртая и последующие по 2 мл (200мг). На курс 30 инъек-ций на протяжении 2-х месяцев. Первые инъекции проводились в условияхстационара. Исследование включало 6 визитов (4 визита в период лечения и2 визита в период наблюдения). Визиты №1, №2 были совмещены. Из иссле-дования исключались пациенты с индексом массы тела более 40 кг/м2, вто-ричным гонартрозом, четвертой рентгенологической стадией остеоартрита,имевшие внутрисуставные введения любых препаратов в течение 6 недельдо начала исследования.Методы. Оценивали клинические (гемоглобин, лейкоциты, СОЭ) и био-химические (АСТ, АЛТ) анализы крови, анализ мочи, рассчитывали индексыWOMAC и Лекена для артроза коленных суставов, тест «встань и иди». Накаждом этапе наблюдения контролировали состояние пациентов, переноси-мость препарата, соблюдение режима лечения, наличие нежелательных яв-лений, оценивалась эффективность и безопасность препарата, потребность вНПВП. Рентгенологическую стадию заболевания определяли по Kellgren-Lawrence.Полученные результаты. Средний возраст включенных в обследованиепациентов составил 56,3±6,3 года. Масса тела у всех пациентов не превы-шала 95 кг (средний вес 78,5 кг), при этом индекс массы тела (ИМТ) соста-вил 29,8 кг/м2 (интервал от 23 до 38 кг/м2). Длительность заболевания со-ставляла в среднем 8,4±4,3 года (от 3 до 18 лет). Рентгенологическая стадиязаболевания по Kellgren-Lawrence была представлена 2 стадией у 15 чело-век, 3 стадией – у 15 больных. Продолжительность последнего обострения унаших пациентов колебалась от 3 недель до 5 месяцев, в среднем 2 месяца.Среди сопутствующих заболеваний отмечалась гипертоническая болезнь (9человек), сахарный диабет 2 типа (1 человек), спондилез позвоночника (2человека), хронический гастрит (1 больной). Все пациенты до начала иссле-дования получали препараты из группы НПВП в средней дозе 116 мг/сутки(в пересчете на диклофенак). Терапия артродолом сопровождалась умень-шением потребности в НПВП начиная со второй недели лечения и к концунаблюдения 40% больных полностью отказались от НПВП. Остальные – сни-зили суточную дозировку на 56%. Достоверным было улучшение по клини-ческим показателям: болевого синдрома по ВАШ, функциональных тестов,индекса Лекена, показателям шкал анкеты WOMAC. При общей оценке эф-фективности лечения установлен высокий эффект терапии – у 82% больныхотмечалось значительное улучшение или улучшение. Не было выявлено по-бочных или нежелательных явлений. Необходимости изменять объем тера-пии сопутствующих заболеваний не потребовалось ни у одного пациента.Наиболее быстрые и стойкие положительные сдвиги установлены у пациен-тов со 2 рентгенологической стадией конартроза.Обсуждение. Проведенные нами исследования показали положительноевлияние хондроитин сульфата в препарате артрадол на клиническое течениеи показатели функциональной активности у пациентов с гонартрозом, более выраженные при его второй рентгенологической стадии. Клинический эф-фект у большинства больных сохранялся в течение 2 месяцев после прекра-щения терапии.Выводы. Инъекционная форма хондроитин сульфата в виде препаратаартрадол хорошо переносится пациентами с оастеартрозом коленных суста-вов, обладает способностью снижать болевые проявления, улучшать функ-циональные показатели. Курсовое использование артрадола позволяет зна-чительно снизить дозы нестероидных противовоспалительных препаратовили даже отказаться от их применения. Артрадол может быть рекомендованв качестве симптоммодифицирующего средства для лечения дегенератвныхпоражений коленных суставов.
Евдокимова Е.В., Зборовский А.Б., Мартемьянов В.Ф.,Мозговая Е.Э., Стажаров М.Ю., Бедина С.А.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЭНЗИМНЫХ ИССЛЕДОВАНИЙ В ПЛАЗМЕ КРОВИ БОЛЬНЫХ РЕАКТИВНЫМ АРТРИТОМ И ПСОРИАТИЧЕСКИМ СПОНДИЛОАРТРИТОМ
ФГБУ«НИИ КиЭР» РАМН, г. Волгоград, Россия
Дифференциальная диагностика спондилоартропатий на ранних этапахимеет сложности, связанные со сходными чертами в клинической картинезаболеваний.Цель: выявить особенности активности ферментов гуаниловой ветви пу-ринового метаболизма в плазме крови, способствующие дифференциацииреактивного артрита (РеА) и псориатического спондилоартрита (ПСА).Материалы и методы: под наблюдением находились 54 больных РеА,из них 17 с сакроилеитом. Больные РеА были представлены 36 (66,7%) муж-чинами и 18 (33,3%) женщинами, средний возраст больных всей группы –31,9±1,0 (σ=7,6) лет, а также 21 пациент ПСА, из которых 12 (57,1%) муж-чин и 9 (42,9%) женщин, возраст всех больных – 41,9±3,5 (σ=13,6) лет. Всебольные с псориатическим артритом имели спондилоартритический вариантзаболевания. Диагноз РеА устанавливался на основании критериев, приня-тых на IV международном совещании по диагностике РеА (Берлин, 1999).Диагноз псориатического спондилоартрита выставлялся с учетом критериевCASPAR (2006). Исходя из клинико-лабораторных особенностей и классифи-кации РеА, I степень активности патологического процесса установлена у 21(38,9%) больного, II степень – у 22 (40,7%) и III степень – у 11 (20,4%)больных; I стадия поражения суставов с учетом критериев Штейнброккера иКеллгрена определялась у 28 (51,9%) и II стадия – у 10 (18,5%) больных. Убольных ПСА I степень активности процесса определялась у 12 (57,1%), IIстепень – у 9 (42,9%) больных, а также II стадия установлена у 5 (23,8%),III стадия – у 4 (19%) и IV стадия – у 9 (42,9%) больных. В плазме по ори-гинальным методикам определялись активности гуаниндезаминазы (ГДА), гуанозиндезаминазы (ГЗДА), пуриннуклеозидфосфорилазы (ПНФ), гуаноз-инфосфорилазы (ГФ). Контрольную группу составили 30 практически здоро-вых людей.Результаты: В плазме здоровых людей зависимости энзимных показате-лей от пола и возраста не выявлено, и в дальнейшем исследовании эти фак-торы не учитывались. По сравнению со здоровыми, у больных РеА с сакрои-леитом в плазме выше активность ГДА (р<0,001), ПНФ (р<0,001), ниже ак-тивность ГЗДА (р>0,05) и нет различий по ГФ (р>0,05), в лимфоцитах вышеактивность ГЗДА (р<0,01), ГФ (р<0,01), незначительно выше ПНФ и нижеГДА (все р>0,05) в эритроцитах выше активность ГДА (р<0,001), ниже ГЗДА(р<0,001), незначительно выше активность ПНФ (р>0,05) и ниже ГФ(р>0,05). У больных РеА без сакроилеита, по сравнению со здоровыми, вплазме выше активность ГДА (р<0,001), ПНФ (р<0,001), ниже активностьГЗДА (р<0,001) и ГФ (р<0,001), в лимфоцитах статистически значимых эн-зимных различий не определялось (р>0,05), в эритроцитах выше активностьГДА (р>0,05), ниже ГЗДА (р<0,001) и ГФ (р<0,001).У больных ПСА (все группы), по сравнению со здоровыми, в плазме вышеактивность всех ферментов: ГДА (р<0,001), ГЗДА (р<0,01), ПНФ (р<0,001) иГФ (р<0,01). Результаты исследования показали, что у больных РеА с сакро-илеитом по сравнению с больными ПСА в плазме ниже активность ГДА(р˂0,001), ГЗДА (р˂0,001), ПНФ (р˂0,05) и ГФ (р˂0,01), а у больных РеА безсакроилеита по сравнению с больными ПСА ниже активность всех ферментов(р˂0,001).Заключение: выявленные энзимные различия способствуют дифферен-циации РеА и ПСА.
Елисеева Л.Н., Сирунянц А.А., Малхасян И.Г.,Бледнова А.Ю., Самородская Н.А.
ЛОКАЛЬНАЯ ТЕРАПИЯ ГЛЮКОЗАМИНСУЛЬФАТОМ (ХОНДРОКСИД МАКСИМУМ) У ПАЦИЕНТОВС ОСТЕОАРТРИТОМ ПЕРИФЕРИЧЕСКИХ СУСТАВОВ
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Использование гликозаминогликанов в лечении клинических проявленийостеоартрита рекомендуется ревматологическими сообществами практическивсех стран. Между тем использование локальных форм вызывает скепсиснекоторых врачей.Цель исследования. Изучить клиническую эффективность локальнойтерапии пациентов с деформирующим артрозом мелких суставов кистей истоп на фоне применения хондроксида максимум.Материалы. В исследование включено 25 пациентов в возрасте 25-42года (средний возраст 28,3±4,2 года) с I-II рентгенологическими стадиями остеоартрита мелких суставов кистей и стоп. Среди обследованных 16 боль-ных имели признаки недифференцированной дисплазии соединительнойткани в виде синдрома гипермобильности. Крем хондроксид максимум(STADA) рекомендовали наносить на кожу над местом поражения суставов 2-3 раза в день полоской длиной 2-3 см и втирать до полного всасывания вкожу. Длительность лечения составила 3 недели с последующим наблюдени-ем в течение 4 недель.Методы. Стадию заболевания устанавливали при рентгенологическомисследовании кистей и стоп. Оценивали уровень болевых ощущений по ви-зуальной аналоговой шкале (ВАШ), отечность и болезненность суставов вбаллах от 0 до 3, потребность в пероральном применении нестероидных про-тивовоспалительных препаратов (НПВП), функциональную активность паци-ентов по ВАШ, удовлетворенность больных результатами лечения. Учитыва-ли приверженность к лечению, развитие побочных и нежелательных прояв-лений.Полученные результаты. Использование крема хондроксид максимум,содержащего 8% крем глюкозамина сульфат калия хлорид в локальной те-рапии остеоартроза периферических суставов показало его достаточнуюанальгетическую и противовоспалительную активность. Практически всепациенты в нашем наблюдении отметили раннее проявление анальгетиче-ских эффектов. Достоверное уменьшение болевых ощущений фиксировалосьчерез 30-40 минут. Степень снижения выраженности боли достигала 30% впервые дни и увеличивалась до 53% к концу второй недели. У 18 больныхстойкое уменьшение боли сохранялось до конца наблюдения и сопровожда-лось отказом от применения пероральных форм НПВП. Особенный эффектмы наблюдали у больных с гипермобильным синдромом. «Хороший» и«очень хороший» ответ на локальную терапию отметили 9 больных, удовле-творительный – 5 человек. Одновременно снижались отечность и болезнен-ность суставов.Обсуждение. В предшествующих исследованиях показано, что глюкоза-мина сульфат обладает хондропротекторными свойствами, снижает дефицитгликозаминогликанов в организме, является специфическим субстратом истимулятором синтеза гиалуроновой кислоты и протеогликанов. Глюкозами-на сульфат способствует восстановлению хрящевых поверхностей перифе-рических суставов и суставов позвоночника. Обладает противовоспалитель-ными и аналгезирующими свойствами. Уменьшает боль и потребность в при-еме нестероидных противовоспалительных препаратов, угнетает образова-ние супероксидных радикалов и ферментов, повреждающих хрящевую ткань(коллагеназы и фосфолипазы). Наши наблюдения показали, что применениеглюкозамина сульфата в виде патентованной технологии трансдермальнгопереноса GLUCOTEC с глюкозамином внутри микронизированных капсулобладает симптоммодифицирующим эффектом у пациентов с начальнымипризнаками дегенеративных нарушений в мелких суставах кистей и стоп. Уобследованных нами больных препарат не вызвал побочных и нежелатель-ных эффектов. В связи с достаточным анальгетическим и противовоспали-тельным действием приверженность больных к терапии достаточно высока.Локальная терапия позволила отказаться от перорального применения НПВП. Выводы. Крем Хондроксид максимум может использоваться для локаль-ной терапии периферических суставов у больных с начальными стадиямиостеоартрита в виде монотерапии. Наиболее эффективна указанная терапияу пациентов с синдромом гипермобильности суставов.
Еремеева И.К., Куликов А.И., Ханов А.Г.
РЕАЛЬНАЯ НЕПРЕРЫВНАЯ РЕВМАТОЛОГИЧЕСКАЯ ПОМОЩЬ В УСЛОВИЯХ ОМС
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Под нашим наблюдением, с ноября 2008г, 6 лет, находится Б., мужчи-на 60 лет, страдающий РА. Дебют РА проявился в виде гонартроза и болей вспине, что вызвало определенные трудности в диагностике. Первоначальнобольной обследовался с подозрением на ББ. При отсутствии убедительныхрентгенологических данных, отрицательным РФ и высокими показателямилабораторных острофазовых реакций и наличии очага инфекции в почках,состояние было расценено как «рабочий» диагноз РеА с рекомендациямисанации очага инфекции и динамическим наблюдением. Кроме того, у боль-ного имел место метаболический синдром с абдоминальным ожирением икардиологический континуум с АГ2ст, степень АГ2, Риск4 с ИБС, ХСНI, ФК2(NYHA). При повторной госпитализации, через полгода, был установлендиагноз РА, серопозитивного по РФ, 2 степени активности, 2 R-стадии, ФК 2-3. Одновременно имела место железодефицитная анемия легкой степени ивыраженные иммунологические нарушения, LE феномен, антитела к ДНК иантитела к циклическому цитрулинсодержащему пептиду (повышение в 50раз). При рентгенологическом исследовании также был обнаружен 2-х сто-ронний сакроилеит. При выборе базисной терапии было проведено углуб-ленное обследование ЖКТ, которое выявило: Острый эрозивный гастрит спониженной секреторной функцией желудка. Гепатоз. Хрон. панкреатит встадии ремиссии. Хрон. геморрой вне обострения. Полипы прямой кишки.Начата базисная терапия сульфасалазином. Также назначен курс вобензима.Следующая госпитализация через 4 месяца, в апреле 2009 года, показалахорошую переносимость и клиническую эффективность базисной терапии.Произошло снижение активности заболевания до I степени. При обследова-нии ССС, на УЗИ сердца появились признаки атеросклеротического пораже-ния АК и МК, дилатация ЛП, ДДЛЖ I типа, КГЛЖ с толщиной миокарда 12 -14мм при незначительном увеличении на 11% конечного диастолического объ-ема ЛЖ. Следующая госпитализация в феврале 2010г, через 8 месяцев, по-казала хорошую переносимость и результативность базисной терапии суль-фасалазином. В связи с вовлечением в процесс коленных суставов и нару-шением функции ходьбы, в формулировку диагноза добавлено упоминание осочетанном остеоартрозе с преимущественным поражением коленных суста-вов. В плане кардиологической патологии, при УЗИ контроле, отмеченодальнейшее увеличение ЛЖ и появление нарушения возбудимости по типусинусовой брадикардии. Профилактика НПВП – гастропатии проводиласьнексиумом. Липидные нарушения корригировались приемом инеджи. Через 6 месяцев, в августе 2010г, повторная госпитализация в виду присоединенияпоражения тазобедренных суставов, при сохранении минимальной лабора-торной активности РА. Для усиления противовоспалительного эффекта тера-пии и снижения вероятности побочного действия, проведена смена базисно-го препарата на салофальк в дозе 500мг/сут. Последующая госпитализация вянваре 2011г, через 5 месяцев, показала хорошую переносимость проводи-мой терапии. В клинической и рентгенологической картине, на первый план,стали выступать явлении деформирующего артроза с деформацией суставови краевыми экзостозами. В анализах мочи впервые появилась оксалатурия.Показатели липидограммы нормализовались. Больному рекомендовано вы-полнение рентгенологической остеоденситометрии. Обнаружены признакиначальной остеопении в области Варда левой бедренной кости. Повторнаягоспитализация в апреле 2011г, через 3 месяца, была вызвана нарушениемазотовыделительной функции почек до ХПН I А степени. Проведена коррек-ция базисной терапии со снижением дозы салофалька до 250мг/сут. Одно-временно регистрировались процессы дилатации ЛЖ (увеличение размеровна 54%). 3-ья госпитализация в 2011 году была вызвана появлением в кли-нике внесуставных проявлений – полисерозитов с явлениями экссудативногоплеврита и перикардита. Доза базисного препарата увеличена до 500мг/сут.Вновь обнаружен LE феномен. Проведенное иммунологическое обследованиепоказало высокий уровень антител к цитрулину (в 100 раз), но при отсут-ствии антител к ДНК и антинуклеарных антител. 4-ая госпитализация в2011г, через 3 месяца, была вызвана необходимостью контроля результатовлечения в связи с системными проявлениями РА. Проведенное обследованиепоказало отсутствие выпота в плевральных полостях и перикарде. Одновре-менно в клинике метаболического синдрома появилось нарушение толерант-ности к углеводам. Больному даны рекомендации по НК диете, разгрузочнымдням и контролю массы тела. Базисная терапия оставлена в той же дозе. В2012 году госпитализация, через 6 месяцев после предыдущей, была вызва-на необходимостью контроля терапии. В плане воспаления отмечалосьнаступление лабораторной ремиссии (отрицательные ревмопробы), серокон-версия по РФ. Нарушения толерантности к глюкозе сохранялись. Липидныенарушения контролировались трайкором. Базисная терапия проводилась втой же дозе. Повторная госпитализация в 2012 году, через 5 месяцев, в свя-зи с болевым суставным синдромом при минимальной степени активности. Вдекабре этого года больной амбулаторно выполняет рентгенологическуюостеоденситометрию, где впервые обнаруживаются признаки остеопороза вобласти Варда с Т критерием -2,7 и начальной остеопенией в поясничномотделе позвоночника в L1 с Т критерием -1,1. В заключительный диагноздополнительно вынесен вторичный остеопороз сочетанного генеза без пере-ломов. Начато программное лечение бисфосфонатами (в/в резокластин).В январе 2013 года (через 3месяца после предыдущей госпитализа-ции) больной госпитализирован связи с нарушением ходьбы, которое, какоказалось при обследовании, было вызвано тендовагинитом с частичныминтрамуральным разрывом левого Ахиллова сухожилия. Больному рекомен-довано использование ортезов.Через 4 месяца повторная госпитализация в ревматологическое отделе-ние в связи с обострением суставного синдрома и нарушение функции ходь-бы в связи с остаточными явлениями частичного разрыва левого Ахилловогосухожилия. Кроме того, клиническая ситуация осложнилась постиньекцион-ным инфильтратом правой ягодицы, образовавшимся во время амбулаторно-го лечения. Базисная терапия не прекращалась, но рекомендовано снижениедозы салофалька до 250мг/сут. Одновременно сохранялись явления метабо-лического синдрома и кардиологического континуума, которые требовалимедикаментозной терапии.Через 5 месяцев, третья в 2013г, госпитализация в ревматологическоеотделение в связи с обострением суставного синдрома. Одновременно, приобследовании, на ЭКГ впервые обнаружены рубцовые изменения в миокар-де, а в лабораторных анализах резкое (больше 10 раз ) повышение КФК иКФК МВ, при отрицательном тропониновом тесте. Проведен курс антианги-нальной и кардиотонической терапии с улучшением общего самочувствия,но с сохранением повышенного уровня лабораторных показателей повре-ждения миокарда. Этапная рентгенологическая денситометрия показала по-ложительную динамику по Т критерию в области бедра с показателя от -2,7до -1,2 и исчезновением признаков остеопении в поясничном отделе позво-ночника за год наблюдения. Программное лечение бисфосфонатами решенопродолжить. Через месяц, уже 4 -ый раз в текущем году, пациент госпитали-зируется для проведения программного лечения бисфосфонатами. Послепредшествующей медикаментозной подготовки, введен препарат Акласта,без каких либо побочных эффектов. В клинической картине РА вновь появи-лись системные проявления, теперь в виде лимфаденопатии. В лаборатор-ных анализах сохранялись стойкие показатели повреждения миокарда с по-вышением КФК до 15 раз. Клиническая ситуация расценена как проявлениямиокардита в рамках системных проявлений РА, пока без нарастания явле-ний ХСН. Длительное повышение уровня ферментов, характеризующих по-вреждение мышц, в том числе и миокарда, требует динамического наблюде-ния для исключения ДМ, эндокринологической патологии (гипотиреоз), воз-можного нарастания ХСН или опасности острых коронарных событий. Вплане коморбидных состояний, также необходимо отметить наличие у боль-ного дисциркуляторной энцефалопатии сочетанного генеза выраженной сте-пени с первых годов нашего наблюдения. Больному рекомендована плановаягоспитализация для подбора новой базисной терапии.Подводя итоги 6-летнего наблюдения больного в рамках ревматологиче-ского континуума, необходимо отметить основные клинические события:Дебют РА под «маской» РеА; Установление достоверного диагноза РА че-рез 6 мес: РА со стойкими, выраженными иммунологическими нарушениями(антитела к цитрулину, антитела к ДНК, антинуклеарные антитела), LE фе-номен.Подбор базисной терапии с хорошим клиническим эффектом контроля ак-тивности заболевания; Проведение терапии РА на фоне патологии ЖКТ, ме-таболического синдрома и сопутствующей кардиологической и церебральнойпатологии; Обнаружение рубцовых изменений миокарда;Эпизоды системных проявлений РА в виде анемии, полисерозитов и лим-фаденопатии: Ранняя (до возникновения патологических переломов) диа-гностика системного остеопороза:Программное лечение остеопороза в/в бисфосфонатами с положительнымэффектом по Т критерию за год наблюдения и контролем безопасности лече-ния; Тендинит Ахиллова сухожилия с частичным разрывом; Постинъекцион-ный абсцесс ягодицы после в/м введения НПВП в амбулаторных условияхРазвитие вторичного остеоартроза «корневых» суставов и наличие рент-генологических признаков 2-х стороннего сакроилеита; Появление в течениепоследних 3-х месяцев стойких, высоких лабораторных показателей повре-ждения сердечной мышцы, требующих уточнения; Сохранение функцииходьбы, продолжение активной трудовой деятельности в полном объеме,кратковременные (до 16 дней) случаи ВН без признаков стойкой утраты тру-доспособности.Во время плановой проверки экспертами страховой компании данныйслучай привлек внимание в связи с повторным обращением застрахованноголица за медицинской помощью по поводу того же заболевания в течение 90дней со дня завершения лечения в стационаре.
Журавлева М.О., Савельева Н.В.
ОЦЕНКА УДОВЛЕТВОРЕННОСТИ КАЧЕСТВОМ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ПАЦИЕНТАМИ С РЕАКТИВНЫМ АРТРИТОМ
ГБОУ ВПО «Оренбургская государственная медицинская академия» Мин-здрава России, г.Оренбург, Россия
Проблема оценки качества медицинских услуг по мере развития меди-цинских технологий и изменения характера заболеваний все время усложня-ется. Сегодня превалируют хронические болезни, при которых эффект лече-ния крайне разнообразный, а, следовательно, оценка качества медицинскихуслуг стала делом значительно более сложным. При этом оценка качествапомощи будет зависеть от предпочтений потребителей и удовлетворенностипациента от взаимодействия с медицинской подсистемой.Качество медицинской помощи рассматривается как совокупностьсвойств процесса оказания медицинской помощи, способствующих формиро-ванию у пациентов чувства удовлетворенности в ходе взаимодействия смедицинскими работниками, при достаточном ресурсном квалификационноми технологическом обеспечении. В свою очередь, удовлетворенность – этосостояние согласия, совпадения ожидаемого пациентом результата взаимо-действия и полученного в действительности.Для обеспечения удовлетворенности пациентов оказанием медицинскойпомощи необходимо максимально полно изучить их ожидания и потребности. Для уменьшения риска развития осложнений и предотвращения переходаострого течения реактивного артрита (РеА) в хроническое необходимо свое-временное и адекватное лечение, что требует постоянного наблюдения врача – ревматолога и поддержания качества оказания медицинской помощи надолжном уровне. Цель работы – оценить степень удовлетворенности качеством оказаниямедицинской помощи пациентами с реактивными артритами.Материалы и методы. Было проанкетировано 20 больных с РеА через2-5 лет после лечения во взрослой поликлинике №2 ГАУЗ “ГКБ им. Н. И. Пи-рогова” г. Оренбурга. Средний возраст опрошенных составил 47 ± 2,4 лет.Полное выздоровление отмечало 2 мужчин (10%), значительное улучше-ние состояния – 8 человек (40%), ухудшение – 1 женщина (5%). Не замети-ли перемен через 5 лет 45% (9 человек). 50% опрошенных, не отмечающихположительную динамику в течение заболевания суставов, указывают наотсутствие у них повышения температуры кожи над суставами и ее покрас-нение, припухлости, но жалуются на боли, возникающие преимущественновечером, после физической нагрузки. Что позволяет говорить об отсутствииу них реактивного артрита, а наличии остеоартроза. При проведении рентге-нологического исследования диагноз остеоартроза подтвердился у 90%.Обострения данные пациенты отмечали 4 раза в год и более. У 30%опрошенных не было обострений, у 20% они отмечались 2 раза в год, но замедицинской помощью они не обращались. При этом на диспансерном учетепо месту жительства по поводу заболевания суставов состоят всего 5 чело-век (25%). Трудоспособными полностью себя считают 11 больных РеА(55%), снижение трудоспособности у себя отмечают 7 пациентов (35%).Инвалидность III группы имеют 2 человека (10%) не по болезням суставов, апо поводу ишемической болезни сердца и дисциркуляторной энцефалопа-тии.Из числа опрошенных считают медицинскую помощь материально до-ступной 50%. Не достаточно доступной медицинскую помощь отметили 40%пациентов РеА, у них с трудом хватает денег на лекарственные препаратыили приходится ограничивать свои затраты в других сферах жизнедеятель-ности. Не доступна медицинская помощь для 10% опрошенных, им не хва-тает денег на лекарственные средства, они не могут пройти платные обсле-дования (рис.1)
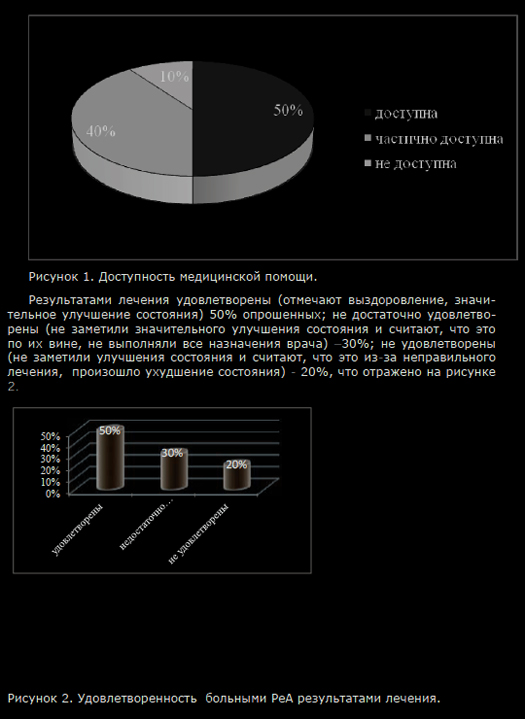 При оценке эффективности лечения выяснилось, что 14 больных РеА(70%) считают его эффективным, а 6 (30%) – таковым не считают, так какполного выздоровления не наступило (рис.3).
При оценке эффективности лечения выяснилось, что 14 больных РеА(70%) считают его эффективным, а 6 (30%) – таковым не считают, так какполного выздоровления не наступило (рис.3).
 Оказание медицинской помощи является удобным для 95% респонден-тов. В основном это связано с внешними (условия предоставления помощи,санитарно-гигиеническое состояние ЛПУ), сервисными (организация оказа-ния помощи, этапность, наличие специалистов, аппаратуры), коммуникатив-ными (отношение, внимание, доброжелательность медицинского персонала)характеристиками медицинской помощи.Систему записи на прием к врачу-ревматологу считают приемлемой 40%опрошенных, не совсем ею довольны 40%, и 20% недовольны существую-щей системой записи на прием, что отражено на рисунке 4.Нежелательные реакции от лечения (на определенный препарат) отмети-ли всего 2 пациентов, остальные же 18 (90%) считают лечение безопасным.Таким образом, результатами лечения удовлетворены 80% больных РеА втечение 2-5 лет. Эффективной проведенную терапию считают 70%, матери-ально доступной и безопасной – 90%. Удовлетворены условиями оказаниямедицинской помощи, квалификацией специалистов 95% пациентов с РеА.Выявленные данные говорят о необходимости дальнейшего совершен-ствования ревматологической помощи населению, назначение более доступ-ной и безопасной терапии, усовершенствования системы самозаписи на при-ем. Хотя проблема материальной доступности лекарственных средств явля-ется скорее общегосударственной проблемой, чем ревматологической.
Оказание медицинской помощи является удобным для 95% респонден-тов. В основном это связано с внешними (условия предоставления помощи,санитарно-гигиеническое состояние ЛПУ), сервисными (организация оказа-ния помощи, этапность, наличие специалистов, аппаратуры), коммуникатив-ными (отношение, внимание, доброжелательность медицинского персонала)характеристиками медицинской помощи.Систему записи на прием к врачу-ревматологу считают приемлемой 40%опрошенных, не совсем ею довольны 40%, и 20% недовольны существую-щей системой записи на прием, что отражено на рисунке 4.Нежелательные реакции от лечения (на определенный препарат) отмети-ли всего 2 пациентов, остальные же 18 (90%) считают лечение безопасным.Таким образом, результатами лечения удовлетворены 80% больных РеА втечение 2-5 лет. Эффективной проведенную терапию считают 70%, матери-ально доступной и безопасной – 90%. Удовлетворены условиями оказаниямедицинской помощи, квалификацией специалистов 95% пациентов с РеА.Выявленные данные говорят о необходимости дальнейшего совершен-ствования ревматологической помощи населению, назначение более доступ-ной и безопасной терапии, усовершенствования системы самозаписи на при-ем. Хотя проблема материальной доступности лекарственных средств явля-ется скорее общегосударственной проблемой, чем ревматологической.
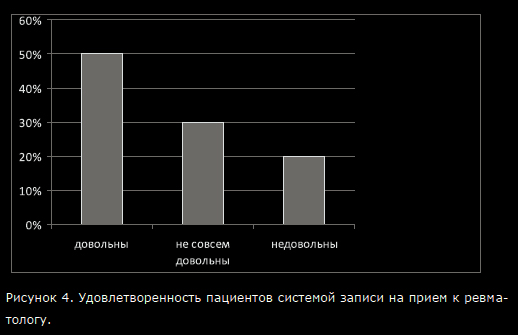 Заводовский Б. В., Ахвердян Ю. Р., Мозговая Е. Э.,Зборовская И. А.
ОПЫТ ПРИМЕНЕНИЯ ПРЕПАРАТА «КАРМОЛИС» (ГЕЛЬ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ) У ПАЦИЕНТОВ С ГОНАРТРОЗОМ
Федеральное государственное бюджетное учреждение «Научно-исследовательский институт клинической и экспериментальной ревматологии» Российской академии медицинских наук
Автор, ответственный за переписку: Елена Эдуардовна Мозговая (nauka@pebma.ru)
Резюме
Цель. Оценить эффективность, переносимость и безопасность препарата«Кармолис» (гель для наружного применения) у пациентов с гонартрозом.Материалы и методы. В исследование включены 60 больных с остео-артрозом (ОА) коленного сустава (гонартрозом), которые были разделены на2 группы. Пациенты первой группы (40 человек) помимо нестероидных про-тивовоспалительных препаратов (НПВП) получали местно «Кармолис» (гельдля наружного применения). Пациенты контрольной группы (20 человек) получали только НПВП. Продолжительность лечения составила 2 недели. Вобеих группах эффективность терапии оценивалась по динамике индексаWOMAC, интенсивности боли в покое и при движении по визуальной анало-говой шкале. Также оценивалась активность заболевания врачом и пациен-том (шкала Likert), наличие локальной припухлости и гипертермии поражен-ного сустава, эффективность лечения, суточная потребность в НПВП.Результаты. В результате проведенного лечения в обеих группах боль-ных была получена положительная динамика клинического состояния. Нафоне комплексной терапии, включавшей гель «Кармолис», наблюдалосьбольшее, чем в контрольной группе снижение боли по индексу WOMAC, болипри движении и в покое (по ВАШ). К моменту завершения исследования помнению врачей значительное улучшение и улучшение было отмечено у 38(95%) больных, использовавших «Кармолис», что совпало с результатамисамооценки пациентов. На фоне применения “Кармолиса” у 18 (45,0%) па-циентов удалось снизить исходную дозу НПВП. Неблагоприятные реакциивстречались редко и не требовали отмены терапии.Заключение. Препарат “Кармолис” (гель для наружного применения)эффективен для купирования клинической симптоматики у больных с го-нартрозом, обладает хорошей переносимостью и безопасностью, что позво-ляет рекомендовать его для использования в комплексном лечении остео-артроза коленного сустава.Ключевые слова: гонартроз, терапия, гель «Кармолис»
EXPERIECE WITH «KARMOLIS» (GEL FOR EXTERNAL USE) IN PATIENTS WITH GONARTHROSIS
Zavodovsky B.V., Akhverdyan Y.R., Mozgovaya E.E., Zborovskaya I.A.
Federal State Budgetary Institution «Research Institute of Clinical and ExperiExperimentalRheumatology» under the Russian Academy of Medical Sciences
Resume
Objective: to evaluate the efficiency, tolerability and safety of «Karmolis»(gel for external use) in patients with gonarthrosis.Subjects and methods. The trial included 60 patients with gonarthrosis,which were divided into two groups. The patients from the 1st group (40 patients)in addition to standard therapy in the form of nonsteroidal antiinflammatorydrugs (NSAIDs) were applied topically “Karmolis” (gel for externaluse). The control group patients (20 patients) received standard therapy only.Duration of treatment was 2 weeks. The efficiency of treatment was evaluatedby dynamics of the index WOMAC, pain intensity at rest and with movement(VAS), assessment of disease activity by the physician and the patient (scaleLikert), availability of local hyperthermia and swelling of the affected joint, severityof synovitis, evaluating the effectiveness by the physician and the patient,a daily need for NSAIDs. Results. As a result of the treatment the patients of both groups showedpositive changes of clinical condition. At the same time among the patients,which had the complex therapy, including gel “Karmolis”, observed more than inthe control group, reductions in pain index WOMAC, pain on movement and atrest (VAS). Upon completion of the study significant improvement and improvementaccording to the physician was noted in 38 (95%) patients of group, whichused the “Karmolis”, which coincided with the results of self-assessment of patients.During treatment with “Karmolis” in 18 (45.0%) patients managed tolower starting dose of NSAIDs. The adverse reactions were rare and did not requirediscontinuation of therapy.Conclusion. «Karmolis» (gel for external use) is effective for the relief of clinicalsymptoms in patients with gonarthrosis, and has good tolerability and safetythat can be recommended for use in treatment of the knee osteoarthritis.Key words: gonarthrosis, therapy, gel «Karmolis»Contact: Elena Eduardovna Mozgovaya (nauka@pebma.ru)
Остеоартроз представляет собой гетерогенную группу заболеваний су-ставов различной этиологии со сходными биологическими, морфологически-ми и клиническими признаками. Помимо гиалинового хряща, при ОА патоло-гически изменяются и другие ткани сустава: синовиальная оболочка,субхондральная кость, суставная капсула, внутрисуставные связки и мышцы[1]. За последние годы отношение к данному заболеванию, как к дегенера-тивно-дистрофическому, претерпело существенные изменения, уступив ме-сто представлениям об участии в его патогенезе фенотипически измененныххондроцитов, синовиального воспаления, процессов. Протекающих в субхон-дральной кости. В поддержании хронического воспалительного процесса всуставах определенную роль играет иммунологический фактор. Источникомразвития аутоиммунных реакций при ОА могут служить не только протеогли-каны хряща, но также, ферменты антиоксидантной системы и пуриновогометаболизма, что может служить одним из механизмов изменения энзимнойактивности при этом заболевании [2, 3]. В последние годы появились дан-ные литературы, позволяющие рассматривать ОА, как системную метаболи-ческую болезнь [1, 4].С возрастом частота ОА резко возрастает: его рентгенологические при-знаки определяются у 90% женщин и у 80% мужчин старше 70 лет. Впервую очередь при ОА поражаются так называемые нагрузочные суставы,что значительно ухудшает качество жизни больных и представляет серьез-ную социально-экономическую проблему. Боль при ОА носит хроническийхарактер и во многом определяет качество жизни больных, страдающих этимнедугом.Важное место в терапии ОА занимает местная обезболивающая и проти-вовоспалительная терапия [5]. Наиболее часто в качестве средств, для ку-пирования боли при этом заболевании, используются нестероидные проти-вовоспалительные препараты (НПВП) [6, 7, 8]. Однако вне зависимости отспособа применения они обладают побочным действием, ограничивающимвозможность их длительного использования [6, 8]. В связи с этим особыйинтерес вызывают средства на основе натуральных природных ингредиентов, которые могут использоваться в комплексной терапии ОА локально,оказывая противовоспалительное и анальгезирующее действие. Имеетсяопыт успешного применения при болезнях опорно-двигательного аппаратажидкости «Кармолис», созданной по рецептуре, составленной монахами-кармелитами еще в XVI веке [9].В настоящее время появилась новая форма препарата «Кармолис» – гельдля наружного применения, который представляет собой лекарственноесредство с местнораздражающим, местнообезболивающим и противовоспа-лительным действием [10, 11, 12, 13]. Активными компонентами геля явля-ются левоментол, метилсалицилат, эфирные масла сосны, эвкалипта, тимья-на, индийской мяты, мускатного ореха, розмарина, лаванды, шалфея, аниса,гвоздики, а также терпентиновое масло, камфора. В качестве основноговспомогательного вещества используется этанол. Препарат наносится наболезненную область до 5 раз в сутки с последующим массажем данной зо-ны.Цель исследования состояла в оценке эффективности, переносимости ибезопасности препарата «Кармолис» (гель для наружного применения) упациентов с гонартрозом.Материалы и методы. В исследование были включены 60 больных го-нартрозом (женщин – 38 (63,3%), мужчин – 22(36,7%)). Диагноз гонартрозаустанавливался на основании критериев AСR, 1991 [1].Критерии включения: Первичный гонартроз; Возраст не менее 40 лет;Потребность в приеме НПВП (прием НПВП в течение как минимум 30 дней запоследние 3 месяца); Подписанное информированное согласие на участие внастоящем исследовании.Критерии исключения: Внутрисуставное введение глюкокортикостерои-дов в течение 1 месяца до исходного визита; Наличие тяжелых заболеванийдругих органов и систем (тяжелой сердечной недостаточности, неконтроли-руемой артериальной гипертензии, неконтролируемого сахарного диабета,злокачественных новообразований (любого генеза) и др.); Нарушения функ-ции почек; Бронхиальная астма; Указание на наличие в анамнезе аллерги-ческих реакций на какой-либо компонент геля «Кармолис»; Лекарственнаяи/или алкогольная зависимость в анамнезе; Открытые и кровоточащие раны,заболевания кожи, раздражение кожи в месте предполагаемого нанесенияпрепарата.Пациенты были рандомизированы на 2 группы. В основную (1-ю группу)вошли 40, контрольную (2-ю группу) – 20 больных (таблица 1). Группы былисопоставимы по оцениваемым показателям.
Заводовский Б. В., Ахвердян Ю. Р., Мозговая Е. Э.,Зборовская И. А.
ОПЫТ ПРИМЕНЕНИЯ ПРЕПАРАТА «КАРМОЛИС» (ГЕЛЬ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ) У ПАЦИЕНТОВ С ГОНАРТРОЗОМ
Федеральное государственное бюджетное учреждение «Научно-исследовательский институт клинической и экспериментальной ревматологии» Российской академии медицинских наук
Автор, ответственный за переписку: Елена Эдуардовна Мозговая (nauka@pebma.ru)
Резюме
Цель. Оценить эффективность, переносимость и безопасность препарата«Кармолис» (гель для наружного применения) у пациентов с гонартрозом.Материалы и методы. В исследование включены 60 больных с остео-артрозом (ОА) коленного сустава (гонартрозом), которые были разделены на2 группы. Пациенты первой группы (40 человек) помимо нестероидных про-тивовоспалительных препаратов (НПВП) получали местно «Кармолис» (гельдля наружного применения). Пациенты контрольной группы (20 человек) получали только НПВП. Продолжительность лечения составила 2 недели. Вобеих группах эффективность терапии оценивалась по динамике индексаWOMAC, интенсивности боли в покое и при движении по визуальной анало-говой шкале. Также оценивалась активность заболевания врачом и пациен-том (шкала Likert), наличие локальной припухлости и гипертермии поражен-ного сустава, эффективность лечения, суточная потребность в НПВП.Результаты. В результате проведенного лечения в обеих группах боль-ных была получена положительная динамика клинического состояния. Нафоне комплексной терапии, включавшей гель «Кармолис», наблюдалосьбольшее, чем в контрольной группе снижение боли по индексу WOMAC, болипри движении и в покое (по ВАШ). К моменту завершения исследования помнению врачей значительное улучшение и улучшение было отмечено у 38(95%) больных, использовавших «Кармолис», что совпало с результатамисамооценки пациентов. На фоне применения “Кармолиса” у 18 (45,0%) па-циентов удалось снизить исходную дозу НПВП. Неблагоприятные реакциивстречались редко и не требовали отмены терапии.Заключение. Препарат “Кармолис” (гель для наружного применения)эффективен для купирования клинической симптоматики у больных с го-нартрозом, обладает хорошей переносимостью и безопасностью, что позво-ляет рекомендовать его для использования в комплексном лечении остео-артроза коленного сустава.Ключевые слова: гонартроз, терапия, гель «Кармолис»
EXPERIECE WITH «KARMOLIS» (GEL FOR EXTERNAL USE) IN PATIENTS WITH GONARTHROSIS
Zavodovsky B.V., Akhverdyan Y.R., Mozgovaya E.E., Zborovskaya I.A.
Federal State Budgetary Institution «Research Institute of Clinical and ExperiExperimentalRheumatology» under the Russian Academy of Medical Sciences
Resume
Objective: to evaluate the efficiency, tolerability and safety of «Karmolis»(gel for external use) in patients with gonarthrosis.Subjects and methods. The trial included 60 patients with gonarthrosis,which were divided into two groups. The patients from the 1st group (40 patients)in addition to standard therapy in the form of nonsteroidal antiinflammatorydrugs (NSAIDs) were applied topically “Karmolis” (gel for externaluse). The control group patients (20 patients) received standard therapy only.Duration of treatment was 2 weeks. The efficiency of treatment was evaluatedby dynamics of the index WOMAC, pain intensity at rest and with movement(VAS), assessment of disease activity by the physician and the patient (scaleLikert), availability of local hyperthermia and swelling of the affected joint, severityof synovitis, evaluating the effectiveness by the physician and the patient,a daily need for NSAIDs. Results. As a result of the treatment the patients of both groups showedpositive changes of clinical condition. At the same time among the patients,which had the complex therapy, including gel “Karmolis”, observed more than inthe control group, reductions in pain index WOMAC, pain on movement and atrest (VAS). Upon completion of the study significant improvement and improvementaccording to the physician was noted in 38 (95%) patients of group, whichused the “Karmolis”, which coincided with the results of self-assessment of patients.During treatment with “Karmolis” in 18 (45.0%) patients managed tolower starting dose of NSAIDs. The adverse reactions were rare and did not requirediscontinuation of therapy.Conclusion. «Karmolis» (gel for external use) is effective for the relief of clinicalsymptoms in patients with gonarthrosis, and has good tolerability and safetythat can be recommended for use in treatment of the knee osteoarthritis.Key words: gonarthrosis, therapy, gel «Karmolis»Contact: Elena Eduardovna Mozgovaya (nauka@pebma.ru)
Остеоартроз представляет собой гетерогенную группу заболеваний су-ставов различной этиологии со сходными биологическими, морфологически-ми и клиническими признаками. Помимо гиалинового хряща, при ОА патоло-гически изменяются и другие ткани сустава: синовиальная оболочка,субхондральная кость, суставная капсула, внутрисуставные связки и мышцы[1]. За последние годы отношение к данному заболеванию, как к дегенера-тивно-дистрофическому, претерпело существенные изменения, уступив ме-сто представлениям об участии в его патогенезе фенотипически измененныххондроцитов, синовиального воспаления, процессов. Протекающих в субхон-дральной кости. В поддержании хронического воспалительного процесса всуставах определенную роль играет иммунологический фактор. Источникомразвития аутоиммунных реакций при ОА могут служить не только протеогли-каны хряща, но также, ферменты антиоксидантной системы и пуриновогометаболизма, что может служить одним из механизмов изменения энзимнойактивности при этом заболевании [2, 3]. В последние годы появились дан-ные литературы, позволяющие рассматривать ОА, как системную метаболи-ческую болезнь [1, 4].С возрастом частота ОА резко возрастает: его рентгенологические при-знаки определяются у 90% женщин и у 80% мужчин старше 70 лет. Впервую очередь при ОА поражаются так называемые нагрузочные суставы,что значительно ухудшает качество жизни больных и представляет серьез-ную социально-экономическую проблему. Боль при ОА носит хроническийхарактер и во многом определяет качество жизни больных, страдающих этимнедугом.Важное место в терапии ОА занимает местная обезболивающая и проти-вовоспалительная терапия [5]. Наиболее часто в качестве средств, для ку-пирования боли при этом заболевании, используются нестероидные проти-вовоспалительные препараты (НПВП) [6, 7, 8]. Однако вне зависимости отспособа применения они обладают побочным действием, ограничивающимвозможность их длительного использования [6, 8]. В связи с этим особыйинтерес вызывают средства на основе натуральных природных ингредиентов, которые могут использоваться в комплексной терапии ОА локально,оказывая противовоспалительное и анальгезирующее действие. Имеетсяопыт успешного применения при болезнях опорно-двигательного аппаратажидкости «Кармолис», созданной по рецептуре, составленной монахами-кармелитами еще в XVI веке [9].В настоящее время появилась новая форма препарата «Кармолис» – гельдля наружного применения, который представляет собой лекарственноесредство с местнораздражающим, местнообезболивающим и противовоспа-лительным действием [10, 11, 12, 13]. Активными компонентами геля явля-ются левоментол, метилсалицилат, эфирные масла сосны, эвкалипта, тимья-на, индийской мяты, мускатного ореха, розмарина, лаванды, шалфея, аниса,гвоздики, а также терпентиновое масло, камфора. В качестве основноговспомогательного вещества используется этанол. Препарат наносится наболезненную область до 5 раз в сутки с последующим массажем данной зо-ны.Цель исследования состояла в оценке эффективности, переносимости ибезопасности препарата «Кармолис» (гель для наружного применения) упациентов с гонартрозом.Материалы и методы. В исследование были включены 60 больных го-нартрозом (женщин – 38 (63,3%), мужчин – 22(36,7%)). Диагноз гонартрозаустанавливался на основании критериев AСR, 1991 [1].Критерии включения: Первичный гонартроз; Возраст не менее 40 лет;Потребность в приеме НПВП (прием НПВП в течение как минимум 30 дней запоследние 3 месяца); Подписанное информированное согласие на участие внастоящем исследовании.Критерии исключения: Внутрисуставное введение глюкокортикостерои-дов в течение 1 месяца до исходного визита; Наличие тяжелых заболеванийдругих органов и систем (тяжелой сердечной недостаточности, неконтроли-руемой артериальной гипертензии, неконтролируемого сахарного диабета,злокачественных новообразований (любого генеза) и др.); Нарушения функ-ции почек; Бронхиальная астма; Указание на наличие в анамнезе аллерги-ческих реакций на какой-либо компонент геля «Кармолис»; Лекарственнаяи/или алкогольная зависимость в анамнезе; Открытые и кровоточащие раны,заболевания кожи, раздражение кожи в месте предполагаемого нанесенияпрепарата.Пациенты были рандомизированы на 2 группы. В основную (1-ю группу)вошли 40, контрольную (2-ю группу) – 20 больных (таблица 1). Группы былисопоставимы по оцениваемым показателям.
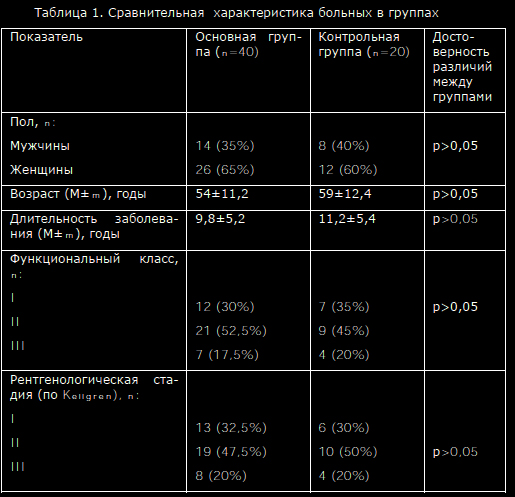 Больные обеих групп получали НПВП: 32 (53,3%) пациента – диклофе-нак, 17 (28,3%) – нимесулид, 11 (18,3%) – мелоксикам. Режим дозированияпрепаратов в обеих группах достоверно не различался. В комплексную тера-пию больных основной группы был добавлен препарат «Кармолис», который4 раза в сутки наносился на область пораженных суставов в виде полосокгеля длиной 4 см с последующим втиранием в кожу легкими массирующимидвижениями.Во время проведения исследования были исключены внутрисуставныевведения глюкокортикоидов и любых других препаратов, физиопроцедуры имассаж. Лечебная физкультура продолжалась, если пациент занимался еюпостоянно на протяжении не менее 3 недель до включения в исследование.Критерии оценки. Все пациенты обследовались дважды (перед курсомлечения и через 14 дней от начала терапии). Эффективность терапии определяли по динамике индекса WOMAC, ин-тенсивности боли в покое и при движении по визуальной аналоговой шкале,оценке активности заболевания врачом и пациентом (шкала Likert), оценкеэффективности лечения врачом и больным, суточной потребности в НПВП.Наличие и выраженность синовита устанавливали по клинико-лабораторными результатам ультразвукового исследования (УЗИ) суставов. Проводиласьрегистрация всех нежелательных явлений, возникших в процессе исследо-вания.Для статистической обработки данных использовались методы описа-тельной статистики, критерии Стьюдента и χ2. Достоверными считались раз-личия при р<0, 05.Результаты. На фоне проведенного лечения в обеих группах отмечалоськлиническое улучшение (табл. 2, 3, 4). При этом у больных, применявшихгель «Кармолис», наблюдалось большее, чем в контрольной группе сниже-ние боли по WOMAC (р<0,01), боли при движении и в покое (по ВАШ) (р<0,01).
Больные обеих групп получали НПВП: 32 (53,3%) пациента – диклофе-нак, 17 (28,3%) – нимесулид, 11 (18,3%) – мелоксикам. Режим дозированияпрепаратов в обеих группах достоверно не различался. В комплексную тера-пию больных основной группы был добавлен препарат «Кармолис», который4 раза в сутки наносился на область пораженных суставов в виде полосокгеля длиной 4 см с последующим втиранием в кожу легкими массирующимидвижениями.Во время проведения исследования были исключены внутрисуставныевведения глюкокортикоидов и любых других препаратов, физиопроцедуры имассаж. Лечебная физкультура продолжалась, если пациент занимался еюпостоянно на протяжении не менее 3 недель до включения в исследование.Критерии оценки. Все пациенты обследовались дважды (перед курсомлечения и через 14 дней от начала терапии). Эффективность терапии определяли по динамике индекса WOMAC, ин-тенсивности боли в покое и при движении по визуальной аналоговой шкале,оценке активности заболевания врачом и пациентом (шкала Likert), оценкеэффективности лечения врачом и больным, суточной потребности в НПВП.Наличие и выраженность синовита устанавливали по клинико-лабораторными результатам ультразвукового исследования (УЗИ) суставов. Проводиласьрегистрация всех нежелательных явлений, возникших в процессе исследо-вания.Для статистической обработки данных использовались методы описа-тельной статистики, критерии Стьюдента и χ2. Достоверными считались раз-личия при р<0, 05.Результаты. На фоне проведенного лечения в обеих группах отмечалоськлиническое улучшение (табл. 2, 3, 4). При этом у больных, применявшихгель «Кармолис», наблюдалось большее, чем в контрольной группе сниже-ние боли по WOMAC (р<0,01), боли при движении и в покое (по ВАШ) (р<0,01).
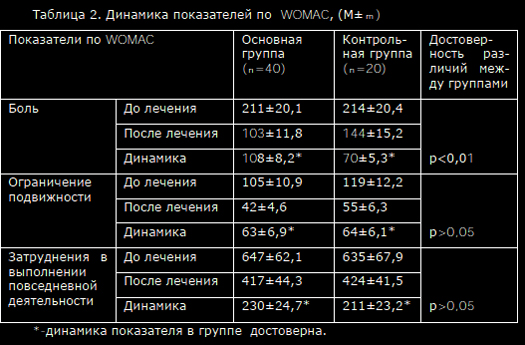
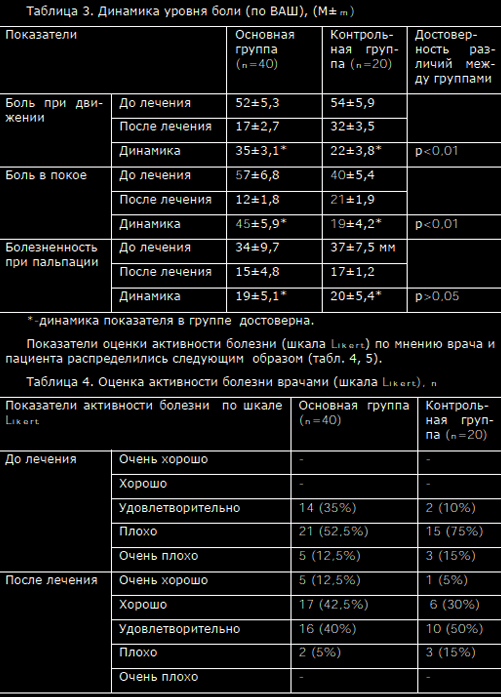 К окончанию исследования наблюдалось по оценке врачей очень хоро-шее и хорошее состояние у 22 (55%) больных основной и 7 (35%) пациентовконтрольной группы, 25 (62,5%) больных основной и 8 (40%) контрольнойгруппы считали свое состояние хорошим и очень хорошим. Однако эти раз-личия статистически недостоверны.К моменту завершения исследования, по мнению врачей, значительноеулучшение и улучшение было отмечено у 38 (95%) больных, применявших«Кармолис», что совпало с результатами самооценки пациентов (рисунок 1).УЗИ коленных суставов проводили на ультразвуковом аппарате Accuvix-V10 (фирмы Medison, производство Южная Корея) линейным датчиком с ча-стотой 5-12 МГц с применением В-режима. При этом до лечения признакисиновита были выявлены у 23 (57,5%) пациентов основной и у 13 (65%) -контрольной группы. По окончании курса лечения пациентам с выявленнымсиновитом УЗИ суставов было проведено повторно. В обеих группах наблю-далось уменьшение явлений синовита, однако достоверных различий междугруппами выявлено не было (табл. 6).
К окончанию исследования наблюдалось по оценке врачей очень хоро-шее и хорошее состояние у 22 (55%) больных основной и 7 (35%) пациентовконтрольной группы, 25 (62,5%) больных основной и 8 (40%) контрольнойгруппы считали свое состояние хорошим и очень хорошим. Однако эти раз-личия статистически недостоверны.К моменту завершения исследования, по мнению врачей, значительноеулучшение и улучшение было отмечено у 38 (95%) больных, применявших«Кармолис», что совпало с результатами самооценки пациентов (рисунок 1).УЗИ коленных суставов проводили на ультразвуковом аппарате Accuvix-V10 (фирмы Medison, производство Южная Корея) линейным датчиком с ча-стотой 5-12 МГц с применением В-режима. При этом до лечения признакисиновита были выявлены у 23 (57,5%) пациентов основной и у 13 (65%) -контрольной группы. По окончании курса лечения пациентам с выявленнымсиновитом УЗИ суставов было проведено повторно. В обеих группах наблю-далось уменьшение явлений синовита, однако достоверных различий междугруппами выявлено не было (табл. 6).
 При динамическом наблюдении пациентов обеих групп отмечалосьуменьшение припухлости и локальной гипертермии пораженных коленныхсуставов. В тоже время достоверных различий динамики данных симптомовмежду группами выявлено не было. Применение геля «Кармолис» в ком-плексной терапии гонартроза позволяло снижать суточную дозу НПВП досто-верно чаще, чем в группе контроля (табл. 7).
При динамическом наблюдении пациентов обеих групп отмечалосьуменьшение припухлости и локальной гипертермии пораженных коленныхсуставов. В тоже время достоверных различий динамики данных симптомовмежду группами выявлено не было. Применение геля «Кармолис» в ком-плексной терапии гонартроза позволяло снижать суточную дозу НПВП досто-верно чаще, чем в группе контроля (табл. 7).
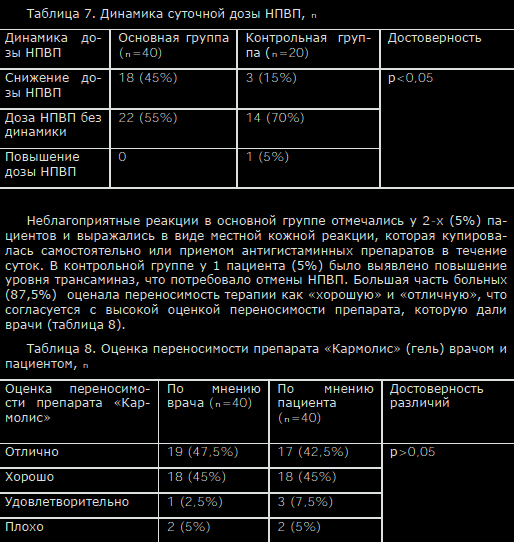 Немаловажным достоинством геля «Кармолис» являлась его быстрая вса-сываемость: от 45 сек до 3 мин. При этом препарат не оставлял следов накоже и обладал приятным запахом. Время до появления анальгетическогодействия варьировало в интервале от 15 до 50 мин, а продолжительностьдействия от 3до 7 часов. Хорошая переносимость геля «Кармолис», наряду сотличными потребительскими качествами, обусловила высокую комплаент-ность его применения – 100%.Таким образом, включение препарата «Кармолис» (гель для наружногоприменения) в комплексную терапию пациентов с гонартрозом способствует повышению эффективности лечения и позволяет снизить суточную дозуНПВП. Препарат характеризуется хорошей переносимостью и может бытьрекомендован для широкого использования в комплексной терапии гонартроза.
ЛитератураРевматология: Национальное руководство. Под редакцией акад. РАМННасонова ЕЛ, акад. РАМН Насоновой ВА. М.: ГЭОТАР-Медиа. 2011, 738с.Зборовский АБ, Мозговая ЕЭ, Герусов ЮИ, Бедина СА, Стажаров МЮ, Ер-молаева НА, Мартемьянов ВФ. Клинико-патогенетическое значение активно-сти энзимов нуклеинового метаболизма в лизатах эритроцитов и сывороткекрови при остеоартрозе. Клиническая медицина. 2010; (4): 52-55.Зборовский АБ, Заводовский БВ, Никитина НВ, Яшина ЮВ, Будкова ЕВ,Доронина ИВ, Павлова АБ, Зборовская ИА. Клинико-патогенетическое значе-ние нарушений липидного обмена у больных с остеоартрозом. Вестник Вол-гоградского государственного медицинского университета. 2010; (3): 69-71.Насонова ВА. Остеоартроз – проблема полиморбидности. Consiliummedicum. 2009; 11 (2): 5-8.Александров АВ, Грехов РА, Алехина ИЮ. Эффективность восстанови-тельной терапии при дегенеративных заболеваниях суставов. Врач. 2009;(10): 66-67.Насонова ВА, Муравьев ЮВ, Кузьмина НН. Локальная терапия суставногосиндрома кремом «Долгит» или системное применение нестероидных проти-вовоспалительных препаратов. Тер. Архив, 1998. (11): 65-66.Полякова ЮВ, Сивордова ЛЕ, Симакова ЕС, Кравцов ВИ, Кравцова ЕГ, За-водовский БВ. Опыт применения препарата «Немулекс» в лечении суставно-го синдрома при остеоартрозе. Русский медицинский журнал, Ревматология.2013; (6): 310-312.Хитров НА, Цурко ВВ, Семочкина ЕН. Локальная терапия остеоартроза.Лечащий врач. 2002 (3): 54-58.Денисов Л. Н., Насонова В. А., Е. И., Тахтай АВ, Шмидт ЕИ, ЗаводовскийБВ, Меньшикова ЛВ, Рассохин ВВ, Лебедева ОВ, Ребров АП, Везикова НН,Архангельская ГС, Оттева ЭН, Дашина ТА, Кормильцева ЕА, Белозерцева ЛВ,Сороцкая ВН, Раскина ТА, Иванова ОН, Ходашинская АВ. Опыт примененияжидкости «Кармолис» для локальной терапии ревматических заболеваний(по данным многоцентрового клинического исследования). Научно-практическая ревматология. 2005 (5): 40-43.Bauer KH, Fromming KH, Fuhter C. Pharmazeutische Technologic, 4 Auflage.1997. 193-194.Ensingbach T, Klumper A, Biedermann L. Sportphysiologie undRehabilitation. 1988. 192-215.Hänsel R, Sticher O, Steinegger E. Pharmakognosie -Phytopharmazi. 1999,29-35.Mütschler E. Arztncimittelwirkungen, 7 Auflage. 1996, 195-198.Опубликовано в журнале «Научно-практическая ревматология», 2014, №3
Зборовская И.А., Русанова О.А., Парамонова О.В.,Герусова Н.М., Трубенко Ю.А.
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ КАРТИНЫ У БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ В СОЧЕТАНИИ С ПОРАЖЕНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Известно, что поражение щитовидной железы (ЩЖ) достаточно частонаблюдается при системной красной волчанке (СКВ).Цель исследования. С учетом того, что аутоиммунный процесс при СКВраспространяется на многие органы и ткани, нами было решено изучить осо-бенности клинических проявлений в группе больных имеющих сочетаннуюпатологию – СКВ и поражение щитовидной железы.Материалы и методы. Из 65 обследованных больных с СКВ на основа-нии комплексного клинико-лабораторного и инструментального обследова-ния какие-либо изменения щитовидной железы выявлены у трети больных(n=22; 33,8%,), что было достоверно выше общепопуляционного значения(2%, 2010 г; p=0,0001).По различным литературным данным, частота тиреоидной патологии приСКВ весьма различна – от 8,8% до 24,1%, а по данным Biro E. с соавт. рас-пространенность тиреоидита Хашимото при СКВ оказалась в 90 раз выше,чем среди населения в целом. Вероятно, подобное сопоставление данных несовсем корректно, так как в приведенных работах под тиреоидной патологи-ей понимались нет только аутоиммунный тиреоидит (АИТ), ДТЗ, пр., а такжесубклинические гормональные изменения и/или наличие антитиреоидныхантител.Среди тиреоидной патологии у обследованных нами больных СКВ АИТконстатирован в 13 случаях (59% среди всей выявленной тиреоидной пато-логии у обследованных пациентов и 20% по отношению к общему количе-ству больных СКВ); у 5 (22,7%) пациентов диагностирован узловой зоб – у 4пациентов I-ой степени по ВОЗ и у 1 больного – II-ей степени по ВОЗ; вединичных случаях отмечался диффузный токсический зоб – 1 (4,5%), сме-шанный зоб – 3 (13,6% среди всей тиреоидной патологии). Все пациентыбыли женщины, в возрасте от 21 до 77 лет (средний возраст составил55,16±15,3 лет). Продолжительность СКВ – 5,08±3,29 лет. Средняя продол-жительность манифестного заболевания щитовидной железы составила3,011,74 года, что в большинстве случаев, свидетельствует о разви-тии/обострении тиреоидной патологии на фоне уже имеющейся СКВ.Таким образом, доминирующей патологией ЩЖ при СКВ ожидаемо ока-зался АИТ. Частота его в нашем исследовании (20%) была несколько выше,чем в общей популяции: в частности, аутоиммунный тиреоидит встречается у3—4% населения Земли. Частота клинически выраженных форм заболевания составляет 1%. Число женщин с аутоимунным тиреоидитом превышает коли-чество мужчин в 4—8 раз. Чаще всего болезнь диагностируется у женщинстарше 60 лет — частота в популяции 6—11%. Распространенность заболе-вания у детей составляет 0,1—1,2%; а по данным Biro E. с соавт., 2006 г.,как уже обсуждалось, распространенность тиреоидита Хашимото при СКВоказалась в 90 раз выше, чем среди населения в целом.Результаты и обсуждение. С функциональной точки зрения у больныхСКВ с тиреоидной патологией отмечалась преимущественно сниженная(54,5%) и, реже, нормальная функция ЩЖ (40,9%). Гипотиреоз был чащесубклинический (7 – 31,8%). У 6 (27,2%) пациентов отмечался манифестныйгипотиреоз в разных стадиях компенсации. Гиперфункция ЩЖ была выявле-на у 1 пациента с ДТЗ. Снижение функции ЩЖ отмечалось исключительно убольных с АИТ; все пациенты, имевшие различные формы зоба, были эути-реоидны.В отношении частоты субклинического гипотиреоза наши данные совпа-дают с некоторыми литературными данными, где частота субклиническогогипотиреоза оказалась довольно высокой – 28,9%. В целом, складываетсявпечатление, что частота и варианты тиреоидной патологии также немалосвязаны с той популяцией больных, где проводилось то или иное исследова-ние. Большинство системных проявлений, таких как васкулиты, лимфоаде-нопатия, синдром Рейно встречалось в данной группе с одинаковой ча-стотой. Однако отмечена большая частота поражения сердца (9 больных– 40,9%) и серозных оболочек (7 человек – 31,8 %) у больных с сопут-ствующей аутотиреоидной патологией.Жалобы и клинические симптомы у больных СКВ с тиреоидной патологи-ей оценивались по диагностическим критериям MEDIAN. У обследованныхнами больных при изучении патологии, связанной с сопутствующим заболе-ванием щитовидной железы, в первую очередь обращали на себя вниманиехарактерные жалобы. Среди них наиболее частыми были жалобы астено-невротического характера: общая слабость (100%), утомляемость (100%). Убольных с гипертиреозом отмечалась повышенная потливость (66,7%), по-худание, дрожание рук (83,3%), сердцебиение. У больных СКВ с гипотирео-зом частыми оказались трофические расстройства, такие как ломкость ног-тей и выпадение волос, которые встречались у 80% больных. Из другихсимптомов, ассоциируемых с тиреоидной патологией, обращало вниманиечастое поражение сердечно-сосудистой системы: тахикардия (66,7%), нару-шение ритма (33,3%) и блокады различного рода (16,6%), кардиалгии(50%), изменения миокарда, главным образом, обменно-дистрофическогохарактера и некоторые другие.Больные СКВ с тиреоидной патологией имели достоверно более значи-тельный возраст в сравнении с группой без поражения ЩЖ (55,16±15,3 и42,5±12,1 лет, p<0,05), за счет того, что среди лиц с поражением ЩЖ пре-обладали женщины в возрасте более 45 лет: 51,3% против 31,8% (p<0,05).Констатировано отсутствие разницы по половой принадлежности, что можнообъяснить преобладанием заболеваемости СКВ среди женщин. Давность бо-лезни была сопоставима (5,08±3,29 и 8,4±6,7 года, p>0,05, соответствен-но). В группе больных СКВ с тиреоидной патологией также можно констатировать выраженную иммунологическую активность болезни, поскольку поколичеству больных, позитивных по антителам к денатурированной ДНК,группа пациентов с поражением ЩЖ значимо превышала таковую без тирео-идной патологии. Количественная оценка обнаружила отчетливую тенден-цию к росту уровня ЦИК, Ig A,M,G у больных с поражением ЩЖ.Индекс повреждения SLICC/ACR в группе с поражением ЩЖ был значимовыше, чем у больных без патологии органа – 4,55 и 3,6 баллов (p=0,002).Этот факт весьма важен, закономерен с учетом вышесказанного и свиде-тельствует о большей тяжести течения СКВ в анамнезе у больных с пораже-нием ЩЖ, что привело к более значительным стойким органным изменениям.Очевидно, это связано с более высокой активностью СКВ в анамнезе, по-скольку давность СКВ в обеих группах была сопоставима, имелось лишь незначимое снижение давности заболевания в группе тиреоидной патологии,что также можно объяснить большей активностью иммунной системы. Этосуждение подтверждалось при анализе органных поражений у больных СКВс тиреоидной патологией. У данной группы больных превалировали пораже-ние суставов (79,5% и 49,9%, p=0,05), серозных оболочек в виде главнымобразом адгезивного, реже экссудативного плеврита (39,4%, 3,0% и 3,0%,0% – соответственно, p<0,05), сердца (66,7 и 24,8% соответственно,p<0,05), лихорадка (23,1% против 15,1%, p>0,05), полинейропатия (36,4%и 23,6%, p>0,05, соответственно), LE-клеточный феномен (44,8% и 31,5%,p<0,05).Синдром Рейно и волчаночный нефрит отмечались у большинства боль-ных независимо от наличия или отсутствия вовлечения в процесс ЩЖ. Лей-копения и тромбоцитопения чаще были в группе с тиреоидной патологией,причем тромбоцитопения была достоверно чаще (20,2% и 5,5% – p<0,05,соответственно). Несколько чаще у больных СКВ с поражением ЩЖ отмечентромбофлебит, хотя и не достоверно (12,8% и 4,5%, p>0,05, соответствен-но), очевидно вследствие более частого наличия вторичного АФС (33,4% и24,6%, p>0,05). Обращало внимание, что синдром Шегрена среди обследо-ванных больных СКВ также ассоциировался с поражением ЩЖ.Поскольку активность СКВ в двух группах была сопоставима, ожидаемозначения СОЭ и СРБ у пациентов с тиреоидной патологией и без нее прак-тически не отличались (СОЭ – 29,8±3,1 и 31,3±1,5 мм/час, СРБ – 4,7±0,84и 4,5±1,02 г/л – соответственно). Не было достоверного отличия по пара-метру, отражающего, в частности, степень лабораторного воспаления, -уровню фибриногена (306,6±81,2 и 294,5±103,7 г/л соответственно,p>0,05).Степень активности по критериям SLEDAI и SLEDAI K2 была также выше вподгруппе АИТ. По мнению исследователей, аутоиммунное тиреоидное пора-жение в ряде случаев манифестирует вследствие появления антител к анти-генам щитовидной железы, что подразумевает значительную активность им-муновоспалительного процесса при СКВ, что мы и могли отметить у обследо-ванных больных СКВ с поражением ЩЖ в виде АИТ. Считают, что, вероятно,повышение уровня интерферона и цитокинов во время обострения СКВ при-водит к аномальной реакции главного комплекса гистосовместимости на антигены тиреоцитов, провоцирует аутоиммунные реакции и синтез антитирео-идных антител.По индексу повреждения подгруппы тиреоидной патологии не отлича-лись. Поражения кожи, сердца, нервной системы, легких, почек, крови,свойственные СКВ, отмечались у больных с различными вариантами тирео-идной патологии приблизительно одинаково. Следует отметить, что приналичии АИТ чаще отмечался АФС.Выводы. Таким образом, обращает внимание, что пациенты СКВ с ауто-иммунной патологией щитовидной железы (АИТ) имеют достоверно болеевысокую степень активности (отличающейся от подгрупп с другими вариан-тами патологии ЩЖ со степенью, близкой к достоверности).
Зудбинова В.Ю., Зудбинова Е.В., Соболева Т.Н.
ИССЛЕДОВАНИЕ ПАРАМЕТРОВ ОБЩЕКЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У ПАЦИЕНТОВ С СИСТЕМНЫМИ ПРОЯВЛЕНИЯМИ РЕВМАТОИДНОГО АРТРИТА
ГБУ РОСТОВСКОЙ ОБЛАСТИ ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА № 2МБУЗ ГОРОДСКАЯ ПОЛИКЛИНИКА № 4 Г. РОСТОВА-Н-ДОНУ
Исследование параметров общеклинического анализа крови имеетбольшое значение при ведении пациентов с ревматоидным артритом, как вкачестве критерия оценки активности воспалительного процесса, так и мар-кера внесуставных проявлений, а также позволяет осуществлять контрольэффективности терапии. Кроме того, доступность данного анализа делаетвозможным мониторинг пациентов на всех этапах медицинской помощи, нетолько в специализированных учреждениях, но и в отдаленных районах.В свете вышеизложенного Целью работы явилось изучение особенно-стей общеклинического анализа крови у пациентов с различными варианта-ми течения ревматоидного артрита, в частности при наличии системных про-явлений заболевания.Работа выполнена на базе ревматологического отделения ГБУ РО Об-ластной больницы № 2 обследовано 90 больных ревматоидным артритом, изкоторых 83 чел (92%) составили женщины, 7 чел (8%) – мужчины в воз-расте от 19 до 74 лет, имеющие умеренную (61 чел -68%), и высокую (29чел-32%) степени активности воспалительного процесса. Из всех обследо-ванных больных 45 чел (50%) страдали суставной формой РА, а у остальных45 пациентов были диагностированы различные поражения внутренних ор-ганов (астенический синдром, ревматоидные узелки, миопатия, амиотрофия,лимфаденопатия, анемия, васкулит, полинейропатия, поражение легких,синдром Фелти, поражение сердца, поражение глаз, остеопороз, нефропа-тия), из них 22 пациента (24% от числа всех обследованных) были серопо-зитивны по ревматоидному фактору, 23 пациента (26%) были серонегативны по РФ. В качестве контрольной группы были использованы 20 здоровых до-норов. Полученные Результаты обрабатывались посредством методов вари-ационной медицинской статистики (Statiatica 6,0) с применением непарамет-рических критериев Манна-Уитни-Вилконсона. Достоверными считались Ре-зультаты при р<0,05.Обсуждение полученных результатов. При оценке показателей общегоанализа крови, полученных у больных с серопозитивным вариантом висце-ральной формы РА при умеренной степени активности воспалительного про-цесса, установлено, что у пациентов этой категории содержание в кровипалочкоядерных нейтрофилов, моноцитов и скорость оседания эритроцитовповышены по сравнению с донорскими показателями. Содержание гемогло-бина, абсолютное количество эритроцитов, лейкоцитов, тромбоцитов и про-цент лимфоцитов, эозинофилов и сегментоядерных нейтрофилов у этихбольных существенно не отличалось от контроля.У пациентов с высокой степенью активности серопозитивного РА с си-стемными проявлениями абсолютное количество лейкоцитов, тромбоцитов ипроцент палочкоядерных нейтрофилов и моноцитов, а также скорость оседа-ния эритроцитов превышали соответствующие параметры у доноров, тогдакак содержание гемоглобина и процент лимфоцитов – были, напротив, сни-жены по сравнению с контролем. В отношении абсолютного числа эритроци-тов и процентного содержания эозинофилов и сегментоядерных нейтрофи-лов достоверных отличий от показателей здоровых лиц выявлено не было.При сопоставлении между собой результатов групп пациентов с раз-личными степенями активности воспалительного процесса при серопозитив-ном варианте РА с внесуставными проявлениями обнаружено, что у больныхс высокой степенью активности РА абсолютное количество лейкоцитов,тромбоцитов и скорость оседания эритроцитов достоверно превышали соот-ветствующие параметры у пациентов с умеренной степенью активности вос-паления. Такие параметры как содержание эритроцитов, гемоглобина, про-цент лимфоцитов, эозинофилов, палочкоядерных и сегментоядерныхнейтрофилов и моноцитов, у больных серопозитивным РА с висцеропатиямив зависимости от степени активности воспаления статистически значимыхотличий не имели.Сравнительный анализ показателей общего анализа крови у больных сcеропозитивным вариантом висцеральной формы ревматоидного артрита приразличных степенях активности
Немаловажным достоинством геля «Кармолис» являлась его быстрая вса-сываемость: от 45 сек до 3 мин. При этом препарат не оставлял следов накоже и обладал приятным запахом. Время до появления анальгетическогодействия варьировало в интервале от 15 до 50 мин, а продолжительностьдействия от 3до 7 часов. Хорошая переносимость геля «Кармолис», наряду сотличными потребительскими качествами, обусловила высокую комплаент-ность его применения – 100%.Таким образом, включение препарата «Кармолис» (гель для наружногоприменения) в комплексную терапию пациентов с гонартрозом способствует повышению эффективности лечения и позволяет снизить суточную дозуНПВП. Препарат характеризуется хорошей переносимостью и может бытьрекомендован для широкого использования в комплексной терапии гонартроза.
ЛитератураРевматология: Национальное руководство. Под редакцией акад. РАМННасонова ЕЛ, акад. РАМН Насоновой ВА. М.: ГЭОТАР-Медиа. 2011, 738с.Зборовский АБ, Мозговая ЕЭ, Герусов ЮИ, Бедина СА, Стажаров МЮ, Ер-молаева НА, Мартемьянов ВФ. Клинико-патогенетическое значение активно-сти энзимов нуклеинового метаболизма в лизатах эритроцитов и сывороткекрови при остеоартрозе. Клиническая медицина. 2010; (4): 52-55.Зборовский АБ, Заводовский БВ, Никитина НВ, Яшина ЮВ, Будкова ЕВ,Доронина ИВ, Павлова АБ, Зборовская ИА. Клинико-патогенетическое значе-ние нарушений липидного обмена у больных с остеоартрозом. Вестник Вол-гоградского государственного медицинского университета. 2010; (3): 69-71.Насонова ВА. Остеоартроз – проблема полиморбидности. Consiliummedicum. 2009; 11 (2): 5-8.Александров АВ, Грехов РА, Алехина ИЮ. Эффективность восстанови-тельной терапии при дегенеративных заболеваниях суставов. Врач. 2009;(10): 66-67.Насонова ВА, Муравьев ЮВ, Кузьмина НН. Локальная терапия суставногосиндрома кремом «Долгит» или системное применение нестероидных проти-вовоспалительных препаратов. Тер. Архив, 1998. (11): 65-66.Полякова ЮВ, Сивордова ЛЕ, Симакова ЕС, Кравцов ВИ, Кравцова ЕГ, За-водовский БВ. Опыт применения препарата «Немулекс» в лечении суставно-го синдрома при остеоартрозе. Русский медицинский журнал, Ревматология.2013; (6): 310-312.Хитров НА, Цурко ВВ, Семочкина ЕН. Локальная терапия остеоартроза.Лечащий врач. 2002 (3): 54-58.Денисов Л. Н., Насонова В. А., Е. И., Тахтай АВ, Шмидт ЕИ, ЗаводовскийБВ, Меньшикова ЛВ, Рассохин ВВ, Лебедева ОВ, Ребров АП, Везикова НН,Архангельская ГС, Оттева ЭН, Дашина ТА, Кормильцева ЕА, Белозерцева ЛВ,Сороцкая ВН, Раскина ТА, Иванова ОН, Ходашинская АВ. Опыт примененияжидкости «Кармолис» для локальной терапии ревматических заболеваний(по данным многоцентрового клинического исследования). Научно-практическая ревматология. 2005 (5): 40-43.Bauer KH, Fromming KH, Fuhter C. Pharmazeutische Technologic, 4 Auflage.1997. 193-194.Ensingbach T, Klumper A, Biedermann L. Sportphysiologie undRehabilitation. 1988. 192-215.Hänsel R, Sticher O, Steinegger E. Pharmakognosie -Phytopharmazi. 1999,29-35.Mütschler E. Arztncimittelwirkungen, 7 Auflage. 1996, 195-198.Опубликовано в журнале «Научно-практическая ревматология», 2014, №3
Зборовская И.А., Русанова О.А., Парамонова О.В.,Герусова Н.М., Трубенко Ю.А.
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ КАРТИНЫ У БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ В СОЧЕТАНИИ С ПОРАЖЕНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Известно, что поражение щитовидной железы (ЩЖ) достаточно частонаблюдается при системной красной волчанке (СКВ).Цель исследования. С учетом того, что аутоиммунный процесс при СКВраспространяется на многие органы и ткани, нами было решено изучить осо-бенности клинических проявлений в группе больных имеющих сочетаннуюпатологию – СКВ и поражение щитовидной железы.Материалы и методы. Из 65 обследованных больных с СКВ на основа-нии комплексного клинико-лабораторного и инструментального обследова-ния какие-либо изменения щитовидной железы выявлены у трети больных(n=22; 33,8%,), что было достоверно выше общепопуляционного значения(2%, 2010 г; p=0,0001).По различным литературным данным, частота тиреоидной патологии приСКВ весьма различна – от 8,8% до 24,1%, а по данным Biro E. с соавт. рас-пространенность тиреоидита Хашимото при СКВ оказалась в 90 раз выше,чем среди населения в целом. Вероятно, подобное сопоставление данных несовсем корректно, так как в приведенных работах под тиреоидной патологи-ей понимались нет только аутоиммунный тиреоидит (АИТ), ДТЗ, пр., а такжесубклинические гормональные изменения и/или наличие антитиреоидныхантител.Среди тиреоидной патологии у обследованных нами больных СКВ АИТконстатирован в 13 случаях (59% среди всей выявленной тиреоидной пато-логии у обследованных пациентов и 20% по отношению к общему количе-ству больных СКВ); у 5 (22,7%) пациентов диагностирован узловой зоб – у 4пациентов I-ой степени по ВОЗ и у 1 больного – II-ей степени по ВОЗ; вединичных случаях отмечался диффузный токсический зоб – 1 (4,5%), сме-шанный зоб – 3 (13,6% среди всей тиреоидной патологии). Все пациентыбыли женщины, в возрасте от 21 до 77 лет (средний возраст составил55,16±15,3 лет). Продолжительность СКВ – 5,08±3,29 лет. Средняя продол-жительность манифестного заболевания щитовидной железы составила3,011,74 года, что в большинстве случаев, свидетельствует о разви-тии/обострении тиреоидной патологии на фоне уже имеющейся СКВ.Таким образом, доминирующей патологией ЩЖ при СКВ ожидаемо ока-зался АИТ. Частота его в нашем исследовании (20%) была несколько выше,чем в общей популяции: в частности, аутоиммунный тиреоидит встречается у3—4% населения Земли. Частота клинически выраженных форм заболевания составляет 1%. Число женщин с аутоимунным тиреоидитом превышает коли-чество мужчин в 4—8 раз. Чаще всего болезнь диагностируется у женщинстарше 60 лет — частота в популяции 6—11%. Распространенность заболе-вания у детей составляет 0,1—1,2%; а по данным Biro E. с соавт., 2006 г.,как уже обсуждалось, распространенность тиреоидита Хашимото при СКВоказалась в 90 раз выше, чем среди населения в целом.Результаты и обсуждение. С функциональной точки зрения у больныхСКВ с тиреоидной патологией отмечалась преимущественно сниженная(54,5%) и, реже, нормальная функция ЩЖ (40,9%). Гипотиреоз был чащесубклинический (7 – 31,8%). У 6 (27,2%) пациентов отмечался манифестныйгипотиреоз в разных стадиях компенсации. Гиперфункция ЩЖ была выявле-на у 1 пациента с ДТЗ. Снижение функции ЩЖ отмечалось исключительно убольных с АИТ; все пациенты, имевшие различные формы зоба, были эути-реоидны.В отношении частоты субклинического гипотиреоза наши данные совпа-дают с некоторыми литературными данными, где частота субклиническогогипотиреоза оказалась довольно высокой – 28,9%. В целом, складываетсявпечатление, что частота и варианты тиреоидной патологии также немалосвязаны с той популяцией больных, где проводилось то или иное исследова-ние. Большинство системных проявлений, таких как васкулиты, лимфоаде-нопатия, синдром Рейно встречалось в данной группе с одинаковой ча-стотой. Однако отмечена большая частота поражения сердца (9 больных– 40,9%) и серозных оболочек (7 человек – 31,8 %) у больных с сопут-ствующей аутотиреоидной патологией.Жалобы и клинические симптомы у больных СКВ с тиреоидной патологи-ей оценивались по диагностическим критериям MEDIAN. У обследованныхнами больных при изучении патологии, связанной с сопутствующим заболе-ванием щитовидной железы, в первую очередь обращали на себя вниманиехарактерные жалобы. Среди них наиболее частыми были жалобы астено-невротического характера: общая слабость (100%), утомляемость (100%). Убольных с гипертиреозом отмечалась повышенная потливость (66,7%), по-худание, дрожание рук (83,3%), сердцебиение. У больных СКВ с гипотирео-зом частыми оказались трофические расстройства, такие как ломкость ног-тей и выпадение волос, которые встречались у 80% больных. Из другихсимптомов, ассоциируемых с тиреоидной патологией, обращало вниманиечастое поражение сердечно-сосудистой системы: тахикардия (66,7%), нару-шение ритма (33,3%) и блокады различного рода (16,6%), кардиалгии(50%), изменения миокарда, главным образом, обменно-дистрофическогохарактера и некоторые другие.Больные СКВ с тиреоидной патологией имели достоверно более значи-тельный возраст в сравнении с группой без поражения ЩЖ (55,16±15,3 и42,5±12,1 лет, p<0,05), за счет того, что среди лиц с поражением ЩЖ пре-обладали женщины в возрасте более 45 лет: 51,3% против 31,8% (p<0,05).Констатировано отсутствие разницы по половой принадлежности, что можнообъяснить преобладанием заболеваемости СКВ среди женщин. Давность бо-лезни была сопоставима (5,08±3,29 и 8,4±6,7 года, p>0,05, соответствен-но). В группе больных СКВ с тиреоидной патологией также можно констатировать выраженную иммунологическую активность болезни, поскольку поколичеству больных, позитивных по антителам к денатурированной ДНК,группа пациентов с поражением ЩЖ значимо превышала таковую без тирео-идной патологии. Количественная оценка обнаружила отчетливую тенден-цию к росту уровня ЦИК, Ig A,M,G у больных с поражением ЩЖ.Индекс повреждения SLICC/ACR в группе с поражением ЩЖ был значимовыше, чем у больных без патологии органа – 4,55 и 3,6 баллов (p=0,002).Этот факт весьма важен, закономерен с учетом вышесказанного и свиде-тельствует о большей тяжести течения СКВ в анамнезе у больных с пораже-нием ЩЖ, что привело к более значительным стойким органным изменениям.Очевидно, это связано с более высокой активностью СКВ в анамнезе, по-скольку давность СКВ в обеих группах была сопоставима, имелось лишь незначимое снижение давности заболевания в группе тиреоидной патологии,что также можно объяснить большей активностью иммунной системы. Этосуждение подтверждалось при анализе органных поражений у больных СКВс тиреоидной патологией. У данной группы больных превалировали пораже-ние суставов (79,5% и 49,9%, p=0,05), серозных оболочек в виде главнымобразом адгезивного, реже экссудативного плеврита (39,4%, 3,0% и 3,0%,0% – соответственно, p<0,05), сердца (66,7 и 24,8% соответственно,p<0,05), лихорадка (23,1% против 15,1%, p>0,05), полинейропатия (36,4%и 23,6%, p>0,05, соответственно), LE-клеточный феномен (44,8% и 31,5%,p<0,05).Синдром Рейно и волчаночный нефрит отмечались у большинства боль-ных независимо от наличия или отсутствия вовлечения в процесс ЩЖ. Лей-копения и тромбоцитопения чаще были в группе с тиреоидной патологией,причем тромбоцитопения была достоверно чаще (20,2% и 5,5% – p<0,05,соответственно). Несколько чаще у больных СКВ с поражением ЩЖ отмечентромбофлебит, хотя и не достоверно (12,8% и 4,5%, p>0,05, соответствен-но), очевидно вследствие более частого наличия вторичного АФС (33,4% и24,6%, p>0,05). Обращало внимание, что синдром Шегрена среди обследо-ванных больных СКВ также ассоциировался с поражением ЩЖ.Поскольку активность СКВ в двух группах была сопоставима, ожидаемозначения СОЭ и СРБ у пациентов с тиреоидной патологией и без нее прак-тически не отличались (СОЭ – 29,8±3,1 и 31,3±1,5 мм/час, СРБ – 4,7±0,84и 4,5±1,02 г/л – соответственно). Не было достоверного отличия по пара-метру, отражающего, в частности, степень лабораторного воспаления, -уровню фибриногена (306,6±81,2 и 294,5±103,7 г/л соответственно,p>0,05).Степень активности по критериям SLEDAI и SLEDAI K2 была также выше вподгруппе АИТ. По мнению исследователей, аутоиммунное тиреоидное пора-жение в ряде случаев манифестирует вследствие появления антител к анти-генам щитовидной железы, что подразумевает значительную активность им-муновоспалительного процесса при СКВ, что мы и могли отметить у обследо-ванных больных СКВ с поражением ЩЖ в виде АИТ. Считают, что, вероятно,повышение уровня интерферона и цитокинов во время обострения СКВ при-водит к аномальной реакции главного комплекса гистосовместимости на антигены тиреоцитов, провоцирует аутоиммунные реакции и синтез антитирео-идных антител.По индексу повреждения подгруппы тиреоидной патологии не отлича-лись. Поражения кожи, сердца, нервной системы, легких, почек, крови,свойственные СКВ, отмечались у больных с различными вариантами тирео-идной патологии приблизительно одинаково. Следует отметить, что приналичии АИТ чаще отмечался АФС.Выводы. Таким образом, обращает внимание, что пациенты СКВ с ауто-иммунной патологией щитовидной железы (АИТ) имеют достоверно болеевысокую степень активности (отличающейся от подгрупп с другими вариан-тами патологии ЩЖ со степенью, близкой к достоверности).
Зудбинова В.Ю., Зудбинова Е.В., Соболева Т.Н.
ИССЛЕДОВАНИЕ ПАРАМЕТРОВ ОБЩЕКЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У ПАЦИЕНТОВ С СИСТЕМНЫМИ ПРОЯВЛЕНИЯМИ РЕВМАТОИДНОГО АРТРИТА
ГБУ РОСТОВСКОЙ ОБЛАСТИ ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА № 2МБУЗ ГОРОДСКАЯ ПОЛИКЛИНИКА № 4 Г. РОСТОВА-Н-ДОНУ
Исследование параметров общеклинического анализа крови имеетбольшое значение при ведении пациентов с ревматоидным артритом, как вкачестве критерия оценки активности воспалительного процесса, так и мар-кера внесуставных проявлений, а также позволяет осуществлять контрольэффективности терапии. Кроме того, доступность данного анализа делаетвозможным мониторинг пациентов на всех этапах медицинской помощи, нетолько в специализированных учреждениях, но и в отдаленных районах.В свете вышеизложенного Целью работы явилось изучение особенно-стей общеклинического анализа крови у пациентов с различными варианта-ми течения ревматоидного артрита, в частности при наличии системных про-явлений заболевания.Работа выполнена на базе ревматологического отделения ГБУ РО Об-ластной больницы № 2 обследовано 90 больных ревматоидным артритом, изкоторых 83 чел (92%) составили женщины, 7 чел (8%) – мужчины в воз-расте от 19 до 74 лет, имеющие умеренную (61 чел -68%), и высокую (29чел-32%) степени активности воспалительного процесса. Из всех обследо-ванных больных 45 чел (50%) страдали суставной формой РА, а у остальных45 пациентов были диагностированы различные поражения внутренних ор-ганов (астенический синдром, ревматоидные узелки, миопатия, амиотрофия,лимфаденопатия, анемия, васкулит, полинейропатия, поражение легких,синдром Фелти, поражение сердца, поражение глаз, остеопороз, нефропа-тия), из них 22 пациента (24% от числа всех обследованных) были серопо-зитивны по ревматоидному фактору, 23 пациента (26%) были серонегативны по РФ. В качестве контрольной группы были использованы 20 здоровых до-норов. Полученные Результаты обрабатывались посредством методов вари-ационной медицинской статистики (Statiatica 6,0) с применением непарамет-рических критериев Манна-Уитни-Вилконсона. Достоверными считались Ре-зультаты при р<0,05.Обсуждение полученных результатов. При оценке показателей общегоанализа крови, полученных у больных с серопозитивным вариантом висце-ральной формы РА при умеренной степени активности воспалительного про-цесса, установлено, что у пациентов этой категории содержание в кровипалочкоядерных нейтрофилов, моноцитов и скорость оседания эритроцитовповышены по сравнению с донорскими показателями. Содержание гемогло-бина, абсолютное количество эритроцитов, лейкоцитов, тромбоцитов и про-цент лимфоцитов, эозинофилов и сегментоядерных нейтрофилов у этихбольных существенно не отличалось от контроля.У пациентов с высокой степенью активности серопозитивного РА с си-стемными проявлениями абсолютное количество лейкоцитов, тромбоцитов ипроцент палочкоядерных нейтрофилов и моноцитов, а также скорость оседа-ния эритроцитов превышали соответствующие параметры у доноров, тогдакак содержание гемоглобина и процент лимфоцитов – были, напротив, сни-жены по сравнению с контролем. В отношении абсолютного числа эритроци-тов и процентного содержания эозинофилов и сегментоядерных нейтрофи-лов достоверных отличий от показателей здоровых лиц выявлено не было.При сопоставлении между собой результатов групп пациентов с раз-личными степенями активности воспалительного процесса при серопозитив-ном варианте РА с внесуставными проявлениями обнаружено, что у больныхс высокой степенью активности РА абсолютное количество лейкоцитов,тромбоцитов и скорость оседания эритроцитов достоверно превышали соот-ветствующие параметры у пациентов с умеренной степенью активности вос-паления. Такие параметры как содержание эритроцитов, гемоглобина, про-цент лимфоцитов, эозинофилов, палочкоядерных и сегментоядерныхнейтрофилов и моноцитов, у больных серопозитивным РА с висцеропатиямив зависимости от степени активности воспаления статистически значимыхотличий не имели.Сравнительный анализ показателей общего анализа крови у больных сcеропозитивным вариантом висцеральной формы ревматоидного артрита приразличных степенях активности
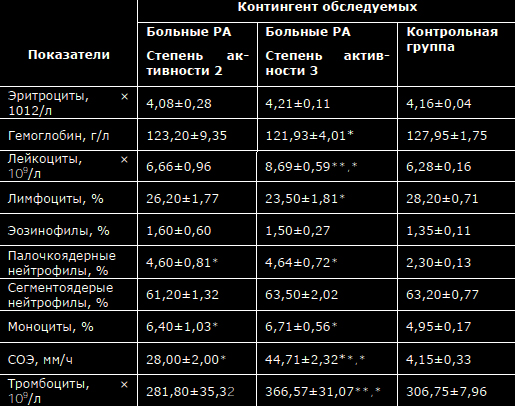 Примечание:Статистическая значимость различий с данными контрольной группы обо-значена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05При исследовании общего анализа крови у больных с серонегативным РАс висцеропатиями при умеренной степени активности воспаления статисти-чески значимым по сравнению с донорами оказалось повышение абсолютно-го количества лейкоцитов, процента палочкоядерных нейтрофилов и моно-цитов и ускорение СОЭ, а количество тромбоцитов было снижено по сравне-нию с контролем. В отношении таких параметров общего анализа крови каксодержание эритроцитов, гемоглобина, процента лимфоцитов, эозинофилов,сегментоядерных нейтрофилов статистически достоверных отличий от до-норских показателей не выявлено.При оценке показателей ОАК у больных с высокой степенью воспали-тельного процесса отмечено снижение процентного содержания лимфоцитови повышение процентного содержания моноцитов по сравнению с контролем.Абсолютное число тромбоцитов и скорость оседания эритроцитов у больныхэтой категории были выше, чем у доноров. Такие параметры как содержаниеэритроцитов, гемоглобина, лейкоцитов, процент эозинофилов, палочкоядер-ных и сегментоядерных нейтрофилов у этих больных существенно не отли-чались от контроля.При сопоставлении между собой показателей, полученных в группахбольных РА с висцеропатиями, серонегативных по РФ при различных степе-нях активности выявлено, что у больных с высокой степенью активности РАколичество тромбоцитов и скорость оседания эритроцитов были достоверновыше, чем соответствующие параметры у пациентов с умеренно выраженнымвоспалением. В содержании гемоглобина, эритроцитов, лейкоцитов, про-центном содержании лимфоцитов, эозинофилов, палочкоядерных и сегментоядерных нейтрофилов статистически достоверных отличий между группа-ми больных в зависимости от степени активности воспаления не оказалось.Сравнительный анализ показателей общего анализа крови у больных сcеронегативным вариантом висцеральной формы ревматоидного артрита приразличных степенях активности
Примечание:Статистическая значимость различий с данными контрольной группы обо-значена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05При исследовании общего анализа крови у больных с серонегативным РАс висцеропатиями при умеренной степени активности воспаления статисти-чески значимым по сравнению с донорами оказалось повышение абсолютно-го количества лейкоцитов, процента палочкоядерных нейтрофилов и моно-цитов и ускорение СОЭ, а количество тромбоцитов было снижено по сравне-нию с контролем. В отношении таких параметров общего анализа крови каксодержание эритроцитов, гемоглобина, процента лимфоцитов, эозинофилов,сегментоядерных нейтрофилов статистически достоверных отличий от до-норских показателей не выявлено.При оценке показателей ОАК у больных с высокой степенью воспали-тельного процесса отмечено снижение процентного содержания лимфоцитови повышение процентного содержания моноцитов по сравнению с контролем.Абсолютное число тромбоцитов и скорость оседания эритроцитов у больныхэтой категории были выше, чем у доноров. Такие параметры как содержаниеэритроцитов, гемоглобина, лейкоцитов, процент эозинофилов, палочкоядер-ных и сегментоядерных нейтрофилов у этих больных существенно не отли-чались от контроля.При сопоставлении между собой показателей, полученных в группахбольных РА с висцеропатиями, серонегативных по РФ при различных степе-нях активности выявлено, что у больных с высокой степенью активности РАколичество тромбоцитов и скорость оседания эритроцитов были достоверновыше, чем соответствующие параметры у пациентов с умеренно выраженнымвоспалением. В содержании гемоглобина, эритроцитов, лейкоцитов, про-центном содержании лимфоцитов, эозинофилов, палочкоядерных и сегментоядерных нейтрофилов статистически достоверных отличий между группа-ми больных в зависимости от степени активности воспаления не оказалось.Сравнительный анализ показателей общего анализа крови у больных сcеронегативным вариантом висцеральной формы ревматоидного артрита приразличных степенях активности
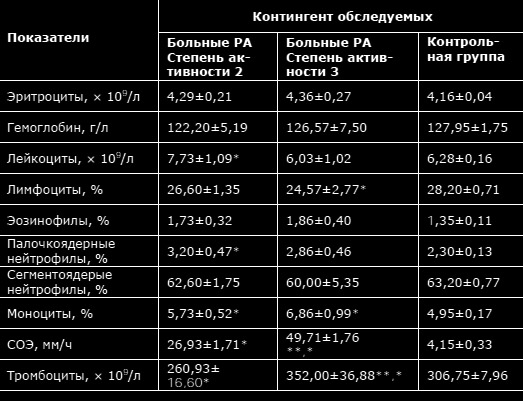 Примечание:Статистическая значимость различий с данными контрольной группы обо-значена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05Выводы. Таким образом, у больных РА с висцеропатиями, серонега-тивных по ревматоидному фактору более высокие показатели болевого су-ставного синдрома и лабораторные маркеры активности оказались выше убольных с высокой степенью активности воспалительного процесса.
Зудбинова В.Ю., Зудбинова Е.В., Соболева Т.Н.
ОЦЕНКА ПОКАЗАТЕЛЕЙ ОБЩЕКЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У БОЛЬНЫХ С СУСТАВНОЙ ФОРМОЙ РЕВМАТОИДНОГО АРТРИТА
ГБУ РОСТОВСКОЙ ОБЛАСТИ ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА № 2,МБУЗ ГОРОДСКАЯ ПОЛИКЛИНИКА № 4 Г. РОСТОВА-Н-ДОНУ
Общеклинический анализ крови представляет собой важный аспект вкурации пациентов с ревматоидным артритом (РА), поскольку позволяет су-дить и об активности воспалительного процесса, и о наличии внесуставныхпроявлений, мониторировать осложнения заболевания и терапии, выявлятьсопутствующие заболевания, оценивать эволюцию болезни и эффективностьтерапии.В связи с актуальностью темы Целью работы явилось изучение особен-ностей общеклинического анализа крови у пациентов с различными вариан-тами течения ревматоидного артрита, в данном случае у пациентов с сустав-ной формой заболевания.В рамках выполненной работы на базе ревматологического отделенияГБУ РО Областной больницы № 2 обследовано 90 больных ревматоиднымартритом, из которых 83 чел (92%) составили женщины, 7 чел (8%) – муж-чины в возрасте от 19 до 74 лет, имеющие умеренную (61 чел -68%), и вы-сокую (29 чел-32%) степени активности воспалительного процесса. Из всехобследованных больных 45 чел (50%) страдали суставной формой РА, приэтом серопозитивный вариант суставной формы диагностирован у 23 чел(26% от числа всех больных), у 22 больных с суставной формой заболевания(24%) ревматоидный фактор в сыворотке отсутствовал. Остальные пациентысоставили группу больных висцеральной формой РА. В качестве контрольнойгруппы были использованы 20 здоровых доноров. Полученные Результатыобрабатывались посредством методов вариационной медицинской статистики(Statiatica 6,0) с применением непараметрических критериев Манна-Уитни-Вилконсона. Достоверными считались Результаты при р<0,05.Обсуждение полученных результатов. Исследование общего анализакрови у больных с серопозитивной суставной формой ревматоидного артритавыявило статистически значимые по сравнению с показателями доноров бо-лее высокие уровни в крови эритроцитов и палочкоядерных нейтрофилов имоноцитов, но не выходящие за рамки физиологической нормы. Данный фе-номен может быть обусловлен сравнительно благоприятным течением забо-левания (в виду отсутствия системных проявлений). Статистически значи-мым по сравнению с данными контрольной группы оказалось повышениеСОЭ. В отношении содержания гемоглобина, абсолютного количества лейко-цитов и тромбоцитов и процентного содержания лимфоцитов, эозинофилов исегментоядерных нейтрофилов у больных с серопозитивной суставной фор-мой РА существенных отличий от донорских показателей не отмечено. Сравнительный анализ показателей общего анализа крови у больных сcеропозитивным вариантом суставной формы ревматоидного артритаПримечание: Статистическая значимость различий с данными контрольной группы обозначена: * р<0,05
Примечание:Статистическая значимость различий с данными контрольной группы обо-значена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05Выводы. Таким образом, у больных РА с висцеропатиями, серонега-тивных по ревматоидному фактору более высокие показатели болевого су-ставного синдрома и лабораторные маркеры активности оказались выше убольных с высокой степенью активности воспалительного процесса.
Зудбинова В.Ю., Зудбинова Е.В., Соболева Т.Н.
ОЦЕНКА ПОКАЗАТЕЛЕЙ ОБЩЕКЛИНИЧЕСКОГО АНАЛИЗА КРОВИ У БОЛЬНЫХ С СУСТАВНОЙ ФОРМОЙ РЕВМАТОИДНОГО АРТРИТА
ГБУ РОСТОВСКОЙ ОБЛАСТИ ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА № 2,МБУЗ ГОРОДСКАЯ ПОЛИКЛИНИКА № 4 Г. РОСТОВА-Н-ДОНУ
Общеклинический анализ крови представляет собой важный аспект вкурации пациентов с ревматоидным артритом (РА), поскольку позволяет су-дить и об активности воспалительного процесса, и о наличии внесуставныхпроявлений, мониторировать осложнения заболевания и терапии, выявлятьсопутствующие заболевания, оценивать эволюцию болезни и эффективностьтерапии.В связи с актуальностью темы Целью работы явилось изучение особен-ностей общеклинического анализа крови у пациентов с различными вариан-тами течения ревматоидного артрита, в данном случае у пациентов с сустав-ной формой заболевания.В рамках выполненной работы на базе ревматологического отделенияГБУ РО Областной больницы № 2 обследовано 90 больных ревматоиднымартритом, из которых 83 чел (92%) составили женщины, 7 чел (8%) – муж-чины в возрасте от 19 до 74 лет, имеющие умеренную (61 чел -68%), и вы-сокую (29 чел-32%) степени активности воспалительного процесса. Из всехобследованных больных 45 чел (50%) страдали суставной формой РА, приэтом серопозитивный вариант суставной формы диагностирован у 23 чел(26% от числа всех больных), у 22 больных с суставной формой заболевания(24%) ревматоидный фактор в сыворотке отсутствовал. Остальные пациентысоставили группу больных висцеральной формой РА. В качестве контрольнойгруппы были использованы 20 здоровых доноров. Полученные Результатыобрабатывались посредством методов вариационной медицинской статистики(Statiatica 6,0) с применением непараметрических критериев Манна-Уитни-Вилконсона. Достоверными считались Результаты при р<0,05.Обсуждение полученных результатов. Исследование общего анализакрови у больных с серопозитивной суставной формой ревматоидного артритавыявило статистически значимые по сравнению с показателями доноров бо-лее высокие уровни в крови эритроцитов и палочкоядерных нейтрофилов имоноцитов, но не выходящие за рамки физиологической нормы. Данный фе-номен может быть обусловлен сравнительно благоприятным течением забо-левания (в виду отсутствия системных проявлений). Статистически значи-мым по сравнению с данными контрольной группы оказалось повышениеСОЭ. В отношении содержания гемоглобина, абсолютного количества лейко-цитов и тромбоцитов и процентного содержания лимфоцитов, эозинофилов исегментоядерных нейтрофилов у больных с серопозитивной суставной фор-мой РА существенных отличий от донорских показателей не отмечено. Сравнительный анализ показателей общего анализа крови у больных сcеропозитивным вариантом суставной формы ревматоидного артритаПримечание: Статистическая значимость различий с данными контрольной группы обозначена: * р<0,05
 При оценке параметров общего анализа крови у пациентов, страдающихсеронегативной суставной формой РА при умеренной степени активностивоспаления выявлено сравнительно большее содержание у них эритроцитов,гемоглобина, абсолютного количества лейкоцитов, процента палочкоядер-ных нейтрофилов и более высокая СОЭ по сравнению с донорами. Процент-ное содержание лимфоцитов, эозинофилов, сегментоядерных нейтрофилов,моноцитов и абсолютно количество тромбоцитов у этих больных существенноне отличалось от контроля.У пациентов с высокой степенью активности серонегативной суставнойформы РА отмечены более высокие, чем у доноров показатели содержаниягемоглобина, абсолютного числа лейкоцитов, эритроцитов и процентногосодержания палочкоядерных нейтрофилов и моноцитов, а также более высо-кая СОЭ. Процент лимфоцитов и сегментоядерных нейтрофилов у больныхэтой категории был снижен относительно здоровых лиц. В показателях про-центного содержания эозинофилов и абсолютного числа тромбоцитов стати-стически значимых отличий от контроля не оказалось. При сопоставлении между собой показателей, полученных у пациентовс умеренной и высокой степенями активности серонегативной суставнойформы РА, было обнаружено, что абсолютное число лейкоцитов, палочко-ядерных нейтрофилов и скорость оседания эритроцитов у пациентов с высо-кой степенью активности воспалительного процесса достоверно превышалосоответствующие параметры у больных с умеренно выраженным воспалени-ем.Статистически значимых отличий в показателях содержания гемогло-бина, абсолютного количества эритроцитов и тромбоцитов, процентного со-держания лимфоцитов, эозинофилов, сегментоядерных нейтрофилов и моно-цитов у больных с серонегативным вариантом суставной формы РА в зависи-мости от степени активности воспалительного процесса выявлено не было.Сравнительный анализ показателей общего анализа крови у больных сcеронегативным вариантом суставной формы ревматоидного артрита приразличных степенях активности
При оценке параметров общего анализа крови у пациентов, страдающихсеронегативной суставной формой РА при умеренной степени активностивоспаления выявлено сравнительно большее содержание у них эритроцитов,гемоглобина, абсолютного количества лейкоцитов, процента палочкоядер-ных нейтрофилов и более высокая СОЭ по сравнению с донорами. Процент-ное содержание лимфоцитов, эозинофилов, сегментоядерных нейтрофилов,моноцитов и абсолютно количество тромбоцитов у этих больных существенноне отличалось от контроля.У пациентов с высокой степенью активности серонегативной суставнойформы РА отмечены более высокие, чем у доноров показатели содержаниягемоглобина, абсолютного числа лейкоцитов, эритроцитов и процентногосодержания палочкоядерных нейтрофилов и моноцитов, а также более высо-кая СОЭ. Процент лимфоцитов и сегментоядерных нейтрофилов у больныхэтой категории был снижен относительно здоровых лиц. В показателях про-центного содержания эозинофилов и абсолютного числа тромбоцитов стати-стически значимых отличий от контроля не оказалось. При сопоставлении между собой показателей, полученных у пациентовс умеренной и высокой степенями активности серонегативной суставнойформы РА, было обнаружено, что абсолютное число лейкоцитов, палочко-ядерных нейтрофилов и скорость оседания эритроцитов у пациентов с высо-кой степенью активности воспалительного процесса достоверно превышалосоответствующие параметры у больных с умеренно выраженным воспалени-ем.Статистически значимых отличий в показателях содержания гемогло-бина, абсолютного количества эритроцитов и тромбоцитов, процентного со-держания лимфоцитов, эозинофилов, сегментоядерных нейтрофилов и моно-цитов у больных с серонегативным вариантом суставной формы РА в зависи-мости от степени активности воспалительного процесса выявлено не было.Сравнительный анализ показателей общего анализа крови у больных сcеронегативным вариантом суставной формы ревматоидного артрита приразличных степенях активности
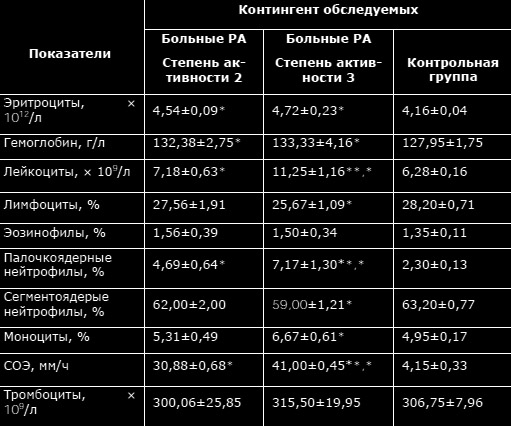 Примечание: Статистическая значимость различий с данными контроль-ной группы обозначена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05Выводы. Таким образом, при обследовании больных с суставной формойревматоидного артрита в ОАК изменение содержания эритроцитов, гемогло-бина, лейкоцитов, лимфоцитов, сегментоядерных нейтрофилов, палочко-ядерных нейтрофилов и ускорение СОЭ по сравнению с донорами, и приразличных степенях активности установлено наличие определенных особен-ностей, имеющих значение в динамическом наблюдении пациентов с ревма-тоидным артритом.
Инина Л.И., Иванова М.М.
НЕКОТОРЫЕ ПАТОГЕНЕТИЧЕСКИЕ АСПЕКТЫИЕРСИНИОЗНОГО АРТРИТА
ФГБУ «НИИР им. В.А. Насоновой» РАМН, Москва; Кафедра внутренних болез-ней педиатрического и стоматологического факультетов ВолгГМУ, Россия
В последнее время особое внимание ревматологами уделяется изучениюразвития суставной патологии при иерсиниозе. По данным различных иссле-дователей артриты наблюдаются в 7,5-30% случаев данного заболевания.Большинство артритов вызывается Y.enterocolitica сероваров 03,09, реже05,06,08 и др. В большинстве случаев иерсиниозный артрит (ИА) рассматри-вается как реактивный артрит но известно и о септических вариантах воспа-ления суставов.Патогенез артритов, обусловленных Y.enterocolitica, в значительной мереопределяется состоянием реактивности организма, характером и степеньюразвития компенсаторных реакций, явлениями аллергии и аутоаллергии,генетически обусловленным и приобретенным иммунитетом.Известно, что генетическим маркером предрасположенности развитияартрита после перенесенной иерсиниозной инфекции является антиген ги-стосовместимости HLA или один из группы CREG. Показано, что например, вФинляндии, 66-90% больных иерсиниозом являются носителями HLA пози-тивных заболеваний, наряду с болезнью Бехтерева, Рейтера, псориатическойартропатией, другими реактивными артритами. Есть мнение, что клиниче-ская картина ИА может быть модифицирована генетическим фоном, связан-ным с HLA антигеном.В настоящее время существует несколько этиопатогенетических теорий,объясняющих взаимосвязь болезни с HLA антигеном:- рецепторная, по которой HLA вступает в качестве рецептора для микро-организма, вызывающего заболевание; – двух генов, допускающая существование равновесного сцепления меж-ду HLA и генами восприимчивыми к заболеванию;- одного гена, допускающая наличие перекрестной реакции между HLA иантигенами микроорганизма, вызывающего заболевание;- медиаторной чувствительности, по которой HLA антиген изменяет чув-ствительность к медиаторам воспаления.Как известно, нейтрофилы принимают непосредственное участие в разви-тии острого воспаления, высвобождая лизосомальные ферменты, суперок-сидные анионы (О2), гидрофильные радикалы и гидроген пероксид. Приостром воспалении увеличивается поступление белка в очаг воспаления; этозависит от скорости кровотока в микроциркуляторном русле и степени про-ницаемости капилляров. Нейтрофилы также принимают участие в контроли-ровании этого процесса. Высокая воспалительная реакция нейтрофилов HLAпозитивных ассоциирует с их повышенной миграционной и хемотоксическойфункцией. Многие ученые на основании проведенных исследований показа-ли, что хемотаксис и хемокинезис, локомоторная функция полиморфонукле-арных лейкоцитов у больных иерсиниозными артритами с наличием HLA ан-тигена гистосовместимости более выражены, чем у больных с отсутствиемэтого антигена. Эта закономерность справедлива как при исследовании invitro, так и in vivo. Реакция иммунной системы является одним из основныхзвеньев в цепи патогенеза ИА. Ряд авторов считает, что у больных иерсини-озом, у которых развился артрит, имеются и значительные иммунологиче-ские отклонения, которые предрасполагают к осложнениям от инфекции иклеточный иммунитет играет важную роль в патогенезе артрита, обуслов-ленного Y.enterocolitica – микроба, способного проникать в клетку и выжи-вать там.С Целью изучения особенностей клеточного иммунитета были проведеныисследования реакции бласттрансформации лейкоцитов у больных с ИА ибез изменений со стороны суставов. Большинство исследователей установи-ло замедление этой реакции у больных ИА в отличие от лиц с не осложнен-ным течением иерсиниоза, хотя некоторые исследователи этих различий невыявили в обеих группах больных. Слабый Т-клеточный ответ у больных ИА,видимо, позволяющий проникновение инфицирующих организмов в эпите-лий дальнейшую циркуляцию антигена.При исследовании клеточной пролиферации лимфоцитов синовиальнойжидкости у больных реактивным артритом, в том числе обусловленныхY.enterocolitica, был обнаружен положительный ответ на эту инфекцию.Большинство лимфоцитов синовиальной жидкости при ИА обладают феноти-пом Т4+ (иммуноиндукторы/помощники), при незначительном количестве В-лимфоцитов. Полученные данные подтверждают активное участие Т-клеточного иммунитета в развитии ИА. Считают, что ИА на фоне перенесен-ной инфекции у генетически предрасположенных лиц развиваются в связи снакоплением активизированных, антигенспецифических Т-лимфоцитов.Изучение гуморального иммунитета у лиц с ИА в сравнении с больнымииерсиниозом, у которых не развился артрит, показало, что качественныхразличий в образовании антител у больных иерсиниозом в 2-х наблюдаемых группах нет, но количественные различия были выявлены. Используя доста-точно чувствительный метод ELISA, проводился качественный анализ анти-тел, принадлежащих к классам IgA, IgM, IgG. Было отмечено, что в большин-стве случаев антитела, относящиеся к классу IgM, сохраняются лишь 1-3месяца и, как правило, исчезают через полгода. При сравнении двух группбольных установлено, что титры антител класса IgM к иерсиниям остаютсяниже при артрите, чем у больных без артрита. Эти данные могут быть объяс-нены двумя причинами : а) иммунный ответ антител класса IgM слабее поотношению к инфекции; б) в некоторых случаях специфические иммуногло-булины класса IgM связаны с иммунными комплексами и не определяютсяпри использовании ELISA техники.Обычно Y.enterocolitica связывает быстрый и выраженный ответ антителIgG, который сохраняется у больных с признаками артрита дольше, чем безнего. IgG – сохраняется более длительный период времени, определяетсядаже на протяжении двух лет и более у пациентов с развившимся артритом.Различие гуморального ответа наиболее выражено на IgA антителах: убольных артритом достоверно более высокие концентрации класса IgA анти-иерсиниозных антител, они персистируют в течение ряда лет, тогда как IgA убольных без ИА исчезают через 5 месяцев от начала заболевания. Установ-лено, что класс IgA бывает двух видов: сывороточный и секреторный. Сыво-роточный IgA обычно мономерен. Полимерный секреторный IgA выделяетсяв просвет кишечника, где связывается с антигеном и удаляется вместе с ним.Обычно секреторный IgA выделяется в сыворотке больных иерсиниозом внебольших количествах. Сывороточный IgA состоит на 90% из IgA I и на10%из IgA II субклассов. IgA II – локально активен в слизистой оболочке. Секре-торный IgA у больных с не осложненным иерсиниозом выявляется в меньшихколичествах. Аналогичная картина наблюдается и при определении уровняIgA II в сравниваемых группах. Высокий уровень антител класса IgA у боль-ных ИА, по-видимому, частично объясняется повышением выработки слизи-стого IgA. Эти данные говорят об измененной иммунной реакции кишечникапри ИА.При анализе полученных данных необходимо учесть, что период полувы-ведения IgA составляет несколько дней, поэтому персистенция антителдолжна быть обусловлена продолжающимся синтезом. Данный феномен мо-жет быть связан либо с персистенцией антигена, либо с перекрестной реак-цией между антигенами Y.enterocolitica и макроорганизма (возможно HLAантигеном гистосовместимости). Подкласс IgA II и секреторный компонентIgA указывают на связь вырабатываемых антител со слизистой кишечника.Установлено, что антиерсиниозный IgA ответ более выражен у больныхHLA позитивных, чем у HLA негативных. Тяжесть ИА коррелирует как с нали-чием HLA антигена, так и с уровнем специфического (антиерсиниозного) IgA.При изучении распределения антител к иерсиниа одновременно в синови-альной жидкости и сыворотке у больных ИА различий не выявлено.Исследования показали, что выраженный и персистирующий IgA ответ кY.enterocolit. в сыворотке крови больных ИА в значительной мере направленпротив липосахаридов, являющихся выраженным антигенным компонентом граммотрицательных бактерий, локализующихся на наружной мембране бак-терии.Есть мнение, что лимфоидные элементы в кишечном эпителии хроническистимулируются иерсиниозными антигенами, что поддерживает высокий уро-вень антител. Установлено, что наличие антигенемии кишечной иерсиниипри ИА выявляется в 70% случаев. Отсутствие этих антигенов ИА может бытьиспользовано в дифференциальной диагностике данных заболеваний. Изу-чая у животных иммуноглобулиновый ответ к Y.enterocolitica. установлено,что выраженность иммунного ответа зависит от количества бактерий, вве-денных в организм. В литературе имеются так же сообщения о результатахизучения Yersinia – специфических иммунных комплексов. Установлено, чторазмеры этих иммунных комплексов относительно небольшие и незначи-тельно превышают размеры анти- Yersinia антител, а их размеры у больных споражением суставов и без него равны. Изменений не отмечалось и при дли-тельном наблюдении. Небольшие размеры специфических иммунных ком-плексов объясняют длительную их персистенцию у некоторых больных иподтверждают их потенциальную роль в патогенезе реактивного артрита,вызванного Y.enterocolitica.При исследовании циркулирующих иммунных комплексов (ЦИК) энзимо-иммуносорбентным методом (ELISA) удалось выявить, что в течение первых2 месяцев от начала заболевания специфические иммунные комплексы IgMимели более высокое содержание у больных с артритом, чем без такового.Причем, разница в распространении комплексов IgM в двух группах пациен-тов со временем сокращалась. Специфические иммунные комплексы YersiniaIgG время от времени наблюдались у пациентов обеих групп. Специфиче-ские Yersinia – циркулирующие иммунные комплексы, содержащие IgA анти-гены, наблюдались у больных артритом и не наблюдались у пациентов безнего. По истечении более 8 месяцев от начала заболевания у лиц и ИА спе-цифические Yersinia – ЦИК выявлялись в три раза чаще, чем у больных безИА.Проведенные исследования показали, что в сыворотке больных иерсини-озом нередко наблюдаются антитела к гладкомышечной ткани, органоспе-цифические антиэпителиальные антитела, реагирующие с желудочно-кишечным, тубулярным эпителием почек и эпителием щитовидной железы, атакже антинуклеарные и антиДНК антитела. В связи с этим предполагается,что механизм реализации тригтерного действия Y.enterocolitica осуществля-ется путем индукции аутоиммунных процессов. Однако механизм этих про-цессов – при иерсиниозе до настоящего времени остается неясным.Известно, что наиболее частой причиной синтеза аутоантител при бакте-риальных инфекциях является наличие перекрестно реагирующих антигеноввозбудителя и антигенных детерминант тканей человека. Многие микробныепроизводные оказывают вспомогательный эффект на иммунный ответ орга-низма. Немаловажным предоставляется тот факт, что Y.enterocolit. являетсяграммотрицательным микроорганизмом, содержащим липополисахариды.Этот LPS взятый из оболочки граммотрицательной бактерии, широко изве-стен как В-лимфоцитарный митоген. Таким образом, действуя неспецифиче-ски, замедляет функцию клеток-помощников синтеза АТ. Предполагают, что воспаление кишечного эпителия, других тканей в сочетании с вспомогатель-ным эффектом, оказываемым бактериальным LPS может вызвать образова-ние аутоантител.
Лященко М.А., Грехов, Р.А., Харченко С.А.,Сулейманова Г.П., Бурлай О.С., Мякишев М.В.
ИЗМЕНЕНИЕ УРОВНЯ СУБЪЕКТИВНОГО КОНТРОЛЯ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ ПРИ ИСПОЛЬЗОВАНИИ МЕТОДА БИОЛОГИЧЕСКОЙ ОБРАТНОЙ СВЯЗИ
ФГБУ “НИИ КиЭР” РАМН, г. Волгоград, Россия
Цель: изучить влияние биологической обратной связи (БОС) на уровеньсубъективного контроля (УСК) у пациентов, страдающих ревматоидным арт-ритом (РА), и обосновать использование данного метода в комплексном ле-чении заболевания.Материалы и методы. Были обследованы 40 пациентов с диагнозом РА,находившихся на стационарном лечении в ревматологическом отделенииклинической больницы №25 г. Волгограда. Средний возраст обследованныхбольных = 48, 6 лет ± 7,73 года (от 30 до 70 лет), женщины составлялибольшинство = 26 (86%), средняя продолжительность заболевания = 12 лет± 3,44 года. При проведении исследования использовалась методика УСК(Головей Л.А., Рыбалко Е.Ф., 2005).Больные РА были разделены на две группы: основную (20 человек) иконтрольную (20 человек). Пациенты основной группы получали комплекс-ную терапию с включением 12 сеансов БОС-тренинга преимущественно наоснове параметров электрической активности мозга – релаксация по ЭЭГ спомощью психофизиологического реабилитационного комплекса «Реакор»производства фирмы «Медиком МТД» (г. Таганрог).Результаты. В Результаты проведенного исследования мы выявили экс-тернальность у больных РА в общей сфере (3,03±0,3), а также в сфере от-ношения к заболеванию (3,86±0,23) и сфере производственных отношений(3,43±0,25). После проведения БОС-тренингов наблюдалось повышение ин-тернальности по шкалам общей сферы (p<0,05) и отношения к заболеванию(p<0,01) у пациентов основной группы. В группе пациентов, получающихтрадиционное лечение, динамика результатов была недостоверной.Обсуждение. Следует отметить, что уровень субъективного контроля –качество, характеризующее склонность человека приписывать ответствен-ность за Результаты своей деятельности внешним силам, либо собственнымспособностям и усилиям. УСК оказывает регулирующее влияние на многиеаспекты поведения человека, играя важную роль в формировании межлич-ностных взаимоотношений, в способе разрешения стрессовых ситуаций, в отношении к болезни и терапевтическим мероприятиям. Экстернальностьпроявляется в том, что пациенты предпочитают перекладывать ответствен-ность за важные события своей жизни на внешние обстоятельства, в своейпроизводственной деятельности – на внешние силы (начальство, коллег ит.д.). В сфере отношения к заболеванию экстернальность проявляется в том,что пациент ведет себя пассивно, так как больной полагает, что никак неможет повлиять на течение болезни, перекладывая всю ответственность заРезультаты лечения на медицинских работников, что может привести к несо-блюдению лечебного режима, повышению уровня тревоги и депрессии, сни-жению самооценки. Возникновение болезни и связанные с ней социальныепоследствия (нарушение трудоспособности, утрата социальных ролей и т. д.)могут вызвать негативное психическое состояние наученной беспомощности.Наученная беспомощность определяется как состояние, возникающее в ре-зультате неконтролируемых, преимущественно негативных событий, котороепроявляется в нарушениях эмоциональных, мотивационных и когнитивныхпроцессов. Другими словами, больной РА, подверженный данному состояниюожидает неудачи в лечении и снижает контроль над соблюдением лечебногорежима. Для корректировки и предотвращения состояния наученной беспо-мощности путем повышения уровня интернальности можно использоватьБОС-терапию.Предполагается, что повышение интернальности в процессе БОС-терапиисвязано с научением пациента навыкам саморегуляции физиологическихпроцессов. По данным исследователей Грехова Р.А., Александрова А.В., Хар-ченко С.А. и др. у пациентов с ревматическими заболеваниями после прове-денных сеансов БОС отмечалось улучшение мозгового и периферическогокровотока, мышечная релаксация, улучшение сна, что также повышает эф-фективность лечения. Механизмы терапевтического эффекта БОС-терапиизаключаются не только в изменениях, касающихся физиологических пара-метров, но и в смещении уровня субъективного контроля с экстернальногона интернальный, что может способствовать повышению комплаенса,уменьшению невротических жалоб, мобилизации волевого потенциала иулучшению самооценки пациента.Выводы:В результате проведенного курса комплексного лечения, с использовани-ем метода БОС у больных было отмечено повышение интернальности пошкалам общей сферы и сферы отношения к заболеванию. Для повышенияэффективности лечения целесообразно применение метода БОС-терапии дляповышения уровня комплаенса.Таким образом, в результате проведенных исследований была доказанацелесообразность применения метода БОС-терапии в комплексном лечениибольных РА.
Майко О.Ю., Иванова К.В.
ОЦЕНКА ПАРАМЕТРОВ СУТОЧНОГО МОНИТОРИРОВАНИЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ У БОЛЬНЫХ ПОДАГРОЙ В СОЧЕТАНИИ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ НА ФОНЕ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ЛОЗАРТАНА И ЕГО КОМБИНАЦИИ С УРИСАНОМ В АМБУЛАТОРНЫХ УСЛОВИЯХ
ГБОУ ВПО Оренбургская государственная медицинская академия МинздраваРФ, Оренбург, Россия
Цель: Выявить особенности суточного ритма артериального давления,уровня мочевой кислоты у больных подагрой в межприступный период приналичии артериальной гипертонии.Материалы и методы. В исследование включено 52 больных, обратив-шихся в поликлинику, с достоверным диагнозом подагры, находящихся вмежприступном периоде, ранее не получавших регулярно гипоурикемиче-скую терапию при наличии артериальной гипертонии I и II степени (Россий-ские рекомендации, 2010), давшие информированное согласие. Для диагно-стики подагры использовались классификационные диагностические крите-рии S.L. Wallace. Всем пациентам проводилось общеклиническое обследова-ние с оценкой антропометрических показателей: рост, масса тела, индексмассы тела (ИМТ), окружность талии (ОТ), окружность бедра (ОБ), отноше-ние ОТ/ОБ. Инструментальное обследование включало: электрокардиогра-фию (ЭКГ), эхокардиографию (ЭхоКГ), суточное мониторирование АД(СМАД), УЗИ почек.Результаты и Обсуждение. Продолжительность заболевания подагройу большинства больных обеих подгрупп колебалась от 3 до 6 лет, средняяпродолжительность составила 3,26±2,18 лет. Частота обострения артрита всреднем составила 2 от 1 до 3 атак в год, в среднем 2,23±0,75. Количествопораженных суставов составило 2 от 1 до 4. У 23,5% пациентов отмечалисьтофусы. Преобладало рецидивирующее течение заболевания у 31 человека(60%) и хронизация течения наблюдалась у 21 человека (40%). На моментисследования больные находились в межприступном периоде и не принима-ли антигиперурикемические препараты. Длительность обострения подагрыколебалась от 1 до 4 недель, а средняя длительность обострения составила1,25±0,79, средняя длительность ремиссии была 5,35±1,29 месяцев. Уро-вень МК в сыворотке крови варьировал от 383 до 564, средний уровень со-ставил 469,18±58,27 ммоль/л. Уровень экскреции МК за сутки колебался от1,4 до 4,32 ммоль/л, средний уровень был 2,83±0,73 ммоль/л. Длительностьартериальной гипертензии не превышала 10 лет, средн. 5,46±3,15 лет. I иII степени АГ встречались с одинаковой частотой .У больных подагрой изменения всех исходных параметров СМАД былистатистически значимо хуже нормативных значений. У большинства больных зарегистрировано повышение среднедневного САД и средненочного САД – у76 %, индекса времени – ИВ САД д – у 76%, ИВ САД н- у 82%, нарушениевариабельности САД – у 80%, средненочного ДАД – у 47%, ИВ ДАД д – у94% , ИВ ДАД н – у 100%, ВУП САД – у 60%, ВУП ДАД – у 83%. Нарушениерегуляции АД, о котором свидетельствует повышение индекса времени (ИВ),чаще регистрировалось для ДАД, чем для САД, у 94% и 100%, пациентовпротив 76% и 71%, соответственно. Инверсия суточного ритма САД и ДАДпо типу ночной гипертонии (найт-пикер) и недостаточного снижения ночно-го АД (нон-диппер), статистически значимо чаще выявлялись у больных по-дагрой. Так, количество найт-пикеров составило по САД 35%, по ДАД 41%.Количество нон-дипперов по САД 35%, по ДАД 37%. Особенностями суточ-ного профиля по ДАД у больных подагрой являлось статистически значимоеуменьшение степени ночного снижения ДАД (37%) и инверсия суточногоритма ДАД по типу найт-пикер (41%), что свидетельствует о большей часто-те диастолической АГ у больных подагрой. ГЛЖ наблюдалась у 60% пациен-тов, при сохраненной фракции ЛЖ, у этих больных была диастолическаядисфункция, также отмечалась тенденция к увеличению толщины межжелу-дочковой перегородки (МЖП) и задней стенки левого желудочка.Выводы: У больных подагрой в межприступном периоде при сочетании сартериальной гипертонией выявлено нарушение регуляции АД, о которомсвидетельствует повышение показателей индекса времени для диастоличе-ского АД, вариабельности и увеличения времени утреннего подъема для си-столического АД, что способствует развитию нагрузки на органы мишени, вчастности гипертрофии левого желудочка, которая диагностирована у 60%больных. Отмечается преобладание инверсии суточного ритма систолическо-го и диастолического АД по типу ночной гипертонии (найт-пикер) и недоста-точного снижения АД (нон-диппер), причем отмечалась высокая частота (до40%) диастолической артериальной гипертонии.
Мартемьянов В.Ф., Галаева О.Ю., Бедина С.А.,Мозговая Е.Э., Стажаров М.Ю., Морозова Т.А.
ЭНЗИМНЫЕ ИССЛЕДОВАНИЯ КРОВИ НА РАННИХСТАДИЯХ ОСТЕОАРТРОЗА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Цель исследования. Выявить особенности активности ферментов аде-ниловой ветви пуринового метаболизма в эритроцитах больных остеоартро-зом на ранних стадиях болезни.Материал и методы. В условиях стационара наблюдались 57 больныхпервичным остеоартрозом (ОА) с длительностью болезни до двух лет. Диа-гностик ОА проводилась на основании критериев Американской ревматоло-гической ассоциации (Альтман, 1991). Контингент больных был представлен16 (28,1%) мужчинами и 41 женщиной. В исследование не включались больные с поражением внутренних органов и тяжелыми нарушениями их функ-ций, беременные, злоупотребляющие алкоголем. Средний возраст больных(М±): 46,3±0,5 лет, длительность болезни – от 3 до 23 месяцев: 10,9±0,6мес. I стадия поражения суставов определялась у 45 (78,9%), II стадия – у12 больных, ФК-1 – у 35 (61,4%), ФК-2 – у 22 больных. Явления синовита –у 35 (61,4%) больных, полиостеоартроз – у 35 (671,4%) больных. В зависи-мости от длительности болезни были сформированы 2 группы больных. В 1-ю группу с длительностью болезни 3-11 месяцев (7,97±0,4 мес.) вошли 37больных, из которых 14 (37,8%) мужчин и 23 женщин. Средний возраст:47,3±0,6 лет. В эту группу вошли 2 больной с синовитом, 36 больных с Iстадией и 1 больной с II стадией. Во 2-ю группу с длительностью болезни от12 до 23 месяцев (16,3±0,8 мес.) вошли 20 больных, из которых 18 (90%)женщин. Средний возраст больных: 44,4±0,9 лет. Явления синовита опреде-лялись у 14 (70%) больных, I стадия – у 9 (45%), II стадия – у 11 (55%)больных. Выделение эритроцитов и приготовление их лизатов проводилось сиспользованием цитратной венозной крови, замораживания-оттаивания,центрифугирования. Подсчет эритроцитов – под микроскопом в камере Горя-ева (до лизиса). В лизатах эритроцитов определялись активности аденозин-дезаминазы (АДА), АМФ-дезаминазы (АМФДА), адениндезаминазы (АД) и 5′-нуклеотидазы (5′-НТ) по оригинальным методикам. Активность ферментоввыражалась в нмоль/мин/мл, содержащим 1×109 клеток (до лизиса). Приобработке результатов использовалась статистическая программа ”Статисти-ка 6.0”.Результаты исследований. Активность энзимов в лизатах эритроцитовздоровых людей не зависела от пола и возраста (р>0,05) и вследствие этогов исследованиях у больных эти факторы не учитывались. Для удобства из-ложения больные ОА с длительностью болезни до двух лет будут именовать-ся как группа больных с ранним остеоартрозом (РОА). При поступлении налечение, по сравнению со здоровыми, у больных РОА (всей группы) в лиза-тах эритроцитов выше активность АДА (р=0,004), АМФДА (р=0,038), АД(р=0,037) и незначительно выше 5′-НТ (р=0,074). По окончании курса лече-ния активность всех ферментов не имела отличий от здоровых (р>0,05). Посравнению со здоровыми, у больных РОА с полиостеоартрозом, выше актив-ность АД (р<0,001), 5′-НТ (р=0,038), АДА (р=0,045) и АМФДА (р=0,038); убольных с моно-олигоартрозом статистически значимых энзимных различийне выявлено. При полиостеоартрозе, по сравнению с моно-олигоартрозом,выше активность всех ферментов (р<0,001). По сравнению со здоровыми, убольных с синовитом в эритроцитах выше активность всех ферментов: АДА(р<0,001), АМФДА (р=0,005), АД (р<0,001) и 5′-НТ (р=0,048); у больных безсиновита – статистически значимых энзимных различий не выявлено, ноопределялась тенденция к повышению активности АДА, АМФДА и снижениюАД и 5′-НТ (р>0,05). У больных с синовитом, по сравнению с больными безсиновита, выше активность всех энзимов (р<0,001). У больных РОА с I ста-дией, по сравнению с больными с II стадией, ниже активность всех фермен-тов: АДА, АМФДА, 5′-НТ (все р<0,001) и АД (р=0,004).Таким образом, проведенные исследования показали, что активностьвышеуказанных ферментов у больных РОА во многом зависит от клиниче-ских особенностей заболевания: наличия или отсутствия синовита, количества пораженных суставов, стадии и ФК суставов. Большое влияние на ак-тивность ферментов оказывает и длительность заболевания, и по мере ееувеличения активность АДА, АМФДА, АД и 5′-НТ имеет тенденцию к сниже-нию, что необходимо учитывать в клинической практике.
Мартемьянов В.Ф., Зборовская И.А., Галаева О.Ю.,Мозговая Е.Э., Стажаров М.Ю., Бедина С.А., Морозова Т.А.
АКТИВНОСТЬ ЭНЗИМОВ ПУРИНОВОГО МЕТАБОЛИЗМАВ ЛИЗАТАХ ЛИМФОЦИТОВ БОЛЬНЫХ ОСТЕОАРТРОЗОМ НА РАННИХ СТАДИЯХ ЗАБОЛЕВАНИЙ
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Цель исследования: выявление особенностей активности аденозиндез-аминазы (АДА), адениндезаминазы (АД), АМФ-дезаминазы (АМФДА), 5´-нуклеотидазы (5´-НТ) в лизатах лимфоцитов больных остеоартрозом (ОА) впервые два года заболевания.Материал и методы. Под наблюдением находились 57 больных первич-ным ОА с длительностью болезни до двух лет. Верификация диагноза прово-дилась на основании диагностических критериев Американской коллегииревматологов (Altman R. et al., 1991).Длительность болезни оценивалась по анамнестическим данным и запи-сям в амбулаторных картах. Контингент больных был представлен 41(71,9%) женщиной и 16 (28,1%) мужчинами. Возраст больных (М±m) -46,3±0,5 лет. Продолжительность болезни от 3 до 23 месяцев: 10,9±0,6 ме-сяцев. Выраженные явления синовита выявлены у 35 (61,4%) больных. Iстадия поражения суставов (по Келлгрену и Лоуренсу) определялась у 45(78,9%), II стадия – у 12 (21,1%) больных. Функциональный класс суставов(ФК) первой степени установлен у 35 (61,4%), ФК-2 – у 22 (38,6%) больных.В зависимости от длительности болезни были сформированы две группыбольных. В первую группу больных с длительностью болезни 3-11 месяцеввошли 37 больных, из которых 14 (37,8%0 мужчин и 23 (62,2%) женщины.Средний возраст больных – 47,3±0,6 лет. Длительность болезни: 7,97±0,4месяца. Явления синовита определялись у 21 (56,8%) больного. I стадияпоражения суставов установлена у 36 (97,3%), II стадия – у 1 больного.Вторую группу составили 20 больных, из которых 18 (90%) женщин и 2мужчины. Средний возраст больных – 44,4±0,9 лет. Длительность болезни от12 до 23 месяцев: 16,3±0,8 месяца. Явления синовита выявлены у 14 (70%)больных. I стадия поражения суставов определялась у 9 (45%), II стадия – у11 больных (55%). Выделение лимфоцитов из периферической венознойкрови проводилось по методике Boyum (1968). Лизаты лимфоцитов готови-лись путем замораживания–оттаивания, центрифугирования. Активностьферментов определялась по оригинальным методикам и выражалась в нмоль/мин/мл, содержащим 1×107 клеток. Полученные данные обрабатыва-лись методом вариационной статистики.Результаты исследований. Активность энзимов в лизатах лимфоцитовздоровых людей не зависела от пола и возраста, что позволило эти факторыв исследовании у больных. Так как все больные ОА находились на раннихстадиях болезни, в дальнейшем эта группа будет именоваться как больные сранним остеоартрозом (РОА). При поступлении на лечение у больных РОА(всей группы), по сравнению со здоровыми в лизатах лимфоцитов выше ак-тивность АДА (р˂0,001), незначительно выше активности АМФДА, 5´-НТ, АД(все р>0,05). У больных с синовитом, по сравнению со здоровыми, в лимфо-цитах выше активность 5´-НТ (р=0,006), АД (р˂0,001), незначительно вышеАДА (р=0,051), а у больных без синовита существенных энзимных различийне определялось (р>0,05). У больных РОА с синовитом, по сравнению сбольными без синовита, выше активность всех ферментов.У больных с по-лиостеоартрозом, по сравнению с больными с моно-олигоартрозом, вышеактивность АД, АМФДА, 5´-НТ и ниже АДА (все р˂0,001). У больных РОА с Iстадией, по сравнению с II стадией, в лимфоцитах выше активность АДА(р˂0,001), ниже АМФДА (р˂0,001), АД (р˂0,05) и 5´-НТ (р˂0,001). У больныхс ФК-1, по сравнению с больными ФК-2, выше активность АДА (р˂0,001),ниже АМФДА, АД и 5´-НТ (р˂0,001). У больных 2-й группы (с длительностьюболезни 12-23 месяца), по сравнению с больными 1-й группы (2-11 меся-цев), в лимфоцитах ниже активность АДА (р˂0,001), АМФДА (р˂0,01), 5´-НТ(р˂0,01). То-есть, по мере увеличения длительности болезни активностьАДА, АМФДА и 5´-НТ достоверно снижается. Проведенные исследования вы-явили существенные изменения активности изученных энзимов в зависимо-сти от синовита, ФК и стадии поражения суставов. Значительное влияние наэнзимную активность оказывает длительность заболевания, что необходимоучитывать в клинической практике при интерпретации энзимных показате-лей в лимфоцитах больных ОА на ранних стадиях заболевания.
Мозговая Е.Э., Мартемьянов В.Ф., Зборовский А.Б.,Бедина С.А., Стажаров М.Ю., Королик О.Д., Чернов А.С.
АКТИВНОСТЬ ФЕРМЕНТОВ ПУРИНОВОГО МЕТАБОЛИЗМА В ПЛАЗМЕ КРОВИ БОЛЬНЫХРЕВМАТОИДНЫМ АРТРИТОМ С I СТЕПЕНЬЮАКТИВНОСТИ ПАТОЛОГИЧЕСКОГО ПРОЦЕССА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ
Если диагностика обострения патологического процесса, протекающего сумеренной или максимальной активностью у больных ревматоидным артри-том (РА) не представляет особых сложностей для врачей-ревматологов, тораспознавание процесса, особенно в амбулаторной практике, достаточно затруднительно даже для опытных врачей вследствие малой информативно-сти общепринятых лабораторных показателей, отражающих интенсивностьвоспалительного процесса. Проблема ранней диагностики минимальной ак-тивации ревматоидного процесса остается актуальной до настоящего време-ни.Цель исследования. Улучшение диагностики минимальной активностиревматоидного процесса за счет использования показателей активности не-которых ферментов пуринового метаболизма в плазме крови больных РА.Материал и методы. Под наблюдением находились 20 больных РА с Iстепенью (минимальной) активности процесса, из которых 14 (70%) женщи-ны. Средний возраст больных – 46,8±0,9 лет. Диагноз РА устанавливался наосновании диагностических и классификационных критериев Американскойколлегии ревматологов и Европейской лиги ревматологов (2010 г.). I стадияпоражения суставов (по Штейнброккеру) определялась у 3 (15%), II стадия– у 10 (50%), III стадия – у 5 (25%) и IV стадия – у 1 (5%) больного. Функ-циональный класс (ФК) суставов 2 степени установлен у 12 (60%) больных,ФК-3 – у 7 (35%) и ФК-4 – у 1 (5%) больного. Системные поражения выяв-лены в 40% случаев, серопозитивный вариант – в 60% и прогрессирующеетечение – в 20% случаев. Контрольную группу составили 30 практическиздоровых людей. В плазме крови здоровых и больных РА по оригинальнымметодикам определялась активность гуаниндезаминазы (ГДА), гуанозиндез-аминазы (ГЗДА), гуанозинфосфорилазы (ГФ), пуриннуклеозидфосфорилазы(ПНФ), ксантиноксидазы (КО) и ксантиндегидрогеназы (КДГ) и выражалась внмоль/мин/мл. Обработка полученных результатов проводилась с использо-ванием программы ”Статистика 6.0”. Комплекс обследования больных такжевключал определение общего анализа крови, мочи, СРБ, РФ, фракций белковсыворотки крови, иммуноглобулинов, сиаловых кислот.Результаты исследований. По сравнению со здоровыми, у больных РАс I степенью активности процесса, выше активность КО, ГДА, ПНФ (всер<0,001), КДГ (р<0,05), ниже активность ГЗДА (р<0,05) и незначительнониже активность ГФ (р>0,05). Если же учитывать индивидуальные показате-ли, то за верхние референтные пределы здоровых (М±2σ) показатели актив-ности КО выходили в 55% случаев, КДГ – в 35%, ПНФ – в 70% и ГДА – в50% случаев, а показатели СОЭ – в 40%, СРБ – в 35%, альфа-2-глобулинов– в 40%, сиаловых кислот – в 35%, гамма-глобулинов – в 25% случаев.Через 7-8 дней лечения снизилась активность ГДА (р<0,05), ПНФ(р<0,05) и повысилась ранее сниженная активность ГЗДА (р<0,05). По окон-чании курса лечения наблюдалась положительная динамика как клиниче-ских проявлений, так и всех энзимных показателей, которые не отличалисьот здоровых, за исключением активности КО, которая хотя и снизилась, ноосталась повышенной (р<0,05).При анализе энзимных показателей в зависимости от клинических осо-бенностей выявлено, что чем выше стадия поражения и ФК суставов, темвыше активность КО, КДГ, ГДА, ПНФ, ГФ и ниже ГЗДА. При системных пора-жениях, по сравнению с суставной формой, выше активность ГДА, ПНФ, ГФ, КО и КДГ. При системных поражениях, по сравнению с суставной формой,выше активность ГДА, ПНФ, ГФ, КО и КДГ.Заключение. Результаты проведенных исследований свидетельствуют,что показатели активности КО, ПНФ и ГДА в плазме крови более четко отра-жают минимальную активность ревматоидного процесса, чем СОЭ, СРБ, сиа-ловые кислоты и белковые фракции крови. Определяется зависимость ак-тивности ферментов от клинических особенностей заболевания. В ранниесроки лечения (первые 7-8 дней) при оценке эффективности назначеннойтерапии целесообразно ориентироваться на динамику показателей активно-сти ГДА, ПНФ и ГЗДА, которые более чувствительны к изменениям клиниче-ского состояния больных.
Моисеенко С.Н., Малахова Н.Л., Ханов А.Г.
СВИЩИ ПИЩЕВОДА И ТРАХЕИ У БОЛЬНЫХ ДЕРМАТОМИОЗИТОМ (КЛИНИКО-РЕНТГЕНО-ПАТОЛОГОАНАТОМИЧЕСКИЕ НАБЛЮДЕНИЯ)
ГБУ РО «Областная клиническая больница №2»,Клиническая больница №1ФГБУЗ ЮОМЦ ФМБА России, г. Ростов-на-Дону, Россия
Поражение мышц глотки, гортани, верхней трети пищевода при ДМ про-является в клинической картине заболевания дисфонией, затруднением гло-тания, приступами кашля.В течение трех месяцев у 3 больных наблюдавшихся в ОКБ №2 с диа-гнозом ДМ наступил летальный исход. Причиной резкого ухудшения течениязаболевания послужили свищи пищевода и трахеи со смертельными ослож-нениями.Первый пациент, м, 28 лет, с остро начавшимся ДМ в течение года ипринимавший большие дозы ГКС, умер от некроза слизистой глотки, ослож-нившейся флегмоной шеи и медиастинитом.Второй пациент, М, 57 лет, заболел полгода назад с высыпаний на коже ислабости в мышцах. За медицинской помощью обратился через 4 мес. В ОКБбыл установлен диагноз ДМ и назначены высокие дозы ГКС, без эффекта.При госпитализации имелась выраженная картина ДМ. Одновременно боль-ной предъявлял жалобы на боли в горле и кашель с гнойной мокротой. Приобъективном обследовании в нижних отделах определялись влажные мел-копузырчатые хрипы, которые расценены как проявления гипостатическойтерапии. Но выполненная рентгенография ОКГ признаков пневмонии не об-наружила. Больному начата пульс терапия в комбинации с в/в МТ. На 10день пребывания в стационаре, во время приема пищи, больной поперхнул-ся, развился приступ удушья, появились боли в сердце. Подозревался ИМ.После проведенного обследования диагноз острого ИМ не подтвердился. На следующий день выполнена рентгеноскопия пищевода, обнаружившаярак пищевода верхней трети и трахеобронхиальный свищ.Третья пациентка, Ж, 53 лет, заболела год назад с «классической» кар-тины ДМ. По м/ж, ревматологом был установлен диагноз: ДМ, назначенывысокие дозы ГКС. Причем, за год до этого больная лечилась стационарно вКВД по поводу дерматита без признаков системного воспаления. Прошла 2курса терапии с интервалом в месяц с диагнозами: «Герпетическая инфек-ция, осложненная токсико-аллергическим дерматитом» и «неутонченнымдерматитом». В первые три месяца заболевания трижды госпитализирова-лась, причем последний раз в ревматологическое отделение областной боль-ницы. Относительная ремиссия продолжалась 3 месяца, после чего вновьгоспитализирована по м/ж. 4 месяца больная чувствовала себя относитель-но удовлетворительно, продолжала прием ГКС в высоких дозах. Резкоеухудшение состояния в течение месяца в связи с образованием язв на коже,во рту, гениталиях. Больная госпитализирована в ревматологическое отде-ление областной больницы. На 2-ой день пребывания в стационаре у боль-ной развился коллапс, по поводу которого пациентка переведена в АРО.Причиной коллапса явился эпизод аспирации, который, по данным КТ про-изошел через гортанно- трахеальный и пищеводный свищ. Организованоэнтеральное питание через назогастральный зонд. Б-ная консультированаторакальным хирургом. Рекомендована подготовка к пластике пищевода .На18 день стационарного лечения случился повторный эпизод аспирации сначинающимся отеком легких, в связи, с чем переведена в АРО, где черезсутки наступила смерть. Направлена на патологоанатомическое вскрытие сзаключительным клиническим диагнозом:Конкурирующие заболевания1.Дерматомиозит, подострое течение, активная фаза, 3 степень активно-сти. Осл. Выраженная слабость проксимальных мышц верхних и нижних ко-нечностей. Вторичный некротизирующий васкулит по типу синдрома Бехче-та. Трофическая язва левой подмышечной области. Хронический ДВС син-дром с рецидивирующими тромбоэмболиями мезентериальных сосудов,ТЭЛА и острое повреждение миокарда 2.9.12 с отеком легких.2. Гортанно-трахеальный и пищеводный свищ в области правого груше-видного синуса. Остаточные явления перенесенной аспирационной пневмо-нии в виде постпневмонического фиброза в кортикальных отделах нижнейдоли правого легкого. Правосторонний малый гидроторакс с признаками ча-стичного осумкования в синусах.Эпизоды аспирации в трахеобронхиальное дерево с сосудистым коллап-сом (13.08 и 15.08.12) и 1.09.12 с интерстициальным отеком легких. Гене-рализация грибковой инфекции с развитием сепсиса. Септический шок. Гра-нулематозное поражение легких вследствие неоднократной аспирации.Травматизация слизистой пищевода вследствие длительного пребыванияназогастрального зонда, частой его смены, ФГДС и повторных диагностиче-ских и санационных бронхоскопий. Энтеральное питание через желудочныйзонд 18 дн. Реанимационные мероприятия (дефибрилляция, ИВЛ 3.912). Соп. Гипертоническая болезнь 3 стадии, степень АГ 2 , Риск 4, очень вы-сокий, дополнительный риск. Хроническая атеросклеротическая болезньсердца, атеросклеротическое поражение аортального и митрального клапа-нов (недостаточность митрального клапана 1 степени) ХСН 2А с неутончен-ным функциональным классом (NYHA). Хронический пиелонефрит латент-ное течение. Дисциркуляторная энцефалопатия сочетанного генеза выра-женной степени. ГРЭБ. Недостаточность кардии. Эрозивный гастродуоденит(об). Хронический фарингит. Хронический тонзиллит. Хронический ларин-готрахеит. Хронический стоматит. Хронический риносинуит. Левостороннийтубоотит.Причина смерти:а) острая сердечно – сосудистая недостаточностьб) ТЭЛА и острое повреждение миокардав) дерматомиозит, подострое течение, а/ф, 3 ст. акт., осложненный гор-танно – трахеальным и пищеводным свищом в области грушевидного сину-са.Патологоанатомический диагноз: Узловой рак левого яичника с метаста-зами в клетчатку малого таза, большой сальник, печень, легкие, парааор-тальные лимфатические узлы и области бифуркации трахеи.Осложнения: Вторичный дерматомиозит. Трофические язвы левой под-мышечной области. Острая двухсторонняя полисегментарная дольково-сливная абсцедирующая пневмония. Пролежни слизистой оболочки верхнейтрети пищевода. Псевдомембранозный колит. Двусторонний гидроторакс.Асцит (500 мл). Жировая дистрофия печени и миокарда. Некротическийнефроз. Отек легких и головного мозга. Сопутствующие: Ожирение 2 степе-ни.Таким образом, имело место расхождение диагноза по основному заболе-ванию. Необходимо указать, что в течение полугода до госпитализации вОКБ, больная 2 раза проходила гинекологическое УЗИ по м/ж в разных ле-чебных учреждениях.Предложения. ДМ у лиц трудоспособного возраста (особенно в старшихвозрастных группах), чаще всего является вторичным на фоне злокаче-ственных опухолей, и может быть одним из первых их проявлений. Такимобразом, больные ДМ, находящиеся на лечении в учреждениях областногоуровня должны в обязательном порядке проходить КТ ОГК, брюшной полостии органов малого таза независимо от жалоб, клинической картины, предше-ствующих результатов обследования в других лечебных учреждениях, нали-чия или отсутствия объективных данных поражения внутренних органов.Подробное описание клинических случаев, патологоанатомическое за-ключение, макро – и микропрепараты представлены по адресу;http://visualrheumatology.ru/svishhi-pishhevoda-i-trahei.html
Неделько Г.Н., Выставкина Е.А.
ФАКТОРЫ РИСКА ПОРАЖЕНИЯ ПОЧЕКПРИ РЕВМАТОИДНОМ АРТРИТЕ
ГБУ РО «Областная клиническая больница №2», г. Ростов-на-Дону, Россия
В последнее время внимание на себя обращает высокая частота наруше-ний функции почек у пациентов с ревматоидным артритом (РА). Почки приРА могут исходно поражаться как вследствие основного заболевания, так иза счет сопутствующей патологии самой почки, проявляющейся при исполь-зовании нестероидных противовоспалительных препаратов. Возможно, РАприводит к снижению функции почек или усугублению уже имеющихсянарушений. Исследования, посвященные изучению патологии почек у боль-ных РА, в которых отражалось бы влияние клинических, лабораторных иинструментальных данных, малочисленны либо противоречивы, что опреде-ляет актуальность последующего изучения данной проблемы.Целью работы явилось изучение распространенности клинических про-явлений поражения почек у больных РА и определение факторов риска по-чечной дисфункции при хроническом заболевании суставов.Основу исследования составили Результаты комплексного клинического,инструментально-лабораторного обследования 100 больных РА (80-ти жен-щин и 20-ти мужчин). Возраст больных в среднем составил 53,71,1 лет.Пациенты клинической группы в зависимости от наличия либо отсутствияклинических признаков поражения почек были разделены на две группы. 1-ю группу составили 64 (64,0%) пациента, у которых почечная дисфункцияотсутствовала, а 2-ю группу – 36 (36,0%) больных с наличием почечнойдисфункции. Внутри 2-й группы среди больных РА выделялись подгруппы сразной вовлеченностью почек в патологический процесс: в зависимости отзначения скорости клубочковой фильтрации (СКФ) (СКФ≥90 мл/мин/1,73м2,СКФ 60-89 мл/мин/1,73 м2 и СКФ 30-59 мл/мин/1,73м2), наличия или отсут-ствия микроальбуминурии (МАУ), протеинурии, уровня экскреции альбуминаи белка с мочой.Изучение функционального состояния почек включало общий анализ мо-чи, анализ мочи по методике Зимницкого, Каковского-Аддиса; определениескорости клубочковой фильтрации по формулам Кокрофта-Гаулта и MDRD,проведение пробы с сухоядением. Для оценки концентрационной способностипочек по результатам пробы Зимницкого вычисляли концентрационный индекс(КИ) по формуле (Батюшин М.М., 2006): КИ = Δуд вес ∙ ДД/НД, где дневной диурез- ДД, ночной диурез – НД, ДД/НД, разница максимального удельного веса мочи к ми-нимальному – Δуд вес. В норме КИ должен составлять более 24,7. Также проводи-ли ультразвуковое исследование почек, оценивали наличие и выраженностьМАУ, протеинурии. При биохимическом анализе крови производилось опре-деление общего белка, альбумина, преальбумина, креатинина, мочевой кис-лоты, соотношения альбумин/креатинин, общего холестерина, липопроте-идов низкой плотности, высокой плотности, триглицеридов, глюкозы. Ре-зультаты исследования были обработаны с помощью компьютерной программы Statistica 7.0 с применением методов описательной статистики, таб-лиц сопряженности, дисперсионного анализа.Результаты. Среди 100 больных клинической группы у 64 (64%) паци-ентов ХБП не выявлялась (1-я группа). Соответственно 36 (36%) больныхвошли во 2-ю группу. Среди больных 2-й группы 1-я стадия ХБП была уста-новлена у 5 (13,9%) пациентов: у 4 пациентов на основании выявления пер-систирующей МАУ, а у одного больного – на основании персистирующегомочевого синдрома в виде эритроцитурии. Незначительное снижение СКФ(60-89 мл/мин/1,73 кв.м) было отмечено у 21 (58,3%) больного РА со 2-йстадией ХБП. У 10 (27,7%) больных с 3-й стадией ХБП имелось умеренноеснижение СКФ в диапазоне 30-59 мл/мин/1,73 кв. м. Нормальная или повы-шенная СКФ (90 и более мл/мин/1,73 кв.м) была определена у 5 пациентов2-й группы. Обращает внимание малый удельный вес больных РА с нормаль-ной или повышенной СКФ (90 и более мл/мин/1.73 кв.м) среди больных 2-йгруппы с ХБП. Возможно, для развития гипофильтрации при РА нехарактерноналичие предшествующей гиперфильтрационной фазы.В общем по группе МАУ наблюдали в 24%, а протеинурия выявлялась в11%. Во 2-й группе пациентов МАУ отмечали у 4 больных с 1-й стадией ХБП,у 20 пациентов со 2-й стадией, а протеинурию – у 1 больного со 2-й и у 10больных с 3-й стадией ХБП. Всего во 2-й группе у МАУ была выявлена у 24(66,7%), а протеинурия – у 11 (30,6%) больных. Cредний уровень креатини-на у больных РА составил 79,4±1,8 мкмоль/л, размах колебания составил от61 мкмоль/л до 135 мкмоль/л. Гиперкреатинемия (мужчины выше 115мкмоль/л, женщины – выше 97 мкмоль/л) наблюдалась в 7 случаях (7%). Упациентов РА мочевина крови колебалась от 2,9 ммоль/л до 13,7 ммоль/л, всреднем составив 5,9±0,2 ммоль/л. Повышение мочевины выше нормы (8,3ммоль/л) выявлялось у 7 больных (7%).На следующем этапе исследования основные показатели, отражающиефункциональное состояние почек, были проанализированы отдельно в груп-пах с наличием или отсутствием ХБП. У больных 2-й группы при присоеди-нении ХБП происходило снижение СКФ на 43,9% (p<0,001), возрастал уро-вень суточной протеинурии в 833,5 раз (p<0,001), содержание креатинина -на 8,9% (p<0,05).Концентрационную способность почек изучали с помощью пробы по Зим-ницкому и посредством пробы с сухоядением. При предварительной оценкеудельного веса мочи по итогам общего анализа было установлено, что в об-щем по группе относительная плотность мочи колебалась от 1005 до 1034,среднее значение составило 1014,2±0,6. В 1-й группе относительная плот-ность мочи варьировала от 1005 до 1034, во 2-й группе – от 1005 до 1025.Средняя величина удельного веса мочи у больных 1-й группы была1013,9±0,79, во 2-й группе – 1014,7±0,77. Среднее значение относительнойплотности мочи у больных 1-й и 2-й групп, а также в общем по клиническойгруппе было немногим меньше нижней границы нормы. По итогам пробы поЗимницкому было установлено, что в общем по группе, а также в 1-й группеконцентрационная и водовыделительная способность почек была в норме. Убольных 2-й группы нарушалась концентрационная способность почек, по-скольку относительная плотность мочи была ниже 1020. Способность к разведению мочи у больных 1-й и 2-й групп была в норме и находилась нижеуровня 1010-1012. Снижение максимального значения относительной плот-ности мочи у пациентов 2-й группы приводило к снижению размаха и свиде-тельствовало об ограничении способности почек к осмотическому концен-трированию мочи. У больных 2-й группы концентрационный индекс был ни-же по сравнению с 1-й группой на 33,5% (p<0,001) (62,2±10,4 против93,6±9,1).У больных 1-й группы проба с сухоядением была в норме: объем порциймочи, собираемой каждые 2 часа, уменьшался до 30-60 мл в порции, суточ-ный диурез снижался до 300-400 мл, относительная плотность мочи нарас-тала до 1028-1032. У больных 2-й группы наблюдалась пониженная концен-трационная способность почек: количество мочи и величина отдельных пор-ций мочи была больше нормальных. Относительная плотность мочи увеличи-валась только до 1020-1022. Содержание форменных элементов в моче убольных РА оценивали по результатам общего анализа мочи и пробы по Ка-ковскому-Аддису. В общем в клинической группе средние величины количе-ства лейкоцитов в поле зрения и их суточное выделение с мочой превышаливерхнюю границу нормы и соответствовали лейкоцитурии. Как известно,лейкоцитурия является маркёром интерстициального нефрита лекарственно-го либо инфекционного генеза при отсутствии инфекции мочевых путей. Уобследованных больных РА инфекции мочевых путей (пиелит, уретерит, ци-стит, уретрита, простатит) отсутствовали, следовательно лейкоцитурия, ве-роятно, была следствием нефрита. При дифференцированном анализе погруппам установлено, что в 1-й группе содержание форменных элементовмочи было в норме, а у пациентов 2-й группы лейкоцитурия была обнаруже-на как при общем анализе мочи, так и при проведении пробы по Каковско-му-Аддису. Содержание эритроцитов и цилиндров было в норме.Проведение дисперсионного анализа с вычислением критерия Фишера иего доверительной вероятности показало, что факторами, которые одновре-менно у больных РА обеспечивают снижение СКФ и МАУ, являются возраст,длительность и степень активности РА, АГ, пульсовое давление, уровень хо-лестерина крови. Развитию одновременного снижения СКФ и протеинурии упациентов с РА способствовали длительность и степень активности РА, АГ,пульсовое давление, уровень холестерина и глюкозы крови (табл.3).У больных РА нами были выявлены изменения в работе клубочковой ча-сти нефрона, снижение концентрационной способности почек, из особенно-стей содержания форменных элементов в моче – лейкоцитурия. Часто у па-циентов с РА выявлялась микроальбуминурия, протеинурия. Все установлен-ные изменения становятся очевидными при исследовании больных РА сосниженной СКФ. В общем по клинической группе, включающей пациентов сРА как с наличием, так и при отсутствии почечного повреждения, выявлен-ные изменения сглаживаются. Этот факт требует разработки алгоритма ран-него выявления почечной дисфункции у пациентов с РА и изучения факто-ров риска почечной дисфункции при хронических воспалительных заболева-ниях суставов. Больные РА являются группой повышенного риска почечнойпатологии, вероятность развития которой возрастает при продолжительном иактивном течении РА. На амбулаторном этапе при диспансерном наблюденииза больными РА необходимо оценивать скорость клубочковой фильтрации, содержание альбуминов и протеинов мочи, концентрацию в крови креатини-на, мочевины, мочевой кислоты, исследовать клеточный состав мочевогоосадка, проводить пробы Зимницкого и пробу с сухоядением. Клиническиесимптомы почечной дисфункции у больных РА при высокой активности ипродолжительности основного заболевания, а также при выявлении артери-альной гипертензии и дислипидемии, должны быть основанием для активно-го диспансерного наблюдения за больными. Такой подход направит усилияклиницистов на своевременное лечение патологии почек у больных РА, чтопозволит продлить жизнь пациентам и улучшить ее качество.Таким образом, среди больных РА распространенность ХБП составляет36% и проявляется снижением СКФ менее 90 мл/мин/1,73м2 в 31%, МАУ в24%, протеинурией в 11%, гиперкреатинемией и повышением мочевины имочевой кислоты крови в 7%, лейкоцитурией, снижением концентрационнойфункции почек по результатам проведения пробы с сухоядением. У больныхРА развитие ХБП и степень выраженности ее проявлений определяется дли-тельностью и активностью основного заболевания, возрастом, наличием ар-териальной гипертензии, дислипидемией и повышением уровня глюкозыкрови.
Ненашева Н.В., Черкашина И.В., Оросс И.В.,Некрасова С.П., Александров А.В.
ДИНАМИКА ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЖИЗНИ У БОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛИТОМ ПОД ВЛИЯНИЕМ ХРОНОМАГНИТОТЕРАПИИ
ФГБУ«НИИ КиЭР» РАМН», Волгоград; Филиал СКК «Вулан» ФГБУ «Россий-ский научный центр медицинской реабилитации и курортологии МинздраваРоссии», Геленджик; ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Целью исследования явилось изучение влияния хрономагнитотерапии(комплекс «Мультимаг») на показатели качества жизни (КЖ) у больных ан-килозирующим спондилитом (АС).Материалы и методы. Под нашим наблюдением находилось 98 больныхс диагнозом АС (согласно модифицированным Нью-Йоркским критериям,1984 г.). Больные АС были разделены на три группы, сопоставимые по поло-вому составу, возрасту, длительности и активности заболевания: основную(n=35), группу сравнения (n=33) и контрольную (n=30). Пациенты всехгрупп получали стандартную терапию. Помимо этого, больные основнойгруппы получали дополнительно 10 ежедневных сеансов хрономагнитотера-пии на аппарате «Мультимаг» (Касимовский приборный завод, г. Рязань) иклиматотерапию в условиях климатобальнеологического курорта Геленджик(Россия, Краснодарский край, СКК «Вулан»); больные группы сравнения –не получали реабилитационной терапии, больные контрольной группы –получали на постгоспитальном этапе только сеансы общей магнитотерапии. КЖ больных изучали с помощью общего опросника Short Form 36-item HealthStatus Questionnaire SF-36.Результаты. Анализ показателей качества жизни обследованных намибольных АС по всем шкалам опросника показал низкие значения исследуе-мых параметров. Прежде всего, страдали такие показатели, как ролевоефункционирование, обусловленное физическим состоянием, интенсивностьболи и общее состояние здоровья.В контрольной группе больных АС, получавших курс общей магнитотера-пии в амбулаторных условиях, было отмечено достоверное увеличение пока-зателей, характеризующих физическое здоровье. Изменение остальных по-казателей в этой группе было незначительным. В группе сравнения (боль-ных АС, получавших стандартное санаторно-курортное лечение) наблюда-лось достоверное увеличение значений шкал, отражающих психическое здо-ровье. Незначительное увеличение значений шкал, характеризующих физи-ческий компонент здоровья, было статистически незначимым (p>0,05).Положительная динамика показателей шкал опросника наиболее выра-жена у пациентов основной группы, получавших сеансы хрономагнитотера-пии в санаторно-курортных условиях. Эти больные АС показали достоверноеувеличение значений как по физическому компоненту здоровья, так и попсихическому.Обсуждение. Применение хрономагнитотерапии у больных АС сопро-вождалось улучшением состояния как физического, так и психического здо-ровья. Воздействие магнитного поля обусловило положительную динамикусоответствующих показателей КЖ у больных АС как в основной группе, так ив контрольной. Однако, в группе пациентов, получавших лечение в амбула-торных условиях, наблюдалось более выраженное изменение параметровфизического здоровья. Это можно объяснить близостью к больному методаобщей магнитотерапии в амбулаторных условиях, в то время как в случаесанаторного лечения преемственность лечения ограничена временными рам-ками. В группе сравнения, наоборот, наблюдалось положительное изменениезначений шкал, характеризующих психический компонент здоровья. Этомогло быть связано и с переменой в условиях проживания, иным режимоминсоляции, приобретением положительных эмоций, отсутствием привычныхсоциально-бытовых проблем.При совместном применении различных методов восстановительной тера-пии, включая аппаратные и климатические, возможно воздействие как нафизический, так и на психический компонент здоровья.Выводы. Таким образом, реабилитационные методы лечения способ-ствуют положительной динамике показателей КЖ у больных АС. Изолиро-ванное применение хрономагнитотерапии и совокупности других физиотера-певтических методов в санаторно-курортных условиях на постгоспитальномэтапе оказывает влияние соответственно на параметры физического и пси-хического здоровья больных АС. Наиболее целесообразным является сов-местное использование метода хрономагнитотерапии в комплексе общепри-нятых методов санаторно-курортного лечения, что позволяет получить пози-тивные Результаты в отношении всех показателей КЖ.
Ненашева Т.М.
АТЕРОСКЛЕРОЗ И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ ПРИ ПОДАГРЕ
ГБОУ ВПО Саратовский ГМУ им. В. И. Разумовского, Саратов
Афоризмы Lecorche «Подагрики почти всегда становятся атеросклеро-тическими больными» и Huchard «Подагра для артерий то же самое, чторевматизм для сердца» не теряют своей актуальности, поскольку по даннымэпидемиологических исследований гиперурикемия – это фактор риска ИБСи составляющая метаболического синдрома. Прогностическая значимостьпоражения сердца и сосудов требует знаний указанной патологии, своевре-менного распознавания поражений.Цель исследования: Изучить частоту артериальной гипертензии иатеросклероза при интермиттирующей и хронической подагре.Материал и методы исследований Обследовано 450 больных пер-вичной подагрой, преимущественно мужчин. Средний возраст об-следованных больных подагрой составил 49,24+_0,46 лет, средний возрастпериода начала заболевания – 40,08+_0,48 лет. Диагноз подагры ставилсяна основании клинико-лабораторных проявлений, верифицирован с помо-щью диагностических критериев. Изучалось состояние микроциркуляции,ЭКГ, ЭХОКГ, состояние липидного обмена, дозированная физическая нагруз-ка на велоэргометре, допплерграфия сосудов. По показаниям проводиласьпроба с мембраноактивными веществами, реография, коронарокардиогра-фия. При проведении исследования в качестве контроля использована груп-па сравнения, состоящая из 450 практически здоровых лиц, идентичных повозрасту и половой принадлежности больным подагрой.Полученные Результаты исследования. Сердечнососудистая пато-логия у больных подагрой встречалась достоверно чаще, чем в группе срав-нения (Р<0,001), и была обусловлена главным образом наличием сопутству-ющего атеросклероза. Атеросклероз установлен у 261 больного подагрой(58,4%). Как и следовало ожидать, его частота увеличивалась с возрастом.Однако атеросклероз нередко развивается и у молодых: в возрасте 30-39лет у каждого четвертого и 40-45 почти у каждого второго. Обращает насебя внимание значительное превышение частоты развитая атеросклероза убольных подагрой по сравнению с контрольной группой – в 2,7 раза(Р<0,001). Так в возрасте до 40 лет атеросклероз при подагре развивается в14 раз чаще, 40-49 лет в 11,7 раза чаще, 50-59 лет в 3,2 раза чаще, 60-69лет в 1,8 раза чаще, чем у пациентов группы сравнения.Проведенный анализ показал, что у больных подагрой при наличии ги-перхолестеринемии атеросклероз установлен в 54;2% случаев, при наличииартериальной гипертензии в 57,8%, при сочетании артериальной гипертен-зии и гиперхолестеринемии в 69,8%, а при их отсутствии лишь в 40,2%наблюдений. Это дает основание полагать, что в атерогенезе при подагреиграют роль как артериальная гипертензия, так и сдвиги в липидном обменеи особенно сочетание этих факторов. У больных хронической подагрой в 2 раза чаще выявляется атеросклероз по сравнению с интермиттирующей по-дагрой. Повышение артериального давления отмечено у 273 из 450 больныхподагрой (60,6%), что достоверно чаще, чем в группе сравнения (Р<0,001).Сравнительный анализ частоты артериальной гипертензии у больных по-дагрой и в группе сравнения показал, что при подагре артериальная ги-пертензия встречается достоверно чаще (Р<0,001). В молодом возрастеповышение артериального давления отмечалось в 52,4% наблюдений приподагре, а в группе сравнения лишь в 10,5%. В среднем возрасте артери-альная гипертензия у больных подагрой была в 64,9% случаев. Что касаетсяпожилого и старческого возраста, то в этих возрастных группах артериаль-ная гипертензия регистрировалась соответственно в 63,3% и 75,0% случа-ев. Клиническое течение артериальной гипертензии при подагре не имееткаких-либо отличий от таковых при других симптоматических гипертензиях.Установлена взаимосвязь повышения артериального давления у больныхподагрой с возрастом (r =+0,36), ожирением (r=+0,37), некоторыми показа-телями острофазового воспаления: содержанием церулоплазмина (r=+0,57),ЦИК (r=+0,89), состоянием микроциркуляции – величиной общего конъюнк-тивального индекса (r=+0,32) и показателями, характеризующими состояниепочек: концентрацией креатинина (r=+0,35), мочевины (r=+0,36), уровнемпротеинурии (r=+0,31) и количеством цилиндров в осадке мочи (r= =+0,72)Р<0,05-0,001. Это дает основание расценивать артериальную гипертензиюпри подагре как симптоматическую, связанную с непосредственно подагри-ческим поражением почек, микроциркуляторными нарушениями и завися-щую от наличия сопутствующего атеросклероза, ожирения. При хроническойподагре в 2 раза чаще регистрируется артериальная гипертензия, чем приинтермиттирующей подагре. Обращено внимание на частоту регистрацииЭКГ изменений. Они превышают частоту атеросклероза и артериальной ги-пертензии при подагре. При хронической подагре ЭКГ изменения регистри-руются в 1,8 раза чаще, чем при интермиттирующей. Частота ИБС при по-дагре увеличивается с возрастом. Так в возрасте до 45 лет ИБС развиваетсяу каждого десятого, в среднем у каждого шестого и у лиц старше 60 лет укаждого третьего.Выводы: При подагре даже в молодом возрасте нередко развиваетсяатеросклероз. Развитие артериальной гипертензии при подагре зависит отналичия сопутствующего атеросклероза, ожирения, и может быть обуслов-лено непосредственно подагрическим поражением почек, микроциркулятор-ными нарушениями.
Осипянц Р.А., Алекберова З.С., Богданова М.Х.,Бабина С.М., Панкина М.Д., Рязанцев А.А., Болотов В.Б.,Миронова Е.В., Кириченко А.А.
БОЛЕЗНЬ БЕХЧЕТА – ТРУДНОСТИ ДИАГНОСТИКИ
НУЗ «Научный клинический центр ОАО «РЖД», ФГБУ «НИИР им. В.А. Насоновой», НУЗ Центральная клиническая больница №1 ОАО «РЖД», кафедра терапии РМАПО, Москва, Россия
Болезнь Бехчета (ББ), или болезнь Шелкового пути – системный вас-кулит неизвестной этиологии, характеризующийся рецидивами язвенногопроцесса в ротовой полости и на гениталиях, поражением глаз, суставов,желудочно-кишечного тракта, ЦНС и других органов. Имеет хроническоетечение с непредсказуемыми обострениями и ремиссиями. ББ заболеваютпреимущественно молодые люди в возрасте от 20 до 40 лет: чаще – мужчи-ны (соотношение М:Ж – 2-10:1 в странах, через которые проходил ВеликийШелковый путь).Инициирующая роль отводится комбинации различных факторов: гене-тических (HLA-B5 (*51)), инфекционных (стрептококки, вирус простого гер-песа), белок теплового шока (англ. HSP, Heat shock proteins), иммуннымнарушениям (гиперпродукция интерлейкинов -2, 6, 8, 12, фактора некрозаопухоли – альфа, интерферона – гамма). Трудности диагностики ББ обу-словлены вариабельностью течения, мультиорганным поражением и отсут-ствием специфических иммунологических критериев.Согласно критериям международной группы по изучению ББ (ISGBD,1990) для диагноза ББ необходимо сочетание рецидивирующего афтозногостоматита с двумя из нижеприведенных признаков: язвенного пораженияполовых органов, воспаления тканей глаза (прежде всего увеита), кожныхпроявлений (псевдофолликулит, акнеподобные высыпания, узловатая эри-тема) и положительного теста патергии (появление кожных пустул через 24-48 ч. после прокола иглой).Приводим собственное наблюдение. Больной Р., 32 лет, коренной жительреспублики Дагестан, железнодорожник, поступил в 4-е терапевтическоеотделение НУЗ ЦКБ №1 ОАО «РЖД» 22.08.2013 г. с жалобами на повышениетемпературы тела до высоких фебрильных цифр, головную боль, сухой ка-шель, боль в правой половине грудной клетки при глубоком дыхании.Из анамнеза известно, что с августа 2011 г. возникают эпизоды лихо-радки до фебрильных цифр, одышка при нагрузке, сухой кашель. Неодно-кратно обследовался по месту жительства. Проводилась дифференциальнаядиагностика между пневмонией, специфическим процессом в легких, инфек-ционным эндокардитом, инфарктом миокарда.По данным коронароангиографии значимых изменений коронарных ар-терий выявлено не было. Диагноз оставался неясным. Антибактериальнаятерапия раличными классами препаратов существенного эффекта не прино-сила. В дальнейшем манифестировала пиодермия, присоединились интенсивные головные боли, не купирующиеся анальгетиками. С июня 2013 г. -стойкое повышение температуры тела с максимальными суточными значени-ями до 39оC, появилась боль в правой половине грудной клетки при глубо-ком дыхании, усилился сухой кашель. Госпитализирован в НУЗ ЦКБ №1 ОАО“РЖД” с диагнозом: “Лихорадка неясного генеза”.При поступлении общее состояние средней тяжести. Температура тела –38,5оС. Единичные пустулезные высыпания на кожных покровах спины. Бо-лезненные афты на слизистой полости рта. Дыхание везикулярное, ослаб-ленное в нижних отделах. По остальным органам – без особенностей. Придетальном расспросе был подтвержден рецидивирующий характер афтозногостоматита.Результаты лабораторного обследования: повышение острофазовыхбелков (СОЭ – 49-63 мм/ч; СРБ – 50-230 мг/л), анемия (гемоглобин – 97 г/л),лейкоцитоз (16 тыс/мкл), повышение активности печеночных трансаминаз(АСТ- 54 ед/л, АЛТ- 145,9 ед/л), позитивность по анти-HCV (HCV– RNA -негативная). АНФ, РФ, АТ к инфекционным агентам и паразитам – отрица-тельные. Посев крови на стерильность – рост микрофлоры не выявлен. Ана-лиз спинно-мозговой жидкости – лимфоцитарный плеоцитоз (46/4), белок –0,66. Обращали на себя внимание, приведенные ниже данные инструмен-тального обследования.Эхо-КГ: в правом желудочке визуализированы плотные подвижные эхо-структуры: над медиальной створкой трикуспидального клапана (ТК) разме-ром до 2,5 см (пролабирующая в выходной тракт правого желудочка); надлатеральной створкой 2,1 х 0,9 см; у основания мышц латеральной створки– 2 структуры 1,0 и 0,7 см, вероятно –вегетации. Утолщение стенок левого иправого желудочков. Регургитация на ТК +2+3. Систолическое давление влегочной артерии 35-38 мм рт. ст. Уплотнение и утолщение листков пери-карда, небольшое количество жидкости в перикардиальной области (около100 мл).Рентгенография органов грудной клетки: в нижней доле правого легкого– S9-S10 сегментах – негомогенное понижение пневматизации за счет ин-фильтрации легочной ткани. Бронхо-сосудистый рисунок усилен. Плевраль-ные синусы свободны.МСКТ органов брюшной полости с в/в болюсным контрастированием: КТ –признаки гепатоспленомегалии, умеренные проявления лимфаденопатиибрыжеечных лимфоузлов.МСКТ органов грудной клетки: участки неравномерной ифильтрации па-ренхимы преимущественно субплевральной локализации (S6,10 – справа;S5, 9 – слева) неоднородной структуры с нечетким контуром.МСКТ сердца (с контрастированием): тромбы выносящего тракта правогожелудочка, полости правого желудочка, ушка правого предсердия; дефектыконтрастирования субсегментарных ветвей легочной артерии в базальныхотделах правого легкого, уплотнение легочной паренхимы справа (S10) ислева (S8-9) – инфаркт-пневмония как следствие тромбоэмболии легочнойартерии (ТЭЛА). МРТ головного мозга – патологических изменений очагового или диффуз-ного характера в веществе головного мозга не выявлено; хронический пра-восторонний гайморит.В связи с развитием диареи на фоне болевого синдрома в животе былапроведена ректосигмоидоскопия. Выявлены множественные изъязвленияпрямой кишки, ректосигмоидного отдела и сигмовидной кишки.Офтальмолог: “плавающая” деструкция стекловидного тела. Невролог:нельзя исключить признаки серозного менингита. Тест патергии – сомни-тельный (1 папула из 4 х).Сочетание рецидивирующего афтозного стоматита, пустулезных высыпа-ний на кожных покровах, вовлечение глаз, ЦНС и кишечника позволили за-подозрить ББ. Кроме того, наличие тромбов выносящего тракта правого же-лудочка, полости правого предсердия и инфаркт – пневмония отнесены кпоражению сосудов в рамках васкуло-бехчета.Диагноз ББ был подтвержден в ФГБУ «НИИР им. В.А. Насоновой». Лече-ние метипредом перорально в дозе 16 мг/сут, азатиоприном 100 мг/сут. при-вело к улучшение состояния: нормализовалась температура тела, купирова-лись головные и абдоминальные боли, восстановился стул, регрессировалилабораторные признаки воспаления (СОЭ – 11 мм/ч, СРБ-1,2 мг/л) и цитоли-тического синдрома (АСТ – 13 ед/л, АЛТ – 36,6 ед/л).Обсуждение. Неоднозначность клинической картины (мультиорганностьпоражения), стойкий характер лихорадки, длительное повышение острофа-зовых маркеров воспаления и неэффективность проводимой антибактери-альной терапии явились причиной поиска системного воспалительного забо-левания. Тщательный сбор анамнеза, анализ клинической картины и пра-вильная интерпретация инструментальных методов визуализации во многомопределяют своевременную диагностику и назначение адекватной терапииББ.
Полякова Ю.В., Симакова Е.С., Сивордова Л.Е.,Заводовский Б.В., Чернов А.С.
АДИПОКИНЫ – ПОТЕНЦИАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ ДЛЯ ЛЕЧЕНИЯ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,РФ
В последние годы активно изучается роль жировой ткани, которая функ-ционирует как сложная многокомпонентная регулирующая система, выделя-ющая большое количество биоактивных веществ. В клетках жировой тканисинтезируется множество адипокинов и классических провоспалительныхфакторов: IL-1, IL-6, IL-8, TNF-α и др. Адипокины влияют на ряд важных процессов в организме: на метаболизм липидов и глюкозы, ангиогенез,апоптоз клеток, опухолевый рост, костный обмен, обмен хондроцитов, вли-яют на выработку других активных компонентов гомеостаза суставного хря-ща. Все эти компоненты могут активировать дегенеративные процессы в су-ставе и вызывать в нем воспалительные реакции.Ревматоидный артрит (РА) – хроническое воспалительное заболеваниесоединительной ткани с преимущественным поражением суставов по типуэрозивно-деструктивного прогрессирующего полиартрита, сопровождающее-ся нарушениями гуморального и клеточного иммунитета, которые придаютревматоидному воспалению характер иммуноопосредованного, с безудерж-ной пролиферацией синовиоцитов. Механизмы гиперплазии синовиальнойоболочки сопровождаются появлением паранеопластических характеристику синовиальных макрофагов и фибробластов в виде экспрессии протоонко-генов и особой ее инвазивности. Активация синовиальных фибробластовприводит к высвобождению таких факторов воспаления, как интерферон-β,интерлейкин-6, висфатин, хемокины. Результаты лечения РА в целом неудо-влетворительны. Ряд пациентов (около 30%) не отвечают должным образомна комбинации базисных противовоспалительных препаратов и генно-инженерную терапию биологическими агентами. Внимание ученых сосредо-точено на растущем числе новых цитокинов, которые принимают важноеучастие в воспалительном ответе и могут быть использованы как цели тера-певтического воздействия.Остеоартроз (ОА) – наиболее частое и распространенное заболевание су-ставов, ассоциированное с возрастом, приводящее к развитию функцио-нальной недостаточности и последующей потере трудоспособности у взрос-лых. Современная концепция патогенеза ОА предполагает принципиальнуюроль хронического синовиального воспаления, без которого невозможнопрогрессирование деструкции хряща и которое имеет немалое значение дляразвития боли. За последние десятилетия достигнут значительный прогрессв изучении этиологии и патогенеза заболевания, однако многие аспекты досих пор остаются спорными.Цель: Изучить клинико-патогенетическое значение уровня висфатина всыворотке крови больных остеоартрозом (ОА) и ревматоидным артритом(РА).Материалы и методы: Под нашим наблюдением находилось 80 пациен-тов с ОА, 140 – с РА и 60 практически здоровых лиц, составивших группусравнения. Больные ОА были в возрасте от 36 до 78 лет (55,7±1,2), больныеРА – от 32 до 74 лет (49,4±0,8). Уровень висфатина в сыворотке крови опре-делялся непрямым твердофазным иммуноферментным методом с использо-ванием коммерческой тест системы (RaiBiotech, cat№ EIA-VIS-1).Результаты: Повышенный уровень висфатина в сыворотке крови былобнаружен у 23 пациентов с ОА (29% случаев) и у 118 пациентов с РА(84%). Повышенный уровень висфатина в сыворотке крови при ОА составил4,18±1,79 нг/мл, при РА – 6,27±0,18 нг/мл, что достоверно выше показате-лей здоровых лиц. Для выяснения клинико-патогенетического значенияопределения уровня висфатина все пациенты с ОА были разделены на 2 группы: I группа (23 пациента) с повышенным уровнем висфатина в сыво-ротке крови, и II группа (57 человек) – с нормальной концентрацией висфа-тина. Пациенты I группы достоверно чаще имели следующий симптомоком-плекс болезни: полиостеоартроз с наличием вторичного синовита, с продол-жительностью заболевания более 5 лет, рентгенологической стадией III и IV,функциональной недостаточностью суставной системы II-IV.Все пациенты с РА так же были разделены на 2 группы: I группа (118 па-циентов) с повышенным уровнем висфатина в сыворотке крови, и II группа(22 человека) – с нормальной концентрацией висфатина. Пациенты I груп-пы достоверно чаще имели более высокую степень активности по индексуDAS28, серопозитивность по РФ, более высокий уровень С-реактивного бел-ка (СРБ), СОЭ, внесуставные проявления заболевания.Выводы: Таким образом, повышенный уровень висфатина достоверночаще имели пациенты с ОА, протекающим с выраженными клинико-лабораторными и рентгенологическими изменениями. При РА отмечалсязначительно больший процент больных с повышенным уровнем висфатина(84,3% при РА и 29% при ОА), отмечалась корреляция уровня висфатина состепенью активности РА. Учитывая участие висфатина в стимуляции выра-ботки провоспалительных цитокинов, можно предположить, что висфатинможет являться патогенетическим фактором, способствующим развитию си-новита при ОА и поддерживающим активность патологического процесса приРА.Данные большого количества исследований предполагают возможнуюроль висфатина в регуляции уровней провоспалительных цитокинов, вклю-чая TNF-α , IL-1β и IL-6. Висфатин играет важную роль в патологии воспали-тельных заболеваний, дальнейшее изучение молекулярных механизмов ак-тивации цитокинов может привести к разработке новых терапевтическихсредств для лечения ревматических заболеваний. В эксперименте блокаторывисфатина приводят к быстрому торможению воспалительных процессов,давая надежду на разработку новых эффективных методов лечения ревма-тических болезней.
Русанова О.А., Парамонова О.В., Емельянов Н.И.,Герусова Н.М., Гонтарь И.П.
ИЗУЧЕНИЕ ТИРЕОИДНОГО СТАТУСА У БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ В СОЧЕТАНИИ С ПОРАЖЕНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО В ВолгГМУ Минздрава России, г. Волгоград, Россия
В настоящее время накопленные сведения о содержании уровня тирео-идных гормонов в плазме крови больных системной красной волчанкой (СКВ) весьма противоречивы, а их диагностическое значение при данномзаболевании до настоящего времени достаточно дискутабельно.Цель исследования. В нашем исследовании мы попытались оценить ди-агностическую ценность определения концентрации тиреотропного гормона(ТТГ), тироксина и трийодтиронина (Т4 и Т3) и антител к ним у больных СКВ.Материалы и методы. Нами обследовано 22 пациента с сочетанной па-тологией – СКВ и тиреоидные заболевания. Все пациенты были женщины, ввозрасте от 21 до 77 лет (средний возраст составил 55,16±15,3 лет). Про-должительность СКВ – 5,08±3,29 лет. Средняя продолжительность мани-фестного заболевания щитовидной железы (ЩЖ) составила 3,011,74 года,что в большинстве случаев, свидетельствует о развитии/обострении тирео-идной патологии на фоне уже имеющейся СКВ.Результаты и Обсуждение. Среднее содержание свободного тирокси-на и тиреотропного гормона в целом по группе больных СКВ имело тенден-цию к повышению. Содержание тиреоидных гормонов и ТТГ у больных безпоражения щитовидной железы, было сопоставимо по уровню со среднимзначением параметров у больных СКВ в целом. У больных с аутоиммуннымтиреоидитом уровни Т3 и ТТГ были выше контроля, хотя и недостоверно, длясв. Т4 – сопоставим с контролем. При наличии узлового, диффузного и сме-шанного зоба отмечалось значимое повышение св. Т3; св. Т4 также был по-вышен (достоверно – у больных диффузным и смешанным зобом), уровеньТТГ имел тенденцию к снижению, отражая тенденцию к гиперфункции ЩЖ. Упациентов с гипотиреозом отмечалось закономерное колебание тиреоидныхгормонов, Т4 и Т3 несколько снижались, ожидаемо достоверно был повышенТТГ.Количество ТТГ и св. Т4 у больных с высокой степенью активности забо-левания на момент поступления были несколько выше, чем в контрольнойгруппе и у больных с I и II степенью активности патологического процесса,но эта разница не была статистически достоверной (р>0,05). Найденныенами изменения уровня тиреоидных гормонов у больных СКВ соответствуютимеющимся представлениям об их содержании в плазме крови при даннойпатологии, описанных в последних работах 1998-2011 гг.Значения антитиреоидных антител (к тиреоглобулину и тиреопероксида-зе) в целом по группе СКВ были выше контроля (АТ к ТГ – 57,5±147,9 Ед/мл,АТ к ТПО- 97,0±239,1 мЕд/мл), однако недостоверно, очевидно, вследствиезначительных колебаний значений. Ожидаемый достоверный рост при срав-нении с контролем АТ к ТГ и АТ к ТПО был в группе больных с поражениемЩЖ. Тем не менее, у пациентов с СКВ, не имевших изменений ЩЖ, такжеимелось увеличение АТ к ТГ и АТ к ТПО, хотя достоверности разница с кон-тролем не достигла. Антитела к ТГ были повышены у 10 (23,2%), к ТПО чаще– у 17 (39,5%). Одновременный рост обоих групп антител был у 7 (16,2%)из 43 больных СКВ без какой-либо патологии ЩЖ.Пациенты с повышенным уровнем антитиреоидных антител имели досто-верно более низкую (p=0,024) давность СКВ; чаще имелось острое (p=0,04)и подострое (р=0,063), достоверно реже – хроническое течение СКВ(р=0,038). Анализ содержания антитиреоидных антител у больных СКВ в зависимости от клинических характеристик болезни показал, что с увеличе-нием степени активности наблюдается отчетливое увеличение и содержанияантител, как к ТГ, так и к ТПО. Особенно значительное и достоверное(р=0,01) увеличение АТ к ТПО наблюдалось при III-ей степени активности.Описанные клинико-лабораторные и иммунологические особенности СКВбез поражения ЩЖ, но с наличием повышенного титра антитиреоидных ан-тител, корреляция уровня АТ к ТПО с ТТГ (r=0,34; p=0,01), очевидно, позво-ляют предполагать возможность дальнейшего возникновения аутоиммунногопоражения ЩЖ.Выводы. По полученным данным имела место зависимость между выра-женностью функции щитовидной железы, с одной стороны и активностьюпроцесса, длительностью ревматического заболевания, частотой егообострения, с другой. Отчетливо выраженные изменения нам удалось вы-явить у больных СКВ при анализе одного из показателей тиреоидной функ-ции — уровня трийодтиронина в сыворотке крови, снижение которого былообнаружено у 68,4% больных. Уровень Т3 статистически достоверно былснижен у больных СКВ с высокой активностью процесса. Наибольшее сниже-ние уровня Т3 в сыворотке крови также отмечалось при длительном течениизаболевания и частых обострениях его. Что касается уровня тироксина, тоего количество повышалось пропорционально снижению трийодтиронина изависело также от активности процесса и длительности патологическогопроцесса.
Савелова Е.Е., Майко О.Ю.
ЗАВИСИМОСТЬ ЭФФЕКТИВНОСТИ ТЕРАПИИ БОЛЬНЫХ ОСТЕОАРТРОЗОМ ОТ РЕНТГЕНОЛОГИЧЕСКОЙ СТАДИИ ПРОЦЕССА
ГБОУ ВПО Оренбургская государственная медицинская академия, г.Оренбург
Цель: оценить клиническую эффективность терапии больных остеоарт-розом (ОА) с применением хондроитин сульфата (ХС) и его комбинации сглюкозамин гидрохлоридом (ГГ) в зависимости от рентгенологической стадиизаболевания.Материалы и методы: Под наблюдением в амбулаторных условияхнаходилось 120 пациентов ОА, преимущественно женщин (91%), с пораже-нием коленных (n=80) и тазобедренных суставов (n=40), выраженностьюболевого синдрома по визуально-аналоговой шкале (ВАШ) ≥ 40 мм и необ-ходимостью приема нестероидных противовоспалительных препаратов(НПВП). Средний возраст пациентов составил 58 (54; 60) лет. Средняя дли-тельность ОА – 7 (5; 12) лет. Диагностирована II рентгенологическая стадияОА по Kellgren-Lawrence у 64 (54%) пациентов, I cтадия – у 34 (28%) и II – у22 (18%). По данным ультразвукового исследования суставов преобладалосочетание признаков синовита и тендинита в 65% случаев. В зависимости отпроводимой терапии было сформировано 2 группы (по n=35): пациенты 1 гр. получали ХС (структум) по 1000 мг/сут. в течение 3-х месяцев, больные 2гр. – ХС в комбинации с ГГ (артра) по 1000 мг х 2 р/сут. в течение 3-хнедель, затем 1 р/сут. до 3-х месяцев по 2 курса терапии в течение 12 меся-цев. Дополнительно назначался НПВП (найз) 200 мг/сут. в течение 2-хнедель. Динамическое наблюдение осуществлялось каждые 3 месяца в тече-ние 12 месяцев с оценкой критериев эффективности: изменение интенсив-ности боли при ходьбе и в покое по ВАШ, динамика функционального индек-са Лекена и параметров качества жизни (КЖ) по анкете EuroQol-5D, суточ-ной потребности в НПВП.Результаты и обсуждение: При проведении корреляционного анализас Целью выявления взаимосвязей рентгенологической стадии ОА со значе-ниями альго-функциональных индексов и параметрами КЖ у больных ГА иКА обеих групп было обнаружено, что прогрессирование стадии заболева-ния соответственно сопровождается ухудшением клинических показателей ипараметров КЖ как исходно, так и на фоне лечения (r=0,40-0,54; р<0,005). Втечение 12 месяцев наблюдения у больных обеих групп, получавших курсо-вое лечение с использованием структума или артры отмечалась волнообраз-ная динамика изменения клинических показателей и параметров КЖ с до-стижением достоверно выраженного клинического эффекта по окончании 1-го и 2-го курсов трехмесячной терапии и постепенным их ухудшением черезнекоторое время. Причем, наиболее статистически значимая положительнаядинамика выявлена на фоне терапии обоими препаратами у пациентов с I иII ст. ОА, чем III ст. (р<0,05).При I ст. клиническая эффективность структума и артры была сопостави-ма. Так, интенсивность боли по ВАШ сократилась на 60% в 1 гр. и 65% во 2гр., показатели функциональной недостаточности суставов по индексу Леке-на на 62% и 70%, параметры КЖ улучшились на 40% и 45% соответственнопо группам (р<0,05), отказались от приема НПВП 75% и 82% больных соот-ветственно по группам (р<0,05). Причем, через 12 месяцев от началанаблюдения сохранялся более выраженный эффект последействия, по боль-шинству показателей, от курсовой терапии артрой, чем структумом.У пациентов со II ст. ОА также выявлена сопоставимая эффективностьтерапии обоими препаратами. Так, болевой синдром по ВАШ уменьшился55% в 1 гр. и 50% во 2 гр., значения функционального индекса Лекена на52% и 48 %, улучшились параметры КЖ по анкете EQ-5D на 42% и 48% со-ответственно по группам (р<0,05), удалось отказаться от приема НПВП 60%и 65% больных соответственно по группам (р<0,05). Эффект последействиябыл сопоставимый по окончании 2-х курсов терапии структумом и артрой,причем, менее выраженным, по сравнению с I ст. ОА.При III ст. ОА определен достоверно менее выраженный положительныйэффект курсовой терапии с использованием структума и артры, по сравне-нию с I и II ст. ОА. Так, показатели боли по ВАШ сократились на 30% в 1 гр.и 27% во 2 гр., параметры КЖ на 34% и 30%, уменьшились функциональ-ные ограничения по индексу Лекена на 32% и 28% соответственно по груп-пам (р<0,05). Достоверно большее количество больных нуждалось в посто-янном и периодическом приеме НПВП, чем при I и II ст.. Так, полностью уда-лось отказаться от приема этих препаратов только около 1/3 больных в обеих группах, что было достоверно хуже по сравнению с I и II ст. Через 12месяцев от начала наблюдения клинические показатели у больных обеихгрупп ухудшались и по некоторым показателям приближались к исходнымзначениям, т.е. эффект последействия при III ст. был непродолжительный ислабо выраженный. Через 12 месяцев от начала лечения суточные дозыпринимаемых НПВП увеличились у больных обеих групп, причем, сохраня-лась зависимость потребляемой дозы от стадии ОА.Выводы: Таким образом, применение 12-месячной курсовой терапии сиспользованием препаратов, содержащих хондроитин сульфат (структум) иего комбинацию с глюкозамин гидрохлоридом (артра) у больных остеоартро-зом I-II cтадии в амбулаторных условиях показало сопоставимую эффектив-ность по влиянию на клинические показатели и параметры КЖ с сохранени-ем более выраженного эффекта последействия терапии с применением арт-ры. При III стадии ОА эффект был кратковременным и слабовыраженным поосновным клиническим показателям и параметрам качества жизни и не зави-сел от принимаемого препарата.
Сатыбалдыев АМ, Акимова ТФ
ДЛИТЕЛЬНОЕ НАБЛЮДЕНИЕ БОЛЬНЫХРЕВМАТИЧЕСКОЙ ПОЛИМИАЛГИЕЙ В КЛИНИЧЕСКОЙПРАКТИКЕ. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
ФГБУ «НИИР им. В.А.НАСОНОВОЙ» РАМН, г. Москва, Россия.
Цель: изучение течения ревматической полимиалгии в клиническойпрактике при многолетнем наблюдении.Материал и методы. Из наблюдаемых нами 111 больных ревматическойполимиалгией (РП) была выделена группа из 35 больных с длительностьюзаболевания от 2 лет и более и сроками наблюдения от 2 лет до 10 лет(мужчин – 9, женщин – 26, средний возраст – 61,5, длительность заболева-ния до взятие под наблюдение составляла 3,9 месяца, средний срок наблю-дения 3,7 года). Диагноз ревматической полимиалгии устанавливался наосновании диагностических критериев, предложенных Европейской группойпо изучению РП (Bird H.A. et al. 2005).Наряду с ревматической полимиалгией у больных выявлены следующиесопутствующие заболевания. Выраженный атеросклероз с поражением серд-ца и сосудов и ИБС наблюдался у 10 больных (у 2 из них проводилось стен-тирование коронарных артерий и у 2 – шунтирование в анамнезе, у 2 – ин-фаркт миокарда, 3 пациента перенесли ишемический инсульт); сахарныйдиабет 2 типа – у 3 больных, выраженный остеопороз – у 10 больных (скомпрессией позвонков –у 2, перелом шейки бедра – у 1), бронхиальнойастмой страдала 1 пациентка, разрыв мышцы – у 2. Глаукома, язвенная бо-лезнь желудка – по 1, туберкулез легких в анамнезе – у 2. Злокачественныеопухоли выявлены у 3 больных (у 2-х рак предстательной железы, у 1-й – рак мочевого пузыря). Таким образом, наблюдаемая группа больных явля-ется рафинированной и наблюдается в связи с наличием заболеваний, за-трудняющих лечение.Лечение. Все больные получали глюкокортикоиды (ГК), начальная дозасоответствовала 7,5-20 мг/сут преднизолона (ср.доза 12,5 мг/сут). Доназначения ГК пациенты, как правило, принимали НПВП без достаточногоэффекта. В процессе дальнейшего ведения больных необходимость в приемеНПВП отпадала.При выборе начальной дозы ГК учитывалась сопутствующая патология:гипертоническая болезнь, ИБС, сахарный диабет, остеопороз, язвенная бо-лезнь желудка и другие. Помимо ГК назначались препараты ацетилсалици-ловой кислоты в низких дозах для профилактики тромботических осложне-ний, при выявлении сниженных показателей минеральной плотности костейдо уровня остеопороза или при длительном приеме ГК назначались антире-зорбтивные средства. По показаниям назначались статины, ингибиторы про-тонной помпы или другая сопутствующая терапия.Результаты лечения. Лечение завершилось успешно у 9 из 35 (26,5%)пациентов, при наблюдении до 3 лет – у 2 из 13 больных (15%),от 3 до 5лет – у 8 из 17 больных (47%). Более 5 лет наблюдались 5 больных, у кото-рых отмечено хроническое течение заболевания.Снижение суточной дозы ГК начиналось после достижения стойкого редуци-рования симптомов РП и нормализации СОЭ и СРБ (обычно через 3-4 неделиот начала терапии). Рецидивы, включая повторные, происходили у 10 (29%) пациентов в течение всего последующего периода наблюдения ( от1,5 мес до 30 месяцев от начала терапии ГК, в среднем через 5,2 мес), в ос-новном при снижении дозы метипреда. Кроме того 8 пациентов самостоя-тельно отменяли ГК в сроки от 1,5 до 5 месяцев, что приводило к рецидивам.Снижение дозы препарата производилось не чаще, чем 1 мг/сут 1 раз в 1,5 –2 месяца при отсутствии клинических симптомов РП и наличии нормальныхпоказателей СОЭ и СРБ. Средняя суточная доза ГК у больных, продолжаю-щих лечение, составила в конце наблюдения 3,5 мг (в эквиваленте к пред-низолону).Обсуждение. Настоящая когорта больных РП сформировалась в резуль-тате отбора больными лечащих врачей в связи со сложностью их ведения инеобходимостью длительного наблюдения. Большинство больных страдалиполиморбидностью, которая требовала более тщательного контроля их со-стояния, назначения индивидуально подобранного лечения и контроля запроводимой терапией. Проведенное исследование показало, что подход квыбору терапии этих больных в реальной практике клиницистов долженбыть индивидуализированным.Выводы.Больные с диагнозом ревматическая полимиалгия нуждаются в назначе-нии и длительном применении ГК, а также длительном наблюдении и кон-троле ревматолога. Начальная доза ГК 10-15 мг в сутки (в перерасчете напреднизолон). Преждевременное снижение дозы ГК часто приводит к обострению РП(рецидиву симптомов)Тяжелая сопутствующая патология пожилого и старого возраста требуеттщательного контроля и наблюдения за результатами терапии ГК. В связи свероятностью прогрессирования атеросклероза и его осложнений (инсульт,инфаркт миокарда и др), а также артериальной гипертонии, нарушения уг-леводного, липидного обменов, усиления тромбообразования и остеопорозанеобходимо проведение превентивной терапии этих состояний, а при их раз-витии –лечения.
Сизова Л.В.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЖИЗНИ ПАЦИЕНТОВ НА РАЗНЫХ СТАДИЯХ РЕВМАТОИДНОГО АРТРИТА ПО АНКЕТЕ QOL-RA SCALE
ГБОУ ВПО «Оренбургская государственная медицинская академия» Мин-здрава России, Оренбург, Российская Федерация
Цель работы – сопоставить показатели качества жизни (КЖ) на разныхстадиях ревматоидного артрита (РА) в сравнительном аспекте по анкетеQOL-RA Scale.Материал и методы. Для анализа использованы данные 114 больных с«ранним РА» в возрасте [Ме (Q25-Q75)] 50,5 (47-54,75) лет, а также данные50 пациентов (группа сравнения) с устоявшимся (развернутой и позднейстадиями) РА в возрасте 53 (48-57) лет; 90% участников исследования –женщины. Медиана длительности раннего РА составила 4,4 (2-7,25) месяца,устоявшегося РА – 5 (3-12) лет. Диагноз РА верифицировали по классифика-ционным критериям ACR (1987). Всем пациентам проводили общепринятое вревматологии обследование. В обеих группах преобладала III степень ак-тивности заболевания по индексу Disease Activity Score 28 (DAS28) и нару-шения жизнедеятельности II и III функциональных классов (p<0,05). Вгруппе раннего РА в суставах превалировали рентгенологические измененияI стадии, в группе сравнения – II стадии (p<0,05). Для сравнительной оцен-ки показателей КЖ применяли валидную русскоязычную версию опросникаQuality of Life-Rheumatoid Arthritis Scale (QOL-RA Scale) – Шкала КачествоЖизни-Ревматоидный Артрит. Путем прямого опроса были получены ответыпациентов на 8 вопросов (пунктов): о влиянии физической способности, по-мощи от семьи и друзей, суставной боли, эмоционального напряжения, здо-ровья, артрита, взаимоотношений с семьей и друзьями, настроения в связи сРА на качество их жизни. Каждый пункт больной оценивал от 0 до 10 бал-лов, где 0 баллов соответствовали «очень плохому», а 10 баллов – «превос-ходному» КЖ. Среднее арифметическое суммы оценок КЖ по 8 пунктампредставлялось в качестве «суммарной шкалы» QOL-RA Scale. Статистиче-скую обработку данных проводили в программе «Statistica 6.0» (StatSoft, Inc., США, 2001) с применением методов вариационной статистики, U-критерия Манна-Уитни, корреляционного анализа.Результаты. Лучшие оценки КЖ (медианы – 6-8 баллов) в группах ран-него и устоявшегося РА были даны «взаимоотношениям с семьей и друзья-ми» и «помощи от семьи и друзей». Худшие показатели (медианы – 3-4 бал-ла) имели пункты «артрит» и «суставная боль», а в группе сравнения допол-нительно еще и пункт «здоровье» (p<0,05). Статистически значимые разли-чия между группами по оценкам QOL-RA Scale отсутствовали.Изучение корреляционных связей для «суммарной шкалы» опросникаQOL-RA Scale у пациентов с ранним РА показало наличие обратной связимежду показателями этой шкалы и возрастом, прямой связи оценок шкалы суровнем образования. Определялись слабые и умеренные обратные корре-ляционные связи показателей «суммарной шкалы» опросника с длительно-стью скованности, числом болезненных и припухших суставов индексомРичи, оценками состояния здоровья по визуальной аналоговой шкале паци-ентом и врачом (R от -0,23 до -0,40; p<0,05). Статистически значимая кор-реляционная связь между «суммарной шкалой» QOL-RA Scale и инструмен-тальными характеристиками (число эрозий в пястно-фаланговых суставах поданным ультразвукового исследования суставов, рентгенологическая стадияРА) отсутствовала. Корреляционные связи между показателями КЖ и такимилабораторными параметрами, как: уровень гемоглобина, лейкоцитов в пе-риферической крови, скорость оседания эритроцитов, С-реактивного белка убольных ранним РА также не были статистически значимыми. Серопозитив-ность артрита не оказывала статистически значимого влияния на оценки КЖ.Анализ корреляционных связей между пунктами QOL-RA Scale и клиниче-скими показателями в группе сравнения выявил статистически значимыеотрицательные корреляционные связи между длительностью скованности иоценками влияния артрита и суставной боли (R=-0,36 и R=-0,43 соответ-ственно; p<0,01), активности заболевания по DAS28 и влиянием артрита наКЖ (R=-29, p<0,05). Пациенты с высоким функциональным классом наруше-ний жизнедеятельности имели более низкие оценки по пунктам «суставнаяболь», «артрит», «эмоциональное напряжение» и «суммарной шкале» QOLRAScale (R составил от -0,34 до -0,40, p<0,05).Обсуждение. Социальные и психологические аспекты КЖ пациентов сразными стадиями РА – взаимоотношения с семьей и друзьями и помощь отсемьи и друзей страдали в меньшей степени, чем показатели физическогосостояния (пункты «суставная боль», «артрит» в обеих группах, «здоровье»– в группе устоявшегося РА). На ранних стадиях РА молодые и более образо-ванные люди выше оценивали КЖ. Наличие большого числа корреляцион-ных связей с клиническими параметрами у больных с разными стадиями РАподтверждает валидность анкеты QOL-RA Scale. Однако отсутствие корреля-ционных связей между показателями КЖ и лабораторными и рентгенологи-ческими данными указывает на сохраняющуюся необходимость учета по-следних не зависимо от оценки КЖ.Выводы. Таким образом, в целом между показателями QOL-RA Scale вгруппах раннего и устоявшегося РА статистически значимые отличия отсут- ствуют. Наиболее значительное ухудшение оценок «суставной боли» и «арт-рита», а также наличие корреляционных связей между показателями КЖ иосновными клиническими параметрами свидетельствует о том, что этотопросник является специфическим для исследования КЖ пациентов с РА наразных стадиях болезни.
Симакова Е.С., Ковех А.А., Королик О.Д., Фофанова Н.А.,Заводовский Б.В.
ЭФФЕКТИВНОСТЬ АЛФЛУТОПА И ГЛЮКОЗАМИНСУЛЬФАТА ПРИ ГОНАРТРОЗЕ В ЗАВИСИМОСТИ ОТ УРОВНЯ АНТИТЕЛ К ХОНДРОИТИН СУЛЬФАТУСУСТАВНОГО ХРЯЩА
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Для лечения остеоартроза в качестве базисной терапии применяютсяструктурно-модифицирующие препараты, однако не всегда лечение оказы-вается эффективным. Возможно искусственное повышение концентрациикомпонентов хряща, входящих в состав этих препаратов, может провоциро-вать развитие иммунологических реакций.Целью исследования являлось повышение качества лечения остеоартрозаи контроля эффективности проводимой терапии путем разработки индивиду-альных показаний к назначению алфлутопа и глюкозамин сульфата в зави-симости от выраженности антителообразования к хондроитин сульфатухряща в сыворотке крови. Эффективность лечения больных оценивалась спомощью клинико-лабораторных и иммунобиохимических показателей. Диа-гноз устанавливали по критериям, разработанным в Институте ревматологииРАМН и клинической классификацией. Обработка результатов проводилась спомощью программного пакета “Statistica for Windows 6.0”.Под нашим наблюдением находилось 120 больных гонартрозом в воз-расте от 21 до 65 лет, из которых 71 женщина (59,17%) и 49 мужчин(40,83%). Средний возраст женщин с ОА составил 47,284,49 лет, мужчин -49,184,73 лет и был сопоставим с группой здоровых лиц (t=0,54, p>0,05;t=0,29, p>0,05 соответственно). Средняя длительность заболевания соста-вила 9,41,76 лет: менее 1 года была у 9 пациентов (7,5%), 1-5 лет у 43больных (35,83%), 6-10 лет – у 38 (31,67%), 11-15 лет – у 21 (17,5%), аболее 15 лет – у 9 человек (7,5%). У 51 больного (42,5%) были клиническиепроявления синовита, у 69 пациентов (57,5%) заболевание протекало безсиновита. При длительности заболевания до 5 лет явления синовита встре-чались чаще (31 больной из 51 (60,78%)), а свыше 5 лет – заболевание ча-ще протекало без синовита (48 больных из 69 (69,57%)). I стадия по критериям Kellgren-Lawrence наблюдалась у 36 (30%) больных, II – у 56 (46,67%),III – у 28 (23,33%) больных.Все больные получали нестероидные противовоспалительные препараты,средства, улучшающие микроциркуляцию, физиотерапевтическое лечение, 9больным с синовитом (17,65%) вводили глюкокортикостероиды параартику-лярно или внутрисуставно. 30 пациентов (I группа) получали – глюкозаминасульфат (стопартроз – производства фирмы Славия Фарм С.Р.Л., Румыния)1200 мг/сут per os в течение 3-х месяцев, 40 больных (II группа) – алфлутоп(производства фирмы Biotehnos, Румыния) 1 мл внутримышечно или пара-вертебрально N20. Группу сравнения составили 50 пациентов, не получав-ших хондропротекторов. Группы достоверно не отличались по полу и возрас-ту.В результате проведенного лечения у большинства больных ОА, полу-чавших хондропротекторы, достигнут положительный результат. Улучшениенаступило у 66,7% пациентов, получавших стопартроз и у 70,0% – алфлу-топ. Эффективность алфлутопа была хорошей при уровне анти-ХС менее0,53 ед.опт.плот. в сыворотке, разведенной 1:80 или при титре антител бо-лее чем 1:320. Важно отметить, что повышенные уровни анти-ХС имели все4 пациента с ухудшением на фоне приема алфлутопа. Эффективность сто-партроза не зависела от уровня анти-ХС.Лечение стопартрозом оказалось неэффективным у 16,7% больных ОА,алфлутопом – у 20,0%. В 16,7% и 10% случаев соответственно наступилоухудшение состояния, которое выражалось в усилении болевого синдрома,уменьшении подвижности суставов из-за болей или в развитии вторичногосиновита. При дальнейшем анализе установлено, что во всех этих случаяхнаблюдался высокий исходный уровень антител к хондроитин сульфату.Таким образом, аутоиммунные реакции к гликозаминогликанам суставно-го хряща выявлены нами у большей части наблюдавшихся пациентов. Анти-ХС были обнаружены как у больных, получавших ранее препараты хондрои-тин сульфата, так и не получавшие их. В связи с этим нельзя считать, чтоединственной причиной выработки анти-ХС является применение инъекци-онных хондропротекторов, например алфлутопа. Высокий уровень анти-ХСассоциировался с определенным симптомокомплексом. Антитела встречалиськак правило у больных с более тяжелым течением ОА, чаще с синовитом. Нафоне проводимой терапии происходило снижение уровня анти-ХС. Известно,что при выраженном синовите у части больных инъекционные хондропротек-торы могут быть неэффективными или вызывать обострение патологическогопроцесса. Можно предположить, что с помощью определения анти-ХС можновыделить группу пациентов, кому назначение алфлутопа временно противо-показано. Вероятно, после снижения концентрации анти-ХС до нормальногоили субнормального уровня путем использования противовоспалительныхпрепаратов, вопрос о назначении алфлутопа конкретному больному можетбыть рассмотрен повторно. Чрезвычайно важным нам представляется тотфакт, что препараты глюкозамина сульфата оказывают положительный эф-фект как при серонегативном, так и при серопозитивном по анти-ХС вариан-те течения ОА. Следовательно, их можно назначать более широкому кругупациентов. При назначении алфлутопа пациентам с ОА определение анти-ХС позволит повысить эффективность применения этого препарата с 70% до81% в основном за счет тех пациентов, у которых препарат может датьухудшение состояния.
Симакова Е.С., Сивордова Л.Е., Коренская Е.Г.,Фофанова Н.А., Заводовский Б.В.
ЗНАЧЕНИЕ АНТИТЕЛООБРАЗОВАНИЯ К ХОНДРОИТИНСУЛЬФАТУ ХРЯЩА У БОЛЬНЫХ ГОНАРТРОЗОМ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Российская Федерация
В настоящее время остеоартроз является самым распространенным забо-леванием суставов, часто являющимся причиной временной, а нередко истойкой утраты трудоспособности (Фоломеева О.М., 2000), что определяетего большое социально-экономическое значение. При развитии остеоартро-за определяющую роль играют нарушения обменных процессов, происходя-щих в соединительнотканных структурах, многие из которых требуют де-тального исследования.Материалы и методы: Под нашим наблюдением находились 120 боль-ных гонартрозом, пациентов ГУЗ «Гоpодская клиническая больница скоpоймедицинской помощи №25» и/или ГУЗ «Клиническая поликлиника N 28Дзержинского района» г. Волгограда и 40 здоровых лиц. Все пациенты об-следовались пpи обращении в поликлинику или поступлении в стационаp, атакже по окончанию курса лечения.Антитела к хондроитин сульфату определялись непрямым твердофазнымиммуноферментным методом на полистироловых планшетах (ELISA-тест). Вкачестве антигена использовался коммерческий препарат хондроитин суль-фат А из хряща трахеи быков (Cat. № С-8529, Sigma (США). Учет результа-тов проводился на спектрофотометре с вертикальным лучом (Multiskan EX,Германия). Обработка полученных результатов проводилась с исполь-зованием программного пакета “STATISTICA FOR WINDOWS 6.0”.У здоровых лиц средний геометрический титр антител к хондроитинсульфату хряща был равен 39,141,19. При этом средняя оптическая плот-ность при разведении сыворотки 1:80 составила 0,070,02. При анализе по-лученных результатов не выявлено достоверных зависимостей между уров-нем анти-ХС, возрастом и полом (p > 0,1). Уровень нормальных показателейантител к хондроитин сульфату, определяемый как М 2, составил по сред-нему геометрическому титру от 24,09 до 54,19, или по оптической плотностидо 0,32 ед. С учетом среднеквадратичного отклонения этого ряда был сделанвывод о том, что повышенным содержанием антител к хондроитин сульфатуследует считать титр сыворотки выше, чем 1:64 или среднюю оптическуюплотность выше, чем 0,32 при разведении сыворотки 1:80, или средний гео-метрический титр выше 54,19. Такие величины выявлены у 3 здоровых лиц (7,5%) случаев, что составило частоту положительных результатов для дан-ного ряда.Среди больных ОА повышенные титры антител к хондроитин сульфатуобнаружили у 99 пациентов, что составило 82,5% случаев, и было достовер-но выше, чем у здоровых лиц (р<0,01). При этом средний геометрическийтитр этих антител составил 187,672,16, а средняя оптическая плотность приразведении сыворотки 1:80 – 0,36 0,13. Эти показатели оказались досто-верно выше, чем у здоровых лиц (p<0,01). Достоверных различий в уровнеанти-ХС больных остеоартрозом в зависимости от пола и возраста не выяв-лено.Для больных остеоартрозом в целом характерна достоверно более высо-кая частота обнаружения и количественные показатели уровня антител кхондроитин сульфату суставного хряща. Наиболее высокий исходный уро-вень антител к хондроитин сульфату и частота положительных результатовобнаружены у больных ОА в молодом возрасте (от 21 до 40 лет). Среднийгеометрический титр антител к хондроитин сульфату в группах больных ОА ввозрасте 21-40 лет достоверно превышал таковой в группе 51-60 лет. Стати-стически достоверной разницы между средней оптической плотностью приразведении сыворотки 1:80 не выявлено ни в одном случае. Зависимости отпола достоверных различий не обнаружено. У мужчин антитела выявлялисьнесколько реже, чем у женщин (81,63% и 83,10% соответственно). Среднийгеометрический титр у мужчин составял 184,14 2,58, а у женщин – 187,61 2,61. Средняя оптическая при разведении сыворотки 1:80 составляла 0,34 0,15 у мужчин и 0,35 0,16 у женщин.Наиболее высокие исходные уровни антител к хондроитин сульфатунаблюдались при длительности заболевания – от 10 до 15 лет (р<0,05). Ча-ще всего антитела к хондроитин сульфату обнаруживались у больных со IIстадией ОА (96,43%) и III стадией заболевания (92,86%). При I стадии ОАсредний титр антител был достоверно ниже, чем при II и III стадии(р<0,05), но выше, чем у здоровых лиц (р<0,01). При явлениях вторичногосиновита антитела к хондроитин сульфату выявлялись у всех 100% больных,что достоверно чаще, чем у больных без синовита (р<0,01). Средний гео-метрический титр (233,472,37 и 139,53 2,75, соответственно) и средняяоптическая плотность (0,55 0,07 и 0,29 0,08, соответственно), развиваю-щаяся в ИФА при разведении сыворотки 1:80 были намного выше у больныхОА с выраженными признаками вторичного синовита, чем у больных ОА безсиновита.Таким образом, антитела к хондроитин сульфату достоверно чаще выяв-лялись у больных гонартрозом с большой длительностью заболевания, II-IIIрентгенологической стадии, с вторичным синовитом в более высоких сред-них геометрических титрах и оптической плотности.
Симонова О.В., Леушина Е.А., Немцов Б.Ф., Сухих Е.Н.,Тимин М.В.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ СИМПТОМАТИЧЕСКИХ ПРЕПАРАТОВ МЕДЛЕННОГО ДЕЙСТВИЯ У ПАЦИЕНТОВ КОКСАРТРОЗОМ
ГБОУ ВПО «Кировская ГМА» Минздрава России, г. Киров, Россия
Цель: Провести сравнительный анализ клинической эффективности диа-цереина, хондроитин сульфата и глюкозамин сульфата у больных коксартро-зом в открытом контролируемом 18-месячном исследовании.Материалы и методы: Исследование проведено у 88 больных достовер-ным диагнозом коксартроз. Критериями включения являлись: достоверныйдиагноз остеоартроза тазобедренных суставов, интенсивность боли в суста-вах 40 мм и более по визуальной аналоговой шкале (ВАШ), необходимостьприема нестероидных противовоспалительных препаратов (НПВП), отсут-ствие клинически значимых нарушений функции печени и почек, подписан-ное информированное согласие. Методом случайной выборки пациенты былиразделены на 4 группы. 20 больных (I группа) получали диацереин 100мг/сутки (3 курса по 3 месяца), 26 больных (II группа) – глюкозамин суль-фат 1500 мг/сутки (3 курса по 3 месяца), 27 больных (III группа) – хондрои-тин сульфат 1000 мг/сутки (2 курса по 6 месяцев), 15 (IV) – ацеклофенак100-200 мг/сутки. Группы были сопоставимы по основным клиническим идемографическим показателям (р>0,05). Во всех группах преобладали жен-щины. Средний возраст пациентов I группы составил 56,3±5,3 лет, II группы– 55,7±10,7 лет, III группы – 59,8±5,9 лет, IV группы- 56,7±9,8 лет. Дли-тельность заболевания менее 5 лет наблюдалась у 10%, 15%, 12% и 4%больных соответственно. Стаж заболевания от 6 до 10 лет у 8%, 5%, 9%, и9% пациентов соответственно. I рентгенологическая стадия была выявлена у35% пациентов I группы, у 38% больных II, у 29,6% – III и у 33% пациентовIVгруппы. II стадия заболевания наблюдалась у 65%, 62%, 70% и 66,6%пациентов соответственно. Признаки двустороннего коксартроза отмечены у15%, 38%, 46,1% и 53% пациентов соответственно. Синовит зарегистировану 35%, 11,5%, 7,6%, 7,6% пациентов соответственно. Для оценки эффек-тивности терапии проводили исследование выраженности боли в тазобед-ренных суставах по ВАШ, оценивали индексы функциональной активностипо опросникам Lequesne для коксартроза и WOMAC, качество жизни с ис-пользованием опросника SF-36, потребность в НПВП, динамику синовита поУЗИ тазобедренных суставов.Полученные результаты: При оценке боли по ВАШ в покое и при ходь-бе, значений индекса Lequesne, всех шкал индекса WOMAC (боли, скован-ности, функции, глобальной) в I и II группах наблюдался более ранний на 3месяце терапии (р<0,001) и стойкий клинический эффект на всех этапахнаблюдения (р<0,01), по сравнению с III и IV группой. В I, II и III группахдостоверно уменьшилось число пациентов, нуждающихся в обезболивании. ВI группе доза ацеклофенака уменьшилась к 18 месяцу на 51,9%, во II группе на 76,4%, в III группе на 65%. Проводимая терапия позволила отменитьНПВП у 25 % больных в I группе, у 31% пациентов во II группе, у 10%больных III группы. Явления синовита по данным УЗИ уменьшились у 71%больных I группы и у 67% пациентов II группы. Полностью купировать си-новит удалось у 28,6% пациентов I группы и у 33% больных во II группе.Побочные действия были выявлены у 25% больных I группы (диарея у 15%,диспепсия у 10%), у 15% пациентов II группы (диспепсия), у 14% больныхIII группы (у 3,7% – боли в эпигастрии, у 11% – диспепсия) и у 35% пациен-тов IV группы (у 20% – боли в эпигастрии, у 13,3% – диарея, у 13,3% – дис-пепсия). При всех случаях наблюдения побочных действий препараты отме-нялись. Отказ от дальнейшего лечения чаще наблюдали в группе больных(11%), получавших хондроитин сульфат, что можно объяснить длительно-стью курса терапии и более поздним появлением клинического эффекта (на5-6 месяце). Сравнительная оценка влияния симптоматических препаратовмедленного действия на показатели качества жизни выявила преимуществоглюкозамин сульфата, по сравнению с диацереином и хондроитин сульфа-том. К окончанию периода наблюдения на фоне приема глюкозамин сульфа-та отмечено статистически значимое улучшение (p<0,05) по шкалам физиче-ского здоровья: физическое функционирование, ролевое физическое функ-ционирование, боль, общее здоровье. В группе диацереина и хондроитинсульфата наблюдалась тенденция к улучшению показателей физическогоздоровья, но она не была статистически значимой. В группе пациентов, по-лучавших только ацеклофенак показатели качества жизни к 18 месяцу те-рапии не отличались от исходных. Улучшение по шкалам психологическогоздоровья не отмечено не в одной из групп.Обсуждение: Результаты исследования показали, что применение симп-томатических препаратов медленного действия у пациентов коксартрозомуменьшает боль, скованность, улучшает функцию суставов и позволяет сни-зить потребность в НПВП. Полученные данные подтверждают данные лите-ратуры о наличии анальгетического и противовоспалительного эффектовдиацереина, глюкозамин сульфата и хондроитин сульфата у пациентовостеоартрозом тазобедренных суставов.Выводы: Применение диацереина, глюкозамин сульфата и хондроитинсульфата у пациентов остеоартрозом тазобедренных суставов приводит куменьшению боли, улучшению функциональной активности, снижает по-требность в НПВП. Терапия диацереином и глюкозамин сульфатом, по срав-нению с хондроитин сульфатом, оказывает более ранний и стойкий эффектпри длительном наблюдении. Применение глюкозамин сульфата в течение18 месяцев у пациентов коксартрозом превосходит диацереин и хондроитинсульфат по влиянию на показатели качества жизни.
Соколов В.А.
ДИСПЛАЗИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ И КЛИНИЧЕСКИЙ МЕТЕОПАТИЧЕСКИЙ СОЕДИНИТЕЛЬНОТКАННЫЙ СИНДРОМ У БОЛЬНЫХ С СОМАТИЧЕСКИМИ И РЕВМАТИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Приднестровский государственный университет им. Т.Г.Шевченко г. Тирас-поль (Приднестровье, Молдова)
Введение. Первые представления о соединительной ткани(СТ), каквнутренней среде организма представлены в работах С.М.Лукьянова(1894),Г.Шаде, В.Г.Гаршина, А.А.Богомольца, А.А.Заварзина, В. П Казначеева., В.ВСерова., А.Б. После чего в медицине появилась идея стромально-паренхиматозных взаимодействий в СТ, она стала одной из методологиче-ских основ изучения закономерностей формирования общепатологическихпроцессов и адаптивно-компенсаторных реакций, как в гистологии, так и втеоретической и клинической медицине, сформировав впоследствии учениео дисплазия соединительной ткани (ДСТ). Авторы. полагали, что морфоге-нетическая функция коллагена обусловлена его способностью быть излож-ницей, придающей форму и внутреннюю архитектуру либо будущему органув эмбриогенезе, либо ткани при морфогенезе, сопровождающем физиологи-ческую, или другой вид регенерации и рассматривали морфогенетическуюфункцию СТ, как для нее основную, “активную”, а опорную считали “пассив-ной”, вторичной. Поэтому СТ сегодня считают морфофункциональной си-стемой, все компоненты которой взаимосвязаны и взаимозависимы черезстромально-паренхиматозные взаимодействия в СТ и нарушения в них при-водит к возникновению дисплазии соединительной ткани.Дисплазия соединительной ткани —это наследственные нарушения со-единительной ткани мультифакториальной природы, объединенные в син-дромы и фенотипы на основе общности внешних и/или висцеральных., ха-рактеризующиеся многообразием клинических проявлений от доброкаче-ственных субклинических форм до развития полиорганной и полисистемнойпатологии с прогредиентным течением. В литературе не обнаружено дан-ных о частоте признаков ДСТ при различных заболеваниях в Приднестров-ском регионе республики Молдова. Это и послужило поводом для настоя-щего исследованияЦелью исследования явилось изучение частоты признаков соедини-тельнотканных дисплазий, включая клинический метеопатический соедини-тельнотканный синдром(КМС-синдром) при соматических и ревматическихзаболеваниях у взрослых.Материалы и методы исследования. Работа выполняется в рамкахцелевой программы НИЛ «ИНТЕРН» ПГУ им. Т.Г.Шевченко г. Тирасполь поизучению особенностей течения СЗ и РЗ, при ДСТ. синдроме. За период2003-2013годы была изучена распространенность соматических заболеваниях (СЗ) и ревматических заболеваниях (РЗ), ассоциированных с ДСТ сре-ди выборки проанкетированых 2000 рабочих текстильного предприятия, 700стационарных и амбулаторных больных с СЗ и 200 больных с РЗ. Контроль-ная группа состояла из 100 совершенно здоровых добровольцев, соответ-ствующего СЗ и РЗ возраста и пола. Диагностика ДСТ проводилась с помо-щью критериев, изложенных в российских рекомендаций ВНОК(2009г) поДСТ и необходимых лабораторно – инструментальных методов исследования.Статистическую обработку данных проводили по схеме анализа программы«Статистика».Результаты исследования. Распространенность симптомов ДСТ сре-ди больных с СЗ в организованной и неорганизованной популяциях соста-вила 30,94%. Распространенность симптомов ДСТ, включая среди больныхс РЗ в организованной и неорганизованной популяциях составила 33,4%.Частоты признаков ДСТ в данных основных группах были достоверно (р<0,05) выше, чем в группе контроля. По результатам исследования былополучено четыре патента на изобретения по способам диагностики ДСТ.В процессе исследования у пациентов были выделены следующиесимптомы ДСТ, такие как общая слабость, недомогание, быстрая утомляе-мость, головная боль, расстройство сна, изменение артериального давле-ния, вегетативные расстройства со стороны внутренних органов, боли в су-ставах и нижней части спины, головные боли, которые, как правило, появ-ляются или усиливаются при перемене погоды, в магнитные бури и в полно-луние (метеопатии). С Целью понимания единого патогенеза этого симпто-мокомплекса, он был выделен нами, как КМС-синдром, который встречал-ся у всех больных с ДСТ.Выводы. У больных с СЗ и РЗ была определена частота признаковДСТ, которая составила 30,9% и 33,4%- соответственно, что было досто-верно(р< 0,05) выше, чем в контрольной группе. В процессе исследованиянами был предложен термин клинический метеопатический соединительнот-канный синдром, который выявлялся у всех больных с ДСТ и проявлял-ся, как правило в виде, астенического синдрома, болей в суставах и позво-ночнике, головных болей, вегето-сосудистых (или гипертонических) кризов,которые появлялись или усиливались при перемене погоды, в магнитныебури и в полнолуние. В заключении хочется обратить внимания практикую-щих врачей к проблеме наследственной неполноценности соединительнойткани, которая на практике проявляется ДСТ и КМС синдромом, лечениекоторых у больных с СЗ и РЗ имеет свои особенности.
Стажаров М.Ю., Зборовская И.А., Мартемьянов В.Ф.,Бедина С.А., Мозговая Е.Э., Хортиева С.С., Левкина М.В.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЭНЗИМНЫХ ИССЛЕДОВАНИЙ КРОВИ У БОЛЬНЫХ С МИНИМАЛЬНОЙ АКТИВНОСТЬЮ РЕВМАТОИДНОГО ПРОЦЕССА
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
В клинической практике у больных с ревматоидным артритом нередкобывает трудно разграничить фазу клинической ремиссии и минимальногообострения ревматоидного процесса вследствие малой информативностиобщепринятых острофазовых лабораторных показателей (СОЭ, СРБ и др.),остающихся в подобных ситуациях в большинстве случаев неизменными.Исходя из этого, поиск более чувствительных параклинических тестов в ин-дикации минимальной активности ревматоидного процесса является акту-альной зГДАчей в ревматологии.Цель исследования. Повышение качества диагностики минимальной ак-тивности ревматоидного процесса с использованием показателей активностинекоторых ферментов пуринового метаболизма в эритроцитах больных РА.Материал и методы. Под наблюдением находились 20 больных РА с ми-нимальной активностью ревматоидного процесса. Диагноз устанавливалсяна основании диагностических критериев Американской коллегии ревмато-логов и Европейской лиги ревматологов (Aletaha et al., 2010). Среди больныхпреоблГДАли женщины (70%). Средний возраст (М±m) больных – 46,8±0,9лет, продолжительность заболевания – 9,2±0,8 лет. Системные поражениявыявлены в 40% случаев. Серопозитивный вариант (по РФ) определялся у12 (60%) больных, прогрессирующее течение – у 4 (20%). I стГФия (поШтейнброккеру) установлена у 3 (15) больных, II стГФия – у 10 (50%), III –у 5 (25%) и IV стГФия – у 1 (5%) больного. Функциональный класс (ФК) су-ставов второй степени (ФК-2) определён у 12 (60%) больных, ФК-3 – у 7(35%) и ФК-4 – у 1 (5%) больных. Контрольную группу составили 30 прак-тически здоровых людей. Выделение эритроцитов и приготовление их лиза-тов проводилось с использованием цитратной венозной крови, заморажива-ния – оттаивания, центрифугирования. Подсчет эритроцитов – под микро-скопом в камере Горяева (до лизиса).В лизатах эритроцитов здоровых и больных РА по оригинальным методи-кам определяли активность гуаниндезаминазы (ГДА), гуанозиндезаминазы(ГЗДА), пуриннуклеозидфосфорилазы (ПНФ), гуанозинфосфорилазы (ГФ),ксантинокидазы (КО), ксантиндегидрогеназы (КДГ). Активность ферментоввыражали в нмоль/мин на 1 мл, содержащий 1×109 клеток (до лизиса). Приобработке полученных результатов использовались пакеты программы «Ста-тистика 6.0».Результаты исследований. Активность изученных ферментов не зави-села от пола и возраста, и поэтому эти факторы не учитывались при анализе. По сравнению со здоровыми, у больных РА с I степенью активности про-цесса, по сравнению со здоровыми, в лимфоцитах выше активность ГДА,ПНФ, ГФ, ниже активность ГЗДА (все р˂0,001), незначительно выше актив-ность КО (р>0,05) и ниже КДГ (р>0,05). Если же учитывать не среднестати-стические величины активности ферментов, а индивидуальные энзимныепоказатели, то за верхние референтные пределы здоровых лиц (М±2G) вы-ходили показатели активности ГДА в 70,0% случаев, ПНФ – в 85%, КДГ – в20% случаев, за нижние границы – только показатели активности КДГ в 25%случаев. У этих же больных за референтные пределы здоровых выходилипоказатели СОЭ в 40% случаев, СРБ – в 35%, альфа-2-глобулинов – в 40%и сиаловых кислот – в 95% случаев. То-есть, показатели активности ГДА иПНФ в 2-2,5 раза более чувствительны в индикации минимальной активностиревматоидного процесса.Через 7-8 дней лечения на фоне некоторого улучшения клинического со-стояния больных статистически значимая положительная динамика толькодля ПНФ и ГЗДА: снизилась активность ПНФ (р˂0,001), повысилась ранеесниженная активность ГЗДА (р˂0,05). После проведенного курса лечениянаблюдалась положительная динамика всех энзимных показателей, и они неотличались от показателей здоровых лиц (р>0,05).Заключение. Результаты проведенных исследований показали, что дляиндикации минимальной активности ревматоидного процесса целесообразноопределять в лизатах эритроцитов активность ГДА и ПНФ, показатели кото-рых оказались более чувствительными, чем СОЭ, СРБ, сиаловые кислоты иальфа-2-глобулины. Показатели активности изученных ферментов способ-ствуют объективизации оценки эффективности проводимой терапии. В пер-вые 7-8 дней лечения целесообразно ориентироваться на показатели актив-ности ПНФ и ГЗДА.
Сулейманова Г.П., Грехов Р.А., Харченко С.А., Мякишев М.В.
ОЦЕНКА ЭФФЕКТИВНОСТИ СТРУКТУРНО-РЕЗОНАНСНОЙ ЭЛЕКТРОМАГНИТНОЙ ТЕРАПИИ УБОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,Россия.
Целью работы явилось изучение эффективности использования струк-турно-резонансной электромагнитной терапии (СРЭМТ) в комплексной тера-пии пациентов с системной склеродермией (ССД) в зависимости от формы,течения, степени активности и стадии заболевания.Материал и методы исследования. Под наблюдением находилось 77больных ССД. Средний возраст пациентов – 38,19 ± 12,1 лет, средняя про-должительность болезни составила 11,2±3,4 года. По степени активностипатологического процесса больные распределились следующим образом: Iстепень была диагностирована у 40 человек (51,9%), II степень – у 34 человек (44,2%), III степень – у 3 пациентов (3,9%). У 32 больных (41,6%) те-чение заболевания расценено как хроническое (медленно прогрессирую-щее), у 42 (54,5%) – как подострое (умеренно прогрессирующее), у 3(3,9%) – как острое (быстро прогрессирующее).Исходя из поставленных задач, больные ССД путем случайного подборабыли разделены на три группы, сопоставимые по половому составу, возрастуи длительности заболевания: основную группу; группу, получающую «пла-цебо» – воздействия по основной методике СРЭМТ, при которой имитирова-лось проведение процедур без подключения электрического тока; и кон-трольную. Пациенты всех групп получали аналогичное медикаментозноелечение. Кроме того, больные основной группы получали дополнительно 10-12 ежедневных сеансов СРЭМТ с помощью аппарата «Рематерп» в сканиру-ющем режиме «А» продолжительностью каждого 43 мин. “Сканирующий”режим включает в себя набор режимов воздействия, направленных на вос-становление собственных частот органов и тканей. Аппарат структурно-резонансной электромагнитной терапии “Рематерп” разработан ГУП МОКБ”МАРС” (г. Москва), сертифицирован и внесен в Государственный Реестр ме-дицинских изделий.Клиническая оценка эффективности метода СРЭМТ проводилась с учетомвыраженности боли по ВАШ, суставного счета, числа припухших суставов,индекса припухлости; лабораторных тестов (СОЭ,СРБ, ЦИК, Ат Scl-70).Результаты исследования и их обсуждение. Анализ эффективностиметода СРЭМТ в комплексном лечении больных ССД представлен в таблице.Динамика клинико-лабораторных показателей эффективности СРЭМ тера-пии в зависимости от характера течения ССД
Примечание: Статистическая значимость различий с данными контроль-ной группы обозначена: * р<0,05Статистическая значимость различий между группами пациентов с РАобозначена: ** р<0,05Выводы. Таким образом, при обследовании больных с суставной формойревматоидного артрита в ОАК изменение содержания эритроцитов, гемогло-бина, лейкоцитов, лимфоцитов, сегментоядерных нейтрофилов, палочко-ядерных нейтрофилов и ускорение СОЭ по сравнению с донорами, и приразличных степенях активности установлено наличие определенных особен-ностей, имеющих значение в динамическом наблюдении пациентов с ревма-тоидным артритом.
Инина Л.И., Иванова М.М.
НЕКОТОРЫЕ ПАТОГЕНЕТИЧЕСКИЕ АСПЕКТЫИЕРСИНИОЗНОГО АРТРИТА
ФГБУ «НИИР им. В.А. Насоновой» РАМН, Москва; Кафедра внутренних болез-ней педиатрического и стоматологического факультетов ВолгГМУ, Россия
В последнее время особое внимание ревматологами уделяется изучениюразвития суставной патологии при иерсиниозе. По данным различных иссле-дователей артриты наблюдаются в 7,5-30% случаев данного заболевания.Большинство артритов вызывается Y.enterocolitica сероваров 03,09, реже05,06,08 и др. В большинстве случаев иерсиниозный артрит (ИА) рассматри-вается как реактивный артрит но известно и о септических вариантах воспа-ления суставов.Патогенез артритов, обусловленных Y.enterocolitica, в значительной мереопределяется состоянием реактивности организма, характером и степеньюразвития компенсаторных реакций, явлениями аллергии и аутоаллергии,генетически обусловленным и приобретенным иммунитетом.Известно, что генетическим маркером предрасположенности развитияартрита после перенесенной иерсиниозной инфекции является антиген ги-стосовместимости HLA или один из группы CREG. Показано, что например, вФинляндии, 66-90% больных иерсиниозом являются носителями HLA пози-тивных заболеваний, наряду с болезнью Бехтерева, Рейтера, псориатическойартропатией, другими реактивными артритами. Есть мнение, что клиниче-ская картина ИА может быть модифицирована генетическим фоном, связан-ным с HLA антигеном.В настоящее время существует несколько этиопатогенетических теорий,объясняющих взаимосвязь болезни с HLA антигеном:- рецепторная, по которой HLA вступает в качестве рецептора для микро-организма, вызывающего заболевание; – двух генов, допускающая существование равновесного сцепления меж-ду HLA и генами восприимчивыми к заболеванию;- одного гена, допускающая наличие перекрестной реакции между HLA иантигенами микроорганизма, вызывающего заболевание;- медиаторной чувствительности, по которой HLA антиген изменяет чув-ствительность к медиаторам воспаления.Как известно, нейтрофилы принимают непосредственное участие в разви-тии острого воспаления, высвобождая лизосомальные ферменты, суперок-сидные анионы (О2), гидрофильные радикалы и гидроген пероксид. Приостром воспалении увеличивается поступление белка в очаг воспаления; этозависит от скорости кровотока в микроциркуляторном русле и степени про-ницаемости капилляров. Нейтрофилы также принимают участие в контроли-ровании этого процесса. Высокая воспалительная реакция нейтрофилов HLAпозитивных ассоциирует с их повышенной миграционной и хемотоксическойфункцией. Многие ученые на основании проведенных исследований показа-ли, что хемотаксис и хемокинезис, локомоторная функция полиморфонукле-арных лейкоцитов у больных иерсиниозными артритами с наличием HLA ан-тигена гистосовместимости более выражены, чем у больных с отсутствиемэтого антигена. Эта закономерность справедлива как при исследовании invitro, так и in vivo. Реакция иммунной системы является одним из основныхзвеньев в цепи патогенеза ИА. Ряд авторов считает, что у больных иерсини-озом, у которых развился артрит, имеются и значительные иммунологиче-ские отклонения, которые предрасполагают к осложнениям от инфекции иклеточный иммунитет играет важную роль в патогенезе артрита, обуслов-ленного Y.enterocolitica – микроба, способного проникать в клетку и выжи-вать там.С Целью изучения особенностей клеточного иммунитета были проведеныисследования реакции бласттрансформации лейкоцитов у больных с ИА ибез изменений со стороны суставов. Большинство исследователей установи-ло замедление этой реакции у больных ИА в отличие от лиц с не осложнен-ным течением иерсиниоза, хотя некоторые исследователи этих различий невыявили в обеих группах больных. Слабый Т-клеточный ответ у больных ИА,видимо, позволяющий проникновение инфицирующих организмов в эпите-лий дальнейшую циркуляцию антигена.При исследовании клеточной пролиферации лимфоцитов синовиальнойжидкости у больных реактивным артритом, в том числе обусловленныхY.enterocolitica, был обнаружен положительный ответ на эту инфекцию.Большинство лимфоцитов синовиальной жидкости при ИА обладают феноти-пом Т4+ (иммуноиндукторы/помощники), при незначительном количестве В-лимфоцитов. Полученные данные подтверждают активное участие Т-клеточного иммунитета в развитии ИА. Считают, что ИА на фоне перенесен-ной инфекции у генетически предрасположенных лиц развиваются в связи снакоплением активизированных, антигенспецифических Т-лимфоцитов.Изучение гуморального иммунитета у лиц с ИА в сравнении с больнымииерсиниозом, у которых не развился артрит, показало, что качественныхразличий в образовании антител у больных иерсиниозом в 2-х наблюдаемых группах нет, но количественные различия были выявлены. Используя доста-точно чувствительный метод ELISA, проводился качественный анализ анти-тел, принадлежащих к классам IgA, IgM, IgG. Было отмечено, что в большин-стве случаев антитела, относящиеся к классу IgM, сохраняются лишь 1-3месяца и, как правило, исчезают через полгода. При сравнении двух группбольных установлено, что титры антител класса IgM к иерсиниям остаютсяниже при артрите, чем у больных без артрита. Эти данные могут быть объяс-нены двумя причинами : а) иммунный ответ антител класса IgM слабее поотношению к инфекции; б) в некоторых случаях специфические иммуногло-булины класса IgM связаны с иммунными комплексами и не определяютсяпри использовании ELISA техники.Обычно Y.enterocolitica связывает быстрый и выраженный ответ антителIgG, который сохраняется у больных с признаками артрита дольше, чем безнего. IgG – сохраняется более длительный период времени, определяетсядаже на протяжении двух лет и более у пациентов с развившимся артритом.Различие гуморального ответа наиболее выражено на IgA антителах: убольных артритом достоверно более высокие концентрации класса IgA анти-иерсиниозных антител, они персистируют в течение ряда лет, тогда как IgA убольных без ИА исчезают через 5 месяцев от начала заболевания. Установ-лено, что класс IgA бывает двух видов: сывороточный и секреторный. Сыво-роточный IgA обычно мономерен. Полимерный секреторный IgA выделяетсяв просвет кишечника, где связывается с антигеном и удаляется вместе с ним.Обычно секреторный IgA выделяется в сыворотке больных иерсиниозом внебольших количествах. Сывороточный IgA состоит на 90% из IgA I и на10%из IgA II субклассов. IgA II – локально активен в слизистой оболочке. Секре-торный IgA у больных с не осложненным иерсиниозом выявляется в меньшихколичествах. Аналогичная картина наблюдается и при определении уровняIgA II в сравниваемых группах. Высокий уровень антител класса IgA у боль-ных ИА, по-видимому, частично объясняется повышением выработки слизи-стого IgA. Эти данные говорят об измененной иммунной реакции кишечникапри ИА.При анализе полученных данных необходимо учесть, что период полувы-ведения IgA составляет несколько дней, поэтому персистенция антителдолжна быть обусловлена продолжающимся синтезом. Данный феномен мо-жет быть связан либо с персистенцией антигена, либо с перекрестной реак-цией между антигенами Y.enterocolitica и макроорганизма (возможно HLAантигеном гистосовместимости). Подкласс IgA II и секреторный компонентIgA указывают на связь вырабатываемых антител со слизистой кишечника.Установлено, что антиерсиниозный IgA ответ более выражен у больныхHLA позитивных, чем у HLA негативных. Тяжесть ИА коррелирует как с нали-чием HLA антигена, так и с уровнем специфического (антиерсиниозного) IgA.При изучении распределения антител к иерсиниа одновременно в синови-альной жидкости и сыворотке у больных ИА различий не выявлено.Исследования показали, что выраженный и персистирующий IgA ответ кY.enterocolit. в сыворотке крови больных ИА в значительной мере направленпротив липосахаридов, являющихся выраженным антигенным компонентом граммотрицательных бактерий, локализующихся на наружной мембране бак-терии.Есть мнение, что лимфоидные элементы в кишечном эпителии хроническистимулируются иерсиниозными антигенами, что поддерживает высокий уро-вень антител. Установлено, что наличие антигенемии кишечной иерсиниипри ИА выявляется в 70% случаев. Отсутствие этих антигенов ИА может бытьиспользовано в дифференциальной диагностике данных заболеваний. Изу-чая у животных иммуноглобулиновый ответ к Y.enterocolitica. установлено,что выраженность иммунного ответа зависит от количества бактерий, вве-денных в организм. В литературе имеются так же сообщения о результатахизучения Yersinia – специфических иммунных комплексов. Установлено, чторазмеры этих иммунных комплексов относительно небольшие и незначи-тельно превышают размеры анти- Yersinia антител, а их размеры у больных споражением суставов и без него равны. Изменений не отмечалось и при дли-тельном наблюдении. Небольшие размеры специфических иммунных ком-плексов объясняют длительную их персистенцию у некоторых больных иподтверждают их потенциальную роль в патогенезе реактивного артрита,вызванного Y.enterocolitica.При исследовании циркулирующих иммунных комплексов (ЦИК) энзимо-иммуносорбентным методом (ELISA) удалось выявить, что в течение первых2 месяцев от начала заболевания специфические иммунные комплексы IgMимели более высокое содержание у больных с артритом, чем без такового.Причем, разница в распространении комплексов IgM в двух группах пациен-тов со временем сокращалась. Специфические иммунные комплексы YersiniaIgG время от времени наблюдались у пациентов обеих групп. Специфиче-ские Yersinia – циркулирующие иммунные комплексы, содержащие IgA анти-гены, наблюдались у больных артритом и не наблюдались у пациентов безнего. По истечении более 8 месяцев от начала заболевания у лиц и ИА спе-цифические Yersinia – ЦИК выявлялись в три раза чаще, чем у больных безИА.Проведенные исследования показали, что в сыворотке больных иерсини-озом нередко наблюдаются антитела к гладкомышечной ткани, органоспе-цифические антиэпителиальные антитела, реагирующие с желудочно-кишечным, тубулярным эпителием почек и эпителием щитовидной железы, атакже антинуклеарные и антиДНК антитела. В связи с этим предполагается,что механизм реализации тригтерного действия Y.enterocolitica осуществля-ется путем индукции аутоиммунных процессов. Однако механизм этих про-цессов – при иерсиниозе до настоящего времени остается неясным.Известно, что наиболее частой причиной синтеза аутоантител при бакте-риальных инфекциях является наличие перекрестно реагирующих антигеноввозбудителя и антигенных детерминант тканей человека. Многие микробныепроизводные оказывают вспомогательный эффект на иммунный ответ орга-низма. Немаловажным предоставляется тот факт, что Y.enterocolit. являетсяграммотрицательным микроорганизмом, содержащим липополисахариды.Этот LPS взятый из оболочки граммотрицательной бактерии, широко изве-стен как В-лимфоцитарный митоген. Таким образом, действуя неспецифиче-ски, замедляет функцию клеток-помощников синтеза АТ. Предполагают, что воспаление кишечного эпителия, других тканей в сочетании с вспомогатель-ным эффектом, оказываемым бактериальным LPS может вызвать образова-ние аутоантител.
Лященко М.А., Грехов, Р.А., Харченко С.А.,Сулейманова Г.П., Бурлай О.С., Мякишев М.В.
ИЗМЕНЕНИЕ УРОВНЯ СУБЪЕКТИВНОГО КОНТРОЛЯ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ ПРИ ИСПОЛЬЗОВАНИИ МЕТОДА БИОЛОГИЧЕСКОЙ ОБРАТНОЙ СВЯЗИ
ФГБУ “НИИ КиЭР” РАМН, г. Волгоград, Россия
Цель: изучить влияние биологической обратной связи (БОС) на уровеньсубъективного контроля (УСК) у пациентов, страдающих ревматоидным арт-ритом (РА), и обосновать использование данного метода в комплексном ле-чении заболевания.Материалы и методы. Были обследованы 40 пациентов с диагнозом РА,находившихся на стационарном лечении в ревматологическом отделенииклинической больницы №25 г. Волгограда. Средний возраст обследованныхбольных = 48, 6 лет ± 7,73 года (от 30 до 70 лет), женщины составлялибольшинство = 26 (86%), средняя продолжительность заболевания = 12 лет± 3,44 года. При проведении исследования использовалась методика УСК(Головей Л.А., Рыбалко Е.Ф., 2005).Больные РА были разделены на две группы: основную (20 человек) иконтрольную (20 человек). Пациенты основной группы получали комплекс-ную терапию с включением 12 сеансов БОС-тренинга преимущественно наоснове параметров электрической активности мозга – релаксация по ЭЭГ спомощью психофизиологического реабилитационного комплекса «Реакор»производства фирмы «Медиком МТД» (г. Таганрог).Результаты. В Результаты проведенного исследования мы выявили экс-тернальность у больных РА в общей сфере (3,03±0,3), а также в сфере от-ношения к заболеванию (3,86±0,23) и сфере производственных отношений(3,43±0,25). После проведения БОС-тренингов наблюдалось повышение ин-тернальности по шкалам общей сферы (p<0,05) и отношения к заболеванию(p<0,01) у пациентов основной группы. В группе пациентов, получающихтрадиционное лечение, динамика результатов была недостоверной.Обсуждение. Следует отметить, что уровень субъективного контроля –качество, характеризующее склонность человека приписывать ответствен-ность за Результаты своей деятельности внешним силам, либо собственнымспособностям и усилиям. УСК оказывает регулирующее влияние на многиеаспекты поведения человека, играя важную роль в формировании межлич-ностных взаимоотношений, в способе разрешения стрессовых ситуаций, в отношении к болезни и терапевтическим мероприятиям. Экстернальностьпроявляется в том, что пациенты предпочитают перекладывать ответствен-ность за важные события своей жизни на внешние обстоятельства, в своейпроизводственной деятельности – на внешние силы (начальство, коллег ит.д.). В сфере отношения к заболеванию экстернальность проявляется в том,что пациент ведет себя пассивно, так как больной полагает, что никак неможет повлиять на течение болезни, перекладывая всю ответственность заРезультаты лечения на медицинских работников, что может привести к несо-блюдению лечебного режима, повышению уровня тревоги и депрессии, сни-жению самооценки. Возникновение болезни и связанные с ней социальныепоследствия (нарушение трудоспособности, утрата социальных ролей и т. д.)могут вызвать негативное психическое состояние наученной беспомощности.Наученная беспомощность определяется как состояние, возникающее в ре-зультате неконтролируемых, преимущественно негативных событий, котороепроявляется в нарушениях эмоциональных, мотивационных и когнитивныхпроцессов. Другими словами, больной РА, подверженный данному состояниюожидает неудачи в лечении и снижает контроль над соблюдением лечебногорежима. Для корректировки и предотвращения состояния наученной беспо-мощности путем повышения уровня интернальности можно использоватьБОС-терапию.Предполагается, что повышение интернальности в процессе БОС-терапиисвязано с научением пациента навыкам саморегуляции физиологическихпроцессов. По данным исследователей Грехова Р.А., Александрова А.В., Хар-ченко С.А. и др. у пациентов с ревматическими заболеваниями после прове-денных сеансов БОС отмечалось улучшение мозгового и периферическогокровотока, мышечная релаксация, улучшение сна, что также повышает эф-фективность лечения. Механизмы терапевтического эффекта БОС-терапиизаключаются не только в изменениях, касающихся физиологических пара-метров, но и в смещении уровня субъективного контроля с экстернальногона интернальный, что может способствовать повышению комплаенса,уменьшению невротических жалоб, мобилизации волевого потенциала иулучшению самооценки пациента.Выводы:В результате проведенного курса комплексного лечения, с использовани-ем метода БОС у больных было отмечено повышение интернальности пошкалам общей сферы и сферы отношения к заболеванию. Для повышенияэффективности лечения целесообразно применение метода БОС-терапии дляповышения уровня комплаенса.Таким образом, в результате проведенных исследований была доказанацелесообразность применения метода БОС-терапии в комплексном лечениибольных РА.
Майко О.Ю., Иванова К.В.
ОЦЕНКА ПАРАМЕТРОВ СУТОЧНОГО МОНИТОРИРОВАНИЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ У БОЛЬНЫХ ПОДАГРОЙ В СОЧЕТАНИИ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ НА ФОНЕ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ЛОЗАРТАНА И ЕГО КОМБИНАЦИИ С УРИСАНОМ В АМБУЛАТОРНЫХ УСЛОВИЯХ
ГБОУ ВПО Оренбургская государственная медицинская академия МинздраваРФ, Оренбург, Россия
Цель: Выявить особенности суточного ритма артериального давления,уровня мочевой кислоты у больных подагрой в межприступный период приналичии артериальной гипертонии.Материалы и методы. В исследование включено 52 больных, обратив-шихся в поликлинику, с достоверным диагнозом подагры, находящихся вмежприступном периоде, ранее не получавших регулярно гипоурикемиче-скую терапию при наличии артериальной гипертонии I и II степени (Россий-ские рекомендации, 2010), давшие информированное согласие. Для диагно-стики подагры использовались классификационные диагностические крите-рии S.L. Wallace. Всем пациентам проводилось общеклиническое обследова-ние с оценкой антропометрических показателей: рост, масса тела, индексмассы тела (ИМТ), окружность талии (ОТ), окружность бедра (ОБ), отноше-ние ОТ/ОБ. Инструментальное обследование включало: электрокардиогра-фию (ЭКГ), эхокардиографию (ЭхоКГ), суточное мониторирование АД(СМАД), УЗИ почек.Результаты и Обсуждение. Продолжительность заболевания подагройу большинства больных обеих подгрупп колебалась от 3 до 6 лет, средняяпродолжительность составила 3,26±2,18 лет. Частота обострения артрита всреднем составила 2 от 1 до 3 атак в год, в среднем 2,23±0,75. Количествопораженных суставов составило 2 от 1 до 4. У 23,5% пациентов отмечалисьтофусы. Преобладало рецидивирующее течение заболевания у 31 человека(60%) и хронизация течения наблюдалась у 21 человека (40%). На моментисследования больные находились в межприступном периоде и не принима-ли антигиперурикемические препараты. Длительность обострения подагрыколебалась от 1 до 4 недель, а средняя длительность обострения составила1,25±0,79, средняя длительность ремиссии была 5,35±1,29 месяцев. Уро-вень МК в сыворотке крови варьировал от 383 до 564, средний уровень со-ставил 469,18±58,27 ммоль/л. Уровень экскреции МК за сутки колебался от1,4 до 4,32 ммоль/л, средний уровень был 2,83±0,73 ммоль/л. Длительностьартериальной гипертензии не превышала 10 лет, средн. 5,46±3,15 лет. I иII степени АГ встречались с одинаковой частотой .У больных подагрой изменения всех исходных параметров СМАД былистатистически значимо хуже нормативных значений. У большинства больных зарегистрировано повышение среднедневного САД и средненочного САД – у76 %, индекса времени – ИВ САД д – у 76%, ИВ САД н- у 82%, нарушениевариабельности САД – у 80%, средненочного ДАД – у 47%, ИВ ДАД д – у94% , ИВ ДАД н – у 100%, ВУП САД – у 60%, ВУП ДАД – у 83%. Нарушениерегуляции АД, о котором свидетельствует повышение индекса времени (ИВ),чаще регистрировалось для ДАД, чем для САД, у 94% и 100%, пациентовпротив 76% и 71%, соответственно. Инверсия суточного ритма САД и ДАДпо типу ночной гипертонии (найт-пикер) и недостаточного снижения ночно-го АД (нон-диппер), статистически значимо чаще выявлялись у больных по-дагрой. Так, количество найт-пикеров составило по САД 35%, по ДАД 41%.Количество нон-дипперов по САД 35%, по ДАД 37%. Особенностями суточ-ного профиля по ДАД у больных подагрой являлось статистически значимоеуменьшение степени ночного снижения ДАД (37%) и инверсия суточногоритма ДАД по типу найт-пикер (41%), что свидетельствует о большей часто-те диастолической АГ у больных подагрой. ГЛЖ наблюдалась у 60% пациен-тов, при сохраненной фракции ЛЖ, у этих больных была диастолическаядисфункция, также отмечалась тенденция к увеличению толщины межжелу-дочковой перегородки (МЖП) и задней стенки левого желудочка.Выводы: У больных подагрой в межприступном периоде при сочетании сартериальной гипертонией выявлено нарушение регуляции АД, о которомсвидетельствует повышение показателей индекса времени для диастоличе-ского АД, вариабельности и увеличения времени утреннего подъема для си-столического АД, что способствует развитию нагрузки на органы мишени, вчастности гипертрофии левого желудочка, которая диагностирована у 60%больных. Отмечается преобладание инверсии суточного ритма систолическо-го и диастолического АД по типу ночной гипертонии (найт-пикер) и недоста-точного снижения АД (нон-диппер), причем отмечалась высокая частота (до40%) диастолической артериальной гипертонии.
Мартемьянов В.Ф., Галаева О.Ю., Бедина С.А.,Мозговая Е.Э., Стажаров М.Ю., Морозова Т.А.
ЭНЗИМНЫЕ ИССЛЕДОВАНИЯ КРОВИ НА РАННИХСТАДИЯХ ОСТЕОАРТРОЗА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Цель исследования. Выявить особенности активности ферментов аде-ниловой ветви пуринового метаболизма в эритроцитах больных остеоартро-зом на ранних стадиях болезни.Материал и методы. В условиях стационара наблюдались 57 больныхпервичным остеоартрозом (ОА) с длительностью болезни до двух лет. Диа-гностик ОА проводилась на основании критериев Американской ревматоло-гической ассоциации (Альтман, 1991). Контингент больных был представлен16 (28,1%) мужчинами и 41 женщиной. В исследование не включались больные с поражением внутренних органов и тяжелыми нарушениями их функ-ций, беременные, злоупотребляющие алкоголем. Средний возраст больных(М±): 46,3±0,5 лет, длительность болезни – от 3 до 23 месяцев: 10,9±0,6мес. I стадия поражения суставов определялась у 45 (78,9%), II стадия – у12 больных, ФК-1 – у 35 (61,4%), ФК-2 – у 22 больных. Явления синовита –у 35 (61,4%) больных, полиостеоартроз – у 35 (671,4%) больных. В зависи-мости от длительности болезни были сформированы 2 группы больных. В 1-ю группу с длительностью болезни 3-11 месяцев (7,97±0,4 мес.) вошли 37больных, из которых 14 (37,8%) мужчин и 23 женщин. Средний возраст:47,3±0,6 лет. В эту группу вошли 2 больной с синовитом, 36 больных с Iстадией и 1 больной с II стадией. Во 2-ю группу с длительностью болезни от12 до 23 месяцев (16,3±0,8 мес.) вошли 20 больных, из которых 18 (90%)женщин. Средний возраст больных: 44,4±0,9 лет. Явления синовита опреде-лялись у 14 (70%) больных, I стадия – у 9 (45%), II стадия – у 11 (55%)больных. Выделение эритроцитов и приготовление их лизатов проводилось сиспользованием цитратной венозной крови, замораживания-оттаивания,центрифугирования. Подсчет эритроцитов – под микроскопом в камере Горя-ева (до лизиса). В лизатах эритроцитов определялись активности аденозин-дезаминазы (АДА), АМФ-дезаминазы (АМФДА), адениндезаминазы (АД) и 5′-нуклеотидазы (5′-НТ) по оригинальным методикам. Активность ферментоввыражалась в нмоль/мин/мл, содержащим 1×109 клеток (до лизиса). Приобработке результатов использовалась статистическая программа ”Статисти-ка 6.0”.Результаты исследований. Активность энзимов в лизатах эритроцитовздоровых людей не зависела от пола и возраста (р>0,05) и вследствие этогов исследованиях у больных эти факторы не учитывались. Для удобства из-ложения больные ОА с длительностью болезни до двух лет будут именовать-ся как группа больных с ранним остеоартрозом (РОА). При поступлении налечение, по сравнению со здоровыми, у больных РОА (всей группы) в лиза-тах эритроцитов выше активность АДА (р=0,004), АМФДА (р=0,038), АД(р=0,037) и незначительно выше 5′-НТ (р=0,074). По окончании курса лече-ния активность всех ферментов не имела отличий от здоровых (р>0,05). Посравнению со здоровыми, у больных РОА с полиостеоартрозом, выше актив-ность АД (р<0,001), 5′-НТ (р=0,038), АДА (р=0,045) и АМФДА (р=0,038); убольных с моно-олигоартрозом статистически значимых энзимных различийне выявлено. При полиостеоартрозе, по сравнению с моно-олигоартрозом,выше активность всех ферментов (р<0,001). По сравнению со здоровыми, убольных с синовитом в эритроцитах выше активность всех ферментов: АДА(р<0,001), АМФДА (р=0,005), АД (р<0,001) и 5′-НТ (р=0,048); у больных безсиновита – статистически значимых энзимных различий не выявлено, ноопределялась тенденция к повышению активности АДА, АМФДА и снижениюАД и 5′-НТ (р>0,05). У больных с синовитом, по сравнению с больными безсиновита, выше активность всех энзимов (р<0,001). У больных РОА с I ста-дией, по сравнению с больными с II стадией, ниже активность всех фермен-тов: АДА, АМФДА, 5′-НТ (все р<0,001) и АД (р=0,004).Таким образом, проведенные исследования показали, что активностьвышеуказанных ферментов у больных РОА во многом зависит от клиниче-ских особенностей заболевания: наличия или отсутствия синовита, количества пораженных суставов, стадии и ФК суставов. Большое влияние на ак-тивность ферментов оказывает и длительность заболевания, и по мере ееувеличения активность АДА, АМФДА, АД и 5′-НТ имеет тенденцию к сниже-нию, что необходимо учитывать в клинической практике.
Мартемьянов В.Ф., Зборовская И.А., Галаева О.Ю.,Мозговая Е.Э., Стажаров М.Ю., Бедина С.А., Морозова Т.А.
АКТИВНОСТЬ ЭНЗИМОВ ПУРИНОВОГО МЕТАБОЛИЗМАВ ЛИЗАТАХ ЛИМФОЦИТОВ БОЛЬНЫХ ОСТЕОАРТРОЗОМ НА РАННИХ СТАДИЯХ ЗАБОЛЕВАНИЙ
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Цель исследования: выявление особенностей активности аденозиндез-аминазы (АДА), адениндезаминазы (АД), АМФ-дезаминазы (АМФДА), 5´-нуклеотидазы (5´-НТ) в лизатах лимфоцитов больных остеоартрозом (ОА) впервые два года заболевания.Материал и методы. Под наблюдением находились 57 больных первич-ным ОА с длительностью болезни до двух лет. Верификация диагноза прово-дилась на основании диагностических критериев Американской коллегииревматологов (Altman R. et al., 1991).Длительность болезни оценивалась по анамнестическим данным и запи-сям в амбулаторных картах. Контингент больных был представлен 41(71,9%) женщиной и 16 (28,1%) мужчинами. Возраст больных (М±m) -46,3±0,5 лет. Продолжительность болезни от 3 до 23 месяцев: 10,9±0,6 ме-сяцев. Выраженные явления синовита выявлены у 35 (61,4%) больных. Iстадия поражения суставов (по Келлгрену и Лоуренсу) определялась у 45(78,9%), II стадия – у 12 (21,1%) больных. Функциональный класс суставов(ФК) первой степени установлен у 35 (61,4%), ФК-2 – у 22 (38,6%) больных.В зависимости от длительности болезни были сформированы две группыбольных. В первую группу больных с длительностью болезни 3-11 месяцеввошли 37 больных, из которых 14 (37,8%0 мужчин и 23 (62,2%) женщины.Средний возраст больных – 47,3±0,6 лет. Длительность болезни: 7,97±0,4месяца. Явления синовита определялись у 21 (56,8%) больного. I стадияпоражения суставов установлена у 36 (97,3%), II стадия – у 1 больного.Вторую группу составили 20 больных, из которых 18 (90%) женщин и 2мужчины. Средний возраст больных – 44,4±0,9 лет. Длительность болезни от12 до 23 месяцев: 16,3±0,8 месяца. Явления синовита выявлены у 14 (70%)больных. I стадия поражения суставов определялась у 9 (45%), II стадия – у11 больных (55%). Выделение лимфоцитов из периферической венознойкрови проводилось по методике Boyum (1968). Лизаты лимфоцитов готови-лись путем замораживания–оттаивания, центрифугирования. Активностьферментов определялась по оригинальным методикам и выражалась в нмоль/мин/мл, содержащим 1×107 клеток. Полученные данные обрабатыва-лись методом вариационной статистики.Результаты исследований. Активность энзимов в лизатах лимфоцитовздоровых людей не зависела от пола и возраста, что позволило эти факторыв исследовании у больных. Так как все больные ОА находились на раннихстадиях болезни, в дальнейшем эта группа будет именоваться как больные сранним остеоартрозом (РОА). При поступлении на лечение у больных РОА(всей группы), по сравнению со здоровыми в лизатах лимфоцитов выше ак-тивность АДА (р˂0,001), незначительно выше активности АМФДА, 5´-НТ, АД(все р>0,05). У больных с синовитом, по сравнению со здоровыми, в лимфо-цитах выше активность 5´-НТ (р=0,006), АД (р˂0,001), незначительно вышеАДА (р=0,051), а у больных без синовита существенных энзимных различийне определялось (р>0,05). У больных РОА с синовитом, по сравнению сбольными без синовита, выше активность всех ферментов.У больных с по-лиостеоартрозом, по сравнению с больными с моно-олигоартрозом, вышеактивность АД, АМФДА, 5´-НТ и ниже АДА (все р˂0,001). У больных РОА с Iстадией, по сравнению с II стадией, в лимфоцитах выше активность АДА(р˂0,001), ниже АМФДА (р˂0,001), АД (р˂0,05) и 5´-НТ (р˂0,001). У больныхс ФК-1, по сравнению с больными ФК-2, выше активность АДА (р˂0,001),ниже АМФДА, АД и 5´-НТ (р˂0,001). У больных 2-й группы (с длительностьюболезни 12-23 месяца), по сравнению с больными 1-й группы (2-11 меся-цев), в лимфоцитах ниже активность АДА (р˂0,001), АМФДА (р˂0,01), 5´-НТ(р˂0,01). То-есть, по мере увеличения длительности болезни активностьАДА, АМФДА и 5´-НТ достоверно снижается. Проведенные исследования вы-явили существенные изменения активности изученных энзимов в зависимо-сти от синовита, ФК и стадии поражения суставов. Значительное влияние наэнзимную активность оказывает длительность заболевания, что необходимоучитывать в клинической практике при интерпретации энзимных показате-лей в лимфоцитах больных ОА на ранних стадиях заболевания.
Мозговая Е.Э., Мартемьянов В.Ф., Зборовский А.Б.,Бедина С.А., Стажаров М.Ю., Королик О.Д., Чернов А.С.
АКТИВНОСТЬ ФЕРМЕНТОВ ПУРИНОВОГО МЕТАБОЛИЗМА В ПЛАЗМЕ КРОВИ БОЛЬНЫХРЕВМАТОИДНЫМ АРТРИТОМ С I СТЕПЕНЬЮАКТИВНОСТИ ПАТОЛОГИЧЕСКОГО ПРОЦЕССА
ФГБУ«НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ
Если диагностика обострения патологического процесса, протекающего сумеренной или максимальной активностью у больных ревматоидным артри-том (РА) не представляет особых сложностей для врачей-ревматологов, тораспознавание процесса, особенно в амбулаторной практике, достаточно затруднительно даже для опытных врачей вследствие малой информативно-сти общепринятых лабораторных показателей, отражающих интенсивностьвоспалительного процесса. Проблема ранней диагностики минимальной ак-тивации ревматоидного процесса остается актуальной до настоящего време-ни.Цель исследования. Улучшение диагностики минимальной активностиревматоидного процесса за счет использования показателей активности не-которых ферментов пуринового метаболизма в плазме крови больных РА.Материал и методы. Под наблюдением находились 20 больных РА с Iстепенью (минимальной) активности процесса, из которых 14 (70%) женщи-ны. Средний возраст больных – 46,8±0,9 лет. Диагноз РА устанавливался наосновании диагностических и классификационных критериев Американскойколлегии ревматологов и Европейской лиги ревматологов (2010 г.). I стадияпоражения суставов (по Штейнброккеру) определялась у 3 (15%), II стадия– у 10 (50%), III стадия – у 5 (25%) и IV стадия – у 1 (5%) больного. Функ-циональный класс (ФК) суставов 2 степени установлен у 12 (60%) больных,ФК-3 – у 7 (35%) и ФК-4 – у 1 (5%) больного. Системные поражения выяв-лены в 40% случаев, серопозитивный вариант – в 60% и прогрессирующеетечение – в 20% случаев. Контрольную группу составили 30 практическиздоровых людей. В плазме крови здоровых и больных РА по оригинальнымметодикам определялась активность гуаниндезаминазы (ГДА), гуанозиндез-аминазы (ГЗДА), гуанозинфосфорилазы (ГФ), пуриннуклеозидфосфорилазы(ПНФ), ксантиноксидазы (КО) и ксантиндегидрогеназы (КДГ) и выражалась внмоль/мин/мл. Обработка полученных результатов проводилась с использо-ванием программы ”Статистика 6.0”. Комплекс обследования больных такжевключал определение общего анализа крови, мочи, СРБ, РФ, фракций белковсыворотки крови, иммуноглобулинов, сиаловых кислот.Результаты исследований. По сравнению со здоровыми, у больных РАс I степенью активности процесса, выше активность КО, ГДА, ПНФ (всер<0,001), КДГ (р<0,05), ниже активность ГЗДА (р<0,05) и незначительнониже активность ГФ (р>0,05). Если же учитывать индивидуальные показате-ли, то за верхние референтные пределы здоровых (М±2σ) показатели актив-ности КО выходили в 55% случаев, КДГ – в 35%, ПНФ – в 70% и ГДА – в50% случаев, а показатели СОЭ – в 40%, СРБ – в 35%, альфа-2-глобулинов– в 40%, сиаловых кислот – в 35%, гамма-глобулинов – в 25% случаев.Через 7-8 дней лечения снизилась активность ГДА (р<0,05), ПНФ(р<0,05) и повысилась ранее сниженная активность ГЗДА (р<0,05). По окон-чании курса лечения наблюдалась положительная динамика как клиниче-ских проявлений, так и всех энзимных показателей, которые не отличалисьот здоровых, за исключением активности КО, которая хотя и снизилась, ноосталась повышенной (р<0,05).При анализе энзимных показателей в зависимости от клинических осо-бенностей выявлено, что чем выше стадия поражения и ФК суставов, темвыше активность КО, КДГ, ГДА, ПНФ, ГФ и ниже ГЗДА. При системных пора-жениях, по сравнению с суставной формой, выше активность ГДА, ПНФ, ГФ, КО и КДГ. При системных поражениях, по сравнению с суставной формой,выше активность ГДА, ПНФ, ГФ, КО и КДГ.Заключение. Результаты проведенных исследований свидетельствуют,что показатели активности КО, ПНФ и ГДА в плазме крови более четко отра-жают минимальную активность ревматоидного процесса, чем СОЭ, СРБ, сиа-ловые кислоты и белковые фракции крови. Определяется зависимость ак-тивности ферментов от клинических особенностей заболевания. В ранниесроки лечения (первые 7-8 дней) при оценке эффективности назначеннойтерапии целесообразно ориентироваться на динамику показателей активно-сти ГДА, ПНФ и ГЗДА, которые более чувствительны к изменениям клиниче-ского состояния больных.
Моисеенко С.Н., Малахова Н.Л., Ханов А.Г.
СВИЩИ ПИЩЕВОДА И ТРАХЕИ У БОЛЬНЫХ ДЕРМАТОМИОЗИТОМ (КЛИНИКО-РЕНТГЕНО-ПАТОЛОГОАНАТОМИЧЕСКИЕ НАБЛЮДЕНИЯ)
ГБУ РО «Областная клиническая больница №2»,Клиническая больница №1ФГБУЗ ЮОМЦ ФМБА России, г. Ростов-на-Дону, Россия
Поражение мышц глотки, гортани, верхней трети пищевода при ДМ про-является в клинической картине заболевания дисфонией, затруднением гло-тания, приступами кашля.В течение трех месяцев у 3 больных наблюдавшихся в ОКБ №2 с диа-гнозом ДМ наступил летальный исход. Причиной резкого ухудшения течениязаболевания послужили свищи пищевода и трахеи со смертельными ослож-нениями.Первый пациент, м, 28 лет, с остро начавшимся ДМ в течение года ипринимавший большие дозы ГКС, умер от некроза слизистой глотки, ослож-нившейся флегмоной шеи и медиастинитом.Второй пациент, М, 57 лет, заболел полгода назад с высыпаний на коже ислабости в мышцах. За медицинской помощью обратился через 4 мес. В ОКБбыл установлен диагноз ДМ и назначены высокие дозы ГКС, без эффекта.При госпитализации имелась выраженная картина ДМ. Одновременно боль-ной предъявлял жалобы на боли в горле и кашель с гнойной мокротой. Приобъективном обследовании в нижних отделах определялись влажные мел-копузырчатые хрипы, которые расценены как проявления гипостатическойтерапии. Но выполненная рентгенография ОКГ признаков пневмонии не об-наружила. Больному начата пульс терапия в комбинации с в/в МТ. На 10день пребывания в стационаре, во время приема пищи, больной поперхнул-ся, развился приступ удушья, появились боли в сердце. Подозревался ИМ.После проведенного обследования диагноз острого ИМ не подтвердился. На следующий день выполнена рентгеноскопия пищевода, обнаружившаярак пищевода верхней трети и трахеобронхиальный свищ.Третья пациентка, Ж, 53 лет, заболела год назад с «классической» кар-тины ДМ. По м/ж, ревматологом был установлен диагноз: ДМ, назначенывысокие дозы ГКС. Причем, за год до этого больная лечилась стационарно вКВД по поводу дерматита без признаков системного воспаления. Прошла 2курса терапии с интервалом в месяц с диагнозами: «Герпетическая инфек-ция, осложненная токсико-аллергическим дерматитом» и «неутонченнымдерматитом». В первые три месяца заболевания трижды госпитализирова-лась, причем последний раз в ревматологическое отделение областной боль-ницы. Относительная ремиссия продолжалась 3 месяца, после чего вновьгоспитализирована по м/ж. 4 месяца больная чувствовала себя относитель-но удовлетворительно, продолжала прием ГКС в высоких дозах. Резкоеухудшение состояния в течение месяца в связи с образованием язв на коже,во рту, гениталиях. Больная госпитализирована в ревматологическое отде-ление областной больницы. На 2-ой день пребывания в стационаре у боль-ной развился коллапс, по поводу которого пациентка переведена в АРО.Причиной коллапса явился эпизод аспирации, который, по данным КТ про-изошел через гортанно- трахеальный и пищеводный свищ. Организованоэнтеральное питание через назогастральный зонд. Б-ная консультированаторакальным хирургом. Рекомендована подготовка к пластике пищевода .На18 день стационарного лечения случился повторный эпизод аспирации сначинающимся отеком легких, в связи, с чем переведена в АРО, где черезсутки наступила смерть. Направлена на патологоанатомическое вскрытие сзаключительным клиническим диагнозом:Конкурирующие заболевания1.Дерматомиозит, подострое течение, активная фаза, 3 степень активно-сти. Осл. Выраженная слабость проксимальных мышц верхних и нижних ко-нечностей. Вторичный некротизирующий васкулит по типу синдрома Бехче-та. Трофическая язва левой подмышечной области. Хронический ДВС син-дром с рецидивирующими тромбоэмболиями мезентериальных сосудов,ТЭЛА и острое повреждение миокарда 2.9.12 с отеком легких.2. Гортанно-трахеальный и пищеводный свищ в области правого груше-видного синуса. Остаточные явления перенесенной аспирационной пневмо-нии в виде постпневмонического фиброза в кортикальных отделах нижнейдоли правого легкого. Правосторонний малый гидроторакс с признаками ча-стичного осумкования в синусах.Эпизоды аспирации в трахеобронхиальное дерево с сосудистым коллап-сом (13.08 и 15.08.12) и 1.09.12 с интерстициальным отеком легких. Гене-рализация грибковой инфекции с развитием сепсиса. Септический шок. Гра-нулематозное поражение легких вследствие неоднократной аспирации.Травматизация слизистой пищевода вследствие длительного пребыванияназогастрального зонда, частой его смены, ФГДС и повторных диагностиче-ских и санационных бронхоскопий. Энтеральное питание через желудочныйзонд 18 дн. Реанимационные мероприятия (дефибрилляция, ИВЛ 3.912). Соп. Гипертоническая болезнь 3 стадии, степень АГ 2 , Риск 4, очень вы-сокий, дополнительный риск. Хроническая атеросклеротическая болезньсердца, атеросклеротическое поражение аортального и митрального клапа-нов (недостаточность митрального клапана 1 степени) ХСН 2А с неутончен-ным функциональным классом (NYHA). Хронический пиелонефрит латент-ное течение. Дисциркуляторная энцефалопатия сочетанного генеза выра-женной степени. ГРЭБ. Недостаточность кардии. Эрозивный гастродуоденит(об). Хронический фарингит. Хронический тонзиллит. Хронический ларин-готрахеит. Хронический стоматит. Хронический риносинуит. Левостороннийтубоотит.Причина смерти:а) острая сердечно – сосудистая недостаточностьб) ТЭЛА и острое повреждение миокардав) дерматомиозит, подострое течение, а/ф, 3 ст. акт., осложненный гор-танно – трахеальным и пищеводным свищом в области грушевидного сину-са.Патологоанатомический диагноз: Узловой рак левого яичника с метаста-зами в клетчатку малого таза, большой сальник, печень, легкие, парааор-тальные лимфатические узлы и области бифуркации трахеи.Осложнения: Вторичный дерматомиозит. Трофические язвы левой под-мышечной области. Острая двухсторонняя полисегментарная дольково-сливная абсцедирующая пневмония. Пролежни слизистой оболочки верхнейтрети пищевода. Псевдомембранозный колит. Двусторонний гидроторакс.Асцит (500 мл). Жировая дистрофия печени и миокарда. Некротическийнефроз. Отек легких и головного мозга. Сопутствующие: Ожирение 2 степе-ни.Таким образом, имело место расхождение диагноза по основному заболе-ванию. Необходимо указать, что в течение полугода до госпитализации вОКБ, больная 2 раза проходила гинекологическое УЗИ по м/ж в разных ле-чебных учреждениях.Предложения. ДМ у лиц трудоспособного возраста (особенно в старшихвозрастных группах), чаще всего является вторичным на фоне злокаче-ственных опухолей, и может быть одним из первых их проявлений. Такимобразом, больные ДМ, находящиеся на лечении в учреждениях областногоуровня должны в обязательном порядке проходить КТ ОГК, брюшной полостии органов малого таза независимо от жалоб, клинической картины, предше-ствующих результатов обследования в других лечебных учреждениях, нали-чия или отсутствия объективных данных поражения внутренних органов.Подробное описание клинических случаев, патологоанатомическое за-ключение, макро – и микропрепараты представлены по адресу;http://visualrheumatology.ru/svishhi-pishhevoda-i-trahei.html
Неделько Г.Н., Выставкина Е.А.
ФАКТОРЫ РИСКА ПОРАЖЕНИЯ ПОЧЕКПРИ РЕВМАТОИДНОМ АРТРИТЕ
ГБУ РО «Областная клиническая больница №2», г. Ростов-на-Дону, Россия
В последнее время внимание на себя обращает высокая частота наруше-ний функции почек у пациентов с ревматоидным артритом (РА). Почки приРА могут исходно поражаться как вследствие основного заболевания, так иза счет сопутствующей патологии самой почки, проявляющейся при исполь-зовании нестероидных противовоспалительных препаратов. Возможно, РАприводит к снижению функции почек или усугублению уже имеющихсянарушений. Исследования, посвященные изучению патологии почек у боль-ных РА, в которых отражалось бы влияние клинических, лабораторных иинструментальных данных, малочисленны либо противоречивы, что опреде-ляет актуальность последующего изучения данной проблемы.Целью работы явилось изучение распространенности клинических про-явлений поражения почек у больных РА и определение факторов риска по-чечной дисфункции при хроническом заболевании суставов.Основу исследования составили Результаты комплексного клинического,инструментально-лабораторного обследования 100 больных РА (80-ти жен-щин и 20-ти мужчин). Возраст больных в среднем составил 53,71,1 лет.Пациенты клинической группы в зависимости от наличия либо отсутствияклинических признаков поражения почек были разделены на две группы. 1-ю группу составили 64 (64,0%) пациента, у которых почечная дисфункцияотсутствовала, а 2-ю группу – 36 (36,0%) больных с наличием почечнойдисфункции. Внутри 2-й группы среди больных РА выделялись подгруппы сразной вовлеченностью почек в патологический процесс: в зависимости отзначения скорости клубочковой фильтрации (СКФ) (СКФ≥90 мл/мин/1,73м2,СКФ 60-89 мл/мин/1,73 м2 и СКФ 30-59 мл/мин/1,73м2), наличия или отсут-ствия микроальбуминурии (МАУ), протеинурии, уровня экскреции альбуминаи белка с мочой.Изучение функционального состояния почек включало общий анализ мо-чи, анализ мочи по методике Зимницкого, Каковского-Аддиса; определениескорости клубочковой фильтрации по формулам Кокрофта-Гаулта и MDRD,проведение пробы с сухоядением. Для оценки концентрационной способностипочек по результатам пробы Зимницкого вычисляли концентрационный индекс(КИ) по формуле (Батюшин М.М., 2006): КИ = Δуд вес ∙ ДД/НД, где дневной диурез- ДД, ночной диурез – НД, ДД/НД, разница максимального удельного веса мочи к ми-нимальному – Δуд вес. В норме КИ должен составлять более 24,7. Также проводи-ли ультразвуковое исследование почек, оценивали наличие и выраженностьМАУ, протеинурии. При биохимическом анализе крови производилось опре-деление общего белка, альбумина, преальбумина, креатинина, мочевой кис-лоты, соотношения альбумин/креатинин, общего холестерина, липопроте-идов низкой плотности, высокой плотности, триглицеридов, глюкозы. Ре-зультаты исследования были обработаны с помощью компьютерной программы Statistica 7.0 с применением методов описательной статистики, таб-лиц сопряженности, дисперсионного анализа.Результаты. Среди 100 больных клинической группы у 64 (64%) паци-ентов ХБП не выявлялась (1-я группа). Соответственно 36 (36%) больныхвошли во 2-ю группу. Среди больных 2-й группы 1-я стадия ХБП была уста-новлена у 5 (13,9%) пациентов: у 4 пациентов на основании выявления пер-систирующей МАУ, а у одного больного – на основании персистирующегомочевого синдрома в виде эритроцитурии. Незначительное снижение СКФ(60-89 мл/мин/1,73 кв.м) было отмечено у 21 (58,3%) больного РА со 2-йстадией ХБП. У 10 (27,7%) больных с 3-й стадией ХБП имелось умеренноеснижение СКФ в диапазоне 30-59 мл/мин/1,73 кв. м. Нормальная или повы-шенная СКФ (90 и более мл/мин/1,73 кв.м) была определена у 5 пациентов2-й группы. Обращает внимание малый удельный вес больных РА с нормаль-ной или повышенной СКФ (90 и более мл/мин/1.73 кв.м) среди больных 2-йгруппы с ХБП. Возможно, для развития гипофильтрации при РА нехарактерноналичие предшествующей гиперфильтрационной фазы.В общем по группе МАУ наблюдали в 24%, а протеинурия выявлялась в11%. Во 2-й группе пациентов МАУ отмечали у 4 больных с 1-й стадией ХБП,у 20 пациентов со 2-й стадией, а протеинурию – у 1 больного со 2-й и у 10больных с 3-й стадией ХБП. Всего во 2-й группе у МАУ была выявлена у 24(66,7%), а протеинурия – у 11 (30,6%) больных. Cредний уровень креатини-на у больных РА составил 79,4±1,8 мкмоль/л, размах колебания составил от61 мкмоль/л до 135 мкмоль/л. Гиперкреатинемия (мужчины выше 115мкмоль/л, женщины – выше 97 мкмоль/л) наблюдалась в 7 случаях (7%). Упациентов РА мочевина крови колебалась от 2,9 ммоль/л до 13,7 ммоль/л, всреднем составив 5,9±0,2 ммоль/л. Повышение мочевины выше нормы (8,3ммоль/л) выявлялось у 7 больных (7%).На следующем этапе исследования основные показатели, отражающиефункциональное состояние почек, были проанализированы отдельно в груп-пах с наличием или отсутствием ХБП. У больных 2-й группы при присоеди-нении ХБП происходило снижение СКФ на 43,9% (p<0,001), возрастал уро-вень суточной протеинурии в 833,5 раз (p<0,001), содержание креатинина -на 8,9% (p<0,05).Концентрационную способность почек изучали с помощью пробы по Зим-ницкому и посредством пробы с сухоядением. При предварительной оценкеудельного веса мочи по итогам общего анализа было установлено, что в об-щем по группе относительная плотность мочи колебалась от 1005 до 1034,среднее значение составило 1014,2±0,6. В 1-й группе относительная плот-ность мочи варьировала от 1005 до 1034, во 2-й группе – от 1005 до 1025.Средняя величина удельного веса мочи у больных 1-й группы была1013,9±0,79, во 2-й группе – 1014,7±0,77. Среднее значение относительнойплотности мочи у больных 1-й и 2-й групп, а также в общем по клиническойгруппе было немногим меньше нижней границы нормы. По итогам пробы поЗимницкому было установлено, что в общем по группе, а также в 1-й группеконцентрационная и водовыделительная способность почек была в норме. Убольных 2-й группы нарушалась концентрационная способность почек, по-скольку относительная плотность мочи была ниже 1020. Способность к разведению мочи у больных 1-й и 2-й групп была в норме и находилась нижеуровня 1010-1012. Снижение максимального значения относительной плот-ности мочи у пациентов 2-й группы приводило к снижению размаха и свиде-тельствовало об ограничении способности почек к осмотическому концен-трированию мочи. У больных 2-й группы концентрационный индекс был ни-же по сравнению с 1-й группой на 33,5% (p<0,001) (62,2±10,4 против93,6±9,1).У больных 1-й группы проба с сухоядением была в норме: объем порциймочи, собираемой каждые 2 часа, уменьшался до 30-60 мл в порции, суточ-ный диурез снижался до 300-400 мл, относительная плотность мочи нарас-тала до 1028-1032. У больных 2-й группы наблюдалась пониженная концен-трационная способность почек: количество мочи и величина отдельных пор-ций мочи была больше нормальных. Относительная плотность мочи увеличи-валась только до 1020-1022. Содержание форменных элементов в моче убольных РА оценивали по результатам общего анализа мочи и пробы по Ка-ковскому-Аддису. В общем в клинической группе средние величины количе-ства лейкоцитов в поле зрения и их суточное выделение с мочой превышаливерхнюю границу нормы и соответствовали лейкоцитурии. Как известно,лейкоцитурия является маркёром интерстициального нефрита лекарственно-го либо инфекционного генеза при отсутствии инфекции мочевых путей. Уобследованных больных РА инфекции мочевых путей (пиелит, уретерит, ци-стит, уретрита, простатит) отсутствовали, следовательно лейкоцитурия, ве-роятно, была следствием нефрита. При дифференцированном анализе погруппам установлено, что в 1-й группе содержание форменных элементовмочи было в норме, а у пациентов 2-й группы лейкоцитурия была обнаруже-на как при общем анализе мочи, так и при проведении пробы по Каковско-му-Аддису. Содержание эритроцитов и цилиндров было в норме.Проведение дисперсионного анализа с вычислением критерия Фишера иего доверительной вероятности показало, что факторами, которые одновре-менно у больных РА обеспечивают снижение СКФ и МАУ, являются возраст,длительность и степень активности РА, АГ, пульсовое давление, уровень хо-лестерина крови. Развитию одновременного снижения СКФ и протеинурии упациентов с РА способствовали длительность и степень активности РА, АГ,пульсовое давление, уровень холестерина и глюкозы крови (табл.3).У больных РА нами были выявлены изменения в работе клубочковой ча-сти нефрона, снижение концентрационной способности почек, из особенно-стей содержания форменных элементов в моче – лейкоцитурия. Часто у па-циентов с РА выявлялась микроальбуминурия, протеинурия. Все установлен-ные изменения становятся очевидными при исследовании больных РА сосниженной СКФ. В общем по клинической группе, включающей пациентов сРА как с наличием, так и при отсутствии почечного повреждения, выявлен-ные изменения сглаживаются. Этот факт требует разработки алгоритма ран-него выявления почечной дисфункции у пациентов с РА и изучения факто-ров риска почечной дисфункции при хронических воспалительных заболева-ниях суставов. Больные РА являются группой повышенного риска почечнойпатологии, вероятность развития которой возрастает при продолжительном иактивном течении РА. На амбулаторном этапе при диспансерном наблюденииза больными РА необходимо оценивать скорость клубочковой фильтрации, содержание альбуминов и протеинов мочи, концентрацию в крови креатини-на, мочевины, мочевой кислоты, исследовать клеточный состав мочевогоосадка, проводить пробы Зимницкого и пробу с сухоядением. Клиническиесимптомы почечной дисфункции у больных РА при высокой активности ипродолжительности основного заболевания, а также при выявлении артери-альной гипертензии и дислипидемии, должны быть основанием для активно-го диспансерного наблюдения за больными. Такой подход направит усилияклиницистов на своевременное лечение патологии почек у больных РА, чтопозволит продлить жизнь пациентам и улучшить ее качество.Таким образом, среди больных РА распространенность ХБП составляет36% и проявляется снижением СКФ менее 90 мл/мин/1,73м2 в 31%, МАУ в24%, протеинурией в 11%, гиперкреатинемией и повышением мочевины имочевой кислоты крови в 7%, лейкоцитурией, снижением концентрационнойфункции почек по результатам проведения пробы с сухоядением. У больныхРА развитие ХБП и степень выраженности ее проявлений определяется дли-тельностью и активностью основного заболевания, возрастом, наличием ар-териальной гипертензии, дислипидемией и повышением уровня глюкозыкрови.
Ненашева Н.В., Черкашина И.В., Оросс И.В.,Некрасова С.П., Александров А.В.
ДИНАМИКА ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЖИЗНИ У БОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛИТОМ ПОД ВЛИЯНИЕМ ХРОНОМАГНИТОТЕРАПИИ
ФГБУ«НИИ КиЭР» РАМН», Волгоград; Филиал СКК «Вулан» ФГБУ «Россий-ский научный центр медицинской реабилитации и курортологии МинздраваРоссии», Геленджик; ГБОУ ВПО ВолгГМУ Минздрава России, Волгоград
Целью исследования явилось изучение влияния хрономагнитотерапии(комплекс «Мультимаг») на показатели качества жизни (КЖ) у больных ан-килозирующим спондилитом (АС).Материалы и методы. Под нашим наблюдением находилось 98 больныхс диагнозом АС (согласно модифицированным Нью-Йоркским критериям,1984 г.). Больные АС были разделены на три группы, сопоставимые по поло-вому составу, возрасту, длительности и активности заболевания: основную(n=35), группу сравнения (n=33) и контрольную (n=30). Пациенты всехгрупп получали стандартную терапию. Помимо этого, больные основнойгруппы получали дополнительно 10 ежедневных сеансов хрономагнитотера-пии на аппарате «Мультимаг» (Касимовский приборный завод, г. Рязань) иклиматотерапию в условиях климатобальнеологического курорта Геленджик(Россия, Краснодарский край, СКК «Вулан»); больные группы сравнения –не получали реабилитационной терапии, больные контрольной группы –получали на постгоспитальном этапе только сеансы общей магнитотерапии. КЖ больных изучали с помощью общего опросника Short Form 36-item HealthStatus Questionnaire SF-36.Результаты. Анализ показателей качества жизни обследованных намибольных АС по всем шкалам опросника показал низкие значения исследуе-мых параметров. Прежде всего, страдали такие показатели, как ролевоефункционирование, обусловленное физическим состоянием, интенсивностьболи и общее состояние здоровья.В контрольной группе больных АС, получавших курс общей магнитотера-пии в амбулаторных условиях, было отмечено достоверное увеличение пока-зателей, характеризующих физическое здоровье. Изменение остальных по-казателей в этой группе было незначительным. В группе сравнения (боль-ных АС, получавших стандартное санаторно-курортное лечение) наблюда-лось достоверное увеличение значений шкал, отражающих психическое здо-ровье. Незначительное увеличение значений шкал, характеризующих физи-ческий компонент здоровья, было статистически незначимым (p>0,05).Положительная динамика показателей шкал опросника наиболее выра-жена у пациентов основной группы, получавших сеансы хрономагнитотера-пии в санаторно-курортных условиях. Эти больные АС показали достоверноеувеличение значений как по физическому компоненту здоровья, так и попсихическому.Обсуждение. Применение хрономагнитотерапии у больных АС сопро-вождалось улучшением состояния как физического, так и психического здо-ровья. Воздействие магнитного поля обусловило положительную динамикусоответствующих показателей КЖ у больных АС как в основной группе, так ив контрольной. Однако, в группе пациентов, получавших лечение в амбула-торных условиях, наблюдалось более выраженное изменение параметровфизического здоровья. Это можно объяснить близостью к больному методаобщей магнитотерапии в амбулаторных условиях, в то время как в случаесанаторного лечения преемственность лечения ограничена временными рам-ками. В группе сравнения, наоборот, наблюдалось положительное изменениезначений шкал, характеризующих психический компонент здоровья. Этомогло быть связано и с переменой в условиях проживания, иным режимоминсоляции, приобретением положительных эмоций, отсутствием привычныхсоциально-бытовых проблем.При совместном применении различных методов восстановительной тера-пии, включая аппаратные и климатические, возможно воздействие как нафизический, так и на психический компонент здоровья.Выводы. Таким образом, реабилитационные методы лечения способ-ствуют положительной динамике показателей КЖ у больных АС. Изолиро-ванное применение хрономагнитотерапии и совокупности других физиотера-певтических методов в санаторно-курортных условиях на постгоспитальномэтапе оказывает влияние соответственно на параметры физического и пси-хического здоровья больных АС. Наиболее целесообразным является сов-местное использование метода хрономагнитотерапии в комплексе общепри-нятых методов санаторно-курортного лечения, что позволяет получить пози-тивные Результаты в отношении всех показателей КЖ.
Ненашева Т.М.
АТЕРОСКЛЕРОЗ И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ ПРИ ПОДАГРЕ
ГБОУ ВПО Саратовский ГМУ им. В. И. Разумовского, Саратов
Афоризмы Lecorche «Подагрики почти всегда становятся атеросклеро-тическими больными» и Huchard «Подагра для артерий то же самое, чторевматизм для сердца» не теряют своей актуальности, поскольку по даннымэпидемиологических исследований гиперурикемия – это фактор риска ИБСи составляющая метаболического синдрома. Прогностическая значимостьпоражения сердца и сосудов требует знаний указанной патологии, своевре-менного распознавания поражений.Цель исследования: Изучить частоту артериальной гипертензии иатеросклероза при интермиттирующей и хронической подагре.Материал и методы исследований Обследовано 450 больных пер-вичной подагрой, преимущественно мужчин. Средний возраст об-следованных больных подагрой составил 49,24+_0,46 лет, средний возрастпериода начала заболевания – 40,08+_0,48 лет. Диагноз подагры ставилсяна основании клинико-лабораторных проявлений, верифицирован с помо-щью диагностических критериев. Изучалось состояние микроциркуляции,ЭКГ, ЭХОКГ, состояние липидного обмена, дозированная физическая нагруз-ка на велоэргометре, допплерграфия сосудов. По показаниям проводиласьпроба с мембраноактивными веществами, реография, коронарокардиогра-фия. При проведении исследования в качестве контроля использована груп-па сравнения, состоящая из 450 практически здоровых лиц, идентичных повозрасту и половой принадлежности больным подагрой.Полученные Результаты исследования. Сердечнососудистая пато-логия у больных подагрой встречалась достоверно чаще, чем в группе срав-нения (Р<0,001), и была обусловлена главным образом наличием сопутству-ющего атеросклероза. Атеросклероз установлен у 261 больного подагрой(58,4%). Как и следовало ожидать, его частота увеличивалась с возрастом.Однако атеросклероз нередко развивается и у молодых: в возрасте 30-39лет у каждого четвертого и 40-45 почти у каждого второго. Обращает насебя внимание значительное превышение частоты развитая атеросклероза убольных подагрой по сравнению с контрольной группой – в 2,7 раза(Р<0,001). Так в возрасте до 40 лет атеросклероз при подагре развивается в14 раз чаще, 40-49 лет в 11,7 раза чаще, 50-59 лет в 3,2 раза чаще, 60-69лет в 1,8 раза чаще, чем у пациентов группы сравнения.Проведенный анализ показал, что у больных подагрой при наличии ги-перхолестеринемии атеросклероз установлен в 54;2% случаев, при наличииартериальной гипертензии в 57,8%, при сочетании артериальной гипертен-зии и гиперхолестеринемии в 69,8%, а при их отсутствии лишь в 40,2%наблюдений. Это дает основание полагать, что в атерогенезе при подагреиграют роль как артериальная гипертензия, так и сдвиги в липидном обменеи особенно сочетание этих факторов. У больных хронической подагрой в 2 раза чаще выявляется атеросклероз по сравнению с интермиттирующей по-дагрой. Повышение артериального давления отмечено у 273 из 450 больныхподагрой (60,6%), что достоверно чаще, чем в группе сравнения (Р<0,001).Сравнительный анализ частоты артериальной гипертензии у больных по-дагрой и в группе сравнения показал, что при подагре артериальная ги-пертензия встречается достоверно чаще (Р<0,001). В молодом возрастеповышение артериального давления отмечалось в 52,4% наблюдений приподагре, а в группе сравнения лишь в 10,5%. В среднем возрасте артери-альная гипертензия у больных подагрой была в 64,9% случаев. Что касаетсяпожилого и старческого возраста, то в этих возрастных группах артериаль-ная гипертензия регистрировалась соответственно в 63,3% и 75,0% случа-ев. Клиническое течение артериальной гипертензии при подагре не имееткаких-либо отличий от таковых при других симптоматических гипертензиях.Установлена взаимосвязь повышения артериального давления у больныхподагрой с возрастом (r =+0,36), ожирением (r=+0,37), некоторыми показа-телями острофазового воспаления: содержанием церулоплазмина (r=+0,57),ЦИК (r=+0,89), состоянием микроциркуляции – величиной общего конъюнк-тивального индекса (r=+0,32) и показателями, характеризующими состояниепочек: концентрацией креатинина (r=+0,35), мочевины (r=+0,36), уровнемпротеинурии (r=+0,31) и количеством цилиндров в осадке мочи (r= =+0,72)Р<0,05-0,001. Это дает основание расценивать артериальную гипертензиюпри подагре как симптоматическую, связанную с непосредственно подагри-ческим поражением почек, микроциркуляторными нарушениями и завися-щую от наличия сопутствующего атеросклероза, ожирения. При хроническойподагре в 2 раза чаще регистрируется артериальная гипертензия, чем приинтермиттирующей подагре. Обращено внимание на частоту регистрацииЭКГ изменений. Они превышают частоту атеросклероза и артериальной ги-пертензии при подагре. При хронической подагре ЭКГ изменения регистри-руются в 1,8 раза чаще, чем при интермиттирующей. Частота ИБС при по-дагре увеличивается с возрастом. Так в возрасте до 45 лет ИБС развиваетсяу каждого десятого, в среднем у каждого шестого и у лиц старше 60 лет укаждого третьего.Выводы: При подагре даже в молодом возрасте нередко развиваетсяатеросклероз. Развитие артериальной гипертензии при подагре зависит отналичия сопутствующего атеросклероза, ожирения, и может быть обуслов-лено непосредственно подагрическим поражением почек, микроциркулятор-ными нарушениями.
Осипянц Р.А., Алекберова З.С., Богданова М.Х.,Бабина С.М., Панкина М.Д., Рязанцев А.А., Болотов В.Б.,Миронова Е.В., Кириченко А.А.
БОЛЕЗНЬ БЕХЧЕТА – ТРУДНОСТИ ДИАГНОСТИКИ
НУЗ «Научный клинический центр ОАО «РЖД», ФГБУ «НИИР им. В.А. Насоновой», НУЗ Центральная клиническая больница №1 ОАО «РЖД», кафедра терапии РМАПО, Москва, Россия
Болезнь Бехчета (ББ), или болезнь Шелкового пути – системный вас-кулит неизвестной этиологии, характеризующийся рецидивами язвенногопроцесса в ротовой полости и на гениталиях, поражением глаз, суставов,желудочно-кишечного тракта, ЦНС и других органов. Имеет хроническоетечение с непредсказуемыми обострениями и ремиссиями. ББ заболеваютпреимущественно молодые люди в возрасте от 20 до 40 лет: чаще – мужчи-ны (соотношение М:Ж – 2-10:1 в странах, через которые проходил ВеликийШелковый путь).Инициирующая роль отводится комбинации различных факторов: гене-тических (HLA-B5 (*51)), инфекционных (стрептококки, вирус простого гер-песа), белок теплового шока (англ. HSP, Heat shock proteins), иммуннымнарушениям (гиперпродукция интерлейкинов -2, 6, 8, 12, фактора некрозаопухоли – альфа, интерферона – гамма). Трудности диагностики ББ обу-словлены вариабельностью течения, мультиорганным поражением и отсут-ствием специфических иммунологических критериев.Согласно критериям международной группы по изучению ББ (ISGBD,1990) для диагноза ББ необходимо сочетание рецидивирующего афтозногостоматита с двумя из нижеприведенных признаков: язвенного пораженияполовых органов, воспаления тканей глаза (прежде всего увеита), кожныхпроявлений (псевдофолликулит, акнеподобные высыпания, узловатая эри-тема) и положительного теста патергии (появление кожных пустул через 24-48 ч. после прокола иглой).Приводим собственное наблюдение. Больной Р., 32 лет, коренной жительреспублики Дагестан, железнодорожник, поступил в 4-е терапевтическоеотделение НУЗ ЦКБ №1 ОАО «РЖД» 22.08.2013 г. с жалобами на повышениетемпературы тела до высоких фебрильных цифр, головную боль, сухой ка-шель, боль в правой половине грудной клетки при глубоком дыхании.Из анамнеза известно, что с августа 2011 г. возникают эпизоды лихо-радки до фебрильных цифр, одышка при нагрузке, сухой кашель. Неодно-кратно обследовался по месту жительства. Проводилась дифференциальнаядиагностика между пневмонией, специфическим процессом в легких, инфек-ционным эндокардитом, инфарктом миокарда.По данным коронароангиографии значимых изменений коронарных ар-терий выявлено не было. Диагноз оставался неясным. Антибактериальнаятерапия раличными классами препаратов существенного эффекта не прино-сила. В дальнейшем манифестировала пиодермия, присоединились интенсивные головные боли, не купирующиеся анальгетиками. С июня 2013 г. -стойкое повышение температуры тела с максимальными суточными значени-ями до 39оC, появилась боль в правой половине грудной клетки при глубо-ком дыхании, усилился сухой кашель. Госпитализирован в НУЗ ЦКБ №1 ОАО“РЖД” с диагнозом: “Лихорадка неясного генеза”.При поступлении общее состояние средней тяжести. Температура тела –38,5оС. Единичные пустулезные высыпания на кожных покровах спины. Бо-лезненные афты на слизистой полости рта. Дыхание везикулярное, ослаб-ленное в нижних отделах. По остальным органам – без особенностей. Придетальном расспросе был подтвержден рецидивирующий характер афтозногостоматита.Результаты лабораторного обследования: повышение острофазовыхбелков (СОЭ – 49-63 мм/ч; СРБ – 50-230 мг/л), анемия (гемоглобин – 97 г/л),лейкоцитоз (16 тыс/мкл), повышение активности печеночных трансаминаз(АСТ- 54 ед/л, АЛТ- 145,9 ед/л), позитивность по анти-HCV (HCV– RNA -негативная). АНФ, РФ, АТ к инфекционным агентам и паразитам – отрица-тельные. Посев крови на стерильность – рост микрофлоры не выявлен. Ана-лиз спинно-мозговой жидкости – лимфоцитарный плеоцитоз (46/4), белок –0,66. Обращали на себя внимание, приведенные ниже данные инструмен-тального обследования.Эхо-КГ: в правом желудочке визуализированы плотные подвижные эхо-структуры: над медиальной створкой трикуспидального клапана (ТК) разме-ром до 2,5 см (пролабирующая в выходной тракт правого желудочка); надлатеральной створкой 2,1 х 0,9 см; у основания мышц латеральной створки– 2 структуры 1,0 и 0,7 см, вероятно –вегетации. Утолщение стенок левого иправого желудочков. Регургитация на ТК +2+3. Систолическое давление влегочной артерии 35-38 мм рт. ст. Уплотнение и утолщение листков пери-карда, небольшое количество жидкости в перикардиальной области (около100 мл).Рентгенография органов грудной клетки: в нижней доле правого легкого– S9-S10 сегментах – негомогенное понижение пневматизации за счет ин-фильтрации легочной ткани. Бронхо-сосудистый рисунок усилен. Плевраль-ные синусы свободны.МСКТ органов брюшной полости с в/в болюсным контрастированием: КТ –признаки гепатоспленомегалии, умеренные проявления лимфаденопатиибрыжеечных лимфоузлов.МСКТ органов грудной клетки: участки неравномерной ифильтрации па-ренхимы преимущественно субплевральной локализации (S6,10 – справа;S5, 9 – слева) неоднородной структуры с нечетким контуром.МСКТ сердца (с контрастированием): тромбы выносящего тракта правогожелудочка, полости правого желудочка, ушка правого предсердия; дефектыконтрастирования субсегментарных ветвей легочной артерии в базальныхотделах правого легкого, уплотнение легочной паренхимы справа (S10) ислева (S8-9) – инфаркт-пневмония как следствие тромбоэмболии легочнойартерии (ТЭЛА). МРТ головного мозга – патологических изменений очагового или диффуз-ного характера в веществе головного мозга не выявлено; хронический пра-восторонний гайморит.В связи с развитием диареи на фоне болевого синдрома в животе былапроведена ректосигмоидоскопия. Выявлены множественные изъязвленияпрямой кишки, ректосигмоидного отдела и сигмовидной кишки.Офтальмолог: “плавающая” деструкция стекловидного тела. Невролог:нельзя исключить признаки серозного менингита. Тест патергии – сомни-тельный (1 папула из 4 х).Сочетание рецидивирующего афтозного стоматита, пустулезных высыпа-ний на кожных покровах, вовлечение глаз, ЦНС и кишечника позволили за-подозрить ББ. Кроме того, наличие тромбов выносящего тракта правого же-лудочка, полости правого предсердия и инфаркт – пневмония отнесены кпоражению сосудов в рамках васкуло-бехчета.Диагноз ББ был подтвержден в ФГБУ «НИИР им. В.А. Насоновой». Лече-ние метипредом перорально в дозе 16 мг/сут, азатиоприном 100 мг/сут. при-вело к улучшение состояния: нормализовалась температура тела, купирова-лись головные и абдоминальные боли, восстановился стул, регрессировалилабораторные признаки воспаления (СОЭ – 11 мм/ч, СРБ-1,2 мг/л) и цитоли-тического синдрома (АСТ – 13 ед/л, АЛТ – 36,6 ед/л).Обсуждение. Неоднозначность клинической картины (мультиорганностьпоражения), стойкий характер лихорадки, длительное повышение острофа-зовых маркеров воспаления и неэффективность проводимой антибактери-альной терапии явились причиной поиска системного воспалительного забо-левания. Тщательный сбор анамнеза, анализ клинической картины и пра-вильная интерпретация инструментальных методов визуализации во многомопределяют своевременную диагностику и назначение адекватной терапииББ.
Полякова Ю.В., Симакова Е.С., Сивордова Л.Е.,Заводовский Б.В., Чернов А.С.
АДИПОКИНЫ – ПОТЕНЦИАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ ДЛЯ ЛЕЧЕНИЯ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,РФ
В последние годы активно изучается роль жировой ткани, которая функ-ционирует как сложная многокомпонентная регулирующая система, выделя-ющая большое количество биоактивных веществ. В клетках жировой тканисинтезируется множество адипокинов и классических провоспалительныхфакторов: IL-1, IL-6, IL-8, TNF-α и др. Адипокины влияют на ряд важных процессов в организме: на метаболизм липидов и глюкозы, ангиогенез,апоптоз клеток, опухолевый рост, костный обмен, обмен хондроцитов, вли-яют на выработку других активных компонентов гомеостаза суставного хря-ща. Все эти компоненты могут активировать дегенеративные процессы в су-ставе и вызывать в нем воспалительные реакции.Ревматоидный артрит (РА) – хроническое воспалительное заболеваниесоединительной ткани с преимущественным поражением суставов по типуэрозивно-деструктивного прогрессирующего полиартрита, сопровождающее-ся нарушениями гуморального и клеточного иммунитета, которые придаютревматоидному воспалению характер иммуноопосредованного, с безудерж-ной пролиферацией синовиоцитов. Механизмы гиперплазии синовиальнойоболочки сопровождаются появлением паранеопластических характеристику синовиальных макрофагов и фибробластов в виде экспрессии протоонко-генов и особой ее инвазивности. Активация синовиальных фибробластовприводит к высвобождению таких факторов воспаления, как интерферон-β,интерлейкин-6, висфатин, хемокины. Результаты лечения РА в целом неудо-влетворительны. Ряд пациентов (около 30%) не отвечают должным образомна комбинации базисных противовоспалительных препаратов и генно-инженерную терапию биологическими агентами. Внимание ученых сосредо-точено на растущем числе новых цитокинов, которые принимают важноеучастие в воспалительном ответе и могут быть использованы как цели тера-певтического воздействия.Остеоартроз (ОА) – наиболее частое и распространенное заболевание су-ставов, ассоциированное с возрастом, приводящее к развитию функцио-нальной недостаточности и последующей потере трудоспособности у взрос-лых. Современная концепция патогенеза ОА предполагает принципиальнуюроль хронического синовиального воспаления, без которого невозможнопрогрессирование деструкции хряща и которое имеет немалое значение дляразвития боли. За последние десятилетия достигнут значительный прогрессв изучении этиологии и патогенеза заболевания, однако многие аспекты досих пор остаются спорными.Цель: Изучить клинико-патогенетическое значение уровня висфатина всыворотке крови больных остеоартрозом (ОА) и ревматоидным артритом(РА).Материалы и методы: Под нашим наблюдением находилось 80 пациен-тов с ОА, 140 – с РА и 60 практически здоровых лиц, составивших группусравнения. Больные ОА были в возрасте от 36 до 78 лет (55,7±1,2), больныеРА – от 32 до 74 лет (49,4±0,8). Уровень висфатина в сыворотке крови опре-делялся непрямым твердофазным иммуноферментным методом с использо-ванием коммерческой тест системы (RaiBiotech, cat№ EIA-VIS-1).Результаты: Повышенный уровень висфатина в сыворотке крови былобнаружен у 23 пациентов с ОА (29% случаев) и у 118 пациентов с РА(84%). Повышенный уровень висфатина в сыворотке крови при ОА составил4,18±1,79 нг/мл, при РА – 6,27±0,18 нг/мл, что достоверно выше показате-лей здоровых лиц. Для выяснения клинико-патогенетического значенияопределения уровня висфатина все пациенты с ОА были разделены на 2 группы: I группа (23 пациента) с повышенным уровнем висфатина в сыво-ротке крови, и II группа (57 человек) – с нормальной концентрацией висфа-тина. Пациенты I группы достоверно чаще имели следующий симптомоком-плекс болезни: полиостеоартроз с наличием вторичного синовита, с продол-жительностью заболевания более 5 лет, рентгенологической стадией III и IV,функциональной недостаточностью суставной системы II-IV.Все пациенты с РА так же были разделены на 2 группы: I группа (118 па-циентов) с повышенным уровнем висфатина в сыворотке крови, и II группа(22 человека) – с нормальной концентрацией висфатина. Пациенты I груп-пы достоверно чаще имели более высокую степень активности по индексуDAS28, серопозитивность по РФ, более высокий уровень С-реактивного бел-ка (СРБ), СОЭ, внесуставные проявления заболевания.Выводы: Таким образом, повышенный уровень висфатина достоверночаще имели пациенты с ОА, протекающим с выраженными клинико-лабораторными и рентгенологическими изменениями. При РА отмечалсязначительно больший процент больных с повышенным уровнем висфатина(84,3% при РА и 29% при ОА), отмечалась корреляция уровня висфатина состепенью активности РА. Учитывая участие висфатина в стимуляции выра-ботки провоспалительных цитокинов, можно предположить, что висфатинможет являться патогенетическим фактором, способствующим развитию си-новита при ОА и поддерживающим активность патологического процесса приРА.Данные большого количества исследований предполагают возможнуюроль висфатина в регуляции уровней провоспалительных цитокинов, вклю-чая TNF-α , IL-1β и IL-6. Висфатин играет важную роль в патологии воспали-тельных заболеваний, дальнейшее изучение молекулярных механизмов ак-тивации цитокинов может привести к разработке новых терапевтическихсредств для лечения ревматических заболеваний. В эксперименте блокаторывисфатина приводят к быстрому торможению воспалительных процессов,давая надежду на разработку новых эффективных методов лечения ревма-тических болезней.
Русанова О.А., Парамонова О.В., Емельянов Н.И.,Герусова Н.М., Гонтарь И.П.
ИЗУЧЕНИЕ ТИРЕОИДНОГО СТАТУСА У БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ В СОЧЕТАНИИ С ПОРАЖЕНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО В ВолгГМУ Минздрава России, г. Волгоград, Россия
В настоящее время накопленные сведения о содержании уровня тирео-идных гормонов в плазме крови больных системной красной волчанкой (СКВ) весьма противоречивы, а их диагностическое значение при данномзаболевании до настоящего времени достаточно дискутабельно.Цель исследования. В нашем исследовании мы попытались оценить ди-агностическую ценность определения концентрации тиреотропного гормона(ТТГ), тироксина и трийодтиронина (Т4 и Т3) и антител к ним у больных СКВ.Материалы и методы. Нами обследовано 22 пациента с сочетанной па-тологией – СКВ и тиреоидные заболевания. Все пациенты были женщины, ввозрасте от 21 до 77 лет (средний возраст составил 55,16±15,3 лет). Про-должительность СКВ – 5,08±3,29 лет. Средняя продолжительность мани-фестного заболевания щитовидной железы (ЩЖ) составила 3,011,74 года,что в большинстве случаев, свидетельствует о развитии/обострении тирео-идной патологии на фоне уже имеющейся СКВ.Результаты и Обсуждение. Среднее содержание свободного тирокси-на и тиреотропного гормона в целом по группе больных СКВ имело тенден-цию к повышению. Содержание тиреоидных гормонов и ТТГ у больных безпоражения щитовидной железы, было сопоставимо по уровню со среднимзначением параметров у больных СКВ в целом. У больных с аутоиммуннымтиреоидитом уровни Т3 и ТТГ были выше контроля, хотя и недостоверно, длясв. Т4 – сопоставим с контролем. При наличии узлового, диффузного и сме-шанного зоба отмечалось значимое повышение св. Т3; св. Т4 также был по-вышен (достоверно – у больных диффузным и смешанным зобом), уровеньТТГ имел тенденцию к снижению, отражая тенденцию к гиперфункции ЩЖ. Упациентов с гипотиреозом отмечалось закономерное колебание тиреоидныхгормонов, Т4 и Т3 несколько снижались, ожидаемо достоверно был повышенТТГ.Количество ТТГ и св. Т4 у больных с высокой степенью активности забо-левания на момент поступления были несколько выше, чем в контрольнойгруппе и у больных с I и II степенью активности патологического процесса,но эта разница не была статистически достоверной (р>0,05). Найденныенами изменения уровня тиреоидных гормонов у больных СКВ соответствуютимеющимся представлениям об их содержании в плазме крови при даннойпатологии, описанных в последних работах 1998-2011 гг.Значения антитиреоидных антител (к тиреоглобулину и тиреопероксида-зе) в целом по группе СКВ были выше контроля (АТ к ТГ – 57,5±147,9 Ед/мл,АТ к ТПО- 97,0±239,1 мЕд/мл), однако недостоверно, очевидно, вследствиезначительных колебаний значений. Ожидаемый достоверный рост при срав-нении с контролем АТ к ТГ и АТ к ТПО был в группе больных с поражениемЩЖ. Тем не менее, у пациентов с СКВ, не имевших изменений ЩЖ, такжеимелось увеличение АТ к ТГ и АТ к ТПО, хотя достоверности разница с кон-тролем не достигла. Антитела к ТГ были повышены у 10 (23,2%), к ТПО чаще– у 17 (39,5%). Одновременный рост обоих групп антител был у 7 (16,2%)из 43 больных СКВ без какой-либо патологии ЩЖ.Пациенты с повышенным уровнем антитиреоидных антител имели досто-верно более низкую (p=0,024) давность СКВ; чаще имелось острое (p=0,04)и подострое (р=0,063), достоверно реже – хроническое течение СКВ(р=0,038). Анализ содержания антитиреоидных антител у больных СКВ в зависимости от клинических характеристик болезни показал, что с увеличе-нием степени активности наблюдается отчетливое увеличение и содержанияантител, как к ТГ, так и к ТПО. Особенно значительное и достоверное(р=0,01) увеличение АТ к ТПО наблюдалось при III-ей степени активности.Описанные клинико-лабораторные и иммунологические особенности СКВбез поражения ЩЖ, но с наличием повышенного титра антитиреоидных ан-тител, корреляция уровня АТ к ТПО с ТТГ (r=0,34; p=0,01), очевидно, позво-ляют предполагать возможность дальнейшего возникновения аутоиммунногопоражения ЩЖ.Выводы. По полученным данным имела место зависимость между выра-женностью функции щитовидной железы, с одной стороны и активностьюпроцесса, длительностью ревматического заболевания, частотой егообострения, с другой. Отчетливо выраженные изменения нам удалось вы-явить у больных СКВ при анализе одного из показателей тиреоидной функ-ции — уровня трийодтиронина в сыворотке крови, снижение которого былообнаружено у 68,4% больных. Уровень Т3 статистически достоверно былснижен у больных СКВ с высокой активностью процесса. Наибольшее сниже-ние уровня Т3 в сыворотке крови также отмечалось при длительном течениизаболевания и частых обострениях его. Что касается уровня тироксина, тоего количество повышалось пропорционально снижению трийодтиронина изависело также от активности процесса и длительности патологическогопроцесса.
Савелова Е.Е., Майко О.Ю.
ЗАВИСИМОСТЬ ЭФФЕКТИВНОСТИ ТЕРАПИИ БОЛЬНЫХ ОСТЕОАРТРОЗОМ ОТ РЕНТГЕНОЛОГИЧЕСКОЙ СТАДИИ ПРОЦЕССА
ГБОУ ВПО Оренбургская государственная медицинская академия, г.Оренбург
Цель: оценить клиническую эффективность терапии больных остеоарт-розом (ОА) с применением хондроитин сульфата (ХС) и его комбинации сглюкозамин гидрохлоридом (ГГ) в зависимости от рентгенологической стадиизаболевания.Материалы и методы: Под наблюдением в амбулаторных условияхнаходилось 120 пациентов ОА, преимущественно женщин (91%), с пораже-нием коленных (n=80) и тазобедренных суставов (n=40), выраженностьюболевого синдрома по визуально-аналоговой шкале (ВАШ) ≥ 40 мм и необ-ходимостью приема нестероидных противовоспалительных препаратов(НПВП). Средний возраст пациентов составил 58 (54; 60) лет. Средняя дли-тельность ОА – 7 (5; 12) лет. Диагностирована II рентгенологическая стадияОА по Kellgren-Lawrence у 64 (54%) пациентов, I cтадия – у 34 (28%) и II – у22 (18%). По данным ультразвукового исследования суставов преобладалосочетание признаков синовита и тендинита в 65% случаев. В зависимости отпроводимой терапии было сформировано 2 группы (по n=35): пациенты 1 гр. получали ХС (структум) по 1000 мг/сут. в течение 3-х месяцев, больные 2гр. – ХС в комбинации с ГГ (артра) по 1000 мг х 2 р/сут. в течение 3-хнедель, затем 1 р/сут. до 3-х месяцев по 2 курса терапии в течение 12 меся-цев. Дополнительно назначался НПВП (найз) 200 мг/сут. в течение 2-хнедель. Динамическое наблюдение осуществлялось каждые 3 месяца в тече-ние 12 месяцев с оценкой критериев эффективности: изменение интенсив-ности боли при ходьбе и в покое по ВАШ, динамика функционального индек-са Лекена и параметров качества жизни (КЖ) по анкете EuroQol-5D, суточ-ной потребности в НПВП.Результаты и обсуждение: При проведении корреляционного анализас Целью выявления взаимосвязей рентгенологической стадии ОА со значе-ниями альго-функциональных индексов и параметрами КЖ у больных ГА иКА обеих групп было обнаружено, что прогрессирование стадии заболева-ния соответственно сопровождается ухудшением клинических показателей ипараметров КЖ как исходно, так и на фоне лечения (r=0,40-0,54; р<0,005). Втечение 12 месяцев наблюдения у больных обеих групп, получавших курсо-вое лечение с использованием структума или артры отмечалась волнообраз-ная динамика изменения клинических показателей и параметров КЖ с до-стижением достоверно выраженного клинического эффекта по окончании 1-го и 2-го курсов трехмесячной терапии и постепенным их ухудшением черезнекоторое время. Причем, наиболее статистически значимая положительнаядинамика выявлена на фоне терапии обоими препаратами у пациентов с I иII ст. ОА, чем III ст. (р<0,05).При I ст. клиническая эффективность структума и артры была сопостави-ма. Так, интенсивность боли по ВАШ сократилась на 60% в 1 гр. и 65% во 2гр., показатели функциональной недостаточности суставов по индексу Леке-на на 62% и 70%, параметры КЖ улучшились на 40% и 45% соответственнопо группам (р<0,05), отказались от приема НПВП 75% и 82% больных соот-ветственно по группам (р<0,05). Причем, через 12 месяцев от началанаблюдения сохранялся более выраженный эффект последействия, по боль-шинству показателей, от курсовой терапии артрой, чем структумом.У пациентов со II ст. ОА также выявлена сопоставимая эффективностьтерапии обоими препаратами. Так, болевой синдром по ВАШ уменьшился55% в 1 гр. и 50% во 2 гр., значения функционального индекса Лекена на52% и 48 %, улучшились параметры КЖ по анкете EQ-5D на 42% и 48% со-ответственно по группам (р<0,05), удалось отказаться от приема НПВП 60%и 65% больных соответственно по группам (р<0,05). Эффект последействиябыл сопоставимый по окончании 2-х курсов терапии структумом и артрой,причем, менее выраженным, по сравнению с I ст. ОА.При III ст. ОА определен достоверно менее выраженный положительныйэффект курсовой терапии с использованием структума и артры, по сравне-нию с I и II ст. ОА. Так, показатели боли по ВАШ сократились на 30% в 1 гр.и 27% во 2 гр., параметры КЖ на 34% и 30%, уменьшились функциональ-ные ограничения по индексу Лекена на 32% и 28% соответственно по груп-пам (р<0,05). Достоверно большее количество больных нуждалось в посто-янном и периодическом приеме НПВП, чем при I и II ст.. Так, полностью уда-лось отказаться от приема этих препаратов только около 1/3 больных в обеих группах, что было достоверно хуже по сравнению с I и II ст. Через 12месяцев от начала наблюдения клинические показатели у больных обеихгрупп ухудшались и по некоторым показателям приближались к исходнымзначениям, т.е. эффект последействия при III ст. был непродолжительный ислабо выраженный. Через 12 месяцев от начала лечения суточные дозыпринимаемых НПВП увеличились у больных обеих групп, причем, сохраня-лась зависимость потребляемой дозы от стадии ОА.Выводы: Таким образом, применение 12-месячной курсовой терапии сиспользованием препаратов, содержащих хондроитин сульфат (структум) иего комбинацию с глюкозамин гидрохлоридом (артра) у больных остеоартро-зом I-II cтадии в амбулаторных условиях показало сопоставимую эффектив-ность по влиянию на клинические показатели и параметры КЖ с сохранени-ем более выраженного эффекта последействия терапии с применением арт-ры. При III стадии ОА эффект был кратковременным и слабовыраженным поосновным клиническим показателям и параметрам качества жизни и не зави-сел от принимаемого препарата.
Сатыбалдыев АМ, Акимова ТФ
ДЛИТЕЛЬНОЕ НАБЛЮДЕНИЕ БОЛЬНЫХРЕВМАТИЧЕСКОЙ ПОЛИМИАЛГИЕЙ В КЛИНИЧЕСКОЙПРАКТИКЕ. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
ФГБУ «НИИР им. В.А.НАСОНОВОЙ» РАМН, г. Москва, Россия.
Цель: изучение течения ревматической полимиалгии в клиническойпрактике при многолетнем наблюдении.Материал и методы. Из наблюдаемых нами 111 больных ревматическойполимиалгией (РП) была выделена группа из 35 больных с длительностьюзаболевания от 2 лет и более и сроками наблюдения от 2 лет до 10 лет(мужчин – 9, женщин – 26, средний возраст – 61,5, длительность заболева-ния до взятие под наблюдение составляла 3,9 месяца, средний срок наблю-дения 3,7 года). Диагноз ревматической полимиалгии устанавливался наосновании диагностических критериев, предложенных Европейской группойпо изучению РП (Bird H.A. et al. 2005).Наряду с ревматической полимиалгией у больных выявлены следующиесопутствующие заболевания. Выраженный атеросклероз с поражением серд-ца и сосудов и ИБС наблюдался у 10 больных (у 2 из них проводилось стен-тирование коронарных артерий и у 2 – шунтирование в анамнезе, у 2 – ин-фаркт миокарда, 3 пациента перенесли ишемический инсульт); сахарныйдиабет 2 типа – у 3 больных, выраженный остеопороз – у 10 больных (скомпрессией позвонков –у 2, перелом шейки бедра – у 1), бронхиальнойастмой страдала 1 пациентка, разрыв мышцы – у 2. Глаукома, язвенная бо-лезнь желудка – по 1, туберкулез легких в анамнезе – у 2. Злокачественныеопухоли выявлены у 3 больных (у 2-х рак предстательной железы, у 1-й – рак мочевого пузыря). Таким образом, наблюдаемая группа больных явля-ется рафинированной и наблюдается в связи с наличием заболеваний, за-трудняющих лечение.Лечение. Все больные получали глюкокортикоиды (ГК), начальная дозасоответствовала 7,5-20 мг/сут преднизолона (ср.доза 12,5 мг/сут). Доназначения ГК пациенты, как правило, принимали НПВП без достаточногоэффекта. В процессе дальнейшего ведения больных необходимость в приемеНПВП отпадала.При выборе начальной дозы ГК учитывалась сопутствующая патология:гипертоническая болезнь, ИБС, сахарный диабет, остеопороз, язвенная бо-лезнь желудка и другие. Помимо ГК назначались препараты ацетилсалици-ловой кислоты в низких дозах для профилактики тромботических осложне-ний, при выявлении сниженных показателей минеральной плотности костейдо уровня остеопороза или при длительном приеме ГК назначались антире-зорбтивные средства. По показаниям назначались статины, ингибиторы про-тонной помпы или другая сопутствующая терапия.Результаты лечения. Лечение завершилось успешно у 9 из 35 (26,5%)пациентов, при наблюдении до 3 лет – у 2 из 13 больных (15%),от 3 до 5лет – у 8 из 17 больных (47%). Более 5 лет наблюдались 5 больных, у кото-рых отмечено хроническое течение заболевания.Снижение суточной дозы ГК начиналось после достижения стойкого редуци-рования симптомов РП и нормализации СОЭ и СРБ (обычно через 3-4 неделиот начала терапии). Рецидивы, включая повторные, происходили у 10 (29%) пациентов в течение всего последующего периода наблюдения ( от1,5 мес до 30 месяцев от начала терапии ГК, в среднем через 5,2 мес), в ос-новном при снижении дозы метипреда. Кроме того 8 пациентов самостоя-тельно отменяли ГК в сроки от 1,5 до 5 месяцев, что приводило к рецидивам.Снижение дозы препарата производилось не чаще, чем 1 мг/сут 1 раз в 1,5 –2 месяца при отсутствии клинических симптомов РП и наличии нормальныхпоказателей СОЭ и СРБ. Средняя суточная доза ГК у больных, продолжаю-щих лечение, составила в конце наблюдения 3,5 мг (в эквиваленте к пред-низолону).Обсуждение. Настоящая когорта больных РП сформировалась в резуль-тате отбора больными лечащих врачей в связи со сложностью их ведения инеобходимостью длительного наблюдения. Большинство больных страдалиполиморбидностью, которая требовала более тщательного контроля их со-стояния, назначения индивидуально подобранного лечения и контроля запроводимой терапией. Проведенное исследование показало, что подход квыбору терапии этих больных в реальной практике клиницистов долженбыть индивидуализированным.Выводы.Больные с диагнозом ревматическая полимиалгия нуждаются в назначе-нии и длительном применении ГК, а также длительном наблюдении и кон-троле ревматолога. Начальная доза ГК 10-15 мг в сутки (в перерасчете напреднизолон). Преждевременное снижение дозы ГК часто приводит к обострению РП(рецидиву симптомов)Тяжелая сопутствующая патология пожилого и старого возраста требуеттщательного контроля и наблюдения за результатами терапии ГК. В связи свероятностью прогрессирования атеросклероза и его осложнений (инсульт,инфаркт миокарда и др), а также артериальной гипертонии, нарушения уг-леводного, липидного обменов, усиления тромбообразования и остеопорозанеобходимо проведение превентивной терапии этих состояний, а при их раз-витии –лечения.
Сизова Л.В.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЖИЗНИ ПАЦИЕНТОВ НА РАЗНЫХ СТАДИЯХ РЕВМАТОИДНОГО АРТРИТА ПО АНКЕТЕ QOL-RA SCALE
ГБОУ ВПО «Оренбургская государственная медицинская академия» Мин-здрава России, Оренбург, Российская Федерация
Цель работы – сопоставить показатели качества жизни (КЖ) на разныхстадиях ревматоидного артрита (РА) в сравнительном аспекте по анкетеQOL-RA Scale.Материал и методы. Для анализа использованы данные 114 больных с«ранним РА» в возрасте [Ме (Q25-Q75)] 50,5 (47-54,75) лет, а также данные50 пациентов (группа сравнения) с устоявшимся (развернутой и позднейстадиями) РА в возрасте 53 (48-57) лет; 90% участников исследования –женщины. Медиана длительности раннего РА составила 4,4 (2-7,25) месяца,устоявшегося РА – 5 (3-12) лет. Диагноз РА верифицировали по классифика-ционным критериям ACR (1987). Всем пациентам проводили общепринятое вревматологии обследование. В обеих группах преобладала III степень ак-тивности заболевания по индексу Disease Activity Score 28 (DAS28) и нару-шения жизнедеятельности II и III функциональных классов (p<0,05). Вгруппе раннего РА в суставах превалировали рентгенологические измененияI стадии, в группе сравнения – II стадии (p<0,05). Для сравнительной оцен-ки показателей КЖ применяли валидную русскоязычную версию опросникаQuality of Life-Rheumatoid Arthritis Scale (QOL-RA Scale) – Шкала КачествоЖизни-Ревматоидный Артрит. Путем прямого опроса были получены ответыпациентов на 8 вопросов (пунктов): о влиянии физической способности, по-мощи от семьи и друзей, суставной боли, эмоционального напряжения, здо-ровья, артрита, взаимоотношений с семьей и друзьями, настроения в связи сРА на качество их жизни. Каждый пункт больной оценивал от 0 до 10 бал-лов, где 0 баллов соответствовали «очень плохому», а 10 баллов – «превос-ходному» КЖ. Среднее арифметическое суммы оценок КЖ по 8 пунктампредставлялось в качестве «суммарной шкалы» QOL-RA Scale. Статистиче-скую обработку данных проводили в программе «Statistica 6.0» (StatSoft, Inc., США, 2001) с применением методов вариационной статистики, U-критерия Манна-Уитни, корреляционного анализа.Результаты. Лучшие оценки КЖ (медианы – 6-8 баллов) в группах ран-него и устоявшегося РА были даны «взаимоотношениям с семьей и друзья-ми» и «помощи от семьи и друзей». Худшие показатели (медианы – 3-4 бал-ла) имели пункты «артрит» и «суставная боль», а в группе сравнения допол-нительно еще и пункт «здоровье» (p<0,05). Статистически значимые разли-чия между группами по оценкам QOL-RA Scale отсутствовали.Изучение корреляционных связей для «суммарной шкалы» опросникаQOL-RA Scale у пациентов с ранним РА показало наличие обратной связимежду показателями этой шкалы и возрастом, прямой связи оценок шкалы суровнем образования. Определялись слабые и умеренные обратные корре-ляционные связи показателей «суммарной шкалы» опросника с длительно-стью скованности, числом болезненных и припухших суставов индексомРичи, оценками состояния здоровья по визуальной аналоговой шкале паци-ентом и врачом (R от -0,23 до -0,40; p<0,05). Статистически значимая кор-реляционная связь между «суммарной шкалой» QOL-RA Scale и инструмен-тальными характеристиками (число эрозий в пястно-фаланговых суставах поданным ультразвукового исследования суставов, рентгенологическая стадияРА) отсутствовала. Корреляционные связи между показателями КЖ и такимилабораторными параметрами, как: уровень гемоглобина, лейкоцитов в пе-риферической крови, скорость оседания эритроцитов, С-реактивного белка убольных ранним РА также не были статистически значимыми. Серопозитив-ность артрита не оказывала статистически значимого влияния на оценки КЖ.Анализ корреляционных связей между пунктами QOL-RA Scale и клиниче-скими показателями в группе сравнения выявил статистически значимыеотрицательные корреляционные связи между длительностью скованности иоценками влияния артрита и суставной боли (R=-0,36 и R=-0,43 соответ-ственно; p<0,01), активности заболевания по DAS28 и влиянием артрита наКЖ (R=-29, p<0,05). Пациенты с высоким функциональным классом наруше-ний жизнедеятельности имели более низкие оценки по пунктам «суставнаяболь», «артрит», «эмоциональное напряжение» и «суммарной шкале» QOLRAScale (R составил от -0,34 до -0,40, p<0,05).Обсуждение. Социальные и психологические аспекты КЖ пациентов сразными стадиями РА – взаимоотношения с семьей и друзьями и помощь отсемьи и друзей страдали в меньшей степени, чем показатели физическогосостояния (пункты «суставная боль», «артрит» в обеих группах, «здоровье»– в группе устоявшегося РА). На ранних стадиях РА молодые и более образо-ванные люди выше оценивали КЖ. Наличие большого числа корреляцион-ных связей с клиническими параметрами у больных с разными стадиями РАподтверждает валидность анкеты QOL-RA Scale. Однако отсутствие корреля-ционных связей между показателями КЖ и лабораторными и рентгенологи-ческими данными указывает на сохраняющуюся необходимость учета по-следних не зависимо от оценки КЖ.Выводы. Таким образом, в целом между показателями QOL-RA Scale вгруппах раннего и устоявшегося РА статистически значимые отличия отсут- ствуют. Наиболее значительное ухудшение оценок «суставной боли» и «арт-рита», а также наличие корреляционных связей между показателями КЖ иосновными клиническими параметрами свидетельствует о том, что этотопросник является специфическим для исследования КЖ пациентов с РА наразных стадиях болезни.
Симакова Е.С., Ковех А.А., Королик О.Д., Фофанова Н.А.,Заводовский Б.В.
ЭФФЕКТИВНОСТЬ АЛФЛУТОПА И ГЛЮКОЗАМИНСУЛЬФАТА ПРИ ГОНАРТРОЗЕ В ЗАВИСИМОСТИ ОТ УРОВНЯ АНТИТЕЛ К ХОНДРОИТИН СУЛЬФАТУСУСТАВНОГО ХРЯЩА
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
Для лечения остеоартроза в качестве базисной терапии применяютсяструктурно-модифицирующие препараты, однако не всегда лечение оказы-вается эффективным. Возможно искусственное повышение концентрациикомпонентов хряща, входящих в состав этих препаратов, может провоциро-вать развитие иммунологических реакций.Целью исследования являлось повышение качества лечения остеоартрозаи контроля эффективности проводимой терапии путем разработки индивиду-альных показаний к назначению алфлутопа и глюкозамин сульфата в зави-симости от выраженности антителообразования к хондроитин сульфатухряща в сыворотке крови. Эффективность лечения больных оценивалась спомощью клинико-лабораторных и иммунобиохимических показателей. Диа-гноз устанавливали по критериям, разработанным в Институте ревматологииРАМН и клинической классификацией. Обработка результатов проводилась спомощью программного пакета “Statistica for Windows 6.0”.Под нашим наблюдением находилось 120 больных гонартрозом в воз-расте от 21 до 65 лет, из которых 71 женщина (59,17%) и 49 мужчин(40,83%). Средний возраст женщин с ОА составил 47,284,49 лет, мужчин -49,184,73 лет и был сопоставим с группой здоровых лиц (t=0,54, p>0,05;t=0,29, p>0,05 соответственно). Средняя длительность заболевания соста-вила 9,41,76 лет: менее 1 года была у 9 пациентов (7,5%), 1-5 лет у 43больных (35,83%), 6-10 лет – у 38 (31,67%), 11-15 лет – у 21 (17,5%), аболее 15 лет – у 9 человек (7,5%). У 51 больного (42,5%) были клиническиепроявления синовита, у 69 пациентов (57,5%) заболевание протекало безсиновита. При длительности заболевания до 5 лет явления синовита встре-чались чаще (31 больной из 51 (60,78%)), а свыше 5 лет – заболевание ча-ще протекало без синовита (48 больных из 69 (69,57%)). I стадия по критериям Kellgren-Lawrence наблюдалась у 36 (30%) больных, II – у 56 (46,67%),III – у 28 (23,33%) больных.Все больные получали нестероидные противовоспалительные препараты,средства, улучшающие микроциркуляцию, физиотерапевтическое лечение, 9больным с синовитом (17,65%) вводили глюкокортикостероиды параартику-лярно или внутрисуставно. 30 пациентов (I группа) получали – глюкозаминасульфат (стопартроз – производства фирмы Славия Фарм С.Р.Л., Румыния)1200 мг/сут per os в течение 3-х месяцев, 40 больных (II группа) – алфлутоп(производства фирмы Biotehnos, Румыния) 1 мл внутримышечно или пара-вертебрально N20. Группу сравнения составили 50 пациентов, не получав-ших хондропротекторов. Группы достоверно не отличались по полу и возрас-ту.В результате проведенного лечения у большинства больных ОА, полу-чавших хондропротекторы, достигнут положительный результат. Улучшениенаступило у 66,7% пациентов, получавших стопартроз и у 70,0% – алфлу-топ. Эффективность алфлутопа была хорошей при уровне анти-ХС менее0,53 ед.опт.плот. в сыворотке, разведенной 1:80 или при титре антител бо-лее чем 1:320. Важно отметить, что повышенные уровни анти-ХС имели все4 пациента с ухудшением на фоне приема алфлутопа. Эффективность сто-партроза не зависела от уровня анти-ХС.Лечение стопартрозом оказалось неэффективным у 16,7% больных ОА,алфлутопом – у 20,0%. В 16,7% и 10% случаев соответственно наступилоухудшение состояния, которое выражалось в усилении болевого синдрома,уменьшении подвижности суставов из-за болей или в развитии вторичногосиновита. При дальнейшем анализе установлено, что во всех этих случаяхнаблюдался высокий исходный уровень антител к хондроитин сульфату.Таким образом, аутоиммунные реакции к гликозаминогликанам суставно-го хряща выявлены нами у большей части наблюдавшихся пациентов. Анти-ХС были обнаружены как у больных, получавших ранее препараты хондрои-тин сульфата, так и не получавшие их. В связи с этим нельзя считать, чтоединственной причиной выработки анти-ХС является применение инъекци-онных хондропротекторов, например алфлутопа. Высокий уровень анти-ХСассоциировался с определенным симптомокомплексом. Антитела встречалиськак правило у больных с более тяжелым течением ОА, чаще с синовитом. Нафоне проводимой терапии происходило снижение уровня анти-ХС. Известно,что при выраженном синовите у части больных инъекционные хондропротек-торы могут быть неэффективными или вызывать обострение патологическогопроцесса. Можно предположить, что с помощью определения анти-ХС можновыделить группу пациентов, кому назначение алфлутопа временно противо-показано. Вероятно, после снижения концентрации анти-ХС до нормальногоили субнормального уровня путем использования противовоспалительныхпрепаратов, вопрос о назначении алфлутопа конкретному больному можетбыть рассмотрен повторно. Чрезвычайно важным нам представляется тотфакт, что препараты глюкозамина сульфата оказывают положительный эф-фект как при серонегативном, так и при серопозитивном по анти-ХС вариан-те течения ОА. Следовательно, их можно назначать более широкому кругупациентов. При назначении алфлутопа пациентам с ОА определение анти-ХС позволит повысить эффективность применения этого препарата с 70% до81% в основном за счет тех пациентов, у которых препарат может датьухудшение состояния.
Симакова Е.С., Сивордова Л.Е., Коренская Е.Г.,Фофанова Н.А., Заводовский Б.В.
ЗНАЧЕНИЕ АНТИТЕЛООБРАЗОВАНИЯ К ХОНДРОИТИНСУЛЬФАТУ ХРЯЩА У БОЛЬНЫХ ГОНАРТРОЗОМ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Российская Федерация
В настоящее время остеоартроз является самым распространенным забо-леванием суставов, часто являющимся причиной временной, а нередко истойкой утраты трудоспособности (Фоломеева О.М., 2000), что определяетего большое социально-экономическое значение. При развитии остеоартро-за определяющую роль играют нарушения обменных процессов, происходя-щих в соединительнотканных структурах, многие из которых требуют де-тального исследования.Материалы и методы: Под нашим наблюдением находились 120 боль-ных гонартрозом, пациентов ГУЗ «Гоpодская клиническая больница скоpоймедицинской помощи №25» и/или ГУЗ «Клиническая поликлиника N 28Дзержинского района» г. Волгограда и 40 здоровых лиц. Все пациенты об-следовались пpи обращении в поликлинику или поступлении в стационаp, атакже по окончанию курса лечения.Антитела к хондроитин сульфату определялись непрямым твердофазнымиммуноферментным методом на полистироловых планшетах (ELISA-тест). Вкачестве антигена использовался коммерческий препарат хондроитин суль-фат А из хряща трахеи быков (Cat. № С-8529, Sigma (США). Учет результа-тов проводился на спектрофотометре с вертикальным лучом (Multiskan EX,Германия). Обработка полученных результатов проводилась с исполь-зованием программного пакета “STATISTICA FOR WINDOWS 6.0”.У здоровых лиц средний геометрический титр антител к хондроитинсульфату хряща был равен 39,141,19. При этом средняя оптическая плот-ность при разведении сыворотки 1:80 составила 0,070,02. При анализе по-лученных результатов не выявлено достоверных зависимостей между уров-нем анти-ХС, возрастом и полом (p > 0,1). Уровень нормальных показателейантител к хондроитин сульфату, определяемый как М 2, составил по сред-нему геометрическому титру от 24,09 до 54,19, или по оптической плотностидо 0,32 ед. С учетом среднеквадратичного отклонения этого ряда был сделанвывод о том, что повышенным содержанием антител к хондроитин сульфатуследует считать титр сыворотки выше, чем 1:64 или среднюю оптическуюплотность выше, чем 0,32 при разведении сыворотки 1:80, или средний гео-метрический титр выше 54,19. Такие величины выявлены у 3 здоровых лиц (7,5%) случаев, что составило частоту положительных результатов для дан-ного ряда.Среди больных ОА повышенные титры антител к хондроитин сульфатуобнаружили у 99 пациентов, что составило 82,5% случаев, и было достовер-но выше, чем у здоровых лиц (р<0,01). При этом средний геометрическийтитр этих антител составил 187,672,16, а средняя оптическая плотность приразведении сыворотки 1:80 – 0,36 0,13. Эти показатели оказались досто-верно выше, чем у здоровых лиц (p<0,01). Достоверных различий в уровнеанти-ХС больных остеоартрозом в зависимости от пола и возраста не выяв-лено.Для больных остеоартрозом в целом характерна достоверно более высо-кая частота обнаружения и количественные показатели уровня антител кхондроитин сульфату суставного хряща. Наиболее высокий исходный уро-вень антител к хондроитин сульфату и частота положительных результатовобнаружены у больных ОА в молодом возрасте (от 21 до 40 лет). Среднийгеометрический титр антител к хондроитин сульфату в группах больных ОА ввозрасте 21-40 лет достоверно превышал таковой в группе 51-60 лет. Стати-стически достоверной разницы между средней оптической плотностью приразведении сыворотки 1:80 не выявлено ни в одном случае. Зависимости отпола достоверных различий не обнаружено. У мужчин антитела выявлялисьнесколько реже, чем у женщин (81,63% и 83,10% соответственно). Среднийгеометрический титр у мужчин составял 184,14 2,58, а у женщин – 187,61 2,61. Средняя оптическая при разведении сыворотки 1:80 составляла 0,34 0,15 у мужчин и 0,35 0,16 у женщин.Наиболее высокие исходные уровни антител к хондроитин сульфатунаблюдались при длительности заболевания – от 10 до 15 лет (р<0,05). Ча-ще всего антитела к хондроитин сульфату обнаруживались у больных со IIстадией ОА (96,43%) и III стадией заболевания (92,86%). При I стадии ОАсредний титр антител был достоверно ниже, чем при II и III стадии(р<0,05), но выше, чем у здоровых лиц (р<0,01). При явлениях вторичногосиновита антитела к хондроитин сульфату выявлялись у всех 100% больных,что достоверно чаще, чем у больных без синовита (р<0,01). Средний гео-метрический титр (233,472,37 и 139,53 2,75, соответственно) и средняяоптическая плотность (0,55 0,07 и 0,29 0,08, соответственно), развиваю-щаяся в ИФА при разведении сыворотки 1:80 были намного выше у больныхОА с выраженными признаками вторичного синовита, чем у больных ОА безсиновита.Таким образом, антитела к хондроитин сульфату достоверно чаще выяв-лялись у больных гонартрозом с большой длительностью заболевания, II-IIIрентгенологической стадии, с вторичным синовитом в более высоких сред-них геометрических титрах и оптической плотности.
Симонова О.В., Леушина Е.А., Немцов Б.Ф., Сухих Е.Н.,Тимин М.В.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ СИМПТОМАТИЧЕСКИХ ПРЕПАРАТОВ МЕДЛЕННОГО ДЕЙСТВИЯ У ПАЦИЕНТОВ КОКСАРТРОЗОМ
ГБОУ ВПО «Кировская ГМА» Минздрава России, г. Киров, Россия
Цель: Провести сравнительный анализ клинической эффективности диа-цереина, хондроитин сульфата и глюкозамин сульфата у больных коксартро-зом в открытом контролируемом 18-месячном исследовании.Материалы и методы: Исследование проведено у 88 больных достовер-ным диагнозом коксартроз. Критериями включения являлись: достоверныйдиагноз остеоартроза тазобедренных суставов, интенсивность боли в суста-вах 40 мм и более по визуальной аналоговой шкале (ВАШ), необходимостьприема нестероидных противовоспалительных препаратов (НПВП), отсут-ствие клинически значимых нарушений функции печени и почек, подписан-ное информированное согласие. Методом случайной выборки пациенты былиразделены на 4 группы. 20 больных (I группа) получали диацереин 100мг/сутки (3 курса по 3 месяца), 26 больных (II группа) – глюкозамин суль-фат 1500 мг/сутки (3 курса по 3 месяца), 27 больных (III группа) – хондрои-тин сульфат 1000 мг/сутки (2 курса по 6 месяцев), 15 (IV) – ацеклофенак100-200 мг/сутки. Группы были сопоставимы по основным клиническим идемографическим показателям (р>0,05). Во всех группах преобладали жен-щины. Средний возраст пациентов I группы составил 56,3±5,3 лет, II группы– 55,7±10,7 лет, III группы – 59,8±5,9 лет, IV группы- 56,7±9,8 лет. Дли-тельность заболевания менее 5 лет наблюдалась у 10%, 15%, 12% и 4%больных соответственно. Стаж заболевания от 6 до 10 лет у 8%, 5%, 9%, и9% пациентов соответственно. I рентгенологическая стадия была выявлена у35% пациентов I группы, у 38% больных II, у 29,6% – III и у 33% пациентовIVгруппы. II стадия заболевания наблюдалась у 65%, 62%, 70% и 66,6%пациентов соответственно. Признаки двустороннего коксартроза отмечены у15%, 38%, 46,1% и 53% пациентов соответственно. Синовит зарегистировану 35%, 11,5%, 7,6%, 7,6% пациентов соответственно. Для оценки эффек-тивности терапии проводили исследование выраженности боли в тазобед-ренных суставах по ВАШ, оценивали индексы функциональной активностипо опросникам Lequesne для коксартроза и WOMAC, качество жизни с ис-пользованием опросника SF-36, потребность в НПВП, динамику синовита поУЗИ тазобедренных суставов.Полученные результаты: При оценке боли по ВАШ в покое и при ходь-бе, значений индекса Lequesne, всех шкал индекса WOMAC (боли, скован-ности, функции, глобальной) в I и II группах наблюдался более ранний на 3месяце терапии (р<0,001) и стойкий клинический эффект на всех этапахнаблюдения (р<0,01), по сравнению с III и IV группой. В I, II и III группахдостоверно уменьшилось число пациентов, нуждающихся в обезболивании. ВI группе доза ацеклофенака уменьшилась к 18 месяцу на 51,9%, во II группе на 76,4%, в III группе на 65%. Проводимая терапия позволила отменитьНПВП у 25 % больных в I группе, у 31% пациентов во II группе, у 10%больных III группы. Явления синовита по данным УЗИ уменьшились у 71%больных I группы и у 67% пациентов II группы. Полностью купировать си-новит удалось у 28,6% пациентов I группы и у 33% больных во II группе.Побочные действия были выявлены у 25% больных I группы (диарея у 15%,диспепсия у 10%), у 15% пациентов II группы (диспепсия), у 14% больныхIII группы (у 3,7% – боли в эпигастрии, у 11% – диспепсия) и у 35% пациен-тов IV группы (у 20% – боли в эпигастрии, у 13,3% – диарея, у 13,3% – дис-пепсия). При всех случаях наблюдения побочных действий препараты отме-нялись. Отказ от дальнейшего лечения чаще наблюдали в группе больных(11%), получавших хондроитин сульфат, что можно объяснить длительно-стью курса терапии и более поздним появлением клинического эффекта (на5-6 месяце). Сравнительная оценка влияния симптоматических препаратовмедленного действия на показатели качества жизни выявила преимуществоглюкозамин сульфата, по сравнению с диацереином и хондроитин сульфа-том. К окончанию периода наблюдения на фоне приема глюкозамин сульфа-та отмечено статистически значимое улучшение (p<0,05) по шкалам физиче-ского здоровья: физическое функционирование, ролевое физическое функ-ционирование, боль, общее здоровье. В группе диацереина и хондроитинсульфата наблюдалась тенденция к улучшению показателей физическогоздоровья, но она не была статистически значимой. В группе пациентов, по-лучавших только ацеклофенак показатели качества жизни к 18 месяцу те-рапии не отличались от исходных. Улучшение по шкалам психологическогоздоровья не отмечено не в одной из групп.Обсуждение: Результаты исследования показали, что применение симп-томатических препаратов медленного действия у пациентов коксартрозомуменьшает боль, скованность, улучшает функцию суставов и позволяет сни-зить потребность в НПВП. Полученные данные подтверждают данные лите-ратуры о наличии анальгетического и противовоспалительного эффектовдиацереина, глюкозамин сульфата и хондроитин сульфата у пациентовостеоартрозом тазобедренных суставов.Выводы: Применение диацереина, глюкозамин сульфата и хондроитинсульфата у пациентов остеоартрозом тазобедренных суставов приводит куменьшению боли, улучшению функциональной активности, снижает по-требность в НПВП. Терапия диацереином и глюкозамин сульфатом, по срав-нению с хондроитин сульфатом, оказывает более ранний и стойкий эффектпри длительном наблюдении. Применение глюкозамин сульфата в течение18 месяцев у пациентов коксартрозом превосходит диацереин и хондроитинсульфат по влиянию на показатели качества жизни.
Соколов В.А.
ДИСПЛАЗИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ И КЛИНИЧЕСКИЙ МЕТЕОПАТИЧЕСКИЙ СОЕДИНИТЕЛЬНОТКАННЫЙ СИНДРОМ У БОЛЬНЫХ С СОМАТИЧЕСКИМИ И РЕВМАТИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Приднестровский государственный университет им. Т.Г.Шевченко г. Тирас-поль (Приднестровье, Молдова)
Введение. Первые представления о соединительной ткани(СТ), каквнутренней среде организма представлены в работах С.М.Лукьянова(1894),Г.Шаде, В.Г.Гаршина, А.А.Богомольца, А.А.Заварзина, В. П Казначеева., В.ВСерова., А.Б. После чего в медицине появилась идея стромально-паренхиматозных взаимодействий в СТ, она стала одной из методологиче-ских основ изучения закономерностей формирования общепатологическихпроцессов и адаптивно-компенсаторных реакций, как в гистологии, так и втеоретической и клинической медицине, сформировав впоследствии учениео дисплазия соединительной ткани (ДСТ). Авторы. полагали, что морфоге-нетическая функция коллагена обусловлена его способностью быть излож-ницей, придающей форму и внутреннюю архитектуру либо будущему органув эмбриогенезе, либо ткани при морфогенезе, сопровождающем физиологи-ческую, или другой вид регенерации и рассматривали морфогенетическуюфункцию СТ, как для нее основную, “активную”, а опорную считали “пассив-ной”, вторичной. Поэтому СТ сегодня считают морфофункциональной си-стемой, все компоненты которой взаимосвязаны и взаимозависимы черезстромально-паренхиматозные взаимодействия в СТ и нарушения в них при-водит к возникновению дисплазии соединительной ткани.Дисплазия соединительной ткани —это наследственные нарушения со-единительной ткани мультифакториальной природы, объединенные в син-дромы и фенотипы на основе общности внешних и/или висцеральных., ха-рактеризующиеся многообразием клинических проявлений от доброкаче-ственных субклинических форм до развития полиорганной и полисистемнойпатологии с прогредиентным течением. В литературе не обнаружено дан-ных о частоте признаков ДСТ при различных заболеваниях в Приднестров-ском регионе республики Молдова. Это и послужило поводом для настоя-щего исследованияЦелью исследования явилось изучение частоты признаков соедини-тельнотканных дисплазий, включая клинический метеопатический соедини-тельнотканный синдром(КМС-синдром) при соматических и ревматическихзаболеваниях у взрослых.Материалы и методы исследования. Работа выполняется в рамкахцелевой программы НИЛ «ИНТЕРН» ПГУ им. Т.Г.Шевченко г. Тирасполь поизучению особенностей течения СЗ и РЗ, при ДСТ. синдроме. За период2003-2013годы была изучена распространенность соматических заболеваниях (СЗ) и ревматических заболеваниях (РЗ), ассоциированных с ДСТ сре-ди выборки проанкетированых 2000 рабочих текстильного предприятия, 700стационарных и амбулаторных больных с СЗ и 200 больных с РЗ. Контроль-ная группа состояла из 100 совершенно здоровых добровольцев, соответ-ствующего СЗ и РЗ возраста и пола. Диагностика ДСТ проводилась с помо-щью критериев, изложенных в российских рекомендаций ВНОК(2009г) поДСТ и необходимых лабораторно – инструментальных методов исследования.Статистическую обработку данных проводили по схеме анализа программы«Статистика».Результаты исследования. Распространенность симптомов ДСТ сре-ди больных с СЗ в организованной и неорганизованной популяциях соста-вила 30,94%. Распространенность симптомов ДСТ, включая среди больныхс РЗ в организованной и неорганизованной популяциях составила 33,4%.Частоты признаков ДСТ в данных основных группах были достоверно (р<0,05) выше, чем в группе контроля. По результатам исследования былополучено четыре патента на изобретения по способам диагностики ДСТ.В процессе исследования у пациентов были выделены следующиесимптомы ДСТ, такие как общая слабость, недомогание, быстрая утомляе-мость, головная боль, расстройство сна, изменение артериального давле-ния, вегетативные расстройства со стороны внутренних органов, боли в су-ставах и нижней части спины, головные боли, которые, как правило, появ-ляются или усиливаются при перемене погоды, в магнитные бури и в полно-луние (метеопатии). С Целью понимания единого патогенеза этого симпто-мокомплекса, он был выделен нами, как КМС-синдром, который встречал-ся у всех больных с ДСТ.Выводы. У больных с СЗ и РЗ была определена частота признаковДСТ, которая составила 30,9% и 33,4%- соответственно, что было досто-верно(р< 0,05) выше, чем в контрольной группе. В процессе исследованиянами был предложен термин клинический метеопатический соединительнот-канный синдром, который выявлялся у всех больных с ДСТ и проявлял-ся, как правило в виде, астенического синдрома, болей в суставах и позво-ночнике, головных болей, вегето-сосудистых (или гипертонических) кризов,которые появлялись или усиливались при перемене погоды, в магнитныебури и в полнолуние. В заключении хочется обратить внимания практикую-щих врачей к проблеме наследственной неполноценности соединительнойткани, которая на практике проявляется ДСТ и КМС синдромом, лечениекоторых у больных с СЗ и РЗ имеет свои особенности.
Стажаров М.Ю., Зборовская И.А., Мартемьянов В.Ф.,Бедина С.А., Мозговая Е.Э., Хортиева С.С., Левкина М.В.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЭНЗИМНЫХ ИССЛЕДОВАНИЙ КРОВИ У БОЛЬНЫХ С МИНИМАЛЬНОЙ АКТИВНОСТЬЮ РЕВМАТОИДНОГО ПРОЦЕССА
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград,Россия
В клинической практике у больных с ревматоидным артритом нередкобывает трудно разграничить фазу клинической ремиссии и минимальногообострения ревматоидного процесса вследствие малой информативностиобщепринятых острофазовых лабораторных показателей (СОЭ, СРБ и др.),остающихся в подобных ситуациях в большинстве случаев неизменными.Исходя из этого, поиск более чувствительных параклинических тестов в ин-дикации минимальной активности ревматоидного процесса является акту-альной зГДАчей в ревматологии.Цель исследования. Повышение качества диагностики минимальной ак-тивности ревматоидного процесса с использованием показателей активностинекоторых ферментов пуринового метаболизма в эритроцитах больных РА.Материал и методы. Под наблюдением находились 20 больных РА с ми-нимальной активностью ревматоидного процесса. Диагноз устанавливалсяна основании диагностических критериев Американской коллегии ревмато-логов и Европейской лиги ревматологов (Aletaha et al., 2010). Среди больныхпреоблГДАли женщины (70%). Средний возраст (М±m) больных – 46,8±0,9лет, продолжительность заболевания – 9,2±0,8 лет. Системные поражениявыявлены в 40% случаев. Серопозитивный вариант (по РФ) определялся у12 (60%) больных, прогрессирующее течение – у 4 (20%). I стГФия (поШтейнброккеру) установлена у 3 (15) больных, II стГФия – у 10 (50%), III –у 5 (25%) и IV стГФия – у 1 (5%) больного. Функциональный класс (ФК) су-ставов второй степени (ФК-2) определён у 12 (60%) больных, ФК-3 – у 7(35%) и ФК-4 – у 1 (5%) больных. Контрольную группу составили 30 прак-тически здоровых людей. Выделение эритроцитов и приготовление их лиза-тов проводилось с использованием цитратной венозной крови, заморажива-ния – оттаивания, центрифугирования. Подсчет эритроцитов – под микро-скопом в камере Горяева (до лизиса).В лизатах эритроцитов здоровых и больных РА по оригинальным методи-кам определяли активность гуаниндезаминазы (ГДА), гуанозиндезаминазы(ГЗДА), пуриннуклеозидфосфорилазы (ПНФ), гуанозинфосфорилазы (ГФ),ксантинокидазы (КО), ксантиндегидрогеназы (КДГ). Активность ферментоввыражали в нмоль/мин на 1 мл, содержащий 1×109 клеток (до лизиса). Приобработке полученных результатов использовались пакеты программы «Ста-тистика 6.0».Результаты исследований. Активность изученных ферментов не зави-села от пола и возраста, и поэтому эти факторы не учитывались при анализе. По сравнению со здоровыми, у больных РА с I степенью активности про-цесса, по сравнению со здоровыми, в лимфоцитах выше активность ГДА,ПНФ, ГФ, ниже активность ГЗДА (все р˂0,001), незначительно выше актив-ность КО (р>0,05) и ниже КДГ (р>0,05). Если же учитывать не среднестати-стические величины активности ферментов, а индивидуальные энзимныепоказатели, то за верхние референтные пределы здоровых лиц (М±2G) вы-ходили показатели активности ГДА в 70,0% случаев, ПНФ – в 85%, КДГ – в20% случаев, за нижние границы – только показатели активности КДГ в 25%случаев. У этих же больных за референтные пределы здоровых выходилипоказатели СОЭ в 40% случаев, СРБ – в 35%, альфа-2-глобулинов – в 40%и сиаловых кислот – в 95% случаев. То-есть, показатели активности ГДА иПНФ в 2-2,5 раза более чувствительны в индикации минимальной активностиревматоидного процесса.Через 7-8 дней лечения на фоне некоторого улучшения клинического со-стояния больных статистически значимая положительная динамика толькодля ПНФ и ГЗДА: снизилась активность ПНФ (р˂0,001), повысилась ранеесниженная активность ГЗДА (р˂0,05). После проведенного курса лечениянаблюдалась положительная динамика всех энзимных показателей, и они неотличались от показателей здоровых лиц (р>0,05).Заключение. Результаты проведенных исследований показали, что дляиндикации минимальной активности ревматоидного процесса целесообразноопределять в лизатах эритроцитов активность ГДА и ПНФ, показатели кото-рых оказались более чувствительными, чем СОЭ, СРБ, сиаловые кислоты иальфа-2-глобулины. Показатели активности изученных ферментов способ-ствуют объективизации оценки эффективности проводимой терапии. В пер-вые 7-8 дней лечения целесообразно ориентироваться на показатели актив-ности ПНФ и ГЗДА.
Сулейманова Г.П., Грехов Р.А., Харченко С.А., Мякишев М.В.
ОЦЕНКА ЭФФЕКТИВНОСТИ СТРУКТУРНО-РЕЗОНАНСНОЙ ЭЛЕКТРОМАГНИТНОЙ ТЕРАПИИ УБОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,Россия.
Целью работы явилось изучение эффективности использования струк-турно-резонансной электромагнитной терапии (СРЭМТ) в комплексной тера-пии пациентов с системной склеродермией (ССД) в зависимости от формы,течения, степени активности и стадии заболевания.Материал и методы исследования. Под наблюдением находилось 77больных ССД. Средний возраст пациентов – 38,19 ± 12,1 лет, средняя про-должительность болезни составила 11,2±3,4 года. По степени активностипатологического процесса больные распределились следующим образом: Iстепень была диагностирована у 40 человек (51,9%), II степень – у 34 человек (44,2%), III степень – у 3 пациентов (3,9%). У 32 больных (41,6%) те-чение заболевания расценено как хроническое (медленно прогрессирую-щее), у 42 (54,5%) – как подострое (умеренно прогрессирующее), у 3(3,9%) – как острое (быстро прогрессирующее).Исходя из поставленных задач, больные ССД путем случайного подборабыли разделены на три группы, сопоставимые по половому составу, возрастуи длительности заболевания: основную группу; группу, получающую «пла-цебо» – воздействия по основной методике СРЭМТ, при которой имитирова-лось проведение процедур без подключения электрического тока; и кон-трольную. Пациенты всех групп получали аналогичное медикаментозноелечение. Кроме того, больные основной группы получали дополнительно 10-12 ежедневных сеансов СРЭМТ с помощью аппарата «Рематерп» в сканиру-ющем режиме «А» продолжительностью каждого 43 мин. “Сканирующий”режим включает в себя набор режимов воздействия, направленных на вос-становление собственных частот органов и тканей. Аппарат структурно-резонансной электромагнитной терапии “Рематерп” разработан ГУП МОКБ”МАРС” (г. Москва), сертифицирован и внесен в Государственный Реестр ме-дицинских изделий.Клиническая оценка эффективности метода СРЭМТ проводилась с учетомвыраженности боли по ВАШ, суставного счета, числа припухших суставов,индекса припухлости; лабораторных тестов (СОЭ,СРБ, ЦИК, Ат Scl-70).Результаты исследования и их обсуждение. Анализ эффективностиметода СРЭМТ в комплексном лечении больных ССД представлен в таблице.Динамика клинико-лабораторных показателей эффективности СРЭМ тера-пии в зависимости от характера течения ССД
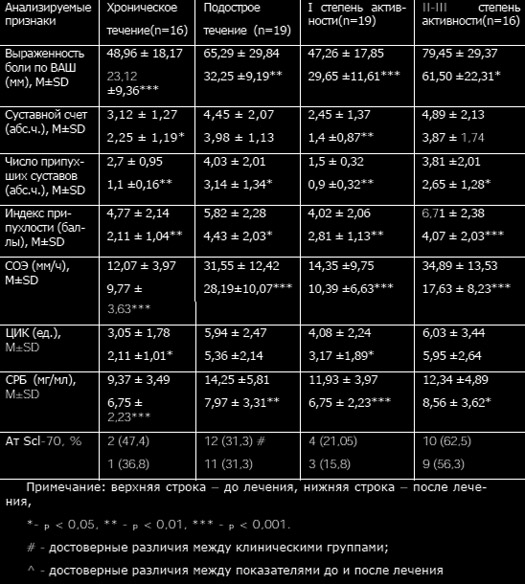 Согласно полученным данным большая эффективность СРЭМ терапиинаблюдалась при хроническом течении заболевания. Также Результаты ис-следования позволяют сделать вывод о том, что Результаты лечения былисущественно лучшими в группе больных ССД c минимальной степенью ак-тивности заболевания. Возможно, под действием электромагнитных низкоча-стотных токов в тканях происходит активация системы регуляции локальногокровотока, повышение резорбционной способности тканей, что приводит кослаблению мышечного тонуса, усилению выделительной функции кожи иуменьшению отека в очаге воспаления. СРЭМТ больных ССД со II и III сте-пенями активности оказалась малоэффективной, оказывая, преимуществен-но, только анальгетическое воздействие, поскольку столь высокая актив-ность патологического процесса сопровождается глубокими нарушениямииммунологической реактивности, требующими назначения гормональных ииммунодепрессивных средств, методов экстракорпоральной терапии.Выводы. Таким образом, СРЭМТ обладает широким спектром лечебногодействия при ССД, включающего позитивное воздействие на нарушения вмикроциркуляторного русла, анальгетический и противовоспалительныйэффекты, способствует уменьшению кожного, сосудистого, болевого синдро-ма. Наиболее эффективно применение метода СРЭМТ у больных ССД с хро-ническим течением, I степенью активности и I стадией заболевания.
Сулейманова Г.П., Грехов Р.А., Харченко С.А.,Рогаткина Т.Ф.
ВЛИЯНИЕ СТРУКТУРНО-РЕЗОНАНСНОЙ ЭЛЕКТРОМАГНИТНОЙ ТЕРАПИИ НА МИКРОЦИРКУЛЯТОРНЫЕ НАРУШЕНИЯ У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,Россия.
Введение. Системная склеродермия (ССД) – прогрессирующее полисин-дромное заболевание с характерными изменениями кожи, опорно-двигательного аппарата, внутренних органов (легкие, сердце, пищевари-тельный тракт, почки) и распространенными вазоспастическими нарушения-ми по типу синдрома Рейно.Целью работы. Оценить лечебное влияние структурно-резонанснойэлектромагнитной терапии на микроциркуляторные нарушения у больныхсистемной склеродермией.Материалы и методы исследования. Под наблюдением находилось 77больных ССД. Средний возраст пациентов – 38,19 ± 12,1 лет, средняя про-должительность болезни составила 11,2±3,4 года. В зависимости от степенираспространенности изменений кожи у 56 (72,7%) больных была диагности-рована лимитированная форма ССД, у 21 (27,3%) – диффузная. БольныеССД путем случайного подбора были разделены на три группы, сопостави-мые по половому составу, возрасту и длительности заболевания: основнуюгруппу; группу, получающую «плацебо» – воздействия по основной методикеСРЭМТ, при которой имитировалось проведение процедур без подключенияэлектрического тока; и контрольную. Пациенты всех групп получали анало-гичное медикаментозное лечение. Кроме того, больные основной группыполучали дополнительно 10-12 ежедневных сеансов СРЭМТ с помощью ап-парата «Рематерп» в сканирующем режиме «А» продолжительностью каждо-го 43 мин.Полученные Результаты. Учитывая высокую значимость сосудистыхрасстройств в патогенезе и клинике системной склеродермии, высокую ча-стоту встречаемости кожного и сосудистого синдромов нами были изученывозможности лечебного воздействия СРЭМТ на данные виды патологии. Ана-лиз эффективности метода СРЭМТ в комплексном лечении больных ССД про-водился путем изучения динамики клинико-лабораторных показателей эф-фективности терапии и их сопоставления у больных основной, плацебо иконтрольной групп. При этом сравнивались не только средние величины от-дельных показателей, но также определялась эффективность лечения укаждого больного индивидуально.Установлено, что у больных основной группы под воздействием СРЭМ те-рапии наблюдалась достоверная положительная динамика кожного счета. В контрольной и плацебо-группах изменения кожного счета были аналогичны-ми, но статистически недостоверными. Кроме того, достоверно изменялисьпосле лечения в основной группе пациентов следующие анализируемые при-знаки капилляроскопической картины: расширение капилляров (2 =4,97,p=0,026), морфологические изменения капилляров (2 =0,414, p=0,042) игеморрагии (2 =4,354, p=0,037). Под влиянием традиционной терапии вконтрольной группе больных и группе, получающей плацебо, достоверныеизменения претерпел только один показатель капилляроскопии, а именнотолько наличие морфологически измененных капилляров (2 =4,49, p=0,034и 2 =4,944, p=0,026, соответственно) (см. таблицу).Динамика клинико-лабораторных показателей эффективности лечениябольных ССД основной, плацебо и контрольной групп.
Согласно полученным данным большая эффективность СРЭМ терапиинаблюдалась при хроническом течении заболевания. Также Результаты ис-следования позволяют сделать вывод о том, что Результаты лечения былисущественно лучшими в группе больных ССД c минимальной степенью ак-тивности заболевания. Возможно, под действием электромагнитных низкоча-стотных токов в тканях происходит активация системы регуляции локальногокровотока, повышение резорбционной способности тканей, что приводит кослаблению мышечного тонуса, усилению выделительной функции кожи иуменьшению отека в очаге воспаления. СРЭМТ больных ССД со II и III сте-пенями активности оказалась малоэффективной, оказывая, преимуществен-но, только анальгетическое воздействие, поскольку столь высокая актив-ность патологического процесса сопровождается глубокими нарушениямииммунологической реактивности, требующими назначения гормональных ииммунодепрессивных средств, методов экстракорпоральной терапии.Выводы. Таким образом, СРЭМТ обладает широким спектром лечебногодействия при ССД, включающего позитивное воздействие на нарушения вмикроциркуляторного русла, анальгетический и противовоспалительныйэффекты, способствует уменьшению кожного, сосудистого, болевого синдро-ма. Наиболее эффективно применение метода СРЭМТ у больных ССД с хро-ническим течением, I степенью активности и I стадией заболевания.
Сулейманова Г.П., Грехов Р.А., Харченко С.А.,Рогаткина Т.Ф.
ВЛИЯНИЕ СТРУКТУРНО-РЕЗОНАНСНОЙ ЭЛЕКТРОМАГНИТНОЙ ТЕРАПИИ НА МИКРОЦИРКУЛЯТОРНЫЕ НАРУШЕНИЯ У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград,Россия.
Введение. Системная склеродермия (ССД) – прогрессирующее полисин-дромное заболевание с характерными изменениями кожи, опорно-двигательного аппарата, внутренних органов (легкие, сердце, пищевари-тельный тракт, почки) и распространенными вазоспастическими нарушения-ми по типу синдрома Рейно.Целью работы. Оценить лечебное влияние структурно-резонанснойэлектромагнитной терапии на микроциркуляторные нарушения у больныхсистемной склеродермией.Материалы и методы исследования. Под наблюдением находилось 77больных ССД. Средний возраст пациентов – 38,19 ± 12,1 лет, средняя про-должительность болезни составила 11,2±3,4 года. В зависимости от степенираспространенности изменений кожи у 56 (72,7%) больных была диагности-рована лимитированная форма ССД, у 21 (27,3%) – диффузная. БольныеССД путем случайного подбора были разделены на три группы, сопостави-мые по половому составу, возрасту и длительности заболевания: основнуюгруппу; группу, получающую «плацебо» – воздействия по основной методикеСРЭМТ, при которой имитировалось проведение процедур без подключенияэлектрического тока; и контрольную. Пациенты всех групп получали анало-гичное медикаментозное лечение. Кроме того, больные основной группыполучали дополнительно 10-12 ежедневных сеансов СРЭМТ с помощью ап-парата «Рематерп» в сканирующем режиме «А» продолжительностью каждо-го 43 мин.Полученные Результаты. Учитывая высокую значимость сосудистыхрасстройств в патогенезе и клинике системной склеродермии, высокую ча-стоту встречаемости кожного и сосудистого синдромов нами были изученывозможности лечебного воздействия СРЭМТ на данные виды патологии. Ана-лиз эффективности метода СРЭМТ в комплексном лечении больных ССД про-водился путем изучения динамики клинико-лабораторных показателей эф-фективности терапии и их сопоставления у больных основной, плацебо иконтрольной групп. При этом сравнивались не только средние величины от-дельных показателей, но также определялась эффективность лечения укаждого больного индивидуально.Установлено, что у больных основной группы под воздействием СРЭМ те-рапии наблюдалась достоверная положительная динамика кожного счета. В контрольной и плацебо-группах изменения кожного счета были аналогичны-ми, но статистически недостоверными. Кроме того, достоверно изменялисьпосле лечения в основной группе пациентов следующие анализируемые при-знаки капилляроскопической картины: расширение капилляров (2 =4,97,p=0,026), морфологические изменения капилляров (2 =0,414, p=0,042) игеморрагии (2 =4,354, p=0,037). Под влиянием традиционной терапии вконтрольной группе больных и группе, получающей плацебо, достоверныеизменения претерпел только один показатель капилляроскопии, а именнотолько наличие морфологически измененных капилляров (2 =4,49, p=0,034и 2 =4,944, p=0,026, соответственно) (см. таблицу).Динамика клинико-лабораторных показателей эффективности лечениябольных ССД основной, плацебо и контрольной групп.
 Полученные данные по совокупности оцениваемых показателей свиде-тельствуют о том, что Результаты лечения были существенно лучшими в ос-новной группе больных ССД. Видимо, СРЭМ терапия обладает способностьювлиять на нарушения микроциркуляторного звена, оказывая положительноевоздействие на развитие изменений в микроциркуляторном русле различныхтканей. Происходит ускорение капиллярного кровотока, улучшение сократи-тельной способности сосудистой стенки и увеличение кровенаполнения.Увеличивается просвет функционирующих компонентов микроциркуляторного русла, возникают условия, способствующие раскрытию капилляров, ана-стомозов и шунтов. Вследствие вышесказанного происходит повышение со-судистой и эпителиальной проницаемости. По-видимому, под действиемэлектромагнитных низкочастотных токов в тканях происходит активациясистемы регуляции локального кровотока, повышение резорбционной спо-собности тканей, что приводит к ослаблению мышечного тонуса, усилениювыделительной функции кожи и уменьшению отека в очаге воспаления.Выводы. Таким образом, применение структурно-резонансной электро-магнитной терапии в комплексном лечении больных ССД способствует нор-мализации микроциркуляции, улучшению трофико-регенераторных и мета-болических процессов.
Сухих Е.Н., Симонова О.В., Немцов Б.Ф., Тимин М.В.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА КАЧЕСТВО ЖИЗНИБОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛОАРТРИТОМ
ГБОУ ВПО «Кировская ГМА» Минздрава России, г. Киров, Россия
Цель. Оценить влияние заболевания на качество жизни (КЖ) больныханкилозирующим спондилитом (АС).Материалы и методы: В исследование включены 62 больных с досто-верным диагнозом АС. Среди больных АС преобладали мужчины (77,4%).Возраст больных варьировал от 20 до 55 лет (средний возраст – 38,57,9лет). Продолжительность болезни составляла от 3 месяцев до 30 лет (всреднем – 17,310,8 лет). Соотношение аксиальной и периферической формАС было примерно равным (51,6% и 48,4% соответственно). Число болез-ненных периферических суставов составляло в среднем 3,5±2,7, припухших– 0,85±1,3. У 40,3% были выявлены энтезопатии. Больные имели преимуще-ственно II степень активности (64,5%). Максимальная активность АС отме-чена в 19,4% случаев, а в 16,1% случаев выраженность воспалительногопроцесса была минимальной. У большинства (48,4%) больных имелась IVрентгенологическая стадия сакроилеита (по Kellgren). В 3,2% случаев опре-делялась I, в 25,8% – II, в 22,6% – III рентгенологическая стадия пораже-ния крестцово-подвздошных сочленений. У трети больных наблюдалисьэкстраартикулярные проявления заболевания. Наиболее часто встречалисьсубфебрилитет (8%), сенсорная полинейропатия (9,7%), анемия (8%), аор-тальная недостаточность (8%), реже похудание (4,8%) и увеит (4,8%) нафоне высокой активности воспалительного процесса. У 2 больных (3,2%) состажем заболевания 12 и 14 лет развился вторичный амилоидоз почек. Увсех больных был выявлен HLAB27. Из сопутствующей патологии наиболеечасто встречалась артериальная гипертензия (25,8%). На момент исследова-ния 46,7% больных получали симптоматическую терапию нестероиднымипротивовоспалительными препаратами, 16% пациентов принимали сульфасалазин, 6,5% – метотрексат, 8% – комбинированную терапию сульфасала-зином и метотрексатом.Для оценки активности заболевания использовали индекс BASDAI. Оцен-ка функциональных возможностей пациента проводилась с помощью индексаBASFI, опросника HAQ и HAQ-AS. КЖ больных изучали по шкале SF-36. Дляоценки влияния заболевания на КЖ пациентов по шкале SF-36 проводилисравнительную оценку показателей КЖ больных АС и показателей популя-ционных норм, которые были получены Межнациональным центром исследо-вания КЖ в Санкт–Петербурге с вычислением 8 основных показателей: фи-зическое функционирование (ФФ), ролевое физическое функционирование(РФФ), боль (Б), общее здоровье (ОЗ), жизнеспособность (Ж), социальноефункционирование (СФ), ролевое эмоциональное функционирование (РЭФ),психическое здоровье (ПЗ).Результаты: Среднее значение индекса BASDAI составило 67,9±17,8 мм.По опроснику HAQ среднее значение составило 1,74±0,8, HAQ-AS – 1,8±0,5.HAQ более 1,5 наблюдалось у 47,5% больных. Средние значения индексаBASFI составили 44,5±18,2 мм. Было выявлено, что наблюдается прямаякорреляционная связь между активностью заболевания и функциональнымстатусом по HAQ (r=0,42; p<0,01) и HAQ-AS (r=0,44; p<0,01). Все показа-тели КЖ были достоверно хуже у больных АС по сравнению со здоровымилицами (р<0,001). У больных АС в наибольшей степени изменялись показа-тели физического здоровья (ФФ, РФФ, Б). РФФ было снижено на 78%, пока-затель Б на 55%, показатель ФФ на 74% по сравнению со здоровыми лица-ми. Среди показателей КЖ, характеризующих психологическое здоровье (Ж,СФ, РЭФ, ПЗ), в большей степени было снижено РЭФ – на 75% и Ж – на 33%.Показатель СФ, являясь самым высоким среди всех параметров КЖ у боль-ных АС (55,3±25,2), тем не менее, был на 15% хуже, чем у здоровых лиц.Для оценки факторов, влияющих на показатели КЖ больных АС, был пред-принят анализ корреляционных связей некоторых клинических показателейсо значениями отдельных шкал SF-36. Была выявлена корреляция между ФФи степенью активности заболевания (r=-0,62; p<0,01), BASDAI (r=-0,61;p<0,01), суставным индексом (r=-0,68; p<0,001) и BASFI (r=-0,59; p<0,01),между РФФ и степенью активности заболевания (r=-0,54; p<0,01), стажемзаболевания (r=-0,44; p<0,05), BASDAI (r=-0,46; p<0,05) и BASFI (r=-0,43;p<0,05), между показателем шкалы боли и BASDAI (r=-0,45; p<0,05), ско-ванностью в позвоночнике по ВАШ (r=-0,50; p<0,05), длительностью утрен-ней скованности в позвоночнике (r=-0,65; p<0,01), между РЭФ и степеньюактивности заболевания (r=-0,54; p<0,01), болью в позвоночнике по ВАШ(r=-0,42; p<0,05), утомляемостью по ВАШ (r=-0,51; p<0,05), общим само-чувствием по ВАШ (r=-0,42; p<0,05).Выводы: Показатели КЖ больных АС достоверно ниже по сравнению создоровыми лицами. Выраженность нарушений по различным шкалам опрос-ника КЖ коррелирует с показателями активности, стажа заболевания инарушением функциональных возможностей.
Тихомирова Н.Ю., Елисеева Л.Н., Фёдорова Н.П.
ОЦЕНКА СЕРДЕЧНО-СОСУДИСТОГО РИСКА У ЛИЦ МОЛОДОГО ВОЗРАСТА С СИНДРОМОМ ГИПЕРМОБИЛЬНОСТИ СУСТАВОВ
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Цель: оценить сердечно-сосудистый риск у лиц молодого возраста с син-дромом гипермобильности суставов.Материалы. Методом анкетирования и экспресс-анализатором обследо-вано 300 студентов медиков. Подписавших информированное согласие наобследование и обработку персональных данных.Методы. Всем обследованным был выполнен экспресс-анализ общегохолестерина и глюкозы в крови на экспресс-анализаторе CardioChek, прове-дены антропометрические исследования, определение окружность талии,вычисление ИМТ (как отношение веса к росту в метрах в квадрате), опреде-лён уровень АД. Проводилась акцентуация на выявление внешних признаковнедифференцированной дисплазии соединительной ткани с особым внима-нием к синдрому гипермобильности суставов. Признаками синдрома гипер-мобильности суставов считалось количество баллов по критериям Брайтона≥ 4. Факторами кардио-васкулярного риска считались уровень глюкозы ка-пиллярной крови ≥ 5,6 ммоль/л; уровень холестерина ≥5,0 ммоль/л; индексмассы тела ≥25 кг/м2; АД≥ 130/85 мм рт.ст.; окружность талии у девушек ≥80 см, а у мужчин ≥94 см.Полученные результаты. Все обследованные являются студентами 4курса медицинского университета. Участники исследования после подписа-ния информированного согласия и анализа с помощью анкет, обследованияантропометрических и инструментальных данных были разделены на группуздоровых и группу пациентов с признаками гипермобильности суставов.Вторая группа подверглась экспресс-анализу риска сердечно-сосудистойсистемы по системе SCORE. Установлено, что 97% имели студентов с при-знаками гипермобильности суставов имели низкий сердечно-сосудистыйриск, 3% – высокий сердечно-сосудистый риск. В целом у 5,5 % обследо-ванных была выявлена гипергликемия, из них никто не страдал сахарнымдиабетом. Впервые зарегистрированная у этих лиц гипергликемия послужи-ла поводом для их направления на более углубленное обследование к эндо-кринологу с целью исключения сахарного диабета и нарушения толерантно-сти к глюкозе. Уровень артериального давления у всех обследованных былнормальным. У 22,2 % обследованных выявлена гиперхолестеринемия.22,2% человек имели отклонения от нормы со стороны индекса массы тела(ИМТ). Среди них 16,6 % имели избыточный вес, ожирение 2 степени –33,3%; а у 50,1 % человек – недостаточную массу тела. Всего у 5,5% муж-чин объём талии превышал 94 см, а среди девушек объём талии более 80 смбыл выявлен в 3,7% случаев. Обсуждение. В настоящее время уделяется большое внимание влияниюдисплазии соединительной ткани, одним из проявлений которой являетсясиндром гипермобильности суставов, на состояние сердечно-сосудистой си-стемы (формирование вегетативной дисфункции, прогрессирование артери-альной гипертензии, ИБС, нарушения ритма сердца и ХСН). Среди лиц моло-дого возраста с синдромом гипермобильности суставов распространены та-кие факторы кардиоваскулярного риска, как гиперхолестеринемия, избы-точный вес, недостаточная масса тела, ожирение 2 степени, гипергликемия,окружность талии у мужчин более 94 см, у девушек более 80 см.Выводы. Устранение факторов кардиоваскулярного риска, выявленныхпри обследовании (гиперхолестеринемия, избыточный вес, недостаточнаямасса тела, ожирение 2 степени, гипергликемия, окружность талии у мужчинболее 94 см, у девушек более 80 см), позволит минимизировать риск разви-тия сердечно-сосудистых заболеваний. Рационально в план диспансерногообследования студентов вводить опросники характеризующие дисплазиюсоединительной ткани и использовать методы экспресс-оценки основныхфакторов риска сердечно-сосудистой системы.
Фомичева А.А., Куликов А. И., Ялтырян В. В., Ханов А.Г.
ДЕФРАГМЕНТАЦИЯ РЕВМАТОЛОГИЧЕСКОЙ ЗАБОЛЕВАЕМОСТИ НАСЕЛЕНИЯ ТЕРРИТОРИИ
Минздрав РО, ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
В настоящей статье мы предлагаем ввести понятие «дефрагментациязаболеваемости населения» и план ее реализации. Термин «дефрагмен-тация» взят из компьютерной литературы, где он обозначает оптимизациюхранения файлов в непрерывной последовательности для ускорения доступак ним. Дефрагментация имеет и графическое выражение, когда до началапроцесса, распределение файлов на жестком диске представляет собой мно-жество линий разного цвета и толщины. После проведения процесса, остает-ся несколько крупных прямоугольников 3-4 цветов дающих общую картинураспределения хранения файлов.В медицинское понятие дефрагментации мы вкладывает выравниваниеуровней заболеваемости и болезненности населения в целом и по отдель-ным нозологиям, в рамках отдельного города, района, отдельных админи-стративных территорий, субъектов федерации, объединенных в админи-стративные округа. Важным моментом является расположения территорийпо соседству, что определяет примерно одинаковые климатические, соци-ально – экономические условия проживания населения.Распространенность БКМС нельзя рассматривать в отрыве от общего здо-ровья населения. Поэтому, нами был проведен анализ эпидемиологическихситуации по РЗ в РО за 6 лет. Результаты изложены в интернет – издании«Эпидемиологические тенденции ревмопатологии в РО. 2013г.» По материалам статистических отчетов, показатели болезненности на 1000 населенияпостоянного росли. Если взять за точку отсчета первоначальные данные, тов каждом году, в сравнении с ней, общая болезненность соответственноувеличивалась на 1%, 3%,7,5%, 9% ежегодно. И только в последний годнаблюдения снизилась на 1% в сравнении с предыдущим.Ситуацию с общей заболеваемостью оценивать сложней, в связи с еепостоянными колебаниями, происходящими без каких-то явных внутреннихили внешних причин. Если взять за точку средний уровень заболеваемостинаселения, то ежегодные отклонения соответственно составляли -2%, +1%,+2%, -1%, +1,5%, -2%. Еще более наглядные данные предоставляет ран-говая таблица первичной заболеваемости по классам заболеваний. Динамикаранга класса БКМС составляла по годам 5-5-4-4-5-4 место. Впереди БКМС,патология дыхательной системы (1-1-1-1-1), мочеполовой системы (2-3-2-2-3-3), травмы и отравления (3-2-3-3-2-2), болезни кожного покрова (4-4-5-5-4-5).Делать строгие Выводы о истиной распространенности БКМС, по даннымофициальной статистики сложно, ввиду ее особенностей, о которых мы ука-зывали в предыдущих статьях. Важным моментом является то, что шифрамиБКМС пользуются врачи массовых терапевтических и хирургических специ-альностей, включая педиатров и даже генетики. Это откладывает опреде-ленный отпечаток на «чистоту» диагнозов и соответственно на возможностьконтроля над процессами ее развития. Еще одним, важным, отрицательныммоментом современной статистики является «потеря» ревматических боль-ных в случаях развития у них осложнений, острых состояний или заболева-ний угрожающих жизни. Особенно это проявляется в учете смертностинаселения, когда на долю РЗ, приходится 0,081% (2011г.). Фактически этоучтенная смертность только от СКВ, ССД, васкулитов. При этом больные стяжелой суставной патологией, которой они страдали десятилетиями, при-знавались инвалидами и соответственно получали значительные объемымедицинской помощи, «утеряны».Показатели болезненности населения по классам заболеваний более«стабильны» и имеют устойчивые тенденции на протяжении десятилетий,чем показатели заболеваемости. Так, ранговое место БКМС 5-4-4-4-4-4. Впе-реди болезни ССС 1-1-1-1-1-1, болезни органов дыхания 2-2-2-2-2-2, моче-половой системы 3-3-3-3-3-3, и раньше были заболевания органов пищева-рения 4-5-6-5-5-5.Изучение распространенности РЗ по отдельным территориям РО проводи-лась нами по данным ежегодного статистического сборника о здоровьевзрослого населения РО, где представлены данные по классу БКМС в целом,и по отдельным ревматическим нозологиям (ОРЛ, ХРБС, РА, АС, системныеболезни соединительной ткани, артрозам) по 12 городам и 43 сельским рай-онам.Общие Выводы о состоянии здоровья по отдельным территориям РОпроводились в целом и отдельно, для «городского» и «сельского» населе-ния». Так «разброс» первичной заболеваемости по сельским районам со-ставляет 2,3, а по городам 3,8 раза. Первичная заболеваемость БКМС в РО на 24% выше, чем по РФ и на 24% выше, чем по ЮФО. Первичная заболева-емость БКМС в сельских районах на 25% выше, чем в городах. В тоже времяобщая заболеваемость (болезненность) БКМС в РО на 7% ниже, чем по РФ ина 22% чем по ЮФО. В городах РО на 10% выше, чем в сельских районах.По отдельным нозологическим формам ситуация такова. Первичная забо-леваемость ОРЛ по РО в 14 раз меньше чем по РФ и 8 раз, чем по ЮФО.Первичная заболеваемость ОРЛ в городах и сельских районах одинакова.Общая заболеваемость ОРЛ по РО на 5% ниже, чем по РФ и на 66% выше,чем в ЮФО. Общая заболеваемость ОРЛ в городах и районах РО одинакова.Первичная заболеваемость ХРБС в РО на 2% выше, чем в РФ и на 7% чемв ЮФО. Первичная заболеваемость ХРБС в 7 раз выше в сельских районах,чем в городах РО. Общая заболеваемость ХРБС в РО на 26% ниже, чем в РФи на 5% выше, чем по ЮФО. Общая заболеваемость ХРБС на 7% больше вгородах, чем на селе.Первичная заболеваемость РА в РО в 6 раз ниже, чем в РФ и 4 раза, чем вЮФО. Первичная заболеваемость РА городского населения на 33% выше,чем сельского. Имеют место случаи, что в отдельных территориях за год невыявлено ни одного нового случая РА. При этом заболеваемость в 2 соседнихсельских районах может различаться в 46 раз, а в двух городах, располо-женных на удалении 25 км, в 17 раз. При этом общая заболеваемость РАнаходится на уровне показателей РФ и на 30% выше, чем по ЮФО. Общаязаболеваемость РА на 55% выше среди городского населения.По первичной заболеваемости АС, РО «обгоняет» РФ в 4 раза, а ЮФО в 3раза. Среди городского населения заболеваемость АС на 33% выше, чемсельского. При этом в 42% сельских территорий за год не было выявлено ниодного больного Болезнью Бехтерева. По показателю общей заболеваемостиАС, РО характеризуется низким уровнем (на 55% ниже РФ и 28% нижеЮФО). Общая заболеваемость АС городского населения на 33% выше, чемсельского. По системным заболеваниям соединительной ткани (общая забо-леваемость) показатели РО на 14% ниже, чем в РФ и на 15% выше, чем поЮФО. Среди городских жителей РО они на 33% встречаются чаще.Аналогичная ситуация и по общей заболеваемости артрозами (по РО онина 14% ниже чем по РФ и на 15% выше, чем по ЮФО). Среди городских жи-телей РО, артрозов фактически на 50% больше чем на селе.Графические материалы к статье в силе скетчноутинга по адресу:http://visualrheumatology.ru/defragmentatsiya-revmatologicheskoyzabolevaemosti-naseleniyaВажнейшим вопросом здравоохранения является дальнейшее наблю-дение, лечение и реабилитация пациента после установления диагноза. Ран-няя диагностика и эффективное лечение соответствует государственныминтересам и гуманистическим принципам медицины. В настоящее время,после установления диагноза ревматологический пациент фактически выпи-сывается « в никуда». Это связано с тем, что нормативными документами,диспансерное наблюдение РЗ должно осуществляться ревматологом. Но ре-альность такова, что ни одного ревматолога в сельских районах нет (их не может быть по существующим нормативам и в свете дефицита врачебныхкадров на селе). Аналогичная ситуация и в городах РО, в 70% которыхштатных ревматологов нет. Последние приказы по диспансеризации тера-певтических заболеваний обязывают терапевтов проводить диспансерноенаблюдение только пациентов с остеопорозом. Все это приводит к тому, чтоновые организационные подходы по ранней диагностике РЗ, международнаяпрограмма по лечению РА «Лечение до достижения цели» («Treat To Target»,T2T) «повисают» в воздухе. Новые подходы (по использованию опыта ипринципов работы врачебных бригад при лечении АГ для ревматическихбольных и расширения полномочий м/с) также не могут быть реализованыиз-за отсутствия ревматологических кадров и регламентирующих докумен-тов.И самое главное, для конкретного больного навсегда теряется «Окновозможностей» -«Золотое» время в лечении и дальнейшем прогнозе каче-ства жизни, до превращения больного в реального инвалида, требующегопостоянной медицинской помощи, но когда он уже может получить доступк высокотехнологичной помощи, эффективность которой на данной стадиизаболевания проблематична.При подготовке анализа ревматологической патологии, нами были ис-пользованы шкалы уровней заболеваемости по каждой нозологии. Так, приОА, уровень заболеваемости оценивался от 0 до 100 случаев на 1000 взрос-лого населения с «шагом» в 10 пунктов; при системных заболеваниях, от0,01 до 5,0, при «шаге» 0,1; при АС от 0,01 до 1,5, при «шаге» 0,05; приРА от 0,2 до 9,0, при «шаге» 0,4; при ХРБС от 0,01 до 1,5, при шаге«0,05»; при ОРЛ от 0,01 до 0,2, при «шаге» 0,02; при БКМС в целом от 10до 120, при «шаге» 10. При составлении таблиц, каждый «шаг» имел свойцвет, что на таблицах и графиках выглядело очень красиво, но при аналити-ческой оценке сильно «дробило» общую картину.Обсуждение. Показатели заболеваемости РЗ по отдельным территориямРО нуждаются в срочной дефрагментации (выравнивании).Случаи не выявления в течение года «основных» РЗ подлежат оператив-ному разбору. Территории, как с высокими, так и с низкими показателямизаболеваемости БКМС, подлежат оперативному контролю областными спе-циалистами. Необходим оперативный, ежеквартальный мониторинг ревма-тологической заболеваемости районными и городскими специалистами, спроведением превентивных мероприятий не дожидаясь окончания года,когда время будет фактически упущено. Для владения оперативной стати-стической информацией необходимо обеспечить районных и городскихспециалистов аналитическими записками о состоянии здоровья населениявсей области и в разрезе территорий. Для выявления РЗ необходимо вырав-нивание лабораторно-диагностической базы ЛПУ, особенно амбулаторно -поликлинического звена. Остается актуальным вопрос повышения квалифи-кации специалистов массовых терапевтических и хирургических специаль-ностей по вопросам ревматологии. Необходимо предусмотреть соответству-ющие курсы и для фельдшеров и акушерок ФАПов и ФП, а также врачейскорой и неотложной помощи. Назрела необходимость расширения полномочий и функциональных обязанностей м/с после их соответствующей под-готовки, при оказании помощи ревматическим больным.При подготовке анализа заболеваемости ревматическими болезнями вцелом, и по отдельным нозологиям, необходимо опираться на минимальныеи максимальные цифры статистики своего региона. Желательно всю заболе-ваемость делить на 4 уровня: нет случаев, низкий, средний и высокий уро-вень, что при цветном графическом изображении обеспечит высокуюнаглядность. Организационно – методические кабинеты ЛПУ, для повышениядостоверности и полноты статистического учета на закрепленной террито-рии, могут привлекать ревматологов или врачей прошедших подготовку поизбранным вопросам ревматологии в качестве консультантов. Совместныйоперативный контроль позволит через статистический талон «выйти» наконкретного пациента, который или часто обращается за медицинской по-мощью, или входит в группу риска по РЗ. Широко известно, что у невроло-гов, под «маской» остеохондрозов могут «скрываться» ревматическиеспондилоартропатии, а в практике амбулаторных хирургов и травматологов,моно – или олигоартриты могут быть дебютом воспалительных артропатий.Необходимо проведение систематической работы со всеми врачами для«искоренения» диагноза «деформирующий» артроз или плечелопаточныйпериартрит «на все случаи жизни». Комплекс мероприятий в конечном итогедаст дополнительный поток больных, нуждающихся в специализированнойпомощи ревматолога.
Фофанова Н.А., Симакова Е.С., Ковех А.А., Кравцова Е.Г., Заводовский Б.В., Чернов А.С.
РАСПРОСТРАНЕННОСТЬ ОСТЕОПОРОЗА И ЕГО ОСЛОЖНЕНИЙ В ВОЛГОГРАДСКОЙ ОБЛАСТИ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград, Россия
В Волгоградской области отмечается постепенное старение населения, всвязи с чем возникает множество медико-социальных проблем, связанных сзаболеваниями пожилых. На одном из первых мест по заболеваемости срединих стоит остеопороз (ОП). Социальная значимость остеопороза определяет-ся его последствиями и осложнениями – низкотравматичными переломамипозвоночника и трубчатых костей, которые обуславливают значительныйподъем заболеваемости, инвалидности и смертности.Целью данной работы было исследовать частоту развития остеопении иостеопороза, а также распространенность остеопоретических переломов вВолгоградской области.Методом рентгеновской абсорбционной остеоденситометрии на аппаратеLUNAR XP (США) было обследовано 10620 человек в возрасте от 20 до 89 лет, из них 6422 женщины и 4198 мужчин. Повторное обследование прово-дилось с интервалом в 1 год.У 3959 пациентов (37,28%) обнаружено снижение показателей BUA, Z и Tниже границ нормы, что сопряжено с риском возникновения переломов. Изних 2796 человек страдали остеопенией (26,38%), 1156 – остеопорозом(10,91%) и 6648 пациентов имели нормальную плотность костной ткани(80,4%). Остеопороз и остеопения достоверно чаще диагностировались уженщин старше 50 лет с низким индексом массы тела (р0,005). Анализ бо-лее 30 факторов риска остеопороза и переломов проводился раздельно всоответствующих группах мужчин и женщин. Выявлено, что к достовернымфакторам риска остеопороза можно отнести возраст 65 лет и более, вес тела57 кг и ниже, индекс массы тела менее 20, курение и злоупотребление алко-голем. Кроме того дополнительно для женщин: возраст начала менопаузы до45 лет и длительность менопаузы более 25 лет. Для мужчин: тяжелый физи-ческий труд в возрасте 15 – 25 лет (р<0,03), низкая физическая активностьпосле 25 лет (р<0,01), недостаточное потребление молочных продуктов(р<0,01).Всем пациентам было проведено исследование биохимических маркеровкостного метаболизма: остеокальцина в крови и Cross Laps в моче (Osteometer,Дания), кислой фосфатазы (Ольвекс Диагностикум), щелочной фосфата-зы (Lachema). У всех пациентов с остеопеническим синдромом было выявле-но нарушение метаболизма костной ткани. Частота переломов костей оцени-валась путем сбора анамнеза и оценки рентгенограмм позвоночника. Стан-дартизованные показатели распространенности переломов предплечья со-ставили 26 (0,245%), позвоночника – 837 (7,896%), шейки бедра – 19(0,179%). Переломы костей у пациентов с остеопорозом и остеопениейнаблюдались достоверно чаше, чем у лиц с нормальной плотностью костнойткани (р<0,001).Наиболее частой локализацией переломов у женщин были переломы ди-стального отдела предплечья и проксимального отдела бедренной кости,которые достоверно превышали их распространенность у мужчин (р<0,001 ир<0,002 соответственно). У мужчин более часто наблюдались переломы дру-гой локализации (голень, кости кистей и стоп) и ребер (р<0,02). Наиболеечастым типом перелома позвоночника был клиновидный (13,6% мужчин и12,2% женщин), выявляемый преимущественно в среднегрудном отделе Т6 –Т8. Следующими по частоте были двояковогнутые переломы (по типу «рыбь-их позвонков»), которые чаще локализовались в нижнегрудном и пояснич-ном отделах позвоночника (3,7% мужчин и 5,9% женщин). Наиболее редкийтип перелома – компрессионный, преобладал у мужчин (4,1%) по сравнениюс женщинами (0,5%) (р<0,001).Проспективное наблюдение когорты в течение трех лет показало, что ча-стота новых случаев переломов костей за период наблюдения составила 3,6среди женщин и 0,7 на 100 человеко-лет среди мужчин (р<0,0001). Основ-ной локализацией новых переломов были переломы дистального отделапредплечья (40,1%), 90,7% которых зарегистрированы у женщин. Новыеслучаи остеопоретических переломов позвоночника выявлены у 9,8% жен-щин и 5,6% мужчин. Максимальное число переломов отмечено в зимнее время (36,4%), которое превышало их частоту (16,2%) в весенние и летниемесяцы (р<0,05).У женщин подавляющее число переломов (93,7%) произошло в резуль-тате минимальной травмы, что превышает аналогичный показатель у мужчин(р<0,0001) и свидетельствует о влиянии остеопороза как ведущей причиныэтих переломов. Среди мужчин преобладало падение с большой высоты илитяжелая травма (31,8% против 5,4% у женщин; (р<0,0005). В нашей выбор-ке была выявлена зависимость частоты переломов от возраста у мужчин(р<0,05), переломами чаще страдали мужчины 75 лет и старше. В то времякак среди женщин наибольшие показатели распространенности переломовотмечены в возрастных группах 65-69 лет и 75 лет и старше, причем в стар-шей группе она была выше, чем во всех предыдущих группах вместе взятых(р<0,004).Таким образом, распространенность остеопенического синдрома срединаселения Волгоградской области составляет 37,28%. Остеопороз являетсячастой причиной переломов костей. По сравнению с другими регионами Рос-сии область является регионом со средней частотой переломов костей.
Ханов А.Г.
КУМАРИНОВЫЙ НЕКРОЗ В ПРАКТИКЕ РЕВМАТОЛОГА
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Ревматолог, как врач – специалист, выступает консультантом в клини-ческих ситуациях, когда имеются трофические нарушения на пальцах, му-тиляция концевых фаланг или развивается их некроз. Эти ситуации воз-можны, как при РЗ, довольно широко известных среди врачей других спе-циальностей (ССД, ПА), так и при заболеваниях, лечением которых занима-ются хирурги (облитерирующий эндартериит – «ноги курильщика», облите-рирующий атеросклероз, болезнь Рейно). Сосудистые поражения дистальныхотделов конечностей возможны при СКВ, практически при всех видах вас-кулитов, как в рамках течения самого заболевания, так и при проведенииантикоагулянтной терапии. Остеолиз ногтевых фаланг отмечается при лепре.Нежелательные кожные реакции на фоне антикоагулянтной терапиинаблюдаются на фоне приема антикоагулянтов прямого ( быстрого)действия (гепарин натрия, надропарин кальция, эноксапарин натрия и др.),и антикоагулянтов непрямого действия (антагонисты витамина К) — дли-тельного действия (варфарин, фениндион, аценокумарол и др), а также ги-рудина. Проявления кожных реакций варьирует от локальных аллергиче-ских проявлений до некрозов. Различные аллергические реакции встре-чаются относительно часто. Некрозы на фоне приема непрямых антикоагу-лянтов, так называемые «кумариновые» или «варфариновые» некрозывстречаются относительно редко — у 0,01—0,1% больных, принимающихантагонисты витамина К. Под нашим наблюдением, находилась больнаяЕ.,84 лет, доставленная по скорой помощи с диагнозом: Гангрена пальцеврук и стоп в хирургический стационар для проведения некрэктомии. Дежурным хирургом приглашен на консультацию ревматолог для исключения си-стемного заболевания. Из анамнеза известно, что в течение года стала отмечать зябкость, онемение, побледнение пальцев рук. Через 3 месяца обрати-лась к сосудистому хирургу. Была госпитализирована в стационар с диагнозом: Облитерирующий атеросклероз, острая эмболия мелких артерий,осложненная гангреной ногтевых фаланг обеих кистей. После выпискиначала прием варфарина в дозе 2,5мг х 2 раза в день. Несмотря на проводи-мое лечение, состояние продолжало ухудшаться. Начавшись на левой кисти,процесс охватил правую кисть. В области лодыжки правой стопы образова-лась глубокая трофическая язва. Развилась симметричная сухая гангренамизинцев стоп. При обращении в стационар, больной выполнены рентгено-граммы кистей рук и стоп, где обнаружен остеолиз ногтевой фаланги Vпальца левой кисти и патологические переломы средних фаланг II и IIIпальцев справа и слева. Подробное описание клинического случая по адре-су: http://visualrheumatology.ru/kumarinovyiy-nekroz-v-praktike-revmatologai-pri-provedenii-antikoagulyantnoy-terapii.htmlОбсуждение. На сегодняшний день, чаще сообщается о кожных реакциях на фоне приема варфарина, что связано с его болеешироким клиническим применением в отличие от фенилина и других пре-паратов этой группы. Однако подобные явления встречаются при ис-пользовании любых непрямых антикоагулянтов. Истинная частотаподобных побочных действий лекарственного средства (ЛС) гораздовыше, так как далеко не о каждом случае специалисты здра-воохранения сообщают в виде печатных работ. Вышедший более 10 лет назад приказ МЗ об учете побочного действия и нежелательных явленийпри использовании ЛС практически прошел незамеченным, не говоря о егопрактической реализации. Для профилактики осложнений при терапии вар-фарином, рекомендуется начинать лечение с малых доз, не превышать це-левые уровни МНО и проводить тщательный лабораторный контроль. Про-гнозируется, что введение в широкую клиническую практику прямых ингибиторов тромбина (аргатробан, мелагатран/ксимелагатран) и селективныхингибиторов фактора Xa (фондапаринукс, идрапаринукс и т.д.) позволитзначительно снизить частоту подобных нежелательных явлений.
Ханов А.Г., Мозговая Е.Э., Стажаров М.Ю.
СТРУКТУРА БОЛЕЗНЕЙ КОСТНО-МЫШЕЧНОЙСИСТЕМЫ И СОЕДИНИТЕЛЬНОЙ ТКАНИ В РАБОТЕ ПРАКТИЧЕСКОГО ВРАЧА
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону;ФГБУ«НИИ КиЭР» РАМН, г.Волгоград, Россия.
В настоящее время ревматические заболевания (РЗ) сохраняют ши-рокую распространенность, на их долю приходится большой процент вструктуре утраты трудоспособности как временной, так и стойкой. Однакопроследить реальную судьбу ревматологического больного и соответственно результативность комплекса лечебно-оздоровительных мероприятий доста-точно сложно. С одной стороны, это связано с особенностями статистики прикоторой в случае возникновения осложнений или серьезных заболеванийревматологический диагноз «теряется». Особенно это наглядно при стати-стическом учете причин смерти, когда например, у ревматологическогобольного случается желудочно-кишечное кровотечение или инфаркт мио-карда. С другой стороны мы имеем множество диагнозов заболеваний кост-но-мышечной системы , установленных врачами различных специальностейв рамках их компетенции и познаний в ревматологии. Здесь возможны, какнеправильная формулировка диагноза, так и поверхностное отношение ксамой диагностике, когда любая боль в спине проходит под диагнозомостеохондроз. Еще более частый пример – остеоартроз, диагноз которогоможно сравнить по частоте выставления с диагнозом ишемической болезнисердца при всех случаях болей в сердце. Формально, такие диагнозы имеютправо на существование, но жаль ,что это не всегда соответствует действи-тельности.Если рассмотреть нозологии в рамках МКБ Х, то диагноз острой ревмати-ческой лихорадки может устанавливаться педиатрами, терапевтами, отори-ноларингологами, кардиологами. Хроническая ревматическая болезнь серца– диагноз терапевтов, кардиологов, кардиохирургов. Инфекционные артро-патии (в их числе реактивные артриты) могут диагностировать инфекциони-сты – постдизентерийный артрит. Гнойный артрит выявляют хирурги, трав-матологи ; туберкулезный артрит – фтизиатры, менингококковый артрит –неврологи, артрит при сифилисе – дерматологи, постиммунизационный арт-рит –педиатры. Диагностика воспалительных полиартропатий, включаяревматоидный артрит, возможна любым врачом, псориатического артрита –дерматологом, артрита при колитах –гастроэнтерологом, ювенильного арт-рита –педиатром. Подагра может диагностироваться урологами и нефроло-гами. Кристаллические, специфические артропатии, неуточненные и другиеартропатии может вывить участковый терапевт или семейный доктор приналичии специальных знаний. Артропатии при нарушениях обмена веществвстречаются в практике эндокринологов и генетиков, остеоартроз – на при-еме у терапевтов и общих хирургов. Травматологи ортопеды, хирурги встре-чаются с приобретенными поражениями суставов, такими как деформации,вывихи, поражение связок, контрактуры, анкилозы. Больные с системнымипоражениями соединительной ткани обращаются к ревматологам, гематоло-гам, дерматологам, окулистам, травматологам, онкологам; при дорсопатиях- к травматологам, подростковым врачам, неврологам, нейрохирургам, рев-матологам, терапевтам; при спондилопатиях – к ревматологам, неврологам,травматологам, нейрохирургам, хирургам, тубологам, инфекционистам; приболезнях мягких тканей, включающих болезни мышц, – к терапевтам, ин-фекционистам, хирургам, травматологам, неврологам, онкологам; при пора-жениях синовиальных оболочек и сухожилий – к хирургам, травматологам.Другие заболевания мягких тканей выявляют профпатологи, травматологи,хирурги, дерматологи, неврологи, терапевты. Остеопатии и хондропатиивстречаются в практике травматолога, хирурга, гинеколога, нейрохирурга,невролога, онколога, эндокринолога, геронтолога, профпатолога, инфекцио-нита, гематолога, туболога, подросткового врача, терапевта; другие нарушения костно-мышечной системы и соединительной ткани на приеме у травма-толога, оториноларинголога, гинеколога, хирурга, нейрохирурга.Таким образом, следует обратить внимание, что заболевания из классаболезней костно-мышечной системы и соединительной ткани (БКМС и СТ)часто диагностируются врачами многих специальностей в меру их компетен-ции, которая не соответствует уровню подготовки врача ревматолога.Значение статистики в оценке состояния здоровья населения, планиро-вания деятельности учреждений здравоохранения огромно. В то же время вдействительности, статистические показатели с одной стороны невостребо-ванны широкой массой врачей, а с другой труднодоступны.Нами подготовлена и размещена в сети интернет презентация «Эпиде-миологические тенденции ревмопатологии в Ростовской области» по адресуhttp://visualrheumatology.ru/epidemiologicheskie-tendentsii-revmopatologii-vrostovskoy-oblasti-prezentatsiya.html. Общий план ее представляет оценкуБКМС и СТ в рамках общей заболеваемости и болезненности населения, по-казателей смертности и потерь трудоспособности, сравнение основных по-казателей РЗ по субъектам ЮФО, характеристику ревматологической служ-бы Ростовской области в сравнении с соседними территориями. Дан анализревмапатологии по городам и районам Ростовской области. Необходимо от-метить, что существенных изменений в статистических показателях на про-тяжении 6 лет анализируемого периода выявлено не было. Также нами под-готовлены сборники по статистике РЗ. В книгу 1 вошли показатели заболе-ваемости острой ревматической лихорадкой и хронической ревматическойболезнью сердца по городам и районам Ростовской области за 2011 г. в ди-намике http://visualrheumatology.ru/zdorove-naseleniya-rostovskoyoblasti.html. В книге 2 содержатся показатели болезненности и заболеваемо-сти по классу БКМС и СТ в целом, по всем городам и районам Ростовскойобласти в динамике 2010-2011 гг. http://visualrheumatology.ru/zdorovenaseleniya-rostovskoy-oblasti-2011g-kniga-2.html. В книгу 3 вошли остеоарт-розы и системные поражения соединительной тканиhttp://visualrheumatology.ru/zdorove-naseleniya-rostovskoy-oblasti-2011gkniga-3.html; в книгу 4 – анкилозирующий спондилоартритhttp://visualrheumatology.ru/zdorove-naseleniya-rostovskoy-oblasti-2011gkniga-4.html.Практикующим врачам вопросы статистики могут показаться не так ин-тересны, как новые перспективы лечения генно-инженерными биологиче-скими препаратами, но они жизненно необходимы. Показатели статистики, иособенно динамика статистических показателей, – реальный показательпрактических результатов работы как отдельного ревматолога так и ревма-тологической службы территории (города, района, области или края) в це-лом.С учетом реального масштаба распространенности БКМС и СТ в целяхобеспечения доступности своевременной специализированной ревматологи-ческой помощи, позволяющей начать лечение на ранних сроках заболева-ний, по-видимому, необходимо пересмотреть (сократить)норму численностиприкрепляемого к врачу ревматологу населения. Одним из важных путей решения проблемы ранней диагностики РЗ явля-ется повышение информированности врачей массовых терапевтическихспециальностей в вопросах ревматологии, тесное сотрудничество врачейсмежных специальностей: ревматологов, терапевтов, неврологов, хирурговамбулаторно-поликлинического звена, травматологов ортопедов.Для решения вопроса о диспансерном наблюдении контингентов ревма-тологических больных возможно возвращению к опыту советского здраво-охранения при проведении всеобщей диспансеризации, с разделением паци-ентов на группы здоровья для проведения персонифицированного лечения.
Чернышева Т.В., Ткаченко И.В.
ВОЗМОЖНОСТИ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ СУСТАВОВ КИСТЕЙ ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ
ГБУ ВПО «Оренбургская государственная медицинская академия» Министер-ства здравоохранения Российской Федерации г. Оренбург, Россия, кафедратерапии1, кафедра поликлинической терапии
В настоящее время современный спектр инструментальной диагностикизаболеваний опорно-двигательного аппарата представлен комплексом высо-котехнологичных методов – магниторезонансная, компьютерная томографии.Высокая информативность результата зачастую нивелируется дороговизнойисследования. Артросонография по праву занимает достойное место в ли-нейке методик, являясь не инвазивной, поли позиционной, позволяющейдетально оценить анатомию суставов, проводить функциональные пробы.Важным является отсутствие лучевой нагрузки для пациента, что дает воз-можность одновременного осмотра нескольких локализаций и наблюдение вдинамике. Многолетний опыт позволяет проводить исследование практиче-ски всех суставов.Цель работы – проанализировать Результаты ультразвукового исследо-вания (УЗИ) суставов кистей у больных с различной патологией, а так жеопределить преимущественное поражение суставов у больных ревматоиднымартритом.Материалы и методы исследования: За 10 месяцев 2013 года прове-дено УЗИ суставов кистей у 182 больных, преимущественно женщин(82,4%). Средний возраст обследованных составил 48,2±14,1 лет (от 18 до82 лет). У 129 больных (70,9%) был выявлен остеоартроз (ОА), у 36 (19,7%)– верифицирован ревматоидный артрит (РА), у 12 (6,6%) – артрит, ассоции-рованный с инфекцией (РеА), у 5 – псориатический артрит (ПсА). У 36 паци-ентов, направленных на исследование с подозрением на РА, в результатеобследования был исключён предполагаемый диагноз. Больные были вклю-чены в группы больных ОА и РеА. 36 больным с установленным сонографи-ческим и клиническим диагнозом РА было выполнено УЗИ и других поражен-ных суставов. Из них мужчин было 8 человек (22,2%), женщин – 28 (77,8%).У всех больных заболевание протекало в развёрнутой форме. Обследованные больные имели I – III рентгенологические стадии патологии (большин-ство II -69,7%). Среди всех пораженных суставов наиболее часто обследо-ванию подвергались суставы кистей – 80,6% случаев, реже коленные –25%, голеностопные – 19,4% и локтевые – 8,3%.Полученные Результаты. По данным УЗИ суставов кистей синовит былдиагностирован в 101 случае (55,5%), периартрит – в 121 (66,5%), эрозиисуставных поверхностей – в 32 (17,6%). У 6 пациентов визуализировалисьгигрома лучезапястного сустава, либо сухожильного комплекса, у 2- хондро-ма, у 1 – фиброма. 4 больных имели изменения в поверхностной фасциисоответствующие контрактуре Дюпюитрена. В единичных случаях выявлялсяхондрокальциноз гиалинового хряща мелких суставов кистей, асептическийнекроз трапециевидной кости, посттравматический разрыв коллатеральнойлучистой связки запястья. При ОА на ряду со снижением толщины гиалино-вого хряща и остеофитозом встречался незначительный моно- или олигоси-новит в сочетании с периартритом (38,8%). При РА умеренный, либо выра-женный преимущественно симметричный синовит характеризовался значи-тельным утолщением синовии и резким усилением в ней кровоток, что явля-ется специфичным для данного заболевания. Чаще экссудативные явления всуставах сочетались с теносиновитами нескольких сухожилий (63,9%). ¾пациентов регистрировались симметричные эрозии головок пястных костей.У 2-х больных ПсА и у 3- больных с РеА, также определялись эрозии, но онине носили симметричный характер. Из воспалительных изменений при РАвстречался чаще периартрит без синовита, при ПсА – синовит с периартри-том. Анализ изменений в суставах отобранной группы больных РА выявилследующие изменения. Синовит был диагностирован у 77,8% больных чащев суставах кистей (46,4%, р<0,05). Периартрит и симметричные эрозивныеизменения в суставных поверхностей имели 69,4% пациентов также с боль-шей частотой в суставах кистей. В подавляющем большинстве эрозии сим-метрично лоцировались в головках II и III пястно-фаланговых суставах и вединичных случаях в ладьевидных костях. У 6 больных не было выявленовоспалительных изменений в суставах, что свидетельствовало о медикамен-тозной ремиссии заболевания. Следует отметить, что у 2-х больных реги-стрировался выраженный симметричный синовит только локтевых суставахс типичными ревматоидными эрозиями мыщелков плечевой кости. Большин-ство больных в поражённых суставах имели сочетание синовита и периарт-рита (63,9%, р<0,05). Также характерным было совместное наличие синови-та и эрозивных изменений суставных поверхностей (61,1%, р<0,05). Опре-делялась взаимосвязь между возрастом и наличием сопутствующего ОА впоражённых суставах (r=0,56, р<0,05). В то же время, не было полученодостоверной корреляционной зависимости между ОА и воспалительнымиизменениями в суставах. Имелись взаимосвязи между наличием синовита ипериартрита у больных РА (r=0,52, р<0,05), синовитом и эрозивными изме-нениями суставных поверхностей (r=0,37, р<0,05).Выводы. Таким образом, наиболее частой патологией суставов кистей, скоторыми обращаются больные на УЗИ, является ОА. При УЗИ суставов в80,2% случаев выявляются воспалительные изменения, характер которыхпомогает в верификации диагноза. Эрозивные изменения суставных поверх-ностей характерны для РА и ПсА, но симметричный характер деструкции свойственен только ревматоидному процессу. Наиболее частой локализациейпоражения суставов у больных РА традиционно являются суставы кистей.
Шелепина Т.А. Степаненко Н.Ю.
CОЦИАЛЬНАЯ АДАПТАЦИЯ ПАЦИЕНТОВ ДЕТСКОГО РЕВМАТОЛОГИЧЕСКОГО СТАЦИОНАРА НАХОДЯЩИХСЯ НА ДОМАШНЕМ ОБУЧЕНИИ
ФГБУ НИИ ревматологии им.Насоновой В.А.
Цель оценить социальную адаптацию пациентов детского ревматологи-ческого стационара, длительно находящихся на домашнем обучении .Материалы и методы. Было обследовано 22 пациента, детского отделе-ния института ,находившихся на домашнем обучении длительное времяСредний возраст был равен 12,8 ( от8 до17) Число девочек и мальчиков бы-ло одинаковым. По нозологии пациенты распределялись следующим обра-зом: СКВ -3д, Ювенильная системная склеродермия 1м, ювенинильный дер-матомиозит -1д, с хроническим артритом было 17 пациентов: с системнымвариантом-5,полиартикулярным-4,олигоартикулярным-7, ЮАС -1 На основа-нии клинических и лабораторных данных об активности заболевания мыоценивали адекватность выбранной формы обучения. Для оценки важногопоказателя качества жизни – степени социальной адаптации –использовалиопросники CHAG, SF-36 Ваш боли и авторскую анкету о частоте общения сосверстниками и посещения культурных мероприятий. Пациенты были обсле-дованы клиническим психологом.Полученные результаты. Медицинские показания для обучения на до-му были у 8 пациентов :у 7 связанные с активностью заболевания, у однойпациентки 8лет с медикаментозной ремиссией это было обусловлено давно-стью расположения школы в гористой местности. У четырех пациентов дан-ный более удобный метод был выбран родителями и пациентами для воз-можности совмещения с дополнительным обучением в музыкальной и худо-жественной школеУ десяти пациентов длительное домашнее обучение было выбором роди-телей. Из этой подгруппы каких –либо проявлений десоциализации не былотолько у одной пациентки , имевшей широкий круг общения на досуге. Упациентов этой подгруппы было достоверное снижение социальной дея-тельности по опроснику SF-36 по сравнению с обучающихся на дому по ме-дицинским показаниям или учащимися в школе; более высокие показателиболи и степени ограничения жизнедеятельности, общение со сверстникамиосуществлялось в основном через интерне. .Полное отсутствие какой либодеятельности , включающей выполнение домашней работы , встреч сосверстниками было отмечено у 4 пациентов. Серьезные психологическиепроблемы( высокий уровень тревожности, субдепрессия ) были у 8 пациен-тов пациентов. Обсуждение. Дополнительным методом лечения пациентов с ревмато-логической патологией является реабилитация, Целью которой являетсяпредотвращение и коррекция двигательных нарушений, психологическаяподдержка и социальная адаптация Большинство пациентов, нуждающихся встационарном лечении имеют инвалидность, по статье «инвалид дет-ства»,допускающей в необходимых случаях организацию индивидуальногообучения в двух вариантах : отдельные занятия с педагогами в школе и ди-станционное обучение через интернет на дому. Для пациентов ,находящихсяв активной фазе заболевания это единственная возможность продолжитьобучение. Благодаря широкому внедрению данной формы обучения практи-чески все наши пациенты получают среднее образование Временное обу-чение в таком режиме не оказывает существенного влияния на их пси-хоэмоциональное состояние. Обучение вне школы длительное время можетпривести к социальной изоляции. При общении с пациентами , длительнообучающихся на дому без медицинских показаний ,мы выяснили, что ос-новной официальной, мотивировкой, данной формы обучения являетсятрудности в обучении из-за частых пропусков занятий- посещение поликли-ники (сдачи анализов, необходимость периодического стационарного лече-ния),а также риск инфекций, которые могут вызвать обострение основногозаболевания. Чаще решение перехода на данную форму принимают родите-ли. У части детей ,продолжающих контактировать со сверстниками вне шко-лы , данная удобная форма никак не влияет на психологический статус иони довольно легко переходят на обучение в школе. У некоторых появляетсястрах и не желание возврата в обычному режиму., у них как правило выяв-ляется несоответствие между высокими показателями боли и клиническимиданными.Среди пациентов, имевших признаки десоциализации большинство со-ставляли больные с ювенильным хроническим артритом( 8 и з 10) . Ведущимпризнаком заболевания является боль, ,возможно носящая хронический ха-рактер. Что подтверждается необходимостью приема нестероидных проти-вовоспалительных препаратов у большинства пациентов находящихся набазисной терапии, включающей и ГИБП.Хроническая боль в настоящее время трактуется в литературе как само-стоятельное заболевание , влияющее на эмоции и поведение личности. Био-психосоциальная модель представляет боль в качестве результата динами-ческого взаимодействия биологических, психологических и социокультурныхфакторов, последние выходят на первый план при хронизации боли . Посто-янное чувство дисконфорта ,чрезмерное внимание к боли на фоне премор-бидных личностных психологических особенностей может привести к боле-вому поведению, предусматривающему принятием пациентом образа жизни сисключением обычных нагрузок. Многомерный характер боли обнаружива-ется в модели Loeser состоящей из 4 кругов .которые отражают взаимодей-ствия между ноцицепцией (органическим компонентом боли), ощущением (регистрацией ЦНС), переживанием (страданием от боли ) и болевым поведе-нием .По мере увеличения продолжительности болевого синдрома компонен-ты переживания и поведения все больше влияют на восприятие боли ребен-ком .Поведенческие реакции ,проявляющиеся неадекватным снижением со-циальной активности чаще наблюдаются у пациентов с психологическими проблемами. Несмотря на наличие боли, хронического течения заболеванияс неопределенным прогнозом подавляющее число наших пациентов ведутобычный образ жизни, посещают школу и считают ,что это единственноправильный способ обучения, который они не хотят менять.Наличие хронической боли, преморбидные или вызванные болезньюнарушения в эмоциональной сфере , внешние изменения , гиперопека всемье могут явиться причиной развития поведенческих реакций, проявляю-щихся в выработке пациентом режима значительного ограничения социаль-ной активности, несоответствующего его физическому состоянию .При реко-мендации обучения в домашних условиях необходимо учитывать все поло-жительные и отрицательные стороны. Наши пациенты отстают в физическомразвитии от сверстников , поэтому проявить свое превосходство в интеллек-туальном развитии они могут именно в школе. Больные посещающие школу ,больше следят за своим физическим состоянием и выполняют назначения полечебной гимнастики.Заключение.1 Необходимость .домашнего обучения в период активного ревматологи-ческого заболевания не вызывает сомнения.2. Правильная форма обучения ученика средней школы и особенно стар-ших классов может быть выбрана при коллегиальном обсуждении родствен-ников, ревматолога длительно наблюдающего больного , педагогов школы исамого пациента.3. При любой форме обучения необходимо общение со сверстниками,позволяющее самоутвердиться в обществе и являющее мощным факторомпредотвращением поведенческих реакций ,выражающихся в уходе в бо-лезнь.
Шилова Л.Н., Страхов А.В., Паньшина Н.Н.,Капустина Е.А.
КАЧЕСТВО ЖИЗНИ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ СУСТАВОВ НА РАННИХ СТАДИЯХ БОЛЕЗНИ
ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград, Россия.
Одной из основных проблем ревматологии являются хронические заболе-вания суставов, вызывающие длительную боль и ограничение подвижности,что приводит к снижению возможностей пациента в профессиональной дея-тельности, а затем и к трудностям при самообслуживании. Все это способ-ствует снижению качества жизни больных и ухудшению их психологическогосостояния. Цель: оценка качества больных с хроническими воспалительными забо-леваниями суставов: ревматоидным артритом (РА), анкилозирующим спон-дилитом (АС), псориатическим артритом (ПсА) на ранних этапах болезни.Материалы и методы: под наблюдением находилось 40 больных ревма-тоидным артритом, 30 – анкилозирующим спондилитом, 25 – псориатическимартритом, 20 – практически здоровых лиц. Среди больных РА было 90 %женщин и 10 % мужчин, АС – 92% мужчин и 8% женщины, ПсА – 55% -женщины, 45% – мужчины. Все больные были в возрасте от 24 до 52 лет.Продолжительность заболевания составила до 5 лет. Все больные были со-поставимые по активности, тяжести поражения, проводимой терапии. Оценкакачества жизни (КЖ) проводилась с использованием шкал SF-36 и HAQ.Средний возраст больных РА составил 53,7 ± 16,8, а средняя продолжи-тельность заболевания 8,4 ± 7,28 лет. Серопозитивный РА выявлялся у 74 %пациентов, серонегативный – у 26%. Чаще всего встречалась II степень ак-тивности у 97% больных. По данным рентгенологического исследования: IIстадия определялась у 17 (42,5%), I – у 7 (17,5%), III – у 14 (35%), IV – у 2(5%) человек. Среди больных АС было 92% мужчин и 8% женщины. Сред-ний возраст больных всей группы составил 36,0±1,36. Средняя продолжи-тельность заболевания составила 12,6±0,72 лет. Дебют заболевания наблю-дался в 24,8±4,5 лет. По степени активности патологического процесса па-циенты были распределены таким образом: I степень установлена у 9 (30%)больных, II степень — у 16 (53,3%) и III степень — у 5 (16,7%).Все больные ПсА имели генерализованный суставной синдром: 2 (20 че-ловек – 80%) и 3 (20%) степени активности заболевания, очаговый (9) илираспространенный (16) вульгарный псориаз. Полиартритический вариантпсориатического артрита наблюдался у 14 больных, из них 60% – женщины;спондилоартритический вариант – у 11 больных, из них 65% – мужчины.Всем пациентам осуществлялось общеклиническое, лабораторное и ин-струментальное обследование. Оценка качества жизни (КЖ) проводилась сиспользованием шкал SF-36 и HAQ.Результаты. Наличие боли и функциональных ограничений в суставахнегативно отразились на параметрах качества жизни больных. По анкетеHAQ в подгруппах выявлены сниженные параметры у всех больных, причем,при РА были достоверно хуже. Значение функционального индекса наруше-ния жизнедеятельности FDI анкеты HAQ у пациентов с ревматоидным артри-том составил 2,6 (1,5; 2,9) баллов и был статистически значимо больше, чему больных анкилозирующим спондилитом – 1,8 (1,4; 2,3) баллов (р=0,008) ипсориатическим артритом – 1,6 (1,2; 2.0). Был проведен корреляционныйанализ клинических показателей и параметров КЖ у больных обеих под-групп. Наиболее чувствительным при анализе оказался показатель боли поВАШ при ходьбе, который продемонстрировал прямые сильные взаимосвязис параметрами КЖ как при АС (r=0,81, p=0,005), ПсА (r=0,61, p=0,004), таки при РА (r=0,72, p=0,000).Показатели КЖ у пациентов с РА по шкале SF-36 по 7 доменам из 8 былидостоверно хуже, чем в контрольной группе: физическое функционирование(39,0±20,3 и 46,2±19,5, р<0,001), физическое ограничение (7,5±17,1 и 30,6±32,5, р<0,05), физическая боль (31,7±10,2 и 66,2±27,7, р<0,01), вос-приятие состояния здоровья (21,2±10,3 и 50,2±15,8, р<0,01), социальноефункционирование (38,5±23,8 и 77,9±21,5, р<0,01), ролевые эмоциональ-ные ограничения (33,9±37,7 и 39,36±39,8, р<0,01), психическое здоровье(38,1±14,4 и 45,3±13,7, р<0,01). Показатели КЖ у больных АС по 6 доме-нам, а при ПсА по 5 доменам (исключая социальное функционирование) до-стоверно отличались от группы контроля: физическое функционирование,физическое ограничение, физическая боль, восприятие состояния здоровья,социальное функционирование, психическое здоровье.Выводы: таким образом, качество жизни у больных с хроническими за-болеваниями суставов достоверно снижается уже на ранних этапах болезни,особенно выражено в группе больных РА и АС.
Полученные данные по совокупности оцениваемых показателей свиде-тельствуют о том, что Результаты лечения были существенно лучшими в ос-новной группе больных ССД. Видимо, СРЭМ терапия обладает способностьювлиять на нарушения микроциркуляторного звена, оказывая положительноевоздействие на развитие изменений в микроциркуляторном русле различныхтканей. Происходит ускорение капиллярного кровотока, улучшение сократи-тельной способности сосудистой стенки и увеличение кровенаполнения.Увеличивается просвет функционирующих компонентов микроциркуляторного русла, возникают условия, способствующие раскрытию капилляров, ана-стомозов и шунтов. Вследствие вышесказанного происходит повышение со-судистой и эпителиальной проницаемости. По-видимому, под действиемэлектромагнитных низкочастотных токов в тканях происходит активациясистемы регуляции локального кровотока, повышение резорбционной спо-собности тканей, что приводит к ослаблению мышечного тонуса, усилениювыделительной функции кожи и уменьшению отека в очаге воспаления.Выводы. Таким образом, применение структурно-резонансной электро-магнитной терапии в комплексном лечении больных ССД способствует нор-мализации микроциркуляции, улучшению трофико-регенераторных и мета-болических процессов.
Сухих Е.Н., Симонова О.В., Немцов Б.Ф., Тимин М.В.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА КАЧЕСТВО ЖИЗНИБОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛОАРТРИТОМ
ГБОУ ВПО «Кировская ГМА» Минздрава России, г. Киров, Россия
Цель. Оценить влияние заболевания на качество жизни (КЖ) больныханкилозирующим спондилитом (АС).Материалы и методы: В исследование включены 62 больных с досто-верным диагнозом АС. Среди больных АС преобладали мужчины (77,4%).Возраст больных варьировал от 20 до 55 лет (средний возраст – 38,57,9лет). Продолжительность болезни составляла от 3 месяцев до 30 лет (всреднем – 17,310,8 лет). Соотношение аксиальной и периферической формАС было примерно равным (51,6% и 48,4% соответственно). Число болез-ненных периферических суставов составляло в среднем 3,5±2,7, припухших– 0,85±1,3. У 40,3% были выявлены энтезопатии. Больные имели преимуще-ственно II степень активности (64,5%). Максимальная активность АС отме-чена в 19,4% случаев, а в 16,1% случаев выраженность воспалительногопроцесса была минимальной. У большинства (48,4%) больных имелась IVрентгенологическая стадия сакроилеита (по Kellgren). В 3,2% случаев опре-делялась I, в 25,8% – II, в 22,6% – III рентгенологическая стадия пораже-ния крестцово-подвздошных сочленений. У трети больных наблюдалисьэкстраартикулярные проявления заболевания. Наиболее часто встречалисьсубфебрилитет (8%), сенсорная полинейропатия (9,7%), анемия (8%), аор-тальная недостаточность (8%), реже похудание (4,8%) и увеит (4,8%) нафоне высокой активности воспалительного процесса. У 2 больных (3,2%) состажем заболевания 12 и 14 лет развился вторичный амилоидоз почек. Увсех больных был выявлен HLAB27. Из сопутствующей патологии наиболеечасто встречалась артериальная гипертензия (25,8%). На момент исследова-ния 46,7% больных получали симптоматическую терапию нестероиднымипротивовоспалительными препаратами, 16% пациентов принимали сульфасалазин, 6,5% – метотрексат, 8% – комбинированную терапию сульфасала-зином и метотрексатом.Для оценки активности заболевания использовали индекс BASDAI. Оцен-ка функциональных возможностей пациента проводилась с помощью индексаBASFI, опросника HAQ и HAQ-AS. КЖ больных изучали по шкале SF-36. Дляоценки влияния заболевания на КЖ пациентов по шкале SF-36 проводилисравнительную оценку показателей КЖ больных АС и показателей популя-ционных норм, которые были получены Межнациональным центром исследо-вания КЖ в Санкт–Петербурге с вычислением 8 основных показателей: фи-зическое функционирование (ФФ), ролевое физическое функционирование(РФФ), боль (Б), общее здоровье (ОЗ), жизнеспособность (Ж), социальноефункционирование (СФ), ролевое эмоциональное функционирование (РЭФ),психическое здоровье (ПЗ).Результаты: Среднее значение индекса BASDAI составило 67,9±17,8 мм.По опроснику HAQ среднее значение составило 1,74±0,8, HAQ-AS – 1,8±0,5.HAQ более 1,5 наблюдалось у 47,5% больных. Средние значения индексаBASFI составили 44,5±18,2 мм. Было выявлено, что наблюдается прямаякорреляционная связь между активностью заболевания и функциональнымстатусом по HAQ (r=0,42; p<0,01) и HAQ-AS (r=0,44; p<0,01). Все показа-тели КЖ были достоверно хуже у больных АС по сравнению со здоровымилицами (р<0,001). У больных АС в наибольшей степени изменялись показа-тели физического здоровья (ФФ, РФФ, Б). РФФ было снижено на 78%, пока-затель Б на 55%, показатель ФФ на 74% по сравнению со здоровыми лица-ми. Среди показателей КЖ, характеризующих психологическое здоровье (Ж,СФ, РЭФ, ПЗ), в большей степени было снижено РЭФ – на 75% и Ж – на 33%.Показатель СФ, являясь самым высоким среди всех параметров КЖ у боль-ных АС (55,3±25,2), тем не менее, был на 15% хуже, чем у здоровых лиц.Для оценки факторов, влияющих на показатели КЖ больных АС, был пред-принят анализ корреляционных связей некоторых клинических показателейсо значениями отдельных шкал SF-36. Была выявлена корреляция между ФФи степенью активности заболевания (r=-0,62; p<0,01), BASDAI (r=-0,61;p<0,01), суставным индексом (r=-0,68; p<0,001) и BASFI (r=-0,59; p<0,01),между РФФ и степенью активности заболевания (r=-0,54; p<0,01), стажемзаболевания (r=-0,44; p<0,05), BASDAI (r=-0,46; p<0,05) и BASFI (r=-0,43;p<0,05), между показателем шкалы боли и BASDAI (r=-0,45; p<0,05), ско-ванностью в позвоночнике по ВАШ (r=-0,50; p<0,05), длительностью утрен-ней скованности в позвоночнике (r=-0,65; p<0,01), между РЭФ и степеньюактивности заболевания (r=-0,54; p<0,01), болью в позвоночнике по ВАШ(r=-0,42; p<0,05), утомляемостью по ВАШ (r=-0,51; p<0,05), общим само-чувствием по ВАШ (r=-0,42; p<0,05).Выводы: Показатели КЖ больных АС достоверно ниже по сравнению создоровыми лицами. Выраженность нарушений по различным шкалам опрос-ника КЖ коррелирует с показателями активности, стажа заболевания инарушением функциональных возможностей.
Тихомирова Н.Ю., Елисеева Л.Н., Фёдорова Н.П.
ОЦЕНКА СЕРДЕЧНО-СОСУДИСТОГО РИСКА У ЛИЦ МОЛОДОГО ВОЗРАСТА С СИНДРОМОМ ГИПЕРМОБИЛЬНОСТИ СУСТАВОВ
ГБОУ ВПО КубГМУ Минздрава России, Краснодар, Россия
Цель: оценить сердечно-сосудистый риск у лиц молодого возраста с син-дромом гипермобильности суставов.Материалы. Методом анкетирования и экспресс-анализатором обследо-вано 300 студентов медиков. Подписавших информированное согласие наобследование и обработку персональных данных.Методы. Всем обследованным был выполнен экспресс-анализ общегохолестерина и глюкозы в крови на экспресс-анализаторе CardioChek, прове-дены антропометрические исследования, определение окружность талии,вычисление ИМТ (как отношение веса к росту в метрах в квадрате), опреде-лён уровень АД. Проводилась акцентуация на выявление внешних признаковнедифференцированной дисплазии соединительной ткани с особым внима-нием к синдрому гипермобильности суставов. Признаками синдрома гипер-мобильности суставов считалось количество баллов по критериям Брайтона≥ 4. Факторами кардио-васкулярного риска считались уровень глюкозы ка-пиллярной крови ≥ 5,6 ммоль/л; уровень холестерина ≥5,0 ммоль/л; индексмассы тела ≥25 кг/м2; АД≥ 130/85 мм рт.ст.; окружность талии у девушек ≥80 см, а у мужчин ≥94 см.Полученные результаты. Все обследованные являются студентами 4курса медицинского университета. Участники исследования после подписа-ния информированного согласия и анализа с помощью анкет, обследованияантропометрических и инструментальных данных были разделены на группуздоровых и группу пациентов с признаками гипермобильности суставов.Вторая группа подверглась экспресс-анализу риска сердечно-сосудистойсистемы по системе SCORE. Установлено, что 97% имели студентов с при-знаками гипермобильности суставов имели низкий сердечно-сосудистыйриск, 3% – высокий сердечно-сосудистый риск. В целом у 5,5 % обследо-ванных была выявлена гипергликемия, из них никто не страдал сахарнымдиабетом. Впервые зарегистрированная у этих лиц гипергликемия послужи-ла поводом для их направления на более углубленное обследование к эндо-кринологу с целью исключения сахарного диабета и нарушения толерантно-сти к глюкозе. Уровень артериального давления у всех обследованных былнормальным. У 22,2 % обследованных выявлена гиперхолестеринемия.22,2% человек имели отклонения от нормы со стороны индекса массы тела(ИМТ). Среди них 16,6 % имели избыточный вес, ожирение 2 степени –33,3%; а у 50,1 % человек – недостаточную массу тела. Всего у 5,5% муж-чин объём талии превышал 94 см, а среди девушек объём талии более 80 смбыл выявлен в 3,7% случаев. Обсуждение. В настоящее время уделяется большое внимание влияниюдисплазии соединительной ткани, одним из проявлений которой являетсясиндром гипермобильности суставов, на состояние сердечно-сосудистой си-стемы (формирование вегетативной дисфункции, прогрессирование артери-альной гипертензии, ИБС, нарушения ритма сердца и ХСН). Среди лиц моло-дого возраста с синдромом гипермобильности суставов распространены та-кие факторы кардиоваскулярного риска, как гиперхолестеринемия, избы-точный вес, недостаточная масса тела, ожирение 2 степени, гипергликемия,окружность талии у мужчин более 94 см, у девушек более 80 см.Выводы. Устранение факторов кардиоваскулярного риска, выявленныхпри обследовании (гиперхолестеринемия, избыточный вес, недостаточнаямасса тела, ожирение 2 степени, гипергликемия, окружность талии у мужчинболее 94 см, у девушек более 80 см), позволит минимизировать риск разви-тия сердечно-сосудистых заболеваний. Рационально в план диспансерногообследования студентов вводить опросники характеризующие дисплазиюсоединительной ткани и использовать методы экспресс-оценки основныхфакторов риска сердечно-сосудистой системы.
Фомичева А.А., Куликов А. И., Ялтырян В. В., Ханов А.Г.
ДЕФРАГМЕНТАЦИЯ РЕВМАТОЛОГИЧЕСКОЙ ЗАБОЛЕВАЕМОСТИ НАСЕЛЕНИЯ ТЕРРИТОРИИ
Минздрав РО, ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
В настоящей статье мы предлагаем ввести понятие «дефрагментациязаболеваемости населения» и план ее реализации. Термин «дефрагмен-тация» взят из компьютерной литературы, где он обозначает оптимизациюхранения файлов в непрерывной последовательности для ускорения доступак ним. Дефрагментация имеет и графическое выражение, когда до началапроцесса, распределение файлов на жестком диске представляет собой мно-жество линий разного цвета и толщины. После проведения процесса, остает-ся несколько крупных прямоугольников 3-4 цветов дающих общую картинураспределения хранения файлов.В медицинское понятие дефрагментации мы вкладывает выравниваниеуровней заболеваемости и болезненности населения в целом и по отдель-ным нозологиям, в рамках отдельного города, района, отдельных админи-стративных территорий, субъектов федерации, объединенных в админи-стративные округа. Важным моментом является расположения территорийпо соседству, что определяет примерно одинаковые климатические, соци-ально – экономические условия проживания населения.Распространенность БКМС нельзя рассматривать в отрыве от общего здо-ровья населения. Поэтому, нами был проведен анализ эпидемиологическихситуации по РЗ в РО за 6 лет. Результаты изложены в интернет – издании«Эпидемиологические тенденции ревмопатологии в РО. 2013г.» По материалам статистических отчетов, показатели болезненности на 1000 населенияпостоянного росли. Если взять за точку отсчета первоначальные данные, тов каждом году, в сравнении с ней, общая болезненность соответственноувеличивалась на 1%, 3%,7,5%, 9% ежегодно. И только в последний годнаблюдения снизилась на 1% в сравнении с предыдущим.Ситуацию с общей заболеваемостью оценивать сложней, в связи с еепостоянными колебаниями, происходящими без каких-то явных внутреннихили внешних причин. Если взять за точку средний уровень заболеваемостинаселения, то ежегодные отклонения соответственно составляли -2%, +1%,+2%, -1%, +1,5%, -2%. Еще более наглядные данные предоставляет ран-говая таблица первичной заболеваемости по классам заболеваний. Динамикаранга класса БКМС составляла по годам 5-5-4-4-5-4 место. Впереди БКМС,патология дыхательной системы (1-1-1-1-1), мочеполовой системы (2-3-2-2-3-3), травмы и отравления (3-2-3-3-2-2), болезни кожного покрова (4-4-5-5-4-5).Делать строгие Выводы о истиной распространенности БКМС, по даннымофициальной статистики сложно, ввиду ее особенностей, о которых мы ука-зывали в предыдущих статьях. Важным моментом является то, что шифрамиБКМС пользуются врачи массовых терапевтических и хирургических специ-альностей, включая педиатров и даже генетики. Это откладывает опреде-ленный отпечаток на «чистоту» диагнозов и соответственно на возможностьконтроля над процессами ее развития. Еще одним, важным, отрицательныммоментом современной статистики является «потеря» ревматических боль-ных в случаях развития у них осложнений, острых состояний или заболева-ний угрожающих жизни. Особенно это проявляется в учете смертностинаселения, когда на долю РЗ, приходится 0,081% (2011г.). Фактически этоучтенная смертность только от СКВ, ССД, васкулитов. При этом больные стяжелой суставной патологией, которой они страдали десятилетиями, при-знавались инвалидами и соответственно получали значительные объемымедицинской помощи, «утеряны».Показатели болезненности населения по классам заболеваний более«стабильны» и имеют устойчивые тенденции на протяжении десятилетий,чем показатели заболеваемости. Так, ранговое место БКМС 5-4-4-4-4-4. Впе-реди болезни ССС 1-1-1-1-1-1, болезни органов дыхания 2-2-2-2-2-2, моче-половой системы 3-3-3-3-3-3, и раньше были заболевания органов пищева-рения 4-5-6-5-5-5.Изучение распространенности РЗ по отдельным территориям РО проводи-лась нами по данным ежегодного статистического сборника о здоровьевзрослого населения РО, где представлены данные по классу БКМС в целом,и по отдельным ревматическим нозологиям (ОРЛ, ХРБС, РА, АС, системныеболезни соединительной ткани, артрозам) по 12 городам и 43 сельским рай-онам.Общие Выводы о состоянии здоровья по отдельным территориям РОпроводились в целом и отдельно, для «городского» и «сельского» населе-ния». Так «разброс» первичной заболеваемости по сельским районам со-ставляет 2,3, а по городам 3,8 раза. Первичная заболеваемость БКМС в РО на 24% выше, чем по РФ и на 24% выше, чем по ЮФО. Первичная заболева-емость БКМС в сельских районах на 25% выше, чем в городах. В тоже времяобщая заболеваемость (болезненность) БКМС в РО на 7% ниже, чем по РФ ина 22% чем по ЮФО. В городах РО на 10% выше, чем в сельских районах.По отдельным нозологическим формам ситуация такова. Первичная забо-леваемость ОРЛ по РО в 14 раз меньше чем по РФ и 8 раз, чем по ЮФО.Первичная заболеваемость ОРЛ в городах и сельских районах одинакова.Общая заболеваемость ОРЛ по РО на 5% ниже, чем по РФ и на 66% выше,чем в ЮФО. Общая заболеваемость ОРЛ в городах и районах РО одинакова.Первичная заболеваемость ХРБС в РО на 2% выше, чем в РФ и на 7% чемв ЮФО. Первичная заболеваемость ХРБС в 7 раз выше в сельских районах,чем в городах РО. Общая заболеваемость ХРБС в РО на 26% ниже, чем в РФи на 5% выше, чем по ЮФО. Общая заболеваемость ХРБС на 7% больше вгородах, чем на селе.Первичная заболеваемость РА в РО в 6 раз ниже, чем в РФ и 4 раза, чем вЮФО. Первичная заболеваемость РА городского населения на 33% выше,чем сельского. Имеют место случаи, что в отдельных территориях за год невыявлено ни одного нового случая РА. При этом заболеваемость в 2 соседнихсельских районах может различаться в 46 раз, а в двух городах, располо-женных на удалении 25 км, в 17 раз. При этом общая заболеваемость РАнаходится на уровне показателей РФ и на 30% выше, чем по ЮФО. Общаязаболеваемость РА на 55% выше среди городского населения.По первичной заболеваемости АС, РО «обгоняет» РФ в 4 раза, а ЮФО в 3раза. Среди городского населения заболеваемость АС на 33% выше, чемсельского. При этом в 42% сельских территорий за год не было выявлено ниодного больного Болезнью Бехтерева. По показателю общей заболеваемостиАС, РО характеризуется низким уровнем (на 55% ниже РФ и 28% нижеЮФО). Общая заболеваемость АС городского населения на 33% выше, чемсельского. По системным заболеваниям соединительной ткани (общая забо-леваемость) показатели РО на 14% ниже, чем в РФ и на 15% выше, чем поЮФО. Среди городских жителей РО они на 33% встречаются чаще.Аналогичная ситуация и по общей заболеваемости артрозами (по РО онина 14% ниже чем по РФ и на 15% выше, чем по ЮФО). Среди городских жи-телей РО, артрозов фактически на 50% больше чем на селе.Графические материалы к статье в силе скетчноутинга по адресу:http://visualrheumatology.ru/defragmentatsiya-revmatologicheskoyzabolevaemosti-naseleniyaВажнейшим вопросом здравоохранения является дальнейшее наблю-дение, лечение и реабилитация пациента после установления диагноза. Ран-няя диагностика и эффективное лечение соответствует государственныминтересам и гуманистическим принципам медицины. В настоящее время,после установления диагноза ревматологический пациент фактически выпи-сывается « в никуда». Это связано с тем, что нормативными документами,диспансерное наблюдение РЗ должно осуществляться ревматологом. Но ре-альность такова, что ни одного ревматолога в сельских районах нет (их не может быть по существующим нормативам и в свете дефицита врачебныхкадров на селе). Аналогичная ситуация и в городах РО, в 70% которыхштатных ревматологов нет. Последние приказы по диспансеризации тера-певтических заболеваний обязывают терапевтов проводить диспансерноенаблюдение только пациентов с остеопорозом. Все это приводит к тому, чтоновые организационные подходы по ранней диагностике РЗ, международнаяпрограмма по лечению РА «Лечение до достижения цели» («Treat To Target»,T2T) «повисают» в воздухе. Новые подходы (по использованию опыта ипринципов работы врачебных бригад при лечении АГ для ревматическихбольных и расширения полномочий м/с) также не могут быть реализованыиз-за отсутствия ревматологических кадров и регламентирующих докумен-тов.И самое главное, для конкретного больного навсегда теряется «Окновозможностей» -«Золотое» время в лечении и дальнейшем прогнозе каче-ства жизни, до превращения больного в реального инвалида, требующегопостоянной медицинской помощи, но когда он уже может получить доступк высокотехнологичной помощи, эффективность которой на данной стадиизаболевания проблематична.При подготовке анализа ревматологической патологии, нами были ис-пользованы шкалы уровней заболеваемости по каждой нозологии. Так, приОА, уровень заболеваемости оценивался от 0 до 100 случаев на 1000 взрос-лого населения с «шагом» в 10 пунктов; при системных заболеваниях, от0,01 до 5,0, при «шаге» 0,1; при АС от 0,01 до 1,5, при «шаге» 0,05; приРА от 0,2 до 9,0, при «шаге» 0,4; при ХРБС от 0,01 до 1,5, при шаге«0,05»; при ОРЛ от 0,01 до 0,2, при «шаге» 0,02; при БКМС в целом от 10до 120, при «шаге» 10. При составлении таблиц, каждый «шаг» имел свойцвет, что на таблицах и графиках выглядело очень красиво, но при аналити-ческой оценке сильно «дробило» общую картину.Обсуждение. Показатели заболеваемости РЗ по отдельным территориямРО нуждаются в срочной дефрагментации (выравнивании).Случаи не выявления в течение года «основных» РЗ подлежат оператив-ному разбору. Территории, как с высокими, так и с низкими показателямизаболеваемости БКМС, подлежат оперативному контролю областными спе-циалистами. Необходим оперативный, ежеквартальный мониторинг ревма-тологической заболеваемости районными и городскими специалистами, спроведением превентивных мероприятий не дожидаясь окончания года,когда время будет фактически упущено. Для владения оперативной стати-стической информацией необходимо обеспечить районных и городскихспециалистов аналитическими записками о состоянии здоровья населениявсей области и в разрезе территорий. Для выявления РЗ необходимо вырав-нивание лабораторно-диагностической базы ЛПУ, особенно амбулаторно -поликлинического звена. Остается актуальным вопрос повышения квалифи-кации специалистов массовых терапевтических и хирургических специаль-ностей по вопросам ревматологии. Необходимо предусмотреть соответству-ющие курсы и для фельдшеров и акушерок ФАПов и ФП, а также врачейскорой и неотложной помощи. Назрела необходимость расширения полномочий и функциональных обязанностей м/с после их соответствующей под-готовки, при оказании помощи ревматическим больным.При подготовке анализа заболеваемости ревматическими болезнями вцелом, и по отдельным нозологиям, необходимо опираться на минимальныеи максимальные цифры статистики своего региона. Желательно всю заболе-ваемость делить на 4 уровня: нет случаев, низкий, средний и высокий уро-вень, что при цветном графическом изображении обеспечит высокуюнаглядность. Организационно – методические кабинеты ЛПУ, для повышениядостоверности и полноты статистического учета на закрепленной террито-рии, могут привлекать ревматологов или врачей прошедших подготовку поизбранным вопросам ревматологии в качестве консультантов. Совместныйоперативный контроль позволит через статистический талон «выйти» наконкретного пациента, который или часто обращается за медицинской по-мощью, или входит в группу риска по РЗ. Широко известно, что у невроло-гов, под «маской» остеохондрозов могут «скрываться» ревматическиеспондилоартропатии, а в практике амбулаторных хирургов и травматологов,моно – или олигоартриты могут быть дебютом воспалительных артропатий.Необходимо проведение систематической работы со всеми врачами для«искоренения» диагноза «деформирующий» артроз или плечелопаточныйпериартрит «на все случаи жизни». Комплекс мероприятий в конечном итогедаст дополнительный поток больных, нуждающихся в специализированнойпомощи ревматолога.
Фофанова Н.А., Симакова Е.С., Ковех А.А., Кравцова Е.Г., Заводовский Б.В., Чернов А.С.
РАСПРОСТРАНЕННОСТЬ ОСТЕОПОРОЗА И ЕГО ОСЛОЖНЕНИЙ В ВОЛГОГРАДСКОЙ ОБЛАСТИ
ФГБУ «НИИ КиЭР» РАМН, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград, Россия
В Волгоградской области отмечается постепенное старение населения, всвязи с чем возникает множество медико-социальных проблем, связанных сзаболеваниями пожилых. На одном из первых мест по заболеваемости срединих стоит остеопороз (ОП). Социальная значимость остеопороза определяет-ся его последствиями и осложнениями – низкотравматичными переломамипозвоночника и трубчатых костей, которые обуславливают значительныйподъем заболеваемости, инвалидности и смертности.Целью данной работы было исследовать частоту развития остеопении иостеопороза, а также распространенность остеопоретических переломов вВолгоградской области.Методом рентгеновской абсорбционной остеоденситометрии на аппаратеLUNAR XP (США) было обследовано 10620 человек в возрасте от 20 до 89 лет, из них 6422 женщины и 4198 мужчин. Повторное обследование прово-дилось с интервалом в 1 год.У 3959 пациентов (37,28%) обнаружено снижение показателей BUA, Z и Tниже границ нормы, что сопряжено с риском возникновения переломов. Изних 2796 человек страдали остеопенией (26,38%), 1156 – остеопорозом(10,91%) и 6648 пациентов имели нормальную плотность костной ткани(80,4%). Остеопороз и остеопения достоверно чаще диагностировались уженщин старше 50 лет с низким индексом массы тела (р0,005). Анализ бо-лее 30 факторов риска остеопороза и переломов проводился раздельно всоответствующих группах мужчин и женщин. Выявлено, что к достовернымфакторам риска остеопороза можно отнести возраст 65 лет и более, вес тела57 кг и ниже, индекс массы тела менее 20, курение и злоупотребление алко-голем. Кроме того дополнительно для женщин: возраст начала менопаузы до45 лет и длительность менопаузы более 25 лет. Для мужчин: тяжелый физи-ческий труд в возрасте 15 – 25 лет (р<0,03), низкая физическая активностьпосле 25 лет (р<0,01), недостаточное потребление молочных продуктов(р<0,01).Всем пациентам было проведено исследование биохимических маркеровкостного метаболизма: остеокальцина в крови и Cross Laps в моче (Osteometer,Дания), кислой фосфатазы (Ольвекс Диагностикум), щелочной фосфата-зы (Lachema). У всех пациентов с остеопеническим синдромом было выявле-но нарушение метаболизма костной ткани. Частота переломов костей оцени-валась путем сбора анамнеза и оценки рентгенограмм позвоночника. Стан-дартизованные показатели распространенности переломов предплечья со-ставили 26 (0,245%), позвоночника – 837 (7,896%), шейки бедра – 19(0,179%). Переломы костей у пациентов с остеопорозом и остеопениейнаблюдались достоверно чаше, чем у лиц с нормальной плотностью костнойткани (р<0,001).Наиболее частой локализацией переломов у женщин были переломы ди-стального отдела предплечья и проксимального отдела бедренной кости,которые достоверно превышали их распространенность у мужчин (р<0,001 ир<0,002 соответственно). У мужчин более часто наблюдались переломы дру-гой локализации (голень, кости кистей и стоп) и ребер (р<0,02). Наиболеечастым типом перелома позвоночника был клиновидный (13,6% мужчин и12,2% женщин), выявляемый преимущественно в среднегрудном отделе Т6 –Т8. Следующими по частоте были двояковогнутые переломы (по типу «рыбь-их позвонков»), которые чаще локализовались в нижнегрудном и пояснич-ном отделах позвоночника (3,7% мужчин и 5,9% женщин). Наиболее редкийтип перелома – компрессионный, преобладал у мужчин (4,1%) по сравнениюс женщинами (0,5%) (р<0,001).Проспективное наблюдение когорты в течение трех лет показало, что ча-стота новых случаев переломов костей за период наблюдения составила 3,6среди женщин и 0,7 на 100 человеко-лет среди мужчин (р<0,0001). Основ-ной локализацией новых переломов были переломы дистального отделапредплечья (40,1%), 90,7% которых зарегистрированы у женщин. Новыеслучаи остеопоретических переломов позвоночника выявлены у 9,8% жен-щин и 5,6% мужчин. Максимальное число переломов отмечено в зимнее время (36,4%), которое превышало их частоту (16,2%) в весенние и летниемесяцы (р<0,05).У женщин подавляющее число переломов (93,7%) произошло в резуль-тате минимальной травмы, что превышает аналогичный показатель у мужчин(р<0,0001) и свидетельствует о влиянии остеопороза как ведущей причиныэтих переломов. Среди мужчин преобладало падение с большой высоты илитяжелая травма (31,8% против 5,4% у женщин; (р<0,0005). В нашей выбор-ке была выявлена зависимость частоты переломов от возраста у мужчин(р<0,05), переломами чаще страдали мужчины 75 лет и старше. В то времякак среди женщин наибольшие показатели распространенности переломовотмечены в возрастных группах 65-69 лет и 75 лет и старше, причем в стар-шей группе она была выше, чем во всех предыдущих группах вместе взятых(р<0,004).Таким образом, распространенность остеопенического синдрома срединаселения Волгоградской области составляет 37,28%. Остеопороз являетсячастой причиной переломов костей. По сравнению с другими регионами Рос-сии область является регионом со средней частотой переломов костей.
Ханов А.Г.
КУМАРИНОВЫЙ НЕКРОЗ В ПРАКТИКЕ РЕВМАТОЛОГА
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону, Россия.
Ревматолог, как врач – специалист, выступает консультантом в клини-ческих ситуациях, когда имеются трофические нарушения на пальцах, му-тиляция концевых фаланг или развивается их некроз. Эти ситуации воз-можны, как при РЗ, довольно широко известных среди врачей других спе-циальностей (ССД, ПА), так и при заболеваниях, лечением которых занима-ются хирурги (облитерирующий эндартериит – «ноги курильщика», облите-рирующий атеросклероз, болезнь Рейно). Сосудистые поражения дистальныхотделов конечностей возможны при СКВ, практически при всех видах вас-кулитов, как в рамках течения самого заболевания, так и при проведенииантикоагулянтной терапии. Остеолиз ногтевых фаланг отмечается при лепре.Нежелательные кожные реакции на фоне антикоагулянтной терапиинаблюдаются на фоне приема антикоагулянтов прямого ( быстрого)действия (гепарин натрия, надропарин кальция, эноксапарин натрия и др.),и антикоагулянтов непрямого действия (антагонисты витамина К) — дли-тельного действия (варфарин, фениндион, аценокумарол и др), а также ги-рудина. Проявления кожных реакций варьирует от локальных аллергиче-ских проявлений до некрозов. Различные аллергические реакции встре-чаются относительно часто. Некрозы на фоне приема непрямых антикоагу-лянтов, так называемые «кумариновые» или «варфариновые» некрозывстречаются относительно редко — у 0,01—0,1% больных, принимающихантагонисты витамина К. Под нашим наблюдением, находилась больнаяЕ.,84 лет, доставленная по скорой помощи с диагнозом: Гангрена пальцеврук и стоп в хирургический стационар для проведения некрэктомии. Дежурным хирургом приглашен на консультацию ревматолог для исключения си-стемного заболевания. Из анамнеза известно, что в течение года стала отмечать зябкость, онемение, побледнение пальцев рук. Через 3 месяца обрати-лась к сосудистому хирургу. Была госпитализирована в стационар с диагнозом: Облитерирующий атеросклероз, острая эмболия мелких артерий,осложненная гангреной ногтевых фаланг обеих кистей. После выпискиначала прием варфарина в дозе 2,5мг х 2 раза в день. Несмотря на проводи-мое лечение, состояние продолжало ухудшаться. Начавшись на левой кисти,процесс охватил правую кисть. В области лодыжки правой стопы образова-лась глубокая трофическая язва. Развилась симметричная сухая гангренамизинцев стоп. При обращении в стационар, больной выполнены рентгено-граммы кистей рук и стоп, где обнаружен остеолиз ногтевой фаланги Vпальца левой кисти и патологические переломы средних фаланг II и IIIпальцев справа и слева. Подробное описание клинического случая по адре-су: http://visualrheumatology.ru/kumarinovyiy-nekroz-v-praktike-revmatologai-pri-provedenii-antikoagulyantnoy-terapii.htmlОбсуждение. На сегодняшний день, чаще сообщается о кожных реакциях на фоне приема варфарина, что связано с его болеешироким клиническим применением в отличие от фенилина и других пре-паратов этой группы. Однако подобные явления встречаются при ис-пользовании любых непрямых антикоагулянтов. Истинная частотаподобных побочных действий лекарственного средства (ЛС) гораздовыше, так как далеко не о каждом случае специалисты здра-воохранения сообщают в виде печатных работ. Вышедший более 10 лет назад приказ МЗ об учете побочного действия и нежелательных явленийпри использовании ЛС практически прошел незамеченным, не говоря о егопрактической реализации. Для профилактики осложнений при терапии вар-фарином, рекомендуется начинать лечение с малых доз, не превышать це-левые уровни МНО и проводить тщательный лабораторный контроль. Про-гнозируется, что введение в широкую клиническую практику прямых ингибиторов тромбина (аргатробан, мелагатран/ксимелагатран) и селективныхингибиторов фактора Xa (фондапаринукс, идрапаринукс и т.д.) позволитзначительно снизить частоту подобных нежелательных явлений.
Ханов А.Г., Мозговая Е.Э., Стажаров М.Ю.
СТРУКТУРА БОЛЕЗНЕЙ КОСТНО-МЫШЕЧНОЙСИСТЕМЫ И СОЕДИНИТЕЛЬНОЙ ТКАНИ В РАБОТЕ ПРАКТИЧЕСКОГО ВРАЧА
ГБУ РО «Областная клиническая больница № 2», г. Ростов-на-Дону;ФГБУ«НИИ КиЭР» РАМН, г.Волгоград, Россия.
В настоящее время ревматические заболевания (РЗ) сохраняют ши-рокую распространенность, на их долю приходится большой процент вструктуре утраты трудоспособности как временной, так и стойкой. Однакопроследить реальную судьбу ревматологического больного и соответственно результативность комплекса лечебно-оздоровительных мероприятий доста-точно сложно. С одной стороны, это связано с особенностями статистики прикоторой в случае возникновения осложнений или серьезных заболеванийревматологический диагноз «теряется». Особенно это наглядно при стати-стическом учете причин смерти, когда например, у ревматологическогобольного случается желудочно-кишечное кровотечение или инфаркт мио-карда. С другой стороны мы имеем множество диагнозов заболеваний кост-но-мышечной системы , установленных врачами различных специальностейв рамках их компетенции и познаний в ревматологии. Здесь возможны, какнеправильная формулировка диагноза, так и поверхностное отношение ксамой диагностике, когда любая боль в спине проходит под диагнозомостеохондроз. Еще более частый пример – остеоартроз, диагноз которогоможно сравнить по частоте выставления с диагнозом ишемической болезнисердца при всех случаях болей в сердце. Формально, такие диагнозы имеютправо на существование, но жаль ,что это не всегда соответствует действи-тельности.Если рассмотреть нозологии в рамках МКБ Х, то диагноз острой ревмати-ческой лихорадки может устанавливаться педиатрами, терапевтами, отори-ноларингологами, кардиологами. Хроническая ревматическая болезнь серца– диагноз терапевтов, кардиологов, кардиохирургов. Инфекционные артро-патии (в их числе реактивные артриты) могут диагностировать инфекциони-сты – постдизентерийный артрит. Гнойный артрит выявляют хирурги, трав-матологи ; туберкулезный артрит – фтизиатры, менингококковый артрит –неврологи, артрит при сифилисе – дерматологи, постиммунизационный арт-рит –педиатры. Диагностика воспалительных полиартропатий, включаяревматоидный артрит, возможна любым врачом, псориатического артрита –дерматологом, артрита при колитах –гастроэнтерологом, ювенильного арт-рита –педиатром. Подагра может диагностироваться урологами и нефроло-гами. Кристаллические, специфические артропатии, неуточненные и другиеартропатии может вывить участковый терапевт или семейный доктор приналичии специальных знаний. Артропатии при нарушениях обмена веществвстречаются в практике эндокринологов и генетиков, остеоартроз – на при-еме у терапевтов и общих хирургов. Травматологи ортопеды, хирурги встре-чаются с приобретенными поражениями суставов, такими как деформации,вывихи, поражение связок, контрактуры, анкилозы. Больные с системнымипоражениями соединительной ткани обращаются к ревматологам, гематоло-гам, дерматологам, окулистам, травматологам, онкологам; при дорсопатиях- к травматологам, подростковым врачам, неврологам, нейрохирургам, рев-матологам, терапевтам; при спондилопатиях – к ревматологам, неврологам,травматологам, нейрохирургам, хирургам, тубологам, инфекционистам; приболезнях мягких тканей, включающих болезни мышц, – к терапевтам, ин-фекционистам, хирургам, травматологам, неврологам, онкологам; при пора-жениях синовиальных оболочек и сухожилий – к хирургам, травматологам.Другие заболевания мягких тканей выявляют профпатологи, травматологи,хирурги, дерматологи, неврологи, терапевты. Остеопатии и хондропатиивстречаются в практике травматолога, хирурга, гинеколога, нейрохирурга,невролога, онколога, эндокринолога, геронтолога, профпатолога, инфекцио-нита, гематолога, туболога, подросткового врача, терапевта; другие нарушения костно-мышечной системы и соединительной ткани на приеме у травма-толога, оториноларинголога, гинеколога, хирурга, нейрохирурга.Таким образом, следует обратить внимание, что заболевания из классаболезней костно-мышечной системы и соединительной ткани (БКМС и СТ)часто диагностируются врачами многих специальностей в меру их компетен-ции, которая не соответствует уровню подготовки врача ревматолога.Значение статистики в оценке состояния здоровья населения, планиро-вания деятельности учреждений здравоохранения огромно. В то же время вдействительности, статистические показатели с одной стороны невостребо-ванны широкой массой врачей, а с другой труднодоступны.Нами подготовлена и размещена в сети интернет презентация «Эпиде-миологические тенденции ревмопатологии в Ростовской области» по адресуhttp://visualrheumatology.ru/epidemiologicheskie-tendentsii-revmopatologii-vrostovskoy-oblasti-prezentatsiya.html. Общий план ее представляет оценкуБКМС и СТ в рамках общей заболеваемости и болезненности населения, по-казателей смертности и потерь трудоспособности, сравнение основных по-казателей РЗ по субъектам ЮФО, характеристику ревматологической служ-бы Ростовской области в сравнении с соседними территориями. Дан анализревмапатологии по городам и районам Ростовской области. Необходимо от-метить, что существенных изменений в статистических показателях на про-тяжении 6 лет анализируемого периода выявлено не было. Также нами под-готовлены сборники по статистике РЗ. В книгу 1 вошли показатели заболе-ваемости острой ревматической лихорадкой и хронической ревматическойболезнью сердца по городам и районам Ростовской области за 2011 г. в ди-намике http://visualrheumatology.ru/zdorove-naseleniya-rostovskoyoblasti.html. В книге 2 содержатся показатели болезненности и заболеваемо-сти по классу БКМС и СТ в целом, по всем городам и районам Ростовскойобласти в динамике 2010-2011 гг. http://visualrheumatology.ru/zdorovenaseleniya-rostovskoy-oblasti-2011g-kniga-2.html. В книгу 3 вошли остеоарт-розы и системные поражения соединительной тканиhttp://visualrheumatology.ru/zdorove-naseleniya-rostovskoy-oblasti-2011gkniga-3.html; в книгу 4 – анкилозирующий спондилоартритhttp://visualrheumatology.ru/zdorove-naseleniya-rostovskoy-oblasti-2011gkniga-4.html.Практикующим врачам вопросы статистики могут показаться не так ин-тересны, как новые перспективы лечения генно-инженерными биологиче-скими препаратами, но они жизненно необходимы. Показатели статистики, иособенно динамика статистических показателей, – реальный показательпрактических результатов работы как отдельного ревматолога так и ревма-тологической службы территории (города, района, области или края) в це-лом.С учетом реального масштаба распространенности БКМС и СТ в целяхобеспечения доступности своевременной специализированной ревматологи-ческой помощи, позволяющей начать лечение на ранних сроках заболева-ний, по-видимому, необходимо пересмотреть (сократить)норму численностиприкрепляемого к врачу ревматологу населения. Одним из важных путей решения проблемы ранней диагностики РЗ явля-ется повышение информированности врачей массовых терапевтическихспециальностей в вопросах ревматологии, тесное сотрудничество врачейсмежных специальностей: ревматологов, терапевтов, неврологов, хирурговамбулаторно-поликлинического звена, травматологов ортопедов.Для решения вопроса о диспансерном наблюдении контингентов ревма-тологических больных возможно возвращению к опыту советского здраво-охранения при проведении всеобщей диспансеризации, с разделением паци-ентов на группы здоровья для проведения персонифицированного лечения.
Чернышева Т.В., Ткаченко И.В.
ВОЗМОЖНОСТИ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ СУСТАВОВ КИСТЕЙ ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ
ГБУ ВПО «Оренбургская государственная медицинская академия» Министер-ства здравоохранения Российской Федерации г. Оренбург, Россия, кафедратерапии1, кафедра поликлинической терапии
В настоящее время современный спектр инструментальной диагностикизаболеваний опорно-двигательного аппарата представлен комплексом высо-котехнологичных методов – магниторезонансная, компьютерная томографии.Высокая информативность результата зачастую нивелируется дороговизнойисследования. Артросонография по праву занимает достойное место в ли-нейке методик, являясь не инвазивной, поли позиционной, позволяющейдетально оценить анатомию суставов, проводить функциональные пробы.Важным является отсутствие лучевой нагрузки для пациента, что дает воз-можность одновременного осмотра нескольких локализаций и наблюдение вдинамике. Многолетний опыт позволяет проводить исследование практиче-ски всех суставов.Цель работы – проанализировать Результаты ультразвукового исследо-вания (УЗИ) суставов кистей у больных с различной патологией, а так жеопределить преимущественное поражение суставов у больных ревматоиднымартритом.Материалы и методы исследования: За 10 месяцев 2013 года прове-дено УЗИ суставов кистей у 182 больных, преимущественно женщин(82,4%). Средний возраст обследованных составил 48,2±14,1 лет (от 18 до82 лет). У 129 больных (70,9%) был выявлен остеоартроз (ОА), у 36 (19,7%)– верифицирован ревматоидный артрит (РА), у 12 (6,6%) – артрит, ассоции-рованный с инфекцией (РеА), у 5 – псориатический артрит (ПсА). У 36 паци-ентов, направленных на исследование с подозрением на РА, в результатеобследования был исключён предполагаемый диагноз. Больные были вклю-чены в группы больных ОА и РеА. 36 больным с установленным сонографи-ческим и клиническим диагнозом РА было выполнено УЗИ и других поражен-ных суставов. Из них мужчин было 8 человек (22,2%), женщин – 28 (77,8%).У всех больных заболевание протекало в развёрнутой форме. Обследованные больные имели I – III рентгенологические стадии патологии (большин-ство II -69,7%). Среди всех пораженных суставов наиболее часто обследо-ванию подвергались суставы кистей – 80,6% случаев, реже коленные –25%, голеностопные – 19,4% и локтевые – 8,3%.Полученные Результаты. По данным УЗИ суставов кистей синовит былдиагностирован в 101 случае (55,5%), периартрит – в 121 (66,5%), эрозиисуставных поверхностей – в 32 (17,6%). У 6 пациентов визуализировалисьгигрома лучезапястного сустава, либо сухожильного комплекса, у 2- хондро-ма, у 1 – фиброма. 4 больных имели изменения в поверхностной фасциисоответствующие контрактуре Дюпюитрена. В единичных случаях выявлялсяхондрокальциноз гиалинового хряща мелких суставов кистей, асептическийнекроз трапециевидной кости, посттравматический разрыв коллатеральнойлучистой связки запястья. При ОА на ряду со снижением толщины гиалино-вого хряща и остеофитозом встречался незначительный моно- или олигоси-новит в сочетании с периартритом (38,8%). При РА умеренный, либо выра-женный преимущественно симметричный синовит характеризовался значи-тельным утолщением синовии и резким усилением в ней кровоток, что явля-ется специфичным для данного заболевания. Чаще экссудативные явления всуставах сочетались с теносиновитами нескольких сухожилий (63,9%). ¾пациентов регистрировались симметричные эрозии головок пястных костей.У 2-х больных ПсА и у 3- больных с РеА, также определялись эрозии, но онине носили симметричный характер. Из воспалительных изменений при РАвстречался чаще периартрит без синовита, при ПсА – синовит с периартри-том. Анализ изменений в суставах отобранной группы больных РА выявилследующие изменения. Синовит был диагностирован у 77,8% больных чащев суставах кистей (46,4%, р<0,05). Периартрит и симметричные эрозивныеизменения в суставных поверхностей имели 69,4% пациентов также с боль-шей частотой в суставах кистей. В подавляющем большинстве эрозии сим-метрично лоцировались в головках II и III пястно-фаланговых суставах и вединичных случаях в ладьевидных костях. У 6 больных не было выявленовоспалительных изменений в суставах, что свидетельствовало о медикамен-тозной ремиссии заболевания. Следует отметить, что у 2-х больных реги-стрировался выраженный симметричный синовит только локтевых суставахс типичными ревматоидными эрозиями мыщелков плечевой кости. Большин-ство больных в поражённых суставах имели сочетание синовита и периарт-рита (63,9%, р<0,05). Также характерным было совместное наличие синови-та и эрозивных изменений суставных поверхностей (61,1%, р<0,05). Опре-делялась взаимосвязь между возрастом и наличием сопутствующего ОА впоражённых суставах (r=0,56, р<0,05). В то же время, не было полученодостоверной корреляционной зависимости между ОА и воспалительнымиизменениями в суставах. Имелись взаимосвязи между наличием синовита ипериартрита у больных РА (r=0,52, р<0,05), синовитом и эрозивными изме-нениями суставных поверхностей (r=0,37, р<0,05).Выводы. Таким образом, наиболее частой патологией суставов кистей, скоторыми обращаются больные на УЗИ, является ОА. При УЗИ суставов в80,2% случаев выявляются воспалительные изменения, характер которыхпомогает в верификации диагноза. Эрозивные изменения суставных поверх-ностей характерны для РА и ПсА, но симметричный характер деструкции свойственен только ревматоидному процессу. Наиболее частой локализациейпоражения суставов у больных РА традиционно являются суставы кистей.
Шелепина Т.А. Степаненко Н.Ю.
CОЦИАЛЬНАЯ АДАПТАЦИЯ ПАЦИЕНТОВ ДЕТСКОГО РЕВМАТОЛОГИЧЕСКОГО СТАЦИОНАРА НАХОДЯЩИХСЯ НА ДОМАШНЕМ ОБУЧЕНИИ
ФГБУ НИИ ревматологии им.Насоновой В.А.
Цель оценить социальную адаптацию пациентов детского ревматологи-ческого стационара, длительно находящихся на домашнем обучении .Материалы и методы. Было обследовано 22 пациента, детского отделе-ния института ,находившихся на домашнем обучении длительное времяСредний возраст был равен 12,8 ( от8 до17) Число девочек и мальчиков бы-ло одинаковым. По нозологии пациенты распределялись следующим обра-зом: СКВ -3д, Ювенильная системная склеродермия 1м, ювенинильный дер-матомиозит -1д, с хроническим артритом было 17 пациентов: с системнымвариантом-5,полиартикулярным-4,олигоартикулярным-7, ЮАС -1 На основа-нии клинических и лабораторных данных об активности заболевания мыоценивали адекватность выбранной формы обучения. Для оценки важногопоказателя качества жизни – степени социальной адаптации –использовалиопросники CHAG, SF-36 Ваш боли и авторскую анкету о частоте общения сосверстниками и посещения культурных мероприятий. Пациенты были обсле-дованы клиническим психологом.Полученные результаты. Медицинские показания для обучения на до-му были у 8 пациентов :у 7 связанные с активностью заболевания, у однойпациентки 8лет с медикаментозной ремиссией это было обусловлено давно-стью расположения школы в гористой местности. У четырех пациентов дан-ный более удобный метод был выбран родителями и пациентами для воз-можности совмещения с дополнительным обучением в музыкальной и худо-жественной школеУ десяти пациентов длительное домашнее обучение было выбором роди-телей. Из этой подгруппы каких –либо проявлений десоциализации не былотолько у одной пациентки , имевшей широкий круг общения на досуге. Упациентов этой подгруппы было достоверное снижение социальной дея-тельности по опроснику SF-36 по сравнению с обучающихся на дому по ме-дицинским показаниям или учащимися в школе; более высокие показателиболи и степени ограничения жизнедеятельности, общение со сверстникамиосуществлялось в основном через интерне. .Полное отсутствие какой либодеятельности , включающей выполнение домашней работы , встреч сосверстниками было отмечено у 4 пациентов. Серьезные психологическиепроблемы( высокий уровень тревожности, субдепрессия ) были у 8 пациен-тов пациентов. Обсуждение. Дополнительным методом лечения пациентов с ревмато-логической патологией является реабилитация, Целью которой являетсяпредотвращение и коррекция двигательных нарушений, психологическаяподдержка и социальная адаптация Большинство пациентов, нуждающихся встационарном лечении имеют инвалидность, по статье «инвалид дет-ства»,допускающей в необходимых случаях организацию индивидуальногообучения в двух вариантах : отдельные занятия с педагогами в школе и ди-станционное обучение через интернет на дому. Для пациентов ,находящихсяв активной фазе заболевания это единственная возможность продолжитьобучение. Благодаря широкому внедрению данной формы обучения практи-чески все наши пациенты получают среднее образование Временное обу-чение в таком режиме не оказывает существенного влияния на их пси-хоэмоциональное состояние. Обучение вне школы длительное время можетпривести к социальной изоляции. При общении с пациентами , длительнообучающихся на дому без медицинских показаний ,мы выяснили, что ос-новной официальной, мотивировкой, данной формы обучения являетсятрудности в обучении из-за частых пропусков занятий- посещение поликли-ники (сдачи анализов, необходимость периодического стационарного лече-ния),а также риск инфекций, которые могут вызвать обострение основногозаболевания. Чаще решение перехода на данную форму принимают родите-ли. У части детей ,продолжающих контактировать со сверстниками вне шко-лы , данная удобная форма никак не влияет на психологический статус иони довольно легко переходят на обучение в школе. У некоторых появляетсястрах и не желание возврата в обычному режиму., у них как правило выяв-ляется несоответствие между высокими показателями боли и клиническимиданными.Среди пациентов, имевших признаки десоциализации большинство со-ставляли больные с ювенильным хроническим артритом( 8 и з 10) . Ведущимпризнаком заболевания является боль, ,возможно носящая хронический ха-рактер. Что подтверждается необходимостью приема нестероидных проти-вовоспалительных препаратов у большинства пациентов находящихся набазисной терапии, включающей и ГИБП.Хроническая боль в настоящее время трактуется в литературе как само-стоятельное заболевание , влияющее на эмоции и поведение личности. Био-психосоциальная модель представляет боль в качестве результата динами-ческого взаимодействия биологических, психологических и социокультурныхфакторов, последние выходят на первый план при хронизации боли . Посто-янное чувство дисконфорта ,чрезмерное внимание к боли на фоне премор-бидных личностных психологических особенностей может привести к боле-вому поведению, предусматривающему принятием пациентом образа жизни сисключением обычных нагрузок. Многомерный характер боли обнаружива-ется в модели Loeser состоящей из 4 кругов .которые отражают взаимодей-ствия между ноцицепцией (органическим компонентом боли), ощущением (регистрацией ЦНС), переживанием (страданием от боли ) и болевым поведе-нием .По мере увеличения продолжительности болевого синдрома компонен-ты переживания и поведения все больше влияют на восприятие боли ребен-ком .Поведенческие реакции ,проявляющиеся неадекватным снижением со-циальной активности чаще наблюдаются у пациентов с психологическими проблемами. Несмотря на наличие боли, хронического течения заболеванияс неопределенным прогнозом подавляющее число наших пациентов ведутобычный образ жизни, посещают школу и считают ,что это единственноправильный способ обучения, который они не хотят менять.Наличие хронической боли, преморбидные или вызванные болезньюнарушения в эмоциональной сфере , внешние изменения , гиперопека всемье могут явиться причиной развития поведенческих реакций, проявляю-щихся в выработке пациентом режима значительного ограничения социаль-ной активности, несоответствующего его физическому состоянию .При реко-мендации обучения в домашних условиях необходимо учитывать все поло-жительные и отрицательные стороны. Наши пациенты отстают в физическомразвитии от сверстников , поэтому проявить свое превосходство в интеллек-туальном развитии они могут именно в школе. Больные посещающие школу ,больше следят за своим физическим состоянием и выполняют назначения полечебной гимнастики.Заключение.1 Необходимость .домашнего обучения в период активного ревматологи-ческого заболевания не вызывает сомнения.2. Правильная форма обучения ученика средней школы и особенно стар-ших классов может быть выбрана при коллегиальном обсуждении родствен-ников, ревматолога длительно наблюдающего больного , педагогов школы исамого пациента.3. При любой форме обучения необходимо общение со сверстниками,позволяющее самоутвердиться в обществе и являющее мощным факторомпредотвращением поведенческих реакций ,выражающихся в уходе в бо-лезнь.
Шилова Л.Н., Страхов А.В., Паньшина Н.Н.,Капустина Е.А.
КАЧЕСТВО ЖИЗНИ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ СУСТАВОВ НА РАННИХ СТАДИЯХ БОЛЕЗНИ
ГБОУ ВПО ВолгГМУ Минздрава России, г.Волгоград, Россия.
Одной из основных проблем ревматологии являются хронические заболе-вания суставов, вызывающие длительную боль и ограничение подвижности,что приводит к снижению возможностей пациента в профессиональной дея-тельности, а затем и к трудностям при самообслуживании. Все это способ-ствует снижению качества жизни больных и ухудшению их психологическогосостояния. Цель: оценка качества больных с хроническими воспалительными забо-леваниями суставов: ревматоидным артритом (РА), анкилозирующим спон-дилитом (АС), псориатическим артритом (ПсА) на ранних этапах болезни.Материалы и методы: под наблюдением находилось 40 больных ревма-тоидным артритом, 30 – анкилозирующим спондилитом, 25 – псориатическимартритом, 20 – практически здоровых лиц. Среди больных РА было 90 %женщин и 10 % мужчин, АС – 92% мужчин и 8% женщины, ПсА – 55% -женщины, 45% – мужчины. Все больные были в возрасте от 24 до 52 лет.Продолжительность заболевания составила до 5 лет. Все больные были со-поставимые по активности, тяжести поражения, проводимой терапии. Оценкакачества жизни (КЖ) проводилась с использованием шкал SF-36 и HAQ.Средний возраст больных РА составил 53,7 ± 16,8, а средняя продолжи-тельность заболевания 8,4 ± 7,28 лет. Серопозитивный РА выявлялся у 74 %пациентов, серонегативный – у 26%. Чаще всего встречалась II степень ак-тивности у 97% больных. По данным рентгенологического исследования: IIстадия определялась у 17 (42,5%), I – у 7 (17,5%), III – у 14 (35%), IV – у 2(5%) человек. Среди больных АС было 92% мужчин и 8% женщины. Сред-ний возраст больных всей группы составил 36,0±1,36. Средняя продолжи-тельность заболевания составила 12,6±0,72 лет. Дебют заболевания наблю-дался в 24,8±4,5 лет. По степени активности патологического процесса па-циенты были распределены таким образом: I степень установлена у 9 (30%)больных, II степень — у 16 (53,3%) и III степень — у 5 (16,7%).Все больные ПсА имели генерализованный суставной синдром: 2 (20 че-ловек – 80%) и 3 (20%) степени активности заболевания, очаговый (9) илираспространенный (16) вульгарный псориаз. Полиартритический вариантпсориатического артрита наблюдался у 14 больных, из них 60% – женщины;спондилоартритический вариант – у 11 больных, из них 65% – мужчины.Всем пациентам осуществлялось общеклиническое, лабораторное и ин-струментальное обследование. Оценка качества жизни (КЖ) проводилась сиспользованием шкал SF-36 и HAQ.Результаты. Наличие боли и функциональных ограничений в суставахнегативно отразились на параметрах качества жизни больных. По анкетеHAQ в подгруппах выявлены сниженные параметры у всех больных, причем,при РА были достоверно хуже. Значение функционального индекса наруше-ния жизнедеятельности FDI анкеты HAQ у пациентов с ревматоидным артри-том составил 2,6 (1,5; 2,9) баллов и был статистически значимо больше, чему больных анкилозирующим спондилитом – 1,8 (1,4; 2,3) баллов (р=0,008) ипсориатическим артритом – 1,6 (1,2; 2.0). Был проведен корреляционныйанализ клинических показателей и параметров КЖ у больных обеих под-групп. Наиболее чувствительным при анализе оказался показатель боли поВАШ при ходьбе, который продемонстрировал прямые сильные взаимосвязис параметрами КЖ как при АС (r=0,81, p=0,005), ПсА (r=0,61, p=0,004), таки при РА (r=0,72, p=0,000).Показатели КЖ у пациентов с РА по шкале SF-36 по 7 доменам из 8 былидостоверно хуже, чем в контрольной группе: физическое функционирование(39,0±20,3 и 46,2±19,5, р<0,001), физическое ограничение (7,5±17,1 и 30,6±32,5, р<0,05), физическая боль (31,7±10,2 и 66,2±27,7, р<0,01), вос-приятие состояния здоровья (21,2±10,3 и 50,2±15,8, р<0,01), социальноефункционирование (38,5±23,8 и 77,9±21,5, р<0,01), ролевые эмоциональ-ные ограничения (33,9±37,7 и 39,36±39,8, р<0,01), психическое здоровье(38,1±14,4 и 45,3±13,7, р<0,01). Показатели КЖ у больных АС по 6 доме-нам, а при ПсА по 5 доменам (исключая социальное функционирование) до-стоверно отличались от группы контроля: физическое функционирование,физическое ограничение, физическая боль, восприятие состояния здоровья,социальное функционирование, психическое здоровье.Выводы: таким образом, качество жизни у больных с хроническими за-болеваниями суставов достоверно снижается уже на ранних этапах болезни,особенно выражено в группе больных РА и АС. 

