Просмотров: 28 931
Справочные материалы для ревматолога. Национальные рекомендации по диагностике и лечению ХСН. 2013 г.
Национальные рекомендации ОССН, РКО и РНМОТпо диагностике и лечению ХСН (четвертый пересмотр)
Утверждены на Конгрессе ОССН 7 декабря 2012 года, на Правлении ОССН 31 марта 2013 и Конгрессе РКО 25 сентября 2013 года
УДК 616.12–008.46–036.12 (083.13) диагностика, лечение, рекомендации, ХСН
diagnostics, treatment, guidelines, CHF
1. Введение
Таблица 1. Классы рекомендаций и уровни доказанности в Рекомендациях ОССН–РКО–РНМОТ
 Уровни доказанности (достоверности данных)
А Факты получены, по меньшей мере, из двух рандомизированных исследовании
B Факты получены из одного рандомизированного исследования или мета-анализа нерандомизированных исследовании
C Совместная точка зрения специалистов
2. Эпидемиология СН в Российской Федерации
По данным эпидемиологических исследований последних10 лет, проведенных в нашей стране в рамках иссле-дований ЭПОХА–ХСН (8 регионов РФ, 19 500 респон-дентов) и ЭПОХА–О–ХСН (одномоментное госпи-тальное исследование в 22 регионах РФ), стало известно,что [11–13]:
A) В РФ распространенность в популяции ХСН I–IV ФКсоставила 7 % случаев (7,9 млн. человек). Клинически выраженная ХСН (II–IV ФК) имеет место у 4,5 %населения (5,1 млн. человек). Распространенностьтерминальной ХСН (III–IV ФК) достигает 2,1 % слу-чаев (2,4 млн. человек);
B) Распространенность ХСН с возрастом значительно увеличивается: в возрастной группе от 20 до 29 лет составляет только 0,3 % случаев, а в возрастной группе старше 90 лет ХСН имеют почти 70 % респондентов. Среди мужчин распространенность ХСН выше, чем среди женщин в возрастных группах до 60 лет,что ассоциируется с более ранней заболеваемостьюАГ и ИБС у мужчин [14]. За счет большей продол-жительности жизни число женщин, имеющих ХСН,в 2,6 раза превосходит число мужчин (72 % против28 %). Более 65 % больных ХСН находятся в возраст-ной группе от 60 до 80 лет, старше 80 лет число боль-ных ХСН резко снижается за счет фактора дожития,и достоверных гендерных различий в этой возраст-ной группе не обнаружено [11, 13, 14];
C) В результате 10-летнего наблюдения за популяциейобнаружено, что распространенность ХСН в популя-ции растет в среднем на 1,2 человека на 1000 населе-ния в год за счет более высокой заболеваемости ХСНмужчин в возрастной группе от 40 до 59 лет и жен-щин в возрастной группе от 70 до 89 лет. Во многомэто связано с неадекватной терапией АГ и ИБС.Можно предполагать, что продолжительность жизнибольных ХСН несколько возрастает за счет увеличе-ния числа пациентов, которые принимают основныелекарственные средства для лечения ХСН. На попу-ляционном уровне появление более тяжелого ФКХСН ассоциировано с увеличением возраста на каж-дые 10 лет;
D) В исследовании Euro Heart Survey, проводившемсяв 14 странах Европы, включая РФ, впервые особое вни-мание было уделено появлению большого числа паци-ентов с ХСН и нормальной (ФВ >50 %) систоличе-ской функцией сердца [15]. По данным исследованияЭПОХА–О–ХСН, в РФ 56,8 % пациентов с очевиднойХСН имеют практическинормальную сократимостьмиокарда (ФВ ЛЖ >50 %) [16]. Исследования, проводившиеся в США, продемонстрировали постоянное увеличение числа таких больных, что позволило опре-делить проблему ХСН с сохранной систолической функцией сердца (ХСН–ССФ), как одну из неинфекционных эпидемий XXI века [17]. К этой категориибольных ХСН в основном относятся женщины болеестаршего возраста с плохо леченными АГ и / или СД.При этом среди женщин встречаемость ХСН–ССФдостигает 68 % [16, 18];
E) Годовая смертность от ХСН достоверно выше,чем в популяции (отношение шансов 10,3). Средипациентов с ХСН I–IV ФК средняя годовая смертностьсоставляет 6 % [19]. При этом однолетняя смертностьбольных с клинически выраженной ХСН достигает12 % (даже в условиях лечения в специализированномстационаре), то есть за один год в РФ умираютдо 612 тыс. больных ХСН [18]. Был получен временной показатель достоверного ухудшения прогноза жизни больных ХСН по сравнению с выборкой респондентов без ССЗ, который составил всего 90 дней [19];
F) Декомпенсация ХСН является причиной госпитализа-ций в стационары, имеющие кардиологические отде-ления, почти каждого второго больного (49 %), а ХСНфигурировала в диагнозе у 92 % госпитализирован-ных в такие стационары [15]. В РФ среди всех боль-ных, госпитализированных в стационары с ССЗ, ХСН(по Фрамингемским критериям) явилась основнойпричиной госпитализации у 16,8 % пациентов [12, 16];
G) Основными причинами развития ХСН в РФ явля-ются АГ (88 % случаев) и ИБС (59 % случаев) [20].При высокой распространенности среди пациентовс ХСН стабильной стенокардии отмечается наличиенизкой распространенности перенесенного острогоИМ (ОИМ) среди них (13,3 % случаев), что говорито низкой эффективности лечения данного осложне-ния ИБС. Комбинация ИБС и АГ встречается у поло-вины больных ХСН [20, 21];
H) В РФ можно отметить еще три важных причины раз-вития ХСН: хроническую обструктивную болезньлегких (ХОБЛ) – 13 % случаев, СД – 11,9 % случаеви перенесенное острое нарушение мозгового крово-обращения (ОНМК) – 10,3 % случаев. Наличие боль-шого количества ФР становится базисом для форми-рования СН в возрастных группах до 60 лет с досто-верно более плохим прогнозом жизни больныхв последующие десятилетия [21, 22]. Для больныхХСН наличие ОИМ или СД определяет значитель-но более плохой прогноз жизни, кроме того, тяжесть ХСН обусловлена сочетанием множества этиологи-ческих факторов;
I) Классические причины ХСН в XXI веке встреча-ются реже. Наличие пороков сердца, как причи-ны декомпенсации, отмечено только у 4,3 % боль-ных, миокардитов у 3,6 % пациентов, а ДКМП всеголишь в 0,8 % случаев ХСН. Даже при ХСН III–IV ФКДКМП, как причина заболевания, регистрироваласьв 5 % (Российская выборка исследования EuroHeartSurvey) – 5,4 % (исследование ЭПОХА–ХСН) случа-ев [15, 21]. Это может быть связано с низкой эффек-тивностью лечения и высоким риском смертельногоисхода при формировании ХСН на фоне ДКМП;
J) В популяции больных ХСН были обнаружены ген-дерные различия в причинах возникновения деком-пенсации. Для мужчин наличие ИБС, перенесенногоОИМ, перенесенного ОНМК в качестве причин раз-вития ХСН более приоритетно. Наоборот, наличиеАГ, СД, пороков сердца и перенесенного миокардитавыявлено чаще среди женщин [21–23];
K) Хроническая (постоянная) форма фибрилляции предсердий утяжеляет течение ХСН в 10,3 % случаев среди общей выборки больных ХСН [21]. С увеличением тяжести ХСН встречаемость фибрилляции предсердий (ФП) неуклонно возрастает, достигая 45 % у пациентов с III–IV ФК [18].
3. Терминология, используемаяпри описании СН
Различают острую и хроническую СН. Под острой СН принято подразумевать возникновение острой (кардиогенной) одышки, связанной с быстрым развитием легочного застоя вплоть до отека легких или кардиогенного шока (с гипотонией, олигурией и т. д.), которые,как правило, являются следствием острого повреждения миокарда, прежде всего ОИМ.
Чаще встречается хроническая форма СН, для которой характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН. Данные Рекомендации посвя-щены в основном диагностике и лечению ХСН, определе-ние которой приведено ниже.
Помимо острой и хронической, различают также систолическую и диастолическую СН. Традиционно СН и ее тяжесть ассоциируют со снижением сократительной способности сердца (систолическая СН), которую чаще оценивают по величине ФВ ЛЖ. Однако значительная частьбольных СН имеет нормальную или почти нормальнуюФВ ЛЖ (>45–50 %) [24]. В таких случаях целесообразноговорить о СН с сохраненной систолической функцией(СН–ССФ) или, что более правильно – о СН с сохраненнойФВ ЛЖ (СН–СФВ ЛЖ). Частота встречаемости больныхc СН–СФВ ЛЖ зависит от тяжести обследуемой популя-ции и критериев оценки ФВ ЛЖ. Так, среди тяжелых деком-пенсированных стационарных больных СН доля СН–СФВЛЖ, как правило, не превышает 20 % [25, 26]. Среди всехбольных с диагнозом СН в стационарной и поликлиниче-ской практике доля СН–СФВ ЛЖ может достигать 30–50 %[24, 27]. В обсервационных популяционных исследова-ниях, например, в российском исследовании ЭПОХА–О–ХСН [16], среди всех больных СН, верифицированнойпо Фрамингемским критериям, уже 56,8 % пациентов имелиФВ ЛЖ >50 %, а 85,6 % – ФВ ЛЖ >40 %. Близкие к этим дан-ные (84,1 %) были получены в другом российском популяци-онном исследовании – IMPROVEMENT, в котором приня-ли участие 100 терапевтов из 10 городов РФ [28].
Патофизиология СН–СФВ ЛЖ, вероятно, гетерогенна. Более чем в 90 % случаев, особенно в старших возраст-ных группах, где высока доля пациентов с повышеннойжесткостью миокарда, с АГ и гипертрофией ЛЖ, СД,СН–СФВ ЛЖ может быть обусловлена собственно диастолической дисфункцией [29], но у отдельных пациен-тов также может быть связана с повышенной жесткостьюартериального сосудистого русла. Наличие у больного СН–СФВ ЛЖ подтвержденных объективными метода мидиастолических расстройств позволяет говорить о нем,как о больном с диастолической СН (ДСН).
Небходимо учитывать, что если диастолическая СН бывает изолированной, то систолическая СН, как правило, протекает не только с систолическими, но и с диастолическими расстройствами [30], то есть чаще носитсмешанный характер. Среди других терминов встречаются деление ХСНна право- и левожелудочковую в зависимости от преоб-ладания застойных явлений в малом или большом кругекровообращения; ХСН с низким или высоким сердечнымвыбросом (СВ). Следует помнить, что высокий СВ встре-чается при ряде заболеваний (тиреотоксикоз, анемияи др.), не имеющих прямого отношения к повреждениюмиокарда.
В отечественной практике часто используются тер-мины «застойная СН – ЗСН» и «хроническая недостаточность кровообращения – ХНК», которые неред-ко «конкурируют» с термином ХСН, что и продолжаетоставаться предметом дискуссий. По сути, ЗСН является синонимом клинически выраженной ХСН с отчетливой симптоматикой застоя жидкости. Термин ХНК, предложенный А. Л. Мясниковым и получивший распространение только в нашей стране, также можно рассматривать,как синоним ХСН, поскольку оба термина фактически призваны обозначить одно и то же заболевание. В этойсвязи (исключительно для унификации терминологии) рекомендуется не применять иной термин, кромекак ХСН, при формулировании диагноза и в других доку-ментах, используемых для отчетности, статистики и т. д.
4. Определение СН
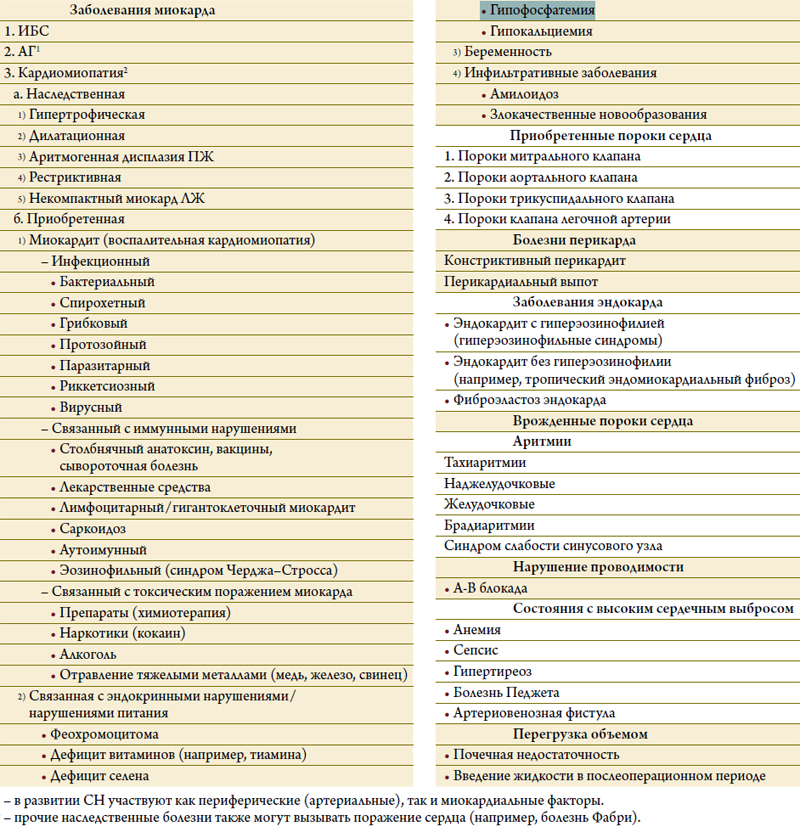
Сердечная недостаточность может быть определена, как такое нарушение структуры или функции сердца,в результате которого сердце не в состоянии удовлетворить потребности организма в кислороде при нормальном давлении наполнения сердца, и это возможно лишь ценой повышения давления наполнения сердца[31]. С практической точки зрения СН – это синдром,для которого характерны определенные симптомы(одышка, отеки лодыжек, утомляемость) и клинические признаки (набухание шейных вен, мелкопузырчатые хрипы в легких, смещение верхушечного толчка влево),возникшие в результате нарушения структуры или функции сердца. Диагностика СН связана с определенными сложностями. Так, многие симптомы СН неспецифичны, и поэтому их диагностическое значение невелико[32–36]. Поскольку многие клинические признаки СН обусловлены задержкой жидкости в организме и быстро исчезают при назначении диуретиков, они могут отсутствовать у больных, получающих эти препараты. В диагностике СН центральное место занимает определение ее причины. Обычно к СН приводит то или иное заболевание миокарда, сопровождающееся систолической дисфункцией. Сердечная недостаточность также может возникать из-за диастолической дисфункции, патологии клапанов, перикарда, эндокарда, нарушений ритма сердца и проводимости; при этом у одного больного могут быть сразу несколько причин (таблица 2). Определение причины СН важно для правильного лечения, особенно если эта причина устранима (например, операция на клапанах при пороках сердца).
Таблица 2. Причины СН (данная классификация не является всеохватывающей;кроме того, многие причины в значительной мере пересекаются друг с другом)
Уровни доказанности (достоверности данных)
А Факты получены, по меньшей мере, из двух рандомизированных исследовании
B Факты получены из одного рандомизированного исследования или мета-анализа нерандомизированных исследовании
C Совместная точка зрения специалистов
2. Эпидемиология СН в Российской Федерации
По данным эпидемиологических исследований последних10 лет, проведенных в нашей стране в рамках иссле-дований ЭПОХА–ХСН (8 регионов РФ, 19 500 респон-дентов) и ЭПОХА–О–ХСН (одномоментное госпи-тальное исследование в 22 регионах РФ), стало известно,что [11–13]:
A) В РФ распространенность в популяции ХСН I–IV ФКсоставила 7 % случаев (7,9 млн. человек). Клинически выраженная ХСН (II–IV ФК) имеет место у 4,5 %населения (5,1 млн. человек). Распространенностьтерминальной ХСН (III–IV ФК) достигает 2,1 % слу-чаев (2,4 млн. человек);
B) Распространенность ХСН с возрастом значительно увеличивается: в возрастной группе от 20 до 29 лет составляет только 0,3 % случаев, а в возрастной группе старше 90 лет ХСН имеют почти 70 % респондентов. Среди мужчин распространенность ХСН выше, чем среди женщин в возрастных группах до 60 лет,что ассоциируется с более ранней заболеваемостьюАГ и ИБС у мужчин [14]. За счет большей продол-жительности жизни число женщин, имеющих ХСН,в 2,6 раза превосходит число мужчин (72 % против28 %). Более 65 % больных ХСН находятся в возраст-ной группе от 60 до 80 лет, старше 80 лет число боль-ных ХСН резко снижается за счет фактора дожития,и достоверных гендерных различий в этой возраст-ной группе не обнаружено [11, 13, 14];
C) В результате 10-летнего наблюдения за популяциейобнаружено, что распространенность ХСН в популя-ции растет в среднем на 1,2 человека на 1000 населе-ния в год за счет более высокой заболеваемости ХСНмужчин в возрастной группе от 40 до 59 лет и жен-щин в возрастной группе от 70 до 89 лет. Во многомэто связано с неадекватной терапией АГ и ИБС.Можно предполагать, что продолжительность жизнибольных ХСН несколько возрастает за счет увеличе-ния числа пациентов, которые принимают основныелекарственные средства для лечения ХСН. На попу-ляционном уровне появление более тяжелого ФКХСН ассоциировано с увеличением возраста на каж-дые 10 лет;
D) В исследовании Euro Heart Survey, проводившемсяв 14 странах Европы, включая РФ, впервые особое вни-мание было уделено появлению большого числа паци-ентов с ХСН и нормальной (ФВ >50 %) систоличе-ской функцией сердца [15]. По данным исследованияЭПОХА–О–ХСН, в РФ 56,8 % пациентов с очевиднойХСН имеют практическинормальную сократимостьмиокарда (ФВ ЛЖ >50 %) [16]. Исследования, проводившиеся в США, продемонстрировали постоянное увеличение числа таких больных, что позволило опре-делить проблему ХСН с сохранной систолической функцией сердца (ХСН–ССФ), как одну из неинфекционных эпидемий XXI века [17]. К этой категориибольных ХСН в основном относятся женщины болеестаршего возраста с плохо леченными АГ и / или СД.При этом среди женщин встречаемость ХСН–ССФдостигает 68 % [16, 18];
E) Годовая смертность от ХСН достоверно выше,чем в популяции (отношение шансов 10,3). Средипациентов с ХСН I–IV ФК средняя годовая смертностьсоставляет 6 % [19]. При этом однолетняя смертностьбольных с клинически выраженной ХСН достигает12 % (даже в условиях лечения в специализированномстационаре), то есть за один год в РФ умираютдо 612 тыс. больных ХСН [18]. Был получен временной показатель достоверного ухудшения прогноза жизни больных ХСН по сравнению с выборкой респондентов без ССЗ, который составил всего 90 дней [19];
F) Декомпенсация ХСН является причиной госпитализа-ций в стационары, имеющие кардиологические отде-ления, почти каждого второго больного (49 %), а ХСНфигурировала в диагнозе у 92 % госпитализирован-ных в такие стационары [15]. В РФ среди всех боль-ных, госпитализированных в стационары с ССЗ, ХСН(по Фрамингемским критериям) явилась основнойпричиной госпитализации у 16,8 % пациентов [12, 16];
G) Основными причинами развития ХСН в РФ явля-ются АГ (88 % случаев) и ИБС (59 % случаев) [20].При высокой распространенности среди пациентовс ХСН стабильной стенокардии отмечается наличиенизкой распространенности перенесенного острогоИМ (ОИМ) среди них (13,3 % случаев), что говорито низкой эффективности лечения данного осложне-ния ИБС. Комбинация ИБС и АГ встречается у поло-вины больных ХСН [20, 21];
H) В РФ можно отметить еще три важных причины раз-вития ХСН: хроническую обструктивную болезньлегких (ХОБЛ) – 13 % случаев, СД – 11,9 % случаеви перенесенное острое нарушение мозгового крово-обращения (ОНМК) – 10,3 % случаев. Наличие боль-шого количества ФР становится базисом для форми-рования СН в возрастных группах до 60 лет с досто-верно более плохим прогнозом жизни больныхв последующие десятилетия [21, 22]. Для больныхХСН наличие ОИМ или СД определяет значитель-но более плохой прогноз жизни, кроме того, тяжесть ХСН обусловлена сочетанием множества этиологи-ческих факторов;
I) Классические причины ХСН в XXI веке встреча-ются реже. Наличие пороков сердца, как причи-ны декомпенсации, отмечено только у 4,3 % боль-ных, миокардитов у 3,6 % пациентов, а ДКМП всеголишь в 0,8 % случаев ХСН. Даже при ХСН III–IV ФКДКМП, как причина заболевания, регистрироваласьв 5 % (Российская выборка исследования EuroHeartSurvey) – 5,4 % (исследование ЭПОХА–ХСН) случа-ев [15, 21]. Это может быть связано с низкой эффек-тивностью лечения и высоким риском смертельногоисхода при формировании ХСН на фоне ДКМП;
J) В популяции больных ХСН были обнаружены ген-дерные различия в причинах возникновения деком-пенсации. Для мужчин наличие ИБС, перенесенногоОИМ, перенесенного ОНМК в качестве причин раз-вития ХСН более приоритетно. Наоборот, наличиеАГ, СД, пороков сердца и перенесенного миокардитавыявлено чаще среди женщин [21–23];
K) Хроническая (постоянная) форма фибрилляции предсердий утяжеляет течение ХСН в 10,3 % случаев среди общей выборки больных ХСН [21]. С увеличением тяжести ХСН встречаемость фибрилляции предсердий (ФП) неуклонно возрастает, достигая 45 % у пациентов с III–IV ФК [18].
3. Терминология, используемаяпри описании СН
Различают острую и хроническую СН. Под острой СН принято подразумевать возникновение острой (кардиогенной) одышки, связанной с быстрым развитием легочного застоя вплоть до отека легких или кардиогенного шока (с гипотонией, олигурией и т. д.), которые,как правило, являются следствием острого повреждения миокарда, прежде всего ОИМ.
Чаще встречается хроническая форма СН, для которой характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН. Данные Рекомендации посвя-щены в основном диагностике и лечению ХСН, определе-ние которой приведено ниже.
Помимо острой и хронической, различают также систолическую и диастолическую СН. Традиционно СН и ее тяжесть ассоциируют со снижением сократительной способности сердца (систолическая СН), которую чаще оценивают по величине ФВ ЛЖ. Однако значительная частьбольных СН имеет нормальную или почти нормальнуюФВ ЛЖ (>45–50 %) [24]. В таких случаях целесообразноговорить о СН с сохраненной систолической функцией(СН–ССФ) или, что более правильно – о СН с сохраненнойФВ ЛЖ (СН–СФВ ЛЖ). Частота встречаемости больныхc СН–СФВ ЛЖ зависит от тяжести обследуемой популя-ции и критериев оценки ФВ ЛЖ. Так, среди тяжелых деком-пенсированных стационарных больных СН доля СН–СФВЛЖ, как правило, не превышает 20 % [25, 26]. Среди всехбольных с диагнозом СН в стационарной и поликлиниче-ской практике доля СН–СФВ ЛЖ может достигать 30–50 %[24, 27]. В обсервационных популяционных исследова-ниях, например, в российском исследовании ЭПОХА–О–ХСН [16], среди всех больных СН, верифицированнойпо Фрамингемским критериям, уже 56,8 % пациентов имелиФВ ЛЖ >50 %, а 85,6 % – ФВ ЛЖ >40 %. Близкие к этим дан-ные (84,1 %) были получены в другом российском популяци-онном исследовании – IMPROVEMENT, в котором приня-ли участие 100 терапевтов из 10 городов РФ [28].
Патофизиология СН–СФВ ЛЖ, вероятно, гетерогенна. Более чем в 90 % случаев, особенно в старших возраст-ных группах, где высока доля пациентов с повышеннойжесткостью миокарда, с АГ и гипертрофией ЛЖ, СД,СН–СФВ ЛЖ может быть обусловлена собственно диастолической дисфункцией [29], но у отдельных пациен-тов также может быть связана с повышенной жесткостьюартериального сосудистого русла. Наличие у больного СН–СФВ ЛЖ подтвержденных объективными метода мидиастолических расстройств позволяет говорить о нем,как о больном с диастолической СН (ДСН).
Небходимо учитывать, что если диастолическая СН бывает изолированной, то систолическая СН, как правило, протекает не только с систолическими, но и с диастолическими расстройствами [30], то есть чаще носитсмешанный характер. Среди других терминов встречаются деление ХСНна право- и левожелудочковую в зависимости от преоб-ладания застойных явлений в малом или большом кругекровообращения; ХСН с низким или высоким сердечнымвыбросом (СВ). Следует помнить, что высокий СВ встре-чается при ряде заболеваний (тиреотоксикоз, анемияи др.), не имеющих прямого отношения к повреждениюмиокарда.
В отечественной практике часто используются тер-мины «застойная СН – ЗСН» и «хроническая недостаточность кровообращения – ХНК», которые неред-ко «конкурируют» с термином ХСН, что и продолжаетоставаться предметом дискуссий. По сути, ЗСН является синонимом клинически выраженной ХСН с отчетливой симптоматикой застоя жидкости. Термин ХНК, предложенный А. Л. Мясниковым и получивший распространение только в нашей стране, также можно рассматривать,как синоним ХСН, поскольку оба термина фактически призваны обозначить одно и то же заболевание. В этойсвязи (исключительно для унификации терминологии) рекомендуется не применять иной термин, кромекак ХСН, при формулировании диагноза и в других доку-ментах, используемых для отчетности, статистики и т. д.
4. Определение СН
Сердечная недостаточность может быть определена, как такое нарушение структуры или функции сердца,в результате которого сердце не в состоянии удовлетворить потребности организма в кислороде при нормальном давлении наполнения сердца, и это возможно лишь ценой повышения давления наполнения сердца[31]. С практической точки зрения СН – это синдром,для которого характерны определенные симптомы(одышка, отеки лодыжек, утомляемость) и клинические признаки (набухание шейных вен, мелкопузырчатые хрипы в легких, смещение верхушечного толчка влево),возникшие в результате нарушения структуры или функции сердца. Диагностика СН связана с определенными сложностями. Так, многие симптомы СН неспецифичны, и поэтому их диагностическое значение невелико[32–36]. Поскольку многие клинические признаки СН обусловлены задержкой жидкости в организме и быстро исчезают при назначении диуретиков, они могут отсутствовать у больных, получающих эти препараты. В диагностике СН центральное место занимает определение ее причины. Обычно к СН приводит то или иное заболевание миокарда, сопровождающееся систолической дисфункцией. Сердечная недостаточность также может возникать из-за диастолической дисфункции, патологии клапанов, перикарда, эндокарда, нарушений ритма сердца и проводимости; при этом у одного больного могут быть сразу несколько причин (таблица 2). Определение причины СН важно для правильного лечения, особенно если эта причина устранима (например, операция на клапанах при пороках сердца).
Таблица 2. Причины СН (данная классификация не является всеохватывающей;кроме того, многие причины в значительной мере пересекаются друг с другом)
 5. Классификация СН
Классификация СН по ФВ ЛЖ
Традиционно СН классифицируют в зависимостиот ФВ ЛЖ. Фракция выброса – основной показательсистолической функции ЛЖ. Он показывает, какая доля объема ЛЖ выбрасывается в аорту с каждым сокраще-нием сердца. Для ее вычисления ударный объем (т. е. раз-ницу между конечно-диастолическим и конечно-систоли-ческим объемами) следует разделить на конечно-диасто-лический объем. У больных с низкой сократимостью (т. е.с систолической дисфункцией) поддержание дóлжногоударного объема во многом обеспечивается за счет рас-ширения ЛЖ; иными словами, сердце выбрасывает в аор-ту меньшую долю (фракцию) от своего увеличенного объ-ема. Чем тяжелее систолическая дисфункция, тем нижеФВ и, как правило, шире ЛЖ.
Фракция выброса является одним из ключевых показателей гемодинамики при СН и имеет большое прогно-стическое значение: чем меньше ФВ, тем хуже прогноз.Традиционно в исследованиях с СН принимали участиебольные исключительно с низкой ФВ (обычно опреде-ляемой как <35 %), то есть имевшие систолическую СН;и на сегодняшний день лишь для этих больных разработа-ны виды лечения, способные улучшать прогноз.
За последнее время в нескольких крупных клинических исследованиях наблюдались больные СН с нормальной ФВ (обычно определяемой как >50 %) и не имевшие иной патологии со стороны сердца, например, клапанных нарушений или заболеваний перикарда. Для описанияСН у этих больных был предложен термин «СН с сохран-ной ФВ (СН–СФВ)». Больные с промежуточными зна-чениями ФВ (от 35 до 50 %) относятся к так называемой«серой зоне», и, по всей видимости, их следует рассма-тривать, как имеющих незначительную систолическуюдисфункцию. Диагностировать СН–СФВ значительнотруднее, чем систолическую СН, поскольку в этом случаенеобходимо последовательно исключить все возможныевнесердечные заболевания, которые могли бы объяснить имеющиеся у больного симптомы (например, анемиюили хронические болезни легких; таблица 3) [37, 38].Обычно у больных СН–СФВ отсутствует расширениеЛЖ, однако часто отмечается увеличение толщины сте-нок ЛЖ и расширение левого предсердия. У большинствабольных СН–СФВ можно выявить диастолическую дис-функцию ЛЖ, которая считается наиболее вероятнойпричиной развития СН у этих больных (отсюда и второйтермин, используемый для их описания – «диастоличе-ская СН») [37, 38].
Вычисление ФВ во многом зависит от выбора визуализирующего метода и способа ее расчета, а также от навыков оператора. Установлено, что современные и болеечувствительные способы оценки систолической функцииЛЖ позволяют обнаружить нарушение сократимостидаже у тех больных, у которых ФВ сохранена. Поэтомупри описании больных СН лучше воспользоваться тер-минами «сохранная / сниженная ФВ», нежели «сохран-ная / сниженная систолическая функция» [39, 40].
5. Классификация СН
Классификация СН по ФВ ЛЖ
Традиционно СН классифицируют в зависимостиот ФВ ЛЖ. Фракция выброса – основной показательсистолической функции ЛЖ. Он показывает, какая доля объема ЛЖ выбрасывается в аорту с каждым сокраще-нием сердца. Для ее вычисления ударный объем (т. е. раз-ницу между конечно-диастолическим и конечно-систоли-ческим объемами) следует разделить на конечно-диасто-лический объем. У больных с низкой сократимостью (т. е.с систолической дисфункцией) поддержание дóлжногоударного объема во многом обеспечивается за счет рас-ширения ЛЖ; иными словами, сердце выбрасывает в аор-ту меньшую долю (фракцию) от своего увеличенного объ-ема. Чем тяжелее систолическая дисфункция, тем нижеФВ и, как правило, шире ЛЖ.
Фракция выброса является одним из ключевых показателей гемодинамики при СН и имеет большое прогно-стическое значение: чем меньше ФВ, тем хуже прогноз.Традиционно в исследованиях с СН принимали участиебольные исключительно с низкой ФВ (обычно опреде-ляемой как <35 %), то есть имевшие систолическую СН;и на сегодняшний день лишь для этих больных разработа-ны виды лечения, способные улучшать прогноз.
За последнее время в нескольких крупных клинических исследованиях наблюдались больные СН с нормальной ФВ (обычно определяемой как >50 %) и не имевшие иной патологии со стороны сердца, например, клапанных нарушений или заболеваний перикарда. Для описанияСН у этих больных был предложен термин «СН с сохран-ной ФВ (СН–СФВ)». Больные с промежуточными зна-чениями ФВ (от 35 до 50 %) относятся к так называемой«серой зоне», и, по всей видимости, их следует рассма-тривать, как имеющих незначительную систолическуюдисфункцию. Диагностировать СН–СФВ значительнотруднее, чем систолическую СН, поскольку в этом случаенеобходимо последовательно исключить все возможныевнесердечные заболевания, которые могли бы объяснить имеющиеся у больного симптомы (например, анемиюили хронические болезни легких; таблица 3) [37, 38].Обычно у больных СН–СФВ отсутствует расширениеЛЖ, однако часто отмечается увеличение толщины сте-нок ЛЖ и расширение левого предсердия. У большинствабольных СН–СФВ можно выявить диастолическую дис-функцию ЛЖ, которая считается наиболее вероятнойпричиной развития СН у этих больных (отсюда и второйтермин, используемый для их описания – «диастоличе-ская СН») [37, 38].
Вычисление ФВ во многом зависит от выбора визуализирующего метода и способа ее расчета, а также от навыков оператора. Установлено, что современные и болеечувствительные способы оценки систолической функцииЛЖ позволяют обнаружить нарушение сократимостидаже у тех больных, у которых ФВ сохранена. Поэтомупри описании больных СН лучше воспользоваться тер-минами «сохранная / сниженная ФВ», нежели «сохран-ная / сниженная систолическая функция» [39, 40].
 Классификация СН по длительности течения
Важно помнить о том, что после соответствующего лечения больной СН может не иметь никаких симптомов.В тех случаях, когда нарушение работы сердца не сопро-вождается клиническими проявлениями, говорят о бес-симптомной СН или бессимптомной дисфункции ЛЖ(независимо от причины СН). Если СН прослеживаетсяна протяжении определенного времени, то ее обознача-ют как хроническую. Больной СН, у которого на фонесоответствующего лечения отсутствует ухудшение забо-левания на протяжении, по меньшей мере, одного месяца,считается стабильным. При усугублении ХСН говорято декомпенсации. Это усугубление может произойтивнезапно (острая СН), характеризуется существеннымувеличением риска смерти и обычно приводит к госпи-тализации. Впервые возникшая СН может дебютироватьостро (например, в момент ИМ) или, наоборот, нарас-тать постепенно, переходя от бессимптомной дисфунк-ции сердца к клинически выраженной СН. В ходе лече-ния клинические проявления СН могут уменьшитьсяили вообще исчезнуть (в таких случаях говорят о дости-жении компенсации), однако дисфункция сердца частоостается без изменений, и такие больные имеют высокийриск повторной декомпенсации. Иногда причина СНможет быть полностью устранима (например, при остромвирусном миокардите). В ряде других случаев, например,при идиопатической дилатационной кардиомиопатиис помощью современной терапии (иАПФ / блокатора-ми ангиотензиновых рецепторов, β-адреноблокаторами,антагонистами альдостерона) можно достичь существен-ного улучшения или даже полного восстановления систо-лической функции ЛЖ. До сих пор в литературе частовстречается термин «застойная СН», который отно-сится к больным острой или хронической СН, у которыхотмечаются застойные явления, связанные с задержкойжидкости. В отличие от других симптомов СН застойныеявления могут быть полностью устранены с помощьюдиуретиков. Важно понимать, что многие из представ-ленных определений СН могут быть применены у одногои того же больного в зависимости от стадии заболевания.
Классификация СН по выраженности симптомов
Для описания выраженности симптомов СН традиционно используют ФК Нью-Йоркской кардиологической ассоциации (таблица 4). Именно на основании этойклассификации отбирались больные для участия в боль-шинстве рандомизированных испытаний с СН. Больныес I ФК не имеют каких‑либо симптомов, связанных с забо-леванием сердца; больные со II, III или IV ФК имеютсоответственно незначительные, умеренные и выражен-ные симптомы СН.5.3.0.0.0.2Важно отметить, что выраженность симптомов сла-бо ассоциируется с систолической функцией ЛЖ, и хотяи существует четкая связь между тяжестью симптомови выживаемостью больных СН, больные с минималь-ными симптомами могут иметь относительно высокийабсолютный риск госпитализации и смерти [41–43].Симптомы также могут претерпевать быстрое измене-ние. Так, у больного с минимально выраженными сим-птомами может внезапно развиться одышка в покое из-завозникновения аритмии; состояние же декомпенсиро-ванного больного с отеком легких может быстро улучшиться при назначении диуретиков. Прогрессирование симптомов свидетельствует о высоком риске госпита-лизации и смерти и поэтому должно являться сигналомдля внесения корректив в лечение. Уменьшение выражен-ности симптомов (в идеале до их полного исчезновения)является одной из двух основных целей лечения СН (дру-гой основной целью является снижение заболеваемостии смертности).5.3.0.0.0.3При ОКС может быть использована классификацияКиллипа [44].
Таблица 4. Классификация сердечной недостаточностиНью-Йоркской кардиологической ассоциации (NYHA)
Классификация СН по длительности течения
Важно помнить о том, что после соответствующего лечения больной СН может не иметь никаких симптомов.В тех случаях, когда нарушение работы сердца не сопро-вождается клиническими проявлениями, говорят о бес-симптомной СН или бессимптомной дисфункции ЛЖ(независимо от причины СН). Если СН прослеживаетсяна протяжении определенного времени, то ее обознача-ют как хроническую. Больной СН, у которого на фонесоответствующего лечения отсутствует ухудшение забо-левания на протяжении, по меньшей мере, одного месяца,считается стабильным. При усугублении ХСН говорято декомпенсации. Это усугубление может произойтивнезапно (острая СН), характеризуется существеннымувеличением риска смерти и обычно приводит к госпи-тализации. Впервые возникшая СН может дебютироватьостро (например, в момент ИМ) или, наоборот, нарас-тать постепенно, переходя от бессимптомной дисфунк-ции сердца к клинически выраженной СН. В ходе лече-ния клинические проявления СН могут уменьшитьсяили вообще исчезнуть (в таких случаях говорят о дости-жении компенсации), однако дисфункция сердца частоостается без изменений, и такие больные имеют высокийриск повторной декомпенсации. Иногда причина СНможет быть полностью устранима (например, при остромвирусном миокардите). В ряде других случаев, например,при идиопатической дилатационной кардиомиопатиис помощью современной терапии (иАПФ / блокатора-ми ангиотензиновых рецепторов, β-адреноблокаторами,антагонистами альдостерона) можно достичь существен-ного улучшения или даже полного восстановления систо-лической функции ЛЖ. До сих пор в литературе частовстречается термин «застойная СН», который отно-сится к больным острой или хронической СН, у которыхотмечаются застойные явления, связанные с задержкойжидкости. В отличие от других симптомов СН застойныеявления могут быть полностью устранены с помощьюдиуретиков. Важно понимать, что многие из представ-ленных определений СН могут быть применены у одногои того же больного в зависимости от стадии заболевания.
Классификация СН по выраженности симптомов
Для описания выраженности симптомов СН традиционно используют ФК Нью-Йоркской кардиологической ассоциации (таблица 4). Именно на основании этойклассификации отбирались больные для участия в боль-шинстве рандомизированных испытаний с СН. Больныес I ФК не имеют каких‑либо симптомов, связанных с забо-леванием сердца; больные со II, III или IV ФК имеютсоответственно незначительные, умеренные и выражен-ные симптомы СН.5.3.0.0.0.2Важно отметить, что выраженность симптомов сла-бо ассоциируется с систолической функцией ЛЖ, и хотяи существует четкая связь между тяжестью симптомови выживаемостью больных СН, больные с минималь-ными симптомами могут иметь относительно высокийабсолютный риск госпитализации и смерти [41–43].Симптомы также могут претерпевать быстрое измене-ние. Так, у больного с минимально выраженными сим-птомами может внезапно развиться одышка в покое из-завозникновения аритмии; состояние же декомпенсиро-ванного больного с отеком легких может быстро улучшиться при назначении диуретиков. Прогрессирование симптомов свидетельствует о высоком риске госпита-лизации и смерти и поэтому должно являться сигналомдля внесения корректив в лечение. Уменьшение выражен-ности симптомов (в идеале до их полного исчезновения)является одной из двух основных целей лечения СН (дру-гой основной целью является снижение заболеваемостии смертности).5.3.0.0.0.3При ОКС может быть использована классификацияКиллипа [44].
Таблица 4. Классификация сердечной недостаточностиНью-Йоркской кардиологической ассоциации (NYHA)
 Отечественная классификация ХСН
Классификация ХСН, предложенная ОССН и утвержденная Российским съездом кардиологовв 2003 году, предусматривает объединение классификации ХСН по стадиям (классификация Стражеско–Василенко)и ФК (по NYHA). Выставление в диагнозе не только ста-дии, но и ФК позволяет разделить тяжесть заболеванияи субъективное самочувствие больного, поскольку ста-дийность болезни (поражения сердца) не связана напря-мую с ФК (переносимостью физической нагрузки).
6. Диагностика СН
Симптомы и клинические признаки
Диагностика СН, особенно на ранних стадиях, может вызывать определенные затруднения. Обычно боль-ной СН обращается за медицинской помощью имен-но из-за возникновения у него симптомов, многиеиз которых имеют низкую специфичность (таблица 5) и не позволяют с уверенностью отличить СН от дру-гих заболеваний. Более же специфичные симптомы(такие как ортопноэ и ночные приступы сердечнойастмы) встречаются гораздо реже, особенно у больныхс начальными стадиями СН, и поэтому имеют низкуючувствительность [32–36].
Таблица 5. Симптомы и признаки, типичные для СН
Отечественная классификация ХСН
Классификация ХСН, предложенная ОССН и утвержденная Российским съездом кардиологовв 2003 году, предусматривает объединение классификации ХСН по стадиям (классификация Стражеско–Василенко)и ФК (по NYHA). Выставление в диагнозе не только ста-дии, но и ФК позволяет разделить тяжесть заболеванияи субъективное самочувствие больного, поскольку ста-дийность болезни (поражения сердца) не связана напря-мую с ФК (переносимостью физической нагрузки).
6. Диагностика СН
Симптомы и клинические признаки
Диагностика СН, особенно на ранних стадиях, может вызывать определенные затруднения. Обычно боль-ной СН обращается за медицинской помощью имен-но из-за возникновения у него симптомов, многиеиз которых имеют низкую специфичность (таблица 5) и не позволяют с уверенностью отличить СН от дру-гих заболеваний. Более же специфичные симптомы(такие как ортопноэ и ночные приступы сердечнойастмы) встречаются гораздо реже, особенно у больныхс начальными стадиями СН, и поэтому имеют низкуючувствительность [32–36].
Таблица 5. Симптомы и признаки, типичные для СН
 Многие клинические признаки СН связаны с задержкой жидкости и посему также не специфичны. Это преждевсего относится к периферическим отекам, которыемогут возникать и из-за внесердечных причин. Крометого, признаки, связанные с задержкой жидкости, доста-точно быстро исчезают при назначении диуретиков, поэ-тому они обычно отсутствуют у больных, получающихдиуретики. Выявление более специфических признаков,таких как набухание шейных вен и смещение верхушечного толчка влево, требует особых навыков, поэтомуих воспроизводимость достаточно низка [32–36].
Симптомы и клинические признаки СН особенно трудно выявлять и, что не менее важно, верно трактовать у пожилых больных, у больных с ожирением, у лиц с заболеваниями легких [45–47].
Большое значение в диагностике СН имеет тщательный сбор анамнеза. Сердечная недостаточностьмаловероятна у лиц без сколько-нибудь значимогоповреждения сердца, в то время как при наличии тако-вого (особенно ранее перенесенного ИМ) вероятностьналичия СН у больного с соответствующими симпто-мами и признаками существенно повышается [32–35].Это подчеркивает важность обнаружения у больногоструктурных или функциональных нарушений, кото-рые могли бы объяснитьимеющиеся симптомы и при-знаки СН и тем самым гарантировали бы ее правиль-ную диагностику.
При оценке эффективности лечения ориентируются главным образом на изменение симптомов и признаков;по ним же судят о стабилизации состояния. Сохранениесимптомов несмотря на предложенное лечение обычносвидетельствует о недостаточности терапии, а нарастаниесимптомов – о прогрессировании СН (то есть о переходебольного в категорию высокого риска экстренной госпи-тализации и смертельного исхода).
Для более точной оценки тяжести клинических про-явлений болезни неоднократно делались попытки создания шкал балльной оценки тяжести СН. С этой целью была предложена российская шкала (ШОКС; таблица 6). Данная шкала выгодно отличается от зарубежныханалогов своей простотой, поскольку основана лишьна сборе анамнеза и клиническом обследовании больного.Использование этой шкалы в динамике позволяет оцени-вать эффективность проводимого лечения ХСН, что былоподтверждено в ходе российских многоцентровых иссле-дований ФАСОН, БЕЗЕ, СНЕГОВИК и др.
Таблица 6. Шкала оценки клинического состояниябольного ХСН (ШОКС) (в модификации Мареева В. Ю.)
Многие клинические признаки СН связаны с задержкой жидкости и посему также не специфичны. Это преждевсего относится к периферическим отекам, которыемогут возникать и из-за внесердечных причин. Крометого, признаки, связанные с задержкой жидкости, доста-точно быстро исчезают при назначении диуретиков, поэ-тому они обычно отсутствуют у больных, получающихдиуретики. Выявление более специфических признаков,таких как набухание шейных вен и смещение верхушечного толчка влево, требует особых навыков, поэтомуих воспроизводимость достаточно низка [32–36].
Симптомы и клинические признаки СН особенно трудно выявлять и, что не менее важно, верно трактовать у пожилых больных, у больных с ожирением, у лиц с заболеваниями легких [45–47].
Большое значение в диагностике СН имеет тщательный сбор анамнеза. Сердечная недостаточностьмаловероятна у лиц без сколько-нибудь значимогоповреждения сердца, в то время как при наличии тако-вого (особенно ранее перенесенного ИМ) вероятностьналичия СН у больного с соответствующими симпто-мами и признаками существенно повышается [32–35].Это подчеркивает важность обнаружения у больногоструктурных или функциональных нарушений, кото-рые могли бы объяснитьимеющиеся симптомы и при-знаки СН и тем самым гарантировали бы ее правиль-ную диагностику.
При оценке эффективности лечения ориентируются главным образом на изменение симптомов и признаков;по ним же судят о стабилизации состояния. Сохранениесимптомов несмотря на предложенное лечение обычносвидетельствует о недостаточности терапии, а нарастаниесимптомов – о прогрессировании СН (то есть о переходебольного в категорию высокого риска экстренной госпи-тализации и смертельного исхода).
Для более точной оценки тяжести клинических про-явлений болезни неоднократно делались попытки создания шкал балльной оценки тяжести СН. С этой целью была предложена российская шкала (ШОКС; таблица 6). Данная шкала выгодно отличается от зарубежныханалогов своей простотой, поскольку основана лишьна сборе анамнеза и клиническом обследовании больного.Использование этой шкалы в динамике позволяет оцени-вать эффективность проводимого лечения ХСН, что былоподтверждено в ходе российских многоцентровых иссле-дований ФАСОН, БЕЗЕ, СНЕГОВИК и др.
Таблица 6. Шкала оценки клинического состояниябольного ХСН (ШОКС) (в модификации Мареева В. Ю.)
 Диагностические исследованияпри СН (таблица 7)
Таблица 7. Рекомендации по диагностическим исследованиям у амбулаторных больных с подозрением на СН1
Диагностические исследованияпри СН (таблица 7)
Таблица 7. Рекомендации по диагностическим исследованиям у амбулаторных больных с подозрением на СН1
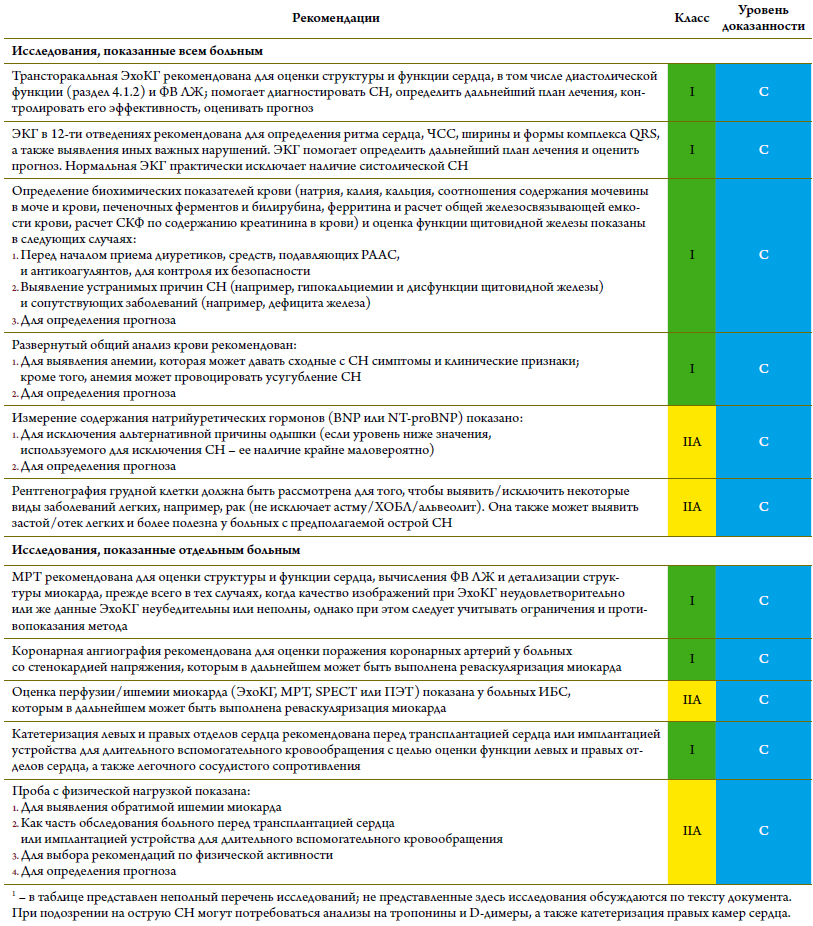 Таблица 8. Часто встречаемые нарушения на ЭКГ при сердечной недостаточности
Таблица 8. Часто встречаемые нарушения на ЭКГ при сердечной недостаточности
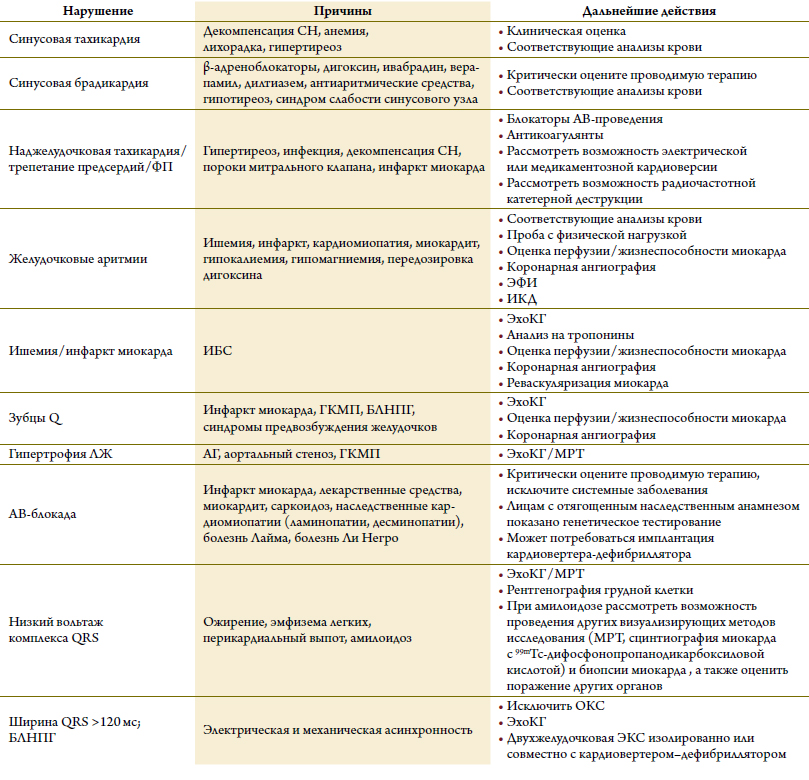 ЭхоКГ и ЭКГ относятся к первоочередным исследованиям у больных с подозрением на СН. Эхокардиографияпозволяет быстро оценить размеры сердца,состояние клапанного аппарата, систолической и диа-столической функции желудочков [37–40, 48–55].Подобная оценка имеет решающее значение при выбо-ре должного лечения (например, назначения иАПФи β-адреноблокаторовпо поводу систолической дис-функции или хирургического лечения по поводу стенозааортального клапана). С помощью ЭКГ можно оценить ритм и проводимость сердца, что также может повлиять на выбор лечения (например, контроль частоты сокращения желудочков и назначение антикоагулянтовпри ФП, имплантация кардиостимулятора при брадикардии, имплантация двухжелудочкового кардиостимулятора при блокаде левой ножки пучка Гиса и др.; таблица 8). На ЭКГ могут быть признаки рубцовыхизменений после перенесенных инфарктов или при-знаки гипертрофии камер сердца, что указывает на при-чину СН. Если у больных с подозрением на острую СН регистрируется нормальная ЭКГ, то это практическиполностью позволяет исключить СН, вероятность кото-рой у таких больных не превышает 2 % [32, 33, 56–59]. У больных же с постепенным началом симптомов обна-ружение нормальной ЭКГ имеет меньшую отрица-тельную прогностическую ценность (вероятность СН составляет 10–14 %).
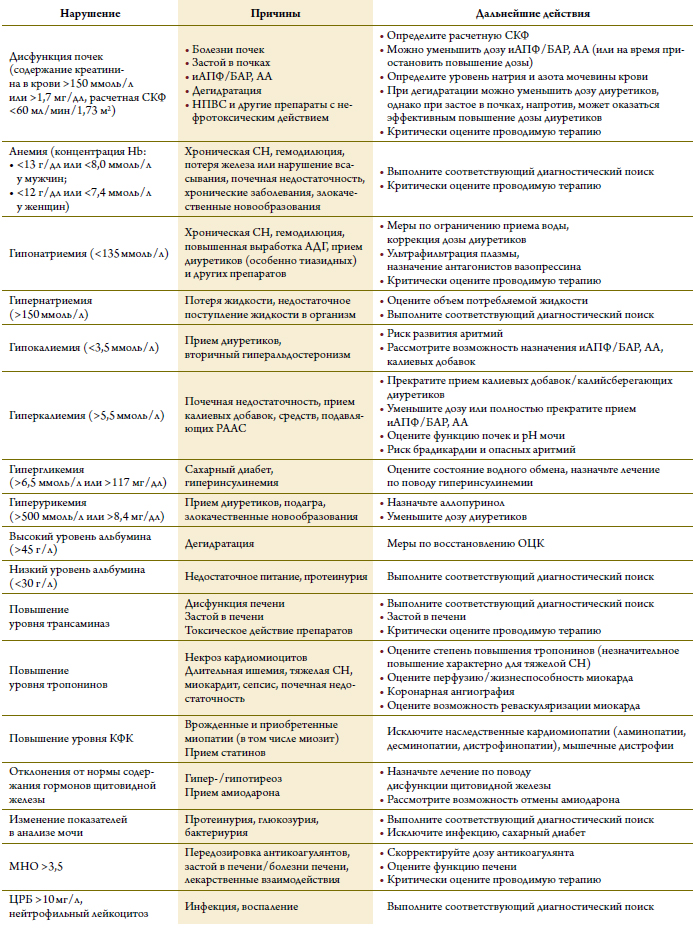
ЭКГ и ЭхоКГ позволяют выставить предваритель-ный диагноз СН и составить план лечения у большин-ства больных. С помощью стандартных биохимическихи гематологических анализов можно оценить функциюпочек и уровень калия перед началом приема средств,блокирующих РААС, исключить анемию (клиническиепроявления которой могут напоминать таковые при СН;в то же время она может усугублять течение уже имею-щейся СН), а также получить дополнительную полезнуюинформацию (таблица 9).
Таблица 9. Типичные отклонения от нормы лабораторных показателей у больных сердечной недостаточностью
ЭхоКГ и ЭКГ относятся к первоочередным исследованиям у больных с подозрением на СН. Эхокардиографияпозволяет быстро оценить размеры сердца,состояние клапанного аппарата, систолической и диа-столической функции желудочков [37–40, 48–55].Подобная оценка имеет решающее значение при выбо-ре должного лечения (например, назначения иАПФи β-адреноблокаторовпо поводу систолической дис-функции или хирургического лечения по поводу стенозааортального клапана). С помощью ЭКГ можно оценить ритм и проводимость сердца, что также может повлиять на выбор лечения (например, контроль частоты сокращения желудочков и назначение антикоагулянтовпри ФП, имплантация кардиостимулятора при брадикардии, имплантация двухжелудочкового кардиостимулятора при блокаде левой ножки пучка Гиса и др.; таблица 8). На ЭКГ могут быть признаки рубцовыхизменений после перенесенных инфарктов или при-знаки гипертрофии камер сердца, что указывает на при-чину СН. Если у больных с подозрением на острую СН регистрируется нормальная ЭКГ, то это практическиполностью позволяет исключить СН, вероятность кото-рой у таких больных не превышает 2 % [32, 33, 56–59]. У больных же с постепенным началом симптомов обна-ружение нормальной ЭКГ имеет меньшую отрица-тельную прогностическую ценность (вероятность СН составляет 10–14 %).
ЭКГ и ЭхоКГ позволяют выставить предваритель-ный диагноз СН и составить план лечения у большин-ства больных. С помощью стандартных биохимическихи гематологических анализов можно оценить функциюпочек и уровень калия перед началом приема средств,блокирующих РААС, исключить анемию (клиническиепроявления которой могут напоминать таковые при СН;в то же время она может усугублять течение уже имею-щейся СН), а также получить дополнительную полезнуюинформацию (таблица 9).
Таблица 9. Типичные отклонения от нормы лабораторных показателей у больных сердечной недостаточностью
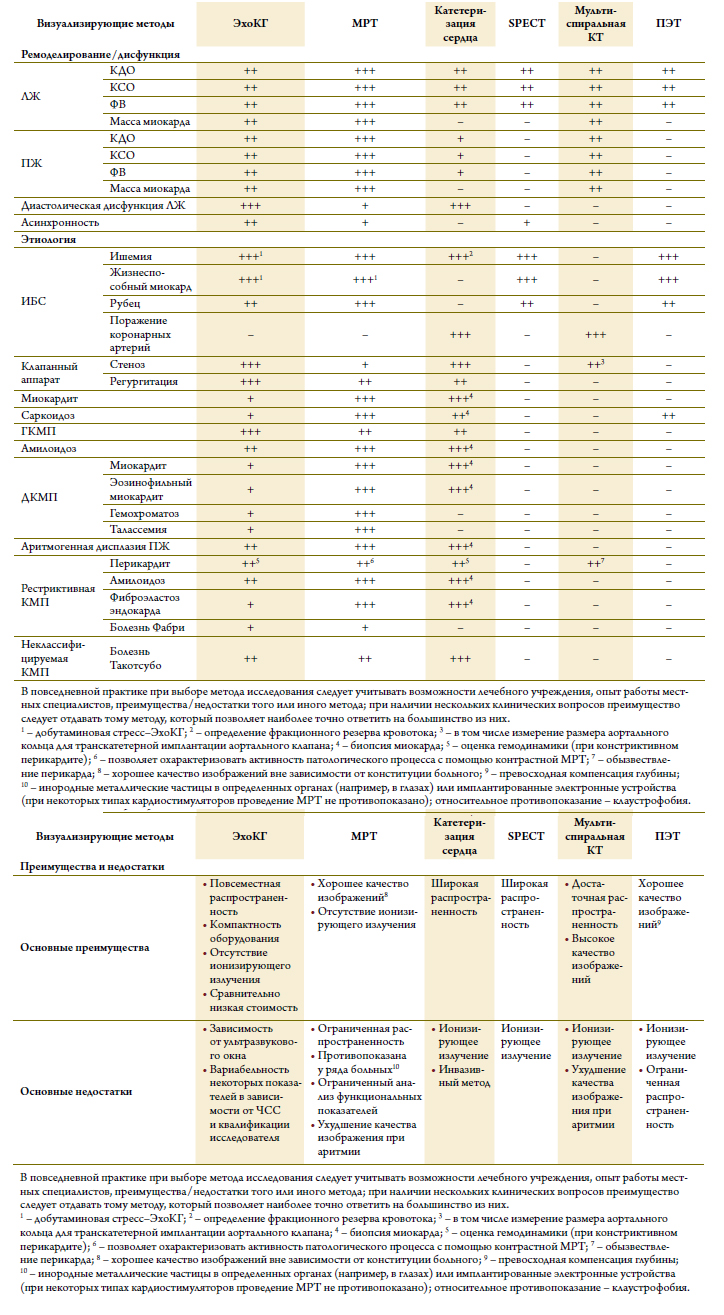
 Визуализирующие методы исследования играют цен-тральную роль в диагностике СН, а также в контролеэффективности лечения. При подозрении на СН мето-дом выбора является ЭхоКГ по причине своей высокойдиагностической точности, повсеместной распростра-ненности, безопасности и относительно низкой стоимо-сти [48–55]. В зависимости от конкретной клиническойзадачи ЭхоКГ может быть дополнена другими методамиисследования (таблица 10) [60–68]. Любое визуализи-рующее исследование должно быть выполнено опытными компетентным специалистом [53].
Прочие же методы исследования требуются главнымобразом лишь в тех случаях, когда:
A) неясен диагноз (например, при неудовлетворительномкачестве изображений при трансторакальной ЭхоКГ);
B) имеется подозрение на редкое заболевание сердцаили на несердечную причину имеющихся у больногосимптомов и клинических признаков;
C) требуется более детальная оценка причины СН(например,перфузионная сцинтиграфия или ангиографияпри подозрении на ИБС или биопсия миокардапри некоторых инфильтративных кардиомиопатиях).
Таблица 10. Сравнительная оценка различных визуализирующих методов, используемых в диагностике СН
Визуализирующие методы исследования играют цен-тральную роль в диагностике СН, а также в контролеэффективности лечения. При подозрении на СН мето-дом выбора является ЭхоКГ по причине своей высокойдиагностической точности, повсеместной распростра-ненности, безопасности и относительно низкой стоимо-сти [48–55]. В зависимости от конкретной клиническойзадачи ЭхоКГ может быть дополнена другими методамиисследования (таблица 10) [60–68]. Любое визуализи-рующее исследование должно быть выполнено опытными компетентным специалистом [53].
Прочие же методы исследования требуются главнымобразом лишь в тех случаях, когда:
A) неясен диагноз (например, при неудовлетворительномкачестве изображений при трансторакальной ЭхоКГ);
B) имеется подозрение на редкое заболевание сердцаили на несердечную причину имеющихся у больногосимптомов и клинических признаков;
C) требуется более детальная оценка причины СН(например,перфузионная сцинтиграфия или ангиографияпри подозрении на ИБС или биопсия миокардапри некоторых инфильтративных кардиомиопатиях).
Таблица 10. Сравнительная оценка различных визуализирующих методов, используемых в диагностике СН
 Натрийуретические гормоны
Поскольку симптомы и клинические признаки СН неспецифичны, у многих больных с клиническим подо-зрением на СН при ЭхоКГ не удается выявить сколь-ко-нибудь значимых нарушений со стороны сердца.Альтернативный диагностический подход подразумевает измерение концентрации в крови натрийуретических гормонов – семейства пептидов, секреция которых воз-растает при органических поражениях сердца, а также при повышении гемодинамической нагрузки на сердце(например, при ФП, тромбоэмболии легочной артерии),а также при ряде внесердечных состояний (например,при почечной недостаточности) [69–72]. Содержание натрийуретических гормонов также повышается с возрастом, но может быть низким у лиц с ожирением [47]или гипотиреозом. Нормальное содержание натрийуретических гормонов при отсутствии предшествующего лечения фактически исключает значимое поражение сердца, что делает необязательным проведение ЭхоКГ.В таких случаях целесообразно сосредоточиться на поиске внесердечных причин имеющихся у больного симптомов и клинических признаков [69, 72].
В ходе многочисленных исследований были определены так называемые «пороговые значения»для натрийуретических гормонов [73–80]. У больных с разным началом симптомов используются разные пороговые значения. При остром началесимптомов или резком их нарастании для исключения СН уровень мозгового натрийуретического гормона (BNP) должен быть менее 100 пг / мл,а его N-концевого предшественника (NT-proBNP) –менее 300 пг / мл. При постепенном начале симптомов для исключения СН уровень BNP должен быть менее 35 пг / мл, а NT-proBNP – менее 125 пг / мл.Чувствительность и специфичность тестов на BNPи NT-proBNP при постепенном начале симптомов ниже, чем при остром начале [73–80].
Поскольку высокий уровень натрийуретических гормонов ассоциируется с неблагоприятным прогнозом,а снижение этого уровня приводит к улучшению прогноза, в свое время было высказано предположение о более четком контроле эффективности лечения с помощью серийного определения уровня натрийуретических гормонов по сравнению с контролем, основанном на слежении лишь за клиническими показателями. Однако в рандомизированных клинических испытаниях, посвященных данному вопросу, были получены весьма противоречивые результаты [81].
Таблица 11. Прогностические факторы при СН (представлены лишь наиболее изученные факторы)
Натрийуретические гормоны
Поскольку симптомы и клинические признаки СН неспецифичны, у многих больных с клиническим подо-зрением на СН при ЭхоКГ не удается выявить сколь-ко-нибудь значимых нарушений со стороны сердца.Альтернативный диагностический подход подразумевает измерение концентрации в крови натрийуретических гормонов – семейства пептидов, секреция которых воз-растает при органических поражениях сердца, а также при повышении гемодинамической нагрузки на сердце(например, при ФП, тромбоэмболии легочной артерии),а также при ряде внесердечных состояний (например,при почечной недостаточности) [69–72]. Содержание натрийуретических гормонов также повышается с возрастом, но может быть низким у лиц с ожирением [47]или гипотиреозом. Нормальное содержание натрийуретических гормонов при отсутствии предшествующего лечения фактически исключает значимое поражение сердца, что делает необязательным проведение ЭхоКГ.В таких случаях целесообразно сосредоточиться на поиске внесердечных причин имеющихся у больного симптомов и клинических признаков [69, 72].
В ходе многочисленных исследований были определены так называемые «пороговые значения»для натрийуретических гормонов [73–80]. У больных с разным началом симптомов используются разные пороговые значения. При остром началесимптомов или резком их нарастании для исключения СН уровень мозгового натрийуретического гормона (BNP) должен быть менее 100 пг / мл,а его N-концевого предшественника (NT-proBNP) –менее 300 пг / мл. При постепенном начале симптомов для исключения СН уровень BNP должен быть менее 35 пг / мл, а NT-proBNP – менее 125 пг / мл.Чувствительность и специфичность тестов на BNPи NT-proBNP при постепенном начале симптомов ниже, чем при остром начале [73–80].
Поскольку высокий уровень натрийуретических гормонов ассоциируется с неблагоприятным прогнозом,а снижение этого уровня приводит к улучшению прогноза, в свое время было высказано предположение о более четком контроле эффективности лечения с помощью серийного определения уровня натрийуретических гормонов по сравнению с контролем, основанном на слежении лишь за клиническими показателями. Однако в рандомизированных клинических испытаниях, посвященных данному вопросу, были получены весьма противоречивые результаты [81].
Таблица 11. Прогностические факторы при СН (представлены лишь наиболее изученные факторы)
 Рентгенография грудной клетки
У больных с подозрением на СН рентгенография груд-ной клетки имеет небольшое значение, хотя и позволяет выявить венозный застой или отек легких. Исчезновениепризнаков венозного застоя в легких на фоне леченияможет служить объективным критерием его эффектив-ности. По всей видимости, рентгенография наиболееполезна для исключения легочной причины одышки.Обнаружение кардиомегалии (величины кардиотора-кального индекса более 50 %) свидетельствует о пато-логии сердца. Впрочем следует заметить, что расширение границ сердечной тени может отсутствовать дажепри выраженной систолической дисфункции ЛЖ.
Лабораторные анализы
В дополнение к стандартным биохимическому и гематологическому анализам крови большое значение имеет измерение концентрации тиреотропногогормона, поскольку клинические проявления заболеваний щитовидной железы и СН могут быть похожими; кроме того, заболевания щитовидной железы могут усугублять течение СН (таблица 9). Крайневажным является определение уровня глюкозы в кро-ви, поскольку при СН часто встречается СД, нередкодо этого никем не распознанный. При СН может бытьповышен уровень печеночных ферментов, что следуетучитывать при назначении таких препаратов, как амиодаронили варфарин.
При лечении средствами, подавляющими активность РААС, следует тщательно следить за функцией почек и содержанием в крови калия, особенно при под-боре дозы этих препаратов. При длительном использовании этих средств оценка функции почек показана в случае возникновения эпизодов потери натрия и жид-кости (например, при диарее или рвоте), при назначении новых препаратов или изменении дозы ранее принимаемых препаратов, влияющих на обмен натрия и воды в организме или на функцию почек (например, НПВС и диуретиков, особенно калийсберегающих). Многие стандартные лабораторные показателипри СН имеют самостоятельное прогностическое значение (таблица 11).
Эхокардиография
Эхокардиография используется для оценки структурыи функции сердца и выявления органических причин СН.
Оценка систолической функции ЛЖ
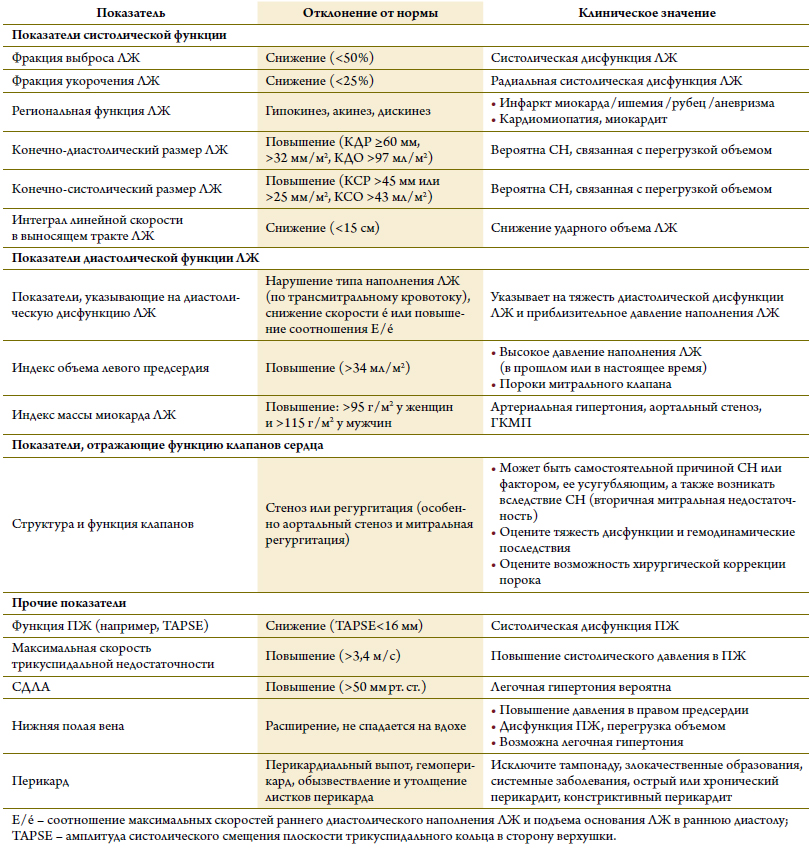
В качестве показателя насосной функции сердцаиспользуется ФВ ЛЖ, которая, впрочем, весьма неточ-но отражает истинное состояние сократимости ЛЖ, поскольку зависит от множества других факторов: объемажелудочка, пред- и посленагрузки, состояния кла-панов. Следует помнить, что ФВ – это не одно и то же,что и ударный объем. Так, при систолической СН (низ-кой ФВ) ударный объем долгое время может оставатьсяв пределах нормы за счет расширения ЛЖ, в то времякак при СН–СФВ и концентрической гипертрофии ЛЖударный объем может быть снижен, несмотря на нор-мальную ФВ. При тяжелой митральной недостаточностиФВ также может быть нормальной и даже повышенной,несмотря на снижение антеградного ударного объема.Поэтому всякий раз, определяя ФВ, ее следует интерпре-тировать с учетом данного клинического контекста.
Оптимальным способом расчета ФВ является методдисков (метод Симпсона) [38, 50–55, 82]. Однако посколькуэтот метод основан на обводе границы эндокар-да, при неудовлетворительном качестве изображений(визуализации <80 % эндокарда ЛЖ) можно восполь-зоваться контрастными веществами, что позволяет луч-ше рассмотреть эндокард [83]. Методы вычисления ФВпо Тейхользу или Хинонесу основаны на измерениилинейных размеров и могут давать неточные результаты(прежде всего у больных с нарушением локальной сокра-тимости ЛЖ). То же самое справедливо для другогометода оценки систолической функции ЛЖ – фракцииукорочения. Трехмерная ЭхоКГ позволяет более точноопределять объемы и ФВ ЛЖ при условии получения изо-бражений приемлемого качества [84]. При оценке сокра-тимости ЛЖ можно также ориентироваться на индексдвижения стенок ЛЖ, однако его редко используютв клинической практике. К прочим показателям систо-лической функции ЛЖ относятся скорость систоличе-ского движения основания ЛЖ, измеренная с помощьютканевого допплеровского исследования, амплитуда сме-щения атрио-вентрикулярной плоскости, деформацияи скорость деформации миокарда (соответственно strainи strain rate). Показатели деформации миокарда болеетонко, нежели ФВ, реагируют на изменения систоличе-ской функции ЛЖ. Однако из-за своей низкой воспроиз-водимости и отсутствия нормативных значений эти пока-затели в настоящее время используются редко. Ударныйобъем можно рассчитать, умножив интеграл линейнойскорости кровотока в выносящем тракте ЛЖ на площадьвыносящего тракта.
В таблице 12 представлены нарушения, часто выявляемые при ЭхоКГ у больных СН.
Таблица 12. Часто встречаемые ЭхоКГ нарушения при СН
Рентгенография грудной клетки
У больных с подозрением на СН рентгенография груд-ной клетки имеет небольшое значение, хотя и позволяет выявить венозный застой или отек легких. Исчезновениепризнаков венозного застоя в легких на фоне леченияможет служить объективным критерием его эффектив-ности. По всей видимости, рентгенография наиболееполезна для исключения легочной причины одышки.Обнаружение кардиомегалии (величины кардиотора-кального индекса более 50 %) свидетельствует о пато-логии сердца. Впрочем следует заметить, что расширение границ сердечной тени может отсутствовать дажепри выраженной систолической дисфункции ЛЖ.
Лабораторные анализы
В дополнение к стандартным биохимическому и гематологическому анализам крови большое значение имеет измерение концентрации тиреотропногогормона, поскольку клинические проявления заболеваний щитовидной железы и СН могут быть похожими; кроме того, заболевания щитовидной железы могут усугублять течение СН (таблица 9). Крайневажным является определение уровня глюкозы в кро-ви, поскольку при СН часто встречается СД, нередкодо этого никем не распознанный. При СН может бытьповышен уровень печеночных ферментов, что следуетучитывать при назначении таких препаратов, как амиодаронили варфарин.
При лечении средствами, подавляющими активность РААС, следует тщательно следить за функцией почек и содержанием в крови калия, особенно при под-боре дозы этих препаратов. При длительном использовании этих средств оценка функции почек показана в случае возникновения эпизодов потери натрия и жид-кости (например, при диарее или рвоте), при назначении новых препаратов или изменении дозы ранее принимаемых препаратов, влияющих на обмен натрия и воды в организме или на функцию почек (например, НПВС и диуретиков, особенно калийсберегающих). Многие стандартные лабораторные показателипри СН имеют самостоятельное прогностическое значение (таблица 11).
Эхокардиография
Эхокардиография используется для оценки структурыи функции сердца и выявления органических причин СН.
Оценка систолической функции ЛЖ
В качестве показателя насосной функции сердцаиспользуется ФВ ЛЖ, которая, впрочем, весьма неточ-но отражает истинное состояние сократимости ЛЖ, поскольку зависит от множества других факторов: объемажелудочка, пред- и посленагрузки, состояния кла-панов. Следует помнить, что ФВ – это не одно и то же,что и ударный объем. Так, при систолической СН (низ-кой ФВ) ударный объем долгое время может оставатьсяв пределах нормы за счет расширения ЛЖ, в то времякак при СН–СФВ и концентрической гипертрофии ЛЖударный объем может быть снижен, несмотря на нор-мальную ФВ. При тяжелой митральной недостаточностиФВ также может быть нормальной и даже повышенной,несмотря на снижение антеградного ударного объема.Поэтому всякий раз, определяя ФВ, ее следует интерпре-тировать с учетом данного клинического контекста.
Оптимальным способом расчета ФВ является методдисков (метод Симпсона) [38, 50–55, 82]. Однако посколькуэтот метод основан на обводе границы эндокар-да, при неудовлетворительном качестве изображений(визуализации <80 % эндокарда ЛЖ) можно восполь-зоваться контрастными веществами, что позволяет луч-ше рассмотреть эндокард [83]. Методы вычисления ФВпо Тейхользу или Хинонесу основаны на измерениилинейных размеров и могут давать неточные результаты(прежде всего у больных с нарушением локальной сокра-тимости ЛЖ). То же самое справедливо для другогометода оценки систолической функции ЛЖ – фракцииукорочения. Трехмерная ЭхоКГ позволяет более точноопределять объемы и ФВ ЛЖ при условии получения изо-бражений приемлемого качества [84]. При оценке сокра-тимости ЛЖ можно также ориентироваться на индексдвижения стенок ЛЖ, однако его редко используютв клинической практике. К прочим показателям систо-лической функции ЛЖ относятся скорость систоличе-ского движения основания ЛЖ, измеренная с помощьютканевого допплеровского исследования, амплитуда сме-щения атрио-вентрикулярной плоскости, деформацияи скорость деформации миокарда (соответственно strainи strain rate). Показатели деформации миокарда болеетонко, нежели ФВ, реагируют на изменения систоличе-ской функции ЛЖ. Однако из-за своей низкой воспроиз-водимости и отсутствия нормативных значений эти пока-затели в настоящее время используются редко. Ударныйобъем можно рассчитать, умножив интеграл линейнойскорости кровотока в выносящем тракте ЛЖ на площадьвыносящего тракта.
В таблице 12 представлены нарушения, часто выявляемые при ЭхоКГ у больных СН.
Таблица 12. Часто встречаемые ЭхоКГ нарушения при СН
 Оценка диастолической функции ЛЖ
Считается, что в основе большинства случаев СН–СФВ лежит нарушение диастолической функции ЛЖ,поэтому ее корректная оценка – краеугольный каменьдиагностики этой формы СН (таблица 13) [48–55, 85,86]. Важно помнить, что нормальные значения боль-шинства ультразвуковых показателей диастолическойфункции ЛЖ зависят от возраста, ЧСС и размера тела[85, 86]. Важно, что ни один из ультразвуковых показа-телей не обладает достаточной диагностической точностью для того, чтобы на его основании был сделан вывод о наличии либо отсутствии у больного диастолической дисфункции ЛЖ. При оценке диастолической функциивсегда следует учитывать данные всех исследований,включая данные допплеровских и двухмерного режимов[38, 85, 86]. Максимальная скорость подъема основа-ния ЛЖ в раннюю диастолу (скорость é), измереннаяс помощью тканевого допплеровского исследования,позволяет оценить скорость расслабления миокарда.Нормальные значения скорости é (>8 см / с из областимежжелудочковой перегородки, >10 см / с из областибоковой стенки или >9 см / с при усреднении скоростей)при СН практически не встречаются. СоотношениеE / é тесно связано с давлением наполнения ЛЖ (табли-ца 13) [85, 86]. Таким образом, основными ультразвуковыми критериями диастолической дисфункции ЛЖ являются снижение скорости é (усредненная скорость<9 см / сек) и / или повышение соотношения E / é (>15).Отклонение от нормы, по меньшей мере, двух показателей и / или наличие ФП повышают точность диагности-ки диастолической дисфункции.
Чреспищеводная ЭхоКГ
Обычно к чреспищеводной ЭхоКГ прибегают при неудовлетворительном качестве изображений при трансторакальном исследовании (например, у больных с ожирением, заболеваниями легких, находящихся на искусственной вентиляции легких), а также тогда, когда прочие визуализирующие методы по тем или иным причинам недоступны. Чреспищеводная ЭхоКГ особенно цен-на у больных со сложными приобретенными порокамисердца (особенно с патологией митрального и протези-рованных клапанов), при подозрении на инфекционныйэндокардит и у некоторых категорий больных с врожден-ными пороками сердца. У больных с ФП чреспищевод-ная ЭхоКГ позволяет обнаружить тромбоз ушка левогопредсердия.
Стресс–ЭхоКГ
Стресс–ЭхоКГ с физической или фармакологическойнагрузкой – надежный метод оценки ишемии и жизне-способности миокарда. При систолической дисфункцииЛЖ, связанной с ИБС, стресс–ЭхоКГ позволяет отли-чить ишемизированный, но жизнеспособный миокардот рубцовой ткани [55]. Стресс–ЭхоКГ показана боль-ным с подозрением на тяжелый стеноз аортального кла-пана, у которых из-за систолической дисфункции ЛЖрегистрируется низкий трансклапанный градиент дав-ления. У больных с симптомами, характерными для СН,нормальной ФВ, незначительной диастолической дис-функцией ЛЖ в покое может быть выполнена стресс–ЭхоКГ с целью оценки изменения давления наполненияпри нагрузке, что позволяет подтвердить или опровер-гнуть диагноз СН–СФВ [85].
Магнитно-резонансная томография (МРТ)
МРТ позволяет оценивать структурные и функци-ональные изменения сердца практически в том же объеме, что и ЭхоКГ (включая оценку ишемии и жизнеспособности миокарда), а также получать дополнительнуюинформацию, недоступную для ЭхоКГ [60, 65, 87]. МРТсчитается «золотым стандартом» по точности измеренияобъемов, массы и сократимости камер сердца. МРТ является наилучшей альтернативой при неудовлетворительном качестве изображений при трансторакальной ЭхоКГ.МРТ особенно ценна в выявлении воспалительныхи инфильтративных заболеваний миокарда (таблица 10)[87]. МРТ может быть включена в программу обследова-ния больных с подозрением на ту или иную кардиомиопа-тию, первичные или вторичные опухоли сердца, болезниперикарда. МРТ является методом выбора при комбини-рованных врожденных пороках сердца [88]. К недостат-кам МРТ относят ограниченную распространенностьисследования и его высокую стоимость, а также невоз-можность выполнения исследования у больных с метал-лическими имплантатами, включая некоторые (но не все!)внутрисердечные устройства. Кроме того, у больныхс наджелудочковыми аритмиями точность оценки функ-циональных показателей значительно снижается. В рядеслучаев исследование не может быть выполнено по при-чине наличия у больного клаудистрофобии. Контрастныесредства на основе гадолиния противопоказаны больнымсо скоростью клубочковой фильтрации <30 мл / мин / м2,поскольку могут вызвать такое опасное и нередко смер-тельное состояние, как нефрогенный системный фиброз(это осложнение в меньшей степени относится к недавноразработанному макроциклическому гадолинию) [89, 90].
Однофотонная эмиссионная компьютернаятомография и изотопная вентрикулография
Однофотонная эмиссионная компьютерная томография(SPECT) используется для выявления ишемиии оценки жизнеспособности миокарда (таблица 10) [62].Также с помощью SPECT можно оценивать объемыкамери функцию сердца, однако следует помнить, что при этомметоде больной подвергается ионизирующему излучению.
Позитронно-эмиссионная томография (ПЭТ)
ПЭТ изолированно или в сочетании с компьютернойтомографией позволяет количественно оценить ишемию и жизнеспособность миокарда, однако используемые для этой оценки 15О-вода и 13N-аммиак производятсяна циклотроне и имеют довольно короткий период полураспада, из-за чего ПЭТ может быть выполнена только в специализированных центрах [66, 68]. В качестве альтернативной метки для оценки ишемии миокарда можно использовать рубидий, который получают с помощью генераторов, что определяет его сравнительно низкую стоимость (таблица 10). Основными недостатками метода являются ограниченная распространенность, ионизи-рующее излучение и высокая стоимость камеры.
Коронарная ангиография
Коронарная ангиография показана больным со стенокардией при условии возможности последующей реваскуляризации миокарда. Ангиография также показана при положительном результате нагрузочных проб, в том числе у больных с низкой сократимостью ЛЖ, посколь-ку у таких больных может оказаться эффективным аорто-коронарное шунтирование. Перед ангиографией следует оценить жизнеспособность миокарда, поскольку при отсутствии такового целесообразность в ангиографии отпадает. У ряда больных острой СН (кардиогеннымшоком или острым отеком легких), особенно при ОКС,может потребоваться экстренная коронарная ангиогра-фия. Коронарная ангиография показана больным с приоб-ретенными пороками сердца перед операцией на клапанах,а также пациентам из группы риска ИБС перед импланта-цией двухкамерных электрокардиостимуляторов (ЭКС).
Компьютерная томография сердца
На сегодняшний день основной «точкой приложения» компьютерной томографии при СН является неин-вазивная оценка поражения коронарных артерий [67].
Таблица 13. Часто встречаемые ЭхоКГ нарушения диастолической функции ЛЖ
Оценка диастолической функции ЛЖ
Считается, что в основе большинства случаев СН–СФВ лежит нарушение диастолической функции ЛЖ,поэтому ее корректная оценка – краеугольный каменьдиагностики этой формы СН (таблица 13) [48–55, 85,86]. Важно помнить, что нормальные значения боль-шинства ультразвуковых показателей диастолическойфункции ЛЖ зависят от возраста, ЧСС и размера тела[85, 86]. Важно, что ни один из ультразвуковых показа-телей не обладает достаточной диагностической точностью для того, чтобы на его основании был сделан вывод о наличии либо отсутствии у больного диастолической дисфункции ЛЖ. При оценке диастолической функциивсегда следует учитывать данные всех исследований,включая данные допплеровских и двухмерного режимов[38, 85, 86]. Максимальная скорость подъема основа-ния ЛЖ в раннюю диастолу (скорость é), измереннаяс помощью тканевого допплеровского исследования,позволяет оценить скорость расслабления миокарда.Нормальные значения скорости é (>8 см / с из областимежжелудочковой перегородки, >10 см / с из областибоковой стенки или >9 см / с при усреднении скоростей)при СН практически не встречаются. СоотношениеE / é тесно связано с давлением наполнения ЛЖ (табли-ца 13) [85, 86]. Таким образом, основными ультразвуковыми критериями диастолической дисфункции ЛЖ являются снижение скорости é (усредненная скорость<9 см / сек) и / или повышение соотношения E / é (>15).Отклонение от нормы, по меньшей мере, двух показателей и / или наличие ФП повышают точность диагности-ки диастолической дисфункции.
Чреспищеводная ЭхоКГ
Обычно к чреспищеводной ЭхоКГ прибегают при неудовлетворительном качестве изображений при трансторакальном исследовании (например, у больных с ожирением, заболеваниями легких, находящихся на искусственной вентиляции легких), а также тогда, когда прочие визуализирующие методы по тем или иным причинам недоступны. Чреспищеводная ЭхоКГ особенно цен-на у больных со сложными приобретенными порокамисердца (особенно с патологией митрального и протези-рованных клапанов), при подозрении на инфекционныйэндокардит и у некоторых категорий больных с врожден-ными пороками сердца. У больных с ФП чреспищевод-ная ЭхоКГ позволяет обнаружить тромбоз ушка левогопредсердия.
Стресс–ЭхоКГ
Стресс–ЭхоКГ с физической или фармакологическойнагрузкой – надежный метод оценки ишемии и жизне-способности миокарда. При систолической дисфункцииЛЖ, связанной с ИБС, стресс–ЭхоКГ позволяет отли-чить ишемизированный, но жизнеспособный миокардот рубцовой ткани [55]. Стресс–ЭхоКГ показана боль-ным с подозрением на тяжелый стеноз аортального кла-пана, у которых из-за систолической дисфункции ЛЖрегистрируется низкий трансклапанный градиент дав-ления. У больных с симптомами, характерными для СН,нормальной ФВ, незначительной диастолической дис-функцией ЛЖ в покое может быть выполнена стресс–ЭхоКГ с целью оценки изменения давления наполненияпри нагрузке, что позволяет подтвердить или опровер-гнуть диагноз СН–СФВ [85].
Магнитно-резонансная томография (МРТ)
МРТ позволяет оценивать структурные и функци-ональные изменения сердца практически в том же объеме, что и ЭхоКГ (включая оценку ишемии и жизнеспособности миокарда), а также получать дополнительнуюинформацию, недоступную для ЭхоКГ [60, 65, 87]. МРТсчитается «золотым стандартом» по точности измеренияобъемов, массы и сократимости камер сердца. МРТ является наилучшей альтернативой при неудовлетворительном качестве изображений при трансторакальной ЭхоКГ.МРТ особенно ценна в выявлении воспалительныхи инфильтративных заболеваний миокарда (таблица 10)[87]. МРТ может быть включена в программу обследова-ния больных с подозрением на ту или иную кардиомиопа-тию, первичные или вторичные опухоли сердца, болезниперикарда. МРТ является методом выбора при комбини-рованных врожденных пороках сердца [88]. К недостат-кам МРТ относят ограниченную распространенностьисследования и его высокую стоимость, а также невоз-можность выполнения исследования у больных с метал-лическими имплантатами, включая некоторые (но не все!)внутрисердечные устройства. Кроме того, у больныхс наджелудочковыми аритмиями точность оценки функ-циональных показателей значительно снижается. В рядеслучаев исследование не может быть выполнено по при-чине наличия у больного клаудистрофобии. Контрастныесредства на основе гадолиния противопоказаны больнымсо скоростью клубочковой фильтрации <30 мл / мин / м2,поскольку могут вызвать такое опасное и нередко смер-тельное состояние, как нефрогенный системный фиброз(это осложнение в меньшей степени относится к недавноразработанному макроциклическому гадолинию) [89, 90].
Однофотонная эмиссионная компьютернаятомография и изотопная вентрикулография
Однофотонная эмиссионная компьютерная томография(SPECT) используется для выявления ишемиии оценки жизнеспособности миокарда (таблица 10) [62].Также с помощью SPECT можно оценивать объемыкамери функцию сердца, однако следует помнить, что при этомметоде больной подвергается ионизирующему излучению.
Позитронно-эмиссионная томография (ПЭТ)
ПЭТ изолированно или в сочетании с компьютернойтомографией позволяет количественно оценить ишемию и жизнеспособность миокарда, однако используемые для этой оценки 15О-вода и 13N-аммиак производятсяна циклотроне и имеют довольно короткий период полураспада, из-за чего ПЭТ может быть выполнена только в специализированных центрах [66, 68]. В качестве альтернативной метки для оценки ишемии миокарда можно использовать рубидий, который получают с помощью генераторов, что определяет его сравнительно низкую стоимость (таблица 10). Основными недостатками метода являются ограниченная распространенность, ионизи-рующее излучение и высокая стоимость камеры.
Коронарная ангиография
Коронарная ангиография показана больным со стенокардией при условии возможности последующей реваскуляризации миокарда. Ангиография также показана при положительном результате нагрузочных проб, в том числе у больных с низкой сократимостью ЛЖ, посколь-ку у таких больных может оказаться эффективным аорто-коронарное шунтирование. Перед ангиографией следует оценить жизнеспособность миокарда, поскольку при отсутствии такового целесообразность в ангиографии отпадает. У ряда больных острой СН (кардиогеннымшоком или острым отеком легких), особенно при ОКС,может потребоваться экстренная коронарная ангиогра-фия. Коронарная ангиография показана больным с приоб-ретенными пороками сердца перед операцией на клапанах,а также пациентам из группы риска ИБС перед импланта-цией двухкамерных электрокардиостимуляторов (ЭКС).
Компьютерная томография сердца
На сегодняшний день основной «точкой приложения» компьютерной томографии при СН является неин-вазивная оценка поражения коронарных артерий [67].
Таблица 13. Часто встречаемые ЭхоКГ нарушения диастолической функции ЛЖ
 Дополнительные методы исследования
Катетеризация сердца и биопсия миокарда
При подозрении на констриктивный перикардитили рестриктивную кардиомиопатию катетеризация сердца, используемая совместно с неинвазивными методами исследования, позволяет установить правильный диагноз (таблица 10). При подозрении на миокардитили инфильтративные заболевания сердца (например,амилоидоз) показана биопсия миокарда [91].
Пробы с физической нагрузкой
Пробы с физической нагрузкой позволяют получить объективную оценку переносимости физической нагрузки, а также выяснить, с чем связана одышка и утомляемость при физической нагрузке [92], и оценить прогноз. Обычно для этого используют тест 6-мин ходьбы и ряд протоколов с велоэргометрией или тредмилом. Анализ газообмена помогает выяснить, с чем связана одышка – с патологией сердца или легких, а также имеет важное прогностическое значение (при рассмотрении вопроса о трансплантации обязательно определяют максимальное потребление кислорода). Нормальная переносимостьфизической нагрузки у больного без предшествующеголечения позволяет с уверенностью исключить диагнозсимптомной СН, однако необходимо помнить о том,что переносимость нагрузки слабо связана с гемодинами-ческими показателями, измеренными в состоянии покоя(прежде всего это касается ФВ).
Генетическое тестирование
Аспекты генетического тестирования при кардиомиопатиях подробно изложены в соответствующем руководстве [83]. Генетическое тестирование рекомендованобольным с дилатационной кардиомиопатией и атрио-вен-трикулярной блокадой или внезапной смертью близкихродственников, поскольку в таких случаях может потре-боваться профилактическая постановка кардиовертера-дефибриллятора.
Холтеровский мониторинг ЭКГ
Холтеровский мониторинг ЭКГ показан при наличии симптомов, предположительно связанных с нарушениями ритма сердца и проводимости (например, при сердцебиении или обмороках). У больных с ФП при суточном мониторинге ЭКГ следят за частотой желудочковых сокращений. С помощью этого исследования можноопределить тип имеющихся у больного нарушений ритмасердца, оценить их продолжительность и частоту сокращения желудочков, зафиксировать эпизоды безболевойишемии миокарда, брадикардии и нарушений проводи-мости, каждый из которых может быть самостоятельнойпричиной СН или же усугублять ее течение.
Алгоритм постановки диагноза СН
На рисунке 1 представлен диагностический алгоритм при СН. У больных с подозрением на СН и с острым началом симптомов рекомендовано как можно более быстрое проведение ЭхоКГ (при кардиогенном шоке или значительных гемодинамических нарушениях – в экстренномпорядке). При постепенном начале симптомов обследование начинают с ЭКГ и теста на натрийуретические гормоны, по результатам которых определяют, нуждается ли больной в проведении ЭхоКГ или нет. Эхокардиография показана при обнаружении патологических изменений на ЭКГ или если содержание натрийуретических гормонов превышает пороговые значения. У больных с посте-пенным началом симптомов следует ориентироватьсяна более низкие значения натрийуретических гормонов,нежели у больных с острым началом, что позволяет мини-мизировать риск ложноотрицательного результата [93–99]. Больные с высокой претестовой вероятностью СН (например, с ранее перенесенным ИМ) могут быть сразу направлены на ЭхоКГ, минуя этап ЭКГ и теста на натрийуретические гормоны.
Рисунок 1. Диагностический алгоритм при подозрении на сердечную недостаточность
Дополнительные методы исследования
Катетеризация сердца и биопсия миокарда
При подозрении на констриктивный перикардитили рестриктивную кардиомиопатию катетеризация сердца, используемая совместно с неинвазивными методами исследования, позволяет установить правильный диагноз (таблица 10). При подозрении на миокардитили инфильтративные заболевания сердца (например,амилоидоз) показана биопсия миокарда [91].
Пробы с физической нагрузкой
Пробы с физической нагрузкой позволяют получить объективную оценку переносимости физической нагрузки, а также выяснить, с чем связана одышка и утомляемость при физической нагрузке [92], и оценить прогноз. Обычно для этого используют тест 6-мин ходьбы и ряд протоколов с велоэргометрией или тредмилом. Анализ газообмена помогает выяснить, с чем связана одышка – с патологией сердца или легких, а также имеет важное прогностическое значение (при рассмотрении вопроса о трансплантации обязательно определяют максимальное потребление кислорода). Нормальная переносимостьфизической нагрузки у больного без предшествующеголечения позволяет с уверенностью исключить диагнозсимптомной СН, однако необходимо помнить о том,что переносимость нагрузки слабо связана с гемодинами-ческими показателями, измеренными в состоянии покоя(прежде всего это касается ФВ).
Генетическое тестирование
Аспекты генетического тестирования при кардиомиопатиях подробно изложены в соответствующем руководстве [83]. Генетическое тестирование рекомендованобольным с дилатационной кардиомиопатией и атрио-вен-трикулярной блокадой или внезапной смертью близкихродственников, поскольку в таких случаях может потре-боваться профилактическая постановка кардиовертера-дефибриллятора.
Холтеровский мониторинг ЭКГ
Холтеровский мониторинг ЭКГ показан при наличии симптомов, предположительно связанных с нарушениями ритма сердца и проводимости (например, при сердцебиении или обмороках). У больных с ФП при суточном мониторинге ЭКГ следят за частотой желудочковых сокращений. С помощью этого исследования можноопределить тип имеющихся у больного нарушений ритмасердца, оценить их продолжительность и частоту сокращения желудочков, зафиксировать эпизоды безболевойишемии миокарда, брадикардии и нарушений проводи-мости, каждый из которых может быть самостоятельнойпричиной СН или же усугублять ее течение.
Алгоритм постановки диагноза СН
На рисунке 1 представлен диагностический алгоритм при СН. У больных с подозрением на СН и с острым началом симптомов рекомендовано как можно более быстрое проведение ЭхоКГ (при кардиогенном шоке или значительных гемодинамических нарушениях – в экстренномпорядке). При постепенном начале симптомов обследование начинают с ЭКГ и теста на натрийуретические гормоны, по результатам которых определяют, нуждается ли больной в проведении ЭхоКГ или нет. Эхокардиография показана при обнаружении патологических изменений на ЭКГ или если содержание натрийуретических гормонов превышает пороговые значения. У больных с посте-пенным началом симптомов следует ориентироватьсяна более низкие значения натрийуретических гормонов,нежели у больных с острым началом, что позволяет мини-мизировать риск ложноотрицательного результата [93–99]. Больные с высокой претестовой вероятностью СН (например, с ранее перенесенным ИМ) могут быть сразу направлены на ЭхоКГ, минуя этап ЭКГ и теста на натрийуретические гормоны.
Рисунок 1. Диагностический алгоритм при подозрении на сердечную недостаточность
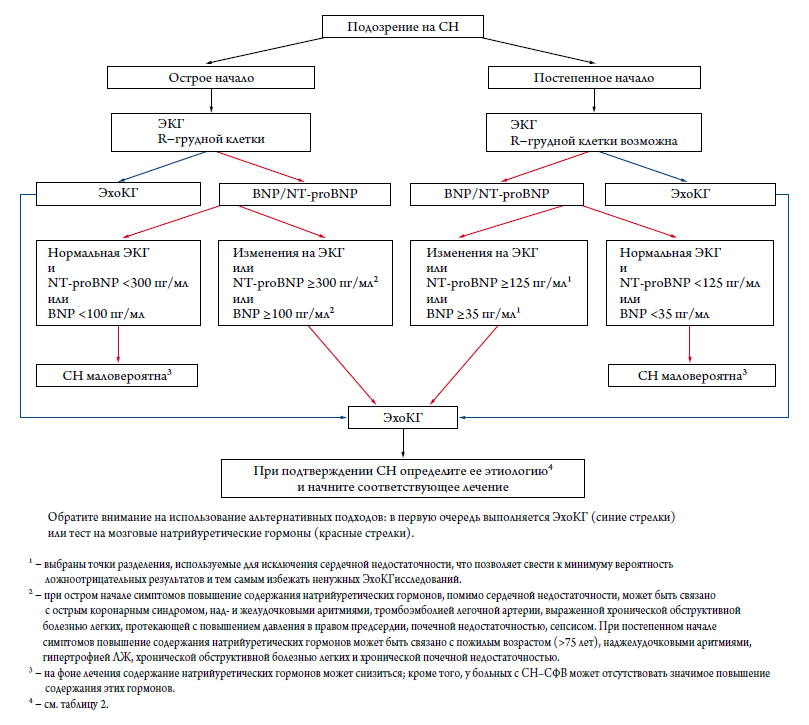 7. Оценка прогноза
При СН многие клинические и инструментальные показатели имеют прогностическое значение(таблица 11). Большинство из этих показателей просты, и их можно определить очень быстро (такие как пол, возраст, причина СН, ФК, определение ФВЛЖ, наличие сопутствующих заболеваний, определение уровня натрийуретических гормонов) [93–99].Оценка прогноза имеет первостепенное значениепри решении вопроса об имплантации внутрисердечных устройств и проведения оперативного лечения,а также при выборе тактики ведения больного с тер-минальной СН.
8. Лечение и профилактика ХСН
Можно сформулировать 6 очевидных задач при лечении ХСН:
A) предотвращение развития симптомной ХСН (дляI стадии ХСН);
B) устранение симптомов ХСН (для стадий IIA–III),
C) замедление прогрессирования болезни путем защи-ты сердца и других органов–мишеней (мозг, почки,сосуды) (для стадий I–III);
D) улучшение качества жизни (для стадий IIA–III);
E) уменьшение количества госпитализаций (и расходов)(для стадий I–III);
F) улучшение прогноза (для стадий I–III).
При постановке диагноза бессимптомной дисфункции ЛЖ (I стадия ХСН) главной целью является недопущение развития клинически выраженных симптомов декомпенсации.
Конечно, когда мы имеем дело с симптомной ХСН,главная задача на начальном этапе лечения – избавить больного от тягостных симптомов (одышки, удушья,отеков): дать возможность просто лежать, спать, отдыхать. Однако если ограничиться лишь этой начальнойцелью, например, применить эффективные диуретикив виде курса терапии, то у такого пациента уже черезнесколько дней (недель) вновь проявятся признакитяжелой декомпенсации, требующие интенсивнойтерапии.
Поэтому важнейшее значение приобретает замедление прогрессирования ХСН, связанное с защитой органов–мишеней, прежде всего сердца, от прогрессирующих патологических изменений (ремоделирования).А поскольку ХСН – это системный процесс, при кото-ром происходит ремоделирование не только сердца,но и почек, сосудов, мышц и т. д., мы говорим именноо системной защите органов–мишеней.
Сегодня Европейское общество кардиологов ориен-тирует каждого врача, лечащего ХСН, ответить на вопрос о назначении того или иного вида терапии: «Зачем я это делаю?» Предполагается, что ответ должен содержатьсяво второй и третьей из поставленных целей – либо добиваюсь устранения симптомов болезни, либо достигаюзамедления прогрессирования болезни. Если врач не спо-собен отнести назначаемое лечение ни к одной из этихкатегорий, возникает вопрос о целесообразности такоговида терапии ХСН.
Естественно, что применяемое лечение, кроме объективной эффективности, должно хорошо субъективно переноситься больными, улучшать или, по крайней мере,не ухудшать качество их жизни. Этот аспект определя-ет и приверженность пациентов с ХСН к проводимымпроцедурам, без которой невозможно рассчитыватьна успешную борьбу с синдромом декомпенсации.
Уменьшение числа госпитализаций имеет двоякийсмысл. Во-первых, это свидетельствует о стабильномтечении заболеваний и отсутствии экстренных деком-пенсаций, требующих повторных обращений к врачу.С другой стороны, госпитализации вносят основнойвклад в структуру затрат на лечение ХСН. По результатамроссийской программы ФАСОН (2001), подтвердилисьданные Института здоровья США о том, что лечениеХСН – это крайне дорогостоящее дело. В России (данныепо 30 городам, участвовавшим в программе ФАСОН)затраты на типичного больного ХСН в 2001 году состав-ляли 45 рублей / сут [100]. При примерной распро-страненности ХСН в России, равной 7 % (исследованиеЭПОХА–ХСН, госпитальный этап, 2006 г.), речь идето более чем 7 млн. человек и затратах в 118 млрд. руб / год.Причем в России почти 62,5 % этой суммы приходитсяна оплату именно госпитального лечения. В США сооб-щается о затратах до 38 млрд. долл. / год [101].
Наконец, последняя и, может быть, самая важная, хотяодновременно и самая трудная задача при лечении ХСН –это продление жизни пациентов, поскольку, как следуетиз предыдущего раздела рекомендаций, декомпенсациясердца является болезнью с крайне плохим прогнозом,и средняя продолжительность жизни больных не превышает 5 лет [102].
Перефразируя рекомендации Европейского обществакардиологов, можно сказать: любой применяемый видлечения ХСН должен помочь достижению, по крайней мере,двух любых из 6 основных целей борьбы с болезнью [1].
Существует шесть путей достижения поставленныхцелей при лечении декомпенсации:
A) диета,
B) режим физической активности,
C) психологическая реабилитация, организация врачебного контроля, школ для больных ХСН,
D) медикаментозная терапия,E) электрофизиологические методы терапии,
F) хирургические, механические методы лечения.
Как видим, медикаментозное лечение представляет собой хотя и очень важную составляющую, но находящуюся в этом списке на четвертой позиции. Игнорированиенемедикаментозных методов борьбы с ХСН затрудняетдостижение конечного успеха и снижает эффективностьлечебных (медикаментозных) воздействий.
Для оценки степени доказанности каждого из предлагаемых методов лечения Европейским обществом кардиологов предложена трехбалльная шкала. Применениепредлагаемого метода абсолютно доказано, по меньшеймере, в двух независимых крупных контролируемыхисследованиях – это степень доказанности А.
Если эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследова-нии или если результаты исследований противоречивы,то есть требуются дополнительные исследования – степень доказанности снижается и обозначается как В.
Когда рекомендации по лечению базируются на результатах отдельных, пусть и положительных, иссле-дований и приближаются к эмпирике, т. е. строго пола-гаться на них трудно, это самая низкая степень доказанности – С.
Кроме того, выделяются классы рекомендаций:
I –лечение показано всем;
IIA – лечение, скорее, показано;
IIB – лечение, скорее, противопоказано;
III – лечениестрого противопоказано.
Учитывая, что ХСН является одним из заключи-тельных этапов сердечно-сосудистого континуума(или непрерывного развития ССЗ), а также осложнением большинства болезней сердца, успешное лечениеэтих заболеваний можно рассматривать, как профилактику развития декомпенсации сердечной деятельности.По классификации ХСН (или, вернее, классификации континуума), предложенной АКК / ААС (2005), выделены четыре стадии, первая из которых (стадия А) относится к той ситуации, когда еще не имеется дисфункции сердца и, тем более, не наступило развитие самой клинически выраженной декомпенсации сердечной деятельности. Поэтому, признавая важность профилактикии лечения основных ФР ХСН, как предтечи развитиядекомпенсации сердечной деятельности,необходимоконстатировать, что эти аспекты остаются за рамкаминастоящих рекомендаций. Задача данного документа –представить алгоритмы диагностики и лечения собственноХСН.
Период В (бессимптомная дисфункция ЛЖ) в Американскойклассификации соответствует I стадии ХСНпо классификации ОССН 2002 года, период С (клинически выраженная ХСН) соответствует II стадии по клас-сификации ОССН 2002 года, и здесь в Российскойклассификации выделены периоды IIA и IIБ (начальнаяи клинически выраженная ХСН). Наконец, стадия Dв Американской классификации, относящаяся к финаль-ной стадии ХСН, соответствует III стадии болезнипо классификации ОССН 2002 года.
9. Профилактика ХСН
Учитывая все большую распространенность ХСН в мире, в том числе и в Российской Федерации, крайнюю тяжесть и злокачественность течения этого синдрома, а также принимая во внимание колоссальные затраты на его лечение, следует обратить особое внимание на проблему профилактики развития ХСН. В отличие от Американской коллегии кардиологов и Американской ассоциации сердца настоящий раздел не призван заменить соответствующие руководства по борьбе с ФР ССЗ. Наша цель – лишь заострить вни-мание на важности предотвращения поражения сердцаи развития симптомов ХСН в случае успешного лечениясоответствующих патологических состояний.
Современный взгляд на проблему предполагает нали-чие возросшей роли комбинации различных факторов,которые способны многократно увеличивать риск разви-тия ИМ и ХСН [103]. Сочетание АГ, ожирения, котороесущественно увеличивается, в том числе и в российскойпопуляции, инсулинорезистентности, дислипидемии,нередко определяемое, как метаболический синдром,является основой развития многих ССЗ, включая ХСН.Обратимся к наиболее очевидным фактам, подтвержда-ющим успешное предотвращение ХСН при нивелирова-нии основных ФР.
Артериальная гипертония
Как известно, повышенное АД является самой частойпричиной развития ХСН. Это было продемонстриро-вано как в США [104], так и в Европе [30]. В России,по результатам эпидемиологических и когортных иссле-дований последних лет, повышенное АД ассоциируетсяс развитием ХСН не менее чем в 80 % случаев, что отра-жает малую эффективность лечения АГ [12, 105].Во Фрамингемском исследовании наличие САД более140 мм рт. ст. ассоциировалось с 4-кратным повышени-ем риска развития ХСН [106]. Соответственно посту-латом можно считать тот факт, что успешное лечение АГ – это наиболее эффективная профилактика развитияХСН (класс IIA, уровень доказанности А). Это доказа-но как для систолической, так и диастолической АГ [107,108]. Нормализация АД позволяет на 50 % снижать рискразвития ХСН [109]. В исследовании VALUE снижениеАД ниже 140 / 90 мм рт. ст. сопровождалось достовернымуменьшением риска развития ХСН на 36 %, независимоот характера антигипертензивного лечения [110].
Среди препаратов для лечения АГ, позволяющихэффективнопредотвращать развитие ХСН, можно выде-лить иАПФ, АРА, β-АБ, диуретики и их комбинации,в то время как использование блокаторов кальциевых кана-лов и α-АБ выглядит менее предпочтительным [111–113].
Исследования последних лет выявили, что и вну-три классов имеются различия в действии разных пре-паратов. Так, в исследовании PROFESS, АРА телми-сартан не продемонстрировалспособности снижатьриск ХСН [114].
Наиболее ярким обоснованием успешной профилак-тики ХСН у пациентов с повышенным АД даже в самыхстарших возрастных группах (свыше 80 лет) можно счи-тать результаты исследования HYVET, в котором лечениетиазидоподобным диуретиком индапамидом и его ком-бинацией с иАПФ периндоприлом снижало риск разви-тия ХСН на 64 % [115].
Особенно важен контроль АД у больных, перенесшихострый ИМ, у пациентов с наличием гипертрофии ЛЖ,перенесенным инсультом и другими осложнениями, т. к.это наиболее обоснованный способ предотвращенияразвития ХСН [108, 116–119]. Более подробно с прин-ципами диагностики и лечения АГ можно ознакомитьсяв соответствующих рекомендациях РКО [120, 121].
Лечение ИБС
Лечение пациентов с ИБС, которая является вто-рым по значимости ФР ХСН, также крайне важно в плане профилактики ХСН [15, 105]. В настоящем разделеречь идет о пациентах с ИБС, не имеющих структурныхизменений сердца(с нормальной ФВ ЛЖ). Следует подчеркнуть, что отсутствуют данные о профилактике ХСНс помощью трех классов лекарств, наиболее часто при-меняемых для лечения стенокардии – нитратов, β-АБи блокаторов медленных кальциевых каналов (классрекомендаций III, уровень доказанности А). В то же вре-мя имеются неопровержимые доказательства предотвра-щения ХСН при применении различных иАПФ (классрекомендаций I, уровень доказанности А). Это касаетсяв первую очередь периндоприла, т. к. одной из конечныхточек исследования EUROPA являлось предотвращениеразвития ХСН [122]. Во вторую очередь – рамиприла,поскольку успешная профилактика ХСH в исследованииHOPE не предполагалась заранее [123].
Телмисартан в исследованиях ONTARGETи TRANSCEND, а также ирбесартан в протоколеI–PRESERVE не показали способности к снижениюриска ХСН у больных ИБС, в том числе и при ХСН–ССФ [124–126].
После перенесенного острого ИМ в качестве профи-лактики ремоделирования сердца и развития ХСН можноиспользовать различные нейрогормональные модулято-ры β-АБ [127, 128], иАПФ [129–131], АРА [132] и анта-гонисты альдостерона [133]. Причем сочетание β-АБс блокадой ренин-ангиотензиновой системы увеличиваетэффект терапии [132, 134].
Сведений о профилактике ХСН при применении аспи-рина у больных, перенесших ОИМ, и тем более у паци-ентов с хроническими формами ИБС нет. Напротив, егоиспользование может приводить к росту числа госпита-лизаций в связи с обострением ХСН (класс рекоменда-ций IIA, уровень доказанности В) [135, 136].
Еще одним важнейшим средством профилактикиХСН у больных с различными формами ИБС являютсястатины, что доказано в исследованиях с симвастатиноми правастатином [137–139]. Сегодня статины реко-мендуются в качестве профилактики ХСН у пациентовс коронарной болезнью сердца (класс рекомендацийIIA, уровень доказанности А). О возможности примене-ния статинов в лечении ХСН будет сказано ниже в соот-ветствующем разделе. Более подробно ознакомитьсяс принципами лечения коронарной болезни сердца мож-но в соответствующих рекомендациях РКО по лечениюИБС и по лечению дислипидемий [140–142].
Сахарный диабет
Нет сомнений, что наличие СД и даже просто инсу-линорезистентность предрасполагают к развитию ХСН,причем в максимальной степени увеличение риска отме-чается у женщин [143, 144]. Сочетание ХСН с СД усу-губляет неблагоприятный прогноз пациентов [145–147].Поэтому успешное лечение пациентов с СД и его ослож-нениями позволяет существенно уменьшать риск раз-вития ХСН (класс IIA, уровень доказанности А) [117,148–151]. Необходимо отметить важность контроляуровня гликемии с использованием препаратов, улучша-ющих чувствительность тканей к инсулину, в частности,метформина (класс IIA, уровень доказанности В) [152].
Мета-анализы последних лет показывают достовер-ное преимущество метформина в профилактике ХСНу больных СД и в лечении больных с сочетанием ХСНи СД перед другими сахароснижающими средствами[153, 154]. Не было отмечено и достоверного роста случаев лактоацидоза, что привело в США к отмене ограни-чений по использованию метформина у больных ХСН.Положительные результаты лечения больных с сочета-нием ХСН и СД метформином были получены в россий-ском проспективном исследовании РЭМБО [155].
Среди основных средств лечения ХСН преимуществоимеют иАПФ и АРА, которые уменьшают риск развитиядиабета, с одной стороны, и уменьшают шансы на разви-тие ХСН у больных СД [156]. В то же время применениеβ-АБ и диуретиков может ухудшать течение СД (классрекомендаций IIB, уровень доказанности В) [117, 157].Учитывая, что положительные эффекты β-АБ при СДсохраняются, отказываться от такой терапии у больных,перенесших ОИМ и имеющих симптомы ХСН, нецелесообразно [158]. В данном случае выбор должен бытьсделан в пользу бисопролола, не ухудшающего чувстви-тельности тканей к инсулину [159], или карведилола,снижающего инсулинорезистентность [160]. Карведилол имеет достоверное преимущество перед метопрололомпо контролю уровня сахара, а также по снижению рискапрогрессирования диабета и появления новых случаев диабета у больных с уже развившейся ХСН (класс рекомендаций IIA, cтепень доказанности B) [161, 162].
Клапанные пороки сердца
Одна из наиболее обсуждаемых в России проблем в связи с ХСН – определение типа расстройств гемодинамики и вариантов лечения больных с клапанными порока-ми сердца. Хотя никаких реальных обсуждений тут бытьне может. Стенозы клапанов, приводящие к перегрузкедавлением, перенапряжению стенок вышележащих отде-лов сердца и их гипертрофии, требуют обязательногохирургического лечения, независимо от степени изме-нения гемодинамики и выраженности симптомов ХСН[163]. Никаких терапевтических (медикаментозных) альтернатив для больных стенозом митрального и аорталь-ного клапана нет (класс IIA, уровень доказанности А).
В настоящее время основной причиной стеноза аортального клапана является его кальцинирование, обычно развивающееся с возрастом, в связи с чем со старением населения таких пациентов становится больше. У пациентов с критическим стенозом аортального клапана развивается компенсаторная гипертрофия левого желудочка,которая со временем из‑за ремоделирования ЛЖ переходит в сердечную недостаточность. Наблюдения за пациентами со стенозом аортального клапана показали, что риск смерти резко повышается при появлении у пациента при-знаков ХСН и / или синкопальных состояний. Для лече-ния стеноза аортального клапана широко используетсяоткрытая операция на сердце. Но такая операция сопря-жена с высоким риском, а у части пациентов ее проведе-ние невозможно в связи с крайне высоким операцион-ным риском. В связи с этим был разработан метод транс-катетерной имплантации аортального клапана (ТИАК).Для проверки безопасности и эффективности ТИАКбыло проведено МРКИ PARTNER [164]. Исследование состояло из двух частей: PARTNER B – сравнение ТИАК и медикаментозной терапии у пациентов, которым отказали в операции, и PARTNER А, в котором сравнивалась эффективность и безопасность ТИАК в сравнениис открытой операцией на сердце. По данным первого годанаблюдения, в PARTNER B риск общей смерти в группеТИАК был на 20 % ниже, чем в группе медикаментознойтерапии. По данным первого года наблюдения за пациен-тами в исследовании PARTNER A, риск смерти был одина-ков в двух группах пациентов, но риск инсульта и ТНМКбыл выше в группе ТИАК [165]. Между тем, по данным3-летнего наблюдения, было показано, что количествоинсультов и смертей в группах ТИАК и открытой опера-ции на сердце достоверно не отличалось [166].
Таким образом, показание к воздействию на аортальном клапане при его стенозе сводятся к следующему:A) Хирургическая замена аортального клапана должна быть рассмотрена у пациентов с критическим стенозом аортального клапана и возможностью проведения операции (класс рекомендаций IIA, уровень доказанности В). B) Проведение ТИАК должно быть рассмотрено у пациентов с критическим стенозом аортального клапана при невозможности проведения открытой операции из‑за высокого риска (класс рекомендацийIIA, уровень доказанности В). C) Проведение ТИАК может быть рассмотрено у паци-ентов с критическим стенозом аортального клапанапри высоком риске проведения открытой операциина сердце (класс рекомендаций IIB, уровень дока-занности В).
При недостаточности клапанов оперативное лечениетакже является средством выбора, даже при относитель-ной недостаточности митрального клапана (МК) у боль-ных с дилатационной кардиомиопатией [163, 167]. Хотяв случаях аортальной и митральной недостаточноститерапия артериолярными вазодилататорами (гидрала-зин, нифедипин) может уменьшать степень регургитациии структурных изменений камер сердца на предопераци-онном этапе лечения (уровень доказанности В) [168–171].
В последнее время для коррекции митральнойрегургитации у пациентов с выраженной симпто-матической митральной регургитацией (MR ≥3+),у которых риск кардиохирургических вмешательств на открытом сердце оценен как слишком высокий,применяется эндоваскулярная методика MitraClip®Clip Delivery System. В исследовании EVEREST II[172], сравнивавшем хирургический метод коррекциинедостаточности МК у больных с выраженной сим-птоматической митральной регургитацией и эндо-васкулярное вмешательство с помощью MitraClip®Clip Delivery System, было показано, что несмотряна менее выраженный уровень коррекции митральнойрегургитации, эффект в отношении процессов ремо-делирования ЛЖ был сравним с группой хирургиче-ского лечения; количество осложнений при исполь-зовании MitraClip® Clip Delivery System было ниже,чем при оперативных вмешательствах.
Следует отметить, что коррекция митральной регур-гитации при относительной недостаточности МКнередко успешно происходит на фоне ресинхронизиру-ющей терапии.
Что касается относительной недостаточности три-куспидального клапана (ТК), то ее хирургическоелечение возможно только в ходе оперативного вмеша-тельства по поводу органической недостаточности МК.При систолической ХСН пластику ТК не проводят,а медикаментозное лечение в таких случаях основанона комбинированной терапии диуретиками. Пациентс систолической ХСН III–IV ФК и ФВ ЛЖ менее 30 %,имеющий выраженную регургитацию на МК и ТК, явля-ется кандидатом на трансплантацию сердца.
Другие ФР
Специальных исследований по профилактике ХСНс помощью ограничения курения и приема алкоголяили снижения массы тела не проводилось, поэтому уро-вень доказанности этих мероприятий не превышаетстепени доказанности С. В то же время имеются сведе-ния о прямой зависимости ожирения и развития ХСН[173]. Это позволяет рекомендовать снижение ИМТниже 30 кг / м2 всем пациентам с риском декомпенса-ции сердечной деятельности. Причем в России эта про-блема приобретает особое значение, т. к. число больныхс ожирением возрастает параллельно увеличению ФКХСН [174].
Еще более опасной выглядит связь приема алкоголяс развитием ХСН, в особенности неишемической этио-логии [175, 176]. Поэтому больным с риском развитияХСН необходимо рекомендовать строгий отказ от при-ема алкоголя, что особенно важно в реальных российскихусловиях [174].
Также не вызывает никаких сомнений рекомендацияпо отказу от курения в качестве профилактики развитияХСН у пациентов с множественными ФР, хотя специальных исследований относительно связи отказа от куренияи развития ХСН не проводилось.
10. Немедикаментозное лечение ХСН
Для всех немедикаментозных методов лечения боль-ных ХСН уровень доказанности является низким и опи-рается на результаты отдельных, хотя и довольно много-численных контролируемых исследований (уровень С).10.1. Диета больных ХСН
На сегодняшний день рекомендации по диете боль-ных ХСН носят весьма конкретный характер.
Ограничение потребления соли
При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее сим-птомы болезни и застойные явления:
A) I ФК – не употреблять соленой пищи (до 3 г NaCl);
B) II ФК – плюс не досаливать пищу (до 1,5 г NaCl);
C) III ФК – плюс продукты с уменьшенным содержани-ем соли и приготовление без соли (<1,0 г NaCl).
D) Необходимо помнить, что диета со значимым ограничением натрия (1,8 г / день – 4,5 г соли), особеннона фоне агрессивной диуретической терапии, можетдаже достоверно увеличивать риск общей смертии повторных госпитализаций в связи с обострением ХСН [177]. Так что во всем нужна мера.10.1.2. Ограничение потребления жидкости.
Ограничение потребления жидкости актуально толь-ко в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в / в введения диуретиков.В обычных ситуациях объем жидкости не рекомендуетсяувеличивать более 2 л / сутки (минимум приема жидко-сти – 1,5 л / сут).10.1.3. Контроль массы тела.
Пища должна быть калорийной, легко усваиваться,с достаточным содержанием витаминов, белка.
Прирост веса >2 кг за 1–3 дня, скорее всего, свиде-тельствует о задержке жидкости в организме и риске раз-вития декомпенсации!
Сегодня контроль массы тела пациентов с ХСН или контроль трофологического статуса приобретаетважнейшее значение.
Трофологический статус – понятие, характеризующеесостояние здоровья и физического развития организма,связанное с питанием.
Необходимо различать следующие патологическиесостояния пациентов с ХСН: ожирение, избыточный вес,нормальный вес, кахексия. Наличие ожирения или избыточного веса ухудшает прогноз больного ХСН, и во всехслучаях ИМТ более 25 кг / м2 требует специальных мери ограничения калорийности питания.
Патологическая потеря массы тела (явные или субклинические признаки обнаруживаются у 50 % больныхХСН). Прогрессивное уменьшение массы тела, обуслов-ленное потерей как жировой ткани, так и мышечноймассы называется сердечной кахексией. Клиницист верифицирует патологическую потерю массы тела во всехслучаях: документированной непреднамеренной потеримассы тела на 5 и более кг или более чем на 7,5 % от исходной (вес без отеков, т. е. вес пациента в компенсированном состоянии) массы тела за 6 месяцев [175, 176];при исходном ИМТ менее 19 кг / м2.
Индекс массы тела рассчитывается, какИМТ = масса тела (кг) /(рост, м).
Развитие кахексии, как правило, свидетельствуето критической активации нейрогормональных систем(в первую очередь ренин-ангиотензин-альдостероновой),задействованных в прогрессировании декомпенсациии неадекватном росте активности цитокинов (преждевсего фактора некроза опухоли-α) [178–180]. В лечениитаких больных необходимым является сочетание медика-ментозной коррекции нейрогормональных расстройств(степень доказанности А), блокады цитокинов (степеньдоказанности С) и нутритивной поддержки (степеньдоказанности С), (приложение 2) [181–185].
Алкоголь
Алкоголь строго запрещен для больных с алкогольной кардиопатией.
У пациентов с ишемическим генезомХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальныхбольных ХСН ограничение приема алкоголя имеет видобычных рекомендаций, хотя по возможности следуетограничивать применение больших объемов (например,пива) [186, 187].
Режим физической активности
Сегодня очевидно, что покой не показан всем боль-ным ХСН вне зависимости от стадии заболевания.Физическая реабилитация рекомендуется всем пациен-там с I–IV ФК ХСН. Единственным требованием можносчитать стабильное течение ХСН, когда нет необходимо-сти в экстренном приеме мочегонных и внутривенномвведении вазодилататоров и положительных инотроп-ных средств [188].
Физическая реабилитации противопоказана при:
A) активном миокардите,
B) стенозе клапанных отверстий,
C) цианотических врожденных пороках,
D) нарушениях ритма высоких градаций,
E) приступах стенокардии у пациентов с низкой ФВ ЛЖ.
Основным для выбора режима нагрузок являетсяопределение исходной толерантности при помощи теста6-мин. ходьбы (рис. 2), (приложение 3). Проведение курсов физических тренировок сроком от 3 мес позволяетувеличить толерантность и максимальное потреблениекислорода до 33 %! При этом доказано восстановлениеструктуры и функции скелетной мускулатуры у боль-ных ХСН. При проведении нагрузок пациенты лучшереагируют на проводимую терапию. Доказано влияниефизической реабилитации на прогноз декомпенсирован-ных больных [128, 129]. Учитывая, что положительныйэффект физических тренировок исчезает через 3 неделипосле введения ограничения физических нагрузок – вве-дение физических нагрузок в длительную (пожизненную) программу ведения пациента с ХСН является необ-ходимым стандартом.
Рисунок 2. Алгоритм проведенияфизических нагрузок у больных ХСН
7. Оценка прогноза
При СН многие клинические и инструментальные показатели имеют прогностическое значение(таблица 11). Большинство из этих показателей просты, и их можно определить очень быстро (такие как пол, возраст, причина СН, ФК, определение ФВЛЖ, наличие сопутствующих заболеваний, определение уровня натрийуретических гормонов) [93–99].Оценка прогноза имеет первостепенное значениепри решении вопроса об имплантации внутрисердечных устройств и проведения оперативного лечения,а также при выборе тактики ведения больного с тер-минальной СН.
8. Лечение и профилактика ХСН
Можно сформулировать 6 очевидных задач при лечении ХСН:
A) предотвращение развития симптомной ХСН (дляI стадии ХСН);
B) устранение симптомов ХСН (для стадий IIA–III),
C) замедление прогрессирования болезни путем защи-ты сердца и других органов–мишеней (мозг, почки,сосуды) (для стадий I–III);
D) улучшение качества жизни (для стадий IIA–III);
E) уменьшение количества госпитализаций (и расходов)(для стадий I–III);
F) улучшение прогноза (для стадий I–III).
При постановке диагноза бессимптомной дисфункции ЛЖ (I стадия ХСН) главной целью является недопущение развития клинически выраженных симптомов декомпенсации.
Конечно, когда мы имеем дело с симптомной ХСН,главная задача на начальном этапе лечения – избавить больного от тягостных симптомов (одышки, удушья,отеков): дать возможность просто лежать, спать, отдыхать. Однако если ограничиться лишь этой начальнойцелью, например, применить эффективные диуретикив виде курса терапии, то у такого пациента уже черезнесколько дней (недель) вновь проявятся признакитяжелой декомпенсации, требующие интенсивнойтерапии.
Поэтому важнейшее значение приобретает замедление прогрессирования ХСН, связанное с защитой органов–мишеней, прежде всего сердца, от прогрессирующих патологических изменений (ремоделирования).А поскольку ХСН – это системный процесс, при кото-ром происходит ремоделирование не только сердца,но и почек, сосудов, мышц и т. д., мы говорим именноо системной защите органов–мишеней.
Сегодня Европейское общество кардиологов ориен-тирует каждого врача, лечащего ХСН, ответить на вопрос о назначении того или иного вида терапии: «Зачем я это делаю?» Предполагается, что ответ должен содержатьсяво второй и третьей из поставленных целей – либо добиваюсь устранения симптомов болезни, либо достигаюзамедления прогрессирования болезни. Если врач не спо-собен отнести назначаемое лечение ни к одной из этихкатегорий, возникает вопрос о целесообразности такоговида терапии ХСН.
Естественно, что применяемое лечение, кроме объективной эффективности, должно хорошо субъективно переноситься больными, улучшать или, по крайней мере,не ухудшать качество их жизни. Этот аспект определя-ет и приверженность пациентов с ХСН к проводимымпроцедурам, без которой невозможно рассчитыватьна успешную борьбу с синдромом декомпенсации.
Уменьшение числа госпитализаций имеет двоякийсмысл. Во-первых, это свидетельствует о стабильномтечении заболеваний и отсутствии экстренных деком-пенсаций, требующих повторных обращений к врачу.С другой стороны, госпитализации вносят основнойвклад в структуру затрат на лечение ХСН. По результатамроссийской программы ФАСОН (2001), подтвердилисьданные Института здоровья США о том, что лечениеХСН – это крайне дорогостоящее дело. В России (данныепо 30 городам, участвовавшим в программе ФАСОН)затраты на типичного больного ХСН в 2001 году состав-ляли 45 рублей / сут [100]. При примерной распро-страненности ХСН в России, равной 7 % (исследованиеЭПОХА–ХСН, госпитальный этап, 2006 г.), речь идето более чем 7 млн. человек и затратах в 118 млрд. руб / год.Причем в России почти 62,5 % этой суммы приходитсяна оплату именно госпитального лечения. В США сооб-щается о затратах до 38 млрд. долл. / год [101].
Наконец, последняя и, может быть, самая важная, хотяодновременно и самая трудная задача при лечении ХСН –это продление жизни пациентов, поскольку, как следуетиз предыдущего раздела рекомендаций, декомпенсациясердца является болезнью с крайне плохим прогнозом,и средняя продолжительность жизни больных не превышает 5 лет [102].
Перефразируя рекомендации Европейского обществакардиологов, можно сказать: любой применяемый видлечения ХСН должен помочь достижению, по крайней мере,двух любых из 6 основных целей борьбы с болезнью [1].
Существует шесть путей достижения поставленныхцелей при лечении декомпенсации:
A) диета,
B) режим физической активности,
C) психологическая реабилитация, организация врачебного контроля, школ для больных ХСН,
D) медикаментозная терапия,E) электрофизиологические методы терапии,
F) хирургические, механические методы лечения.
Как видим, медикаментозное лечение представляет собой хотя и очень важную составляющую, но находящуюся в этом списке на четвертой позиции. Игнорированиенемедикаментозных методов борьбы с ХСН затрудняетдостижение конечного успеха и снижает эффективностьлечебных (медикаментозных) воздействий.
Для оценки степени доказанности каждого из предлагаемых методов лечения Европейским обществом кардиологов предложена трехбалльная шкала. Применениепредлагаемого метода абсолютно доказано, по меньшеймере, в двух независимых крупных контролируемыхисследованиях – это степень доказанности А.
Если эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследова-нии или если результаты исследований противоречивы,то есть требуются дополнительные исследования – степень доказанности снижается и обозначается как В.
Когда рекомендации по лечению базируются на результатах отдельных, пусть и положительных, иссле-дований и приближаются к эмпирике, т. е. строго пола-гаться на них трудно, это самая низкая степень доказанности – С.
Кроме того, выделяются классы рекомендаций:
I –лечение показано всем;
IIA – лечение, скорее, показано;
IIB – лечение, скорее, противопоказано;
III – лечениестрого противопоказано.
Учитывая, что ХСН является одним из заключи-тельных этапов сердечно-сосудистого континуума(или непрерывного развития ССЗ), а также осложнением большинства болезней сердца, успешное лечениеэтих заболеваний можно рассматривать, как профилактику развития декомпенсации сердечной деятельности.По классификации ХСН (или, вернее, классификации континуума), предложенной АКК / ААС (2005), выделены четыре стадии, первая из которых (стадия А) относится к той ситуации, когда еще не имеется дисфункции сердца и, тем более, не наступило развитие самой клинически выраженной декомпенсации сердечной деятельности. Поэтому, признавая важность профилактикии лечения основных ФР ХСН, как предтечи развитиядекомпенсации сердечной деятельности,необходимоконстатировать, что эти аспекты остаются за рамкаминастоящих рекомендаций. Задача данного документа –представить алгоритмы диагностики и лечения собственноХСН.
Период В (бессимптомная дисфункция ЛЖ) в Американскойклассификации соответствует I стадии ХСНпо классификации ОССН 2002 года, период С (клинически выраженная ХСН) соответствует II стадии по клас-сификации ОССН 2002 года, и здесь в Российскойклассификации выделены периоды IIA и IIБ (начальнаяи клинически выраженная ХСН). Наконец, стадия Dв Американской классификации, относящаяся к финаль-ной стадии ХСН, соответствует III стадии болезнипо классификации ОССН 2002 года.
9. Профилактика ХСН
Учитывая все большую распространенность ХСН в мире, в том числе и в Российской Федерации, крайнюю тяжесть и злокачественность течения этого синдрома, а также принимая во внимание колоссальные затраты на его лечение, следует обратить особое внимание на проблему профилактики развития ХСН. В отличие от Американской коллегии кардиологов и Американской ассоциации сердца настоящий раздел не призван заменить соответствующие руководства по борьбе с ФР ССЗ. Наша цель – лишь заострить вни-мание на важности предотвращения поражения сердцаи развития симптомов ХСН в случае успешного лечениясоответствующих патологических состояний.
Современный взгляд на проблему предполагает нали-чие возросшей роли комбинации различных факторов,которые способны многократно увеличивать риск разви-тия ИМ и ХСН [103]. Сочетание АГ, ожирения, котороесущественно увеличивается, в том числе и в российскойпопуляции, инсулинорезистентности, дислипидемии,нередко определяемое, как метаболический синдром,является основой развития многих ССЗ, включая ХСН.Обратимся к наиболее очевидным фактам, подтвержда-ющим успешное предотвращение ХСН при нивелирова-нии основных ФР.
Артериальная гипертония
Как известно, повышенное АД является самой частойпричиной развития ХСН. Это было продемонстриро-вано как в США [104], так и в Европе [30]. В России,по результатам эпидемиологических и когортных иссле-дований последних лет, повышенное АД ассоциируетсяс развитием ХСН не менее чем в 80 % случаев, что отра-жает малую эффективность лечения АГ [12, 105].Во Фрамингемском исследовании наличие САД более140 мм рт. ст. ассоциировалось с 4-кратным повышени-ем риска развития ХСН [106]. Соответственно посту-латом можно считать тот факт, что успешное лечение АГ – это наиболее эффективная профилактика развитияХСН (класс IIA, уровень доказанности А). Это доказа-но как для систолической, так и диастолической АГ [107,108]. Нормализация АД позволяет на 50 % снижать рискразвития ХСН [109]. В исследовании VALUE снижениеАД ниже 140 / 90 мм рт. ст. сопровождалось достовернымуменьшением риска развития ХСН на 36 %, независимоот характера антигипертензивного лечения [110].
Среди препаратов для лечения АГ, позволяющихэффективнопредотвращать развитие ХСН, можно выде-лить иАПФ, АРА, β-АБ, диуретики и их комбинации,в то время как использование блокаторов кальциевых кана-лов и α-АБ выглядит менее предпочтительным [111–113].
Исследования последних лет выявили, что и вну-три классов имеются различия в действии разных пре-паратов. Так, в исследовании PROFESS, АРА телми-сартан не продемонстрировалспособности снижатьриск ХСН [114].
Наиболее ярким обоснованием успешной профилак-тики ХСН у пациентов с повышенным АД даже в самыхстарших возрастных группах (свыше 80 лет) можно счи-тать результаты исследования HYVET, в котором лечениетиазидоподобным диуретиком индапамидом и его ком-бинацией с иАПФ периндоприлом снижало риск разви-тия ХСН на 64 % [115].
Особенно важен контроль АД у больных, перенесшихострый ИМ, у пациентов с наличием гипертрофии ЛЖ,перенесенным инсультом и другими осложнениями, т. к.это наиболее обоснованный способ предотвращенияразвития ХСН [108, 116–119]. Более подробно с прин-ципами диагностики и лечения АГ можно ознакомитьсяв соответствующих рекомендациях РКО [120, 121].
Лечение ИБС
Лечение пациентов с ИБС, которая является вто-рым по значимости ФР ХСН, также крайне важно в плане профилактики ХСН [15, 105]. В настоящем разделеречь идет о пациентах с ИБС, не имеющих структурныхизменений сердца(с нормальной ФВ ЛЖ). Следует подчеркнуть, что отсутствуют данные о профилактике ХСНс помощью трех классов лекарств, наиболее часто при-меняемых для лечения стенокардии – нитратов, β-АБи блокаторов медленных кальциевых каналов (классрекомендаций III, уровень доказанности А). В то же вре-мя имеются неопровержимые доказательства предотвра-щения ХСН при применении различных иАПФ (классрекомендаций I, уровень доказанности А). Это касаетсяв первую очередь периндоприла, т. к. одной из конечныхточек исследования EUROPA являлось предотвращениеразвития ХСН [122]. Во вторую очередь – рамиприла,поскольку успешная профилактика ХСH в исследованииHOPE не предполагалась заранее [123].
Телмисартан в исследованиях ONTARGETи TRANSCEND, а также ирбесартан в протоколеI–PRESERVE не показали способности к снижениюриска ХСН у больных ИБС, в том числе и при ХСН–ССФ [124–126].
После перенесенного острого ИМ в качестве профи-лактики ремоделирования сердца и развития ХСН можноиспользовать различные нейрогормональные модулято-ры β-АБ [127, 128], иАПФ [129–131], АРА [132] и анта-гонисты альдостерона [133]. Причем сочетание β-АБс блокадой ренин-ангиотензиновой системы увеличиваетэффект терапии [132, 134].
Сведений о профилактике ХСН при применении аспи-рина у больных, перенесших ОИМ, и тем более у паци-ентов с хроническими формами ИБС нет. Напротив, егоиспользование может приводить к росту числа госпита-лизаций в связи с обострением ХСН (класс рекоменда-ций IIA, уровень доказанности В) [135, 136].
Еще одним важнейшим средством профилактикиХСН у больных с различными формами ИБС являютсястатины, что доказано в исследованиях с симвастатиноми правастатином [137–139]. Сегодня статины реко-мендуются в качестве профилактики ХСН у пациентовс коронарной болезнью сердца (класс рекомендацийIIA, уровень доказанности А). О возможности примене-ния статинов в лечении ХСН будет сказано ниже в соот-ветствующем разделе. Более подробно ознакомитьсяс принципами лечения коронарной болезни сердца мож-но в соответствующих рекомендациях РКО по лечениюИБС и по лечению дислипидемий [140–142].
Сахарный диабет
Нет сомнений, что наличие СД и даже просто инсу-линорезистентность предрасполагают к развитию ХСН,причем в максимальной степени увеличение риска отме-чается у женщин [143, 144]. Сочетание ХСН с СД усу-губляет неблагоприятный прогноз пациентов [145–147].Поэтому успешное лечение пациентов с СД и его ослож-нениями позволяет существенно уменьшать риск раз-вития ХСН (класс IIA, уровень доказанности А) [117,148–151]. Необходимо отметить важность контроляуровня гликемии с использованием препаратов, улучша-ющих чувствительность тканей к инсулину, в частности,метформина (класс IIA, уровень доказанности В) [152].
Мета-анализы последних лет показывают достовер-ное преимущество метформина в профилактике ХСНу больных СД и в лечении больных с сочетанием ХСНи СД перед другими сахароснижающими средствами[153, 154]. Не было отмечено и достоверного роста случаев лактоацидоза, что привело в США к отмене ограни-чений по использованию метформина у больных ХСН.Положительные результаты лечения больных с сочета-нием ХСН и СД метформином были получены в россий-ском проспективном исследовании РЭМБО [155].
Среди основных средств лечения ХСН преимуществоимеют иАПФ и АРА, которые уменьшают риск развитиядиабета, с одной стороны, и уменьшают шансы на разви-тие ХСН у больных СД [156]. В то же время применениеβ-АБ и диуретиков может ухудшать течение СД (классрекомендаций IIB, уровень доказанности В) [117, 157].Учитывая, что положительные эффекты β-АБ при СДсохраняются, отказываться от такой терапии у больных,перенесших ОИМ и имеющих симптомы ХСН, нецелесообразно [158]. В данном случае выбор должен бытьсделан в пользу бисопролола, не ухудшающего чувстви-тельности тканей к инсулину [159], или карведилола,снижающего инсулинорезистентность [160]. Карведилол имеет достоверное преимущество перед метопрололомпо контролю уровня сахара, а также по снижению рискапрогрессирования диабета и появления новых случаев диабета у больных с уже развившейся ХСН (класс рекомендаций IIA, cтепень доказанности B) [161, 162].
Клапанные пороки сердца
Одна из наиболее обсуждаемых в России проблем в связи с ХСН – определение типа расстройств гемодинамики и вариантов лечения больных с клапанными порока-ми сердца. Хотя никаких реальных обсуждений тут бытьне может. Стенозы клапанов, приводящие к перегрузкедавлением, перенапряжению стенок вышележащих отде-лов сердца и их гипертрофии, требуют обязательногохирургического лечения, независимо от степени изме-нения гемодинамики и выраженности симптомов ХСН[163]. Никаких терапевтических (медикаментозных) альтернатив для больных стенозом митрального и аорталь-ного клапана нет (класс IIA, уровень доказанности А).
В настоящее время основной причиной стеноза аортального клапана является его кальцинирование, обычно развивающееся с возрастом, в связи с чем со старением населения таких пациентов становится больше. У пациентов с критическим стенозом аортального клапана развивается компенсаторная гипертрофия левого желудочка,которая со временем из‑за ремоделирования ЛЖ переходит в сердечную недостаточность. Наблюдения за пациентами со стенозом аортального клапана показали, что риск смерти резко повышается при появлении у пациента при-знаков ХСН и / или синкопальных состояний. Для лече-ния стеноза аортального клапана широко используетсяоткрытая операция на сердце. Но такая операция сопря-жена с высоким риском, а у части пациентов ее проведе-ние невозможно в связи с крайне высоким операцион-ным риском. В связи с этим был разработан метод транс-катетерной имплантации аортального клапана (ТИАК).Для проверки безопасности и эффективности ТИАКбыло проведено МРКИ PARTNER [164]. Исследование состояло из двух частей: PARTNER B – сравнение ТИАК и медикаментозной терапии у пациентов, которым отказали в операции, и PARTNER А, в котором сравнивалась эффективность и безопасность ТИАК в сравнениис открытой операцией на сердце. По данным первого годанаблюдения, в PARTNER B риск общей смерти в группеТИАК был на 20 % ниже, чем в группе медикаментознойтерапии. По данным первого года наблюдения за пациен-тами в исследовании PARTNER A, риск смерти был одина-ков в двух группах пациентов, но риск инсульта и ТНМКбыл выше в группе ТИАК [165]. Между тем, по данным3-летнего наблюдения, было показано, что количествоинсультов и смертей в группах ТИАК и открытой опера-ции на сердце достоверно не отличалось [166].
Таким образом, показание к воздействию на аортальном клапане при его стенозе сводятся к следующему:A) Хирургическая замена аортального клапана должна быть рассмотрена у пациентов с критическим стенозом аортального клапана и возможностью проведения операции (класс рекомендаций IIA, уровень доказанности В). B) Проведение ТИАК должно быть рассмотрено у пациентов с критическим стенозом аортального клапана при невозможности проведения открытой операции из‑за высокого риска (класс рекомендацийIIA, уровень доказанности В). C) Проведение ТИАК может быть рассмотрено у паци-ентов с критическим стенозом аортального клапанапри высоком риске проведения открытой операциина сердце (класс рекомендаций IIB, уровень дока-занности В).
При недостаточности клапанов оперативное лечениетакже является средством выбора, даже при относитель-ной недостаточности митрального клапана (МК) у боль-ных с дилатационной кардиомиопатией [163, 167]. Хотяв случаях аортальной и митральной недостаточноститерапия артериолярными вазодилататорами (гидрала-зин, нифедипин) может уменьшать степень регургитациии структурных изменений камер сердца на предопераци-онном этапе лечения (уровень доказанности В) [168–171].
В последнее время для коррекции митральнойрегургитации у пациентов с выраженной симпто-матической митральной регургитацией (MR ≥3+),у которых риск кардиохирургических вмешательств на открытом сердце оценен как слишком высокий,применяется эндоваскулярная методика MitraClip®Clip Delivery System. В исследовании EVEREST II[172], сравнивавшем хирургический метод коррекциинедостаточности МК у больных с выраженной сим-птоматической митральной регургитацией и эндо-васкулярное вмешательство с помощью MitraClip®Clip Delivery System, было показано, что несмотряна менее выраженный уровень коррекции митральнойрегургитации, эффект в отношении процессов ремо-делирования ЛЖ был сравним с группой хирургиче-ского лечения; количество осложнений при исполь-зовании MitraClip® Clip Delivery System было ниже,чем при оперативных вмешательствах.
Следует отметить, что коррекция митральной регур-гитации при относительной недостаточности МКнередко успешно происходит на фоне ресинхронизиру-ющей терапии.
Что касается относительной недостаточности три-куспидального клапана (ТК), то ее хирургическоелечение возможно только в ходе оперативного вмеша-тельства по поводу органической недостаточности МК.При систолической ХСН пластику ТК не проводят,а медикаментозное лечение в таких случаях основанона комбинированной терапии диуретиками. Пациентс систолической ХСН III–IV ФК и ФВ ЛЖ менее 30 %,имеющий выраженную регургитацию на МК и ТК, явля-ется кандидатом на трансплантацию сердца.
Другие ФР
Специальных исследований по профилактике ХСНс помощью ограничения курения и приема алкоголяили снижения массы тела не проводилось, поэтому уро-вень доказанности этих мероприятий не превышаетстепени доказанности С. В то же время имеются сведе-ния о прямой зависимости ожирения и развития ХСН[173]. Это позволяет рекомендовать снижение ИМТниже 30 кг / м2 всем пациентам с риском декомпенса-ции сердечной деятельности. Причем в России эта про-блема приобретает особое значение, т. к. число больныхс ожирением возрастает параллельно увеличению ФКХСН [174].
Еще более опасной выглядит связь приема алкоголяс развитием ХСН, в особенности неишемической этио-логии [175, 176]. Поэтому больным с риском развитияХСН необходимо рекомендовать строгий отказ от при-ема алкоголя, что особенно важно в реальных российскихусловиях [174].
Также не вызывает никаких сомнений рекомендацияпо отказу от курения в качестве профилактики развитияХСН у пациентов с множественными ФР, хотя специальных исследований относительно связи отказа от куренияи развития ХСН не проводилось.
10. Немедикаментозное лечение ХСН
Для всех немедикаментозных методов лечения боль-ных ХСН уровень доказанности является низким и опи-рается на результаты отдельных, хотя и довольно много-численных контролируемых исследований (уровень С).10.1. Диета больных ХСН
На сегодняшний день рекомендации по диете боль-ных ХСН носят весьма конкретный характер.
Ограничение потребления соли
При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее сим-птомы болезни и застойные явления:
A) I ФК – не употреблять соленой пищи (до 3 г NaCl);
B) II ФК – плюс не досаливать пищу (до 1,5 г NaCl);
C) III ФК – плюс продукты с уменьшенным содержани-ем соли и приготовление без соли (<1,0 г NaCl).
D) Необходимо помнить, что диета со значимым ограничением натрия (1,8 г / день – 4,5 г соли), особеннона фоне агрессивной диуретической терапии, можетдаже достоверно увеличивать риск общей смертии повторных госпитализаций в связи с обострением ХСН [177]. Так что во всем нужна мера.10.1.2. Ограничение потребления жидкости.
Ограничение потребления жидкости актуально толь-ко в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в / в введения диуретиков.В обычных ситуациях объем жидкости не рекомендуетсяувеличивать более 2 л / сутки (минимум приема жидко-сти – 1,5 л / сут).10.1.3. Контроль массы тела.
Пища должна быть калорийной, легко усваиваться,с достаточным содержанием витаминов, белка.
Прирост веса >2 кг за 1–3 дня, скорее всего, свиде-тельствует о задержке жидкости в организме и риске раз-вития декомпенсации!
Сегодня контроль массы тела пациентов с ХСН или контроль трофологического статуса приобретаетважнейшее значение.
Трофологический статус – понятие, характеризующеесостояние здоровья и физического развития организма,связанное с питанием.
Необходимо различать следующие патологическиесостояния пациентов с ХСН: ожирение, избыточный вес,нормальный вес, кахексия. Наличие ожирения или избыточного веса ухудшает прогноз больного ХСН, и во всехслучаях ИМТ более 25 кг / м2 требует специальных мери ограничения калорийности питания.
Патологическая потеря массы тела (явные или субклинические признаки обнаруживаются у 50 % больныхХСН). Прогрессивное уменьшение массы тела, обуслов-ленное потерей как жировой ткани, так и мышечноймассы называется сердечной кахексией. Клиницист верифицирует патологическую потерю массы тела во всехслучаях: документированной непреднамеренной потеримассы тела на 5 и более кг или более чем на 7,5 % от исходной (вес без отеков, т. е. вес пациента в компенсированном состоянии) массы тела за 6 месяцев [175, 176];при исходном ИМТ менее 19 кг / м2.
Индекс массы тела рассчитывается, какИМТ = масса тела (кг) /(рост, м).
Развитие кахексии, как правило, свидетельствуето критической активации нейрогормональных систем(в первую очередь ренин-ангиотензин-альдостероновой),задействованных в прогрессировании декомпенсациии неадекватном росте активности цитокинов (преждевсего фактора некроза опухоли-α) [178–180]. В лечениитаких больных необходимым является сочетание медика-ментозной коррекции нейрогормональных расстройств(степень доказанности А), блокады цитокинов (степеньдоказанности С) и нутритивной поддержки (степеньдоказанности С), (приложение 2) [181–185].
Алкоголь
Алкоголь строго запрещен для больных с алкогольной кардиопатией.
У пациентов с ишемическим генезомХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальныхбольных ХСН ограничение приема алкоголя имеет видобычных рекомендаций, хотя по возможности следуетограничивать применение больших объемов (например,пива) [186, 187].
Режим физической активности
Сегодня очевидно, что покой не показан всем боль-ным ХСН вне зависимости от стадии заболевания.Физическая реабилитация рекомендуется всем пациен-там с I–IV ФК ХСН. Единственным требованием можносчитать стабильное течение ХСН, когда нет необходимо-сти в экстренном приеме мочегонных и внутривенномвведении вазодилататоров и положительных инотроп-ных средств [188].
Физическая реабилитации противопоказана при:
A) активном миокардите,
B) стенозе клапанных отверстий,
C) цианотических врожденных пороках,
D) нарушениях ритма высоких градаций,
E) приступах стенокардии у пациентов с низкой ФВ ЛЖ.
Основным для выбора режима нагрузок являетсяопределение исходной толерантности при помощи теста6-мин. ходьбы (рис. 2), (приложение 3). Проведение курсов физических тренировок сроком от 3 мес позволяетувеличить толерантность и максимальное потреблениекислорода до 33 %! При этом доказано восстановлениеструктуры и функции скелетной мускулатуры у боль-ных ХСН. При проведении нагрузок пациенты лучшереагируют на проводимую терапию. Доказано влияниефизической реабилитации на прогноз декомпенсирован-ных больных [128, 129]. Учитывая, что положительныйэффект физических тренировок исчезает через 3 неделипосле введения ограничения физических нагрузок – вве-дение физических нагрузок в длительную (пожизненную) программу ведения пациента с ХСН является необ-ходимым стандартом.
Рисунок 2. Алгоритм проведенияфизических нагрузок у больных ХСН
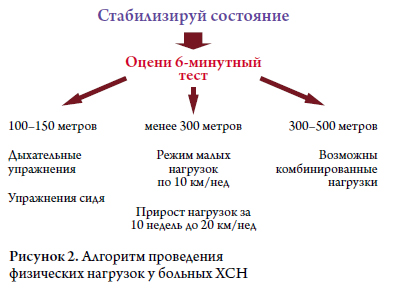 Для пациентов, прошедших менее 150 м, т. е. находя-щихся в III–IV ФК, а также имеющих выраженный дефи-цит массы тела, кахексию, общепринятые физические нагрузки не показаны (по крайней мере, на начальном этапе). В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тре-нировки мышц вдоха и выдоха. Для тренировок используются дыхательные тренажеры с созданием дополни-тельного сопротивления на вдохе и выдохе (тренажерыThreshold IMT и Threshold PEP, дыхательный тренажерФролова и др.) [189, 190], (приложение 4).
Доказано, что через 3–4 недели регулярные физи-ческие нагрузки в форме дыхательных упражненийс затрудненным выдохом приводят к системному влияниюна организм. Увеличивается толерантность к физическимнагрузкам, улучшается качество жизни, замедляется про-грессия кахексии, улучшается течение ХСН, достовернозамедляется прогрессирование заболевания [191, 192].
При стабилизации состояния пациента необходимоповторить тест 6-мин. ходьбы. Дальнейшая тактика зави-сит от полученных результатов (рис. 3). Если пройденноерасстояние менее 200 м, то пациентам рекомендуетсяпродолжить дыхательные упражнения. Если пройденное расстояние более 200 м, то целесообразно рекомен-довать физические нагрузки в виде ходьбы. Ухудшениесостояния (усиление одышки, тахикардия, прогрессияусталости, снижение общей массы тела) является основа-нием для перехода на предыдущую ступень либо возвра-та к дыхательным упражнениям. Полный отказ от физи-ческих нагрузок нежелателен и должен рассматриваться, как крайняя мера. Для пациентов, прошедших за 6 мин.хотя бы 350 м, показаны динамические нагрузки (преждевсего в виде ходьбы) [193].
Метод усиленной наружной контрпульсации (УНКП)может быть рекомендован, как дополнительный метод лече-ния пациентов с ХСН II–III ФК в период полной компен-сации на оптимальной медикаментозной терапии (классрекомендаций IIB). По данным исследования PEECH [194]и небольших пилотных работ [195, 196], применение этогометода у больных ХСН увеличивает толерантность к физи-ческим нагрузкам и улучшает качество жизни.
Рисунок 3. Объем физических нагрузокдля больных ХСН I–IV ФК
Для пациентов, прошедших менее 150 м, т. е. находя-щихся в III–IV ФК, а также имеющих выраженный дефи-цит массы тела, кахексию, общепринятые физические нагрузки не показаны (по крайней мере, на начальном этапе). В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тре-нировки мышц вдоха и выдоха. Для тренировок используются дыхательные тренажеры с созданием дополни-тельного сопротивления на вдохе и выдохе (тренажерыThreshold IMT и Threshold PEP, дыхательный тренажерФролова и др.) [189, 190], (приложение 4).
Доказано, что через 3–4 недели регулярные физи-ческие нагрузки в форме дыхательных упражненийс затрудненным выдохом приводят к системному влияниюна организм. Увеличивается толерантность к физическимнагрузкам, улучшается качество жизни, замедляется про-грессия кахексии, улучшается течение ХСН, достовернозамедляется прогрессирование заболевания [191, 192].
При стабилизации состояния пациента необходимоповторить тест 6-мин. ходьбы. Дальнейшая тактика зави-сит от полученных результатов (рис. 3). Если пройденноерасстояние менее 200 м, то пациентам рекомендуетсяпродолжить дыхательные упражнения. Если пройденное расстояние более 200 м, то целесообразно рекомен-довать физические нагрузки в виде ходьбы. Ухудшениесостояния (усиление одышки, тахикардия, прогрессияусталости, снижение общей массы тела) является основа-нием для перехода на предыдущую ступень либо возвра-та к дыхательным упражнениям. Полный отказ от физи-ческих нагрузок нежелателен и должен рассматриваться, как крайняя мера. Для пациентов, прошедших за 6 мин.хотя бы 350 м, показаны динамические нагрузки (преждевсего в виде ходьбы) [193].
Метод усиленной наружной контрпульсации (УНКП)может быть рекомендован, как дополнительный метод лече-ния пациентов с ХСН II–III ФК в период полной компен-сации на оптимальной медикаментозной терапии (классрекомендаций IIB). По данным исследования PEECH [194]и небольших пилотных работ [195, 196], применение этогометода у больных ХСН увеличивает толерантность к физи-ческим нагрузкам и улучшает качество жизни.
Рисунок 3. Объем физических нагрузокдля больных ХСН I–IV ФК
 Режим. Общие рекомендации
Вакцинация
Нет доказательств влияния вакцинации на исходы ХСН. Тем не менее использование вакцины против грип-па, пневмонии и гепатита В является целесообразным.
Путешествия
Не рекомендуется пребывание в условиях высокогорья, высоких температур, влажности. Желательнопроводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение отдается непро-должительным (до 2–2,5 часов) авиационным перелетам.Длительные перелеты чреваты обезвоживанием, усилени-ем отеков нижних конечностей и / или развитием тромбо-за глубоких вен голени. При любой форме путешествийпротивопоказано длительное вынужденное фиксирован-ное положение. Специально рекомендуется вставание,ходьба или легкая гимнастика каждые 30 минут.
Коррекция доз мочегонных при пребывании в нео-бычном для больного, прежде всего жарком и влажном(хуже всего – вместе) климате, носит обязательный, хотяи строго индивидуальный характер.
Курение
Строго и абсолютно однозначно не рекомендуетсявсем пациентам с ХСН.
Сексуальная активность
Вопросы сексуальной активности находятся в компетенции врача–сексопатолога. Врач–кардиолог пред-принимает усилия для предотвращения развития деком-пенсации ХСН. Как правило, улучшение течения деком-пенсации восстанавливает сниженные сексуальные §Рекомендациивозможности. Ограничения актуальны для больных ХСНIV ФК и носят общий характер:
A) избегать чрезмерного эмоционального напряжения;
B) в ряде случаев принимать нитраты сублингвальноперед половым актом;
C) применение виагры не противопоказано (за исключением сочетаний с длительно действующими нитратами);
D) для пациентов с ХСН I–III ФК риск развития деком-пенсации ХСН при регулярной половой активности носит весьма умеренный характер.
Распорядок дня
В таблице 14 представлен распорядок дня пациента с СН.
Режим. Общие рекомендации
Вакцинация
Нет доказательств влияния вакцинации на исходы ХСН. Тем не менее использование вакцины против грип-па, пневмонии и гепатита В является целесообразным.
Путешествия
Не рекомендуется пребывание в условиях высокогорья, высоких температур, влажности. Желательнопроводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение отдается непро-должительным (до 2–2,5 часов) авиационным перелетам.Длительные перелеты чреваты обезвоживанием, усилени-ем отеков нижних конечностей и / или развитием тромбо-за глубоких вен голени. При любой форме путешествийпротивопоказано длительное вынужденное фиксирован-ное положение. Специально рекомендуется вставание,ходьба или легкая гимнастика каждые 30 минут.
Коррекция доз мочегонных при пребывании в нео-бычном для больного, прежде всего жарком и влажном(хуже всего – вместе) климате, носит обязательный, хотяи строго индивидуальный характер.
Курение
Строго и абсолютно однозначно не рекомендуетсявсем пациентам с ХСН.
Сексуальная активность
Вопросы сексуальной активности находятся в компетенции врача–сексопатолога. Врач–кардиолог пред-принимает усилия для предотвращения развития деком-пенсации ХСН. Как правило, улучшение течения деком-пенсации восстанавливает сниженные сексуальные §Рекомендациивозможности. Ограничения актуальны для больных ХСНIV ФК и носят общий характер:
A) избегать чрезмерного эмоционального напряжения;
B) в ряде случаев принимать нитраты сублингвальноперед половым актом;
C) применение виагры не противопоказано (за исключением сочетаний с длительно действующими нитратами);
D) для пациентов с ХСН I–III ФК риск развития деком-пенсации ХСН при регулярной половой активности носит весьма умеренный характер.
Распорядок дня
В таблице 14 представлен распорядок дня пациента с СН.
 Психологическая реабилитация и создание школамбулаторного наблюдения для больных ХСН
Сегодня пациент с ХСН, выписывающийся из клини-ки или покидающий врача амбулаторной практики после устранения декомпенсации, должен, кроме рекомендаций по оптимальному медикаментозному лечению, иметь возможность контролировать свое состояние и быть под наблюдением специально обученного персонала. Этот своеобразный принцип диспансерного наблюдения имеет различные названия: мультидисциплинарного подхода в ведении больных ХСН или школы для больных с декомпенсацией, или клиник для больных ХСН, или домашнего сестринского контроля за больными с декомпенсацией. Но дело не в названиях, а в том, что задача врачей – обу-чить больного и его ближайших родственников приемамконтроля за течением ХСН, методам самопомощи и датьвозможность регулярного контакта со специалистамидля своевременной коррекции состояния и недопущения экстренных декомпенсаций.
Эпидемиологические исследования последних лет,включавшие больных ХСН в Западной Европе и США,показали, что несмотря на повсеместное внедрениево врачебную практику самых эффективных средств терапии ХСН смертность больных в течение года в этой популяции остается по-прежнему высокой [197–199].
Среди возможных причин такого несоответствиядоказанной высокой эффективности современныхпрепаратов и сохраняющегося в популяции высокогоуровня смертности больных ХСН особая роль отводится низкой приверженности пациентов предписан-ному терапевтическому режиму и отсутствию строгоговыполнения врачебных рекомендаций, касающихся диеты и образа жизни.
Целью обучения является помощь пациентам и их родственникам в получении информации о заболевании, при-обретении навыков самоконтроля, касающихся диетиче-ских рекомендаций, физической активности, строгогособлюдения режима медикаментозной терапии, наблю-дения за симптомами СН и обращения за медицинскойпомощью в случае их усиления [200].
С пациентами проводятся структурированные заня-тия по следующим темам:
A) Общая информация о ХСН,
B) Симптомы ХСН и принципы самоконтроля,
C) Диета при ХСН,
D) Медикаментозная терапия ХСН,
E) Физические нагрузки при ХСН.
Пациенты должны получать обучающие материалыпо самоконтролю (брошюра «Жизнь с СН», «Дневниксамоконтроля пациента с СН»). Обучающие материалыдолжны содержать сведения о диете, контроле веса, физи-ческой активности, правильном приеме препаратов и т. д.Целесообразно с пациентами группы осуществлять регу-лярные телефонные контакты: первый месяц после выпи-ски из стационара – еженедельно; еще 2 месяца – 1 разв 2 недели; далее – 1 раз в месяц. Во время телефонныхконтактов врач должен проводить контроль самочув-ствия пациента, отвечать на вопросы, при необходимо-сти приглашать на дополнительный визит или решатьвопрос о госпитализации пациента.
Первым крупным российским многоцентровымисследованием эффективности использования обученияи мониторинга пациентов с ХСН стало исследованиеШАНС (Школа и Амбулаторное Наблюдение больныхСН), организованное ОССН. В группе вмешательствастатистически достоверно увеличилась дистанция в ходепроведения 6-мин. теста, также отмечено улучшениекачества жизни и снижение ЧСС в покое. Главным ито-гом программы ШАНС явилось достоверное уменьше-ние количества повторных госпитализаций из-за декомпенсации и снижение смертности больных с 13 до 8,3 %(р=0,044). Это позволяет рекомендовать внедрениеметодики мультидисциплинарного воздействия на боль-ных ХСН в широкую медицинскую практику. Такой под-ход позволяет существенно снизить число повторныхгоспитализаций, затраты на лечение, а по данным некоторых авторов, даже снизить смертность больных ХСН.Однако последнее утверждение имеет низкую степеньдоказанности (степень доказанности В).
Медико-социальная работа
Медико-социальная работа в комплексном ведениибольного ХСН должна включать мероприятия социаль-но-медицинского, психолого-педагогического и социаль-но-правового характера.
Эти мероприятия выполняет квалифицированныйсоциальный работник, участвующий в оказании медико-социальной помощи больному. Такому специалисту целе-сообразно:
A) провести комплексную оценку социального статусабольного, а также оценку качества его жизни совмест-но с другими специалистами;
B) формировать у больного здоровый образ жизнис учетом состояния его здоровья;
C) обеспечить выбор режима физических нагрузоки организовать физическую активность пациента;
D) вести психологическое консультирование и психо-коррекционную работу;
E) организовать совместно с другими специалистамиработу школы для больных ХСН;
F) участвовать в медико-социальной экспертизе боль-ного, разработке, реализации и оценке результатовиндивидуальной программы реабилитации;
G) провести социально-правовое консультированиепо вопросам прав больного на получение медико-социальной помощи, включая выплату пенсий, посо-бий и льгот на получение различных видов помощи;
H) организовать социальное обслуживание больно-го на дому;
I) организовать трудовое обучение и обеспечить тру-довую занятость, адекватную состоянию здоровьябольного;
J) вести реадаптацию пациента в семье и обществе;
K) способствовать больному в реализации его прав,представлять интересы больного в органах государственной власти и судебных органах.
Социальному работнику необходимо обеспечить взаимодействие больного с членами семьи и ближайшим окружением. Рекомендуется провести социальную экспертизу семьи с целью выявления проблем социально-медицинскогохарактера, разрешить возникшие проблем-ные ситуации и содействовать устранению ФР с мобили-зацией личностных резервов пациента.
Необходимо оказать психологическую поддержку и провести психологическое консультирование членов семьи и ближайшего окружения больного в разрешении микросоциальных проблем, содействовать сохранению семейных связей и переориентации семейных ролей в связи с болезнью члена семьи.
Социальный работник должен обеспечить членам семьи и ближайшему окружению доступность необходимой медико-социальной информации, информации о льготах и видах социальной защиты. Рекомендуетсяоказать помощь семье в организации адекватной состо-янию здоровья больного реабилитационной социально-бытовой среды, способствующей его автономному суще-ствованию. В том числе при необходимости для улучше-ния материального положения семьи создать условиядля надомного труда члену семьи, осуществляющему уходза больным.
Необходимо обеспечить санитарно-гигиеническое просвещение с целью формирования установок на здоровый образ жизни с учетом наличия больного в семье,содействовать в организации семейного досуга и отдыха путем предоставления возможности временного устройства больного в стационарное учреждение социального обслуживания.
Социальный работник должен помогать членам семьи больного в выработке адекватных стереотипов поведения в трудных жизненных ситуациях.
11. Медикаментозное лечение ХСН.
Общие принципы
Принципы медикаментозной терапии любого заболевания и ХСН, в частности, в первом десятилетии XXI века строятся на основе медицины доказательств. Иными словами, только препараты, эффективность (в том числе и по влиянию на прогноз больных) и безопасность которых доказана в длительных многоцентровых двойных слепых плацебоконтролируемых исследованиях,могут быть рекомендованы к широкому клиническому применению. Точно так же все рекомендации по дозамлекарственных средств и кратности их приема даются на основании контролируемых исследований, доказавших эффективность того или иного метода терапии. Лишь при отсутствии подобных исследований в расчет принимаются результаты фармакокинетических исследований.На основании имеющихся в настоящее время сведений иформируются современные принципы медикаментозной терапии ХСН.
Учитывая, что для пациентов с ХСН и низкой (<40 %,иногда учитывается величина <35%) ФВ ЛЖ имеетсямножество доказательств эффективности медикаментозных и инструментальных методов лечения (данныеМРКИ), именно этой группе больных будет посвященпервый раздел медикаментозного лечения.
Для пациентов с ХСН и нормальной (сохранной)систолической функцией сердца (ФВ ЛЖ >40 %) име-ется минимальное количество доказательных данных,что делает объективизацию подробных рекомендацийпо лечению затруднительным. Простой «перенос»рекомендаций по лечению больных преимуществен-но с систолической дисфункцией ЛЖ на группу боль-ных ХСН с сохранной ФВ (преимущественно диасто-лической ХСН) выглядит сомнительным. Но и отказот лечения таких пациентов из-за того, что не всегдаимеются убедительные данные МРКИ, не может бытьобоснованным. Поэтому во втором разделе будетотдельный анализ современных возможностей лечениябольных ХСН с сохранной систолической функциейсердца (СН–ССФ).
Основные препараты для медикаментозноголечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сни-женной ФВ ЛЖ можно разделить на две основные кате-гории соответственно степени доказанности (рис. 4).
Рисунок 4. Препараты для лечения ХСН c ФВ ЛЖ <40 (35 %)
Психологическая реабилитация и создание школамбулаторного наблюдения для больных ХСН
Сегодня пациент с ХСН, выписывающийся из клини-ки или покидающий врача амбулаторной практики после устранения декомпенсации, должен, кроме рекомендаций по оптимальному медикаментозному лечению, иметь возможность контролировать свое состояние и быть под наблюдением специально обученного персонала. Этот своеобразный принцип диспансерного наблюдения имеет различные названия: мультидисциплинарного подхода в ведении больных ХСН или школы для больных с декомпенсацией, или клиник для больных ХСН, или домашнего сестринского контроля за больными с декомпенсацией. Но дело не в названиях, а в том, что задача врачей – обу-чить больного и его ближайших родственников приемамконтроля за течением ХСН, методам самопомощи и датьвозможность регулярного контакта со специалистамидля своевременной коррекции состояния и недопущения экстренных декомпенсаций.
Эпидемиологические исследования последних лет,включавшие больных ХСН в Западной Европе и США,показали, что несмотря на повсеместное внедрениево врачебную практику самых эффективных средств терапии ХСН смертность больных в течение года в этой популяции остается по-прежнему высокой [197–199].
Среди возможных причин такого несоответствиядоказанной высокой эффективности современныхпрепаратов и сохраняющегося в популяции высокогоуровня смертности больных ХСН особая роль отводится низкой приверженности пациентов предписан-ному терапевтическому режиму и отсутствию строгоговыполнения врачебных рекомендаций, касающихся диеты и образа жизни.
Целью обучения является помощь пациентам и их родственникам в получении информации о заболевании, при-обретении навыков самоконтроля, касающихся диетиче-ских рекомендаций, физической активности, строгогособлюдения режима медикаментозной терапии, наблю-дения за симптомами СН и обращения за медицинскойпомощью в случае их усиления [200].
С пациентами проводятся структурированные заня-тия по следующим темам:
A) Общая информация о ХСН,
B) Симптомы ХСН и принципы самоконтроля,
C) Диета при ХСН,
D) Медикаментозная терапия ХСН,
E) Физические нагрузки при ХСН.
Пациенты должны получать обучающие материалыпо самоконтролю (брошюра «Жизнь с СН», «Дневниксамоконтроля пациента с СН»). Обучающие материалыдолжны содержать сведения о диете, контроле веса, физи-ческой активности, правильном приеме препаратов и т. д.Целесообразно с пациентами группы осуществлять регу-лярные телефонные контакты: первый месяц после выпи-ски из стационара – еженедельно; еще 2 месяца – 1 разв 2 недели; далее – 1 раз в месяц. Во время телефонныхконтактов врач должен проводить контроль самочув-ствия пациента, отвечать на вопросы, при необходимо-сти приглашать на дополнительный визит или решатьвопрос о госпитализации пациента.
Первым крупным российским многоцентровымисследованием эффективности использования обученияи мониторинга пациентов с ХСН стало исследованиеШАНС (Школа и Амбулаторное Наблюдение больныхСН), организованное ОССН. В группе вмешательствастатистически достоверно увеличилась дистанция в ходепроведения 6-мин. теста, также отмечено улучшениекачества жизни и снижение ЧСС в покое. Главным ито-гом программы ШАНС явилось достоверное уменьше-ние количества повторных госпитализаций из-за декомпенсации и снижение смертности больных с 13 до 8,3 %(р=0,044). Это позволяет рекомендовать внедрениеметодики мультидисциплинарного воздействия на боль-ных ХСН в широкую медицинскую практику. Такой под-ход позволяет существенно снизить число повторныхгоспитализаций, затраты на лечение, а по данным некоторых авторов, даже снизить смертность больных ХСН.Однако последнее утверждение имеет низкую степеньдоказанности (степень доказанности В).
Медико-социальная работа
Медико-социальная работа в комплексном ведениибольного ХСН должна включать мероприятия социаль-но-медицинского, психолого-педагогического и социаль-но-правового характера.
Эти мероприятия выполняет квалифицированныйсоциальный работник, участвующий в оказании медико-социальной помощи больному. Такому специалисту целе-сообразно:
A) провести комплексную оценку социального статусабольного, а также оценку качества его жизни совмест-но с другими специалистами;
B) формировать у больного здоровый образ жизнис учетом состояния его здоровья;
C) обеспечить выбор режима физических нагрузоки организовать физическую активность пациента;
D) вести психологическое консультирование и психо-коррекционную работу;
E) организовать совместно с другими специалистамиработу школы для больных ХСН;
F) участвовать в медико-социальной экспертизе боль-ного, разработке, реализации и оценке результатовиндивидуальной программы реабилитации;
G) провести социально-правовое консультированиепо вопросам прав больного на получение медико-социальной помощи, включая выплату пенсий, посо-бий и льгот на получение различных видов помощи;
H) организовать социальное обслуживание больно-го на дому;
I) организовать трудовое обучение и обеспечить тру-довую занятость, адекватную состоянию здоровьябольного;
J) вести реадаптацию пациента в семье и обществе;
K) способствовать больному в реализации его прав,представлять интересы больного в органах государственной власти и судебных органах.
Социальному работнику необходимо обеспечить взаимодействие больного с членами семьи и ближайшим окружением. Рекомендуется провести социальную экспертизу семьи с целью выявления проблем социально-медицинскогохарактера, разрешить возникшие проблем-ные ситуации и содействовать устранению ФР с мобили-зацией личностных резервов пациента.
Необходимо оказать психологическую поддержку и провести психологическое консультирование членов семьи и ближайшего окружения больного в разрешении микросоциальных проблем, содействовать сохранению семейных связей и переориентации семейных ролей в связи с болезнью члена семьи.
Социальный работник должен обеспечить членам семьи и ближайшему окружению доступность необходимой медико-социальной информации, информации о льготах и видах социальной защиты. Рекомендуетсяоказать помощь семье в организации адекватной состо-янию здоровья больного реабилитационной социально-бытовой среды, способствующей его автономному суще-ствованию. В том числе при необходимости для улучше-ния материального положения семьи создать условиядля надомного труда члену семьи, осуществляющему уходза больным.
Необходимо обеспечить санитарно-гигиеническое просвещение с целью формирования установок на здоровый образ жизни с учетом наличия больного в семье,содействовать в организации семейного досуга и отдыха путем предоставления возможности временного устройства больного в стационарное учреждение социального обслуживания.
Социальный работник должен помогать членам семьи больного в выработке адекватных стереотипов поведения в трудных жизненных ситуациях.
11. Медикаментозное лечение ХСН.
Общие принципы
Принципы медикаментозной терапии любого заболевания и ХСН, в частности, в первом десятилетии XXI века строятся на основе медицины доказательств. Иными словами, только препараты, эффективность (в том числе и по влиянию на прогноз больных) и безопасность которых доказана в длительных многоцентровых двойных слепых плацебоконтролируемых исследованиях,могут быть рекомендованы к широкому клиническому применению. Точно так же все рекомендации по дозамлекарственных средств и кратности их приема даются на основании контролируемых исследований, доказавших эффективность того или иного метода терапии. Лишь при отсутствии подобных исследований в расчет принимаются результаты фармакокинетических исследований.На основании имеющихся в настоящее время сведений иформируются современные принципы медикаментозной терапии ХСН.
Учитывая, что для пациентов с ХСН и низкой (<40 %,иногда учитывается величина <35%) ФВ ЛЖ имеетсямножество доказательств эффективности медикаментозных и инструментальных методов лечения (данныеМРКИ), именно этой группе больных будет посвященпервый раздел медикаментозного лечения.
Для пациентов с ХСН и нормальной (сохранной)систолической функцией сердца (ФВ ЛЖ >40 %) име-ется минимальное количество доказательных данных,что делает объективизацию подробных рекомендацийпо лечению затруднительным. Простой «перенос»рекомендаций по лечению больных преимуществен-но с систолической дисфункцией ЛЖ на группу боль-ных ХСН с сохранной ФВ (преимущественно диасто-лической ХСН) выглядит сомнительным. Но и отказот лечения таких пациентов из-за того, что не всегдаимеются убедительные данные МРКИ, не может бытьобоснованным. Поэтому во втором разделе будетотдельный анализ современных возможностей лечениябольных ХСН с сохранной систолической функциейсердца (СН–ССФ).
Основные препараты для медикаментозноголечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сни-женной ФВ ЛЖ можно разделить на две основные кате-гории соответственно степени доказанности (рис. 4).
Рисунок 4. Препараты для лечения ХСН c ФВ ЛЖ <40 (35 %)
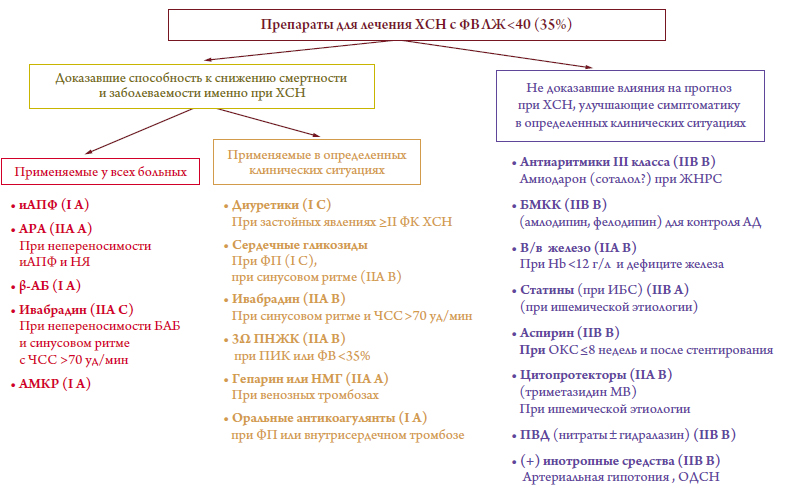 Основные препараты для медикаментозного лечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказанности (рис. 4).
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН с выделением двух подгрупп:
A) препараты, применяемые у всех больных,
B) препараты, применяемые в особых клиническихситуациях;
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые у всех больных (таблица 15)
Ингибиторы АПФ
Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН. Впервые в 1995 году в классическом метаанализе, включавшем более 7 100 больных,была продемонстрирована способность и АПФ к снижению риска смерти больных ХСН на 23 % [201]. Эффект отмечается уже в первые 90 дней лечения (снижение риска смерти 44 %). Эти результаты неоднократно подтверждены во множестве исследований и анализов, показавших, что положительные эффекты и АПФ не зависят от возраста больных, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН(I–IV ФК). По этим позициям класс рекомендаций I, уровень доказанности А.
Таблица 15. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способностьк снижению риска смерти и госпитализаций именно при ХСН и применяющиеся у всех больных)
Основные препараты для медикаментозного лечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказанности (рис. 4).
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН с выделением двух подгрупп:
A) препараты, применяемые у всех больных,
B) препараты, применяемые в особых клиническихситуациях;
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые у всех больных (таблица 15)
Ингибиторы АПФ
Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН. Впервые в 1995 году в классическом метаанализе, включавшем более 7 100 больных,была продемонстрирована способность и АПФ к снижению риска смерти больных ХСН на 23 % [201]. Эффект отмечается уже в первые 90 дней лечения (снижение риска смерти 44 %). Эти результаты неоднократно подтверждены во множестве исследований и анализов, показавших, что положительные эффекты и АПФ не зависят от возраста больных, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН(I–IV ФК). По этим позициям класс рекомендаций I, уровень доказанности А.
Таблица 15. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способностьк снижению риска смерти и госпитализаций именно при ХСН и применяющиеся у всех больных)
 Следует отметить, что эффективность использования иАПФ может несколько снижаться при ишемической этиологии ХСН [18, 201, 202] и у женщин [201,202], а также ослабляться одновременным применением НПВП (в меньшей степени – малыми дозами аспирина)[203]. Эти данные получены в основном по результатамретроспективных мета-анализов и имеют уровень дока-занности С, но игнорировать их полностью не следует.
В частности, обращает на себя внимание мéньшая эффективность иАПФ у женщин, однако до проведенияспециальных проспективных исследований этот вопросостается пока открытым [204, 205]. При наличии кли-нических признаков ХСН ингибиторы АПФ достовер-но снижают риск смерти и госпитализаций у женщин,но этот эффект менее выражен, чем у мужчин (мета-анализ исследований SAVE, SOLVD, CONSENSUS, SMILE,TRACE [204]). Кроме того, учитывая, что иАПФ крайне редко используются в качестве монотерапии (лишьу больных ХСН I ФК), клиническая значимость этих дан-ных ограничена.
Эффекты иАПФ могут ослабляться одновременнымприменением НПВП за счет конкурентной блокады син-теза простациклина, стимулируемого кининовой системой [206, 207]. Поэтому нужно избегать назначения НПВП больным ХСН, находящимся на приеме иАПФ,особенно при перегрузке жидкостью (в период деком-пенсации). В меньшей степени этими свойствами облада-ют малые дозы аспирина, хотя и в этом случае описанынегативные взаимодействия аспирина с иАПФ [208]. Этотакже может быть связано с блокадой синтеза вазодила-тирующих простаноидов в результате блокады фермен-та циклооксигеназы [209]. Негативное взаимодействиеаспирина и иАПФ при ХСН отмечено и в ретроспектив-ных анализах крупных плацебо-контролируемых исследований [210, 211], и в специально спланированныхпроспективных протоколах [207, 208]. Причем очевидно,что антиагреганты с другим механизмом действия (тикло-пидин, клопидогрел) не ослабляют эффектов иАПФв той же степени, что и аспирин [212, 213]. Этот слож-ный вопрос неоднократно подробно обсуждался на конференциях ОССН [209, 214, 215]. Однако по даннымдвух мета-анализов, не выявлено существенного досто-верного снижения эффектов иАПФ при одновременномприменении малых (до 325 мг / сут) доз аспирина [216,217]. Поэтому совместное применение иАПФ и малыхдоз аспирина при ХСН возможно. Однако доказательствэффективности аспирина при длительном лечении ХСНне имеется [218], и назначение аспирина может быть чре-вато увеличением количества декомпенсаций в результатеобострения ХСН [135, 136].
Неправильно лечить иАПФ (впрочем, как и другими лекарственными средствами) больных ХСН на почвепороков сердца с преобладающими стенозами клапанныхотверстий. Такие пороки должны корригироваться хирур-гическим путем. Однако для достижения компенсациидо хирургической коррекции подобные больные долж-ны лечиться в соответствии с общими принципам, хотядозы всех препаратов, влияющих на пред- и посленагрузку(включая иАПФ), должны титроваться крайне медленнопри тщательном контроле за состоянием и уровнем АД.
Основные позиции по применению иАПФ в лече-нии ХСН:A) иАПФ показаны всем больным ХСН со снижен-ной ФВ ЛЖ;
B) иАПФ улучшают клиническую симптоматику, качество жизни (КЖ), замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных ХСН, а также предотвращают насту-пление клинически выраженной декомпенсации, т. е.позволяют решить все шесть задач при достижениицели, что означает успешное лечение ХСН;
C) эти препараты эффективны от самых начальных стадий ХСН, включая бессимптомную дисфункцию ЛЖ, до самых поздних стадий декомпенсации;
D) чем раньше начинается лечение, тем больше шансов на успех и продление жизни пациентов;
E) неназначение иАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти декомпенсированных больных.
В России зарегистрировано 11 иАПФ, имеющихв качестве показания ХСН: беназеприл, зофеноприл,каптоприл, квинаприл, лизиноприл, периндоприл, спи-раприл, рамиприл, фозиноприл, цилазаприл, эналаприл.Хотя общепринята точка зрения, что имеет место такназываемый класс–эффект при использовании иАПФв лечении ХСН с точки зрения медицины, основаннойна доказательствах, степень доказанности их эффектив-ности при лечении ХСН весьма различна. Ниже приведе-ны данные, характеризующие иАПФ с максимальной сте-пенью доказанности по лечению и профилактике именноХСН с указанием контролируемых исследований, под-твердивших эту эффективность (таблица 16) [118, 122,130, 132, 139, 219–236].
Таблица 16. Ингибиторы АПФ, доказавшие способность предотвращать развитие ХСН и / или успешно лечить больных ХСН*
Следует отметить, что эффективность использования иАПФ может несколько снижаться при ишемической этиологии ХСН [18, 201, 202] и у женщин [201,202], а также ослабляться одновременным применением НПВП (в меньшей степени – малыми дозами аспирина)[203]. Эти данные получены в основном по результатамретроспективных мета-анализов и имеют уровень дока-занности С, но игнорировать их полностью не следует.
В частности, обращает на себя внимание мéньшая эффективность иАПФ у женщин, однако до проведенияспециальных проспективных исследований этот вопросостается пока открытым [204, 205]. При наличии кли-нических признаков ХСН ингибиторы АПФ достовер-но снижают риск смерти и госпитализаций у женщин,но этот эффект менее выражен, чем у мужчин (мета-анализ исследований SAVE, SOLVD, CONSENSUS, SMILE,TRACE [204]). Кроме того, учитывая, что иАПФ крайне редко используются в качестве монотерапии (лишьу больных ХСН I ФК), клиническая значимость этих дан-ных ограничена.
Эффекты иАПФ могут ослабляться одновременнымприменением НПВП за счет конкурентной блокады син-теза простациклина, стимулируемого кининовой системой [206, 207]. Поэтому нужно избегать назначения НПВП больным ХСН, находящимся на приеме иАПФ,особенно при перегрузке жидкостью (в период деком-пенсации). В меньшей степени этими свойствами облада-ют малые дозы аспирина, хотя и в этом случае описанынегативные взаимодействия аспирина с иАПФ [208]. Этотакже может быть связано с блокадой синтеза вазодила-тирующих простаноидов в результате блокады фермен-та циклооксигеназы [209]. Негативное взаимодействиеаспирина и иАПФ при ХСН отмечено и в ретроспектив-ных анализах крупных плацебо-контролируемых исследований [210, 211], и в специально спланированныхпроспективных протоколах [207, 208]. Причем очевидно,что антиагреганты с другим механизмом действия (тикло-пидин, клопидогрел) не ослабляют эффектов иАПФв той же степени, что и аспирин [212, 213]. Этот слож-ный вопрос неоднократно подробно обсуждался на конференциях ОССН [209, 214, 215]. Однако по даннымдвух мета-анализов, не выявлено существенного досто-верного снижения эффектов иАПФ при одновременномприменении малых (до 325 мг / сут) доз аспирина [216,217]. Поэтому совместное применение иАПФ и малыхдоз аспирина при ХСН возможно. Однако доказательствэффективности аспирина при длительном лечении ХСНне имеется [218], и назначение аспирина может быть чре-вато увеличением количества декомпенсаций в результатеобострения ХСН [135, 136].
Неправильно лечить иАПФ (впрочем, как и другими лекарственными средствами) больных ХСН на почвепороков сердца с преобладающими стенозами клапанныхотверстий. Такие пороки должны корригироваться хирур-гическим путем. Однако для достижения компенсациидо хирургической коррекции подобные больные долж-ны лечиться в соответствии с общими принципам, хотядозы всех препаратов, влияющих на пред- и посленагрузку(включая иАПФ), должны титроваться крайне медленнопри тщательном контроле за состоянием и уровнем АД.
Основные позиции по применению иАПФ в лече-нии ХСН:A) иАПФ показаны всем больным ХСН со снижен-ной ФВ ЛЖ;
B) иАПФ улучшают клиническую симптоматику, качество жизни (КЖ), замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных ХСН, а также предотвращают насту-пление клинически выраженной декомпенсации, т. е.позволяют решить все шесть задач при достижениицели, что означает успешное лечение ХСН;
C) эти препараты эффективны от самых начальных стадий ХСН, включая бессимптомную дисфункцию ЛЖ, до самых поздних стадий декомпенсации;
D) чем раньше начинается лечение, тем больше шансов на успех и продление жизни пациентов;
E) неназначение иАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти декомпенсированных больных.
В России зарегистрировано 11 иАПФ, имеющихв качестве показания ХСН: беназеприл, зофеноприл,каптоприл, квинаприл, лизиноприл, периндоприл, спи-раприл, рамиприл, фозиноприл, цилазаприл, эналаприл.Хотя общепринята точка зрения, что имеет место такназываемый класс–эффект при использовании иАПФв лечении ХСН с точки зрения медицины, основаннойна доказательствах, степень доказанности их эффектив-ности при лечении ХСН весьма различна. Ниже приведе-ны данные, характеризующие иАПФ с максимальной сте-пенью доказанности по лечению и профилактике именноХСН с указанием контролируемых исследований, под-твердивших эту эффективность (таблица 16) [118, 122,130, 132, 139, 219–236].
Таблица 16. Ингибиторы АПФ, доказавшие способность предотвращать развитие ХСН и / или успешно лечить больных ХСН*
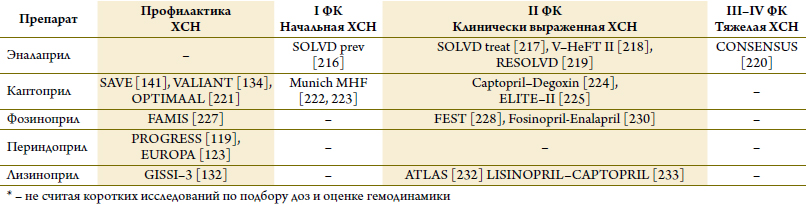 Как видим, максимальную степень доказанностив лечении ХСН всех стадий имеют только «классиче-ские» иАПФ, абсолютно не потерявшие своего значе-ния – эналаприл и каптоприл (класс рекомендации I, сте-пень доказанности А). Именно этим препаратам правиль-но отдавать предпочтение в терапии ХСН.
Также доказана лечебная эффективность и возмож-ность профилактики ХСН при применении фозино-прила, периндоприла и лизиноприла (класс рекоменда-ций I, степень доказанности В). Причем способностьпериндоприла достоверно уменьшать количество госпи-тализаций была доказана в группе пожилых больныхс сохранной систолической функцией ЛЖ [234]. Этоединственное проспективное исследование, показавшееперспективность иАПФ (периндоприла) в лечении боль-ных с СН–СФ.
В двух контролируемых протоколах продемонстри-рована способность фозиноприла увеличивать толерант-ность к физическим нагрузкам, замедлять прогрессиро-вание ХСН и уменьшать число госпитализаций как в при-сутствии, так и в отсутствие параллельного применениясердечных гликозидов [233, 234]. В многоцентровомрандомизированном сравнительном исследовании с эна-лаприлом продемонстрировано даже преимуществофозиноприла в эффективности и безопасности в предот-вращении осложнений [235].
Один из первых иАПФ лизиноприл также изучалсяв качестве средства профилактики и лечения ХСН, хотяполученные данные менее убедительны, чем результатыисследований с каптоприлом и эналаприлом. Так, в иссле-довании GISSI–III у больных, перенесших ОИМ, про-должительность лечения лизиноприлом составила лишь6 недель [130], а исследование ATLAS у больных ХСНне было плацебо-контролируемым и ставило задачейсравнение эффективности разных доз иАПФ [235]. Хотяпо влиянию на толерантность к нагрузкам и величину ФВлизиноприл не уступал каптоприлу [236].
Учитывая, что лизиноприл не метаболизирует в пече-ни и выводится на 100 % почками в неизмененном виде,его применение должно быть ограничено при тяжелойХСН, когда большинство больных имеют ухудшениефункции почек [237, 238]. В этих случаях выгоднееиспользовать фозиноприл и спираприл, имеющих двапути выведения из организма. Кроме этого, исследо-вание ALLHAT продемонстрировало, что лизиноприлдостоверно уступает диуретикам в предотвращенииразвития ХСН [113].
Таким образом, только 5 иАПФ (каптоприл, энала-прил, лизиноприл, периндоприл и фозиноприл) могутбыть в первую очередь рекомендованы для профилакти-ки и лечения ХСН, хотя это не исключает возможностиприменения и других представителей этого класса.
Для профилактики ХСН у больных, перенесших ОИМ,могут применяться каптоприл, рамиприл, трандолаприл,фозиноприл и зофеноприл (класс рекомендаций I, сте-пень доказанности А). Эти результаты были полученыв классических исследоваваниях SAVE [139], AIRE [239],TRACE [240], SMILE [241] и FAMIS [230], продемонстрировавшихспособность разных иАПФ снижать рискобострения ХСН и смертности у пациентов с ОКС.
Периндоприл в исследовании PRE–AMI продемон-стрировал способность достоверно блокировать про-цессы постинфарктного ремоделирования ЛЖ, что явля-ется основным механизмом в предотвращении развитияХСН [242].
Для профилактики ХСН у пациентов с хроническимизаболеваниями сердечно-сосудистой системы (в част-ности, ИБС) возможно использование трех иАПФ –периндоприла, рамиприла и трандолаприла (класс реко-мендаций I, степень доказанности А). Причем степеньдоказанности профилактики ХСН при ИБС максимальнадля периндоприла [122]. Рамиприл продемонстрировалспособность предотвращать развитие декомпенсацииу смешанной группы больных с ИБС, АГ, СД, перифе-рическим атеросклерозом и перенесенным инсультом,что не позволяет дифференцировать его эффект у каж-дой из этих подгрупп пациентов [123]. В исследованииPEACE применение трандолаприла у больных ИБСс сохранной систолической функцией сердца не сни-жало достоверно риск наступления смерти, развитиянового ОИМ или реваскуляризации, но сопровождалосьдостоверным снижением развития новой ХСН [243].Периндоприл в исследовании EUROPA достоверноуменьшал риск развития ХСН на 39 %, превосходя по это-му показателю трандолаприл (–25 %) и рамиприл (–23 %)[123, 243, 244]. Кроме того, у пациентов с инсультамив анамнезе (половина с АГ) применение периндоприлаи его комбинации с индапамидом сопровождалось досто-верным снижением риска развития ХСН на 26 % [119].
Кроме иАПФ с полностью доказанной эффективно-стью в крупных международных многоцетровых иссле-дованиях, о которых говорилось выше, необходимо упо-мянуть хинаприл и спираприл, которые продемонстри-ровали свою эффективность в лечении ХСН на меньшемчисле пациентов [245–249]. Клиническая эффективностьхинаприла и спираприла в лечении ХСН подтвержде-на и в многоцентровых российских программах РКОи ОССН (САДКО–ХСН и КВАНК).
Следует напомнить, что максимальная информацияпо лечению ХСН иАПФ была получена в серии класси-ческих исследований с эналаприлом (SOLVD treatment,SOLVD prevention, V–HeFT II и CONSENSUS) у паци-ентов со всеми стадиями декомпенсации.
Побочные эффекты (требующие остановки лечения)осложняют применение иАПФ достаточно редко.
Повышение уровня креатинина возможно у 5–15 %больных ХСН и связано с основным механизмом действияиАПФ – блокадой влияния АII на уровень почечной филь-трации. При этом может развиваться функциональнаяпочечная недостаточность, что особенно опасно у больныхс исходной гипонатриемией [250, 251]. Однако при мед-ленном титровании доз иАПФ стойкая высокая азотемия(повышение уровня креатинина более чем в 2 раза вышенормы) и усугубление почечной недостаточности встреча-ется у 1–2 % декомпенсированных больных.
Сегодня гораздо более точным методом оценки функционального состояния почек является скорость клубоч-ковой фильтрации (СКФ), рассчитываемая по формуламMDRD или Cockroft–Gault. При СКФ менее 60 мл / миндозу иАПФ следует уменьшить наполовину, а при СКФ<30 мл / мин на ¾. В этих случаях показано примене-ние иАПФ, имеющих два пути выведения из организма(почки / печень): фозиноприла (50 / 50) и спираприла(50 / 50), рамиприла (70 / 30) и трандолаприла (30 / 70)(класс рекомендаций IIA, степень доказанности В). Дозыэтих препаратов нужно корригировать лишь при сниже-нии СКФ менее 30 мл / мин. Следует избегать назначениялизиноприла, который выводится почками в неизменен-ном виде, что чревато опасным повышением концентра-ции препарата (класс рекомендаций IIA, степень дока-занности А).
Сухой кашель. Типичный побочный эффект всехиАПФ (2–3 % леченных иАПФ больных), связанныйс блокадой деградации брадикинина и минимально выра-женный у фозиноприла (степень доказанности В) [252].При развитии упорного кашля иАПФ должны быть заме-нены на АРА, которым не свойственно развитие этогоосложнения.
Симптомная гипотония объясняется основнымимеханизмами действия иАПФ, однако может затруднять начало терапии иАПФ. В небольшом количестве случаев(3–4 %) это может требовать прекращения терапии иАПФ.Имеются сведения, что в наименьшей степени гипотонияпервой дозы развивается на фоне применения перин-доприла (класс IIA, степень доказанности В) [253, 254].Следует помнить, что при развитии гипотонии на фонелечения иАПФ дозу нужно уменьшить, а при останов-ке лечения сделать все возможное для как можно болеебыстрого возврата к терапии иАПФ.
Непереносимость иАПФ. Абсолютными противопо-казаниями к назначению иАПФ являются непереноси-мость (ангионевротическийотек), двусторонний стенозпочечных артерий, беременность. Непереносимостьв связи с развитием ангионевротического отека при при-менении рекомендованных доз иАПФ в терапевтическихдозах не превышает 0,4 %.
В случаях непереносимости иАПФ могут быть заме-нены АРА, хотя при развитии почечной недостаточностии повышении уровня креатинина, скорее всего, и назна-чение АРА не принесет желаемого результата.
Практические вопросы применения иАПФ при ХСН(дозы, тактика лечения, меры предосторожности).
Назначение всех иАПФ начинается с маленьких доз,при их постепенном (не чаще одного раза в 2–3 дня,а при системной гипотонии еще реже – не чаще одногораза в неделю) титровании до оптимальных (среднихтерапевтических) доз.
При отсутствии клинических противопоказаний(и снижения АД) необходимо пытаться увеличивать дозудо рекомендованной (терапевтической) (таблица 17). Однако следует помнить, что при попытке достижениямаксимальных доз иАПФ дополнительное снижениечисла обострений ХСН (и отсутствие дополнительного снижения риска смерти) сопровождается ростом чис-ла осложнений (гипотония, гиперкалиемия, увеличениеуровня креатинина). В исследовании NETWORK увели-чение дозы иАПФ эналаприла в терапевтических пределах(5–20 мг / сут) не сопровождалось улучшением прогнозаили снижением числа госпитализаций в связи с обостре-нием ХСН [255]. Исследование ATLAS с лизиноприломсравнивало эффективность малых (2,5–5 мг / сут) и оченьвысоких (32,5–35 мг / сут) доз препарата. Это исследо-вание показало, что 7–10‑кратное повышение доз лизи-ноприла не улучшает выживаемость больных ХСН, хотяуменьшает число повторных госпитализаций, одновре-менно достоверно увеличивая риск побочных реакций(гиперкалиемии, гипотонии) [235].
Таблица 17. Дозировки иАПФ для лечения ХСН (в мг × кратность приема)
Как видим, максимальную степень доказанностив лечении ХСН всех стадий имеют только «классиче-ские» иАПФ, абсолютно не потерявшие своего значе-ния – эналаприл и каптоприл (класс рекомендации I, сте-пень доказанности А). Именно этим препаратам правиль-но отдавать предпочтение в терапии ХСН.
Также доказана лечебная эффективность и возмож-ность профилактики ХСН при применении фозино-прила, периндоприла и лизиноприла (класс рекоменда-ций I, степень доказанности В). Причем способностьпериндоприла достоверно уменьшать количество госпи-тализаций была доказана в группе пожилых больныхс сохранной систолической функцией ЛЖ [234]. Этоединственное проспективное исследование, показавшееперспективность иАПФ (периндоприла) в лечении боль-ных с СН–СФ.
В двух контролируемых протоколах продемонстри-рована способность фозиноприла увеличивать толерант-ность к физическим нагрузкам, замедлять прогрессиро-вание ХСН и уменьшать число госпитализаций как в при-сутствии, так и в отсутствие параллельного применениясердечных гликозидов [233, 234]. В многоцентровомрандомизированном сравнительном исследовании с эна-лаприлом продемонстрировано даже преимуществофозиноприла в эффективности и безопасности в предот-вращении осложнений [235].
Один из первых иАПФ лизиноприл также изучалсяв качестве средства профилактики и лечения ХСН, хотяполученные данные менее убедительны, чем результатыисследований с каптоприлом и эналаприлом. Так, в иссле-довании GISSI–III у больных, перенесших ОИМ, про-должительность лечения лизиноприлом составила лишь6 недель [130], а исследование ATLAS у больных ХСНне было плацебо-контролируемым и ставило задачейсравнение эффективности разных доз иАПФ [235]. Хотяпо влиянию на толерантность к нагрузкам и величину ФВлизиноприл не уступал каптоприлу [236].
Учитывая, что лизиноприл не метаболизирует в пече-ни и выводится на 100 % почками в неизмененном виде,его применение должно быть ограничено при тяжелойХСН, когда большинство больных имеют ухудшениефункции почек [237, 238]. В этих случаях выгоднееиспользовать фозиноприл и спираприл, имеющих двапути выведения из организма. Кроме этого, исследо-вание ALLHAT продемонстрировало, что лизиноприлдостоверно уступает диуретикам в предотвращенииразвития ХСН [113].
Таким образом, только 5 иАПФ (каптоприл, энала-прил, лизиноприл, периндоприл и фозиноприл) могутбыть в первую очередь рекомендованы для профилакти-ки и лечения ХСН, хотя это не исключает возможностиприменения и других представителей этого класса.
Для профилактики ХСН у больных, перенесших ОИМ,могут применяться каптоприл, рамиприл, трандолаприл,фозиноприл и зофеноприл (класс рекомендаций I, сте-пень доказанности А). Эти результаты были полученыв классических исследоваваниях SAVE [139], AIRE [239],TRACE [240], SMILE [241] и FAMIS [230], продемонстрировавшихспособность разных иАПФ снижать рискобострения ХСН и смертности у пациентов с ОКС.
Периндоприл в исследовании PRE–AMI продемон-стрировал способность достоверно блокировать про-цессы постинфарктного ремоделирования ЛЖ, что явля-ется основным механизмом в предотвращении развитияХСН [242].
Для профилактики ХСН у пациентов с хроническимизаболеваниями сердечно-сосудистой системы (в част-ности, ИБС) возможно использование трех иАПФ –периндоприла, рамиприла и трандолаприла (класс реко-мендаций I, степень доказанности А). Причем степеньдоказанности профилактики ХСН при ИБС максимальнадля периндоприла [122]. Рамиприл продемонстрировалспособность предотвращать развитие декомпенсацииу смешанной группы больных с ИБС, АГ, СД, перифе-рическим атеросклерозом и перенесенным инсультом,что не позволяет дифференцировать его эффект у каж-дой из этих подгрупп пациентов [123]. В исследованииPEACE применение трандолаприла у больных ИБСс сохранной систолической функцией сердца не сни-жало достоверно риск наступления смерти, развитиянового ОИМ или реваскуляризации, но сопровождалосьдостоверным снижением развития новой ХСН [243].Периндоприл в исследовании EUROPA достоверноуменьшал риск развития ХСН на 39 %, превосходя по это-му показателю трандолаприл (–25 %) и рамиприл (–23 %)[123, 243, 244]. Кроме того, у пациентов с инсультамив анамнезе (половина с АГ) применение периндоприлаи его комбинации с индапамидом сопровождалось досто-верным снижением риска развития ХСН на 26 % [119].
Кроме иАПФ с полностью доказанной эффективно-стью в крупных международных многоцетровых иссле-дованиях, о которых говорилось выше, необходимо упо-мянуть хинаприл и спираприл, которые продемонстри-ровали свою эффективность в лечении ХСН на меньшемчисле пациентов [245–249]. Клиническая эффективностьхинаприла и спираприла в лечении ХСН подтвержде-на и в многоцентровых российских программах РКОи ОССН (САДКО–ХСН и КВАНК).
Следует напомнить, что максимальная информацияпо лечению ХСН иАПФ была получена в серии класси-ческих исследований с эналаприлом (SOLVD treatment,SOLVD prevention, V–HeFT II и CONSENSUS) у паци-ентов со всеми стадиями декомпенсации.
Побочные эффекты (требующие остановки лечения)осложняют применение иАПФ достаточно редко.
Повышение уровня креатинина возможно у 5–15 %больных ХСН и связано с основным механизмом действияиАПФ – блокадой влияния АII на уровень почечной филь-трации. При этом может развиваться функциональнаяпочечная недостаточность, что особенно опасно у больныхс исходной гипонатриемией [250, 251]. Однако при мед-ленном титровании доз иАПФ стойкая высокая азотемия(повышение уровня креатинина более чем в 2 раза вышенормы) и усугубление почечной недостаточности встреча-ется у 1–2 % декомпенсированных больных.
Сегодня гораздо более точным методом оценки функционального состояния почек является скорость клубоч-ковой фильтрации (СКФ), рассчитываемая по формуламMDRD или Cockroft–Gault. При СКФ менее 60 мл / миндозу иАПФ следует уменьшить наполовину, а при СКФ<30 мл / мин на ¾. В этих случаях показано примене-ние иАПФ, имеющих два пути выведения из организма(почки / печень): фозиноприла (50 / 50) и спираприла(50 / 50), рамиприла (70 / 30) и трандолаприла (30 / 70)(класс рекомендаций IIA, степень доказанности В). Дозыэтих препаратов нужно корригировать лишь при сниже-нии СКФ менее 30 мл / мин. Следует избегать назначениялизиноприла, который выводится почками в неизменен-ном виде, что чревато опасным повышением концентра-ции препарата (класс рекомендаций IIA, степень дока-занности А).
Сухой кашель. Типичный побочный эффект всехиАПФ (2–3 % леченных иАПФ больных), связанныйс блокадой деградации брадикинина и минимально выра-женный у фозиноприла (степень доказанности В) [252].При развитии упорного кашля иАПФ должны быть заме-нены на АРА, которым не свойственно развитие этогоосложнения.
Симптомная гипотония объясняется основнымимеханизмами действия иАПФ, однако может затруднять начало терапии иАПФ. В небольшом количестве случаев(3–4 %) это может требовать прекращения терапии иАПФ.Имеются сведения, что в наименьшей степени гипотонияпервой дозы развивается на фоне применения перин-доприла (класс IIA, степень доказанности В) [253, 254].Следует помнить, что при развитии гипотонии на фонелечения иАПФ дозу нужно уменьшить, а при останов-ке лечения сделать все возможное для как можно болеебыстрого возврата к терапии иАПФ.
Непереносимость иАПФ. Абсолютными противопо-казаниями к назначению иАПФ являются непереноси-мость (ангионевротическийотек), двусторонний стенозпочечных артерий, беременность. Непереносимостьв связи с развитием ангионевротического отека при при-менении рекомендованных доз иАПФ в терапевтическихдозах не превышает 0,4 %.
В случаях непереносимости иАПФ могут быть заме-нены АРА, хотя при развитии почечной недостаточностии повышении уровня креатинина, скорее всего, и назна-чение АРА не принесет желаемого результата.
Практические вопросы применения иАПФ при ХСН(дозы, тактика лечения, меры предосторожности).
Назначение всех иАПФ начинается с маленьких доз,при их постепенном (не чаще одного раза в 2–3 дня,а при системной гипотонии еще реже – не чаще одногораза в неделю) титровании до оптимальных (среднихтерапевтических) доз.
При отсутствии клинических противопоказаний(и снижения АД) необходимо пытаться увеличивать дозудо рекомендованной (терапевтической) (таблица 17). Однако следует помнить, что при попытке достижениямаксимальных доз иАПФ дополнительное снижениечисла обострений ХСН (и отсутствие дополнительного снижения риска смерти) сопровождается ростом чис-ла осложнений (гипотония, гиперкалиемия, увеличениеуровня креатинина). В исследовании NETWORK увели-чение дозы иАПФ эналаприла в терапевтических пределах(5–20 мг / сут) не сопровождалось улучшением прогнозаили снижением числа госпитализаций в связи с обостре-нием ХСН [255]. Исследование ATLAS с лизиноприломсравнивало эффективность малых (2,5–5 мг / сут) и оченьвысоких (32,5–35 мг / сут) доз препарата. Это исследо-вание показало, что 7–10‑кратное повышение доз лизи-ноприла не улучшает выживаемость больных ХСН, хотяуменьшает число повторных госпитализаций, одновре-менно достоверно увеличивая риск побочных реакций(гиперкалиемии, гипотонии) [235].
Таблица 17. Дозировки иАПФ для лечения ХСН (в мг × кратность приема)
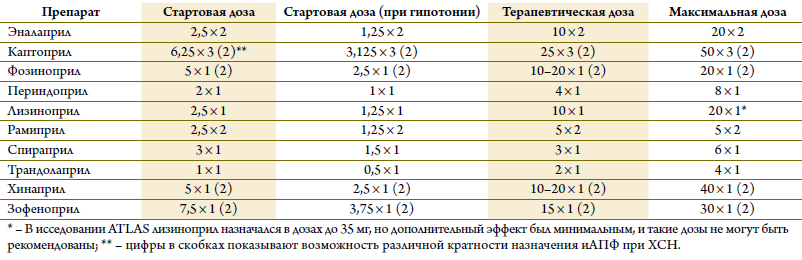 Следует помнить, что титрование дозы иАПФ – процесс сугубо индивидуальный и у каждого пациента свой оптимум и максимум в эффективных и переносимыхдозах лекарств. Тем более, что использование комбина-ции иАПФ с другими нейрогормональными ингибитора-ми (β-АБ, АМКР) у подавляющего числа больных ХСНпозволяет достигать эффекта с меньшим риском неже-лательных явлений, свойственных максимальным дозамлекарств. Однако останавливаться на минимальных дозахиАПФ, если пациент их хорошо переносит и у него нетснижения АД – это ошибка. При этом вы лишаете своегобольного дополнительных шансов на уменьшение обо-стрений болезни.
Ингибиторы АПФ можно назначать больным ХСНпри уровне САД выше 85 мм рт. ст. При исходно низкомCАД (85–100 мм рт. ст.) эффективность иАПФ сохраня-ется, поэтому их всегда и обязательно следует назначать,снижая стартовую дозу в два раза (для всех иАПФ).
Риск гипотонии возрастает:
A) у наиболее тяжелых больных ХСН IV ФК,
B) при сочетании иАПФ с ПВД (нитраты, БМКК),
C) при назначении после обильного диуреза,
D) у больных с высокоренинной формой ХСН.
Для избежания гипотензии первой дозы иАПФ следу-ет назначать не менее чем через 24 часа после обильно-го диуреза, предварительно отменив вазодилатирующиесредства.
В таблице 17 показаны дозы иАПФ, применяющихсяв лечении и профилактике ХСН в Российской Федерации.
В тех случаях, когда в скобках приведена цифра 2, этоозначает, что может иметь место как одно-, так и двух-кратное назначение препарата (двух- или трехкратноедля каптоприла).
Следует помнить, что при снижении почечной фильтра-ции ниже 60 мл / мин дозы всех иАПФ должны быть умень-шены вдвое, а при снижении ниже 30 мл / мин на 75 %.Это же относится и к лечению пожилых больных ХСН,у которых почечная функция, как правило, нарушена.
В этих случаях лучше предпочесть препараты с двой-ным путем выведения из организма (почки / желудочно-кишечный тракт)
Ниже представлены подробные рекомендациипо безопасномуначалу лечения ХСН препаратами груп-пы иАПФ, которые целесообразно выполнять у всехбольных ХСН и особенно у «проблемных» пациентовс исходной гипотонией, нарушенной функцией почек,гиперкалиемией:
A) еще раз оценить необходимость применения в исполь-зуемых дозировках диуретиков и особенно вазодилататоров;
B) не допускать чрезмерного диуреза перед началомлечения. Отменить диуретики за 24 ч до первого при-менения иАПФ в случае их использования;
C) целесообразно начинать терапию вечером, когдабольной находится в горизонтальном положении,чтобы снизить до минимума возможное негативноевлияние препарата на АД, хотя данных, подтверж-дающих это предположение относительно СН, нет (уровень доказательности В). Если лечение начинаютутром, рекомендуется наблюдение за АД в течениенескольких часов;
D) начинать лечение с малых доз и увеличиватьих до терапевтического уровня, который оказалсяэффективным по данным МРКИ (таблица 17);
E) избегать назначения калийсберегающих диурети-ков в начале лечения иАПФ, особенно у больныхс исходно высоким уровнем калия плазмы (выше5,2 ммоль / л). Однако это не противоречит рекомен-дациям по совместному применению иАПФ с высоки-ми дозами спиронолактона в период декомпенсациисердечной деятельности и сочетанию иАПФ с малымидозами АМКР при длительном лечении ХСН;
F) избегать назначения НПВП;
G) контролировать АД, содержание креатинина и элек-тролитов в крови через 2 недели после каждого после-дующего увеличения дозы.
За консультацией к специалисту-кардиологу следуетнаправлять больных, у которых:
A) причина СН неизвестна,
B) САД <100 мм рт. ст.,
C) содержание в сыворотке креатинина >130 мкмоль / л,или СКФ < 60 мл / мин и нет клинического эффекта,
D) содержание в сыворотке натрия <130 ммоль / л,
E) одержание в сыворотке калия >6,0 ммоль / л,
F) тяжелая СН,
G) клапанные пороки сердца, как причина СН.
При развитии серьезных нежелательных явленийи / или отсутствии эффекта от применения иАПФ можнопопробовать терапию АРА.
Антагонисты рецепторов к АII
Появление второго класса блокаторов РААС – селективных антагонистов рецепторов к АII (АРА) произошло уже после укрепления иАПФ на позициях основныхсредств лечения декомпенсации. Учитывая абсолютныепоказания к назначению иАПФ всем пациентам с ХСН,невозможно было организовать плацебо-контролируемые исследования с АРА в «эру иАПФ», что затруднялооценку истинных возможностей препаратов этого классау декомпенсированных больных. Хотя необходимо отметить «фирменную» особенность препаратов этого клас-са – прекрасную переносимость при минимуме побоч-ных эффектов. Кроме того, АРА крайне редко вызываюткашель и стандартно рекомендуются для лечения ХСН при непереносимости иАПФ (как это и указано в настоя-щих рекомендациях).
На начальном этапе первый АРА лозартан напрямуюсравнивался с эталонным иАПФ каптоприлом с целью доказать преимущества нового класса блокаторов РААСна смертность и заболеваемость больных ХСН [228],однако гипотеза о возможных преимуществах АРА в лече-нии ХСН не подтвердилась.
В исследовании ELITE II лозартан незначительно и недостоверно уступал каптоприлу по влиянию на прогноз пациентов с декомпенсацией и имел лучший профиль переносимости [228]. Относительная неудача лозар-тана (в сравнении с высокой дозой иАПФ каптопри-ла – 150 мг / сут) в этом исследовании, как и при леченииОИМ в исследовании ОРТIMAAL [224], связываетсяс применением недостаточных (50 мг 1 р / д) дозировок.В 2009 году завершилось крайне важное исследование HEAAL, впервые сравнившее эффективность различныхдозировок АРА в лечении ХСН. Было продемонстрирова-но, что применение лозартана в дозе 150 мг / сут достовер-но снижает риск смерти и госпитализаций больных ХСНв сравнении с дозой 50 мг / сут [256]. Смысл этого иссле-дования не только в «реабилитации» лозартана, как сред-ства лечения ХСН с возможностью снижения рискасмерти и госпитализации больных, но и в напоминании,что только оптимальные дозы блокаторов РААС позволяют рассчитывать на улучшение прогноза больных ХСН.
Лозартан в дозах 100 мг / сут может предупреждатьразвитие ХСН, в том числе у пациентов с диабетоми нефропатией [150], что обусловливает его применениедля профилактики декомпенсации сердечной деятельно-сти (класс рекомендаций IIA, степень доказанности В).
В дальнейшем все клинические исследования дока-зывали лишь то что АРА не уступают иАПФ в леченииХСН. Главной доказательной базой являются результа-ты трех исследований, вошедших в программу CHARM,в которых изучалась эффективность и безопасность при-менения АРА кандесартана у пациентов с ХСН и снижен-ной или сохранной ФВ ЛЖ [257–259]. В исследованииCHARM alternative кандесартан сравнивался с плацебоу пациентов с ХСН, сниженной ФВ ЛЖ <40 % и непере-носимостью иАПФ. В этом исследовании АРА кандесар-тан достоверно снижал риск первичной конечной точки(смерть плюс госпитализации в связи с обострениемХСН) на 23 %, но показатель смертности достоверноне менялся [257].
Ретроспективный анализ программы CHARM про-демонстрировал достоверное снижение смертности и сердечно-сосудистых госпитализаций среди пациентов с классической СН и низкой ФВ (<40 %) на фоне лечения кандесартаном. Снижение риска смерти составляло 33 %после первого, 20 % после второго и 12 % после третьегогода наблюдения, что очень близко к показателям, полу-ченным в исследовании SOLVD с «эталонным» иАПФэналаприлом (23 % через год, 23 % через два и 16 % черезтри года терапии, соответственно). Однако часть паци-ентов получала комбинацию иАПФ и АРА кандесарта-на, что может искажать результаты. С другой стороны,кандесартан был поставлен в более сложные условия,чем иАПФ, которые применялись на фоне комбинациилишь двух препаратов – сердечных гликозидов и моче-гонных. Эффект кандесартана доказан для больных ХСН,большинство из которых уже получали и гликозиды,и диуретики, и β-АБ, и антагонисты альдостерона, а частьи иАПФ, но не достигли состояния компенсации.
Дополнительное значение имеет анализ эффективности другого АРА – валсартана у больных, не получав-ших иАПФ в связи с их непереносимостью [260]. В этомслучае были впервые продемонстрированы способно-сти АРА не только к уменьшению числа госпитализаций,но и снижению риска смерти больных ХСН в сравнениис плацебо. Валсартан на 33 % снижал риск смерти и на 44 %риск смерти плюс повторных госпитализаций у деком-пенсированных больных, даже превосходя по этим пока-зателям кандесартан. Правда, эти результаты были полу-чены в ходе вторичного анализа.
Валсартан является эффективным средством про-филактики ХСН у больных с ОКС, не уступая по этомупоказателю иАПФ каптоприлу, что было подтвержденов крупном международном исследовании VALIANT [132]и при хронической ИБС, вне зависимости от уровня АД.
Таким образом, можно констатировать, что некото-рые АРА – кандесартан, валсартан и лозартан могут при-меняться для лечения ХСН при непереносимости иАПФ [256, 257, 260].
Сведения о трех наиболее эффективных АРА, приме-няемых сегодня для лечения и профилактики ХСН, пред-ставлены в таблице 18. Титрование доз АРА проводитсяпо тем же принципам, что и иАПФ. Стартовая доза канде-сартана – 4 мг однократно в сутки, которая при стабиль-ном АД и отсутствии осложнений удваивается каждые3–5 дней до достижения дозировки 16 мг однократнов сутки. У больных с высоким уровнем АД максимальнаядозировка – 32 мг однократно в сутки. При исходной гипо-тонии (САД менее 100 мм рт. ст.) терапию безопасно начинать с дозы 2 мг в сутки. Для валсартана стартовая доза –40 мг × 2 р / сут, которая может быть увеличена до 80 мг ×2 р / сут и максимально до 160 мг × 2 р / сут. При исходной гипотонии необходимо стартовать с дозы 20 мг × 2 р / сут.
Таблица 18. Дозировки АРА, рекомендуемых для профилактики и лечения ХСН
Следует помнить, что титрование дозы иАПФ – процесс сугубо индивидуальный и у каждого пациента свой оптимум и максимум в эффективных и переносимыхдозах лекарств. Тем более, что использование комбина-ции иАПФ с другими нейрогормональными ингибитора-ми (β-АБ, АМКР) у подавляющего числа больных ХСНпозволяет достигать эффекта с меньшим риском неже-лательных явлений, свойственных максимальным дозамлекарств. Однако останавливаться на минимальных дозахиАПФ, если пациент их хорошо переносит и у него нетснижения АД – это ошибка. При этом вы лишаете своегобольного дополнительных шансов на уменьшение обо-стрений болезни.
Ингибиторы АПФ можно назначать больным ХСНпри уровне САД выше 85 мм рт. ст. При исходно низкомCАД (85–100 мм рт. ст.) эффективность иАПФ сохраня-ется, поэтому их всегда и обязательно следует назначать,снижая стартовую дозу в два раза (для всех иАПФ).
Риск гипотонии возрастает:
A) у наиболее тяжелых больных ХСН IV ФК,
B) при сочетании иАПФ с ПВД (нитраты, БМКК),
C) при назначении после обильного диуреза,
D) у больных с высокоренинной формой ХСН.
Для избежания гипотензии первой дозы иАПФ следу-ет назначать не менее чем через 24 часа после обильно-го диуреза, предварительно отменив вазодилатирующиесредства.
В таблице 17 показаны дозы иАПФ, применяющихсяв лечении и профилактике ХСН в Российской Федерации.
В тех случаях, когда в скобках приведена цифра 2, этоозначает, что может иметь место как одно-, так и двух-кратное назначение препарата (двух- или трехкратноедля каптоприла).
Следует помнить, что при снижении почечной фильтра-ции ниже 60 мл / мин дозы всех иАПФ должны быть умень-шены вдвое, а при снижении ниже 30 мл / мин на 75 %.Это же относится и к лечению пожилых больных ХСН,у которых почечная функция, как правило, нарушена.
В этих случаях лучше предпочесть препараты с двой-ным путем выведения из организма (почки / желудочно-кишечный тракт)
Ниже представлены подробные рекомендациипо безопасномуначалу лечения ХСН препаратами груп-пы иАПФ, которые целесообразно выполнять у всехбольных ХСН и особенно у «проблемных» пациентовс исходной гипотонией, нарушенной функцией почек,гиперкалиемией:
A) еще раз оценить необходимость применения в исполь-зуемых дозировках диуретиков и особенно вазодилататоров;
B) не допускать чрезмерного диуреза перед началомлечения. Отменить диуретики за 24 ч до первого при-менения иАПФ в случае их использования;
C) целесообразно начинать терапию вечером, когдабольной находится в горизонтальном положении,чтобы снизить до минимума возможное негативноевлияние препарата на АД, хотя данных, подтверж-дающих это предположение относительно СН, нет (уровень доказательности В). Если лечение начинаютутром, рекомендуется наблюдение за АД в течениенескольких часов;
D) начинать лечение с малых доз и увеличиватьих до терапевтического уровня, который оказалсяэффективным по данным МРКИ (таблица 17);
E) избегать назначения калийсберегающих диурети-ков в начале лечения иАПФ, особенно у больныхс исходно высоким уровнем калия плазмы (выше5,2 ммоль / л). Однако это не противоречит рекомен-дациям по совместному применению иАПФ с высоки-ми дозами спиронолактона в период декомпенсациисердечной деятельности и сочетанию иАПФ с малымидозами АМКР при длительном лечении ХСН;
F) избегать назначения НПВП;
G) контролировать АД, содержание креатинина и элек-тролитов в крови через 2 недели после каждого после-дующего увеличения дозы.
За консультацией к специалисту-кардиологу следуетнаправлять больных, у которых:
A) причина СН неизвестна,
B) САД <100 мм рт. ст.,
C) содержание в сыворотке креатинина >130 мкмоль / л,или СКФ < 60 мл / мин и нет клинического эффекта,
D) содержание в сыворотке натрия <130 ммоль / л,
E) одержание в сыворотке калия >6,0 ммоль / л,
F) тяжелая СН,
G) клапанные пороки сердца, как причина СН.
При развитии серьезных нежелательных явленийи / или отсутствии эффекта от применения иАПФ можнопопробовать терапию АРА.
Антагонисты рецепторов к АII
Появление второго класса блокаторов РААС – селективных антагонистов рецепторов к АII (АРА) произошло уже после укрепления иАПФ на позициях основныхсредств лечения декомпенсации. Учитывая абсолютныепоказания к назначению иАПФ всем пациентам с ХСН,невозможно было организовать плацебо-контролируемые исследования с АРА в «эру иАПФ», что затруднялооценку истинных возможностей препаратов этого классау декомпенсированных больных. Хотя необходимо отметить «фирменную» особенность препаратов этого клас-са – прекрасную переносимость при минимуме побоч-ных эффектов. Кроме того, АРА крайне редко вызываюткашель и стандартно рекомендуются для лечения ХСН при непереносимости иАПФ (как это и указано в настоя-щих рекомендациях).
На начальном этапе первый АРА лозартан напрямуюсравнивался с эталонным иАПФ каптоприлом с целью доказать преимущества нового класса блокаторов РААСна смертность и заболеваемость больных ХСН [228],однако гипотеза о возможных преимуществах АРА в лече-нии ХСН не подтвердилась.
В исследовании ELITE II лозартан незначительно и недостоверно уступал каптоприлу по влиянию на прогноз пациентов с декомпенсацией и имел лучший профиль переносимости [228]. Относительная неудача лозар-тана (в сравнении с высокой дозой иАПФ каптопри-ла – 150 мг / сут) в этом исследовании, как и при леченииОИМ в исследовании ОРТIMAAL [224], связываетсяс применением недостаточных (50 мг 1 р / д) дозировок.В 2009 году завершилось крайне важное исследование HEAAL, впервые сравнившее эффективность различныхдозировок АРА в лечении ХСН. Было продемонстрирова-но, что применение лозартана в дозе 150 мг / сут достовер-но снижает риск смерти и госпитализаций больных ХСНв сравнении с дозой 50 мг / сут [256]. Смысл этого иссле-дования не только в «реабилитации» лозартана, как сред-ства лечения ХСН с возможностью снижения рискасмерти и госпитализации больных, но и в напоминании,что только оптимальные дозы блокаторов РААС позволяют рассчитывать на улучшение прогноза больных ХСН.
Лозартан в дозах 100 мг / сут может предупреждатьразвитие ХСН, в том числе у пациентов с диабетоми нефропатией [150], что обусловливает его применениедля профилактики декомпенсации сердечной деятельно-сти (класс рекомендаций IIA, степень доказанности В).
В дальнейшем все клинические исследования дока-зывали лишь то что АРА не уступают иАПФ в леченииХСН. Главной доказательной базой являются результа-ты трех исследований, вошедших в программу CHARM,в которых изучалась эффективность и безопасность при-менения АРА кандесартана у пациентов с ХСН и снижен-ной или сохранной ФВ ЛЖ [257–259]. В исследованииCHARM alternative кандесартан сравнивался с плацебоу пациентов с ХСН, сниженной ФВ ЛЖ <40 % и непере-носимостью иАПФ. В этом исследовании АРА кандесар-тан достоверно снижал риск первичной конечной точки(смерть плюс госпитализации в связи с обострениемХСН) на 23 %, но показатель смертности достоверноне менялся [257].
Ретроспективный анализ программы CHARM про-демонстрировал достоверное снижение смертности и сердечно-сосудистых госпитализаций среди пациентов с классической СН и низкой ФВ (<40 %) на фоне лечения кандесартаном. Снижение риска смерти составляло 33 %после первого, 20 % после второго и 12 % после третьегогода наблюдения, что очень близко к показателям, полу-ченным в исследовании SOLVD с «эталонным» иАПФэналаприлом (23 % через год, 23 % через два и 16 % черезтри года терапии, соответственно). Однако часть паци-ентов получала комбинацию иАПФ и АРА кандесарта-на, что может искажать результаты. С другой стороны,кандесартан был поставлен в более сложные условия,чем иАПФ, которые применялись на фоне комбинациилишь двух препаратов – сердечных гликозидов и моче-гонных. Эффект кандесартана доказан для больных ХСН,большинство из которых уже получали и гликозиды,и диуретики, и β-АБ, и антагонисты альдостерона, а частьи иАПФ, но не достигли состояния компенсации.
Дополнительное значение имеет анализ эффективности другого АРА – валсартана у больных, не получав-ших иАПФ в связи с их непереносимостью [260]. В этомслучае были впервые продемонстрированы способно-сти АРА не только к уменьшению числа госпитализаций,но и снижению риска смерти больных ХСН в сравнениис плацебо. Валсартан на 33 % снижал риск смерти и на 44 %риск смерти плюс повторных госпитализаций у деком-пенсированных больных, даже превосходя по этим пока-зателям кандесартан. Правда, эти результаты были полу-чены в ходе вторичного анализа.
Валсартан является эффективным средством про-филактики ХСН у больных с ОКС, не уступая по этомупоказателю иАПФ каптоприлу, что было подтвержденов крупном международном исследовании VALIANT [132]и при хронической ИБС, вне зависимости от уровня АД.
Таким образом, можно констатировать, что некото-рые АРА – кандесартан, валсартан и лозартан могут при-меняться для лечения ХСН при непереносимости иАПФ [256, 257, 260].
Сведения о трех наиболее эффективных АРА, приме-няемых сегодня для лечения и профилактики ХСН, пред-ставлены в таблице 18. Титрование доз АРА проводитсяпо тем же принципам, что и иАПФ. Стартовая доза канде-сартана – 4 мг однократно в сутки, которая при стабиль-ном АД и отсутствии осложнений удваивается каждые3–5 дней до достижения дозировки 16 мг однократнов сутки. У больных с высоким уровнем АД максимальнаядозировка – 32 мг однократно в сутки. При исходной гипо-тонии (САД менее 100 мм рт. ст.) терапию безопасно начинать с дозы 2 мг в сутки. Для валсартана стартовая доза –40 мг × 2 р / сут, которая может быть увеличена до 80 мг ×2 р / сут и максимально до 160 мг × 2 р / сут. При исходной гипотонии необходимо стартовать с дозы 20 мг × 2 р / сут.
Таблица 18. Дозировки АРА, рекомендуемых для профилактики и лечения ХСН
 Стартовая доза лозартана для лечения ХСН 50 мг ×1 р / сут, которая должна титроваться до оптимальной –150 мг / сут. При исходной гипотонии начало терапиис дозы 25 мг × 1 р / сут. Для профилактики ХСН (при АГ,СД и ХПН) рекомендуется назначать АРА лозартан в дозе100 мг × 1 р / сут.
Возможности комбинирования иАПФ и АРА в лечении больных ХСН
Достаточно сложным является и вопрос о комбиниро-ванном применении иАПФ и АРА. Здесь возможны дваварианта – начало лечения сразу с комбинации иАПФи АРА или присоединение АРА к лечению больных, нахо-дящихся на длительной терапии иАПФ при невысокойэффективности последней. Первый вариант – одновременногоназначения иАПФ и АРА у больных ХСНне исследовался из-за риска чрезмерного снижения АДи роста нежелательных явлений. Hо попытки лечениябольных, перенесших ОИМ (VALIANT), и пациентоввысокого CC риска (ONTARGET) с одновременнымназначением иАПФ и АРА оказались неудачными. В обо-их случаях дополнительного влияния на заболеваемостьи смертность получено не было, а число побочных реак-ций (в том числе симптомных гипотоний и ухудшенияфункции почек) значительно увеличивалось [124, 132].Таким образом, применение комбинации иАПФ с АРАв качестве стартового лечения не может быть рекомен-довано ни одной категории кардиологических больных(класс рекомендаций III, степень доказанности А).
Возможности добавления АРА в качестве дополни-тельного блокатора РААС больным ХСН, находившимсяна длительном лечении иАПФ, исследовались в специ-альных программах CHARM–additive (с кандесартаном)и Val–HeFT (с валсартаном) [258, 261]. Применениеобоих АРА на фоне длительного лечения иАПФ приводи-ло к дополнительному достоверному снижению комби-нированной конечной точки (смерть + госпитализациииз-за прогрессирования ХСН) на 13–15 %, в основномза счет снижения обострений ХСН. Кроме того, приме-нение валсартана сопровождается клиническим улучше-нием и значительной блокадой процессов ремоделирова-ния сердца [261–263].
Исходя из имеющихся на сегодня данных АРА можноназначать дополнительно к иАПФ после того, как эффектпоследних ослабевает в ходе длительной терапии. Однакоучитывая, что все пациенты с ХСН и II–IV ФК должнынаходиться на тройной терапии нейрогормональнымимодуляторами (иАПФ + β-АБ + АМКР), в действительно-сти речь идет о назначении четвертого нейрогормональ-ного блокатора (!). Показано, что комбинация иАПФс АРА (и нередко при дополнительном назначении β-АБи АМКР) способна в большей степени блокировать ней-рогормоны и процессы ремоделирования, что доказанодля кандесартана [222] и валсартана [261, 263]. Доказано,что комбинация иАПФ + β-АБ + АМКР+ АРА может при-водить к чрезмерному снижению уровня АД и реактива-ции нейрогормональных систем, ответственных за про-грессирование ХСН [264]. Второй опасностью являетсяпрогрессирующее ухудшение функции почек и риск раз-вития гиперкалиемии. Поэтому рекомендация по вклю-чению АРА в комплекс нейрогормональной блокадыпри ХСН имеет невысокий класс (IIB, А).
Не выявлено гендерных различий в эффективно-сти АРА при ХСН (Val–HeFT, CHARM, ELITE–II),что выгодно отличает этот класс препаратов от иАПФ.Результаты когортных исследований и данные последнихмета-анализов показывают значительное преимуществоАРА над иАПФ в лечении женщин, особенно при сочета-нии АГ и ХСН [265].
Блокаторы β-адренергических рецепторов
Рациональным обоснованием применения β-АБ в леченииХСН является блокада симпатико-адреналовой систе-мы (САС), которая находится в состоянии хроническойгиперактивации у больных с декомпенсацией и опреде-ляет плохой прогноз (высокую смертность) этих паци-ентов [266]. Активность САС прогрессивно нарастаетпараллельно увеличению тяжести ХСН, причем, начи-ная со II стадии болезни или со II ФК, преобладающимистановятся негативные дезадаптивные свойства кате-холаминов [267–270]. В связи с этим применение β-АБстановится наиболее целесообразным и эффективныму пациентов с клинически выраженной ХСН II–IV ФК.Доказано, что гиперактивация САС способствует досто-верному увеличению как риска внезапной смерти, таки смерти от прогрессирования декомпенсации. Поэтомуосновная идея применения β-АБ в лечении больныхХСН – это улучшение прогноза и снижение смертности.
В настоящее время доказано, что β-АБ оказывают бло-кирующее действие и на некоторые другие нейрогормо-нальные системы, ответственные за прогрессированиеХСН – РААС, эндотелиновую систему и систему цитоки-нов. Таким образом, β-АБ в лечении ХСН – это не только средства, блокирующие влияние катехоламиновна β-адренергическиерецепторы (хотя это очень важ-но), но и комплексные нейрогормональные модуляторы,оптимально дополняющие эффекты иАПФ [268, 271].
Негативные последствия гиперактивации САС макси-мально проявляются в результате чрезмерной стимуляцииβ1-рецепторов, поэтому применение β1‑селективных(часто ошибочно используется термин кардиоселек-тивных) β-АБ в лечении больных ХСН вполне обо-сновано и эффективно. Хотя имеются предположения,что использование β-АБ с дополнительными свой-ствами, например, β1-, β2-, α1-блокатора карведилолаили высокоселективного β-АБ небиволола, одновре-менно увеличивающего синтез оксида азота в эндотели-альных клетках, может быть более эффективным за счетдополнительных вазодилатирующих свойств (степеньдоказанности С) [272–275].
К положительным свойствам β-АБ при ХСН относит-ся способность:A) уменьшать дисфункцию и смерть кардиомиоцитовкак путем некроза, так и апоптоза;B) уменьшать число гибернирующих (находящихсяв «спячке») кардиомиоцитов;C) при длительном применении за счет увеличениязон сокращающегося миокарда улучшать показателигемодинамики;D) повышать плотность и аффинность β-адренорецепторов,которые резко снижены у больных ХСН;E) уменьшать гипертрофию миокарда;F) снижать ЧСС, что является «зеркалом» успешногоприменения β-АБ у больных ХСН. Уменьшение ЧССминимум на 15 % от исходной величины характеризу-ет правильное лечение β-АБ больных ХСН;G) уменьшать степень ишемии миокарда в покое и осо-бенно при физической активности;H) несколько уменьшать частоту желудочковых аритмий;I) оказывать антифибрилляторное действие, что снижа-ет риск внезапной смерти.
Таким образом, наряду с улучшением прогноза β-АБуменьшают степень ремоделирования сердца, т. е. оказы-вают кардиопротекторное действие, позволяющее замедлять прогрессирование декомпенсации и снижать числогоспитализаций [276–281].
Главным же негативным свойством, в течение многихлет препятствующим включению β-АБ в число основныхпрепаратов для лечения ХСН, считался их отрицательныйинотропный эффект, который, по мнению многих кардиологови терапевтов, был способен стимулировать усугу-бление проявлений ХСН. В настоящее время доказананекая двухфазность влияния β-АБ на центральную гемо-динамику у больных ХСН [268, 282, 283]. Действительно,в первые две недели лечения этими препаратами сердеч-ный выброс может снижаться (как за счет уменьшениясобственно сократимости, так и в результате сниженияЧСС), а клинические проявления ХСН даже нескольконарастать. Но затем в результате уменьшения тахикардиии потребления миокардом кислорода гибернированныекардиомиоциты восстанавливают свою сократимостьи сердечный выброс начинает расти. Причем некоторыеβ-АБ (карведилол) при длительном применении позво-ляют добиваться бóльшего роста ФВ, чем номинальныеположительные инотропные агенты (в частности, сердеч-ные гликозиды) [284].
К настоящему времени завершено более 30 плаце-бо-контролируемых исследований, включавших свыше20 тыс. больных ХСН со сниженной ФВ ЛЖ <40 %, кото-рые показали способность β-АБ снижать смертностьбольных с декомпенсацией на 29 % (что даже больше,чем при применении иАПФ). Хотя, справедливости ради,нужно отметить, что в большинстве случаев β-АБ приме-нялись дополнительно к иАПФ [1, 4, 6, 8].
В связи с многочисленными вопросами и комментари-ями по поводу применения β-АБ при лечении ХСН нижеприводятся результаты важнейших исследований, сфор-мировавших концепцию использования этой группы пре-паратов для лечения ХСН:
A) MDC с β1‑селективным β-АБ метопролола тартратом(около 400 больных ХСН на почве ДКМП), не пока-завшее снижения смертности, хотя снижалась часто-та комбинированной конечной точки в виде числасмертей плюс пересадок сердца [285];
B) CIBIS–II с β1‑селективным β-АБ бисопрололом(более 2 600 больных ХСН III–IV ФК), показавшееснижение риска смерти на 34 % [282];
C) MERIT–HF с β1‑селективным β-АБ метопролола сук-цинатом замедленного высвобождения (почти 4 тыс.больных ХСН II–IV ФК), продемонстрировавшееснижение риска смерти также на 34 % [279];
D) COPERNICUS с неселективным β1- и β2-, а такжеα1‑блокатором карведилолом (более 2 200 больныхХСН с исходной ФВ <25 %), позволившее снизитьриск смерти на 35 % [284];
E) мета-анализ четырех протоколов, проводившихсяв США с карведилолом (USCP), включивший около1 тыс. больных ХСН II–IV ФК и показавший сниже-ние риска смерти на 65 % [276];
F) Австралийско-Новозеландское исследование по при-менению карведилола у более чем 400 пациентов с ХСН II–III ФК ишемической этиологии, позволив-шее снизить риск смерти на 28 % [277];
G) исследование COMET (более 3 000 больных ХСН),напрямую сравнившее эффективность примене-ния неселективного β- и α-блокатора карведилолаи β1‑селективного короткодействующего β-АБ мето-пролола тартрата и продемонстрировавшее досто-верное преимущество карведилола по снижениюриска смерти на 17 % [286];
H) исследование SENIORS с высоко β1‑селективнымβ-АБ, обладающим дополнительным влиянием на син-тез оксида азота в эндотелии сосудов, небивололом(более чем 2 100 больных ХСН старше 70 лет), про-демонстрировавшее достоверное снижение суммысмертей и сердечно-сосудистых госпитализаций (пер-вичная точка исследования) на 14 % и незначительноеснижение общей смертности на 12 % (р=0,21) [281]. Следует отметить отличия исследования SENIORS,в котором применялся небиволол. Пациенты с ХСНв этом случае были гораздо старше и более ⅓ из нихимели ФВ ЛЖ >35 %, что отличается от всех иссле-дований с другими β-АБ. Для более адекватногосравнения эффектов небиволола с другими β-АБ,использовавшимися в лечении ХСН, был проведендополнительный анализ относительно более «моло-дых» пациентов (моложе среднего возраста 75,2 лет,т. е. 70–75 лет). Этот анализ продемонстрировал сни-жение первичной конечной точки на 27 %, а общейсмертности на 38 %, что полностью соответствуетрезультам применения бисопролола, карведилолаи метопролола сукцината замедленного выведения;
I) по результатам многоцентрового рандомизирован-ного исследования НЕМЕЗИДА, организованногои проведенного под эгидой ОССН, было проде-монстрировано, что небиволол в адекватных дозах,по крайней мере, не уступает метопрололу в контроле ЧСС, АД и повышению ФВ ЛЖ; дополнительнонебиволол уменьшает внутриаортальное сопротив-ление сердечному выбросу, что сопрвождается разгрузкой левых отделов сердца (лучшее наполнениеЛЖ в диастолу и уменьшение размеров левого пред-сердия). Эти эффекты могут быть связаны с дополни-тельной вазодилатацией и улучшением периферического кровотока, что не усугубляет нарушения усвоения глюкозы мышцами (инсулинорезистентности);
J) исследование CIBIS–III у 1050 больных ХСН II–III ФК, доказавшее, что по эффективности и безопас-ности начало лечения с β1‑селективного β-АБ бисо-пролола (в течение 6 месяцев) с последующим переводом на его комбинацию с эналаприлом не уступаетобщепринятому режиму – началу лечения с иАПФэналаприла с последующим переводом на комбина-цию иАПФ плюс β-АБ (при анализе тех пациентов,которые выполнили протокол исследования) [287].
Таким образом, в четырех наиболее успешных протоколах (CIBIS–II, MERIT–HF, COPERNICUSи SENIORS) четыре различных (по влиянию на типы рецепторов и возможности вазодилатации) β-АБ показали практически одинаковое снижение риска смертибольных ХСН. Кроме того, и бисопролол, и метопрололасукцинат замедленного выведения, и карведилол и неби-волол достоверно уменьшали как риск внезапной смер-ти, так и смерти от прогрессирования ХСН и снижаличастоту госпитализаций.
Другие β-АБ, включая атенолол и метопролола тартраткороткого действия, не показали способности улучшатьпрогноз больных ХСН. Применение атенолола и метопро-лола тартрата для лечения больных ХСН нецелесообразно(класс рекомендаций III, степень доказанности А).
В лечении пожилых больных ХСН (старше 70 лет)наиболее доказан эффект небиволола, обладающего,ко всему прочему, высоким профилем безопасности.Ретроспективный анализ показывает, что другие β-АБ,рекомендованные для лечения ХСН – бисопрололи метопролола сукцинат замедленного выведения так-же снижают риск госпитализаций и улучшают прогнозбольных ХСН старше 65 лет.
По способности снижать риск заболеваемости и смерти декомпенсированных больных β-АБ даже превосходятиАПФ.
Сегодня β-АБ наряду с иАПФ являются главными средствами лечения ХСН cо сниженной систолическойфункцией сердца. Их способность замедлять прогрес-сирование болезни, уменьшать число госпитализацийи улучшать прогноз декомпенсированных больныхне вызывает сомнений (класс рекомендаций I, уровеньдоказанности А).
β-АБ должны применяться у всех больных ХСН с ФВ<40 %, не имеющих противопоказаний (обычных для этойгруппы лекарств). Это очень важное положение, ставшеепостулатом лишь в последние годы. Тяжесть декомпен-сации, пол, возраст, уровень исходного давления (есте-ственно, если САД исходно больше 85 мм рт. ст.) и исход-ная ЧСС не играют самостоятельной роли в определе-нии противопоказаний к назначению β-АБ. Хотя эффектот лечения более выражен у больных с исходной тахикардией (более 80 уд / мин) и достаточно высоким АД (систолическое более 100 мм рт. ст.) (степень доказанности В).
Таблица 19. Дозировки β-АБ , рекомендуемых для лечения больных ХСН
Стартовая доза лозартана для лечения ХСН 50 мг ×1 р / сут, которая должна титроваться до оптимальной –150 мг / сут. При исходной гипотонии начало терапиис дозы 25 мг × 1 р / сут. Для профилактики ХСН (при АГ,СД и ХПН) рекомендуется назначать АРА лозартан в дозе100 мг × 1 р / сут.
Возможности комбинирования иАПФ и АРА в лечении больных ХСН
Достаточно сложным является и вопрос о комбиниро-ванном применении иАПФ и АРА. Здесь возможны дваварианта – начало лечения сразу с комбинации иАПФи АРА или присоединение АРА к лечению больных, нахо-дящихся на длительной терапии иАПФ при невысокойэффективности последней. Первый вариант – одновременногоназначения иАПФ и АРА у больных ХСНне исследовался из-за риска чрезмерного снижения АДи роста нежелательных явлений. Hо попытки лечениябольных, перенесших ОИМ (VALIANT), и пациентоввысокого CC риска (ONTARGET) с одновременнымназначением иАПФ и АРА оказались неудачными. В обо-их случаях дополнительного влияния на заболеваемостьи смертность получено не было, а число побочных реак-ций (в том числе симптомных гипотоний и ухудшенияфункции почек) значительно увеличивалось [124, 132].Таким образом, применение комбинации иАПФ с АРАв качестве стартового лечения не может быть рекомен-довано ни одной категории кардиологических больных(класс рекомендаций III, степень доказанности А).
Возможности добавления АРА в качестве дополни-тельного блокатора РААС больным ХСН, находившимсяна длительном лечении иАПФ, исследовались в специ-альных программах CHARM–additive (с кандесартаном)и Val–HeFT (с валсартаном) [258, 261]. Применениеобоих АРА на фоне длительного лечения иАПФ приводи-ло к дополнительному достоверному снижению комби-нированной конечной точки (смерть + госпитализациииз-за прогрессирования ХСН) на 13–15 %, в основномза счет снижения обострений ХСН. Кроме того, приме-нение валсартана сопровождается клиническим улучше-нием и значительной блокадой процессов ремоделирова-ния сердца [261–263].
Исходя из имеющихся на сегодня данных АРА можноназначать дополнительно к иАПФ после того, как эффектпоследних ослабевает в ходе длительной терапии. Однакоучитывая, что все пациенты с ХСН и II–IV ФК должнынаходиться на тройной терапии нейрогормональнымимодуляторами (иАПФ + β-АБ + АМКР), в действительно-сти речь идет о назначении четвертого нейрогормональ-ного блокатора (!). Показано, что комбинация иАПФс АРА (и нередко при дополнительном назначении β-АБи АМКР) способна в большей степени блокировать ней-рогормоны и процессы ремоделирования, что доказанодля кандесартана [222] и валсартана [261, 263]. Доказано,что комбинация иАПФ + β-АБ + АМКР+ АРА может при-водить к чрезмерному снижению уровня АД и реактива-ции нейрогормональных систем, ответственных за про-грессирование ХСН [264]. Второй опасностью являетсяпрогрессирующее ухудшение функции почек и риск раз-вития гиперкалиемии. Поэтому рекомендация по вклю-чению АРА в комплекс нейрогормональной блокадыпри ХСН имеет невысокий класс (IIB, А).
Не выявлено гендерных различий в эффективно-сти АРА при ХСН (Val–HeFT, CHARM, ELITE–II),что выгодно отличает этот класс препаратов от иАПФ.Результаты когортных исследований и данные последнихмета-анализов показывают значительное преимуществоАРА над иАПФ в лечении женщин, особенно при сочета-нии АГ и ХСН [265].
Блокаторы β-адренергических рецепторов
Рациональным обоснованием применения β-АБ в леченииХСН является блокада симпатико-адреналовой систе-мы (САС), которая находится в состоянии хроническойгиперактивации у больных с декомпенсацией и опреде-ляет плохой прогноз (высокую смертность) этих паци-ентов [266]. Активность САС прогрессивно нарастаетпараллельно увеличению тяжести ХСН, причем, начи-ная со II стадии болезни или со II ФК, преобладающимистановятся негативные дезадаптивные свойства кате-холаминов [267–270]. В связи с этим применение β-АБстановится наиболее целесообразным и эффективныму пациентов с клинически выраженной ХСН II–IV ФК.Доказано, что гиперактивация САС способствует досто-верному увеличению как риска внезапной смерти, таки смерти от прогрессирования декомпенсации. Поэтомуосновная идея применения β-АБ в лечении больныхХСН – это улучшение прогноза и снижение смертности.
В настоящее время доказано, что β-АБ оказывают бло-кирующее действие и на некоторые другие нейрогормо-нальные системы, ответственные за прогрессированиеХСН – РААС, эндотелиновую систему и систему цитоки-нов. Таким образом, β-АБ в лечении ХСН – это не только средства, блокирующие влияние катехоламиновна β-адренергическиерецепторы (хотя это очень важ-но), но и комплексные нейрогормональные модуляторы,оптимально дополняющие эффекты иАПФ [268, 271].
Негативные последствия гиперактивации САС макси-мально проявляются в результате чрезмерной стимуляцииβ1-рецепторов, поэтому применение β1‑селективных(часто ошибочно используется термин кардиоселек-тивных) β-АБ в лечении больных ХСН вполне обо-сновано и эффективно. Хотя имеются предположения,что использование β-АБ с дополнительными свой-ствами, например, β1-, β2-, α1-блокатора карведилолаили высокоселективного β-АБ небиволола, одновре-менно увеличивающего синтез оксида азота в эндотели-альных клетках, может быть более эффективным за счетдополнительных вазодилатирующих свойств (степеньдоказанности С) [272–275].
К положительным свойствам β-АБ при ХСН относит-ся способность:A) уменьшать дисфункцию и смерть кардиомиоцитовкак путем некроза, так и апоптоза;B) уменьшать число гибернирующих (находящихсяв «спячке») кардиомиоцитов;C) при длительном применении за счет увеличениязон сокращающегося миокарда улучшать показателигемодинамики;D) повышать плотность и аффинность β-адренорецепторов,которые резко снижены у больных ХСН;E) уменьшать гипертрофию миокарда;F) снижать ЧСС, что является «зеркалом» успешногоприменения β-АБ у больных ХСН. Уменьшение ЧССминимум на 15 % от исходной величины характеризу-ет правильное лечение β-АБ больных ХСН;G) уменьшать степень ишемии миокарда в покое и осо-бенно при физической активности;H) несколько уменьшать частоту желудочковых аритмий;I) оказывать антифибрилляторное действие, что снижа-ет риск внезапной смерти.
Таким образом, наряду с улучшением прогноза β-АБуменьшают степень ремоделирования сердца, т. е. оказы-вают кардиопротекторное действие, позволяющее замедлять прогрессирование декомпенсации и снижать числогоспитализаций [276–281].
Главным же негативным свойством, в течение многихлет препятствующим включению β-АБ в число основныхпрепаратов для лечения ХСН, считался их отрицательныйинотропный эффект, который, по мнению многих кардиологови терапевтов, был способен стимулировать усугу-бление проявлений ХСН. В настоящее время доказананекая двухфазность влияния β-АБ на центральную гемо-динамику у больных ХСН [268, 282, 283]. Действительно,в первые две недели лечения этими препаратами сердеч-ный выброс может снижаться (как за счет уменьшениясобственно сократимости, так и в результате сниженияЧСС), а клинические проявления ХСН даже нескольконарастать. Но затем в результате уменьшения тахикардиии потребления миокардом кислорода гибернированныекардиомиоциты восстанавливают свою сократимостьи сердечный выброс начинает расти. Причем некоторыеβ-АБ (карведилол) при длительном применении позво-ляют добиваться бóльшего роста ФВ, чем номинальныеположительные инотропные агенты (в частности, сердеч-ные гликозиды) [284].
К настоящему времени завершено более 30 плаце-бо-контролируемых исследований, включавших свыше20 тыс. больных ХСН со сниженной ФВ ЛЖ <40 %, кото-рые показали способность β-АБ снижать смертностьбольных с декомпенсацией на 29 % (что даже больше,чем при применении иАПФ). Хотя, справедливости ради,нужно отметить, что в большинстве случаев β-АБ приме-нялись дополнительно к иАПФ [1, 4, 6, 8].
В связи с многочисленными вопросами и комментари-ями по поводу применения β-АБ при лечении ХСН нижеприводятся результаты важнейших исследований, сфор-мировавших концепцию использования этой группы пре-паратов для лечения ХСН:
A) MDC с β1‑селективным β-АБ метопролола тартратом(около 400 больных ХСН на почве ДКМП), не пока-завшее снижения смертности, хотя снижалась часто-та комбинированной конечной точки в виде числасмертей плюс пересадок сердца [285];
B) CIBIS–II с β1‑селективным β-АБ бисопрололом(более 2 600 больных ХСН III–IV ФК), показавшееснижение риска смерти на 34 % [282];
C) MERIT–HF с β1‑селективным β-АБ метопролола сук-цинатом замедленного высвобождения (почти 4 тыс.больных ХСН II–IV ФК), продемонстрировавшееснижение риска смерти также на 34 % [279];
D) COPERNICUS с неселективным β1- и β2-, а такжеα1‑блокатором карведилолом (более 2 200 больныхХСН с исходной ФВ <25 %), позволившее снизитьриск смерти на 35 % [284];
E) мета-анализ четырех протоколов, проводившихсяв США с карведилолом (USCP), включивший около1 тыс. больных ХСН II–IV ФК и показавший сниже-ние риска смерти на 65 % [276];
F) Австралийско-Новозеландское исследование по при-менению карведилола у более чем 400 пациентов с ХСН II–III ФК ишемической этиологии, позволив-шее снизить риск смерти на 28 % [277];
G) исследование COMET (более 3 000 больных ХСН),напрямую сравнившее эффективность примене-ния неселективного β- и α-блокатора карведилолаи β1‑селективного короткодействующего β-АБ мето-пролола тартрата и продемонстрировавшее досто-верное преимущество карведилола по снижениюриска смерти на 17 % [286];
H) исследование SENIORS с высоко β1‑селективнымβ-АБ, обладающим дополнительным влиянием на син-тез оксида азота в эндотелии сосудов, небивололом(более чем 2 100 больных ХСН старше 70 лет), про-демонстрировавшее достоверное снижение суммысмертей и сердечно-сосудистых госпитализаций (пер-вичная точка исследования) на 14 % и незначительноеснижение общей смертности на 12 % (р=0,21) [281]. Следует отметить отличия исследования SENIORS,в котором применялся небиволол. Пациенты с ХСНв этом случае были гораздо старше и более ⅓ из нихимели ФВ ЛЖ >35 %, что отличается от всех иссле-дований с другими β-АБ. Для более адекватногосравнения эффектов небиволола с другими β-АБ,использовавшимися в лечении ХСН, был проведендополнительный анализ относительно более «моло-дых» пациентов (моложе среднего возраста 75,2 лет,т. е. 70–75 лет). Этот анализ продемонстрировал сни-жение первичной конечной точки на 27 %, а общейсмертности на 38 %, что полностью соответствуетрезультам применения бисопролола, карведилолаи метопролола сукцината замедленного выведения;
I) по результатам многоцентрового рандомизирован-ного исследования НЕМЕЗИДА, организованногои проведенного под эгидой ОССН, было проде-монстрировано, что небиволол в адекватных дозах,по крайней мере, не уступает метопрололу в контроле ЧСС, АД и повышению ФВ ЛЖ; дополнительнонебиволол уменьшает внутриаортальное сопротив-ление сердечному выбросу, что сопрвождается разгрузкой левых отделов сердца (лучшее наполнениеЛЖ в диастолу и уменьшение размеров левого пред-сердия). Эти эффекты могут быть связаны с дополни-тельной вазодилатацией и улучшением периферического кровотока, что не усугубляет нарушения усвоения глюкозы мышцами (инсулинорезистентности);
J) исследование CIBIS–III у 1050 больных ХСН II–III ФК, доказавшее, что по эффективности и безопас-ности начало лечения с β1‑селективного β-АБ бисо-пролола (в течение 6 месяцев) с последующим переводом на его комбинацию с эналаприлом не уступаетобщепринятому режиму – началу лечения с иАПФэналаприла с последующим переводом на комбина-цию иАПФ плюс β-АБ (при анализе тех пациентов,которые выполнили протокол исследования) [287].
Таким образом, в четырех наиболее успешных протоколах (CIBIS–II, MERIT–HF, COPERNICUSи SENIORS) четыре различных (по влиянию на типы рецепторов и возможности вазодилатации) β-АБ показали практически одинаковое снижение риска смертибольных ХСН. Кроме того, и бисопролол, и метопрололасукцинат замедленного выведения, и карведилол и неби-волол достоверно уменьшали как риск внезапной смер-ти, так и смерти от прогрессирования ХСН и снижаличастоту госпитализаций.
Другие β-АБ, включая атенолол и метопролола тартраткороткого действия, не показали способности улучшатьпрогноз больных ХСН. Применение атенолола и метопро-лола тартрата для лечения больных ХСН нецелесообразно(класс рекомендаций III, степень доказанности А).
В лечении пожилых больных ХСН (старше 70 лет)наиболее доказан эффект небиволола, обладающего,ко всему прочему, высоким профилем безопасности.Ретроспективный анализ показывает, что другие β-АБ,рекомендованные для лечения ХСН – бисопрололи метопролола сукцинат замедленного выведения так-же снижают риск госпитализаций и улучшают прогнозбольных ХСН старше 65 лет.
По способности снижать риск заболеваемости и смерти декомпенсированных больных β-АБ даже превосходятиАПФ.
Сегодня β-АБ наряду с иАПФ являются главными средствами лечения ХСН cо сниженной систолическойфункцией сердца. Их способность замедлять прогрес-сирование болезни, уменьшать число госпитализацийи улучшать прогноз декомпенсированных больныхне вызывает сомнений (класс рекомендаций I, уровеньдоказанности А).
β-АБ должны применяться у всех больных ХСН с ФВ<40 %, не имеющих противопоказаний (обычных для этойгруппы лекарств). Это очень важное положение, ставшеепостулатом лишь в последние годы. Тяжесть декомпен-сации, пол, возраст, уровень исходного давления (есте-ственно, если САД исходно больше 85 мм рт. ст.) и исход-ная ЧСС не играют самостоятельной роли в определе-нии противопоказаний к назначению β-АБ. Хотя эффектот лечения более выражен у больных с исходной тахикардией (более 80 уд / мин) и достаточно высоким АД (систолическое более 100 мм рт. ст.) (степень доказанности В).
Таблица 19. Дозировки β-АБ , рекомендуемых для лечения больных ХСН
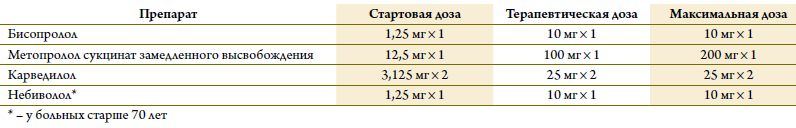 Тем не менее при обычных клинических ситуациях β-АБ должны применяться только вместе с иАПФи у больных, у которых достигнута стабилизация состояния. Важно помнить, что β-АБ не относятся к числусредств «скорой помощи» и не могут выводить больных из состояния декомпенсации и гипергидратации.
В подавляющем большинстве случаев терапия начинается с иАПФ с возможно более быстрым добавлени-ем β-АБ. В редких клинических ситуациях (преобладание выраженной тахикардии при невысоком АД, когдаодновременное назначение иАПФ и β-АБ затруднено) можно начать терапию с β1селективного β-АБ бисопро-лола с последующим присоединением иАПФ. Наиболееоправдан такой порядок лечения при исходно низкой ФВ<28 % (класс рекомендаций IIB, степень доказанности В). Конечная цель в любом случае – максимально быстрыйперевод больных ХСН на комбинацию иАПФ плюс β-АБили β-АБ плюс иАПФ [274, 287].
β-АБ оказывают у женщин столь же выраженный эффект по снижению смертности, как и у мужчин(мета-анализ исследований CIBIS–II, MERIT–HF, BEST,COPERNICUS, US Carvedilol HF, а также данные иссле-дования CIBIS–III, SENIORS) [288].
В таблице 19 представлены оптимальные дозы β-АБ,применяющиеся в лечении ХСН.
Лечение β-АБ при ХСН должно начинаться осторожно, начиная с ⅛ терапевтической дозы, которая показана в таблице 19, как стартовая. Дозы увеличиваются медленно (не чаще 1 раза в две недели,а при сомнительной переносимости и чрезмерном снижении АД – 1 раз в месяц) до достижения оптимальной, указанной как терапевтическая. Как и в случаес иАПФ, необходимо помнить, что у каждого больногосвоя оптимальная дозировка β-АБ, которая определя-ется снижением ЧСС до уровня <70 уд / мин. Толькоснижение ЧСС (а не доза β-АБ и не исходная ЧСС)определяет эффективность лечения. На каждые 5 уда-ров снижения ЧСС достигается 18 % снижения рискасмерти больных ХСН [289].
Примеры титрования дозы β-АБ:
A) Для бисопролола: 1,25 мг – 2 недели; затем 2,5 мг до 4‑йнедели; 3,75 мг до 6‑й недели, 5 мг до 8‑й недели, 7,5 мгдо 10‑й недели и затем, наконец – 10 мг к 12‑й неделелечения. При сомнительной переносимости (появлениепобочных реакций и снижение САД ниже 85 мм рт. ст.)периоды титрования составят промежутки по 4 неделии оптимальная доза будет достигнута лишь к 24-й неде-ле, то есть через полгода после начала терапии. Спешкапри титровании дозы β-АБ больным ХСН не нужна.
B) Для метопролола сукцината (ЗОК) шаги титрованиясоставят: 12,5–25–50–75–100–200 мг.
C) Для карведилола: 3,125 мг × 2 раза, затем 6,25 мг ×2 раза, затем 12,5 мг × 2 раза, затем 18,75 мг × 2 раза и,наконец, 25 мг × 2 раза.
D) Для небиволола – 1,25 мг, затем – 2,5, 5 мг, потом –7,5 и 10 мг.
Часть пациентов с ХСН в реальной практике ужеможет находиться на лечении не рекомендованными β-АБ (чаще всего атенололом или метопролола тартратомкороткого действия). Перевод на рекомендованные пре-параты следует осуществлять в соответствии с данными,представленными в таблице 20.
Таблица 20. Таблица перевода больных ХСН с атенололаи метопролола тартрата на рекомендованные β-АБ
Тем не менее при обычных клинических ситуациях β-АБ должны применяться только вместе с иАПФи у больных, у которых достигнута стабилизация состояния. Важно помнить, что β-АБ не относятся к числусредств «скорой помощи» и не могут выводить больных из состояния декомпенсации и гипергидратации.
В подавляющем большинстве случаев терапия начинается с иАПФ с возможно более быстрым добавлени-ем β-АБ. В редких клинических ситуациях (преобладание выраженной тахикардии при невысоком АД, когдаодновременное назначение иАПФ и β-АБ затруднено) можно начать терапию с β1селективного β-АБ бисопро-лола с последующим присоединением иАПФ. Наиболееоправдан такой порядок лечения при исходно низкой ФВ<28 % (класс рекомендаций IIB, степень доказанности В). Конечная цель в любом случае – максимально быстрыйперевод больных ХСН на комбинацию иАПФ плюс β-АБили β-АБ плюс иАПФ [274, 287].
β-АБ оказывают у женщин столь же выраженный эффект по снижению смертности, как и у мужчин(мета-анализ исследований CIBIS–II, MERIT–HF, BEST,COPERNICUS, US Carvedilol HF, а также данные иссле-дования CIBIS–III, SENIORS) [288].
В таблице 19 представлены оптимальные дозы β-АБ,применяющиеся в лечении ХСН.
Лечение β-АБ при ХСН должно начинаться осторожно, начиная с ⅛ терапевтической дозы, которая показана в таблице 19, как стартовая. Дозы увеличиваются медленно (не чаще 1 раза в две недели,а при сомнительной переносимости и чрезмерном снижении АД – 1 раз в месяц) до достижения оптимальной, указанной как терапевтическая. Как и в случаес иАПФ, необходимо помнить, что у каждого больногосвоя оптимальная дозировка β-АБ, которая определя-ется снижением ЧСС до уровня <70 уд / мин. Толькоснижение ЧСС (а не доза β-АБ и не исходная ЧСС)определяет эффективность лечения. На каждые 5 уда-ров снижения ЧСС достигается 18 % снижения рискасмерти больных ХСН [289].
Примеры титрования дозы β-АБ:
A) Для бисопролола: 1,25 мг – 2 недели; затем 2,5 мг до 4‑йнедели; 3,75 мг до 6‑й недели, 5 мг до 8‑й недели, 7,5 мгдо 10‑й недели и затем, наконец – 10 мг к 12‑й неделелечения. При сомнительной переносимости (появлениепобочных реакций и снижение САД ниже 85 мм рт. ст.)периоды титрования составят промежутки по 4 неделии оптимальная доза будет достигнута лишь к 24-й неде-ле, то есть через полгода после начала терапии. Спешкапри титровании дозы β-АБ больным ХСН не нужна.
B) Для метопролола сукцината (ЗОК) шаги титрованиясоставят: 12,5–25–50–75–100–200 мг.
C) Для карведилола: 3,125 мг × 2 раза, затем 6,25 мг ×2 раза, затем 12,5 мг × 2 раза, затем 18,75 мг × 2 раза и,наконец, 25 мг × 2 раза.
D) Для небиволола – 1,25 мг, затем – 2,5, 5 мг, потом –7,5 и 10 мг.
Часть пациентов с ХСН в реальной практике ужеможет находиться на лечении не рекомендованными β-АБ (чаще всего атенололом или метопролола тартратомкороткого действия). Перевод на рекомендованные пре-параты следует осуществлять в соответствии с данными,представленными в таблице 20.
Таблица 20. Таблица перевода больных ХСН с атенололаи метопролола тартрата на рекомендованные β-АБ
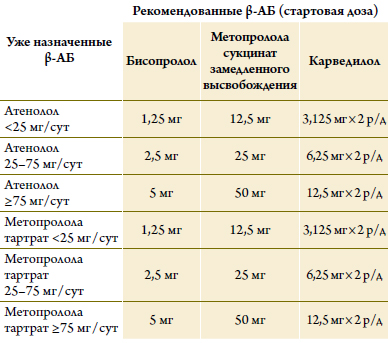 Если больные получают очень малые дозы атенолола(<25 мг / сут) или метопролола тартрата (<25 мг / сут),то титрование доз рекомендованных β-АБ необходимо начинать с общепринятых стартовых доз. Если пациентыпринимали средние дозировки атенолола (25–75 мг / сут)или метопролола тартрата (25–75 мг / сут), то титрование рекомендованных β-АБ можно начать сразу со второй ступени. Наконец, если пациенты успешно прини-мали высокие дозы атенолола (>75 мг / сут) или метопролола тартрата (>75 мг / сут), то титрование бисопролола,карведилола, метопролола сукцината и небиволола мож-но начать с третьей ступени. Между последним приемоматенолола или метопролола тартрата и первым приемомрекомендованного β-АБ, на который переводится боль-ной, должно пройти 12 часов. В дальнейшем титрованиедоз рекомендованных β-АБ проходит по обычным принципам – увеличение доз каждые 2 недели, а при гипото-нии и нестабильном состоянии 1 раз в 4 недели.
В первые две недели лечения β-АБ возможно снижение сердечного выброса и обострение симптомов ХСН,что требует тщательного контроля. В этих случаях реко-мендуется:
A) некоторое увеличение дозы диуретиков,
B) увеличение (если возможно) дозы иАПФ,
C) применение положительных инотропных препаратов(малых доз сердечных гликозидов или сенситизаторовкальция – левосимендана), гемодинамический эффекткоторого в отличие от добутамина и допамина не зави-сит от степени блокады β-адренорецепторов[290],
D) более медленное титрование дозы β-АБ.
В случаях обострения ХСН на фоне длительного приема β-АБ следует попытаться оптимизировать другуютерапию (диуретики, иАПФ, сердечные гликозиды), сни-зить дозу β-АБ, избегая его полной отмены. Отмена β-АБможет приводить к ухудшению течения ХСН, поэтомудолжна производиться лишь при невозможности продол-жить лечение в соответствии с принципами, указаннымивыше [291]. После стабилизации состояния лечение β-АБдолжно быть возобновлено, начиная с меньших доз [292].В исследовании B-CONVINCE было доказано, что отме-на β-АБ в случаях обострения ХСН не приводит к улуч-шению прогноза, а возврат к оптимальному применениюэтого класса лекарств лишь затягивается [293].
Противопоказания к назначению β-АБ при СН:
A) бронхиальная астма и тяжелая степень ХОБЛ,
B) симптомная брадикардия (<50 уд / мин),
C) симптомная гипотония (<85 мм рт. ст.),
D) атрио-вентрикулярная блокада II и более степени,
E) тяжелый облитерирующий эндартериит и атероскле-роз нижних конечностей.
Наличие хронического обструктивного бронхита,осложняющего течение ХСН, не является абсолютнымпротивопоказанием к назначению β-АБ. Во всех случаяхнеобходимо сделать попытку к их назначению, начинаяс малых доз и придерживаясь медленного титрования.Лишь при обострении симптомов бронхообструкциина фоне лечения β-АБ от их применения придется отказать-ся. Средством выбора в такой ситуации является использование высокоселективных β1-блокаторов бисопрололаили небиволола (степень доказанности В) [294, 295].
При сочетании ХСН и СД 2 типа назначение β-АБабсолютно показано. Все положительные свойства препа-ратов этого класса полностью сохраняются. Препаратомвыбора в таких ситуациях является карведилол, которыйв отличие от всех других β-АБ даже улучшает чувствитель-ность периферических тканей к инсулину (класс реко-мендаций IIA, степень доказанности А) [296]. Имеютсяданные и о позитивном влиянии небиволола на инсулино-резистентность [297, 298].
Таким образом, β-АБ применяются у всех больныхХСН II–IV ФК с ФВ ЛЖ <40 % для снижения риска смер-ти и повторных госпитализаций и вместе с иАПФ (АРА)и АМКР (класс рекомендаций I, уровень доказанности А).
Ивабрадин при непереносимости β-АБу больных ХСН II–IV ФК со сниженнойФВ ЛЖ и синусовым ритмом с ЧСС более70 уд / мин
Терапия β-АБ, как указано в предыдущем разделе,должна быть иниицирована всем больным ХСН. К сожалению, не все пациенты способны без осложнений принимать препараты этой группы. В исследовании SHIFT,где все врачи должны были предпринять попытку лечения β-АБ, около 10 % пациентов из 6 558 не смогли пере-носить терапию β-АБ [299].
Этим больным, имевшим синусовый ритм и среднююЧСС 80 уд / мин (по условиям включения в исследованиеЧСС должна была быть более 70 уд / мин), назначался препарат ивабрадин в сравнении с плацебо. Ивабрадин – селективный блокатор f-каналов (If -токов) в клетках синусового узла, урежающий ЧСС без других гемодинамических эффектов [300, 301]. В результате риск первичной конечнойточки (время до сердечно-сосудистой смерти или госпита-лизации в связи с обострением ХСН) достоверно снижалсяна 29 % при отсутствии серьезных побочных реакций [299].
Учитывая относительно небольшое количество наблю-дений (около 700 больных) и ретроспективный характерпроведенного анализа, следует признать невысокий уровень доказанности положения о применении ивабрадинабольным, не переносящим терапию β-АБ в случаях сину-сового ритма с ЧСС более 70 уд / мин у пациентов с ХСН. С другой стороны, при истинной непереносимости β-АБименно ивабрадин остается средством положительноговлияния на заболеаваемость и смертность в указаннойгруппе больных ХСН. Таким образом, положение о том,что ивабрадин должен применяться у больных ХСН II–IVс ФВ ЛЖ <40 % для снижения риска суммы смертей плюсгоспитализаций из-за ХСН c синусовым ритмом, ЧСС>70 уд / мин при непереносимости β-АБ имеет класс IIA,уровень доказанности С.
Антагонисты минералокортикоидныхрецепторов (АМКР)
Негативная роль вторичного альдостеронизмапри ХСН известна давно. Долгое время высокий уровеньмнералокортикоидного гормона альдостерона связы-вался с задержкой жидкости в организме и стимулиро-ванием электролитного дисбаланса с задержкой в орга-низме натрия и потерей калия. Поэтому с середины 60-хгодов XX века на протяжении почти полувека спироно-лактон в дозах 100–300 мг / сут успешно применялсяв комплексной диуретической терапии тяжелой ХСН,как калийсберегающий диуретик [168, 268, 302, 303].Показанием к такому использованию препарата являет-ся наличие декомпенсированной ХСН, гипергидратациии необходимости лечения активными диуретиками, кото-рые могут провоцировать избыточную потерю калия.Именно в качестве надежного партнера тиазидных и пет-левых диуретиков следует рассматривать назначение спи-ронолактона в период достижения компенсации (особен-но у пациентов с ХСН III–IV ФК). В этих случаях приме-нение спиронолактона абсолютно необходимо и можноне бояться сочетания его высоких доз с иАПФ или АРА,если параллельно правильно используются активные диу-ретики и достигается положительный диурез. Однакопосле достижения состояния компенсации (дни, неделитерапии) применение высоких доз спиронолактона пре-кращается и может рассматриваться вопрос о длительномназначении невысоких доз препарата в качестве дополни-тельного нейрогормонального модулятора [168, 268].
При обострении явлений декомпенсации спиро-нолактон используется в высоких дозах (100–300 мгили 4–12 таблеток, назначаемых однократно утромили в два приема – утром и в обед) на период 1–3 недельдо достижения компенсации. После этого доза спиро-нолактона должна быть уменьшена. Критериями эффек-тивности применения спиронолактона в комплексномлечении упорного отечного синдрома являются:A) увеличение диуреза в пределах 20–25 % (это хотяи немного, но особенно важно при упорных рефрак-терных отеках);B) уменьшение жажды, сухости во рту и исчезновениеспецифического «печеночного» запаха изо рта;C) стабильная концентрация калия и магния в плазме(отсутствие снижения), несмотря на достижениеположительного диуреза.
Нужно помнить, что концентрация спиронолакто-на в плазме крови выходит на плато к 3-му дню леченияи после отмены (или уменьшения дозы препарата) егоконцентрация и действие пропадают (снижаются) черезтрое суток.
Сложный период в «жизни» спиронолактона насту-пил после появления в практике иАПФ, которые в началь-ном периоде лечения снижают синтез альдостеронав организме. Поэтому появились рекомендации о нежела-тельном сочетании иАПФ и спиронолактона при леченииХСН, т. к. это могло быть чревато развитием гиперкалие-мии и ухудшением функции почек [290, 304, 305]. Однаковыяснилось, что ни иАПФ, ни АРА, ни β-АБ, ни сочетаниеиАПФ с β-АБ и даже тройная комбинация иАПФ+АРА+β-АБ не могут в течение длительного времени блокиро-вать синтез альдостерона [306, 307]. Поэтому не реко-мендуется лишь сочетание больших доз спиронолактонаи высоких доз иАПФ при длительном лечении ХСН и тре-буется тщательный контроль уровня калия (на начальномэтапе лечения один раз в месяц) и функции почек (СКФи уровень креатинина) [308, 309].
Исследования 90-х годов прошлого века и началаXXI века доказали, что негативная роль гиперальдосте-ронизма при ХСН связана не только с задержкой жид-кости и электролитным дисбалансом, но и с развитиемфиброза миокарда, прогрессирующим ухудшением функ-ции сердца, риском жизнеугрожающих аритмий и про-воцированием коронарной недостаточности. Учитываяневозможность эффективной блокады синтеза альдосте-рона с помощью комбинации иАПФ с β-АБ, была сдела-на попытка длительного применения малых доз АМКРв продолжительном лечении ХСН в качестве третьегонейрогормонального модулятора.
В исследовании RALES впервые было показано,что назначение 12,5–50 мг / сут (в среднем 27 мг) АМКР спиронолактона больным ХСН III–IV ФК в дополнение к оптимальной терапии, включавшей иАПФ и у 10 %пациентов β-АБ, позволяло достоверно снижать рисксмерти на 27 %, причем как внезапной, так и связаннойс обострением декомпенсации [310]. Это было первым обоснованием целесообразности сочетания трех ней-рогормональных модуляторов (иАПФ + β-АБ + АМКР)для лечения больных тяжелой ХСН III–IV ФК, что нашлоотражение в Рекомендациях ОССН по лечению ХСН ужев первой редакции 2003 года.
Вопрос о применении малых доз АМКР в комбинациис другими нейрогормональными модуляторами для лечения больных с начальными стадиями ХСН (I–II ФК)оставался открытым. Эффективность спиронолактонавступала в противоречие с его недостаточной безопасно-стью – развитием гинекомастии или аменореи (до 10 %),гиперкалиемии (до 20 %) и ухудшением функции почек,частота которых нарастает параллельно увеличению доз.Следует помнить, что при наличии повышенного уров-ня креатинина сыворотки (>130 мкмоль / л), почечнойнедостаточности в анамнезе, при снижении СКФ менее60 мл / мин, гиперкалиемии (причем даже умеренной –>5,2 ммоль / л) сочетание антагонистов альдостеронас иАПФ требует тщательного клинического и лаборатор-ного контроля [250–252]. При таких ситуациях долженбыть предусмотрен контроль уровней калия и креатини-на плазмы и рассчет скорости клубочковой фильтрациичерез 2 и 4 недели лечения, затем через 2 и 3 месяца лече-ния, а потом 1 раз в полгода. Это позволяет минимизиро-вать число побочных реакций [133, 310].
Ситуация изменилась с появлением в клиническойпрактике нового высокоселективного АМКР эплерено-на, не оказывающего влияния на андрогеновые и проге-стероновые рецепторы и не вызывающего гинекомастии,нарушений менструального цикла и реже провоцирую-щего ухудшение функции почек и гиперкалиемию в срав-нении со спиронолактоном.
Первое крупное исследование EPHESUS продемон-стрировало, что применение АМКР эплеренона в дозах25–50 мг / сут у больных, перенесших ОИМ и имеющихдисфункцию ЛЖ (ФВ ЛЖ <40 %) и в 90 % симптомыХСН, позволяет снизить риск общей смертности на 15 %и внезапной смерти на 21 % [133]. Причем достовер-ное положительное влияние эплеренона на риск общейи внезапной смерти регистрируется уже к 30‑му днютерапии [311]. Наибольший эффект терапии отмечалсяв группе лечения пациентов с ФВ ЛЖ <30 % и симпто-мами ХСН [312]. В этой группе назначение эплеренонавсего 35 больным позволяло предотвратить одну внезап-ную смерть и лишь 23 – одну смерть по любой причине.При этом отмечена высокая безопасность лечения. Хотяувеличение серьезной гиперкалиемии (>6 ммоль / л)было достоверным, составило 1,6 % в сравнении с плаце-бо, терапия эплереноном ассоциировалась с уменьшени-ем частоты гипокалиемии на 4,7 % [133].
Полученные результаты стимулировали специаль-ное исследование по применению АМКР эплеренонау больных с подтвержденной ХСН II ФК со сниженной ФВ ЛЖ <35 %, находившихся на терапии блокаторамиРААС (96,5 %) и β-АБ (86,7 %), получивших акронимEMPHASIS–HF [313]. Применение АМКР эплерено-на в качестве третьего нейрогормонального модуляторав течение в среднем 21 месяца сопровождалось достовер-ным снижением риска первичной конечной точки (сер-дечно-сосудистая смертность плюс госпитализации из-заобострения ХСН) на 37 % и риска общей смертностина 24 % (33 больных необходимо было пролечить эплере-ноном для предотвращения одного летального исхода).Эплеренон отлично зарекомендовал себя и в длительнойтерапии ХСН, снижая на 42 % риск повторных госпитали-заций в связи с обострением декомпенсации (при назна-чении препарата 14 пациентам удается предотвратитьодну госпитализацию). И важной находкой этого иссле-дования явился тот факт, что в средней дозе 39,1 мг / сутэплеренон не вызывал достоверного прироста гиперка-лиемии, в том числе и опасной (>6 ммоль / л), и наруше-ния функции почек.
В таблице 21 представлены результаты трех основных исследований с АМКР в лечении ХСН, убедительные результаты которых позволили отнести класс АМКР к основным средствам лечения декомпенсации нарядус иАПФ и β-АБ (класс рекомендаций I, степень доказанности А). Как видно, доказательная база для препаратаэплеренон гораздо большая как по количеству обсле-дованных больных, так и по их разнообразию, включаяпациентов с дисфункцией ЛЖ и начальными стадиямиХСН. Поэтому показанием к применению спиронолактона (25–50 мг) остается выраженная ХСН III–IV ФКи случаи острой декомпенсации кровообращения, когдапрепарат применяется в высоких дозах. При ХСН, начи-ная со II ФК, а у больных, перенесших ОИМ, при дис-фунции ЛЖ показано применение высокоселективногоАМКР эплеренона в дозах 25–50 мг / сут.
Важными свойствами АМКР является способностьуменьшать выраженность фиброза миокарда [314, 315],что сопровождается блокадой ремоделирования серд-ца (уменьшение объемов сердца и уровней МНУП)и ростом ФВ ЛЖ [316–318]. Подобные эффекты позво-ляют проявляться антиаритмическим свойствам АМКР. Эплеренон у больных ХСН II ФК на 42 % снижает рискразвития новой ФП [319]. Кроме того, мета-анализисследований с применением АМКР подтвердил их спо-собность достоверно снижать риск внезапной смертиу больных ХСН [320].
Последний мета-анализ продемонстрировал способ-ность АМКР снижать риск смерти (на 21 %) и госпита-лизаций в связи с обострением декомпенсации (на 38 %)и у больных с более ранней ХСН I–II ФК, однакопри этом в 1,78 раза увеличивается риск гиперкалие-мии [321]. Учитывая небольшое число обследованныхбольных, перенос показаний к использованию АМКРв комплексной терапии ХСН I ФК следует считать преждевременным.
Итак, несмотря на необходимость контроля уров-ня калия при начале лечения, АМКР по праву занимаютместо в списке трех основных групп препаратов, приме-няемых для лечения ХСН (вместе с иАПФ и β-АБ).
Таблица 21. Результаты основных исследований с АМКР при ХСН
Если больные получают очень малые дозы атенолола(<25 мг / сут) или метопролола тартрата (<25 мг / сут),то титрование доз рекомендованных β-АБ необходимо начинать с общепринятых стартовых доз. Если пациентыпринимали средние дозировки атенолола (25–75 мг / сут)или метопролола тартрата (25–75 мг / сут), то титрование рекомендованных β-АБ можно начать сразу со второй ступени. Наконец, если пациенты успешно прини-мали высокие дозы атенолола (>75 мг / сут) или метопролола тартрата (>75 мг / сут), то титрование бисопролола,карведилола, метопролола сукцината и небиволола мож-но начать с третьей ступени. Между последним приемоматенолола или метопролола тартрата и первым приемомрекомендованного β-АБ, на который переводится боль-ной, должно пройти 12 часов. В дальнейшем титрованиедоз рекомендованных β-АБ проходит по обычным принципам – увеличение доз каждые 2 недели, а при гипото-нии и нестабильном состоянии 1 раз в 4 недели.
В первые две недели лечения β-АБ возможно снижение сердечного выброса и обострение симптомов ХСН,что требует тщательного контроля. В этих случаях реко-мендуется:
A) некоторое увеличение дозы диуретиков,
B) увеличение (если возможно) дозы иАПФ,
C) применение положительных инотропных препаратов(малых доз сердечных гликозидов или сенситизаторовкальция – левосимендана), гемодинамический эффекткоторого в отличие от добутамина и допамина не зави-сит от степени блокады β-адренорецепторов[290],
D) более медленное титрование дозы β-АБ.
В случаях обострения ХСН на фоне длительного приема β-АБ следует попытаться оптимизировать другуютерапию (диуретики, иАПФ, сердечные гликозиды), сни-зить дозу β-АБ, избегая его полной отмены. Отмена β-АБможет приводить к ухудшению течения ХСН, поэтомудолжна производиться лишь при невозможности продол-жить лечение в соответствии с принципами, указаннымивыше [291]. После стабилизации состояния лечение β-АБдолжно быть возобновлено, начиная с меньших доз [292].В исследовании B-CONVINCE было доказано, что отме-на β-АБ в случаях обострения ХСН не приводит к улуч-шению прогноза, а возврат к оптимальному применениюэтого класса лекарств лишь затягивается [293].
Противопоказания к назначению β-АБ при СН:
A) бронхиальная астма и тяжелая степень ХОБЛ,
B) симптомная брадикардия (<50 уд / мин),
C) симптомная гипотония (<85 мм рт. ст.),
D) атрио-вентрикулярная блокада II и более степени,
E) тяжелый облитерирующий эндартериит и атероскле-роз нижних конечностей.
Наличие хронического обструктивного бронхита,осложняющего течение ХСН, не является абсолютнымпротивопоказанием к назначению β-АБ. Во всех случаяхнеобходимо сделать попытку к их назначению, начинаяс малых доз и придерживаясь медленного титрования.Лишь при обострении симптомов бронхообструкциина фоне лечения β-АБ от их применения придется отказать-ся. Средством выбора в такой ситуации является использование высокоселективных β1-блокаторов бисопрололаили небиволола (степень доказанности В) [294, 295].
При сочетании ХСН и СД 2 типа назначение β-АБабсолютно показано. Все положительные свойства препа-ратов этого класса полностью сохраняются. Препаратомвыбора в таких ситуациях является карведилол, которыйв отличие от всех других β-АБ даже улучшает чувствитель-ность периферических тканей к инсулину (класс реко-мендаций IIA, степень доказанности А) [296]. Имеютсяданные и о позитивном влиянии небиволола на инсулино-резистентность [297, 298].
Таким образом, β-АБ применяются у всех больныхХСН II–IV ФК с ФВ ЛЖ <40 % для снижения риска смер-ти и повторных госпитализаций и вместе с иАПФ (АРА)и АМКР (класс рекомендаций I, уровень доказанности А).
Ивабрадин при непереносимости β-АБу больных ХСН II–IV ФК со сниженнойФВ ЛЖ и синусовым ритмом с ЧСС более70 уд / мин
Терапия β-АБ, как указано в предыдущем разделе,должна быть иниицирована всем больным ХСН. К сожалению, не все пациенты способны без осложнений принимать препараты этой группы. В исследовании SHIFT,где все врачи должны были предпринять попытку лечения β-АБ, около 10 % пациентов из 6 558 не смогли пере-носить терапию β-АБ [299].
Этим больным, имевшим синусовый ритм и среднююЧСС 80 уд / мин (по условиям включения в исследованиеЧСС должна была быть более 70 уд / мин), назначался препарат ивабрадин в сравнении с плацебо. Ивабрадин – селективный блокатор f-каналов (If -токов) в клетках синусового узла, урежающий ЧСС без других гемодинамических эффектов [300, 301]. В результате риск первичной конечнойточки (время до сердечно-сосудистой смерти или госпита-лизации в связи с обострением ХСН) достоверно снижалсяна 29 % при отсутствии серьезных побочных реакций [299].
Учитывая относительно небольшое количество наблю-дений (около 700 больных) и ретроспективный характерпроведенного анализа, следует признать невысокий уровень доказанности положения о применении ивабрадинабольным, не переносящим терапию β-АБ в случаях сину-сового ритма с ЧСС более 70 уд / мин у пациентов с ХСН. С другой стороны, при истинной непереносимости β-АБименно ивабрадин остается средством положительноговлияния на заболеаваемость и смертность в указаннойгруппе больных ХСН. Таким образом, положение о том,что ивабрадин должен применяться у больных ХСН II–IVс ФВ ЛЖ <40 % для снижения риска суммы смертей плюсгоспитализаций из-за ХСН c синусовым ритмом, ЧСС>70 уд / мин при непереносимости β-АБ имеет класс IIA,уровень доказанности С.
Антагонисты минералокортикоидныхрецепторов (АМКР)
Негативная роль вторичного альдостеронизмапри ХСН известна давно. Долгое время высокий уровеньмнералокортикоидного гормона альдостерона связы-вался с задержкой жидкости в организме и стимулиро-ванием электролитного дисбаланса с задержкой в орга-низме натрия и потерей калия. Поэтому с середины 60-хгодов XX века на протяжении почти полувека спироно-лактон в дозах 100–300 мг / сут успешно применялсяв комплексной диуретической терапии тяжелой ХСН,как калийсберегающий диуретик [168, 268, 302, 303].Показанием к такому использованию препарата являет-ся наличие декомпенсированной ХСН, гипергидратациии необходимости лечения активными диуретиками, кото-рые могут провоцировать избыточную потерю калия.Именно в качестве надежного партнера тиазидных и пет-левых диуретиков следует рассматривать назначение спи-ронолактона в период достижения компенсации (особен-но у пациентов с ХСН III–IV ФК). В этих случаях приме-нение спиронолактона абсолютно необходимо и можноне бояться сочетания его высоких доз с иАПФ или АРА,если параллельно правильно используются активные диу-ретики и достигается положительный диурез. Однакопосле достижения состояния компенсации (дни, неделитерапии) применение высоких доз спиронолактона пре-кращается и может рассматриваться вопрос о длительномназначении невысоких доз препарата в качестве дополни-тельного нейрогормонального модулятора [168, 268].
При обострении явлений декомпенсации спиро-нолактон используется в высоких дозах (100–300 мгили 4–12 таблеток, назначаемых однократно утромили в два приема – утром и в обед) на период 1–3 недельдо достижения компенсации. После этого доза спиро-нолактона должна быть уменьшена. Критериями эффек-тивности применения спиронолактона в комплексномлечении упорного отечного синдрома являются:A) увеличение диуреза в пределах 20–25 % (это хотяи немного, но особенно важно при упорных рефрак-терных отеках);B) уменьшение жажды, сухости во рту и исчезновениеспецифического «печеночного» запаха изо рта;C) стабильная концентрация калия и магния в плазме(отсутствие снижения), несмотря на достижениеположительного диуреза.
Нужно помнить, что концентрация спиронолакто-на в плазме крови выходит на плато к 3-му дню леченияи после отмены (или уменьшения дозы препарата) егоконцентрация и действие пропадают (снижаются) черезтрое суток.
Сложный период в «жизни» спиронолактона насту-пил после появления в практике иАПФ, которые в началь-ном периоде лечения снижают синтез альдостеронав организме. Поэтому появились рекомендации о нежела-тельном сочетании иАПФ и спиронолактона при леченииХСН, т. к. это могло быть чревато развитием гиперкалие-мии и ухудшением функции почек [290, 304, 305]. Однаковыяснилось, что ни иАПФ, ни АРА, ни β-АБ, ни сочетаниеиАПФ с β-АБ и даже тройная комбинация иАПФ+АРА+β-АБ не могут в течение длительного времени блокиро-вать синтез альдостерона [306, 307]. Поэтому не реко-мендуется лишь сочетание больших доз спиронолактонаи высоких доз иАПФ при длительном лечении ХСН и тре-буется тщательный контроль уровня калия (на начальномэтапе лечения один раз в месяц) и функции почек (СКФи уровень креатинина) [308, 309].
Исследования 90-х годов прошлого века и началаXXI века доказали, что негативная роль гиперальдосте-ронизма при ХСН связана не только с задержкой жид-кости и электролитным дисбалансом, но и с развитиемфиброза миокарда, прогрессирующим ухудшением функ-ции сердца, риском жизнеугрожающих аритмий и про-воцированием коронарной недостаточности. Учитываяневозможность эффективной блокады синтеза альдосте-рона с помощью комбинации иАПФ с β-АБ, была сдела-на попытка длительного применения малых доз АМКРв продолжительном лечении ХСН в качестве третьегонейрогормонального модулятора.
В исследовании RALES впервые было показано,что назначение 12,5–50 мг / сут (в среднем 27 мг) АМКР спиронолактона больным ХСН III–IV ФК в дополнение к оптимальной терапии, включавшей иАПФ и у 10 %пациентов β-АБ, позволяло достоверно снижать рисксмерти на 27 %, причем как внезапной, так и связаннойс обострением декомпенсации [310]. Это было первым обоснованием целесообразности сочетания трех ней-рогормональных модуляторов (иАПФ + β-АБ + АМКР)для лечения больных тяжелой ХСН III–IV ФК, что нашлоотражение в Рекомендациях ОССН по лечению ХСН ужев первой редакции 2003 года.
Вопрос о применении малых доз АМКР в комбинациис другими нейрогормональными модуляторами для лечения больных с начальными стадиями ХСН (I–II ФК)оставался открытым. Эффективность спиронолактонавступала в противоречие с его недостаточной безопасно-стью – развитием гинекомастии или аменореи (до 10 %),гиперкалиемии (до 20 %) и ухудшением функции почек,частота которых нарастает параллельно увеличению доз.Следует помнить, что при наличии повышенного уров-ня креатинина сыворотки (>130 мкмоль / л), почечнойнедостаточности в анамнезе, при снижении СКФ менее60 мл / мин, гиперкалиемии (причем даже умеренной –>5,2 ммоль / л) сочетание антагонистов альдостеронас иАПФ требует тщательного клинического и лаборатор-ного контроля [250–252]. При таких ситуациях долженбыть предусмотрен контроль уровней калия и креатини-на плазмы и рассчет скорости клубочковой фильтрациичерез 2 и 4 недели лечения, затем через 2 и 3 месяца лече-ния, а потом 1 раз в полгода. Это позволяет минимизиро-вать число побочных реакций [133, 310].
Ситуация изменилась с появлением в клиническойпрактике нового высокоселективного АМКР эплерено-на, не оказывающего влияния на андрогеновые и проге-стероновые рецепторы и не вызывающего гинекомастии,нарушений менструального цикла и реже провоцирую-щего ухудшение функции почек и гиперкалиемию в срав-нении со спиронолактоном.
Первое крупное исследование EPHESUS продемон-стрировало, что применение АМКР эплеренона в дозах25–50 мг / сут у больных, перенесших ОИМ и имеющихдисфункцию ЛЖ (ФВ ЛЖ <40 %) и в 90 % симптомыХСН, позволяет снизить риск общей смертности на 15 %и внезапной смерти на 21 % [133]. Причем достовер-ное положительное влияние эплеренона на риск общейи внезапной смерти регистрируется уже к 30‑му днютерапии [311]. Наибольший эффект терапии отмечалсяв группе лечения пациентов с ФВ ЛЖ <30 % и симпто-мами ХСН [312]. В этой группе назначение эплеренонавсего 35 больным позволяло предотвратить одну внезап-ную смерть и лишь 23 – одну смерть по любой причине.При этом отмечена высокая безопасность лечения. Хотяувеличение серьезной гиперкалиемии (>6 ммоль / л)было достоверным, составило 1,6 % в сравнении с плаце-бо, терапия эплереноном ассоциировалась с уменьшени-ем частоты гипокалиемии на 4,7 % [133].
Полученные результаты стимулировали специаль-ное исследование по применению АМКР эплеренонау больных с подтвержденной ХСН II ФК со сниженной ФВ ЛЖ <35 %, находившихся на терапии блокаторамиРААС (96,5 %) и β-АБ (86,7 %), получивших акронимEMPHASIS–HF [313]. Применение АМКР эплерено-на в качестве третьего нейрогормонального модуляторав течение в среднем 21 месяца сопровождалось достовер-ным снижением риска первичной конечной точки (сер-дечно-сосудистая смертность плюс госпитализации из-заобострения ХСН) на 37 % и риска общей смертностина 24 % (33 больных необходимо было пролечить эплере-ноном для предотвращения одного летального исхода).Эплеренон отлично зарекомендовал себя и в длительнойтерапии ХСН, снижая на 42 % риск повторных госпитали-заций в связи с обострением декомпенсации (при назна-чении препарата 14 пациентам удается предотвратитьодну госпитализацию). И важной находкой этого иссле-дования явился тот факт, что в средней дозе 39,1 мг / сутэплеренон не вызывал достоверного прироста гиперка-лиемии, в том числе и опасной (>6 ммоль / л), и наруше-ния функции почек.
В таблице 21 представлены результаты трех основных исследований с АМКР в лечении ХСН, убедительные результаты которых позволили отнести класс АМКР к основным средствам лечения декомпенсации нарядус иАПФ и β-АБ (класс рекомендаций I, степень доказанности А). Как видно, доказательная база для препаратаэплеренон гораздо большая как по количеству обсле-дованных больных, так и по их разнообразию, включаяпациентов с дисфункцией ЛЖ и начальными стадиямиХСН. Поэтому показанием к применению спиронолактона (25–50 мг) остается выраженная ХСН III–IV ФКи случаи острой декомпенсации кровообращения, когдапрепарат применяется в высоких дозах. При ХСН, начи-ная со II ФК, а у больных, перенесших ОИМ, при дис-фунции ЛЖ показано применение высокоселективногоАМКР эплеренона в дозах 25–50 мг / сут.
Важными свойствами АМКР является способностьуменьшать выраженность фиброза миокарда [314, 315],что сопровождается блокадой ремоделирования серд-ца (уменьшение объемов сердца и уровней МНУП)и ростом ФВ ЛЖ [316–318]. Подобные эффекты позво-ляют проявляться антиаритмическим свойствам АМКР. Эплеренон у больных ХСН II ФК на 42 % снижает рискразвития новой ФП [319]. Кроме того, мета-анализисследований с применением АМКР подтвердил их спо-собность достоверно снижать риск внезапной смертиу больных ХСН [320].
Последний мета-анализ продемонстрировал способ-ность АМКР снижать риск смерти (на 21 %) и госпита-лизаций в связи с обострением декомпенсации (на 38 %)и у больных с более ранней ХСН I–II ФК, однакопри этом в 1,78 раза увеличивается риск гиперкалие-мии [321]. Учитывая небольшое число обследованныхбольных, перенос показаний к использованию АМКРв комплексной терапии ХСН I ФК следует считать преждевременным.
Итак, несмотря на необходимость контроля уров-ня калия при начале лечения, АМКР по праву занимаютместо в списке трех основных групп препаратов, приме-няемых для лечения ХСН (вместе с иАПФ и β-АБ).
Таблица 21. Результаты основных исследований с АМКР при ХСН
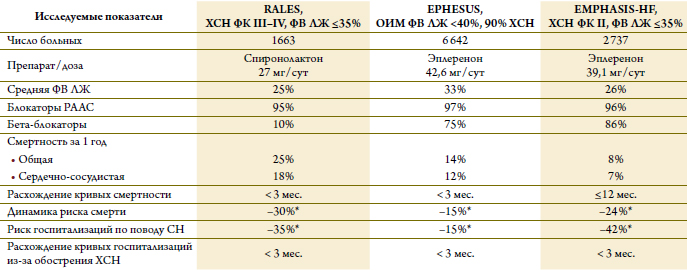 Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые в определенных клинических ситуациях (таблица 22)
Диуретические (мочегонные) средства в лечении ХСН
Задержка жидкости в организме и формирова-ние отечного синдрома являются типичным и наиболее известным проявлением ХСН, начиная со II ФК. Поэтому дегидратационная терапия представляетсобой одну из важнейших составляющих успешного лечения больных ХСН.
Однако необходимо помнить, что в развитии отечного синдрома задействованы сложные нейрогормональные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и «рикошетную» задержкужидкости. То, что характеризуется как отеки и одышка,представляет собой накопление жидкости во внекле-точном пространстве. Поэтому для выделения этойжидкости из организма необходимо осуществлениетрех этапов.
Таблица 22. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способность к снижениюриска смерти и госпитализаций именно при ХСН и применяющиеся в определенных клинических ситуациях)
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые в определенных клинических ситуациях (таблица 22)
Диуретические (мочегонные) средства в лечении ХСН
Задержка жидкости в организме и формирова-ние отечного синдрома являются типичным и наиболее известным проявлением ХСН, начиная со II ФК. Поэтому дегидратационная терапия представляетсобой одну из важнейших составляющих успешного лечения больных ХСН.
Однако необходимо помнить, что в развитии отечного синдрома задействованы сложные нейрогормональные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и «рикошетную» задержкужидкости. То, что характеризуется как отеки и одышка,представляет собой накопление жидкости во внекле-точном пространстве. Поэтому для выделения этойжидкости из организма необходимо осуществлениетрех этапов.
Таблица 22. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способность к снижениюриска смерти и госпитализаций именно при ХСН и применяющиеся в определенных клинических ситуациях)
 На первом этапе избыточная жидкость сначала должна быть переведена из внеклеточного пространства в сосудистое русло. Для осуществления первого этапаис пользуются активные мочегонные средства (диурети-ки), которые за счет снижения объема циркулирующейкрови и гидростатического давления облегчают переходжидкости из внеклеточного пространства в сосудистое русло. На этом этапе эффективно применение гемодинамически активных препаратов (положительные инотроп-ные средства) и особенно нейрогормональных модуля-торов (иАПФ, АРА). Важным подспорьем на этом этапеявляется повышение онкотического (введение препаратов плазмы или альбумина) и осмотического давления(применение АМКР в высоких, «диуретических» дозах,усиливающих ионообмен и уменьшающих выраженностьгипонатриемии разведения).
На втором этапе необходима доставка этой избыточной жидкости к почкам и обеспечение ее фильтрации. На этом этапе эффективно применение препаратов, уси-ливающих почечную фильтрацию. При ФП целесообразно использовать невысокие дозы дигоксина. При гипотонии и синусовом ритме используются положительныеинотропные средства, из которых особо выделяется допамин. За счет влияния на допаминергические рецеп-торы этот препарат увеличивает долю почечного крово-тока. При уровне САД выше 100 мм рт. ст. эффективноприменение эуфиллина.
Третий этап – при попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбциянатрия и воды, что обеспечит избыточное выведение жидкости из организма. Как раз в осуществлении этогоэтапа незаменимыми являются собственно диуретики.
Только при выполнении трех перечисленных условий удастся достичь положительного диуреза и нач-нется процесс дегидратации. Следовательно, диурети-ки выполняют функцию лишь одного из компонентовдегидратационного лечения. Поэтому применениемочегонных препаратов должно быть строго обосно-ванным, обязательно сочетаться с использованиемнейрогормональных модуляторов, таких как иАПФи АМКР, а также препаратов, удерживающих жидкостьв сосудистом русле и улучшающих почечный кровотоки фильтрацию.
Как это ни странно, но серьезных плацебо-контро-лируемых исследований по применению диуретиковпрактически не проводилось (за исключением АМКР),поэтому все положения основываются на мнении экс-пертов. Формально это соответствует степени доказан-ности С, хотя учитывая громадный практический опытпо лечению мочегонными, обоснованность их приме-нения у всех больных ХСН, имеющих гипергидратацию,не вызввает сомнений.
Основные положения дегидратационной терапии, в томчисле применения диуретиков, сводятся к следующему.
Диуретики (мочегонные средства) применяютсядля устранения отечного синдрома и улучшения клини-ческой симптоматики у больных ХСН. При правильномприменении эти средства позволяют уменьшить числогоспитализаций, что соответствует достижению двухиз 6 основных целей при лечении ХСН. Большинстводиуретиков (кроме торасемида) не замедляют прогресси-рования ХСН и не улучшают прогноза больных. Их вли-яние на качество жизни при неправильном назначении(ударные дозы раз в 3–4–5–7 дней) может быть даженегативным [168, 268, 302, 303, 322–324].
Лечение мочегонными средствами начинается лишьпри клинических или инструментальных признакахзастоя (II А стадия, II ФК по классификации ОССН).Впрок мочегонными не лечат, т. к. они, как сказано выше,не замедляют прогрессирования ХСН.
Общие вопросыдегидратационной терапии ХСН
Алгоритм назначения диуретиков (в зависимостиот тяжести ХСН) представляется следующим:
A) I ФК – не лечить мочегонными (0 препаратов)
B) II ФК (без клинических признаков застоя) – малыедозы торасемида (2,5–5 мг) (1 препарат)
C) II ФК (с признаками застоя) – петлевые (тиазидные)диуретики + спиронолактон 100–150 мг (2 препарата)
D) III ФК (поддерживающее лечение) – петлевые диуретики (лучше торасемид) ежедневно в дозах, достаточ-ных для поддержания сбалансированного диуреза +АМКР (25–50 мг / сут) + ингибиторы карбоангидра-зы = ИКАГ (ацетазоламид по 0,25 мг × 3 раза / сутв течение 3–4 дней один раз в 2 недели) (3 препарата)
E) III ФК (декомпенсация) – петлевые диуретики (лучше торасемид) + тиазидные + спиронолактонв дозах 100–300 мг / сут + ИКАГ (4 препарата)
F) IV ФК – петлевые диуретики (торасемид однократ-но или фуросемид дважды в сутки или в / в капельнов высоких дозах) + тиазидные + АМКР + ИКАГ (аце-тазоламид по 0,25 мг × 3 раза / сут в течение 3–4 днейодин раз в 2 недели) + при необходимости механиче-ское удаление жидкости (5 препаратов / воздействий).
Лечение необходимо начинать с малых доз (особен-но у больных, не получавших ранее мочегонных пре-паратов), в последующем подбирая дозу по принципуquantum satis.
Дегидратационная терапия при ХСН имеет две фазы –активную (в период гипергидратации и застоя) и поддер-живающую (для поддержания эуволюмического состоя-ния после достижения компенсации).
В активной фазе превышение количества выделен-ной мочи над количеством принятой жидкости должносоставлять 1–2 литра в сутки при снижении веса еже-дневно ~ по 1 кг. Никакая стремительная дегидратацияне может быть оправданной и лишь приводит к чрезмер-ной гиперактивации нейрогормонов и «рикошетной»задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных. Наиболеечастая ошибка в назначении диуретиков в России:попытка «ударного» диуреза – один раз в несколькодней. Более ошибочную тактику лечения, как с учетомкачества жизни пациента, так и прогрессирования ХСН,трудно представить.
Все активные мочегонные препараты (в том числеи петлевые, и тиазидные) носят название салурети-ков, так как их действие основано на снижении реаб-сорбции натрия и осмотически связанной жидкости.Основными недостатками являются гиперактивацияРААС, приводящая к «рикошетной» задержке жидко-сти, а также электролитные расстройства (гипокалие-мия и гипомагниемия). На третьем месте по значимостиидут метаболические нарушения, вызываемые умень-шением циркулирующей крови (повышение уров-ня глюкозы и ХС), тем более выраженные, чем болееобильным был диурез.
Поэтому применение и петлевых, и тиазидных диу-ретиков всегда должно сочетаться с блокаторами РААС(иАПФ, АРА, АМКР) и калийсберегающими препаратами(АМКР, реже – триамтерен). Важным моментом являетсятот факт, что после обильного диуреза активность РААСсущественно повышается и в ответ на применение иАПФ(или АРА) можно ожидать серьезного снижения АД.Поэтому за исключением экстренных случаев декомпен-сации терапию правильнее начинать с иАПФ (или АРА)с последующим добавлением мочегонных. В этом случаеопасность гиперактивации РААС будет «демпфирована»нейрогормональными модуляторами.
Придерживаясь указанных принципов, можно успешно лечить большинство пациентов с декомпенсацией сер-дечной деятельности и отечным синдромом.
Характеристика основных диуретиков,применяемых при лечении ХСН
Диуретики разделяются на группы соответственно локализации действия в нефроне.
На проксимальные канальцы действуют слабейшие из мочегонных – ингибиторы карбоангидразы (ацетозоламид). На кортикаль-ную часть восходящего колена петли Генле и начальнуючасть дистальных канальцев – тиазидные и тиазидопо-добные диуретики (гипотиазид, индапамид, хлортали-дон). На все восходящее колено петли Генле – самыемощные петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид). На дистальные каналь-цы – конкурентные (спиронолактон) и неконкурентные(триамтерен) антагонисты альдостерона, относящиесяк группе калийсберегающих мочегонных [168, 268, 302,303, 322–324].
В таблице 23 приведены основные показания к назначению, стартовые и максимальные дозировки, а также продолжительность действия мочегонных препаратов,наиболее часто используемых в лечении ХСН. Основнуюроль в лечении отечного синдрома у больных ХСН игра-ют петлевые и тиазидные диуретики.
Петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид) – самые эффективные мочегонные, блокирующие реабсорбцию натрияна всем протяжении восходящей части петли Генлеи сохраняющие активность даже при ХПН и фильтра-ции >5 мл / мин. Иными словами, они эффективны даже при явлениях почечной недостаточности. На сегодняименно петлевые диуретики – основа лечения отечногосиндрома при ХСН.
Таблица 23. Показания, дозировки и продолжительность действия диуретиков при лечении больных ХСН
На первом этапе избыточная жидкость сначала должна быть переведена из внеклеточного пространства в сосудистое русло. Для осуществления первого этапаис пользуются активные мочегонные средства (диурети-ки), которые за счет снижения объема циркулирующейкрови и гидростатического давления облегчают переходжидкости из внеклеточного пространства в сосудистое русло. На этом этапе эффективно применение гемодинамически активных препаратов (положительные инотроп-ные средства) и особенно нейрогормональных модуля-торов (иАПФ, АРА). Важным подспорьем на этом этапеявляется повышение онкотического (введение препаратов плазмы или альбумина) и осмотического давления(применение АМКР в высоких, «диуретических» дозах,усиливающих ионообмен и уменьшающих выраженностьгипонатриемии разведения).
На втором этапе необходима доставка этой избыточной жидкости к почкам и обеспечение ее фильтрации. На этом этапе эффективно применение препаратов, уси-ливающих почечную фильтрацию. При ФП целесообразно использовать невысокие дозы дигоксина. При гипотонии и синусовом ритме используются положительныеинотропные средства, из которых особо выделяется допамин. За счет влияния на допаминергические рецеп-торы этот препарат увеличивает долю почечного крово-тока. При уровне САД выше 100 мм рт. ст. эффективноприменение эуфиллина.
Третий этап – при попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбциянатрия и воды, что обеспечит избыточное выведение жидкости из организма. Как раз в осуществлении этогоэтапа незаменимыми являются собственно диуретики.
Только при выполнении трех перечисленных условий удастся достичь положительного диуреза и нач-нется процесс дегидратации. Следовательно, диурети-ки выполняют функцию лишь одного из компонентовдегидратационного лечения. Поэтому применениемочегонных препаратов должно быть строго обосно-ванным, обязательно сочетаться с использованиемнейрогормональных модуляторов, таких как иАПФи АМКР, а также препаратов, удерживающих жидкостьв сосудистом русле и улучшающих почечный кровотоки фильтрацию.
Как это ни странно, но серьезных плацебо-контро-лируемых исследований по применению диуретиковпрактически не проводилось (за исключением АМКР),поэтому все положения основываются на мнении экс-пертов. Формально это соответствует степени доказан-ности С, хотя учитывая громадный практический опытпо лечению мочегонными, обоснованность их приме-нения у всех больных ХСН, имеющих гипергидратацию,не вызввает сомнений.
Основные положения дегидратационной терапии, в томчисле применения диуретиков, сводятся к следующему.
Диуретики (мочегонные средства) применяютсядля устранения отечного синдрома и улучшения клини-ческой симптоматики у больных ХСН. При правильномприменении эти средства позволяют уменьшить числогоспитализаций, что соответствует достижению двухиз 6 основных целей при лечении ХСН. Большинстводиуретиков (кроме торасемида) не замедляют прогресси-рования ХСН и не улучшают прогноза больных. Их вли-яние на качество жизни при неправильном назначении(ударные дозы раз в 3–4–5–7 дней) может быть даженегативным [168, 268, 302, 303, 322–324].
Лечение мочегонными средствами начинается лишьпри клинических или инструментальных признакахзастоя (II А стадия, II ФК по классификации ОССН).Впрок мочегонными не лечат, т. к. они, как сказано выше,не замедляют прогрессирования ХСН.
Общие вопросыдегидратационной терапии ХСН
Алгоритм назначения диуретиков (в зависимостиот тяжести ХСН) представляется следующим:
A) I ФК – не лечить мочегонными (0 препаратов)
B) II ФК (без клинических признаков застоя) – малыедозы торасемида (2,5–5 мг) (1 препарат)
C) II ФК (с признаками застоя) – петлевые (тиазидные)диуретики + спиронолактон 100–150 мг (2 препарата)
D) III ФК (поддерживающее лечение) – петлевые диуретики (лучше торасемид) ежедневно в дозах, достаточ-ных для поддержания сбалансированного диуреза +АМКР (25–50 мг / сут) + ингибиторы карбоангидра-зы = ИКАГ (ацетазоламид по 0,25 мг × 3 раза / сутв течение 3–4 дней один раз в 2 недели) (3 препарата)
E) III ФК (декомпенсация) – петлевые диуретики (лучше торасемид) + тиазидные + спиронолактонв дозах 100–300 мг / сут + ИКАГ (4 препарата)
F) IV ФК – петлевые диуретики (торасемид однократ-но или фуросемид дважды в сутки или в / в капельнов высоких дозах) + тиазидные + АМКР + ИКАГ (аце-тазоламид по 0,25 мг × 3 раза / сут в течение 3–4 днейодин раз в 2 недели) + при необходимости механиче-ское удаление жидкости (5 препаратов / воздействий).
Лечение необходимо начинать с малых доз (особен-но у больных, не получавших ранее мочегонных пре-паратов), в последующем подбирая дозу по принципуquantum satis.
Дегидратационная терапия при ХСН имеет две фазы –активную (в период гипергидратации и застоя) и поддер-живающую (для поддержания эуволюмического состоя-ния после достижения компенсации).
В активной фазе превышение количества выделен-ной мочи над количеством принятой жидкости должносоставлять 1–2 литра в сутки при снижении веса еже-дневно ~ по 1 кг. Никакая стремительная дегидратацияне может быть оправданной и лишь приводит к чрезмер-ной гиперактивации нейрогормонов и «рикошетной»задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных. Наиболеечастая ошибка в назначении диуретиков в России:попытка «ударного» диуреза – один раз в несколькодней. Более ошибочную тактику лечения, как с учетомкачества жизни пациента, так и прогрессирования ХСН,трудно представить.
Все активные мочегонные препараты (в том числеи петлевые, и тиазидные) носят название салурети-ков, так как их действие основано на снижении реаб-сорбции натрия и осмотически связанной жидкости.Основными недостатками являются гиперактивацияРААС, приводящая к «рикошетной» задержке жидко-сти, а также электролитные расстройства (гипокалие-мия и гипомагниемия). На третьем месте по значимостиидут метаболические нарушения, вызываемые умень-шением циркулирующей крови (повышение уров-ня глюкозы и ХС), тем более выраженные, чем болееобильным был диурез.
Поэтому применение и петлевых, и тиазидных диу-ретиков всегда должно сочетаться с блокаторами РААС(иАПФ, АРА, АМКР) и калийсберегающими препаратами(АМКР, реже – триамтерен). Важным моментом являетсятот факт, что после обильного диуреза активность РААСсущественно повышается и в ответ на применение иАПФ(или АРА) можно ожидать серьезного снижения АД.Поэтому за исключением экстренных случаев декомпен-сации терапию правильнее начинать с иАПФ (или АРА)с последующим добавлением мочегонных. В этом случаеопасность гиперактивации РААС будет «демпфирована»нейрогормональными модуляторами.
Придерживаясь указанных принципов, можно успешно лечить большинство пациентов с декомпенсацией сер-дечной деятельности и отечным синдромом.
Характеристика основных диуретиков,применяемых при лечении ХСН
Диуретики разделяются на группы соответственно локализации действия в нефроне.
На проксимальные канальцы действуют слабейшие из мочегонных – ингибиторы карбоангидразы (ацетозоламид). На кортикаль-ную часть восходящего колена петли Генле и начальнуючасть дистальных канальцев – тиазидные и тиазидопо-добные диуретики (гипотиазид, индапамид, хлортали-дон). На все восходящее колено петли Генле – самыемощные петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид). На дистальные каналь-цы – конкурентные (спиронолактон) и неконкурентные(триамтерен) антагонисты альдостерона, относящиесяк группе калийсберегающих мочегонных [168, 268, 302,303, 322–324].
В таблице 23 приведены основные показания к назначению, стартовые и максимальные дозировки, а также продолжительность действия мочегонных препаратов,наиболее часто используемых в лечении ХСН. Основнуюроль в лечении отечного синдрома у больных ХСН игра-ют петлевые и тиазидные диуретики.
Петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид) – самые эффективные мочегонные, блокирующие реабсорбцию натрияна всем протяжении восходящей части петли Генлеи сохраняющие активность даже при ХПН и фильтра-ции >5 мл / мин. Иными словами, они эффективны даже при явлениях почечной недостаточности. На сегодняименно петлевые диуретики – основа лечения отечногосиндрома при ХСН.
Таблица 23. Показания, дозировки и продолжительность действия диуретиков при лечении больных ХСН
 Лидером в лечении отечного синдрома на протя-жении более 50 лет является фуросемид [325, 326].Препарат применяется как в виде внутривенных инъекций(особенно при обострениях ХСН), так и в видетаблеток для длительного поддерживающего леченияпациентов со II–IV ФК ХСН. Дозы фуросемида – старто-вая обычно 20–40 мг, максимальная до 500–600 мг (хотяимеются сведения об использовании доз до 1800 мг / сут).Диуретический эффект препарата длится 6–8 часов, поэ-тому сегодня для лечения наиболее тяжелых пациентовможет быть рекомендовано двукратное (а в критическихсостояниях и длительное, иногда 24-часовое, внутривен-ное капельное введение) в сутки применение фуросеми-да, как альтернатива увеличению однократной дозы [324,327]. С формальной точки зрения двукратное назначе-ние фуросемида наиболее обосновано для лечения ХСН,однако с практической (диурез в ночные часы после вто-рой дозы препарата) выполнимо лишь у больных СН III–IV ФК с рефрактерным отечным синдромом. Наиболеесерьезными побочными реакциями на лечение фуросе-мидом можно считать гипокалиемию и гипомагниемию,повышение активности РААС, гипергликемию и увели-чение уровня ХС. Выход из положения – применениеадекватных доз и сочетание с блокаторами РААС (иАПФ,АРА), особенно с АМКР, позволяющими предотвращатьэлектролитные нарушения [268, 324].
Этакриновая кислота (стартовая доза 25–50 мг / сут,максимальная до 250 мг) по диуретическим свойстваммало отличается от фуросемида, хотя по химическойструктуре это единственный диуретик, не содержащийв молекуле остатков сульфомоильной кислоты. Поэтомупри привыкании и снижении эффективности фуросемида(или торасемида) может быть обоснован временный пере-вод «диуретикзависимых» больных на прием этакриновойкислоты. Как и фуросемид, этакриновая кислота обладаеткоротким периодом полувыведения, что невыгодно и тре-бует, как минимум, двукратного назначения препарата.
Аналогичными с фуросемидом и этакриновой кисло-той диуретическими свойствами обладает и буметанид(стартовая доза 0,5–1,0 мг, максимальная – до 10 мг),но он является самым короткодействующим петлевымдиуретиком, что снижает обоснованность его использо-вания в лечении ХСН.
Торасемид – самый эффективный и безопасный петлевойдиуретик с оптимальным фармакокинетическим про-филем. Стартовая доза препарата 2,5–5 мг, которая при необ-ходимости может быть увеличена до 100–200 мг в сутки.
Торасемид – типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей частипетли Генле. По фармакокинетическим свойствам он пре-восходит фуросемид (длительность эффекта до 18 часов),имеет лучшую и предсказуемую всасываемость по срав-нению с фуросемидом (90 % против 50 %), причем егобиоусвояемость не зависит от приема пищи и почтивдвое выше, чем у фуросемида [323, 328].
При почечной недостаточности период полувыведенияторасемидане изменяется (метаболизм в печени = 80 %) [329]. Но главным положительным отличием торасемидаот других петлевых диуретиков являются его дополни-тельные эффекты, в частности, связанные с одновремен-ной блокадой РААС.
Доказан дозозависимый блокирующий эффект торасе-мида на стимулируемый АII вход кальция в клетки [330].
В многочисленных исследованиях показаны антиаль-достероновые эффекты торасемида, сопровождающиесядостоверным уменьшением фиброза миокарда и параллель-ным улучшением диастолических свойств миокарда [331].
Более того, имеются сведения и об антиадренергиче-ских эффектах препарата [332].
Таким образом, торасемид – первый диуретик, спо-собный не только влиять на симптоматику больных ХСН,но и на прогрессирование болезни и течение патологиче-ских процессов в сердечной мышце. В недавних россий-ских исследованиях была подтверждена способность тора-семида влиять на ремоделирование ЛЖ и нормализоватьсоотношение маркеров синтеза / распада коллагена [333].
Кроме того, применение торасемида позволяет пре-одолевать основные недостатки активной диуретическойтерапии: усиливается собственно мочегонное действиеи блокируются побочные эффекты (электролитные нару-шения и активация РААС).
В сравнительных контролируемых исследованияхс фуросемидом торасемид продемонстрировал болеевысокую клиническую эффективность и переносимость[334], а также способность уменьшать число повтор-ных госпитализаций в связи с обострением ХСН [335].Длительный плавный диурез (14–18 часов в сравнениис 4–5 часами для фуросемида) позволяет пациенту бытьмобильным, что существенно увеличивает привержен-ность к лечению. В российском многоцентровом исследо-вании ДУЭЛЬ торасемид превосходил фуросемид в ско-рости достижения компенсации, максимуме эффектаи вызывал минимальное количество побочных эффектов,в том числе метаболических и электролитных (0,3 % про-тив 4,2 % на фуросемиде) [336].
В исследовании TORIC торасемид продемонстриро-вал способность лучше влиять на прогноз больных ХСН,что делает этот современный мочегонный препарат сред-ством выбора, в особенности при длительном леченииклинически выраженной декомпенсации (уровень дока-занности В) [337]. Поэтому торасемид обоснованно счи-тается, по мнению АКК / ААС, диуретическим препара-том первого выбора в лечении больных ХСН [4].
Тиазидные диуретики (гипотиазид) нарушают реаб-сорбцию натрия в кортикальном сегменте восходящейчасти петли Генле и в начальной части дистальных каналь-цев. Повышают диурез и натрийурез на 30–50 %, эффек-тивны при уровне фильтрации более 30–50 мл / мин.Поэтому при почечной недостаточности их примене-ние бесполезно.
Гидрохлортиазид (гипотиазид) – основной пред-ставитель класса тиазидных диуретиков, применяет-ся, как правило, у больных умеренной ХСН (II ФК).Стартовая доза препарата 25 мг, максимальная 200 мг,поскольку при ее превышении диуретический эффектувеличивается минимально, а риск типичных побоч-ных явлений существенно возрастает. Следует помнить,что гипотиазид при всех своих положительных эффектах –препарат, требующий аккуратного и правильного приме-нения во избежание серьезных нежелательных явленийи для достижения оптимального эффекта на протяжениисуток требует двукратного применения.
Индапамид по профилю безопасности существеннопревосходит гипотиазид, однако данных по его приме-нению в лечении ХСН в настоящее время недостаточно.Еще один представитель этого класса диуретиков – хлор-талидон обычно используется в лечении больных АГ. Но,как и индапамид, может быть применен у пациентовс начальными стадиями ХСН, при сохранной фильтраци-онной функции почек.
К сожалению, в России не зарегистрирован самыйсильный из современных тиазидных диуретиков – мето-лазон (дозы от 2,5 до 10 мг), который в США рассматри-вается, как основное дополнение к петлевым диуретикампри рефрактерном отечном синдроме.
Ингибиторы карбоангидразы (ИКАГ), как сле-дует из их названия, блокируют фермент карбоанги-дразу в области проксимальных почечных канальцев,что сопровождается незначительным диурезом (при-рост до 10–15 %). Как самостоятельные диуретики,ингибиторы карбоангидразы в лечении ХСН почтине применяются из-за недостаточного диуретическо-го действия, однако усиливают «загрузку» натриемнижележащих отделов канальцев, что повышает эффек-тивность более сильных диуретиков. При истощениифермента карбоангидразы через 3–4 дня непрерывногоприменения активность ацетазоламида падает, что тре-бует перерыва в лечении.
Поэтому ацетазоламид используется в качествевспомогательного средства на фоне приема актив-ных мочегонных (тиазидных и / или петлевых).Назначаемый в дозе 0,25 мг трижды в день в течение3–4 дней с двухнедельным перерывом, этот препаратподкисляет среду, что восстанавливает диуретиче-скую активность тиазидных и петлевых диуретиков,при длительном применении которых типично раз-витие алкалоза. Обязательным считается сочетаниеактивных диуретиков и ацетазоламида у больных ХСНи сопутствующей легочной патологией (уровень дока-занности В) [338].
Кроме того, имеются сведения, что применение ацета-золамида в дозе 0,25 мг за 1 час до отхода ко сну позволя-ет уменьшить степень ночного апноэ, способного ослож-нять течение болезни у 40 % больных ХСН (уровень дока-занности С) [339, 340].
АМКР в высоких дозах (как правило, спиронолак-тон) применяются в качестве калийсберегающих пре-паратов вместе с активными мочегонными.
Другие калийсберегающие препараты (триамтерен)в настоящее время используются редко и лишь при непе-реносимости АМКР.
Рефрактерный отечный синдром
В ряде случаев может развиваться толерантностьк дегидратационному лечению, в частности, к использо-ванию диуретиков.11.1.2.1.3.2Рефрактерность бывает ранняя (так называемое тор-можение эффекта) и поздняя.
Ранняя рефрактерность развивается в первые часыили дни после начала активного назначения мочегон-ных средств, зависит от гиперактивации нейрогормонови тем сильнее, чем активнее дегидратация (тот самыйнерекомендуемый обильный диурез). Преодолеваетсяадекватным (не чрезмерным) диурезом (особенно редкоэто осложнение развивается при назначении торасеми-да) плюс обязательным совместным применением иАПФи / или спиронолактона.
Поздняя рефрактерность развивается спустя неделии месяцы постоянной диуретической терапии и связанас гипертрофией апикальных клеток почечных каналь-цев, где как раз и действуют диуретики. Бороться с этимвидом рефрактерности сложнее. Требуется периодиче-ская (один раз в 3–4 недели) смена активных диуретикови их комбинация с иАПФ. В этих случаях предпочтитель-но применение торасемида.
Как же поступать при рефрактерном отечном синдро-ме, когда пациенту требуется экстренная дегидратация?Существуют относительно простые приемы преодоле-ния устойчивости к использованию мочегонных средств.
A) Применение диуретиков (лучше предпочесть тора-семид) только на фоне иАПФ и спиронолактона. Этоглавное условие успеха.
B) Введение большой (вдвое бóльшей, чем предыдущаянеэффективная доза) дозы диуретика и только вну-тривенно.
C) Некоторые авторы предлагают вводить фуросемид(лазикс) дважды в сутки и даже постоянно внутри-венно капельно [327].
D) Сочетание диуретиков с препаратами, улучшающимифильтрацию. При САД более 100 мм рт. ст. – эуфил-лин (10 мл 2,4 % раствора внутривенно капельнои сразу после капельницы – внутривенно лазикс)или сердечные гликозиды, при более низком АД –допамин (2–5 мкг / мин). Завершившееся в 2009 годуисследование DAD–HF продемонстрировало, чтоинфузия допамина (5 мкг / кг / мин) позволяла в 4 разаснизить дозу фуросемида при сохранении диурезаи сохранении функции почек [341].
E) Применение диуретиков с альбумином или плазмой(можно вместе, что особенно важно при гипопроте-инемии, но эффективно и у пациентов с нормальнымуровнем белка плазмы).
F) При выраженной гипотонии – комбинация с поло-жительными инотропными средствами (левосимен-дан, добутамин, допамин) и, в крайнем случае, с глю-кокортикоидами (только на период критическойгипотонии).
G) При САД более 125 мм рт. ст. эффективной можетбыть комбинация с вазодилататорами (нитроглице-рин, нитропруссид натрия), из которых наиболееперспективным выглядит применение серелаксина(в РФ пока не зарегистрирован) [342].
H) Сочетания диуретиков по тем принципам, что указа-ны выше.
I) Механические способы удаления жидкости (плев-ральная, перикардиальная пункции, парацентез)используются лишь по витальным показаниям.
Сердечные гликозиды
Сердечные гликозиды остаются в числе основных средств лечения ХСН в течение более 200 лет.
Гликозиды имеют три основных механизма действия –положительный инотропный, отрицательный хронотроп-ный (имеющий разную физиологическую основу при ФПи синусовом ритме) и нейромодуляторный эффекты. Хотяэто хорошо и давно известный факт, однако повсеместнопрактические врачи считают главным именно положитель-ное инотропное действие гликозидов, что совершенноне обосновано [343–346]. Мощное положительное ино-тропное действие гликозидов проявляется при их приме-нении в высоких дозах (для дигоксина более 0,375 мг / сут).Однако использование высоких (более 0,375 мг) доздигоксина чревато развитием интоксикации и являетсяпредиктором негативного влияния на прогноз больныхХСН [346–348]. Поэтому дигоксин у больных ХСН всег-да должен применяться в малых дозах: до 0,25 мг / сут(для больных с массой тела более 85 кг до 0,375 мг / сут,а при массе тела менее 65 кг – до 0,125 мг / сут). В такихдозировках он действует преимущественно как нейрогор-мональный модулятор, оказывает слабое положительноеинотропное действие и не стимулирует развитие наруше-ний сердечного ритма [344–346].
В настоящее время в клинической практике в подавля-ющем большинстве случаев используется дигоксин, обла-дающий оптимальными фармакодинамическими свой-ствами и доказанной клинической эффективностью [1,4, 6, 8]. Применение других гликозидов для длительноголечения больных ХСН не имеет оснований.
Применение короткодействующих сердечных гли-козидов для внутривенного введения (Строфантин К)крайне ограничено: только в случаях обострения ХСНна фоне тахисистолической формы мерцания предсердий.И даже в этом случае предпочтительным выглядит восста-новление синусового ритма.
Классически дигоксин использовался для лече-ния систолической ХСН. Накоплен богатый клиниче-ский опыт по его успешному применению у пациентовс декомпенсацией. При этом считалось, что препаратнаиболее эффективен у пациентов с ФП, так как, помимоположительного инотропного эффекта, препарат умень-шает ЧСС (как за счет парасимпатической активации, таки в результате отрицательного дромотропного эффекта –замедления проведения импульсов через атрио-вентрику-лярное = A–V соединение) и главное – делает ритм болеерегулярным (устраняет дефицит пульса и число гемоди-намически активных сокращений из-за короткой диасто-лы). В отличие от дигоксина β-АБ, урежая ЧСС при ФП,не «упорядочивают» ритма, т. к. минимально влияютна проведение импульсов через А–V узел. Данные недав-него мета-анализа не продемонстрировали, что β-АБулучшают прогноз пациентов с систолической ХСН и ФП[349]. Это делает еще более актуальным вопрос о возмож-ности урежения ЧСС и снижения смертности у даннойкатегории пациентов при помощи дигоксина. К сожале-нию, как и в случаях с диуретиками, рандомизированныхисследований на эту тему нет. Данные последнего наибо-лее методически правильного ретроспективного анализаисследования AFFIRM, в котором дигоксин применяетсяу пациентов с ФП (не обязательно с ХСН), не выявилидостоверной связи между применением дигоксина и про-гнозом больных [350]. В небольшом, но проспективном(3,3 года) исследовании продемонстрировано достовер-ное снижение риска смерти у больных с декомпенсиро-ванной ХСН, получавших лечение дигоксином [351].
Таким образом, до проведения проспективных кон-тролируемых исследований следует руководствоватьсярекомендациями – дигоксин должен назначаться всембольным ХСН II–IV ФК, с ФВ ЛЖ <40 % при ФП с цельюурежения и упорядочения ритма, возможного улучшенияпрогноза и снижения риска госпитализаций (класс реко-мендаций I, уровень доказанности С).
Применение дигоксина у пациентов с ХСН и сину-совым ритмом было изучено в проспективном исследо-вании DIG, показавшем, что дигокин достоверно снижа-ет риск госпитализаций (на 30 %), но не влияет на рисксмерти.
Особенно эффективно применение дигоксина у паци-ентов с выраженной ХСН III–IV ФК, низкой ФВ ЛЖ<25 % и большими размерами сердца (кардиоторакаль-ный индекс более 55 %) [352].
В этом же исследовании было показано, что исполь-зование низких доз дигоксина (концентрация в плазмедо 0,9 нг / мл) позволяет достоверно снижать риск смертибольных ХСН с синусовым ритмом на 6 % и риск обостре-ний ХСН на 30 %, что делает отказ от применения этогопрепарата в лечении ХСН совершенно не обоснован-ным. Однако при концентрации 0,9–1,1 нг / мл дигоксинне оказывает влияния на прогноз, а при концентрацияхвыше 1,1 нг / мл может провоцировать развитие наруше-ний ритма сердца и увеличение риска смерти [347].
При применении сердечных гликозидов у женщинчаще, чем у мужчин, возникают интоксикация и риск жиз-неугрожающих желудочковых нарушений ритма сердца,что связано с более высокими концентрациями, в част-ности, дигоксина, создающимися в крови при приемеодинаковых доз (исследование DIG). Поэтому рекомендуется назначать им более низкие дозы и контролироватьуровень дигоксина в крови, не превышая концентрацию1,1 нг / мл [348].
При явлениях почечной недостаточности суточнаядоза дигоксина должна быть уменьшена пропорциональноснижению клиренса креатинина и СКФ менее 60 мл / мин.У пожилых больных суточные дозы дигоксина должныбыть снижены до 0,0625–0,125 мг (¼–½ таблетки).
Предпочтительным во всех случаях является соче-тание сердечных гликозидов с β-АБ, при котором лучшеконтролируется ЧСС, снижается риск опасных для жиз-ни желудочковых нарушений ритма сердца и уменьшает-ся опасность обострения коронарной недостаточности.
Таким образом, при ХСН с ФВ ЛЖ <40 % и синусо-вым ритмом применение дигоксина ДОЛЖНО быть рас-смотрено при недостаточной эффективности основныхсредств лечения декомпенсации для уменьшения рискаповторных госпитализаций (класс рекомендаций IIA,уровень доказанности B).
Ивабрадин
Ивабрадин – селективный блокатор If -токов в клет-ках синусового узла, обладает выраженным антиан-гинальным эффектом, не уступающим β-АБ и БМКК[353, 354]. В современных рекомендациях показания-ми к применению ивабрадина у больных ИБС являетсяналичие стенокардии при синусовом ритме с ЧСС более60 уд / мин. [355]. Причем доказан не только эффектмонотерапии ивабрадином, но и дополнительное уве-личение толерантности к нагрузкам при сочетании егос β-АБ [353, 356]. Учитывая, что ИБС является наибо-лее частой причиной дисфункции ЛЖ и в дальнейшемХСН, важной страницей в изучении эффектов ивабра-дина явилось исследование BEAUTIFUL, включившееоколо 11 тыс. пациентов с ИБС и ФВ ЛЖ <40 % (более1300 больных в РФ) [357].
Хотя исследование изучало группу больных с ише-мической дисфункцией ЛЖ, среди обследованных 84 %пациентов имели симптомы ХСН II–III ФК в моментвключения в исследование. В исследовании BEAUTIFULбыло доказано, что пациенты с ИБС и ЧСС более70 уд / мин имеют достоверно более высокий риск смер-ти (на 34 %), ОИМ и обострения ХСН (на 53 %), несмо-тря на проводимую терапию, включавшую у 90 % блока-торы РААС и почти у 90 % пациентов β-АБ. Причем зави-симость между ЧСС и риском обострений ХСН былалинейной, риск плохого прогноза максимально возрасталпри ЧСС выше 90 уд / мин. В исследовании BEAUTIFULприменение комбинации ивабрадина с β-АБ у больныхХСН и средней исходной ЧСС 78 уд / мин не снижа-ло достоверно риска смерти и обострений ХСН (рискпоследних был на 16 % меньше на фоне лечения ива-брадином). Но в подруппе пациентов с исходной ЧССболее 70 уд / мин отмечено достоверное снижение коро-нарных осложнений (ОИМ на 36 % и необходимостив реваскуляризации на 30 %). Показание к применениюивабрадина у больных ИБС с дисфункцией ЛЖ и ЧССболее 70 уд / мин для предотвращения повторных ОИМи коронарных реваскуляризаций вошло в Российскиерекомендации по лечению ИБС [355].
Для прояснения истинных позиций блокаторовIf -каналов в лечении больных с декомпенсацией былопроведено исследование SHIFT, в котором комбинация ивабрадина с β-АБ (90 % пациентов) исследовалась у 6 500 пациентов с выраженной ХСН ишемическойи неишемической этиологии на синусовом ритме с ЧСС более 70 уд / мин по влиянию на комбинированную точку риск сердечно-сосудистой смертности и госпитализаций в связи с обострением ХСН (более 700 больныхв РФ). Необходимо отметить, что ни о каком сравненииивабрадина с β-АБ речь не шла и всем пациентам должнабыла быть сделана попытка назначения β-АБ и титрова-ния их доз до оптимальных. Основными причинами нена-значения β-АБ или недостижения оптимальной ЧСС яви-лись низкое АД с соответсвующей симптоматикой и обо-стрение ХОБЛ [299].
Результаты исследования продемонстрировали достоверное снижение риска сердечно-сосудистой смерт-ности плюс госпитализаций из-за обострения ХСН (классическаяпервичная точка протоколов с ХСН)на 18 %, при этом назначение ивабрадина 31 больномуХСН предотвращало одно событие. Риск смерти из-заХСН и риск госпитализаций в связи с обострениемдекомпенсации снижались достоверно на 26 % каждыйсоответственно [299]. Важным дополнительным преи-муществом ивабрадина явилось снижение на 25 % рискалюбых госпитализаций (включая повторные), что дела-ет лечение больных ХСН блокатором If -каналов эконо-мически выгодным [358].
Снижение смертности по любым причинам (что не было первичной точкой исследования и даже ком-понентом первичной точки) составило 10 % (р=0,092)в группе больных ХСН с ЧСС >70 уд / мин. Однаков исследовании SHIFT достоверное возрастание риска смерти больных ХСН отмечалось при исходной ЧССболее 75 уд / мин [359], и подгрупповой (запланировантивность ивабрадина у пациентов с ЧСС более 77 уд / мин[299]. Выполненный ретроспективно анализ среди пациентов, включавшихся в исследование SHIFT с исходнойЧСС более 75 уд / мин, подтвердил способность ивабради-на достоверно снижать риск общей (на 17 %) и сердечно-сосудистой смерти (на 17 %) [359]. Это спровоцировалоЕвропейское агентство по контролю за применениемлекарственных препаратов рекомендовать применениеивабрадина у больных ХСН со сниженной ФВ ЛЖ и ЧССболее 75 уд / мин, что является формальным нарушениемпринципов доказательной медицины и не соответствуеткритериям исследования SHIFT. Ассоциация сердечнойнедостаточности Европейского общества кардиологоврекомендует ивабрадин при ЧСС больше 70 уд / мин, но в целях терапии отмечает лишь снижение госпитализа-ций (одного из компонентов первичной точки), что так-же не соответствует реалиям исследования SHIFT [3].
По мнению экспертов ОССН, в полном соответствиис критериями и результатами исследования SHIFT ива-брадин должен быть назначен больным ХСН II–IV ФК,с ФВ ЛЖ <40 % и синусовым ритмом, ЧСС >70 уд / минв дополнение к основной терапии (в том числе β-АБ)для снижения риска суммы смертей плюс госпитали-заций из-за обострения ХСН (класс рекомендаций IIA,уровень доказанности В).
Имеющиеся результаты исследований позволяютрекомендовать достижение ЧСС ниже 60 уд / мин (опти-мальный диапазон 55–60 уд / мин) и степень сниженияне менее 10 уд / мин от исходного, что обеспечиваетмаксимальное снижение риска заболеваемости и смерт-ности у больных ХСН [360]. Среднее снижение рискасмерти больных ХСН, находящихся на синусовом ритме,в расчете на каждые 10 ударов снижения ЧСС на фонетерапии ивабрадином составляет 29 %, что сравнимос эффектами β-АБ [361]. Это позволяет считать сниже-ние ЧСС универсальным механизмом улучшения про-гноза пациентов с ХСН.
Эфиры омега-3 полиненасыщенныхжирных кислот (Омакор)
Одним из наиболее дискутируемых вопросов в лече-нии ССЗ является применение полиненасыщенных жир-ных кислот. Данные последних мета-анализов и проспек-тивных исследований по профилактике ФП и первичнойпрофилактике ССЗ, включая СД, не позволяют надеять-ся на сколько-нибудь выраженный эффект рыбьего жираи приема препаратов, содержащих добавки «морских»омега ненасыщенных жирных кислот.
Однако имеются результаты нескольких крупных ран-домизированных исследований у больных, перенесшихОИМ, и пациентов, имеющих симптомы выраженнойХСН II–IV ФК, с назначением «подготовленной» фор-мы, содержащей эфиры длинноцепочечных омега-3 поли-ненасыщенных жирных кислот (ПНЖК), содержащих46 % эйкозапентаеновой и 38 % докозагексаеновой кислот,по влиянию на твердые конечные точки. Прием такойформы позволяет через 72 часа достоверно повышатьиндекс ω-3 ПНЖК в мембране клеток, что может оказы-вать целый ряд эффектов, основным из которых являетсяантиаритмический, связанный, как показано в экпери-ментальных исследованиях, с:
A) блокадой натрий-кальциевого насоса в кардиомиоцитах,
B) блокадой позднего натриевого тока,
C) блокадой кальциевых каналов L-типа,
D) антагонизмом к рецепторам растяжения (при повы-шенном миокардиальном стрессе),
E) способностью уменьшать образование «пенных кле-ток» и воспаления на поверхности атеросклеротиче-ской бляшки,
F) снижением образования свободных радикалов и умень-шением реперфузионных нарушений,
G) улучшением синтеза энергии в митохондриях,
H) снижением ЧСС (~2 уд / мин) и потребления О2
В самом крупном исследовании GISSI-P (более11 тыс. больных, перенесших ОИМ) назначение 1 г / сутω-3 ПНЖК достоверно снижало риск общей смертина 41 %, причем этот эффект развивался быстро (в тече-ние 90 дней лечения) и был связан с анитифибрилляторнымэффектом и снижением риска аритмической смертина 45 % [362]. Дальнейшее лечение практически не вли-яло на прогноз пациентов, что позволило предположитьналичие выраженного антифибрилляторного эффектаω-3 ПНЖК, который проявлялся тем больше, чем нижебыла ФВ ЛЖ у пациентов, переживших ОИМ [363].В меньших по объему исследованиях либо снижениериска смерти не достигало статистически достоверныхразличий, либо результаты были нейтральными. В послед-нем мета-анализе продемонстрировано, что назначениеω-3 ПНЖК в первые 14 дней после ОИМ ассоцииру-ется с достоверным снижением риска смерти на 32 %,при назначении до 90‑го дня риск смерти снижаетсяна 22 % (все еще статистически значимо), а назначениеэтой терапии более чем через 3 месяца после перенесен-ного ОИМ фактически не влияет на прогноз [364].
В 2008 году в многоцентровом двойном слепом пла-цебо-контролируемом исследовании GISSI–HF Омакор мальной терапии (иАПФ или АРА + β-АБ + антагонистыальдостерона + диуретики + дигоксин). В результатебыло достигнуто достоверное снижение риска общейсмерти больных ХСН на 9 %, р=0,041 (среди закончив-ших исследование на 14 %) и количества госпитализацийна 8 % (в основном связанных с ЖНРС) при длительной(более 18 месяцев) терапии. При этом количество побоч-ных эффектов в группе лечения Омакором не отличалосьот плацебо [365].
Ретроспективный анализ продемонстрировал сни-жение частоты срабатывания ИКД у пациентов, нахо-дившихся на лечении ω-3 ПНЖК, и снижение смерт-ности и госпитализаций в связи с нарушениями ритмасердца [366].
В дополнительном анализе было продемонстрирова-но повышение ФВ ЛЖ на 1,6 % при терапии 1 г / сут ω-3ПНЖК [367].
Позднее в ряде небольших исследований была обна-ружена дозозависимая (1 г / сут против 2 г / сут и 4 г / сут)способность ω-3 ПНЖК положительно влиять на уро-вень провоспалительных цитокинов, улучшать степеньэндотелий-зависимой функции сосудов и увеличивать ФВЛЖ [368]. Это позволяет предположить наличие анти-ремоделирующего эффекта ω-3 ПНЖК у больных ХСН,что вместе с антифибрилляторным действием можетположительно влиять на заболеваемость и смертностьпациентов с декомпенсацией. К примеру, в плацебо-кон-тролируемом исследовании с применением 2 г / сут ома-кора достигалось выраженное снижение числа повтор-ных госпитализаций из-за обострения ХСН [365].
Исходя из изложенных фактов и признавая, чтоне на все вопросы имеются адекватные ответы, а такжене очень выраженный эффект омакора, наступавшийчерез месяцы после начала лечения, показания к его при-менению при ХСН и особенно у пациентов, перенесшихОИМ, вошли во все рекомендации. В Европейских реко-мендациях 2012 года эксперты оценили класс рекомен-даций как IIB (может быть назначен) при уровне дока-занности В. Эксперты ОССН при разделившихся мне-ниях предпочли определить класс рекомендаций, как IIAпри уровне доказанности В. Аналогичная степень обо-снованности использования эфиров ω-3 ПНЖК приня-та в Американских рекомендациях 2013 года.
Таким образом, назначение ω-3 ПНЖК в дозе 1 г / сутдолжно быть рассмотрено у больных ХСН II–IV ФКс ФВ ЛЖ <35 % для снижения риска смерти (в том числевнезапной) и повторных госпитализаций в дополнениек основным средствам лечения ХСН.
Антикоагулянты в лечении больных ХСН
Низкомолекулярные гепариныпри наличии венозных тромбозови высоком риске их развития
Учитывая, что ХСН – это состояние, при которомвозрастает риск тромбоэмболий и инсультов, важ-ную роль в терапии этого синдрома играют антико-агулянты [369, 370]. Причем, по мнению ряда иссле-дователей, само наличие ХСН из-за стаза в полостяхсердца, наблюдаемого при дилатации ЛЖ, являетсяфактором, способствующим развитию как перифери-ческого венозного, так и внутрисердечного тромбо-за, как источника будущих тромбоэмболий [371–374].До 40 % больных с выраженной ХСН имеют призна-ки тромбоза глубоких вен, и у 5,5 % пациентов тром-боэмболии легочной артерии осложняют течениедекомпенсации, причем чем тяжелее ХСН и ниже ФВ,тем более вероятно появление тромбозов и эмболий[375]. Дополнительными факторами являются деги-дратационная терапия (чем обильнее диурез, тем хуже)и нахождение больного на постельном режиме (напри-мер, при декомпенсации) [376].
Доказано, что для предотвращения тромбозов и эмбо-лий у пациентов с ХСН, находящихся на постельномрежиме, эффективным может быть лечение низкомоле-кулярными гепаринами (эноксипарином) по 40 мг / сутв течение 2 недель [377, 378]. При этом риск тромбо-зов и эмболий снижается на 60 % в течение 4‑месяч-ного наблюдения. Аналогичные сведения имеютсяи для дальтепарина, хотя процент снижения осложненийзначительно ниже [379, 380]. Таким образом, при нали-чии венозного тромбоза, высоком риске его развитияи декомпенсации, требующей постельного режимав течение не менее 3 суток, больные ХСН с ФВ ЛЖ <35 %должны получать лечение низкомолекулярными гепари-нами в течение 2 недель (класс рекомендаций IIA, уро-вень доказанности А). Аналогичная степень обоснован-ности использования эфиров омега‑3 ПНЖК принятав Американских рекомендациях 2013 года.
Оральные антикоагулянтыдля предотвращения риска тромбоэмболий
Вопрос о применении оральных антикоагулянтов(ОАКГ) при ХСН можно разделить на две неравные по значимости темы в связи с характером основного ритма сердца. При синусовом ритме каких‑либо серьезных про-спективных исследований не проводилось, и все имею-щиеся сведения касаются только антагонистов витамина К (варфарина).
Таблица 24. Применение оральных антикоагулянтов при ХСН с синусовым ритмом
Лидером в лечении отечного синдрома на протя-жении более 50 лет является фуросемид [325, 326].Препарат применяется как в виде внутривенных инъекций(особенно при обострениях ХСН), так и в видетаблеток для длительного поддерживающего леченияпациентов со II–IV ФК ХСН. Дозы фуросемида – старто-вая обычно 20–40 мг, максимальная до 500–600 мг (хотяимеются сведения об использовании доз до 1800 мг / сут).Диуретический эффект препарата длится 6–8 часов, поэ-тому сегодня для лечения наиболее тяжелых пациентовможет быть рекомендовано двукратное (а в критическихсостояниях и длительное, иногда 24-часовое, внутривен-ное капельное введение) в сутки применение фуросеми-да, как альтернатива увеличению однократной дозы [324,327]. С формальной точки зрения двукратное назначе-ние фуросемида наиболее обосновано для лечения ХСН,однако с практической (диурез в ночные часы после вто-рой дозы препарата) выполнимо лишь у больных СН III–IV ФК с рефрактерным отечным синдромом. Наиболеесерьезными побочными реакциями на лечение фуросе-мидом можно считать гипокалиемию и гипомагниемию,повышение активности РААС, гипергликемию и увели-чение уровня ХС. Выход из положения – применениеадекватных доз и сочетание с блокаторами РААС (иАПФ,АРА), особенно с АМКР, позволяющими предотвращатьэлектролитные нарушения [268, 324].
Этакриновая кислота (стартовая доза 25–50 мг / сут,максимальная до 250 мг) по диуретическим свойстваммало отличается от фуросемида, хотя по химическойструктуре это единственный диуретик, не содержащийв молекуле остатков сульфомоильной кислоты. Поэтомупри привыкании и снижении эффективности фуросемида(или торасемида) может быть обоснован временный пере-вод «диуретикзависимых» больных на прием этакриновойкислоты. Как и фуросемид, этакриновая кислота обладаеткоротким периодом полувыведения, что невыгодно и тре-бует, как минимум, двукратного назначения препарата.
Аналогичными с фуросемидом и этакриновой кисло-той диуретическими свойствами обладает и буметанид(стартовая доза 0,5–1,0 мг, максимальная – до 10 мг),но он является самым короткодействующим петлевымдиуретиком, что снижает обоснованность его использо-вания в лечении ХСН.
Торасемид – самый эффективный и безопасный петлевойдиуретик с оптимальным фармакокинетическим про-филем. Стартовая доза препарата 2,5–5 мг, которая при необ-ходимости может быть увеличена до 100–200 мг в сутки.
Торасемид – типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей частипетли Генле. По фармакокинетическим свойствам он пре-восходит фуросемид (длительность эффекта до 18 часов),имеет лучшую и предсказуемую всасываемость по срав-нению с фуросемидом (90 % против 50 %), причем егобиоусвояемость не зависит от приема пищи и почтивдвое выше, чем у фуросемида [323, 328].
При почечной недостаточности период полувыведенияторасемидане изменяется (метаболизм в печени = 80 %) [329]. Но главным положительным отличием торасемидаот других петлевых диуретиков являются его дополни-тельные эффекты, в частности, связанные с одновремен-ной блокадой РААС.
Доказан дозозависимый блокирующий эффект торасе-мида на стимулируемый АII вход кальция в клетки [330].
В многочисленных исследованиях показаны антиаль-достероновые эффекты торасемида, сопровождающиесядостоверным уменьшением фиброза миокарда и параллель-ным улучшением диастолических свойств миокарда [331].
Более того, имеются сведения и об антиадренергиче-ских эффектах препарата [332].
Таким образом, торасемид – первый диуретик, спо-собный не только влиять на симптоматику больных ХСН,но и на прогрессирование болезни и течение патологиче-ских процессов в сердечной мышце. В недавних россий-ских исследованиях была подтверждена способность тора-семида влиять на ремоделирование ЛЖ и нормализоватьсоотношение маркеров синтеза / распада коллагена [333].
Кроме того, применение торасемида позволяет пре-одолевать основные недостатки активной диуретическойтерапии: усиливается собственно мочегонное действиеи блокируются побочные эффекты (электролитные нару-шения и активация РААС).
В сравнительных контролируемых исследованияхс фуросемидом торасемид продемонстрировал болеевысокую клиническую эффективность и переносимость[334], а также способность уменьшать число повтор-ных госпитализаций в связи с обострением ХСН [335].Длительный плавный диурез (14–18 часов в сравнениис 4–5 часами для фуросемида) позволяет пациенту бытьмобильным, что существенно увеличивает привержен-ность к лечению. В российском многоцентровом исследо-вании ДУЭЛЬ торасемид превосходил фуросемид в ско-рости достижения компенсации, максимуме эффектаи вызывал минимальное количество побочных эффектов,в том числе метаболических и электролитных (0,3 % про-тив 4,2 % на фуросемиде) [336].
В исследовании TORIC торасемид продемонстриро-вал способность лучше влиять на прогноз больных ХСН,что делает этот современный мочегонный препарат сред-ством выбора, в особенности при длительном леченииклинически выраженной декомпенсации (уровень дока-занности В) [337]. Поэтому торасемид обоснованно счи-тается, по мнению АКК / ААС, диуретическим препара-том первого выбора в лечении больных ХСН [4].
Тиазидные диуретики (гипотиазид) нарушают реаб-сорбцию натрия в кортикальном сегменте восходящейчасти петли Генле и в начальной части дистальных каналь-цев. Повышают диурез и натрийурез на 30–50 %, эффек-тивны при уровне фильтрации более 30–50 мл / мин.Поэтому при почечной недостаточности их примене-ние бесполезно.
Гидрохлортиазид (гипотиазид) – основной пред-ставитель класса тиазидных диуретиков, применяет-ся, как правило, у больных умеренной ХСН (II ФК).Стартовая доза препарата 25 мг, максимальная 200 мг,поскольку при ее превышении диуретический эффектувеличивается минимально, а риск типичных побоч-ных явлений существенно возрастает. Следует помнить,что гипотиазид при всех своих положительных эффектах –препарат, требующий аккуратного и правильного приме-нения во избежание серьезных нежелательных явленийи для достижения оптимального эффекта на протяжениисуток требует двукратного применения.
Индапамид по профилю безопасности существеннопревосходит гипотиазид, однако данных по его приме-нению в лечении ХСН в настоящее время недостаточно.Еще один представитель этого класса диуретиков – хлор-талидон обычно используется в лечении больных АГ. Но,как и индапамид, может быть применен у пациентовс начальными стадиями ХСН, при сохранной фильтраци-онной функции почек.
К сожалению, в России не зарегистрирован самыйсильный из современных тиазидных диуретиков – мето-лазон (дозы от 2,5 до 10 мг), который в США рассматри-вается, как основное дополнение к петлевым диуретикампри рефрактерном отечном синдроме.
Ингибиторы карбоангидразы (ИКАГ), как сле-дует из их названия, блокируют фермент карбоанги-дразу в области проксимальных почечных канальцев,что сопровождается незначительным диурезом (при-рост до 10–15 %). Как самостоятельные диуретики,ингибиторы карбоангидразы в лечении ХСН почтине применяются из-за недостаточного диуретическо-го действия, однако усиливают «загрузку» натриемнижележащих отделов канальцев, что повышает эффек-тивность более сильных диуретиков. При истощениифермента карбоангидразы через 3–4 дня непрерывногоприменения активность ацетазоламида падает, что тре-бует перерыва в лечении.
Поэтому ацетазоламид используется в качествевспомогательного средства на фоне приема актив-ных мочегонных (тиазидных и / или петлевых).Назначаемый в дозе 0,25 мг трижды в день в течение3–4 дней с двухнедельным перерывом, этот препаратподкисляет среду, что восстанавливает диуретиче-скую активность тиазидных и петлевых диуретиков,при длительном применении которых типично раз-витие алкалоза. Обязательным считается сочетаниеактивных диуретиков и ацетазоламида у больных ХСНи сопутствующей легочной патологией (уровень дока-занности В) [338].
Кроме того, имеются сведения, что применение ацета-золамида в дозе 0,25 мг за 1 час до отхода ко сну позволя-ет уменьшить степень ночного апноэ, способного ослож-нять течение болезни у 40 % больных ХСН (уровень дока-занности С) [339, 340].
АМКР в высоких дозах (как правило, спиронолак-тон) применяются в качестве калийсберегающих пре-паратов вместе с активными мочегонными.
Другие калийсберегающие препараты (триамтерен)в настоящее время используются редко и лишь при непе-реносимости АМКР.
Рефрактерный отечный синдром
В ряде случаев может развиваться толерантностьк дегидратационному лечению, в частности, к использо-ванию диуретиков.11.1.2.1.3.2Рефрактерность бывает ранняя (так называемое тор-можение эффекта) и поздняя.
Ранняя рефрактерность развивается в первые часыили дни после начала активного назначения мочегон-ных средств, зависит от гиперактивации нейрогормонови тем сильнее, чем активнее дегидратация (тот самыйнерекомендуемый обильный диурез). Преодолеваетсяадекватным (не чрезмерным) диурезом (особенно редкоэто осложнение развивается при назначении торасеми-да) плюс обязательным совместным применением иАПФи / или спиронолактона.
Поздняя рефрактерность развивается спустя неделии месяцы постоянной диуретической терапии и связанас гипертрофией апикальных клеток почечных каналь-цев, где как раз и действуют диуретики. Бороться с этимвидом рефрактерности сложнее. Требуется периодиче-ская (один раз в 3–4 недели) смена активных диуретикови их комбинация с иАПФ. В этих случаях предпочтитель-но применение торасемида.
Как же поступать при рефрактерном отечном синдро-ме, когда пациенту требуется экстренная дегидратация?Существуют относительно простые приемы преодоле-ния устойчивости к использованию мочегонных средств.
A) Применение диуретиков (лучше предпочесть тора-семид) только на фоне иАПФ и спиронолактона. Этоглавное условие успеха.
B) Введение большой (вдвое бóльшей, чем предыдущаянеэффективная доза) дозы диуретика и только вну-тривенно.
C) Некоторые авторы предлагают вводить фуросемид(лазикс) дважды в сутки и даже постоянно внутри-венно капельно [327].
D) Сочетание диуретиков с препаратами, улучшающимифильтрацию. При САД более 100 мм рт. ст. – эуфил-лин (10 мл 2,4 % раствора внутривенно капельнои сразу после капельницы – внутривенно лазикс)или сердечные гликозиды, при более низком АД –допамин (2–5 мкг / мин). Завершившееся в 2009 годуисследование DAD–HF продемонстрировало, чтоинфузия допамина (5 мкг / кг / мин) позволяла в 4 разаснизить дозу фуросемида при сохранении диурезаи сохранении функции почек [341].
E) Применение диуретиков с альбумином или плазмой(можно вместе, что особенно важно при гипопроте-инемии, но эффективно и у пациентов с нормальнымуровнем белка плазмы).
F) При выраженной гипотонии – комбинация с поло-жительными инотропными средствами (левосимен-дан, добутамин, допамин) и, в крайнем случае, с глю-кокортикоидами (только на период критическойгипотонии).
G) При САД более 125 мм рт. ст. эффективной можетбыть комбинация с вазодилататорами (нитроглице-рин, нитропруссид натрия), из которых наиболееперспективным выглядит применение серелаксина(в РФ пока не зарегистрирован) [342].
H) Сочетания диуретиков по тем принципам, что указа-ны выше.
I) Механические способы удаления жидкости (плев-ральная, перикардиальная пункции, парацентез)используются лишь по витальным показаниям.
Сердечные гликозиды
Сердечные гликозиды остаются в числе основных средств лечения ХСН в течение более 200 лет.
Гликозиды имеют три основных механизма действия –положительный инотропный, отрицательный хронотроп-ный (имеющий разную физиологическую основу при ФПи синусовом ритме) и нейромодуляторный эффекты. Хотяэто хорошо и давно известный факт, однако повсеместнопрактические врачи считают главным именно положитель-ное инотропное действие гликозидов, что совершенноне обосновано [343–346]. Мощное положительное ино-тропное действие гликозидов проявляется при их приме-нении в высоких дозах (для дигоксина более 0,375 мг / сут).Однако использование высоких (более 0,375 мг) доздигоксина чревато развитием интоксикации и являетсяпредиктором негативного влияния на прогноз больныхХСН [346–348]. Поэтому дигоксин у больных ХСН всег-да должен применяться в малых дозах: до 0,25 мг / сут(для больных с массой тела более 85 кг до 0,375 мг / сут,а при массе тела менее 65 кг – до 0,125 мг / сут). В такихдозировках он действует преимущественно как нейрогор-мональный модулятор, оказывает слабое положительноеинотропное действие и не стимулирует развитие наруше-ний сердечного ритма [344–346].
В настоящее время в клинической практике в подавля-ющем большинстве случаев используется дигоксин, обла-дающий оптимальными фармакодинамическими свой-ствами и доказанной клинической эффективностью [1,4, 6, 8]. Применение других гликозидов для длительноголечения больных ХСН не имеет оснований.
Применение короткодействующих сердечных гли-козидов для внутривенного введения (Строфантин К)крайне ограничено: только в случаях обострения ХСНна фоне тахисистолической формы мерцания предсердий.И даже в этом случае предпочтительным выглядит восста-новление синусового ритма.
Классически дигоксин использовался для лече-ния систолической ХСН. Накоплен богатый клиниче-ский опыт по его успешному применению у пациентовс декомпенсацией. При этом считалось, что препаратнаиболее эффективен у пациентов с ФП, так как, помимоположительного инотропного эффекта, препарат умень-шает ЧСС (как за счет парасимпатической активации, таки в результате отрицательного дромотропного эффекта –замедления проведения импульсов через атрио-вентрику-лярное = A–V соединение) и главное – делает ритм болеерегулярным (устраняет дефицит пульса и число гемоди-намически активных сокращений из-за короткой диасто-лы). В отличие от дигоксина β-АБ, урежая ЧСС при ФП,не «упорядочивают» ритма, т. к. минимально влияютна проведение импульсов через А–V узел. Данные недав-него мета-анализа не продемонстрировали, что β-АБулучшают прогноз пациентов с систолической ХСН и ФП[349]. Это делает еще более актуальным вопрос о возмож-ности урежения ЧСС и снижения смертности у даннойкатегории пациентов при помощи дигоксина. К сожале-нию, как и в случаях с диуретиками, рандомизированныхисследований на эту тему нет. Данные последнего наибо-лее методически правильного ретроспективного анализаисследования AFFIRM, в котором дигоксин применяетсяу пациентов с ФП (не обязательно с ХСН), не выявилидостоверной связи между применением дигоксина и про-гнозом больных [350]. В небольшом, но проспективном(3,3 года) исследовании продемонстрировано достовер-ное снижение риска смерти у больных с декомпенсиро-ванной ХСН, получавших лечение дигоксином [351].
Таким образом, до проведения проспективных кон-тролируемых исследований следует руководствоватьсярекомендациями – дигоксин должен назначаться всембольным ХСН II–IV ФК, с ФВ ЛЖ <40 % при ФП с цельюурежения и упорядочения ритма, возможного улучшенияпрогноза и снижения риска госпитализаций (класс реко-мендаций I, уровень доказанности С).
Применение дигоксина у пациентов с ХСН и сину-совым ритмом было изучено в проспективном исследо-вании DIG, показавшем, что дигокин достоверно снижа-ет риск госпитализаций (на 30 %), но не влияет на рисксмерти.
Особенно эффективно применение дигоксина у паци-ентов с выраженной ХСН III–IV ФК, низкой ФВ ЛЖ<25 % и большими размерами сердца (кардиоторакаль-ный индекс более 55 %) [352].
В этом же исследовании было показано, что исполь-зование низких доз дигоксина (концентрация в плазмедо 0,9 нг / мл) позволяет достоверно снижать риск смертибольных ХСН с синусовым ритмом на 6 % и риск обостре-ний ХСН на 30 %, что делает отказ от применения этогопрепарата в лечении ХСН совершенно не обоснован-ным. Однако при концентрации 0,9–1,1 нг / мл дигоксинне оказывает влияния на прогноз, а при концентрацияхвыше 1,1 нг / мл может провоцировать развитие наруше-ний ритма сердца и увеличение риска смерти [347].
При применении сердечных гликозидов у женщинчаще, чем у мужчин, возникают интоксикация и риск жиз-неугрожающих желудочковых нарушений ритма сердца,что связано с более высокими концентрациями, в част-ности, дигоксина, создающимися в крови при приемеодинаковых доз (исследование DIG). Поэтому рекомендуется назначать им более низкие дозы и контролироватьуровень дигоксина в крови, не превышая концентрацию1,1 нг / мл [348].
При явлениях почечной недостаточности суточнаядоза дигоксина должна быть уменьшена пропорциональноснижению клиренса креатинина и СКФ менее 60 мл / мин.У пожилых больных суточные дозы дигоксина должныбыть снижены до 0,0625–0,125 мг (¼–½ таблетки).
Предпочтительным во всех случаях является соче-тание сердечных гликозидов с β-АБ, при котором лучшеконтролируется ЧСС, снижается риск опасных для жиз-ни желудочковых нарушений ритма сердца и уменьшает-ся опасность обострения коронарной недостаточности.
Таким образом, при ХСН с ФВ ЛЖ <40 % и синусо-вым ритмом применение дигоксина ДОЛЖНО быть рас-смотрено при недостаточной эффективности основныхсредств лечения декомпенсации для уменьшения рискаповторных госпитализаций (класс рекомендаций IIA,уровень доказанности B).
Ивабрадин
Ивабрадин – селективный блокатор If -токов в клет-ках синусового узла, обладает выраженным антиан-гинальным эффектом, не уступающим β-АБ и БМКК[353, 354]. В современных рекомендациях показания-ми к применению ивабрадина у больных ИБС являетсяналичие стенокардии при синусовом ритме с ЧСС более60 уд / мин. [355]. Причем доказан не только эффектмонотерапии ивабрадином, но и дополнительное уве-личение толерантности к нагрузкам при сочетании егос β-АБ [353, 356]. Учитывая, что ИБС является наибо-лее частой причиной дисфункции ЛЖ и в дальнейшемХСН, важной страницей в изучении эффектов ивабра-дина явилось исследование BEAUTIFUL, включившееоколо 11 тыс. пациентов с ИБС и ФВ ЛЖ <40 % (более1300 больных в РФ) [357].
Хотя исследование изучало группу больных с ише-мической дисфункцией ЛЖ, среди обследованных 84 %пациентов имели симптомы ХСН II–III ФК в моментвключения в исследование. В исследовании BEAUTIFULбыло доказано, что пациенты с ИБС и ЧСС более70 уд / мин имеют достоверно более высокий риск смер-ти (на 34 %), ОИМ и обострения ХСН (на 53 %), несмо-тря на проводимую терапию, включавшую у 90 % блока-торы РААС и почти у 90 % пациентов β-АБ. Причем зави-симость между ЧСС и риском обострений ХСН былалинейной, риск плохого прогноза максимально возрасталпри ЧСС выше 90 уд / мин. В исследовании BEAUTIFULприменение комбинации ивабрадина с β-АБ у больныхХСН и средней исходной ЧСС 78 уд / мин не снижа-ло достоверно риска смерти и обострений ХСН (рискпоследних был на 16 % меньше на фоне лечения ива-брадином). Но в подруппе пациентов с исходной ЧССболее 70 уд / мин отмечено достоверное снижение коро-нарных осложнений (ОИМ на 36 % и необходимостив реваскуляризации на 30 %). Показание к применениюивабрадина у больных ИБС с дисфункцией ЛЖ и ЧССболее 70 уд / мин для предотвращения повторных ОИМи коронарных реваскуляризаций вошло в Российскиерекомендации по лечению ИБС [355].
Для прояснения истинных позиций блокаторовIf -каналов в лечении больных с декомпенсацией былопроведено исследование SHIFT, в котором комбинация ивабрадина с β-АБ (90 % пациентов) исследовалась у 6 500 пациентов с выраженной ХСН ишемическойи неишемической этиологии на синусовом ритме с ЧСС более 70 уд / мин по влиянию на комбинированную точку риск сердечно-сосудистой смертности и госпитализаций в связи с обострением ХСН (более 700 больныхв РФ). Необходимо отметить, что ни о каком сравненииивабрадина с β-АБ речь не шла и всем пациентам должнабыла быть сделана попытка назначения β-АБ и титрова-ния их доз до оптимальных. Основными причинами нена-значения β-АБ или недостижения оптимальной ЧСС яви-лись низкое АД с соответсвующей симптоматикой и обо-стрение ХОБЛ [299].
Результаты исследования продемонстрировали достоверное снижение риска сердечно-сосудистой смерт-ности плюс госпитализаций из-за обострения ХСН (классическаяпервичная точка протоколов с ХСН)на 18 %, при этом назначение ивабрадина 31 больномуХСН предотвращало одно событие. Риск смерти из-заХСН и риск госпитализаций в связи с обострениемдекомпенсации снижались достоверно на 26 % каждыйсоответственно [299]. Важным дополнительным преи-муществом ивабрадина явилось снижение на 25 % рискалюбых госпитализаций (включая повторные), что дела-ет лечение больных ХСН блокатором If -каналов эконо-мически выгодным [358].
Снижение смертности по любым причинам (что не было первичной точкой исследования и даже ком-понентом первичной точки) составило 10 % (р=0,092)в группе больных ХСН с ЧСС >70 уд / мин. Однаков исследовании SHIFT достоверное возрастание риска смерти больных ХСН отмечалось при исходной ЧССболее 75 уд / мин [359], и подгрупповой (запланировантивность ивабрадина у пациентов с ЧСС более 77 уд / мин[299]. Выполненный ретроспективно анализ среди пациентов, включавшихся в исследование SHIFT с исходнойЧСС более 75 уд / мин, подтвердил способность ивабради-на достоверно снижать риск общей (на 17 %) и сердечно-сосудистой смерти (на 17 %) [359]. Это спровоцировалоЕвропейское агентство по контролю за применениемлекарственных препаратов рекомендовать применениеивабрадина у больных ХСН со сниженной ФВ ЛЖ и ЧССболее 75 уд / мин, что является формальным нарушениемпринципов доказательной медицины и не соответствуеткритериям исследования SHIFT. Ассоциация сердечнойнедостаточности Европейского общества кардиологоврекомендует ивабрадин при ЧСС больше 70 уд / мин, но в целях терапии отмечает лишь снижение госпитализа-ций (одного из компонентов первичной точки), что так-же не соответствует реалиям исследования SHIFT [3].
По мнению экспертов ОССН, в полном соответствиис критериями и результатами исследования SHIFT ива-брадин должен быть назначен больным ХСН II–IV ФК,с ФВ ЛЖ <40 % и синусовым ритмом, ЧСС >70 уд / минв дополнение к основной терапии (в том числе β-АБ)для снижения риска суммы смертей плюс госпитали-заций из-за обострения ХСН (класс рекомендаций IIA,уровень доказанности В).
Имеющиеся результаты исследований позволяютрекомендовать достижение ЧСС ниже 60 уд / мин (опти-мальный диапазон 55–60 уд / мин) и степень сниженияне менее 10 уд / мин от исходного, что обеспечиваетмаксимальное снижение риска заболеваемости и смерт-ности у больных ХСН [360]. Среднее снижение рискасмерти больных ХСН, находящихся на синусовом ритме,в расчете на каждые 10 ударов снижения ЧСС на фонетерапии ивабрадином составляет 29 %, что сравнимос эффектами β-АБ [361]. Это позволяет считать сниже-ние ЧСС универсальным механизмом улучшения про-гноза пациентов с ХСН.
Эфиры омега-3 полиненасыщенныхжирных кислот (Омакор)
Одним из наиболее дискутируемых вопросов в лече-нии ССЗ является применение полиненасыщенных жир-ных кислот. Данные последних мета-анализов и проспек-тивных исследований по профилактике ФП и первичнойпрофилактике ССЗ, включая СД, не позволяют надеять-ся на сколько-нибудь выраженный эффект рыбьего жираи приема препаратов, содержащих добавки «морских»омега ненасыщенных жирных кислот.
Однако имеются результаты нескольких крупных ран-домизированных исследований у больных, перенесшихОИМ, и пациентов, имеющих симптомы выраженнойХСН II–IV ФК, с назначением «подготовленной» фор-мы, содержащей эфиры длинноцепочечных омега-3 поли-ненасыщенных жирных кислот (ПНЖК), содержащих46 % эйкозапентаеновой и 38 % докозагексаеновой кислот,по влиянию на твердые конечные точки. Прием такойформы позволяет через 72 часа достоверно повышатьиндекс ω-3 ПНЖК в мембране клеток, что может оказы-вать целый ряд эффектов, основным из которых являетсяантиаритмический, связанный, как показано в экпери-ментальных исследованиях, с:
A) блокадой натрий-кальциевого насоса в кардиомиоцитах,
B) блокадой позднего натриевого тока,
C) блокадой кальциевых каналов L-типа,
D) антагонизмом к рецепторам растяжения (при повы-шенном миокардиальном стрессе),
E) способностью уменьшать образование «пенных кле-ток» и воспаления на поверхности атеросклеротиче-ской бляшки,
F) снижением образования свободных радикалов и умень-шением реперфузионных нарушений,
G) улучшением синтеза энергии в митохондриях,
H) снижением ЧСС (~2 уд / мин) и потребления О2
В самом крупном исследовании GISSI-P (более11 тыс. больных, перенесших ОИМ) назначение 1 г / сутω-3 ПНЖК достоверно снижало риск общей смертина 41 %, причем этот эффект развивался быстро (в тече-ние 90 дней лечения) и был связан с анитифибрилляторнымэффектом и снижением риска аритмической смертина 45 % [362]. Дальнейшее лечение практически не вли-яло на прогноз пациентов, что позволило предположитьналичие выраженного антифибрилляторного эффектаω-3 ПНЖК, который проявлялся тем больше, чем нижебыла ФВ ЛЖ у пациентов, переживших ОИМ [363].В меньших по объему исследованиях либо снижениериска смерти не достигало статистически достоверныхразличий, либо результаты были нейтральными. В послед-нем мета-анализе продемонстрировано, что назначениеω-3 ПНЖК в первые 14 дней после ОИМ ассоцииру-ется с достоверным снижением риска смерти на 32 %,при назначении до 90‑го дня риск смерти снижаетсяна 22 % (все еще статистически значимо), а назначениеэтой терапии более чем через 3 месяца после перенесен-ного ОИМ фактически не влияет на прогноз [364].
В 2008 году в многоцентровом двойном слепом пла-цебо-контролируемом исследовании GISSI–HF Омакор мальной терапии (иАПФ или АРА + β-АБ + антагонистыальдостерона + диуретики + дигоксин). В результатебыло достигнуто достоверное снижение риска общейсмерти больных ХСН на 9 %, р=0,041 (среди закончив-ших исследование на 14 %) и количества госпитализацийна 8 % (в основном связанных с ЖНРС) при длительной(более 18 месяцев) терапии. При этом количество побоч-ных эффектов в группе лечения Омакором не отличалосьот плацебо [365].
Ретроспективный анализ продемонстрировал сни-жение частоты срабатывания ИКД у пациентов, нахо-дившихся на лечении ω-3 ПНЖК, и снижение смерт-ности и госпитализаций в связи с нарушениями ритмасердца [366].
В дополнительном анализе было продемонстрирова-но повышение ФВ ЛЖ на 1,6 % при терапии 1 г / сут ω-3ПНЖК [367].
Позднее в ряде небольших исследований была обна-ружена дозозависимая (1 г / сут против 2 г / сут и 4 г / сут)способность ω-3 ПНЖК положительно влиять на уро-вень провоспалительных цитокинов, улучшать степеньэндотелий-зависимой функции сосудов и увеличивать ФВЛЖ [368]. Это позволяет предположить наличие анти-ремоделирующего эффекта ω-3 ПНЖК у больных ХСН,что вместе с антифибрилляторным действием можетположительно влиять на заболеваемость и смертностьпациентов с декомпенсацией. К примеру, в плацебо-кон-тролируемом исследовании с применением 2 г / сут ома-кора достигалось выраженное снижение числа повтор-ных госпитализаций из-за обострения ХСН [365].
Исходя из изложенных фактов и признавая, чтоне на все вопросы имеются адекватные ответы, а такжене очень выраженный эффект омакора, наступавшийчерез месяцы после начала лечения, показания к его при-менению при ХСН и особенно у пациентов, перенесшихОИМ, вошли во все рекомендации. В Европейских реко-мендациях 2012 года эксперты оценили класс рекомен-даций как IIB (может быть назначен) при уровне дока-занности В. Эксперты ОССН при разделившихся мне-ниях предпочли определить класс рекомендаций, как IIAпри уровне доказанности В. Аналогичная степень обо-снованности использования эфиров ω-3 ПНЖК приня-та в Американских рекомендациях 2013 года.
Таким образом, назначение ω-3 ПНЖК в дозе 1 г / сутдолжно быть рассмотрено у больных ХСН II–IV ФКс ФВ ЛЖ <35 % для снижения риска смерти (в том числевнезапной) и повторных госпитализаций в дополнениек основным средствам лечения ХСН.
Антикоагулянты в лечении больных ХСН
Низкомолекулярные гепариныпри наличии венозных тромбозови высоком риске их развития
Учитывая, что ХСН – это состояние, при которомвозрастает риск тромбоэмболий и инсультов, важ-ную роль в терапии этого синдрома играют антико-агулянты [369, 370]. Причем, по мнению ряда иссле-дователей, само наличие ХСН из-за стаза в полостяхсердца, наблюдаемого при дилатации ЛЖ, являетсяфактором, способствующим развитию как перифери-ческого венозного, так и внутрисердечного тромбо-за, как источника будущих тромбоэмболий [371–374].До 40 % больных с выраженной ХСН имеют призна-ки тромбоза глубоких вен, и у 5,5 % пациентов тром-боэмболии легочной артерии осложняют течениедекомпенсации, причем чем тяжелее ХСН и ниже ФВ,тем более вероятно появление тромбозов и эмболий[375]. Дополнительными факторами являются деги-дратационная терапия (чем обильнее диурез, тем хуже)и нахождение больного на постельном режиме (напри-мер, при декомпенсации) [376].
Доказано, что для предотвращения тромбозов и эмбо-лий у пациентов с ХСН, находящихся на постельномрежиме, эффективным может быть лечение низкомоле-кулярными гепаринами (эноксипарином) по 40 мг / сутв течение 2 недель [377, 378]. При этом риск тромбо-зов и эмболий снижается на 60 % в течение 4‑месяч-ного наблюдения. Аналогичные сведения имеютсяи для дальтепарина, хотя процент снижения осложненийзначительно ниже [379, 380]. Таким образом, при нали-чии венозного тромбоза, высоком риске его развитияи декомпенсации, требующей постельного режимав течение не менее 3 суток, больные ХСН с ФВ ЛЖ <35 %должны получать лечение низкомолекулярными гепари-нами в течение 2 недель (класс рекомендаций IIA, уро-вень доказанности А). Аналогичная степень обоснован-ности использования эфиров омега‑3 ПНЖК принятав Американских рекомендациях 2013 года.
Оральные антикоагулянтыдля предотвращения риска тромбоэмболий
Вопрос о применении оральных антикоагулянтов(ОАКГ) при ХСН можно разделить на две неравные по значимости темы в связи с характером основного ритма сердца. При синусовом ритме каких‑либо серьезных про-спективных исследований не проводилось, и все имею-щиеся сведения касаются только антагонистов витамина К (варфарина).
Таблица 24. Применение оральных антикоагулянтов при ХСН с синусовым ритмом
 При наличии доказанных тромбов в полостях сердца (около 20 % пациентов с ХСН и ФВ ЛЖ <40 %, из нихдо 40 % имели тромбы в полости левого предсердия) [381]показано применение варфарина, особенно при нали-чии постинфарктного кардиосклероза и аневризмы ЛЖ[382] (класс рекомендаций IIA, уровень доказанности С).
У больных ХСН со сниженной ФВ ЛЖ и синусовомритмом без признаков наличия тромбов в полости сердцаприменение варфарина не показано, так как при отсут-ствии влияния на заболеваемость и смертность можетвозрастать риск кровотечений (класс рекомендаций III,уровень доказанности В) (таблица 24).
Единственное исследование в этой области WARCEFне выявило преимуществ варфарина перед аспириномв снижении риска смерти больных ХСН с синусовым рит-мом [383]. Хотя применение варфарина и сопровожда-лось достоверным снижением риска инсультов на 48 %,это достигалось ценой достоверного прироста рискакровотечений. Однако дополнительный анализ выявилсущественные различия в эффективности варфаринав зависимости от возраста. Так, у больных ХСН с синусо-вым ритмом моложе 60 лет варфарин в сравнении с аспи-рином достоверно на 37 % снижал риск первичной точки(смерть или инсульт) и на 35 % риск смерти при недосто-верном росте риска кровотечений [383].
Исходя из этого варфарин может быть назначенбольным ХСН с синусовым ритмом, моложе 60 лет дажепри отсутствии внутрисердечного тромбоза (класс рекомендаций IIB, уровень доказанности С).
При ФП всем больным ХСН (постоянной, перси-стирующей или пароксизмальной при частоте пароксиз-мов более 1 раза в месяц) показано применение ОАКГ. Для определения риска развития тромбоэмболическихосложнений и показанности применения ОАКГ исполь-зуется шкала CHA2DS2VASc (рис. 5). Как видно, парал-лельно нарастанию числа баллов по шкале от 1 до 9(0 баллов при ХСН быть не может, т. к. само наличиеХСН является одним баллом риска) линейно нарастаетриск тромбоэмболических осложнений и необходимостьтерапии ОАКГ [384].
Для определения риска кровотечений применяетсяшкала HAS–BLED, которая также определяет 9 балловпотенциального риска, а при наличии 3 баллов и больше терапия ОАКГ потенциально опасна в плане разви-тия осложнений [382, 384]. Многие из ФР кровотече-ний являются модифицируемыми, что позволяет сни-жать риск кровотечений и увеличивать безопасностьтерапии. При наличии более одного балла по шкалеCHA2DS2VASc, меньше 3 баллов по шкале HAS–BLEDи большего или хотя бы равного числа баллов по шкалеCHA2DS2VASc, чем по шкале HAS–BLED, терапия ОАКГэффективна и достаточно безопасна.
В настоящее время могут быть использованы три типаОАКГ:A) классические антагонисты витамина K (варфарин),B) прямой ингибитор тромбина дабигатран,C) селективные блокаторы Ха ривароксабан и апиксабан.
Изучаются и другие представители этого класса.
Применение антагонистов витамина К (варфари-на) на протяжении 60 лет было наиболее эффективными единственным методом борьбы с тромбоэмболиямии инсультом. Применение варфарина при ФП снижаетриск тромбоэмболий на 64 % при 2 %-м риске развитиякровотечений, в то время как применение антиагрегантов (аспирина) уменьшает риск тромбоэмболий на 21 %при 1,2 % риске кровотечений, причем преимуществоварфарина над аспирином (36 %) больше, чем аспиринаи плацебо [385]. Поэтому в Европейских рекомендаци-ях по лечению ФП аспирин не рекомендуется для про-филактики тромбоэмболических осложнений. Варфарин не может быть адекватно заменен и комбинацией двухантитромботических препаратов (аспирин + клопидо-грел), поскольку эффективность лечения достоверноснижается, а по риску осложнений (кровотечений) ком-бинация аспирина с клопидогрелом не отличается от вар-фарина (степень доказанности А) [386]. В то же времядвойная антитромботическая терапия лучше, чем одинаспирин, предотвращает риск тромбоэмболий [387].Поэтому при невозможности лечения ОАКГ или отказабольных от приема этого класса лекарств единственнойальтернативой (правда, менее эффективной) являетсяназначение двойной антитромботической терапии (классрекомендаций IIA, степень доказанности В).
Рисунок 5. Шкалы CHA2DS2VASc и HAS–BLED, как гид к терапии ОАКГ больных ХСН и ФП
При наличии доказанных тромбов в полостях сердца (около 20 % пациентов с ХСН и ФВ ЛЖ <40 %, из нихдо 40 % имели тромбы в полости левого предсердия) [381]показано применение варфарина, особенно при нали-чии постинфарктного кардиосклероза и аневризмы ЛЖ[382] (класс рекомендаций IIA, уровень доказанности С).
У больных ХСН со сниженной ФВ ЛЖ и синусовомритмом без признаков наличия тромбов в полости сердцаприменение варфарина не показано, так как при отсут-ствии влияния на заболеваемость и смертность можетвозрастать риск кровотечений (класс рекомендаций III,уровень доказанности В) (таблица 24).
Единственное исследование в этой области WARCEFне выявило преимуществ варфарина перед аспириномв снижении риска смерти больных ХСН с синусовым рит-мом [383]. Хотя применение варфарина и сопровожда-лось достоверным снижением риска инсультов на 48 %,это достигалось ценой достоверного прироста рискакровотечений. Однако дополнительный анализ выявилсущественные различия в эффективности варфаринав зависимости от возраста. Так, у больных ХСН с синусо-вым ритмом моложе 60 лет варфарин в сравнении с аспи-рином достоверно на 37 % снижал риск первичной точки(смерть или инсульт) и на 35 % риск смерти при недосто-верном росте риска кровотечений [383].
Исходя из этого варфарин может быть назначенбольным ХСН с синусовым ритмом, моложе 60 лет дажепри отсутствии внутрисердечного тромбоза (класс рекомендаций IIB, уровень доказанности С).
При ФП всем больным ХСН (постоянной, перси-стирующей или пароксизмальной при частоте пароксиз-мов более 1 раза в месяц) показано применение ОАКГ. Для определения риска развития тромбоэмболическихосложнений и показанности применения ОАКГ исполь-зуется шкала CHA2DS2VASc (рис. 5). Как видно, парал-лельно нарастанию числа баллов по шкале от 1 до 9(0 баллов при ХСН быть не может, т. к. само наличиеХСН является одним баллом риска) линейно нарастаетриск тромбоэмболических осложнений и необходимостьтерапии ОАКГ [384].
Для определения риска кровотечений применяетсяшкала HAS–BLED, которая также определяет 9 балловпотенциального риска, а при наличии 3 баллов и больше терапия ОАКГ потенциально опасна в плане разви-тия осложнений [382, 384]. Многие из ФР кровотече-ний являются модифицируемыми, что позволяет сни-жать риск кровотечений и увеличивать безопасностьтерапии. При наличии более одного балла по шкалеCHA2DS2VASc, меньше 3 баллов по шкале HAS–BLEDи большего или хотя бы равного числа баллов по шкалеCHA2DS2VASc, чем по шкале HAS–BLED, терапия ОАКГэффективна и достаточно безопасна.
В настоящее время могут быть использованы три типаОАКГ:A) классические антагонисты витамина K (варфарин),B) прямой ингибитор тромбина дабигатран,C) селективные блокаторы Ха ривароксабан и апиксабан.
Изучаются и другие представители этого класса.
Применение антагонистов витамина К (варфари-на) на протяжении 60 лет было наиболее эффективными единственным методом борьбы с тромбоэмболиямии инсультом. Применение варфарина при ФП снижаетриск тромбоэмболий на 64 % при 2 %-м риске развитиякровотечений, в то время как применение антиагрегантов (аспирина) уменьшает риск тромбоэмболий на 21 %при 1,2 % риске кровотечений, причем преимуществоварфарина над аспирином (36 %) больше, чем аспиринаи плацебо [385]. Поэтому в Европейских рекомендаци-ях по лечению ФП аспирин не рекомендуется для про-филактики тромбоэмболических осложнений. Варфарин не может быть адекватно заменен и комбинацией двухантитромботических препаратов (аспирин + клопидо-грел), поскольку эффективность лечения достоверноснижается, а по риску осложнений (кровотечений) ком-бинация аспирина с клопидогрелом не отличается от вар-фарина (степень доказанности А) [386]. В то же времядвойная антитромботическая терапия лучше, чем одинаспирин, предотвращает риск тромбоэмболий [387].Поэтому при невозможности лечения ОАКГ или отказабольных от приема этого класса лекарств единственнойальтернативой (правда, менее эффективной) являетсяназначение двойной антитромботической терапии (классрекомендаций IIA, степень доказанности В).
Рисунок 5. Шкалы CHA2DS2VASc и HAS–BLED, как гид к терапии ОАКГ больных ХСН и ФП
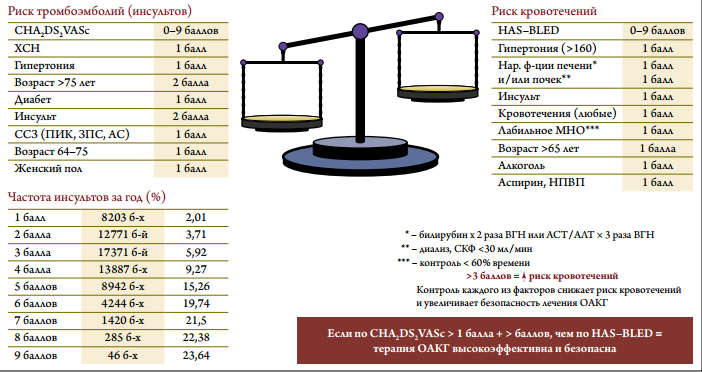 Эффективность и безопасность лечения варфари-ном зависит от достигнутой степени антикоагуляции,причем показатель международного нормализованного отношения (МНО) в ходе лечения должен быть больше 2,0 [388]. Для уменьшения риска геморрагическихосложнений антикоагулянты должны применятьсяпри тщательном контроле (раз в месяц) МНО. Известно,что риск тромбоэмболий и выживаемость больных ХСНи ФП напрямую зависят от длительности и правиль-ности (поддержание МНО в пределах 2,0–3,0) леченияантикоагулянтами [389–391]. При достижении времениконтроля МНО в пределах 2,0–3,0 более 75 % времении использовании домашнего контроля МНО (аппаратcoagucheck) можно вдвое снизить риск кровотечений[392]. При подборе дозы варфарина измерение МНОпроизводится один раз в 3–5 дней, после получения двухстабильных показателей в терапевтическом диапазоненаиболее безопасно измерять МНО ежемесячно (минимум 1 раз в три месяца).
Применение новых антикоагулянтов – дабигатрана(прадаксы) в дозе 110 мг 2 раза в сутки или 150 мг двараза в сутки, ривароксабана (ксарелто) 10 мг один разв сутки и апиксабана (эликвис) 5 мг два раза в суткине требует контроля МНО, что принято считать их главными преимуществами над варфарином. При этом новыеАКГ, по крайней мере, не уступают варфарину по эффек-тивности (снижение риска тромбоэмболий) и что оченьважно – достоверно снижают риск фатальных (внутриче-репных) кровотечений [393–396].
Прямых сравнений между дабигатраном, ривароксабаном и апиксабаном не проводилось, поэтому однознач-ных выводов об их сравнительной эффективности и безопасностисделать невозможно. Тем не менее:
A) дабигатран (в дозе 110 мг × 2 раза в сутки) и ривароксабан не уступают варфарину в способности снижать риск инсультов и тромбоэмболий. А дабигатран(в дозе 150 мг 2 раза в день) и апиксабан достовернопревосходят варфарин по эффективности;
B) применение дабигатрана (110 мг 2 раза в день)и апиксабана сопровождается и общим снижениемриска кровотечений, в отличие от ривароксабанаи высокой дозы дабигатрана (150 мг 2 раза в день);
C) риск смерти достоверно снижается лишь при применении апиксабана. Таким образом, апиксабан (эликвис) – единственный из новых АКГ превосходит варфарин и по эффективности, и по безопасности;
D) отмена дабигатрана и ривароксабана в исследованияхпроводилась чаще, чем варфарина, а апиксабан отменялся достоверно реже, чем варфарин;
E) при увеличении дозы дабигатрана до 150 мг два разав сутки риск тромбоэмболий снижается даже больше, чем при лечении варфарином, но возрастает рискжелудочно-кишечных кровотечений и ИМ;
F) в исследовании AVERROES апиксабан вдвое снижалриск тромбоэмболических осложнений в сравнениис аспирином, не уступая последнему по влияниюна риск кровотечений.
При всех положительных качествах новых ОАКГ следует выделить и проблемы:
A) отсутствие необходимости контроля МНО не означает отказа от контроля режима, других ФР;
B) короткий период полувыведения 12–24 час препаратов может быть выгоден, т. к. при необходимости,например, хирургического вмешательства отменунужно проводить не за 3–5 дней, как в случае с варфа-рином, а всего за сутки;
C) с другой стороны, лечение новыми ОАКГ требуетвысокой дисциплины: даже одна пропущенная дозаприводит к гиперкоагуляции и риску тромбоэмболий (что особенно опасно при отсутствии доступныхметодов контроля коагуляции), в то время как концентрация варфарина при одной пропущенной доземеняется незначительно и МНО показывает эффективность и безопасность терапии;
D) в случае кровотечения при терапии варфарином имеется хотя и не очень эффективный и медленно действу-ющий, но антидот (витамин К), а при примененииновых ОАКГ таковых нет. Более того, даже перелива-ние крови может оказаться не сразу эффективным, т. к.факторы свертывания (тромбин и Ха фактор) могутблокироваться и в переливаемой крови;
E) при ФП у больных ХСН с искусственными клапана-ми, вне зависимости от типа протеза, новые ОАКГприменяться не должны. Единственным препаратомвыбора в этих случаях остается варфарин (при этомконтроль МНО должен быть в пределах 2,5–3,5);
F) при ухудшении функции почек (снижении СКФ менее30 мл / мин) применение новых ОАКГ строго не реко-мендовано, а использование варфарина возможно;
G) апиксабан, выводящийся почками лишь на 27 %,может применяться у больных со СКФ <50 мл / мин,причем риск кровотечений в этом случае достоверноменьший, чем при лечении варфарином;
H) при применении дабигатрана может увеличивать-ся риск повторных ОИМ, и хотя абсолютный рискинфарктов невысок, назначение дабигатрана послеОИМ вызывает вопросы;
I) наконец, нельзя забывать, что стоимость лечения новы-ми ОАКГ многократно выше, чем оригинальным вар-фарином (варфарин – Никомед), что не позволяет реко-мендовать новые ОАКГ всем пациентам с ХСН, ФПи высоким риском тромбоэмболических осложнений.
Таблица 25. Применение оральных антикоагулянтов при ХСН с ФП
Эффективность и безопасность лечения варфари-ном зависит от достигнутой степени антикоагуляции,причем показатель международного нормализованного отношения (МНО) в ходе лечения должен быть больше 2,0 [388]. Для уменьшения риска геморрагическихосложнений антикоагулянты должны применятьсяпри тщательном контроле (раз в месяц) МНО. Известно,что риск тромбоэмболий и выживаемость больных ХСНи ФП напрямую зависят от длительности и правиль-ности (поддержание МНО в пределах 2,0–3,0) леченияантикоагулянтами [389–391]. При достижении времениконтроля МНО в пределах 2,0–3,0 более 75 % времении использовании домашнего контроля МНО (аппаратcoagucheck) можно вдвое снизить риск кровотечений[392]. При подборе дозы варфарина измерение МНОпроизводится один раз в 3–5 дней, после получения двухстабильных показателей в терапевтическом диапазоненаиболее безопасно измерять МНО ежемесячно (минимум 1 раз в три месяца).
Применение новых антикоагулянтов – дабигатрана(прадаксы) в дозе 110 мг 2 раза в сутки или 150 мг двараза в сутки, ривароксабана (ксарелто) 10 мг один разв сутки и апиксабана (эликвис) 5 мг два раза в суткине требует контроля МНО, что принято считать их главными преимуществами над варфарином. При этом новыеАКГ, по крайней мере, не уступают варфарину по эффек-тивности (снижение риска тромбоэмболий) и что оченьважно – достоверно снижают риск фатальных (внутриче-репных) кровотечений [393–396].
Прямых сравнений между дабигатраном, ривароксабаном и апиксабаном не проводилось, поэтому однознач-ных выводов об их сравнительной эффективности и безопасностисделать невозможно. Тем не менее:
A) дабигатран (в дозе 110 мг × 2 раза в сутки) и ривароксабан не уступают варфарину в способности снижать риск инсультов и тромбоэмболий. А дабигатран(в дозе 150 мг 2 раза в день) и апиксабан достовернопревосходят варфарин по эффективности;
B) применение дабигатрана (110 мг 2 раза в день)и апиксабана сопровождается и общим снижениемриска кровотечений, в отличие от ривароксабанаи высокой дозы дабигатрана (150 мг 2 раза в день);
C) риск смерти достоверно снижается лишь при применении апиксабана. Таким образом, апиксабан (эликвис) – единственный из новых АКГ превосходит варфарин и по эффективности, и по безопасности;
D) отмена дабигатрана и ривароксабана в исследованияхпроводилась чаще, чем варфарина, а апиксабан отменялся достоверно реже, чем варфарин;
E) при увеличении дозы дабигатрана до 150 мг два разав сутки риск тромбоэмболий снижается даже больше, чем при лечении варфарином, но возрастает рискжелудочно-кишечных кровотечений и ИМ;
F) в исследовании AVERROES апиксабан вдвое снижалриск тромбоэмболических осложнений в сравнениис аспирином, не уступая последнему по влияниюна риск кровотечений.
При всех положительных качествах новых ОАКГ следует выделить и проблемы:
A) отсутствие необходимости контроля МНО не означает отказа от контроля режима, других ФР;
B) короткий период полувыведения 12–24 час препаратов может быть выгоден, т. к. при необходимости,например, хирургического вмешательства отменунужно проводить не за 3–5 дней, как в случае с варфа-рином, а всего за сутки;
C) с другой стороны, лечение новыми ОАКГ требуетвысокой дисциплины: даже одна пропущенная дозаприводит к гиперкоагуляции и риску тромбоэмболий (что особенно опасно при отсутствии доступныхметодов контроля коагуляции), в то время как концентрация варфарина при одной пропущенной доземеняется незначительно и МНО показывает эффективность и безопасность терапии;
D) в случае кровотечения при терапии варфарином имеется хотя и не очень эффективный и медленно действу-ющий, но антидот (витамин К), а при примененииновых ОАКГ таковых нет. Более того, даже перелива-ние крови может оказаться не сразу эффективным, т. к.факторы свертывания (тромбин и Ха фактор) могутблокироваться и в переливаемой крови;
E) при ФП у больных ХСН с искусственными клапана-ми, вне зависимости от типа протеза, новые ОАКГприменяться не должны. Единственным препаратомвыбора в этих случаях остается варфарин (при этомконтроль МНО должен быть в пределах 2,5–3,5);
F) при ухудшении функции почек (снижении СКФ менее30 мл / мин) применение новых ОАКГ строго не реко-мендовано, а использование варфарина возможно;
G) апиксабан, выводящийся почками лишь на 27 %,может применяться у больных со СКФ <50 мл / мин,причем риск кровотечений в этом случае достоверноменьший, чем при лечении варфарином;
H) при применении дабигатрана может увеличивать-ся риск повторных ОИМ, и хотя абсолютный рискинфарктов невысок, назначение дабигатрана послеОИМ вызывает вопросы;
I) наконец, нельзя забывать, что стоимость лечения новы-ми ОАКГ многократно выше, чем оригинальным вар-фарином (варфарин – Никомед), что не позволяет реко-мендовать новые ОАКГ всем пациентам с ХСН, ФПи высоким риском тромбоэмболических осложнений.
Таблица 25. Применение оральных антикоагулянтов при ХСН с ФП
 Подробные показания к назначению ОАКГ в разныхклинических ситуациях представлены в таблицах 24 и 25. При фибрилляции предсердий наиболее вероятнообразование тромбов, являющихся источником тромбо-эмболических осложнений в гемодинамически неактив-ных участках, прежде всего в ушке левого предсердия.Исходя из этого на протяжении последних 20 лет обсуж-дается закрытие (сначала хирургическое, а сейчас транска-тетерное) ушка левого предсердия с целью профилактикитромбоэмболий и как альтернатива ОАКГ. Однако факти-ческих данных пока недостаточно для строгих выводов.В МРКИ PROTECT–AF использование наиболее попу-лярной системы в виде имплантируемого трансвенознос последующей пункцией межпредсердной перегородкираскрывающегося «зонтика», блокирующего ушко лево-го предсердия (Watchman), сравнивалось с ОАКГ. Былодоказано, что окклюзия ушка левого предсердия не усту-пала по эффективности ОАКГ, но приводила к большемучислу осложнений, в том числе кровотечений [397]. Болеетого, с накоплением опыта риск осложнений при транс-катетерном закрытии ушка левого предсердия снижал-ся и не отличался от группы ОАКГ [398]. Плюс к томузакрытие ушка левого предсердия не должно противопо-ставляться ОАКГ [399]. Хотя в настоящее время закры-тие ушка левого предсердия с целью профилактики тром-боэмболических осложнений у пациентов с ХСН и ФПимеет невысокий класс доказательств IIb и уровень дока-занности B, интерес к этому методу сохраняется, в томчисле с использованием новых устройств.
Коэнзим Q10
Интерес вызывают перспективы применения коэнзима Q10 в комплексном лечении ХСН. Убихинон (или коэн-зим Q10) может способствовать улучшению переносаэлектронов в митохондриальной дыхательной цепи, уве-личивать синтез АТФ в миокарде и одновременно облада-ет антиоксидантными свойствами, позволяющими нор-мализовать функцию эндотелия [400].
Низкая концентрация коэнзима Q10 в крови больныхХСН является предиктором плохого прогноза, при-чем по своей предсказующей значимости может дополнять такой общепринятый маркер, как МНУП [401].Исследования по применению убихинона в лечениибольных ХСН показали и клиническую эффективность,и способность увеличивать ФВ ЛЖ, и нормализоватьфункцию эндотелия. Мета-анализ 2013 года выявил, чтопри добавлении убихинона к оптимальной терапии при-рост ФВ ЛЖ составлял в среднем на 3,67 % [402].
Наконец, в 2013 году появились данные о возмож-ном влиянии коэнзима Q10 на прогноз больных ХСН.В Шведском проспективном исследовании, продолжавшемся более 4 лет, было продемонстрировано 55 %-е снижение риска смерти больных ХСН на фоне приема ком-бинации коэнзима Q10 и селена [403].
Еще больший резонанс вызвало окончание много-центрового плацебо-контролируемого исследованияпо применению коэнзима Q10 у больных ХСН III–IV ФК(Q-SYMBIO) [404].
В этом исследовании, включавшем 420 пациентов,находившихся на оптимальной терапии, длительное при-менение коэнзима Q10 вдвое снижало риск смерти пациентов с тяжелой ХСН (с 17 до 9 %, р=0,01) и комбинированной конечной точки смерть плюс госпитализации,связанные с обострением ХСН (с 25 до 14 %, р=0,003).Причем в обоих исследованиях переносимость коэнзимаQ10 не отличалась от плацебо.
Казалось бы, на результатах двух относительно небольших по объему исследований трудно делать окон-чательные выводы, но возможность улучшения прогнозабольных ХСН с помощью коэнзима Q10 явилась одной из наиболее обсуждаемых новостей 2013 года.
В РФ в настоящее время также проводится плацебо-контролируемое исследование по применению водо-растворимой формы коэнзима Q10 у больных ХСН(КУДЕСНИК).
Препараты, не влияющие на прогнозпри ХСН, но улучшающие симптоматикув определенных клинических ситуациях
Антиаритмические средства в лечении ХСНс желудочковыми нарушениями сердца (классрекомендаций IIB, уровень доказанности А)
Подавляющее число больных ХСН имеют опасныедля жизни желудочковые нарушения ритма сердца (IIIи выше градации по классификации Lown–Wolf) [405–407]. До ⅔ больных с начальными стадиями декомпенсациии до ⅓ пациентов даже с финальными стадиями ХСНумирают внезапно (скорее всего, из-за наличия аритмий)[279, 408, 409]. Причем улучшение гемодинамики неисключает возможность развития опасных аритмий, кото-рые могут потребовать специального лечения [410, 411].
Основные позиции при лечении желудочковых арит-мий у больных ХСН сводятся к следующему:
A) лечения при ХСН требуют лишь опасные для жиз-ни и симптомные желудочковые нарушения ритма сердца (класс IIA, уровень доказанности В) [1, 4, 6,8, 407, 412];
B) антиаритмики I класса (блокаторы натриевых кана-лов) и IV класса (БМКК) противопоказаны больным ХСН (класс III, уровень доказанности А) [413];
C) во всех случаях средством выбора в лечении больных ХСН и желудочковыми нарушениями сердечного ритма являются β-АБ, обладающие умеренным анти-аритмическим, но выраженным антифибрилляторным действием, что позволяет им достоверно снижать риск внезапной смерти [278, 279, 287, 414];
D) При неэффективности β-АБ для антиаритмического лечения применяются препараты III класса (из зарегистрированных в России – амиодарон и соталол) [4, 6].
Средством выбора для лечения симптомных и жизне-угрожающих нарушений ритма сердца у больных, пере-несших ОИМ и имеющих клинически выраженную ХСН,является амиодарон. Его использование не только устра-няет желудочковые нарушения ритма сердца, но можетвлиять и на риск внезапной смерти. Амиодарон досто-верно снижает риск внезапной смерти у декомпенсиро-ванных больных с желудочковыми аритмиями (на 28,4 %),риск сердечно-сосудистой смертности (на 18,2 %),в то время как риск общей смертности достоверноне меняется (класс IIA, уровень доказанности В) [415].Важно помнить, что сочетание β-АБ с амиодароном явля-ется рациональным и эффект амиодарона проявляетсямаксимально ярко именно при сочетании с β-АБ (классIIA, уровень доказанности В) [416]. Более эффективногосредства борьбы с желудочковыми аритмиями, чем амио-дарон, до настоящего времени нет.
Поддерживающая доза амиодарона не должна пре-вышать 100–200 мг / сут для минимизации риска экстракардиальных побочных эффектов (чаще всего, особеннов России – нарушение функции щитовидной железы).Разработан совместный алгоритм лечения амиодарономбольных с жизнеугрожающими аритмиями и проблема-ми со стороны щитовидной железы кардиологами и эндо-кринологами, позволяющий долгое время проводитьтерапию эффективно и с минимальным числом осложне-ний [417]. Использование амиодарона всегда подразуме-вает реальную оценку соотношения польза / риск.
Применение амиодарона у пациентов без симптомоваритмии с целью первичной профилактики внезапнойсмерти малоэффективно. У пациентов с умеренной ХСНего эффект не выражен, а при прогрессировании деком-пенсации до III–IV ФК амиодарон может даже увеличи-вать риск смерти [418]. Наиболее оправданным мето-дом профилактики внезапной смерти у больных ХСНс жизнеугрожающими аритмиями является постановкаимплантируемого кардиовертера–дефибриллятора.
Альтернативой амиодарону может быть соталол –антиаритмик III класса, имеющий дополнительные свой-ства β-АБ. По влиянию на желудочковые нарушения рит-ма сердца соталол лишь немного уступает амиодарону[419]. Соталол имеет существенно меньше внесердечныхпобочных реакций в сравнении с амиодароном, но чащевызывает проаритмии, особенно у больных с тяжелымпоражением миокарда [420]. Доза соталола титрует-ся подобно другим β-АБ, начиная с 20 мг 2 раза в сутки.Через 2 недели дозу увеличивают до 40 мг 2 раза в сутки,еще через две недели до 80 мг 2 раза в сутки и, наконец,еще через две недели до максимальной – 160 мг 2 разав сутки. С увеличением дозы препарата и тяжести ХСНувеличивается опасность проаритмических осложнений,поэтому у больных ХСН III–IV ФК нежелательно превы-шать суточную дозу 160 мг [420].
Отдельного внимания заслуживает проблема ФП,которая в качестве основного ритма или пароксизмоврегистрируется почти у 40 % пациентов с клинически выраженной ХСН [421]. Сведения о влиянии ФП на про-гноз больных ХСН противоречивы [422, 423]. ЛечениеФП у больных ХСН должно проводиться по принципам,изложенным в последних руководствах ЕОК по диагно-стике и лечению этого вида нарушения ритма [424, 425].
При ФП нет доказательств, что восстановление сер-дечного ритма превосходит терапевтическую тактику,предполагающую контроль ЧСС, особенно у больных ХСН (класс IIA, уровень доказанности В) [426–428].Поэтому целесообразность восстановления синусовогоритма (электрическая дефибрилляция или медикаментозное купирование) оставляется на усмотрение врача. Эффективность электрической дефибрилляции достигает 90 %, но в течение первого года синусовый ритмудерживается не более чем у 30 % больных, что требуетактивной поддерживающей терапии [429]. Из меди-каментозных средств поддержания синусового ритмасегодня в основном применяются антиаритмики III класса, из которых наиболее эффективным представляетсяамиодарон (69 % успешного удержания восстановленно-го синусового ритма), превосходящий по эффективно-сти соталол и антиаритмики I класса [430, 431]. Причемамиодарон может предупреждать возникновение новойФП, но не эффективен в конверсии ФП в синусовый ритм[432]. Кроме того, и по способности провоцироватьжизненноопасные желудочковые нарушения сердечногоритма при лечении больных ХСН с ФП амиодарон выгодно отличается от соталола [433] Антиаритмики I класса строго не рекомендованы у больных с дисфункцией ЛЖи при ХСН, несмотря на наличие ФП (класс III, степеньдоказанности А).
Единственным независимым предиктором лучшейвыживаемости больных ХСН с ФП является постоянныйприем антикоагулянтов при поддержании МНО в пределах от 2,0 до 3,0 (класс IIA, степень доказанности А) [391,426, 434, 435].
К факторам, способствующим вероятному повторно-му срыву ритма и рецидивированию ФП, относятся:A) пожилой возраст (более 65 лет),
B) давнее (более 6 месяцев) мерцание предсердий,
C) частые пароксизмы (рецидивы) ФП,
D) большие размеры левого предсердия (передне-задний размер более 4,2 см),
E) наличие тромбов в полостях сердца (в том числев ушке левого предсердия),
F) низкая ФВ ЛЖ (<35 %),G) выраженная гипертрофия ЛЖ.
В этих случаях восстановление синусового ритманецелесообразно.
Одним из основных принципов лечения больныхХСН и имеющейся (или угрожающей) ФП можносчитать применение не антиаритмических средств,а препаратов, блокирующих активность РААС (пре-жде всего иАПФ), β-АБ и статинов (upstream therapy).Считается, что, уменьшая степень ремоделированиясердца, подобная «неспецифическая» терапия спо-собна замедлять наступление ФП. Однако и в этомвопросе много неясного. Несмотря на обнадежива-ющие результаты мета-анализов [436, 437], проспек-тивные исследования не всегда заканчивались успешно.Например, АРА ни в одном из четырех проведенныхисследований не оказали влияния на риск ФП [438–441]. Однако лечение иАПФ и β-АБ необходимо про-водить всем больным ХСН независимо от характераосновного ритма.
Для контроля ЧСС при постоянной форме ФП наи-более эффективным может быть использование комби-нации сердечных гликозидов и β-АБ. В данном случаеиспользуются два аддитивных механизма. Дигоксинзамедляет атрио-вентрикулярную проводимость, умень-шает ЧСС покоя и «упорядочивает» ритм, устраняядефицит пульса и число гемодинамически неэффектив-ных сокращений [442, 443]. В то же время β-АБ за счетснижения симпатической стимуляции синусового узлапотенцируют брадикардитические эффекты дигоксинаи предотвращают появление тахикардии во время физи-ческих нагрузок [444, 445]. Данные последнего мета-ана-лиза показали, что применение одних β-АБ при систоли-ческой ХСН на фоне ФП не улучшает прогноза [349]. Этоне только свидетельство целесообразности их сочетанияс дигоксином, но и вопрос о том, с какого препарата сле-дует начинать лечение этой группы пациентов.
Комбинация дигоксина с β-АБ (в том числе и сотало-лом, способным удерживать синусовый ритм у 40 % боль-ных после кардиоверсии [430, 433]) позволяет эффек-тивно контролировать ЧСС у пациентов как с сохраняю-щейся ФП, так и с синусовым ритмом в межпри´ступныйпериод (класс IIA, степень доказанности В) [442–445].
Степень оптимального контроля ЧСС при ФПв отличие от синусового ритма не определена. В про-вокационном исследовании RACE-II было показа-но, что степень контроля ЧСС при ФП мало влияетна прогноз и достаточным можно считать ЧСС менее110 уд / мин [446]. Но, во-первых, это не были пациен-ты с ХСН, во-вторых, реально достигнутая ЧСС к кон-цу исследования в группе нестрогого контроля соста-вила 85 уд / мин и 76 уд / мин в группе строгого кон-троля, соответственно, и, в‑третьих, при высокой ЧССв покое резерв ее безопасного увеличения будет снижени сократит возможность выполнения физических нагру-зок без риска обострения декомпенсации. Поэтомупри ХСН и ФП все же наиболее оправдано снижениеЧСС хотя бы менее 85 уд / мин в покое.
При неэффективности медикаментозного контроляЧСС, на фоне отягощения течения ХСН может потре-боваться проведение радиочастотной аблации в надеж-де восстановить синусовый ритм, однако эта процедурадолжна проводиться, лишь когда исчерпаны все другиевозможности контроля ситуации.
Блокаторы медленных кальциевыхканалов при недостаточном контролеАД и легочной гипертензии (классрекомендаций IIB, уровень доказанности А)
Блокаторы медленных кальциевых каналов (БМКК),замедляющие ЧСС (верапамил и дилтиазем), не должныиспользоваться в лечении ХСН, т. к. ухудшают клиниче-ское течение ХСН II–IV ФК и повышают риск развитияотека легких. Использование этих БМКК (обязательнов сочетании с иАПФ, β-АБ, диуретиками, АМКР) можетрассматриваться при ХСН I ФК, преимущественновызванной диастолическими расстройствами (класс IIB,уровень доказанности С).
Из группы длительнодействующих дигидропириди-нов амлодипин (исследование PRAISE I и II) и фелоди-пин (исследование V–HeFT III) доказали способностьне ухудшать прогноз больных ХСН [447–450]. При этомв некоторых случаях применение этих препаратов можетулучшать клинику и уменьшать выраженность симптомовдекомпенсации. Возможными показаниями к исполь-зованию амлодипина или фелодипина в лечении ХСН(на фоне основных средств лечения) являются:
A) наличие упорной стенокардии,
B) наличие сопутствующей стойкой гипертонии,
C) высокая легочная гипертония, в том числе при сопут-ствующей ХОБЛ,
D) выраженная клапанная регургитация.
Применение дигидропиридиновых кальциевых антагонистов позволяет уменьшать степень клапанной регурги-тации (митральной и аортальной). Причем эффект дигидропиридинов сохраняется как при органической, таки относительной митральной недостаточности [170, 171].
К сожалению, применение дигидропиридинов у больных АГ может способствовать задержке жидкости и раз-витию симптомов ХСН [112, 202, 447]. Поэтому БМККс вазодилатирующими свойствами не применяютсядля профилактики ХСН.
Использование БМКК обязательно сочетается с лече-нием основными средствами терапии ХСН (иАПФ,АМКР, β-АБ, диуретики), что может нивелировать нега-тивные эффекты, связанные с гиперактивацией нейро-гормонов и задержкой жидкости.
Препараты железа при сопутствующейжелезодефицитной анемии (классрекомендаций IIA, уровень доказанности В)
При неосложненной ХСН наличие анемии не харак-терно, так как в ответ на недостаточно эффективноегемодинамическое обеспечение органов кровью и кислородом должен развиваться эритроцитоз и увеличиватьсяуровень гемоглобина. Однако в результате задержки жид-кости (гемодилюции), вторичного нарушения функциипочек, печени, снижению чувствительности костногомозга к ЭПО, около ⅓ пациентов с ХСН имеют уровеньгемоглобина менее 120 мг / л, что можно определить,как анемию [451]. Чем тяжелее ХСН, тем ниже среднийуровень гемоглобина, тем больший процент больныхимеет анемию [452]. Прогноз больных ХСН ухудшаетсяпараллельно снижению уровня гемоглобина, что позво-лило считать анемию одним из факторов не только ухуд-шения клинического состояния, но и увеличения рисказаболеваемости больных ХСН [453], причем вне зависи-мости от ФВ ЛЖ [454].
Учитывая эти факты, магистральным направлени-ем в лечении анемии у больных ХСН в последние годывиделось применение в комплексе эритропоэтина [455].Первые обнадеживающие результаты, продемонстри-ровавшие улучшение клинического состояния, умень-шение одышки, увеличение толерантности к нагрузкаму больных ХСН на фоне лечения эитропоэтином [456],стимулировали проведение крупномасштабного МРКИ,получившего название RED–HF. К сожалению, резуль-таты этого исследования не подтвердили первичнойгипотезы. Применение эритропоэтина (дарбепоэтина–альфа) не оказывало влияния ни на количество госпи-тализаций, ни на смертность больных ХСН с уровнемгемоглобина менее 120 мг / л [457]. При этом достовер-но в 3,5 раза увеличивался риск тромбозов и эмболийи в 1,7 раза – риск мозговых инсультов. Аналогичноеповышение риска сердечно-сосудистых осложненийотмечалось и при применении эритропоэтина у боль-ных ХБП и СД 2 типа [458].
Ранее подобные эффекты связывали с чрезмернымповышением уровня гемоглобина более 145 мг / л, пред-полагая, что его оптимальный уровень находится в пре-делах 120–140 мг / л [459]. Однако в исследовании RED–HF достигнутый уровень гемоглобина мониторировалсяи в среднем не превышал 130 мг / л, но тем не менее, рискосложнений возрастал [457].
Можно констатировать, что идея коррекции анемииу больных ХСН с помощью эритропоэтина не получиласвоего подтверждения. Эритропоэтин не должен при-меняться в лечении больных ХСН даже при сниженномуровне гемоглобина (класс рекомендаций III, уровеньдоказанности А).
С другой стороны, среди всех случаев анемии у паци-ентов с ХСН ¾ относятся к железодефицитным состо-яниям [460]. Об этом свидетельствует сочетание сни-женного гемоглобина (менее 120 мг / л) и уменьшениесодержания сывороточного железа (менее 10 мкмоль / лжелеза). Более точная оценка характера анемии можетбыть сделана на основании содержания ферритина(снижается ниже 100 нг / мл в случаях абсолютногодефицита железа) или насыщения трансферрина желе-зом (ниже 20 %). Низкий уровень насыщения транс-феррина железом при наличии сохранного уровняферритина может свидетельствовать об относительномдефиците железа.
В этих случаях логичным и эффективным должнобыть использование препаратов железа. Хотя пероральные препараты железа кажутся удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасыванияи часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10–40 % пациен-тов), которые снижают приверженность к лечению.Внутривенное введение препаратов железа обоснова-но в тех случаях, когда необходимо быстро добитьсяэффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих ССЗ или находящих-ся на химиотерапии), при плохой переносимости пре-паратов для приема внутрь или их неэффективности(синдром мальабсорбции), то есть при всех проявле-ниях ХСН.
По крайней мере, два открытых и два контролируе-мых исследования с применением препарата венофер(сахарат железа) продемонстрировали уменьшениеявлений анемии и улучшением клинического состоянияу пациентов с ХСН [461–463]. Но наиболее крупноеМРКИ (FAIR–HF) с участием и российских центровиспользовало препарат ферринжект (феррокарбо-мальтозный комплекс железа) [464]. Это стабильныймононуклеарный комплекс железа, не вызывающийгиперчувствительности, что позволяет быстро (в тече-ние 15 минут) ввести высокую дозу железа (1000 мг),которое медленно высвобождается, что позволяет про-водить инъекции 1 раз в неделю [465]. При этом желе-зо оптимально распределяется в организме, включаяпечень, селезенку и костный мозг [466].
В исследовании FAIR–HF введение ферринжектав сравнении с контролем приводило к достоверномуулучшению клинического состояния уже после второйинъекции. Суммарно 50 % пациентов, получавших фер-ринжект, и лишь 27 % в контроле отметили значительноеулучшение клинического состояния и 47 % достигли I ФКХСН (против 30 % в контроле). Увеличение дистанции6-мин ходьбы составило 40 метров (против 10 метровв контроле), и СКФ увеличилась на 4 мл / мин, что сви-детельствует об улучшении функция почек. При этомриск заболеваемости и смертности был на 6,5 % меньшев группе лечения ферринжектом, что, вкупе с отсутстви-ем серьезных побочных реакций, позволяет рекомен-довать подобное лечение больным ХСН с железодефи-цитной анемией [464]. В настоящее время проводятсяеще два более длительных исследования по применениюферринжекта в лечении пациентов с ХСН и сопутству-ющей анемией.
Статины при ишемической этиологииХСН (класс рекомендаций IIB,уровень доказанности А)
До 2007 года вопрос об эффективности примене-ния статинов в лечении ХСН оставался открытым.Результаты ретроспективных анализов, когортныхисследований и протоколов по принципу «случай–контроль» демонстрировали, что статины могуткак снижать риск развития ХСН, так и улучшать про-гноз пациентов с уже развившейся декомпенсацией[467, 468]. Многочисленность и абсолютная одно-направленность имеющихся данных позволяли пред-полагать способность дополнительного улучшенияпрогноза больных ХСН ишемической этиологиипри назначении статинов.
Учитывая, что снижение уровня ЛПНП не являетсяединственным механизмом положительного действиястатинов у больных ХСН, большое значение придавалось плейотропным эффектам этого класса лекарств[469]. В этой связи обсуждался даже вопрос о возмож-ности применения этого класса лекарств в лечении ХСНне только ишемической этиологии [467, 468].
Однако завершение двух крупных многоцентровыхпроспективных исследований по применению статинову больных ХСН ишемической (CORONA) и различной,в том числе и неишемической этиологии (GISSI–HF),не оправдало возлагавшихся надежд [470, 471].
Ни в одном из исследований применение розуваста-тина в дозе 10 мг / сут (на фоне максимальной терапииХСН) не приводило к улучшению прогноза больныхХСН, несмотря на достоверное снижение атероген-ного ХС липопротеидов низкой плотности и уровняС-реактивного белка. Возможным объяснением неудачиможет быть то, что у больных ХСН IIБ – III стадии, осо-бенно при развитии кардиального цирроза печени, уро-вень ХС может снижаться, что является одним из преди-кторов неблагоприятного прогноза [472–474].
У больных ХСН ишемической этиологии (исследова-ние CORONA) применение розувастатина достоверноуменьшало риск госпитализаций, в том числе связанныхс обострением ХСН и, по данным ретроспективногоанализа, суммарную частоту инфарктов и инсультов.В группе больных со смешанной, в том числе и неише-мической (около половины больных) этиологией ХСН(исследование GISSI–HF), применение розувастатинане меняло не только показатели смертности, но и заболеваемости (число госпитализаций).
В обоих исследованиях была подтверждена высокая безопасность лечения розувастатином даже у декомпен-сированных больных при нарушениях функции печении почек. В исследовании CORONA отмена розувастати-на из-за нежелательных реакций происходила достовернореже, чем плацебо.
На основании полученных данных можно дать практи-ческие рекомендации по применению статинов у больныхс риском и с уже развившейся ХСН: статины являютсяэффективным средством профилактики появления ХСНу больных с наличием коронарной болезни сердца, дажеу пациентов с исходно низким уровнем ХС ЛПНП [475]; применение статинов при уже развившейся ХСН не сопро-вождается улучшением прогноза больных, вне зависимостиот этиологии; у больных с ишемической этиологией ХСНприменение розувастатина в дополнение к оптимальнойтерапии ХСН позволяет снижать число госпитализаций(в том числе из-за обострения ХСН) и уменьшать вероят-ность ОИМ и инсульта; переносимость розувастатинане отличается от плацебо даже у пациентов с выраженнойХСН; если статины были назначены больному с коронар-ной болезнью сердца, терапия может быть (и должна!) безопаснопродолжена при присоединении симптомов ХСН.
Для практического использования у пациентов с ише-мической этиологией ХСН сегодня рекомендуется при-менение розувастатина в дозе 10 мг / сут.
Ретроспективные анализы и мета-анализы небольшихисследований позволяют предположить, что препаратомвыбора у больных ХСН может оказаться аторвастатин(10 мг / сут), хотя и это требует подтверждения (класс IIB,уровень доказанности В) [476].
Кроме того, в первые три месяца лечения больных ХСНстатинами требуется регулярный контроль уровней печеноч-ных трансаминаз, а также креатинфосфокиназы. При повы-шении уровня АСТ и АЛТ более чем в три раза от исход-ных или КФК в 10 раз выше нормы, а также при появлениимышечных болей лечение статинами необходимо прервать.В остальном контроль безопасности терапии не отличаетсяот пациентов, не имеющих симптомов ХСН, как изложенов Рекомендациях РКО по лечению атеросклероза [141].
Антиагреганты (в частности, аспирин)в лечении ХСН (класс рекомендацийIIB, уровень доказанности В)
Вопрос о применении аспирина в лечении ХСН остается не до конца решенным. Проблема – в возможностиблокады синтеза простациклина даже при использо-вании самой малой дозы препарата – 75 мг [208, 477].Блокада фермента циклооксигеназы, определяющаямеханизм действия аспирина и других НПВП, чреватаодновременным ослаблением эффекта иАПФ, диурети-ков, альдактона и даже β-АБ с вазодилатирующими свой-ствами – карведилола (класс IIA, уровень доказанностиВ) [168, 207, 478, 479].
С этой точки зрения применение антиагрегантовс другим механизмом действия (клопидогрел), которые позволяют достигать антиагрегационного эффектабез блокады фермента циклооксигеназы, выглядит теоретически более обоснованным, хотя клинических подтверждений этому нет. Следовательно, аспирин и другие антиагрегантыдолжны применяться у больных ХСН лишь при строгихпоказаниях. Поэтому позиции по применению антиагре-гантов у пациентов с клинически выраженной ХСН сво-дятся к следующему:
A) убедительных данных о целесообразности примене-ния антиагрегантов для лечения ХСН нет (за исключением раннего периода (до 8 недель) после пере-несенного ОИМ). При назначении антиагрегантовнарастает риск геморрагических осложнений, вклю-чая желудочно-кишечные кровотечения и геморраги-ческие инсульты [480];
B) назначение аспирина достоверно увеличивает числогоспитализаций, связанных с обострением декомпен-сации (класс IIB, уровень доказанности В) [135, 136];
C) при необходимости использования аспирина тео-ретически более оправданным выглядит его соче-тание с АРА (а не с иАПФ), хотя контролируемыхклинических исследований, подтверждающих этоположение, нет;
D) иАПФ более обоснованно сочетать с дезагреганта-ми, имеющими другой механизм действия (клопидо-грел), хотя и это положение не подтверждено клини-ческими исследованиями;
E) двойная антитромботическая терапия при ХСНне показана (за исключением случаев ангиопластикис применением стентов с лекарственным покрытием)[391, 481];
F) большинство имеющихся на сегодня результатовретроспективных анализов МРКИ (при отсутствиипроспективных исследований) позволяют констати-ровать, что хотя некий негативный момент во взаимо-действии малых доз аспирина (75–100 мг!) и иАПФприсутствует, совместное использование этих препа-ратов у больных, перенесших ОИМ и имеющих ХСН,возможно [216, 221, 482, 483];
G) нужно избегать назначения НПВП (включая дозыаспирина >325 мг) больным ХСН, находящим-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти (вплоть до развития отека легких).
Цитопротекторы (триметазидинмедленного высводождения = триметазидинМВ) при лечении ХСН ишемическойэтиологии (класс рекомендаций IIA,уровень доказанности В)
Единственным препаратом этого класса, рекомен-дуемым для лечения стенокардии, является ингибиторфермента 3КАТ триметазидин, переводящий синтезвысокоэнергетических соединений в миокарде на болееэкономный аэробный путь [355, 484]. Это единствен-ный цитопротектор, клиническая эффективность кото-рого была исследована у больных со стенокардией в пол-ноценных МРКИ, причем как в виде монотерапии, таки при комбинированном лечении. Последние мета-ана-лизы продемонстрировали способность триметазидинаМВ достоверно уменьшать стенокардию и увеличиватьвремя нагрузки до появления изменения сегмента ST[485, 486]. Кроме того, длительное лечение триметази-дином МВ может положительно влиять на прогноз боль-ных, перенесших ОИМ, при котором высока вероят-ность появления ХСН [487].
Учитывая, что метаболический дисбаланс являетсяодним из важных механизмов развития и прогрессирова-ния ХСН (особенно ишемической этиологии), возмож-ность активации аэробного гликолиза при использованиитриметазидина МВ может рассматриваться, как реальныйспособ лечения декомпенсированных больных [488, 489].Сегодня в довольно большом числе плацебо-контроли-руемых исследований убедительно продемонстрирова-но, что длительное лечение триметазидином больныхХСН ишемической этиологии сопровождается не толькоулучшением клинического состояния больных и качестважизни, но и приростом ФВ ЛЖ (в пределах 7 %), а так-же уменьшением ремоделирования сердца [490–492].Высокая клиническая эффективность триметазидина МВпри ХСН потверждена и в Российских многоцентровыхпрограммах ПРИМА и ПРЕАМБУЛА [493].
Вопрос о влиянии триметазидина МВ на заболе-ваемость и смертность при ХСН требует дальнейшихисследований. Однако результаты последних мета-ана-лизов показывают cнижение риска госпитализацийиз-за обострения ХСН при применении триметазиди-на МВ в пределах 50 % [492, 494]. Эти предположенияподтвердились и в самом крупном когортном иссле-довании (669 больных) по применению триметазиди-на у больных ХСН ишемической этиологии. Лечениетриметазидином с большой достоверностьтю снижалориск смерти и обострения ХСН на 11,4 % и продлеваложизнь без осложнений на 7,8 месяца [495]. Имеющиесярезультаты диктуют необходимость проведения круп-ного проспективного МРКИ для окончательного опре-деления места триметазидина в лечении ХСН ишемиче-ской этиологии.
Данные по лечению триметазидином больных ХСНнеишемической этиологии слишком малочисленныдля сколько-нибудь серьезных выводов.
Таким образом, назначение триметазидина МВ долж-но быть рассмотрено у больных ХСН ишемическойэтиологии в дополнение к основным средствам лечениядекомпенсации для устранения симптомов, нормализа-ции гемодинамики (и роста ФВ ЛЖ) и возможного сни-жения риска смерти и повторных госпитализаций (классрекомендаций IIA, уровень доказанности В).
Более жесткой должна быть позиция по отношениюк препаратам с неясным механизмом действия и недока-занной клинической эффективностью, хотя многие из нихпозиционируются, как кардиопротекторы или метаболи-чески активные средства. Поэтому использование таури-на, карнитина, милдроната в лечении ХСН не показано(класс III, уровень доказанности С).
Периферические вазодилататоры (классрекомендаций IIB, уровень доказанности В)
В настоящее время ПВД не входят в число препаратовпервой линии, используемых для лечения ХСН. На прогноз, количество госпитализаций, прогрессированиеболезни они не влияют.
Исключение составляет применение комбинациинитратов (венозных вазодилататоров) с гидралазином(артериолярными вазодилататорами) у пациентов негроидной расы. У этого контингента пациентов подобнаякомбинация (в дополнение к иАПФ, β-АБ, диуретикам)может способствовать улучшению прогноза [496–498].У лиц белой расы всегда более предпочтительно исполь-зование иАПФ [221, 498]. Кроме того, применение ком-бинации нитратов с гидралазином стимулирует развитиепобочных реакций (гипотония, тахикардия), которыезатрудняют лечение больных ХСН [499].
Нитраты могут даже негативно влиять на прогнозбольных ХСН и затруднять применение иАПФ, т. е. сни-жать эффективность последних (класс IIB, уровень дока-занности С) [202].
Нитраты могут назначаться при ХСН лишь при нали-чии доказанной ИБС и стенокардии, которая проходитименно (только) от нитропрепаратов. Во всех остальныхслучаях нитраты при ХСН не показаны.
В качестве артериолярных ПВД можно применятьлишь дигидропиридины длительного действия (предпо-чтительно амлодипин), а не гидралазин.
Следует помнить, что сопутствующее лечение вазо-дилататорами лишь затрудняет использование абсолют-но необходимых в терапии декомпенсации препаратов –иАПФ, АРА и β-АБ из-за дополнительной способностик снижению АД. Кроме того, применение прямых ПВДсопровождается активацией нейрогормонов, что чреватопрогрессированием ХСН [202, 269].
Негликозидные инотропные средства в леченииХСН при симптомной гипотонии и остройдекомпенсации сердечной деятельности (классрекомендаций IIB, уровень доказанности В)
Применение негликозидных инотропных средств,несмотря на кратковременное улучшение гемодинамикии клинического состояния больных с обострением деком-пенсации, при долгосрочном наблюдении повышает рисксмерти больных ХСН. Более того, даже кратковременнаяинотропная поддержка в период обострения декомпенсации может негативно повлиять на отдаленный прогноз больных ХСН (класс IIA, уровень доказанности В). Поэтому сегодня эти препараты не рекомендованыдля лечения ХСН [500–503].
При критическом состоянии (при обострении ХСН)лучше всего использовать сенситизатор кальция лево-симендан (болюс 12 мкг / кг, затем внутривенно капель-но 0,1–0,21 мкг / кг / мин). Этот препарат максимальноулучшает показатели гемодинамики, не имеет негатив-ных взаимодействийс β-АБ (в отличие от добутамина)и рекомендован ЕОК для лечения обострения ХСН [261,504]. Впервые способность левосимендана улучшатьпрогноз больных после ОИМ была продемонстрирова-на в исследовании RUSSLAN, проводившемся в России[505]. Однако при длительном лечении левосимендан,как и другие негликозидные инотропные стимуляторы,не влияет на прогноз больных ХСН [502].
Внутривенное введение добутамина (внутривенноекапельное введение со скоростью 2,5–10 мкг / кг / мин)должно проводиться лишь при симптомной гипотониипо витальным показаниям, учитывая его негативное вли-яние на прогноз.
Средства, не рекомендованныек применению при ХСН cо сниженнойФВ ЛЖ (класс рекомендаций III)
Применение этих препаратов должно быть, по воз-можности, исключено при лечении декомпенсации.К ним относятся:
A) НПВП (селективные и неселективные, включаядозы аспирина >325 мг). Особенно неблагоприят-но их использование у больных ХСН, находящих-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти, вплоть до развития отека легких;
B) Глюкокортикоиды. Применение стероидных гор-монов имеет чисто симптоматические показанияв случаях упорной гипотонии и тяжелого отечно-го синдрома для облегчения начала лечения иАПФ,диуретиками и β-АБ. С другой стороны, возмож-ность опасных для жизни осложнений ограничиваетиспользование этих препаратов;
C) Трициклические антидепрессанты;
D) Антиаритмики I класса;
E) Некоторые БМКК (верапамил, дилтиазем, коротко-действующие дигидропиридины).
Медикаментозная терапия больных ХСНс сохраненной систолической функцией ЛЖ(ФВ ЛЖ >50 %) или диастолической ХСН
Нижеприведенные рекомендации носят, скорее, предположительный характер ввиду ограниченности имеющихся данных по вопросу лечения больных ХСН–ССФили ДСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследованийу этой категории больных.
В настоящее время отсутствуют убедительныедоказательства улучшения выживаемости при исполь-зовании какого‑либо специфического медикамен-тозного лечения у пациентов с ХСН–ССФ или ДСН.Тем не менее эффективность применения некоторыхпрепаратов была показана в отдельных исследованияхи продолжает изучаться.
Наиболее агрессивным апологетам доказательноймедицины следует напомнить, что отсутствие дока-зательств возможности улучшения прогноза больныхне может обосновывать бездействие и оставление паци-ентов без надежды хотя бы на клиническое улучшениесостояния.
Кроме того, первым и обязательным условием являет-ся выявление и коррекция всех факторов и заболеваний,способствующих развитию диастолических расстройств,появлению и прогрессированию ХСН–ССФ. К нимчаще всего относятся АГ и ГЛЖ, ИБС, констриктивныепоражения миокарда / перикарда, СД, ожирение и т. д.Поэтому контроль АД, успешное лечение ИБС, кор-рекция уровня глюкозы, нормализация массы тела, уме-ренные физические нагрузки могут быть важным под-спорьем в успешном ведении этой сложной для лечениягруппы больных.
Как известно, что блокаторы РААС (иАПФ, АРА)и β-АБ относятся к основным средствам лечения пода-вляющего числа заболеваний, приводящих к ХСН–ССФ,поэтому их наличие в числе препаратов, рекомендованных больным ДСН, не вызывает сомнений. Гораздо труд-нее обосновать бездействие и отсутствие попыток лече-ния больных ХСН–ССФ, несмотря на ограниченностьклинических исследований.
Для возможного улучшения диастолического наполне-ния ЛЖ показан контроль ЧСС.
Следует принять адекватное решение и выбрать соот-ветствующие меры по вопросу профилактики, восстановления и поддержания синусового ритма у больныхс мерцательной тахиаритмией согласно принятым реко-мендациям [30, 506]. При сохранении постоянной фор-мы мерцания предсердий необходимо добиться нормали-зации частоты желудочковых сокращений.
Ингибиторы АПФ
Ингибиторы АПФ способны напрямую улучшатьрелаксацию и растяжимость миокарда, а также оказыватьопосредованное действие на диастолические свойстваЛЖ за счет своего гипотензивного эффекта и способ-ности уменьшать выраженность гипертрофии и фибро-за миокарда. В ранних исследованиях было показано,что терапия иАПФ пациентов с СН–ССФ достовернопродлевает время до вынужденной госпитализациииз‑за развития декомпенсации, хотя и не снижает смерт-ность [507]. Достоверное улучшение суррогатных конеч-ных точек (функционального статуса, толерантностик нагрузке, качества жизни) у больных ХСН с относитель-но сохраненной сократимостью (ФВ >45 %) было показа-но в проспективном российском исследовании ФАСОН[508]. Единственное завершившееся к настоящему вре-мени плацебо-контролируемое исследование по оценкевлияния иАПФ на выживаемость пожилых больных ДСН(>70 лет) – (PEP–CHF), выполненное с периндоприлом,не показало достоверного снижения общей или сердеч-но-сосудистой смертности на фоне лечения иАПФ [509].Тем не менее через 1 год после начала исследования тера-пия иАПФ ассоциировалась с достоверным снижениемриска внеплановой госпитализации из-за декомпенсации(OP 0,63; ДИ 0,40–0,97; p=0,033). Клинически у пациен-тов, находившихся на лечении периндоприлом, отмечал-ся достоверно меньший ФК ХСН и достоверно бóльшимбыл прирост дистанции теста 6‑мин ходьбы [509]. Болеетого, ретроспективный анализ показал, что в подгруппемоложе 75 лет эффект периндоприла был более отчетли-вым и сопровождался снижением риска смерти и количе-ства госпитализаций из-за обострения ХСН.
Мета-анализ всех исследований по применениюиАПФ в лечении больных с ХСН–ССФ продемонстри-ровал снижение риска смерти без достоверного влиянияна риск госпитализаций, в том числе связанных и с обо-стрением ХСН [510].
Таким образом, иАПФ пока не доказали своей способ-ности улучшать прогноз пациентов с ХСН–ССФ и ДСН,однако их применение у таких больных абсолютнооправдано, по крайней мере, в связи с улучшением функ-ционального статуса пациентов и уменьшением рискавынужденных госпитализаций (класс рекомендаций IIA,уровень доказательности В).
Антагонисты рецепторов к АII
По степени положительного влияния на ГЛЖ и выра-женность фиброза АРА не уступают иАПФ, а по способности устранять диастолические расстройства могут даже превосходить иАПФ [511, 512].
Эффективность АРА по влиянию на заболеваемость и смертность при лечении пациентов с ХСН и сохранной систолической функцией ЛЖ выглядит умеренной.При применении кандесартана в группе больных ХСНс ФВ ЛЖ <40 % число госпитализаций из-за обостренияХСН достоверно снижалось, хотя улучшения прогно-за не наблюдается [259]. Еще более разочаровывающиерезультаты были получены при попытке лечения ХСНс сохранной систолической функцией сердца в исследовании I-PRESERVE с ирбесартаном. Препарат не влиялни на смертность, ни на число госпитализаций, ни на про-грессирование ХСН [126].
Таким образом, АРА пока также не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН.Тем не менее, как показали итоги исследования CHARM–preserved, применение АРА кандесартана при диасто-лических расстройствах позволяет, по меньшей мере,снизить частоту госпитализаций, и его использованиев таких ситуациях обосновано, особенно при неперено-симости иАПФ (класс рекомендаций IIB, уровень дока-зательности В).
Блокаторы β-адренергических рецепторов
β-АБ могут быть назначены больным ХСН–ССФс целью уменьшения ЧСС (увеличения периода диа-столического наполнения ЛЖ) и выраженности ГЛЖ(уменьшения жесткости камеры ЛЖ). ИсследованиеSWEDIC [513] показало, что α-, β-адреноблокаторкарве-дилол, помимо снижения ЧСС, оказывает положительноевлияние на допплер–ЭхоКГ показатели релаксации ЛЖу больных ДСН. Специальных работ по изучению влия-ния β-АБ на выживаемость больных СН–ССФ или ДСНне проводилось. Однако в исследовании SENIORS с неби-вололом, в которое было включено более 700 пожилыхбольных с незначительно сниженной сократимостью (ФВЛЖ >35 %), терапия этим β-АБ ассоциировалась со сни-жением комбинированного показателя общей смертно-сти или госпитализации по сердечно-сосудистым причи-нам (класс IIB, уровень доказательности С) [514].11.2.4. Блокаторы медленныхкальциевых каналов (БМКК)
С той же целью, что и β-АБ, может быть использованБМКК верапамил. Однако, как показало исследованиеDAVIT II, у больных в раннем постинфарктном перио-де назначение верапамила при наличии СН в анамнеземалоэффективно [515]. Таким образом, назначение вера-памила больному ДСН для снижения ЧСС может бытьрекомендовано только в случае непереносимости β-АБи при отсутствии выраженной ХСН, проявляющейся,например, задержкой жидкости (класс IIB, уровень дока-зательности С).
Начаты исследования и по применению селективногоблокатора If -токов в клетках синусового узла ивабрадинас целью урежения ритма и возможного влияния на клини-ку, заболеваемость и прогноз больных ХСН–ССФ с сину-совым ритмом.
Диуретики
Диуретики могут быть необходимы в случае задержкижидкости в организме, но у пациентов с ДСН их следуетиспользовать с осторожностью, чтобы не вызвать чрез-мерного снижения преднагрузки на ЛЖ и падения сер-дечного выброса (класс IIB, уровень доказательности С).Среди других следует выделить торасемид, обладающийдлительным (до 18 часов) диуретическим эффектом,меньшим, чем у фуросемида, калийуретическим действи-ем [337], и что может быть особенно важно для больныхДСН – обладает собственным антифибротическим влия-нием на миокард [516].
Сравнительные исследования с фуросемидом показа-ли способность торасемида в большей степени улучшатьдиастолические свойства ЛЖ [517]. Однако проспектив-ных исследований по влиянию торасемида на заболевае-мость и смертность у больных ХСН с преобладающимидиастолическими расстройствами еще не проводилось.
Антагонисты МКР
Антагонисты МКР у больных с диастолическимирасстройствами должны рассматриваться не столькокак калийсберегающие диуретики, сколько как анти-фибротические препараты. До настоящего временине закончено ни одного плацебо-контролируемого иссле-дования по оценке влияния антагонистов альдостеро-на на выживаемость больных диастолической СН. Хотямногочисленные экспериментальные и клиническиеисследования продемонстрировали способность АМКР(в том числе в сочетании с иАПФ и АРА) к уменьшениюфиброза и улучшению диастолического наполнения ЛЖкак при сниженной, так и при сохранной ФВЛЖ. В насто-ящее время завершается первое МРКИ исследование,целью которого является изучение влияния спиронолак-тона (плюс к иАПФ или АРА) на выживаемость больныхс начальной и умеренной стадиями ХСН и ФВ ЛЖ >45 %(TOPCAT), результаты которого ожидаются в 2014 году.
Сердечные гликозиды
Ритмурежающее действие сердечных гликозидов (дигоксина) может быть полезно для пациентов с ФП, которая встречается примерно у 30 % больных с диастолической СН[16]. Однако результаты исследования DIG [518] показали,что даже независимо от характера основного ритма применение дигоксина ассоциируется с более чем 30 %-м сниже-нием госпитализаций из-за декомпенсации ХСН у больныхкак со сниженной (<45 %), так и с относительно сохранной(>45 %) ФВ ЛЖ. Более того, субанализ этого исследования ме крови (<0,9 нг / мл) отмечается достоверное снижениериска смерти и госпитализаций по любым причинам, в т. ч.и у больных с сохраненной систолической функцией [519].Положительный эффект дигоксина может быть связанс увеличением сократимости спиральных волокон миокар-да, определяющих активную позднюю фазу опорожненияЛЖ («скручивание») и активную же раннюю фазу диа-столического наполнения («раскручивание» и присасыва-ющий эффект) в большей степени, чем со снижением ЧСС(особенно при синусовом ритме). Подобный эффект былпоказан почти 40 лет назад при изучении гемодинамическихэффектов сердечных гликозидов с помощью динамическойэхокардиографии в реальном масштабе времени [520].
Доза дигоксина не должна превышать 0,25 мг, а кон-центрация в плазме – 1,1 нг / мл. При необходимостиснижения ЧСС у больных ХСН–ССФ с синусовымритмом следует отдать предпочтение комбинации β-АБс дигоксином.
Мета-анализ всех 30 основных проспективных иссле-дований и когортных наблюдений, включивший анализтерапии более 53 тысяч пациентов с ХСН–ССФ, проде-монстрировал, что проводимое лечение (не только иАПФ,АРА, β-АБ и дигоксином, но и БМКК, и вазодилататора-ми) улучшает клиническое состояние и переносимосьфизических нагрузок, но не влияет на прогноз [521]. Этоеще раз подчеркивает сложность эффективного лечениярассматриваемой группы больных и должно стимулиро-вать поиск новых подходов к терапии ХСН–ССФ.
Лечение острой декомпенсации ХСН
Лечение зависит от преобладающих клиническихсимптомов.
Оксигенотерапия
Оксигенотерапия должна проводиться всем пациентам с ОДСН до достижения сатурации кислорода ≥95или ≥90 % у пациентов с ХОБЛ (класс рекомендаций I,уровень доказанности С).
Диуретики
Диуретики показаны при наличии отечного синдрома(класс рекомендаций I, уровень доказанности В).
Назначая диуретики при ОДСН, следует руководство-ваться данными, представленными в таблице 26.
Таблица 26. Рекомендации для назначения диуретиков при ОДСН
Подробные показания к назначению ОАКГ в разныхклинических ситуациях представлены в таблицах 24 и 25. При фибрилляции предсердий наиболее вероятнообразование тромбов, являющихся источником тромбо-эмболических осложнений в гемодинамически неактив-ных участках, прежде всего в ушке левого предсердия.Исходя из этого на протяжении последних 20 лет обсуж-дается закрытие (сначала хирургическое, а сейчас транска-тетерное) ушка левого предсердия с целью профилактикитромбоэмболий и как альтернатива ОАКГ. Однако факти-ческих данных пока недостаточно для строгих выводов.В МРКИ PROTECT–AF использование наиболее попу-лярной системы в виде имплантируемого трансвенознос последующей пункцией межпредсердной перегородкираскрывающегося «зонтика», блокирующего ушко лево-го предсердия (Watchman), сравнивалось с ОАКГ. Былодоказано, что окклюзия ушка левого предсердия не усту-пала по эффективности ОАКГ, но приводила к большемучислу осложнений, в том числе кровотечений [397]. Болеетого, с накоплением опыта риск осложнений при транс-катетерном закрытии ушка левого предсердия снижал-ся и не отличался от группы ОАКГ [398]. Плюс к томузакрытие ушка левого предсердия не должно противопо-ставляться ОАКГ [399]. Хотя в настоящее время закры-тие ушка левого предсердия с целью профилактики тром-боэмболических осложнений у пациентов с ХСН и ФПимеет невысокий класс доказательств IIb и уровень дока-занности B, интерес к этому методу сохраняется, в томчисле с использованием новых устройств.
Коэнзим Q10
Интерес вызывают перспективы применения коэнзима Q10 в комплексном лечении ХСН. Убихинон (или коэн-зим Q10) может способствовать улучшению переносаэлектронов в митохондриальной дыхательной цепи, уве-личивать синтез АТФ в миокарде и одновременно облада-ет антиоксидантными свойствами, позволяющими нор-мализовать функцию эндотелия [400].
Низкая концентрация коэнзима Q10 в крови больныхХСН является предиктором плохого прогноза, при-чем по своей предсказующей значимости может дополнять такой общепринятый маркер, как МНУП [401].Исследования по применению убихинона в лечениибольных ХСН показали и клиническую эффективность,и способность увеличивать ФВ ЛЖ, и нормализоватьфункцию эндотелия. Мета-анализ 2013 года выявил, чтопри добавлении убихинона к оптимальной терапии при-рост ФВ ЛЖ составлял в среднем на 3,67 % [402].
Наконец, в 2013 году появились данные о возмож-ном влиянии коэнзима Q10 на прогноз больных ХСН.В Шведском проспективном исследовании, продолжавшемся более 4 лет, было продемонстрировано 55 %-е снижение риска смерти больных ХСН на фоне приема ком-бинации коэнзима Q10 и селена [403].
Еще больший резонанс вызвало окончание много-центрового плацебо-контролируемого исследованияпо применению коэнзима Q10 у больных ХСН III–IV ФК(Q-SYMBIO) [404].
В этом исследовании, включавшем 420 пациентов,находившихся на оптимальной терапии, длительное при-менение коэнзима Q10 вдвое снижало риск смерти пациентов с тяжелой ХСН (с 17 до 9 %, р=0,01) и комбинированной конечной точки смерть плюс госпитализации,связанные с обострением ХСН (с 25 до 14 %, р=0,003).Причем в обоих исследованиях переносимость коэнзимаQ10 не отличалась от плацебо.
Казалось бы, на результатах двух относительно небольших по объему исследований трудно делать окон-чательные выводы, но возможность улучшения прогнозабольных ХСН с помощью коэнзима Q10 явилась одной из наиболее обсуждаемых новостей 2013 года.
В РФ в настоящее время также проводится плацебо-контролируемое исследование по применению водо-растворимой формы коэнзима Q10 у больных ХСН(КУДЕСНИК).
Препараты, не влияющие на прогнозпри ХСН, но улучшающие симптоматикув определенных клинических ситуациях
Антиаритмические средства в лечении ХСНс желудочковыми нарушениями сердца (классрекомендаций IIB, уровень доказанности А)
Подавляющее число больных ХСН имеют опасныедля жизни желудочковые нарушения ритма сердца (IIIи выше градации по классификации Lown–Wolf) [405–407]. До ⅔ больных с начальными стадиями декомпенсациии до ⅓ пациентов даже с финальными стадиями ХСНумирают внезапно (скорее всего, из-за наличия аритмий)[279, 408, 409]. Причем улучшение гемодинамики неисключает возможность развития опасных аритмий, кото-рые могут потребовать специального лечения [410, 411].
Основные позиции при лечении желудочковых арит-мий у больных ХСН сводятся к следующему:
A) лечения при ХСН требуют лишь опасные для жиз-ни и симптомные желудочковые нарушения ритма сердца (класс IIA, уровень доказанности В) [1, 4, 6,8, 407, 412];
B) антиаритмики I класса (блокаторы натриевых кана-лов) и IV класса (БМКК) противопоказаны больным ХСН (класс III, уровень доказанности А) [413];
C) во всех случаях средством выбора в лечении больных ХСН и желудочковыми нарушениями сердечного ритма являются β-АБ, обладающие умеренным анти-аритмическим, но выраженным антифибрилляторным действием, что позволяет им достоверно снижать риск внезапной смерти [278, 279, 287, 414];
D) При неэффективности β-АБ для антиаритмического лечения применяются препараты III класса (из зарегистрированных в России – амиодарон и соталол) [4, 6].
Средством выбора для лечения симптомных и жизне-угрожающих нарушений ритма сердца у больных, пере-несших ОИМ и имеющих клинически выраженную ХСН,является амиодарон. Его использование не только устра-няет желудочковые нарушения ритма сердца, но можетвлиять и на риск внезапной смерти. Амиодарон досто-верно снижает риск внезапной смерти у декомпенсиро-ванных больных с желудочковыми аритмиями (на 28,4 %),риск сердечно-сосудистой смертности (на 18,2 %),в то время как риск общей смертности достоверноне меняется (класс IIA, уровень доказанности В) [415].Важно помнить, что сочетание β-АБ с амиодароном явля-ется рациональным и эффект амиодарона проявляетсямаксимально ярко именно при сочетании с β-АБ (классIIA, уровень доказанности В) [416]. Более эффективногосредства борьбы с желудочковыми аритмиями, чем амио-дарон, до настоящего времени нет.
Поддерживающая доза амиодарона не должна пре-вышать 100–200 мг / сут для минимизации риска экстракардиальных побочных эффектов (чаще всего, особеннов России – нарушение функции щитовидной железы).Разработан совместный алгоритм лечения амиодарономбольных с жизнеугрожающими аритмиями и проблема-ми со стороны щитовидной железы кардиологами и эндо-кринологами, позволяющий долгое время проводитьтерапию эффективно и с минимальным числом осложне-ний [417]. Использование амиодарона всегда подразуме-вает реальную оценку соотношения польза / риск.
Применение амиодарона у пациентов без симптомоваритмии с целью первичной профилактики внезапнойсмерти малоэффективно. У пациентов с умеренной ХСНего эффект не выражен, а при прогрессировании деком-пенсации до III–IV ФК амиодарон может даже увеличи-вать риск смерти [418]. Наиболее оправданным мето-дом профилактики внезапной смерти у больных ХСНс жизнеугрожающими аритмиями является постановкаимплантируемого кардиовертера–дефибриллятора.
Альтернативой амиодарону может быть соталол –антиаритмик III класса, имеющий дополнительные свой-ства β-АБ. По влиянию на желудочковые нарушения рит-ма сердца соталол лишь немного уступает амиодарону[419]. Соталол имеет существенно меньше внесердечныхпобочных реакций в сравнении с амиодароном, но чащевызывает проаритмии, особенно у больных с тяжелымпоражением миокарда [420]. Доза соталола титрует-ся подобно другим β-АБ, начиная с 20 мг 2 раза в сутки.Через 2 недели дозу увеличивают до 40 мг 2 раза в сутки,еще через две недели до 80 мг 2 раза в сутки и, наконец,еще через две недели до максимальной – 160 мг 2 разав сутки. С увеличением дозы препарата и тяжести ХСНувеличивается опасность проаритмических осложнений,поэтому у больных ХСН III–IV ФК нежелательно превы-шать суточную дозу 160 мг [420].
Отдельного внимания заслуживает проблема ФП,которая в качестве основного ритма или пароксизмоврегистрируется почти у 40 % пациентов с клинически выраженной ХСН [421]. Сведения о влиянии ФП на про-гноз больных ХСН противоречивы [422, 423]. ЛечениеФП у больных ХСН должно проводиться по принципам,изложенным в последних руководствах ЕОК по диагно-стике и лечению этого вида нарушения ритма [424, 425].
При ФП нет доказательств, что восстановление сер-дечного ритма превосходит терапевтическую тактику,предполагающую контроль ЧСС, особенно у больных ХСН (класс IIA, уровень доказанности В) [426–428].Поэтому целесообразность восстановления синусовогоритма (электрическая дефибрилляция или медикаментозное купирование) оставляется на усмотрение врача. Эффективность электрической дефибрилляции достигает 90 %, но в течение первого года синусовый ритмудерживается не более чем у 30 % больных, что требуетактивной поддерживающей терапии [429]. Из меди-каментозных средств поддержания синусового ритмасегодня в основном применяются антиаритмики III класса, из которых наиболее эффективным представляетсяамиодарон (69 % успешного удержания восстановленно-го синусового ритма), превосходящий по эффективно-сти соталол и антиаритмики I класса [430, 431]. Причемамиодарон может предупреждать возникновение новойФП, но не эффективен в конверсии ФП в синусовый ритм[432]. Кроме того, и по способности провоцироватьжизненноопасные желудочковые нарушения сердечногоритма при лечении больных ХСН с ФП амиодарон выгодно отличается от соталола [433] Антиаритмики I класса строго не рекомендованы у больных с дисфункцией ЛЖи при ХСН, несмотря на наличие ФП (класс III, степеньдоказанности А).
Единственным независимым предиктором лучшейвыживаемости больных ХСН с ФП является постоянныйприем антикоагулянтов при поддержании МНО в пределах от 2,0 до 3,0 (класс IIA, степень доказанности А) [391,426, 434, 435].
К факторам, способствующим вероятному повторно-му срыву ритма и рецидивированию ФП, относятся:A) пожилой возраст (более 65 лет),
B) давнее (более 6 месяцев) мерцание предсердий,
C) частые пароксизмы (рецидивы) ФП,
D) большие размеры левого предсердия (передне-задний размер более 4,2 см),
E) наличие тромбов в полостях сердца (в том числев ушке левого предсердия),
F) низкая ФВ ЛЖ (<35 %),G) выраженная гипертрофия ЛЖ.
В этих случаях восстановление синусового ритманецелесообразно.
Одним из основных принципов лечения больныхХСН и имеющейся (или угрожающей) ФП можносчитать применение не антиаритмических средств,а препаратов, блокирующих активность РААС (пре-жде всего иАПФ), β-АБ и статинов (upstream therapy).Считается, что, уменьшая степень ремоделированиясердца, подобная «неспецифическая» терапия спо-собна замедлять наступление ФП. Однако и в этомвопросе много неясного. Несмотря на обнадежива-ющие результаты мета-анализов [436, 437], проспек-тивные исследования не всегда заканчивались успешно.Например, АРА ни в одном из четырех проведенныхисследований не оказали влияния на риск ФП [438–441]. Однако лечение иАПФ и β-АБ необходимо про-водить всем больным ХСН независимо от характераосновного ритма.
Для контроля ЧСС при постоянной форме ФП наи-более эффективным может быть использование комби-нации сердечных гликозидов и β-АБ. В данном случаеиспользуются два аддитивных механизма. Дигоксинзамедляет атрио-вентрикулярную проводимость, умень-шает ЧСС покоя и «упорядочивает» ритм, устраняядефицит пульса и число гемодинамически неэффектив-ных сокращений [442, 443]. В то же время β-АБ за счетснижения симпатической стимуляции синусового узлапотенцируют брадикардитические эффекты дигоксинаи предотвращают появление тахикардии во время физи-ческих нагрузок [444, 445]. Данные последнего мета-ана-лиза показали, что применение одних β-АБ при систоли-ческой ХСН на фоне ФП не улучшает прогноза [349]. Этоне только свидетельство целесообразности их сочетанияс дигоксином, но и вопрос о том, с какого препарата сле-дует начинать лечение этой группы пациентов.
Комбинация дигоксина с β-АБ (в том числе и сотало-лом, способным удерживать синусовый ритм у 40 % боль-ных после кардиоверсии [430, 433]) позволяет эффек-тивно контролировать ЧСС у пациентов как с сохраняю-щейся ФП, так и с синусовым ритмом в межпри´ступныйпериод (класс IIA, степень доказанности В) [442–445].
Степень оптимального контроля ЧСС при ФПв отличие от синусового ритма не определена. В про-вокационном исследовании RACE-II было показа-но, что степень контроля ЧСС при ФП мало влияетна прогноз и достаточным можно считать ЧСС менее110 уд / мин [446]. Но, во-первых, это не были пациен-ты с ХСН, во-вторых, реально достигнутая ЧСС к кон-цу исследования в группе нестрогого контроля соста-вила 85 уд / мин и 76 уд / мин в группе строгого кон-троля, соответственно, и, в‑третьих, при высокой ЧССв покое резерв ее безопасного увеличения будет снижени сократит возможность выполнения физических нагру-зок без риска обострения декомпенсации. Поэтомупри ХСН и ФП все же наиболее оправдано снижениеЧСС хотя бы менее 85 уд / мин в покое.
При неэффективности медикаментозного контроляЧСС, на фоне отягощения течения ХСН может потре-боваться проведение радиочастотной аблации в надеж-де восстановить синусовый ритм, однако эта процедурадолжна проводиться, лишь когда исчерпаны все другиевозможности контроля ситуации.
Блокаторы медленных кальциевыхканалов при недостаточном контролеАД и легочной гипертензии (классрекомендаций IIB, уровень доказанности А)
Блокаторы медленных кальциевых каналов (БМКК),замедляющие ЧСС (верапамил и дилтиазем), не должныиспользоваться в лечении ХСН, т. к. ухудшают клиниче-ское течение ХСН II–IV ФК и повышают риск развитияотека легких. Использование этих БМКК (обязательнов сочетании с иАПФ, β-АБ, диуретиками, АМКР) можетрассматриваться при ХСН I ФК, преимущественновызванной диастолическими расстройствами (класс IIB,уровень доказанности С).
Из группы длительнодействующих дигидропириди-нов амлодипин (исследование PRAISE I и II) и фелоди-пин (исследование V–HeFT III) доказали способностьне ухудшать прогноз больных ХСН [447–450]. При этомв некоторых случаях применение этих препаратов можетулучшать клинику и уменьшать выраженность симптомовдекомпенсации. Возможными показаниями к исполь-зованию амлодипина или фелодипина в лечении ХСН(на фоне основных средств лечения) являются:
A) наличие упорной стенокардии,
B) наличие сопутствующей стойкой гипертонии,
C) высокая легочная гипертония, в том числе при сопут-ствующей ХОБЛ,
D) выраженная клапанная регургитация.
Применение дигидропиридиновых кальциевых антагонистов позволяет уменьшать степень клапанной регурги-тации (митральной и аортальной). Причем эффект дигидропиридинов сохраняется как при органической, таки относительной митральной недостаточности [170, 171].
К сожалению, применение дигидропиридинов у больных АГ может способствовать задержке жидкости и раз-витию симптомов ХСН [112, 202, 447]. Поэтому БМККс вазодилатирующими свойствами не применяютсядля профилактики ХСН.
Использование БМКК обязательно сочетается с лече-нием основными средствами терапии ХСН (иАПФ,АМКР, β-АБ, диуретики), что может нивелировать нега-тивные эффекты, связанные с гиперактивацией нейро-гормонов и задержкой жидкости.
Препараты железа при сопутствующейжелезодефицитной анемии (классрекомендаций IIA, уровень доказанности В)
При неосложненной ХСН наличие анемии не харак-терно, так как в ответ на недостаточно эффективноегемодинамическое обеспечение органов кровью и кислородом должен развиваться эритроцитоз и увеличиватьсяуровень гемоглобина. Однако в результате задержки жид-кости (гемодилюции), вторичного нарушения функциипочек, печени, снижению чувствительности костногомозга к ЭПО, около ⅓ пациентов с ХСН имеют уровеньгемоглобина менее 120 мг / л, что можно определить,как анемию [451]. Чем тяжелее ХСН, тем ниже среднийуровень гемоглобина, тем больший процент больныхимеет анемию [452]. Прогноз больных ХСН ухудшаетсяпараллельно снижению уровня гемоглобина, что позво-лило считать анемию одним из факторов не только ухуд-шения клинического состояния, но и увеличения рисказаболеваемости больных ХСН [453], причем вне зависи-мости от ФВ ЛЖ [454].
Учитывая эти факты, магистральным направлени-ем в лечении анемии у больных ХСН в последние годывиделось применение в комплексе эритропоэтина [455].Первые обнадеживающие результаты, продемонстри-ровавшие улучшение клинического состояния, умень-шение одышки, увеличение толерантности к нагрузкаму больных ХСН на фоне лечения эитропоэтином [456],стимулировали проведение крупномасштабного МРКИ,получившего название RED–HF. К сожалению, резуль-таты этого исследования не подтвердили первичнойгипотезы. Применение эритропоэтина (дарбепоэтина–альфа) не оказывало влияния ни на количество госпи-тализаций, ни на смертность больных ХСН с уровнемгемоглобина менее 120 мг / л [457]. При этом достовер-но в 3,5 раза увеличивался риск тромбозов и эмболийи в 1,7 раза – риск мозговых инсультов. Аналогичноеповышение риска сердечно-сосудистых осложненийотмечалось и при применении эритропоэтина у боль-ных ХБП и СД 2 типа [458].
Ранее подобные эффекты связывали с чрезмернымповышением уровня гемоглобина более 145 мг / л, пред-полагая, что его оптимальный уровень находится в пре-делах 120–140 мг / л [459]. Однако в исследовании RED–HF достигнутый уровень гемоглобина мониторировалсяи в среднем не превышал 130 мг / л, но тем не менее, рискосложнений возрастал [457].
Можно констатировать, что идея коррекции анемииу больных ХСН с помощью эритропоэтина не получиласвоего подтверждения. Эритропоэтин не должен при-меняться в лечении больных ХСН даже при сниженномуровне гемоглобина (класс рекомендаций III, уровеньдоказанности А).
С другой стороны, среди всех случаев анемии у паци-ентов с ХСН ¾ относятся к железодефицитным состо-яниям [460]. Об этом свидетельствует сочетание сни-женного гемоглобина (менее 120 мг / л) и уменьшениесодержания сывороточного железа (менее 10 мкмоль / лжелеза). Более точная оценка характера анемии можетбыть сделана на основании содержания ферритина(снижается ниже 100 нг / мл в случаях абсолютногодефицита железа) или насыщения трансферрина желе-зом (ниже 20 %). Низкий уровень насыщения транс-феррина железом при наличии сохранного уровняферритина может свидетельствовать об относительномдефиците железа.
В этих случаях логичным и эффективным должнобыть использование препаратов железа. Хотя пероральные препараты железа кажутся удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасыванияи часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10–40 % пациен-тов), которые снижают приверженность к лечению.Внутривенное введение препаратов железа обоснова-но в тех случаях, когда необходимо быстро добитьсяэффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих ССЗ или находящих-ся на химиотерапии), при плохой переносимости пре-паратов для приема внутрь или их неэффективности(синдром мальабсорбции), то есть при всех проявле-ниях ХСН.
По крайней мере, два открытых и два контролируе-мых исследования с применением препарата венофер(сахарат железа) продемонстрировали уменьшениеявлений анемии и улучшением клинического состоянияу пациентов с ХСН [461–463]. Но наиболее крупноеМРКИ (FAIR–HF) с участием и российских центровиспользовало препарат ферринжект (феррокарбо-мальтозный комплекс железа) [464]. Это стабильныймононуклеарный комплекс железа, не вызывающийгиперчувствительности, что позволяет быстро (в тече-ние 15 минут) ввести высокую дозу железа (1000 мг),которое медленно высвобождается, что позволяет про-водить инъекции 1 раз в неделю [465]. При этом желе-зо оптимально распределяется в организме, включаяпечень, селезенку и костный мозг [466].
В исследовании FAIR–HF введение ферринжектав сравнении с контролем приводило к достоверномуулучшению клинического состояния уже после второйинъекции. Суммарно 50 % пациентов, получавших фер-ринжект, и лишь 27 % в контроле отметили значительноеулучшение клинического состояния и 47 % достигли I ФКХСН (против 30 % в контроле). Увеличение дистанции6-мин ходьбы составило 40 метров (против 10 метровв контроле), и СКФ увеличилась на 4 мл / мин, что сви-детельствует об улучшении функция почек. При этомриск заболеваемости и смертности был на 6,5 % меньшев группе лечения ферринжектом, что, вкупе с отсутстви-ем серьезных побочных реакций, позволяет рекомен-довать подобное лечение больным ХСН с железодефи-цитной анемией [464]. В настоящее время проводятсяеще два более длительных исследования по применениюферринжекта в лечении пациентов с ХСН и сопутству-ющей анемией.
Статины при ишемической этиологииХСН (класс рекомендаций IIB,уровень доказанности А)
До 2007 года вопрос об эффективности примене-ния статинов в лечении ХСН оставался открытым.Результаты ретроспективных анализов, когортныхисследований и протоколов по принципу «случай–контроль» демонстрировали, что статины могуткак снижать риск развития ХСН, так и улучшать про-гноз пациентов с уже развившейся декомпенсацией[467, 468]. Многочисленность и абсолютная одно-направленность имеющихся данных позволяли пред-полагать способность дополнительного улучшенияпрогноза больных ХСН ишемической этиологиипри назначении статинов.
Учитывая, что снижение уровня ЛПНП не являетсяединственным механизмом положительного действиястатинов у больных ХСН, большое значение придавалось плейотропным эффектам этого класса лекарств[469]. В этой связи обсуждался даже вопрос о возмож-ности применения этого класса лекарств в лечении ХСНне только ишемической этиологии [467, 468].
Однако завершение двух крупных многоцентровыхпроспективных исследований по применению статинову больных ХСН ишемической (CORONA) и различной,в том числе и неишемической этиологии (GISSI–HF),не оправдало возлагавшихся надежд [470, 471].
Ни в одном из исследований применение розуваста-тина в дозе 10 мг / сут (на фоне максимальной терапииХСН) не приводило к улучшению прогноза больныхХСН, несмотря на достоверное снижение атероген-ного ХС липопротеидов низкой плотности и уровняС-реактивного белка. Возможным объяснением неудачиможет быть то, что у больных ХСН IIБ – III стадии, осо-бенно при развитии кардиального цирроза печени, уро-вень ХС может снижаться, что является одним из преди-кторов неблагоприятного прогноза [472–474].
У больных ХСН ишемической этиологии (исследова-ние CORONA) применение розувастатина достоверноуменьшало риск госпитализаций, в том числе связанныхс обострением ХСН и, по данным ретроспективногоанализа, суммарную частоту инфарктов и инсультов.В группе больных со смешанной, в том числе и неише-мической (около половины больных) этиологией ХСН(исследование GISSI–HF), применение розувастатинане меняло не только показатели смертности, но и заболеваемости (число госпитализаций).
В обоих исследованиях была подтверждена высокая безопасность лечения розувастатином даже у декомпен-сированных больных при нарушениях функции печении почек. В исследовании CORONA отмена розувастати-на из-за нежелательных реакций происходила достовернореже, чем плацебо.
На основании полученных данных можно дать практи-ческие рекомендации по применению статинов у больныхс риском и с уже развившейся ХСН: статины являютсяэффективным средством профилактики появления ХСНу больных с наличием коронарной болезни сердца, дажеу пациентов с исходно низким уровнем ХС ЛПНП [475]; применение статинов при уже развившейся ХСН не сопро-вождается улучшением прогноза больных, вне зависимостиот этиологии; у больных с ишемической этиологией ХСНприменение розувастатина в дополнение к оптимальнойтерапии ХСН позволяет снижать число госпитализаций(в том числе из-за обострения ХСН) и уменьшать вероят-ность ОИМ и инсульта; переносимость розувастатинане отличается от плацебо даже у пациентов с выраженнойХСН; если статины были назначены больному с коронар-ной болезнью сердца, терапия может быть (и должна!) безопаснопродолжена при присоединении симптомов ХСН.
Для практического использования у пациентов с ише-мической этиологией ХСН сегодня рекомендуется при-менение розувастатина в дозе 10 мг / сут.
Ретроспективные анализы и мета-анализы небольшихисследований позволяют предположить, что препаратомвыбора у больных ХСН может оказаться аторвастатин(10 мг / сут), хотя и это требует подтверждения (класс IIB,уровень доказанности В) [476].
Кроме того, в первые три месяца лечения больных ХСНстатинами требуется регулярный контроль уровней печеноч-ных трансаминаз, а также креатинфосфокиназы. При повы-шении уровня АСТ и АЛТ более чем в три раза от исход-ных или КФК в 10 раз выше нормы, а также при появлениимышечных болей лечение статинами необходимо прервать.В остальном контроль безопасности терапии не отличаетсяот пациентов, не имеющих симптомов ХСН, как изложенов Рекомендациях РКО по лечению атеросклероза [141].
Антиагреганты (в частности, аспирин)в лечении ХСН (класс рекомендацийIIB, уровень доказанности В)
Вопрос о применении аспирина в лечении ХСН остается не до конца решенным. Проблема – в возможностиблокады синтеза простациклина даже при использо-вании самой малой дозы препарата – 75 мг [208, 477].Блокада фермента циклооксигеназы, определяющаямеханизм действия аспирина и других НПВП, чреватаодновременным ослаблением эффекта иАПФ, диурети-ков, альдактона и даже β-АБ с вазодилатирующими свой-ствами – карведилола (класс IIA, уровень доказанностиВ) [168, 207, 478, 479].
С этой точки зрения применение антиагрегантовс другим механизмом действия (клопидогрел), которые позволяют достигать антиагрегационного эффектабез блокады фермента циклооксигеназы, выглядит теоретически более обоснованным, хотя клинических подтверждений этому нет. Следовательно, аспирин и другие антиагрегантыдолжны применяться у больных ХСН лишь при строгихпоказаниях. Поэтому позиции по применению антиагре-гантов у пациентов с клинически выраженной ХСН сво-дятся к следующему:
A) убедительных данных о целесообразности примене-ния антиагрегантов для лечения ХСН нет (за исключением раннего периода (до 8 недель) после пере-несенного ОИМ). При назначении антиагрегантовнарастает риск геморрагических осложнений, вклю-чая желудочно-кишечные кровотечения и геморраги-ческие инсульты [480];
B) назначение аспирина достоверно увеличивает числогоспитализаций, связанных с обострением декомпен-сации (класс IIB, уровень доказанности В) [135, 136];
C) при необходимости использования аспирина тео-ретически более оправданным выглядит его соче-тание с АРА (а не с иАПФ), хотя контролируемыхклинических исследований, подтверждающих этоположение, нет;
D) иАПФ более обоснованно сочетать с дезагреганта-ми, имеющими другой механизм действия (клопидо-грел), хотя и это положение не подтверждено клини-ческими исследованиями;
E) двойная антитромботическая терапия при ХСНне показана (за исключением случаев ангиопластикис применением стентов с лекарственным покрытием)[391, 481];
F) большинство имеющихся на сегодня результатовретроспективных анализов МРКИ (при отсутствиипроспективных исследований) позволяют констати-ровать, что хотя некий негативный момент во взаимо-действии малых доз аспирина (75–100 мг!) и иАПФприсутствует, совместное использование этих препа-ратов у больных, перенесших ОИМ и имеющих ХСН,возможно [216, 221, 482, 483];
G) нужно избегать назначения НПВП (включая дозыаспирина >325 мг) больным ХСН, находящим-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти (вплоть до развития отека легких).
Цитопротекторы (триметазидинмедленного высводождения = триметазидинМВ) при лечении ХСН ишемическойэтиологии (класс рекомендаций IIA,уровень доказанности В)
Единственным препаратом этого класса, рекомен-дуемым для лечения стенокардии, является ингибиторфермента 3КАТ триметазидин, переводящий синтезвысокоэнергетических соединений в миокарде на болееэкономный аэробный путь [355, 484]. Это единствен-ный цитопротектор, клиническая эффективность кото-рого была исследована у больных со стенокардией в пол-ноценных МРКИ, причем как в виде монотерапии, таки при комбинированном лечении. Последние мета-ана-лизы продемонстрировали способность триметазидинаМВ достоверно уменьшать стенокардию и увеличиватьвремя нагрузки до появления изменения сегмента ST[485, 486]. Кроме того, длительное лечение триметази-дином МВ может положительно влиять на прогноз боль-ных, перенесших ОИМ, при котором высока вероят-ность появления ХСН [487].
Учитывая, что метаболический дисбаланс являетсяодним из важных механизмов развития и прогрессирова-ния ХСН (особенно ишемической этиологии), возмож-ность активации аэробного гликолиза при использованиитриметазидина МВ может рассматриваться, как реальныйспособ лечения декомпенсированных больных [488, 489].Сегодня в довольно большом числе плацебо-контроли-руемых исследований убедительно продемонстрирова-но, что длительное лечение триметазидином больныхХСН ишемической этиологии сопровождается не толькоулучшением клинического состояния больных и качестважизни, но и приростом ФВ ЛЖ (в пределах 7 %), а так-же уменьшением ремоделирования сердца [490–492].Высокая клиническая эффективность триметазидина МВпри ХСН потверждена и в Российских многоцентровыхпрограммах ПРИМА и ПРЕАМБУЛА [493].
Вопрос о влиянии триметазидина МВ на заболе-ваемость и смертность при ХСН требует дальнейшихисследований. Однако результаты последних мета-ана-лизов показывают cнижение риска госпитализацийиз-за обострения ХСН при применении триметазиди-на МВ в пределах 50 % [492, 494]. Эти предположенияподтвердились и в самом крупном когортном иссле-довании (669 больных) по применению триметазиди-на у больных ХСН ишемической этиологии. Лечениетриметазидином с большой достоверностьтю снижалориск смерти и обострения ХСН на 11,4 % и продлеваложизнь без осложнений на 7,8 месяца [495]. Имеющиесярезультаты диктуют необходимость проведения круп-ного проспективного МРКИ для окончательного опре-деления места триметазидина в лечении ХСН ишемиче-ской этиологии.
Данные по лечению триметазидином больных ХСНнеишемической этиологии слишком малочисленныдля сколько-нибудь серьезных выводов.
Таким образом, назначение триметазидина МВ долж-но быть рассмотрено у больных ХСН ишемическойэтиологии в дополнение к основным средствам лечениядекомпенсации для устранения симптомов, нормализа-ции гемодинамики (и роста ФВ ЛЖ) и возможного сни-жения риска смерти и повторных госпитализаций (классрекомендаций IIA, уровень доказанности В).
Более жесткой должна быть позиция по отношениюк препаратам с неясным механизмом действия и недока-занной клинической эффективностью, хотя многие из нихпозиционируются, как кардиопротекторы или метаболи-чески активные средства. Поэтому использование таури-на, карнитина, милдроната в лечении ХСН не показано(класс III, уровень доказанности С).
Периферические вазодилататоры (классрекомендаций IIB, уровень доказанности В)
В настоящее время ПВД не входят в число препаратовпервой линии, используемых для лечения ХСН. На прогноз, количество госпитализаций, прогрессированиеболезни они не влияют.
Исключение составляет применение комбинациинитратов (венозных вазодилататоров) с гидралазином(артериолярными вазодилататорами) у пациентов негроидной расы. У этого контингента пациентов подобнаякомбинация (в дополнение к иАПФ, β-АБ, диуретикам)может способствовать улучшению прогноза [496–498].У лиц белой расы всегда более предпочтительно исполь-зование иАПФ [221, 498]. Кроме того, применение ком-бинации нитратов с гидралазином стимулирует развитиепобочных реакций (гипотония, тахикардия), которыезатрудняют лечение больных ХСН [499].
Нитраты могут даже негативно влиять на прогнозбольных ХСН и затруднять применение иАПФ, т. е. сни-жать эффективность последних (класс IIB, уровень дока-занности С) [202].
Нитраты могут назначаться при ХСН лишь при нали-чии доказанной ИБС и стенокардии, которая проходитименно (только) от нитропрепаратов. Во всех остальныхслучаях нитраты при ХСН не показаны.
В качестве артериолярных ПВД можно применятьлишь дигидропиридины длительного действия (предпо-чтительно амлодипин), а не гидралазин.
Следует помнить, что сопутствующее лечение вазо-дилататорами лишь затрудняет использование абсолют-но необходимых в терапии декомпенсации препаратов –иАПФ, АРА и β-АБ из-за дополнительной способностик снижению АД. Кроме того, применение прямых ПВДсопровождается активацией нейрогормонов, что чреватопрогрессированием ХСН [202, 269].
Негликозидные инотропные средства в леченииХСН при симптомной гипотонии и остройдекомпенсации сердечной деятельности (классрекомендаций IIB, уровень доказанности В)
Применение негликозидных инотропных средств,несмотря на кратковременное улучшение гемодинамикии клинического состояния больных с обострением деком-пенсации, при долгосрочном наблюдении повышает рисксмерти больных ХСН. Более того, даже кратковременнаяинотропная поддержка в период обострения декомпенсации может негативно повлиять на отдаленный прогноз больных ХСН (класс IIA, уровень доказанности В). Поэтому сегодня эти препараты не рекомендованыдля лечения ХСН [500–503].
При критическом состоянии (при обострении ХСН)лучше всего использовать сенситизатор кальция лево-симендан (болюс 12 мкг / кг, затем внутривенно капель-но 0,1–0,21 мкг / кг / мин). Этот препарат максимальноулучшает показатели гемодинамики, не имеет негатив-ных взаимодействийс β-АБ (в отличие от добутамина)и рекомендован ЕОК для лечения обострения ХСН [261,504]. Впервые способность левосимендана улучшатьпрогноз больных после ОИМ была продемонстрирова-на в исследовании RUSSLAN, проводившемся в России[505]. Однако при длительном лечении левосимендан,как и другие негликозидные инотропные стимуляторы,не влияет на прогноз больных ХСН [502].
Внутривенное введение добутамина (внутривенноекапельное введение со скоростью 2,5–10 мкг / кг / мин)должно проводиться лишь при симптомной гипотониипо витальным показаниям, учитывая его негативное вли-яние на прогноз.
Средства, не рекомендованныек применению при ХСН cо сниженнойФВ ЛЖ (класс рекомендаций III)
Применение этих препаратов должно быть, по воз-можности, исключено при лечении декомпенсации.К ним относятся:
A) НПВП (селективные и неселективные, включаядозы аспирина >325 мг). Особенно неблагоприят-но их использование у больных ХСН, находящих-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти, вплоть до развития отека легких;
B) Глюкокортикоиды. Применение стероидных гор-монов имеет чисто симптоматические показанияв случаях упорной гипотонии и тяжелого отечно-го синдрома для облегчения начала лечения иАПФ,диуретиками и β-АБ. С другой стороны, возмож-ность опасных для жизни осложнений ограничиваетиспользование этих препаратов;
C) Трициклические антидепрессанты;
D) Антиаритмики I класса;
E) Некоторые БМКК (верапамил, дилтиазем, коротко-действующие дигидропиридины).
Медикаментозная терапия больных ХСНс сохраненной систолической функцией ЛЖ(ФВ ЛЖ >50 %) или диастолической ХСН
Нижеприведенные рекомендации носят, скорее, предположительный характер ввиду ограниченности имеющихся данных по вопросу лечения больных ХСН–ССФили ДСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследованийу этой категории больных.
В настоящее время отсутствуют убедительныедоказательства улучшения выживаемости при исполь-зовании какого‑либо специфического медикамен-тозного лечения у пациентов с ХСН–ССФ или ДСН.Тем не менее эффективность применения некоторыхпрепаратов была показана в отдельных исследованияхи продолжает изучаться.
Наиболее агрессивным апологетам доказательноймедицины следует напомнить, что отсутствие дока-зательств возможности улучшения прогноза больныхне может обосновывать бездействие и оставление паци-ентов без надежды хотя бы на клиническое улучшениесостояния.
Кроме того, первым и обязательным условием являет-ся выявление и коррекция всех факторов и заболеваний,способствующих развитию диастолических расстройств,появлению и прогрессированию ХСН–ССФ. К нимчаще всего относятся АГ и ГЛЖ, ИБС, констриктивныепоражения миокарда / перикарда, СД, ожирение и т. д.Поэтому контроль АД, успешное лечение ИБС, кор-рекция уровня глюкозы, нормализация массы тела, уме-ренные физические нагрузки могут быть важным под-спорьем в успешном ведении этой сложной для лечениягруппы больных.
Как известно, что блокаторы РААС (иАПФ, АРА)и β-АБ относятся к основным средствам лечения пода-вляющего числа заболеваний, приводящих к ХСН–ССФ,поэтому их наличие в числе препаратов, рекомендованных больным ДСН, не вызывает сомнений. Гораздо труд-нее обосновать бездействие и отсутствие попыток лече-ния больных ХСН–ССФ, несмотря на ограниченностьклинических исследований.
Для возможного улучшения диастолического наполне-ния ЛЖ показан контроль ЧСС.
Следует принять адекватное решение и выбрать соот-ветствующие меры по вопросу профилактики, восстановления и поддержания синусового ритма у больныхс мерцательной тахиаритмией согласно принятым реко-мендациям [30, 506]. При сохранении постоянной фор-мы мерцания предсердий необходимо добиться нормали-зации частоты желудочковых сокращений.
Ингибиторы АПФ
Ингибиторы АПФ способны напрямую улучшатьрелаксацию и растяжимость миокарда, а также оказыватьопосредованное действие на диастолические свойстваЛЖ за счет своего гипотензивного эффекта и способ-ности уменьшать выраженность гипертрофии и фибро-за миокарда. В ранних исследованиях было показано,что терапия иАПФ пациентов с СН–ССФ достовернопродлевает время до вынужденной госпитализациииз‑за развития декомпенсации, хотя и не снижает смерт-ность [507]. Достоверное улучшение суррогатных конеч-ных точек (функционального статуса, толерантностик нагрузке, качества жизни) у больных ХСН с относитель-но сохраненной сократимостью (ФВ >45 %) было показа-но в проспективном российском исследовании ФАСОН[508]. Единственное завершившееся к настоящему вре-мени плацебо-контролируемое исследование по оценкевлияния иАПФ на выживаемость пожилых больных ДСН(>70 лет) – (PEP–CHF), выполненное с периндоприлом,не показало достоверного снижения общей или сердеч-но-сосудистой смертности на фоне лечения иАПФ [509].Тем не менее через 1 год после начала исследования тера-пия иАПФ ассоциировалась с достоверным снижениемриска внеплановой госпитализации из-за декомпенсации(OP 0,63; ДИ 0,40–0,97; p=0,033). Клинически у пациен-тов, находившихся на лечении периндоприлом, отмечал-ся достоверно меньший ФК ХСН и достоверно бóльшимбыл прирост дистанции теста 6‑мин ходьбы [509]. Болеетого, ретроспективный анализ показал, что в подгруппемоложе 75 лет эффект периндоприла был более отчетли-вым и сопровождался снижением риска смерти и количе-ства госпитализаций из-за обострения ХСН.
Мета-анализ всех исследований по применениюиАПФ в лечении больных с ХСН–ССФ продемонстри-ровал снижение риска смерти без достоверного влиянияна риск госпитализаций, в том числе связанных и с обо-стрением ХСН [510].
Таким образом, иАПФ пока не доказали своей способ-ности улучшать прогноз пациентов с ХСН–ССФ и ДСН,однако их применение у таких больных абсолютнооправдано, по крайней мере, в связи с улучшением функ-ционального статуса пациентов и уменьшением рискавынужденных госпитализаций (класс рекомендаций IIA,уровень доказательности В).
Антагонисты рецепторов к АII
По степени положительного влияния на ГЛЖ и выра-женность фиброза АРА не уступают иАПФ, а по способности устранять диастолические расстройства могут даже превосходить иАПФ [511, 512].
Эффективность АРА по влиянию на заболеваемость и смертность при лечении пациентов с ХСН и сохранной систолической функцией ЛЖ выглядит умеренной.При применении кандесартана в группе больных ХСНс ФВ ЛЖ <40 % число госпитализаций из-за обостренияХСН достоверно снижалось, хотя улучшения прогно-за не наблюдается [259]. Еще более разочаровывающиерезультаты были получены при попытке лечения ХСНс сохранной систолической функцией сердца в исследовании I-PRESERVE с ирбесартаном. Препарат не влиялни на смертность, ни на число госпитализаций, ни на про-грессирование ХСН [126].
Таким образом, АРА пока также не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН.Тем не менее, как показали итоги исследования CHARM–preserved, применение АРА кандесартана при диасто-лических расстройствах позволяет, по меньшей мере,снизить частоту госпитализаций, и его использованиев таких ситуациях обосновано, особенно при неперено-симости иАПФ (класс рекомендаций IIB, уровень дока-зательности В).
Блокаторы β-адренергических рецепторов
β-АБ могут быть назначены больным ХСН–ССФс целью уменьшения ЧСС (увеличения периода диа-столического наполнения ЛЖ) и выраженности ГЛЖ(уменьшения жесткости камеры ЛЖ). ИсследованиеSWEDIC [513] показало, что α-, β-адреноблокаторкарве-дилол, помимо снижения ЧСС, оказывает положительноевлияние на допплер–ЭхоКГ показатели релаксации ЛЖу больных ДСН. Специальных работ по изучению влия-ния β-АБ на выживаемость больных СН–ССФ или ДСНне проводилось. Однако в исследовании SENIORS с неби-вололом, в которое было включено более 700 пожилыхбольных с незначительно сниженной сократимостью (ФВЛЖ >35 %), терапия этим β-АБ ассоциировалась со сни-жением комбинированного показателя общей смертно-сти или госпитализации по сердечно-сосудистым причи-нам (класс IIB, уровень доказательности С) [514].11.2.4. Блокаторы медленныхкальциевых каналов (БМКК)
С той же целью, что и β-АБ, может быть использованБМКК верапамил. Однако, как показало исследованиеDAVIT II, у больных в раннем постинфарктном перио-де назначение верапамила при наличии СН в анамнеземалоэффективно [515]. Таким образом, назначение вера-памила больному ДСН для снижения ЧСС может бытьрекомендовано только в случае непереносимости β-АБи при отсутствии выраженной ХСН, проявляющейся,например, задержкой жидкости (класс IIB, уровень дока-зательности С).
Начаты исследования и по применению селективногоблокатора If -токов в клетках синусового узла ивабрадинас целью урежения ритма и возможного влияния на клини-ку, заболеваемость и прогноз больных ХСН–ССФ с сину-совым ритмом.
Диуретики
Диуретики могут быть необходимы в случае задержкижидкости в организме, но у пациентов с ДСН их следуетиспользовать с осторожностью, чтобы не вызвать чрез-мерного снижения преднагрузки на ЛЖ и падения сер-дечного выброса (класс IIB, уровень доказательности С).Среди других следует выделить торасемид, обладающийдлительным (до 18 часов) диуретическим эффектом,меньшим, чем у фуросемида, калийуретическим действи-ем [337], и что может быть особенно важно для больныхДСН – обладает собственным антифибротическим влия-нием на миокард [516].
Сравнительные исследования с фуросемидом показа-ли способность торасемида в большей степени улучшатьдиастолические свойства ЛЖ [517]. Однако проспектив-ных исследований по влиянию торасемида на заболевае-мость и смертность у больных ХСН с преобладающимидиастолическими расстройствами еще не проводилось.
Антагонисты МКР
Антагонисты МКР у больных с диастолическимирасстройствами должны рассматриваться не столькокак калийсберегающие диуретики, сколько как анти-фибротические препараты. До настоящего временине закончено ни одного плацебо-контролируемого иссле-дования по оценке влияния антагонистов альдостеро-на на выживаемость больных диастолической СН. Хотямногочисленные экспериментальные и клиническиеисследования продемонстрировали способность АМКР(в том числе в сочетании с иАПФ и АРА) к уменьшениюфиброза и улучшению диастолического наполнения ЛЖкак при сниженной, так и при сохранной ФВЛЖ. В насто-ящее время завершается первое МРКИ исследование,целью которого является изучение влияния спиронолак-тона (плюс к иАПФ или АРА) на выживаемость больныхс начальной и умеренной стадиями ХСН и ФВ ЛЖ >45 %(TOPCAT), результаты которого ожидаются в 2014 году.
Сердечные гликозиды
Ритмурежающее действие сердечных гликозидов (дигоксина) может быть полезно для пациентов с ФП, которая встречается примерно у 30 % больных с диастолической СН[16]. Однако результаты исследования DIG [518] показали,что даже независимо от характера основного ритма применение дигоксина ассоциируется с более чем 30 %-м сниже-нием госпитализаций из-за декомпенсации ХСН у больныхкак со сниженной (<45 %), так и с относительно сохранной(>45 %) ФВ ЛЖ. Более того, субанализ этого исследования ме крови (<0,9 нг / мл) отмечается достоверное снижениериска смерти и госпитализаций по любым причинам, в т. ч.и у больных с сохраненной систолической функцией [519].Положительный эффект дигоксина может быть связанс увеличением сократимости спиральных волокон миокар-да, определяющих активную позднюю фазу опорожненияЛЖ («скручивание») и активную же раннюю фазу диа-столического наполнения («раскручивание» и присасыва-ющий эффект) в большей степени, чем со снижением ЧСС(особенно при синусовом ритме). Подобный эффект былпоказан почти 40 лет назад при изучении гемодинамическихэффектов сердечных гликозидов с помощью динамическойэхокардиографии в реальном масштабе времени [520].
Доза дигоксина не должна превышать 0,25 мг, а кон-центрация в плазме – 1,1 нг / мл. При необходимостиснижения ЧСС у больных ХСН–ССФ с синусовымритмом следует отдать предпочтение комбинации β-АБс дигоксином.
Мета-анализ всех 30 основных проспективных иссле-дований и когортных наблюдений, включивший анализтерапии более 53 тысяч пациентов с ХСН–ССФ, проде-монстрировал, что проводимое лечение (не только иАПФ,АРА, β-АБ и дигоксином, но и БМКК, и вазодилататора-ми) улучшает клиническое состояние и переносимосьфизических нагрузок, но не влияет на прогноз [521]. Этоеще раз подчеркивает сложность эффективного лечениярассматриваемой группы больных и должно стимулиро-вать поиск новых подходов к терапии ХСН–ССФ.
Лечение острой декомпенсации ХСН
Лечение зависит от преобладающих клиническихсимптомов.
Оксигенотерапия
Оксигенотерапия должна проводиться всем пациентам с ОДСН до достижения сатурации кислорода ≥95или ≥90 % у пациентов с ХОБЛ (класс рекомендаций I,уровень доказанности С).
Диуретики
Диуретики показаны при наличии отечного синдрома(класс рекомендаций I, уровень доказанности В).
Назначая диуретики при ОДСН, следует руководство-ваться данными, представленными в таблице 26.
Таблица 26. Рекомендации для назначения диуретиков при ОДСН
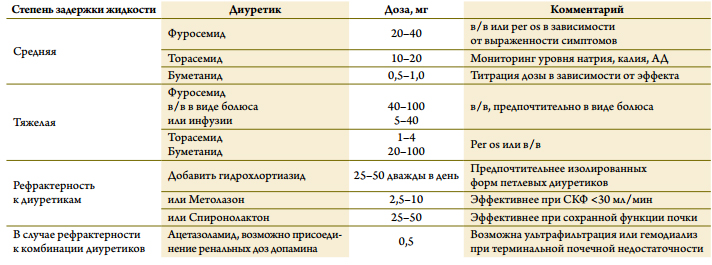 Дигоксин
У пациентов с синусовым ритмом дигоксин можетбыть использован для контроля ЧСС, однако требует-ся тщательный мониторинг состояния пациента, таккак в условиях ОДСН высок риск развития гликозиднойинтоксикации. При сопутствующейФП, ФВ менее 40 %дигоксин должен назначаться в сочетании с β-АБ (классрекомендаций I, уровень доказанности С). У пациентовс ОДСН дигоксин ведет к незначительному приросту СВ(класс рекомендаций IIB, уровень доказанности С).
Вазодилататоры
Вазодилататоры показаны при лечении ОДСН, посколькуснижают давление в малом круге кровообращения (МКК).Они могут применяться у всех пациентов с АД ≥90 мм рт. ст.(класс рекомендаций I, уровень доказанности С).
При назначении вазодилататоров следует основывать-ся на рекомендациях, представленных в таблице 27.
Таблица 27. Рекомендации для назначения вазодилататоров
Дигоксин
У пациентов с синусовым ритмом дигоксин можетбыть использован для контроля ЧСС, однако требует-ся тщательный мониторинг состояния пациента, таккак в условиях ОДСН высок риск развития гликозиднойинтоксикации. При сопутствующейФП, ФВ менее 40 %дигоксин должен назначаться в сочетании с β-АБ (классрекомендаций I, уровень доказанности С). У пациентовс ОДСН дигоксин ведет к незначительному приросту СВ(класс рекомендаций IIB, уровень доказанности С).
Вазодилататоры
Вазодилататоры показаны при лечении ОДСН, посколькуснижают давление в малом круге кровообращения (МКК).Они могут применяться у всех пациентов с АД ≥90 мм рт. ст.(класс рекомендаций I, уровень доказанности С).
При назначении вазодилататоров следует основывать-ся на рекомендациях, представленных в таблице 27.
Таблица 27. Рекомендации для назначения вазодилататоров
 Применение диуретиков и вазодилататоров при ОДСН может быть затруднено двумя факторами – чрез-мерным снижением АД и ухудшением функции почек(нередко преходящим). Поэтому чрезмерно мощныйдиурез в ответ на применение диуретиков и падение АДв ответ на применение вазодилататоров можно рассматривать, как предикторы нового обострения ХСН, повы-шающие риск регоспитализаций.
В последние годы особое внимание уделялось поискубезопасныхпрепаратов для лечения ОДСН при одно-временном улучшении функции почек. Наиболее обе-щающие результаты были достигнуты при использова-нии препарата серелаксин (натуральный релаксин-2 –вещество, определяющее адаптацию к беременности,одновременно обладающее вазодилатирующими свой-ствами и улучшающее почечный кровоток). В МРКИRELAX–AHF применение серелаксина приводилок достоверному уменьшению одышки (по визуальноаналоговой шкале), хотя по Lickert (вторая первичнаяконечная точка) одышка достоверно не менялась [342]
Препараты с положительныминотропным действием
Препараты показаны пациентам с низким сердечнымвыбросом, сохраняющимися явлениями застоя, гипо-перфузии, несмотря на применение вазодилататорови / или диуретиков (класс рекомендаций IIA, уровеньдоказанности С).
Добутамин
Препарат с преимущественным воздействием на β1‑рецепторы,оказывает дозозависимый положительныйинотропный и хронотропный эффекты. При назначе-нии не требуется болюсное введение, начальная доза2–3 мкг / кг / мин. Применение добутамина требует мони-торинга гемодинамики. Основным побочным эффектомявляется тахикардия.
Допамин
Действие препарата обусловлено стимуляциейβ-рецепторов,что ведет к увеличению сердечного выброса, сократительной способности миокарда. В малых дозах(1–3 мкг / кг / мин) оказывает допаминэргический эффекти стимулирует диурез. Большиедозы допамина исполь-зуются с целью поддержания уровня АД, однако ониассоциированы с прогрессирующим приростом ЧСС.У пациентов с ЧСС, превышающей 100 уд / мин, назначе-ние допамина должно осуществляется крайне осторожно(класс рекомендаций IIB, уровень доказанности С).
Левосимендан
Кальциевый сенситизатор, применение которогоу пациентов с ОДСН увеличивает сердечный выброси ударный объем, а также снижает давление в легочнойартерии, системное и легочное сосудистое сопротивление. Эффект левосимендана сохраняется в течениемесяца. Препарат является альтернативой для пациен-тов, находящихся на терапии β-АБ, так как не конкури-рует за связь с β-рецепторами. Левосимендан назнача-ется: болюсом в дозе 3–12 мкг / кг в течение 10 минут,с последующей инфузией 0,05–0,2 мкг / кг / мин в течение24 часов. У пациентов с АД менее 100 мм рт. ст. долженназначаться без болюсной дозы во избежание гипотензии(класс рекомендаций IIA, уровень доказанности Б).
Блокаторы If -каналов
Назначение блокаторов If -каналов при ОДСН показанопациентам с ЧСС выше 100 уд / мин с целью контроля ЧСС (в том числе при параллельном назначении положительныхинотропных препаратов). Назначение блокаторов If -кана-лов при ОДСН ассоциировано с улучшением прогноза,снижением сроков госпитализации. Назначение блока-торов If -каналов возможно в сочетании с малыми дозамиβ-АБ. Титрацию блокаторов If ‑каналов следует начинатьс малых доз, при хорошей переносимости увеличиватьдозу до среднетерапевтической (для ивабрадина титрациюдозы следует начинать с 5 мг 2 раза в сутки, в дальнейшем дозу препарата увеличивают до 7,5 мг 2 раза в сутки) (классрекомендаций IIB, уровень доказанности С).
12. Хирургические и электрофизиологическиеметоды лечения ХСН
Электрофизиологические методы лечения ХСН
Электрофизиологические методы лечения ХСН сводятся на сегодняшний день к трем процедурам:
A) имплантации обычных (правожелудочковых) ЭКС;
B) имплантации бивентрикулярных электрокардиостимуляторов (БВЭКС) для проведения сердечной ресин-
хронизирующей терапии;
C) имплантации кардиовертеров–дефибрилляторов.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинать-
ся только на фоне оптимальной медикаментозной терапии (ОМТ) при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуется больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
12.1.1. Имплантация обычных (правожелудочковых) электрокардиостимуляторов
Постановка (имплантация) обычных ЭКС актуальна для пациентов с синдромом слабости синусового узла и атрио-вентрикулярными блокадами [522–525]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а с адаптируемой частотой
стимуляции, и прежде всего двухкамерных или однокамерных с предсердным электродом (при слабости синусового узла и нормальной функции АВ узла).
Однако длительная стимуляция ПЖ сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН. Поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа [526] (класс показаний IIA, уровень доказанности С).
Впервые исследование DAVID показало, что у пациентов с выраженной систолической дисфункцией (ФВ ЛЖ <35 %), у которых стимуляция ПЖ длится больше 40 % времени, возрастает риск комбинированной точки – смерть и госпитализация из-за ХСН [527]. Затем было подтверждено, что изолированная правожелудочковая стимуляция даже у пациентов с исходно нормальной ФВ ЛЖ приводит к диссинхронии и ремоделированию сердца с увеличением объемов ЛЖ и падением сократимости [528, 529]. В недавно завершившемся исследовании BLOCK HF было показано, что правожелудочковая стимуляция у больных, требующих постановки ЭКС, с исходной ФВ ЛЖ менее 50 % в сравнении с бивентрикулярной стимуляцией сопровождалась достоверным увеличением риска смерти, госпитализации в связи с обострением ХСН или увеличением объемов ЛЖ более чем на 15 % [530]. Таким образом, правожелудочковая стимуляция не может быть методом выбора в лечении пациентов, по крайней мере, с ХСН и исходной дисфункцией ЛЖ (имеющих показания к стимуляции) (класс III, уровень доказанности В). У пациентов с имплантированными ЭКС необходимо использовать алгоритмы по минимизации желудочковой стимуляции (класс показаний I, уровень доказанности C).
12.1.2. Бивентрикулярная электрокардиостимуляция (БВЭКС) = сердечная ресинхронизирующая терапия (СРТ)
Доказательства несинхронной работы желудочков сердца при ХСН и дисфункции ЛЖ, особенно при наличии блокад ножек пучка Гиса и широкого комплекса QRS, а также недостаточная эффективность изолированной правожелудочковой стимуляции обусловили разработку и внедрение метода так называемой сердечной ресинхронизирующей терапии – БВЭКС. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
СРТ – метод лечения пациентов с выраженной систолической дисфункцией и расширенным комплексом QRS. Показания к проведению СРТ основаны на результатах ряда проведенных МРКИ. Для отбора пациентов на СРТ используется комбинация из четырех параметров: длительности QRS, ФК ХСН, ФВ ЛЖ и основного ритма сердца (синусовый или ФП). Во всех случаях БВЭКС должна выполняться пациентам, находящимся не менее 3 месяцев на подобранной оптимальной медикаментозной терапии ХСН. СРТ проводится при помощи бивентрикулярного ЭКС без функции дефибрилляции (СРТ) или с функцией дефибрилляции (СРТ Д).
Длительность QRS. В большинство исследований, оценивавших эффекты от применения СРТ, включались пациенты с ХСН III–IV ФК с QRS >120–130 мс и ФВ ЛЖ <35 % или больные ХСН II ФК, с ФВ ЛЖ<40–30 % и такой же длительностью QRS. При этом большинство
пациентов, включенных в исследования, имели QRS >150 мс. Более того, мета-анализ 12 проведенных МРКИ, в которых обследовался 6 501 пациент, показал, что лишь в группе пациентов с QRS >150 мс применение СРТ достоверно на 42 % снижало риск смерти или госпитализации из-за ХСН [531]. В группе пациентов с QRS <150 мс достоверного влияния на заболеваемость и смертность больных ХСН отмечено не было. Другой мета-анализ 2012 года (5 365 пациентов, включенных в 4 МРКИ) продемонстрировал, что СРТ снижает комбинированную клиническую точку (общая смерть плюс госпитализации из-за обострения ХСН) у пациентов с наличием БЛНПГ,
а у больных с другой морфологией комплекса QRS применение БВЭКС не влияло на динамику заболеваемости и смертности [532]. Специальный анализ исследования MADIT CRT показал, что пациенты с БЛНПГ отмечают уменьшение риска госпитализации и смерти, как при QRS 130–150, так и при QRS >150 мс, в то время как пациенты с другой морфологией QRS не отмечают улучшения
на фоне СРТ (независимо от длительности QRS) [533].
Таким образом, можно выделить группу пациентов с максимальным доказанным эффектом от применения СРТ – это больные с БЛНПГ и QRS >150 мс. Несколько меньшая эффективность СРТ регистрируется у пациентов с БЛНПГ и QRS 120–150 мс. Хотя и в этом случае
БВЭКС положительно влияет на заболеваемость и смертность пациентов с клинически выраженной ХСН. Но СРТ не оказывает эффекта у пациентов с БПНПГ и с неспецифическими блокадами внутрижелудочкового проведения.
В проведенных четырех МРКИ участвовали пациенты с QRS <120 мс и наличием механической диссинхронии работы желудочков сердца по данным ЭхоКГ. В этих случаях ни клинической эффективности СРТ, ни влияния БВЭКС на прогноз больных ХСН выявлено не было
[534, 535]. Поэтому наличие механической диссинхронии по эхокардиографии при ширине комплекса QRS <130 мс (без БЛНПГ) не может быть показанием к проведению СРТ (класс III, уровень доказанности В).
ФВ ЛЖ. В большинстве исследований у пациентов III–IV ФК в качестве границы «сниженной систолической функции сердца» использовалась величина ФВ ЛЖ <35 %, хотя в двух МРКИ обследовались пациенты с ФВ ЛЖ <30 % [533, 536], а в исследовании REVERSE ФВ ЛЖ <40 % [537]. Таким образом, диапазон «сниженной» ФВ ЛЖ колебался от 30 до 40 %, и все же наиболее обоснованно рекомендовать применение СРТ с ХСН и ФВ ЛЖ <35 %, хотя чем ниже величина ФВ ЛЖ, тем больший эффект оказывает выполненная по показаниям БВЭКС.
Функциональный класс ХСН. Вначале применение СРТ исследовалось у пациентов с ХСН III и IV ФК. После получения позитивных результатов в четырех МРКИ положительные эффекты БВЭКС были продемонстрированы и при ХСН II ФК [536–539]. Но использование СРТ у пациентов с I ФК по данным двух исследований не влияло на заболеваемость и смертность [537, 538]. Таким
образом, чем тяжелее ФК ХСН, тем большего эффекта от СРТ можно ожидать у больных ХСН.
Характер ритма сердца. В основные МРКИ, изучающие эффекты СРТ, не включались пациенты с постоянной формой ФП, так что основные доказательства эффективности этого метода лечения доказаны для больных с синусовым ритмом. В двух небольших исследованиях было показано преимущество БВЭКС перед изолированной правожелудочковой стимуляцией по влиянию на клини-
ку и количество госпитализаций у больных с постоянной формой ФП [540, 541]. Однако по данным регистров, смертность у пациентов с ФП и имплантированным СРТ не отличается от аналогичных показателей пациентов с синусовым ритмом. Не выяснено только, необходимо ли при проведении БВЭКС больным ХСН и ФП выполнять радиочастотную аблацию атрио-вентрикулярного соединения [541]. Имеются данные о высокой эффективности применения СРТ у пациентов с постоянной формой ФП и строгим контролем ЧСС фармакологическими препаратами [542]. Эффективность СРТ при ФП и синусовом ритме практически одинакова при условии, что количество навязанных (эффективных) бивентрикулярных комплексов превышает 90–95 % [543], что оптимально контроли-
руется при Холтеровском мониторировании ЭКГ [544].
Таким образом, несмотря на лучшую изученность СРТ у больных с синусовым ритмом, успешная БВЭКС может выполняться и у пациентов с ФП при обеспечении высокого процента навязанных комплексов.
Основные рекомендации по применению СРТ у больных ХСН сводятся к следующему (таблица 28): A) СРТ / СРТ-Д показана всем больным ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и БЛНПГ при величине комплекса QRS, равной или более 150 мс, с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А).B) СРТ / СРТ-Д показана больным ХСН II ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусо-
вого ритма и БЛНПГ при величине комплекса QRS >150 мс с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А). C) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и при ширине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). D) Имплантация СРТ / СРТ-Д может быть рассмотрена у пациентов с ХСН II ФК, с ФВ ЛЖ <30–35 %, несмотря на ОМТ, при наличии синусового ритма и при величине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). E) Имплантация СРТ / СРТ-Д не показана пациентам с ХСН II–IVФК без наличия БЛНПГ вне зависимости от ширины комплекса QRS (класс рекомендаций
III, уровень доказанности А) F) Имплантация СРТ / СРТ-Д не показана у пациентов с ХСН II–IVФК при QRS <120 мс (класс рекоменда-
ций III, уровень доказанности А). G) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН II–IV ФК, c постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и проведенного
или планируемого РЧА АВ узла (класс рекомендаций IIA, уровень доказанности B).H) Имплантация СРТ / СРТ-Д может быть рассмотрена
у пациентов с ХСН II–IV ФК, с постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и фармакологическом контроле ЧСС, обеспечивающем более 95 % навязанных комплексов (класс рекомендаций IIB,
уровень доказанности C).
Таблица 28. Основные рекомендации по применению СРТ-P / СРТ-Д у больных ХСН
Применение диуретиков и вазодилататоров при ОДСН может быть затруднено двумя факторами – чрез-мерным снижением АД и ухудшением функции почек(нередко преходящим). Поэтому чрезмерно мощныйдиурез в ответ на применение диуретиков и падение АДв ответ на применение вазодилататоров можно рассматривать, как предикторы нового обострения ХСН, повы-шающие риск регоспитализаций.
В последние годы особое внимание уделялось поискубезопасныхпрепаратов для лечения ОДСН при одно-временном улучшении функции почек. Наиболее обе-щающие результаты были достигнуты при использова-нии препарата серелаксин (натуральный релаксин-2 –вещество, определяющее адаптацию к беременности,одновременно обладающее вазодилатирующими свой-ствами и улучшающее почечный кровоток). В МРКИRELAX–AHF применение серелаксина приводилок достоверному уменьшению одышки (по визуальноаналоговой шкале), хотя по Lickert (вторая первичнаяконечная точка) одышка достоверно не менялась [342]
Препараты с положительныминотропным действием
Препараты показаны пациентам с низким сердечнымвыбросом, сохраняющимися явлениями застоя, гипо-перфузии, несмотря на применение вазодилататорови / или диуретиков (класс рекомендаций IIA, уровеньдоказанности С).
Добутамин
Препарат с преимущественным воздействием на β1‑рецепторы,оказывает дозозависимый положительныйинотропный и хронотропный эффекты. При назначе-нии не требуется болюсное введение, начальная доза2–3 мкг / кг / мин. Применение добутамина требует мони-торинга гемодинамики. Основным побочным эффектомявляется тахикардия.
Допамин
Действие препарата обусловлено стимуляциейβ-рецепторов,что ведет к увеличению сердечного выброса, сократительной способности миокарда. В малых дозах(1–3 мкг / кг / мин) оказывает допаминэргический эффекти стимулирует диурез. Большиедозы допамина исполь-зуются с целью поддержания уровня АД, однако ониассоциированы с прогрессирующим приростом ЧСС.У пациентов с ЧСС, превышающей 100 уд / мин, назначе-ние допамина должно осуществляется крайне осторожно(класс рекомендаций IIB, уровень доказанности С).
Левосимендан
Кальциевый сенситизатор, применение которогоу пациентов с ОДСН увеличивает сердечный выброси ударный объем, а также снижает давление в легочнойартерии, системное и легочное сосудистое сопротивление. Эффект левосимендана сохраняется в течениемесяца. Препарат является альтернативой для пациен-тов, находящихся на терапии β-АБ, так как не конкури-рует за связь с β-рецепторами. Левосимендан назнача-ется: болюсом в дозе 3–12 мкг / кг в течение 10 минут,с последующей инфузией 0,05–0,2 мкг / кг / мин в течение24 часов. У пациентов с АД менее 100 мм рт. ст. долженназначаться без болюсной дозы во избежание гипотензии(класс рекомендаций IIA, уровень доказанности Б).
Блокаторы If -каналов
Назначение блокаторов If -каналов при ОДСН показанопациентам с ЧСС выше 100 уд / мин с целью контроля ЧСС (в том числе при параллельном назначении положительныхинотропных препаратов). Назначение блокаторов If -кана-лов при ОДСН ассоциировано с улучшением прогноза,снижением сроков госпитализации. Назначение блока-торов If -каналов возможно в сочетании с малыми дозамиβ-АБ. Титрацию блокаторов If ‑каналов следует начинатьс малых доз, при хорошей переносимости увеличиватьдозу до среднетерапевтической (для ивабрадина титрациюдозы следует начинать с 5 мг 2 раза в сутки, в дальнейшем дозу препарата увеличивают до 7,5 мг 2 раза в сутки) (классрекомендаций IIB, уровень доказанности С).
12. Хирургические и электрофизиологическиеметоды лечения ХСН
Электрофизиологические методы лечения ХСН
Электрофизиологические методы лечения ХСН сводятся на сегодняшний день к трем процедурам:
A) имплантации обычных (правожелудочковых) ЭКС;
B) имплантации бивентрикулярных электрокардиостимуляторов (БВЭКС) для проведения сердечной ресин-
хронизирующей терапии;
C) имплантации кардиовертеров–дефибрилляторов.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинать-
ся только на фоне оптимальной медикаментозной терапии (ОМТ) при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуется больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
12.1.1. Имплантация обычных (правожелудочковых) электрокардиостимуляторов
Постановка (имплантация) обычных ЭКС актуальна для пациентов с синдромом слабости синусового узла и атрио-вентрикулярными блокадами [522–525]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а с адаптируемой частотой
стимуляции, и прежде всего двухкамерных или однокамерных с предсердным электродом (при слабости синусового узла и нормальной функции АВ узла).
Однако длительная стимуляция ПЖ сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН. Поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа [526] (класс показаний IIA, уровень доказанности С).
Впервые исследование DAVID показало, что у пациентов с выраженной систолической дисфункцией (ФВ ЛЖ <35 %), у которых стимуляция ПЖ длится больше 40 % времени, возрастает риск комбинированной точки – смерть и госпитализация из-за ХСН [527]. Затем было подтверждено, что изолированная правожелудочковая стимуляция даже у пациентов с исходно нормальной ФВ ЛЖ приводит к диссинхронии и ремоделированию сердца с увеличением объемов ЛЖ и падением сократимости [528, 529]. В недавно завершившемся исследовании BLOCK HF было показано, что правожелудочковая стимуляция у больных, требующих постановки ЭКС, с исходной ФВ ЛЖ менее 50 % в сравнении с бивентрикулярной стимуляцией сопровождалась достоверным увеличением риска смерти, госпитализации в связи с обострением ХСН или увеличением объемов ЛЖ более чем на 15 % [530]. Таким образом, правожелудочковая стимуляция не может быть методом выбора в лечении пациентов, по крайней мере, с ХСН и исходной дисфункцией ЛЖ (имеющих показания к стимуляции) (класс III, уровень доказанности В). У пациентов с имплантированными ЭКС необходимо использовать алгоритмы по минимизации желудочковой стимуляции (класс показаний I, уровень доказанности C).
12.1.2. Бивентрикулярная электрокардиостимуляция (БВЭКС) = сердечная ресинхронизирующая терапия (СРТ)
Доказательства несинхронной работы желудочков сердца при ХСН и дисфункции ЛЖ, особенно при наличии блокад ножек пучка Гиса и широкого комплекса QRS, а также недостаточная эффективность изолированной правожелудочковой стимуляции обусловили разработку и внедрение метода так называемой сердечной ресинхронизирующей терапии – БВЭКС. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
СРТ – метод лечения пациентов с выраженной систолической дисфункцией и расширенным комплексом QRS. Показания к проведению СРТ основаны на результатах ряда проведенных МРКИ. Для отбора пациентов на СРТ используется комбинация из четырех параметров: длительности QRS, ФК ХСН, ФВ ЛЖ и основного ритма сердца (синусовый или ФП). Во всех случаях БВЭКС должна выполняться пациентам, находящимся не менее 3 месяцев на подобранной оптимальной медикаментозной терапии ХСН. СРТ проводится при помощи бивентрикулярного ЭКС без функции дефибрилляции (СРТ) или с функцией дефибрилляции (СРТ Д).
Длительность QRS. В большинство исследований, оценивавших эффекты от применения СРТ, включались пациенты с ХСН III–IV ФК с QRS >120–130 мс и ФВ ЛЖ <35 % или больные ХСН II ФК, с ФВ ЛЖ<40–30 % и такой же длительностью QRS. При этом большинство
пациентов, включенных в исследования, имели QRS >150 мс. Более того, мета-анализ 12 проведенных МРКИ, в которых обследовался 6 501 пациент, показал, что лишь в группе пациентов с QRS >150 мс применение СРТ достоверно на 42 % снижало риск смерти или госпитализации из-за ХСН [531]. В группе пациентов с QRS <150 мс достоверного влияния на заболеваемость и смертность больных ХСН отмечено не было. Другой мета-анализ 2012 года (5 365 пациентов, включенных в 4 МРКИ) продемонстрировал, что СРТ снижает комбинированную клиническую точку (общая смерть плюс госпитализации из-за обострения ХСН) у пациентов с наличием БЛНПГ,
а у больных с другой морфологией комплекса QRS применение БВЭКС не влияло на динамику заболеваемости и смертности [532]. Специальный анализ исследования MADIT CRT показал, что пациенты с БЛНПГ отмечают уменьшение риска госпитализации и смерти, как при QRS 130–150, так и при QRS >150 мс, в то время как пациенты с другой морфологией QRS не отмечают улучшения
на фоне СРТ (независимо от длительности QRS) [533].
Таким образом, можно выделить группу пациентов с максимальным доказанным эффектом от применения СРТ – это больные с БЛНПГ и QRS >150 мс. Несколько меньшая эффективность СРТ регистрируется у пациентов с БЛНПГ и QRS 120–150 мс. Хотя и в этом случае
БВЭКС положительно влияет на заболеваемость и смертность пациентов с клинически выраженной ХСН. Но СРТ не оказывает эффекта у пациентов с БПНПГ и с неспецифическими блокадами внутрижелудочкового проведения.
В проведенных четырех МРКИ участвовали пациенты с QRS <120 мс и наличием механической диссинхронии работы желудочков сердца по данным ЭхоКГ. В этих случаях ни клинической эффективности СРТ, ни влияния БВЭКС на прогноз больных ХСН выявлено не было
[534, 535]. Поэтому наличие механической диссинхронии по эхокардиографии при ширине комплекса QRS <130 мс (без БЛНПГ) не может быть показанием к проведению СРТ (класс III, уровень доказанности В).
ФВ ЛЖ. В большинстве исследований у пациентов III–IV ФК в качестве границы «сниженной систолической функции сердца» использовалась величина ФВ ЛЖ <35 %, хотя в двух МРКИ обследовались пациенты с ФВ ЛЖ <30 % [533, 536], а в исследовании REVERSE ФВ ЛЖ <40 % [537]. Таким образом, диапазон «сниженной» ФВ ЛЖ колебался от 30 до 40 %, и все же наиболее обоснованно рекомендовать применение СРТ с ХСН и ФВ ЛЖ <35 %, хотя чем ниже величина ФВ ЛЖ, тем больший эффект оказывает выполненная по показаниям БВЭКС.
Функциональный класс ХСН. Вначале применение СРТ исследовалось у пациентов с ХСН III и IV ФК. После получения позитивных результатов в четырех МРКИ положительные эффекты БВЭКС были продемонстрированы и при ХСН II ФК [536–539]. Но использование СРТ у пациентов с I ФК по данным двух исследований не влияло на заболеваемость и смертность [537, 538]. Таким
образом, чем тяжелее ФК ХСН, тем большего эффекта от СРТ можно ожидать у больных ХСН.
Характер ритма сердца. В основные МРКИ, изучающие эффекты СРТ, не включались пациенты с постоянной формой ФП, так что основные доказательства эффективности этого метода лечения доказаны для больных с синусовым ритмом. В двух небольших исследованиях было показано преимущество БВЭКС перед изолированной правожелудочковой стимуляцией по влиянию на клини-
ку и количество госпитализаций у больных с постоянной формой ФП [540, 541]. Однако по данным регистров, смертность у пациентов с ФП и имплантированным СРТ не отличается от аналогичных показателей пациентов с синусовым ритмом. Не выяснено только, необходимо ли при проведении БВЭКС больным ХСН и ФП выполнять радиочастотную аблацию атрио-вентрикулярного соединения [541]. Имеются данные о высокой эффективности применения СРТ у пациентов с постоянной формой ФП и строгим контролем ЧСС фармакологическими препаратами [542]. Эффективность СРТ при ФП и синусовом ритме практически одинакова при условии, что количество навязанных (эффективных) бивентрикулярных комплексов превышает 90–95 % [543], что оптимально контроли-
руется при Холтеровском мониторировании ЭКГ [544].
Таким образом, несмотря на лучшую изученность СРТ у больных с синусовым ритмом, успешная БВЭКС может выполняться и у пациентов с ФП при обеспечении высокого процента навязанных комплексов.
Основные рекомендации по применению СРТ у больных ХСН сводятся к следующему (таблица 28): A) СРТ / СРТ-Д показана всем больным ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и БЛНПГ при величине комплекса QRS, равной или более 150 мс, с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А).B) СРТ / СРТ-Д показана больным ХСН II ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусо-
вого ритма и БЛНПГ при величине комплекса QRS >150 мс с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А). C) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и при ширине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). D) Имплантация СРТ / СРТ-Д может быть рассмотрена у пациентов с ХСН II ФК, с ФВ ЛЖ <30–35 %, несмотря на ОМТ, при наличии синусового ритма и при величине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). E) Имплантация СРТ / СРТ-Д не показана пациентам с ХСН II–IVФК без наличия БЛНПГ вне зависимости от ширины комплекса QRS (класс рекомендаций
III, уровень доказанности А) F) Имплантация СРТ / СРТ-Д не показана у пациентов с ХСН II–IVФК при QRS <120 мс (класс рекоменда-
ций III, уровень доказанности А). G) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН II–IV ФК, c постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и проведенного
или планируемого РЧА АВ узла (класс рекомендаций IIA, уровень доказанности B).H) Имплантация СРТ / СРТ-Д может быть рассмотрена
у пациентов с ХСН II–IV ФК, с постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и фармакологическом контроле ЧСС, обеспечивающем более 95 % навязанных комплексов (класс рекомендаций IIB,
уровень доказанности C).
Таблица 28. Основные рекомендации по применению СРТ-P / СРТ-Д у больных ХСН
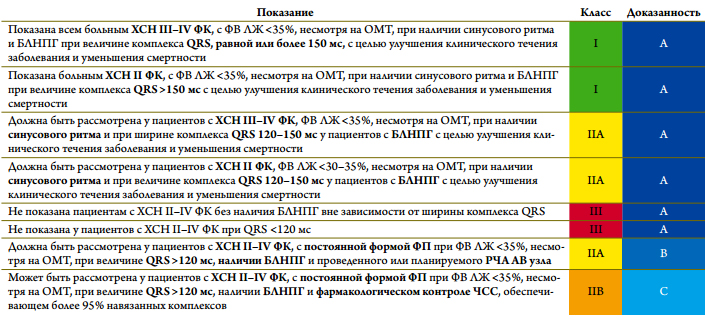 Возвращаясь к больным ХСН со сниженной ФВ ЛЖ и прямыми показаниями к постоянной ЭКС, следует напомнить о бóльшей эффективности БВЭКС и в этой группе больных. Причем как при синусовом ритме, так и при ФП, в том числе и после радиочастотной аблации атрио-вентрикулярного соединения (PAVE, DAVID).
Несмотря на меньшее число МРКИ для этой группы пациентов, также можно сформулировать основные показания к СРТ: A) У больных ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), должна применяться БВЭКС (первичная имплантация СРТ или дополнение ранее имплантированного кардиостимулятора до бивентрикулярного) с целью улучшения клинического состояния и уменьшения риска смерти или госпитализаций (класс рекомендаций I, уровень доказанности В). B) У пациентов с ХСН III–IV ФК, умеренной систолической дисфункцией ФВ ЛЖ (36–49 %), несмотря на ОМТ имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), имплантация СРТ может быть рассмотрена для уменьшения риска дальнейшего снижения ФВ ЛЖ и госпитализации из-за ХСН (класс рекомендаций IIB, уровень доказанности B).
Таблица 29. Основные рекомендации по постановке ИКД у больных ХСН
Возвращаясь к больным ХСН со сниженной ФВ ЛЖ и прямыми показаниями к постоянной ЭКС, следует напомнить о бóльшей эффективности БВЭКС и в этой группе больных. Причем как при синусовом ритме, так и при ФП, в том числе и после радиочастотной аблации атрио-вентрикулярного соединения (PAVE, DAVID).
Несмотря на меньшее число МРКИ для этой группы пациентов, также можно сформулировать основные показания к СРТ: A) У больных ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), должна применяться БВЭКС (первичная имплантация СРТ или дополнение ранее имплантированного кардиостимулятора до бивентрикулярного) с целью улучшения клинического состояния и уменьшения риска смерти или госпитализаций (класс рекомендаций I, уровень доказанности В). B) У пациентов с ХСН III–IV ФК, умеренной систолической дисфункцией ФВ ЛЖ (36–49 %), несмотря на ОМТ имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), имплантация СРТ может быть рассмотрена для уменьшения риска дальнейшего снижения ФВ ЛЖ и госпитализации из-за ХСН (класс рекомендаций IIB, уровень доказанности B).
Таблица 29. Основные рекомендации по постановке ИКД у больных ХСН
 12.1.3. Постановка имплантируемого кардиовертера–дефибриллятора
Постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным ХСН предполагает срабытывания устройства (электрическая кардиоверсия или частая желудочковая стимуляция) при появлении фибрилляции желудочков или устойчивой желудочковой тахикардии для предотвращения внезапной смерти. В то же время нет доказательств положительного влияния ИКД на прогресирование ХСН и сердечно-сосудистую (не внезапную) смертность. Кроме того, постановка ИКД с одним правожелудочковым электродом (используемым и для ЭКС) при достаточном времени изолированной правожелудочковой стимуляции приводит к диссинхронии и ухудшению прогноза больных ХСН. Показания к постановке и программированию работы ИКД базируются на проведении множества МРКИ и сводятся к следующему (таблица 29): A) ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или желудочковой тахикардии (вторичная профилактика внезапной сердечной смерти – ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс рекомендаций I, степень доказанности А) [522, 545–548]. B) Постановка ИКД должна быть рассмотрена у больных ХСН, устойчивой пароксизмальной ЖТ, с удовлетворительной насосной функцией ЛЖ (ФВ ЛЖ >40 %),
на фоне оптимальной медикаментозной терапии ХСН для предупреждения ВСС (класс рекомендаций IIA, степень доказанности С) [522, 545, 546, 549]. C) ИКД рекомендуется всем больным ХСН II ФК или III ФК при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 35 % с целью первичной профилактики ВСС (класс рекомендаций
I, степень доказанности А) [545, 547, 550]. D) ИКД может быть рекомендован больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 35 %, находящимся в I ФК для предотвращенияриска внезапной сердечной смерти (класс рекомендаций IIB, степень доказанности В) [545, 549]. E) ИКД рекомендуется больным ХСН II или III ФК
с неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, с целью профилактики внезапной сердечной смерти (класс рекомендаций I, степень доказанности В) [545, 547, 550]. F) ИКД не показан пациентам с рефрактерной ХСН, в том числе при IV ФК, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс рекомендаций III, степень доказанности А) [522, 545]. G) При имплантации ИКД без функции СРТ больным ХСН II–IV ФК с ФВ ЛЖ <40 %, не имеющим показаний к постоянной ЭКС, программирование работы ИКД в качестве стимулятора должно проводиться в режиме деманд (VVI) с базовой ЧСС 40 уд в мин для уменьшения риска прогрессирования ХСН (класс показаний IIA, уровень доказанности B) [527]. H) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью первичной профилактики внезапной смерти рекомендовано программировать срабатывание ИКД только при ЖТ / ФЖ >200 уд в минуту с задержкой перед срабатыванием 2,5 сек с целью уменьшения количества срабатываний ИКД в режиме дефибриллятора, замедления прогрессирования ХСН и снижения
риска смерти (класс показаний IIA, уровень доказанности B) [551]. I) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью вторичной профилактики ВСС рекомендовано программировать срабатывание ИКД при ЖТ с ЧСС >180 уд / мин
при длительности анализа не менее 30 / 40 комплексов, с целью снижения количества срабатывний ИКД и замедления прогрессирования ХСН (класс показании IIA, уровень доказанности B) [552].
12.1.4. Имплантация БВЭКС с функцией ИКД (СРТ-Д)
Изолированная постановка ИКД больным ХСН со сниженной ФВ ЛЖ имеет ограничения, связанные как со стимуляцией ПЖ, ведущей к диссинхронии работы сердца, так и с повторными разрядами, как обоснованными, так и необоснованными, способными вызывать
повреждения миокарда. В обоих случаях происходит ухудшение течения ХСН.
Для устранения диссинхронии вследствие изолированной правожелудочковой стимуляции необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца (СРТ-Д).
Постановка ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ-Д) показана всем больным ХСН III–IV ФК со сниженной ФВ ЛЖ <35 % и желудочковой диссинхронией (QRS ≥120 мс) и БЛНПГ для улучшения течения заболевания и снижения смертности (класс рекомендаций I, степень доказанности В)[545, 553, 554].
Больным с умеренно выраженной ХСН II ФК и ФВ ЛЖ <40 % при наличии желудочковой диссинхронии (QRS >120 мс) сочетание ИКД с БВЭКС (СРТ-Д) может быть показано для улучшения течения ХСН и снижения риска госпитализаций (класс рекомендаций IIA, степень
доказанности С) [546, 553, 554].
Для минимизации количества разрядов ИКД (в том числе и необоснованных) и снижения риска прогрессирования ХСН необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, β-АБ или их комбинация) (класс рекомендаций I, уровень доказанности B) [418, 555].
12.2. Хирургические методы лечения ХСН
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности
их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХСН.
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляризации миокарда (аортокоронарное или маммарно-коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ <35 %. Для проверки эффективности проведения реваскуляризации у больных ХСН и ФВ <35 % было проведено исследование STICH [556].
Первичная точка исследования (общая смертность) не различалась в группах оперативного вмешательства в сравнении с медикаментозным лечением, хотя сумма сердечно-сосудистых смертей и госпитализаций оказалась ниже в группе АКШ. В первые три месяца бóльшее число осложнений отмечено в группе оперативного лечения, а затем имела место тенденция к лучшему прогнозу
у оперированных больных. Причем выживаемость боль-ных не зависела от наличия жизнеспособного миокарда [557]. Однако выживаемость пациентов, рандомизированных в группу медикаментозного лечения и вынужденно оперированных, оказалась достоверно лучше [558]. Это позволяет высказать сдержанный оптимизм по поводу эффективности коронарной реваскуляризации у больных ХСН с низкой ФВ ЛЖ (класс рекомендаций IIB, уровень доказанности В).
Наличие митральной регургитации увеличивает риск смерти пациентов с сердечной недостаточностью. В медикаментозном лечении митральной регургитации используются иАПФ и периферические вазодилататоры, кроме этого, степень митральной регургитации уменьшает применение СРТ при условии наличия у пациента электрической диссинхронии (QRS больше 120–150 мс / наличие БЛНПГ). Для лечения тяжелой степени митральной регургитации используются открытая операция на сердце, замена МК или пластика МК. Решение о возможности и сроках проведения пластики и замены МК необходимо принимать совместно кардиологу и кардиохирургу.
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательно отобранной подгруппы больных (класс IIB, уровень доказанности В). В исследовании STICH было показано умеренное улучшение прогноза при сочетании АКШ и митральной валвулопластики у больных ХСН ишемической этиологии с низкой ФВ ЛЖ [559].
Проведение операции по коррекции МК сопряжено с высоким риском у пациентов с низкой ФВ ЛЖ, в связи с чем в настоящее время разрабатывается новый вид лечения – эндоваскулярная постановка клипсы МК. В исследовании EVEREST II [172] было показано, что несмотря на меньшую эффективность митральных клипс в снижении степени митральной регургитации сразу после
проведения процедуры, смертность в группе клипс и открытой операции на МК была одинаковой, как и степень митральной регургитации была одинаковой через 12 месяцев после лечения. При этом степень уменьшения КДО и увеличения ФВ ЛЖ была выше в группе операции, но и число пациентов с III–IVФК по NYHA было выше в группе операции (13 % против 2 %, p=0,002). Следует
учитывать, что в группе больных, рандомизированных на постановку митральных клипс, у 21 % из них проводилась операция на МК. Поэтому пока нет достаточно убедительных данных в пользу транскатетерной коррекции функциональной митральной регургитации (класс IIB, уровень доказанности В).
Пластика левого желудочка у больных ХСН ишемической этиологии с низкой ФВ ЛЖ, несмотря на уменьшение объемов сердца, не влияла на прогноз больных и также не может считаться рекомендованной (класс III, уровень доказанности В) [560].
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие-либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать: A) отсутствие достаточного количества донорских сердец, B) проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
C) болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего, и как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно снижается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН с критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата у некоторых
пациентов происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Создан и успешно применяется в клинической практике особо миниатюрный искусственный желудочек, представляющий собой микротурбину, приводимую в движение маленьким электродвигателем, делающим до 50 тыс. оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости
ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 5 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности. Она особенно эффективна для лечения кардиогенного шока, развившегося на фоне острого ИМ, а также для подстраховки рентгенэндоваскулярных вмешательств
на коронарных артериях у пациентов повышенного риска.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (класс IIA, уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения [561].
В настоящее время применяются два типа ИЛЖ: пульсового (синхронизированного с ЭКГ) и постоянного тока. Причем последние устройства роторного типа имеют меньшую массу, меньше двигающихся деталей, меньше влияют на элементы крови, менее тромбогенны
и более долговечны. В МРКИ было доказано достоверное улучшение прогноза при применении ИЛЖ постоянного
тока по сравнению с пульсовым [562] (класс рекомендаций IIA, уровеь доказанности B).
Основным ограничением к использованию в России ИЛЖ может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарас-
тание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кардиомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков.
Вместе с тем данная методика пока находится на этапе своего становления, и для подтверждения ее эффективности необходимы результаты клинических исследований.
Рисунок 6. Алгоритм лечения ХСН cо сниженной ФВ ЛЖ <40%
12.1.3. Постановка имплантируемого кардиовертера–дефибриллятора
Постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным ХСН предполагает срабытывания устройства (электрическая кардиоверсия или частая желудочковая стимуляция) при появлении фибрилляции желудочков или устойчивой желудочковой тахикардии для предотвращения внезапной смерти. В то же время нет доказательств положительного влияния ИКД на прогресирование ХСН и сердечно-сосудистую (не внезапную) смертность. Кроме того, постановка ИКД с одним правожелудочковым электродом (используемым и для ЭКС) при достаточном времени изолированной правожелудочковой стимуляции приводит к диссинхронии и ухудшению прогноза больных ХСН. Показания к постановке и программированию работы ИКД базируются на проведении множества МРКИ и сводятся к следующему (таблица 29): A) ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или желудочковой тахикардии (вторичная профилактика внезапной сердечной смерти – ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс рекомендаций I, степень доказанности А) [522, 545–548]. B) Постановка ИКД должна быть рассмотрена у больных ХСН, устойчивой пароксизмальной ЖТ, с удовлетворительной насосной функцией ЛЖ (ФВ ЛЖ >40 %),
на фоне оптимальной медикаментозной терапии ХСН для предупреждения ВСС (класс рекомендаций IIA, степень доказанности С) [522, 545, 546, 549]. C) ИКД рекомендуется всем больным ХСН II ФК или III ФК при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 35 % с целью первичной профилактики ВСС (класс рекомендаций
I, степень доказанности А) [545, 547, 550]. D) ИКД может быть рекомендован больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 35 %, находящимся в I ФК для предотвращенияриска внезапной сердечной смерти (класс рекомендаций IIB, степень доказанности В) [545, 549]. E) ИКД рекомендуется больным ХСН II или III ФК
с неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, с целью профилактики внезапной сердечной смерти (класс рекомендаций I, степень доказанности В) [545, 547, 550]. F) ИКД не показан пациентам с рефрактерной ХСН, в том числе при IV ФК, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс рекомендаций III, степень доказанности А) [522, 545]. G) При имплантации ИКД без функции СРТ больным ХСН II–IV ФК с ФВ ЛЖ <40 %, не имеющим показаний к постоянной ЭКС, программирование работы ИКД в качестве стимулятора должно проводиться в режиме деманд (VVI) с базовой ЧСС 40 уд в мин для уменьшения риска прогрессирования ХСН (класс показаний IIA, уровень доказанности B) [527]. H) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью первичной профилактики внезапной смерти рекомендовано программировать срабатывание ИКД только при ЖТ / ФЖ >200 уд в минуту с задержкой перед срабатыванием 2,5 сек с целью уменьшения количества срабатываний ИКД в режиме дефибриллятора, замедления прогрессирования ХСН и снижения
риска смерти (класс показаний IIA, уровень доказанности B) [551]. I) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью вторичной профилактики ВСС рекомендовано программировать срабатывание ИКД при ЖТ с ЧСС >180 уд / мин
при длительности анализа не менее 30 / 40 комплексов, с целью снижения количества срабатывний ИКД и замедления прогрессирования ХСН (класс показании IIA, уровень доказанности B) [552].
12.1.4. Имплантация БВЭКС с функцией ИКД (СРТ-Д)
Изолированная постановка ИКД больным ХСН со сниженной ФВ ЛЖ имеет ограничения, связанные как со стимуляцией ПЖ, ведущей к диссинхронии работы сердца, так и с повторными разрядами, как обоснованными, так и необоснованными, способными вызывать
повреждения миокарда. В обоих случаях происходит ухудшение течения ХСН.
Для устранения диссинхронии вследствие изолированной правожелудочковой стимуляции необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца (СРТ-Д).
Постановка ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ-Д) показана всем больным ХСН III–IV ФК со сниженной ФВ ЛЖ <35 % и желудочковой диссинхронией (QRS ≥120 мс) и БЛНПГ для улучшения течения заболевания и снижения смертности (класс рекомендаций I, степень доказанности В)[545, 553, 554].
Больным с умеренно выраженной ХСН II ФК и ФВ ЛЖ <40 % при наличии желудочковой диссинхронии (QRS >120 мс) сочетание ИКД с БВЭКС (СРТ-Д) может быть показано для улучшения течения ХСН и снижения риска госпитализаций (класс рекомендаций IIA, степень
доказанности С) [546, 553, 554].
Для минимизации количества разрядов ИКД (в том числе и необоснованных) и снижения риска прогрессирования ХСН необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, β-АБ или их комбинация) (класс рекомендаций I, уровень доказанности B) [418, 555].
12.2. Хирургические методы лечения ХСН
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности
их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХСН.
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляризации миокарда (аортокоронарное или маммарно-коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ <35 %. Для проверки эффективности проведения реваскуляризации у больных ХСН и ФВ <35 % было проведено исследование STICH [556].
Первичная точка исследования (общая смертность) не различалась в группах оперативного вмешательства в сравнении с медикаментозным лечением, хотя сумма сердечно-сосудистых смертей и госпитализаций оказалась ниже в группе АКШ. В первые три месяца бóльшее число осложнений отмечено в группе оперативного лечения, а затем имела место тенденция к лучшему прогнозу
у оперированных больных. Причем выживаемость боль-ных не зависела от наличия жизнеспособного миокарда [557]. Однако выживаемость пациентов, рандомизированных в группу медикаментозного лечения и вынужденно оперированных, оказалась достоверно лучше [558]. Это позволяет высказать сдержанный оптимизм по поводу эффективности коронарной реваскуляризации у больных ХСН с низкой ФВ ЛЖ (класс рекомендаций IIB, уровень доказанности В).
Наличие митральной регургитации увеличивает риск смерти пациентов с сердечной недостаточностью. В медикаментозном лечении митральной регургитации используются иАПФ и периферические вазодилататоры, кроме этого, степень митральной регургитации уменьшает применение СРТ при условии наличия у пациента электрической диссинхронии (QRS больше 120–150 мс / наличие БЛНПГ). Для лечения тяжелой степени митральной регургитации используются открытая операция на сердце, замена МК или пластика МК. Решение о возможности и сроках проведения пластики и замены МК необходимо принимать совместно кардиологу и кардиохирургу.
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательно отобранной подгруппы больных (класс IIB, уровень доказанности В). В исследовании STICH было показано умеренное улучшение прогноза при сочетании АКШ и митральной валвулопластики у больных ХСН ишемической этиологии с низкой ФВ ЛЖ [559].
Проведение операции по коррекции МК сопряжено с высоким риском у пациентов с низкой ФВ ЛЖ, в связи с чем в настоящее время разрабатывается новый вид лечения – эндоваскулярная постановка клипсы МК. В исследовании EVEREST II [172] было показано, что несмотря на меньшую эффективность митральных клипс в снижении степени митральной регургитации сразу после
проведения процедуры, смертность в группе клипс и открытой операции на МК была одинаковой, как и степень митральной регургитации была одинаковой через 12 месяцев после лечения. При этом степень уменьшения КДО и увеличения ФВ ЛЖ была выше в группе операции, но и число пациентов с III–IVФК по NYHA было выше в группе операции (13 % против 2 %, p=0,002). Следует
учитывать, что в группе больных, рандомизированных на постановку митральных клипс, у 21 % из них проводилась операция на МК. Поэтому пока нет достаточно убедительных данных в пользу транскатетерной коррекции функциональной митральной регургитации (класс IIB, уровень доказанности В).
Пластика левого желудочка у больных ХСН ишемической этиологии с низкой ФВ ЛЖ, несмотря на уменьшение объемов сердца, не влияла на прогноз больных и также не может считаться рекомендованной (класс III, уровень доказанности В) [560].
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие-либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать: A) отсутствие достаточного количества донорских сердец, B) проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
C) болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего, и как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно снижается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН с критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата у некоторых
пациентов происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Создан и успешно применяется в клинической практике особо миниатюрный искусственный желудочек, представляющий собой микротурбину, приводимую в движение маленьким электродвигателем, делающим до 50 тыс. оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости
ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 5 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности. Она особенно эффективна для лечения кардиогенного шока, развившегося на фоне острого ИМ, а также для подстраховки рентгенэндоваскулярных вмешательств
на коронарных артериях у пациентов повышенного риска.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (класс IIA, уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения [561].
В настоящее время применяются два типа ИЛЖ: пульсового (синхронизированного с ЭКГ) и постоянного тока. Причем последние устройства роторного типа имеют меньшую массу, меньше двигающихся деталей, меньше влияют на элементы крови, менее тромбогенны
и более долговечны. В МРКИ было доказано достоверное улучшение прогноза при применении ИЛЖ постоянного
тока по сравнению с пульсовым [562] (класс рекомендаций IIA, уровеь доказанности B).
Основным ограничением к использованию в России ИЛЖ может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарас-
тание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кардиомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков.
Вместе с тем данная методика пока находится на этапе своего становления, и для подтверждения ее эффективности необходимы результаты клинических исследований.
Рисунок 6. Алгоритм лечения ХСН cо сниженной ФВ ЛЖ <40%
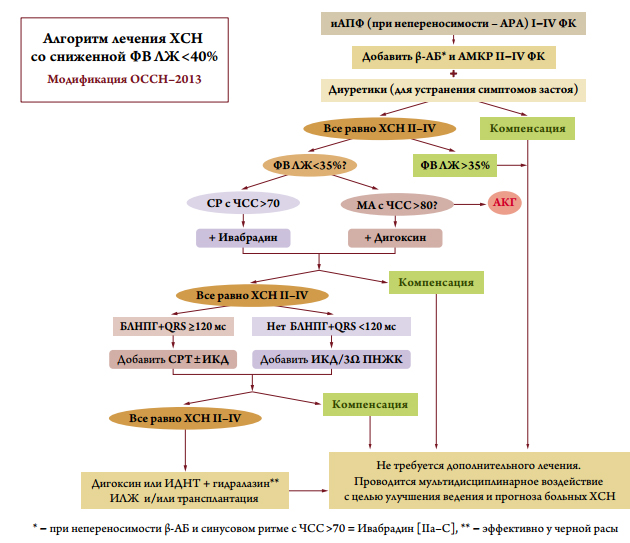 13. Алгоритм лечения ХСН
Обобщенное схематическое руководство по стратегии выбора лечебной тактики (как медикаментозной, так и немедикаментозной) для больных ХСН представлено на рисунке 6. A) Ингибиторы АПФ являются обязательными препаратами, начиная с I ст. ХСН, и их назначение является необходимым на всех этапах прогрессирования болезни. Предпочтительным выбором можно считать каптоприл, эналаприл, периндоприл и фозиноприл. При сохранной функции почек можно использовать и лизиноприл. B) При непереносимости иАПФ терапия может начинаться и с АРА, предпочтительно с наиболее изученного именно при ХСН кандесартана. Также возможно назначение лозартана или валсартана. C) При I ФК можно ограничиться назначением только блокатора РААС. D) Начиная со II ФК, целесообразно применение тройной нейрогормональной блокады (блокатор РААС + β-АБ + АМКР). E) Из β-АБ к применению в лечении ХСН рекомендованы: бисопролол, карведилол, метопролола сукцинат замедленного выведения и небиволол. Эффективность лечения зависит от степени снижения ЧСС. F) При синусовом ритме с ЧСС более 70 уд / мин и непереносимости β-АБ вместо них может использоваться ивабрадин. G) Из АМКР применение спиронолактона должно быть ограничено ХСН III–IV ФК и периодами обострения декомпенсации. Применение эплеренона показано пациентам II–IV ФК и является оптимальным при длительном лечении больных.
H) При отсутствии задержки жидкости в организме можно ограничиться назначением трех нейрогормональных модуляторов (иАПФ + β-АБ + АМКР) пациентам с ХСН II–IV ФК. I) При наличии застойных явлений к терапии должны быть присоединены диуретические средства, наиболее эффективным и безопасным из которых является торасемид. При более выраженной задержке жидко-
сти возможно сочетание петлевых (торасемид) тиазидных диуретиков и ингибиторов карбоангидразы. J) Если подобная терапия не позволяет достигать состояния компенсации, должна быть проведена оценка систолической функции ЛЖ. При сохранной ФВ ЛЖ
(>40 %) в настоящее время нет доказательств, что какое-либо дополнительное лечение может положительно влиять на прогноз больных ХСН. K) У больных со сниженной ФВ ЛЖ следующим критерием оценки является определение характера основного ритма и ЧСС. L) При синусовом ритме с ЧСС более 70 уд / мин, несмотря на терапию β-АБ (при невозможности безопасного увеличения их дозировок), целесообразно дополнительное назначение ивабрадина. M) При ФП и ЧСС, по крайней мере, более 85 уд / мин рекомендовано назначение невысоких доз дигоксина (концентрация в плазме не должна превышать 1,1 нг / мл). N) При ФП назначение антикоагулянтов является обязательной процедурой независимо от стадии болезни и ЧСС. При синусовом ритме даже при наличии
внутрисердечного тромбоза эффективность антикоагулянтов не полностью доказана. Антиагреганты не могут адекватно заменить антикоагулянты в предотвращении риска тромбоэмболических осложнений. O) Если и при этом не достигается состояние компенса-
ции, следующим критерием оценки является определение морфологии и ширины комплекса QRS. P) При наличии БЛНПГ и широком комплексе QRS (≥120 мс) у больных ХСН II–IV ФК применяется метод СРТ (трехкамерная стимуляция сердца). Эффективность СРТ выше при синусовом ритме и более тяжелой ХСН III–IV ФК. При ФП необходима либо дополнительная РЧА аблация атрио-вентрикулярного соединения или оптимальный медикаментозный контроль ЧСС, позволяющий добиваться не менее 95 % навязанных комплексов.
Q) В настоящее время используются аппараты, объединяющие ресинхронизатор и ИКД. R) Постановка ИКД (лучше вместе с СРТ) показана для первичной и вторичной профилактики ВСС у больных ХСН II–IV ФК с низкой ФВ ЛЖ вне зависимости от ширины комплекса QRS. S) Для снижения риска общей и внезапной смерти возможно применение препаратов омега-3 ПНЖК.
T) Если и в этом случае не удается добиться состояния компенсации, дополнительно может быть ис ван дигоксин, у лиц черной расы комбинация вазодилататоров или хирургические методы лечения. U) Дигоксин при синусовом ритме наиболее эффективен у больных ХСН III–IV ФК с увеличенными размерами сердца (КТИ >0,55) и низкой ФВ ЛЖ (<30 %) и позволяет на ⅓ снижать риск обострения ХСН и повторных госпитализаций. V) Пересадка сердца может быть последним шансом спасения жизни больных с терминальной ХСН.
Ограничениями являются: недостаток донорского материала, необходимость пожизненной иммуносупрессивной терапии и необходимость постоянного мониторирования состояния больных с пересаженными сердцами, что требует существенных финан
совых затрат. В качестве альтернативы возможно использование искусственных желудочков сердца. W) Эффективность и безопасность других хирургических методов лечения требует дальнейших исследований.
Следует помнить, что на всех этапах развития болезни необходимо сохранять преемственность госпитального и амбулаторного лечения больных ХСН и пропагандиро вать здоровый образ жизни.
Комитет экспертов – рецензентов
Акчурин Р. C., Аронов Д. М., Архипов М. В., Барт Б. Я., Белоусов Ю. Б., Бойцов С. А., Гендлин Г. Е., Голиков А. П.,
Голицын С. П., Гуревич М. А., Даниелян М. О., Довгалевский П. Я., Задионченко В. С., Карпов Р. С., Карпов Ю. А.,
Кобалава Ж. Д., Кузнецов В. А., Лазебник Л. Б., Насонов Е. Л., Недогода С. В., Никитин Ю. П., Оганов Р. Г., Панченко Е. П.,
Перепеч Н. Б., Подзолков В. И., Поздняков Ю. А., Раков А. Л., Руда М. Я., Рылова А. К., Симоненко В. А., Сидоренко Б. А.,
Староверов И. И., Сулимов В. А., Тарловская Е. И., Терещенко С. Н., Фомина И. Г., Чазова И. Е.
Приложение 1.
Классификация хронической сердечной недостаточности ОССН (2002 г.)
13. Алгоритм лечения ХСН
Обобщенное схематическое руководство по стратегии выбора лечебной тактики (как медикаментозной, так и немедикаментозной) для больных ХСН представлено на рисунке 6. A) Ингибиторы АПФ являются обязательными препаратами, начиная с I ст. ХСН, и их назначение является необходимым на всех этапах прогрессирования болезни. Предпочтительным выбором можно считать каптоприл, эналаприл, периндоприл и фозиноприл. При сохранной функции почек можно использовать и лизиноприл. B) При непереносимости иАПФ терапия может начинаться и с АРА, предпочтительно с наиболее изученного именно при ХСН кандесартана. Также возможно назначение лозартана или валсартана. C) При I ФК можно ограничиться назначением только блокатора РААС. D) Начиная со II ФК, целесообразно применение тройной нейрогормональной блокады (блокатор РААС + β-АБ + АМКР). E) Из β-АБ к применению в лечении ХСН рекомендованы: бисопролол, карведилол, метопролола сукцинат замедленного выведения и небиволол. Эффективность лечения зависит от степени снижения ЧСС. F) При синусовом ритме с ЧСС более 70 уд / мин и непереносимости β-АБ вместо них может использоваться ивабрадин. G) Из АМКР применение спиронолактона должно быть ограничено ХСН III–IV ФК и периодами обострения декомпенсации. Применение эплеренона показано пациентам II–IV ФК и является оптимальным при длительном лечении больных.
H) При отсутствии задержки жидкости в организме можно ограничиться назначением трех нейрогормональных модуляторов (иАПФ + β-АБ + АМКР) пациентам с ХСН II–IV ФК. I) При наличии застойных явлений к терапии должны быть присоединены диуретические средства, наиболее эффективным и безопасным из которых является торасемид. При более выраженной задержке жидко-
сти возможно сочетание петлевых (торасемид) тиазидных диуретиков и ингибиторов карбоангидразы. J) Если подобная терапия не позволяет достигать состояния компенсации, должна быть проведена оценка систолической функции ЛЖ. При сохранной ФВ ЛЖ
(>40 %) в настоящее время нет доказательств, что какое-либо дополнительное лечение может положительно влиять на прогноз больных ХСН. K) У больных со сниженной ФВ ЛЖ следующим критерием оценки является определение характера основного ритма и ЧСС. L) При синусовом ритме с ЧСС более 70 уд / мин, несмотря на терапию β-АБ (при невозможности безопасного увеличения их дозировок), целесообразно дополнительное назначение ивабрадина. M) При ФП и ЧСС, по крайней мере, более 85 уд / мин рекомендовано назначение невысоких доз дигоксина (концентрация в плазме не должна превышать 1,1 нг / мл). N) При ФП назначение антикоагулянтов является обязательной процедурой независимо от стадии болезни и ЧСС. При синусовом ритме даже при наличии
внутрисердечного тромбоза эффективность антикоагулянтов не полностью доказана. Антиагреганты не могут адекватно заменить антикоагулянты в предотвращении риска тромбоэмболических осложнений. O) Если и при этом не достигается состояние компенса-
ции, следующим критерием оценки является определение морфологии и ширины комплекса QRS. P) При наличии БЛНПГ и широком комплексе QRS (≥120 мс) у больных ХСН II–IV ФК применяется метод СРТ (трехкамерная стимуляция сердца). Эффективность СРТ выше при синусовом ритме и более тяжелой ХСН III–IV ФК. При ФП необходима либо дополнительная РЧА аблация атрио-вентрикулярного соединения или оптимальный медикаментозный контроль ЧСС, позволяющий добиваться не менее 95 % навязанных комплексов.
Q) В настоящее время используются аппараты, объединяющие ресинхронизатор и ИКД. R) Постановка ИКД (лучше вместе с СРТ) показана для первичной и вторичной профилактики ВСС у больных ХСН II–IV ФК с низкой ФВ ЛЖ вне зависимости от ширины комплекса QRS. S) Для снижения риска общей и внезапной смерти возможно применение препаратов омега-3 ПНЖК.
T) Если и в этом случае не удается добиться состояния компенсации, дополнительно может быть ис ван дигоксин, у лиц черной расы комбинация вазодилататоров или хирургические методы лечения. U) Дигоксин при синусовом ритме наиболее эффективен у больных ХСН III–IV ФК с увеличенными размерами сердца (КТИ >0,55) и низкой ФВ ЛЖ (<30 %) и позволяет на ⅓ снижать риск обострения ХСН и повторных госпитализаций. V) Пересадка сердца может быть последним шансом спасения жизни больных с терминальной ХСН.
Ограничениями являются: недостаток донорского материала, необходимость пожизненной иммуносупрессивной терапии и необходимость постоянного мониторирования состояния больных с пересаженными сердцами, что требует существенных финан
совых затрат. В качестве альтернативы возможно использование искусственных желудочков сердца. W) Эффективность и безопасность других хирургических методов лечения требует дальнейших исследований.
Следует помнить, что на всех этапах развития болезни необходимо сохранять преемственность госпитального и амбулаторного лечения больных ХСН и пропагандиро вать здоровый образ жизни.
Комитет экспертов – рецензентов
Акчурин Р. C., Аронов Д. М., Архипов М. В., Барт Б. Я., Белоусов Ю. Б., Бойцов С. А., Гендлин Г. Е., Голиков А. П.,
Голицын С. П., Гуревич М. А., Даниелян М. О., Довгалевский П. Я., Задионченко В. С., Карпов Р. С., Карпов Ю. А.,
Кобалава Ж. Д., Кузнецов В. А., Лазебник Л. Б., Насонов Е. Л., Недогода С. В., Никитин Ю. П., Оганов Р. Г., Панченко Е. П.,
Перепеч Н. Б., Подзолков В. И., Поздняков Ю. А., Раков А. Л., Руда М. Я., Рылова А. К., Симоненко В. А., Сидоренко Б. А.,
Староверов И. И., Сулимов В. А., Тарловская Е. И., Терещенко С. Н., Фомина И. Г., Чазова И. Е.
Приложение 1.
Классификация хронической сердечной недостаточности ОССН (2002 г.)
 Комментарии к классификации ХСН ОССН
Во-первых, что касается ХСН стадии 0. В классификации ее нет, т. к. при отсутствии симптомов и поражения сердца ХСН у больного про-
сто не может быть. Бессимптомная дисфункция ЛЖ уже соответствует I-й стадии болезни или по выраженности симптомов – I-му ФК.
• Бессимптомная дисфункция ЛЖ (соответствует I стадии).
• Симптомы ХСН в покое и при обычных нагрузках отсутствуют (см. соответствующее определение в I стадии).
• Систолическая дисфункция: ФВ ЛЖ ≤45 % и / или конечно-диастолический размер (КДР) ЛЖ>5,5 см (индекс конечно-диастолическо-
го размера (ИКДР) ЛЖ >3,3 см / м2).
• Диастолическая дисфункция: ТМЖП (толщина межжелудочковой перегородки) + ТЗСЛЖ (толщина задней стенки ЛЖ) ÷ 2>1,3 см
и / или ТЗСЖ >1,2 см, и / или гипертрофический тип спектра трансмитрального допплеровского потока (ТМДП) (Е / А <1,0).
При этом относительная толщина стенок ЛЖ ТМЖП + ТЗСЛЖ / КДР не отличается от нормы и составляет ≥0,45.
• Индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) не отличается от нормы (<0,70).
• Адаптивное ремоделирование ЛЖ (соответствует IIA стадии).
• Симптомы (см. соответствующее определение во IIA стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,70 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) >0,30 и <0,45.
• Диастолическая дисфункция (см. в I стадии) + псевдонормальный тип спектра ТМДП ≥1,1 и ≤2,0.
• Дезадаптивное ремоделирование ЛЖ (соответствует IIБ стадии).
• Симптомы (см. соответствующее определение во IIБ стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,80 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) ≤0,30.
• Диастолическая дисфункция (см. в I стадии) + рестриктивный тип спектра ТМДП >2,0.
Во-вторых, для определения стадии ХСН, как это было в классификации В. Х. Василенко и Н. Д. Стражеско, также как и для определе-
ния ФК ХСН, как это принято в классификации Нью-Йоркской ассоциации сердца (NYHA), специальных процедур и исследований
(например, велоэргометрии) не требуется.
В-третьих, для объективизации ФК ХСН используются ТШХ и ШОКС.
Приложение 2.
Назначение нутритивной поддержки
2.1. Назначение нутритивной поддержки
• Перед назначением нутритивной поддержки необходимо произ-
вести расчет истинной потребности в энергии (ИПЭ). ИПЭ опре-
деляется, как произведение величины основного обмена (ОО)
и фактора активности пациента. ОО рассчитывается по уравне-
нию Харриса–Бенедикта [563]:
Мужчины
ОО = 66,47 + 13,75 × вес (кг) + 5 × рост (м) – 6,77 × возраст (годы)
Женщины
ОО = 665,1 + 9,56 × вес (кг) + 1,85 × рост (м) – 4,67 × возраст (годы)
• Фактор активности (ФА) определяется в зависимости от физиче-
ской активности больного: постельный режим – 1,2, умеренная
физическая активность – 1,3, значительная физическая актив-
ность – 1,4.
• При массе тела менее 10–20 % от нормы дефицит массы тела
(ДМТ) равен 1,1, 20–30 % – 1,2, больше 30 % – 1,3.
ИПЭ = ОО × ФА × ДМТ
2.2. Принципы введения энтерального питания в рацион
• Начинать нутритивную поддержку с малых доз (не более 5–10 %
от уровня истинной энергопотребности).
• Обязательно добавлять ферментные препараты (1–2 таблетки / сут).
• Постепенно увеличивать объем энерговосполнения за счет
питательной смеси (объем вводимой смеси увеличивать 1 раз
в 5–7 дней).
• Рекомендуется следующая процедура титрации дозы:
1-я неделя – 5–10 % энергопотребности
2-я неделя – 10–20 % энергопотребности
3-я неделя – 20–30 % энергопотребности
• Контроль эффективности нутритивной поддержки должен
осуществляться уже с первой недели терапии и включать в себя
динамику антропометрических показателей (ИМТ, тощая масса
тела, окружность мышц плеча), лабораторный контроль и оценку
переносимости питательных смесей.
• У больных с декомпенсацией кровообращения, когда резко
ухудшаются показатели всасывания, оптимальным является при-
менение олигомерных питательных смесей (Пептамен, уровень
доказательности С) [564]. В период стабилизации состояния
для ежедневного приема можно рекомендовать высокомолекуляр-
ные сбалансированные смеси в количестве 25–50 % от суточной
энергопотребности [563, 565–567] (Унипит, Нутриэн-стандарт,
Берламин модуляр, Клинутрен; уровень доказательности С) [568,
569]. Вопрос о сочетании энтерального и парентерального пита-
ния ставится при выраженной сердечной кахексии, когда приме-
нение лишь энтерального питания невозможно или недостаточно
эффективно [570, 571].
2.3. Применение пробиотиков
В последние годы в ряде работ было продемонстрировано уве-
личение концентрации эндотоксина грамотрицательных бакте-
рий в крови пациентов с ХСН по мере нарастания ФК. Уровень
эндотоксина в крови этих пациентов коррелирует с изменениями
микрофлоры толстой кишки: уменьшением количества грампо-
ложительных лакто- и бифидобактерий и ростом числа условно-
патогенных грамотрицательных микроорганизмов (клебсиелл,
энтеробактеров, эшерихий). Причем изменения микрофлоры
выявляются как при исследовании полостной микрофлоры, так
и пристеночной. Предполагавшаяся многими авторами целесо-
образность применения селективной деконтаминации у пациентов
с высокими ФК ХСН не показала своей эффективности и сопрово-
ждалась большим количеством побочных эффектов.
В результате проведенных исследований была отмечена эффектив-
ность и безопасность применения пробиотиков после недельного
курса селективной деконтаминации препаратами группы фторхи-
нолонов. Данная схема позволяет нормализовать микробный пей-
заж толстой кишки, снизить уровень эндотоксина грамотрицатель-
ных бактерий в крови, уровень провоспалительных цитокинов,
а также уменьшить сроки госпитализации пациентов с III–IV ФК
ХСН. Таким образом, для пациентов с высокими ФК ХСН можно
рекомендовать провести оценку микрофлоры кишечника и в слу-
чае выявления изменений – применять селективную деконтамина-
цию (фторхинолоны) с последующим назначением пробиотиков.
Приложение 3.
Методика проведения физических нагрузок в форме ходьбы
I этап. Вхождение.
• Продолжительность этапа – 6–10 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 25 мин / 1 км
• Расстояние – 1 км
• При стабильной клинической картине возможен переход
ко второму этапу
II этап.
• Продолжительность этапа 12 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 20 мин / 1 км
• Расстояние – 2 км
• При стабильном клиническом состоянии – переход на постоян-
ную форму занятий
• Для пациентов, прошедших 500 и более метров за 6 мин, по-
казаны динамические физические нагрузки (например, ходьба
с прогрессивным повышением нагрузки до скорости 6 км / ч
и продолжительностью до 40 минут в день). Титрация нагрузки –
до 6–8 месяцев
• В связи с невозможностью оценивать в каждом конкретном
случае максимальное потребление кислорода расчет нагрузок дан
в конкретных цифрах – расстояние, нагрузка, продолжительность
Приложение 4.
Методика проведения тренировок дыхательных мышц
Пациент занимает удобное положение сидя, помещает зажим
на нос. После обычных вдоха и выдоха пациент делает медленный
вдох, в течение 4–5 с, через загубник тренажера Threshold IMT.
После этого, не выдыхая воздух, пациент делает медленный выдох,
в течение 5–6 с, в тренажер Threshold PEP, после чего следует пауза
3 с. Затем вдох и выдох с использованием тренажеров повторяются
еще 3 раза. После этого следует обычное спокойное дыхание в тече-
ние 2 мин. Таким образом осуществляется профилактика гипервен-
тиляции. В дальнейшем весь цикл, состоящий из 4 вдохов, 4 выдохов
и 2 мин отдыха, повторяется еще 3 раза. Таким образом, продолжи-
тельность одной тренировки составляет около 20 мин. Необходимо
проводить 2 тренировки в день утром и вечером не менее 5 раз
в неделю. Увеличение сопротивления происходит на 2 мм водного
столба каждую 3–5-ю тренировку с учетом состояния пациента.
СПИСОК Л ИТЕРАТУРЫ
Комментарии к классификации ХСН ОССН
Во-первых, что касается ХСН стадии 0. В классификации ее нет, т. к. при отсутствии симптомов и поражения сердца ХСН у больного про-
сто не может быть. Бессимптомная дисфункция ЛЖ уже соответствует I-й стадии болезни или по выраженности симптомов – I-му ФК.
• Бессимптомная дисфункция ЛЖ (соответствует I стадии).
• Симптомы ХСН в покое и при обычных нагрузках отсутствуют (см. соответствующее определение в I стадии).
• Систолическая дисфункция: ФВ ЛЖ ≤45 % и / или конечно-диастолический размер (КДР) ЛЖ>5,5 см (индекс конечно-диастолическо-
го размера (ИКДР) ЛЖ >3,3 см / м2).
• Диастолическая дисфункция: ТМЖП (толщина межжелудочковой перегородки) + ТЗСЛЖ (толщина задней стенки ЛЖ) ÷ 2>1,3 см
и / или ТЗСЖ >1,2 см, и / или гипертрофический тип спектра трансмитрального допплеровского потока (ТМДП) (Е / А <1,0).
При этом относительная толщина стенок ЛЖ ТМЖП + ТЗСЛЖ / КДР не отличается от нормы и составляет ≥0,45.
• Индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) не отличается от нормы (<0,70).
• Адаптивное ремоделирование ЛЖ (соответствует IIA стадии).
• Симптомы (см. соответствующее определение во IIA стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,70 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) >0,30 и <0,45.
• Диастолическая дисфункция (см. в I стадии) + псевдонормальный тип спектра ТМДП ≥1,1 и ≤2,0.
• Дезадаптивное ремоделирование ЛЖ (соответствует IIБ стадии).
• Симптомы (см. соответствующее определение во IIБ стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,80 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) ≤0,30.
• Диастолическая дисфункция (см. в I стадии) + рестриктивный тип спектра ТМДП >2,0.
Во-вторых, для определения стадии ХСН, как это было в классификации В. Х. Василенко и Н. Д. Стражеско, также как и для определе-
ния ФК ХСН, как это принято в классификации Нью-Йоркской ассоциации сердца (NYHA), специальных процедур и исследований
(например, велоэргометрии) не требуется.
В-третьих, для объективизации ФК ХСН используются ТШХ и ШОКС.
Приложение 2.
Назначение нутритивной поддержки
2.1. Назначение нутритивной поддержки
• Перед назначением нутритивной поддержки необходимо произ-
вести расчет истинной потребности в энергии (ИПЭ). ИПЭ опре-
деляется, как произведение величины основного обмена (ОО)
и фактора активности пациента. ОО рассчитывается по уравне-
нию Харриса–Бенедикта [563]:
Мужчины
ОО = 66,47 + 13,75 × вес (кг) + 5 × рост (м) – 6,77 × возраст (годы)
Женщины
ОО = 665,1 + 9,56 × вес (кг) + 1,85 × рост (м) – 4,67 × возраст (годы)
• Фактор активности (ФА) определяется в зависимости от физиче-
ской активности больного: постельный режим – 1,2, умеренная
физическая активность – 1,3, значительная физическая актив-
ность – 1,4.
• При массе тела менее 10–20 % от нормы дефицит массы тела
(ДМТ) равен 1,1, 20–30 % – 1,2, больше 30 % – 1,3.
ИПЭ = ОО × ФА × ДМТ
2.2. Принципы введения энтерального питания в рацион
• Начинать нутритивную поддержку с малых доз (не более 5–10 %
от уровня истинной энергопотребности).
• Обязательно добавлять ферментные препараты (1–2 таблетки / сут).
• Постепенно увеличивать объем энерговосполнения за счет
питательной смеси (объем вводимой смеси увеличивать 1 раз
в 5–7 дней).
• Рекомендуется следующая процедура титрации дозы:
1-я неделя – 5–10 % энергопотребности
2-я неделя – 10–20 % энергопотребности
3-я неделя – 20–30 % энергопотребности
• Контроль эффективности нутритивной поддержки должен
осуществляться уже с первой недели терапии и включать в себя
динамику антропометрических показателей (ИМТ, тощая масса
тела, окружность мышц плеча), лабораторный контроль и оценку
переносимости питательных смесей.
• У больных с декомпенсацией кровообращения, когда резко
ухудшаются показатели всасывания, оптимальным является при-
менение олигомерных питательных смесей (Пептамен, уровень
доказательности С) [564]. В период стабилизации состояния
для ежедневного приема можно рекомендовать высокомолекуляр-
ные сбалансированные смеси в количестве 25–50 % от суточной
энергопотребности [563, 565–567] (Унипит, Нутриэн-стандарт,
Берламин модуляр, Клинутрен; уровень доказательности С) [568,
569]. Вопрос о сочетании энтерального и парентерального пита-
ния ставится при выраженной сердечной кахексии, когда приме-
нение лишь энтерального питания невозможно или недостаточно
эффективно [570, 571].
2.3. Применение пробиотиков
В последние годы в ряде работ было продемонстрировано уве-
личение концентрации эндотоксина грамотрицательных бакте-
рий в крови пациентов с ХСН по мере нарастания ФК. Уровень
эндотоксина в крови этих пациентов коррелирует с изменениями
микрофлоры толстой кишки: уменьшением количества грампо-
ложительных лакто- и бифидобактерий и ростом числа условно-
патогенных грамотрицательных микроорганизмов (клебсиелл,
энтеробактеров, эшерихий). Причем изменения микрофлоры
выявляются как при исследовании полостной микрофлоры, так
и пристеночной. Предполагавшаяся многими авторами целесо-
образность применения селективной деконтаминации у пациентов
с высокими ФК ХСН не показала своей эффективности и сопрово-
ждалась большим количеством побочных эффектов.
В результате проведенных исследований была отмечена эффектив-
ность и безопасность применения пробиотиков после недельного
курса селективной деконтаминации препаратами группы фторхи-
нолонов. Данная схема позволяет нормализовать микробный пей-
заж толстой кишки, снизить уровень эндотоксина грамотрицатель-
ных бактерий в крови, уровень провоспалительных цитокинов,
а также уменьшить сроки госпитализации пациентов с III–IV ФК
ХСН. Таким образом, для пациентов с высокими ФК ХСН можно
рекомендовать провести оценку микрофлоры кишечника и в слу-
чае выявления изменений – применять селективную деконтамина-
цию (фторхинолоны) с последующим назначением пробиотиков.
Приложение 3.
Методика проведения физических нагрузок в форме ходьбы
I этап. Вхождение.
• Продолжительность этапа – 6–10 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 25 мин / 1 км
• Расстояние – 1 км
• При стабильной клинической картине возможен переход
ко второму этапу
II этап.
• Продолжительность этапа 12 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 20 мин / 1 км
• Расстояние – 2 км
• При стабильном клиническом состоянии – переход на постоян-
ную форму занятий
• Для пациентов, прошедших 500 и более метров за 6 мин, по-
казаны динамические физические нагрузки (например, ходьба
с прогрессивным повышением нагрузки до скорости 6 км / ч
и продолжительностью до 40 минут в день). Титрация нагрузки –
до 6–8 месяцев
• В связи с невозможностью оценивать в каждом конкретном
случае максимальное потребление кислорода расчет нагрузок дан
в конкретных цифрах – расстояние, нагрузка, продолжительность
Приложение 4.
Методика проведения тренировок дыхательных мышц
Пациент занимает удобное положение сидя, помещает зажим
на нос. После обычных вдоха и выдоха пациент делает медленный
вдох, в течение 4–5 с, через загубник тренажера Threshold IMT.
После этого, не выдыхая воздух, пациент делает медленный выдох,
в течение 5–6 с, в тренажер Threshold PEP, после чего следует пауза
3 с. Затем вдох и выдох с использованием тренажеров повторяются
еще 3 раза. После этого следует обычное спокойное дыхание в тече-
ние 2 мин. Таким образом осуществляется профилактика гипервен-
тиляции. В дальнейшем весь цикл, состоящий из 4 вдохов, 4 выдохов
и 2 мин отдыха, повторяется еще 3 раза. Таким образом, продолжи-
тельность одной тренировки составляет около 20 мин. Необходимо
проводить 2 тренировки в день утром и вечером не менее 5 раз
в неделю. Увеличение сопротивления происходит на 2 мм водного
столба каждую 3–5-ю тренировку с учетом состояния пациента.
СПИСОК Л ИТЕРАТУРЫ
















 Уровни доказанности (достоверности данных)
А Факты получены, по меньшей мере, из двух рандомизированных исследовании
B Факты получены из одного рандомизированного исследования или мета-анализа нерандомизированных исследовании
C Совместная точка зрения специалистов
2. Эпидемиология СН в Российской Федерации
По данным эпидемиологических исследований последних10 лет, проведенных в нашей стране в рамках иссле-дований ЭПОХА–ХСН (8 регионов РФ, 19 500 респон-дентов) и ЭПОХА–О–ХСН (одномоментное госпи-тальное исследование в 22 регионах РФ), стало известно,что [11–13]:
A) В РФ распространенность в популяции ХСН I–IV ФКсоставила 7 % случаев (7,9 млн. человек). Клинически выраженная ХСН (II–IV ФК) имеет место у 4,5 %населения (5,1 млн. человек). Распространенностьтерминальной ХСН (III–IV ФК) достигает 2,1 % слу-чаев (2,4 млн. человек);
B) Распространенность ХСН с возрастом значительно увеличивается: в возрастной группе от 20 до 29 лет составляет только 0,3 % случаев, а в возрастной группе старше 90 лет ХСН имеют почти 70 % респондентов. Среди мужчин распространенность ХСН выше, чем среди женщин в возрастных группах до 60 лет,что ассоциируется с более ранней заболеваемостьюАГ и ИБС у мужчин [14]. За счет большей продол-жительности жизни число женщин, имеющих ХСН,в 2,6 раза превосходит число мужчин (72 % против28 %). Более 65 % больных ХСН находятся в возраст-ной группе от 60 до 80 лет, старше 80 лет число боль-ных ХСН резко снижается за счет фактора дожития,и достоверных гендерных различий в этой возраст-ной группе не обнаружено [11, 13, 14];
C) В результате 10-летнего наблюдения за популяциейобнаружено, что распространенность ХСН в популя-ции растет в среднем на 1,2 человека на 1000 населе-ния в год за счет более высокой заболеваемости ХСНмужчин в возрастной группе от 40 до 59 лет и жен-щин в возрастной группе от 70 до 89 лет. Во многомэто связано с неадекватной терапией АГ и ИБС.Можно предполагать, что продолжительность жизнибольных ХСН несколько возрастает за счет увеличе-ния числа пациентов, которые принимают основныелекарственные средства для лечения ХСН. На попу-ляционном уровне появление более тяжелого ФКХСН ассоциировано с увеличением возраста на каж-дые 10 лет;
D) В исследовании Euro Heart Survey, проводившемсяв 14 странах Европы, включая РФ, впервые особое вни-мание было уделено появлению большого числа паци-ентов с ХСН и нормальной (ФВ >50 %) систоличе-ской функцией сердца [15]. По данным исследованияЭПОХА–О–ХСН, в РФ 56,8 % пациентов с очевиднойХСН имеют практическинормальную сократимостьмиокарда (ФВ ЛЖ >50 %) [16]. Исследования, проводившиеся в США, продемонстрировали постоянное увеличение числа таких больных, что позволило опре-делить проблему ХСН с сохранной систолической функцией сердца (ХСН–ССФ), как одну из неинфекционных эпидемий XXI века [17]. К этой категориибольных ХСН в основном относятся женщины болеестаршего возраста с плохо леченными АГ и / или СД.При этом среди женщин встречаемость ХСН–ССФдостигает 68 % [16, 18];
E) Годовая смертность от ХСН достоверно выше,чем в популяции (отношение шансов 10,3). Средипациентов с ХСН I–IV ФК средняя годовая смертностьсоставляет 6 % [19]. При этом однолетняя смертностьбольных с клинически выраженной ХСН достигает12 % (даже в условиях лечения в специализированномстационаре), то есть за один год в РФ умираютдо 612 тыс. больных ХСН [18]. Был получен временной показатель достоверного ухудшения прогноза жизни больных ХСН по сравнению с выборкой респондентов без ССЗ, который составил всего 90 дней [19];
F) Декомпенсация ХСН является причиной госпитализа-ций в стационары, имеющие кардиологические отде-ления, почти каждого второго больного (49 %), а ХСНфигурировала в диагнозе у 92 % госпитализирован-ных в такие стационары [15]. В РФ среди всех боль-ных, госпитализированных в стационары с ССЗ, ХСН(по Фрамингемским критериям) явилась основнойпричиной госпитализации у 16,8 % пациентов [12, 16];
G) Основными причинами развития ХСН в РФ явля-ются АГ (88 % случаев) и ИБС (59 % случаев) [20].При высокой распространенности среди пациентовс ХСН стабильной стенокардии отмечается наличиенизкой распространенности перенесенного острогоИМ (ОИМ) среди них (13,3 % случаев), что говорито низкой эффективности лечения данного осложне-ния ИБС. Комбинация ИБС и АГ встречается у поло-вины больных ХСН [20, 21];
H) В РФ можно отметить еще три важных причины раз-вития ХСН: хроническую обструктивную болезньлегких (ХОБЛ) – 13 % случаев, СД – 11,9 % случаеви перенесенное острое нарушение мозгового крово-обращения (ОНМК) – 10,3 % случаев. Наличие боль-шого количества ФР становится базисом для форми-рования СН в возрастных группах до 60 лет с досто-верно более плохим прогнозом жизни больныхв последующие десятилетия [21, 22]. Для больныхХСН наличие ОИМ или СД определяет значитель-но более плохой прогноз жизни, кроме того, тяжесть ХСН обусловлена сочетанием множества этиологи-ческих факторов;
I) Классические причины ХСН в XXI веке встреча-ются реже. Наличие пороков сердца, как причи-ны декомпенсации, отмечено только у 4,3 % боль-ных, миокардитов у 3,6 % пациентов, а ДКМП всеголишь в 0,8 % случаев ХСН. Даже при ХСН III–IV ФКДКМП, как причина заболевания, регистрироваласьв 5 % (Российская выборка исследования EuroHeartSurvey) – 5,4 % (исследование ЭПОХА–ХСН) случа-ев [15, 21]. Это может быть связано с низкой эффек-тивностью лечения и высоким риском смертельногоисхода при формировании ХСН на фоне ДКМП;
J) В популяции больных ХСН были обнаружены ген-дерные различия в причинах возникновения деком-пенсации. Для мужчин наличие ИБС, перенесенногоОИМ, перенесенного ОНМК в качестве причин раз-вития ХСН более приоритетно. Наоборот, наличиеАГ, СД, пороков сердца и перенесенного миокардитавыявлено чаще среди женщин [21–23];
K) Хроническая (постоянная) форма фибрилляции предсердий утяжеляет течение ХСН в 10,3 % случаев среди общей выборки больных ХСН [21]. С увеличением тяжести ХСН встречаемость фибрилляции предсердий (ФП) неуклонно возрастает, достигая 45 % у пациентов с III–IV ФК [18].
3. Терминология, используемаяпри описании СН
Различают острую и хроническую СН. Под острой СН принято подразумевать возникновение острой (кардиогенной) одышки, связанной с быстрым развитием легочного застоя вплоть до отека легких или кардиогенного шока (с гипотонией, олигурией и т. д.), которые,как правило, являются следствием острого повреждения миокарда, прежде всего ОИМ.
Чаще встречается хроническая форма СН, для которой характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН. Данные Рекомендации посвя-щены в основном диагностике и лечению ХСН, определе-ние которой приведено ниже.
Помимо острой и хронической, различают также систолическую и диастолическую СН. Традиционно СН и ее тяжесть ассоциируют со снижением сократительной способности сердца (систолическая СН), которую чаще оценивают по величине ФВ ЛЖ. Однако значительная частьбольных СН имеет нормальную или почти нормальнуюФВ ЛЖ (>45–50 %) [24]. В таких случаях целесообразноговорить о СН с сохраненной систолической функцией(СН–ССФ) или, что более правильно – о СН с сохраненнойФВ ЛЖ (СН–СФВ ЛЖ). Частота встречаемости больныхc СН–СФВ ЛЖ зависит от тяжести обследуемой популя-ции и критериев оценки ФВ ЛЖ. Так, среди тяжелых деком-пенсированных стационарных больных СН доля СН–СФВЛЖ, как правило, не превышает 20 % [25, 26]. Среди всехбольных с диагнозом СН в стационарной и поликлиниче-ской практике доля СН–СФВ ЛЖ может достигать 30–50 %[24, 27]. В обсервационных популяционных исследова-ниях, например, в российском исследовании ЭПОХА–О–ХСН [16], среди всех больных СН, верифицированнойпо Фрамингемским критериям, уже 56,8 % пациентов имелиФВ ЛЖ >50 %, а 85,6 % – ФВ ЛЖ >40 %. Близкие к этим дан-ные (84,1 %) были получены в другом российском популяци-онном исследовании – IMPROVEMENT, в котором приня-ли участие 100 терапевтов из 10 городов РФ [28].
Патофизиология СН–СФВ ЛЖ, вероятно, гетерогенна. Более чем в 90 % случаев, особенно в старших возраст-ных группах, где высока доля пациентов с повышеннойжесткостью миокарда, с АГ и гипертрофией ЛЖ, СД,СН–СФВ ЛЖ может быть обусловлена собственно диастолической дисфункцией [29], но у отдельных пациен-тов также может быть связана с повышенной жесткостьюартериального сосудистого русла. Наличие у больного СН–СФВ ЛЖ подтвержденных объективными метода мидиастолических расстройств позволяет говорить о нем,как о больном с диастолической СН (ДСН).
Небходимо учитывать, что если диастолическая СН бывает изолированной, то систолическая СН, как правило, протекает не только с систолическими, но и с диастолическими расстройствами [30], то есть чаще носитсмешанный характер. Среди других терминов встречаются деление ХСНна право- и левожелудочковую в зависимости от преоб-ладания застойных явлений в малом или большом кругекровообращения; ХСН с низким или высоким сердечнымвыбросом (СВ). Следует помнить, что высокий СВ встре-чается при ряде заболеваний (тиреотоксикоз, анемияи др.), не имеющих прямого отношения к повреждениюмиокарда.
В отечественной практике часто используются тер-мины «застойная СН – ЗСН» и «хроническая недостаточность кровообращения – ХНК», которые неред-ко «конкурируют» с термином ХСН, что и продолжаетоставаться предметом дискуссий. По сути, ЗСН является синонимом клинически выраженной ХСН с отчетливой симптоматикой застоя жидкости. Термин ХНК, предложенный А. Л. Мясниковым и получивший распространение только в нашей стране, также можно рассматривать,как синоним ХСН, поскольку оба термина фактически призваны обозначить одно и то же заболевание. В этойсвязи (исключительно для унификации терминологии) рекомендуется не применять иной термин, кромекак ХСН, при формулировании диагноза и в других доку-ментах, используемых для отчетности, статистики и т. д.
4. Определение СН
Сердечная недостаточность может быть определена, как такое нарушение структуры или функции сердца,в результате которого сердце не в состоянии удовлетворить потребности организма в кислороде при нормальном давлении наполнения сердца, и это возможно лишь ценой повышения давления наполнения сердца[31]. С практической точки зрения СН – это синдром,для которого характерны определенные симптомы(одышка, отеки лодыжек, утомляемость) и клинические признаки (набухание шейных вен, мелкопузырчатые хрипы в легких, смещение верхушечного толчка влево),возникшие в результате нарушения структуры или функции сердца. Диагностика СН связана с определенными сложностями. Так, многие симптомы СН неспецифичны, и поэтому их диагностическое значение невелико[32–36]. Поскольку многие клинические признаки СН обусловлены задержкой жидкости в организме и быстро исчезают при назначении диуретиков, они могут отсутствовать у больных, получающих эти препараты. В диагностике СН центральное место занимает определение ее причины. Обычно к СН приводит то или иное заболевание миокарда, сопровождающееся систолической дисфункцией. Сердечная недостаточность также может возникать из-за диастолической дисфункции, патологии клапанов, перикарда, эндокарда, нарушений ритма сердца и проводимости; при этом у одного больного могут быть сразу несколько причин (таблица 2). Определение причины СН важно для правильного лечения, особенно если эта причина устранима (например, операция на клапанах при пороках сердца).
Таблица 2. Причины СН (данная классификация не является всеохватывающей;кроме того, многие причины в значительной мере пересекаются друг с другом)
Уровни доказанности (достоверности данных)
А Факты получены, по меньшей мере, из двух рандомизированных исследовании
B Факты получены из одного рандомизированного исследования или мета-анализа нерандомизированных исследовании
C Совместная точка зрения специалистов
2. Эпидемиология СН в Российской Федерации
По данным эпидемиологических исследований последних10 лет, проведенных в нашей стране в рамках иссле-дований ЭПОХА–ХСН (8 регионов РФ, 19 500 респон-дентов) и ЭПОХА–О–ХСН (одномоментное госпи-тальное исследование в 22 регионах РФ), стало известно,что [11–13]:
A) В РФ распространенность в популяции ХСН I–IV ФКсоставила 7 % случаев (7,9 млн. человек). Клинически выраженная ХСН (II–IV ФК) имеет место у 4,5 %населения (5,1 млн. человек). Распространенностьтерминальной ХСН (III–IV ФК) достигает 2,1 % слу-чаев (2,4 млн. человек);
B) Распространенность ХСН с возрастом значительно увеличивается: в возрастной группе от 20 до 29 лет составляет только 0,3 % случаев, а в возрастной группе старше 90 лет ХСН имеют почти 70 % респондентов. Среди мужчин распространенность ХСН выше, чем среди женщин в возрастных группах до 60 лет,что ассоциируется с более ранней заболеваемостьюАГ и ИБС у мужчин [14]. За счет большей продол-жительности жизни число женщин, имеющих ХСН,в 2,6 раза превосходит число мужчин (72 % против28 %). Более 65 % больных ХСН находятся в возраст-ной группе от 60 до 80 лет, старше 80 лет число боль-ных ХСН резко снижается за счет фактора дожития,и достоверных гендерных различий в этой возраст-ной группе не обнаружено [11, 13, 14];
C) В результате 10-летнего наблюдения за популяциейобнаружено, что распространенность ХСН в популя-ции растет в среднем на 1,2 человека на 1000 населе-ния в год за счет более высокой заболеваемости ХСНмужчин в возрастной группе от 40 до 59 лет и жен-щин в возрастной группе от 70 до 89 лет. Во многомэто связано с неадекватной терапией АГ и ИБС.Можно предполагать, что продолжительность жизнибольных ХСН несколько возрастает за счет увеличе-ния числа пациентов, которые принимают основныелекарственные средства для лечения ХСН. На попу-ляционном уровне появление более тяжелого ФКХСН ассоциировано с увеличением возраста на каж-дые 10 лет;
D) В исследовании Euro Heart Survey, проводившемсяв 14 странах Европы, включая РФ, впервые особое вни-мание было уделено появлению большого числа паци-ентов с ХСН и нормальной (ФВ >50 %) систоличе-ской функцией сердца [15]. По данным исследованияЭПОХА–О–ХСН, в РФ 56,8 % пациентов с очевиднойХСН имеют практическинормальную сократимостьмиокарда (ФВ ЛЖ >50 %) [16]. Исследования, проводившиеся в США, продемонстрировали постоянное увеличение числа таких больных, что позволило опре-делить проблему ХСН с сохранной систолической функцией сердца (ХСН–ССФ), как одну из неинфекционных эпидемий XXI века [17]. К этой категориибольных ХСН в основном относятся женщины болеестаршего возраста с плохо леченными АГ и / или СД.При этом среди женщин встречаемость ХСН–ССФдостигает 68 % [16, 18];
E) Годовая смертность от ХСН достоверно выше,чем в популяции (отношение шансов 10,3). Средипациентов с ХСН I–IV ФК средняя годовая смертностьсоставляет 6 % [19]. При этом однолетняя смертностьбольных с клинически выраженной ХСН достигает12 % (даже в условиях лечения в специализированномстационаре), то есть за один год в РФ умираютдо 612 тыс. больных ХСН [18]. Был получен временной показатель достоверного ухудшения прогноза жизни больных ХСН по сравнению с выборкой респондентов без ССЗ, который составил всего 90 дней [19];
F) Декомпенсация ХСН является причиной госпитализа-ций в стационары, имеющие кардиологические отде-ления, почти каждого второго больного (49 %), а ХСНфигурировала в диагнозе у 92 % госпитализирован-ных в такие стационары [15]. В РФ среди всех боль-ных, госпитализированных в стационары с ССЗ, ХСН(по Фрамингемским критериям) явилась основнойпричиной госпитализации у 16,8 % пациентов [12, 16];
G) Основными причинами развития ХСН в РФ явля-ются АГ (88 % случаев) и ИБС (59 % случаев) [20].При высокой распространенности среди пациентовс ХСН стабильной стенокардии отмечается наличиенизкой распространенности перенесенного острогоИМ (ОИМ) среди них (13,3 % случаев), что говорито низкой эффективности лечения данного осложне-ния ИБС. Комбинация ИБС и АГ встречается у поло-вины больных ХСН [20, 21];
H) В РФ можно отметить еще три важных причины раз-вития ХСН: хроническую обструктивную болезньлегких (ХОБЛ) – 13 % случаев, СД – 11,9 % случаеви перенесенное острое нарушение мозгового крово-обращения (ОНМК) – 10,3 % случаев. Наличие боль-шого количества ФР становится базисом для форми-рования СН в возрастных группах до 60 лет с досто-верно более плохим прогнозом жизни больныхв последующие десятилетия [21, 22]. Для больныхХСН наличие ОИМ или СД определяет значитель-но более плохой прогноз жизни, кроме того, тяжесть ХСН обусловлена сочетанием множества этиологи-ческих факторов;
I) Классические причины ХСН в XXI веке встреча-ются реже. Наличие пороков сердца, как причи-ны декомпенсации, отмечено только у 4,3 % боль-ных, миокардитов у 3,6 % пациентов, а ДКМП всеголишь в 0,8 % случаев ХСН. Даже при ХСН III–IV ФКДКМП, как причина заболевания, регистрироваласьв 5 % (Российская выборка исследования EuroHeartSurvey) – 5,4 % (исследование ЭПОХА–ХСН) случа-ев [15, 21]. Это может быть связано с низкой эффек-тивностью лечения и высоким риском смертельногоисхода при формировании ХСН на фоне ДКМП;
J) В популяции больных ХСН были обнаружены ген-дерные различия в причинах возникновения деком-пенсации. Для мужчин наличие ИБС, перенесенногоОИМ, перенесенного ОНМК в качестве причин раз-вития ХСН более приоритетно. Наоборот, наличиеАГ, СД, пороков сердца и перенесенного миокардитавыявлено чаще среди женщин [21–23];
K) Хроническая (постоянная) форма фибрилляции предсердий утяжеляет течение ХСН в 10,3 % случаев среди общей выборки больных ХСН [21]. С увеличением тяжести ХСН встречаемость фибрилляции предсердий (ФП) неуклонно возрастает, достигая 45 % у пациентов с III–IV ФК [18].
3. Терминология, используемаяпри описании СН
Различают острую и хроническую СН. Под острой СН принято подразумевать возникновение острой (кардиогенной) одышки, связанной с быстрым развитием легочного застоя вплоть до отека легких или кардиогенного шока (с гипотонией, олигурией и т. д.), которые,как правило, являются следствием острого повреждения миокарда, прежде всего ОИМ.
Чаще встречается хроническая форма СН, для которой характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН. Данные Рекомендации посвя-щены в основном диагностике и лечению ХСН, определе-ние которой приведено ниже.
Помимо острой и хронической, различают также систолическую и диастолическую СН. Традиционно СН и ее тяжесть ассоциируют со снижением сократительной способности сердца (систолическая СН), которую чаще оценивают по величине ФВ ЛЖ. Однако значительная частьбольных СН имеет нормальную или почти нормальнуюФВ ЛЖ (>45–50 %) [24]. В таких случаях целесообразноговорить о СН с сохраненной систолической функцией(СН–ССФ) или, что более правильно – о СН с сохраненнойФВ ЛЖ (СН–СФВ ЛЖ). Частота встречаемости больныхc СН–СФВ ЛЖ зависит от тяжести обследуемой популя-ции и критериев оценки ФВ ЛЖ. Так, среди тяжелых деком-пенсированных стационарных больных СН доля СН–СФВЛЖ, как правило, не превышает 20 % [25, 26]. Среди всехбольных с диагнозом СН в стационарной и поликлиниче-ской практике доля СН–СФВ ЛЖ может достигать 30–50 %[24, 27]. В обсервационных популяционных исследова-ниях, например, в российском исследовании ЭПОХА–О–ХСН [16], среди всех больных СН, верифицированнойпо Фрамингемским критериям, уже 56,8 % пациентов имелиФВ ЛЖ >50 %, а 85,6 % – ФВ ЛЖ >40 %. Близкие к этим дан-ные (84,1 %) были получены в другом российском популяци-онном исследовании – IMPROVEMENT, в котором приня-ли участие 100 терапевтов из 10 городов РФ [28].
Патофизиология СН–СФВ ЛЖ, вероятно, гетерогенна. Более чем в 90 % случаев, особенно в старших возраст-ных группах, где высока доля пациентов с повышеннойжесткостью миокарда, с АГ и гипертрофией ЛЖ, СД,СН–СФВ ЛЖ может быть обусловлена собственно диастолической дисфункцией [29], но у отдельных пациен-тов также может быть связана с повышенной жесткостьюартериального сосудистого русла. Наличие у больного СН–СФВ ЛЖ подтвержденных объективными метода мидиастолических расстройств позволяет говорить о нем,как о больном с диастолической СН (ДСН).
Небходимо учитывать, что если диастолическая СН бывает изолированной, то систолическая СН, как правило, протекает не только с систолическими, но и с диастолическими расстройствами [30], то есть чаще носитсмешанный характер. Среди других терминов встречаются деление ХСНна право- и левожелудочковую в зависимости от преоб-ладания застойных явлений в малом или большом кругекровообращения; ХСН с низким или высоким сердечнымвыбросом (СВ). Следует помнить, что высокий СВ встре-чается при ряде заболеваний (тиреотоксикоз, анемияи др.), не имеющих прямого отношения к повреждениюмиокарда.
В отечественной практике часто используются тер-мины «застойная СН – ЗСН» и «хроническая недостаточность кровообращения – ХНК», которые неред-ко «конкурируют» с термином ХСН, что и продолжаетоставаться предметом дискуссий. По сути, ЗСН является синонимом клинически выраженной ХСН с отчетливой симптоматикой застоя жидкости. Термин ХНК, предложенный А. Л. Мясниковым и получивший распространение только в нашей стране, также можно рассматривать,как синоним ХСН, поскольку оба термина фактически призваны обозначить одно и то же заболевание. В этойсвязи (исключительно для унификации терминологии) рекомендуется не применять иной термин, кромекак ХСН, при формулировании диагноза и в других доку-ментах, используемых для отчетности, статистики и т. д.
4. Определение СН
Сердечная недостаточность может быть определена, как такое нарушение структуры или функции сердца,в результате которого сердце не в состоянии удовлетворить потребности организма в кислороде при нормальном давлении наполнения сердца, и это возможно лишь ценой повышения давления наполнения сердца[31]. С практической точки зрения СН – это синдром,для которого характерны определенные симптомы(одышка, отеки лодыжек, утомляемость) и клинические признаки (набухание шейных вен, мелкопузырчатые хрипы в легких, смещение верхушечного толчка влево),возникшие в результате нарушения структуры или функции сердца. Диагностика СН связана с определенными сложностями. Так, многие симптомы СН неспецифичны, и поэтому их диагностическое значение невелико[32–36]. Поскольку многие клинические признаки СН обусловлены задержкой жидкости в организме и быстро исчезают при назначении диуретиков, они могут отсутствовать у больных, получающих эти препараты. В диагностике СН центральное место занимает определение ее причины. Обычно к СН приводит то или иное заболевание миокарда, сопровождающееся систолической дисфункцией. Сердечная недостаточность также может возникать из-за диастолической дисфункции, патологии клапанов, перикарда, эндокарда, нарушений ритма сердца и проводимости; при этом у одного больного могут быть сразу несколько причин (таблица 2). Определение причины СН важно для правильного лечения, особенно если эта причина устранима (например, операция на клапанах при пороках сердца).
Таблица 2. Причины СН (данная классификация не является всеохватывающей;кроме того, многие причины в значительной мере пересекаются друг с другом)
 5. Классификация СН
Классификация СН по ФВ ЛЖ
Традиционно СН классифицируют в зависимостиот ФВ ЛЖ. Фракция выброса – основной показательсистолической функции ЛЖ. Он показывает, какая доля объема ЛЖ выбрасывается в аорту с каждым сокраще-нием сердца. Для ее вычисления ударный объем (т. е. раз-ницу между конечно-диастолическим и конечно-систоли-ческим объемами) следует разделить на конечно-диасто-лический объем. У больных с низкой сократимостью (т. е.с систолической дисфункцией) поддержание дóлжногоударного объема во многом обеспечивается за счет рас-ширения ЛЖ; иными словами, сердце выбрасывает в аор-ту меньшую долю (фракцию) от своего увеличенного объ-ема. Чем тяжелее систолическая дисфункция, тем нижеФВ и, как правило, шире ЛЖ.
Фракция выброса является одним из ключевых показателей гемодинамики при СН и имеет большое прогно-стическое значение: чем меньше ФВ, тем хуже прогноз.Традиционно в исследованиях с СН принимали участиебольные исключительно с низкой ФВ (обычно опреде-ляемой как <35 %), то есть имевшие систолическую СН;и на сегодняшний день лишь для этих больных разработа-ны виды лечения, способные улучшать прогноз.
За последнее время в нескольких крупных клинических исследованиях наблюдались больные СН с нормальной ФВ (обычно определяемой как >50 %) и не имевшие иной патологии со стороны сердца, например, клапанных нарушений или заболеваний перикарда. Для описанияСН у этих больных был предложен термин «СН с сохран-ной ФВ (СН–СФВ)». Больные с промежуточными зна-чениями ФВ (от 35 до 50 %) относятся к так называемой«серой зоне», и, по всей видимости, их следует рассма-тривать, как имеющих незначительную систолическуюдисфункцию. Диагностировать СН–СФВ значительнотруднее, чем систолическую СН, поскольку в этом случаенеобходимо последовательно исключить все возможныевнесердечные заболевания, которые могли бы объяснить имеющиеся у больного симптомы (например, анемиюили хронические болезни легких; таблица 3) [37, 38].Обычно у больных СН–СФВ отсутствует расширениеЛЖ, однако часто отмечается увеличение толщины сте-нок ЛЖ и расширение левого предсердия. У большинствабольных СН–СФВ можно выявить диастолическую дис-функцию ЛЖ, которая считается наиболее вероятнойпричиной развития СН у этих больных (отсюда и второйтермин, используемый для их описания – «диастоличе-ская СН») [37, 38].
Вычисление ФВ во многом зависит от выбора визуализирующего метода и способа ее расчета, а также от навыков оператора. Установлено, что современные и болеечувствительные способы оценки систолической функцииЛЖ позволяют обнаружить нарушение сократимостидаже у тех больных, у которых ФВ сохранена. Поэтомупри описании больных СН лучше воспользоваться тер-минами «сохранная / сниженная ФВ», нежели «сохран-ная / сниженная систолическая функция» [39, 40].
5. Классификация СН
Классификация СН по ФВ ЛЖ
Традиционно СН классифицируют в зависимостиот ФВ ЛЖ. Фракция выброса – основной показательсистолической функции ЛЖ. Он показывает, какая доля объема ЛЖ выбрасывается в аорту с каждым сокраще-нием сердца. Для ее вычисления ударный объем (т. е. раз-ницу между конечно-диастолическим и конечно-систоли-ческим объемами) следует разделить на конечно-диасто-лический объем. У больных с низкой сократимостью (т. е.с систолической дисфункцией) поддержание дóлжногоударного объема во многом обеспечивается за счет рас-ширения ЛЖ; иными словами, сердце выбрасывает в аор-ту меньшую долю (фракцию) от своего увеличенного объ-ема. Чем тяжелее систолическая дисфункция, тем нижеФВ и, как правило, шире ЛЖ.
Фракция выброса является одним из ключевых показателей гемодинамики при СН и имеет большое прогно-стическое значение: чем меньше ФВ, тем хуже прогноз.Традиционно в исследованиях с СН принимали участиебольные исключительно с низкой ФВ (обычно опреде-ляемой как <35 %), то есть имевшие систолическую СН;и на сегодняшний день лишь для этих больных разработа-ны виды лечения, способные улучшать прогноз.
За последнее время в нескольких крупных клинических исследованиях наблюдались больные СН с нормальной ФВ (обычно определяемой как >50 %) и не имевшие иной патологии со стороны сердца, например, клапанных нарушений или заболеваний перикарда. Для описанияСН у этих больных был предложен термин «СН с сохран-ной ФВ (СН–СФВ)». Больные с промежуточными зна-чениями ФВ (от 35 до 50 %) относятся к так называемой«серой зоне», и, по всей видимости, их следует рассма-тривать, как имеющих незначительную систолическуюдисфункцию. Диагностировать СН–СФВ значительнотруднее, чем систолическую СН, поскольку в этом случаенеобходимо последовательно исключить все возможныевнесердечные заболевания, которые могли бы объяснить имеющиеся у больного симптомы (например, анемиюили хронические болезни легких; таблица 3) [37, 38].Обычно у больных СН–СФВ отсутствует расширениеЛЖ, однако часто отмечается увеличение толщины сте-нок ЛЖ и расширение левого предсердия. У большинствабольных СН–СФВ можно выявить диастолическую дис-функцию ЛЖ, которая считается наиболее вероятнойпричиной развития СН у этих больных (отсюда и второйтермин, используемый для их описания – «диастоличе-ская СН») [37, 38].
Вычисление ФВ во многом зависит от выбора визуализирующего метода и способа ее расчета, а также от навыков оператора. Установлено, что современные и болеечувствительные способы оценки систолической функцииЛЖ позволяют обнаружить нарушение сократимостидаже у тех больных, у которых ФВ сохранена. Поэтомупри описании больных СН лучше воспользоваться тер-минами «сохранная / сниженная ФВ», нежели «сохран-ная / сниженная систолическая функция» [39, 40].
 Классификация СН по длительности течения
Важно помнить о том, что после соответствующего лечения больной СН может не иметь никаких симптомов.В тех случаях, когда нарушение работы сердца не сопро-вождается клиническими проявлениями, говорят о бес-симптомной СН или бессимптомной дисфункции ЛЖ(независимо от причины СН). Если СН прослеживаетсяна протяжении определенного времени, то ее обознача-ют как хроническую. Больной СН, у которого на фонесоответствующего лечения отсутствует ухудшение забо-левания на протяжении, по меньшей мере, одного месяца,считается стабильным. При усугублении ХСН говорято декомпенсации. Это усугубление может произойтивнезапно (острая СН), характеризуется существеннымувеличением риска смерти и обычно приводит к госпи-тализации. Впервые возникшая СН может дебютироватьостро (например, в момент ИМ) или, наоборот, нарас-тать постепенно, переходя от бессимптомной дисфунк-ции сердца к клинически выраженной СН. В ходе лече-ния клинические проявления СН могут уменьшитьсяили вообще исчезнуть (в таких случаях говорят о дости-жении компенсации), однако дисфункция сердца частоостается без изменений, и такие больные имеют высокийриск повторной декомпенсации. Иногда причина СНможет быть полностью устранима (например, при остромвирусном миокардите). В ряде других случаев, например,при идиопатической дилатационной кардиомиопатиис помощью современной терапии (иАПФ / блокатора-ми ангиотензиновых рецепторов, β-адреноблокаторами,антагонистами альдостерона) можно достичь существен-ного улучшения или даже полного восстановления систо-лической функции ЛЖ. До сих пор в литературе частовстречается термин «застойная СН», который отно-сится к больным острой или хронической СН, у которыхотмечаются застойные явления, связанные с задержкойжидкости. В отличие от других симптомов СН застойныеявления могут быть полностью устранены с помощьюдиуретиков. Важно понимать, что многие из представ-ленных определений СН могут быть применены у одногои того же больного в зависимости от стадии заболевания.
Классификация СН по выраженности симптомов
Для описания выраженности симптомов СН традиционно используют ФК Нью-Йоркской кардиологической ассоциации (таблица 4). Именно на основании этойклассификации отбирались больные для участия в боль-шинстве рандомизированных испытаний с СН. Больныес I ФК не имеют каких‑либо симптомов, связанных с забо-леванием сердца; больные со II, III или IV ФК имеютсоответственно незначительные, умеренные и выражен-ные симптомы СН.5.3.0.0.0.2Важно отметить, что выраженность симптомов сла-бо ассоциируется с систолической функцией ЛЖ, и хотяи существует четкая связь между тяжестью симптомови выживаемостью больных СН, больные с минималь-ными симптомами могут иметь относительно высокийабсолютный риск госпитализации и смерти [41–43].Симптомы также могут претерпевать быстрое измене-ние. Так, у больного с минимально выраженными сим-птомами может внезапно развиться одышка в покое из-завозникновения аритмии; состояние же декомпенсиро-ванного больного с отеком легких может быстро улучшиться при назначении диуретиков. Прогрессирование симптомов свидетельствует о высоком риске госпита-лизации и смерти и поэтому должно являться сигналомдля внесения корректив в лечение. Уменьшение выражен-ности симптомов (в идеале до их полного исчезновения)является одной из двух основных целей лечения СН (дру-гой основной целью является снижение заболеваемостии смертности).5.3.0.0.0.3При ОКС может быть использована классификацияКиллипа [44].
Таблица 4. Классификация сердечной недостаточностиНью-Йоркской кардиологической ассоциации (NYHA)
Классификация СН по длительности течения
Важно помнить о том, что после соответствующего лечения больной СН может не иметь никаких симптомов.В тех случаях, когда нарушение работы сердца не сопро-вождается клиническими проявлениями, говорят о бес-симптомной СН или бессимптомной дисфункции ЛЖ(независимо от причины СН). Если СН прослеживаетсяна протяжении определенного времени, то ее обознача-ют как хроническую. Больной СН, у которого на фонесоответствующего лечения отсутствует ухудшение забо-левания на протяжении, по меньшей мере, одного месяца,считается стабильным. При усугублении ХСН говорято декомпенсации. Это усугубление может произойтивнезапно (острая СН), характеризуется существеннымувеличением риска смерти и обычно приводит к госпи-тализации. Впервые возникшая СН может дебютироватьостро (например, в момент ИМ) или, наоборот, нарас-тать постепенно, переходя от бессимптомной дисфунк-ции сердца к клинически выраженной СН. В ходе лече-ния клинические проявления СН могут уменьшитьсяили вообще исчезнуть (в таких случаях говорят о дости-жении компенсации), однако дисфункция сердца частоостается без изменений, и такие больные имеют высокийриск повторной декомпенсации. Иногда причина СНможет быть полностью устранима (например, при остромвирусном миокардите). В ряде других случаев, например,при идиопатической дилатационной кардиомиопатиис помощью современной терапии (иАПФ / блокатора-ми ангиотензиновых рецепторов, β-адреноблокаторами,антагонистами альдостерона) можно достичь существен-ного улучшения или даже полного восстановления систо-лической функции ЛЖ. До сих пор в литературе частовстречается термин «застойная СН», который отно-сится к больным острой или хронической СН, у которыхотмечаются застойные явления, связанные с задержкойжидкости. В отличие от других симптомов СН застойныеявления могут быть полностью устранены с помощьюдиуретиков. Важно понимать, что многие из представ-ленных определений СН могут быть применены у одногои того же больного в зависимости от стадии заболевания.
Классификация СН по выраженности симптомов
Для описания выраженности симптомов СН традиционно используют ФК Нью-Йоркской кардиологической ассоциации (таблица 4). Именно на основании этойклассификации отбирались больные для участия в боль-шинстве рандомизированных испытаний с СН. Больныес I ФК не имеют каких‑либо симптомов, связанных с забо-леванием сердца; больные со II, III или IV ФК имеютсоответственно незначительные, умеренные и выражен-ные симптомы СН.5.3.0.0.0.2Важно отметить, что выраженность симптомов сла-бо ассоциируется с систолической функцией ЛЖ, и хотяи существует четкая связь между тяжестью симптомови выживаемостью больных СН, больные с минималь-ными симптомами могут иметь относительно высокийабсолютный риск госпитализации и смерти [41–43].Симптомы также могут претерпевать быстрое измене-ние. Так, у больного с минимально выраженными сим-птомами может внезапно развиться одышка в покое из-завозникновения аритмии; состояние же декомпенсиро-ванного больного с отеком легких может быстро улучшиться при назначении диуретиков. Прогрессирование симптомов свидетельствует о высоком риске госпита-лизации и смерти и поэтому должно являться сигналомдля внесения корректив в лечение. Уменьшение выражен-ности симптомов (в идеале до их полного исчезновения)является одной из двух основных целей лечения СН (дру-гой основной целью является снижение заболеваемостии смертности).5.3.0.0.0.3При ОКС может быть использована классификацияКиллипа [44].
Таблица 4. Классификация сердечной недостаточностиНью-Йоркской кардиологической ассоциации (NYHA)
 Отечественная классификация ХСН
Классификация ХСН, предложенная ОССН и утвержденная Российским съездом кардиологовв 2003 году, предусматривает объединение классификации ХСН по стадиям (классификация Стражеско–Василенко)и ФК (по NYHA). Выставление в диагнозе не только ста-дии, но и ФК позволяет разделить тяжесть заболеванияи субъективное самочувствие больного, поскольку ста-дийность болезни (поражения сердца) не связана напря-мую с ФК (переносимостью физической нагрузки).
6. Диагностика СН
Симптомы и клинические признаки
Диагностика СН, особенно на ранних стадиях, может вызывать определенные затруднения. Обычно боль-ной СН обращается за медицинской помощью имен-но из-за возникновения у него симптомов, многиеиз которых имеют низкую специфичность (таблица 5) и не позволяют с уверенностью отличить СН от дру-гих заболеваний. Более же специфичные симптомы(такие как ортопноэ и ночные приступы сердечнойастмы) встречаются гораздо реже, особенно у больныхс начальными стадиями СН, и поэтому имеют низкуючувствительность [32–36].
Таблица 5. Симптомы и признаки, типичные для СН
Отечественная классификация ХСН
Классификация ХСН, предложенная ОССН и утвержденная Российским съездом кардиологовв 2003 году, предусматривает объединение классификации ХСН по стадиям (классификация Стражеско–Василенко)и ФК (по NYHA). Выставление в диагнозе не только ста-дии, но и ФК позволяет разделить тяжесть заболеванияи субъективное самочувствие больного, поскольку ста-дийность болезни (поражения сердца) не связана напря-мую с ФК (переносимостью физической нагрузки).
6. Диагностика СН
Симптомы и клинические признаки
Диагностика СН, особенно на ранних стадиях, может вызывать определенные затруднения. Обычно боль-ной СН обращается за медицинской помощью имен-но из-за возникновения у него симптомов, многиеиз которых имеют низкую специфичность (таблица 5) и не позволяют с уверенностью отличить СН от дру-гих заболеваний. Более же специфичные симптомы(такие как ортопноэ и ночные приступы сердечнойастмы) встречаются гораздо реже, особенно у больныхс начальными стадиями СН, и поэтому имеют низкуючувствительность [32–36].
Таблица 5. Симптомы и признаки, типичные для СН
 Многие клинические признаки СН связаны с задержкой жидкости и посему также не специфичны. Это преждевсего относится к периферическим отекам, которыемогут возникать и из-за внесердечных причин. Крометого, признаки, связанные с задержкой жидкости, доста-точно быстро исчезают при назначении диуретиков, поэ-тому они обычно отсутствуют у больных, получающихдиуретики. Выявление более специфических признаков,таких как набухание шейных вен и смещение верхушечного толчка влево, требует особых навыков, поэтомуих воспроизводимость достаточно низка [32–36].
Симптомы и клинические признаки СН особенно трудно выявлять и, что не менее важно, верно трактовать у пожилых больных, у больных с ожирением, у лиц с заболеваниями легких [45–47].
Большое значение в диагностике СН имеет тщательный сбор анамнеза. Сердечная недостаточностьмаловероятна у лиц без сколько-нибудь значимогоповреждения сердца, в то время как при наличии тако-вого (особенно ранее перенесенного ИМ) вероятностьналичия СН у больного с соответствующими симпто-мами и признаками существенно повышается [32–35].Это подчеркивает важность обнаружения у больногоструктурных или функциональных нарушений, кото-рые могли бы объяснитьимеющиеся симптомы и при-знаки СН и тем самым гарантировали бы ее правиль-ную диагностику.
При оценке эффективности лечения ориентируются главным образом на изменение симптомов и признаков;по ним же судят о стабилизации состояния. Сохранениесимптомов несмотря на предложенное лечение обычносвидетельствует о недостаточности терапии, а нарастаниесимптомов – о прогрессировании СН (то есть о переходебольного в категорию высокого риска экстренной госпи-тализации и смертельного исхода).
Для более точной оценки тяжести клинических про-явлений болезни неоднократно делались попытки создания шкал балльной оценки тяжести СН. С этой целью была предложена российская шкала (ШОКС; таблица 6). Данная шкала выгодно отличается от зарубежныханалогов своей простотой, поскольку основана лишьна сборе анамнеза и клиническом обследовании больного.Использование этой шкалы в динамике позволяет оцени-вать эффективность проводимого лечения ХСН, что былоподтверждено в ходе российских многоцентровых иссле-дований ФАСОН, БЕЗЕ, СНЕГОВИК и др.
Таблица 6. Шкала оценки клинического состояниябольного ХСН (ШОКС) (в модификации Мареева В. Ю.)
Многие клинические признаки СН связаны с задержкой жидкости и посему также не специфичны. Это преждевсего относится к периферическим отекам, которыемогут возникать и из-за внесердечных причин. Крометого, признаки, связанные с задержкой жидкости, доста-точно быстро исчезают при назначении диуретиков, поэ-тому они обычно отсутствуют у больных, получающихдиуретики. Выявление более специфических признаков,таких как набухание шейных вен и смещение верхушечного толчка влево, требует особых навыков, поэтомуих воспроизводимость достаточно низка [32–36].
Симптомы и клинические признаки СН особенно трудно выявлять и, что не менее важно, верно трактовать у пожилых больных, у больных с ожирением, у лиц с заболеваниями легких [45–47].
Большое значение в диагностике СН имеет тщательный сбор анамнеза. Сердечная недостаточностьмаловероятна у лиц без сколько-нибудь значимогоповреждения сердца, в то время как при наличии тако-вого (особенно ранее перенесенного ИМ) вероятностьналичия СН у больного с соответствующими симпто-мами и признаками существенно повышается [32–35].Это подчеркивает важность обнаружения у больногоструктурных или функциональных нарушений, кото-рые могли бы объяснитьимеющиеся симптомы и при-знаки СН и тем самым гарантировали бы ее правиль-ную диагностику.
При оценке эффективности лечения ориентируются главным образом на изменение симптомов и признаков;по ним же судят о стабилизации состояния. Сохранениесимптомов несмотря на предложенное лечение обычносвидетельствует о недостаточности терапии, а нарастаниесимптомов – о прогрессировании СН (то есть о переходебольного в категорию высокого риска экстренной госпи-тализации и смертельного исхода).
Для более точной оценки тяжести клинических про-явлений болезни неоднократно делались попытки создания шкал балльной оценки тяжести СН. С этой целью была предложена российская шкала (ШОКС; таблица 6). Данная шкала выгодно отличается от зарубежныханалогов своей простотой, поскольку основана лишьна сборе анамнеза и клиническом обследовании больного.Использование этой шкалы в динамике позволяет оцени-вать эффективность проводимого лечения ХСН, что былоподтверждено в ходе российских многоцентровых иссле-дований ФАСОН, БЕЗЕ, СНЕГОВИК и др.
Таблица 6. Шкала оценки клинического состояниябольного ХСН (ШОКС) (в модификации Мареева В. Ю.)
 Диагностические исследованияпри СН (таблица 7)
Таблица 7. Рекомендации по диагностическим исследованиям у амбулаторных больных с подозрением на СН1
Диагностические исследованияпри СН (таблица 7)
Таблица 7. Рекомендации по диагностическим исследованиям у амбулаторных больных с подозрением на СН1
 Таблица 8. Часто встречаемые нарушения на ЭКГ при сердечной недостаточности
Таблица 8. Часто встречаемые нарушения на ЭКГ при сердечной недостаточности
 ЭхоКГ и ЭКГ относятся к первоочередным исследованиям у больных с подозрением на СН. Эхокардиографияпозволяет быстро оценить размеры сердца,состояние клапанного аппарата, систолической и диа-столической функции желудочков [37–40, 48–55].Подобная оценка имеет решающее значение при выбо-ре должного лечения (например, назначения иАПФи β-адреноблокаторовпо поводу систолической дис-функции или хирургического лечения по поводу стенозааортального клапана). С помощью ЭКГ можно оценить ритм и проводимость сердца, что также может повлиять на выбор лечения (например, контроль частоты сокращения желудочков и назначение антикоагулянтовпри ФП, имплантация кардиостимулятора при брадикардии, имплантация двухжелудочкового кардиостимулятора при блокаде левой ножки пучка Гиса и др.; таблица 8). На ЭКГ могут быть признаки рубцовыхизменений после перенесенных инфарктов или при-знаки гипертрофии камер сердца, что указывает на при-чину СН. Если у больных с подозрением на острую СН регистрируется нормальная ЭКГ, то это практическиполностью позволяет исключить СН, вероятность кото-рой у таких больных не превышает 2 % [32, 33, 56–59]. У больных же с постепенным началом симптомов обна-ружение нормальной ЭКГ имеет меньшую отрица-тельную прогностическую ценность (вероятность СН составляет 10–14 %).
ЭКГ и ЭхоКГ позволяют выставить предваритель-ный диагноз СН и составить план лечения у большин-ства больных. С помощью стандартных биохимическихи гематологических анализов можно оценить функциюпочек и уровень калия перед началом приема средств,блокирующих РААС, исключить анемию (клиническиепроявления которой могут напоминать таковые при СН;в то же время она может усугублять течение уже имею-щейся СН), а также получить дополнительную полезнуюинформацию (таблица 9).
Таблица 9. Типичные отклонения от нормы лабораторных показателей у больных сердечной недостаточностью
ЭхоКГ и ЭКГ относятся к первоочередным исследованиям у больных с подозрением на СН. Эхокардиографияпозволяет быстро оценить размеры сердца,состояние клапанного аппарата, систолической и диа-столической функции желудочков [37–40, 48–55].Подобная оценка имеет решающее значение при выбо-ре должного лечения (например, назначения иАПФи β-адреноблокаторовпо поводу систолической дис-функции или хирургического лечения по поводу стенозааортального клапана). С помощью ЭКГ можно оценить ритм и проводимость сердца, что также может повлиять на выбор лечения (например, контроль частоты сокращения желудочков и назначение антикоагулянтовпри ФП, имплантация кардиостимулятора при брадикардии, имплантация двухжелудочкового кардиостимулятора при блокаде левой ножки пучка Гиса и др.; таблица 8). На ЭКГ могут быть признаки рубцовыхизменений после перенесенных инфарктов или при-знаки гипертрофии камер сердца, что указывает на при-чину СН. Если у больных с подозрением на острую СН регистрируется нормальная ЭКГ, то это практическиполностью позволяет исключить СН, вероятность кото-рой у таких больных не превышает 2 % [32, 33, 56–59]. У больных же с постепенным началом симптомов обна-ружение нормальной ЭКГ имеет меньшую отрица-тельную прогностическую ценность (вероятность СН составляет 10–14 %).
ЭКГ и ЭхоКГ позволяют выставить предваритель-ный диагноз СН и составить план лечения у большин-ства больных. С помощью стандартных биохимическихи гематологических анализов можно оценить функциюпочек и уровень калия перед началом приема средств,блокирующих РААС, исключить анемию (клиническиепроявления которой могут напоминать таковые при СН;в то же время она может усугублять течение уже имею-щейся СН), а также получить дополнительную полезнуюинформацию (таблица 9).
Таблица 9. Типичные отклонения от нормы лабораторных показателей у больных сердечной недостаточностью
 Визуализирующие методы исследования играют цен-тральную роль в диагностике СН, а также в контролеэффективности лечения. При подозрении на СН мето-дом выбора является ЭхоКГ по причине своей высокойдиагностической точности, повсеместной распростра-ненности, безопасности и относительно низкой стоимо-сти [48–55]. В зависимости от конкретной клиническойзадачи ЭхоКГ может быть дополнена другими методамиисследования (таблица 10) [60–68]. Любое визуализи-рующее исследование должно быть выполнено опытными компетентным специалистом [53].
Прочие же методы исследования требуются главнымобразом лишь в тех случаях, когда:
A) неясен диагноз (например, при неудовлетворительномкачестве изображений при трансторакальной ЭхоКГ);
B) имеется подозрение на редкое заболевание сердцаили на несердечную причину имеющихся у больногосимптомов и клинических признаков;
C) требуется более детальная оценка причины СН(например,перфузионная сцинтиграфия или ангиографияпри подозрении на ИБС или биопсия миокардапри некоторых инфильтративных кардиомиопатиях).
Таблица 10. Сравнительная оценка различных визуализирующих методов, используемых в диагностике СН
Визуализирующие методы исследования играют цен-тральную роль в диагностике СН, а также в контролеэффективности лечения. При подозрении на СН мето-дом выбора является ЭхоКГ по причине своей высокойдиагностической точности, повсеместной распростра-ненности, безопасности и относительно низкой стоимо-сти [48–55]. В зависимости от конкретной клиническойзадачи ЭхоКГ может быть дополнена другими методамиисследования (таблица 10) [60–68]. Любое визуализи-рующее исследование должно быть выполнено опытными компетентным специалистом [53].
Прочие же методы исследования требуются главнымобразом лишь в тех случаях, когда:
A) неясен диагноз (например, при неудовлетворительномкачестве изображений при трансторакальной ЭхоКГ);
B) имеется подозрение на редкое заболевание сердцаили на несердечную причину имеющихся у больногосимптомов и клинических признаков;
C) требуется более детальная оценка причины СН(например,перфузионная сцинтиграфия или ангиографияпри подозрении на ИБС или биопсия миокардапри некоторых инфильтративных кардиомиопатиях).
Таблица 10. Сравнительная оценка различных визуализирующих методов, используемых в диагностике СН
 Натрийуретические гормоны
Поскольку симптомы и клинические признаки СН неспецифичны, у многих больных с клиническим подо-зрением на СН при ЭхоКГ не удается выявить сколь-ко-нибудь значимых нарушений со стороны сердца.Альтернативный диагностический подход подразумевает измерение концентрации в крови натрийуретических гормонов – семейства пептидов, секреция которых воз-растает при органических поражениях сердца, а также при повышении гемодинамической нагрузки на сердце(например, при ФП, тромбоэмболии легочной артерии),а также при ряде внесердечных состояний (например,при почечной недостаточности) [69–72]. Содержание натрийуретических гормонов также повышается с возрастом, но может быть низким у лиц с ожирением [47]или гипотиреозом. Нормальное содержание натрийуретических гормонов при отсутствии предшествующего лечения фактически исключает значимое поражение сердца, что делает необязательным проведение ЭхоКГ.В таких случаях целесообразно сосредоточиться на поиске внесердечных причин имеющихся у больного симптомов и клинических признаков [69, 72].
В ходе многочисленных исследований были определены так называемые «пороговые значения»для натрийуретических гормонов [73–80]. У больных с разным началом симптомов используются разные пороговые значения. При остром началесимптомов или резком их нарастании для исключения СН уровень мозгового натрийуретического гормона (BNP) должен быть менее 100 пг / мл,а его N-концевого предшественника (NT-proBNP) –менее 300 пг / мл. При постепенном начале симптомов для исключения СН уровень BNP должен быть менее 35 пг / мл, а NT-proBNP – менее 125 пг / мл.Чувствительность и специфичность тестов на BNPи NT-proBNP при постепенном начале симптомов ниже, чем при остром начале [73–80].
Поскольку высокий уровень натрийуретических гормонов ассоциируется с неблагоприятным прогнозом,а снижение этого уровня приводит к улучшению прогноза, в свое время было высказано предположение о более четком контроле эффективности лечения с помощью серийного определения уровня натрийуретических гормонов по сравнению с контролем, основанном на слежении лишь за клиническими показателями. Однако в рандомизированных клинических испытаниях, посвященных данному вопросу, были получены весьма противоречивые результаты [81].
Таблица 11. Прогностические факторы при СН (представлены лишь наиболее изученные факторы)
Натрийуретические гормоны
Поскольку симптомы и клинические признаки СН неспецифичны, у многих больных с клиническим подо-зрением на СН при ЭхоКГ не удается выявить сколь-ко-нибудь значимых нарушений со стороны сердца.Альтернативный диагностический подход подразумевает измерение концентрации в крови натрийуретических гормонов – семейства пептидов, секреция которых воз-растает при органических поражениях сердца, а также при повышении гемодинамической нагрузки на сердце(например, при ФП, тромбоэмболии легочной артерии),а также при ряде внесердечных состояний (например,при почечной недостаточности) [69–72]. Содержание натрийуретических гормонов также повышается с возрастом, но может быть низким у лиц с ожирением [47]или гипотиреозом. Нормальное содержание натрийуретических гормонов при отсутствии предшествующего лечения фактически исключает значимое поражение сердца, что делает необязательным проведение ЭхоКГ.В таких случаях целесообразно сосредоточиться на поиске внесердечных причин имеющихся у больного симптомов и клинических признаков [69, 72].
В ходе многочисленных исследований были определены так называемые «пороговые значения»для натрийуретических гормонов [73–80]. У больных с разным началом симптомов используются разные пороговые значения. При остром началесимптомов или резком их нарастании для исключения СН уровень мозгового натрийуретического гормона (BNP) должен быть менее 100 пг / мл,а его N-концевого предшественника (NT-proBNP) –менее 300 пг / мл. При постепенном начале симптомов для исключения СН уровень BNP должен быть менее 35 пг / мл, а NT-proBNP – менее 125 пг / мл.Чувствительность и специфичность тестов на BNPи NT-proBNP при постепенном начале симптомов ниже, чем при остром начале [73–80].
Поскольку высокий уровень натрийуретических гормонов ассоциируется с неблагоприятным прогнозом,а снижение этого уровня приводит к улучшению прогноза, в свое время было высказано предположение о более четком контроле эффективности лечения с помощью серийного определения уровня натрийуретических гормонов по сравнению с контролем, основанном на слежении лишь за клиническими показателями. Однако в рандомизированных клинических испытаниях, посвященных данному вопросу, были получены весьма противоречивые результаты [81].
Таблица 11. Прогностические факторы при СН (представлены лишь наиболее изученные факторы)
 Рентгенография грудной клетки
У больных с подозрением на СН рентгенография груд-ной клетки имеет небольшое значение, хотя и позволяет выявить венозный застой или отек легких. Исчезновениепризнаков венозного застоя в легких на фоне леченияможет служить объективным критерием его эффектив-ности. По всей видимости, рентгенография наиболееполезна для исключения легочной причины одышки.Обнаружение кардиомегалии (величины кардиотора-кального индекса более 50 %) свидетельствует о пато-логии сердца. Впрочем следует заметить, что расширение границ сердечной тени может отсутствовать дажепри выраженной систолической дисфункции ЛЖ.
Лабораторные анализы
В дополнение к стандартным биохимическому и гематологическому анализам крови большое значение имеет измерение концентрации тиреотропногогормона, поскольку клинические проявления заболеваний щитовидной железы и СН могут быть похожими; кроме того, заболевания щитовидной железы могут усугублять течение СН (таблица 9). Крайневажным является определение уровня глюкозы в кро-ви, поскольку при СН часто встречается СД, нередкодо этого никем не распознанный. При СН может бытьповышен уровень печеночных ферментов, что следуетучитывать при назначении таких препаратов, как амиодаронили варфарин.
При лечении средствами, подавляющими активность РААС, следует тщательно следить за функцией почек и содержанием в крови калия, особенно при под-боре дозы этих препаратов. При длительном использовании этих средств оценка функции почек показана в случае возникновения эпизодов потери натрия и жид-кости (например, при диарее или рвоте), при назначении новых препаратов или изменении дозы ранее принимаемых препаратов, влияющих на обмен натрия и воды в организме или на функцию почек (например, НПВС и диуретиков, особенно калийсберегающих). Многие стандартные лабораторные показателипри СН имеют самостоятельное прогностическое значение (таблица 11).
Эхокардиография
Эхокардиография используется для оценки структурыи функции сердца и выявления органических причин СН.
Оценка систолической функции ЛЖ
В качестве показателя насосной функции сердцаиспользуется ФВ ЛЖ, которая, впрочем, весьма неточ-но отражает истинное состояние сократимости ЛЖ, поскольку зависит от множества других факторов: объемажелудочка, пред- и посленагрузки, состояния кла-панов. Следует помнить, что ФВ – это не одно и то же,что и ударный объем. Так, при систолической СН (низ-кой ФВ) ударный объем долгое время может оставатьсяв пределах нормы за счет расширения ЛЖ, в то времякак при СН–СФВ и концентрической гипертрофии ЛЖударный объем может быть снижен, несмотря на нор-мальную ФВ. При тяжелой митральной недостаточностиФВ также может быть нормальной и даже повышенной,несмотря на снижение антеградного ударного объема.Поэтому всякий раз, определяя ФВ, ее следует интерпре-тировать с учетом данного клинического контекста.
Оптимальным способом расчета ФВ является методдисков (метод Симпсона) [38, 50–55, 82]. Однако посколькуэтот метод основан на обводе границы эндокар-да, при неудовлетворительном качестве изображений(визуализации <80 % эндокарда ЛЖ) можно восполь-зоваться контрастными веществами, что позволяет луч-ше рассмотреть эндокард [83]. Методы вычисления ФВпо Тейхользу или Хинонесу основаны на измерениилинейных размеров и могут давать неточные результаты(прежде всего у больных с нарушением локальной сокра-тимости ЛЖ). То же самое справедливо для другогометода оценки систолической функции ЛЖ – фракцииукорочения. Трехмерная ЭхоКГ позволяет более точноопределять объемы и ФВ ЛЖ при условии получения изо-бражений приемлемого качества [84]. При оценке сокра-тимости ЛЖ можно также ориентироваться на индексдвижения стенок ЛЖ, однако его редко используютв клинической практике. К прочим показателям систо-лической функции ЛЖ относятся скорость систоличе-ского движения основания ЛЖ, измеренная с помощьютканевого допплеровского исследования, амплитуда сме-щения атрио-вентрикулярной плоскости, деформацияи скорость деформации миокарда (соответственно strainи strain rate). Показатели деформации миокарда болеетонко, нежели ФВ, реагируют на изменения систоличе-ской функции ЛЖ. Однако из-за своей низкой воспроиз-водимости и отсутствия нормативных значений эти пока-затели в настоящее время используются редко. Ударныйобъем можно рассчитать, умножив интеграл линейнойскорости кровотока в выносящем тракте ЛЖ на площадьвыносящего тракта.
В таблице 12 представлены нарушения, часто выявляемые при ЭхоКГ у больных СН.
Таблица 12. Часто встречаемые ЭхоКГ нарушения при СН
Рентгенография грудной клетки
У больных с подозрением на СН рентгенография груд-ной клетки имеет небольшое значение, хотя и позволяет выявить венозный застой или отек легких. Исчезновениепризнаков венозного застоя в легких на фоне леченияможет служить объективным критерием его эффектив-ности. По всей видимости, рентгенография наиболееполезна для исключения легочной причины одышки.Обнаружение кардиомегалии (величины кардиотора-кального индекса более 50 %) свидетельствует о пато-логии сердца. Впрочем следует заметить, что расширение границ сердечной тени может отсутствовать дажепри выраженной систолической дисфункции ЛЖ.
Лабораторные анализы
В дополнение к стандартным биохимическому и гематологическому анализам крови большое значение имеет измерение концентрации тиреотропногогормона, поскольку клинические проявления заболеваний щитовидной железы и СН могут быть похожими; кроме того, заболевания щитовидной железы могут усугублять течение СН (таблица 9). Крайневажным является определение уровня глюкозы в кро-ви, поскольку при СН часто встречается СД, нередкодо этого никем не распознанный. При СН может бытьповышен уровень печеночных ферментов, что следуетучитывать при назначении таких препаратов, как амиодаронили варфарин.
При лечении средствами, подавляющими активность РААС, следует тщательно следить за функцией почек и содержанием в крови калия, особенно при под-боре дозы этих препаратов. При длительном использовании этих средств оценка функции почек показана в случае возникновения эпизодов потери натрия и жид-кости (например, при диарее или рвоте), при назначении новых препаратов или изменении дозы ранее принимаемых препаратов, влияющих на обмен натрия и воды в организме или на функцию почек (например, НПВС и диуретиков, особенно калийсберегающих). Многие стандартные лабораторные показателипри СН имеют самостоятельное прогностическое значение (таблица 11).
Эхокардиография
Эхокардиография используется для оценки структурыи функции сердца и выявления органических причин СН.
Оценка систолической функции ЛЖ
В качестве показателя насосной функции сердцаиспользуется ФВ ЛЖ, которая, впрочем, весьма неточ-но отражает истинное состояние сократимости ЛЖ, поскольку зависит от множества других факторов: объемажелудочка, пред- и посленагрузки, состояния кла-панов. Следует помнить, что ФВ – это не одно и то же,что и ударный объем. Так, при систолической СН (низ-кой ФВ) ударный объем долгое время может оставатьсяв пределах нормы за счет расширения ЛЖ, в то времякак при СН–СФВ и концентрической гипертрофии ЛЖударный объем может быть снижен, несмотря на нор-мальную ФВ. При тяжелой митральной недостаточностиФВ также может быть нормальной и даже повышенной,несмотря на снижение антеградного ударного объема.Поэтому всякий раз, определяя ФВ, ее следует интерпре-тировать с учетом данного клинического контекста.
Оптимальным способом расчета ФВ является методдисков (метод Симпсона) [38, 50–55, 82]. Однако посколькуэтот метод основан на обводе границы эндокар-да, при неудовлетворительном качестве изображений(визуализации <80 % эндокарда ЛЖ) можно восполь-зоваться контрастными веществами, что позволяет луч-ше рассмотреть эндокард [83]. Методы вычисления ФВпо Тейхользу или Хинонесу основаны на измерениилинейных размеров и могут давать неточные результаты(прежде всего у больных с нарушением локальной сокра-тимости ЛЖ). То же самое справедливо для другогометода оценки систолической функции ЛЖ – фракцииукорочения. Трехмерная ЭхоКГ позволяет более точноопределять объемы и ФВ ЛЖ при условии получения изо-бражений приемлемого качества [84]. При оценке сокра-тимости ЛЖ можно также ориентироваться на индексдвижения стенок ЛЖ, однако его редко используютв клинической практике. К прочим показателям систо-лической функции ЛЖ относятся скорость систоличе-ского движения основания ЛЖ, измеренная с помощьютканевого допплеровского исследования, амплитуда сме-щения атрио-вентрикулярной плоскости, деформацияи скорость деформации миокарда (соответственно strainи strain rate). Показатели деформации миокарда болеетонко, нежели ФВ, реагируют на изменения систоличе-ской функции ЛЖ. Однако из-за своей низкой воспроиз-водимости и отсутствия нормативных значений эти пока-затели в настоящее время используются редко. Ударныйобъем можно рассчитать, умножив интеграл линейнойскорости кровотока в выносящем тракте ЛЖ на площадьвыносящего тракта.
В таблице 12 представлены нарушения, часто выявляемые при ЭхоКГ у больных СН.
Таблица 12. Часто встречаемые ЭхоКГ нарушения при СН
 Оценка диастолической функции ЛЖ
Считается, что в основе большинства случаев СН–СФВ лежит нарушение диастолической функции ЛЖ,поэтому ее корректная оценка – краеугольный каменьдиагностики этой формы СН (таблица 13) [48–55, 85,86]. Важно помнить, что нормальные значения боль-шинства ультразвуковых показателей диастолическойфункции ЛЖ зависят от возраста, ЧСС и размера тела[85, 86]. Важно, что ни один из ультразвуковых показа-телей не обладает достаточной диагностической точностью для того, чтобы на его основании был сделан вывод о наличии либо отсутствии у больного диастолической дисфункции ЛЖ. При оценке диастолической функциивсегда следует учитывать данные всех исследований,включая данные допплеровских и двухмерного режимов[38, 85, 86]. Максимальная скорость подъема основа-ния ЛЖ в раннюю диастолу (скорость é), измереннаяс помощью тканевого допплеровского исследования,позволяет оценить скорость расслабления миокарда.Нормальные значения скорости é (>8 см / с из областимежжелудочковой перегородки, >10 см / с из областибоковой стенки или >9 см / с при усреднении скоростей)при СН практически не встречаются. СоотношениеE / é тесно связано с давлением наполнения ЛЖ (табли-ца 13) [85, 86]. Таким образом, основными ультразвуковыми критериями диастолической дисфункции ЛЖ являются снижение скорости é (усредненная скорость<9 см / сек) и / или повышение соотношения E / é (>15).Отклонение от нормы, по меньшей мере, двух показателей и / или наличие ФП повышают точность диагности-ки диастолической дисфункции.
Чреспищеводная ЭхоКГ
Обычно к чреспищеводной ЭхоКГ прибегают при неудовлетворительном качестве изображений при трансторакальном исследовании (например, у больных с ожирением, заболеваниями легких, находящихся на искусственной вентиляции легких), а также тогда, когда прочие визуализирующие методы по тем или иным причинам недоступны. Чреспищеводная ЭхоКГ особенно цен-на у больных со сложными приобретенными порокамисердца (особенно с патологией митрального и протези-рованных клапанов), при подозрении на инфекционныйэндокардит и у некоторых категорий больных с врожден-ными пороками сердца. У больных с ФП чреспищевод-ная ЭхоКГ позволяет обнаружить тромбоз ушка левогопредсердия.
Стресс–ЭхоКГ
Стресс–ЭхоКГ с физической или фармакологическойнагрузкой – надежный метод оценки ишемии и жизне-способности миокарда. При систолической дисфункцииЛЖ, связанной с ИБС, стресс–ЭхоКГ позволяет отли-чить ишемизированный, но жизнеспособный миокардот рубцовой ткани [55]. Стресс–ЭхоКГ показана боль-ным с подозрением на тяжелый стеноз аортального кла-пана, у которых из-за систолической дисфункции ЛЖрегистрируется низкий трансклапанный градиент дав-ления. У больных с симптомами, характерными для СН,нормальной ФВ, незначительной диастолической дис-функцией ЛЖ в покое может быть выполнена стресс–ЭхоКГ с целью оценки изменения давления наполненияпри нагрузке, что позволяет подтвердить или опровер-гнуть диагноз СН–СФВ [85].
Магнитно-резонансная томография (МРТ)
МРТ позволяет оценивать структурные и функци-ональные изменения сердца практически в том же объеме, что и ЭхоКГ (включая оценку ишемии и жизнеспособности миокарда), а также получать дополнительнуюинформацию, недоступную для ЭхоКГ [60, 65, 87]. МРТсчитается «золотым стандартом» по точности измеренияобъемов, массы и сократимости камер сердца. МРТ является наилучшей альтернативой при неудовлетворительном качестве изображений при трансторакальной ЭхоКГ.МРТ особенно ценна в выявлении воспалительныхи инфильтративных заболеваний миокарда (таблица 10)[87]. МРТ может быть включена в программу обследова-ния больных с подозрением на ту или иную кардиомиопа-тию, первичные или вторичные опухоли сердца, болезниперикарда. МРТ является методом выбора при комбини-рованных врожденных пороках сердца [88]. К недостат-кам МРТ относят ограниченную распространенностьисследования и его высокую стоимость, а также невоз-можность выполнения исследования у больных с метал-лическими имплантатами, включая некоторые (но не все!)внутрисердечные устройства. Кроме того, у больныхс наджелудочковыми аритмиями точность оценки функ-циональных показателей значительно снижается. В рядеслучаев исследование не может быть выполнено по при-чине наличия у больного клаудистрофобии. Контрастныесредства на основе гадолиния противопоказаны больнымсо скоростью клубочковой фильтрации <30 мл / мин / м2,поскольку могут вызвать такое опасное и нередко смер-тельное состояние, как нефрогенный системный фиброз(это осложнение в меньшей степени относится к недавноразработанному макроциклическому гадолинию) [89, 90].
Однофотонная эмиссионная компьютернаятомография и изотопная вентрикулография
Однофотонная эмиссионная компьютерная томография(SPECT) используется для выявления ишемиии оценки жизнеспособности миокарда (таблица 10) [62].Также с помощью SPECT можно оценивать объемыкамери функцию сердца, однако следует помнить, что при этомметоде больной подвергается ионизирующему излучению.
Позитронно-эмиссионная томография (ПЭТ)
ПЭТ изолированно или в сочетании с компьютернойтомографией позволяет количественно оценить ишемию и жизнеспособность миокарда, однако используемые для этой оценки 15О-вода и 13N-аммиак производятсяна циклотроне и имеют довольно короткий период полураспада, из-за чего ПЭТ может быть выполнена только в специализированных центрах [66, 68]. В качестве альтернативной метки для оценки ишемии миокарда можно использовать рубидий, который получают с помощью генераторов, что определяет его сравнительно низкую стоимость (таблица 10). Основными недостатками метода являются ограниченная распространенность, ионизи-рующее излучение и высокая стоимость камеры.
Коронарная ангиография
Коронарная ангиография показана больным со стенокардией при условии возможности последующей реваскуляризации миокарда. Ангиография также показана при положительном результате нагрузочных проб, в том числе у больных с низкой сократимостью ЛЖ, посколь-ку у таких больных может оказаться эффективным аорто-коронарное шунтирование. Перед ангиографией следует оценить жизнеспособность миокарда, поскольку при отсутствии такового целесообразность в ангиографии отпадает. У ряда больных острой СН (кардиогеннымшоком или острым отеком легких), особенно при ОКС,может потребоваться экстренная коронарная ангиогра-фия. Коронарная ангиография показана больным с приоб-ретенными пороками сердца перед операцией на клапанах,а также пациентам из группы риска ИБС перед импланта-цией двухкамерных электрокардиостимуляторов (ЭКС).
Компьютерная томография сердца
На сегодняшний день основной «точкой приложения» компьютерной томографии при СН является неин-вазивная оценка поражения коронарных артерий [67].
Таблица 13. Часто встречаемые ЭхоКГ нарушения диастолической функции ЛЖ
Оценка диастолической функции ЛЖ
Считается, что в основе большинства случаев СН–СФВ лежит нарушение диастолической функции ЛЖ,поэтому ее корректная оценка – краеугольный каменьдиагностики этой формы СН (таблица 13) [48–55, 85,86]. Важно помнить, что нормальные значения боль-шинства ультразвуковых показателей диастолическойфункции ЛЖ зависят от возраста, ЧСС и размера тела[85, 86]. Важно, что ни один из ультразвуковых показа-телей не обладает достаточной диагностической точностью для того, чтобы на его основании был сделан вывод о наличии либо отсутствии у больного диастолической дисфункции ЛЖ. При оценке диастолической функциивсегда следует учитывать данные всех исследований,включая данные допплеровских и двухмерного режимов[38, 85, 86]. Максимальная скорость подъема основа-ния ЛЖ в раннюю диастолу (скорость é), измереннаяс помощью тканевого допплеровского исследования,позволяет оценить скорость расслабления миокарда.Нормальные значения скорости é (>8 см / с из областимежжелудочковой перегородки, >10 см / с из областибоковой стенки или >9 см / с при усреднении скоростей)при СН практически не встречаются. СоотношениеE / é тесно связано с давлением наполнения ЛЖ (табли-ца 13) [85, 86]. Таким образом, основными ультразвуковыми критериями диастолической дисфункции ЛЖ являются снижение скорости é (усредненная скорость<9 см / сек) и / или повышение соотношения E / é (>15).Отклонение от нормы, по меньшей мере, двух показателей и / или наличие ФП повышают точность диагности-ки диастолической дисфункции.
Чреспищеводная ЭхоКГ
Обычно к чреспищеводной ЭхоКГ прибегают при неудовлетворительном качестве изображений при трансторакальном исследовании (например, у больных с ожирением, заболеваниями легких, находящихся на искусственной вентиляции легких), а также тогда, когда прочие визуализирующие методы по тем или иным причинам недоступны. Чреспищеводная ЭхоКГ особенно цен-на у больных со сложными приобретенными порокамисердца (особенно с патологией митрального и протези-рованных клапанов), при подозрении на инфекционныйэндокардит и у некоторых категорий больных с врожден-ными пороками сердца. У больных с ФП чреспищевод-ная ЭхоКГ позволяет обнаружить тромбоз ушка левогопредсердия.
Стресс–ЭхоКГ
Стресс–ЭхоКГ с физической или фармакологическойнагрузкой – надежный метод оценки ишемии и жизне-способности миокарда. При систолической дисфункцииЛЖ, связанной с ИБС, стресс–ЭхоКГ позволяет отли-чить ишемизированный, но жизнеспособный миокардот рубцовой ткани [55]. Стресс–ЭхоКГ показана боль-ным с подозрением на тяжелый стеноз аортального кла-пана, у которых из-за систолической дисфункции ЛЖрегистрируется низкий трансклапанный градиент дав-ления. У больных с симптомами, характерными для СН,нормальной ФВ, незначительной диастолической дис-функцией ЛЖ в покое может быть выполнена стресс–ЭхоКГ с целью оценки изменения давления наполненияпри нагрузке, что позволяет подтвердить или опровер-гнуть диагноз СН–СФВ [85].
Магнитно-резонансная томография (МРТ)
МРТ позволяет оценивать структурные и функци-ональные изменения сердца практически в том же объеме, что и ЭхоКГ (включая оценку ишемии и жизнеспособности миокарда), а также получать дополнительнуюинформацию, недоступную для ЭхоКГ [60, 65, 87]. МРТсчитается «золотым стандартом» по точности измеренияобъемов, массы и сократимости камер сердца. МРТ является наилучшей альтернативой при неудовлетворительном качестве изображений при трансторакальной ЭхоКГ.МРТ особенно ценна в выявлении воспалительныхи инфильтративных заболеваний миокарда (таблица 10)[87]. МРТ может быть включена в программу обследова-ния больных с подозрением на ту или иную кардиомиопа-тию, первичные или вторичные опухоли сердца, болезниперикарда. МРТ является методом выбора при комбини-рованных врожденных пороках сердца [88]. К недостат-кам МРТ относят ограниченную распространенностьисследования и его высокую стоимость, а также невоз-можность выполнения исследования у больных с метал-лическими имплантатами, включая некоторые (но не все!)внутрисердечные устройства. Кроме того, у больныхс наджелудочковыми аритмиями точность оценки функ-циональных показателей значительно снижается. В рядеслучаев исследование не может быть выполнено по при-чине наличия у больного клаудистрофобии. Контрастныесредства на основе гадолиния противопоказаны больнымсо скоростью клубочковой фильтрации <30 мл / мин / м2,поскольку могут вызвать такое опасное и нередко смер-тельное состояние, как нефрогенный системный фиброз(это осложнение в меньшей степени относится к недавноразработанному макроциклическому гадолинию) [89, 90].
Однофотонная эмиссионная компьютернаятомография и изотопная вентрикулография
Однофотонная эмиссионная компьютерная томография(SPECT) используется для выявления ишемиии оценки жизнеспособности миокарда (таблица 10) [62].Также с помощью SPECT можно оценивать объемыкамери функцию сердца, однако следует помнить, что при этомметоде больной подвергается ионизирующему излучению.
Позитронно-эмиссионная томография (ПЭТ)
ПЭТ изолированно или в сочетании с компьютернойтомографией позволяет количественно оценить ишемию и жизнеспособность миокарда, однако используемые для этой оценки 15О-вода и 13N-аммиак производятсяна циклотроне и имеют довольно короткий период полураспада, из-за чего ПЭТ может быть выполнена только в специализированных центрах [66, 68]. В качестве альтернативной метки для оценки ишемии миокарда можно использовать рубидий, который получают с помощью генераторов, что определяет его сравнительно низкую стоимость (таблица 10). Основными недостатками метода являются ограниченная распространенность, ионизи-рующее излучение и высокая стоимость камеры.
Коронарная ангиография
Коронарная ангиография показана больным со стенокардией при условии возможности последующей реваскуляризации миокарда. Ангиография также показана при положительном результате нагрузочных проб, в том числе у больных с низкой сократимостью ЛЖ, посколь-ку у таких больных может оказаться эффективным аорто-коронарное шунтирование. Перед ангиографией следует оценить жизнеспособность миокарда, поскольку при отсутствии такового целесообразность в ангиографии отпадает. У ряда больных острой СН (кардиогеннымшоком или острым отеком легких), особенно при ОКС,может потребоваться экстренная коронарная ангиогра-фия. Коронарная ангиография показана больным с приоб-ретенными пороками сердца перед операцией на клапанах,а также пациентам из группы риска ИБС перед импланта-цией двухкамерных электрокардиостимуляторов (ЭКС).
Компьютерная томография сердца
На сегодняшний день основной «точкой приложения» компьютерной томографии при СН является неин-вазивная оценка поражения коронарных артерий [67].
Таблица 13. Часто встречаемые ЭхоКГ нарушения диастолической функции ЛЖ
 Дополнительные методы исследования
Катетеризация сердца и биопсия миокарда
При подозрении на констриктивный перикардитили рестриктивную кардиомиопатию катетеризация сердца, используемая совместно с неинвазивными методами исследования, позволяет установить правильный диагноз (таблица 10). При подозрении на миокардитили инфильтративные заболевания сердца (например,амилоидоз) показана биопсия миокарда [91].
Пробы с физической нагрузкой
Пробы с физической нагрузкой позволяют получить объективную оценку переносимости физической нагрузки, а также выяснить, с чем связана одышка и утомляемость при физической нагрузке [92], и оценить прогноз. Обычно для этого используют тест 6-мин ходьбы и ряд протоколов с велоэргометрией или тредмилом. Анализ газообмена помогает выяснить, с чем связана одышка – с патологией сердца или легких, а также имеет важное прогностическое значение (при рассмотрении вопроса о трансплантации обязательно определяют максимальное потребление кислорода). Нормальная переносимостьфизической нагрузки у больного без предшествующеголечения позволяет с уверенностью исключить диагнозсимптомной СН, однако необходимо помнить о том,что переносимость нагрузки слабо связана с гемодинами-ческими показателями, измеренными в состоянии покоя(прежде всего это касается ФВ).
Генетическое тестирование
Аспекты генетического тестирования при кардиомиопатиях подробно изложены в соответствующем руководстве [83]. Генетическое тестирование рекомендованобольным с дилатационной кардиомиопатией и атрио-вен-трикулярной блокадой или внезапной смертью близкихродственников, поскольку в таких случаях может потре-боваться профилактическая постановка кардиовертера-дефибриллятора.
Холтеровский мониторинг ЭКГ
Холтеровский мониторинг ЭКГ показан при наличии симптомов, предположительно связанных с нарушениями ритма сердца и проводимости (например, при сердцебиении или обмороках). У больных с ФП при суточном мониторинге ЭКГ следят за частотой желудочковых сокращений. С помощью этого исследования можноопределить тип имеющихся у больного нарушений ритмасердца, оценить их продолжительность и частоту сокращения желудочков, зафиксировать эпизоды безболевойишемии миокарда, брадикардии и нарушений проводи-мости, каждый из которых может быть самостоятельнойпричиной СН или же усугублять ее течение.
Алгоритм постановки диагноза СН
На рисунке 1 представлен диагностический алгоритм при СН. У больных с подозрением на СН и с острым началом симптомов рекомендовано как можно более быстрое проведение ЭхоКГ (при кардиогенном шоке или значительных гемодинамических нарушениях – в экстренномпорядке). При постепенном начале симптомов обследование начинают с ЭКГ и теста на натрийуретические гормоны, по результатам которых определяют, нуждается ли больной в проведении ЭхоКГ или нет. Эхокардиография показана при обнаружении патологических изменений на ЭКГ или если содержание натрийуретических гормонов превышает пороговые значения. У больных с посте-пенным началом симптомов следует ориентироватьсяна более низкие значения натрийуретических гормонов,нежели у больных с острым началом, что позволяет мини-мизировать риск ложноотрицательного результата [93–99]. Больные с высокой претестовой вероятностью СН (например, с ранее перенесенным ИМ) могут быть сразу направлены на ЭхоКГ, минуя этап ЭКГ и теста на натрийуретические гормоны.
Рисунок 1. Диагностический алгоритм при подозрении на сердечную недостаточность
Дополнительные методы исследования
Катетеризация сердца и биопсия миокарда
При подозрении на констриктивный перикардитили рестриктивную кардиомиопатию катетеризация сердца, используемая совместно с неинвазивными методами исследования, позволяет установить правильный диагноз (таблица 10). При подозрении на миокардитили инфильтративные заболевания сердца (например,амилоидоз) показана биопсия миокарда [91].
Пробы с физической нагрузкой
Пробы с физической нагрузкой позволяют получить объективную оценку переносимости физической нагрузки, а также выяснить, с чем связана одышка и утомляемость при физической нагрузке [92], и оценить прогноз. Обычно для этого используют тест 6-мин ходьбы и ряд протоколов с велоэргометрией или тредмилом. Анализ газообмена помогает выяснить, с чем связана одышка – с патологией сердца или легких, а также имеет важное прогностическое значение (при рассмотрении вопроса о трансплантации обязательно определяют максимальное потребление кислорода). Нормальная переносимостьфизической нагрузки у больного без предшествующеголечения позволяет с уверенностью исключить диагнозсимптомной СН, однако необходимо помнить о том,что переносимость нагрузки слабо связана с гемодинами-ческими показателями, измеренными в состоянии покоя(прежде всего это касается ФВ).
Генетическое тестирование
Аспекты генетического тестирования при кардиомиопатиях подробно изложены в соответствующем руководстве [83]. Генетическое тестирование рекомендованобольным с дилатационной кардиомиопатией и атрио-вен-трикулярной блокадой или внезапной смертью близкихродственников, поскольку в таких случаях может потре-боваться профилактическая постановка кардиовертера-дефибриллятора.
Холтеровский мониторинг ЭКГ
Холтеровский мониторинг ЭКГ показан при наличии симптомов, предположительно связанных с нарушениями ритма сердца и проводимости (например, при сердцебиении или обмороках). У больных с ФП при суточном мониторинге ЭКГ следят за частотой желудочковых сокращений. С помощью этого исследования можноопределить тип имеющихся у больного нарушений ритмасердца, оценить их продолжительность и частоту сокращения желудочков, зафиксировать эпизоды безболевойишемии миокарда, брадикардии и нарушений проводи-мости, каждый из которых может быть самостоятельнойпричиной СН или же усугублять ее течение.
Алгоритм постановки диагноза СН
На рисунке 1 представлен диагностический алгоритм при СН. У больных с подозрением на СН и с острым началом симптомов рекомендовано как можно более быстрое проведение ЭхоКГ (при кардиогенном шоке или значительных гемодинамических нарушениях – в экстренномпорядке). При постепенном начале симптомов обследование начинают с ЭКГ и теста на натрийуретические гормоны, по результатам которых определяют, нуждается ли больной в проведении ЭхоКГ или нет. Эхокардиография показана при обнаружении патологических изменений на ЭКГ или если содержание натрийуретических гормонов превышает пороговые значения. У больных с посте-пенным началом симптомов следует ориентироватьсяна более низкие значения натрийуретических гормонов,нежели у больных с острым началом, что позволяет мини-мизировать риск ложноотрицательного результата [93–99]. Больные с высокой претестовой вероятностью СН (например, с ранее перенесенным ИМ) могут быть сразу направлены на ЭхоКГ, минуя этап ЭКГ и теста на натрийуретические гормоны.
Рисунок 1. Диагностический алгоритм при подозрении на сердечную недостаточность
 7. Оценка прогноза
При СН многие клинические и инструментальные показатели имеют прогностическое значение(таблица 11). Большинство из этих показателей просты, и их можно определить очень быстро (такие как пол, возраст, причина СН, ФК, определение ФВЛЖ, наличие сопутствующих заболеваний, определение уровня натрийуретических гормонов) [93–99].Оценка прогноза имеет первостепенное значениепри решении вопроса об имплантации внутрисердечных устройств и проведения оперативного лечения,а также при выборе тактики ведения больного с тер-минальной СН.
8. Лечение и профилактика ХСН
Можно сформулировать 6 очевидных задач при лечении ХСН:
A) предотвращение развития симптомной ХСН (дляI стадии ХСН);
B) устранение симптомов ХСН (для стадий IIA–III),
C) замедление прогрессирования болезни путем защи-ты сердца и других органов–мишеней (мозг, почки,сосуды) (для стадий I–III);
D) улучшение качества жизни (для стадий IIA–III);
E) уменьшение количества госпитализаций (и расходов)(для стадий I–III);
F) улучшение прогноза (для стадий I–III).
При постановке диагноза бессимптомной дисфункции ЛЖ (I стадия ХСН) главной целью является недопущение развития клинически выраженных симптомов декомпенсации.
Конечно, когда мы имеем дело с симптомной ХСН,главная задача на начальном этапе лечения – избавить больного от тягостных симптомов (одышки, удушья,отеков): дать возможность просто лежать, спать, отдыхать. Однако если ограничиться лишь этой начальнойцелью, например, применить эффективные диуретикив виде курса терапии, то у такого пациента уже черезнесколько дней (недель) вновь проявятся признакитяжелой декомпенсации, требующие интенсивнойтерапии.
Поэтому важнейшее значение приобретает замедление прогрессирования ХСН, связанное с защитой органов–мишеней, прежде всего сердца, от прогрессирующих патологических изменений (ремоделирования).А поскольку ХСН – это системный процесс, при кото-ром происходит ремоделирование не только сердца,но и почек, сосудов, мышц и т. д., мы говорим именноо системной защите органов–мишеней.
Сегодня Европейское общество кардиологов ориен-тирует каждого врача, лечащего ХСН, ответить на вопрос о назначении того или иного вида терапии: «Зачем я это делаю?» Предполагается, что ответ должен содержатьсяво второй и третьей из поставленных целей – либо добиваюсь устранения симптомов болезни, либо достигаюзамедления прогрессирования болезни. Если врач не спо-собен отнести назначаемое лечение ни к одной из этихкатегорий, возникает вопрос о целесообразности такоговида терапии ХСН.
Естественно, что применяемое лечение, кроме объективной эффективности, должно хорошо субъективно переноситься больными, улучшать или, по крайней мере,не ухудшать качество их жизни. Этот аспект определя-ет и приверженность пациентов с ХСН к проводимымпроцедурам, без которой невозможно рассчитыватьна успешную борьбу с синдромом декомпенсации.
Уменьшение числа госпитализаций имеет двоякийсмысл. Во-первых, это свидетельствует о стабильномтечении заболеваний и отсутствии экстренных деком-пенсаций, требующих повторных обращений к врачу.С другой стороны, госпитализации вносят основнойвклад в структуру затрат на лечение ХСН. По результатамроссийской программы ФАСОН (2001), подтвердилисьданные Института здоровья США о том, что лечениеХСН – это крайне дорогостоящее дело. В России (данныепо 30 городам, участвовавшим в программе ФАСОН)затраты на типичного больного ХСН в 2001 году состав-ляли 45 рублей / сут [100]. При примерной распро-страненности ХСН в России, равной 7 % (исследованиеЭПОХА–ХСН, госпитальный этап, 2006 г.), речь идето более чем 7 млн. человек и затратах в 118 млрд. руб / год.Причем в России почти 62,5 % этой суммы приходитсяна оплату именно госпитального лечения. В США сооб-щается о затратах до 38 млрд. долл. / год [101].
Наконец, последняя и, может быть, самая важная, хотяодновременно и самая трудная задача при лечении ХСН –это продление жизни пациентов, поскольку, как следуетиз предыдущего раздела рекомендаций, декомпенсациясердца является болезнью с крайне плохим прогнозом,и средняя продолжительность жизни больных не превышает 5 лет [102].
Перефразируя рекомендации Европейского обществакардиологов, можно сказать: любой применяемый видлечения ХСН должен помочь достижению, по крайней мере,двух любых из 6 основных целей борьбы с болезнью [1].
Существует шесть путей достижения поставленныхцелей при лечении декомпенсации:
A) диета,
B) режим физической активности,
C) психологическая реабилитация, организация врачебного контроля, школ для больных ХСН,
D) медикаментозная терапия,E) электрофизиологические методы терапии,
F) хирургические, механические методы лечения.
Как видим, медикаментозное лечение представляет собой хотя и очень важную составляющую, но находящуюся в этом списке на четвертой позиции. Игнорированиенемедикаментозных методов борьбы с ХСН затрудняетдостижение конечного успеха и снижает эффективностьлечебных (медикаментозных) воздействий.
Для оценки степени доказанности каждого из предлагаемых методов лечения Европейским обществом кардиологов предложена трехбалльная шкала. Применениепредлагаемого метода абсолютно доказано, по меньшеймере, в двух независимых крупных контролируемыхисследованиях – это степень доказанности А.
Если эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследова-нии или если результаты исследований противоречивы,то есть требуются дополнительные исследования – степень доказанности снижается и обозначается как В.
Когда рекомендации по лечению базируются на результатах отдельных, пусть и положительных, иссле-дований и приближаются к эмпирике, т. е. строго пола-гаться на них трудно, это самая низкая степень доказанности – С.
Кроме того, выделяются классы рекомендаций:
I –лечение показано всем;
IIA – лечение, скорее, показано;
IIB – лечение, скорее, противопоказано;
III – лечениестрого противопоказано.
Учитывая, что ХСН является одним из заключи-тельных этапов сердечно-сосудистого континуума(или непрерывного развития ССЗ), а также осложнением большинства болезней сердца, успешное лечениеэтих заболеваний можно рассматривать, как профилактику развития декомпенсации сердечной деятельности.По классификации ХСН (или, вернее, классификации континуума), предложенной АКК / ААС (2005), выделены четыре стадии, первая из которых (стадия А) относится к той ситуации, когда еще не имеется дисфункции сердца и, тем более, не наступило развитие самой клинически выраженной декомпенсации сердечной деятельности. Поэтому, признавая важность профилактикии лечения основных ФР ХСН, как предтечи развитиядекомпенсации сердечной деятельности,необходимоконстатировать, что эти аспекты остаются за рамкаминастоящих рекомендаций. Задача данного документа –представить алгоритмы диагностики и лечения собственноХСН.
Период В (бессимптомная дисфункция ЛЖ) в Американскойклассификации соответствует I стадии ХСНпо классификации ОССН 2002 года, период С (клинически выраженная ХСН) соответствует II стадии по клас-сификации ОССН 2002 года, и здесь в Российскойклассификации выделены периоды IIA и IIБ (начальнаяи клинически выраженная ХСН). Наконец, стадия Dв Американской классификации, относящаяся к финаль-ной стадии ХСН, соответствует III стадии болезнипо классификации ОССН 2002 года.
9. Профилактика ХСН
Учитывая все большую распространенность ХСН в мире, в том числе и в Российской Федерации, крайнюю тяжесть и злокачественность течения этого синдрома, а также принимая во внимание колоссальные затраты на его лечение, следует обратить особое внимание на проблему профилактики развития ХСН. В отличие от Американской коллегии кардиологов и Американской ассоциации сердца настоящий раздел не призван заменить соответствующие руководства по борьбе с ФР ССЗ. Наша цель – лишь заострить вни-мание на важности предотвращения поражения сердцаи развития симптомов ХСН в случае успешного лечениясоответствующих патологических состояний.
Современный взгляд на проблему предполагает нали-чие возросшей роли комбинации различных факторов,которые способны многократно увеличивать риск разви-тия ИМ и ХСН [103]. Сочетание АГ, ожирения, котороесущественно увеличивается, в том числе и в российскойпопуляции, инсулинорезистентности, дислипидемии,нередко определяемое, как метаболический синдром,является основой развития многих ССЗ, включая ХСН.Обратимся к наиболее очевидным фактам, подтвержда-ющим успешное предотвращение ХСН при нивелирова-нии основных ФР.
Артериальная гипертония
Как известно, повышенное АД является самой частойпричиной развития ХСН. Это было продемонстриро-вано как в США [104], так и в Европе [30]. В России,по результатам эпидемиологических и когортных иссле-дований последних лет, повышенное АД ассоциируетсяс развитием ХСН не менее чем в 80 % случаев, что отра-жает малую эффективность лечения АГ [12, 105].Во Фрамингемском исследовании наличие САД более140 мм рт. ст. ассоциировалось с 4-кратным повышени-ем риска развития ХСН [106]. Соответственно посту-латом можно считать тот факт, что успешное лечение АГ – это наиболее эффективная профилактика развитияХСН (класс IIA, уровень доказанности А). Это доказа-но как для систолической, так и диастолической АГ [107,108]. Нормализация АД позволяет на 50 % снижать рискразвития ХСН [109]. В исследовании VALUE снижениеАД ниже 140 / 90 мм рт. ст. сопровождалось достовернымуменьшением риска развития ХСН на 36 %, независимоот характера антигипертензивного лечения [110].
Среди препаратов для лечения АГ, позволяющихэффективнопредотвращать развитие ХСН, можно выде-лить иАПФ, АРА, β-АБ, диуретики и их комбинации,в то время как использование блокаторов кальциевых кана-лов и α-АБ выглядит менее предпочтительным [111–113].
Исследования последних лет выявили, что и вну-три классов имеются различия в действии разных пре-паратов. Так, в исследовании PROFESS, АРА телми-сартан не продемонстрировалспособности снижатьриск ХСН [114].
Наиболее ярким обоснованием успешной профилак-тики ХСН у пациентов с повышенным АД даже в самыхстарших возрастных группах (свыше 80 лет) можно счи-тать результаты исследования HYVET, в котором лечениетиазидоподобным диуретиком индапамидом и его ком-бинацией с иАПФ периндоприлом снижало риск разви-тия ХСН на 64 % [115].
Особенно важен контроль АД у больных, перенесшихострый ИМ, у пациентов с наличием гипертрофии ЛЖ,перенесенным инсультом и другими осложнениями, т. к.это наиболее обоснованный способ предотвращенияразвития ХСН [108, 116–119]. Более подробно с прин-ципами диагностики и лечения АГ можно ознакомитьсяв соответствующих рекомендациях РКО [120, 121].
Лечение ИБС
Лечение пациентов с ИБС, которая является вто-рым по значимости ФР ХСН, также крайне важно в плане профилактики ХСН [15, 105]. В настоящем разделеречь идет о пациентах с ИБС, не имеющих структурныхизменений сердца(с нормальной ФВ ЛЖ). Следует подчеркнуть, что отсутствуют данные о профилактике ХСНс помощью трех классов лекарств, наиболее часто при-меняемых для лечения стенокардии – нитратов, β-АБи блокаторов медленных кальциевых каналов (классрекомендаций III, уровень доказанности А). В то же вре-мя имеются неопровержимые доказательства предотвра-щения ХСН при применении различных иАПФ (классрекомендаций I, уровень доказанности А). Это касаетсяв первую очередь периндоприла, т. к. одной из конечныхточек исследования EUROPA являлось предотвращениеразвития ХСН [122]. Во вторую очередь – рамиприла,поскольку успешная профилактика ХСH в исследованииHOPE не предполагалась заранее [123].
Телмисартан в исследованиях ONTARGETи TRANSCEND, а также ирбесартан в протоколеI–PRESERVE не показали способности к снижениюриска ХСН у больных ИБС, в том числе и при ХСН–ССФ [124–126].
После перенесенного острого ИМ в качестве профи-лактики ремоделирования сердца и развития ХСН можноиспользовать различные нейрогормональные модулято-ры β-АБ [127, 128], иАПФ [129–131], АРА [132] и анта-гонисты альдостерона [133]. Причем сочетание β-АБс блокадой ренин-ангиотензиновой системы увеличиваетэффект терапии [132, 134].
Сведений о профилактике ХСН при применении аспи-рина у больных, перенесших ОИМ, и тем более у паци-ентов с хроническими формами ИБС нет. Напротив, егоиспользование может приводить к росту числа госпита-лизаций в связи с обострением ХСН (класс рекоменда-ций IIA, уровень доказанности В) [135, 136].
Еще одним важнейшим средством профилактикиХСН у больных с различными формами ИБС являютсястатины, что доказано в исследованиях с симвастатиноми правастатином [137–139]. Сегодня статины реко-мендуются в качестве профилактики ХСН у пациентовс коронарной болезнью сердца (класс рекомендацийIIA, уровень доказанности А). О возможности примене-ния статинов в лечении ХСН будет сказано ниже в соот-ветствующем разделе. Более подробно ознакомитьсяс принципами лечения коронарной болезни сердца мож-но в соответствующих рекомендациях РКО по лечениюИБС и по лечению дислипидемий [140–142].
Сахарный диабет
Нет сомнений, что наличие СД и даже просто инсу-линорезистентность предрасполагают к развитию ХСН,причем в максимальной степени увеличение риска отме-чается у женщин [143, 144]. Сочетание ХСН с СД усу-губляет неблагоприятный прогноз пациентов [145–147].Поэтому успешное лечение пациентов с СД и его ослож-нениями позволяет существенно уменьшать риск раз-вития ХСН (класс IIA, уровень доказанности А) [117,148–151]. Необходимо отметить важность контроляуровня гликемии с использованием препаратов, улучша-ющих чувствительность тканей к инсулину, в частности,метформина (класс IIA, уровень доказанности В) [152].
Мета-анализы последних лет показывают достовер-ное преимущество метформина в профилактике ХСНу больных СД и в лечении больных с сочетанием ХСНи СД перед другими сахароснижающими средствами[153, 154]. Не было отмечено и достоверного роста случаев лактоацидоза, что привело в США к отмене ограни-чений по использованию метформина у больных ХСН.Положительные результаты лечения больных с сочета-нием ХСН и СД метформином были получены в россий-ском проспективном исследовании РЭМБО [155].
Среди основных средств лечения ХСН преимуществоимеют иАПФ и АРА, которые уменьшают риск развитиядиабета, с одной стороны, и уменьшают шансы на разви-тие ХСН у больных СД [156]. В то же время применениеβ-АБ и диуретиков может ухудшать течение СД (классрекомендаций IIB, уровень доказанности В) [117, 157].Учитывая, что положительные эффекты β-АБ при СДсохраняются, отказываться от такой терапии у больных,перенесших ОИМ и имеющих симптомы ХСН, нецелесообразно [158]. В данном случае выбор должен бытьсделан в пользу бисопролола, не ухудшающего чувстви-тельности тканей к инсулину [159], или карведилола,снижающего инсулинорезистентность [160]. Карведилол имеет достоверное преимущество перед метопрололомпо контролю уровня сахара, а также по снижению рискапрогрессирования диабета и появления новых случаев диабета у больных с уже развившейся ХСН (класс рекомендаций IIA, cтепень доказанности B) [161, 162].
Клапанные пороки сердца
Одна из наиболее обсуждаемых в России проблем в связи с ХСН – определение типа расстройств гемодинамики и вариантов лечения больных с клапанными порока-ми сердца. Хотя никаких реальных обсуждений тут бытьне может. Стенозы клапанов, приводящие к перегрузкедавлением, перенапряжению стенок вышележащих отде-лов сердца и их гипертрофии, требуют обязательногохирургического лечения, независимо от степени изме-нения гемодинамики и выраженности симптомов ХСН[163]. Никаких терапевтических (медикаментозных) альтернатив для больных стенозом митрального и аорталь-ного клапана нет (класс IIA, уровень доказанности А).
В настоящее время основной причиной стеноза аортального клапана является его кальцинирование, обычно развивающееся с возрастом, в связи с чем со старением населения таких пациентов становится больше. У пациентов с критическим стенозом аортального клапана развивается компенсаторная гипертрофия левого желудочка,которая со временем из‑за ремоделирования ЛЖ переходит в сердечную недостаточность. Наблюдения за пациентами со стенозом аортального клапана показали, что риск смерти резко повышается при появлении у пациента при-знаков ХСН и / или синкопальных состояний. Для лече-ния стеноза аортального клапана широко используетсяоткрытая операция на сердце. Но такая операция сопря-жена с высоким риском, а у части пациентов ее проведе-ние невозможно в связи с крайне высоким операцион-ным риском. В связи с этим был разработан метод транс-катетерной имплантации аортального клапана (ТИАК).Для проверки безопасности и эффективности ТИАКбыло проведено МРКИ PARTNER [164]. Исследование состояло из двух частей: PARTNER B – сравнение ТИАК и медикаментозной терапии у пациентов, которым отказали в операции, и PARTNER А, в котором сравнивалась эффективность и безопасность ТИАК в сравнениис открытой операцией на сердце. По данным первого годанаблюдения, в PARTNER B риск общей смерти в группеТИАК был на 20 % ниже, чем в группе медикаментознойтерапии. По данным первого года наблюдения за пациен-тами в исследовании PARTNER A, риск смерти был одина-ков в двух группах пациентов, но риск инсульта и ТНМКбыл выше в группе ТИАК [165]. Между тем, по данным3-летнего наблюдения, было показано, что количествоинсультов и смертей в группах ТИАК и открытой опера-ции на сердце достоверно не отличалось [166].
Таким образом, показание к воздействию на аортальном клапане при его стенозе сводятся к следующему:A) Хирургическая замена аортального клапана должна быть рассмотрена у пациентов с критическим стенозом аортального клапана и возможностью проведения операции (класс рекомендаций IIA, уровень доказанности В). B) Проведение ТИАК должно быть рассмотрено у пациентов с критическим стенозом аортального клапана при невозможности проведения открытой операции из‑за высокого риска (класс рекомендацийIIA, уровень доказанности В). C) Проведение ТИАК может быть рассмотрено у паци-ентов с критическим стенозом аортального клапанапри высоком риске проведения открытой операциина сердце (класс рекомендаций IIB, уровень дока-занности В).
При недостаточности клапанов оперативное лечениетакже является средством выбора, даже при относитель-ной недостаточности митрального клапана (МК) у боль-ных с дилатационной кардиомиопатией [163, 167]. Хотяв случаях аортальной и митральной недостаточноститерапия артериолярными вазодилататорами (гидрала-зин, нифедипин) может уменьшать степень регургитациии структурных изменений камер сердца на предопераци-онном этапе лечения (уровень доказанности В) [168–171].
В последнее время для коррекции митральнойрегургитации у пациентов с выраженной симпто-матической митральной регургитацией (MR ≥3+),у которых риск кардиохирургических вмешательств на открытом сердце оценен как слишком высокий,применяется эндоваскулярная методика MitraClip®Clip Delivery System. В исследовании EVEREST II[172], сравнивавшем хирургический метод коррекциинедостаточности МК у больных с выраженной сим-птоматической митральной регургитацией и эндо-васкулярное вмешательство с помощью MitraClip®Clip Delivery System, было показано, что несмотряна менее выраженный уровень коррекции митральнойрегургитации, эффект в отношении процессов ремо-делирования ЛЖ был сравним с группой хирургиче-ского лечения; количество осложнений при исполь-зовании MitraClip® Clip Delivery System было ниже,чем при оперативных вмешательствах.
Следует отметить, что коррекция митральной регур-гитации при относительной недостаточности МКнередко успешно происходит на фоне ресинхронизиру-ющей терапии.
Что касается относительной недостаточности три-куспидального клапана (ТК), то ее хирургическоелечение возможно только в ходе оперативного вмеша-тельства по поводу органической недостаточности МК.При систолической ХСН пластику ТК не проводят,а медикаментозное лечение в таких случаях основанона комбинированной терапии диуретиками. Пациентс систолической ХСН III–IV ФК и ФВ ЛЖ менее 30 %,имеющий выраженную регургитацию на МК и ТК, явля-ется кандидатом на трансплантацию сердца.
Другие ФР
Специальных исследований по профилактике ХСНс помощью ограничения курения и приема алкоголяили снижения массы тела не проводилось, поэтому уро-вень доказанности этих мероприятий не превышаетстепени доказанности С. В то же время имеются сведе-ния о прямой зависимости ожирения и развития ХСН[173]. Это позволяет рекомендовать снижение ИМТниже 30 кг / м2 всем пациентам с риском декомпенса-ции сердечной деятельности. Причем в России эта про-блема приобретает особое значение, т. к. число больныхс ожирением возрастает параллельно увеличению ФКХСН [174].
Еще более опасной выглядит связь приема алкоголяс развитием ХСН, в особенности неишемической этио-логии [175, 176]. Поэтому больным с риском развитияХСН необходимо рекомендовать строгий отказ от при-ема алкоголя, что особенно важно в реальных российскихусловиях [174].
Также не вызывает никаких сомнений рекомендацияпо отказу от курения в качестве профилактики развитияХСН у пациентов с множественными ФР, хотя специальных исследований относительно связи отказа от куренияи развития ХСН не проводилось.
10. Немедикаментозное лечение ХСН
Для всех немедикаментозных методов лечения боль-ных ХСН уровень доказанности является низким и опи-рается на результаты отдельных, хотя и довольно много-численных контролируемых исследований (уровень С).10.1. Диета больных ХСН
На сегодняшний день рекомендации по диете боль-ных ХСН носят весьма конкретный характер.
Ограничение потребления соли
При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее сим-птомы болезни и застойные явления:
A) I ФК – не употреблять соленой пищи (до 3 г NaCl);
B) II ФК – плюс не досаливать пищу (до 1,5 г NaCl);
C) III ФК – плюс продукты с уменьшенным содержани-ем соли и приготовление без соли (<1,0 г NaCl).
D) Необходимо помнить, что диета со значимым ограничением натрия (1,8 г / день – 4,5 г соли), особеннона фоне агрессивной диуретической терапии, можетдаже достоверно увеличивать риск общей смертии повторных госпитализаций в связи с обострением ХСН [177]. Так что во всем нужна мера.10.1.2. Ограничение потребления жидкости.
Ограничение потребления жидкости актуально толь-ко в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в / в введения диуретиков.В обычных ситуациях объем жидкости не рекомендуетсяувеличивать более 2 л / сутки (минимум приема жидко-сти – 1,5 л / сут).10.1.3. Контроль массы тела.
Пища должна быть калорийной, легко усваиваться,с достаточным содержанием витаминов, белка.
Прирост веса >2 кг за 1–3 дня, скорее всего, свиде-тельствует о задержке жидкости в организме и риске раз-вития декомпенсации!
Сегодня контроль массы тела пациентов с ХСН или контроль трофологического статуса приобретаетважнейшее значение.
Трофологический статус – понятие, характеризующеесостояние здоровья и физического развития организма,связанное с питанием.
Необходимо различать следующие патологическиесостояния пациентов с ХСН: ожирение, избыточный вес,нормальный вес, кахексия. Наличие ожирения или избыточного веса ухудшает прогноз больного ХСН, и во всехслучаях ИМТ более 25 кг / м2 требует специальных мери ограничения калорийности питания.
Патологическая потеря массы тела (явные или субклинические признаки обнаруживаются у 50 % больныхХСН). Прогрессивное уменьшение массы тела, обуслов-ленное потерей как жировой ткани, так и мышечноймассы называется сердечной кахексией. Клиницист верифицирует патологическую потерю массы тела во всехслучаях: документированной непреднамеренной потеримассы тела на 5 и более кг или более чем на 7,5 % от исходной (вес без отеков, т. е. вес пациента в компенсированном состоянии) массы тела за 6 месяцев [175, 176];при исходном ИМТ менее 19 кг / м2.
Индекс массы тела рассчитывается, какИМТ = масса тела (кг) /(рост, м).
Развитие кахексии, как правило, свидетельствуето критической активации нейрогормональных систем(в первую очередь ренин-ангиотензин-альдостероновой),задействованных в прогрессировании декомпенсациии неадекватном росте активности цитокинов (преждевсего фактора некроза опухоли-α) [178–180]. В лечениитаких больных необходимым является сочетание медика-ментозной коррекции нейрогормональных расстройств(степень доказанности А), блокады цитокинов (степеньдоказанности С) и нутритивной поддержки (степеньдоказанности С), (приложение 2) [181–185].
Алкоголь
Алкоголь строго запрещен для больных с алкогольной кардиопатией.
У пациентов с ишемическим генезомХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальныхбольных ХСН ограничение приема алкоголя имеет видобычных рекомендаций, хотя по возможности следуетограничивать применение больших объемов (например,пива) [186, 187].
Режим физической активности
Сегодня очевидно, что покой не показан всем боль-ным ХСН вне зависимости от стадии заболевания.Физическая реабилитация рекомендуется всем пациен-там с I–IV ФК ХСН. Единственным требованием можносчитать стабильное течение ХСН, когда нет необходимо-сти в экстренном приеме мочегонных и внутривенномвведении вазодилататоров и положительных инотроп-ных средств [188].
Физическая реабилитации противопоказана при:
A) активном миокардите,
B) стенозе клапанных отверстий,
C) цианотических врожденных пороках,
D) нарушениях ритма высоких градаций,
E) приступах стенокардии у пациентов с низкой ФВ ЛЖ.
Основным для выбора режима нагрузок являетсяопределение исходной толерантности при помощи теста6-мин. ходьбы (рис. 2), (приложение 3). Проведение курсов физических тренировок сроком от 3 мес позволяетувеличить толерантность и максимальное потреблениекислорода до 33 %! При этом доказано восстановлениеструктуры и функции скелетной мускулатуры у боль-ных ХСН. При проведении нагрузок пациенты лучшереагируют на проводимую терапию. Доказано влияниефизической реабилитации на прогноз декомпенсирован-ных больных [128, 129]. Учитывая, что положительныйэффект физических тренировок исчезает через 3 неделипосле введения ограничения физических нагрузок – вве-дение физических нагрузок в длительную (пожизненную) программу ведения пациента с ХСН является необ-ходимым стандартом.
Рисунок 2. Алгоритм проведенияфизических нагрузок у больных ХСН
7. Оценка прогноза
При СН многие клинические и инструментальные показатели имеют прогностическое значение(таблица 11). Большинство из этих показателей просты, и их можно определить очень быстро (такие как пол, возраст, причина СН, ФК, определение ФВЛЖ, наличие сопутствующих заболеваний, определение уровня натрийуретических гормонов) [93–99].Оценка прогноза имеет первостепенное значениепри решении вопроса об имплантации внутрисердечных устройств и проведения оперативного лечения,а также при выборе тактики ведения больного с тер-минальной СН.
8. Лечение и профилактика ХСН
Можно сформулировать 6 очевидных задач при лечении ХСН:
A) предотвращение развития симптомной ХСН (дляI стадии ХСН);
B) устранение симптомов ХСН (для стадий IIA–III),
C) замедление прогрессирования болезни путем защи-ты сердца и других органов–мишеней (мозг, почки,сосуды) (для стадий I–III);
D) улучшение качества жизни (для стадий IIA–III);
E) уменьшение количества госпитализаций (и расходов)(для стадий I–III);
F) улучшение прогноза (для стадий I–III).
При постановке диагноза бессимптомной дисфункции ЛЖ (I стадия ХСН) главной целью является недопущение развития клинически выраженных симптомов декомпенсации.
Конечно, когда мы имеем дело с симптомной ХСН,главная задача на начальном этапе лечения – избавить больного от тягостных симптомов (одышки, удушья,отеков): дать возможность просто лежать, спать, отдыхать. Однако если ограничиться лишь этой начальнойцелью, например, применить эффективные диуретикив виде курса терапии, то у такого пациента уже черезнесколько дней (недель) вновь проявятся признакитяжелой декомпенсации, требующие интенсивнойтерапии.
Поэтому важнейшее значение приобретает замедление прогрессирования ХСН, связанное с защитой органов–мишеней, прежде всего сердца, от прогрессирующих патологических изменений (ремоделирования).А поскольку ХСН – это системный процесс, при кото-ром происходит ремоделирование не только сердца,но и почек, сосудов, мышц и т. д., мы говорим именноо системной защите органов–мишеней.
Сегодня Европейское общество кардиологов ориен-тирует каждого врача, лечащего ХСН, ответить на вопрос о назначении того или иного вида терапии: «Зачем я это делаю?» Предполагается, что ответ должен содержатьсяво второй и третьей из поставленных целей – либо добиваюсь устранения симптомов болезни, либо достигаюзамедления прогрессирования болезни. Если врач не спо-собен отнести назначаемое лечение ни к одной из этихкатегорий, возникает вопрос о целесообразности такоговида терапии ХСН.
Естественно, что применяемое лечение, кроме объективной эффективности, должно хорошо субъективно переноситься больными, улучшать или, по крайней мере,не ухудшать качество их жизни. Этот аспект определя-ет и приверженность пациентов с ХСН к проводимымпроцедурам, без которой невозможно рассчитыватьна успешную борьбу с синдромом декомпенсации.
Уменьшение числа госпитализаций имеет двоякийсмысл. Во-первых, это свидетельствует о стабильномтечении заболеваний и отсутствии экстренных деком-пенсаций, требующих повторных обращений к врачу.С другой стороны, госпитализации вносят основнойвклад в структуру затрат на лечение ХСН. По результатамроссийской программы ФАСОН (2001), подтвердилисьданные Института здоровья США о том, что лечениеХСН – это крайне дорогостоящее дело. В России (данныепо 30 городам, участвовавшим в программе ФАСОН)затраты на типичного больного ХСН в 2001 году состав-ляли 45 рублей / сут [100]. При примерной распро-страненности ХСН в России, равной 7 % (исследованиеЭПОХА–ХСН, госпитальный этап, 2006 г.), речь идето более чем 7 млн. человек и затратах в 118 млрд. руб / год.Причем в России почти 62,5 % этой суммы приходитсяна оплату именно госпитального лечения. В США сооб-щается о затратах до 38 млрд. долл. / год [101].
Наконец, последняя и, может быть, самая важная, хотяодновременно и самая трудная задача при лечении ХСН –это продление жизни пациентов, поскольку, как следуетиз предыдущего раздела рекомендаций, декомпенсациясердца является болезнью с крайне плохим прогнозом,и средняя продолжительность жизни больных не превышает 5 лет [102].
Перефразируя рекомендации Европейского обществакардиологов, можно сказать: любой применяемый видлечения ХСН должен помочь достижению, по крайней мере,двух любых из 6 основных целей борьбы с болезнью [1].
Существует шесть путей достижения поставленныхцелей при лечении декомпенсации:
A) диета,
B) режим физической активности,
C) психологическая реабилитация, организация врачебного контроля, школ для больных ХСН,
D) медикаментозная терапия,E) электрофизиологические методы терапии,
F) хирургические, механические методы лечения.
Как видим, медикаментозное лечение представляет собой хотя и очень важную составляющую, но находящуюся в этом списке на четвертой позиции. Игнорированиенемедикаментозных методов борьбы с ХСН затрудняетдостижение конечного успеха и снижает эффективностьлечебных (медикаментозных) воздействий.
Для оценки степени доказанности каждого из предлагаемых методов лечения Европейским обществом кардиологов предложена трехбалльная шкала. Применениепредлагаемого метода абсолютно доказано, по меньшеймере, в двух независимых крупных контролируемыхисследованиях – это степень доказанности А.
Если эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследова-нии или если результаты исследований противоречивы,то есть требуются дополнительные исследования – степень доказанности снижается и обозначается как В.
Когда рекомендации по лечению базируются на результатах отдельных, пусть и положительных, иссле-дований и приближаются к эмпирике, т. е. строго пола-гаться на них трудно, это самая низкая степень доказанности – С.
Кроме того, выделяются классы рекомендаций:
I –лечение показано всем;
IIA – лечение, скорее, показано;
IIB – лечение, скорее, противопоказано;
III – лечениестрого противопоказано.
Учитывая, что ХСН является одним из заключи-тельных этапов сердечно-сосудистого континуума(или непрерывного развития ССЗ), а также осложнением большинства болезней сердца, успешное лечениеэтих заболеваний можно рассматривать, как профилактику развития декомпенсации сердечной деятельности.По классификации ХСН (или, вернее, классификации континуума), предложенной АКК / ААС (2005), выделены четыре стадии, первая из которых (стадия А) относится к той ситуации, когда еще не имеется дисфункции сердца и, тем более, не наступило развитие самой клинически выраженной декомпенсации сердечной деятельности. Поэтому, признавая важность профилактикии лечения основных ФР ХСН, как предтечи развитиядекомпенсации сердечной деятельности,необходимоконстатировать, что эти аспекты остаются за рамкаминастоящих рекомендаций. Задача данного документа –представить алгоритмы диагностики и лечения собственноХСН.
Период В (бессимптомная дисфункция ЛЖ) в Американскойклассификации соответствует I стадии ХСНпо классификации ОССН 2002 года, период С (клинически выраженная ХСН) соответствует II стадии по клас-сификации ОССН 2002 года, и здесь в Российскойклассификации выделены периоды IIA и IIБ (начальнаяи клинически выраженная ХСН). Наконец, стадия Dв Американской классификации, относящаяся к финаль-ной стадии ХСН, соответствует III стадии болезнипо классификации ОССН 2002 года.
9. Профилактика ХСН
Учитывая все большую распространенность ХСН в мире, в том числе и в Российской Федерации, крайнюю тяжесть и злокачественность течения этого синдрома, а также принимая во внимание колоссальные затраты на его лечение, следует обратить особое внимание на проблему профилактики развития ХСН. В отличие от Американской коллегии кардиологов и Американской ассоциации сердца настоящий раздел не призван заменить соответствующие руководства по борьбе с ФР ССЗ. Наша цель – лишь заострить вни-мание на важности предотвращения поражения сердцаи развития симптомов ХСН в случае успешного лечениясоответствующих патологических состояний.
Современный взгляд на проблему предполагает нали-чие возросшей роли комбинации различных факторов,которые способны многократно увеличивать риск разви-тия ИМ и ХСН [103]. Сочетание АГ, ожирения, котороесущественно увеличивается, в том числе и в российскойпопуляции, инсулинорезистентности, дислипидемии,нередко определяемое, как метаболический синдром,является основой развития многих ССЗ, включая ХСН.Обратимся к наиболее очевидным фактам, подтвержда-ющим успешное предотвращение ХСН при нивелирова-нии основных ФР.
Артериальная гипертония
Как известно, повышенное АД является самой частойпричиной развития ХСН. Это было продемонстриро-вано как в США [104], так и в Европе [30]. В России,по результатам эпидемиологических и когортных иссле-дований последних лет, повышенное АД ассоциируетсяс развитием ХСН не менее чем в 80 % случаев, что отра-жает малую эффективность лечения АГ [12, 105].Во Фрамингемском исследовании наличие САД более140 мм рт. ст. ассоциировалось с 4-кратным повышени-ем риска развития ХСН [106]. Соответственно посту-латом можно считать тот факт, что успешное лечение АГ – это наиболее эффективная профилактика развитияХСН (класс IIA, уровень доказанности А). Это доказа-но как для систолической, так и диастолической АГ [107,108]. Нормализация АД позволяет на 50 % снижать рискразвития ХСН [109]. В исследовании VALUE снижениеАД ниже 140 / 90 мм рт. ст. сопровождалось достовернымуменьшением риска развития ХСН на 36 %, независимоот характера антигипертензивного лечения [110].
Среди препаратов для лечения АГ, позволяющихэффективнопредотвращать развитие ХСН, можно выде-лить иАПФ, АРА, β-АБ, диуретики и их комбинации,в то время как использование блокаторов кальциевых кана-лов и α-АБ выглядит менее предпочтительным [111–113].
Исследования последних лет выявили, что и вну-три классов имеются различия в действии разных пре-паратов. Так, в исследовании PROFESS, АРА телми-сартан не продемонстрировалспособности снижатьриск ХСН [114].
Наиболее ярким обоснованием успешной профилак-тики ХСН у пациентов с повышенным АД даже в самыхстарших возрастных группах (свыше 80 лет) можно счи-тать результаты исследования HYVET, в котором лечениетиазидоподобным диуретиком индапамидом и его ком-бинацией с иАПФ периндоприлом снижало риск разви-тия ХСН на 64 % [115].
Особенно важен контроль АД у больных, перенесшихострый ИМ, у пациентов с наличием гипертрофии ЛЖ,перенесенным инсультом и другими осложнениями, т. к.это наиболее обоснованный способ предотвращенияразвития ХСН [108, 116–119]. Более подробно с прин-ципами диагностики и лечения АГ можно ознакомитьсяв соответствующих рекомендациях РКО [120, 121].
Лечение ИБС
Лечение пациентов с ИБС, которая является вто-рым по значимости ФР ХСН, также крайне важно в плане профилактики ХСН [15, 105]. В настоящем разделеречь идет о пациентах с ИБС, не имеющих структурныхизменений сердца(с нормальной ФВ ЛЖ). Следует подчеркнуть, что отсутствуют данные о профилактике ХСНс помощью трех классов лекарств, наиболее часто при-меняемых для лечения стенокардии – нитратов, β-АБи блокаторов медленных кальциевых каналов (классрекомендаций III, уровень доказанности А). В то же вре-мя имеются неопровержимые доказательства предотвра-щения ХСН при применении различных иАПФ (классрекомендаций I, уровень доказанности А). Это касаетсяв первую очередь периндоприла, т. к. одной из конечныхточек исследования EUROPA являлось предотвращениеразвития ХСН [122]. Во вторую очередь – рамиприла,поскольку успешная профилактика ХСH в исследованииHOPE не предполагалась заранее [123].
Телмисартан в исследованиях ONTARGETи TRANSCEND, а также ирбесартан в протоколеI–PRESERVE не показали способности к снижениюриска ХСН у больных ИБС, в том числе и при ХСН–ССФ [124–126].
После перенесенного острого ИМ в качестве профи-лактики ремоделирования сердца и развития ХСН можноиспользовать различные нейрогормональные модулято-ры β-АБ [127, 128], иАПФ [129–131], АРА [132] и анта-гонисты альдостерона [133]. Причем сочетание β-АБс блокадой ренин-ангиотензиновой системы увеличиваетэффект терапии [132, 134].
Сведений о профилактике ХСН при применении аспи-рина у больных, перенесших ОИМ, и тем более у паци-ентов с хроническими формами ИБС нет. Напротив, егоиспользование может приводить к росту числа госпита-лизаций в связи с обострением ХСН (класс рекоменда-ций IIA, уровень доказанности В) [135, 136].
Еще одним важнейшим средством профилактикиХСН у больных с различными формами ИБС являютсястатины, что доказано в исследованиях с симвастатиноми правастатином [137–139]. Сегодня статины реко-мендуются в качестве профилактики ХСН у пациентовс коронарной болезнью сердца (класс рекомендацийIIA, уровень доказанности А). О возможности примене-ния статинов в лечении ХСН будет сказано ниже в соот-ветствующем разделе. Более подробно ознакомитьсяс принципами лечения коронарной болезни сердца мож-но в соответствующих рекомендациях РКО по лечениюИБС и по лечению дислипидемий [140–142].
Сахарный диабет
Нет сомнений, что наличие СД и даже просто инсу-линорезистентность предрасполагают к развитию ХСН,причем в максимальной степени увеличение риска отме-чается у женщин [143, 144]. Сочетание ХСН с СД усу-губляет неблагоприятный прогноз пациентов [145–147].Поэтому успешное лечение пациентов с СД и его ослож-нениями позволяет существенно уменьшать риск раз-вития ХСН (класс IIA, уровень доказанности А) [117,148–151]. Необходимо отметить важность контроляуровня гликемии с использованием препаратов, улучша-ющих чувствительность тканей к инсулину, в частности,метформина (класс IIA, уровень доказанности В) [152].
Мета-анализы последних лет показывают достовер-ное преимущество метформина в профилактике ХСНу больных СД и в лечении больных с сочетанием ХСНи СД перед другими сахароснижающими средствами[153, 154]. Не было отмечено и достоверного роста случаев лактоацидоза, что привело в США к отмене ограни-чений по использованию метформина у больных ХСН.Положительные результаты лечения больных с сочета-нием ХСН и СД метформином были получены в россий-ском проспективном исследовании РЭМБО [155].
Среди основных средств лечения ХСН преимуществоимеют иАПФ и АРА, которые уменьшают риск развитиядиабета, с одной стороны, и уменьшают шансы на разви-тие ХСН у больных СД [156]. В то же время применениеβ-АБ и диуретиков может ухудшать течение СД (классрекомендаций IIB, уровень доказанности В) [117, 157].Учитывая, что положительные эффекты β-АБ при СДсохраняются, отказываться от такой терапии у больных,перенесших ОИМ и имеющих симптомы ХСН, нецелесообразно [158]. В данном случае выбор должен бытьсделан в пользу бисопролола, не ухудшающего чувстви-тельности тканей к инсулину [159], или карведилола,снижающего инсулинорезистентность [160]. Карведилол имеет достоверное преимущество перед метопрололомпо контролю уровня сахара, а также по снижению рискапрогрессирования диабета и появления новых случаев диабета у больных с уже развившейся ХСН (класс рекомендаций IIA, cтепень доказанности B) [161, 162].
Клапанные пороки сердца
Одна из наиболее обсуждаемых в России проблем в связи с ХСН – определение типа расстройств гемодинамики и вариантов лечения больных с клапанными порока-ми сердца. Хотя никаких реальных обсуждений тут бытьне может. Стенозы клапанов, приводящие к перегрузкедавлением, перенапряжению стенок вышележащих отде-лов сердца и их гипертрофии, требуют обязательногохирургического лечения, независимо от степени изме-нения гемодинамики и выраженности симптомов ХСН[163]. Никаких терапевтических (медикаментозных) альтернатив для больных стенозом митрального и аорталь-ного клапана нет (класс IIA, уровень доказанности А).
В настоящее время основной причиной стеноза аортального клапана является его кальцинирование, обычно развивающееся с возрастом, в связи с чем со старением населения таких пациентов становится больше. У пациентов с критическим стенозом аортального клапана развивается компенсаторная гипертрофия левого желудочка,которая со временем из‑за ремоделирования ЛЖ переходит в сердечную недостаточность. Наблюдения за пациентами со стенозом аортального клапана показали, что риск смерти резко повышается при появлении у пациента при-знаков ХСН и / или синкопальных состояний. Для лече-ния стеноза аортального клапана широко используетсяоткрытая операция на сердце. Но такая операция сопря-жена с высоким риском, а у части пациентов ее проведе-ние невозможно в связи с крайне высоким операцион-ным риском. В связи с этим был разработан метод транс-катетерной имплантации аортального клапана (ТИАК).Для проверки безопасности и эффективности ТИАКбыло проведено МРКИ PARTNER [164]. Исследование состояло из двух частей: PARTNER B – сравнение ТИАК и медикаментозной терапии у пациентов, которым отказали в операции, и PARTNER А, в котором сравнивалась эффективность и безопасность ТИАК в сравнениис открытой операцией на сердце. По данным первого годанаблюдения, в PARTNER B риск общей смерти в группеТИАК был на 20 % ниже, чем в группе медикаментознойтерапии. По данным первого года наблюдения за пациен-тами в исследовании PARTNER A, риск смерти был одина-ков в двух группах пациентов, но риск инсульта и ТНМКбыл выше в группе ТИАК [165]. Между тем, по данным3-летнего наблюдения, было показано, что количествоинсультов и смертей в группах ТИАК и открытой опера-ции на сердце достоверно не отличалось [166].
Таким образом, показание к воздействию на аортальном клапане при его стенозе сводятся к следующему:A) Хирургическая замена аортального клапана должна быть рассмотрена у пациентов с критическим стенозом аортального клапана и возможностью проведения операции (класс рекомендаций IIA, уровень доказанности В). B) Проведение ТИАК должно быть рассмотрено у пациентов с критическим стенозом аортального клапана при невозможности проведения открытой операции из‑за высокого риска (класс рекомендацийIIA, уровень доказанности В). C) Проведение ТИАК может быть рассмотрено у паци-ентов с критическим стенозом аортального клапанапри высоком риске проведения открытой операциина сердце (класс рекомендаций IIB, уровень дока-занности В).
При недостаточности клапанов оперативное лечениетакже является средством выбора, даже при относитель-ной недостаточности митрального клапана (МК) у боль-ных с дилатационной кардиомиопатией [163, 167]. Хотяв случаях аортальной и митральной недостаточноститерапия артериолярными вазодилататорами (гидрала-зин, нифедипин) может уменьшать степень регургитациии структурных изменений камер сердца на предопераци-онном этапе лечения (уровень доказанности В) [168–171].
В последнее время для коррекции митральнойрегургитации у пациентов с выраженной симпто-матической митральной регургитацией (MR ≥3+),у которых риск кардиохирургических вмешательств на открытом сердце оценен как слишком высокий,применяется эндоваскулярная методика MitraClip®Clip Delivery System. В исследовании EVEREST II[172], сравнивавшем хирургический метод коррекциинедостаточности МК у больных с выраженной сим-птоматической митральной регургитацией и эндо-васкулярное вмешательство с помощью MitraClip®Clip Delivery System, было показано, что несмотряна менее выраженный уровень коррекции митральнойрегургитации, эффект в отношении процессов ремо-делирования ЛЖ был сравним с группой хирургиче-ского лечения; количество осложнений при исполь-зовании MitraClip® Clip Delivery System было ниже,чем при оперативных вмешательствах.
Следует отметить, что коррекция митральной регур-гитации при относительной недостаточности МКнередко успешно происходит на фоне ресинхронизиру-ющей терапии.
Что касается относительной недостаточности три-куспидального клапана (ТК), то ее хирургическоелечение возможно только в ходе оперативного вмеша-тельства по поводу органической недостаточности МК.При систолической ХСН пластику ТК не проводят,а медикаментозное лечение в таких случаях основанона комбинированной терапии диуретиками. Пациентс систолической ХСН III–IV ФК и ФВ ЛЖ менее 30 %,имеющий выраженную регургитацию на МК и ТК, явля-ется кандидатом на трансплантацию сердца.
Другие ФР
Специальных исследований по профилактике ХСНс помощью ограничения курения и приема алкоголяили снижения массы тела не проводилось, поэтому уро-вень доказанности этих мероприятий не превышаетстепени доказанности С. В то же время имеются сведе-ния о прямой зависимости ожирения и развития ХСН[173]. Это позволяет рекомендовать снижение ИМТниже 30 кг / м2 всем пациентам с риском декомпенса-ции сердечной деятельности. Причем в России эта про-блема приобретает особое значение, т. к. число больныхс ожирением возрастает параллельно увеличению ФКХСН [174].
Еще более опасной выглядит связь приема алкоголяс развитием ХСН, в особенности неишемической этио-логии [175, 176]. Поэтому больным с риском развитияХСН необходимо рекомендовать строгий отказ от при-ема алкоголя, что особенно важно в реальных российскихусловиях [174].
Также не вызывает никаких сомнений рекомендацияпо отказу от курения в качестве профилактики развитияХСН у пациентов с множественными ФР, хотя специальных исследований относительно связи отказа от куренияи развития ХСН не проводилось.
10. Немедикаментозное лечение ХСН
Для всех немедикаментозных методов лечения боль-ных ХСН уровень доказанности является низким и опи-рается на результаты отдельных, хотя и довольно много-численных контролируемых исследований (уровень С).10.1. Диета больных ХСН
На сегодняшний день рекомендации по диете боль-ных ХСН носят весьма конкретный характер.
Ограничение потребления соли
При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее сим-птомы болезни и застойные явления:
A) I ФК – не употреблять соленой пищи (до 3 г NaCl);
B) II ФК – плюс не досаливать пищу (до 1,5 г NaCl);
C) III ФК – плюс продукты с уменьшенным содержани-ем соли и приготовление без соли (<1,0 г NaCl).
D) Необходимо помнить, что диета со значимым ограничением натрия (1,8 г / день – 4,5 г соли), особеннона фоне агрессивной диуретической терапии, можетдаже достоверно увеличивать риск общей смертии повторных госпитализаций в связи с обострением ХСН [177]. Так что во всем нужна мера.10.1.2. Ограничение потребления жидкости.
Ограничение потребления жидкости актуально толь-ко в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в / в введения диуретиков.В обычных ситуациях объем жидкости не рекомендуетсяувеличивать более 2 л / сутки (минимум приема жидко-сти – 1,5 л / сут).10.1.3. Контроль массы тела.
Пища должна быть калорийной, легко усваиваться,с достаточным содержанием витаминов, белка.
Прирост веса >2 кг за 1–3 дня, скорее всего, свиде-тельствует о задержке жидкости в организме и риске раз-вития декомпенсации!
Сегодня контроль массы тела пациентов с ХСН или контроль трофологического статуса приобретаетважнейшее значение.
Трофологический статус – понятие, характеризующеесостояние здоровья и физического развития организма,связанное с питанием.
Необходимо различать следующие патологическиесостояния пациентов с ХСН: ожирение, избыточный вес,нормальный вес, кахексия. Наличие ожирения или избыточного веса ухудшает прогноз больного ХСН, и во всехслучаях ИМТ более 25 кг / м2 требует специальных мери ограничения калорийности питания.
Патологическая потеря массы тела (явные или субклинические признаки обнаруживаются у 50 % больныхХСН). Прогрессивное уменьшение массы тела, обуслов-ленное потерей как жировой ткани, так и мышечноймассы называется сердечной кахексией. Клиницист верифицирует патологическую потерю массы тела во всехслучаях: документированной непреднамеренной потеримассы тела на 5 и более кг или более чем на 7,5 % от исходной (вес без отеков, т. е. вес пациента в компенсированном состоянии) массы тела за 6 месяцев [175, 176];при исходном ИМТ менее 19 кг / м2.
Индекс массы тела рассчитывается, какИМТ = масса тела (кг) /(рост, м).
Развитие кахексии, как правило, свидетельствуето критической активации нейрогормональных систем(в первую очередь ренин-ангиотензин-альдостероновой),задействованных в прогрессировании декомпенсациии неадекватном росте активности цитокинов (преждевсего фактора некроза опухоли-α) [178–180]. В лечениитаких больных необходимым является сочетание медика-ментозной коррекции нейрогормональных расстройств(степень доказанности А), блокады цитокинов (степеньдоказанности С) и нутритивной поддержки (степеньдоказанности С), (приложение 2) [181–185].
Алкоголь
Алкоголь строго запрещен для больных с алкогольной кардиопатией.
У пациентов с ишемическим генезомХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальныхбольных ХСН ограничение приема алкоголя имеет видобычных рекомендаций, хотя по возможности следуетограничивать применение больших объемов (например,пива) [186, 187].
Режим физической активности
Сегодня очевидно, что покой не показан всем боль-ным ХСН вне зависимости от стадии заболевания.Физическая реабилитация рекомендуется всем пациен-там с I–IV ФК ХСН. Единственным требованием можносчитать стабильное течение ХСН, когда нет необходимо-сти в экстренном приеме мочегонных и внутривенномвведении вазодилататоров и положительных инотроп-ных средств [188].
Физическая реабилитации противопоказана при:
A) активном миокардите,
B) стенозе клапанных отверстий,
C) цианотических врожденных пороках,
D) нарушениях ритма высоких градаций,
E) приступах стенокардии у пациентов с низкой ФВ ЛЖ.
Основным для выбора режима нагрузок являетсяопределение исходной толерантности при помощи теста6-мин. ходьбы (рис. 2), (приложение 3). Проведение курсов физических тренировок сроком от 3 мес позволяетувеличить толерантность и максимальное потреблениекислорода до 33 %! При этом доказано восстановлениеструктуры и функции скелетной мускулатуры у боль-ных ХСН. При проведении нагрузок пациенты лучшереагируют на проводимую терапию. Доказано влияниефизической реабилитации на прогноз декомпенсирован-ных больных [128, 129]. Учитывая, что положительныйэффект физических тренировок исчезает через 3 неделипосле введения ограничения физических нагрузок – вве-дение физических нагрузок в длительную (пожизненную) программу ведения пациента с ХСН является необ-ходимым стандартом.
Рисунок 2. Алгоритм проведенияфизических нагрузок у больных ХСН
 Для пациентов, прошедших менее 150 м, т. е. находя-щихся в III–IV ФК, а также имеющих выраженный дефи-цит массы тела, кахексию, общепринятые физические нагрузки не показаны (по крайней мере, на начальном этапе). В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тре-нировки мышц вдоха и выдоха. Для тренировок используются дыхательные тренажеры с созданием дополни-тельного сопротивления на вдохе и выдохе (тренажерыThreshold IMT и Threshold PEP, дыхательный тренажерФролова и др.) [189, 190], (приложение 4).
Доказано, что через 3–4 недели регулярные физи-ческие нагрузки в форме дыхательных упражненийс затрудненным выдохом приводят к системному влияниюна организм. Увеличивается толерантность к физическимнагрузкам, улучшается качество жизни, замедляется про-грессия кахексии, улучшается течение ХСН, достовернозамедляется прогрессирование заболевания [191, 192].
При стабилизации состояния пациента необходимоповторить тест 6-мин. ходьбы. Дальнейшая тактика зави-сит от полученных результатов (рис. 3). Если пройденноерасстояние менее 200 м, то пациентам рекомендуетсяпродолжить дыхательные упражнения. Если пройденное расстояние более 200 м, то целесообразно рекомен-довать физические нагрузки в виде ходьбы. Ухудшениесостояния (усиление одышки, тахикардия, прогрессияусталости, снижение общей массы тела) является основа-нием для перехода на предыдущую ступень либо возвра-та к дыхательным упражнениям. Полный отказ от физи-ческих нагрузок нежелателен и должен рассматриваться, как крайняя мера. Для пациентов, прошедших за 6 мин.хотя бы 350 м, показаны динамические нагрузки (преждевсего в виде ходьбы) [193].
Метод усиленной наружной контрпульсации (УНКП)может быть рекомендован, как дополнительный метод лече-ния пациентов с ХСН II–III ФК в период полной компен-сации на оптимальной медикаментозной терапии (классрекомендаций IIB). По данным исследования PEECH [194]и небольших пилотных работ [195, 196], применение этогометода у больных ХСН увеличивает толерантность к физи-ческим нагрузкам и улучшает качество жизни.
Рисунок 3. Объем физических нагрузокдля больных ХСН I–IV ФК
Для пациентов, прошедших менее 150 м, т. е. находя-щихся в III–IV ФК, а также имеющих выраженный дефи-цит массы тела, кахексию, общепринятые физические нагрузки не показаны (по крайней мере, на начальном этапе). В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тре-нировки мышц вдоха и выдоха. Для тренировок используются дыхательные тренажеры с созданием дополни-тельного сопротивления на вдохе и выдохе (тренажерыThreshold IMT и Threshold PEP, дыхательный тренажерФролова и др.) [189, 190], (приложение 4).
Доказано, что через 3–4 недели регулярные физи-ческие нагрузки в форме дыхательных упражненийс затрудненным выдохом приводят к системному влияниюна организм. Увеличивается толерантность к физическимнагрузкам, улучшается качество жизни, замедляется про-грессия кахексии, улучшается течение ХСН, достовернозамедляется прогрессирование заболевания [191, 192].
При стабилизации состояния пациента необходимоповторить тест 6-мин. ходьбы. Дальнейшая тактика зави-сит от полученных результатов (рис. 3). Если пройденноерасстояние менее 200 м, то пациентам рекомендуетсяпродолжить дыхательные упражнения. Если пройденное расстояние более 200 м, то целесообразно рекомен-довать физические нагрузки в виде ходьбы. Ухудшениесостояния (усиление одышки, тахикардия, прогрессияусталости, снижение общей массы тела) является основа-нием для перехода на предыдущую ступень либо возвра-та к дыхательным упражнениям. Полный отказ от физи-ческих нагрузок нежелателен и должен рассматриваться, как крайняя мера. Для пациентов, прошедших за 6 мин.хотя бы 350 м, показаны динамические нагрузки (преждевсего в виде ходьбы) [193].
Метод усиленной наружной контрпульсации (УНКП)может быть рекомендован, как дополнительный метод лече-ния пациентов с ХСН II–III ФК в период полной компен-сации на оптимальной медикаментозной терапии (классрекомендаций IIB). По данным исследования PEECH [194]и небольших пилотных работ [195, 196], применение этогометода у больных ХСН увеличивает толерантность к физи-ческим нагрузкам и улучшает качество жизни.
Рисунок 3. Объем физических нагрузокдля больных ХСН I–IV ФК
 Режим. Общие рекомендации
Вакцинация
Нет доказательств влияния вакцинации на исходы ХСН. Тем не менее использование вакцины против грип-па, пневмонии и гепатита В является целесообразным.
Путешествия
Не рекомендуется пребывание в условиях высокогорья, высоких температур, влажности. Желательнопроводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение отдается непро-должительным (до 2–2,5 часов) авиационным перелетам.Длительные перелеты чреваты обезвоживанием, усилени-ем отеков нижних конечностей и / или развитием тромбо-за глубоких вен голени. При любой форме путешествийпротивопоказано длительное вынужденное фиксирован-ное положение. Специально рекомендуется вставание,ходьба или легкая гимнастика каждые 30 минут.
Коррекция доз мочегонных при пребывании в нео-бычном для больного, прежде всего жарком и влажном(хуже всего – вместе) климате, носит обязательный, хотяи строго индивидуальный характер.
Курение
Строго и абсолютно однозначно не рекомендуетсявсем пациентам с ХСН.
Сексуальная активность
Вопросы сексуальной активности находятся в компетенции врача–сексопатолога. Врач–кардиолог пред-принимает усилия для предотвращения развития деком-пенсации ХСН. Как правило, улучшение течения деком-пенсации восстанавливает сниженные сексуальные §Рекомендациивозможности. Ограничения актуальны для больных ХСНIV ФК и носят общий характер:
A) избегать чрезмерного эмоционального напряжения;
B) в ряде случаев принимать нитраты сублингвальноперед половым актом;
C) применение виагры не противопоказано (за исключением сочетаний с длительно действующими нитратами);
D) для пациентов с ХСН I–III ФК риск развития деком-пенсации ХСН при регулярной половой активности носит весьма умеренный характер.
Распорядок дня
В таблице 14 представлен распорядок дня пациента с СН.
Режим. Общие рекомендации
Вакцинация
Нет доказательств влияния вакцинации на исходы ХСН. Тем не менее использование вакцины против грип-па, пневмонии и гепатита В является целесообразным.
Путешествия
Не рекомендуется пребывание в условиях высокогорья, высоких температур, влажности. Желательнопроводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение отдается непро-должительным (до 2–2,5 часов) авиационным перелетам.Длительные перелеты чреваты обезвоживанием, усилени-ем отеков нижних конечностей и / или развитием тромбо-за глубоких вен голени. При любой форме путешествийпротивопоказано длительное вынужденное фиксирован-ное положение. Специально рекомендуется вставание,ходьба или легкая гимнастика каждые 30 минут.
Коррекция доз мочегонных при пребывании в нео-бычном для больного, прежде всего жарком и влажном(хуже всего – вместе) климате, носит обязательный, хотяи строго индивидуальный характер.
Курение
Строго и абсолютно однозначно не рекомендуетсявсем пациентам с ХСН.
Сексуальная активность
Вопросы сексуальной активности находятся в компетенции врача–сексопатолога. Врач–кардиолог пред-принимает усилия для предотвращения развития деком-пенсации ХСН. Как правило, улучшение течения деком-пенсации восстанавливает сниженные сексуальные §Рекомендациивозможности. Ограничения актуальны для больных ХСНIV ФК и носят общий характер:
A) избегать чрезмерного эмоционального напряжения;
B) в ряде случаев принимать нитраты сублингвальноперед половым актом;
C) применение виагры не противопоказано (за исключением сочетаний с длительно действующими нитратами);
D) для пациентов с ХСН I–III ФК риск развития деком-пенсации ХСН при регулярной половой активности носит весьма умеренный характер.
Распорядок дня
В таблице 14 представлен распорядок дня пациента с СН.
 Психологическая реабилитация и создание школамбулаторного наблюдения для больных ХСН
Сегодня пациент с ХСН, выписывающийся из клини-ки или покидающий врача амбулаторной практики после устранения декомпенсации, должен, кроме рекомендаций по оптимальному медикаментозному лечению, иметь возможность контролировать свое состояние и быть под наблюдением специально обученного персонала. Этот своеобразный принцип диспансерного наблюдения имеет различные названия: мультидисциплинарного подхода в ведении больных ХСН или школы для больных с декомпенсацией, или клиник для больных ХСН, или домашнего сестринского контроля за больными с декомпенсацией. Но дело не в названиях, а в том, что задача врачей – обу-чить больного и его ближайших родственников приемамконтроля за течением ХСН, методам самопомощи и датьвозможность регулярного контакта со специалистамидля своевременной коррекции состояния и недопущения экстренных декомпенсаций.
Эпидемиологические исследования последних лет,включавшие больных ХСН в Западной Европе и США,показали, что несмотря на повсеместное внедрениево врачебную практику самых эффективных средств терапии ХСН смертность больных в течение года в этой популяции остается по-прежнему высокой [197–199].
Среди возможных причин такого несоответствиядоказанной высокой эффективности современныхпрепаратов и сохраняющегося в популяции высокогоуровня смертности больных ХСН особая роль отводится низкой приверженности пациентов предписан-ному терапевтическому режиму и отсутствию строгоговыполнения врачебных рекомендаций, касающихся диеты и образа жизни.
Целью обучения является помощь пациентам и их родственникам в получении информации о заболевании, при-обретении навыков самоконтроля, касающихся диетиче-ских рекомендаций, физической активности, строгогособлюдения режима медикаментозной терапии, наблю-дения за симптомами СН и обращения за медицинскойпомощью в случае их усиления [200].
С пациентами проводятся структурированные заня-тия по следующим темам:
A) Общая информация о ХСН,
B) Симптомы ХСН и принципы самоконтроля,
C) Диета при ХСН,
D) Медикаментозная терапия ХСН,
E) Физические нагрузки при ХСН.
Пациенты должны получать обучающие материалыпо самоконтролю (брошюра «Жизнь с СН», «Дневниксамоконтроля пациента с СН»). Обучающие материалыдолжны содержать сведения о диете, контроле веса, физи-ческой активности, правильном приеме препаратов и т. д.Целесообразно с пациентами группы осуществлять регу-лярные телефонные контакты: первый месяц после выпи-ски из стационара – еженедельно; еще 2 месяца – 1 разв 2 недели; далее – 1 раз в месяц. Во время телефонныхконтактов врач должен проводить контроль самочув-ствия пациента, отвечать на вопросы, при необходимо-сти приглашать на дополнительный визит или решатьвопрос о госпитализации пациента.
Первым крупным российским многоцентровымисследованием эффективности использования обученияи мониторинга пациентов с ХСН стало исследованиеШАНС (Школа и Амбулаторное Наблюдение больныхСН), организованное ОССН. В группе вмешательствастатистически достоверно увеличилась дистанция в ходепроведения 6-мин. теста, также отмечено улучшениекачества жизни и снижение ЧСС в покое. Главным ито-гом программы ШАНС явилось достоверное уменьше-ние количества повторных госпитализаций из-за декомпенсации и снижение смертности больных с 13 до 8,3 %(р=0,044). Это позволяет рекомендовать внедрениеметодики мультидисциплинарного воздействия на боль-ных ХСН в широкую медицинскую практику. Такой под-ход позволяет существенно снизить число повторныхгоспитализаций, затраты на лечение, а по данным некоторых авторов, даже снизить смертность больных ХСН.Однако последнее утверждение имеет низкую степеньдоказанности (степень доказанности В).
Медико-социальная работа
Медико-социальная работа в комплексном ведениибольного ХСН должна включать мероприятия социаль-но-медицинского, психолого-педагогического и социаль-но-правового характера.
Эти мероприятия выполняет квалифицированныйсоциальный работник, участвующий в оказании медико-социальной помощи больному. Такому специалисту целе-сообразно:
A) провести комплексную оценку социального статусабольного, а также оценку качества его жизни совмест-но с другими специалистами;
B) формировать у больного здоровый образ жизнис учетом состояния его здоровья;
C) обеспечить выбор режима физических нагрузоки организовать физическую активность пациента;
D) вести психологическое консультирование и психо-коррекционную работу;
E) организовать совместно с другими специалистамиработу школы для больных ХСН;
F) участвовать в медико-социальной экспертизе боль-ного, разработке, реализации и оценке результатовиндивидуальной программы реабилитации;
G) провести социально-правовое консультированиепо вопросам прав больного на получение медико-социальной помощи, включая выплату пенсий, посо-бий и льгот на получение различных видов помощи;
H) организовать социальное обслуживание больно-го на дому;
I) организовать трудовое обучение и обеспечить тру-довую занятость, адекватную состоянию здоровьябольного;
J) вести реадаптацию пациента в семье и обществе;
K) способствовать больному в реализации его прав,представлять интересы больного в органах государственной власти и судебных органах.
Социальному работнику необходимо обеспечить взаимодействие больного с членами семьи и ближайшим окружением. Рекомендуется провести социальную экспертизу семьи с целью выявления проблем социально-медицинскогохарактера, разрешить возникшие проблем-ные ситуации и содействовать устранению ФР с мобили-зацией личностных резервов пациента.
Необходимо оказать психологическую поддержку и провести психологическое консультирование членов семьи и ближайшего окружения больного в разрешении микросоциальных проблем, содействовать сохранению семейных связей и переориентации семейных ролей в связи с болезнью члена семьи.
Социальный работник должен обеспечить членам семьи и ближайшему окружению доступность необходимой медико-социальной информации, информации о льготах и видах социальной защиты. Рекомендуетсяоказать помощь семье в организации адекватной состо-янию здоровья больного реабилитационной социально-бытовой среды, способствующей его автономному суще-ствованию. В том числе при необходимости для улучше-ния материального положения семьи создать условиядля надомного труда члену семьи, осуществляющему уходза больным.
Необходимо обеспечить санитарно-гигиеническое просвещение с целью формирования установок на здоровый образ жизни с учетом наличия больного в семье,содействовать в организации семейного досуга и отдыха путем предоставления возможности временного устройства больного в стационарное учреждение социального обслуживания.
Социальный работник должен помогать членам семьи больного в выработке адекватных стереотипов поведения в трудных жизненных ситуациях.
11. Медикаментозное лечение ХСН.
Общие принципы
Принципы медикаментозной терапии любого заболевания и ХСН, в частности, в первом десятилетии XXI века строятся на основе медицины доказательств. Иными словами, только препараты, эффективность (в том числе и по влиянию на прогноз больных) и безопасность которых доказана в длительных многоцентровых двойных слепых плацебоконтролируемых исследованиях,могут быть рекомендованы к широкому клиническому применению. Точно так же все рекомендации по дозамлекарственных средств и кратности их приема даются на основании контролируемых исследований, доказавших эффективность того или иного метода терапии. Лишь при отсутствии подобных исследований в расчет принимаются результаты фармакокинетических исследований.На основании имеющихся в настоящее время сведений иформируются современные принципы медикаментозной терапии ХСН.
Учитывая, что для пациентов с ХСН и низкой (<40 %,иногда учитывается величина <35%) ФВ ЛЖ имеетсямножество доказательств эффективности медикаментозных и инструментальных методов лечения (данныеМРКИ), именно этой группе больных будет посвященпервый раздел медикаментозного лечения.
Для пациентов с ХСН и нормальной (сохранной)систолической функцией сердца (ФВ ЛЖ >40 %) име-ется минимальное количество доказательных данных,что делает объективизацию подробных рекомендацийпо лечению затруднительным. Простой «перенос»рекомендаций по лечению больных преимуществен-но с систолической дисфункцией ЛЖ на группу боль-ных ХСН с сохранной ФВ (преимущественно диасто-лической ХСН) выглядит сомнительным. Но и отказот лечения таких пациентов из-за того, что не всегдаимеются убедительные данные МРКИ, не может бытьобоснованным. Поэтому во втором разделе будетотдельный анализ современных возможностей лечениябольных ХСН с сохранной систолической функциейсердца (СН–ССФ).
Основные препараты для медикаментозноголечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сни-женной ФВ ЛЖ можно разделить на две основные кате-гории соответственно степени доказанности (рис. 4).
Рисунок 4. Препараты для лечения ХСН c ФВ ЛЖ <40 (35 %)
Психологическая реабилитация и создание школамбулаторного наблюдения для больных ХСН
Сегодня пациент с ХСН, выписывающийся из клини-ки или покидающий врача амбулаторной практики после устранения декомпенсации, должен, кроме рекомендаций по оптимальному медикаментозному лечению, иметь возможность контролировать свое состояние и быть под наблюдением специально обученного персонала. Этот своеобразный принцип диспансерного наблюдения имеет различные названия: мультидисциплинарного подхода в ведении больных ХСН или школы для больных с декомпенсацией, или клиник для больных ХСН, или домашнего сестринского контроля за больными с декомпенсацией. Но дело не в названиях, а в том, что задача врачей – обу-чить больного и его ближайших родственников приемамконтроля за течением ХСН, методам самопомощи и датьвозможность регулярного контакта со специалистамидля своевременной коррекции состояния и недопущения экстренных декомпенсаций.
Эпидемиологические исследования последних лет,включавшие больных ХСН в Западной Европе и США,показали, что несмотря на повсеместное внедрениево врачебную практику самых эффективных средств терапии ХСН смертность больных в течение года в этой популяции остается по-прежнему высокой [197–199].
Среди возможных причин такого несоответствиядоказанной высокой эффективности современныхпрепаратов и сохраняющегося в популяции высокогоуровня смертности больных ХСН особая роль отводится низкой приверженности пациентов предписан-ному терапевтическому режиму и отсутствию строгоговыполнения врачебных рекомендаций, касающихся диеты и образа жизни.
Целью обучения является помощь пациентам и их родственникам в получении информации о заболевании, при-обретении навыков самоконтроля, касающихся диетиче-ских рекомендаций, физической активности, строгогособлюдения режима медикаментозной терапии, наблю-дения за симптомами СН и обращения за медицинскойпомощью в случае их усиления [200].
С пациентами проводятся структурированные заня-тия по следующим темам:
A) Общая информация о ХСН,
B) Симптомы ХСН и принципы самоконтроля,
C) Диета при ХСН,
D) Медикаментозная терапия ХСН,
E) Физические нагрузки при ХСН.
Пациенты должны получать обучающие материалыпо самоконтролю (брошюра «Жизнь с СН», «Дневниксамоконтроля пациента с СН»). Обучающие материалыдолжны содержать сведения о диете, контроле веса, физи-ческой активности, правильном приеме препаратов и т. д.Целесообразно с пациентами группы осуществлять регу-лярные телефонные контакты: первый месяц после выпи-ски из стационара – еженедельно; еще 2 месяца – 1 разв 2 недели; далее – 1 раз в месяц. Во время телефонныхконтактов врач должен проводить контроль самочув-ствия пациента, отвечать на вопросы, при необходимо-сти приглашать на дополнительный визит или решатьвопрос о госпитализации пациента.
Первым крупным российским многоцентровымисследованием эффективности использования обученияи мониторинга пациентов с ХСН стало исследованиеШАНС (Школа и Амбулаторное Наблюдение больныхСН), организованное ОССН. В группе вмешательствастатистически достоверно увеличилась дистанция в ходепроведения 6-мин. теста, также отмечено улучшениекачества жизни и снижение ЧСС в покое. Главным ито-гом программы ШАНС явилось достоверное уменьше-ние количества повторных госпитализаций из-за декомпенсации и снижение смертности больных с 13 до 8,3 %(р=0,044). Это позволяет рекомендовать внедрениеметодики мультидисциплинарного воздействия на боль-ных ХСН в широкую медицинскую практику. Такой под-ход позволяет существенно снизить число повторныхгоспитализаций, затраты на лечение, а по данным некоторых авторов, даже снизить смертность больных ХСН.Однако последнее утверждение имеет низкую степеньдоказанности (степень доказанности В).
Медико-социальная работа
Медико-социальная работа в комплексном ведениибольного ХСН должна включать мероприятия социаль-но-медицинского, психолого-педагогического и социаль-но-правового характера.
Эти мероприятия выполняет квалифицированныйсоциальный работник, участвующий в оказании медико-социальной помощи больному. Такому специалисту целе-сообразно:
A) провести комплексную оценку социального статусабольного, а также оценку качества его жизни совмест-но с другими специалистами;
B) формировать у больного здоровый образ жизнис учетом состояния его здоровья;
C) обеспечить выбор режима физических нагрузоки организовать физическую активность пациента;
D) вести психологическое консультирование и психо-коррекционную работу;
E) организовать совместно с другими специалистамиработу школы для больных ХСН;
F) участвовать в медико-социальной экспертизе боль-ного, разработке, реализации и оценке результатовиндивидуальной программы реабилитации;
G) провести социально-правовое консультированиепо вопросам прав больного на получение медико-социальной помощи, включая выплату пенсий, посо-бий и льгот на получение различных видов помощи;
H) организовать социальное обслуживание больно-го на дому;
I) организовать трудовое обучение и обеспечить тру-довую занятость, адекватную состоянию здоровьябольного;
J) вести реадаптацию пациента в семье и обществе;
K) способствовать больному в реализации его прав,представлять интересы больного в органах государственной власти и судебных органах.
Социальному работнику необходимо обеспечить взаимодействие больного с членами семьи и ближайшим окружением. Рекомендуется провести социальную экспертизу семьи с целью выявления проблем социально-медицинскогохарактера, разрешить возникшие проблем-ные ситуации и содействовать устранению ФР с мобили-зацией личностных резервов пациента.
Необходимо оказать психологическую поддержку и провести психологическое консультирование членов семьи и ближайшего окружения больного в разрешении микросоциальных проблем, содействовать сохранению семейных связей и переориентации семейных ролей в связи с болезнью члена семьи.
Социальный работник должен обеспечить членам семьи и ближайшему окружению доступность необходимой медико-социальной информации, информации о льготах и видах социальной защиты. Рекомендуетсяоказать помощь семье в организации адекватной состо-янию здоровья больного реабилитационной социально-бытовой среды, способствующей его автономному суще-ствованию. В том числе при необходимости для улучше-ния материального положения семьи создать условиядля надомного труда члену семьи, осуществляющему уходза больным.
Необходимо обеспечить санитарно-гигиеническое просвещение с целью формирования установок на здоровый образ жизни с учетом наличия больного в семье,содействовать в организации семейного досуга и отдыха путем предоставления возможности временного устройства больного в стационарное учреждение социального обслуживания.
Социальный работник должен помогать членам семьи больного в выработке адекватных стереотипов поведения в трудных жизненных ситуациях.
11. Медикаментозное лечение ХСН.
Общие принципы
Принципы медикаментозной терапии любого заболевания и ХСН, в частности, в первом десятилетии XXI века строятся на основе медицины доказательств. Иными словами, только препараты, эффективность (в том числе и по влиянию на прогноз больных) и безопасность которых доказана в длительных многоцентровых двойных слепых плацебоконтролируемых исследованиях,могут быть рекомендованы к широкому клиническому применению. Точно так же все рекомендации по дозамлекарственных средств и кратности их приема даются на основании контролируемых исследований, доказавших эффективность того или иного метода терапии. Лишь при отсутствии подобных исследований в расчет принимаются результаты фармакокинетических исследований.На основании имеющихся в настоящее время сведений иформируются современные принципы медикаментозной терапии ХСН.
Учитывая, что для пациентов с ХСН и низкой (<40 %,иногда учитывается величина <35%) ФВ ЛЖ имеетсямножество доказательств эффективности медикаментозных и инструментальных методов лечения (данныеМРКИ), именно этой группе больных будет посвященпервый раздел медикаментозного лечения.
Для пациентов с ХСН и нормальной (сохранной)систолической функцией сердца (ФВ ЛЖ >40 %) име-ется минимальное количество доказательных данных,что делает объективизацию подробных рекомендацийпо лечению затруднительным. Простой «перенос»рекомендаций по лечению больных преимуществен-но с систолической дисфункцией ЛЖ на группу боль-ных ХСН с сохранной ФВ (преимущественно диасто-лической ХСН) выглядит сомнительным. Но и отказот лечения таких пациентов из-за того, что не всегдаимеются убедительные данные МРКИ, не может бытьобоснованным. Поэтому во втором разделе будетотдельный анализ современных возможностей лечениябольных ХСН с сохранной систолической функциейсердца (СН–ССФ).
Основные препараты для медикаментозноголечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сни-женной ФВ ЛЖ можно разделить на две основные кате-гории соответственно степени доказанности (рис. 4).
Рисунок 4. Препараты для лечения ХСН c ФВ ЛЖ <40 (35 %)
 Основные препараты для медикаментозного лечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказанности (рис. 4).
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН с выделением двух подгрупп:
A) препараты, применяемые у всех больных,
B) препараты, применяемые в особых клиническихситуациях;
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые у всех больных (таблица 15)
Ингибиторы АПФ
Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН. Впервые в 1995 году в классическом метаанализе, включавшем более 7 100 больных,была продемонстрирована способность и АПФ к снижению риска смерти больных ХСН на 23 % [201]. Эффект отмечается уже в первые 90 дней лечения (снижение риска смерти 44 %). Эти результаты неоднократно подтверждены во множестве исследований и анализов, показавших, что положительные эффекты и АПФ не зависят от возраста больных, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН(I–IV ФК). По этим позициям класс рекомендаций I, уровень доказанности А.
Таблица 15. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способностьк снижению риска смерти и госпитализаций именно при ХСН и применяющиеся у всех больных)
Основные препараты для медикаментозного лечения ХСН со сниженной систолическойфункцией сердца (ФВ ЛЖ <40 %)
Все лекарственные средства для лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказанности (рис. 4).
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН с выделением двух подгрупп:
A) препараты, применяемые у всех больных,
B) препараты, применяемые в особых клиническихситуациях;
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые у всех больных (таблица 15)
Ингибиторы АПФ
Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН. Впервые в 1995 году в классическом метаанализе, включавшем более 7 100 больных,была продемонстрирована способность и АПФ к снижению риска смерти больных ХСН на 23 % [201]. Эффект отмечается уже в первые 90 дней лечения (снижение риска смерти 44 %). Эти результаты неоднократно подтверждены во множестве исследований и анализов, показавших, что положительные эффекты и АПФ не зависят от возраста больных, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН(I–IV ФК). По этим позициям класс рекомендаций I, уровень доказанности А.
Таблица 15. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способностьк снижению риска смерти и госпитализаций именно при ХСН и применяющиеся у всех больных)
 Следует отметить, что эффективность использования иАПФ может несколько снижаться при ишемической этиологии ХСН [18, 201, 202] и у женщин [201,202], а также ослабляться одновременным применением НПВП (в меньшей степени – малыми дозами аспирина)[203]. Эти данные получены в основном по результатамретроспективных мета-анализов и имеют уровень дока-занности С, но игнорировать их полностью не следует.
В частности, обращает на себя внимание мéньшая эффективность иАПФ у женщин, однако до проведенияспециальных проспективных исследований этот вопросостается пока открытым [204, 205]. При наличии кли-нических признаков ХСН ингибиторы АПФ достовер-но снижают риск смерти и госпитализаций у женщин,но этот эффект менее выражен, чем у мужчин (мета-анализ исследований SAVE, SOLVD, CONSENSUS, SMILE,TRACE [204]). Кроме того, учитывая, что иАПФ крайне редко используются в качестве монотерапии (лишьу больных ХСН I ФК), клиническая значимость этих дан-ных ограничена.
Эффекты иАПФ могут ослабляться одновременнымприменением НПВП за счет конкурентной блокады син-теза простациклина, стимулируемого кининовой системой [206, 207]. Поэтому нужно избегать назначения НПВП больным ХСН, находящимся на приеме иАПФ,особенно при перегрузке жидкостью (в период деком-пенсации). В меньшей степени этими свойствами облада-ют малые дозы аспирина, хотя и в этом случае описанынегативные взаимодействия аспирина с иАПФ [208]. Этотакже может быть связано с блокадой синтеза вазодила-тирующих простаноидов в результате блокады фермен-та циклооксигеназы [209]. Негативное взаимодействиеаспирина и иАПФ при ХСН отмечено и в ретроспектив-ных анализах крупных плацебо-контролируемых исследований [210, 211], и в специально спланированныхпроспективных протоколах [207, 208]. Причем очевидно,что антиагреганты с другим механизмом действия (тикло-пидин, клопидогрел) не ослабляют эффектов иАПФв той же степени, что и аспирин [212, 213]. Этот слож-ный вопрос неоднократно подробно обсуждался на конференциях ОССН [209, 214, 215]. Однако по даннымдвух мета-анализов, не выявлено существенного досто-верного снижения эффектов иАПФ при одновременномприменении малых (до 325 мг / сут) доз аспирина [216,217]. Поэтому совместное применение иАПФ и малыхдоз аспирина при ХСН возможно. Однако доказательствэффективности аспирина при длительном лечении ХСНне имеется [218], и назначение аспирина может быть чре-вато увеличением количества декомпенсаций в результатеобострения ХСН [135, 136].
Неправильно лечить иАПФ (впрочем, как и другими лекарственными средствами) больных ХСН на почвепороков сердца с преобладающими стенозами клапанныхотверстий. Такие пороки должны корригироваться хирур-гическим путем. Однако для достижения компенсациидо хирургической коррекции подобные больные долж-ны лечиться в соответствии с общими принципам, хотядозы всех препаратов, влияющих на пред- и посленагрузку(включая иАПФ), должны титроваться крайне медленнопри тщательном контроле за состоянием и уровнем АД.
Основные позиции по применению иАПФ в лече-нии ХСН:A) иАПФ показаны всем больным ХСН со снижен-ной ФВ ЛЖ;
B) иАПФ улучшают клиническую симптоматику, качество жизни (КЖ), замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных ХСН, а также предотвращают насту-пление клинически выраженной декомпенсации, т. е.позволяют решить все шесть задач при достижениицели, что означает успешное лечение ХСН;
C) эти препараты эффективны от самых начальных стадий ХСН, включая бессимптомную дисфункцию ЛЖ, до самых поздних стадий декомпенсации;
D) чем раньше начинается лечение, тем больше шансов на успех и продление жизни пациентов;
E) неназначение иАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти декомпенсированных больных.
В России зарегистрировано 11 иАПФ, имеющихв качестве показания ХСН: беназеприл, зофеноприл,каптоприл, квинаприл, лизиноприл, периндоприл, спи-раприл, рамиприл, фозиноприл, цилазаприл, эналаприл.Хотя общепринята точка зрения, что имеет место такназываемый класс–эффект при использовании иАПФв лечении ХСН с точки зрения медицины, основаннойна доказательствах, степень доказанности их эффектив-ности при лечении ХСН весьма различна. Ниже приведе-ны данные, характеризующие иАПФ с максимальной сте-пенью доказанности по лечению и профилактике именноХСН с указанием контролируемых исследований, под-твердивших эту эффективность (таблица 16) [118, 122,130, 132, 139, 219–236].
Таблица 16. Ингибиторы АПФ, доказавшие способность предотвращать развитие ХСН и / или успешно лечить больных ХСН*
Следует отметить, что эффективность использования иАПФ может несколько снижаться при ишемической этиологии ХСН [18, 201, 202] и у женщин [201,202], а также ослабляться одновременным применением НПВП (в меньшей степени – малыми дозами аспирина)[203]. Эти данные получены в основном по результатамретроспективных мета-анализов и имеют уровень дока-занности С, но игнорировать их полностью не следует.
В частности, обращает на себя внимание мéньшая эффективность иАПФ у женщин, однако до проведенияспециальных проспективных исследований этот вопросостается пока открытым [204, 205]. При наличии кли-нических признаков ХСН ингибиторы АПФ достовер-но снижают риск смерти и госпитализаций у женщин,но этот эффект менее выражен, чем у мужчин (мета-анализ исследований SAVE, SOLVD, CONSENSUS, SMILE,TRACE [204]). Кроме того, учитывая, что иАПФ крайне редко используются в качестве монотерапии (лишьу больных ХСН I ФК), клиническая значимость этих дан-ных ограничена.
Эффекты иАПФ могут ослабляться одновременнымприменением НПВП за счет конкурентной блокады син-теза простациклина, стимулируемого кининовой системой [206, 207]. Поэтому нужно избегать назначения НПВП больным ХСН, находящимся на приеме иАПФ,особенно при перегрузке жидкостью (в период деком-пенсации). В меньшей степени этими свойствами облада-ют малые дозы аспирина, хотя и в этом случае описанынегативные взаимодействия аспирина с иАПФ [208]. Этотакже может быть связано с блокадой синтеза вазодила-тирующих простаноидов в результате блокады фермен-та циклооксигеназы [209]. Негативное взаимодействиеаспирина и иАПФ при ХСН отмечено и в ретроспектив-ных анализах крупных плацебо-контролируемых исследований [210, 211], и в специально спланированныхпроспективных протоколах [207, 208]. Причем очевидно,что антиагреганты с другим механизмом действия (тикло-пидин, клопидогрел) не ослабляют эффектов иАПФв той же степени, что и аспирин [212, 213]. Этот слож-ный вопрос неоднократно подробно обсуждался на конференциях ОССН [209, 214, 215]. Однако по даннымдвух мета-анализов, не выявлено существенного досто-верного снижения эффектов иАПФ при одновременномприменении малых (до 325 мг / сут) доз аспирина [216,217]. Поэтому совместное применение иАПФ и малыхдоз аспирина при ХСН возможно. Однако доказательствэффективности аспирина при длительном лечении ХСНне имеется [218], и назначение аспирина может быть чре-вато увеличением количества декомпенсаций в результатеобострения ХСН [135, 136].
Неправильно лечить иАПФ (впрочем, как и другими лекарственными средствами) больных ХСН на почвепороков сердца с преобладающими стенозами клапанныхотверстий. Такие пороки должны корригироваться хирур-гическим путем. Однако для достижения компенсациидо хирургической коррекции подобные больные долж-ны лечиться в соответствии с общими принципам, хотядозы всех препаратов, влияющих на пред- и посленагрузку(включая иАПФ), должны титроваться крайне медленнопри тщательном контроле за состоянием и уровнем АД.
Основные позиции по применению иАПФ в лече-нии ХСН:A) иАПФ показаны всем больным ХСН со снижен-ной ФВ ЛЖ;
B) иАПФ улучшают клиническую симптоматику, качество жизни (КЖ), замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных ХСН, а также предотвращают насту-пление клинически выраженной декомпенсации, т. е.позволяют решить все шесть задач при достижениицели, что означает успешное лечение ХСН;
C) эти препараты эффективны от самых начальных стадий ХСН, включая бессимптомную дисфункцию ЛЖ, до самых поздних стадий декомпенсации;
D) чем раньше начинается лечение, тем больше шансов на успех и продление жизни пациентов;
E) неназначение иАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти декомпенсированных больных.
В России зарегистрировано 11 иАПФ, имеющихв качестве показания ХСН: беназеприл, зофеноприл,каптоприл, квинаприл, лизиноприл, периндоприл, спи-раприл, рамиприл, фозиноприл, цилазаприл, эналаприл.Хотя общепринята точка зрения, что имеет место такназываемый класс–эффект при использовании иАПФв лечении ХСН с точки зрения медицины, основаннойна доказательствах, степень доказанности их эффектив-ности при лечении ХСН весьма различна. Ниже приведе-ны данные, характеризующие иАПФ с максимальной сте-пенью доказанности по лечению и профилактике именноХСН с указанием контролируемых исследований, под-твердивших эту эффективность (таблица 16) [118, 122,130, 132, 139, 219–236].
Таблица 16. Ингибиторы АПФ, доказавшие способность предотвращать развитие ХСН и / или успешно лечить больных ХСН*
 Как видим, максимальную степень доказанностив лечении ХСН всех стадий имеют только «классиче-ские» иАПФ, абсолютно не потерявшие своего значе-ния – эналаприл и каптоприл (класс рекомендации I, сте-пень доказанности А). Именно этим препаратам правиль-но отдавать предпочтение в терапии ХСН.
Также доказана лечебная эффективность и возмож-ность профилактики ХСН при применении фозино-прила, периндоприла и лизиноприла (класс рекоменда-ций I, степень доказанности В). Причем способностьпериндоприла достоверно уменьшать количество госпи-тализаций была доказана в группе пожилых больныхс сохранной систолической функцией ЛЖ [234]. Этоединственное проспективное исследование, показавшееперспективность иАПФ (периндоприла) в лечении боль-ных с СН–СФ.
В двух контролируемых протоколах продемонстри-рована способность фозиноприла увеличивать толерант-ность к физическим нагрузкам, замедлять прогрессиро-вание ХСН и уменьшать число госпитализаций как в при-сутствии, так и в отсутствие параллельного применениясердечных гликозидов [233, 234]. В многоцентровомрандомизированном сравнительном исследовании с эна-лаприлом продемонстрировано даже преимуществофозиноприла в эффективности и безопасности в предот-вращении осложнений [235].
Один из первых иАПФ лизиноприл также изучалсяв качестве средства профилактики и лечения ХСН, хотяполученные данные менее убедительны, чем результатыисследований с каптоприлом и эналаприлом. Так, в иссле-довании GISSI–III у больных, перенесших ОИМ, про-должительность лечения лизиноприлом составила лишь6 недель [130], а исследование ATLAS у больных ХСНне было плацебо-контролируемым и ставило задачейсравнение эффективности разных доз иАПФ [235]. Хотяпо влиянию на толерантность к нагрузкам и величину ФВлизиноприл не уступал каптоприлу [236].
Учитывая, что лизиноприл не метаболизирует в пече-ни и выводится на 100 % почками в неизмененном виде,его применение должно быть ограничено при тяжелойХСН, когда большинство больных имеют ухудшениефункции почек [237, 238]. В этих случаях выгоднееиспользовать фозиноприл и спираприл, имеющих двапути выведения из организма. Кроме этого, исследо-вание ALLHAT продемонстрировало, что лизиноприлдостоверно уступает диуретикам в предотвращенииразвития ХСН [113].
Таким образом, только 5 иАПФ (каптоприл, энала-прил, лизиноприл, периндоприл и фозиноприл) могутбыть в первую очередь рекомендованы для профилакти-ки и лечения ХСН, хотя это не исключает возможностиприменения и других представителей этого класса.
Для профилактики ХСН у больных, перенесших ОИМ,могут применяться каптоприл, рамиприл, трандолаприл,фозиноприл и зофеноприл (класс рекомендаций I, сте-пень доказанности А). Эти результаты были полученыв классических исследоваваниях SAVE [139], AIRE [239],TRACE [240], SMILE [241] и FAMIS [230], продемонстрировавшихспособность разных иАПФ снижать рискобострения ХСН и смертности у пациентов с ОКС.
Периндоприл в исследовании PRE–AMI продемон-стрировал способность достоверно блокировать про-цессы постинфарктного ремоделирования ЛЖ, что явля-ется основным механизмом в предотвращении развитияХСН [242].
Для профилактики ХСН у пациентов с хроническимизаболеваниями сердечно-сосудистой системы (в част-ности, ИБС) возможно использование трех иАПФ –периндоприла, рамиприла и трандолаприла (класс реко-мендаций I, степень доказанности А). Причем степеньдоказанности профилактики ХСН при ИБС максимальнадля периндоприла [122]. Рамиприл продемонстрировалспособность предотвращать развитие декомпенсацииу смешанной группы больных с ИБС, АГ, СД, перифе-рическим атеросклерозом и перенесенным инсультом,что не позволяет дифференцировать его эффект у каж-дой из этих подгрупп пациентов [123]. В исследованииPEACE применение трандолаприла у больных ИБСс сохранной систолической функцией сердца не сни-жало достоверно риск наступления смерти, развитиянового ОИМ или реваскуляризации, но сопровождалосьдостоверным снижением развития новой ХСН [243].Периндоприл в исследовании EUROPA достоверноуменьшал риск развития ХСН на 39 %, превосходя по это-му показателю трандолаприл (–25 %) и рамиприл (–23 %)[123, 243, 244]. Кроме того, у пациентов с инсультамив анамнезе (половина с АГ) применение периндоприлаи его комбинации с индапамидом сопровождалось досто-верным снижением риска развития ХСН на 26 % [119].
Кроме иАПФ с полностью доказанной эффективно-стью в крупных международных многоцетровых иссле-дованиях, о которых говорилось выше, необходимо упо-мянуть хинаприл и спираприл, которые продемонстри-ровали свою эффективность в лечении ХСН на меньшемчисле пациентов [245–249]. Клиническая эффективностьхинаприла и спираприла в лечении ХСН подтвержде-на и в многоцентровых российских программах РКОи ОССН (САДКО–ХСН и КВАНК).
Следует напомнить, что максимальная информацияпо лечению ХСН иАПФ была получена в серии класси-ческих исследований с эналаприлом (SOLVD treatment,SOLVD prevention, V–HeFT II и CONSENSUS) у паци-ентов со всеми стадиями декомпенсации.
Побочные эффекты (требующие остановки лечения)осложняют применение иАПФ достаточно редко.
Повышение уровня креатинина возможно у 5–15 %больных ХСН и связано с основным механизмом действияиАПФ – блокадой влияния АII на уровень почечной филь-трации. При этом может развиваться функциональнаяпочечная недостаточность, что особенно опасно у больныхс исходной гипонатриемией [250, 251]. Однако при мед-ленном титровании доз иАПФ стойкая высокая азотемия(повышение уровня креатинина более чем в 2 раза вышенормы) и усугубление почечной недостаточности встреча-ется у 1–2 % декомпенсированных больных.
Сегодня гораздо более точным методом оценки функционального состояния почек является скорость клубоч-ковой фильтрации (СКФ), рассчитываемая по формуламMDRD или Cockroft–Gault. При СКФ менее 60 мл / миндозу иАПФ следует уменьшить наполовину, а при СКФ<30 мл / мин на ¾. В этих случаях показано примене-ние иАПФ, имеющих два пути выведения из организма(почки / печень): фозиноприла (50 / 50) и спираприла(50 / 50), рамиприла (70 / 30) и трандолаприла (30 / 70)(класс рекомендаций IIA, степень доказанности В). Дозыэтих препаратов нужно корригировать лишь при сниже-нии СКФ менее 30 мл / мин. Следует избегать назначениялизиноприла, который выводится почками в неизменен-ном виде, что чревато опасным повышением концентра-ции препарата (класс рекомендаций IIA, степень дока-занности А).
Сухой кашель. Типичный побочный эффект всехиАПФ (2–3 % леченных иАПФ больных), связанныйс блокадой деградации брадикинина и минимально выра-женный у фозиноприла (степень доказанности В) [252].При развитии упорного кашля иАПФ должны быть заме-нены на АРА, которым не свойственно развитие этогоосложнения.
Симптомная гипотония объясняется основнымимеханизмами действия иАПФ, однако может затруднять начало терапии иАПФ. В небольшом количестве случаев(3–4 %) это может требовать прекращения терапии иАПФ.Имеются сведения, что в наименьшей степени гипотонияпервой дозы развивается на фоне применения перин-доприла (класс IIA, степень доказанности В) [253, 254].Следует помнить, что при развитии гипотонии на фонелечения иАПФ дозу нужно уменьшить, а при останов-ке лечения сделать все возможное для как можно болеебыстрого возврата к терапии иАПФ.
Непереносимость иАПФ. Абсолютными противопо-казаниями к назначению иАПФ являются непереноси-мость (ангионевротическийотек), двусторонний стенозпочечных артерий, беременность. Непереносимостьв связи с развитием ангионевротического отека при при-менении рекомендованных доз иАПФ в терапевтическихдозах не превышает 0,4 %.
В случаях непереносимости иАПФ могут быть заме-нены АРА, хотя при развитии почечной недостаточностии повышении уровня креатинина, скорее всего, и назна-чение АРА не принесет желаемого результата.
Практические вопросы применения иАПФ при ХСН(дозы, тактика лечения, меры предосторожности).
Назначение всех иАПФ начинается с маленьких доз,при их постепенном (не чаще одного раза в 2–3 дня,а при системной гипотонии еще реже – не чаще одногораза в неделю) титровании до оптимальных (среднихтерапевтических) доз.
При отсутствии клинических противопоказаний(и снижения АД) необходимо пытаться увеличивать дозудо рекомендованной (терапевтической) (таблица 17). Однако следует помнить, что при попытке достижениямаксимальных доз иАПФ дополнительное снижениечисла обострений ХСН (и отсутствие дополнительного снижения риска смерти) сопровождается ростом чис-ла осложнений (гипотония, гиперкалиемия, увеличениеуровня креатинина). В исследовании NETWORK увели-чение дозы иАПФ эналаприла в терапевтических пределах(5–20 мг / сут) не сопровождалось улучшением прогнозаили снижением числа госпитализаций в связи с обостре-нием ХСН [255]. Исследование ATLAS с лизиноприломсравнивало эффективность малых (2,5–5 мг / сут) и оченьвысоких (32,5–35 мг / сут) доз препарата. Это исследо-вание показало, что 7–10‑кратное повышение доз лизи-ноприла не улучшает выживаемость больных ХСН, хотяуменьшает число повторных госпитализаций, одновре-менно достоверно увеличивая риск побочных реакций(гиперкалиемии, гипотонии) [235].
Таблица 17. Дозировки иАПФ для лечения ХСН (в мг × кратность приема)
Как видим, максимальную степень доказанностив лечении ХСН всех стадий имеют только «классиче-ские» иАПФ, абсолютно не потерявшие своего значе-ния – эналаприл и каптоприл (класс рекомендации I, сте-пень доказанности А). Именно этим препаратам правиль-но отдавать предпочтение в терапии ХСН.
Также доказана лечебная эффективность и возмож-ность профилактики ХСН при применении фозино-прила, периндоприла и лизиноприла (класс рекоменда-ций I, степень доказанности В). Причем способностьпериндоприла достоверно уменьшать количество госпи-тализаций была доказана в группе пожилых больныхс сохранной систолической функцией ЛЖ [234]. Этоединственное проспективное исследование, показавшееперспективность иАПФ (периндоприла) в лечении боль-ных с СН–СФ.
В двух контролируемых протоколах продемонстри-рована способность фозиноприла увеличивать толерант-ность к физическим нагрузкам, замедлять прогрессиро-вание ХСН и уменьшать число госпитализаций как в при-сутствии, так и в отсутствие параллельного применениясердечных гликозидов [233, 234]. В многоцентровомрандомизированном сравнительном исследовании с эна-лаприлом продемонстрировано даже преимуществофозиноприла в эффективности и безопасности в предот-вращении осложнений [235].
Один из первых иАПФ лизиноприл также изучалсяв качестве средства профилактики и лечения ХСН, хотяполученные данные менее убедительны, чем результатыисследований с каптоприлом и эналаприлом. Так, в иссле-довании GISSI–III у больных, перенесших ОИМ, про-должительность лечения лизиноприлом составила лишь6 недель [130], а исследование ATLAS у больных ХСНне было плацебо-контролируемым и ставило задачейсравнение эффективности разных доз иАПФ [235]. Хотяпо влиянию на толерантность к нагрузкам и величину ФВлизиноприл не уступал каптоприлу [236].
Учитывая, что лизиноприл не метаболизирует в пече-ни и выводится на 100 % почками в неизмененном виде,его применение должно быть ограничено при тяжелойХСН, когда большинство больных имеют ухудшениефункции почек [237, 238]. В этих случаях выгоднееиспользовать фозиноприл и спираприл, имеющих двапути выведения из организма. Кроме этого, исследо-вание ALLHAT продемонстрировало, что лизиноприлдостоверно уступает диуретикам в предотвращенииразвития ХСН [113].
Таким образом, только 5 иАПФ (каптоприл, энала-прил, лизиноприл, периндоприл и фозиноприл) могутбыть в первую очередь рекомендованы для профилакти-ки и лечения ХСН, хотя это не исключает возможностиприменения и других представителей этого класса.
Для профилактики ХСН у больных, перенесших ОИМ,могут применяться каптоприл, рамиприл, трандолаприл,фозиноприл и зофеноприл (класс рекомендаций I, сте-пень доказанности А). Эти результаты были полученыв классических исследоваваниях SAVE [139], AIRE [239],TRACE [240], SMILE [241] и FAMIS [230], продемонстрировавшихспособность разных иАПФ снижать рискобострения ХСН и смертности у пациентов с ОКС.
Периндоприл в исследовании PRE–AMI продемон-стрировал способность достоверно блокировать про-цессы постинфарктного ремоделирования ЛЖ, что явля-ется основным механизмом в предотвращении развитияХСН [242].
Для профилактики ХСН у пациентов с хроническимизаболеваниями сердечно-сосудистой системы (в част-ности, ИБС) возможно использование трех иАПФ –периндоприла, рамиприла и трандолаприла (класс реко-мендаций I, степень доказанности А). Причем степеньдоказанности профилактики ХСН при ИБС максимальнадля периндоприла [122]. Рамиприл продемонстрировалспособность предотвращать развитие декомпенсацииу смешанной группы больных с ИБС, АГ, СД, перифе-рическим атеросклерозом и перенесенным инсультом,что не позволяет дифференцировать его эффект у каж-дой из этих подгрупп пациентов [123]. В исследованииPEACE применение трандолаприла у больных ИБСс сохранной систолической функцией сердца не сни-жало достоверно риск наступления смерти, развитиянового ОИМ или реваскуляризации, но сопровождалосьдостоверным снижением развития новой ХСН [243].Периндоприл в исследовании EUROPA достоверноуменьшал риск развития ХСН на 39 %, превосходя по это-му показателю трандолаприл (–25 %) и рамиприл (–23 %)[123, 243, 244]. Кроме того, у пациентов с инсультамив анамнезе (половина с АГ) применение периндоприлаи его комбинации с индапамидом сопровождалось досто-верным снижением риска развития ХСН на 26 % [119].
Кроме иАПФ с полностью доказанной эффективно-стью в крупных международных многоцетровых иссле-дованиях, о которых говорилось выше, необходимо упо-мянуть хинаприл и спираприл, которые продемонстри-ровали свою эффективность в лечении ХСН на меньшемчисле пациентов [245–249]. Клиническая эффективностьхинаприла и спираприла в лечении ХСН подтвержде-на и в многоцентровых российских программах РКОи ОССН (САДКО–ХСН и КВАНК).
Следует напомнить, что максимальная информацияпо лечению ХСН иАПФ была получена в серии класси-ческих исследований с эналаприлом (SOLVD treatment,SOLVD prevention, V–HeFT II и CONSENSUS) у паци-ентов со всеми стадиями декомпенсации.
Побочные эффекты (требующие остановки лечения)осложняют применение иАПФ достаточно редко.
Повышение уровня креатинина возможно у 5–15 %больных ХСН и связано с основным механизмом действияиАПФ – блокадой влияния АII на уровень почечной филь-трации. При этом может развиваться функциональнаяпочечная недостаточность, что особенно опасно у больныхс исходной гипонатриемией [250, 251]. Однако при мед-ленном титровании доз иАПФ стойкая высокая азотемия(повышение уровня креатинина более чем в 2 раза вышенормы) и усугубление почечной недостаточности встреча-ется у 1–2 % декомпенсированных больных.
Сегодня гораздо более точным методом оценки функционального состояния почек является скорость клубоч-ковой фильтрации (СКФ), рассчитываемая по формуламMDRD или Cockroft–Gault. При СКФ менее 60 мл / миндозу иАПФ следует уменьшить наполовину, а при СКФ<30 мл / мин на ¾. В этих случаях показано примене-ние иАПФ, имеющих два пути выведения из организма(почки / печень): фозиноприла (50 / 50) и спираприла(50 / 50), рамиприла (70 / 30) и трандолаприла (30 / 70)(класс рекомендаций IIA, степень доказанности В). Дозыэтих препаратов нужно корригировать лишь при сниже-нии СКФ менее 30 мл / мин. Следует избегать назначениялизиноприла, который выводится почками в неизменен-ном виде, что чревато опасным повышением концентра-ции препарата (класс рекомендаций IIA, степень дока-занности А).
Сухой кашель. Типичный побочный эффект всехиАПФ (2–3 % леченных иАПФ больных), связанныйс блокадой деградации брадикинина и минимально выра-женный у фозиноприла (степень доказанности В) [252].При развитии упорного кашля иАПФ должны быть заме-нены на АРА, которым не свойственно развитие этогоосложнения.
Симптомная гипотония объясняется основнымимеханизмами действия иАПФ, однако может затруднять начало терапии иАПФ. В небольшом количестве случаев(3–4 %) это может требовать прекращения терапии иАПФ.Имеются сведения, что в наименьшей степени гипотонияпервой дозы развивается на фоне применения перин-доприла (класс IIA, степень доказанности В) [253, 254].Следует помнить, что при развитии гипотонии на фонелечения иАПФ дозу нужно уменьшить, а при останов-ке лечения сделать все возможное для как можно болеебыстрого возврата к терапии иАПФ.
Непереносимость иАПФ. Абсолютными противопо-казаниями к назначению иАПФ являются непереноси-мость (ангионевротическийотек), двусторонний стенозпочечных артерий, беременность. Непереносимостьв связи с развитием ангионевротического отека при при-менении рекомендованных доз иАПФ в терапевтическихдозах не превышает 0,4 %.
В случаях непереносимости иАПФ могут быть заме-нены АРА, хотя при развитии почечной недостаточностии повышении уровня креатинина, скорее всего, и назна-чение АРА не принесет желаемого результата.
Практические вопросы применения иАПФ при ХСН(дозы, тактика лечения, меры предосторожности).
Назначение всех иАПФ начинается с маленьких доз,при их постепенном (не чаще одного раза в 2–3 дня,а при системной гипотонии еще реже – не чаще одногораза в неделю) титровании до оптимальных (среднихтерапевтических) доз.
При отсутствии клинических противопоказаний(и снижения АД) необходимо пытаться увеличивать дозудо рекомендованной (терапевтической) (таблица 17). Однако следует помнить, что при попытке достижениямаксимальных доз иАПФ дополнительное снижениечисла обострений ХСН (и отсутствие дополнительного снижения риска смерти) сопровождается ростом чис-ла осложнений (гипотония, гиперкалиемия, увеличениеуровня креатинина). В исследовании NETWORK увели-чение дозы иАПФ эналаприла в терапевтических пределах(5–20 мг / сут) не сопровождалось улучшением прогнозаили снижением числа госпитализаций в связи с обостре-нием ХСН [255]. Исследование ATLAS с лизиноприломсравнивало эффективность малых (2,5–5 мг / сут) и оченьвысоких (32,5–35 мг / сут) доз препарата. Это исследо-вание показало, что 7–10‑кратное повышение доз лизи-ноприла не улучшает выживаемость больных ХСН, хотяуменьшает число повторных госпитализаций, одновре-менно достоверно увеличивая риск побочных реакций(гиперкалиемии, гипотонии) [235].
Таблица 17. Дозировки иАПФ для лечения ХСН (в мг × кратность приема)
 Следует помнить, что титрование дозы иАПФ – процесс сугубо индивидуальный и у каждого пациента свой оптимум и максимум в эффективных и переносимыхдозах лекарств. Тем более, что использование комбина-ции иАПФ с другими нейрогормональными ингибитора-ми (β-АБ, АМКР) у подавляющего числа больных ХСНпозволяет достигать эффекта с меньшим риском неже-лательных явлений, свойственных максимальным дозамлекарств. Однако останавливаться на минимальных дозахиАПФ, если пациент их хорошо переносит и у него нетснижения АД – это ошибка. При этом вы лишаете своегобольного дополнительных шансов на уменьшение обо-стрений болезни.
Ингибиторы АПФ можно назначать больным ХСНпри уровне САД выше 85 мм рт. ст. При исходно низкомCАД (85–100 мм рт. ст.) эффективность иАПФ сохраня-ется, поэтому их всегда и обязательно следует назначать,снижая стартовую дозу в два раза (для всех иАПФ).
Риск гипотонии возрастает:
A) у наиболее тяжелых больных ХСН IV ФК,
B) при сочетании иАПФ с ПВД (нитраты, БМКК),
C) при назначении после обильного диуреза,
D) у больных с высокоренинной формой ХСН.
Для избежания гипотензии первой дозы иАПФ следу-ет назначать не менее чем через 24 часа после обильно-го диуреза, предварительно отменив вазодилатирующиесредства.
В таблице 17 показаны дозы иАПФ, применяющихсяв лечении и профилактике ХСН в Российской Федерации.
В тех случаях, когда в скобках приведена цифра 2, этоозначает, что может иметь место как одно-, так и двух-кратное назначение препарата (двух- или трехкратноедля каптоприла).
Следует помнить, что при снижении почечной фильтра-ции ниже 60 мл / мин дозы всех иАПФ должны быть умень-шены вдвое, а при снижении ниже 30 мл / мин на 75 %.Это же относится и к лечению пожилых больных ХСН,у которых почечная функция, как правило, нарушена.
В этих случаях лучше предпочесть препараты с двой-ным путем выведения из организма (почки / желудочно-кишечный тракт)
Ниже представлены подробные рекомендациипо безопасномуначалу лечения ХСН препаратами груп-пы иАПФ, которые целесообразно выполнять у всехбольных ХСН и особенно у «проблемных» пациентовс исходной гипотонией, нарушенной функцией почек,гиперкалиемией:
A) еще раз оценить необходимость применения в исполь-зуемых дозировках диуретиков и особенно вазодилататоров;
B) не допускать чрезмерного диуреза перед началомлечения. Отменить диуретики за 24 ч до первого при-менения иАПФ в случае их использования;
C) целесообразно начинать терапию вечером, когдабольной находится в горизонтальном положении,чтобы снизить до минимума возможное негативноевлияние препарата на АД, хотя данных, подтверж-дающих это предположение относительно СН, нет (уровень доказательности В). Если лечение начинаютутром, рекомендуется наблюдение за АД в течениенескольких часов;
D) начинать лечение с малых доз и увеличиватьих до терапевтического уровня, который оказалсяэффективным по данным МРКИ (таблица 17);
E) избегать назначения калийсберегающих диурети-ков в начале лечения иАПФ, особенно у больныхс исходно высоким уровнем калия плазмы (выше5,2 ммоль / л). Однако это не противоречит рекомен-дациям по совместному применению иАПФ с высоки-ми дозами спиронолактона в период декомпенсациисердечной деятельности и сочетанию иАПФ с малымидозами АМКР при длительном лечении ХСН;
F) избегать назначения НПВП;
G) контролировать АД, содержание креатинина и элек-тролитов в крови через 2 недели после каждого после-дующего увеличения дозы.
За консультацией к специалисту-кардиологу следуетнаправлять больных, у которых:
A) причина СН неизвестна,
B) САД <100 мм рт. ст.,
C) содержание в сыворотке креатинина >130 мкмоль / л,или СКФ < 60 мл / мин и нет клинического эффекта,
D) содержание в сыворотке натрия <130 ммоль / л,
E) одержание в сыворотке калия >6,0 ммоль / л,
F) тяжелая СН,
G) клапанные пороки сердца, как причина СН.
При развитии серьезных нежелательных явленийи / или отсутствии эффекта от применения иАПФ можнопопробовать терапию АРА.
Антагонисты рецепторов к АII
Появление второго класса блокаторов РААС – селективных антагонистов рецепторов к АII (АРА) произошло уже после укрепления иАПФ на позициях основныхсредств лечения декомпенсации. Учитывая абсолютныепоказания к назначению иАПФ всем пациентам с ХСН,невозможно было организовать плацебо-контролируемые исследования с АРА в «эру иАПФ», что затруднялооценку истинных возможностей препаратов этого классау декомпенсированных больных. Хотя необходимо отметить «фирменную» особенность препаратов этого клас-са – прекрасную переносимость при минимуме побоч-ных эффектов. Кроме того, АРА крайне редко вызываюткашель и стандартно рекомендуются для лечения ХСН при непереносимости иАПФ (как это и указано в настоя-щих рекомендациях).
На начальном этапе первый АРА лозартан напрямуюсравнивался с эталонным иАПФ каптоприлом с целью доказать преимущества нового класса блокаторов РААСна смертность и заболеваемость больных ХСН [228],однако гипотеза о возможных преимуществах АРА в лече-нии ХСН не подтвердилась.
В исследовании ELITE II лозартан незначительно и недостоверно уступал каптоприлу по влиянию на прогноз пациентов с декомпенсацией и имел лучший профиль переносимости [228]. Относительная неудача лозар-тана (в сравнении с высокой дозой иАПФ каптопри-ла – 150 мг / сут) в этом исследовании, как и при леченииОИМ в исследовании ОРТIMAAL [224], связываетсяс применением недостаточных (50 мг 1 р / д) дозировок.В 2009 году завершилось крайне важное исследование HEAAL, впервые сравнившее эффективность различныхдозировок АРА в лечении ХСН. Было продемонстрирова-но, что применение лозартана в дозе 150 мг / сут достовер-но снижает риск смерти и госпитализаций больных ХСНв сравнении с дозой 50 мг / сут [256]. Смысл этого иссле-дования не только в «реабилитации» лозартана, как сред-ства лечения ХСН с возможностью снижения рискасмерти и госпитализации больных, но и в напоминании,что только оптимальные дозы блокаторов РААС позволяют рассчитывать на улучшение прогноза больных ХСН.
Лозартан в дозах 100 мг / сут может предупреждатьразвитие ХСН, в том числе у пациентов с диабетоми нефропатией [150], что обусловливает его применениедля профилактики декомпенсации сердечной деятельно-сти (класс рекомендаций IIA, степень доказанности В).
В дальнейшем все клинические исследования дока-зывали лишь то что АРА не уступают иАПФ в леченииХСН. Главной доказательной базой являются результа-ты трех исследований, вошедших в программу CHARM,в которых изучалась эффективность и безопасность при-менения АРА кандесартана у пациентов с ХСН и снижен-ной или сохранной ФВ ЛЖ [257–259]. В исследованииCHARM alternative кандесартан сравнивался с плацебоу пациентов с ХСН, сниженной ФВ ЛЖ <40 % и непере-носимостью иАПФ. В этом исследовании АРА кандесар-тан достоверно снижал риск первичной конечной точки(смерть плюс госпитализации в связи с обострениемХСН) на 23 %, но показатель смертности достоверноне менялся [257].
Ретроспективный анализ программы CHARM про-демонстрировал достоверное снижение смертности и сердечно-сосудистых госпитализаций среди пациентов с классической СН и низкой ФВ (<40 %) на фоне лечения кандесартаном. Снижение риска смерти составляло 33 %после первого, 20 % после второго и 12 % после третьегогода наблюдения, что очень близко к показателям, полу-ченным в исследовании SOLVD с «эталонным» иАПФэналаприлом (23 % через год, 23 % через два и 16 % черезтри года терапии, соответственно). Однако часть паци-ентов получала комбинацию иАПФ и АРА кандесарта-на, что может искажать результаты. С другой стороны,кандесартан был поставлен в более сложные условия,чем иАПФ, которые применялись на фоне комбинациилишь двух препаратов – сердечных гликозидов и моче-гонных. Эффект кандесартана доказан для больных ХСН,большинство из которых уже получали и гликозиды,и диуретики, и β-АБ, и антагонисты альдостерона, а частьи иАПФ, но не достигли состояния компенсации.
Дополнительное значение имеет анализ эффективности другого АРА – валсартана у больных, не получав-ших иАПФ в связи с их непереносимостью [260]. В этомслучае были впервые продемонстрированы способно-сти АРА не только к уменьшению числа госпитализаций,но и снижению риска смерти больных ХСН в сравнениис плацебо. Валсартан на 33 % снижал риск смерти и на 44 %риск смерти плюс повторных госпитализаций у деком-пенсированных больных, даже превосходя по этим пока-зателям кандесартан. Правда, эти результаты были полу-чены в ходе вторичного анализа.
Валсартан является эффективным средством про-филактики ХСН у больных с ОКС, не уступая по этомупоказателю иАПФ каптоприлу, что было подтвержденов крупном международном исследовании VALIANT [132]и при хронической ИБС, вне зависимости от уровня АД.
Таким образом, можно констатировать, что некото-рые АРА – кандесартан, валсартан и лозартан могут при-меняться для лечения ХСН при непереносимости иАПФ [256, 257, 260].
Сведения о трех наиболее эффективных АРА, приме-няемых сегодня для лечения и профилактики ХСН, пред-ставлены в таблице 18. Титрование доз АРА проводитсяпо тем же принципам, что и иАПФ. Стартовая доза канде-сартана – 4 мг однократно в сутки, которая при стабиль-ном АД и отсутствии осложнений удваивается каждые3–5 дней до достижения дозировки 16 мг однократнов сутки. У больных с высоким уровнем АД максимальнаядозировка – 32 мг однократно в сутки. При исходной гипо-тонии (САД менее 100 мм рт. ст.) терапию безопасно начинать с дозы 2 мг в сутки. Для валсартана стартовая доза –40 мг × 2 р / сут, которая может быть увеличена до 80 мг ×2 р / сут и максимально до 160 мг × 2 р / сут. При исходной гипотонии необходимо стартовать с дозы 20 мг × 2 р / сут.
Таблица 18. Дозировки АРА, рекомендуемых для профилактики и лечения ХСН
Следует помнить, что титрование дозы иАПФ – процесс сугубо индивидуальный и у каждого пациента свой оптимум и максимум в эффективных и переносимыхдозах лекарств. Тем более, что использование комбина-ции иАПФ с другими нейрогормональными ингибитора-ми (β-АБ, АМКР) у подавляющего числа больных ХСНпозволяет достигать эффекта с меньшим риском неже-лательных явлений, свойственных максимальным дозамлекарств. Однако останавливаться на минимальных дозахиАПФ, если пациент их хорошо переносит и у него нетснижения АД – это ошибка. При этом вы лишаете своегобольного дополнительных шансов на уменьшение обо-стрений болезни.
Ингибиторы АПФ можно назначать больным ХСНпри уровне САД выше 85 мм рт. ст. При исходно низкомCАД (85–100 мм рт. ст.) эффективность иАПФ сохраня-ется, поэтому их всегда и обязательно следует назначать,снижая стартовую дозу в два раза (для всех иАПФ).
Риск гипотонии возрастает:
A) у наиболее тяжелых больных ХСН IV ФК,
B) при сочетании иАПФ с ПВД (нитраты, БМКК),
C) при назначении после обильного диуреза,
D) у больных с высокоренинной формой ХСН.
Для избежания гипотензии первой дозы иАПФ следу-ет назначать не менее чем через 24 часа после обильно-го диуреза, предварительно отменив вазодилатирующиесредства.
В таблице 17 показаны дозы иАПФ, применяющихсяв лечении и профилактике ХСН в Российской Федерации.
В тех случаях, когда в скобках приведена цифра 2, этоозначает, что может иметь место как одно-, так и двух-кратное назначение препарата (двух- или трехкратноедля каптоприла).
Следует помнить, что при снижении почечной фильтра-ции ниже 60 мл / мин дозы всех иАПФ должны быть умень-шены вдвое, а при снижении ниже 30 мл / мин на 75 %.Это же относится и к лечению пожилых больных ХСН,у которых почечная функция, как правило, нарушена.
В этих случаях лучше предпочесть препараты с двой-ным путем выведения из организма (почки / желудочно-кишечный тракт)
Ниже представлены подробные рекомендациипо безопасномуначалу лечения ХСН препаратами груп-пы иАПФ, которые целесообразно выполнять у всехбольных ХСН и особенно у «проблемных» пациентовс исходной гипотонией, нарушенной функцией почек,гиперкалиемией:
A) еще раз оценить необходимость применения в исполь-зуемых дозировках диуретиков и особенно вазодилататоров;
B) не допускать чрезмерного диуреза перед началомлечения. Отменить диуретики за 24 ч до первого при-менения иАПФ в случае их использования;
C) целесообразно начинать терапию вечером, когдабольной находится в горизонтальном положении,чтобы снизить до минимума возможное негативноевлияние препарата на АД, хотя данных, подтверж-дающих это предположение относительно СН, нет (уровень доказательности В). Если лечение начинаютутром, рекомендуется наблюдение за АД в течениенескольких часов;
D) начинать лечение с малых доз и увеличиватьих до терапевтического уровня, который оказалсяэффективным по данным МРКИ (таблица 17);
E) избегать назначения калийсберегающих диурети-ков в начале лечения иАПФ, особенно у больныхс исходно высоким уровнем калия плазмы (выше5,2 ммоль / л). Однако это не противоречит рекомен-дациям по совместному применению иАПФ с высоки-ми дозами спиронолактона в период декомпенсациисердечной деятельности и сочетанию иАПФ с малымидозами АМКР при длительном лечении ХСН;
F) избегать назначения НПВП;
G) контролировать АД, содержание креатинина и элек-тролитов в крови через 2 недели после каждого после-дующего увеличения дозы.
За консультацией к специалисту-кардиологу следуетнаправлять больных, у которых:
A) причина СН неизвестна,
B) САД <100 мм рт. ст.,
C) содержание в сыворотке креатинина >130 мкмоль / л,или СКФ < 60 мл / мин и нет клинического эффекта,
D) содержание в сыворотке натрия <130 ммоль / л,
E) одержание в сыворотке калия >6,0 ммоль / л,
F) тяжелая СН,
G) клапанные пороки сердца, как причина СН.
При развитии серьезных нежелательных явленийи / или отсутствии эффекта от применения иАПФ можнопопробовать терапию АРА.
Антагонисты рецепторов к АII
Появление второго класса блокаторов РААС – селективных антагонистов рецепторов к АII (АРА) произошло уже после укрепления иАПФ на позициях основныхсредств лечения декомпенсации. Учитывая абсолютныепоказания к назначению иАПФ всем пациентам с ХСН,невозможно было организовать плацебо-контролируемые исследования с АРА в «эру иАПФ», что затруднялооценку истинных возможностей препаратов этого классау декомпенсированных больных. Хотя необходимо отметить «фирменную» особенность препаратов этого клас-са – прекрасную переносимость при минимуме побоч-ных эффектов. Кроме того, АРА крайне редко вызываюткашель и стандартно рекомендуются для лечения ХСН при непереносимости иАПФ (как это и указано в настоя-щих рекомендациях).
На начальном этапе первый АРА лозартан напрямуюсравнивался с эталонным иАПФ каптоприлом с целью доказать преимущества нового класса блокаторов РААСна смертность и заболеваемость больных ХСН [228],однако гипотеза о возможных преимуществах АРА в лече-нии ХСН не подтвердилась.
В исследовании ELITE II лозартан незначительно и недостоверно уступал каптоприлу по влиянию на прогноз пациентов с декомпенсацией и имел лучший профиль переносимости [228]. Относительная неудача лозар-тана (в сравнении с высокой дозой иАПФ каптопри-ла – 150 мг / сут) в этом исследовании, как и при леченииОИМ в исследовании ОРТIMAAL [224], связываетсяс применением недостаточных (50 мг 1 р / д) дозировок.В 2009 году завершилось крайне важное исследование HEAAL, впервые сравнившее эффективность различныхдозировок АРА в лечении ХСН. Было продемонстрирова-но, что применение лозартана в дозе 150 мг / сут достовер-но снижает риск смерти и госпитализаций больных ХСНв сравнении с дозой 50 мг / сут [256]. Смысл этого иссле-дования не только в «реабилитации» лозартана, как сред-ства лечения ХСН с возможностью снижения рискасмерти и госпитализации больных, но и в напоминании,что только оптимальные дозы блокаторов РААС позволяют рассчитывать на улучшение прогноза больных ХСН.
Лозартан в дозах 100 мг / сут может предупреждатьразвитие ХСН, в том числе у пациентов с диабетоми нефропатией [150], что обусловливает его применениедля профилактики декомпенсации сердечной деятельно-сти (класс рекомендаций IIA, степень доказанности В).
В дальнейшем все клинические исследования дока-зывали лишь то что АРА не уступают иАПФ в леченииХСН. Главной доказательной базой являются результа-ты трех исследований, вошедших в программу CHARM,в которых изучалась эффективность и безопасность при-менения АРА кандесартана у пациентов с ХСН и снижен-ной или сохранной ФВ ЛЖ [257–259]. В исследованииCHARM alternative кандесартан сравнивался с плацебоу пациентов с ХСН, сниженной ФВ ЛЖ <40 % и непере-носимостью иАПФ. В этом исследовании АРА кандесар-тан достоверно снижал риск первичной конечной точки(смерть плюс госпитализации в связи с обострениемХСН) на 23 %, но показатель смертности достоверноне менялся [257].
Ретроспективный анализ программы CHARM про-демонстрировал достоверное снижение смертности и сердечно-сосудистых госпитализаций среди пациентов с классической СН и низкой ФВ (<40 %) на фоне лечения кандесартаном. Снижение риска смерти составляло 33 %после первого, 20 % после второго и 12 % после третьегогода наблюдения, что очень близко к показателям, полу-ченным в исследовании SOLVD с «эталонным» иАПФэналаприлом (23 % через год, 23 % через два и 16 % черезтри года терапии, соответственно). Однако часть паци-ентов получала комбинацию иАПФ и АРА кандесарта-на, что может искажать результаты. С другой стороны,кандесартан был поставлен в более сложные условия,чем иАПФ, которые применялись на фоне комбинациилишь двух препаратов – сердечных гликозидов и моче-гонных. Эффект кандесартана доказан для больных ХСН,большинство из которых уже получали и гликозиды,и диуретики, и β-АБ, и антагонисты альдостерона, а частьи иАПФ, но не достигли состояния компенсации.
Дополнительное значение имеет анализ эффективности другого АРА – валсартана у больных, не получав-ших иАПФ в связи с их непереносимостью [260]. В этомслучае были впервые продемонстрированы способно-сти АРА не только к уменьшению числа госпитализаций,но и снижению риска смерти больных ХСН в сравнениис плацебо. Валсартан на 33 % снижал риск смерти и на 44 %риск смерти плюс повторных госпитализаций у деком-пенсированных больных, даже превосходя по этим пока-зателям кандесартан. Правда, эти результаты были полу-чены в ходе вторичного анализа.
Валсартан является эффективным средством про-филактики ХСН у больных с ОКС, не уступая по этомупоказателю иАПФ каптоприлу, что было подтвержденов крупном международном исследовании VALIANT [132]и при хронической ИБС, вне зависимости от уровня АД.
Таким образом, можно констатировать, что некото-рые АРА – кандесартан, валсартан и лозартан могут при-меняться для лечения ХСН при непереносимости иАПФ [256, 257, 260].
Сведения о трех наиболее эффективных АРА, приме-няемых сегодня для лечения и профилактики ХСН, пред-ставлены в таблице 18. Титрование доз АРА проводитсяпо тем же принципам, что и иАПФ. Стартовая доза канде-сартана – 4 мг однократно в сутки, которая при стабиль-ном АД и отсутствии осложнений удваивается каждые3–5 дней до достижения дозировки 16 мг однократнов сутки. У больных с высоким уровнем АД максимальнаядозировка – 32 мг однократно в сутки. При исходной гипо-тонии (САД менее 100 мм рт. ст.) терапию безопасно начинать с дозы 2 мг в сутки. Для валсартана стартовая доза –40 мг × 2 р / сут, которая может быть увеличена до 80 мг ×2 р / сут и максимально до 160 мг × 2 р / сут. При исходной гипотонии необходимо стартовать с дозы 20 мг × 2 р / сут.
Таблица 18. Дозировки АРА, рекомендуемых для профилактики и лечения ХСН
 Стартовая доза лозартана для лечения ХСН 50 мг ×1 р / сут, которая должна титроваться до оптимальной –150 мг / сут. При исходной гипотонии начало терапиис дозы 25 мг × 1 р / сут. Для профилактики ХСН (при АГ,СД и ХПН) рекомендуется назначать АРА лозартан в дозе100 мг × 1 р / сут.
Возможности комбинирования иАПФ и АРА в лечении больных ХСН
Достаточно сложным является и вопрос о комбиниро-ванном применении иАПФ и АРА. Здесь возможны дваварианта – начало лечения сразу с комбинации иАПФи АРА или присоединение АРА к лечению больных, нахо-дящихся на длительной терапии иАПФ при невысокойэффективности последней. Первый вариант – одновременногоназначения иАПФ и АРА у больных ХСНне исследовался из-за риска чрезмерного снижения АДи роста нежелательных явлений. Hо попытки лечениябольных, перенесших ОИМ (VALIANT), и пациентоввысокого CC риска (ONTARGET) с одновременнымназначением иАПФ и АРА оказались неудачными. В обо-их случаях дополнительного влияния на заболеваемостьи смертность получено не было, а число побочных реак-ций (в том числе симптомных гипотоний и ухудшенияфункции почек) значительно увеличивалось [124, 132].Таким образом, применение комбинации иАПФ с АРАв качестве стартового лечения не может быть рекомен-довано ни одной категории кардиологических больных(класс рекомендаций III, степень доказанности А).
Возможности добавления АРА в качестве дополни-тельного блокатора РААС больным ХСН, находившимсяна длительном лечении иАПФ, исследовались в специ-альных программах CHARM–additive (с кандесартаном)и Val–HeFT (с валсартаном) [258, 261]. Применениеобоих АРА на фоне длительного лечения иАПФ приводи-ло к дополнительному достоверному снижению комби-нированной конечной точки (смерть + госпитализациииз-за прогрессирования ХСН) на 13–15 %, в основномза счет снижения обострений ХСН. Кроме того, приме-нение валсартана сопровождается клиническим улучше-нием и значительной блокадой процессов ремоделирова-ния сердца [261–263].
Исходя из имеющихся на сегодня данных АРА можноназначать дополнительно к иАПФ после того, как эффектпоследних ослабевает в ходе длительной терапии. Однакоучитывая, что все пациенты с ХСН и II–IV ФК должнынаходиться на тройной терапии нейрогормональнымимодуляторами (иАПФ + β-АБ + АМКР), в действительно-сти речь идет о назначении четвертого нейрогормональ-ного блокатора (!). Показано, что комбинация иАПФс АРА (и нередко при дополнительном назначении β-АБи АМКР) способна в большей степени блокировать ней-рогормоны и процессы ремоделирования, что доказанодля кандесартана [222] и валсартана [261, 263]. Доказано,что комбинация иАПФ + β-АБ + АМКР+ АРА может при-водить к чрезмерному снижению уровня АД и реактива-ции нейрогормональных систем, ответственных за про-грессирование ХСН [264]. Второй опасностью являетсяпрогрессирующее ухудшение функции почек и риск раз-вития гиперкалиемии. Поэтому рекомендация по вклю-чению АРА в комплекс нейрогормональной блокадыпри ХСН имеет невысокий класс (IIB, А).
Не выявлено гендерных различий в эффективно-сти АРА при ХСН (Val–HeFT, CHARM, ELITE–II),что выгодно отличает этот класс препаратов от иАПФ.Результаты когортных исследований и данные последнихмета-анализов показывают значительное преимуществоАРА над иАПФ в лечении женщин, особенно при сочета-нии АГ и ХСН [265].
Блокаторы β-адренергических рецепторов
Рациональным обоснованием применения β-АБ в леченииХСН является блокада симпатико-адреналовой систе-мы (САС), которая находится в состоянии хроническойгиперактивации у больных с декомпенсацией и опреде-ляет плохой прогноз (высокую смертность) этих паци-ентов [266]. Активность САС прогрессивно нарастаетпараллельно увеличению тяжести ХСН, причем, начи-ная со II стадии болезни или со II ФК, преобладающимистановятся негативные дезадаптивные свойства кате-холаминов [267–270]. В связи с этим применение β-АБстановится наиболее целесообразным и эффективныму пациентов с клинически выраженной ХСН II–IV ФК.Доказано, что гиперактивация САС способствует досто-верному увеличению как риска внезапной смерти, таки смерти от прогрессирования декомпенсации. Поэтомуосновная идея применения β-АБ в лечении больныхХСН – это улучшение прогноза и снижение смертности.
В настоящее время доказано, что β-АБ оказывают бло-кирующее действие и на некоторые другие нейрогормо-нальные системы, ответственные за прогрессированиеХСН – РААС, эндотелиновую систему и систему цитоки-нов. Таким образом, β-АБ в лечении ХСН – это не только средства, блокирующие влияние катехоламиновна β-адренергическиерецепторы (хотя это очень важ-но), но и комплексные нейрогормональные модуляторы,оптимально дополняющие эффекты иАПФ [268, 271].
Негативные последствия гиперактивации САС макси-мально проявляются в результате чрезмерной стимуляцииβ1-рецепторов, поэтому применение β1‑селективных(часто ошибочно используется термин кардиоселек-тивных) β-АБ в лечении больных ХСН вполне обо-сновано и эффективно. Хотя имеются предположения,что использование β-АБ с дополнительными свой-ствами, например, β1-, β2-, α1-блокатора карведилолаили высокоселективного β-АБ небиволола, одновре-менно увеличивающего синтез оксида азота в эндотели-альных клетках, может быть более эффективным за счетдополнительных вазодилатирующих свойств (степеньдоказанности С) [272–275].
К положительным свойствам β-АБ при ХСН относит-ся способность:A) уменьшать дисфункцию и смерть кардиомиоцитовкак путем некроза, так и апоптоза;B) уменьшать число гибернирующих (находящихсяв «спячке») кардиомиоцитов;C) при длительном применении за счет увеличениязон сокращающегося миокарда улучшать показателигемодинамики;D) повышать плотность и аффинность β-адренорецепторов,которые резко снижены у больных ХСН;E) уменьшать гипертрофию миокарда;F) снижать ЧСС, что является «зеркалом» успешногоприменения β-АБ у больных ХСН. Уменьшение ЧССминимум на 15 % от исходной величины характеризу-ет правильное лечение β-АБ больных ХСН;G) уменьшать степень ишемии миокарда в покое и осо-бенно при физической активности;H) несколько уменьшать частоту желудочковых аритмий;I) оказывать антифибрилляторное действие, что снижа-ет риск внезапной смерти.
Таким образом, наряду с улучшением прогноза β-АБуменьшают степень ремоделирования сердца, т. е. оказы-вают кардиопротекторное действие, позволяющее замедлять прогрессирование декомпенсации и снижать числогоспитализаций [276–281].
Главным же негативным свойством, в течение многихлет препятствующим включению β-АБ в число основныхпрепаратов для лечения ХСН, считался их отрицательныйинотропный эффект, который, по мнению многих кардиологови терапевтов, был способен стимулировать усугу-бление проявлений ХСН. В настоящее время доказананекая двухфазность влияния β-АБ на центральную гемо-динамику у больных ХСН [268, 282, 283]. Действительно,в первые две недели лечения этими препаратами сердеч-ный выброс может снижаться (как за счет уменьшениясобственно сократимости, так и в результате сниженияЧСС), а клинические проявления ХСН даже нескольконарастать. Но затем в результате уменьшения тахикардиии потребления миокардом кислорода гибернированныекардиомиоциты восстанавливают свою сократимостьи сердечный выброс начинает расти. Причем некоторыеβ-АБ (карведилол) при длительном применении позво-ляют добиваться бóльшего роста ФВ, чем номинальныеположительные инотропные агенты (в частности, сердеч-ные гликозиды) [284].
К настоящему времени завершено более 30 плаце-бо-контролируемых исследований, включавших свыше20 тыс. больных ХСН со сниженной ФВ ЛЖ <40 %, кото-рые показали способность β-АБ снижать смертностьбольных с декомпенсацией на 29 % (что даже больше,чем при применении иАПФ). Хотя, справедливости ради,нужно отметить, что в большинстве случаев β-АБ приме-нялись дополнительно к иАПФ [1, 4, 6, 8].
В связи с многочисленными вопросами и комментари-ями по поводу применения β-АБ при лечении ХСН нижеприводятся результаты важнейших исследований, сфор-мировавших концепцию использования этой группы пре-паратов для лечения ХСН:
A) MDC с β1‑селективным β-АБ метопролола тартратом(около 400 больных ХСН на почве ДКМП), не пока-завшее снижения смертности, хотя снижалась часто-та комбинированной конечной точки в виде числасмертей плюс пересадок сердца [285];
B) CIBIS–II с β1‑селективным β-АБ бисопрололом(более 2 600 больных ХСН III–IV ФК), показавшееснижение риска смерти на 34 % [282];
C) MERIT–HF с β1‑селективным β-АБ метопролола сук-цинатом замедленного высвобождения (почти 4 тыс.больных ХСН II–IV ФК), продемонстрировавшееснижение риска смерти также на 34 % [279];
D) COPERNICUS с неселективным β1- и β2-, а такжеα1‑блокатором карведилолом (более 2 200 больныхХСН с исходной ФВ <25 %), позволившее снизитьриск смерти на 35 % [284];
E) мета-анализ четырех протоколов, проводившихсяв США с карведилолом (USCP), включивший около1 тыс. больных ХСН II–IV ФК и показавший сниже-ние риска смерти на 65 % [276];
F) Австралийско-Новозеландское исследование по при-менению карведилола у более чем 400 пациентов с ХСН II–III ФК ишемической этиологии, позволив-шее снизить риск смерти на 28 % [277];
G) исследование COMET (более 3 000 больных ХСН),напрямую сравнившее эффективность примене-ния неселективного β- и α-блокатора карведилолаи β1‑селективного короткодействующего β-АБ мето-пролола тартрата и продемонстрировавшее досто-верное преимущество карведилола по снижениюриска смерти на 17 % [286];
H) исследование SENIORS с высоко β1‑селективнымβ-АБ, обладающим дополнительным влиянием на син-тез оксида азота в эндотелии сосудов, небивололом(более чем 2 100 больных ХСН старше 70 лет), про-демонстрировавшее достоверное снижение суммысмертей и сердечно-сосудистых госпитализаций (пер-вичная точка исследования) на 14 % и незначительноеснижение общей смертности на 12 % (р=0,21) [281]. Следует отметить отличия исследования SENIORS,в котором применялся небиволол. Пациенты с ХСНв этом случае были гораздо старше и более ⅓ из нихимели ФВ ЛЖ >35 %, что отличается от всех иссле-дований с другими β-АБ. Для более адекватногосравнения эффектов небиволола с другими β-АБ,использовавшимися в лечении ХСН, был проведендополнительный анализ относительно более «моло-дых» пациентов (моложе среднего возраста 75,2 лет,т. е. 70–75 лет). Этот анализ продемонстрировал сни-жение первичной конечной точки на 27 %, а общейсмертности на 38 %, что полностью соответствуетрезультам применения бисопролола, карведилолаи метопролола сукцината замедленного выведения;
I) по результатам многоцентрового рандомизирован-ного исследования НЕМЕЗИДА, организованногои проведенного под эгидой ОССН, было проде-монстрировано, что небиволол в адекватных дозах,по крайней мере, не уступает метопрололу в контроле ЧСС, АД и повышению ФВ ЛЖ; дополнительнонебиволол уменьшает внутриаортальное сопротив-ление сердечному выбросу, что сопрвождается разгрузкой левых отделов сердца (лучшее наполнениеЛЖ в диастолу и уменьшение размеров левого пред-сердия). Эти эффекты могут быть связаны с дополни-тельной вазодилатацией и улучшением периферического кровотока, что не усугубляет нарушения усвоения глюкозы мышцами (инсулинорезистентности);
J) исследование CIBIS–III у 1050 больных ХСН II–III ФК, доказавшее, что по эффективности и безопас-ности начало лечения с β1‑селективного β-АБ бисо-пролола (в течение 6 месяцев) с последующим переводом на его комбинацию с эналаприлом не уступаетобщепринятому режиму – началу лечения с иАПФэналаприла с последующим переводом на комбина-цию иАПФ плюс β-АБ (при анализе тех пациентов,которые выполнили протокол исследования) [287].
Таким образом, в четырех наиболее успешных протоколах (CIBIS–II, MERIT–HF, COPERNICUSи SENIORS) четыре различных (по влиянию на типы рецепторов и возможности вазодилатации) β-АБ показали практически одинаковое снижение риска смертибольных ХСН. Кроме того, и бисопролол, и метопрололасукцинат замедленного выведения, и карведилол и неби-волол достоверно уменьшали как риск внезапной смер-ти, так и смерти от прогрессирования ХСН и снижаличастоту госпитализаций.
Другие β-АБ, включая атенолол и метопролола тартраткороткого действия, не показали способности улучшатьпрогноз больных ХСН. Применение атенолола и метопро-лола тартрата для лечения больных ХСН нецелесообразно(класс рекомендаций III, степень доказанности А).
В лечении пожилых больных ХСН (старше 70 лет)наиболее доказан эффект небиволола, обладающего,ко всему прочему, высоким профилем безопасности.Ретроспективный анализ показывает, что другие β-АБ,рекомендованные для лечения ХСН – бисопрололи метопролола сукцинат замедленного выведения так-же снижают риск госпитализаций и улучшают прогнозбольных ХСН старше 65 лет.
По способности снижать риск заболеваемости и смерти декомпенсированных больных β-АБ даже превосходятиАПФ.
Сегодня β-АБ наряду с иАПФ являются главными средствами лечения ХСН cо сниженной систолическойфункцией сердца. Их способность замедлять прогрес-сирование болезни, уменьшать число госпитализацийи улучшать прогноз декомпенсированных больныхне вызывает сомнений (класс рекомендаций I, уровеньдоказанности А).
β-АБ должны применяться у всех больных ХСН с ФВ<40 %, не имеющих противопоказаний (обычных для этойгруппы лекарств). Это очень важное положение, ставшеепостулатом лишь в последние годы. Тяжесть декомпен-сации, пол, возраст, уровень исходного давления (есте-ственно, если САД исходно больше 85 мм рт. ст.) и исход-ная ЧСС не играют самостоятельной роли в определе-нии противопоказаний к назначению β-АБ. Хотя эффектот лечения более выражен у больных с исходной тахикардией (более 80 уд / мин) и достаточно высоким АД (систолическое более 100 мм рт. ст.) (степень доказанности В).
Таблица 19. Дозировки β-АБ , рекомендуемых для лечения больных ХСН
Стартовая доза лозартана для лечения ХСН 50 мг ×1 р / сут, которая должна титроваться до оптимальной –150 мг / сут. При исходной гипотонии начало терапиис дозы 25 мг × 1 р / сут. Для профилактики ХСН (при АГ,СД и ХПН) рекомендуется назначать АРА лозартан в дозе100 мг × 1 р / сут.
Возможности комбинирования иАПФ и АРА в лечении больных ХСН
Достаточно сложным является и вопрос о комбиниро-ванном применении иАПФ и АРА. Здесь возможны дваварианта – начало лечения сразу с комбинации иАПФи АРА или присоединение АРА к лечению больных, нахо-дящихся на длительной терапии иАПФ при невысокойэффективности последней. Первый вариант – одновременногоназначения иАПФ и АРА у больных ХСНне исследовался из-за риска чрезмерного снижения АДи роста нежелательных явлений. Hо попытки лечениябольных, перенесших ОИМ (VALIANT), и пациентоввысокого CC риска (ONTARGET) с одновременнымназначением иАПФ и АРА оказались неудачными. В обо-их случаях дополнительного влияния на заболеваемостьи смертность получено не было, а число побочных реак-ций (в том числе симптомных гипотоний и ухудшенияфункции почек) значительно увеличивалось [124, 132].Таким образом, применение комбинации иАПФ с АРАв качестве стартового лечения не может быть рекомен-довано ни одной категории кардиологических больных(класс рекомендаций III, степень доказанности А).
Возможности добавления АРА в качестве дополни-тельного блокатора РААС больным ХСН, находившимсяна длительном лечении иАПФ, исследовались в специ-альных программах CHARM–additive (с кандесартаном)и Val–HeFT (с валсартаном) [258, 261]. Применениеобоих АРА на фоне длительного лечения иАПФ приводи-ло к дополнительному достоверному снижению комби-нированной конечной точки (смерть + госпитализациииз-за прогрессирования ХСН) на 13–15 %, в основномза счет снижения обострений ХСН. Кроме того, приме-нение валсартана сопровождается клиническим улучше-нием и значительной блокадой процессов ремоделирова-ния сердца [261–263].
Исходя из имеющихся на сегодня данных АРА можноназначать дополнительно к иАПФ после того, как эффектпоследних ослабевает в ходе длительной терапии. Однакоучитывая, что все пациенты с ХСН и II–IV ФК должнынаходиться на тройной терапии нейрогормональнымимодуляторами (иАПФ + β-АБ + АМКР), в действительно-сти речь идет о назначении четвертого нейрогормональ-ного блокатора (!). Показано, что комбинация иАПФс АРА (и нередко при дополнительном назначении β-АБи АМКР) способна в большей степени блокировать ней-рогормоны и процессы ремоделирования, что доказанодля кандесартана [222] и валсартана [261, 263]. Доказано,что комбинация иАПФ + β-АБ + АМКР+ АРА может при-водить к чрезмерному снижению уровня АД и реактива-ции нейрогормональных систем, ответственных за про-грессирование ХСН [264]. Второй опасностью являетсяпрогрессирующее ухудшение функции почек и риск раз-вития гиперкалиемии. Поэтому рекомендация по вклю-чению АРА в комплекс нейрогормональной блокадыпри ХСН имеет невысокий класс (IIB, А).
Не выявлено гендерных различий в эффективно-сти АРА при ХСН (Val–HeFT, CHARM, ELITE–II),что выгодно отличает этот класс препаратов от иАПФ.Результаты когортных исследований и данные последнихмета-анализов показывают значительное преимуществоАРА над иАПФ в лечении женщин, особенно при сочета-нии АГ и ХСН [265].
Блокаторы β-адренергических рецепторов
Рациональным обоснованием применения β-АБ в леченииХСН является блокада симпатико-адреналовой систе-мы (САС), которая находится в состоянии хроническойгиперактивации у больных с декомпенсацией и опреде-ляет плохой прогноз (высокую смертность) этих паци-ентов [266]. Активность САС прогрессивно нарастаетпараллельно увеличению тяжести ХСН, причем, начи-ная со II стадии болезни или со II ФК, преобладающимистановятся негативные дезадаптивные свойства кате-холаминов [267–270]. В связи с этим применение β-АБстановится наиболее целесообразным и эффективныму пациентов с клинически выраженной ХСН II–IV ФК.Доказано, что гиперактивация САС способствует досто-верному увеличению как риска внезапной смерти, таки смерти от прогрессирования декомпенсации. Поэтомуосновная идея применения β-АБ в лечении больныхХСН – это улучшение прогноза и снижение смертности.
В настоящее время доказано, что β-АБ оказывают бло-кирующее действие и на некоторые другие нейрогормо-нальные системы, ответственные за прогрессированиеХСН – РААС, эндотелиновую систему и систему цитоки-нов. Таким образом, β-АБ в лечении ХСН – это не только средства, блокирующие влияние катехоламиновна β-адренергическиерецепторы (хотя это очень важ-но), но и комплексные нейрогормональные модуляторы,оптимально дополняющие эффекты иАПФ [268, 271].
Негативные последствия гиперактивации САС макси-мально проявляются в результате чрезмерной стимуляцииβ1-рецепторов, поэтому применение β1‑селективных(часто ошибочно используется термин кардиоселек-тивных) β-АБ в лечении больных ХСН вполне обо-сновано и эффективно. Хотя имеются предположения,что использование β-АБ с дополнительными свой-ствами, например, β1-, β2-, α1-блокатора карведилолаили высокоселективного β-АБ небиволола, одновре-менно увеличивающего синтез оксида азота в эндотели-альных клетках, может быть более эффективным за счетдополнительных вазодилатирующих свойств (степеньдоказанности С) [272–275].
К положительным свойствам β-АБ при ХСН относит-ся способность:A) уменьшать дисфункцию и смерть кардиомиоцитовкак путем некроза, так и апоптоза;B) уменьшать число гибернирующих (находящихсяв «спячке») кардиомиоцитов;C) при длительном применении за счет увеличениязон сокращающегося миокарда улучшать показателигемодинамики;D) повышать плотность и аффинность β-адренорецепторов,которые резко снижены у больных ХСН;E) уменьшать гипертрофию миокарда;F) снижать ЧСС, что является «зеркалом» успешногоприменения β-АБ у больных ХСН. Уменьшение ЧССминимум на 15 % от исходной величины характеризу-ет правильное лечение β-АБ больных ХСН;G) уменьшать степень ишемии миокарда в покое и осо-бенно при физической активности;H) несколько уменьшать частоту желудочковых аритмий;I) оказывать антифибрилляторное действие, что снижа-ет риск внезапной смерти.
Таким образом, наряду с улучшением прогноза β-АБуменьшают степень ремоделирования сердца, т. е. оказы-вают кардиопротекторное действие, позволяющее замедлять прогрессирование декомпенсации и снижать числогоспитализаций [276–281].
Главным же негативным свойством, в течение многихлет препятствующим включению β-АБ в число основныхпрепаратов для лечения ХСН, считался их отрицательныйинотропный эффект, который, по мнению многих кардиологови терапевтов, был способен стимулировать усугу-бление проявлений ХСН. В настоящее время доказананекая двухфазность влияния β-АБ на центральную гемо-динамику у больных ХСН [268, 282, 283]. Действительно,в первые две недели лечения этими препаратами сердеч-ный выброс может снижаться (как за счет уменьшениясобственно сократимости, так и в результате сниженияЧСС), а клинические проявления ХСН даже нескольконарастать. Но затем в результате уменьшения тахикардиии потребления миокардом кислорода гибернированныекардиомиоциты восстанавливают свою сократимостьи сердечный выброс начинает расти. Причем некоторыеβ-АБ (карведилол) при длительном применении позво-ляют добиваться бóльшего роста ФВ, чем номинальныеположительные инотропные агенты (в частности, сердеч-ные гликозиды) [284].
К настоящему времени завершено более 30 плаце-бо-контролируемых исследований, включавших свыше20 тыс. больных ХСН со сниженной ФВ ЛЖ <40 %, кото-рые показали способность β-АБ снижать смертностьбольных с декомпенсацией на 29 % (что даже больше,чем при применении иАПФ). Хотя, справедливости ради,нужно отметить, что в большинстве случаев β-АБ приме-нялись дополнительно к иАПФ [1, 4, 6, 8].
В связи с многочисленными вопросами и комментари-ями по поводу применения β-АБ при лечении ХСН нижеприводятся результаты важнейших исследований, сфор-мировавших концепцию использования этой группы пре-паратов для лечения ХСН:
A) MDC с β1‑селективным β-АБ метопролола тартратом(около 400 больных ХСН на почве ДКМП), не пока-завшее снижения смертности, хотя снижалась часто-та комбинированной конечной точки в виде числасмертей плюс пересадок сердца [285];
B) CIBIS–II с β1‑селективным β-АБ бисопрололом(более 2 600 больных ХСН III–IV ФК), показавшееснижение риска смерти на 34 % [282];
C) MERIT–HF с β1‑селективным β-АБ метопролола сук-цинатом замедленного высвобождения (почти 4 тыс.больных ХСН II–IV ФК), продемонстрировавшееснижение риска смерти также на 34 % [279];
D) COPERNICUS с неселективным β1- и β2-, а такжеα1‑блокатором карведилолом (более 2 200 больныхХСН с исходной ФВ <25 %), позволившее снизитьриск смерти на 35 % [284];
E) мета-анализ четырех протоколов, проводившихсяв США с карведилолом (USCP), включивший около1 тыс. больных ХСН II–IV ФК и показавший сниже-ние риска смерти на 65 % [276];
F) Австралийско-Новозеландское исследование по при-менению карведилола у более чем 400 пациентов с ХСН II–III ФК ишемической этиологии, позволив-шее снизить риск смерти на 28 % [277];
G) исследование COMET (более 3 000 больных ХСН),напрямую сравнившее эффективность примене-ния неселективного β- и α-блокатора карведилолаи β1‑селективного короткодействующего β-АБ мето-пролола тартрата и продемонстрировавшее досто-верное преимущество карведилола по снижениюриска смерти на 17 % [286];
H) исследование SENIORS с высоко β1‑селективнымβ-АБ, обладающим дополнительным влиянием на син-тез оксида азота в эндотелии сосудов, небивололом(более чем 2 100 больных ХСН старше 70 лет), про-демонстрировавшее достоверное снижение суммысмертей и сердечно-сосудистых госпитализаций (пер-вичная точка исследования) на 14 % и незначительноеснижение общей смертности на 12 % (р=0,21) [281]. Следует отметить отличия исследования SENIORS,в котором применялся небиволол. Пациенты с ХСНв этом случае были гораздо старше и более ⅓ из нихимели ФВ ЛЖ >35 %, что отличается от всех иссле-дований с другими β-АБ. Для более адекватногосравнения эффектов небиволола с другими β-АБ,использовавшимися в лечении ХСН, был проведендополнительный анализ относительно более «моло-дых» пациентов (моложе среднего возраста 75,2 лет,т. е. 70–75 лет). Этот анализ продемонстрировал сни-жение первичной конечной точки на 27 %, а общейсмертности на 38 %, что полностью соответствуетрезультам применения бисопролола, карведилолаи метопролола сукцината замедленного выведения;
I) по результатам многоцентрового рандомизирован-ного исследования НЕМЕЗИДА, организованногои проведенного под эгидой ОССН, было проде-монстрировано, что небиволол в адекватных дозах,по крайней мере, не уступает метопрололу в контроле ЧСС, АД и повышению ФВ ЛЖ; дополнительнонебиволол уменьшает внутриаортальное сопротив-ление сердечному выбросу, что сопрвождается разгрузкой левых отделов сердца (лучшее наполнениеЛЖ в диастолу и уменьшение размеров левого пред-сердия). Эти эффекты могут быть связаны с дополни-тельной вазодилатацией и улучшением периферического кровотока, что не усугубляет нарушения усвоения глюкозы мышцами (инсулинорезистентности);
J) исследование CIBIS–III у 1050 больных ХСН II–III ФК, доказавшее, что по эффективности и безопас-ности начало лечения с β1‑селективного β-АБ бисо-пролола (в течение 6 месяцев) с последующим переводом на его комбинацию с эналаприлом не уступаетобщепринятому режиму – началу лечения с иАПФэналаприла с последующим переводом на комбина-цию иАПФ плюс β-АБ (при анализе тех пациентов,которые выполнили протокол исследования) [287].
Таким образом, в четырех наиболее успешных протоколах (CIBIS–II, MERIT–HF, COPERNICUSи SENIORS) четыре различных (по влиянию на типы рецепторов и возможности вазодилатации) β-АБ показали практически одинаковое снижение риска смертибольных ХСН. Кроме того, и бисопролол, и метопрололасукцинат замедленного выведения, и карведилол и неби-волол достоверно уменьшали как риск внезапной смер-ти, так и смерти от прогрессирования ХСН и снижаличастоту госпитализаций.
Другие β-АБ, включая атенолол и метопролола тартраткороткого действия, не показали способности улучшатьпрогноз больных ХСН. Применение атенолола и метопро-лола тартрата для лечения больных ХСН нецелесообразно(класс рекомендаций III, степень доказанности А).
В лечении пожилых больных ХСН (старше 70 лет)наиболее доказан эффект небиволола, обладающего,ко всему прочему, высоким профилем безопасности.Ретроспективный анализ показывает, что другие β-АБ,рекомендованные для лечения ХСН – бисопрололи метопролола сукцинат замедленного выведения так-же снижают риск госпитализаций и улучшают прогнозбольных ХСН старше 65 лет.
По способности снижать риск заболеваемости и смерти декомпенсированных больных β-АБ даже превосходятиАПФ.
Сегодня β-АБ наряду с иАПФ являются главными средствами лечения ХСН cо сниженной систолическойфункцией сердца. Их способность замедлять прогрес-сирование болезни, уменьшать число госпитализацийи улучшать прогноз декомпенсированных больныхне вызывает сомнений (класс рекомендаций I, уровеньдоказанности А).
β-АБ должны применяться у всех больных ХСН с ФВ<40 %, не имеющих противопоказаний (обычных для этойгруппы лекарств). Это очень важное положение, ставшеепостулатом лишь в последние годы. Тяжесть декомпен-сации, пол, возраст, уровень исходного давления (есте-ственно, если САД исходно больше 85 мм рт. ст.) и исход-ная ЧСС не играют самостоятельной роли в определе-нии противопоказаний к назначению β-АБ. Хотя эффектот лечения более выражен у больных с исходной тахикардией (более 80 уд / мин) и достаточно высоким АД (систолическое более 100 мм рт. ст.) (степень доказанности В).
Таблица 19. Дозировки β-АБ , рекомендуемых для лечения больных ХСН
 Тем не менее при обычных клинических ситуациях β-АБ должны применяться только вместе с иАПФи у больных, у которых достигнута стабилизация состояния. Важно помнить, что β-АБ не относятся к числусредств «скорой помощи» и не могут выводить больных из состояния декомпенсации и гипергидратации.
В подавляющем большинстве случаев терапия начинается с иАПФ с возможно более быстрым добавлени-ем β-АБ. В редких клинических ситуациях (преобладание выраженной тахикардии при невысоком АД, когдаодновременное назначение иАПФ и β-АБ затруднено) можно начать терапию с β1селективного β-АБ бисопро-лола с последующим присоединением иАПФ. Наиболееоправдан такой порядок лечения при исходно низкой ФВ<28 % (класс рекомендаций IIB, степень доказанности В). Конечная цель в любом случае – максимально быстрыйперевод больных ХСН на комбинацию иАПФ плюс β-АБили β-АБ плюс иАПФ [274, 287].
β-АБ оказывают у женщин столь же выраженный эффект по снижению смертности, как и у мужчин(мета-анализ исследований CIBIS–II, MERIT–HF, BEST,COPERNICUS, US Carvedilol HF, а также данные иссле-дования CIBIS–III, SENIORS) [288].
В таблице 19 представлены оптимальные дозы β-АБ,применяющиеся в лечении ХСН.
Лечение β-АБ при ХСН должно начинаться осторожно, начиная с ⅛ терапевтической дозы, которая показана в таблице 19, как стартовая. Дозы увеличиваются медленно (не чаще 1 раза в две недели,а при сомнительной переносимости и чрезмерном снижении АД – 1 раз в месяц) до достижения оптимальной, указанной как терапевтическая. Как и в случаес иАПФ, необходимо помнить, что у каждого больногосвоя оптимальная дозировка β-АБ, которая определя-ется снижением ЧСС до уровня <70 уд / мин. Толькоснижение ЧСС (а не доза β-АБ и не исходная ЧСС)определяет эффективность лечения. На каждые 5 уда-ров снижения ЧСС достигается 18 % снижения рискасмерти больных ХСН [289].
Примеры титрования дозы β-АБ:
A) Для бисопролола: 1,25 мг – 2 недели; затем 2,5 мг до 4‑йнедели; 3,75 мг до 6‑й недели, 5 мг до 8‑й недели, 7,5 мгдо 10‑й недели и затем, наконец – 10 мг к 12‑й неделелечения. При сомнительной переносимости (появлениепобочных реакций и снижение САД ниже 85 мм рт. ст.)периоды титрования составят промежутки по 4 неделии оптимальная доза будет достигнута лишь к 24-й неде-ле, то есть через полгода после начала терапии. Спешкапри титровании дозы β-АБ больным ХСН не нужна.
B) Для метопролола сукцината (ЗОК) шаги титрованиясоставят: 12,5–25–50–75–100–200 мг.
C) Для карведилола: 3,125 мг × 2 раза, затем 6,25 мг ×2 раза, затем 12,5 мг × 2 раза, затем 18,75 мг × 2 раза и,наконец, 25 мг × 2 раза.
D) Для небиволола – 1,25 мг, затем – 2,5, 5 мг, потом –7,5 и 10 мг.
Часть пациентов с ХСН в реальной практике ужеможет находиться на лечении не рекомендованными β-АБ (чаще всего атенололом или метопролола тартратомкороткого действия). Перевод на рекомендованные пре-параты следует осуществлять в соответствии с данными,представленными в таблице 20.
Таблица 20. Таблица перевода больных ХСН с атенололаи метопролола тартрата на рекомендованные β-АБ
Тем не менее при обычных клинических ситуациях β-АБ должны применяться только вместе с иАПФи у больных, у которых достигнута стабилизация состояния. Важно помнить, что β-АБ не относятся к числусредств «скорой помощи» и не могут выводить больных из состояния декомпенсации и гипергидратации.
В подавляющем большинстве случаев терапия начинается с иАПФ с возможно более быстрым добавлени-ем β-АБ. В редких клинических ситуациях (преобладание выраженной тахикардии при невысоком АД, когдаодновременное назначение иАПФ и β-АБ затруднено) можно начать терапию с β1селективного β-АБ бисопро-лола с последующим присоединением иАПФ. Наиболееоправдан такой порядок лечения при исходно низкой ФВ<28 % (класс рекомендаций IIB, степень доказанности В). Конечная цель в любом случае – максимально быстрыйперевод больных ХСН на комбинацию иАПФ плюс β-АБили β-АБ плюс иАПФ [274, 287].
β-АБ оказывают у женщин столь же выраженный эффект по снижению смертности, как и у мужчин(мета-анализ исследований CIBIS–II, MERIT–HF, BEST,COPERNICUS, US Carvedilol HF, а также данные иссле-дования CIBIS–III, SENIORS) [288].
В таблице 19 представлены оптимальные дозы β-АБ,применяющиеся в лечении ХСН.
Лечение β-АБ при ХСН должно начинаться осторожно, начиная с ⅛ терапевтической дозы, которая показана в таблице 19, как стартовая. Дозы увеличиваются медленно (не чаще 1 раза в две недели,а при сомнительной переносимости и чрезмерном снижении АД – 1 раз в месяц) до достижения оптимальной, указанной как терапевтическая. Как и в случаес иАПФ, необходимо помнить, что у каждого больногосвоя оптимальная дозировка β-АБ, которая определя-ется снижением ЧСС до уровня <70 уд / мин. Толькоснижение ЧСС (а не доза β-АБ и не исходная ЧСС)определяет эффективность лечения. На каждые 5 уда-ров снижения ЧСС достигается 18 % снижения рискасмерти больных ХСН [289].
Примеры титрования дозы β-АБ:
A) Для бисопролола: 1,25 мг – 2 недели; затем 2,5 мг до 4‑йнедели; 3,75 мг до 6‑й недели, 5 мг до 8‑й недели, 7,5 мгдо 10‑й недели и затем, наконец – 10 мг к 12‑й неделелечения. При сомнительной переносимости (появлениепобочных реакций и снижение САД ниже 85 мм рт. ст.)периоды титрования составят промежутки по 4 неделии оптимальная доза будет достигнута лишь к 24-й неде-ле, то есть через полгода после начала терапии. Спешкапри титровании дозы β-АБ больным ХСН не нужна.
B) Для метопролола сукцината (ЗОК) шаги титрованиясоставят: 12,5–25–50–75–100–200 мг.
C) Для карведилола: 3,125 мг × 2 раза, затем 6,25 мг ×2 раза, затем 12,5 мг × 2 раза, затем 18,75 мг × 2 раза и,наконец, 25 мг × 2 раза.
D) Для небиволола – 1,25 мг, затем – 2,5, 5 мг, потом –7,5 и 10 мг.
Часть пациентов с ХСН в реальной практике ужеможет находиться на лечении не рекомендованными β-АБ (чаще всего атенололом или метопролола тартратомкороткого действия). Перевод на рекомендованные пре-параты следует осуществлять в соответствии с данными,представленными в таблице 20.
Таблица 20. Таблица перевода больных ХСН с атенололаи метопролола тартрата на рекомендованные β-АБ
 Если больные получают очень малые дозы атенолола(<25 мг / сут) или метопролола тартрата (<25 мг / сут),то титрование доз рекомендованных β-АБ необходимо начинать с общепринятых стартовых доз. Если пациентыпринимали средние дозировки атенолола (25–75 мг / сут)или метопролола тартрата (25–75 мг / сут), то титрование рекомендованных β-АБ можно начать сразу со второй ступени. Наконец, если пациенты успешно прини-мали высокие дозы атенолола (>75 мг / сут) или метопролола тартрата (>75 мг / сут), то титрование бисопролола,карведилола, метопролола сукцината и небиволола мож-но начать с третьей ступени. Между последним приемоматенолола или метопролола тартрата и первым приемомрекомендованного β-АБ, на который переводится боль-ной, должно пройти 12 часов. В дальнейшем титрованиедоз рекомендованных β-АБ проходит по обычным принципам – увеличение доз каждые 2 недели, а при гипото-нии и нестабильном состоянии 1 раз в 4 недели.
В первые две недели лечения β-АБ возможно снижение сердечного выброса и обострение симптомов ХСН,что требует тщательного контроля. В этих случаях реко-мендуется:
A) некоторое увеличение дозы диуретиков,
B) увеличение (если возможно) дозы иАПФ,
C) применение положительных инотропных препаратов(малых доз сердечных гликозидов или сенситизаторовкальция – левосимендана), гемодинамический эффекткоторого в отличие от добутамина и допамина не зави-сит от степени блокады β-адренорецепторов[290],
D) более медленное титрование дозы β-АБ.
В случаях обострения ХСН на фоне длительного приема β-АБ следует попытаться оптимизировать другуютерапию (диуретики, иАПФ, сердечные гликозиды), сни-зить дозу β-АБ, избегая его полной отмены. Отмена β-АБможет приводить к ухудшению течения ХСН, поэтомудолжна производиться лишь при невозможности продол-жить лечение в соответствии с принципами, указаннымивыше [291]. После стабилизации состояния лечение β-АБдолжно быть возобновлено, начиная с меньших доз [292].В исследовании B-CONVINCE было доказано, что отме-на β-АБ в случаях обострения ХСН не приводит к улуч-шению прогноза, а возврат к оптимальному применениюэтого класса лекарств лишь затягивается [293].
Противопоказания к назначению β-АБ при СН:
A) бронхиальная астма и тяжелая степень ХОБЛ,
B) симптомная брадикардия (<50 уд / мин),
C) симптомная гипотония (<85 мм рт. ст.),
D) атрио-вентрикулярная блокада II и более степени,
E) тяжелый облитерирующий эндартериит и атероскле-роз нижних конечностей.
Наличие хронического обструктивного бронхита,осложняющего течение ХСН, не является абсолютнымпротивопоказанием к назначению β-АБ. Во всех случаяхнеобходимо сделать попытку к их назначению, начинаяс малых доз и придерживаясь медленного титрования.Лишь при обострении симптомов бронхообструкциина фоне лечения β-АБ от их применения придется отказать-ся. Средством выбора в такой ситуации является использование высокоселективных β1-блокаторов бисопрололаили небиволола (степень доказанности В) [294, 295].
При сочетании ХСН и СД 2 типа назначение β-АБабсолютно показано. Все положительные свойства препа-ратов этого класса полностью сохраняются. Препаратомвыбора в таких ситуациях является карведилол, которыйв отличие от всех других β-АБ даже улучшает чувствитель-ность периферических тканей к инсулину (класс реко-мендаций IIA, степень доказанности А) [296]. Имеютсяданные и о позитивном влиянии небиволола на инсулино-резистентность [297, 298].
Таким образом, β-АБ применяются у всех больныхХСН II–IV ФК с ФВ ЛЖ <40 % для снижения риска смер-ти и повторных госпитализаций и вместе с иАПФ (АРА)и АМКР (класс рекомендаций I, уровень доказанности А).
Ивабрадин при непереносимости β-АБу больных ХСН II–IV ФК со сниженнойФВ ЛЖ и синусовым ритмом с ЧСС более70 уд / мин
Терапия β-АБ, как указано в предыдущем разделе,должна быть иниицирована всем больным ХСН. К сожалению, не все пациенты способны без осложнений принимать препараты этой группы. В исследовании SHIFT,где все врачи должны были предпринять попытку лечения β-АБ, около 10 % пациентов из 6 558 не смогли пере-носить терапию β-АБ [299].
Этим больным, имевшим синусовый ритм и среднююЧСС 80 уд / мин (по условиям включения в исследованиеЧСС должна была быть более 70 уд / мин), назначался препарат ивабрадин в сравнении с плацебо. Ивабрадин – селективный блокатор f-каналов (If -токов) в клетках синусового узла, урежающий ЧСС без других гемодинамических эффектов [300, 301]. В результате риск первичной конечнойточки (время до сердечно-сосудистой смерти или госпита-лизации в связи с обострением ХСН) достоверно снижалсяна 29 % при отсутствии серьезных побочных реакций [299].
Учитывая относительно небольшое количество наблю-дений (около 700 больных) и ретроспективный характерпроведенного анализа, следует признать невысокий уровень доказанности положения о применении ивабрадинабольным, не переносящим терапию β-АБ в случаях сину-сового ритма с ЧСС более 70 уд / мин у пациентов с ХСН. С другой стороны, при истинной непереносимости β-АБименно ивабрадин остается средством положительноговлияния на заболеаваемость и смертность в указаннойгруппе больных ХСН. Таким образом, положение о том,что ивабрадин должен применяться у больных ХСН II–IVс ФВ ЛЖ <40 % для снижения риска суммы смертей плюсгоспитализаций из-за ХСН c синусовым ритмом, ЧСС>70 уд / мин при непереносимости β-АБ имеет класс IIA,уровень доказанности С.
Антагонисты минералокортикоидныхрецепторов (АМКР)
Негативная роль вторичного альдостеронизмапри ХСН известна давно. Долгое время высокий уровеньмнералокортикоидного гормона альдостерона связы-вался с задержкой жидкости в организме и стимулиро-ванием электролитного дисбаланса с задержкой в орга-низме натрия и потерей калия. Поэтому с середины 60-хгодов XX века на протяжении почти полувека спироно-лактон в дозах 100–300 мг / сут успешно применялсяв комплексной диуретической терапии тяжелой ХСН,как калийсберегающий диуретик [168, 268, 302, 303].Показанием к такому использованию препарата являет-ся наличие декомпенсированной ХСН, гипергидратациии необходимости лечения активными диуретиками, кото-рые могут провоцировать избыточную потерю калия.Именно в качестве надежного партнера тиазидных и пет-левых диуретиков следует рассматривать назначение спи-ронолактона в период достижения компенсации (особен-но у пациентов с ХСН III–IV ФК). В этих случаях приме-нение спиронолактона абсолютно необходимо и можноне бояться сочетания его высоких доз с иАПФ или АРА,если параллельно правильно используются активные диу-ретики и достигается положительный диурез. Однакопосле достижения состояния компенсации (дни, неделитерапии) применение высоких доз спиронолактона пре-кращается и может рассматриваться вопрос о длительномназначении невысоких доз препарата в качестве дополни-тельного нейрогормонального модулятора [168, 268].
При обострении явлений декомпенсации спиро-нолактон используется в высоких дозах (100–300 мгили 4–12 таблеток, назначаемых однократно утромили в два приема – утром и в обед) на период 1–3 недельдо достижения компенсации. После этого доза спиро-нолактона должна быть уменьшена. Критериями эффек-тивности применения спиронолактона в комплексномлечении упорного отечного синдрома являются:A) увеличение диуреза в пределах 20–25 % (это хотяи немного, но особенно важно при упорных рефрак-терных отеках);B) уменьшение жажды, сухости во рту и исчезновениеспецифического «печеночного» запаха изо рта;C) стабильная концентрация калия и магния в плазме(отсутствие снижения), несмотря на достижениеположительного диуреза.
Нужно помнить, что концентрация спиронолакто-на в плазме крови выходит на плато к 3-му дню леченияи после отмены (или уменьшения дозы препарата) егоконцентрация и действие пропадают (снижаются) черезтрое суток.
Сложный период в «жизни» спиронолактона насту-пил после появления в практике иАПФ, которые в началь-ном периоде лечения снижают синтез альдостеронав организме. Поэтому появились рекомендации о нежела-тельном сочетании иАПФ и спиронолактона при леченииХСН, т. к. это могло быть чревато развитием гиперкалие-мии и ухудшением функции почек [290, 304, 305]. Однаковыяснилось, что ни иАПФ, ни АРА, ни β-АБ, ни сочетаниеиАПФ с β-АБ и даже тройная комбинация иАПФ+АРА+β-АБ не могут в течение длительного времени блокиро-вать синтез альдостерона [306, 307]. Поэтому не реко-мендуется лишь сочетание больших доз спиронолактонаи высоких доз иАПФ при длительном лечении ХСН и тре-буется тщательный контроль уровня калия (на начальномэтапе лечения один раз в месяц) и функции почек (СКФи уровень креатинина) [308, 309].
Исследования 90-х годов прошлого века и началаXXI века доказали, что негативная роль гиперальдосте-ронизма при ХСН связана не только с задержкой жид-кости и электролитным дисбалансом, но и с развитиемфиброза миокарда, прогрессирующим ухудшением функ-ции сердца, риском жизнеугрожающих аритмий и про-воцированием коронарной недостаточности. Учитываяневозможность эффективной блокады синтеза альдосте-рона с помощью комбинации иАПФ с β-АБ, была сдела-на попытка длительного применения малых доз АМКРв продолжительном лечении ХСН в качестве третьегонейрогормонального модулятора.
В исследовании RALES впервые было показано,что назначение 12,5–50 мг / сут (в среднем 27 мг) АМКР спиронолактона больным ХСН III–IV ФК в дополнение к оптимальной терапии, включавшей иАПФ и у 10 %пациентов β-АБ, позволяло достоверно снижать рисксмерти на 27 %, причем как внезапной, так и связаннойс обострением декомпенсации [310]. Это было первым обоснованием целесообразности сочетания трех ней-рогормональных модуляторов (иАПФ + β-АБ + АМКР)для лечения больных тяжелой ХСН III–IV ФК, что нашлоотражение в Рекомендациях ОССН по лечению ХСН ужев первой редакции 2003 года.
Вопрос о применении малых доз АМКР в комбинациис другими нейрогормональными модуляторами для лечения больных с начальными стадиями ХСН (I–II ФК)оставался открытым. Эффективность спиронолактонавступала в противоречие с его недостаточной безопасно-стью – развитием гинекомастии или аменореи (до 10 %),гиперкалиемии (до 20 %) и ухудшением функции почек,частота которых нарастает параллельно увеличению доз.Следует помнить, что при наличии повышенного уров-ня креатинина сыворотки (>130 мкмоль / л), почечнойнедостаточности в анамнезе, при снижении СКФ менее60 мл / мин, гиперкалиемии (причем даже умеренной –>5,2 ммоль / л) сочетание антагонистов альдостеронас иАПФ требует тщательного клинического и лаборатор-ного контроля [250–252]. При таких ситуациях долженбыть предусмотрен контроль уровней калия и креатини-на плазмы и рассчет скорости клубочковой фильтрациичерез 2 и 4 недели лечения, затем через 2 и 3 месяца лече-ния, а потом 1 раз в полгода. Это позволяет минимизиро-вать число побочных реакций [133, 310].
Ситуация изменилась с появлением в клиническойпрактике нового высокоселективного АМКР эплерено-на, не оказывающего влияния на андрогеновые и проге-стероновые рецепторы и не вызывающего гинекомастии,нарушений менструального цикла и реже провоцирую-щего ухудшение функции почек и гиперкалиемию в срав-нении со спиронолактоном.
Первое крупное исследование EPHESUS продемон-стрировало, что применение АМКР эплеренона в дозах25–50 мг / сут у больных, перенесших ОИМ и имеющихдисфункцию ЛЖ (ФВ ЛЖ <40 %) и в 90 % симптомыХСН, позволяет снизить риск общей смертности на 15 %и внезапной смерти на 21 % [133]. Причем достовер-ное положительное влияние эплеренона на риск общейи внезапной смерти регистрируется уже к 30‑му днютерапии [311]. Наибольший эффект терапии отмечалсяв группе лечения пациентов с ФВ ЛЖ <30 % и симпто-мами ХСН [312]. В этой группе назначение эплеренонавсего 35 больным позволяло предотвратить одну внезап-ную смерть и лишь 23 – одну смерть по любой причине.При этом отмечена высокая безопасность лечения. Хотяувеличение серьезной гиперкалиемии (>6 ммоль / л)было достоверным, составило 1,6 % в сравнении с плаце-бо, терапия эплереноном ассоциировалась с уменьшени-ем частоты гипокалиемии на 4,7 % [133].
Полученные результаты стимулировали специаль-ное исследование по применению АМКР эплеренонау больных с подтвержденной ХСН II ФК со сниженной ФВ ЛЖ <35 %, находившихся на терапии блокаторамиРААС (96,5 %) и β-АБ (86,7 %), получивших акронимEMPHASIS–HF [313]. Применение АМКР эплерено-на в качестве третьего нейрогормонального модуляторав течение в среднем 21 месяца сопровождалось достовер-ным снижением риска первичной конечной точки (сер-дечно-сосудистая смертность плюс госпитализации из-заобострения ХСН) на 37 % и риска общей смертностина 24 % (33 больных необходимо было пролечить эплере-ноном для предотвращения одного летального исхода).Эплеренон отлично зарекомендовал себя и в длительнойтерапии ХСН, снижая на 42 % риск повторных госпитали-заций в связи с обострением декомпенсации (при назна-чении препарата 14 пациентам удается предотвратитьодну госпитализацию). И важной находкой этого иссле-дования явился тот факт, что в средней дозе 39,1 мг / сутэплеренон не вызывал достоверного прироста гиперка-лиемии, в том числе и опасной (>6 ммоль / л), и наруше-ния функции почек.
В таблице 21 представлены результаты трех основных исследований с АМКР в лечении ХСН, убедительные результаты которых позволили отнести класс АМКР к основным средствам лечения декомпенсации нарядус иАПФ и β-АБ (класс рекомендаций I, степень доказанности А). Как видно, доказательная база для препаратаэплеренон гораздо большая как по количеству обсле-дованных больных, так и по их разнообразию, включаяпациентов с дисфункцией ЛЖ и начальными стадиямиХСН. Поэтому показанием к применению спиронолактона (25–50 мг) остается выраженная ХСН III–IV ФКи случаи острой декомпенсации кровообращения, когдапрепарат применяется в высоких дозах. При ХСН, начи-ная со II ФК, а у больных, перенесших ОИМ, при дис-фунции ЛЖ показано применение высокоселективногоАМКР эплеренона в дозах 25–50 мг / сут.
Важными свойствами АМКР является способностьуменьшать выраженность фиброза миокарда [314, 315],что сопровождается блокадой ремоделирования серд-ца (уменьшение объемов сердца и уровней МНУП)и ростом ФВ ЛЖ [316–318]. Подобные эффекты позво-ляют проявляться антиаритмическим свойствам АМКР. Эплеренон у больных ХСН II ФК на 42 % снижает рискразвития новой ФП [319]. Кроме того, мета-анализисследований с применением АМКР подтвердил их спо-собность достоверно снижать риск внезапной смертиу больных ХСН [320].
Последний мета-анализ продемонстрировал способ-ность АМКР снижать риск смерти (на 21 %) и госпита-лизаций в связи с обострением декомпенсации (на 38 %)и у больных с более ранней ХСН I–II ФК, однакопри этом в 1,78 раза увеличивается риск гиперкалие-мии [321]. Учитывая небольшое число обследованныхбольных, перенос показаний к использованию АМКРв комплексной терапии ХСН I ФК следует считать преждевременным.
Итак, несмотря на необходимость контроля уров-ня калия при начале лечения, АМКР по праву занимаютместо в списке трех основных групп препаратов, приме-няемых для лечения ХСН (вместе с иАПФ и β-АБ).
Таблица 21. Результаты основных исследований с АМКР при ХСН
Если больные получают очень малые дозы атенолола(<25 мг / сут) или метопролола тартрата (<25 мг / сут),то титрование доз рекомендованных β-АБ необходимо начинать с общепринятых стартовых доз. Если пациентыпринимали средние дозировки атенолола (25–75 мг / сут)или метопролола тартрата (25–75 мг / сут), то титрование рекомендованных β-АБ можно начать сразу со второй ступени. Наконец, если пациенты успешно прини-мали высокие дозы атенолола (>75 мг / сут) или метопролола тартрата (>75 мг / сут), то титрование бисопролола,карведилола, метопролола сукцината и небиволола мож-но начать с третьей ступени. Между последним приемоматенолола или метопролола тартрата и первым приемомрекомендованного β-АБ, на который переводится боль-ной, должно пройти 12 часов. В дальнейшем титрованиедоз рекомендованных β-АБ проходит по обычным принципам – увеличение доз каждые 2 недели, а при гипото-нии и нестабильном состоянии 1 раз в 4 недели.
В первые две недели лечения β-АБ возможно снижение сердечного выброса и обострение симптомов ХСН,что требует тщательного контроля. В этих случаях реко-мендуется:
A) некоторое увеличение дозы диуретиков,
B) увеличение (если возможно) дозы иАПФ,
C) применение положительных инотропных препаратов(малых доз сердечных гликозидов или сенситизаторовкальция – левосимендана), гемодинамический эффекткоторого в отличие от добутамина и допамина не зави-сит от степени блокады β-адренорецепторов[290],
D) более медленное титрование дозы β-АБ.
В случаях обострения ХСН на фоне длительного приема β-АБ следует попытаться оптимизировать другуютерапию (диуретики, иАПФ, сердечные гликозиды), сни-зить дозу β-АБ, избегая его полной отмены. Отмена β-АБможет приводить к ухудшению течения ХСН, поэтомудолжна производиться лишь при невозможности продол-жить лечение в соответствии с принципами, указаннымивыше [291]. После стабилизации состояния лечение β-АБдолжно быть возобновлено, начиная с меньших доз [292].В исследовании B-CONVINCE было доказано, что отме-на β-АБ в случаях обострения ХСН не приводит к улуч-шению прогноза, а возврат к оптимальному применениюэтого класса лекарств лишь затягивается [293].
Противопоказания к назначению β-АБ при СН:
A) бронхиальная астма и тяжелая степень ХОБЛ,
B) симптомная брадикардия (<50 уд / мин),
C) симптомная гипотония (<85 мм рт. ст.),
D) атрио-вентрикулярная блокада II и более степени,
E) тяжелый облитерирующий эндартериит и атероскле-роз нижних конечностей.
Наличие хронического обструктивного бронхита,осложняющего течение ХСН, не является абсолютнымпротивопоказанием к назначению β-АБ. Во всех случаяхнеобходимо сделать попытку к их назначению, начинаяс малых доз и придерживаясь медленного титрования.Лишь при обострении симптомов бронхообструкциина фоне лечения β-АБ от их применения придется отказать-ся. Средством выбора в такой ситуации является использование высокоселективных β1-блокаторов бисопрололаили небиволола (степень доказанности В) [294, 295].
При сочетании ХСН и СД 2 типа назначение β-АБабсолютно показано. Все положительные свойства препа-ратов этого класса полностью сохраняются. Препаратомвыбора в таких ситуациях является карведилол, которыйв отличие от всех других β-АБ даже улучшает чувствитель-ность периферических тканей к инсулину (класс реко-мендаций IIA, степень доказанности А) [296]. Имеютсяданные и о позитивном влиянии небиволола на инсулино-резистентность [297, 298].
Таким образом, β-АБ применяются у всех больныхХСН II–IV ФК с ФВ ЛЖ <40 % для снижения риска смер-ти и повторных госпитализаций и вместе с иАПФ (АРА)и АМКР (класс рекомендаций I, уровень доказанности А).
Ивабрадин при непереносимости β-АБу больных ХСН II–IV ФК со сниженнойФВ ЛЖ и синусовым ритмом с ЧСС более70 уд / мин
Терапия β-АБ, как указано в предыдущем разделе,должна быть иниицирована всем больным ХСН. К сожалению, не все пациенты способны без осложнений принимать препараты этой группы. В исследовании SHIFT,где все врачи должны были предпринять попытку лечения β-АБ, около 10 % пациентов из 6 558 не смогли пере-носить терапию β-АБ [299].
Этим больным, имевшим синусовый ритм и среднююЧСС 80 уд / мин (по условиям включения в исследованиеЧСС должна была быть более 70 уд / мин), назначался препарат ивабрадин в сравнении с плацебо. Ивабрадин – селективный блокатор f-каналов (If -токов) в клетках синусового узла, урежающий ЧСС без других гемодинамических эффектов [300, 301]. В результате риск первичной конечнойточки (время до сердечно-сосудистой смерти или госпита-лизации в связи с обострением ХСН) достоверно снижалсяна 29 % при отсутствии серьезных побочных реакций [299].
Учитывая относительно небольшое количество наблю-дений (около 700 больных) и ретроспективный характерпроведенного анализа, следует признать невысокий уровень доказанности положения о применении ивабрадинабольным, не переносящим терапию β-АБ в случаях сину-сового ритма с ЧСС более 70 уд / мин у пациентов с ХСН. С другой стороны, при истинной непереносимости β-АБименно ивабрадин остается средством положительноговлияния на заболеаваемость и смертность в указаннойгруппе больных ХСН. Таким образом, положение о том,что ивабрадин должен применяться у больных ХСН II–IVс ФВ ЛЖ <40 % для снижения риска суммы смертей плюсгоспитализаций из-за ХСН c синусовым ритмом, ЧСС>70 уд / мин при непереносимости β-АБ имеет класс IIA,уровень доказанности С.
Антагонисты минералокортикоидныхрецепторов (АМКР)
Негативная роль вторичного альдостеронизмапри ХСН известна давно. Долгое время высокий уровеньмнералокортикоидного гормона альдостерона связы-вался с задержкой жидкости в организме и стимулиро-ванием электролитного дисбаланса с задержкой в орга-низме натрия и потерей калия. Поэтому с середины 60-хгодов XX века на протяжении почти полувека спироно-лактон в дозах 100–300 мг / сут успешно применялсяв комплексной диуретической терапии тяжелой ХСН,как калийсберегающий диуретик [168, 268, 302, 303].Показанием к такому использованию препарата являет-ся наличие декомпенсированной ХСН, гипергидратациии необходимости лечения активными диуретиками, кото-рые могут провоцировать избыточную потерю калия.Именно в качестве надежного партнера тиазидных и пет-левых диуретиков следует рассматривать назначение спи-ронолактона в период достижения компенсации (особен-но у пациентов с ХСН III–IV ФК). В этих случаях приме-нение спиронолактона абсолютно необходимо и можноне бояться сочетания его высоких доз с иАПФ или АРА,если параллельно правильно используются активные диу-ретики и достигается положительный диурез. Однакопосле достижения состояния компенсации (дни, неделитерапии) применение высоких доз спиронолактона пре-кращается и может рассматриваться вопрос о длительномназначении невысоких доз препарата в качестве дополни-тельного нейрогормонального модулятора [168, 268].
При обострении явлений декомпенсации спиро-нолактон используется в высоких дозах (100–300 мгили 4–12 таблеток, назначаемых однократно утромили в два приема – утром и в обед) на период 1–3 недельдо достижения компенсации. После этого доза спиро-нолактона должна быть уменьшена. Критериями эффек-тивности применения спиронолактона в комплексномлечении упорного отечного синдрома являются:A) увеличение диуреза в пределах 20–25 % (это хотяи немного, но особенно важно при упорных рефрак-терных отеках);B) уменьшение жажды, сухости во рту и исчезновениеспецифического «печеночного» запаха изо рта;C) стабильная концентрация калия и магния в плазме(отсутствие снижения), несмотря на достижениеположительного диуреза.
Нужно помнить, что концентрация спиронолакто-на в плазме крови выходит на плато к 3-му дню леченияи после отмены (или уменьшения дозы препарата) егоконцентрация и действие пропадают (снижаются) черезтрое суток.
Сложный период в «жизни» спиронолактона насту-пил после появления в практике иАПФ, которые в началь-ном периоде лечения снижают синтез альдостеронав организме. Поэтому появились рекомендации о нежела-тельном сочетании иАПФ и спиронолактона при леченииХСН, т. к. это могло быть чревато развитием гиперкалие-мии и ухудшением функции почек [290, 304, 305]. Однаковыяснилось, что ни иАПФ, ни АРА, ни β-АБ, ни сочетаниеиАПФ с β-АБ и даже тройная комбинация иАПФ+АРА+β-АБ не могут в течение длительного времени блокиро-вать синтез альдостерона [306, 307]. Поэтому не реко-мендуется лишь сочетание больших доз спиронолактонаи высоких доз иАПФ при длительном лечении ХСН и тре-буется тщательный контроль уровня калия (на начальномэтапе лечения один раз в месяц) и функции почек (СКФи уровень креатинина) [308, 309].
Исследования 90-х годов прошлого века и началаXXI века доказали, что негативная роль гиперальдосте-ронизма при ХСН связана не только с задержкой жид-кости и электролитным дисбалансом, но и с развитиемфиброза миокарда, прогрессирующим ухудшением функ-ции сердца, риском жизнеугрожающих аритмий и про-воцированием коронарной недостаточности. Учитываяневозможность эффективной блокады синтеза альдосте-рона с помощью комбинации иАПФ с β-АБ, была сдела-на попытка длительного применения малых доз АМКРв продолжительном лечении ХСН в качестве третьегонейрогормонального модулятора.
В исследовании RALES впервые было показано,что назначение 12,5–50 мг / сут (в среднем 27 мг) АМКР спиронолактона больным ХСН III–IV ФК в дополнение к оптимальной терапии, включавшей иАПФ и у 10 %пациентов β-АБ, позволяло достоверно снижать рисксмерти на 27 %, причем как внезапной, так и связаннойс обострением декомпенсации [310]. Это было первым обоснованием целесообразности сочетания трех ней-рогормональных модуляторов (иАПФ + β-АБ + АМКР)для лечения больных тяжелой ХСН III–IV ФК, что нашлоотражение в Рекомендациях ОССН по лечению ХСН ужев первой редакции 2003 года.
Вопрос о применении малых доз АМКР в комбинациис другими нейрогормональными модуляторами для лечения больных с начальными стадиями ХСН (I–II ФК)оставался открытым. Эффективность спиронолактонавступала в противоречие с его недостаточной безопасно-стью – развитием гинекомастии или аменореи (до 10 %),гиперкалиемии (до 20 %) и ухудшением функции почек,частота которых нарастает параллельно увеличению доз.Следует помнить, что при наличии повышенного уров-ня креатинина сыворотки (>130 мкмоль / л), почечнойнедостаточности в анамнезе, при снижении СКФ менее60 мл / мин, гиперкалиемии (причем даже умеренной –>5,2 ммоль / л) сочетание антагонистов альдостеронас иАПФ требует тщательного клинического и лаборатор-ного контроля [250–252]. При таких ситуациях долженбыть предусмотрен контроль уровней калия и креатини-на плазмы и рассчет скорости клубочковой фильтрациичерез 2 и 4 недели лечения, затем через 2 и 3 месяца лече-ния, а потом 1 раз в полгода. Это позволяет минимизиро-вать число побочных реакций [133, 310].
Ситуация изменилась с появлением в клиническойпрактике нового высокоселективного АМКР эплерено-на, не оказывающего влияния на андрогеновые и проге-стероновые рецепторы и не вызывающего гинекомастии,нарушений менструального цикла и реже провоцирую-щего ухудшение функции почек и гиперкалиемию в срав-нении со спиронолактоном.
Первое крупное исследование EPHESUS продемон-стрировало, что применение АМКР эплеренона в дозах25–50 мг / сут у больных, перенесших ОИМ и имеющихдисфункцию ЛЖ (ФВ ЛЖ <40 %) и в 90 % симптомыХСН, позволяет снизить риск общей смертности на 15 %и внезапной смерти на 21 % [133]. Причем достовер-ное положительное влияние эплеренона на риск общейи внезапной смерти регистрируется уже к 30‑му днютерапии [311]. Наибольший эффект терапии отмечалсяв группе лечения пациентов с ФВ ЛЖ <30 % и симпто-мами ХСН [312]. В этой группе назначение эплеренонавсего 35 больным позволяло предотвратить одну внезап-ную смерть и лишь 23 – одну смерть по любой причине.При этом отмечена высокая безопасность лечения. Хотяувеличение серьезной гиперкалиемии (>6 ммоль / л)было достоверным, составило 1,6 % в сравнении с плаце-бо, терапия эплереноном ассоциировалась с уменьшени-ем частоты гипокалиемии на 4,7 % [133].
Полученные результаты стимулировали специаль-ное исследование по применению АМКР эплеренонау больных с подтвержденной ХСН II ФК со сниженной ФВ ЛЖ <35 %, находившихся на терапии блокаторамиРААС (96,5 %) и β-АБ (86,7 %), получивших акронимEMPHASIS–HF [313]. Применение АМКР эплерено-на в качестве третьего нейрогормонального модуляторав течение в среднем 21 месяца сопровождалось достовер-ным снижением риска первичной конечной точки (сер-дечно-сосудистая смертность плюс госпитализации из-заобострения ХСН) на 37 % и риска общей смертностина 24 % (33 больных необходимо было пролечить эплере-ноном для предотвращения одного летального исхода).Эплеренон отлично зарекомендовал себя и в длительнойтерапии ХСН, снижая на 42 % риск повторных госпитали-заций в связи с обострением декомпенсации (при назна-чении препарата 14 пациентам удается предотвратитьодну госпитализацию). И важной находкой этого иссле-дования явился тот факт, что в средней дозе 39,1 мг / сутэплеренон не вызывал достоверного прироста гиперка-лиемии, в том числе и опасной (>6 ммоль / л), и наруше-ния функции почек.
В таблице 21 представлены результаты трех основных исследований с АМКР в лечении ХСН, убедительные результаты которых позволили отнести класс АМКР к основным средствам лечения декомпенсации нарядус иАПФ и β-АБ (класс рекомендаций I, степень доказанности А). Как видно, доказательная база для препаратаэплеренон гораздо большая как по количеству обсле-дованных больных, так и по их разнообразию, включаяпациентов с дисфункцией ЛЖ и начальными стадиямиХСН. Поэтому показанием к применению спиронолактона (25–50 мг) остается выраженная ХСН III–IV ФКи случаи острой декомпенсации кровообращения, когдапрепарат применяется в высоких дозах. При ХСН, начи-ная со II ФК, а у больных, перенесших ОИМ, при дис-фунции ЛЖ показано применение высокоселективногоАМКР эплеренона в дозах 25–50 мг / сут.
Важными свойствами АМКР является способностьуменьшать выраженность фиброза миокарда [314, 315],что сопровождается блокадой ремоделирования серд-ца (уменьшение объемов сердца и уровней МНУП)и ростом ФВ ЛЖ [316–318]. Подобные эффекты позво-ляют проявляться антиаритмическим свойствам АМКР. Эплеренон у больных ХСН II ФК на 42 % снижает рискразвития новой ФП [319]. Кроме того, мета-анализисследований с применением АМКР подтвердил их спо-собность достоверно снижать риск внезапной смертиу больных ХСН [320].
Последний мета-анализ продемонстрировал способ-ность АМКР снижать риск смерти (на 21 %) и госпита-лизаций в связи с обострением декомпенсации (на 38 %)и у больных с более ранней ХСН I–II ФК, однакопри этом в 1,78 раза увеличивается риск гиперкалие-мии [321]. Учитывая небольшое число обследованныхбольных, перенос показаний к использованию АМКРв комплексной терапии ХСН I ФК следует считать преждевременным.
Итак, несмотря на необходимость контроля уров-ня калия при начале лечения, АМКР по праву занимаютместо в списке трех основных групп препаратов, приме-няемых для лечения ХСН (вместе с иАПФ и β-АБ).
Таблица 21. Результаты основных исследований с АМКР при ХСН
 Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые в определенных клинических ситуациях (таблица 22)
Диуретические (мочегонные) средства в лечении ХСН
Задержка жидкости в организме и формирова-ние отечного синдрома являются типичным и наиболее известным проявлением ХСН, начиная со II ФК. Поэтому дегидратационная терапия представляетсобой одну из важнейших составляющих успешного лечения больных ХСН.
Однако необходимо помнить, что в развитии отечного синдрома задействованы сложные нейрогормональные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и «рикошетную» задержкужидкости. То, что характеризуется как отеки и одышка,представляет собой накопление жидкости во внекле-точном пространстве. Поэтому для выделения этойжидкости из организма необходимо осуществлениетрех этапов.
Таблица 22. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способность к снижениюриска смерти и госпитализаций именно при ХСН и применяющиеся в определенных клинических ситуациях)
Средства, доказавшие способность к снижению смертности и заболеваемости именно при ХСН и применяемые в определенных клинических ситуациях (таблица 22)
Диуретические (мочегонные) средства в лечении ХСН
Задержка жидкости в организме и формирова-ние отечного синдрома являются типичным и наиболее известным проявлением ХСН, начиная со II ФК. Поэтому дегидратационная терапия представляетсобой одну из важнейших составляющих успешного лечения больных ХСН.
Однако необходимо помнить, что в развитии отечного синдрома задействованы сложные нейрогормональные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и «рикошетную» задержкужидкости. То, что характеризуется как отеки и одышка,представляет собой накопление жидкости во внекле-точном пространстве. Поэтому для выделения этойжидкости из организма необходимо осуществлениетрех этапов.
Таблица 22. Фармакологическое лечение больных ХСН с ФВ <40 % (лекарства, доказавшие способность к снижениюриска смерти и госпитализаций именно при ХСН и применяющиеся в определенных клинических ситуациях)
 На первом этапе избыточная жидкость сначала должна быть переведена из внеклеточного пространства в сосудистое русло. Для осуществления первого этапаис пользуются активные мочегонные средства (диурети-ки), которые за счет снижения объема циркулирующейкрови и гидростатического давления облегчают переходжидкости из внеклеточного пространства в сосудистое русло. На этом этапе эффективно применение гемодинамически активных препаратов (положительные инотроп-ные средства) и особенно нейрогормональных модуля-торов (иАПФ, АРА). Важным подспорьем на этом этапеявляется повышение онкотического (введение препаратов плазмы или альбумина) и осмотического давления(применение АМКР в высоких, «диуретических» дозах,усиливающих ионообмен и уменьшающих выраженностьгипонатриемии разведения).
На втором этапе необходима доставка этой избыточной жидкости к почкам и обеспечение ее фильтрации. На этом этапе эффективно применение препаратов, уси-ливающих почечную фильтрацию. При ФП целесообразно использовать невысокие дозы дигоксина. При гипотонии и синусовом ритме используются положительныеинотропные средства, из которых особо выделяется допамин. За счет влияния на допаминергические рецеп-торы этот препарат увеличивает долю почечного крово-тока. При уровне САД выше 100 мм рт. ст. эффективноприменение эуфиллина.
Третий этап – при попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбциянатрия и воды, что обеспечит избыточное выведение жидкости из организма. Как раз в осуществлении этогоэтапа незаменимыми являются собственно диуретики.
Только при выполнении трех перечисленных условий удастся достичь положительного диуреза и нач-нется процесс дегидратации. Следовательно, диурети-ки выполняют функцию лишь одного из компонентовдегидратационного лечения. Поэтому применениемочегонных препаратов должно быть строго обосно-ванным, обязательно сочетаться с использованиемнейрогормональных модуляторов, таких как иАПФи АМКР, а также препаратов, удерживающих жидкостьв сосудистом русле и улучшающих почечный кровотоки фильтрацию.
Как это ни странно, но серьезных плацебо-контро-лируемых исследований по применению диуретиковпрактически не проводилось (за исключением АМКР),поэтому все положения основываются на мнении экс-пертов. Формально это соответствует степени доказан-ности С, хотя учитывая громадный практический опытпо лечению мочегонными, обоснованность их приме-нения у всех больных ХСН, имеющих гипергидратацию,не вызввает сомнений.
Основные положения дегидратационной терапии, в томчисле применения диуретиков, сводятся к следующему.
Диуретики (мочегонные средства) применяютсядля устранения отечного синдрома и улучшения клини-ческой симптоматики у больных ХСН. При правильномприменении эти средства позволяют уменьшить числогоспитализаций, что соответствует достижению двухиз 6 основных целей при лечении ХСН. Большинстводиуретиков (кроме торасемида) не замедляют прогресси-рования ХСН и не улучшают прогноза больных. Их вли-яние на качество жизни при неправильном назначении(ударные дозы раз в 3–4–5–7 дней) может быть даженегативным [168, 268, 302, 303, 322–324].
Лечение мочегонными средствами начинается лишьпри клинических или инструментальных признакахзастоя (II А стадия, II ФК по классификации ОССН).Впрок мочегонными не лечат, т. к. они, как сказано выше,не замедляют прогрессирования ХСН.
Общие вопросыдегидратационной терапии ХСН
Алгоритм назначения диуретиков (в зависимостиот тяжести ХСН) представляется следующим:
A) I ФК – не лечить мочегонными (0 препаратов)
B) II ФК (без клинических признаков застоя) – малыедозы торасемида (2,5–5 мг) (1 препарат)
C) II ФК (с признаками застоя) – петлевые (тиазидные)диуретики + спиронолактон 100–150 мг (2 препарата)
D) III ФК (поддерживающее лечение) – петлевые диуретики (лучше торасемид) ежедневно в дозах, достаточ-ных для поддержания сбалансированного диуреза +АМКР (25–50 мг / сут) + ингибиторы карбоангидра-зы = ИКАГ (ацетазоламид по 0,25 мг × 3 раза / сутв течение 3–4 дней один раз в 2 недели) (3 препарата)
E) III ФК (декомпенсация) – петлевые диуретики (лучше торасемид) + тиазидные + спиронолактонв дозах 100–300 мг / сут + ИКАГ (4 препарата)
F) IV ФК – петлевые диуретики (торасемид однократ-но или фуросемид дважды в сутки или в / в капельнов высоких дозах) + тиазидные + АМКР + ИКАГ (аце-тазоламид по 0,25 мг × 3 раза / сут в течение 3–4 днейодин раз в 2 недели) + при необходимости механиче-ское удаление жидкости (5 препаратов / воздействий).
Лечение необходимо начинать с малых доз (особен-но у больных, не получавших ранее мочегонных пре-паратов), в последующем подбирая дозу по принципуquantum satis.
Дегидратационная терапия при ХСН имеет две фазы –активную (в период гипергидратации и застоя) и поддер-живающую (для поддержания эуволюмического состоя-ния после достижения компенсации).
В активной фазе превышение количества выделен-ной мочи над количеством принятой жидкости должносоставлять 1–2 литра в сутки при снижении веса еже-дневно ~ по 1 кг. Никакая стремительная дегидратацияне может быть оправданной и лишь приводит к чрезмер-ной гиперактивации нейрогормонов и «рикошетной»задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных. Наиболеечастая ошибка в назначении диуретиков в России:попытка «ударного» диуреза – один раз в несколькодней. Более ошибочную тактику лечения, как с учетомкачества жизни пациента, так и прогрессирования ХСН,трудно представить.
Все активные мочегонные препараты (в том числеи петлевые, и тиазидные) носят название салурети-ков, так как их действие основано на снижении реаб-сорбции натрия и осмотически связанной жидкости.Основными недостатками являются гиперактивацияРААС, приводящая к «рикошетной» задержке жидко-сти, а также электролитные расстройства (гипокалие-мия и гипомагниемия). На третьем месте по значимостиидут метаболические нарушения, вызываемые умень-шением циркулирующей крови (повышение уров-ня глюкозы и ХС), тем более выраженные, чем болееобильным был диурез.
Поэтому применение и петлевых, и тиазидных диу-ретиков всегда должно сочетаться с блокаторами РААС(иАПФ, АРА, АМКР) и калийсберегающими препаратами(АМКР, реже – триамтерен). Важным моментом являетсятот факт, что после обильного диуреза активность РААСсущественно повышается и в ответ на применение иАПФ(или АРА) можно ожидать серьезного снижения АД.Поэтому за исключением экстренных случаев декомпен-сации терапию правильнее начинать с иАПФ (или АРА)с последующим добавлением мочегонных. В этом случаеопасность гиперактивации РААС будет «демпфирована»нейрогормональными модуляторами.
Придерживаясь указанных принципов, можно успешно лечить большинство пациентов с декомпенсацией сер-дечной деятельности и отечным синдромом.
Характеристика основных диуретиков,применяемых при лечении ХСН
Диуретики разделяются на группы соответственно локализации действия в нефроне.
На проксимальные канальцы действуют слабейшие из мочегонных – ингибиторы карбоангидразы (ацетозоламид). На кортикаль-ную часть восходящего колена петли Генле и начальнуючасть дистальных канальцев – тиазидные и тиазидопо-добные диуретики (гипотиазид, индапамид, хлортали-дон). На все восходящее колено петли Генле – самыемощные петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид). На дистальные каналь-цы – конкурентные (спиронолактон) и неконкурентные(триамтерен) антагонисты альдостерона, относящиесяк группе калийсберегающих мочегонных [168, 268, 302,303, 322–324].
В таблице 23 приведены основные показания к назначению, стартовые и максимальные дозировки, а также продолжительность действия мочегонных препаратов,наиболее часто используемых в лечении ХСН. Основнуюроль в лечении отечного синдрома у больных ХСН игра-ют петлевые и тиазидные диуретики.
Петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид) – самые эффективные мочегонные, блокирующие реабсорбцию натрияна всем протяжении восходящей части петли Генлеи сохраняющие активность даже при ХПН и фильтра-ции >5 мл / мин. Иными словами, они эффективны даже при явлениях почечной недостаточности. На сегодняименно петлевые диуретики – основа лечения отечногосиндрома при ХСН.
Таблица 23. Показания, дозировки и продолжительность действия диуретиков при лечении больных ХСН
На первом этапе избыточная жидкость сначала должна быть переведена из внеклеточного пространства в сосудистое русло. Для осуществления первого этапаис пользуются активные мочегонные средства (диурети-ки), которые за счет снижения объема циркулирующейкрови и гидростатического давления облегчают переходжидкости из внеклеточного пространства в сосудистое русло. На этом этапе эффективно применение гемодинамически активных препаратов (положительные инотроп-ные средства) и особенно нейрогормональных модуля-торов (иАПФ, АРА). Важным подспорьем на этом этапеявляется повышение онкотического (введение препаратов плазмы или альбумина) и осмотического давления(применение АМКР в высоких, «диуретических» дозах,усиливающих ионообмен и уменьшающих выраженностьгипонатриемии разведения).
На втором этапе необходима доставка этой избыточной жидкости к почкам и обеспечение ее фильтрации. На этом этапе эффективно применение препаратов, уси-ливающих почечную фильтрацию. При ФП целесообразно использовать невысокие дозы дигоксина. При гипотонии и синусовом ритме используются положительныеинотропные средства, из которых особо выделяется допамин. За счет влияния на допаминергические рецеп-торы этот препарат увеличивает долю почечного крово-тока. При уровне САД выше 100 мм рт. ст. эффективноприменение эуфиллина.
Третий этап – при попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбциянатрия и воды, что обеспечит избыточное выведение жидкости из организма. Как раз в осуществлении этогоэтапа незаменимыми являются собственно диуретики.
Только при выполнении трех перечисленных условий удастся достичь положительного диуреза и нач-нется процесс дегидратации. Следовательно, диурети-ки выполняют функцию лишь одного из компонентовдегидратационного лечения. Поэтому применениемочегонных препаратов должно быть строго обосно-ванным, обязательно сочетаться с использованиемнейрогормональных модуляторов, таких как иАПФи АМКР, а также препаратов, удерживающих жидкостьв сосудистом русле и улучшающих почечный кровотоки фильтрацию.
Как это ни странно, но серьезных плацебо-контро-лируемых исследований по применению диуретиковпрактически не проводилось (за исключением АМКР),поэтому все положения основываются на мнении экс-пертов. Формально это соответствует степени доказан-ности С, хотя учитывая громадный практический опытпо лечению мочегонными, обоснованность их приме-нения у всех больных ХСН, имеющих гипергидратацию,не вызввает сомнений.
Основные положения дегидратационной терапии, в томчисле применения диуретиков, сводятся к следующему.
Диуретики (мочегонные средства) применяютсядля устранения отечного синдрома и улучшения клини-ческой симптоматики у больных ХСН. При правильномприменении эти средства позволяют уменьшить числогоспитализаций, что соответствует достижению двухиз 6 основных целей при лечении ХСН. Большинстводиуретиков (кроме торасемида) не замедляют прогресси-рования ХСН и не улучшают прогноза больных. Их вли-яние на качество жизни при неправильном назначении(ударные дозы раз в 3–4–5–7 дней) может быть даженегативным [168, 268, 302, 303, 322–324].
Лечение мочегонными средствами начинается лишьпри клинических или инструментальных признакахзастоя (II А стадия, II ФК по классификации ОССН).Впрок мочегонными не лечат, т. к. они, как сказано выше,не замедляют прогрессирования ХСН.
Общие вопросыдегидратационной терапии ХСН
Алгоритм назначения диуретиков (в зависимостиот тяжести ХСН) представляется следующим:
A) I ФК – не лечить мочегонными (0 препаратов)
B) II ФК (без клинических признаков застоя) – малыедозы торасемида (2,5–5 мг) (1 препарат)
C) II ФК (с признаками застоя) – петлевые (тиазидные)диуретики + спиронолактон 100–150 мг (2 препарата)
D) III ФК (поддерживающее лечение) – петлевые диуретики (лучше торасемид) ежедневно в дозах, достаточ-ных для поддержания сбалансированного диуреза +АМКР (25–50 мг / сут) + ингибиторы карбоангидра-зы = ИКАГ (ацетазоламид по 0,25 мг × 3 раза / сутв течение 3–4 дней один раз в 2 недели) (3 препарата)
E) III ФК (декомпенсация) – петлевые диуретики (лучше торасемид) + тиазидные + спиронолактонв дозах 100–300 мг / сут + ИКАГ (4 препарата)
F) IV ФК – петлевые диуретики (торасемид однократ-но или фуросемид дважды в сутки или в / в капельнов высоких дозах) + тиазидные + АМКР + ИКАГ (аце-тазоламид по 0,25 мг × 3 раза / сут в течение 3–4 днейодин раз в 2 недели) + при необходимости механиче-ское удаление жидкости (5 препаратов / воздействий).
Лечение необходимо начинать с малых доз (особен-но у больных, не получавших ранее мочегонных пре-паратов), в последующем подбирая дозу по принципуquantum satis.
Дегидратационная терапия при ХСН имеет две фазы –активную (в период гипергидратации и застоя) и поддер-живающую (для поддержания эуволюмического состоя-ния после достижения компенсации).
В активной фазе превышение количества выделен-ной мочи над количеством принятой жидкости должносоставлять 1–2 литра в сутки при снижении веса еже-дневно ~ по 1 кг. Никакая стремительная дегидратацияне может быть оправданной и лишь приводит к чрезмер-ной гиперактивации нейрогормонов и «рикошетной»задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных. Наиболеечастая ошибка в назначении диуретиков в России:попытка «ударного» диуреза – один раз в несколькодней. Более ошибочную тактику лечения, как с учетомкачества жизни пациента, так и прогрессирования ХСН,трудно представить.
Все активные мочегонные препараты (в том числеи петлевые, и тиазидные) носят название салурети-ков, так как их действие основано на снижении реаб-сорбции натрия и осмотически связанной жидкости.Основными недостатками являются гиперактивацияРААС, приводящая к «рикошетной» задержке жидко-сти, а также электролитные расстройства (гипокалие-мия и гипомагниемия). На третьем месте по значимостиидут метаболические нарушения, вызываемые умень-шением циркулирующей крови (повышение уров-ня глюкозы и ХС), тем более выраженные, чем болееобильным был диурез.
Поэтому применение и петлевых, и тиазидных диу-ретиков всегда должно сочетаться с блокаторами РААС(иАПФ, АРА, АМКР) и калийсберегающими препаратами(АМКР, реже – триамтерен). Важным моментом являетсятот факт, что после обильного диуреза активность РААСсущественно повышается и в ответ на применение иАПФ(или АРА) можно ожидать серьезного снижения АД.Поэтому за исключением экстренных случаев декомпен-сации терапию правильнее начинать с иАПФ (или АРА)с последующим добавлением мочегонных. В этом случаеопасность гиперактивации РААС будет «демпфирована»нейрогормональными модуляторами.
Придерживаясь указанных принципов, можно успешно лечить большинство пациентов с декомпенсацией сер-дечной деятельности и отечным синдромом.
Характеристика основных диуретиков,применяемых при лечении ХСН
Диуретики разделяются на группы соответственно локализации действия в нефроне.
На проксимальные канальцы действуют слабейшие из мочегонных – ингибиторы карбоангидразы (ацетозоламид). На кортикаль-ную часть восходящего колена петли Генле и начальнуючасть дистальных канальцев – тиазидные и тиазидопо-добные диуретики (гипотиазид, индапамид, хлортали-дон). На все восходящее колено петли Генле – самыемощные петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид). На дистальные каналь-цы – конкурентные (спиронолактон) и неконкурентные(триамтерен) антагонисты альдостерона, относящиесяк группе калийсберегающих мочегонных [168, 268, 302,303, 322–324].
В таблице 23 приведены основные показания к назначению, стартовые и максимальные дозировки, а также продолжительность действия мочегонных препаратов,наиболее часто используемых в лечении ХСН. Основнуюроль в лечении отечного синдрома у больных ХСН игра-ют петлевые и тиазидные диуретики.
Петлевые диуретики (фуросемид, этакриноваякислота, буметанид, торасемид) – самые эффективные мочегонные, блокирующие реабсорбцию натрияна всем протяжении восходящей части петли Генлеи сохраняющие активность даже при ХПН и фильтра-ции >5 мл / мин. Иными словами, они эффективны даже при явлениях почечной недостаточности. На сегодняименно петлевые диуретики – основа лечения отечногосиндрома при ХСН.
Таблица 23. Показания, дозировки и продолжительность действия диуретиков при лечении больных ХСН
 Лидером в лечении отечного синдрома на протя-жении более 50 лет является фуросемид [325, 326].Препарат применяется как в виде внутривенных инъекций(особенно при обострениях ХСН), так и в видетаблеток для длительного поддерживающего леченияпациентов со II–IV ФК ХСН. Дозы фуросемида – старто-вая обычно 20–40 мг, максимальная до 500–600 мг (хотяимеются сведения об использовании доз до 1800 мг / сут).Диуретический эффект препарата длится 6–8 часов, поэ-тому сегодня для лечения наиболее тяжелых пациентовможет быть рекомендовано двукратное (а в критическихсостояниях и длительное, иногда 24-часовое, внутривен-ное капельное введение) в сутки применение фуросеми-да, как альтернатива увеличению однократной дозы [324,327]. С формальной точки зрения двукратное назначе-ние фуросемида наиболее обосновано для лечения ХСН,однако с практической (диурез в ночные часы после вто-рой дозы препарата) выполнимо лишь у больных СН III–IV ФК с рефрактерным отечным синдромом. Наиболеесерьезными побочными реакциями на лечение фуросе-мидом можно считать гипокалиемию и гипомагниемию,повышение активности РААС, гипергликемию и увели-чение уровня ХС. Выход из положения – применениеадекватных доз и сочетание с блокаторами РААС (иАПФ,АРА), особенно с АМКР, позволяющими предотвращатьэлектролитные нарушения [268, 324].
Этакриновая кислота (стартовая доза 25–50 мг / сут,максимальная до 250 мг) по диуретическим свойстваммало отличается от фуросемида, хотя по химическойструктуре это единственный диуретик, не содержащийв молекуле остатков сульфомоильной кислоты. Поэтомупри привыкании и снижении эффективности фуросемида(или торасемида) может быть обоснован временный пере-вод «диуретикзависимых» больных на прием этакриновойкислоты. Как и фуросемид, этакриновая кислота обладаеткоротким периодом полувыведения, что невыгодно и тре-бует, как минимум, двукратного назначения препарата.
Аналогичными с фуросемидом и этакриновой кисло-той диуретическими свойствами обладает и буметанид(стартовая доза 0,5–1,0 мг, максимальная – до 10 мг),но он является самым короткодействующим петлевымдиуретиком, что снижает обоснованность его использо-вания в лечении ХСН.
Торасемид – самый эффективный и безопасный петлевойдиуретик с оптимальным фармакокинетическим про-филем. Стартовая доза препарата 2,5–5 мг, которая при необ-ходимости может быть увеличена до 100–200 мг в сутки.
Торасемид – типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей частипетли Генле. По фармакокинетическим свойствам он пре-восходит фуросемид (длительность эффекта до 18 часов),имеет лучшую и предсказуемую всасываемость по срав-нению с фуросемидом (90 % против 50 %), причем егобиоусвояемость не зависит от приема пищи и почтивдвое выше, чем у фуросемида [323, 328].
При почечной недостаточности период полувыведенияторасемидане изменяется (метаболизм в печени = 80 %) [329]. Но главным положительным отличием торасемидаот других петлевых диуретиков являются его дополни-тельные эффекты, в частности, связанные с одновремен-ной блокадой РААС.
Доказан дозозависимый блокирующий эффект торасе-мида на стимулируемый АII вход кальция в клетки [330].
В многочисленных исследованиях показаны антиаль-достероновые эффекты торасемида, сопровождающиесядостоверным уменьшением фиброза миокарда и параллель-ным улучшением диастолических свойств миокарда [331].
Более того, имеются сведения и об антиадренергиче-ских эффектах препарата [332].
Таким образом, торасемид – первый диуретик, спо-собный не только влиять на симптоматику больных ХСН,но и на прогрессирование болезни и течение патологиче-ских процессов в сердечной мышце. В недавних россий-ских исследованиях была подтверждена способность тора-семида влиять на ремоделирование ЛЖ и нормализоватьсоотношение маркеров синтеза / распада коллагена [333].
Кроме того, применение торасемида позволяет пре-одолевать основные недостатки активной диуретическойтерапии: усиливается собственно мочегонное действиеи блокируются побочные эффекты (электролитные нару-шения и активация РААС).
В сравнительных контролируемых исследованияхс фуросемидом торасемид продемонстрировал болеевысокую клиническую эффективность и переносимость[334], а также способность уменьшать число повтор-ных госпитализаций в связи с обострением ХСН [335].Длительный плавный диурез (14–18 часов в сравнениис 4–5 часами для фуросемида) позволяет пациенту бытьмобильным, что существенно увеличивает привержен-ность к лечению. В российском многоцентровом исследо-вании ДУЭЛЬ торасемид превосходил фуросемид в ско-рости достижения компенсации, максимуме эффектаи вызывал минимальное количество побочных эффектов,в том числе метаболических и электролитных (0,3 % про-тив 4,2 % на фуросемиде) [336].
В исследовании TORIC торасемид продемонстриро-вал способность лучше влиять на прогноз больных ХСН,что делает этот современный мочегонный препарат сред-ством выбора, в особенности при длительном леченииклинически выраженной декомпенсации (уровень дока-занности В) [337]. Поэтому торасемид обоснованно счи-тается, по мнению АКК / ААС, диуретическим препара-том первого выбора в лечении больных ХСН [4].
Тиазидные диуретики (гипотиазид) нарушают реаб-сорбцию натрия в кортикальном сегменте восходящейчасти петли Генле и в начальной части дистальных каналь-цев. Повышают диурез и натрийурез на 30–50 %, эффек-тивны при уровне фильтрации более 30–50 мл / мин.Поэтому при почечной недостаточности их примене-ние бесполезно.
Гидрохлортиазид (гипотиазид) – основной пред-ставитель класса тиазидных диуретиков, применяет-ся, как правило, у больных умеренной ХСН (II ФК).Стартовая доза препарата 25 мг, максимальная 200 мг,поскольку при ее превышении диуретический эффектувеличивается минимально, а риск типичных побоч-ных явлений существенно возрастает. Следует помнить,что гипотиазид при всех своих положительных эффектах –препарат, требующий аккуратного и правильного приме-нения во избежание серьезных нежелательных явленийи для достижения оптимального эффекта на протяжениисуток требует двукратного применения.
Индапамид по профилю безопасности существеннопревосходит гипотиазид, однако данных по его приме-нению в лечении ХСН в настоящее время недостаточно.Еще один представитель этого класса диуретиков – хлор-талидон обычно используется в лечении больных АГ. Но,как и индапамид, может быть применен у пациентовс начальными стадиями ХСН, при сохранной фильтраци-онной функции почек.
К сожалению, в России не зарегистрирован самыйсильный из современных тиазидных диуретиков – мето-лазон (дозы от 2,5 до 10 мг), который в США рассматри-вается, как основное дополнение к петлевым диуретикампри рефрактерном отечном синдроме.
Ингибиторы карбоангидразы (ИКАГ), как сле-дует из их названия, блокируют фермент карбоанги-дразу в области проксимальных почечных канальцев,что сопровождается незначительным диурезом (при-рост до 10–15 %). Как самостоятельные диуретики,ингибиторы карбоангидразы в лечении ХСН почтине применяются из-за недостаточного диуретическо-го действия, однако усиливают «загрузку» натриемнижележащих отделов канальцев, что повышает эффек-тивность более сильных диуретиков. При истощениифермента карбоангидразы через 3–4 дня непрерывногоприменения активность ацетазоламида падает, что тре-бует перерыва в лечении.
Поэтому ацетазоламид используется в качествевспомогательного средства на фоне приема актив-ных мочегонных (тиазидных и / или петлевых).Назначаемый в дозе 0,25 мг трижды в день в течение3–4 дней с двухнедельным перерывом, этот препаратподкисляет среду, что восстанавливает диуретиче-скую активность тиазидных и петлевых диуретиков,при длительном применении которых типично раз-витие алкалоза. Обязательным считается сочетаниеактивных диуретиков и ацетазоламида у больных ХСНи сопутствующей легочной патологией (уровень дока-занности В) [338].
Кроме того, имеются сведения, что применение ацета-золамида в дозе 0,25 мг за 1 час до отхода ко сну позволя-ет уменьшить степень ночного апноэ, способного ослож-нять течение болезни у 40 % больных ХСН (уровень дока-занности С) [339, 340].
АМКР в высоких дозах (как правило, спиронолак-тон) применяются в качестве калийсберегающих пре-паратов вместе с активными мочегонными.
Другие калийсберегающие препараты (триамтерен)в настоящее время используются редко и лишь при непе-реносимости АМКР.
Рефрактерный отечный синдром
В ряде случаев может развиваться толерантностьк дегидратационному лечению, в частности, к использо-ванию диуретиков.11.1.2.1.3.2Рефрактерность бывает ранняя (так называемое тор-можение эффекта) и поздняя.
Ранняя рефрактерность развивается в первые часыили дни после начала активного назначения мочегон-ных средств, зависит от гиперактивации нейрогормонови тем сильнее, чем активнее дегидратация (тот самыйнерекомендуемый обильный диурез). Преодолеваетсяадекватным (не чрезмерным) диурезом (особенно редкоэто осложнение развивается при назначении торасеми-да) плюс обязательным совместным применением иАПФи / или спиронолактона.
Поздняя рефрактерность развивается спустя неделии месяцы постоянной диуретической терапии и связанас гипертрофией апикальных клеток почечных каналь-цев, где как раз и действуют диуретики. Бороться с этимвидом рефрактерности сложнее. Требуется периодиче-ская (один раз в 3–4 недели) смена активных диуретикови их комбинация с иАПФ. В этих случаях предпочтитель-но применение торасемида.
Как же поступать при рефрактерном отечном синдро-ме, когда пациенту требуется экстренная дегидратация?Существуют относительно простые приемы преодоле-ния устойчивости к использованию мочегонных средств.
A) Применение диуретиков (лучше предпочесть тора-семид) только на фоне иАПФ и спиронолактона. Этоглавное условие успеха.
B) Введение большой (вдвое бóльшей, чем предыдущаянеэффективная доза) дозы диуретика и только вну-тривенно.
C) Некоторые авторы предлагают вводить фуросемид(лазикс) дважды в сутки и даже постоянно внутри-венно капельно [327].
D) Сочетание диуретиков с препаратами, улучшающимифильтрацию. При САД более 100 мм рт. ст. – эуфил-лин (10 мл 2,4 % раствора внутривенно капельнои сразу после капельницы – внутривенно лазикс)или сердечные гликозиды, при более низком АД –допамин (2–5 мкг / мин). Завершившееся в 2009 годуисследование DAD–HF продемонстрировало, чтоинфузия допамина (5 мкг / кг / мин) позволяла в 4 разаснизить дозу фуросемида при сохранении диурезаи сохранении функции почек [341].
E) Применение диуретиков с альбумином или плазмой(можно вместе, что особенно важно при гипопроте-инемии, но эффективно и у пациентов с нормальнымуровнем белка плазмы).
F) При выраженной гипотонии – комбинация с поло-жительными инотропными средствами (левосимен-дан, добутамин, допамин) и, в крайнем случае, с глю-кокортикоидами (только на период критическойгипотонии).
G) При САД более 125 мм рт. ст. эффективной можетбыть комбинация с вазодилататорами (нитроглице-рин, нитропруссид натрия), из которых наиболееперспективным выглядит применение серелаксина(в РФ пока не зарегистрирован) [342].
H) Сочетания диуретиков по тем принципам, что указа-ны выше.
I) Механические способы удаления жидкости (плев-ральная, перикардиальная пункции, парацентез)используются лишь по витальным показаниям.
Сердечные гликозиды
Сердечные гликозиды остаются в числе основных средств лечения ХСН в течение более 200 лет.
Гликозиды имеют три основных механизма действия –положительный инотропный, отрицательный хронотроп-ный (имеющий разную физиологическую основу при ФПи синусовом ритме) и нейромодуляторный эффекты. Хотяэто хорошо и давно известный факт, однако повсеместнопрактические врачи считают главным именно положитель-ное инотропное действие гликозидов, что совершенноне обосновано [343–346]. Мощное положительное ино-тропное действие гликозидов проявляется при их приме-нении в высоких дозах (для дигоксина более 0,375 мг / сут).Однако использование высоких (более 0,375 мг) доздигоксина чревато развитием интоксикации и являетсяпредиктором негативного влияния на прогноз больныхХСН [346–348]. Поэтому дигоксин у больных ХСН всег-да должен применяться в малых дозах: до 0,25 мг / сут(для больных с массой тела более 85 кг до 0,375 мг / сут,а при массе тела менее 65 кг – до 0,125 мг / сут). В такихдозировках он действует преимущественно как нейрогор-мональный модулятор, оказывает слабое положительноеинотропное действие и не стимулирует развитие наруше-ний сердечного ритма [344–346].
В настоящее время в клинической практике в подавля-ющем большинстве случаев используется дигоксин, обла-дающий оптимальными фармакодинамическими свой-ствами и доказанной клинической эффективностью [1,4, 6, 8]. Применение других гликозидов для длительноголечения больных ХСН не имеет оснований.
Применение короткодействующих сердечных гли-козидов для внутривенного введения (Строфантин К)крайне ограничено: только в случаях обострения ХСНна фоне тахисистолической формы мерцания предсердий.И даже в этом случае предпочтительным выглядит восста-новление синусового ритма.
Классически дигоксин использовался для лече-ния систолической ХСН. Накоплен богатый клиниче-ский опыт по его успешному применению у пациентовс декомпенсацией. При этом считалось, что препаратнаиболее эффективен у пациентов с ФП, так как, помимоположительного инотропного эффекта, препарат умень-шает ЧСС (как за счет парасимпатической активации, таки в результате отрицательного дромотропного эффекта –замедления проведения импульсов через атрио-вентрику-лярное = A–V соединение) и главное – делает ритм болеерегулярным (устраняет дефицит пульса и число гемоди-намически активных сокращений из-за короткой диасто-лы). В отличие от дигоксина β-АБ, урежая ЧСС при ФП,не «упорядочивают» ритма, т. к. минимально влияютна проведение импульсов через А–V узел. Данные недав-него мета-анализа не продемонстрировали, что β-АБулучшают прогноз пациентов с систолической ХСН и ФП[349]. Это делает еще более актуальным вопрос о возмож-ности урежения ЧСС и снижения смертности у даннойкатегории пациентов при помощи дигоксина. К сожале-нию, как и в случаях с диуретиками, рандомизированныхисследований на эту тему нет. Данные последнего наибо-лее методически правильного ретроспективного анализаисследования AFFIRM, в котором дигоксин применяетсяу пациентов с ФП (не обязательно с ХСН), не выявилидостоверной связи между применением дигоксина и про-гнозом больных [350]. В небольшом, но проспективном(3,3 года) исследовании продемонстрировано достовер-ное снижение риска смерти у больных с декомпенсиро-ванной ХСН, получавших лечение дигоксином [351].
Таким образом, до проведения проспективных кон-тролируемых исследований следует руководствоватьсярекомендациями – дигоксин должен назначаться всембольным ХСН II–IV ФК, с ФВ ЛЖ <40 % при ФП с цельюурежения и упорядочения ритма, возможного улучшенияпрогноза и снижения риска госпитализаций (класс реко-мендаций I, уровень доказанности С).
Применение дигоксина у пациентов с ХСН и сину-совым ритмом было изучено в проспективном исследо-вании DIG, показавшем, что дигокин достоверно снижа-ет риск госпитализаций (на 30 %), но не влияет на рисксмерти.
Особенно эффективно применение дигоксина у паци-ентов с выраженной ХСН III–IV ФК, низкой ФВ ЛЖ<25 % и большими размерами сердца (кардиоторакаль-ный индекс более 55 %) [352].
В этом же исследовании было показано, что исполь-зование низких доз дигоксина (концентрация в плазмедо 0,9 нг / мл) позволяет достоверно снижать риск смертибольных ХСН с синусовым ритмом на 6 % и риск обостре-ний ХСН на 30 %, что делает отказ от применения этогопрепарата в лечении ХСН совершенно не обоснован-ным. Однако при концентрации 0,9–1,1 нг / мл дигоксинне оказывает влияния на прогноз, а при концентрацияхвыше 1,1 нг / мл может провоцировать развитие наруше-ний ритма сердца и увеличение риска смерти [347].
При применении сердечных гликозидов у женщинчаще, чем у мужчин, возникают интоксикация и риск жиз-неугрожающих желудочковых нарушений ритма сердца,что связано с более высокими концентрациями, в част-ности, дигоксина, создающимися в крови при приемеодинаковых доз (исследование DIG). Поэтому рекомендуется назначать им более низкие дозы и контролироватьуровень дигоксина в крови, не превышая концентрацию1,1 нг / мл [348].
При явлениях почечной недостаточности суточнаядоза дигоксина должна быть уменьшена пропорциональноснижению клиренса креатинина и СКФ менее 60 мл / мин.У пожилых больных суточные дозы дигоксина должныбыть снижены до 0,0625–0,125 мг (¼–½ таблетки).
Предпочтительным во всех случаях является соче-тание сердечных гликозидов с β-АБ, при котором лучшеконтролируется ЧСС, снижается риск опасных для жиз-ни желудочковых нарушений ритма сердца и уменьшает-ся опасность обострения коронарной недостаточности.
Таким образом, при ХСН с ФВ ЛЖ <40 % и синусо-вым ритмом применение дигоксина ДОЛЖНО быть рас-смотрено при недостаточной эффективности основныхсредств лечения декомпенсации для уменьшения рискаповторных госпитализаций (класс рекомендаций IIA,уровень доказанности B).
Ивабрадин
Ивабрадин – селективный блокатор If -токов в клет-ках синусового узла, обладает выраженным антиан-гинальным эффектом, не уступающим β-АБ и БМКК[353, 354]. В современных рекомендациях показания-ми к применению ивабрадина у больных ИБС являетсяналичие стенокардии при синусовом ритме с ЧСС более60 уд / мин. [355]. Причем доказан не только эффектмонотерапии ивабрадином, но и дополнительное уве-личение толерантности к нагрузкам при сочетании егос β-АБ [353, 356]. Учитывая, что ИБС является наибо-лее частой причиной дисфункции ЛЖ и в дальнейшемХСН, важной страницей в изучении эффектов ивабра-дина явилось исследование BEAUTIFUL, включившееоколо 11 тыс. пациентов с ИБС и ФВ ЛЖ <40 % (более1300 больных в РФ) [357].
Хотя исследование изучало группу больных с ише-мической дисфункцией ЛЖ, среди обследованных 84 %пациентов имели симптомы ХСН II–III ФК в моментвключения в исследование. В исследовании BEAUTIFULбыло доказано, что пациенты с ИБС и ЧСС более70 уд / мин имеют достоверно более высокий риск смер-ти (на 34 %), ОИМ и обострения ХСН (на 53 %), несмо-тря на проводимую терапию, включавшую у 90 % блока-торы РААС и почти у 90 % пациентов β-АБ. Причем зави-симость между ЧСС и риском обострений ХСН былалинейной, риск плохого прогноза максимально возрасталпри ЧСС выше 90 уд / мин. В исследовании BEAUTIFULприменение комбинации ивабрадина с β-АБ у больныхХСН и средней исходной ЧСС 78 уд / мин не снижа-ло достоверно риска смерти и обострений ХСН (рискпоследних был на 16 % меньше на фоне лечения ива-брадином). Но в подруппе пациентов с исходной ЧССболее 70 уд / мин отмечено достоверное снижение коро-нарных осложнений (ОИМ на 36 % и необходимостив реваскуляризации на 30 %). Показание к применениюивабрадина у больных ИБС с дисфункцией ЛЖ и ЧССболее 70 уд / мин для предотвращения повторных ОИМи коронарных реваскуляризаций вошло в Российскиерекомендации по лечению ИБС [355].
Для прояснения истинных позиций блокаторовIf -каналов в лечении больных с декомпенсацией былопроведено исследование SHIFT, в котором комбинация ивабрадина с β-АБ (90 % пациентов) исследовалась у 6 500 пациентов с выраженной ХСН ишемическойи неишемической этиологии на синусовом ритме с ЧСС более 70 уд / мин по влиянию на комбинированную точку риск сердечно-сосудистой смертности и госпитализаций в связи с обострением ХСН (более 700 больныхв РФ). Необходимо отметить, что ни о каком сравненииивабрадина с β-АБ речь не шла и всем пациентам должнабыла быть сделана попытка назначения β-АБ и титрова-ния их доз до оптимальных. Основными причинами нена-значения β-АБ или недостижения оптимальной ЧСС яви-лись низкое АД с соответсвующей симптоматикой и обо-стрение ХОБЛ [299].
Результаты исследования продемонстрировали достоверное снижение риска сердечно-сосудистой смерт-ности плюс госпитализаций из-за обострения ХСН (классическаяпервичная точка протоколов с ХСН)на 18 %, при этом назначение ивабрадина 31 больномуХСН предотвращало одно событие. Риск смерти из-заХСН и риск госпитализаций в связи с обострениемдекомпенсации снижались достоверно на 26 % каждыйсоответственно [299]. Важным дополнительным преи-муществом ивабрадина явилось снижение на 25 % рискалюбых госпитализаций (включая повторные), что дела-ет лечение больных ХСН блокатором If -каналов эконо-мически выгодным [358].
Снижение смертности по любым причинам (что не было первичной точкой исследования и даже ком-понентом первичной точки) составило 10 % (р=0,092)в группе больных ХСН с ЧСС >70 уд / мин. Однаков исследовании SHIFT достоверное возрастание риска смерти больных ХСН отмечалось при исходной ЧССболее 75 уд / мин [359], и подгрупповой (запланировантивность ивабрадина у пациентов с ЧСС более 77 уд / мин[299]. Выполненный ретроспективно анализ среди пациентов, включавшихся в исследование SHIFT с исходнойЧСС более 75 уд / мин, подтвердил способность ивабради-на достоверно снижать риск общей (на 17 %) и сердечно-сосудистой смерти (на 17 %) [359]. Это спровоцировалоЕвропейское агентство по контролю за применениемлекарственных препаратов рекомендовать применениеивабрадина у больных ХСН со сниженной ФВ ЛЖ и ЧССболее 75 уд / мин, что является формальным нарушениемпринципов доказательной медицины и не соответствуеткритериям исследования SHIFT. Ассоциация сердечнойнедостаточности Европейского общества кардиологоврекомендует ивабрадин при ЧСС больше 70 уд / мин, но в целях терапии отмечает лишь снижение госпитализа-ций (одного из компонентов первичной точки), что так-же не соответствует реалиям исследования SHIFT [3].
По мнению экспертов ОССН, в полном соответствиис критериями и результатами исследования SHIFT ива-брадин должен быть назначен больным ХСН II–IV ФК,с ФВ ЛЖ <40 % и синусовым ритмом, ЧСС >70 уд / минв дополнение к основной терапии (в том числе β-АБ)для снижения риска суммы смертей плюс госпитали-заций из-за обострения ХСН (класс рекомендаций IIA,уровень доказанности В).
Имеющиеся результаты исследований позволяютрекомендовать достижение ЧСС ниже 60 уд / мин (опти-мальный диапазон 55–60 уд / мин) и степень сниженияне менее 10 уд / мин от исходного, что обеспечиваетмаксимальное снижение риска заболеваемости и смерт-ности у больных ХСН [360]. Среднее снижение рискасмерти больных ХСН, находящихся на синусовом ритме,в расчете на каждые 10 ударов снижения ЧСС на фонетерапии ивабрадином составляет 29 %, что сравнимос эффектами β-АБ [361]. Это позволяет считать сниже-ние ЧСС универсальным механизмом улучшения про-гноза пациентов с ХСН.
Эфиры омега-3 полиненасыщенныхжирных кислот (Омакор)
Одним из наиболее дискутируемых вопросов в лече-нии ССЗ является применение полиненасыщенных жир-ных кислот. Данные последних мета-анализов и проспек-тивных исследований по профилактике ФП и первичнойпрофилактике ССЗ, включая СД, не позволяют надеять-ся на сколько-нибудь выраженный эффект рыбьего жираи приема препаратов, содержащих добавки «морских»омега ненасыщенных жирных кислот.
Однако имеются результаты нескольких крупных ран-домизированных исследований у больных, перенесшихОИМ, и пациентов, имеющих симптомы выраженнойХСН II–IV ФК, с назначением «подготовленной» фор-мы, содержащей эфиры длинноцепочечных омега-3 поли-ненасыщенных жирных кислот (ПНЖК), содержащих46 % эйкозапентаеновой и 38 % докозагексаеновой кислот,по влиянию на твердые конечные точки. Прием такойформы позволяет через 72 часа достоверно повышатьиндекс ω-3 ПНЖК в мембране клеток, что может оказы-вать целый ряд эффектов, основным из которых являетсяантиаритмический, связанный, как показано в экпери-ментальных исследованиях, с:
A) блокадой натрий-кальциевого насоса в кардиомиоцитах,
B) блокадой позднего натриевого тока,
C) блокадой кальциевых каналов L-типа,
D) антагонизмом к рецепторам растяжения (при повы-шенном миокардиальном стрессе),
E) способностью уменьшать образование «пенных кле-ток» и воспаления на поверхности атеросклеротиче-ской бляшки,
F) снижением образования свободных радикалов и умень-шением реперфузионных нарушений,
G) улучшением синтеза энергии в митохондриях,
H) снижением ЧСС (~2 уд / мин) и потребления О2
В самом крупном исследовании GISSI-P (более11 тыс. больных, перенесших ОИМ) назначение 1 г / сутω-3 ПНЖК достоверно снижало риск общей смертина 41 %, причем этот эффект развивался быстро (в тече-ние 90 дней лечения) и был связан с анитифибрилляторнымэффектом и снижением риска аритмической смертина 45 % [362]. Дальнейшее лечение практически не вли-яло на прогноз пациентов, что позволило предположитьналичие выраженного антифибрилляторного эффектаω-3 ПНЖК, который проявлялся тем больше, чем нижебыла ФВ ЛЖ у пациентов, переживших ОИМ [363].В меньших по объему исследованиях либо снижениериска смерти не достигало статистически достоверныхразличий, либо результаты были нейтральными. В послед-нем мета-анализе продемонстрировано, что назначениеω-3 ПНЖК в первые 14 дней после ОИМ ассоцииру-ется с достоверным снижением риска смерти на 32 %,при назначении до 90‑го дня риск смерти снижаетсяна 22 % (все еще статистически значимо), а назначениеэтой терапии более чем через 3 месяца после перенесен-ного ОИМ фактически не влияет на прогноз [364].
В 2008 году в многоцентровом двойном слепом пла-цебо-контролируемом исследовании GISSI–HF Омакор мальной терапии (иАПФ или АРА + β-АБ + антагонистыальдостерона + диуретики + дигоксин). В результатебыло достигнуто достоверное снижение риска общейсмерти больных ХСН на 9 %, р=0,041 (среди закончив-ших исследование на 14 %) и количества госпитализацийна 8 % (в основном связанных с ЖНРС) при длительной(более 18 месяцев) терапии. При этом количество побоч-ных эффектов в группе лечения Омакором не отличалосьот плацебо [365].
Ретроспективный анализ продемонстрировал сни-жение частоты срабатывания ИКД у пациентов, нахо-дившихся на лечении ω-3 ПНЖК, и снижение смерт-ности и госпитализаций в связи с нарушениями ритмасердца [366].
В дополнительном анализе было продемонстрирова-но повышение ФВ ЛЖ на 1,6 % при терапии 1 г / сут ω-3ПНЖК [367].
Позднее в ряде небольших исследований была обна-ружена дозозависимая (1 г / сут против 2 г / сут и 4 г / сут)способность ω-3 ПНЖК положительно влиять на уро-вень провоспалительных цитокинов, улучшать степеньэндотелий-зависимой функции сосудов и увеличивать ФВЛЖ [368]. Это позволяет предположить наличие анти-ремоделирующего эффекта ω-3 ПНЖК у больных ХСН,что вместе с антифибрилляторным действием можетположительно влиять на заболеваемость и смертностьпациентов с декомпенсацией. К примеру, в плацебо-кон-тролируемом исследовании с применением 2 г / сут ома-кора достигалось выраженное снижение числа повтор-ных госпитализаций из-за обострения ХСН [365].
Исходя из изложенных фактов и признавая, чтоне на все вопросы имеются адекватные ответы, а такжене очень выраженный эффект омакора, наступавшийчерез месяцы после начала лечения, показания к его при-менению при ХСН и особенно у пациентов, перенесшихОИМ, вошли во все рекомендации. В Европейских реко-мендациях 2012 года эксперты оценили класс рекомен-даций как IIB (может быть назначен) при уровне дока-занности В. Эксперты ОССН при разделившихся мне-ниях предпочли определить класс рекомендаций, как IIAпри уровне доказанности В. Аналогичная степень обо-снованности использования эфиров ω-3 ПНЖК приня-та в Американских рекомендациях 2013 года.
Таким образом, назначение ω-3 ПНЖК в дозе 1 г / сутдолжно быть рассмотрено у больных ХСН II–IV ФКс ФВ ЛЖ <35 % для снижения риска смерти (в том числевнезапной) и повторных госпитализаций в дополнениек основным средствам лечения ХСН.
Антикоагулянты в лечении больных ХСН
Низкомолекулярные гепариныпри наличии венозных тромбозови высоком риске их развития
Учитывая, что ХСН – это состояние, при которомвозрастает риск тромбоэмболий и инсультов, важ-ную роль в терапии этого синдрома играют антико-агулянты [369, 370]. Причем, по мнению ряда иссле-дователей, само наличие ХСН из-за стаза в полостяхсердца, наблюдаемого при дилатации ЛЖ, являетсяфактором, способствующим развитию как перифери-ческого венозного, так и внутрисердечного тромбо-за, как источника будущих тромбоэмболий [371–374].До 40 % больных с выраженной ХСН имеют призна-ки тромбоза глубоких вен, и у 5,5 % пациентов тром-боэмболии легочной артерии осложняют течениедекомпенсации, причем чем тяжелее ХСН и ниже ФВ,тем более вероятно появление тромбозов и эмболий[375]. Дополнительными факторами являются деги-дратационная терапия (чем обильнее диурез, тем хуже)и нахождение больного на постельном режиме (напри-мер, при декомпенсации) [376].
Доказано, что для предотвращения тромбозов и эмбо-лий у пациентов с ХСН, находящихся на постельномрежиме, эффективным может быть лечение низкомоле-кулярными гепаринами (эноксипарином) по 40 мг / сутв течение 2 недель [377, 378]. При этом риск тромбо-зов и эмболий снижается на 60 % в течение 4‑месяч-ного наблюдения. Аналогичные сведения имеютсяи для дальтепарина, хотя процент снижения осложненийзначительно ниже [379, 380]. Таким образом, при нали-чии венозного тромбоза, высоком риске его развитияи декомпенсации, требующей постельного режимав течение не менее 3 суток, больные ХСН с ФВ ЛЖ <35 %должны получать лечение низкомолекулярными гепари-нами в течение 2 недель (класс рекомендаций IIA, уро-вень доказанности А). Аналогичная степень обоснован-ности использования эфиров омега‑3 ПНЖК принятав Американских рекомендациях 2013 года.
Оральные антикоагулянтыдля предотвращения риска тромбоэмболий
Вопрос о применении оральных антикоагулянтов(ОАКГ) при ХСН можно разделить на две неравные по значимости темы в связи с характером основного ритма сердца. При синусовом ритме каких‑либо серьезных про-спективных исследований не проводилось, и все имею-щиеся сведения касаются только антагонистов витамина К (варфарина).
Таблица 24. Применение оральных антикоагулянтов при ХСН с синусовым ритмом
Лидером в лечении отечного синдрома на протя-жении более 50 лет является фуросемид [325, 326].Препарат применяется как в виде внутривенных инъекций(особенно при обострениях ХСН), так и в видетаблеток для длительного поддерживающего леченияпациентов со II–IV ФК ХСН. Дозы фуросемида – старто-вая обычно 20–40 мг, максимальная до 500–600 мг (хотяимеются сведения об использовании доз до 1800 мг / сут).Диуретический эффект препарата длится 6–8 часов, поэ-тому сегодня для лечения наиболее тяжелых пациентовможет быть рекомендовано двукратное (а в критическихсостояниях и длительное, иногда 24-часовое, внутривен-ное капельное введение) в сутки применение фуросеми-да, как альтернатива увеличению однократной дозы [324,327]. С формальной точки зрения двукратное назначе-ние фуросемида наиболее обосновано для лечения ХСН,однако с практической (диурез в ночные часы после вто-рой дозы препарата) выполнимо лишь у больных СН III–IV ФК с рефрактерным отечным синдромом. Наиболеесерьезными побочными реакциями на лечение фуросе-мидом можно считать гипокалиемию и гипомагниемию,повышение активности РААС, гипергликемию и увели-чение уровня ХС. Выход из положения – применениеадекватных доз и сочетание с блокаторами РААС (иАПФ,АРА), особенно с АМКР, позволяющими предотвращатьэлектролитные нарушения [268, 324].
Этакриновая кислота (стартовая доза 25–50 мг / сут,максимальная до 250 мг) по диуретическим свойстваммало отличается от фуросемида, хотя по химическойструктуре это единственный диуретик, не содержащийв молекуле остатков сульфомоильной кислоты. Поэтомупри привыкании и снижении эффективности фуросемида(или торасемида) может быть обоснован временный пере-вод «диуретикзависимых» больных на прием этакриновойкислоты. Как и фуросемид, этакриновая кислота обладаеткоротким периодом полувыведения, что невыгодно и тре-бует, как минимум, двукратного назначения препарата.
Аналогичными с фуросемидом и этакриновой кисло-той диуретическими свойствами обладает и буметанид(стартовая доза 0,5–1,0 мг, максимальная – до 10 мг),но он является самым короткодействующим петлевымдиуретиком, что снижает обоснованность его использо-вания в лечении ХСН.
Торасемид – самый эффективный и безопасный петлевойдиуретик с оптимальным фармакокинетическим про-филем. Стартовая доза препарата 2,5–5 мг, которая при необ-ходимости может быть увеличена до 100–200 мг в сутки.
Торасемид – типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей частипетли Генле. По фармакокинетическим свойствам он пре-восходит фуросемид (длительность эффекта до 18 часов),имеет лучшую и предсказуемую всасываемость по срав-нению с фуросемидом (90 % против 50 %), причем егобиоусвояемость не зависит от приема пищи и почтивдвое выше, чем у фуросемида [323, 328].
При почечной недостаточности период полувыведенияторасемидане изменяется (метаболизм в печени = 80 %) [329]. Но главным положительным отличием торасемидаот других петлевых диуретиков являются его дополни-тельные эффекты, в частности, связанные с одновремен-ной блокадой РААС.
Доказан дозозависимый блокирующий эффект торасе-мида на стимулируемый АII вход кальция в клетки [330].
В многочисленных исследованиях показаны антиаль-достероновые эффекты торасемида, сопровождающиесядостоверным уменьшением фиброза миокарда и параллель-ным улучшением диастолических свойств миокарда [331].
Более того, имеются сведения и об антиадренергиче-ских эффектах препарата [332].
Таким образом, торасемид – первый диуретик, спо-собный не только влиять на симптоматику больных ХСН,но и на прогрессирование болезни и течение патологиче-ских процессов в сердечной мышце. В недавних россий-ских исследованиях была подтверждена способность тора-семида влиять на ремоделирование ЛЖ и нормализоватьсоотношение маркеров синтеза / распада коллагена [333].
Кроме того, применение торасемида позволяет пре-одолевать основные недостатки активной диуретическойтерапии: усиливается собственно мочегонное действиеи блокируются побочные эффекты (электролитные нару-шения и активация РААС).
В сравнительных контролируемых исследованияхс фуросемидом торасемид продемонстрировал болеевысокую клиническую эффективность и переносимость[334], а также способность уменьшать число повтор-ных госпитализаций в связи с обострением ХСН [335].Длительный плавный диурез (14–18 часов в сравнениис 4–5 часами для фуросемида) позволяет пациенту бытьмобильным, что существенно увеличивает привержен-ность к лечению. В российском многоцентровом исследо-вании ДУЭЛЬ торасемид превосходил фуросемид в ско-рости достижения компенсации, максимуме эффектаи вызывал минимальное количество побочных эффектов,в том числе метаболических и электролитных (0,3 % про-тив 4,2 % на фуросемиде) [336].
В исследовании TORIC торасемид продемонстриро-вал способность лучше влиять на прогноз больных ХСН,что делает этот современный мочегонный препарат сред-ством выбора, в особенности при длительном леченииклинически выраженной декомпенсации (уровень дока-занности В) [337]. Поэтому торасемид обоснованно счи-тается, по мнению АКК / ААС, диуретическим препара-том первого выбора в лечении больных ХСН [4].
Тиазидные диуретики (гипотиазид) нарушают реаб-сорбцию натрия в кортикальном сегменте восходящейчасти петли Генле и в начальной части дистальных каналь-цев. Повышают диурез и натрийурез на 30–50 %, эффек-тивны при уровне фильтрации более 30–50 мл / мин.Поэтому при почечной недостаточности их примене-ние бесполезно.
Гидрохлортиазид (гипотиазид) – основной пред-ставитель класса тиазидных диуретиков, применяет-ся, как правило, у больных умеренной ХСН (II ФК).Стартовая доза препарата 25 мг, максимальная 200 мг,поскольку при ее превышении диуретический эффектувеличивается минимально, а риск типичных побоч-ных явлений существенно возрастает. Следует помнить,что гипотиазид при всех своих положительных эффектах –препарат, требующий аккуратного и правильного приме-нения во избежание серьезных нежелательных явленийи для достижения оптимального эффекта на протяжениисуток требует двукратного применения.
Индапамид по профилю безопасности существеннопревосходит гипотиазид, однако данных по его приме-нению в лечении ХСН в настоящее время недостаточно.Еще один представитель этого класса диуретиков – хлор-талидон обычно используется в лечении больных АГ. Но,как и индапамид, может быть применен у пациентовс начальными стадиями ХСН, при сохранной фильтраци-онной функции почек.
К сожалению, в России не зарегистрирован самыйсильный из современных тиазидных диуретиков – мето-лазон (дозы от 2,5 до 10 мг), который в США рассматри-вается, как основное дополнение к петлевым диуретикампри рефрактерном отечном синдроме.
Ингибиторы карбоангидразы (ИКАГ), как сле-дует из их названия, блокируют фермент карбоанги-дразу в области проксимальных почечных канальцев,что сопровождается незначительным диурезом (при-рост до 10–15 %). Как самостоятельные диуретики,ингибиторы карбоангидразы в лечении ХСН почтине применяются из-за недостаточного диуретическо-го действия, однако усиливают «загрузку» натриемнижележащих отделов канальцев, что повышает эффек-тивность более сильных диуретиков. При истощениифермента карбоангидразы через 3–4 дня непрерывногоприменения активность ацетазоламида падает, что тре-бует перерыва в лечении.
Поэтому ацетазоламид используется в качествевспомогательного средства на фоне приема актив-ных мочегонных (тиазидных и / или петлевых).Назначаемый в дозе 0,25 мг трижды в день в течение3–4 дней с двухнедельным перерывом, этот препаратподкисляет среду, что восстанавливает диуретиче-скую активность тиазидных и петлевых диуретиков,при длительном применении которых типично раз-витие алкалоза. Обязательным считается сочетаниеактивных диуретиков и ацетазоламида у больных ХСНи сопутствующей легочной патологией (уровень дока-занности В) [338].
Кроме того, имеются сведения, что применение ацета-золамида в дозе 0,25 мг за 1 час до отхода ко сну позволя-ет уменьшить степень ночного апноэ, способного ослож-нять течение болезни у 40 % больных ХСН (уровень дока-занности С) [339, 340].
АМКР в высоких дозах (как правило, спиронолак-тон) применяются в качестве калийсберегающих пре-паратов вместе с активными мочегонными.
Другие калийсберегающие препараты (триамтерен)в настоящее время используются редко и лишь при непе-реносимости АМКР.
Рефрактерный отечный синдром
В ряде случаев может развиваться толерантностьк дегидратационному лечению, в частности, к использо-ванию диуретиков.11.1.2.1.3.2Рефрактерность бывает ранняя (так называемое тор-можение эффекта) и поздняя.
Ранняя рефрактерность развивается в первые часыили дни после начала активного назначения мочегон-ных средств, зависит от гиперактивации нейрогормонови тем сильнее, чем активнее дегидратация (тот самыйнерекомендуемый обильный диурез). Преодолеваетсяадекватным (не чрезмерным) диурезом (особенно редкоэто осложнение развивается при назначении торасеми-да) плюс обязательным совместным применением иАПФи / или спиронолактона.
Поздняя рефрактерность развивается спустя неделии месяцы постоянной диуретической терапии и связанас гипертрофией апикальных клеток почечных каналь-цев, где как раз и действуют диуретики. Бороться с этимвидом рефрактерности сложнее. Требуется периодиче-ская (один раз в 3–4 недели) смена активных диуретикови их комбинация с иАПФ. В этих случаях предпочтитель-но применение торасемида.
Как же поступать при рефрактерном отечном синдро-ме, когда пациенту требуется экстренная дегидратация?Существуют относительно простые приемы преодоле-ния устойчивости к использованию мочегонных средств.
A) Применение диуретиков (лучше предпочесть тора-семид) только на фоне иАПФ и спиронолактона. Этоглавное условие успеха.
B) Введение большой (вдвое бóльшей, чем предыдущаянеэффективная доза) дозы диуретика и только вну-тривенно.
C) Некоторые авторы предлагают вводить фуросемид(лазикс) дважды в сутки и даже постоянно внутри-венно капельно [327].
D) Сочетание диуретиков с препаратами, улучшающимифильтрацию. При САД более 100 мм рт. ст. – эуфил-лин (10 мл 2,4 % раствора внутривенно капельнои сразу после капельницы – внутривенно лазикс)или сердечные гликозиды, при более низком АД –допамин (2–5 мкг / мин). Завершившееся в 2009 годуисследование DAD–HF продемонстрировало, чтоинфузия допамина (5 мкг / кг / мин) позволяла в 4 разаснизить дозу фуросемида при сохранении диурезаи сохранении функции почек [341].
E) Применение диуретиков с альбумином или плазмой(можно вместе, что особенно важно при гипопроте-инемии, но эффективно и у пациентов с нормальнымуровнем белка плазмы).
F) При выраженной гипотонии – комбинация с поло-жительными инотропными средствами (левосимен-дан, добутамин, допамин) и, в крайнем случае, с глю-кокортикоидами (только на период критическойгипотонии).
G) При САД более 125 мм рт. ст. эффективной можетбыть комбинация с вазодилататорами (нитроглице-рин, нитропруссид натрия), из которых наиболееперспективным выглядит применение серелаксина(в РФ пока не зарегистрирован) [342].
H) Сочетания диуретиков по тем принципам, что указа-ны выше.
I) Механические способы удаления жидкости (плев-ральная, перикардиальная пункции, парацентез)используются лишь по витальным показаниям.
Сердечные гликозиды
Сердечные гликозиды остаются в числе основных средств лечения ХСН в течение более 200 лет.
Гликозиды имеют три основных механизма действия –положительный инотропный, отрицательный хронотроп-ный (имеющий разную физиологическую основу при ФПи синусовом ритме) и нейромодуляторный эффекты. Хотяэто хорошо и давно известный факт, однако повсеместнопрактические врачи считают главным именно положитель-ное инотропное действие гликозидов, что совершенноне обосновано [343–346]. Мощное положительное ино-тропное действие гликозидов проявляется при их приме-нении в высоких дозах (для дигоксина более 0,375 мг / сут).Однако использование высоких (более 0,375 мг) доздигоксина чревато развитием интоксикации и являетсяпредиктором негативного влияния на прогноз больныхХСН [346–348]. Поэтому дигоксин у больных ХСН всег-да должен применяться в малых дозах: до 0,25 мг / сут(для больных с массой тела более 85 кг до 0,375 мг / сут,а при массе тела менее 65 кг – до 0,125 мг / сут). В такихдозировках он действует преимущественно как нейрогор-мональный модулятор, оказывает слабое положительноеинотропное действие и не стимулирует развитие наруше-ний сердечного ритма [344–346].
В настоящее время в клинической практике в подавля-ющем большинстве случаев используется дигоксин, обла-дающий оптимальными фармакодинамическими свой-ствами и доказанной клинической эффективностью [1,4, 6, 8]. Применение других гликозидов для длительноголечения больных ХСН не имеет оснований.
Применение короткодействующих сердечных гли-козидов для внутривенного введения (Строфантин К)крайне ограничено: только в случаях обострения ХСНна фоне тахисистолической формы мерцания предсердий.И даже в этом случае предпочтительным выглядит восста-новление синусового ритма.
Классически дигоксин использовался для лече-ния систолической ХСН. Накоплен богатый клиниче-ский опыт по его успешному применению у пациентовс декомпенсацией. При этом считалось, что препаратнаиболее эффективен у пациентов с ФП, так как, помимоположительного инотропного эффекта, препарат умень-шает ЧСС (как за счет парасимпатической активации, таки в результате отрицательного дромотропного эффекта –замедления проведения импульсов через атрио-вентрику-лярное = A–V соединение) и главное – делает ритм болеерегулярным (устраняет дефицит пульса и число гемоди-намически активных сокращений из-за короткой диасто-лы). В отличие от дигоксина β-АБ, урежая ЧСС при ФП,не «упорядочивают» ритма, т. к. минимально влияютна проведение импульсов через А–V узел. Данные недав-него мета-анализа не продемонстрировали, что β-АБулучшают прогноз пациентов с систолической ХСН и ФП[349]. Это делает еще более актуальным вопрос о возмож-ности урежения ЧСС и снижения смертности у даннойкатегории пациентов при помощи дигоксина. К сожале-нию, как и в случаях с диуретиками, рандомизированныхисследований на эту тему нет. Данные последнего наибо-лее методически правильного ретроспективного анализаисследования AFFIRM, в котором дигоксин применяетсяу пациентов с ФП (не обязательно с ХСН), не выявилидостоверной связи между применением дигоксина и про-гнозом больных [350]. В небольшом, но проспективном(3,3 года) исследовании продемонстрировано достовер-ное снижение риска смерти у больных с декомпенсиро-ванной ХСН, получавших лечение дигоксином [351].
Таким образом, до проведения проспективных кон-тролируемых исследований следует руководствоватьсярекомендациями – дигоксин должен назначаться всембольным ХСН II–IV ФК, с ФВ ЛЖ <40 % при ФП с цельюурежения и упорядочения ритма, возможного улучшенияпрогноза и снижения риска госпитализаций (класс реко-мендаций I, уровень доказанности С).
Применение дигоксина у пациентов с ХСН и сину-совым ритмом было изучено в проспективном исследо-вании DIG, показавшем, что дигокин достоверно снижа-ет риск госпитализаций (на 30 %), но не влияет на рисксмерти.
Особенно эффективно применение дигоксина у паци-ентов с выраженной ХСН III–IV ФК, низкой ФВ ЛЖ<25 % и большими размерами сердца (кардиоторакаль-ный индекс более 55 %) [352].
В этом же исследовании было показано, что исполь-зование низких доз дигоксина (концентрация в плазмедо 0,9 нг / мл) позволяет достоверно снижать риск смертибольных ХСН с синусовым ритмом на 6 % и риск обостре-ний ХСН на 30 %, что делает отказ от применения этогопрепарата в лечении ХСН совершенно не обоснован-ным. Однако при концентрации 0,9–1,1 нг / мл дигоксинне оказывает влияния на прогноз, а при концентрацияхвыше 1,1 нг / мл может провоцировать развитие наруше-ний ритма сердца и увеличение риска смерти [347].
При применении сердечных гликозидов у женщинчаще, чем у мужчин, возникают интоксикация и риск жиз-неугрожающих желудочковых нарушений ритма сердца,что связано с более высокими концентрациями, в част-ности, дигоксина, создающимися в крови при приемеодинаковых доз (исследование DIG). Поэтому рекомендуется назначать им более низкие дозы и контролироватьуровень дигоксина в крови, не превышая концентрацию1,1 нг / мл [348].
При явлениях почечной недостаточности суточнаядоза дигоксина должна быть уменьшена пропорциональноснижению клиренса креатинина и СКФ менее 60 мл / мин.У пожилых больных суточные дозы дигоксина должныбыть снижены до 0,0625–0,125 мг (¼–½ таблетки).
Предпочтительным во всех случаях является соче-тание сердечных гликозидов с β-АБ, при котором лучшеконтролируется ЧСС, снижается риск опасных для жиз-ни желудочковых нарушений ритма сердца и уменьшает-ся опасность обострения коронарной недостаточности.
Таким образом, при ХСН с ФВ ЛЖ <40 % и синусо-вым ритмом применение дигоксина ДОЛЖНО быть рас-смотрено при недостаточной эффективности основныхсредств лечения декомпенсации для уменьшения рискаповторных госпитализаций (класс рекомендаций IIA,уровень доказанности B).
Ивабрадин
Ивабрадин – селективный блокатор If -токов в клет-ках синусового узла, обладает выраженным антиан-гинальным эффектом, не уступающим β-АБ и БМКК[353, 354]. В современных рекомендациях показания-ми к применению ивабрадина у больных ИБС являетсяналичие стенокардии при синусовом ритме с ЧСС более60 уд / мин. [355]. Причем доказан не только эффектмонотерапии ивабрадином, но и дополнительное уве-личение толерантности к нагрузкам при сочетании егос β-АБ [353, 356]. Учитывая, что ИБС является наибо-лее частой причиной дисфункции ЛЖ и в дальнейшемХСН, важной страницей в изучении эффектов ивабра-дина явилось исследование BEAUTIFUL, включившееоколо 11 тыс. пациентов с ИБС и ФВ ЛЖ <40 % (более1300 больных в РФ) [357].
Хотя исследование изучало группу больных с ише-мической дисфункцией ЛЖ, среди обследованных 84 %пациентов имели симптомы ХСН II–III ФК в моментвключения в исследование. В исследовании BEAUTIFULбыло доказано, что пациенты с ИБС и ЧСС более70 уд / мин имеют достоверно более высокий риск смер-ти (на 34 %), ОИМ и обострения ХСН (на 53 %), несмо-тря на проводимую терапию, включавшую у 90 % блока-торы РААС и почти у 90 % пациентов β-АБ. Причем зави-симость между ЧСС и риском обострений ХСН былалинейной, риск плохого прогноза максимально возрасталпри ЧСС выше 90 уд / мин. В исследовании BEAUTIFULприменение комбинации ивабрадина с β-АБ у больныхХСН и средней исходной ЧСС 78 уд / мин не снижа-ло достоверно риска смерти и обострений ХСН (рискпоследних был на 16 % меньше на фоне лечения ива-брадином). Но в подруппе пациентов с исходной ЧССболее 70 уд / мин отмечено достоверное снижение коро-нарных осложнений (ОИМ на 36 % и необходимостив реваскуляризации на 30 %). Показание к применениюивабрадина у больных ИБС с дисфункцией ЛЖ и ЧССболее 70 уд / мин для предотвращения повторных ОИМи коронарных реваскуляризаций вошло в Российскиерекомендации по лечению ИБС [355].
Для прояснения истинных позиций блокаторовIf -каналов в лечении больных с декомпенсацией былопроведено исследование SHIFT, в котором комбинация ивабрадина с β-АБ (90 % пациентов) исследовалась у 6 500 пациентов с выраженной ХСН ишемическойи неишемической этиологии на синусовом ритме с ЧСС более 70 уд / мин по влиянию на комбинированную точку риск сердечно-сосудистой смертности и госпитализаций в связи с обострением ХСН (более 700 больныхв РФ). Необходимо отметить, что ни о каком сравненииивабрадина с β-АБ речь не шла и всем пациентам должнабыла быть сделана попытка назначения β-АБ и титрова-ния их доз до оптимальных. Основными причинами нена-значения β-АБ или недостижения оптимальной ЧСС яви-лись низкое АД с соответсвующей симптоматикой и обо-стрение ХОБЛ [299].
Результаты исследования продемонстрировали достоверное снижение риска сердечно-сосудистой смерт-ности плюс госпитализаций из-за обострения ХСН (классическаяпервичная точка протоколов с ХСН)на 18 %, при этом назначение ивабрадина 31 больномуХСН предотвращало одно событие. Риск смерти из-заХСН и риск госпитализаций в связи с обострениемдекомпенсации снижались достоверно на 26 % каждыйсоответственно [299]. Важным дополнительным преи-муществом ивабрадина явилось снижение на 25 % рискалюбых госпитализаций (включая повторные), что дела-ет лечение больных ХСН блокатором If -каналов эконо-мически выгодным [358].
Снижение смертности по любым причинам (что не было первичной точкой исследования и даже ком-понентом первичной точки) составило 10 % (р=0,092)в группе больных ХСН с ЧСС >70 уд / мин. Однаков исследовании SHIFT достоверное возрастание риска смерти больных ХСН отмечалось при исходной ЧССболее 75 уд / мин [359], и подгрупповой (запланировантивность ивабрадина у пациентов с ЧСС более 77 уд / мин[299]. Выполненный ретроспективно анализ среди пациентов, включавшихся в исследование SHIFT с исходнойЧСС более 75 уд / мин, подтвердил способность ивабради-на достоверно снижать риск общей (на 17 %) и сердечно-сосудистой смерти (на 17 %) [359]. Это спровоцировалоЕвропейское агентство по контролю за применениемлекарственных препаратов рекомендовать применениеивабрадина у больных ХСН со сниженной ФВ ЛЖ и ЧССболее 75 уд / мин, что является формальным нарушениемпринципов доказательной медицины и не соответствуеткритериям исследования SHIFT. Ассоциация сердечнойнедостаточности Европейского общества кардиологоврекомендует ивабрадин при ЧСС больше 70 уд / мин, но в целях терапии отмечает лишь снижение госпитализа-ций (одного из компонентов первичной точки), что так-же не соответствует реалиям исследования SHIFT [3].
По мнению экспертов ОССН, в полном соответствиис критериями и результатами исследования SHIFT ива-брадин должен быть назначен больным ХСН II–IV ФК,с ФВ ЛЖ <40 % и синусовым ритмом, ЧСС >70 уд / минв дополнение к основной терапии (в том числе β-АБ)для снижения риска суммы смертей плюс госпитали-заций из-за обострения ХСН (класс рекомендаций IIA,уровень доказанности В).
Имеющиеся результаты исследований позволяютрекомендовать достижение ЧСС ниже 60 уд / мин (опти-мальный диапазон 55–60 уд / мин) и степень сниженияне менее 10 уд / мин от исходного, что обеспечиваетмаксимальное снижение риска заболеваемости и смерт-ности у больных ХСН [360]. Среднее снижение рискасмерти больных ХСН, находящихся на синусовом ритме,в расчете на каждые 10 ударов снижения ЧСС на фонетерапии ивабрадином составляет 29 %, что сравнимос эффектами β-АБ [361]. Это позволяет считать сниже-ние ЧСС универсальным механизмом улучшения про-гноза пациентов с ХСН.
Эфиры омега-3 полиненасыщенныхжирных кислот (Омакор)
Одним из наиболее дискутируемых вопросов в лече-нии ССЗ является применение полиненасыщенных жир-ных кислот. Данные последних мета-анализов и проспек-тивных исследований по профилактике ФП и первичнойпрофилактике ССЗ, включая СД, не позволяют надеять-ся на сколько-нибудь выраженный эффект рыбьего жираи приема препаратов, содержащих добавки «морских»омега ненасыщенных жирных кислот.
Однако имеются результаты нескольких крупных ран-домизированных исследований у больных, перенесшихОИМ, и пациентов, имеющих симптомы выраженнойХСН II–IV ФК, с назначением «подготовленной» фор-мы, содержащей эфиры длинноцепочечных омега-3 поли-ненасыщенных жирных кислот (ПНЖК), содержащих46 % эйкозапентаеновой и 38 % докозагексаеновой кислот,по влиянию на твердые конечные точки. Прием такойформы позволяет через 72 часа достоверно повышатьиндекс ω-3 ПНЖК в мембране клеток, что может оказы-вать целый ряд эффектов, основным из которых являетсяантиаритмический, связанный, как показано в экпери-ментальных исследованиях, с:
A) блокадой натрий-кальциевого насоса в кардиомиоцитах,
B) блокадой позднего натриевого тока,
C) блокадой кальциевых каналов L-типа,
D) антагонизмом к рецепторам растяжения (при повы-шенном миокардиальном стрессе),
E) способностью уменьшать образование «пенных кле-ток» и воспаления на поверхности атеросклеротиче-ской бляшки,
F) снижением образования свободных радикалов и умень-шением реперфузионных нарушений,
G) улучшением синтеза энергии в митохондриях,
H) снижением ЧСС (~2 уд / мин) и потребления О2
В самом крупном исследовании GISSI-P (более11 тыс. больных, перенесших ОИМ) назначение 1 г / сутω-3 ПНЖК достоверно снижало риск общей смертина 41 %, причем этот эффект развивался быстро (в тече-ние 90 дней лечения) и был связан с анитифибрилляторнымэффектом и снижением риска аритмической смертина 45 % [362]. Дальнейшее лечение практически не вли-яло на прогноз пациентов, что позволило предположитьналичие выраженного антифибрилляторного эффектаω-3 ПНЖК, который проявлялся тем больше, чем нижебыла ФВ ЛЖ у пациентов, переживших ОИМ [363].В меньших по объему исследованиях либо снижениериска смерти не достигало статистически достоверныхразличий, либо результаты были нейтральными. В послед-нем мета-анализе продемонстрировано, что назначениеω-3 ПНЖК в первые 14 дней после ОИМ ассоцииру-ется с достоверным снижением риска смерти на 32 %,при назначении до 90‑го дня риск смерти снижаетсяна 22 % (все еще статистически значимо), а назначениеэтой терапии более чем через 3 месяца после перенесен-ного ОИМ фактически не влияет на прогноз [364].
В 2008 году в многоцентровом двойном слепом пла-цебо-контролируемом исследовании GISSI–HF Омакор мальной терапии (иАПФ или АРА + β-АБ + антагонистыальдостерона + диуретики + дигоксин). В результатебыло достигнуто достоверное снижение риска общейсмерти больных ХСН на 9 %, р=0,041 (среди закончив-ших исследование на 14 %) и количества госпитализацийна 8 % (в основном связанных с ЖНРС) при длительной(более 18 месяцев) терапии. При этом количество побоч-ных эффектов в группе лечения Омакором не отличалосьот плацебо [365].
Ретроспективный анализ продемонстрировал сни-жение частоты срабатывания ИКД у пациентов, нахо-дившихся на лечении ω-3 ПНЖК, и снижение смерт-ности и госпитализаций в связи с нарушениями ритмасердца [366].
В дополнительном анализе было продемонстрирова-но повышение ФВ ЛЖ на 1,6 % при терапии 1 г / сут ω-3ПНЖК [367].
Позднее в ряде небольших исследований была обна-ружена дозозависимая (1 г / сут против 2 г / сут и 4 г / сут)способность ω-3 ПНЖК положительно влиять на уро-вень провоспалительных цитокинов, улучшать степеньэндотелий-зависимой функции сосудов и увеличивать ФВЛЖ [368]. Это позволяет предположить наличие анти-ремоделирующего эффекта ω-3 ПНЖК у больных ХСН,что вместе с антифибрилляторным действием можетположительно влиять на заболеваемость и смертностьпациентов с декомпенсацией. К примеру, в плацебо-кон-тролируемом исследовании с применением 2 г / сут ома-кора достигалось выраженное снижение числа повтор-ных госпитализаций из-за обострения ХСН [365].
Исходя из изложенных фактов и признавая, чтоне на все вопросы имеются адекватные ответы, а такжене очень выраженный эффект омакора, наступавшийчерез месяцы после начала лечения, показания к его при-менению при ХСН и особенно у пациентов, перенесшихОИМ, вошли во все рекомендации. В Европейских реко-мендациях 2012 года эксперты оценили класс рекомен-даций как IIB (может быть назначен) при уровне дока-занности В. Эксперты ОССН при разделившихся мне-ниях предпочли определить класс рекомендаций, как IIAпри уровне доказанности В. Аналогичная степень обо-снованности использования эфиров ω-3 ПНЖК приня-та в Американских рекомендациях 2013 года.
Таким образом, назначение ω-3 ПНЖК в дозе 1 г / сутдолжно быть рассмотрено у больных ХСН II–IV ФКс ФВ ЛЖ <35 % для снижения риска смерти (в том числевнезапной) и повторных госпитализаций в дополнениек основным средствам лечения ХСН.
Антикоагулянты в лечении больных ХСН
Низкомолекулярные гепариныпри наличии венозных тромбозови высоком риске их развития
Учитывая, что ХСН – это состояние, при которомвозрастает риск тромбоэмболий и инсультов, важ-ную роль в терапии этого синдрома играют антико-агулянты [369, 370]. Причем, по мнению ряда иссле-дователей, само наличие ХСН из-за стаза в полостяхсердца, наблюдаемого при дилатации ЛЖ, являетсяфактором, способствующим развитию как перифери-ческого венозного, так и внутрисердечного тромбо-за, как источника будущих тромбоэмболий [371–374].До 40 % больных с выраженной ХСН имеют призна-ки тромбоза глубоких вен, и у 5,5 % пациентов тром-боэмболии легочной артерии осложняют течениедекомпенсации, причем чем тяжелее ХСН и ниже ФВ,тем более вероятно появление тромбозов и эмболий[375]. Дополнительными факторами являются деги-дратационная терапия (чем обильнее диурез, тем хуже)и нахождение больного на постельном режиме (напри-мер, при декомпенсации) [376].
Доказано, что для предотвращения тромбозов и эмбо-лий у пациентов с ХСН, находящихся на постельномрежиме, эффективным может быть лечение низкомоле-кулярными гепаринами (эноксипарином) по 40 мг / сутв течение 2 недель [377, 378]. При этом риск тромбо-зов и эмболий снижается на 60 % в течение 4‑месяч-ного наблюдения. Аналогичные сведения имеютсяи для дальтепарина, хотя процент снижения осложненийзначительно ниже [379, 380]. Таким образом, при нали-чии венозного тромбоза, высоком риске его развитияи декомпенсации, требующей постельного режимав течение не менее 3 суток, больные ХСН с ФВ ЛЖ <35 %должны получать лечение низкомолекулярными гепари-нами в течение 2 недель (класс рекомендаций IIA, уро-вень доказанности А). Аналогичная степень обоснован-ности использования эфиров омега‑3 ПНЖК принятав Американских рекомендациях 2013 года.
Оральные антикоагулянтыдля предотвращения риска тромбоэмболий
Вопрос о применении оральных антикоагулянтов(ОАКГ) при ХСН можно разделить на две неравные по значимости темы в связи с характером основного ритма сердца. При синусовом ритме каких‑либо серьезных про-спективных исследований не проводилось, и все имею-щиеся сведения касаются только антагонистов витамина К (варфарина).
Таблица 24. Применение оральных антикоагулянтов при ХСН с синусовым ритмом
 При наличии доказанных тромбов в полостях сердца (около 20 % пациентов с ХСН и ФВ ЛЖ <40 %, из нихдо 40 % имели тромбы в полости левого предсердия) [381]показано применение варфарина, особенно при нали-чии постинфарктного кардиосклероза и аневризмы ЛЖ[382] (класс рекомендаций IIA, уровень доказанности С).
У больных ХСН со сниженной ФВ ЛЖ и синусовомритмом без признаков наличия тромбов в полости сердцаприменение варфарина не показано, так как при отсут-ствии влияния на заболеваемость и смертность можетвозрастать риск кровотечений (класс рекомендаций III,уровень доказанности В) (таблица 24).
Единственное исследование в этой области WARCEFне выявило преимуществ варфарина перед аспириномв снижении риска смерти больных ХСН с синусовым рит-мом [383]. Хотя применение варфарина и сопровожда-лось достоверным снижением риска инсультов на 48 %,это достигалось ценой достоверного прироста рискакровотечений. Однако дополнительный анализ выявилсущественные различия в эффективности варфаринав зависимости от возраста. Так, у больных ХСН с синусо-вым ритмом моложе 60 лет варфарин в сравнении с аспи-рином достоверно на 37 % снижал риск первичной точки(смерть или инсульт) и на 35 % риск смерти при недосто-верном росте риска кровотечений [383].
Исходя из этого варфарин может быть назначенбольным ХСН с синусовым ритмом, моложе 60 лет дажепри отсутствии внутрисердечного тромбоза (класс рекомендаций IIB, уровень доказанности С).
При ФП всем больным ХСН (постоянной, перси-стирующей или пароксизмальной при частоте пароксиз-мов более 1 раза в месяц) показано применение ОАКГ. Для определения риска развития тромбоэмболическихосложнений и показанности применения ОАКГ исполь-зуется шкала CHA2DS2VASc (рис. 5). Как видно, парал-лельно нарастанию числа баллов по шкале от 1 до 9(0 баллов при ХСН быть не может, т. к. само наличиеХСН является одним баллом риска) линейно нарастаетриск тромбоэмболических осложнений и необходимостьтерапии ОАКГ [384].
Для определения риска кровотечений применяетсяшкала HAS–BLED, которая также определяет 9 балловпотенциального риска, а при наличии 3 баллов и больше терапия ОАКГ потенциально опасна в плане разви-тия осложнений [382, 384]. Многие из ФР кровотече-ний являются модифицируемыми, что позволяет сни-жать риск кровотечений и увеличивать безопасностьтерапии. При наличии более одного балла по шкалеCHA2DS2VASc, меньше 3 баллов по шкале HAS–BLEDи большего или хотя бы равного числа баллов по шкалеCHA2DS2VASc, чем по шкале HAS–BLED, терапия ОАКГэффективна и достаточно безопасна.
В настоящее время могут быть использованы три типаОАКГ:A) классические антагонисты витамина K (варфарин),B) прямой ингибитор тромбина дабигатран,C) селективные блокаторы Ха ривароксабан и апиксабан.
Изучаются и другие представители этого класса.
Применение антагонистов витамина К (варфари-на) на протяжении 60 лет было наиболее эффективными единственным методом борьбы с тромбоэмболиямии инсультом. Применение варфарина при ФП снижаетриск тромбоэмболий на 64 % при 2 %-м риске развитиякровотечений, в то время как применение антиагрегантов (аспирина) уменьшает риск тромбоэмболий на 21 %при 1,2 % риске кровотечений, причем преимуществоварфарина над аспирином (36 %) больше, чем аспиринаи плацебо [385]. Поэтому в Европейских рекомендаци-ях по лечению ФП аспирин не рекомендуется для про-филактики тромбоэмболических осложнений. Варфарин не может быть адекватно заменен и комбинацией двухантитромботических препаратов (аспирин + клопидо-грел), поскольку эффективность лечения достоверноснижается, а по риску осложнений (кровотечений) ком-бинация аспирина с клопидогрелом не отличается от вар-фарина (степень доказанности А) [386]. В то же времядвойная антитромботическая терапия лучше, чем одинаспирин, предотвращает риск тромбоэмболий [387].Поэтому при невозможности лечения ОАКГ или отказабольных от приема этого класса лекарств единственнойальтернативой (правда, менее эффективной) являетсяназначение двойной антитромботической терапии (классрекомендаций IIA, степень доказанности В).
Рисунок 5. Шкалы CHA2DS2VASc и HAS–BLED, как гид к терапии ОАКГ больных ХСН и ФП
При наличии доказанных тромбов в полостях сердца (около 20 % пациентов с ХСН и ФВ ЛЖ <40 %, из нихдо 40 % имели тромбы в полости левого предсердия) [381]показано применение варфарина, особенно при нали-чии постинфарктного кардиосклероза и аневризмы ЛЖ[382] (класс рекомендаций IIA, уровень доказанности С).
У больных ХСН со сниженной ФВ ЛЖ и синусовомритмом без признаков наличия тромбов в полости сердцаприменение варфарина не показано, так как при отсут-ствии влияния на заболеваемость и смертность можетвозрастать риск кровотечений (класс рекомендаций III,уровень доказанности В) (таблица 24).
Единственное исследование в этой области WARCEFне выявило преимуществ варфарина перед аспириномв снижении риска смерти больных ХСН с синусовым рит-мом [383]. Хотя применение варфарина и сопровожда-лось достоверным снижением риска инсультов на 48 %,это достигалось ценой достоверного прироста рискакровотечений. Однако дополнительный анализ выявилсущественные различия в эффективности варфаринав зависимости от возраста. Так, у больных ХСН с синусо-вым ритмом моложе 60 лет варфарин в сравнении с аспи-рином достоверно на 37 % снижал риск первичной точки(смерть или инсульт) и на 35 % риск смерти при недосто-верном росте риска кровотечений [383].
Исходя из этого варфарин может быть назначенбольным ХСН с синусовым ритмом, моложе 60 лет дажепри отсутствии внутрисердечного тромбоза (класс рекомендаций IIB, уровень доказанности С).
При ФП всем больным ХСН (постоянной, перси-стирующей или пароксизмальной при частоте пароксиз-мов более 1 раза в месяц) показано применение ОАКГ. Для определения риска развития тромбоэмболическихосложнений и показанности применения ОАКГ исполь-зуется шкала CHA2DS2VASc (рис. 5). Как видно, парал-лельно нарастанию числа баллов по шкале от 1 до 9(0 баллов при ХСН быть не может, т. к. само наличиеХСН является одним баллом риска) линейно нарастаетриск тромбоэмболических осложнений и необходимостьтерапии ОАКГ [384].
Для определения риска кровотечений применяетсяшкала HAS–BLED, которая также определяет 9 балловпотенциального риска, а при наличии 3 баллов и больше терапия ОАКГ потенциально опасна в плане разви-тия осложнений [382, 384]. Многие из ФР кровотече-ний являются модифицируемыми, что позволяет сни-жать риск кровотечений и увеличивать безопасностьтерапии. При наличии более одного балла по шкалеCHA2DS2VASc, меньше 3 баллов по шкале HAS–BLEDи большего или хотя бы равного числа баллов по шкалеCHA2DS2VASc, чем по шкале HAS–BLED, терапия ОАКГэффективна и достаточно безопасна.
В настоящее время могут быть использованы три типаОАКГ:A) классические антагонисты витамина K (варфарин),B) прямой ингибитор тромбина дабигатран,C) селективные блокаторы Ха ривароксабан и апиксабан.
Изучаются и другие представители этого класса.
Применение антагонистов витамина К (варфари-на) на протяжении 60 лет было наиболее эффективными единственным методом борьбы с тромбоэмболиямии инсультом. Применение варфарина при ФП снижаетриск тромбоэмболий на 64 % при 2 %-м риске развитиякровотечений, в то время как применение антиагрегантов (аспирина) уменьшает риск тромбоэмболий на 21 %при 1,2 % риске кровотечений, причем преимуществоварфарина над аспирином (36 %) больше, чем аспиринаи плацебо [385]. Поэтому в Европейских рекомендаци-ях по лечению ФП аспирин не рекомендуется для про-филактики тромбоэмболических осложнений. Варфарин не может быть адекватно заменен и комбинацией двухантитромботических препаратов (аспирин + клопидо-грел), поскольку эффективность лечения достоверноснижается, а по риску осложнений (кровотечений) ком-бинация аспирина с клопидогрелом не отличается от вар-фарина (степень доказанности А) [386]. В то же времядвойная антитромботическая терапия лучше, чем одинаспирин, предотвращает риск тромбоэмболий [387].Поэтому при невозможности лечения ОАКГ или отказабольных от приема этого класса лекарств единственнойальтернативой (правда, менее эффективной) являетсяназначение двойной антитромботической терапии (классрекомендаций IIA, степень доказанности В).
Рисунок 5. Шкалы CHA2DS2VASc и HAS–BLED, как гид к терапии ОАКГ больных ХСН и ФП
 Эффективность и безопасность лечения варфари-ном зависит от достигнутой степени антикоагуляции,причем показатель международного нормализованного отношения (МНО) в ходе лечения должен быть больше 2,0 [388]. Для уменьшения риска геморрагическихосложнений антикоагулянты должны применятьсяпри тщательном контроле (раз в месяц) МНО. Известно,что риск тромбоэмболий и выживаемость больных ХСНи ФП напрямую зависят от длительности и правиль-ности (поддержание МНО в пределах 2,0–3,0) леченияантикоагулянтами [389–391]. При достижении времениконтроля МНО в пределах 2,0–3,0 более 75 % времении использовании домашнего контроля МНО (аппаратcoagucheck) можно вдвое снизить риск кровотечений[392]. При подборе дозы варфарина измерение МНОпроизводится один раз в 3–5 дней, после получения двухстабильных показателей в терапевтическом диапазоненаиболее безопасно измерять МНО ежемесячно (минимум 1 раз в три месяца).
Применение новых антикоагулянтов – дабигатрана(прадаксы) в дозе 110 мг 2 раза в сутки или 150 мг двараза в сутки, ривароксабана (ксарелто) 10 мг один разв сутки и апиксабана (эликвис) 5 мг два раза в суткине требует контроля МНО, что принято считать их главными преимуществами над варфарином. При этом новыеАКГ, по крайней мере, не уступают варфарину по эффек-тивности (снижение риска тромбоэмболий) и что оченьважно – достоверно снижают риск фатальных (внутриче-репных) кровотечений [393–396].
Прямых сравнений между дабигатраном, ривароксабаном и апиксабаном не проводилось, поэтому однознач-ных выводов об их сравнительной эффективности и безопасностисделать невозможно. Тем не менее:
A) дабигатран (в дозе 110 мг × 2 раза в сутки) и ривароксабан не уступают варфарину в способности снижать риск инсультов и тромбоэмболий. А дабигатран(в дозе 150 мг 2 раза в день) и апиксабан достовернопревосходят варфарин по эффективности;
B) применение дабигатрана (110 мг 2 раза в день)и апиксабана сопровождается и общим снижениемриска кровотечений, в отличие от ривароксабанаи высокой дозы дабигатрана (150 мг 2 раза в день);
C) риск смерти достоверно снижается лишь при применении апиксабана. Таким образом, апиксабан (эликвис) – единственный из новых АКГ превосходит варфарин и по эффективности, и по безопасности;
D) отмена дабигатрана и ривароксабана в исследованияхпроводилась чаще, чем варфарина, а апиксабан отменялся достоверно реже, чем варфарин;
E) при увеличении дозы дабигатрана до 150 мг два разав сутки риск тромбоэмболий снижается даже больше, чем при лечении варфарином, но возрастает рискжелудочно-кишечных кровотечений и ИМ;
F) в исследовании AVERROES апиксабан вдвое снижалриск тромбоэмболических осложнений в сравнениис аспирином, не уступая последнему по влияниюна риск кровотечений.
При всех положительных качествах новых ОАКГ следует выделить и проблемы:
A) отсутствие необходимости контроля МНО не означает отказа от контроля режима, других ФР;
B) короткий период полувыведения 12–24 час препаратов может быть выгоден, т. к. при необходимости,например, хирургического вмешательства отменунужно проводить не за 3–5 дней, как в случае с варфа-рином, а всего за сутки;
C) с другой стороны, лечение новыми ОАКГ требуетвысокой дисциплины: даже одна пропущенная дозаприводит к гиперкоагуляции и риску тромбоэмболий (что особенно опасно при отсутствии доступныхметодов контроля коагуляции), в то время как концентрация варфарина при одной пропущенной доземеняется незначительно и МНО показывает эффективность и безопасность терапии;
D) в случае кровотечения при терапии варфарином имеется хотя и не очень эффективный и медленно действу-ющий, но антидот (витамин К), а при примененииновых ОАКГ таковых нет. Более того, даже перелива-ние крови может оказаться не сразу эффективным, т. к.факторы свертывания (тромбин и Ха фактор) могутблокироваться и в переливаемой крови;
E) при ФП у больных ХСН с искусственными клапана-ми, вне зависимости от типа протеза, новые ОАКГприменяться не должны. Единственным препаратомвыбора в этих случаях остается варфарин (при этомконтроль МНО должен быть в пределах 2,5–3,5);
F) при ухудшении функции почек (снижении СКФ менее30 мл / мин) применение новых ОАКГ строго не реко-мендовано, а использование варфарина возможно;
G) апиксабан, выводящийся почками лишь на 27 %,может применяться у больных со СКФ <50 мл / мин,причем риск кровотечений в этом случае достоверноменьший, чем при лечении варфарином;
H) при применении дабигатрана может увеличивать-ся риск повторных ОИМ, и хотя абсолютный рискинфарктов невысок, назначение дабигатрана послеОИМ вызывает вопросы;
I) наконец, нельзя забывать, что стоимость лечения новы-ми ОАКГ многократно выше, чем оригинальным вар-фарином (варфарин – Никомед), что не позволяет реко-мендовать новые ОАКГ всем пациентам с ХСН, ФПи высоким риском тромбоэмболических осложнений.
Таблица 25. Применение оральных антикоагулянтов при ХСН с ФП
Эффективность и безопасность лечения варфари-ном зависит от достигнутой степени антикоагуляции,причем показатель международного нормализованного отношения (МНО) в ходе лечения должен быть больше 2,0 [388]. Для уменьшения риска геморрагическихосложнений антикоагулянты должны применятьсяпри тщательном контроле (раз в месяц) МНО. Известно,что риск тромбоэмболий и выживаемость больных ХСНи ФП напрямую зависят от длительности и правиль-ности (поддержание МНО в пределах 2,0–3,0) леченияантикоагулянтами [389–391]. При достижении времениконтроля МНО в пределах 2,0–3,0 более 75 % времении использовании домашнего контроля МНО (аппаратcoagucheck) можно вдвое снизить риск кровотечений[392]. При подборе дозы варфарина измерение МНОпроизводится один раз в 3–5 дней, после получения двухстабильных показателей в терапевтическом диапазоненаиболее безопасно измерять МНО ежемесячно (минимум 1 раз в три месяца).
Применение новых антикоагулянтов – дабигатрана(прадаксы) в дозе 110 мг 2 раза в сутки или 150 мг двараза в сутки, ривароксабана (ксарелто) 10 мг один разв сутки и апиксабана (эликвис) 5 мг два раза в суткине требует контроля МНО, что принято считать их главными преимуществами над варфарином. При этом новыеАКГ, по крайней мере, не уступают варфарину по эффек-тивности (снижение риска тромбоэмболий) и что оченьважно – достоверно снижают риск фатальных (внутриче-репных) кровотечений [393–396].
Прямых сравнений между дабигатраном, ривароксабаном и апиксабаном не проводилось, поэтому однознач-ных выводов об их сравнительной эффективности и безопасностисделать невозможно. Тем не менее:
A) дабигатран (в дозе 110 мг × 2 раза в сутки) и ривароксабан не уступают варфарину в способности снижать риск инсультов и тромбоэмболий. А дабигатран(в дозе 150 мг 2 раза в день) и апиксабан достовернопревосходят варфарин по эффективности;
B) применение дабигатрана (110 мг 2 раза в день)и апиксабана сопровождается и общим снижениемриска кровотечений, в отличие от ривароксабанаи высокой дозы дабигатрана (150 мг 2 раза в день);
C) риск смерти достоверно снижается лишь при применении апиксабана. Таким образом, апиксабан (эликвис) – единственный из новых АКГ превосходит варфарин и по эффективности, и по безопасности;
D) отмена дабигатрана и ривароксабана в исследованияхпроводилась чаще, чем варфарина, а апиксабан отменялся достоверно реже, чем варфарин;
E) при увеличении дозы дабигатрана до 150 мг два разав сутки риск тромбоэмболий снижается даже больше, чем при лечении варфарином, но возрастает рискжелудочно-кишечных кровотечений и ИМ;
F) в исследовании AVERROES апиксабан вдвое снижалриск тромбоэмболических осложнений в сравнениис аспирином, не уступая последнему по влияниюна риск кровотечений.
При всех положительных качествах новых ОАКГ следует выделить и проблемы:
A) отсутствие необходимости контроля МНО не означает отказа от контроля режима, других ФР;
B) короткий период полувыведения 12–24 час препаратов может быть выгоден, т. к. при необходимости,например, хирургического вмешательства отменунужно проводить не за 3–5 дней, как в случае с варфа-рином, а всего за сутки;
C) с другой стороны, лечение новыми ОАКГ требуетвысокой дисциплины: даже одна пропущенная дозаприводит к гиперкоагуляции и риску тромбоэмболий (что особенно опасно при отсутствии доступныхметодов контроля коагуляции), в то время как концентрация варфарина при одной пропущенной доземеняется незначительно и МНО показывает эффективность и безопасность терапии;
D) в случае кровотечения при терапии варфарином имеется хотя и не очень эффективный и медленно действу-ющий, но антидот (витамин К), а при примененииновых ОАКГ таковых нет. Более того, даже перелива-ние крови может оказаться не сразу эффективным, т. к.факторы свертывания (тромбин и Ха фактор) могутблокироваться и в переливаемой крови;
E) при ФП у больных ХСН с искусственными клапана-ми, вне зависимости от типа протеза, новые ОАКГприменяться не должны. Единственным препаратомвыбора в этих случаях остается варфарин (при этомконтроль МНО должен быть в пределах 2,5–3,5);
F) при ухудшении функции почек (снижении СКФ менее30 мл / мин) применение новых ОАКГ строго не реко-мендовано, а использование варфарина возможно;
G) апиксабан, выводящийся почками лишь на 27 %,может применяться у больных со СКФ <50 мл / мин,причем риск кровотечений в этом случае достоверноменьший, чем при лечении варфарином;
H) при применении дабигатрана может увеличивать-ся риск повторных ОИМ, и хотя абсолютный рискинфарктов невысок, назначение дабигатрана послеОИМ вызывает вопросы;
I) наконец, нельзя забывать, что стоимость лечения новы-ми ОАКГ многократно выше, чем оригинальным вар-фарином (варфарин – Никомед), что не позволяет реко-мендовать новые ОАКГ всем пациентам с ХСН, ФПи высоким риском тромбоэмболических осложнений.
Таблица 25. Применение оральных антикоагулянтов при ХСН с ФП
 Подробные показания к назначению ОАКГ в разныхклинических ситуациях представлены в таблицах 24 и 25. При фибрилляции предсердий наиболее вероятнообразование тромбов, являющихся источником тромбо-эмболических осложнений в гемодинамически неактив-ных участках, прежде всего в ушке левого предсердия.Исходя из этого на протяжении последних 20 лет обсуж-дается закрытие (сначала хирургическое, а сейчас транска-тетерное) ушка левого предсердия с целью профилактикитромбоэмболий и как альтернатива ОАКГ. Однако факти-ческих данных пока недостаточно для строгих выводов.В МРКИ PROTECT–AF использование наиболее попу-лярной системы в виде имплантируемого трансвенознос последующей пункцией межпредсердной перегородкираскрывающегося «зонтика», блокирующего ушко лево-го предсердия (Watchman), сравнивалось с ОАКГ. Былодоказано, что окклюзия ушка левого предсердия не усту-пала по эффективности ОАКГ, но приводила к большемучислу осложнений, в том числе кровотечений [397]. Болеетого, с накоплением опыта риск осложнений при транс-катетерном закрытии ушка левого предсердия снижал-ся и не отличался от группы ОАКГ [398]. Плюс к томузакрытие ушка левого предсердия не должно противопо-ставляться ОАКГ [399]. Хотя в настоящее время закры-тие ушка левого предсердия с целью профилактики тром-боэмболических осложнений у пациентов с ХСН и ФПимеет невысокий класс доказательств IIb и уровень дока-занности B, интерес к этому методу сохраняется, в томчисле с использованием новых устройств.
Коэнзим Q10
Интерес вызывают перспективы применения коэнзима Q10 в комплексном лечении ХСН. Убихинон (или коэн-зим Q10) может способствовать улучшению переносаэлектронов в митохондриальной дыхательной цепи, уве-личивать синтез АТФ в миокарде и одновременно облада-ет антиоксидантными свойствами, позволяющими нор-мализовать функцию эндотелия [400].
Низкая концентрация коэнзима Q10 в крови больныхХСН является предиктором плохого прогноза, при-чем по своей предсказующей значимости может дополнять такой общепринятый маркер, как МНУП [401].Исследования по применению убихинона в лечениибольных ХСН показали и клиническую эффективность,и способность увеличивать ФВ ЛЖ, и нормализоватьфункцию эндотелия. Мета-анализ 2013 года выявил, чтопри добавлении убихинона к оптимальной терапии при-рост ФВ ЛЖ составлял в среднем на 3,67 % [402].
Наконец, в 2013 году появились данные о возмож-ном влиянии коэнзима Q10 на прогноз больных ХСН.В Шведском проспективном исследовании, продолжавшемся более 4 лет, было продемонстрировано 55 %-е снижение риска смерти больных ХСН на фоне приема ком-бинации коэнзима Q10 и селена [403].
Еще больший резонанс вызвало окончание много-центрового плацебо-контролируемого исследованияпо применению коэнзима Q10 у больных ХСН III–IV ФК(Q-SYMBIO) [404].
В этом исследовании, включавшем 420 пациентов,находившихся на оптимальной терапии, длительное при-менение коэнзима Q10 вдвое снижало риск смерти пациентов с тяжелой ХСН (с 17 до 9 %, р=0,01) и комбинированной конечной точки смерть плюс госпитализации,связанные с обострением ХСН (с 25 до 14 %, р=0,003).Причем в обоих исследованиях переносимость коэнзимаQ10 не отличалась от плацебо.
Казалось бы, на результатах двух относительно небольших по объему исследований трудно делать окон-чательные выводы, но возможность улучшения прогнозабольных ХСН с помощью коэнзима Q10 явилась одной из наиболее обсуждаемых новостей 2013 года.
В РФ в настоящее время также проводится плацебо-контролируемое исследование по применению водо-растворимой формы коэнзима Q10 у больных ХСН(КУДЕСНИК).
Препараты, не влияющие на прогнозпри ХСН, но улучшающие симптоматикув определенных клинических ситуациях
Антиаритмические средства в лечении ХСНс желудочковыми нарушениями сердца (классрекомендаций IIB, уровень доказанности А)
Подавляющее число больных ХСН имеют опасныедля жизни желудочковые нарушения ритма сердца (IIIи выше градации по классификации Lown–Wolf) [405–407]. До ⅔ больных с начальными стадиями декомпенсациии до ⅓ пациентов даже с финальными стадиями ХСНумирают внезапно (скорее всего, из-за наличия аритмий)[279, 408, 409]. Причем улучшение гемодинамики неисключает возможность развития опасных аритмий, кото-рые могут потребовать специального лечения [410, 411].
Основные позиции при лечении желудочковых арит-мий у больных ХСН сводятся к следующему:
A) лечения при ХСН требуют лишь опасные для жиз-ни и симптомные желудочковые нарушения ритма сердца (класс IIA, уровень доказанности В) [1, 4, 6,8, 407, 412];
B) антиаритмики I класса (блокаторы натриевых кана-лов) и IV класса (БМКК) противопоказаны больным ХСН (класс III, уровень доказанности А) [413];
C) во всех случаях средством выбора в лечении больных ХСН и желудочковыми нарушениями сердечного ритма являются β-АБ, обладающие умеренным анти-аритмическим, но выраженным антифибрилляторным действием, что позволяет им достоверно снижать риск внезапной смерти [278, 279, 287, 414];
D) При неэффективности β-АБ для антиаритмического лечения применяются препараты III класса (из зарегистрированных в России – амиодарон и соталол) [4, 6].
Средством выбора для лечения симптомных и жизне-угрожающих нарушений ритма сердца у больных, пере-несших ОИМ и имеющих клинически выраженную ХСН,является амиодарон. Его использование не только устра-няет желудочковые нарушения ритма сердца, но можетвлиять и на риск внезапной смерти. Амиодарон досто-верно снижает риск внезапной смерти у декомпенсиро-ванных больных с желудочковыми аритмиями (на 28,4 %),риск сердечно-сосудистой смертности (на 18,2 %),в то время как риск общей смертности достоверноне меняется (класс IIA, уровень доказанности В) [415].Важно помнить, что сочетание β-АБ с амиодароном явля-ется рациональным и эффект амиодарона проявляетсямаксимально ярко именно при сочетании с β-АБ (классIIA, уровень доказанности В) [416]. Более эффективногосредства борьбы с желудочковыми аритмиями, чем амио-дарон, до настоящего времени нет.
Поддерживающая доза амиодарона не должна пре-вышать 100–200 мг / сут для минимизации риска экстракардиальных побочных эффектов (чаще всего, особеннов России – нарушение функции щитовидной железы).Разработан совместный алгоритм лечения амиодарономбольных с жизнеугрожающими аритмиями и проблема-ми со стороны щитовидной железы кардиологами и эндо-кринологами, позволяющий долгое время проводитьтерапию эффективно и с минимальным числом осложне-ний [417]. Использование амиодарона всегда подразуме-вает реальную оценку соотношения польза / риск.
Применение амиодарона у пациентов без симптомоваритмии с целью первичной профилактики внезапнойсмерти малоэффективно. У пациентов с умеренной ХСНего эффект не выражен, а при прогрессировании деком-пенсации до III–IV ФК амиодарон может даже увеличи-вать риск смерти [418]. Наиболее оправданным мето-дом профилактики внезапной смерти у больных ХСНс жизнеугрожающими аритмиями является постановкаимплантируемого кардиовертера–дефибриллятора.
Альтернативой амиодарону может быть соталол –антиаритмик III класса, имеющий дополнительные свой-ства β-АБ. По влиянию на желудочковые нарушения рит-ма сердца соталол лишь немного уступает амиодарону[419]. Соталол имеет существенно меньше внесердечныхпобочных реакций в сравнении с амиодароном, но чащевызывает проаритмии, особенно у больных с тяжелымпоражением миокарда [420]. Доза соталола титрует-ся подобно другим β-АБ, начиная с 20 мг 2 раза в сутки.Через 2 недели дозу увеличивают до 40 мг 2 раза в сутки,еще через две недели до 80 мг 2 раза в сутки и, наконец,еще через две недели до максимальной – 160 мг 2 разав сутки. С увеличением дозы препарата и тяжести ХСНувеличивается опасность проаритмических осложнений,поэтому у больных ХСН III–IV ФК нежелательно превы-шать суточную дозу 160 мг [420].
Отдельного внимания заслуживает проблема ФП,которая в качестве основного ритма или пароксизмоврегистрируется почти у 40 % пациентов с клинически выраженной ХСН [421]. Сведения о влиянии ФП на про-гноз больных ХСН противоречивы [422, 423]. ЛечениеФП у больных ХСН должно проводиться по принципам,изложенным в последних руководствах ЕОК по диагно-стике и лечению этого вида нарушения ритма [424, 425].
При ФП нет доказательств, что восстановление сер-дечного ритма превосходит терапевтическую тактику,предполагающую контроль ЧСС, особенно у больных ХСН (класс IIA, уровень доказанности В) [426–428].Поэтому целесообразность восстановления синусовогоритма (электрическая дефибрилляция или медикаментозное купирование) оставляется на усмотрение врача. Эффективность электрической дефибрилляции достигает 90 %, но в течение первого года синусовый ритмудерживается не более чем у 30 % больных, что требуетактивной поддерживающей терапии [429]. Из меди-каментозных средств поддержания синусового ритмасегодня в основном применяются антиаритмики III класса, из которых наиболее эффективным представляетсяамиодарон (69 % успешного удержания восстановленно-го синусового ритма), превосходящий по эффективно-сти соталол и антиаритмики I класса [430, 431]. Причемамиодарон может предупреждать возникновение новойФП, но не эффективен в конверсии ФП в синусовый ритм[432]. Кроме того, и по способности провоцироватьжизненноопасные желудочковые нарушения сердечногоритма при лечении больных ХСН с ФП амиодарон выгодно отличается от соталола [433] Антиаритмики I класса строго не рекомендованы у больных с дисфункцией ЛЖи при ХСН, несмотря на наличие ФП (класс III, степеньдоказанности А).
Единственным независимым предиктором лучшейвыживаемости больных ХСН с ФП является постоянныйприем антикоагулянтов при поддержании МНО в пределах от 2,0 до 3,0 (класс IIA, степень доказанности А) [391,426, 434, 435].
К факторам, способствующим вероятному повторно-му срыву ритма и рецидивированию ФП, относятся:A) пожилой возраст (более 65 лет),
B) давнее (более 6 месяцев) мерцание предсердий,
C) частые пароксизмы (рецидивы) ФП,
D) большие размеры левого предсердия (передне-задний размер более 4,2 см),
E) наличие тромбов в полостях сердца (в том числев ушке левого предсердия),
F) низкая ФВ ЛЖ (<35 %),G) выраженная гипертрофия ЛЖ.
В этих случаях восстановление синусового ритманецелесообразно.
Одним из основных принципов лечения больныхХСН и имеющейся (или угрожающей) ФП можносчитать применение не антиаритмических средств,а препаратов, блокирующих активность РААС (пре-жде всего иАПФ), β-АБ и статинов (upstream therapy).Считается, что, уменьшая степень ремоделированиясердца, подобная «неспецифическая» терапия спо-собна замедлять наступление ФП. Однако и в этомвопросе много неясного. Несмотря на обнадежива-ющие результаты мета-анализов [436, 437], проспек-тивные исследования не всегда заканчивались успешно.Например, АРА ни в одном из четырех проведенныхисследований не оказали влияния на риск ФП [438–441]. Однако лечение иАПФ и β-АБ необходимо про-водить всем больным ХСН независимо от характераосновного ритма.
Для контроля ЧСС при постоянной форме ФП наи-более эффективным может быть использование комби-нации сердечных гликозидов и β-АБ. В данном случаеиспользуются два аддитивных механизма. Дигоксинзамедляет атрио-вентрикулярную проводимость, умень-шает ЧСС покоя и «упорядочивает» ритм, устраняядефицит пульса и число гемодинамически неэффектив-ных сокращений [442, 443]. В то же время β-АБ за счетснижения симпатической стимуляции синусового узлапотенцируют брадикардитические эффекты дигоксинаи предотвращают появление тахикардии во время физи-ческих нагрузок [444, 445]. Данные последнего мета-ана-лиза показали, что применение одних β-АБ при систоли-ческой ХСН на фоне ФП не улучшает прогноза [349]. Этоне только свидетельство целесообразности их сочетанияс дигоксином, но и вопрос о том, с какого препарата сле-дует начинать лечение этой группы пациентов.
Комбинация дигоксина с β-АБ (в том числе и сотало-лом, способным удерживать синусовый ритм у 40 % боль-ных после кардиоверсии [430, 433]) позволяет эффек-тивно контролировать ЧСС у пациентов как с сохраняю-щейся ФП, так и с синусовым ритмом в межпри´ступныйпериод (класс IIA, степень доказанности В) [442–445].
Степень оптимального контроля ЧСС при ФПв отличие от синусового ритма не определена. В про-вокационном исследовании RACE-II было показа-но, что степень контроля ЧСС при ФП мало влияетна прогноз и достаточным можно считать ЧСС менее110 уд / мин [446]. Но, во-первых, это не были пациен-ты с ХСН, во-вторых, реально достигнутая ЧСС к кон-цу исследования в группе нестрогого контроля соста-вила 85 уд / мин и 76 уд / мин в группе строгого кон-троля, соответственно, и, в‑третьих, при высокой ЧССв покое резерв ее безопасного увеличения будет снижени сократит возможность выполнения физических нагру-зок без риска обострения декомпенсации. Поэтомупри ХСН и ФП все же наиболее оправдано снижениеЧСС хотя бы менее 85 уд / мин в покое.
При неэффективности медикаментозного контроляЧСС, на фоне отягощения течения ХСН может потре-боваться проведение радиочастотной аблации в надеж-де восстановить синусовый ритм, однако эта процедурадолжна проводиться, лишь когда исчерпаны все другиевозможности контроля ситуации.
Блокаторы медленных кальциевыхканалов при недостаточном контролеАД и легочной гипертензии (классрекомендаций IIB, уровень доказанности А)
Блокаторы медленных кальциевых каналов (БМКК),замедляющие ЧСС (верапамил и дилтиазем), не должныиспользоваться в лечении ХСН, т. к. ухудшают клиниче-ское течение ХСН II–IV ФК и повышают риск развитияотека легких. Использование этих БМКК (обязательнов сочетании с иАПФ, β-АБ, диуретиками, АМКР) можетрассматриваться при ХСН I ФК, преимущественновызванной диастолическими расстройствами (класс IIB,уровень доказанности С).
Из группы длительнодействующих дигидропириди-нов амлодипин (исследование PRAISE I и II) и фелоди-пин (исследование V–HeFT III) доказали способностьне ухудшать прогноз больных ХСН [447–450]. При этомв некоторых случаях применение этих препаратов можетулучшать клинику и уменьшать выраженность симптомовдекомпенсации. Возможными показаниями к исполь-зованию амлодипина или фелодипина в лечении ХСН(на фоне основных средств лечения) являются:
A) наличие упорной стенокардии,
B) наличие сопутствующей стойкой гипертонии,
C) высокая легочная гипертония, в том числе при сопут-ствующей ХОБЛ,
D) выраженная клапанная регургитация.
Применение дигидропиридиновых кальциевых антагонистов позволяет уменьшать степень клапанной регурги-тации (митральной и аортальной). Причем эффект дигидропиридинов сохраняется как при органической, таки относительной митральной недостаточности [170, 171].
К сожалению, применение дигидропиридинов у больных АГ может способствовать задержке жидкости и раз-витию симптомов ХСН [112, 202, 447]. Поэтому БМККс вазодилатирующими свойствами не применяютсядля профилактики ХСН.
Использование БМКК обязательно сочетается с лече-нием основными средствами терапии ХСН (иАПФ,АМКР, β-АБ, диуретики), что может нивелировать нега-тивные эффекты, связанные с гиперактивацией нейро-гормонов и задержкой жидкости.
Препараты железа при сопутствующейжелезодефицитной анемии (классрекомендаций IIA, уровень доказанности В)
При неосложненной ХСН наличие анемии не харак-терно, так как в ответ на недостаточно эффективноегемодинамическое обеспечение органов кровью и кислородом должен развиваться эритроцитоз и увеличиватьсяуровень гемоглобина. Однако в результате задержки жид-кости (гемодилюции), вторичного нарушения функциипочек, печени, снижению чувствительности костногомозга к ЭПО, около ⅓ пациентов с ХСН имеют уровеньгемоглобина менее 120 мг / л, что можно определить,как анемию [451]. Чем тяжелее ХСН, тем ниже среднийуровень гемоглобина, тем больший процент больныхимеет анемию [452]. Прогноз больных ХСН ухудшаетсяпараллельно снижению уровня гемоглобина, что позво-лило считать анемию одним из факторов не только ухуд-шения клинического состояния, но и увеличения рисказаболеваемости больных ХСН [453], причем вне зависи-мости от ФВ ЛЖ [454].
Учитывая эти факты, магистральным направлени-ем в лечении анемии у больных ХСН в последние годывиделось применение в комплексе эритропоэтина [455].Первые обнадеживающие результаты, продемонстри-ровавшие улучшение клинического состояния, умень-шение одышки, увеличение толерантности к нагрузкаму больных ХСН на фоне лечения эитропоэтином [456],стимулировали проведение крупномасштабного МРКИ,получившего название RED–HF. К сожалению, резуль-таты этого исследования не подтвердили первичнойгипотезы. Применение эритропоэтина (дарбепоэтина–альфа) не оказывало влияния ни на количество госпи-тализаций, ни на смертность больных ХСН с уровнемгемоглобина менее 120 мг / л [457]. При этом достовер-но в 3,5 раза увеличивался риск тромбозов и эмболийи в 1,7 раза – риск мозговых инсультов. Аналогичноеповышение риска сердечно-сосудистых осложненийотмечалось и при применении эритропоэтина у боль-ных ХБП и СД 2 типа [458].
Ранее подобные эффекты связывали с чрезмернымповышением уровня гемоглобина более 145 мг / л, пред-полагая, что его оптимальный уровень находится в пре-делах 120–140 мг / л [459]. Однако в исследовании RED–HF достигнутый уровень гемоглобина мониторировалсяи в среднем не превышал 130 мг / л, но тем не менее, рискосложнений возрастал [457].
Можно констатировать, что идея коррекции анемииу больных ХСН с помощью эритропоэтина не получиласвоего подтверждения. Эритропоэтин не должен при-меняться в лечении больных ХСН даже при сниженномуровне гемоглобина (класс рекомендаций III, уровеньдоказанности А).
С другой стороны, среди всех случаев анемии у паци-ентов с ХСН ¾ относятся к железодефицитным состо-яниям [460]. Об этом свидетельствует сочетание сни-женного гемоглобина (менее 120 мг / л) и уменьшениесодержания сывороточного железа (менее 10 мкмоль / лжелеза). Более точная оценка характера анемии можетбыть сделана на основании содержания ферритина(снижается ниже 100 нг / мл в случаях абсолютногодефицита железа) или насыщения трансферрина желе-зом (ниже 20 %). Низкий уровень насыщения транс-феррина железом при наличии сохранного уровняферритина может свидетельствовать об относительномдефиците железа.
В этих случаях логичным и эффективным должнобыть использование препаратов железа. Хотя пероральные препараты железа кажутся удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасыванияи часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10–40 % пациен-тов), которые снижают приверженность к лечению.Внутривенное введение препаратов железа обоснова-но в тех случаях, когда необходимо быстро добитьсяэффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих ССЗ или находящих-ся на химиотерапии), при плохой переносимости пре-паратов для приема внутрь или их неэффективности(синдром мальабсорбции), то есть при всех проявле-ниях ХСН.
По крайней мере, два открытых и два контролируе-мых исследования с применением препарата венофер(сахарат железа) продемонстрировали уменьшениеявлений анемии и улучшением клинического состоянияу пациентов с ХСН [461–463]. Но наиболее крупноеМРКИ (FAIR–HF) с участием и российских центровиспользовало препарат ферринжект (феррокарбо-мальтозный комплекс железа) [464]. Это стабильныймононуклеарный комплекс железа, не вызывающийгиперчувствительности, что позволяет быстро (в тече-ние 15 минут) ввести высокую дозу железа (1000 мг),которое медленно высвобождается, что позволяет про-водить инъекции 1 раз в неделю [465]. При этом желе-зо оптимально распределяется в организме, включаяпечень, селезенку и костный мозг [466].
В исследовании FAIR–HF введение ферринжектав сравнении с контролем приводило к достоверномуулучшению клинического состояния уже после второйинъекции. Суммарно 50 % пациентов, получавших фер-ринжект, и лишь 27 % в контроле отметили значительноеулучшение клинического состояния и 47 % достигли I ФКХСН (против 30 % в контроле). Увеличение дистанции6-мин ходьбы составило 40 метров (против 10 метровв контроле), и СКФ увеличилась на 4 мл / мин, что сви-детельствует об улучшении функция почек. При этомриск заболеваемости и смертности был на 6,5 % меньшев группе лечения ферринжектом, что, вкупе с отсутстви-ем серьезных побочных реакций, позволяет рекомен-довать подобное лечение больным ХСН с железодефи-цитной анемией [464]. В настоящее время проводятсяеще два более длительных исследования по применениюферринжекта в лечении пациентов с ХСН и сопутству-ющей анемией.
Статины при ишемической этиологииХСН (класс рекомендаций IIB,уровень доказанности А)
До 2007 года вопрос об эффективности примене-ния статинов в лечении ХСН оставался открытым.Результаты ретроспективных анализов, когортныхисследований и протоколов по принципу «случай–контроль» демонстрировали, что статины могуткак снижать риск развития ХСН, так и улучшать про-гноз пациентов с уже развившейся декомпенсацией[467, 468]. Многочисленность и абсолютная одно-направленность имеющихся данных позволяли пред-полагать способность дополнительного улучшенияпрогноза больных ХСН ишемической этиологиипри назначении статинов.
Учитывая, что снижение уровня ЛПНП не являетсяединственным механизмом положительного действиястатинов у больных ХСН, большое значение придавалось плейотропным эффектам этого класса лекарств[469]. В этой связи обсуждался даже вопрос о возмож-ности применения этого класса лекарств в лечении ХСНне только ишемической этиологии [467, 468].
Однако завершение двух крупных многоцентровыхпроспективных исследований по применению статинову больных ХСН ишемической (CORONA) и различной,в том числе и неишемической этиологии (GISSI–HF),не оправдало возлагавшихся надежд [470, 471].
Ни в одном из исследований применение розуваста-тина в дозе 10 мг / сут (на фоне максимальной терапииХСН) не приводило к улучшению прогноза больныхХСН, несмотря на достоверное снижение атероген-ного ХС липопротеидов низкой плотности и уровняС-реактивного белка. Возможным объяснением неудачиможет быть то, что у больных ХСН IIБ – III стадии, осо-бенно при развитии кардиального цирроза печени, уро-вень ХС может снижаться, что является одним из преди-кторов неблагоприятного прогноза [472–474].
У больных ХСН ишемической этиологии (исследова-ние CORONA) применение розувастатина достоверноуменьшало риск госпитализаций, в том числе связанныхс обострением ХСН и, по данным ретроспективногоанализа, суммарную частоту инфарктов и инсультов.В группе больных со смешанной, в том числе и неише-мической (около половины больных) этиологией ХСН(исследование GISSI–HF), применение розувастатинане меняло не только показатели смертности, но и заболеваемости (число госпитализаций).
В обоих исследованиях была подтверждена высокая безопасность лечения розувастатином даже у декомпен-сированных больных при нарушениях функции печении почек. В исследовании CORONA отмена розувастати-на из-за нежелательных реакций происходила достовернореже, чем плацебо.
На основании полученных данных можно дать практи-ческие рекомендации по применению статинов у больныхс риском и с уже развившейся ХСН: статины являютсяэффективным средством профилактики появления ХСНу больных с наличием коронарной болезни сердца, дажеу пациентов с исходно низким уровнем ХС ЛПНП [475]; применение статинов при уже развившейся ХСН не сопро-вождается улучшением прогноза больных, вне зависимостиот этиологии; у больных с ишемической этиологией ХСНприменение розувастатина в дополнение к оптимальнойтерапии ХСН позволяет снижать число госпитализаций(в том числе из-за обострения ХСН) и уменьшать вероят-ность ОИМ и инсульта; переносимость розувастатинане отличается от плацебо даже у пациентов с выраженнойХСН; если статины были назначены больному с коронар-ной болезнью сердца, терапия может быть (и должна!) безопаснопродолжена при присоединении симптомов ХСН.
Для практического использования у пациентов с ише-мической этиологией ХСН сегодня рекомендуется при-менение розувастатина в дозе 10 мг / сут.
Ретроспективные анализы и мета-анализы небольшихисследований позволяют предположить, что препаратомвыбора у больных ХСН может оказаться аторвастатин(10 мг / сут), хотя и это требует подтверждения (класс IIB,уровень доказанности В) [476].
Кроме того, в первые три месяца лечения больных ХСНстатинами требуется регулярный контроль уровней печеноч-ных трансаминаз, а также креатинфосфокиназы. При повы-шении уровня АСТ и АЛТ более чем в три раза от исход-ных или КФК в 10 раз выше нормы, а также при появлениимышечных болей лечение статинами необходимо прервать.В остальном контроль безопасности терапии не отличаетсяот пациентов, не имеющих симптомов ХСН, как изложенов Рекомендациях РКО по лечению атеросклероза [141].
Антиагреганты (в частности, аспирин)в лечении ХСН (класс рекомендацийIIB, уровень доказанности В)
Вопрос о применении аспирина в лечении ХСН остается не до конца решенным. Проблема – в возможностиблокады синтеза простациклина даже при использо-вании самой малой дозы препарата – 75 мг [208, 477].Блокада фермента циклооксигеназы, определяющаямеханизм действия аспирина и других НПВП, чреватаодновременным ослаблением эффекта иАПФ, диурети-ков, альдактона и даже β-АБ с вазодилатирующими свой-ствами – карведилола (класс IIA, уровень доказанностиВ) [168, 207, 478, 479].
С этой точки зрения применение антиагрегантовс другим механизмом действия (клопидогрел), которые позволяют достигать антиагрегационного эффектабез блокады фермента циклооксигеназы, выглядит теоретически более обоснованным, хотя клинических подтверждений этому нет. Следовательно, аспирин и другие антиагрегантыдолжны применяться у больных ХСН лишь при строгихпоказаниях. Поэтому позиции по применению антиагре-гантов у пациентов с клинически выраженной ХСН сво-дятся к следующему:
A) убедительных данных о целесообразности примене-ния антиагрегантов для лечения ХСН нет (за исключением раннего периода (до 8 недель) после пере-несенного ОИМ). При назначении антиагрегантовнарастает риск геморрагических осложнений, вклю-чая желудочно-кишечные кровотечения и геморраги-ческие инсульты [480];
B) назначение аспирина достоверно увеличивает числогоспитализаций, связанных с обострением декомпен-сации (класс IIB, уровень доказанности В) [135, 136];
C) при необходимости использования аспирина тео-ретически более оправданным выглядит его соче-тание с АРА (а не с иАПФ), хотя контролируемыхклинических исследований, подтверждающих этоположение, нет;
D) иАПФ более обоснованно сочетать с дезагреганта-ми, имеющими другой механизм действия (клопидо-грел), хотя и это положение не подтверждено клини-ческими исследованиями;
E) двойная антитромботическая терапия при ХСНне показана (за исключением случаев ангиопластикис применением стентов с лекарственным покрытием)[391, 481];
F) большинство имеющихся на сегодня результатовретроспективных анализов МРКИ (при отсутствиипроспективных исследований) позволяют констати-ровать, что хотя некий негативный момент во взаимо-действии малых доз аспирина (75–100 мг!) и иАПФприсутствует, совместное использование этих препа-ратов у больных, перенесших ОИМ и имеющих ХСН,возможно [216, 221, 482, 483];
G) нужно избегать назначения НПВП (включая дозыаспирина >325 мг) больным ХСН, находящим-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти (вплоть до развития отека легких).
Цитопротекторы (триметазидинмедленного высводождения = триметазидинМВ) при лечении ХСН ишемическойэтиологии (класс рекомендаций IIA,уровень доказанности В)
Единственным препаратом этого класса, рекомен-дуемым для лечения стенокардии, является ингибиторфермента 3КАТ триметазидин, переводящий синтезвысокоэнергетических соединений в миокарде на болееэкономный аэробный путь [355, 484]. Это единствен-ный цитопротектор, клиническая эффективность кото-рого была исследована у больных со стенокардией в пол-ноценных МРКИ, причем как в виде монотерапии, таки при комбинированном лечении. Последние мета-ана-лизы продемонстрировали способность триметазидинаМВ достоверно уменьшать стенокардию и увеличиватьвремя нагрузки до появления изменения сегмента ST[485, 486]. Кроме того, длительное лечение триметази-дином МВ может положительно влиять на прогноз боль-ных, перенесших ОИМ, при котором высока вероят-ность появления ХСН [487].
Учитывая, что метаболический дисбаланс являетсяодним из важных механизмов развития и прогрессирова-ния ХСН (особенно ишемической этиологии), возмож-ность активации аэробного гликолиза при использованиитриметазидина МВ может рассматриваться, как реальныйспособ лечения декомпенсированных больных [488, 489].Сегодня в довольно большом числе плацебо-контроли-руемых исследований убедительно продемонстрирова-но, что длительное лечение триметазидином больныхХСН ишемической этиологии сопровождается не толькоулучшением клинического состояния больных и качестважизни, но и приростом ФВ ЛЖ (в пределах 7 %), а так-же уменьшением ремоделирования сердца [490–492].Высокая клиническая эффективность триметазидина МВпри ХСН потверждена и в Российских многоцентровыхпрограммах ПРИМА и ПРЕАМБУЛА [493].
Вопрос о влиянии триметазидина МВ на заболе-ваемость и смертность при ХСН требует дальнейшихисследований. Однако результаты последних мета-ана-лизов показывают cнижение риска госпитализацийиз-за обострения ХСН при применении триметазиди-на МВ в пределах 50 % [492, 494]. Эти предположенияподтвердились и в самом крупном когортном иссле-довании (669 больных) по применению триметазиди-на у больных ХСН ишемической этиологии. Лечениетриметазидином с большой достоверностьтю снижалориск смерти и обострения ХСН на 11,4 % и продлеваложизнь без осложнений на 7,8 месяца [495]. Имеющиесярезультаты диктуют необходимость проведения круп-ного проспективного МРКИ для окончательного опре-деления места триметазидина в лечении ХСН ишемиче-ской этиологии.
Данные по лечению триметазидином больных ХСНнеишемической этиологии слишком малочисленныдля сколько-нибудь серьезных выводов.
Таким образом, назначение триметазидина МВ долж-но быть рассмотрено у больных ХСН ишемическойэтиологии в дополнение к основным средствам лечениядекомпенсации для устранения симптомов, нормализа-ции гемодинамики (и роста ФВ ЛЖ) и возможного сни-жения риска смерти и повторных госпитализаций (классрекомендаций IIA, уровень доказанности В).
Более жесткой должна быть позиция по отношениюк препаратам с неясным механизмом действия и недока-занной клинической эффективностью, хотя многие из нихпозиционируются, как кардиопротекторы или метаболи-чески активные средства. Поэтому использование таури-на, карнитина, милдроната в лечении ХСН не показано(класс III, уровень доказанности С).
Периферические вазодилататоры (классрекомендаций IIB, уровень доказанности В)
В настоящее время ПВД не входят в число препаратовпервой линии, используемых для лечения ХСН. На прогноз, количество госпитализаций, прогрессированиеболезни они не влияют.
Исключение составляет применение комбинациинитратов (венозных вазодилататоров) с гидралазином(артериолярными вазодилататорами) у пациентов негроидной расы. У этого контингента пациентов подобнаякомбинация (в дополнение к иАПФ, β-АБ, диуретикам)может способствовать улучшению прогноза [496–498].У лиц белой расы всегда более предпочтительно исполь-зование иАПФ [221, 498]. Кроме того, применение ком-бинации нитратов с гидралазином стимулирует развитиепобочных реакций (гипотония, тахикардия), которыезатрудняют лечение больных ХСН [499].
Нитраты могут даже негативно влиять на прогнозбольных ХСН и затруднять применение иАПФ, т. е. сни-жать эффективность последних (класс IIB, уровень дока-занности С) [202].
Нитраты могут назначаться при ХСН лишь при нали-чии доказанной ИБС и стенокардии, которая проходитименно (только) от нитропрепаратов. Во всех остальныхслучаях нитраты при ХСН не показаны.
В качестве артериолярных ПВД можно применятьлишь дигидропиридины длительного действия (предпо-чтительно амлодипин), а не гидралазин.
Следует помнить, что сопутствующее лечение вазо-дилататорами лишь затрудняет использование абсолют-но необходимых в терапии декомпенсации препаратов –иАПФ, АРА и β-АБ из-за дополнительной способностик снижению АД. Кроме того, применение прямых ПВДсопровождается активацией нейрогормонов, что чреватопрогрессированием ХСН [202, 269].
Негликозидные инотропные средства в леченииХСН при симптомной гипотонии и остройдекомпенсации сердечной деятельности (классрекомендаций IIB, уровень доказанности В)
Применение негликозидных инотропных средств,несмотря на кратковременное улучшение гемодинамикии клинического состояния больных с обострением деком-пенсации, при долгосрочном наблюдении повышает рисксмерти больных ХСН. Более того, даже кратковременнаяинотропная поддержка в период обострения декомпенсации может негативно повлиять на отдаленный прогноз больных ХСН (класс IIA, уровень доказанности В). Поэтому сегодня эти препараты не рекомендованыдля лечения ХСН [500–503].
При критическом состоянии (при обострении ХСН)лучше всего использовать сенситизатор кальция лево-симендан (болюс 12 мкг / кг, затем внутривенно капель-но 0,1–0,21 мкг / кг / мин). Этот препарат максимальноулучшает показатели гемодинамики, не имеет негатив-ных взаимодействийс β-АБ (в отличие от добутамина)и рекомендован ЕОК для лечения обострения ХСН [261,504]. Впервые способность левосимендана улучшатьпрогноз больных после ОИМ была продемонстрирова-на в исследовании RUSSLAN, проводившемся в России[505]. Однако при длительном лечении левосимендан,как и другие негликозидные инотропные стимуляторы,не влияет на прогноз больных ХСН [502].
Внутривенное введение добутамина (внутривенноекапельное введение со скоростью 2,5–10 мкг / кг / мин)должно проводиться лишь при симптомной гипотониипо витальным показаниям, учитывая его негативное вли-яние на прогноз.
Средства, не рекомендованныек применению при ХСН cо сниженнойФВ ЛЖ (класс рекомендаций III)
Применение этих препаратов должно быть, по воз-можности, исключено при лечении декомпенсации.К ним относятся:
A) НПВП (селективные и неселективные, включаядозы аспирина >325 мг). Особенно неблагоприят-но их использование у больных ХСН, находящих-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти, вплоть до развития отека легких;
B) Глюкокортикоиды. Применение стероидных гор-монов имеет чисто симптоматические показанияв случаях упорной гипотонии и тяжелого отечно-го синдрома для облегчения начала лечения иАПФ,диуретиками и β-АБ. С другой стороны, возмож-ность опасных для жизни осложнений ограничиваетиспользование этих препаратов;
C) Трициклические антидепрессанты;
D) Антиаритмики I класса;
E) Некоторые БМКК (верапамил, дилтиазем, коротко-действующие дигидропиридины).
Медикаментозная терапия больных ХСНс сохраненной систолической функцией ЛЖ(ФВ ЛЖ >50 %) или диастолической ХСН
Нижеприведенные рекомендации носят, скорее, предположительный характер ввиду ограниченности имеющихся данных по вопросу лечения больных ХСН–ССФили ДСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследованийу этой категории больных.
В настоящее время отсутствуют убедительныедоказательства улучшения выживаемости при исполь-зовании какого‑либо специфического медикамен-тозного лечения у пациентов с ХСН–ССФ или ДСН.Тем не менее эффективность применения некоторыхпрепаратов была показана в отдельных исследованияхи продолжает изучаться.
Наиболее агрессивным апологетам доказательноймедицины следует напомнить, что отсутствие дока-зательств возможности улучшения прогноза больныхне может обосновывать бездействие и оставление паци-ентов без надежды хотя бы на клиническое улучшениесостояния.
Кроме того, первым и обязательным условием являет-ся выявление и коррекция всех факторов и заболеваний,способствующих развитию диастолических расстройств,появлению и прогрессированию ХСН–ССФ. К нимчаще всего относятся АГ и ГЛЖ, ИБС, констриктивныепоражения миокарда / перикарда, СД, ожирение и т. д.Поэтому контроль АД, успешное лечение ИБС, кор-рекция уровня глюкозы, нормализация массы тела, уме-ренные физические нагрузки могут быть важным под-спорьем в успешном ведении этой сложной для лечениягруппы больных.
Как известно, что блокаторы РААС (иАПФ, АРА)и β-АБ относятся к основным средствам лечения пода-вляющего числа заболеваний, приводящих к ХСН–ССФ,поэтому их наличие в числе препаратов, рекомендованных больным ДСН, не вызывает сомнений. Гораздо труд-нее обосновать бездействие и отсутствие попыток лече-ния больных ХСН–ССФ, несмотря на ограниченностьклинических исследований.
Для возможного улучшения диастолического наполне-ния ЛЖ показан контроль ЧСС.
Следует принять адекватное решение и выбрать соот-ветствующие меры по вопросу профилактики, восстановления и поддержания синусового ритма у больныхс мерцательной тахиаритмией согласно принятым реко-мендациям [30, 506]. При сохранении постоянной фор-мы мерцания предсердий необходимо добиться нормали-зации частоты желудочковых сокращений.
Ингибиторы АПФ
Ингибиторы АПФ способны напрямую улучшатьрелаксацию и растяжимость миокарда, а также оказыватьопосредованное действие на диастолические свойстваЛЖ за счет своего гипотензивного эффекта и способ-ности уменьшать выраженность гипертрофии и фибро-за миокарда. В ранних исследованиях было показано,что терапия иАПФ пациентов с СН–ССФ достовернопродлевает время до вынужденной госпитализациииз‑за развития декомпенсации, хотя и не снижает смерт-ность [507]. Достоверное улучшение суррогатных конеч-ных точек (функционального статуса, толерантностик нагрузке, качества жизни) у больных ХСН с относитель-но сохраненной сократимостью (ФВ >45 %) было показа-но в проспективном российском исследовании ФАСОН[508]. Единственное завершившееся к настоящему вре-мени плацебо-контролируемое исследование по оценкевлияния иАПФ на выживаемость пожилых больных ДСН(>70 лет) – (PEP–CHF), выполненное с периндоприлом,не показало достоверного снижения общей или сердеч-но-сосудистой смертности на фоне лечения иАПФ [509].Тем не менее через 1 год после начала исследования тера-пия иАПФ ассоциировалась с достоверным снижениемриска внеплановой госпитализации из-за декомпенсации(OP 0,63; ДИ 0,40–0,97; p=0,033). Клинически у пациен-тов, находившихся на лечении периндоприлом, отмечал-ся достоверно меньший ФК ХСН и достоверно бóльшимбыл прирост дистанции теста 6‑мин ходьбы [509]. Болеетого, ретроспективный анализ показал, что в подгруппемоложе 75 лет эффект периндоприла был более отчетли-вым и сопровождался снижением риска смерти и количе-ства госпитализаций из-за обострения ХСН.
Мета-анализ всех исследований по применениюиАПФ в лечении больных с ХСН–ССФ продемонстри-ровал снижение риска смерти без достоверного влиянияна риск госпитализаций, в том числе связанных и с обо-стрением ХСН [510].
Таким образом, иАПФ пока не доказали своей способ-ности улучшать прогноз пациентов с ХСН–ССФ и ДСН,однако их применение у таких больных абсолютнооправдано, по крайней мере, в связи с улучшением функ-ционального статуса пациентов и уменьшением рискавынужденных госпитализаций (класс рекомендаций IIA,уровень доказательности В).
Антагонисты рецепторов к АII
По степени положительного влияния на ГЛЖ и выра-женность фиброза АРА не уступают иАПФ, а по способности устранять диастолические расстройства могут даже превосходить иАПФ [511, 512].
Эффективность АРА по влиянию на заболеваемость и смертность при лечении пациентов с ХСН и сохранной систолической функцией ЛЖ выглядит умеренной.При применении кандесартана в группе больных ХСНс ФВ ЛЖ <40 % число госпитализаций из-за обостренияХСН достоверно снижалось, хотя улучшения прогно-за не наблюдается [259]. Еще более разочаровывающиерезультаты были получены при попытке лечения ХСНс сохранной систолической функцией сердца в исследовании I-PRESERVE с ирбесартаном. Препарат не влиялни на смертность, ни на число госпитализаций, ни на про-грессирование ХСН [126].
Таким образом, АРА пока также не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН.Тем не менее, как показали итоги исследования CHARM–preserved, применение АРА кандесартана при диасто-лических расстройствах позволяет, по меньшей мере,снизить частоту госпитализаций, и его использованиев таких ситуациях обосновано, особенно при неперено-симости иАПФ (класс рекомендаций IIB, уровень дока-зательности В).
Блокаторы β-адренергических рецепторов
β-АБ могут быть назначены больным ХСН–ССФс целью уменьшения ЧСС (увеличения периода диа-столического наполнения ЛЖ) и выраженности ГЛЖ(уменьшения жесткости камеры ЛЖ). ИсследованиеSWEDIC [513] показало, что α-, β-адреноблокаторкарве-дилол, помимо снижения ЧСС, оказывает положительноевлияние на допплер–ЭхоКГ показатели релаксации ЛЖу больных ДСН. Специальных работ по изучению влия-ния β-АБ на выживаемость больных СН–ССФ или ДСНне проводилось. Однако в исследовании SENIORS с неби-вололом, в которое было включено более 700 пожилыхбольных с незначительно сниженной сократимостью (ФВЛЖ >35 %), терапия этим β-АБ ассоциировалась со сни-жением комбинированного показателя общей смертно-сти или госпитализации по сердечно-сосудистым причи-нам (класс IIB, уровень доказательности С) [514].11.2.4. Блокаторы медленныхкальциевых каналов (БМКК)
С той же целью, что и β-АБ, может быть использованБМКК верапамил. Однако, как показало исследованиеDAVIT II, у больных в раннем постинфарктном перио-де назначение верапамила при наличии СН в анамнеземалоэффективно [515]. Таким образом, назначение вера-памила больному ДСН для снижения ЧСС может бытьрекомендовано только в случае непереносимости β-АБи при отсутствии выраженной ХСН, проявляющейся,например, задержкой жидкости (класс IIB, уровень дока-зательности С).
Начаты исследования и по применению селективногоблокатора If -токов в клетках синусового узла ивабрадинас целью урежения ритма и возможного влияния на клини-ку, заболеваемость и прогноз больных ХСН–ССФ с сину-совым ритмом.
Диуретики
Диуретики могут быть необходимы в случае задержкижидкости в организме, но у пациентов с ДСН их следуетиспользовать с осторожностью, чтобы не вызвать чрез-мерного снижения преднагрузки на ЛЖ и падения сер-дечного выброса (класс IIB, уровень доказательности С).Среди других следует выделить торасемид, обладающийдлительным (до 18 часов) диуретическим эффектом,меньшим, чем у фуросемида, калийуретическим действи-ем [337], и что может быть особенно важно для больныхДСН – обладает собственным антифибротическим влия-нием на миокард [516].
Сравнительные исследования с фуросемидом показа-ли способность торасемида в большей степени улучшатьдиастолические свойства ЛЖ [517]. Однако проспектив-ных исследований по влиянию торасемида на заболевае-мость и смертность у больных ХСН с преобладающимидиастолическими расстройствами еще не проводилось.
Антагонисты МКР
Антагонисты МКР у больных с диастолическимирасстройствами должны рассматриваться не столькокак калийсберегающие диуретики, сколько как анти-фибротические препараты. До настоящего временине закончено ни одного плацебо-контролируемого иссле-дования по оценке влияния антагонистов альдостеро-на на выживаемость больных диастолической СН. Хотямногочисленные экспериментальные и клиническиеисследования продемонстрировали способность АМКР(в том числе в сочетании с иАПФ и АРА) к уменьшениюфиброза и улучшению диастолического наполнения ЛЖкак при сниженной, так и при сохранной ФВЛЖ. В насто-ящее время завершается первое МРКИ исследование,целью которого является изучение влияния спиронолак-тона (плюс к иАПФ или АРА) на выживаемость больныхс начальной и умеренной стадиями ХСН и ФВ ЛЖ >45 %(TOPCAT), результаты которого ожидаются в 2014 году.
Сердечные гликозиды
Ритмурежающее действие сердечных гликозидов (дигоксина) может быть полезно для пациентов с ФП, которая встречается примерно у 30 % больных с диастолической СН[16]. Однако результаты исследования DIG [518] показали,что даже независимо от характера основного ритма применение дигоксина ассоциируется с более чем 30 %-м сниже-нием госпитализаций из-за декомпенсации ХСН у больныхкак со сниженной (<45 %), так и с относительно сохранной(>45 %) ФВ ЛЖ. Более того, субанализ этого исследования ме крови (<0,9 нг / мл) отмечается достоверное снижениериска смерти и госпитализаций по любым причинам, в т. ч.и у больных с сохраненной систолической функцией [519].Положительный эффект дигоксина может быть связанс увеличением сократимости спиральных волокон миокар-да, определяющих активную позднюю фазу опорожненияЛЖ («скручивание») и активную же раннюю фазу диа-столического наполнения («раскручивание» и присасыва-ющий эффект) в большей степени, чем со снижением ЧСС(особенно при синусовом ритме). Подобный эффект былпоказан почти 40 лет назад при изучении гемодинамическихэффектов сердечных гликозидов с помощью динамическойэхокардиографии в реальном масштабе времени [520].
Доза дигоксина не должна превышать 0,25 мг, а кон-центрация в плазме – 1,1 нг / мл. При необходимостиснижения ЧСС у больных ХСН–ССФ с синусовымритмом следует отдать предпочтение комбинации β-АБс дигоксином.
Мета-анализ всех 30 основных проспективных иссле-дований и когортных наблюдений, включивший анализтерапии более 53 тысяч пациентов с ХСН–ССФ, проде-монстрировал, что проводимое лечение (не только иАПФ,АРА, β-АБ и дигоксином, но и БМКК, и вазодилататора-ми) улучшает клиническое состояние и переносимосьфизических нагрузок, но не влияет на прогноз [521]. Этоеще раз подчеркивает сложность эффективного лечениярассматриваемой группы больных и должно стимулиро-вать поиск новых подходов к терапии ХСН–ССФ.
Лечение острой декомпенсации ХСН
Лечение зависит от преобладающих клиническихсимптомов.
Оксигенотерапия
Оксигенотерапия должна проводиться всем пациентам с ОДСН до достижения сатурации кислорода ≥95или ≥90 % у пациентов с ХОБЛ (класс рекомендаций I,уровень доказанности С).
Диуретики
Диуретики показаны при наличии отечного синдрома(класс рекомендаций I, уровень доказанности В).
Назначая диуретики при ОДСН, следует руководство-ваться данными, представленными в таблице 26.
Таблица 26. Рекомендации для назначения диуретиков при ОДСН
Подробные показания к назначению ОАКГ в разныхклинических ситуациях представлены в таблицах 24 и 25. При фибрилляции предсердий наиболее вероятнообразование тромбов, являющихся источником тромбо-эмболических осложнений в гемодинамически неактив-ных участках, прежде всего в ушке левого предсердия.Исходя из этого на протяжении последних 20 лет обсуж-дается закрытие (сначала хирургическое, а сейчас транска-тетерное) ушка левого предсердия с целью профилактикитромбоэмболий и как альтернатива ОАКГ. Однако факти-ческих данных пока недостаточно для строгих выводов.В МРКИ PROTECT–AF использование наиболее попу-лярной системы в виде имплантируемого трансвенознос последующей пункцией межпредсердной перегородкираскрывающегося «зонтика», блокирующего ушко лево-го предсердия (Watchman), сравнивалось с ОАКГ. Былодоказано, что окклюзия ушка левого предсердия не усту-пала по эффективности ОАКГ, но приводила к большемучислу осложнений, в том числе кровотечений [397]. Болеетого, с накоплением опыта риск осложнений при транс-катетерном закрытии ушка левого предсердия снижал-ся и не отличался от группы ОАКГ [398]. Плюс к томузакрытие ушка левого предсердия не должно противопо-ставляться ОАКГ [399]. Хотя в настоящее время закры-тие ушка левого предсердия с целью профилактики тром-боэмболических осложнений у пациентов с ХСН и ФПимеет невысокий класс доказательств IIb и уровень дока-занности B, интерес к этому методу сохраняется, в томчисле с использованием новых устройств.
Коэнзим Q10
Интерес вызывают перспективы применения коэнзима Q10 в комплексном лечении ХСН. Убихинон (или коэн-зим Q10) может способствовать улучшению переносаэлектронов в митохондриальной дыхательной цепи, уве-личивать синтез АТФ в миокарде и одновременно облада-ет антиоксидантными свойствами, позволяющими нор-мализовать функцию эндотелия [400].
Низкая концентрация коэнзима Q10 в крови больныхХСН является предиктором плохого прогноза, при-чем по своей предсказующей значимости может дополнять такой общепринятый маркер, как МНУП [401].Исследования по применению убихинона в лечениибольных ХСН показали и клиническую эффективность,и способность увеличивать ФВ ЛЖ, и нормализоватьфункцию эндотелия. Мета-анализ 2013 года выявил, чтопри добавлении убихинона к оптимальной терапии при-рост ФВ ЛЖ составлял в среднем на 3,67 % [402].
Наконец, в 2013 году появились данные о возмож-ном влиянии коэнзима Q10 на прогноз больных ХСН.В Шведском проспективном исследовании, продолжавшемся более 4 лет, было продемонстрировано 55 %-е снижение риска смерти больных ХСН на фоне приема ком-бинации коэнзима Q10 и селена [403].
Еще больший резонанс вызвало окончание много-центрового плацебо-контролируемого исследованияпо применению коэнзима Q10 у больных ХСН III–IV ФК(Q-SYMBIO) [404].
В этом исследовании, включавшем 420 пациентов,находившихся на оптимальной терапии, длительное при-менение коэнзима Q10 вдвое снижало риск смерти пациентов с тяжелой ХСН (с 17 до 9 %, р=0,01) и комбинированной конечной точки смерть плюс госпитализации,связанные с обострением ХСН (с 25 до 14 %, р=0,003).Причем в обоих исследованиях переносимость коэнзимаQ10 не отличалась от плацебо.
Казалось бы, на результатах двух относительно небольших по объему исследований трудно делать окон-чательные выводы, но возможность улучшения прогнозабольных ХСН с помощью коэнзима Q10 явилась одной из наиболее обсуждаемых новостей 2013 года.
В РФ в настоящее время также проводится плацебо-контролируемое исследование по применению водо-растворимой формы коэнзима Q10 у больных ХСН(КУДЕСНИК).
Препараты, не влияющие на прогнозпри ХСН, но улучшающие симптоматикув определенных клинических ситуациях
Антиаритмические средства в лечении ХСНс желудочковыми нарушениями сердца (классрекомендаций IIB, уровень доказанности А)
Подавляющее число больных ХСН имеют опасныедля жизни желудочковые нарушения ритма сердца (IIIи выше градации по классификации Lown–Wolf) [405–407]. До ⅔ больных с начальными стадиями декомпенсациии до ⅓ пациентов даже с финальными стадиями ХСНумирают внезапно (скорее всего, из-за наличия аритмий)[279, 408, 409]. Причем улучшение гемодинамики неисключает возможность развития опасных аритмий, кото-рые могут потребовать специального лечения [410, 411].
Основные позиции при лечении желудочковых арит-мий у больных ХСН сводятся к следующему:
A) лечения при ХСН требуют лишь опасные для жиз-ни и симптомные желудочковые нарушения ритма сердца (класс IIA, уровень доказанности В) [1, 4, 6,8, 407, 412];
B) антиаритмики I класса (блокаторы натриевых кана-лов) и IV класса (БМКК) противопоказаны больным ХСН (класс III, уровень доказанности А) [413];
C) во всех случаях средством выбора в лечении больных ХСН и желудочковыми нарушениями сердечного ритма являются β-АБ, обладающие умеренным анти-аритмическим, но выраженным антифибрилляторным действием, что позволяет им достоверно снижать риск внезапной смерти [278, 279, 287, 414];
D) При неэффективности β-АБ для антиаритмического лечения применяются препараты III класса (из зарегистрированных в России – амиодарон и соталол) [4, 6].
Средством выбора для лечения симптомных и жизне-угрожающих нарушений ритма сердца у больных, пере-несших ОИМ и имеющих клинически выраженную ХСН,является амиодарон. Его использование не только устра-няет желудочковые нарушения ритма сердца, но можетвлиять и на риск внезапной смерти. Амиодарон досто-верно снижает риск внезапной смерти у декомпенсиро-ванных больных с желудочковыми аритмиями (на 28,4 %),риск сердечно-сосудистой смертности (на 18,2 %),в то время как риск общей смертности достоверноне меняется (класс IIA, уровень доказанности В) [415].Важно помнить, что сочетание β-АБ с амиодароном явля-ется рациональным и эффект амиодарона проявляетсямаксимально ярко именно при сочетании с β-АБ (классIIA, уровень доказанности В) [416]. Более эффективногосредства борьбы с желудочковыми аритмиями, чем амио-дарон, до настоящего времени нет.
Поддерживающая доза амиодарона не должна пре-вышать 100–200 мг / сут для минимизации риска экстракардиальных побочных эффектов (чаще всего, особеннов России – нарушение функции щитовидной железы).Разработан совместный алгоритм лечения амиодарономбольных с жизнеугрожающими аритмиями и проблема-ми со стороны щитовидной железы кардиологами и эндо-кринологами, позволяющий долгое время проводитьтерапию эффективно и с минимальным числом осложне-ний [417]. Использование амиодарона всегда подразуме-вает реальную оценку соотношения польза / риск.
Применение амиодарона у пациентов без симптомоваритмии с целью первичной профилактики внезапнойсмерти малоэффективно. У пациентов с умеренной ХСНего эффект не выражен, а при прогрессировании деком-пенсации до III–IV ФК амиодарон может даже увеличи-вать риск смерти [418]. Наиболее оправданным мето-дом профилактики внезапной смерти у больных ХСНс жизнеугрожающими аритмиями является постановкаимплантируемого кардиовертера–дефибриллятора.
Альтернативой амиодарону может быть соталол –антиаритмик III класса, имеющий дополнительные свой-ства β-АБ. По влиянию на желудочковые нарушения рит-ма сердца соталол лишь немного уступает амиодарону[419]. Соталол имеет существенно меньше внесердечныхпобочных реакций в сравнении с амиодароном, но чащевызывает проаритмии, особенно у больных с тяжелымпоражением миокарда [420]. Доза соталола титрует-ся подобно другим β-АБ, начиная с 20 мг 2 раза в сутки.Через 2 недели дозу увеличивают до 40 мг 2 раза в сутки,еще через две недели до 80 мг 2 раза в сутки и, наконец,еще через две недели до максимальной – 160 мг 2 разав сутки. С увеличением дозы препарата и тяжести ХСНувеличивается опасность проаритмических осложнений,поэтому у больных ХСН III–IV ФК нежелательно превы-шать суточную дозу 160 мг [420].
Отдельного внимания заслуживает проблема ФП,которая в качестве основного ритма или пароксизмоврегистрируется почти у 40 % пациентов с клинически выраженной ХСН [421]. Сведения о влиянии ФП на про-гноз больных ХСН противоречивы [422, 423]. ЛечениеФП у больных ХСН должно проводиться по принципам,изложенным в последних руководствах ЕОК по диагно-стике и лечению этого вида нарушения ритма [424, 425].
При ФП нет доказательств, что восстановление сер-дечного ритма превосходит терапевтическую тактику,предполагающую контроль ЧСС, особенно у больных ХСН (класс IIA, уровень доказанности В) [426–428].Поэтому целесообразность восстановления синусовогоритма (электрическая дефибрилляция или медикаментозное купирование) оставляется на усмотрение врача. Эффективность электрической дефибрилляции достигает 90 %, но в течение первого года синусовый ритмудерживается не более чем у 30 % больных, что требуетактивной поддерживающей терапии [429]. Из меди-каментозных средств поддержания синусового ритмасегодня в основном применяются антиаритмики III класса, из которых наиболее эффективным представляетсяамиодарон (69 % успешного удержания восстановленно-го синусового ритма), превосходящий по эффективно-сти соталол и антиаритмики I класса [430, 431]. Причемамиодарон может предупреждать возникновение новойФП, но не эффективен в конверсии ФП в синусовый ритм[432]. Кроме того, и по способности провоцироватьжизненноопасные желудочковые нарушения сердечногоритма при лечении больных ХСН с ФП амиодарон выгодно отличается от соталола [433] Антиаритмики I класса строго не рекомендованы у больных с дисфункцией ЛЖи при ХСН, несмотря на наличие ФП (класс III, степеньдоказанности А).
Единственным независимым предиктором лучшейвыживаемости больных ХСН с ФП является постоянныйприем антикоагулянтов при поддержании МНО в пределах от 2,0 до 3,0 (класс IIA, степень доказанности А) [391,426, 434, 435].
К факторам, способствующим вероятному повторно-му срыву ритма и рецидивированию ФП, относятся:A) пожилой возраст (более 65 лет),
B) давнее (более 6 месяцев) мерцание предсердий,
C) частые пароксизмы (рецидивы) ФП,
D) большие размеры левого предсердия (передне-задний размер более 4,2 см),
E) наличие тромбов в полостях сердца (в том числев ушке левого предсердия),
F) низкая ФВ ЛЖ (<35 %),G) выраженная гипертрофия ЛЖ.
В этих случаях восстановление синусового ритманецелесообразно.
Одним из основных принципов лечения больныхХСН и имеющейся (или угрожающей) ФП можносчитать применение не антиаритмических средств,а препаратов, блокирующих активность РААС (пре-жде всего иАПФ), β-АБ и статинов (upstream therapy).Считается, что, уменьшая степень ремоделированиясердца, подобная «неспецифическая» терапия спо-собна замедлять наступление ФП. Однако и в этомвопросе много неясного. Несмотря на обнадежива-ющие результаты мета-анализов [436, 437], проспек-тивные исследования не всегда заканчивались успешно.Например, АРА ни в одном из четырех проведенныхисследований не оказали влияния на риск ФП [438–441]. Однако лечение иАПФ и β-АБ необходимо про-водить всем больным ХСН независимо от характераосновного ритма.
Для контроля ЧСС при постоянной форме ФП наи-более эффективным может быть использование комби-нации сердечных гликозидов и β-АБ. В данном случаеиспользуются два аддитивных механизма. Дигоксинзамедляет атрио-вентрикулярную проводимость, умень-шает ЧСС покоя и «упорядочивает» ритм, устраняядефицит пульса и число гемодинамически неэффектив-ных сокращений [442, 443]. В то же время β-АБ за счетснижения симпатической стимуляции синусового узлапотенцируют брадикардитические эффекты дигоксинаи предотвращают появление тахикардии во время физи-ческих нагрузок [444, 445]. Данные последнего мета-ана-лиза показали, что применение одних β-АБ при систоли-ческой ХСН на фоне ФП не улучшает прогноза [349]. Этоне только свидетельство целесообразности их сочетанияс дигоксином, но и вопрос о том, с какого препарата сле-дует начинать лечение этой группы пациентов.
Комбинация дигоксина с β-АБ (в том числе и сотало-лом, способным удерживать синусовый ритм у 40 % боль-ных после кардиоверсии [430, 433]) позволяет эффек-тивно контролировать ЧСС у пациентов как с сохраняю-щейся ФП, так и с синусовым ритмом в межпри´ступныйпериод (класс IIA, степень доказанности В) [442–445].
Степень оптимального контроля ЧСС при ФПв отличие от синусового ритма не определена. В про-вокационном исследовании RACE-II было показа-но, что степень контроля ЧСС при ФП мало влияетна прогноз и достаточным можно считать ЧСС менее110 уд / мин [446]. Но, во-первых, это не были пациен-ты с ХСН, во-вторых, реально достигнутая ЧСС к кон-цу исследования в группе нестрогого контроля соста-вила 85 уд / мин и 76 уд / мин в группе строгого кон-троля, соответственно, и, в‑третьих, при высокой ЧССв покое резерв ее безопасного увеличения будет снижени сократит возможность выполнения физических нагру-зок без риска обострения декомпенсации. Поэтомупри ХСН и ФП все же наиболее оправдано снижениеЧСС хотя бы менее 85 уд / мин в покое.
При неэффективности медикаментозного контроляЧСС, на фоне отягощения течения ХСН может потре-боваться проведение радиочастотной аблации в надеж-де восстановить синусовый ритм, однако эта процедурадолжна проводиться, лишь когда исчерпаны все другиевозможности контроля ситуации.
Блокаторы медленных кальциевыхканалов при недостаточном контролеАД и легочной гипертензии (классрекомендаций IIB, уровень доказанности А)
Блокаторы медленных кальциевых каналов (БМКК),замедляющие ЧСС (верапамил и дилтиазем), не должныиспользоваться в лечении ХСН, т. к. ухудшают клиниче-ское течение ХСН II–IV ФК и повышают риск развитияотека легких. Использование этих БМКК (обязательнов сочетании с иАПФ, β-АБ, диуретиками, АМКР) можетрассматриваться при ХСН I ФК, преимущественновызванной диастолическими расстройствами (класс IIB,уровень доказанности С).
Из группы длительнодействующих дигидропириди-нов амлодипин (исследование PRAISE I и II) и фелоди-пин (исследование V–HeFT III) доказали способностьне ухудшать прогноз больных ХСН [447–450]. При этомв некоторых случаях применение этих препаратов можетулучшать клинику и уменьшать выраженность симптомовдекомпенсации. Возможными показаниями к исполь-зованию амлодипина или фелодипина в лечении ХСН(на фоне основных средств лечения) являются:
A) наличие упорной стенокардии,
B) наличие сопутствующей стойкой гипертонии,
C) высокая легочная гипертония, в том числе при сопут-ствующей ХОБЛ,
D) выраженная клапанная регургитация.
Применение дигидропиридиновых кальциевых антагонистов позволяет уменьшать степень клапанной регурги-тации (митральной и аортальной). Причем эффект дигидропиридинов сохраняется как при органической, таки относительной митральной недостаточности [170, 171].
К сожалению, применение дигидропиридинов у больных АГ может способствовать задержке жидкости и раз-витию симптомов ХСН [112, 202, 447]. Поэтому БМККс вазодилатирующими свойствами не применяютсядля профилактики ХСН.
Использование БМКК обязательно сочетается с лече-нием основными средствами терапии ХСН (иАПФ,АМКР, β-АБ, диуретики), что может нивелировать нега-тивные эффекты, связанные с гиперактивацией нейро-гормонов и задержкой жидкости.
Препараты железа при сопутствующейжелезодефицитной анемии (классрекомендаций IIA, уровень доказанности В)
При неосложненной ХСН наличие анемии не харак-терно, так как в ответ на недостаточно эффективноегемодинамическое обеспечение органов кровью и кислородом должен развиваться эритроцитоз и увеличиватьсяуровень гемоглобина. Однако в результате задержки жид-кости (гемодилюции), вторичного нарушения функциипочек, печени, снижению чувствительности костногомозга к ЭПО, около ⅓ пациентов с ХСН имеют уровеньгемоглобина менее 120 мг / л, что можно определить,как анемию [451]. Чем тяжелее ХСН, тем ниже среднийуровень гемоглобина, тем больший процент больныхимеет анемию [452]. Прогноз больных ХСН ухудшаетсяпараллельно снижению уровня гемоглобина, что позво-лило считать анемию одним из факторов не только ухуд-шения клинического состояния, но и увеличения рисказаболеваемости больных ХСН [453], причем вне зависи-мости от ФВ ЛЖ [454].
Учитывая эти факты, магистральным направлени-ем в лечении анемии у больных ХСН в последние годывиделось применение в комплексе эритропоэтина [455].Первые обнадеживающие результаты, продемонстри-ровавшие улучшение клинического состояния, умень-шение одышки, увеличение толерантности к нагрузкаму больных ХСН на фоне лечения эитропоэтином [456],стимулировали проведение крупномасштабного МРКИ,получившего название RED–HF. К сожалению, резуль-таты этого исследования не подтвердили первичнойгипотезы. Применение эритропоэтина (дарбепоэтина–альфа) не оказывало влияния ни на количество госпи-тализаций, ни на смертность больных ХСН с уровнемгемоглобина менее 120 мг / л [457]. При этом достовер-но в 3,5 раза увеличивался риск тромбозов и эмболийи в 1,7 раза – риск мозговых инсультов. Аналогичноеповышение риска сердечно-сосудистых осложненийотмечалось и при применении эритропоэтина у боль-ных ХБП и СД 2 типа [458].
Ранее подобные эффекты связывали с чрезмернымповышением уровня гемоглобина более 145 мг / л, пред-полагая, что его оптимальный уровень находится в пре-делах 120–140 мг / л [459]. Однако в исследовании RED–HF достигнутый уровень гемоглобина мониторировалсяи в среднем не превышал 130 мг / л, но тем не менее, рискосложнений возрастал [457].
Можно констатировать, что идея коррекции анемииу больных ХСН с помощью эритропоэтина не получиласвоего подтверждения. Эритропоэтин не должен при-меняться в лечении больных ХСН даже при сниженномуровне гемоглобина (класс рекомендаций III, уровеньдоказанности А).
С другой стороны, среди всех случаев анемии у паци-ентов с ХСН ¾ относятся к железодефицитным состо-яниям [460]. Об этом свидетельствует сочетание сни-женного гемоглобина (менее 120 мг / л) и уменьшениесодержания сывороточного железа (менее 10 мкмоль / лжелеза). Более точная оценка характера анемии можетбыть сделана на основании содержания ферритина(снижается ниже 100 нг / мл в случаях абсолютногодефицита железа) или насыщения трансферрина желе-зом (ниже 20 %). Низкий уровень насыщения транс-феррина железом при наличии сохранного уровняферритина может свидетельствовать об относительномдефиците железа.
В этих случаях логичным и эффективным должнобыть использование препаратов железа. Хотя пероральные препараты железа кажутся удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасыванияи часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10–40 % пациен-тов), которые снижают приверженность к лечению.Внутривенное введение препаратов железа обоснова-но в тех случаях, когда необходимо быстро добитьсяэффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих ССЗ или находящих-ся на химиотерапии), при плохой переносимости пре-паратов для приема внутрь или их неэффективности(синдром мальабсорбции), то есть при всех проявле-ниях ХСН.
По крайней мере, два открытых и два контролируе-мых исследования с применением препарата венофер(сахарат железа) продемонстрировали уменьшениеявлений анемии и улучшением клинического состоянияу пациентов с ХСН [461–463]. Но наиболее крупноеМРКИ (FAIR–HF) с участием и российских центровиспользовало препарат ферринжект (феррокарбо-мальтозный комплекс железа) [464]. Это стабильныймононуклеарный комплекс железа, не вызывающийгиперчувствительности, что позволяет быстро (в тече-ние 15 минут) ввести высокую дозу железа (1000 мг),которое медленно высвобождается, что позволяет про-водить инъекции 1 раз в неделю [465]. При этом желе-зо оптимально распределяется в организме, включаяпечень, селезенку и костный мозг [466].
В исследовании FAIR–HF введение ферринжектав сравнении с контролем приводило к достоверномуулучшению клинического состояния уже после второйинъекции. Суммарно 50 % пациентов, получавших фер-ринжект, и лишь 27 % в контроле отметили значительноеулучшение клинического состояния и 47 % достигли I ФКХСН (против 30 % в контроле). Увеличение дистанции6-мин ходьбы составило 40 метров (против 10 метровв контроле), и СКФ увеличилась на 4 мл / мин, что сви-детельствует об улучшении функция почек. При этомриск заболеваемости и смертности был на 6,5 % меньшев группе лечения ферринжектом, что, вкупе с отсутстви-ем серьезных побочных реакций, позволяет рекомен-довать подобное лечение больным ХСН с железодефи-цитной анемией [464]. В настоящее время проводятсяеще два более длительных исследования по применениюферринжекта в лечении пациентов с ХСН и сопутству-ющей анемией.
Статины при ишемической этиологииХСН (класс рекомендаций IIB,уровень доказанности А)
До 2007 года вопрос об эффективности примене-ния статинов в лечении ХСН оставался открытым.Результаты ретроспективных анализов, когортныхисследований и протоколов по принципу «случай–контроль» демонстрировали, что статины могуткак снижать риск развития ХСН, так и улучшать про-гноз пациентов с уже развившейся декомпенсацией[467, 468]. Многочисленность и абсолютная одно-направленность имеющихся данных позволяли пред-полагать способность дополнительного улучшенияпрогноза больных ХСН ишемической этиологиипри назначении статинов.
Учитывая, что снижение уровня ЛПНП не являетсяединственным механизмом положительного действиястатинов у больных ХСН, большое значение придавалось плейотропным эффектам этого класса лекарств[469]. В этой связи обсуждался даже вопрос о возмож-ности применения этого класса лекарств в лечении ХСНне только ишемической этиологии [467, 468].
Однако завершение двух крупных многоцентровыхпроспективных исследований по применению статинову больных ХСН ишемической (CORONA) и различной,в том числе и неишемической этиологии (GISSI–HF),не оправдало возлагавшихся надежд [470, 471].
Ни в одном из исследований применение розуваста-тина в дозе 10 мг / сут (на фоне максимальной терапииХСН) не приводило к улучшению прогноза больныхХСН, несмотря на достоверное снижение атероген-ного ХС липопротеидов низкой плотности и уровняС-реактивного белка. Возможным объяснением неудачиможет быть то, что у больных ХСН IIБ – III стадии, осо-бенно при развитии кардиального цирроза печени, уро-вень ХС может снижаться, что является одним из преди-кторов неблагоприятного прогноза [472–474].
У больных ХСН ишемической этиологии (исследова-ние CORONA) применение розувастатина достоверноуменьшало риск госпитализаций, в том числе связанныхс обострением ХСН и, по данным ретроспективногоанализа, суммарную частоту инфарктов и инсультов.В группе больных со смешанной, в том числе и неише-мической (около половины больных) этиологией ХСН(исследование GISSI–HF), применение розувастатинане меняло не только показатели смертности, но и заболеваемости (число госпитализаций).
В обоих исследованиях была подтверждена высокая безопасность лечения розувастатином даже у декомпен-сированных больных при нарушениях функции печении почек. В исследовании CORONA отмена розувастати-на из-за нежелательных реакций происходила достовернореже, чем плацебо.
На основании полученных данных можно дать практи-ческие рекомендации по применению статинов у больныхс риском и с уже развившейся ХСН: статины являютсяэффективным средством профилактики появления ХСНу больных с наличием коронарной болезни сердца, дажеу пациентов с исходно низким уровнем ХС ЛПНП [475]; применение статинов при уже развившейся ХСН не сопро-вождается улучшением прогноза больных, вне зависимостиот этиологии; у больных с ишемической этиологией ХСНприменение розувастатина в дополнение к оптимальнойтерапии ХСН позволяет снижать число госпитализаций(в том числе из-за обострения ХСН) и уменьшать вероят-ность ОИМ и инсульта; переносимость розувастатинане отличается от плацебо даже у пациентов с выраженнойХСН; если статины были назначены больному с коронар-ной болезнью сердца, терапия может быть (и должна!) безопаснопродолжена при присоединении симптомов ХСН.
Для практического использования у пациентов с ише-мической этиологией ХСН сегодня рекомендуется при-менение розувастатина в дозе 10 мг / сут.
Ретроспективные анализы и мета-анализы небольшихисследований позволяют предположить, что препаратомвыбора у больных ХСН может оказаться аторвастатин(10 мг / сут), хотя и это требует подтверждения (класс IIB,уровень доказанности В) [476].
Кроме того, в первые три месяца лечения больных ХСНстатинами требуется регулярный контроль уровней печеноч-ных трансаминаз, а также креатинфосфокиназы. При повы-шении уровня АСТ и АЛТ более чем в три раза от исход-ных или КФК в 10 раз выше нормы, а также при появлениимышечных болей лечение статинами необходимо прервать.В остальном контроль безопасности терапии не отличаетсяот пациентов, не имеющих симптомов ХСН, как изложенов Рекомендациях РКО по лечению атеросклероза [141].
Антиагреганты (в частности, аспирин)в лечении ХСН (класс рекомендацийIIB, уровень доказанности В)
Вопрос о применении аспирина в лечении ХСН остается не до конца решенным. Проблема – в возможностиблокады синтеза простациклина даже при использо-вании самой малой дозы препарата – 75 мг [208, 477].Блокада фермента циклооксигеназы, определяющаямеханизм действия аспирина и других НПВП, чреватаодновременным ослаблением эффекта иАПФ, диурети-ков, альдактона и даже β-АБ с вазодилатирующими свой-ствами – карведилола (класс IIA, уровень доказанностиВ) [168, 207, 478, 479].
С этой точки зрения применение антиагрегантовс другим механизмом действия (клопидогрел), которые позволяют достигать антиагрегационного эффектабез блокады фермента циклооксигеназы, выглядит теоретически более обоснованным, хотя клинических подтверждений этому нет. Следовательно, аспирин и другие антиагрегантыдолжны применяться у больных ХСН лишь при строгихпоказаниях. Поэтому позиции по применению антиагре-гантов у пациентов с клинически выраженной ХСН сво-дятся к следующему:
A) убедительных данных о целесообразности примене-ния антиагрегантов для лечения ХСН нет (за исключением раннего периода (до 8 недель) после пере-несенного ОИМ). При назначении антиагрегантовнарастает риск геморрагических осложнений, вклю-чая желудочно-кишечные кровотечения и геморраги-ческие инсульты [480];
B) назначение аспирина достоверно увеличивает числогоспитализаций, связанных с обострением декомпен-сации (класс IIB, уровень доказанности В) [135, 136];
C) при необходимости использования аспирина тео-ретически более оправданным выглядит его соче-тание с АРА (а не с иАПФ), хотя контролируемыхклинических исследований, подтверждающих этоположение, нет;
D) иАПФ более обоснованно сочетать с дезагреганта-ми, имеющими другой механизм действия (клопидо-грел), хотя и это положение не подтверждено клини-ческими исследованиями;
E) двойная антитромботическая терапия при ХСНне показана (за исключением случаев ангиопластикис применением стентов с лекарственным покрытием)[391, 481];
F) большинство имеющихся на сегодня результатовретроспективных анализов МРКИ (при отсутствиипроспективных исследований) позволяют констати-ровать, что хотя некий негативный момент во взаимо-действии малых доз аспирина (75–100 мг!) и иАПФприсутствует, совместное использование этих препа-ратов у больных, перенесших ОИМ и имеющих ХСН,возможно [216, 221, 482, 483];
G) нужно избегать назначения НПВП (включая дозыаспирина >325 мг) больным ХСН, находящим-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти (вплоть до развития отека легких).
Цитопротекторы (триметазидинмедленного высводождения = триметазидинМВ) при лечении ХСН ишемическойэтиологии (класс рекомендаций IIA,уровень доказанности В)
Единственным препаратом этого класса, рекомен-дуемым для лечения стенокардии, является ингибиторфермента 3КАТ триметазидин, переводящий синтезвысокоэнергетических соединений в миокарде на болееэкономный аэробный путь [355, 484]. Это единствен-ный цитопротектор, клиническая эффективность кото-рого была исследована у больных со стенокардией в пол-ноценных МРКИ, причем как в виде монотерапии, таки при комбинированном лечении. Последние мета-ана-лизы продемонстрировали способность триметазидинаМВ достоверно уменьшать стенокардию и увеличиватьвремя нагрузки до появления изменения сегмента ST[485, 486]. Кроме того, длительное лечение триметази-дином МВ может положительно влиять на прогноз боль-ных, перенесших ОИМ, при котором высока вероят-ность появления ХСН [487].
Учитывая, что метаболический дисбаланс являетсяодним из важных механизмов развития и прогрессирова-ния ХСН (особенно ишемической этиологии), возмож-ность активации аэробного гликолиза при использованиитриметазидина МВ может рассматриваться, как реальныйспособ лечения декомпенсированных больных [488, 489].Сегодня в довольно большом числе плацебо-контроли-руемых исследований убедительно продемонстрирова-но, что длительное лечение триметазидином больныхХСН ишемической этиологии сопровождается не толькоулучшением клинического состояния больных и качестважизни, но и приростом ФВ ЛЖ (в пределах 7 %), а так-же уменьшением ремоделирования сердца [490–492].Высокая клиническая эффективность триметазидина МВпри ХСН потверждена и в Российских многоцентровыхпрограммах ПРИМА и ПРЕАМБУЛА [493].
Вопрос о влиянии триметазидина МВ на заболе-ваемость и смертность при ХСН требует дальнейшихисследований. Однако результаты последних мета-ана-лизов показывают cнижение риска госпитализацийиз-за обострения ХСН при применении триметазиди-на МВ в пределах 50 % [492, 494]. Эти предположенияподтвердились и в самом крупном когортном иссле-довании (669 больных) по применению триметазиди-на у больных ХСН ишемической этиологии. Лечениетриметазидином с большой достоверностьтю снижалориск смерти и обострения ХСН на 11,4 % и продлеваложизнь без осложнений на 7,8 месяца [495]. Имеющиесярезультаты диктуют необходимость проведения круп-ного проспективного МРКИ для окончательного опре-деления места триметазидина в лечении ХСН ишемиче-ской этиологии.
Данные по лечению триметазидином больных ХСНнеишемической этиологии слишком малочисленныдля сколько-нибудь серьезных выводов.
Таким образом, назначение триметазидина МВ долж-но быть рассмотрено у больных ХСН ишемическойэтиологии в дополнение к основным средствам лечениядекомпенсации для устранения симптомов, нормализа-ции гемодинамики (и роста ФВ ЛЖ) и возможного сни-жения риска смерти и повторных госпитализаций (классрекомендаций IIA, уровень доказанности В).
Более жесткой должна быть позиция по отношениюк препаратам с неясным механизмом действия и недока-занной клинической эффективностью, хотя многие из нихпозиционируются, как кардиопротекторы или метаболи-чески активные средства. Поэтому использование таури-на, карнитина, милдроната в лечении ХСН не показано(класс III, уровень доказанности С).
Периферические вазодилататоры (классрекомендаций IIB, уровень доказанности В)
В настоящее время ПВД не входят в число препаратовпервой линии, используемых для лечения ХСН. На прогноз, количество госпитализаций, прогрессированиеболезни они не влияют.
Исключение составляет применение комбинациинитратов (венозных вазодилататоров) с гидралазином(артериолярными вазодилататорами) у пациентов негроидной расы. У этого контингента пациентов подобнаякомбинация (в дополнение к иАПФ, β-АБ, диуретикам)может способствовать улучшению прогноза [496–498].У лиц белой расы всегда более предпочтительно исполь-зование иАПФ [221, 498]. Кроме того, применение ком-бинации нитратов с гидралазином стимулирует развитиепобочных реакций (гипотония, тахикардия), которыезатрудняют лечение больных ХСН [499].
Нитраты могут даже негативно влиять на прогнозбольных ХСН и затруднять применение иАПФ, т. е. сни-жать эффективность последних (класс IIB, уровень дока-занности С) [202].
Нитраты могут назначаться при ХСН лишь при нали-чии доказанной ИБС и стенокардии, которая проходитименно (только) от нитропрепаратов. Во всех остальныхслучаях нитраты при ХСН не показаны.
В качестве артериолярных ПВД можно применятьлишь дигидропиридины длительного действия (предпо-чтительно амлодипин), а не гидралазин.
Следует помнить, что сопутствующее лечение вазо-дилататорами лишь затрудняет использование абсолют-но необходимых в терапии декомпенсации препаратов –иАПФ, АРА и β-АБ из-за дополнительной способностик снижению АД. Кроме того, применение прямых ПВДсопровождается активацией нейрогормонов, что чреватопрогрессированием ХСН [202, 269].
Негликозидные инотропные средства в леченииХСН при симптомной гипотонии и остройдекомпенсации сердечной деятельности (классрекомендаций IIB, уровень доказанности В)
Применение негликозидных инотропных средств,несмотря на кратковременное улучшение гемодинамикии клинического состояния больных с обострением деком-пенсации, при долгосрочном наблюдении повышает рисксмерти больных ХСН. Более того, даже кратковременнаяинотропная поддержка в период обострения декомпенсации может негативно повлиять на отдаленный прогноз больных ХСН (класс IIA, уровень доказанности В). Поэтому сегодня эти препараты не рекомендованыдля лечения ХСН [500–503].
При критическом состоянии (при обострении ХСН)лучше всего использовать сенситизатор кальция лево-симендан (болюс 12 мкг / кг, затем внутривенно капель-но 0,1–0,21 мкг / кг / мин). Этот препарат максимальноулучшает показатели гемодинамики, не имеет негатив-ных взаимодействийс β-АБ (в отличие от добутамина)и рекомендован ЕОК для лечения обострения ХСН [261,504]. Впервые способность левосимендана улучшатьпрогноз больных после ОИМ была продемонстрирова-на в исследовании RUSSLAN, проводившемся в России[505]. Однако при длительном лечении левосимендан,как и другие негликозидные инотропные стимуляторы,не влияет на прогноз больных ХСН [502].
Внутривенное введение добутамина (внутривенноекапельное введение со скоростью 2,5–10 мкг / кг / мин)должно проводиться лишь при симптомной гипотониипо витальным показаниям, учитывая его негативное вли-яние на прогноз.
Средства, не рекомендованныек применению при ХСН cо сниженнойФВ ЛЖ (класс рекомендаций III)
Применение этих препаратов должно быть, по воз-можности, исключено при лечении декомпенсации.К ним относятся:
A) НПВП (селективные и неселективные, включаядозы аспирина >325 мг). Особенно неблагоприят-но их использование у больных ХСН, находящих-ся на лечении иАПФ, диуретиками и альдактоном.Особенно опасно применение НПВП в периоддекомпенсации и гипергидратации, что чревато ухуд-шением клинического состояния и задержкой жидко-сти, вплоть до развития отека легких;
B) Глюкокортикоиды. Применение стероидных гор-монов имеет чисто симптоматические показанияв случаях упорной гипотонии и тяжелого отечно-го синдрома для облегчения начала лечения иАПФ,диуретиками и β-АБ. С другой стороны, возмож-ность опасных для жизни осложнений ограничиваетиспользование этих препаратов;
C) Трициклические антидепрессанты;
D) Антиаритмики I класса;
E) Некоторые БМКК (верапамил, дилтиазем, коротко-действующие дигидропиридины).
Медикаментозная терапия больных ХСНс сохраненной систолической функцией ЛЖ(ФВ ЛЖ >50 %) или диастолической ХСН
Нижеприведенные рекомендации носят, скорее, предположительный характер ввиду ограниченности имеющихся данных по вопросу лечения больных ХСН–ССФили ДСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследованийу этой категории больных.
В настоящее время отсутствуют убедительныедоказательства улучшения выживаемости при исполь-зовании какого‑либо специфического медикамен-тозного лечения у пациентов с ХСН–ССФ или ДСН.Тем не менее эффективность применения некоторыхпрепаратов была показана в отдельных исследованияхи продолжает изучаться.
Наиболее агрессивным апологетам доказательноймедицины следует напомнить, что отсутствие дока-зательств возможности улучшения прогноза больныхне может обосновывать бездействие и оставление паци-ентов без надежды хотя бы на клиническое улучшениесостояния.
Кроме того, первым и обязательным условием являет-ся выявление и коррекция всех факторов и заболеваний,способствующих развитию диастолических расстройств,появлению и прогрессированию ХСН–ССФ. К нимчаще всего относятся АГ и ГЛЖ, ИБС, констриктивныепоражения миокарда / перикарда, СД, ожирение и т. д.Поэтому контроль АД, успешное лечение ИБС, кор-рекция уровня глюкозы, нормализация массы тела, уме-ренные физические нагрузки могут быть важным под-спорьем в успешном ведении этой сложной для лечениягруппы больных.
Как известно, что блокаторы РААС (иАПФ, АРА)и β-АБ относятся к основным средствам лечения пода-вляющего числа заболеваний, приводящих к ХСН–ССФ,поэтому их наличие в числе препаратов, рекомендованных больным ДСН, не вызывает сомнений. Гораздо труд-нее обосновать бездействие и отсутствие попыток лече-ния больных ХСН–ССФ, несмотря на ограниченностьклинических исследований.
Для возможного улучшения диастолического наполне-ния ЛЖ показан контроль ЧСС.
Следует принять адекватное решение и выбрать соот-ветствующие меры по вопросу профилактики, восстановления и поддержания синусового ритма у больныхс мерцательной тахиаритмией согласно принятым реко-мендациям [30, 506]. При сохранении постоянной фор-мы мерцания предсердий необходимо добиться нормали-зации частоты желудочковых сокращений.
Ингибиторы АПФ
Ингибиторы АПФ способны напрямую улучшатьрелаксацию и растяжимость миокарда, а также оказыватьопосредованное действие на диастолические свойстваЛЖ за счет своего гипотензивного эффекта и способ-ности уменьшать выраженность гипертрофии и фибро-за миокарда. В ранних исследованиях было показано,что терапия иАПФ пациентов с СН–ССФ достовернопродлевает время до вынужденной госпитализациииз‑за развития декомпенсации, хотя и не снижает смерт-ность [507]. Достоверное улучшение суррогатных конеч-ных точек (функционального статуса, толерантностик нагрузке, качества жизни) у больных ХСН с относитель-но сохраненной сократимостью (ФВ >45 %) было показа-но в проспективном российском исследовании ФАСОН[508]. Единственное завершившееся к настоящему вре-мени плацебо-контролируемое исследование по оценкевлияния иАПФ на выживаемость пожилых больных ДСН(>70 лет) – (PEP–CHF), выполненное с периндоприлом,не показало достоверного снижения общей или сердеч-но-сосудистой смертности на фоне лечения иАПФ [509].Тем не менее через 1 год после начала исследования тера-пия иАПФ ассоциировалась с достоверным снижениемриска внеплановой госпитализации из-за декомпенсации(OP 0,63; ДИ 0,40–0,97; p=0,033). Клинически у пациен-тов, находившихся на лечении периндоприлом, отмечал-ся достоверно меньший ФК ХСН и достоверно бóльшимбыл прирост дистанции теста 6‑мин ходьбы [509]. Болеетого, ретроспективный анализ показал, что в подгруппемоложе 75 лет эффект периндоприла был более отчетли-вым и сопровождался снижением риска смерти и количе-ства госпитализаций из-за обострения ХСН.
Мета-анализ всех исследований по применениюиАПФ в лечении больных с ХСН–ССФ продемонстри-ровал снижение риска смерти без достоверного влиянияна риск госпитализаций, в том числе связанных и с обо-стрением ХСН [510].
Таким образом, иАПФ пока не доказали своей способ-ности улучшать прогноз пациентов с ХСН–ССФ и ДСН,однако их применение у таких больных абсолютнооправдано, по крайней мере, в связи с улучшением функ-ционального статуса пациентов и уменьшением рискавынужденных госпитализаций (класс рекомендаций IIA,уровень доказательности В).
Антагонисты рецепторов к АII
По степени положительного влияния на ГЛЖ и выра-женность фиброза АРА не уступают иАПФ, а по способности устранять диастолические расстройства могут даже превосходить иАПФ [511, 512].
Эффективность АРА по влиянию на заболеваемость и смертность при лечении пациентов с ХСН и сохранной систолической функцией ЛЖ выглядит умеренной.При применении кандесартана в группе больных ХСНс ФВ ЛЖ <40 % число госпитализаций из-за обостренияХСН достоверно снижалось, хотя улучшения прогно-за не наблюдается [259]. Еще более разочаровывающиерезультаты были получены при попытке лечения ХСНс сохранной систолической функцией сердца в исследовании I-PRESERVE с ирбесартаном. Препарат не влиялни на смертность, ни на число госпитализаций, ни на про-грессирование ХСН [126].
Таким образом, АРА пока также не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН.Тем не менее, как показали итоги исследования CHARM–preserved, применение АРА кандесартана при диасто-лических расстройствах позволяет, по меньшей мере,снизить частоту госпитализаций, и его использованиев таких ситуациях обосновано, особенно при неперено-симости иАПФ (класс рекомендаций IIB, уровень дока-зательности В).
Блокаторы β-адренергических рецепторов
β-АБ могут быть назначены больным ХСН–ССФс целью уменьшения ЧСС (увеличения периода диа-столического наполнения ЛЖ) и выраженности ГЛЖ(уменьшения жесткости камеры ЛЖ). ИсследованиеSWEDIC [513] показало, что α-, β-адреноблокаторкарве-дилол, помимо снижения ЧСС, оказывает положительноевлияние на допплер–ЭхоКГ показатели релаксации ЛЖу больных ДСН. Специальных работ по изучению влия-ния β-АБ на выживаемость больных СН–ССФ или ДСНне проводилось. Однако в исследовании SENIORS с неби-вололом, в которое было включено более 700 пожилыхбольных с незначительно сниженной сократимостью (ФВЛЖ >35 %), терапия этим β-АБ ассоциировалась со сни-жением комбинированного показателя общей смертно-сти или госпитализации по сердечно-сосудистым причи-нам (класс IIB, уровень доказательности С) [514].11.2.4. Блокаторы медленныхкальциевых каналов (БМКК)
С той же целью, что и β-АБ, может быть использованБМКК верапамил. Однако, как показало исследованиеDAVIT II, у больных в раннем постинфарктном перио-де назначение верапамила при наличии СН в анамнеземалоэффективно [515]. Таким образом, назначение вера-памила больному ДСН для снижения ЧСС может бытьрекомендовано только в случае непереносимости β-АБи при отсутствии выраженной ХСН, проявляющейся,например, задержкой жидкости (класс IIB, уровень дока-зательности С).
Начаты исследования и по применению селективногоблокатора If -токов в клетках синусового узла ивабрадинас целью урежения ритма и возможного влияния на клини-ку, заболеваемость и прогноз больных ХСН–ССФ с сину-совым ритмом.
Диуретики
Диуретики могут быть необходимы в случае задержкижидкости в организме, но у пациентов с ДСН их следуетиспользовать с осторожностью, чтобы не вызвать чрез-мерного снижения преднагрузки на ЛЖ и падения сер-дечного выброса (класс IIB, уровень доказательности С).Среди других следует выделить торасемид, обладающийдлительным (до 18 часов) диуретическим эффектом,меньшим, чем у фуросемида, калийуретическим действи-ем [337], и что может быть особенно важно для больныхДСН – обладает собственным антифибротическим влия-нием на миокард [516].
Сравнительные исследования с фуросемидом показа-ли способность торасемида в большей степени улучшатьдиастолические свойства ЛЖ [517]. Однако проспектив-ных исследований по влиянию торасемида на заболевае-мость и смертность у больных ХСН с преобладающимидиастолическими расстройствами еще не проводилось.
Антагонисты МКР
Антагонисты МКР у больных с диастолическимирасстройствами должны рассматриваться не столькокак калийсберегающие диуретики, сколько как анти-фибротические препараты. До настоящего временине закончено ни одного плацебо-контролируемого иссле-дования по оценке влияния антагонистов альдостеро-на на выживаемость больных диастолической СН. Хотямногочисленные экспериментальные и клиническиеисследования продемонстрировали способность АМКР(в том числе в сочетании с иАПФ и АРА) к уменьшениюфиброза и улучшению диастолического наполнения ЛЖкак при сниженной, так и при сохранной ФВЛЖ. В насто-ящее время завершается первое МРКИ исследование,целью которого является изучение влияния спиронолак-тона (плюс к иАПФ или АРА) на выживаемость больныхс начальной и умеренной стадиями ХСН и ФВ ЛЖ >45 %(TOPCAT), результаты которого ожидаются в 2014 году.
Сердечные гликозиды
Ритмурежающее действие сердечных гликозидов (дигоксина) может быть полезно для пациентов с ФП, которая встречается примерно у 30 % больных с диастолической СН[16]. Однако результаты исследования DIG [518] показали,что даже независимо от характера основного ритма применение дигоксина ассоциируется с более чем 30 %-м сниже-нием госпитализаций из-за декомпенсации ХСН у больныхкак со сниженной (<45 %), так и с относительно сохранной(>45 %) ФВ ЛЖ. Более того, субанализ этого исследования ме крови (<0,9 нг / мл) отмечается достоверное снижениериска смерти и госпитализаций по любым причинам, в т. ч.и у больных с сохраненной систолической функцией [519].Положительный эффект дигоксина может быть связанс увеличением сократимости спиральных волокон миокар-да, определяющих активную позднюю фазу опорожненияЛЖ («скручивание») и активную же раннюю фазу диа-столического наполнения («раскручивание» и присасыва-ющий эффект) в большей степени, чем со снижением ЧСС(особенно при синусовом ритме). Подобный эффект былпоказан почти 40 лет назад при изучении гемодинамическихэффектов сердечных гликозидов с помощью динамическойэхокардиографии в реальном масштабе времени [520].
Доза дигоксина не должна превышать 0,25 мг, а кон-центрация в плазме – 1,1 нг / мл. При необходимостиснижения ЧСС у больных ХСН–ССФ с синусовымритмом следует отдать предпочтение комбинации β-АБс дигоксином.
Мета-анализ всех 30 основных проспективных иссле-дований и когортных наблюдений, включивший анализтерапии более 53 тысяч пациентов с ХСН–ССФ, проде-монстрировал, что проводимое лечение (не только иАПФ,АРА, β-АБ и дигоксином, но и БМКК, и вазодилататора-ми) улучшает клиническое состояние и переносимосьфизических нагрузок, но не влияет на прогноз [521]. Этоеще раз подчеркивает сложность эффективного лечениярассматриваемой группы больных и должно стимулиро-вать поиск новых подходов к терапии ХСН–ССФ.
Лечение острой декомпенсации ХСН
Лечение зависит от преобладающих клиническихсимптомов.
Оксигенотерапия
Оксигенотерапия должна проводиться всем пациентам с ОДСН до достижения сатурации кислорода ≥95или ≥90 % у пациентов с ХОБЛ (класс рекомендаций I,уровень доказанности С).
Диуретики
Диуретики показаны при наличии отечного синдрома(класс рекомендаций I, уровень доказанности В).
Назначая диуретики при ОДСН, следует руководство-ваться данными, представленными в таблице 26.
Таблица 26. Рекомендации для назначения диуретиков при ОДСН
 Дигоксин
У пациентов с синусовым ритмом дигоксин можетбыть использован для контроля ЧСС, однако требует-ся тщательный мониторинг состояния пациента, таккак в условиях ОДСН высок риск развития гликозиднойинтоксикации. При сопутствующейФП, ФВ менее 40 %дигоксин должен назначаться в сочетании с β-АБ (классрекомендаций I, уровень доказанности С). У пациентовс ОДСН дигоксин ведет к незначительному приросту СВ(класс рекомендаций IIB, уровень доказанности С).
Вазодилататоры
Вазодилататоры показаны при лечении ОДСН, посколькуснижают давление в малом круге кровообращения (МКК).Они могут применяться у всех пациентов с АД ≥90 мм рт. ст.(класс рекомендаций I, уровень доказанности С).
При назначении вазодилататоров следует основывать-ся на рекомендациях, представленных в таблице 27.
Таблица 27. Рекомендации для назначения вазодилататоров
Дигоксин
У пациентов с синусовым ритмом дигоксин можетбыть использован для контроля ЧСС, однако требует-ся тщательный мониторинг состояния пациента, таккак в условиях ОДСН высок риск развития гликозиднойинтоксикации. При сопутствующейФП, ФВ менее 40 %дигоксин должен назначаться в сочетании с β-АБ (классрекомендаций I, уровень доказанности С). У пациентовс ОДСН дигоксин ведет к незначительному приросту СВ(класс рекомендаций IIB, уровень доказанности С).
Вазодилататоры
Вазодилататоры показаны при лечении ОДСН, посколькуснижают давление в малом круге кровообращения (МКК).Они могут применяться у всех пациентов с АД ≥90 мм рт. ст.(класс рекомендаций I, уровень доказанности С).
При назначении вазодилататоров следует основывать-ся на рекомендациях, представленных в таблице 27.
Таблица 27. Рекомендации для назначения вазодилататоров
 Применение диуретиков и вазодилататоров при ОДСН может быть затруднено двумя факторами – чрез-мерным снижением АД и ухудшением функции почек(нередко преходящим). Поэтому чрезмерно мощныйдиурез в ответ на применение диуретиков и падение АДв ответ на применение вазодилататоров можно рассматривать, как предикторы нового обострения ХСН, повы-шающие риск регоспитализаций.
В последние годы особое внимание уделялось поискубезопасныхпрепаратов для лечения ОДСН при одно-временном улучшении функции почек. Наиболее обе-щающие результаты были достигнуты при использова-нии препарата серелаксин (натуральный релаксин-2 –вещество, определяющее адаптацию к беременности,одновременно обладающее вазодилатирующими свой-ствами и улучшающее почечный кровоток). В МРКИRELAX–AHF применение серелаксина приводилок достоверному уменьшению одышки (по визуальноаналоговой шкале), хотя по Lickert (вторая первичнаяконечная точка) одышка достоверно не менялась [342]
Препараты с положительныминотропным действием
Препараты показаны пациентам с низким сердечнымвыбросом, сохраняющимися явлениями застоя, гипо-перфузии, несмотря на применение вазодилататорови / или диуретиков (класс рекомендаций IIA, уровеньдоказанности С).
Добутамин
Препарат с преимущественным воздействием на β1‑рецепторы,оказывает дозозависимый положительныйинотропный и хронотропный эффекты. При назначе-нии не требуется болюсное введение, начальная доза2–3 мкг / кг / мин. Применение добутамина требует мони-торинга гемодинамики. Основным побочным эффектомявляется тахикардия.
Допамин
Действие препарата обусловлено стимуляциейβ-рецепторов,что ведет к увеличению сердечного выброса, сократительной способности миокарда. В малых дозах(1–3 мкг / кг / мин) оказывает допаминэргический эффекти стимулирует диурез. Большиедозы допамина исполь-зуются с целью поддержания уровня АД, однако ониассоциированы с прогрессирующим приростом ЧСС.У пациентов с ЧСС, превышающей 100 уд / мин, назначе-ние допамина должно осуществляется крайне осторожно(класс рекомендаций IIB, уровень доказанности С).
Левосимендан
Кальциевый сенситизатор, применение которогоу пациентов с ОДСН увеличивает сердечный выброси ударный объем, а также снижает давление в легочнойартерии, системное и легочное сосудистое сопротивление. Эффект левосимендана сохраняется в течениемесяца. Препарат является альтернативой для пациен-тов, находящихся на терапии β-АБ, так как не конкури-рует за связь с β-рецепторами. Левосимендан назнача-ется: болюсом в дозе 3–12 мкг / кг в течение 10 минут,с последующей инфузией 0,05–0,2 мкг / кг / мин в течение24 часов. У пациентов с АД менее 100 мм рт. ст. долженназначаться без болюсной дозы во избежание гипотензии(класс рекомендаций IIA, уровень доказанности Б).
Блокаторы If -каналов
Назначение блокаторов If -каналов при ОДСН показанопациентам с ЧСС выше 100 уд / мин с целью контроля ЧСС (в том числе при параллельном назначении положительныхинотропных препаратов). Назначение блокаторов If -кана-лов при ОДСН ассоциировано с улучшением прогноза,снижением сроков госпитализации. Назначение блока-торов If -каналов возможно в сочетании с малыми дозамиβ-АБ. Титрацию блокаторов If ‑каналов следует начинатьс малых доз, при хорошей переносимости увеличиватьдозу до среднетерапевтической (для ивабрадина титрациюдозы следует начинать с 5 мг 2 раза в сутки, в дальнейшем дозу препарата увеличивают до 7,5 мг 2 раза в сутки) (классрекомендаций IIB, уровень доказанности С).
12. Хирургические и электрофизиологическиеметоды лечения ХСН
Электрофизиологические методы лечения ХСН
Электрофизиологические методы лечения ХСН сводятся на сегодняшний день к трем процедурам:
A) имплантации обычных (правожелудочковых) ЭКС;
B) имплантации бивентрикулярных электрокардиостимуляторов (БВЭКС) для проведения сердечной ресин-
хронизирующей терапии;
C) имплантации кардиовертеров–дефибрилляторов.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинать-
ся только на фоне оптимальной медикаментозной терапии (ОМТ) при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуется больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
12.1.1. Имплантация обычных (правожелудочковых) электрокардиостимуляторов
Постановка (имплантация) обычных ЭКС актуальна для пациентов с синдромом слабости синусового узла и атрио-вентрикулярными блокадами [522–525]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а с адаптируемой частотой
стимуляции, и прежде всего двухкамерных или однокамерных с предсердным электродом (при слабости синусового узла и нормальной функции АВ узла).
Однако длительная стимуляция ПЖ сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН. Поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа [526] (класс показаний IIA, уровень доказанности С).
Впервые исследование DAVID показало, что у пациентов с выраженной систолической дисфункцией (ФВ ЛЖ <35 %), у которых стимуляция ПЖ длится больше 40 % времени, возрастает риск комбинированной точки – смерть и госпитализация из-за ХСН [527]. Затем было подтверждено, что изолированная правожелудочковая стимуляция даже у пациентов с исходно нормальной ФВ ЛЖ приводит к диссинхронии и ремоделированию сердца с увеличением объемов ЛЖ и падением сократимости [528, 529]. В недавно завершившемся исследовании BLOCK HF было показано, что правожелудочковая стимуляция у больных, требующих постановки ЭКС, с исходной ФВ ЛЖ менее 50 % в сравнении с бивентрикулярной стимуляцией сопровождалась достоверным увеличением риска смерти, госпитализации в связи с обострением ХСН или увеличением объемов ЛЖ более чем на 15 % [530]. Таким образом, правожелудочковая стимуляция не может быть методом выбора в лечении пациентов, по крайней мере, с ХСН и исходной дисфункцией ЛЖ (имеющих показания к стимуляции) (класс III, уровень доказанности В). У пациентов с имплантированными ЭКС необходимо использовать алгоритмы по минимизации желудочковой стимуляции (класс показаний I, уровень доказанности C).
12.1.2. Бивентрикулярная электрокардиостимуляция (БВЭКС) = сердечная ресинхронизирующая терапия (СРТ)
Доказательства несинхронной работы желудочков сердца при ХСН и дисфункции ЛЖ, особенно при наличии блокад ножек пучка Гиса и широкого комплекса QRS, а также недостаточная эффективность изолированной правожелудочковой стимуляции обусловили разработку и внедрение метода так называемой сердечной ресинхронизирующей терапии – БВЭКС. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
СРТ – метод лечения пациентов с выраженной систолической дисфункцией и расширенным комплексом QRS. Показания к проведению СРТ основаны на результатах ряда проведенных МРКИ. Для отбора пациентов на СРТ используется комбинация из четырех параметров: длительности QRS, ФК ХСН, ФВ ЛЖ и основного ритма сердца (синусовый или ФП). Во всех случаях БВЭКС должна выполняться пациентам, находящимся не менее 3 месяцев на подобранной оптимальной медикаментозной терапии ХСН. СРТ проводится при помощи бивентрикулярного ЭКС без функции дефибрилляции (СРТ) или с функцией дефибрилляции (СРТ Д).
Длительность QRS. В большинство исследований, оценивавших эффекты от применения СРТ, включались пациенты с ХСН III–IV ФК с QRS >120–130 мс и ФВ ЛЖ <35 % или больные ХСН II ФК, с ФВ ЛЖ<40–30 % и такой же длительностью QRS. При этом большинство
пациентов, включенных в исследования, имели QRS >150 мс. Более того, мета-анализ 12 проведенных МРКИ, в которых обследовался 6 501 пациент, показал, что лишь в группе пациентов с QRS >150 мс применение СРТ достоверно на 42 % снижало риск смерти или госпитализации из-за ХСН [531]. В группе пациентов с QRS <150 мс достоверного влияния на заболеваемость и смертность больных ХСН отмечено не было. Другой мета-анализ 2012 года (5 365 пациентов, включенных в 4 МРКИ) продемонстрировал, что СРТ снижает комбинированную клиническую точку (общая смерть плюс госпитализации из-за обострения ХСН) у пациентов с наличием БЛНПГ,
а у больных с другой морфологией комплекса QRS применение БВЭКС не влияло на динамику заболеваемости и смертности [532]. Специальный анализ исследования MADIT CRT показал, что пациенты с БЛНПГ отмечают уменьшение риска госпитализации и смерти, как при QRS 130–150, так и при QRS >150 мс, в то время как пациенты с другой морфологией QRS не отмечают улучшения
на фоне СРТ (независимо от длительности QRS) [533].
Таким образом, можно выделить группу пациентов с максимальным доказанным эффектом от применения СРТ – это больные с БЛНПГ и QRS >150 мс. Несколько меньшая эффективность СРТ регистрируется у пациентов с БЛНПГ и QRS 120–150 мс. Хотя и в этом случае
БВЭКС положительно влияет на заболеваемость и смертность пациентов с клинически выраженной ХСН. Но СРТ не оказывает эффекта у пациентов с БПНПГ и с неспецифическими блокадами внутрижелудочкового проведения.
В проведенных четырех МРКИ участвовали пациенты с QRS <120 мс и наличием механической диссинхронии работы желудочков сердца по данным ЭхоКГ. В этих случаях ни клинической эффективности СРТ, ни влияния БВЭКС на прогноз больных ХСН выявлено не было
[534, 535]. Поэтому наличие механической диссинхронии по эхокардиографии при ширине комплекса QRS <130 мс (без БЛНПГ) не может быть показанием к проведению СРТ (класс III, уровень доказанности В).
ФВ ЛЖ. В большинстве исследований у пациентов III–IV ФК в качестве границы «сниженной систолической функции сердца» использовалась величина ФВ ЛЖ <35 %, хотя в двух МРКИ обследовались пациенты с ФВ ЛЖ <30 % [533, 536], а в исследовании REVERSE ФВ ЛЖ <40 % [537]. Таким образом, диапазон «сниженной» ФВ ЛЖ колебался от 30 до 40 %, и все же наиболее обоснованно рекомендовать применение СРТ с ХСН и ФВ ЛЖ <35 %, хотя чем ниже величина ФВ ЛЖ, тем больший эффект оказывает выполненная по показаниям БВЭКС.
Функциональный класс ХСН. Вначале применение СРТ исследовалось у пациентов с ХСН III и IV ФК. После получения позитивных результатов в четырех МРКИ положительные эффекты БВЭКС были продемонстрированы и при ХСН II ФК [536–539]. Но использование СРТ у пациентов с I ФК по данным двух исследований не влияло на заболеваемость и смертность [537, 538]. Таким
образом, чем тяжелее ФК ХСН, тем большего эффекта от СРТ можно ожидать у больных ХСН.
Характер ритма сердца. В основные МРКИ, изучающие эффекты СРТ, не включались пациенты с постоянной формой ФП, так что основные доказательства эффективности этого метода лечения доказаны для больных с синусовым ритмом. В двух небольших исследованиях было показано преимущество БВЭКС перед изолированной правожелудочковой стимуляцией по влиянию на клини-
ку и количество госпитализаций у больных с постоянной формой ФП [540, 541]. Однако по данным регистров, смертность у пациентов с ФП и имплантированным СРТ не отличается от аналогичных показателей пациентов с синусовым ритмом. Не выяснено только, необходимо ли при проведении БВЭКС больным ХСН и ФП выполнять радиочастотную аблацию атрио-вентрикулярного соединения [541]. Имеются данные о высокой эффективности применения СРТ у пациентов с постоянной формой ФП и строгим контролем ЧСС фармакологическими препаратами [542]. Эффективность СРТ при ФП и синусовом ритме практически одинакова при условии, что количество навязанных (эффективных) бивентрикулярных комплексов превышает 90–95 % [543], что оптимально контроли-
руется при Холтеровском мониторировании ЭКГ [544].
Таким образом, несмотря на лучшую изученность СРТ у больных с синусовым ритмом, успешная БВЭКС может выполняться и у пациентов с ФП при обеспечении высокого процента навязанных комплексов.
Основные рекомендации по применению СРТ у больных ХСН сводятся к следующему (таблица 28): A) СРТ / СРТ-Д показана всем больным ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и БЛНПГ при величине комплекса QRS, равной или более 150 мс, с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А).B) СРТ / СРТ-Д показана больным ХСН II ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусо-
вого ритма и БЛНПГ при величине комплекса QRS >150 мс с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А). C) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и при ширине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). D) Имплантация СРТ / СРТ-Д может быть рассмотрена у пациентов с ХСН II ФК, с ФВ ЛЖ <30–35 %, несмотря на ОМТ, при наличии синусового ритма и при величине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). E) Имплантация СРТ / СРТ-Д не показана пациентам с ХСН II–IVФК без наличия БЛНПГ вне зависимости от ширины комплекса QRS (класс рекомендаций
III, уровень доказанности А) F) Имплантация СРТ / СРТ-Д не показана у пациентов с ХСН II–IVФК при QRS <120 мс (класс рекоменда-
ций III, уровень доказанности А). G) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН II–IV ФК, c постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и проведенного
или планируемого РЧА АВ узла (класс рекомендаций IIA, уровень доказанности B).H) Имплантация СРТ / СРТ-Д может быть рассмотрена
у пациентов с ХСН II–IV ФК, с постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и фармакологическом контроле ЧСС, обеспечивающем более 95 % навязанных комплексов (класс рекомендаций IIB,
уровень доказанности C).
Таблица 28. Основные рекомендации по применению СРТ-P / СРТ-Д у больных ХСН
Применение диуретиков и вазодилататоров при ОДСН может быть затруднено двумя факторами – чрез-мерным снижением АД и ухудшением функции почек(нередко преходящим). Поэтому чрезмерно мощныйдиурез в ответ на применение диуретиков и падение АДв ответ на применение вазодилататоров можно рассматривать, как предикторы нового обострения ХСН, повы-шающие риск регоспитализаций.
В последние годы особое внимание уделялось поискубезопасныхпрепаратов для лечения ОДСН при одно-временном улучшении функции почек. Наиболее обе-щающие результаты были достигнуты при использова-нии препарата серелаксин (натуральный релаксин-2 –вещество, определяющее адаптацию к беременности,одновременно обладающее вазодилатирующими свой-ствами и улучшающее почечный кровоток). В МРКИRELAX–AHF применение серелаксина приводилок достоверному уменьшению одышки (по визуальноаналоговой шкале), хотя по Lickert (вторая первичнаяконечная точка) одышка достоверно не менялась [342]
Препараты с положительныминотропным действием
Препараты показаны пациентам с низким сердечнымвыбросом, сохраняющимися явлениями застоя, гипо-перфузии, несмотря на применение вазодилататорови / или диуретиков (класс рекомендаций IIA, уровеньдоказанности С).
Добутамин
Препарат с преимущественным воздействием на β1‑рецепторы,оказывает дозозависимый положительныйинотропный и хронотропный эффекты. При назначе-нии не требуется болюсное введение, начальная доза2–3 мкг / кг / мин. Применение добутамина требует мони-торинга гемодинамики. Основным побочным эффектомявляется тахикардия.
Допамин
Действие препарата обусловлено стимуляциейβ-рецепторов,что ведет к увеличению сердечного выброса, сократительной способности миокарда. В малых дозах(1–3 мкг / кг / мин) оказывает допаминэргический эффекти стимулирует диурез. Большиедозы допамина исполь-зуются с целью поддержания уровня АД, однако ониассоциированы с прогрессирующим приростом ЧСС.У пациентов с ЧСС, превышающей 100 уд / мин, назначе-ние допамина должно осуществляется крайне осторожно(класс рекомендаций IIB, уровень доказанности С).
Левосимендан
Кальциевый сенситизатор, применение которогоу пациентов с ОДСН увеличивает сердечный выброси ударный объем, а также снижает давление в легочнойартерии, системное и легочное сосудистое сопротивление. Эффект левосимендана сохраняется в течениемесяца. Препарат является альтернативой для пациен-тов, находящихся на терапии β-АБ, так как не конкури-рует за связь с β-рецепторами. Левосимендан назнача-ется: болюсом в дозе 3–12 мкг / кг в течение 10 минут,с последующей инфузией 0,05–0,2 мкг / кг / мин в течение24 часов. У пациентов с АД менее 100 мм рт. ст. долженназначаться без болюсной дозы во избежание гипотензии(класс рекомендаций IIA, уровень доказанности Б).
Блокаторы If -каналов
Назначение блокаторов If -каналов при ОДСН показанопациентам с ЧСС выше 100 уд / мин с целью контроля ЧСС (в том числе при параллельном назначении положительныхинотропных препаратов). Назначение блокаторов If -кана-лов при ОДСН ассоциировано с улучшением прогноза,снижением сроков госпитализации. Назначение блока-торов If -каналов возможно в сочетании с малыми дозамиβ-АБ. Титрацию блокаторов If ‑каналов следует начинатьс малых доз, при хорошей переносимости увеличиватьдозу до среднетерапевтической (для ивабрадина титрациюдозы следует начинать с 5 мг 2 раза в сутки, в дальнейшем дозу препарата увеличивают до 7,5 мг 2 раза в сутки) (классрекомендаций IIB, уровень доказанности С).
12. Хирургические и электрофизиологическиеметоды лечения ХСН
Электрофизиологические методы лечения ХСН
Электрофизиологические методы лечения ХСН сводятся на сегодняшний день к трем процедурам:
A) имплантации обычных (правожелудочковых) ЭКС;
B) имплантации бивентрикулярных электрокардиостимуляторов (БВЭКС) для проведения сердечной ресин-
хронизирующей терапии;
C) имплантации кардиовертеров–дефибрилляторов.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинать-
ся только на фоне оптимальной медикаментозной терапии (ОМТ) при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуется больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
12.1.1. Имплантация обычных (правожелудочковых) электрокардиостимуляторов
Постановка (имплантация) обычных ЭКС актуальна для пациентов с синдромом слабости синусового узла и атрио-вентрикулярными блокадами [522–525]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а с адаптируемой частотой
стимуляции, и прежде всего двухкамерных или однокамерных с предсердным электродом (при слабости синусового узла и нормальной функции АВ узла).
Однако длительная стимуляция ПЖ сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН. Поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа [526] (класс показаний IIA, уровень доказанности С).
Впервые исследование DAVID показало, что у пациентов с выраженной систолической дисфункцией (ФВ ЛЖ <35 %), у которых стимуляция ПЖ длится больше 40 % времени, возрастает риск комбинированной точки – смерть и госпитализация из-за ХСН [527]. Затем было подтверждено, что изолированная правожелудочковая стимуляция даже у пациентов с исходно нормальной ФВ ЛЖ приводит к диссинхронии и ремоделированию сердца с увеличением объемов ЛЖ и падением сократимости [528, 529]. В недавно завершившемся исследовании BLOCK HF было показано, что правожелудочковая стимуляция у больных, требующих постановки ЭКС, с исходной ФВ ЛЖ менее 50 % в сравнении с бивентрикулярной стимуляцией сопровождалась достоверным увеличением риска смерти, госпитализации в связи с обострением ХСН или увеличением объемов ЛЖ более чем на 15 % [530]. Таким образом, правожелудочковая стимуляция не может быть методом выбора в лечении пациентов, по крайней мере, с ХСН и исходной дисфункцией ЛЖ (имеющих показания к стимуляции) (класс III, уровень доказанности В). У пациентов с имплантированными ЭКС необходимо использовать алгоритмы по минимизации желудочковой стимуляции (класс показаний I, уровень доказанности C).
12.1.2. Бивентрикулярная электрокардиостимуляция (БВЭКС) = сердечная ресинхронизирующая терапия (СРТ)
Доказательства несинхронной работы желудочков сердца при ХСН и дисфункции ЛЖ, особенно при наличии блокад ножек пучка Гиса и широкого комплекса QRS, а также недостаточная эффективность изолированной правожелудочковой стимуляции обусловили разработку и внедрение метода так называемой сердечной ресинхронизирующей терапии – БВЭКС. При этой методике используется схема трехкамерной стимуляции сердца: один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус, реже эпикардиально) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
СРТ – метод лечения пациентов с выраженной систолической дисфункцией и расширенным комплексом QRS. Показания к проведению СРТ основаны на результатах ряда проведенных МРКИ. Для отбора пациентов на СРТ используется комбинация из четырех параметров: длительности QRS, ФК ХСН, ФВ ЛЖ и основного ритма сердца (синусовый или ФП). Во всех случаях БВЭКС должна выполняться пациентам, находящимся не менее 3 месяцев на подобранной оптимальной медикаментозной терапии ХСН. СРТ проводится при помощи бивентрикулярного ЭКС без функции дефибрилляции (СРТ) или с функцией дефибрилляции (СРТ Д).
Длительность QRS. В большинство исследований, оценивавших эффекты от применения СРТ, включались пациенты с ХСН III–IV ФК с QRS >120–130 мс и ФВ ЛЖ <35 % или больные ХСН II ФК, с ФВ ЛЖ<40–30 % и такой же длительностью QRS. При этом большинство
пациентов, включенных в исследования, имели QRS >150 мс. Более того, мета-анализ 12 проведенных МРКИ, в которых обследовался 6 501 пациент, показал, что лишь в группе пациентов с QRS >150 мс применение СРТ достоверно на 42 % снижало риск смерти или госпитализации из-за ХСН [531]. В группе пациентов с QRS <150 мс достоверного влияния на заболеваемость и смертность больных ХСН отмечено не было. Другой мета-анализ 2012 года (5 365 пациентов, включенных в 4 МРКИ) продемонстрировал, что СРТ снижает комбинированную клиническую точку (общая смерть плюс госпитализации из-за обострения ХСН) у пациентов с наличием БЛНПГ,
а у больных с другой морфологией комплекса QRS применение БВЭКС не влияло на динамику заболеваемости и смертности [532]. Специальный анализ исследования MADIT CRT показал, что пациенты с БЛНПГ отмечают уменьшение риска госпитализации и смерти, как при QRS 130–150, так и при QRS >150 мс, в то время как пациенты с другой морфологией QRS не отмечают улучшения
на фоне СРТ (независимо от длительности QRS) [533].
Таким образом, можно выделить группу пациентов с максимальным доказанным эффектом от применения СРТ – это больные с БЛНПГ и QRS >150 мс. Несколько меньшая эффективность СРТ регистрируется у пациентов с БЛНПГ и QRS 120–150 мс. Хотя и в этом случае
БВЭКС положительно влияет на заболеваемость и смертность пациентов с клинически выраженной ХСН. Но СРТ не оказывает эффекта у пациентов с БПНПГ и с неспецифическими блокадами внутрижелудочкового проведения.
В проведенных четырех МРКИ участвовали пациенты с QRS <120 мс и наличием механической диссинхронии работы желудочков сердца по данным ЭхоКГ. В этих случаях ни клинической эффективности СРТ, ни влияния БВЭКС на прогноз больных ХСН выявлено не было
[534, 535]. Поэтому наличие механической диссинхронии по эхокардиографии при ширине комплекса QRS <130 мс (без БЛНПГ) не может быть показанием к проведению СРТ (класс III, уровень доказанности В).
ФВ ЛЖ. В большинстве исследований у пациентов III–IV ФК в качестве границы «сниженной систолической функции сердца» использовалась величина ФВ ЛЖ <35 %, хотя в двух МРКИ обследовались пациенты с ФВ ЛЖ <30 % [533, 536], а в исследовании REVERSE ФВ ЛЖ <40 % [537]. Таким образом, диапазон «сниженной» ФВ ЛЖ колебался от 30 до 40 %, и все же наиболее обоснованно рекомендовать применение СРТ с ХСН и ФВ ЛЖ <35 %, хотя чем ниже величина ФВ ЛЖ, тем больший эффект оказывает выполненная по показаниям БВЭКС.
Функциональный класс ХСН. Вначале применение СРТ исследовалось у пациентов с ХСН III и IV ФК. После получения позитивных результатов в четырех МРКИ положительные эффекты БВЭКС были продемонстрированы и при ХСН II ФК [536–539]. Но использование СРТ у пациентов с I ФК по данным двух исследований не влияло на заболеваемость и смертность [537, 538]. Таким
образом, чем тяжелее ФК ХСН, тем большего эффекта от СРТ можно ожидать у больных ХСН.
Характер ритма сердца. В основные МРКИ, изучающие эффекты СРТ, не включались пациенты с постоянной формой ФП, так что основные доказательства эффективности этого метода лечения доказаны для больных с синусовым ритмом. В двух небольших исследованиях было показано преимущество БВЭКС перед изолированной правожелудочковой стимуляцией по влиянию на клини-
ку и количество госпитализаций у больных с постоянной формой ФП [540, 541]. Однако по данным регистров, смертность у пациентов с ФП и имплантированным СРТ не отличается от аналогичных показателей пациентов с синусовым ритмом. Не выяснено только, необходимо ли при проведении БВЭКС больным ХСН и ФП выполнять радиочастотную аблацию атрио-вентрикулярного соединения [541]. Имеются данные о высокой эффективности применения СРТ у пациентов с постоянной формой ФП и строгим контролем ЧСС фармакологическими препаратами [542]. Эффективность СРТ при ФП и синусовом ритме практически одинакова при условии, что количество навязанных (эффективных) бивентрикулярных комплексов превышает 90–95 % [543], что оптимально контроли-
руется при Холтеровском мониторировании ЭКГ [544].
Таким образом, несмотря на лучшую изученность СРТ у больных с синусовым ритмом, успешная БВЭКС может выполняться и у пациентов с ФП при обеспечении высокого процента навязанных комплексов.
Основные рекомендации по применению СРТ у больных ХСН сводятся к следующему (таблица 28): A) СРТ / СРТ-Д показана всем больным ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и БЛНПГ при величине комплекса QRS, равной или более 150 мс, с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А).B) СРТ / СРТ-Д показана больным ХСН II ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусо-
вого ритма и БЛНПГ при величине комплекса QRS >150 мс с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности А). C) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, при наличии синусового ритма и при ширине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). D) Имплантация СРТ / СРТ-Д может быть рассмотрена у пациентов с ХСН II ФК, с ФВ ЛЖ <30–35 %, несмотря на ОМТ, при наличии синусового ритма и при величине комплекса QRS 120–150 мс у пациентов с БЛНПГ с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций IIA, уровень доказанности А). E) Имплантация СРТ / СРТ-Д не показана пациентам с ХСН II–IVФК без наличия БЛНПГ вне зависимости от ширины комплекса QRS (класс рекомендаций
III, уровень доказанности А) F) Имплантация СРТ / СРТ-Д не показана у пациентов с ХСН II–IVФК при QRS <120 мс (класс рекоменда-
ций III, уровень доказанности А). G) Имплантация СРТ / СРТ-Д должна быть рассмотрена у пациентов с ХСН II–IV ФК, c постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и проведенного
или планируемого РЧА АВ узла (класс рекомендаций IIA, уровень доказанности B).H) Имплантация СРТ / СРТ-Д может быть рассмотрена
у пациентов с ХСН II–IV ФК, с постоянной формой ФП при ФВ ЛЖ <35 %, несмотря на ОМТ, при величине QRS >120 мс, наличии БЛНПГ и фармакологическом контроле ЧСС, обеспечивающем более 95 % навязанных комплексов (класс рекомендаций IIB,
уровень доказанности C).
Таблица 28. Основные рекомендации по применению СРТ-P / СРТ-Д у больных ХСН
 Возвращаясь к больным ХСН со сниженной ФВ ЛЖ и прямыми показаниями к постоянной ЭКС, следует напомнить о бóльшей эффективности БВЭКС и в этой группе больных. Причем как при синусовом ритме, так и при ФП, в том числе и после радиочастотной аблации атрио-вентрикулярного соединения (PAVE, DAVID).
Несмотря на меньшее число МРКИ для этой группы пациентов, также можно сформулировать основные показания к СРТ: A) У больных ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), должна применяться БВЭКС (первичная имплантация СРТ или дополнение ранее имплантированного кардиостимулятора до бивентрикулярного) с целью улучшения клинического состояния и уменьшения риска смерти или госпитализаций (класс рекомендаций I, уровень доказанности В). B) У пациентов с ХСН III–IV ФК, умеренной систолической дисфункцией ФВ ЛЖ (36–49 %), несмотря на ОМТ имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), имплантация СРТ может быть рассмотрена для уменьшения риска дальнейшего снижения ФВ ЛЖ и госпитализации из-за ХСН (класс рекомендаций IIB, уровень доказанности B).
Таблица 29. Основные рекомендации по постановке ИКД у больных ХСН
Возвращаясь к больным ХСН со сниженной ФВ ЛЖ и прямыми показаниями к постоянной ЭКС, следует напомнить о бóльшей эффективности БВЭКС и в этой группе больных. Причем как при синусовом ритме, так и при ФП, в том числе и после радиочастотной аблации атрио-вентрикулярного соединения (PAVE, DAVID).
Несмотря на меньшее число МРКИ для этой группы пациентов, также можно сформулировать основные показания к СРТ: A) У больных ХСН III–IV ФК, с ФВ ЛЖ <35 %, несмотря на ОМТ, имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), должна применяться БВЭКС (первичная имплантация СРТ или дополнение ранее имплантированного кардиостимулятора до бивентрикулярного) с целью улучшения клинического состояния и уменьшения риска смерти или госпитализаций (класс рекомендаций I, уровень доказанности В). B) У пациентов с ХСН III–IV ФК, умеренной систолической дисфункцией ФВ ЛЖ (36–49 %), несмотря на ОМТ имеющих прямые показания к проведению постоянной ЭКС (процент ожидаемой стимуляции >40 %), имплантация СРТ может быть рассмотрена для уменьшения риска дальнейшего снижения ФВ ЛЖ и госпитализации из-за ХСН (класс рекомендаций IIB, уровень доказанности B).
Таблица 29. Основные рекомендации по постановке ИКД у больных ХСН
 12.1.3. Постановка имплантируемого кардиовертера–дефибриллятора
Постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным ХСН предполагает срабытывания устройства (электрическая кардиоверсия или частая желудочковая стимуляция) при появлении фибрилляции желудочков или устойчивой желудочковой тахикардии для предотвращения внезапной смерти. В то же время нет доказательств положительного влияния ИКД на прогресирование ХСН и сердечно-сосудистую (не внезапную) смертность. Кроме того, постановка ИКД с одним правожелудочковым электродом (используемым и для ЭКС) при достаточном времени изолированной правожелудочковой стимуляции приводит к диссинхронии и ухудшению прогноза больных ХСН. Показания к постановке и программированию работы ИКД базируются на проведении множества МРКИ и сводятся к следующему (таблица 29): A) ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или желудочковой тахикардии (вторичная профилактика внезапной сердечной смерти – ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс рекомендаций I, степень доказанности А) [522, 545–548]. B) Постановка ИКД должна быть рассмотрена у больных ХСН, устойчивой пароксизмальной ЖТ, с удовлетворительной насосной функцией ЛЖ (ФВ ЛЖ >40 %),
на фоне оптимальной медикаментозной терапии ХСН для предупреждения ВСС (класс рекомендаций IIA, степень доказанности С) [522, 545, 546, 549]. C) ИКД рекомендуется всем больным ХСН II ФК или III ФК при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 35 % с целью первичной профилактики ВСС (класс рекомендаций
I, степень доказанности А) [545, 547, 550]. D) ИКД может быть рекомендован больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 35 %, находящимся в I ФК для предотвращенияриска внезапной сердечной смерти (класс рекомендаций IIB, степень доказанности В) [545, 549]. E) ИКД рекомендуется больным ХСН II или III ФК
с неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, с целью профилактики внезапной сердечной смерти (класс рекомендаций I, степень доказанности В) [545, 547, 550]. F) ИКД не показан пациентам с рефрактерной ХСН, в том числе при IV ФК, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс рекомендаций III, степень доказанности А) [522, 545]. G) При имплантации ИКД без функции СРТ больным ХСН II–IV ФК с ФВ ЛЖ <40 %, не имеющим показаний к постоянной ЭКС, программирование работы ИКД в качестве стимулятора должно проводиться в режиме деманд (VVI) с базовой ЧСС 40 уд в мин для уменьшения риска прогрессирования ХСН (класс показаний IIA, уровень доказанности B) [527]. H) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью первичной профилактики внезапной смерти рекомендовано программировать срабатывание ИКД только при ЖТ / ФЖ >200 уд в минуту с задержкой перед срабатыванием 2,5 сек с целью уменьшения количества срабатываний ИКД в режиме дефибриллятора, замедления прогрессирования ХСН и снижения
риска смерти (класс показаний IIA, уровень доказанности B) [551]. I) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью вторичной профилактики ВСС рекомендовано программировать срабатывание ИКД при ЖТ с ЧСС >180 уд / мин
при длительности анализа не менее 30 / 40 комплексов, с целью снижения количества срабатывний ИКД и замедления прогрессирования ХСН (класс показании IIA, уровень доказанности B) [552].
12.1.4. Имплантация БВЭКС с функцией ИКД (СРТ-Д)
Изолированная постановка ИКД больным ХСН со сниженной ФВ ЛЖ имеет ограничения, связанные как со стимуляцией ПЖ, ведущей к диссинхронии работы сердца, так и с повторными разрядами, как обоснованными, так и необоснованными, способными вызывать
повреждения миокарда. В обоих случаях происходит ухудшение течения ХСН.
Для устранения диссинхронии вследствие изолированной правожелудочковой стимуляции необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца (СРТ-Д).
Постановка ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ-Д) показана всем больным ХСН III–IV ФК со сниженной ФВ ЛЖ <35 % и желудочковой диссинхронией (QRS ≥120 мс) и БЛНПГ для улучшения течения заболевания и снижения смертности (класс рекомендаций I, степень доказанности В)[545, 553, 554].
Больным с умеренно выраженной ХСН II ФК и ФВ ЛЖ <40 % при наличии желудочковой диссинхронии (QRS >120 мс) сочетание ИКД с БВЭКС (СРТ-Д) может быть показано для улучшения течения ХСН и снижения риска госпитализаций (класс рекомендаций IIA, степень
доказанности С) [546, 553, 554].
Для минимизации количества разрядов ИКД (в том числе и необоснованных) и снижения риска прогрессирования ХСН необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, β-АБ или их комбинация) (класс рекомендаций I, уровень доказанности B) [418, 555].
12.2. Хирургические методы лечения ХСН
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности
их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХСН.
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляризации миокарда (аортокоронарное или маммарно-коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ <35 %. Для проверки эффективности проведения реваскуляризации у больных ХСН и ФВ <35 % было проведено исследование STICH [556].
Первичная точка исследования (общая смертность) не различалась в группах оперативного вмешательства в сравнении с медикаментозным лечением, хотя сумма сердечно-сосудистых смертей и госпитализаций оказалась ниже в группе АКШ. В первые три месяца бóльшее число осложнений отмечено в группе оперативного лечения, а затем имела место тенденция к лучшему прогнозу
у оперированных больных. Причем выживаемость боль-ных не зависела от наличия жизнеспособного миокарда [557]. Однако выживаемость пациентов, рандомизированных в группу медикаментозного лечения и вынужденно оперированных, оказалась достоверно лучше [558]. Это позволяет высказать сдержанный оптимизм по поводу эффективности коронарной реваскуляризации у больных ХСН с низкой ФВ ЛЖ (класс рекомендаций IIB, уровень доказанности В).
Наличие митральной регургитации увеличивает риск смерти пациентов с сердечной недостаточностью. В медикаментозном лечении митральной регургитации используются иАПФ и периферические вазодилататоры, кроме этого, степень митральной регургитации уменьшает применение СРТ при условии наличия у пациента электрической диссинхронии (QRS больше 120–150 мс / наличие БЛНПГ). Для лечения тяжелой степени митральной регургитации используются открытая операция на сердце, замена МК или пластика МК. Решение о возможности и сроках проведения пластики и замены МК необходимо принимать совместно кардиологу и кардиохирургу.
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательно отобранной подгруппы больных (класс IIB, уровень доказанности В). В исследовании STICH было показано умеренное улучшение прогноза при сочетании АКШ и митральной валвулопластики у больных ХСН ишемической этиологии с низкой ФВ ЛЖ [559].
Проведение операции по коррекции МК сопряжено с высоким риском у пациентов с низкой ФВ ЛЖ, в связи с чем в настоящее время разрабатывается новый вид лечения – эндоваскулярная постановка клипсы МК. В исследовании EVEREST II [172] было показано, что несмотря на меньшую эффективность митральных клипс в снижении степени митральной регургитации сразу после
проведения процедуры, смертность в группе клипс и открытой операции на МК была одинаковой, как и степень митральной регургитации была одинаковой через 12 месяцев после лечения. При этом степень уменьшения КДО и увеличения ФВ ЛЖ была выше в группе операции, но и число пациентов с III–IVФК по NYHA было выше в группе операции (13 % против 2 %, p=0,002). Следует
учитывать, что в группе больных, рандомизированных на постановку митральных клипс, у 21 % из них проводилась операция на МК. Поэтому пока нет достаточно убедительных данных в пользу транскатетерной коррекции функциональной митральной регургитации (класс IIB, уровень доказанности В).
Пластика левого желудочка у больных ХСН ишемической этиологии с низкой ФВ ЛЖ, несмотря на уменьшение объемов сердца, не влияла на прогноз больных и также не может считаться рекомендованной (класс III, уровень доказанности В) [560].
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие-либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать: A) отсутствие достаточного количества донорских сердец, B) проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
C) болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего, и как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно снижается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН с критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата у некоторых
пациентов происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Создан и успешно применяется в клинической практике особо миниатюрный искусственный желудочек, представляющий собой микротурбину, приводимую в движение маленьким электродвигателем, делающим до 50 тыс. оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости
ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 5 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности. Она особенно эффективна для лечения кардиогенного шока, развившегося на фоне острого ИМ, а также для подстраховки рентгенэндоваскулярных вмешательств
на коронарных артериях у пациентов повышенного риска.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (класс IIA, уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения [561].
В настоящее время применяются два типа ИЛЖ: пульсового (синхронизированного с ЭКГ) и постоянного тока. Причем последние устройства роторного типа имеют меньшую массу, меньше двигающихся деталей, меньше влияют на элементы крови, менее тромбогенны
и более долговечны. В МРКИ было доказано достоверное улучшение прогноза при применении ИЛЖ постоянного
тока по сравнению с пульсовым [562] (класс рекомендаций IIA, уровеь доказанности B).
Основным ограничением к использованию в России ИЛЖ может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарас-
тание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кардиомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков.
Вместе с тем данная методика пока находится на этапе своего становления, и для подтверждения ее эффективности необходимы результаты клинических исследований.
Рисунок 6. Алгоритм лечения ХСН cо сниженной ФВ ЛЖ <40%
12.1.3. Постановка имплантируемого кардиовертера–дефибриллятора
Постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным ХСН предполагает срабытывания устройства (электрическая кардиоверсия или частая желудочковая стимуляция) при появлении фибрилляции желудочков или устойчивой желудочковой тахикардии для предотвращения внезапной смерти. В то же время нет доказательств положительного влияния ИКД на прогресирование ХСН и сердечно-сосудистую (не внезапную) смертность. Кроме того, постановка ИКД с одним правожелудочковым электродом (используемым и для ЭКС) при достаточном времени изолированной правожелудочковой стимуляции приводит к диссинхронии и ухудшению прогноза больных ХСН. Показания к постановке и программированию работы ИКД базируются на проведении множества МРКИ и сводятся к следующему (таблица 29): A) ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или желудочковой тахикардии (вторичная профилактика внезапной сердечной смерти – ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс рекомендаций I, степень доказанности А) [522, 545–548]. B) Постановка ИКД должна быть рассмотрена у больных ХСН, устойчивой пароксизмальной ЖТ, с удовлетворительной насосной функцией ЛЖ (ФВ ЛЖ >40 %),
на фоне оптимальной медикаментозной терапии ХСН для предупреждения ВСС (класс рекомендаций IIA, степень доказанности С) [522, 545, 546, 549]. C) ИКД рекомендуется всем больным ХСН II ФК или III ФК при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 35 % с целью первичной профилактики ВСС (класс рекомендаций
I, степень доказанности А) [545, 547, 550]. D) ИКД может быть рекомендован больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 35 %, находящимся в I ФК для предотвращенияриска внезапной сердечной смерти (класс рекомендаций IIB, степень доказанности В) [545, 549]. E) ИКД рекомендуется больным ХСН II или III ФК
с неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, с целью профилактики внезапной сердечной смерти (класс рекомендаций I, степень доказанности В) [545, 547, 550]. F) ИКД не показан пациентам с рефрактерной ХСН, в том числе при IV ФК, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс рекомендаций III, степень доказанности А) [522, 545]. G) При имплантации ИКД без функции СРТ больным ХСН II–IV ФК с ФВ ЛЖ <40 %, не имеющим показаний к постоянной ЭКС, программирование работы ИКД в качестве стимулятора должно проводиться в режиме деманд (VVI) с базовой ЧСС 40 уд в мин для уменьшения риска прогрессирования ХСН (класс показаний IIA, уровень доказанности B) [527]. H) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью первичной профилактики внезапной смерти рекомендовано программировать срабатывание ИКД только при ЖТ / ФЖ >200 уд в минуту с задержкой перед срабатыванием 2,5 сек с целью уменьшения количества срабатываний ИКД в режиме дефибриллятора, замедления прогрессирования ХСН и снижения
риска смерти (класс показаний IIA, уровень доказанности B) [551]. I) При постановке ИКД (как с функцией СРТ, так и без) больным ХСН II–IV ФК с целью вторичной профилактики ВСС рекомендовано программировать срабатывание ИКД при ЖТ с ЧСС >180 уд / мин
при длительности анализа не менее 30 / 40 комплексов, с целью снижения количества срабатывний ИКД и замедления прогрессирования ХСН (класс показании IIA, уровень доказанности B) [552].
12.1.4. Имплантация БВЭКС с функцией ИКД (СРТ-Д)
Изолированная постановка ИКД больным ХСН со сниженной ФВ ЛЖ имеет ограничения, связанные как со стимуляцией ПЖ, ведущей к диссинхронии работы сердца, так и с повторными разрядами, как обоснованными, так и необоснованными, способными вызывать
повреждения миокарда. В обоих случаях происходит ухудшение течения ХСН.
Для устранения диссинхронии вследствие изолированной правожелудочковой стимуляции необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца (СРТ-Д).
Постановка ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ-Д) показана всем больным ХСН III–IV ФК со сниженной ФВ ЛЖ <35 % и желудочковой диссинхронией (QRS ≥120 мс) и БЛНПГ для улучшения течения заболевания и снижения смертности (класс рекомендаций I, степень доказанности В)[545, 553, 554].
Больным с умеренно выраженной ХСН II ФК и ФВ ЛЖ <40 % при наличии желудочковой диссинхронии (QRS >120 мс) сочетание ИКД с БВЭКС (СРТ-Д) может быть показано для улучшения течения ХСН и снижения риска госпитализаций (класс рекомендаций IIA, степень
доказанности С) [546, 553, 554].
Для минимизации количества разрядов ИКД (в том числе и необоснованных) и снижения риска прогрессирования ХСН необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, β-АБ или их комбинация) (класс рекомендаций I, уровень доказанности B) [418, 555].
12.2. Хирургические методы лечения ХСН
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности
их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХСН.
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляризации миокарда (аортокоронарное или маммарно-коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ <35 %. Для проверки эффективности проведения реваскуляризации у больных ХСН и ФВ <35 % было проведено исследование STICH [556].
Первичная точка исследования (общая смертность) не различалась в группах оперативного вмешательства в сравнении с медикаментозным лечением, хотя сумма сердечно-сосудистых смертей и госпитализаций оказалась ниже в группе АКШ. В первые три месяца бóльшее число осложнений отмечено в группе оперативного лечения, а затем имела место тенденция к лучшему прогнозу
у оперированных больных. Причем выживаемость боль-ных не зависела от наличия жизнеспособного миокарда [557]. Однако выживаемость пациентов, рандомизированных в группу медикаментозного лечения и вынужденно оперированных, оказалась достоверно лучше [558]. Это позволяет высказать сдержанный оптимизм по поводу эффективности коронарной реваскуляризации у больных ХСН с низкой ФВ ЛЖ (класс рекомендаций IIB, уровень доказанности В).
Наличие митральной регургитации увеличивает риск смерти пациентов с сердечной недостаточностью. В медикаментозном лечении митральной регургитации используются иАПФ и периферические вазодилататоры, кроме этого, степень митральной регургитации уменьшает применение СРТ при условии наличия у пациента электрической диссинхронии (QRS больше 120–150 мс / наличие БЛНПГ). Для лечения тяжелой степени митральной регургитации используются открытая операция на сердце, замена МК или пластика МК. Решение о возможности и сроках проведения пластики и замены МК необходимо принимать совместно кардиологу и кардиохирургу.
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательно отобранной подгруппы больных (класс IIB, уровень доказанности В). В исследовании STICH было показано умеренное улучшение прогноза при сочетании АКШ и митральной валвулопластики у больных ХСН ишемической этиологии с низкой ФВ ЛЖ [559].
Проведение операции по коррекции МК сопряжено с высоким риском у пациентов с низкой ФВ ЛЖ, в связи с чем в настоящее время разрабатывается новый вид лечения – эндоваскулярная постановка клипсы МК. В исследовании EVEREST II [172] было показано, что несмотря на меньшую эффективность митральных клипс в снижении степени митральной регургитации сразу после
проведения процедуры, смертность в группе клипс и открытой операции на МК была одинаковой, как и степень митральной регургитации была одинаковой через 12 месяцев после лечения. При этом степень уменьшения КДО и увеличения ФВ ЛЖ была выше в группе операции, но и число пациентов с III–IVФК по NYHA было выше в группе операции (13 % против 2 %, p=0,002). Следует
учитывать, что в группе больных, рандомизированных на постановку митральных клипс, у 21 % из них проводилась операция на МК. Поэтому пока нет достаточно убедительных данных в пользу транскатетерной коррекции функциональной митральной регургитации (класс IIB, уровень доказанности В).
Пластика левого желудочка у больных ХСН ишемической этиологии с низкой ФВ ЛЖ, несмотря на уменьшение объемов сердца, не влияла на прогноз больных и также не может считаться рекомендованной (класс III, уровень доказанности В) [560].
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие-либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать: A) отсутствие достаточного количества донорских сердец, B) проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
C) болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего, и как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно снижается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН с критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата у некоторых
пациентов происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Создан и успешно применяется в клинической практике особо миниатюрный искусственный желудочек, представляющий собой микротурбину, приводимую в движение маленьким электродвигателем, делающим до 50 тыс. оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости
ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 5 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности. Она особенно эффективна для лечения кардиогенного шока, развившегося на фоне острого ИМ, а также для подстраховки рентгенэндоваскулярных вмешательств
на коронарных артериях у пациентов повышенного риска.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (класс IIA, уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения [561].
В настоящее время применяются два типа ИЛЖ: пульсового (синхронизированного с ЭКГ) и постоянного тока. Причем последние устройства роторного типа имеют меньшую массу, меньше двигающихся деталей, меньше влияют на элементы крови, менее тромбогенны
и более долговечны. В МРКИ было доказано достоверное улучшение прогноза при применении ИЛЖ постоянного
тока по сравнению с пульсовым [562] (класс рекомендаций IIA, уровеь доказанности B).
Основным ограничением к использованию в России ИЛЖ может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарас-
тание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кардиомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков.
Вместе с тем данная методика пока находится на этапе своего становления, и для подтверждения ее эффективности необходимы результаты клинических исследований.
Рисунок 6. Алгоритм лечения ХСН cо сниженной ФВ ЛЖ <40%
 13. Алгоритм лечения ХСН
Обобщенное схематическое руководство по стратегии выбора лечебной тактики (как медикаментозной, так и немедикаментозной) для больных ХСН представлено на рисунке 6. A) Ингибиторы АПФ являются обязательными препаратами, начиная с I ст. ХСН, и их назначение является необходимым на всех этапах прогрессирования болезни. Предпочтительным выбором можно считать каптоприл, эналаприл, периндоприл и фозиноприл. При сохранной функции почек можно использовать и лизиноприл. B) При непереносимости иАПФ терапия может начинаться и с АРА, предпочтительно с наиболее изученного именно при ХСН кандесартана. Также возможно назначение лозартана или валсартана. C) При I ФК можно ограничиться назначением только блокатора РААС. D) Начиная со II ФК, целесообразно применение тройной нейрогормональной блокады (блокатор РААС + β-АБ + АМКР). E) Из β-АБ к применению в лечении ХСН рекомендованы: бисопролол, карведилол, метопролола сукцинат замедленного выведения и небиволол. Эффективность лечения зависит от степени снижения ЧСС. F) При синусовом ритме с ЧСС более 70 уд / мин и непереносимости β-АБ вместо них может использоваться ивабрадин. G) Из АМКР применение спиронолактона должно быть ограничено ХСН III–IV ФК и периодами обострения декомпенсации. Применение эплеренона показано пациентам II–IV ФК и является оптимальным при длительном лечении больных.
H) При отсутствии задержки жидкости в организме можно ограничиться назначением трех нейрогормональных модуляторов (иАПФ + β-АБ + АМКР) пациентам с ХСН II–IV ФК. I) При наличии застойных явлений к терапии должны быть присоединены диуретические средства, наиболее эффективным и безопасным из которых является торасемид. При более выраженной задержке жидко-
сти возможно сочетание петлевых (торасемид) тиазидных диуретиков и ингибиторов карбоангидразы. J) Если подобная терапия не позволяет достигать состояния компенсации, должна быть проведена оценка систолической функции ЛЖ. При сохранной ФВ ЛЖ
(>40 %) в настоящее время нет доказательств, что какое-либо дополнительное лечение может положительно влиять на прогноз больных ХСН. K) У больных со сниженной ФВ ЛЖ следующим критерием оценки является определение характера основного ритма и ЧСС. L) При синусовом ритме с ЧСС более 70 уд / мин, несмотря на терапию β-АБ (при невозможности безопасного увеличения их дозировок), целесообразно дополнительное назначение ивабрадина. M) При ФП и ЧСС, по крайней мере, более 85 уд / мин рекомендовано назначение невысоких доз дигоксина (концентрация в плазме не должна превышать 1,1 нг / мл). N) При ФП назначение антикоагулянтов является обязательной процедурой независимо от стадии болезни и ЧСС. При синусовом ритме даже при наличии
внутрисердечного тромбоза эффективность антикоагулянтов не полностью доказана. Антиагреганты не могут адекватно заменить антикоагулянты в предотвращении риска тромбоэмболических осложнений. O) Если и при этом не достигается состояние компенса-
ции, следующим критерием оценки является определение морфологии и ширины комплекса QRS. P) При наличии БЛНПГ и широком комплексе QRS (≥120 мс) у больных ХСН II–IV ФК применяется метод СРТ (трехкамерная стимуляция сердца). Эффективность СРТ выше при синусовом ритме и более тяжелой ХСН III–IV ФК. При ФП необходима либо дополнительная РЧА аблация атрио-вентрикулярного соединения или оптимальный медикаментозный контроль ЧСС, позволяющий добиваться не менее 95 % навязанных комплексов.
Q) В настоящее время используются аппараты, объединяющие ресинхронизатор и ИКД. R) Постановка ИКД (лучше вместе с СРТ) показана для первичной и вторичной профилактики ВСС у больных ХСН II–IV ФК с низкой ФВ ЛЖ вне зависимости от ширины комплекса QRS. S) Для снижения риска общей и внезапной смерти возможно применение препаратов омега-3 ПНЖК.
T) Если и в этом случае не удается добиться состояния компенсации, дополнительно может быть ис ван дигоксин, у лиц черной расы комбинация вазодилататоров или хирургические методы лечения. U) Дигоксин при синусовом ритме наиболее эффективен у больных ХСН III–IV ФК с увеличенными размерами сердца (КТИ >0,55) и низкой ФВ ЛЖ (<30 %) и позволяет на ⅓ снижать риск обострения ХСН и повторных госпитализаций. V) Пересадка сердца может быть последним шансом спасения жизни больных с терминальной ХСН.
Ограничениями являются: недостаток донорского материала, необходимость пожизненной иммуносупрессивной терапии и необходимость постоянного мониторирования состояния больных с пересаженными сердцами, что требует существенных финан
совых затрат. В качестве альтернативы возможно использование искусственных желудочков сердца. W) Эффективность и безопасность других хирургических методов лечения требует дальнейших исследований.
Следует помнить, что на всех этапах развития болезни необходимо сохранять преемственность госпитального и амбулаторного лечения больных ХСН и пропагандиро вать здоровый образ жизни.
Комитет экспертов – рецензентов
Акчурин Р. C., Аронов Д. М., Архипов М. В., Барт Б. Я., Белоусов Ю. Б., Бойцов С. А., Гендлин Г. Е., Голиков А. П.,
Голицын С. П., Гуревич М. А., Даниелян М. О., Довгалевский П. Я., Задионченко В. С., Карпов Р. С., Карпов Ю. А.,
Кобалава Ж. Д., Кузнецов В. А., Лазебник Л. Б., Насонов Е. Л., Недогода С. В., Никитин Ю. П., Оганов Р. Г., Панченко Е. П.,
Перепеч Н. Б., Подзолков В. И., Поздняков Ю. А., Раков А. Л., Руда М. Я., Рылова А. К., Симоненко В. А., Сидоренко Б. А.,
Староверов И. И., Сулимов В. А., Тарловская Е. И., Терещенко С. Н., Фомина И. Г., Чазова И. Е.
Приложение 1.
Классификация хронической сердечной недостаточности ОССН (2002 г.)
13. Алгоритм лечения ХСН
Обобщенное схематическое руководство по стратегии выбора лечебной тактики (как медикаментозной, так и немедикаментозной) для больных ХСН представлено на рисунке 6. A) Ингибиторы АПФ являются обязательными препаратами, начиная с I ст. ХСН, и их назначение является необходимым на всех этапах прогрессирования болезни. Предпочтительным выбором можно считать каптоприл, эналаприл, периндоприл и фозиноприл. При сохранной функции почек можно использовать и лизиноприл. B) При непереносимости иАПФ терапия может начинаться и с АРА, предпочтительно с наиболее изученного именно при ХСН кандесартана. Также возможно назначение лозартана или валсартана. C) При I ФК можно ограничиться назначением только блокатора РААС. D) Начиная со II ФК, целесообразно применение тройной нейрогормональной блокады (блокатор РААС + β-АБ + АМКР). E) Из β-АБ к применению в лечении ХСН рекомендованы: бисопролол, карведилол, метопролола сукцинат замедленного выведения и небиволол. Эффективность лечения зависит от степени снижения ЧСС. F) При синусовом ритме с ЧСС более 70 уд / мин и непереносимости β-АБ вместо них может использоваться ивабрадин. G) Из АМКР применение спиронолактона должно быть ограничено ХСН III–IV ФК и периодами обострения декомпенсации. Применение эплеренона показано пациентам II–IV ФК и является оптимальным при длительном лечении больных.
H) При отсутствии задержки жидкости в организме можно ограничиться назначением трех нейрогормональных модуляторов (иАПФ + β-АБ + АМКР) пациентам с ХСН II–IV ФК. I) При наличии застойных явлений к терапии должны быть присоединены диуретические средства, наиболее эффективным и безопасным из которых является торасемид. При более выраженной задержке жидко-
сти возможно сочетание петлевых (торасемид) тиазидных диуретиков и ингибиторов карбоангидразы. J) Если подобная терапия не позволяет достигать состояния компенсации, должна быть проведена оценка систолической функции ЛЖ. При сохранной ФВ ЛЖ
(>40 %) в настоящее время нет доказательств, что какое-либо дополнительное лечение может положительно влиять на прогноз больных ХСН. K) У больных со сниженной ФВ ЛЖ следующим критерием оценки является определение характера основного ритма и ЧСС. L) При синусовом ритме с ЧСС более 70 уд / мин, несмотря на терапию β-АБ (при невозможности безопасного увеличения их дозировок), целесообразно дополнительное назначение ивабрадина. M) При ФП и ЧСС, по крайней мере, более 85 уд / мин рекомендовано назначение невысоких доз дигоксина (концентрация в плазме не должна превышать 1,1 нг / мл). N) При ФП назначение антикоагулянтов является обязательной процедурой независимо от стадии болезни и ЧСС. При синусовом ритме даже при наличии
внутрисердечного тромбоза эффективность антикоагулянтов не полностью доказана. Антиагреганты не могут адекватно заменить антикоагулянты в предотвращении риска тромбоэмболических осложнений. O) Если и при этом не достигается состояние компенса-
ции, следующим критерием оценки является определение морфологии и ширины комплекса QRS. P) При наличии БЛНПГ и широком комплексе QRS (≥120 мс) у больных ХСН II–IV ФК применяется метод СРТ (трехкамерная стимуляция сердца). Эффективность СРТ выше при синусовом ритме и более тяжелой ХСН III–IV ФК. При ФП необходима либо дополнительная РЧА аблация атрио-вентрикулярного соединения или оптимальный медикаментозный контроль ЧСС, позволяющий добиваться не менее 95 % навязанных комплексов.
Q) В настоящее время используются аппараты, объединяющие ресинхронизатор и ИКД. R) Постановка ИКД (лучше вместе с СРТ) показана для первичной и вторичной профилактики ВСС у больных ХСН II–IV ФК с низкой ФВ ЛЖ вне зависимости от ширины комплекса QRS. S) Для снижения риска общей и внезапной смерти возможно применение препаратов омега-3 ПНЖК.
T) Если и в этом случае не удается добиться состояния компенсации, дополнительно может быть ис ван дигоксин, у лиц черной расы комбинация вазодилататоров или хирургические методы лечения. U) Дигоксин при синусовом ритме наиболее эффективен у больных ХСН III–IV ФК с увеличенными размерами сердца (КТИ >0,55) и низкой ФВ ЛЖ (<30 %) и позволяет на ⅓ снижать риск обострения ХСН и повторных госпитализаций. V) Пересадка сердца может быть последним шансом спасения жизни больных с терминальной ХСН.
Ограничениями являются: недостаток донорского материала, необходимость пожизненной иммуносупрессивной терапии и необходимость постоянного мониторирования состояния больных с пересаженными сердцами, что требует существенных финан
совых затрат. В качестве альтернативы возможно использование искусственных желудочков сердца. W) Эффективность и безопасность других хирургических методов лечения требует дальнейших исследований.
Следует помнить, что на всех этапах развития болезни необходимо сохранять преемственность госпитального и амбулаторного лечения больных ХСН и пропагандиро вать здоровый образ жизни.
Комитет экспертов – рецензентов
Акчурин Р. C., Аронов Д. М., Архипов М. В., Барт Б. Я., Белоусов Ю. Б., Бойцов С. А., Гендлин Г. Е., Голиков А. П.,
Голицын С. П., Гуревич М. А., Даниелян М. О., Довгалевский П. Я., Задионченко В. С., Карпов Р. С., Карпов Ю. А.,
Кобалава Ж. Д., Кузнецов В. А., Лазебник Л. Б., Насонов Е. Л., Недогода С. В., Никитин Ю. П., Оганов Р. Г., Панченко Е. П.,
Перепеч Н. Б., Подзолков В. И., Поздняков Ю. А., Раков А. Л., Руда М. Я., Рылова А. К., Симоненко В. А., Сидоренко Б. А.,
Староверов И. И., Сулимов В. А., Тарловская Е. И., Терещенко С. Н., Фомина И. Г., Чазова И. Е.
Приложение 1.
Классификация хронической сердечной недостаточности ОССН (2002 г.)
 Комментарии к классификации ХСН ОССН
Во-первых, что касается ХСН стадии 0. В классификации ее нет, т. к. при отсутствии симптомов и поражения сердца ХСН у больного про-
сто не может быть. Бессимптомная дисфункция ЛЖ уже соответствует I-й стадии болезни или по выраженности симптомов – I-му ФК.
• Бессимптомная дисфункция ЛЖ (соответствует I стадии).
• Симптомы ХСН в покое и при обычных нагрузках отсутствуют (см. соответствующее определение в I стадии).
• Систолическая дисфункция: ФВ ЛЖ ≤45 % и / или конечно-диастолический размер (КДР) ЛЖ>5,5 см (индекс конечно-диастолическо-
го размера (ИКДР) ЛЖ >3,3 см / м2).
• Диастолическая дисфункция: ТМЖП (толщина межжелудочковой перегородки) + ТЗСЛЖ (толщина задней стенки ЛЖ) ÷ 2>1,3 см
и / или ТЗСЖ >1,2 см, и / или гипертрофический тип спектра трансмитрального допплеровского потока (ТМДП) (Е / А <1,0).
При этом относительная толщина стенок ЛЖ ТМЖП + ТЗСЛЖ / КДР не отличается от нормы и составляет ≥0,45.
• Индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) не отличается от нормы (<0,70).
• Адаптивное ремоделирование ЛЖ (соответствует IIA стадии).
• Симптомы (см. соответствующее определение во IIA стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,70 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) >0,30 и <0,45.
• Диастолическая дисфункция (см. в I стадии) + псевдонормальный тип спектра ТМДП ≥1,1 и ≤2,0.
• Дезадаптивное ремоделирование ЛЖ (соответствует IIБ стадии).
• Симптомы (см. соответствующее определение во IIБ стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,80 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) ≤0,30.
• Диастолическая дисфункция (см. в I стадии) + рестриктивный тип спектра ТМДП >2,0.
Во-вторых, для определения стадии ХСН, как это было в классификации В. Х. Василенко и Н. Д. Стражеско, также как и для определе-
ния ФК ХСН, как это принято в классификации Нью-Йоркской ассоциации сердца (NYHA), специальных процедур и исследований
(например, велоэргометрии) не требуется.
В-третьих, для объективизации ФК ХСН используются ТШХ и ШОКС.
Приложение 2.
Назначение нутритивной поддержки
2.1. Назначение нутритивной поддержки
• Перед назначением нутритивной поддержки необходимо произ-
вести расчет истинной потребности в энергии (ИПЭ). ИПЭ опре-
деляется, как произведение величины основного обмена (ОО)
и фактора активности пациента. ОО рассчитывается по уравне-
нию Харриса–Бенедикта [563]:
Мужчины
ОО = 66,47 + 13,75 × вес (кг) + 5 × рост (м) – 6,77 × возраст (годы)
Женщины
ОО = 665,1 + 9,56 × вес (кг) + 1,85 × рост (м) – 4,67 × возраст (годы)
• Фактор активности (ФА) определяется в зависимости от физиче-
ской активности больного: постельный режим – 1,2, умеренная
физическая активность – 1,3, значительная физическая актив-
ность – 1,4.
• При массе тела менее 10–20 % от нормы дефицит массы тела
(ДМТ) равен 1,1, 20–30 % – 1,2, больше 30 % – 1,3.
ИПЭ = ОО × ФА × ДМТ
2.2. Принципы введения энтерального питания в рацион
• Начинать нутритивную поддержку с малых доз (не более 5–10 %
от уровня истинной энергопотребности).
• Обязательно добавлять ферментные препараты (1–2 таблетки / сут).
• Постепенно увеличивать объем энерговосполнения за счет
питательной смеси (объем вводимой смеси увеличивать 1 раз
в 5–7 дней).
• Рекомендуется следующая процедура титрации дозы:
1-я неделя – 5–10 % энергопотребности
2-я неделя – 10–20 % энергопотребности
3-я неделя – 20–30 % энергопотребности
• Контроль эффективности нутритивной поддержки должен
осуществляться уже с первой недели терапии и включать в себя
динамику антропометрических показателей (ИМТ, тощая масса
тела, окружность мышц плеча), лабораторный контроль и оценку
переносимости питательных смесей.
• У больных с декомпенсацией кровообращения, когда резко
ухудшаются показатели всасывания, оптимальным является при-
менение олигомерных питательных смесей (Пептамен, уровень
доказательности С) [564]. В период стабилизации состояния
для ежедневного приема можно рекомендовать высокомолекуляр-
ные сбалансированные смеси в количестве 25–50 % от суточной
энергопотребности [563, 565–567] (Унипит, Нутриэн-стандарт,
Берламин модуляр, Клинутрен; уровень доказательности С) [568,
569]. Вопрос о сочетании энтерального и парентерального пита-
ния ставится при выраженной сердечной кахексии, когда приме-
нение лишь энтерального питания невозможно или недостаточно
эффективно [570, 571].
2.3. Применение пробиотиков
В последние годы в ряде работ было продемонстрировано уве-
личение концентрации эндотоксина грамотрицательных бакте-
рий в крови пациентов с ХСН по мере нарастания ФК. Уровень
эндотоксина в крови этих пациентов коррелирует с изменениями
микрофлоры толстой кишки: уменьшением количества грампо-
ложительных лакто- и бифидобактерий и ростом числа условно-
патогенных грамотрицательных микроорганизмов (клебсиелл,
энтеробактеров, эшерихий). Причем изменения микрофлоры
выявляются как при исследовании полостной микрофлоры, так
и пристеночной. Предполагавшаяся многими авторами целесо-
образность применения селективной деконтаминации у пациентов
с высокими ФК ХСН не показала своей эффективности и сопрово-
ждалась большим количеством побочных эффектов.
В результате проведенных исследований была отмечена эффектив-
ность и безопасность применения пробиотиков после недельного
курса селективной деконтаминации препаратами группы фторхи-
нолонов. Данная схема позволяет нормализовать микробный пей-
заж толстой кишки, снизить уровень эндотоксина грамотрицатель-
ных бактерий в крови, уровень провоспалительных цитокинов,
а также уменьшить сроки госпитализации пациентов с III–IV ФК
ХСН. Таким образом, для пациентов с высокими ФК ХСН можно
рекомендовать провести оценку микрофлоры кишечника и в слу-
чае выявления изменений – применять селективную деконтамина-
цию (фторхинолоны) с последующим назначением пробиотиков.
Приложение 3.
Методика проведения физических нагрузок в форме ходьбы
I этап. Вхождение.
• Продолжительность этапа – 6–10 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 25 мин / 1 км
• Расстояние – 1 км
• При стабильной клинической картине возможен переход
ко второму этапу
II этап.
• Продолжительность этапа 12 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 20 мин / 1 км
• Расстояние – 2 км
• При стабильном клиническом состоянии – переход на постоян-
ную форму занятий
• Для пациентов, прошедших 500 и более метров за 6 мин, по-
казаны динамические физические нагрузки (например, ходьба
с прогрессивным повышением нагрузки до скорости 6 км / ч
и продолжительностью до 40 минут в день). Титрация нагрузки –
до 6–8 месяцев
• В связи с невозможностью оценивать в каждом конкретном
случае максимальное потребление кислорода расчет нагрузок дан
в конкретных цифрах – расстояние, нагрузка, продолжительность
Приложение 4.
Методика проведения тренировок дыхательных мышц
Пациент занимает удобное положение сидя, помещает зажим
на нос. После обычных вдоха и выдоха пациент делает медленный
вдох, в течение 4–5 с, через загубник тренажера Threshold IMT.
После этого, не выдыхая воздух, пациент делает медленный выдох,
в течение 5–6 с, в тренажер Threshold PEP, после чего следует пауза
3 с. Затем вдох и выдох с использованием тренажеров повторяются
еще 3 раза. После этого следует обычное спокойное дыхание в тече-
ние 2 мин. Таким образом осуществляется профилактика гипервен-
тиляции. В дальнейшем весь цикл, состоящий из 4 вдохов, 4 выдохов
и 2 мин отдыха, повторяется еще 3 раза. Таким образом, продолжи-
тельность одной тренировки составляет около 20 мин. Необходимо
проводить 2 тренировки в день утром и вечером не менее 5 раз
в неделю. Увеличение сопротивления происходит на 2 мм водного
столба каждую 3–5-ю тренировку с учетом состояния пациента.
СПИСОК Л ИТЕРАТУРЫ
Комментарии к классификации ХСН ОССН
Во-первых, что касается ХСН стадии 0. В классификации ее нет, т. к. при отсутствии симптомов и поражения сердца ХСН у больного про-
сто не может быть. Бессимптомная дисфункция ЛЖ уже соответствует I-й стадии болезни или по выраженности симптомов – I-му ФК.
• Бессимптомная дисфункция ЛЖ (соответствует I стадии).
• Симптомы ХСН в покое и при обычных нагрузках отсутствуют (см. соответствующее определение в I стадии).
• Систолическая дисфункция: ФВ ЛЖ ≤45 % и / или конечно-диастолический размер (КДР) ЛЖ>5,5 см (индекс конечно-диастолическо-
го размера (ИКДР) ЛЖ >3,3 см / м2).
• Диастолическая дисфункция: ТМЖП (толщина межжелудочковой перегородки) + ТЗСЛЖ (толщина задней стенки ЛЖ) ÷ 2>1,3 см
и / или ТЗСЖ >1,2 см, и / или гипертрофический тип спектра трансмитрального допплеровского потока (ТМДП) (Е / А <1,0).
При этом относительная толщина стенок ЛЖ ТМЖП + ТЗСЛЖ / КДР не отличается от нормы и составляет ≥0,45.
• Индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) не отличается от нормы (<0,70).
• Адаптивное ремоделирование ЛЖ (соответствует IIA стадии).
• Симптомы (см. соответствующее определение во IIA стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,70 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) >0,30 и <0,45.
• Диастолическая дисфункция (см. в I стадии) + псевдонормальный тип спектра ТМДП ≥1,1 и ≤2,0.
• Дезадаптивное ремоделирование ЛЖ (соответствует IIБ стадии).
• Симптомы (см. соответствующее определение во IIБ стадии).
• Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)
>0,80 и / или относительная толщина стенок ЛЖ (ТМЖП + ТЗСЛЖ / КДР ЛЖ) ≤0,30.
• Диастолическая дисфункция (см. в I стадии) + рестриктивный тип спектра ТМДП >2,0.
Во-вторых, для определения стадии ХСН, как это было в классификации В. Х. Василенко и Н. Д. Стражеско, также как и для определе-
ния ФК ХСН, как это принято в классификации Нью-Йоркской ассоциации сердца (NYHA), специальных процедур и исследований
(например, велоэргометрии) не требуется.
В-третьих, для объективизации ФК ХСН используются ТШХ и ШОКС.
Приложение 2.
Назначение нутритивной поддержки
2.1. Назначение нутритивной поддержки
• Перед назначением нутритивной поддержки необходимо произ-
вести расчет истинной потребности в энергии (ИПЭ). ИПЭ опре-
деляется, как произведение величины основного обмена (ОО)
и фактора активности пациента. ОО рассчитывается по уравне-
нию Харриса–Бенедикта [563]:
Мужчины
ОО = 66,47 + 13,75 × вес (кг) + 5 × рост (м) – 6,77 × возраст (годы)
Женщины
ОО = 665,1 + 9,56 × вес (кг) + 1,85 × рост (м) – 4,67 × возраст (годы)
• Фактор активности (ФА) определяется в зависимости от физиче-
ской активности больного: постельный режим – 1,2, умеренная
физическая активность – 1,3, значительная физическая актив-
ность – 1,4.
• При массе тела менее 10–20 % от нормы дефицит массы тела
(ДМТ) равен 1,1, 20–30 % – 1,2, больше 30 % – 1,3.
ИПЭ = ОО × ФА × ДМТ
2.2. Принципы введения энтерального питания в рацион
• Начинать нутритивную поддержку с малых доз (не более 5–10 %
от уровня истинной энергопотребности).
• Обязательно добавлять ферментные препараты (1–2 таблетки / сут).
• Постепенно увеличивать объем энерговосполнения за счет
питательной смеси (объем вводимой смеси увеличивать 1 раз
в 5–7 дней).
• Рекомендуется следующая процедура титрации дозы:
1-я неделя – 5–10 % энергопотребности
2-я неделя – 10–20 % энергопотребности
3-я неделя – 20–30 % энергопотребности
• Контроль эффективности нутритивной поддержки должен
осуществляться уже с первой недели терапии и включать в себя
динамику антропометрических показателей (ИМТ, тощая масса
тела, окружность мышц плеча), лабораторный контроль и оценку
переносимости питательных смесей.
• У больных с декомпенсацией кровообращения, когда резко
ухудшаются показатели всасывания, оптимальным является при-
менение олигомерных питательных смесей (Пептамен, уровень
доказательности С) [564]. В период стабилизации состояния
для ежедневного приема можно рекомендовать высокомолекуляр-
ные сбалансированные смеси в количестве 25–50 % от суточной
энергопотребности [563, 565–567] (Унипит, Нутриэн-стандарт,
Берламин модуляр, Клинутрен; уровень доказательности С) [568,
569]. Вопрос о сочетании энтерального и парентерального пита-
ния ставится при выраженной сердечной кахексии, когда приме-
нение лишь энтерального питания невозможно или недостаточно
эффективно [570, 571].
2.3. Применение пробиотиков
В последние годы в ряде работ было продемонстрировано уве-
личение концентрации эндотоксина грамотрицательных бакте-
рий в крови пациентов с ХСН по мере нарастания ФК. Уровень
эндотоксина в крови этих пациентов коррелирует с изменениями
микрофлоры толстой кишки: уменьшением количества грампо-
ложительных лакто- и бифидобактерий и ростом числа условно-
патогенных грамотрицательных микроорганизмов (клебсиелл,
энтеробактеров, эшерихий). Причем изменения микрофлоры
выявляются как при исследовании полостной микрофлоры, так
и пристеночной. Предполагавшаяся многими авторами целесо-
образность применения селективной деконтаминации у пациентов
с высокими ФК ХСН не показала своей эффективности и сопрово-
ждалась большим количеством побочных эффектов.
В результате проведенных исследований была отмечена эффектив-
ность и безопасность применения пробиотиков после недельного
курса селективной деконтаминации препаратами группы фторхи-
нолонов. Данная схема позволяет нормализовать микробный пей-
заж толстой кишки, снизить уровень эндотоксина грамотрицатель-
ных бактерий в крови, уровень провоспалительных цитокинов,
а также уменьшить сроки госпитализации пациентов с III–IV ФК
ХСН. Таким образом, для пациентов с высокими ФК ХСН можно
рекомендовать провести оценку микрофлоры кишечника и в слу-
чае выявления изменений – применять селективную деконтамина-
цию (фторхинолоны) с последующим назначением пробиотиков.
Приложение 3.
Методика проведения физических нагрузок в форме ходьбы
I этап. Вхождение.
• Продолжительность этапа – 6–10 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 25 мин / 1 км
• Расстояние – 1 км
• При стабильной клинической картине возможен переход
ко второму этапу
II этап.
• Продолжительность этапа 12 недель
• Частота занятий – 5 раз в неделю
• Скорость движения – 20 мин / 1 км
• Расстояние – 2 км
• При стабильном клиническом состоянии – переход на постоян-
ную форму занятий
• Для пациентов, прошедших 500 и более метров за 6 мин, по-
казаны динамические физические нагрузки (например, ходьба
с прогрессивным повышением нагрузки до скорости 6 км / ч
и продолжительностью до 40 минут в день). Титрация нагрузки –
до 6–8 месяцев
• В связи с невозможностью оценивать в каждом конкретном
случае максимальное потребление кислорода расчет нагрузок дан
в конкретных цифрах – расстояние, нагрузка, продолжительность
Приложение 4.
Методика проведения тренировок дыхательных мышц
Пациент занимает удобное положение сидя, помещает зажим
на нос. После обычных вдоха и выдоха пациент делает медленный
вдох, в течение 4–5 с, через загубник тренажера Threshold IMT.
После этого, не выдыхая воздух, пациент делает медленный выдох,
в течение 5–6 с, в тренажер Threshold PEP, после чего следует пауза
3 с. Затем вдох и выдох с использованием тренажеров повторяются
еще 3 раза. После этого следует обычное спокойное дыхание в тече-
ние 2 мин. Таким образом осуществляется профилактика гипервен-
тиляции. В дальнейшем весь цикл, состоящий из 4 вдохов, 4 выдохов
и 2 мин отдыха, повторяется еще 3 раза. Таким образом, продолжи-
тельность одной тренировки составляет около 20 мин. Необходимо
проводить 2 тренировки в день утром и вечером не менее 5 раз
в неделю. Увеличение сопротивления происходит на 2 мм водного
столба каждую 3–5-ю тренировку с учетом состояния пациента.
СПИСОК Л ИТЕРАТУРЫ


















