Просмотров: 7 283
Применение ЛС с нарушением предписаний инструкции («off-label use of drugs»)
«Современная медикаментозная терапия иной раз острее скальпеля хирурга» Б.Е. Вотчал
Безопасность терапии ЛС является на сегодняшний день одной из важнейших в лечебной практике. В медицинской практике появились высокоактивные ЛС, которые наряду с лечебным эффектом при определенных условиях могут вызвать осложнения, вплоть до фатальных. Практика фармакотерапии в России далека от совершенства и определяется многими немодифицируемыми факторами, такими как: массовая сенсибилизация населения к биологическим и химическим веществам, неудолитворительным состоянием экологической среды, низкой санитарной культурой населения, широким распространением вредных привычек, недоступностью широким слоям населения занятий физической культурой, отсутствием мотивации (в том числе на государственном уровне) к здоровому образу жизни, высоким стрессорным уровнем в производственных отношениях, недоверием населения к отечественным медицинским учреждениям и уровни оказания помощи в них, широким распространением терапии БАДами, доверием к всевозможным целителям и народной медицины, доступностью рецептурных препаратов без рецептов, широкое распространение самолечения (в том числе, по информации полученной из интернета), медицинскими ошибками, нерациональным использованием ЛС, применение ЛС с нарушением предписаний официально утвержденных инструкций по медицинскому применению.
В зарубежной литературе для применения ЛС с нарушением инструкций имеется специальный термин.
«Off-label use of drugs» – назначение ЛС по показаниям, в возрастных группах, дозировках, путях введения и т.д., отличающихся от рекомендованных и утвержденной инструкции по медицинскому применению ЛС.
В медицинской практике появление ситуаций, при которых применение ЛС нарушением предписаний неизбежно.
Существует ряд редких заболеваний, эффективная терапия которых не разработаны либо отсутствуют специфические средства их лечения, но при этом имеются научные данные о возможном положительном курабельном или паллиативном эффекте при применении определенного ЛС.
Отсутствие клинических исследований ,по этическим соображениям, в отдельных группах пациентов (беременные, дети).
Медицинские ошибки, вызванные недостатком специальных знаний, недостаточной информацией по фармакотерапии, поверхностным изучением медицинской инструкции, небрежностью или самонадеятеностью.
Существуют группы пациентов, у которых наиболее часто отмечается использование ЛС с нарушением предписаний инструкции :
Дети,
Беременные,
Пациенты с редкими (орфанными) заболеваниями,
Онкологические больные,
Пациенты с заболеваниями, для которых эффективная медикаментозная терапия пока не разработана.
За рубежом, среди препаратов, зарегистрированных на рынке, к применению у детей разрешено лишь 35% в Европе и 20-30% в США.
В России действует БД НР «АИС Росздравнадзор», для регистрации сведений о различных осложнениях фармакотерапии вследствие применения ЛС с нарушением предписаний инструкции. Соответствующие приказы МЗ предписывают предоставления врачами всех специальностей информации о побочном и неблагоприятном действии ЛС. Но приказ в полной мере, по ряду причин ( в том числе отсутствии заинтересованности обеих сторон) не заработал. Так за 3 года, было подано всего 2375 сообщений о НР ЛС у детей. В 16,8% случаев сообщалось о развитии осложнений при применении ЛС с нарушением инструкций (в 21% нарушение дозировки, в 17% без зарегистрированных показаний). Среди ЛС это в 19% противомикробные препараты, в 16% психофармакологические средства, в 5% противовирусные препараты.
За рубежом, 91%гинекологов Германии используют ЛС «off-label», причем в 54% у беременных. При этом, 34% специалистов считают, что такое лечение не связано со значительными рисками. В 34% это препараты- утеротоники (ЛС повышающие тонус и сократительную способность миометрия).
В России, у 62% беременных назначалось от 6 до 15 ЛС, 15% женщин получали 16-20, а 5% 21-26 ЛС, за время беременности. Практически каждой беременной (95%) назначалось около 5 препаратов с неустановленной безопасностью, 76% назначалось около 2 ЛС с возможным риском для плода, а 6% 1-2 ЛС с доказанным риском для плода. Среди ЛС, только 44% антимикробных препаратов имели официальное разрешения по использованию во время беременности. Практиковалось также применение АСК и других НПВП, которые могут оказывать тератогенное действие, в том числе и на сердце плода.
На сегодняшний день в клинической практике сложилась ситуация, когда с одной стороны, массовое использование ЛС «off-label» служит источником инноваций в области практической медицины (особенно в случае неэффективности существующих схем лечения), а с другой представляет угрозу здоровью и жизнью пациента. Особенно когда данных о безопасности применения ЛС с нарушением инструкции недостаточно или вовсе нет.
В российском законодательстве имеется пробел по вопросу терапии «off-label».
Федеральный закон от 12.04.2010 №61-ФЗ « Об обращении ЛС» и закон «Об основах охраны здоровья в РФ» от 21.11.2011 №323-ФЗ, не содержит четких норм права по этому вопросу. Акушеры, гинекологи, педиатры (чаще всего среди врачей различных специальностей) оказываются незащищенными в случае судебных исков, как со стороны пациентов, так и со стороны контролирующих органов.
За рубежом накоплен определенный опыт в случаях терапии ЛС «off-label».
В ФРГ выработаны критерии, по которым возможно применение ЛС с нарушением предписания инструкции.
Критерий 1. «Наличие у пациента тяжелого, угрожающего жизни или нарушающего длительное время качество его жизни»
Критерий 2.»Отсутствие специфических средств лечения заболевания, по поводу которого назначается ЛС с нарушением инструкции».
Критерий 3.»Научные данные дают основания предполагать возможность достичь куративный или паллиативный эффект в терапии»
Эти критерии должны применяться в комплексе или по заключению экспертных комиссий.
В США назначение ЛС «off-label» не является противозаконным. Врачи в своей практике могут применять ЛС с нарушением инструкций. Законодательно закреплен перечень источников информации о «off-label» терапии.
Каждый врач практического здравоохранения должен внимательно относиться к назначению ЛС, так как от этого зависит жизнь и здоровье их пациентов.
Комментарий
Официальные разъяснения
Утверждено Приказом Министерства здравоохранения
и социального развития
Российской Федерации
от 09.08.2005 N 494
ПОЛОЖЕНИЕ О ПОРЯДКЕ ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
У БОЛЬНЫХ ПО ЖИЗНЕННЫМ ПОКАЗАНИЯМ
1. Настоящее Положение определяет порядок применения лекарственных средств у больных по жизненным показаниям.
2. Контроль за качеством, эффективностью, безопасностью и порядком использования лекарственных средств, необходимых для лечения больных по жизненным показаниям, осуществляет Федеральная служба по надзору в сфере здравоохранения и социального развития.
3. В случае необходимости индивидуального применения по жизненным показаниям лекарственного средства, не зарегистрированного на территории Российской Федерации, решение о назначении указанного препарата принимается консилиумом федеральной специализированной медицинской организации, оформляется протоколом и подписывается главным врачом или директором федеральной специализированной медицинской организации.
4. Перед началом применения лечащий врач должен проинформировать пациента (в случаях, установленных законодательством Российской Федерации, родителей или законных представителей) о лекарственном средстве, об ожидаемой эффективности предлагаемой терапии, о безопасности лекарственного средства, степени риска для пациента, а также о действиях в случае непредвиденных эффектов влияния лекарственного средства на состояние его здоровья.
5. Не разрешенные к применению, но находящиеся на рассмотрении в установленном порядке лекарственные средства могут использоваться в интересах излечения пациента только после получения его добровольного письменного согласия, а для лечения лиц, не достигших возраста, установленного частью второй статьи 24 Основ законодательства Российской Федерации об охране здоровья граждан, только при непосредственной угрозе их жизни и с письменного согласия их законных представителей.
6. Ввоз незарегистрированных лекарственных средств, предназначенных для больных по жизненным показаниям, осуществляется в порядке, определяемом законодательством Российской Федерации.
7. Ввозимые лекарственные средства подлежат государственному контролю качества в порядке, определяемом законодательством Российской Федерации.
8. Федеральная специализированная медицинская организация обеспечивает ведение предметно-количественного учета лекарственного средства, использованного для лечения больных по жизненным показаниям, и отчетов об острых побочных эффектах, эффективности проведенного лечения и об отсроченных побочных эффектах.
Разъяснения Министерства здравоохранения России по вопросам ввоза незарегистрированных лекарственных средств на территорию Российской Федерации
Письмо Министерства здравоохранения РФ от 04.02.2015 N 20-2/74
Департамент лекарственного обеспечения и регулирования обращения медицинских изделий Минздрава России в связи в принятием Федерального закона от 31.12.2014 N 532-ФЗ “О внесении изменений в отдельные законодательные акты Российской Федерации в части противодействия обороту фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и фальсифицированных биологически активных добавок” (далее – Закон N 532-ФЗ), информирует о следующем.
Закон N 532-ФЗ направлен на комплексное эффективное противодействие обращению на территории Российской Федерации небезопасной фармацевтической и медицинской (в том числе фальсифицированной и недоброкачественной), а также незарегистрированной продукции.
Вышеуказанный закон разработан с учетом положений подписанной Российской Федерацией в Москве в октябре 2011 года Конвенции Совета Европы о борьбе с фальсификацией медицинской продукции и сходными преступлениями, угрожающими здоровью населения” в Москве состоялось подписание Конвенции Совета Европы “О борьбе с фальсификацией медицинской продукции и сходными преступлениями, угрожающими здоровью населения” (Конвенция “Медикрим”).
Основными целями Конвенции “Медикрим” являются установление уголовной ответственности за фальсификацию медицинской продукции и сходные преступления (производство, хранение и предложения по реализации данной продукции, подделка соответствующей документации и упаковочных материалов), защита прав потерпевших вследствие данных правонарушений, развитие сотрудничества на международном и внутригосударственном уровнях.
Изменения законодательной базы Российской Федерации на основе гармонизированных с международной практикой правовых и организационных подходов позволят эффективно предотвращать и бороться с широким кругом правонарушений и преступлений в сферах обращения лекарственных средств и медицинских изделий.
Законом N 532-ФЗ среди прочих механизмов противодействия обращению фальсифицированных, недоброкачественных и небезопасных лекарственных средств устанавливается запрет на незаконные производство, сбыт или ввоз на территорию Российской Федерации в целях сбыта незарегистрированных лекарственных средств или медицинских изделий, а также соответствующие санкции в Уголовном Кодексе Российской Федерации и Кодексе Российской Федерации об административных правонарушениях.
Предметом преступления являются лекарственные средства, определение которых содержится в Федеральном законе от 12.04.2010 N 61-ФЗ (ред. от 22.10.2014) “Об обращении лекарственных средств” (с изм. и доп., вступ. в силу с 01.01.2015) (далее – Федеральный закон N 61-ФЗ).
Субъективная сторона рассматриваемого преступления характеризуется виной в форме прямого умысла и специальной целью – желание сбыта незарегистрированных лекарственных средств.
При отсутствии цели сбыта лицо не должно подлежать уголовной ответственности. Таким образом, ответственность по ч. 1 ст. 238.1 УК РФ, т.е. за незаконный ввоз на территорию Российской Федерации незарегистрированных лекарственных средств наступит лишь в том случае, когда лицо преследует цель сбыта ввезенных средств (при прочих условиях).
В случае же приобретения физическим лицом незарегистрированных лекарственных препаратов за пределами территории Российской Федерации, которые предназначены для его личного использования, уголовная ответственность не наступает.
Данное правило вытекает из требований п. 3 ч. 5 ст. 13 и п. 1 ч. 1 статьи 50 Федерального закона N 61-ФЗ. В соответствии с названными нормами лекарственные препараты, приобретенные физическими лицами за пределами территории Российской Федерации и предназначенные для личного использования, государственной регистрации не подлежат. Для таких средств не предусмотрены особые правила их ввоза.
Следовательно, такое лицо также не должно подвергаться уголовному преследованию по новой статье 238.1 УК РФ.
Департамент государственного регулирования обращения лекарственных средств Минздрава России отмечает, что Федеральный закон N 61-ФЗ урегулировал возможность ввоза в Российскую Федерацию конкретной партии незарегистрированных лекарственных средств, предназначенных для оказания медицинской помощи по жизненным показаниям конкретного пациента.
В соответствии с ч. 3 ст. 47 Федерального закона N 61-ФЗ, ввоз незарегистрированных лекарственных средств производится на основании разрешения, выданного уполномоченным федеральным органом исполнительной власти по заявлениям лиц. К числу таких лиц отнесены медицинские организации, производители лекарственных средств; организации оптовой торговли лекарственными средствами; научно-исследовательские организации, образовательные организации высшего образования, а также иные указанные в пунктах 1-4 статьи 48 Федерального закона N 61-ФЗ.
Рассмотрение Минздравом России заявления и принятие решения о выдаче разрешения на ввоз конкретной партии незарегистрированных лекарственных средств, предназначенных для оказания медицинской помощи по жизненным показаниям конкретного пациента либо об отказе в выдаче указанного разрешения производятся в срок, не превышающий пяти рабочих дней. Плата за выдачу указанного разрешения не взимается.
Соответствующие положения о возможности ввоза незарегистрированных лекарственных препаратов для оказания медицинской помощи по жизненным показаниям конкретного пациента предусмотрены пунктом 10 Правил ввоза лекарственных средств для медицинского применения на территорию Российской Федерации, утвержденных постановлением Правительства Российской Федерации от 29.09.2010 N 771 “О порядке ввоза лекарственных средств для медицинского применения на территорию Российской Федерации”.
Во исполнение вышеуказанных норм издан приказ Минздрава России от 02.08.2012 N 58н “Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче разрешений на ввоз на территорию Российской Федерации конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств, предназначенных для проведения экспертизы лекарственных средств в целях осуществления государственной регистрации лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента” (зарегистрирован в Минюсте России 04.03.2013, N 27438).
Порядок назначения и применения таких препаратов установлен приказом Минздравсоцразвития России от 09.08.2005 N 494 “О порядке применения лекарственных средств у больных по жизненным показаниям”.
Решение о необходимости назначения препарата принимается консилиумом федеральной специализированной медицинской организации, или учреждения Российской академии медицинских наук, либо учреждения субъекта Российской Федерации, в котором оказывается медицинская помощь конкретному пациенту, оформляется протоколом и подписывается главным врачом или директором специализированной медицинской организации.
Одновременно отмечаем, что согласно пункту 9 постановления Правительства Российской Федерации от 29.09.2010 N 771 “Об утверждении правил ввоза лекарственных средств для медицинского применения на территорию Российской Федерации” лекарственные препараты для медицинского применения (как не зарегистрированные в Российской Федерации, так и зарегистрированные) могут быть ввезены на территорию Российской Федерации без разрешения Министерства здравоохранения Российской Федерации, если они предназначены в целях личного использования лекарственных препаратов физическими лицами, прибывшими на территорию Российской Федерации.
Также частью 5 Положения о порядке ввоза на таможенную территорию Таможенного союза лекарственных средств и фармацевтических субстанций предусмотрено, что помещение под таможенные процедуры незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований, экспертизы лекарственных средств, осуществления государственной регистрации лекарственных средств, оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редко и (или) особо тяжелой патологией, а также зарегистрированных лекарственных средств, предназначенных для проведения клинических исследований, зарегистрированных или незарегистрированных лекарственных средств, предназначенных для оказания гуманитарной помощи (содействия), помощи при чрезвычайных ситуациях, осуществляется на основании заключений (разрешений), выдаваемых уполномоченным органом в соответствии с законодательством государства – члена Таможенного союза (в ред. решения Коллегии Евразийской экономической комиссии от 18.12.2014 N 235).
Таким образом, действующим законодательством установлена возможность ввоза на территорию Российской Федерации не имеющих государственной регистрации лекарственных препаратов, приобретенных за пределами территории Российской Федерации физическими лицами для личного использования и юридическими лицами для оказания медицинской помощи по жизненным показаниям конкретного пациента, и определен порядок осуществления такого ввоза, а именно.
Для получения разрешения на ввоз на территорию Российской Федерации незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента заявитель представляет в Министерство здравоохранения Российской Федерации заявление (оформляется заявителем на бумажном носителе, заполняется на печатающем устройстве и в виде электронной копии по форме согласно приложению N 1) и прилагает следующие документы:
– заключение консилиума врачей федерального учреждения, в котором оказывается медицинская помощь конкретному пациенту, подписанное главным врачом (директором) или лицом, исполняющим его обязанности, и его электронная копия, подписанная электронной цифровой подписью, о назначении этому пациенту незарегистрированного лекарственного препарата для оказания ему медицинской помощи по жизненным показаниям и необходимости его ввоза;
– обращение уполномоченного органа исполнительной власти субъекта Российской Федерации в форме электронного документа, подписанного электронной цифровой подписью, о необходимости ввоза незарегистрированного лекарственного препарата для оказания медицинской помощи по жизненным показаниям конкретного пациента с приложением копии заключения консилиума врачей учреждения субъекта Российской Федерации, в котором оказывается медицинская помощь этому пациенту, о назначении ему незарегистрированного лекарственного препарата для оказания медицинской помощи по жизненным показаниям и необходимости его ввоза, подписанного главным врачом (директором) или лицом, исполняющим его обязанности;
– копия паспорта или свидетельства о рождении пациента, которому назначен незарегистрированный лекарственный препарат по жизненным показаниям для оказания медицинской помощи, заверенная федеральным учреждением (учреждением), оказывающим медицинскую помощь, в форме электронного документа, подписанного электронной цифровой подписью.
Документы для получения государственной услуги должны представляться на русском языке либо иметь заверенный в установленном порядке перевод на русский язык.
В случае отсутствия сертификата на электронную цифровую подпись необходимо обратиться по адресу http://www.crt.rosminzdrav.ru/ “Удостоверяющий Центр Министерства здравоохранения Российской Федерации”.
Прием электронных заявлений, подписанных электронной цифровой подписью, осуществляется по электронному адресу vozlekpreparatov@rosminzdrav.ru.
В рамках деятельности Совета общественных организаций по защите прав пациентов при Министерстве здравоохранения Российской Федерации осуществляется эффективное взаимодействие с медицинским сообществом, общественными организациями, в том числе благотворительными, по вопросам совершенствования оказания медицинской помощи и обеспечения доступности необходимых лекарственных препаратов, в том числе незарегистрированных.
Принятые изменения законодательства Российской Федерации создают условия для повышения ответственности субъектов обращения лекарственных средств, пресечения незаконных трансграничных перемещений, защиты населения от небезопасной фармацевтической продукции и недобросовестных участников рынка.
ДИССКУСИЯ
Фармакоэпидемиология нерегламентированных назначений ЛС (портал ZDRAV.RU 10/08/2012)
Назначение ЛС по незарегистрированным показаниям широко распространено во всем мире. Например, в США доля таких назначений составляет более 20%, а для препаратов отдельных фармакологических групп (психотропных, противоопухолевых) превышает 30% [1]. Наиболее часто нарушения инструкции по медицинскому применению отмечаются при применении антиконвульсантов (в 74 % случаев), антипсихотических средств (60%) и антибиотиков (41%) [1].
Особые масштабы проблема нерегламентированного применения ЛС, прежде всего по незарегистрированным показаниям, приобрела в педиатрии. Так, в США до 75% всех препаратов, назначаемых детям, официально не разрешены для применения в данной возрастной группе [2, 3], а в странах Европейского союза – более 50% [4]. У госпитализированных детей, включая новорожденных, доля таких назначений может достигать 90% [4–9]. Применение нерекомендованных препаратов у новорожденных, возможно, наблюдается чаще, чем у детей более старшего возраста [10–13]. Оно также широко практикуется у подростков [14–16].
Нерегламентированное применение ЛС распространено не только у госпитализированных, но и у амбулаторных больных. Так, в США 22–56% амбулаторных педиатрических пациентов получают нерегламентированные назначения ЛС [17]. В Нидерландах, по результатам большого исследования, в ходе которого были проанализированы данные об отпуске ЛС 66 222 аптеками, 80,7% всех выписанных детям препаратов из группы ЛС, применяемых в офтальмологии и отоларингологии, не были официально разрешены для использования у этой категории пациентов. Сходная ситуация наблюдалась при назначении сердечнососудистых (74,7%) и дерматологических (73,3 %) препаратов, а также ЛС, влияющих на кровь и кроветворение (75,7%) [14]. Последняя группа ЛС вошла в число лидеров применения по незарегистрированным показаниям преимущественно за счет назначения витамина к новорожденным, находящимся на грудном вскармливании.
Особенно интенсивно растет число назначений детям и подросткам психотропных средств по незарегистрированным показаниям [18]. Проблемы НП существуют в педиатрической кардиологии [19], гастроэнтерологии [20],пульмонологии и отоларингологии [21]. Ежегодно только в США на нерегламентированные лекарственные назначения детям тратится 270 млн долл. (40% от всех затрат на ЛС) [14].
Официально не рекомендованные препараты часто назначают беременным женщинам для профилактики рецидивирующих спонтанных абортов, подавления преждевременной родовой деятельности, профилактики инфекций у плода и новорожденного, профилактики и лечения гестозов, стимуляции созревания шейки и индукции родов [22]. Все более широкое применение у беременных и кормящих грудью женщин приобретают антидепрессанты, назначаемые в том числе по незарегистрированным показаниям или противопоказанные в период гестации [23].
Проблема НП ЛС остро стоит и в геронтологии [24, 25]. В целенаправленном исследовании, проведенном в Великобритании, показано, что 84% лиц пожилого и старческого возраста (67–97 лет, медиана – 81 год) получают незарегистрированные (unlicensed) препараты или зарегистрированные ЛС по нерекомендованным показаниям и/или в дозах, противоречащих инструкции по медицинскому применению [25]. В старшей возрастной группе наиболее часто нерегламентированно назначают препараты, влияющие на ЦНС. В частности, лицам в возрасте 9–70 лет антипсихотические средства назначаются преимущественно по незарегистрированным показаниям [26], прежде всего для лечения ажитации и агрессии, связанной с деменцией [27]. К распространенным проблемам относится назначение пожилым людям официально не рекомендованных с этой целью препаратов для лечения нарушений сна [28]. По незарегистрированным показаниям в гериатрии также широко используются антиконвульсанты [29]. В последние годы расширяется НП у пожилых больных препаратов, полученных биотехнологическими методами [30].
Как в педиатрической, так и гериатрической практике распространено применение нерекомендованных доз и путей введения ЛС [13, 31, 32].
Таким образом, нерегламентированное применение ЛС широко распространено и особенно часто встречается у пациентов групп риска – детей, лиц пожилого возраста и беременных женщин.
Причины и последствия нерегламентированного применения ЛС
Причины нарушения инструкции при применении ЛС разнообразны. Они, прежде всего, включают экстраполяцию показаний к применению:
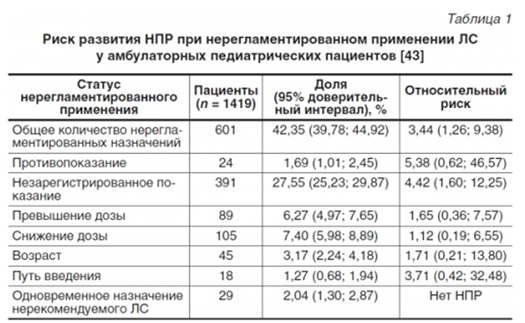 Результаты этих исследований подтверждаются и сообщениями, содержащимися в базе данных Европейского медицинского агентства (EMEA) [44].
Таким образом, нерегламентированное применение ЛС сопряжено с повышенным риском развития НПР, включая серьезные и фатальные, как у госпитализированных, так и у амбулаторных больных.
Нерегламентированное применение ЛС с точки зрения законодательства. Меры повышения безопасности пациента.
Нерегламентированное применение ЛС не запрещено законом и, как указывалось, может быть оправдано в отдельных случаях при серьезных заболеваниях, когда отсутствуют альтернативные ЛС и когда потенциальная польза от НП перевешивает связанный с ним потенциальный риск [45– 48]. Это касается прежде всего ситуаций, когда речь идет о спасении жизни пациента (например, назначение онкологическим больным противоопухолевых препаратов по незарегистрированным показаниям в том случае, когда другие ЛС этой группы оказались неэффективными; назначение антидотов при интоксикациях; назначение антибиотиков при высоком уровне резистентности возбудителя к официально рекомендованным препаратам и т. д.) [47,48]. Однако в большинстве случаев НП ЛС не подкреплено достаточной доказательной базой, особенно в педиатрии.
В последние годы в США и Европейском союзе органами, регулирующими применение ЛС, были предприняты инициативы, направленные на создание у производителей ЛС мотиваций и стимулов к проведению клинических исследований с участием детей [49, 50]. Ожидается, что эти исследования позволят оценить соотношение польза/риск при применении ЛС в педиатрии и перевести часть нерегламентированных назначений в разряд регламентированных.
Однако нерегламентированное назначение ЛС конкретному больному всегда будет оставаться в сфере “профессионального суждения” врача [51]. Чтобы облегчить врачу решение этой задачи и повысить безопасность пациентов, австралийские эксперты разработали рекомендации по оценке правомерности НП ЛС [52]. В них подчеркивается, что при назначении любого ЛС врачу всегда следует задавать себе вопрос: “будет ли этот препарат использоваться в соответствии с инструкцией по медицинскому применению (показание, возраст, доза, путь введения и т. д.)?”. В случае если ответ на этот вопрос окажется отрицательным, рекомендуется проанализировать опубликованные доказательные данные об эффективности и безопасности данного ЛС при данной патологии. Если доказательства того, что польза НП значительно превышает потенциальный риск его применения, достаточно убедительны, НП может быть рекомендовано.
Если уровень доказательств невысок, НП можно разрешить лишь в следующих ситуациях:
Результаты этих исследований подтверждаются и сообщениями, содержащимися в базе данных Европейского медицинского агентства (EMEA) [44].
Таким образом, нерегламентированное применение ЛС сопряжено с повышенным риском развития НПР, включая серьезные и фатальные, как у госпитализированных, так и у амбулаторных больных.
Нерегламентированное применение ЛС с точки зрения законодательства. Меры повышения безопасности пациента.
Нерегламентированное применение ЛС не запрещено законом и, как указывалось, может быть оправдано в отдельных случаях при серьезных заболеваниях, когда отсутствуют альтернативные ЛС и когда потенциальная польза от НП перевешивает связанный с ним потенциальный риск [45– 48]. Это касается прежде всего ситуаций, когда речь идет о спасении жизни пациента (например, назначение онкологическим больным противоопухолевых препаратов по незарегистрированным показаниям в том случае, когда другие ЛС этой группы оказались неэффективными; назначение антидотов при интоксикациях; назначение антибиотиков при высоком уровне резистентности возбудителя к официально рекомендованным препаратам и т. д.) [47,48]. Однако в большинстве случаев НП ЛС не подкреплено достаточной доказательной базой, особенно в педиатрии.
В последние годы в США и Европейском союзе органами, регулирующими применение ЛС, были предприняты инициативы, направленные на создание у производителей ЛС мотиваций и стимулов к проведению клинических исследований с участием детей [49, 50]. Ожидается, что эти исследования позволят оценить соотношение польза/риск при применении ЛС в педиатрии и перевести часть нерегламентированных назначений в разряд регламентированных.
Однако нерегламентированное назначение ЛС конкретному больному всегда будет оставаться в сфере “профессионального суждения” врача [51]. Чтобы облегчить врачу решение этой задачи и повысить безопасность пациентов, австралийские эксперты разработали рекомендации по оценке правомерности НП ЛС [52]. В них подчеркивается, что при назначении любого ЛС врачу всегда следует задавать себе вопрос: “будет ли этот препарат использоваться в соответствии с инструкцией по медицинскому применению (показание, возраст, доза, путь введения и т. д.)?”. В случае если ответ на этот вопрос окажется отрицательным, рекомендуется проанализировать опубликованные доказательные данные об эффективности и безопасности данного ЛС при данной патологии. Если доказательства того, что польза НП значительно превышает потенциальный риск его применения, достаточно убедительны, НП может быть рекомендовано.
Если уровень доказательств невысок, НП можно разрешить лишь в следующих ситуациях:
- c одного на другие препараты того же класса (предположение наличия группового эффекта);
- c более тяжелых на более легкие формы заболевания;
- на близкие заболевания (например, применение антиастматического препарата Монтелукаста при хронической обструктивной болезни легких);
- на физиологически близкие состояния (например, применение антидиабетического препарата Метформина для лечения поликистоза яичников);
- на состояния, при которых часть симптомов совпадает с симптомами заболевания, рекомендованного для лечения этим препаратом [33].
 Результаты этих исследований подтверждаются и сообщениями, содержащимися в базе данных Европейского медицинского агентства (EMEA) [44].
Таким образом, нерегламентированное применение ЛС сопряжено с повышенным риском развития НПР, включая серьезные и фатальные, как у госпитализированных, так и у амбулаторных больных.
Нерегламентированное применение ЛС с точки зрения законодательства. Меры повышения безопасности пациента.
Нерегламентированное применение ЛС не запрещено законом и, как указывалось, может быть оправдано в отдельных случаях при серьезных заболеваниях, когда отсутствуют альтернативные ЛС и когда потенциальная польза от НП перевешивает связанный с ним потенциальный риск [45– 48]. Это касается прежде всего ситуаций, когда речь идет о спасении жизни пациента (например, назначение онкологическим больным противоопухолевых препаратов по незарегистрированным показаниям в том случае, когда другие ЛС этой группы оказались неэффективными; назначение антидотов при интоксикациях; назначение антибиотиков при высоком уровне резистентности возбудителя к официально рекомендованным препаратам и т. д.) [47,48]. Однако в большинстве случаев НП ЛС не подкреплено достаточной доказательной базой, особенно в педиатрии.
В последние годы в США и Европейском союзе органами, регулирующими применение ЛС, были предприняты инициативы, направленные на создание у производителей ЛС мотиваций и стимулов к проведению клинических исследований с участием детей [49, 50]. Ожидается, что эти исследования позволят оценить соотношение польза/риск при применении ЛС в педиатрии и перевести часть нерегламентированных назначений в разряд регламентированных.
Однако нерегламентированное назначение ЛС конкретному больному всегда будет оставаться в сфере “профессионального суждения” врача [51]. Чтобы облегчить врачу решение этой задачи и повысить безопасность пациентов, австралийские эксперты разработали рекомендации по оценке правомерности НП ЛС [52]. В них подчеркивается, что при назначении любого ЛС врачу всегда следует задавать себе вопрос: “будет ли этот препарат использоваться в соответствии с инструкцией по медицинскому применению (показание, возраст, доза, путь введения и т. д.)?”. В случае если ответ на этот вопрос окажется отрицательным, рекомендуется проанализировать опубликованные доказательные данные об эффективности и безопасности данного ЛС при данной патологии. Если доказательства того, что польза НП значительно превышает потенциальный риск его применения, достаточно убедительны, НП может быть рекомендовано.
Если уровень доказательств невысок, НП можно разрешить лишь в следующих ситуациях:
Результаты этих исследований подтверждаются и сообщениями, содержащимися в базе данных Европейского медицинского агентства (EMEA) [44].
Таким образом, нерегламентированное применение ЛС сопряжено с повышенным риском развития НПР, включая серьезные и фатальные, как у госпитализированных, так и у амбулаторных больных.
Нерегламентированное применение ЛС с точки зрения законодательства. Меры повышения безопасности пациента.
Нерегламентированное применение ЛС не запрещено законом и, как указывалось, может быть оправдано в отдельных случаях при серьезных заболеваниях, когда отсутствуют альтернативные ЛС и когда потенциальная польза от НП перевешивает связанный с ним потенциальный риск [45– 48]. Это касается прежде всего ситуаций, когда речь идет о спасении жизни пациента (например, назначение онкологическим больным противоопухолевых препаратов по незарегистрированным показаниям в том случае, когда другие ЛС этой группы оказались неэффективными; назначение антидотов при интоксикациях; назначение антибиотиков при высоком уровне резистентности возбудителя к официально рекомендованным препаратам и т. д.) [47,48]. Однако в большинстве случаев НП ЛС не подкреплено достаточной доказательной базой, особенно в педиатрии.
В последние годы в США и Европейском союзе органами, регулирующими применение ЛС, были предприняты инициативы, направленные на создание у производителей ЛС мотиваций и стимулов к проведению клинических исследований с участием детей [49, 50]. Ожидается, что эти исследования позволят оценить соотношение польза/риск при применении ЛС в педиатрии и перевести часть нерегламентированных назначений в разряд регламентированных.
Однако нерегламентированное назначение ЛС конкретному больному всегда будет оставаться в сфере “профессионального суждения” врача [51]. Чтобы облегчить врачу решение этой задачи и повысить безопасность пациентов, австралийские эксперты разработали рекомендации по оценке правомерности НП ЛС [52]. В них подчеркивается, что при назначении любого ЛС врачу всегда следует задавать себе вопрос: “будет ли этот препарат использоваться в соответствии с инструкцией по медицинскому применению (показание, возраст, доза, путь введения и т. д.)?”. В случае если ответ на этот вопрос окажется отрицательным, рекомендуется проанализировать опубликованные доказательные данные об эффективности и безопасности данного ЛС при данной патологии. Если доказательства того, что польза НП значительно превышает потенциальный риск его применения, достаточно убедительны, НП может быть рекомендовано.
Если уровень доказательств невысок, НП можно разрешить лишь в следующих ситуациях:
- в рамках формального исследования – при условии, что его проведение одобрено этическим комитетом учреждения и получено письменное информированное согласие пациентов;
- в виде исключения у отдельных пациентов при наличии всех нижеизложенных условий:
- если больной страдает серьезным заболеванием или находится в тяжелом состоянии;
- существуют определенные доказательства потенциальной пользы НП, которая перевешивает связанные с ним потенциальные риски;
- предварительное лечение стандартными ЛС оказалось неэффективным или применение стандартной терапии неуместно (непереносимость, противопоказания и т. д.).
- Radley D.C., Finkelstein S.N., Stafford R.S. Off-label prescribing among office-based physicians // Arch. Intern. Med., 2006; 166:1021–1026. 2. Blumer J.L. Off-label uses of drugs in children // Pediatrics, 1999, Sep;104 (3 Pt 2): 598–602. 3. Cote C.J., Kauffman R.E., Troendle G.J., Lambert G.H. Is the “therapeutic orphan” about to be adopted? // Pediatrics, 1996, Jul; 98 (1): 118–123. 4. Conroy S., Choonara I., Impicciatore P. et al. Survey of unlicensed and off-label drug use in paediatric wards in European countries // BMJ, 2000; 320: 79–82. 5. McIntyre J., Conroy S., Avery A. et al. Unlicensed and off label prescribing of drugs in general practice // Arch. Dis. Child, 2000; 83: 498–501. 6. Pandolfini C., Impicciatore P., Provasi D. et al. Off-label use of drugs in Italy: a prospective, observational and multicentre study // Acta Paediatr, 2002; 91: 339–347. 7. Cuzzolin L., Zaccaron A., Fanos V. Unlicensed and off-label uses of drugs in paediatrics: a review of the literature // Fundam. Clin. Pharmacol., 2003; 17: 125–131. 8. Stephenson T. Medicines for children – the last century and the next // Arch. Dis. Child, 2001; 85: 177–179. 9. Choonara I., Conroy S. Unlicensed and off-label drug use in children: implications for safety // Drug Saf., 2002;25(1):1–5. 10. Pandolfini C., Bonati M.A. Literature review on off-label drug use in children // Eur. J. Pediatr., 2005, Sep; 164 (9): 552–558. 11. Cuzzolin L., Atzei A., Fanos V. Off-label and unlicensed prescribing for newborns and children in different settings: a review of the literature and a consideration about drug safety // Expert Opin. Drug Saf., 2006, Sep., 5 (5):703–718. 12. Lopez Martinez R., Cabanas Poy M.J., Oliveras Arenas M., Clemente Bautista S. [Drug use in a neonatal ICU: a prospective study] // Farm. Hosp., 2005, Jan-Feb; 29 (1): 26–29. 13. Avenel S., Bomkratz A., Dassieu G. et al. [The incidence of prescriptions without marketing product license in a neonatal intensive care unit] // Arch. Pediatr., 2000, Feb; 7 (2): 143–147. 14. Schirm E., Tobi H., de Jong-van den Berg L.T.W. Risk factors for unlicensed and off-label drug use in children outside the hospital // Pediatrics, 2003, Feb; 111 (2) : 291–295. 15. Shah S.S., Hall M., Goodman D.M. et al. Off-label drug use in hospitalized children // Arch. Pediatr. Adolesc. Med., 2007, Mar; 161 (3): 282. 16. Yoon E.Y., Dombkowski K.J., Rocchini A. et al. Off-label Utilization of Antihypertensive Medications in Children // Ambul. Pediatr., 2007; 7(4): 299–303. 17. Chalumeau M., Treluyer J.M., Salanave B. et al. Off-label and unlicensed drug use among French office based paediatricians // Arch. Dis. Child., 2000; 83 : 502–505. 18. Lakhan S.E., Hagger-Johnson G.E. The impact of prescribed psychotropics on youth // Clin. Pract. Epidemiol. Ment. Health, 2007, Oct, 20; 3: 2. 19. Bajcetic M., Jelisavcic M., Mitrovic J. et al. Off-label and unlicensed drugs use in paediatric cardiology // Eur. J. Clin. Pharmacol., 2005, Nov., 61 (10): 775. 20. Dick A., Keady S., Mohamed F. et al. Use of unlicensed and off-label medications in paediatric gastroenterology with a review of the commonly used formularies in the UK // Aliment. Pharmacol. Ther., 2003, Feb., 15; 17 (4): 571–575. 21. ‘t Jong G.W., Eland I.A., Sturkenboom M.C. et al. Unlicensed and off-label prescription of respiratory drugs to children //Eur. Respir. J., 2004, Feb.; 23 (2): 310–313. 22. Rayburn W.F., Farmer K.C. Off-label prescribing during pregnancy // Obstet. Gynecol. Clin. North Am., 1997, Sep.; 24 (3): 471–478. 23. Hallberg P., Sjoblom V. The use of selective serotonin reuptake inhibitors during pregnancy and breast-feeding: a review and clinical aspects //J. Clin. Psychopharmacol, 2005, Feb.; 25 (1): 59–73. 24. Haw C., Stubbs J. Off-label use of antipsychotics: are we mad? // Expert Opin. Drug Saf., 2007, Sep.; 6 (5): 533–534. 25. Hames A., Wynne H.A. Unlicensed and off-label drug use in elderly people // Age Ageing, 2001, Nov.; 30 (6): 530–531. 26. Weiss E., Hummer M., Koller D., Ulmer H., Fleischhaker W.W. Off-label use of antipsychotic drugs // J. of Clin. Psychopharm.. 2000; 20 : 695–698. 27. Salzman C., Jeste D.V., Meyer R.E. et al. Elderly patients with dementia-related symptoms of severe agitation and aggression: consensus statement on treatment options, clinical trials methodology and policy // J. Clin. Psychiatry, 2008, Jun.; 69 (6): 889–898. 28. Salzman C. Pharmacologic treatment of disturbed sleep in the elderly // Harv. Rev. Psychiatry, 2008, Sept.-Oct.; 16 (5): 271–278. 29. Lackner T.E., Cloyd J.C., Thomas L.W., Leppik I.E. Antiepileptic drug use in nursing home residents: effect of age, gender, and co-medication on patterns of use // Epilepsia, 1998; 39: 1083–1087. 30. Ljung T., Karlе′n P., Schmidt D. et al. Infliximab in inflammatory bowel disease: clinical outcome in a population based cohort from Stockholm County // Gut. 2004, Jun; 53 (6): 849-853. 31. Unapproved uses of approved drugs: the physician, the package insert, and the Food and Drug Administration: subject review. American Academy of Pediatrics Committee on Drugs // Pediatrics, 1996, Jul; 98 (1): 143–145. 32. Fonzo-Christe C., Vukasovic C., Wasilewski-Rasca A.F., Bonnabry P. Subcutaneous administration of drugs in the elderly: survey of practice and systematic literature review // Palliat. Med., 2005, Apr.; 19 (3) : 208–219. 33. Stafford R.S. Regulating off-label drug use – rethinking the role of the FDA // NEJM, 2008; 358: 1427–1429. 34. Carleton B.C., Smith M.A., Gelin M.N., Heathcote S.C. Paediatric adverse drug reaction reporting: understanding and future directions // Can. J. Clin. Pharmacol., 2007, Winter; 14 (1) :e 45–57. 35. Ekins-Daukes S., Helms P.J., Taylor M.W., McLay J.S. Off-label prescribing to children: attitudes and experience of general practitioners // Br. J. Clin. Pharmacol., 2005, August; 60 (2): 145–149. 36. Riordan F.A.I. Use of unlabelled and off-license drugs in children Use of unlicensed drugs may be recommended in guidelines // BMJ, 2000; 320: 1210. 37. FDA Public Health Advisory. Deaths with Antipsychotics in Elderly Patients with Behavioral Disturbances. http://www.fda.gov/cder/drug/advisory/antipsychotics.htm 38. Public Health Advisory. Nonprescription Cough and Cold Medicine Use in Children FDA Recommends that Over-the-Counter (OTC) Cough and Cold Products not be used for Infants and Children under 2 Years of Age. http://www.fda.gov/cder/drug/advisory/cough_cold_2008.htm 39. Gonzalez-Martin G., Caroca C.M., Paris E. Adverse drug reactions (ADRs) in hospitalized pediatric patients. A prospective study // Int. J. Clin. Pharmacol. Ther., 1998, 36 (10): 530–533. 40. Gill A.M., Leach H.J., Hughes J., Barker C., Nunn A.J., Choonara I. Adverse drug reactions in a paediatric intensive care unit // Acta Paediatr. 1995; 84: 438–44 1. 41. Turner S., Nunn A.J., Fielding K., Choonara I. Adverse drug reactions to unlicensed and off-label drugs on paediatric wards: a prospective study // Acta Paediatr., 1999; 88: 965–968. 42. Santos D.B., Clavenna A., Bonati M., Coelho H.L. Off-label and unlicensed drug utilization in hospitalized children in Fortaleza, Brazil // Eur. J. Clin. Pharmacol, 2008, Nov; 64 (11): 1111–1118. 43. Horen B., Montastruc J.-L., Lapeyre-mestre M. Adverse drug reactions and off-label drug use in paediatric outpatients // Br. J. Clin. Pharmacol, 2002, December; 54(6): 665–670. 44 . European Medicines Agency (EMEA). Evidence of harm from off label or unlicensed medicines in children, London: EMEA, October 2004 (EMEA/11207/04). http://www.cabrnoch.cz/media/emea_statement_harmfull_drugs.pdf 45. Blum R. Legal consideration in off-label medication prescribing // Arch. Intern. Med., 2002; 162: 1777–1779. 46. Kelly M., Gazarian M., McPhee J. Off-label prescribing [letter] // Aust. Prescr, 2005; 28: 7. 47. Collier J. Paediatric prescribing: using unlicensed drugs and medicines outside their licensed indications // Br. J. Clin. Pharmacol, 1999; 48: 5–8. 48. Roberts R., Rodriguez W., Murphy D., Crescenzi T. Pediatric drug labelling. Improving the safety and efficacy of pediatric therapies // JAMA, 2003; 290 (7): 905–911. 49. Schreiner M. Paediatric clinical trials: redressing the imbalance // Nat. Rev. Drug Discov, 2003; 2: 949–961. 50. European Parliament. Committee on the Environment, Public Health and Food Safety. Draft recommendation for second reading on the Council common position for adopting a regulation of the European Parliament and of the Council on medicinal products for paediatric use and amending Regulation (EEC) № 1768/92, Directive 2001/20/EC, Directive 2001/83/EC and Regulation (EC) № 726/2004. http://www.europarl.europa.eu/meetdocs/2004_2009/documents/pr/605/605939/605939en.pdf 51. Glauser T.A. Behavioral and psychiatric adverse events associated with antiepileptic drugs commonly used in pediatric patients // 2004, 19 (Suppl 1): S25–38. 52. Gazarian M., Kelly J.R., Graudins L.V. Off-label use of medicines: consensus recommendations for evaluating appropriateness // MJA, 2006; 185 (10): 544 –548. 53. Luo X., Doherty J., Cappelleri J.C., Frush K. Role of pharmacoepidemiology in evaluating prescription drug safety in pediatrics // Curr. Med. Res. Opin., 2007. 54. Грацианская А.Н., Белоусов Ю.Б. Фармаконадзор // Менеджмент качества в сфере здравоохранения и социального развития, 2008. – № 3. – С. 135–174.


