Ирина Александровна Зборовская – д.м.н., профессор, профессор кафедры госпитальной терапии с курсом клинической ревматологии факультета усовершенствования врачей Волгоградского государственного медицинского университета, директор Федерального Бюджетного Государственного Учреждения «Научно-исследовательский институт клинической и экспериментальной ревматологии» РАМН, руководитель регионального Центра по проблемам остеопороза, член президиума Ассоциации ревматологов России, член редакционных советов журналов «Научно – практическая ревматология» и «Современная ревматология»
Определение
На протяжении двух с половиной тысячелетий – со времени описания Гиппократом синдрома острых болей в области большого пальца стопы, который он назвал подагрой (дословно с латыни “капкан на стопе”), интерес к этой болезни всегда носил волнообразное течение, как правило, связанное с открытием какого-то нового взгляда.
Но особенно интересны данные по изучению кристаллов, вызывающих подагрический артрит. Показано, что это мононатриевые уратные кристаллы, обнаружение которых имеет абсолютное диагностическое значение. В сущности, к концу XX века подагру стали рассматривать как болезнь накопления уратных кристаллов в структуре сустава, подкожной клетчатке и костях, почках в виде уролитиаза или тубулярной нефропатии.
Итак, подагра – это заболевание, в основе которого лежит нарушение пуринового обмена с повышением содержания мочевой кислоты в крови, избыточным отложением солей мочевой кислоты, прежде всего в тканях опорно-двигательного аппарата и внутренних органов и с развитием в них воспалительных, а затем и деструктивно-склеротических изменений.
Относится к мультифакторным заболеваниям.
Эпидемиология
I. В Европе и США частота подагры составляет 0,3% общей заболеваемости, среди ревматических болезней на её долю приходиться 5%, у нас – 7-8%.
II. В нашей стране в послевоенные годы, по-видимому, в связи с ограниченностью белкового питания частота подагры снизилась, но в последующем значительно возросла и приобрела большую социальную значимость.
В нашей стране подагра выявлена у 0,1% населения; вероятно, истинный процент выше, так как диагностируется подагра поздно. 3аболеваемость подагрой во всем мире растет.
Подагрой болеют в основном мужчины (в 95-98%), обычно старше 30 лет.
Однако в последние годы ряд исследователей отмечает повсеместный рост численности больных подагрическим артритом среди женщин. Выявлена обратная зависимость между уровнем эстрагенов и концентрацией мочевой кислоты. Снижение уровня этих гормонов в крови во время менопаузы способствует появлению гиперурикемии и образованию депозитов в тканях.
III. Важно также и то, что у большей части больных диагноз устанавливается не своевременно.
IV. Особенностями заболевания в последние десятилетия являются возникновение его в более молодом возрасте, ранее формирование осложнений. Частое вовлечение в процесс почек и сердечно – сосудистой системы. У молодых чаще наблюдается тяжелое течение заболевания со множественным поражением суставов, частыми и длительными обострениями, множественными тофусами и более выраженной гиперурикемией.
Этиопатогенез
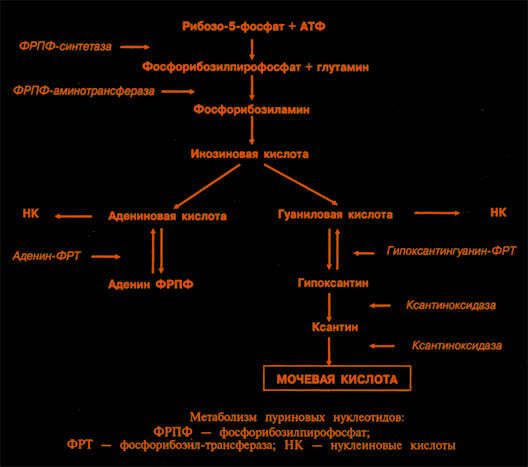
I. Мочевая кислота – это конечный продукт распада пуринов у человека. В плазме, внеклеточной и синовиальной жидкости она содержится главным образом в виде солей (уратов). При рН 7,4 мочевая кислота на 98% представлена мононатриевой солью, которая легко удаляется из плазмы при гемофильтрации или диализе. Мочевая кислота практически не связывается с белками плазмы.
Концентрация насыщенного раствора мочевой кислоты в сыворотке при температуре 37°С составляет 416 мкмоль/л (7 мг%). Превышение этого порога создает предпосылку для кристаллизации уратов. Однако в крови содержатся вещества, которые увеличивают растворимость, поэтому обычно кристаллизации не происходит даже при концентрации мочевой кислоты в сыворотке 4800 мкмоль/л (80 мг%).
Мочевая кислота растворяется в моче лучше, чем в воде, возможно, из-за присутствия мочевины, белков и гликозаминогликанов. Ее растворимость зависит от рН. При рН, равном 5, растворимость мочевой кислоты в моче составляет 360—900 мкмоль/л (6—15 мг%), а при рН, равном 7, – 9480—12000 мкмоль/л (158—200 мг%). Часть мочевой кислоты находится в моче в виде солей: мононатриевой, динатриевой, калиевой, аммониевой и кальциевой.
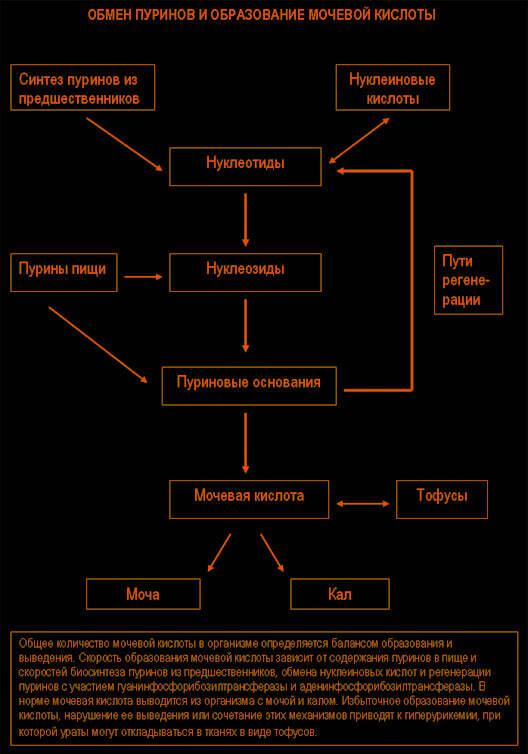
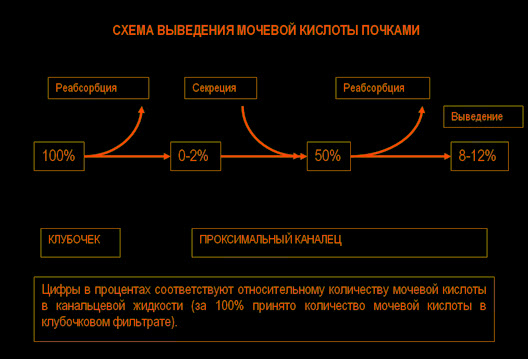
Синтез и распад пуринов происходят во всех тканях, но мочевая кислота образуется только там, где есть ксантиноксидаза, прежде всего в печени и тонкой кишке. Количество мочевой кислоты в организме определяется соотношением скоростей образования мочевой кислоты и ее выведения. Скорость образования мочевой кислоты зависит от количества пуринов в рационе и скоростей синтеза, регенерации и распада пуринов. В норме 66—75% мочевой кислоты выводится с мочой, а оставшаяся часть — в основном с калом.
Приблизительно 98 – 100% мочевой кислоты из клубочкового фильтрата реабсорбируется в проксимальных канальцах, но половина этого количества секретируется в этих канальцах обратно, а затем около 40% снова подвергается реабсорбции. В результате в мочу попадает лишь 8 – 12% отфильтровавшейся мочевой кислоты.
Концентрация мочевой кислоты в сыворотке зависит от пола и возраста, а у взрослых — от роста, веса, АД, функции почек и употребления спиртных напитков. У большинства детей она составляет 180 – 240 мкмоль/л (3 – 4 мг%). По мере полового созревания у мужчин концентрация нарастает, а у женщин остается низкой до наступления менопаузы. Причина такого различия окончательно не установлена. Верхняя граница нормальной концентрации мочевой кислоты в сыворотке у женщин детородного возраста и у взрослых мужчин составляет соответственно 360 и 416 мкмоль/л (6 и 7 мг%). В постменопаузе концентрация мочевой кислоты в сыворотке у женщин увеличивается и приближается к концентрации, характерной для мужчин.
II. Возникновение подагры связывают как с генетической обусловленностью, так и с алиментарными причинами.
Среди населения в целом распространенность гиперурикемии составляет 2 – 13,2%, а подагры — 1,3 – 3,7%. Чем выше концентрация мочевой кислоты в сыворотке, тем больше вероятность подагры. Согласно одному из исследований, заболеваемость подагрой при концентрации мочевой кислоты в сыворотке более 540 мкмоль/л (9 мг%) составила 4,9%, а при концентрации 415 – 535 мкмоль/л (7 – 9 мг%) — 0,5%. Течение подагры зависит от продолжительности и тяжести гиперурикемии. Первый приступ подагры чаще всего возникает через 20—40 лет стойкой гиперурикемии; у мужчин это обычно происходит в возрасте 40—60 лет, а у женщин – после наступления менопаузы.
III. Однако, необходимо особо подчеркнуть, что выявления гиперурикемии недостаточно для установления диагноза, так как лишь около 10% больных гиперурикемией страдают подагрой. В этой связи важно подчеркнуть парадокс XX века – у всех больных с подагрой определяется гиперурикемия, но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита. А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающееся воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия – необходимое, но недостаточное предшествующее явление для развития уратной микрокристаллической болезни, а, следовательно, гиперурикемия – отличный от подагры клинический синдром.
IV. Следовательно, в развитии подагры наряду с гиперурикемией важное значение имеют другие факторы.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом “антивоспалительных” медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста-В и др.).
V. До настоящего времени неизвестны факторы, предрасполагающие к отложению уратов и воспалению суставов у лиц с гиперурикемией (за исключением семейных случаев).
КЛАССИФИКАЦИЯ ПРИЧИН ГИПЕРУРИКЕМИИ
Метаболическая гиперурикемия
Первичная идиопатическая гиперурикемия
Недостаточность гипоксантинфосфорибозилтрансферазы
Избыточная активность фосфорибозилпирофосфатсинтетазы
Гемолиз
Лимфопролиферативные заболевания
Миелопролиферативные заболевания
Эритремия (болезнь Вакеза)
Псориаз
Болезнь Педжета
Гликогенозы типов III, V и VII
Рабдомиолиз
Физическая нагрузка
Употребление алкоголя
Ожирение
Высокое содержание пуринов в пище
Почечная гиперурикемия
Первичная идиопатическая гиперурикемия
Почечная недостаточность
Поликистоз почек
Несахарный диабет
Артериальная гипертония
Ацидоз
Лактацидоз
Диабетический кетоацидоз
Кетоацидоз при голодании
Бериллиоз
Саркоидоз
Свинцовое отравление
Отравление этанолом
Гиперпаратиреоз
Гипотиреоз
Преэклампсия
Синдром Бартера
Синдром Дауна
Прием лекарственных средств
Салицилаты (> 2 г/сут)
Диуретики
Леводофа
Этамбутол
Пиразинамид
Никотиновая кислота
Циклоспорин
Смешанная гиперурикемия
Гликогеноз типа I
Непереносимость фруктозы (недостаточность фруктозодифосфатальдолазы)
Употребление алкоголя
Шок
Подробный перечень факторов, способствующих гиперурикемии, приводит в своей работе Дж. Скотт (1990):
1. факторы, обусловливающие повышенное образование мочевой кислоты:
1) специфические ферментные дефекты, (снижение активности гипоксантин-гуанин-фосфорибозил трансферазы, повышение активности фосфорибозил-пирофосфат-синтетазы),
2) усиление обмена нуклеопротеинов,
3) характер питания: избыточное потребление пищи, богатой пуринами, алкоголя, фруктозы;
4) гематологические: миелопролиферативные и лимфопролиферативные синдромы, полицитемия;
5) ЛС: этанол, цитотоксические, витамин В
12 (лечение пернициозной анемии);
2. Факторы, обусловливающие замедление выведения мочевой кислоты:
1) нарушение функции почек и уменьшение объема внеклеточной жидкости,
2) лекарства,
3) голодание и накопление кетоновых соединений,
4) артериальная гипертензия,
5) микседема и т. д.;
Например:
- ЛС: циклоспорин, инсулин, тиазидные диуретики, фуросемид и другие петлевые диуретики, этамбутол, пиразинамид, аспирин (в низких дозах), леводопа, никотиновая кислота;
- алкоголь;
- почечные: гипертензия, поликистоз почек, хроническая почечная недостаточность любой этиологии;
- метаболические/эндокринные: дегидратация, ацидоз, кетоз, гипотиреоз, гиперпаратиреоз;
- другие: ожирение, саркоидоз, токсикоз беременных.
3. Другие факторы риска: раса, пол, возраст, нарушение липидного обмена, алкоголь, псориаз, гипертриглицеридемия.
VI. Для гиперурекемии характерно эпизодическое или постоянное повышение уровня мочевой кислоты в крови более 7 мг/% (416 мкмоль/л).
О причине гиперурикемии можно судить по суточной экскреции мочевой кислоты. У мужчин в отсутствие пуринов в рационе и при нормальной функции почек она составляет менее 3,6 ммоль (600мг). Превышение этой величины свидетельствует об усиленном образовании мочевой кислоты, и наоборот, ее снижение свидетельствует о нарушении выведения. При обычном рационе верхней границей нормы считается 4,8 ммоль/сут (800 мг/сут). Снижение СКФ приводит к уменьшению экскреции мочевой кислоты. Поэтому низкая величина ее суточной экскреции у таких больных не исключает повышенного образования мочевой кислоты, но увеличенная экскреция мочевой кислоты однозначно свидетельствует о ее избыточном образовании. Глюкокортикоиды, аскорбиновая кислота, салицилаты в дозе более 2 г/сут и некоторые другие препараты усиливают экскрецию мочевой кислоты, что необходимо учитывать при оценке результатов лабораторного анализа.
Соотношение концентраций мочевой кислоты и креатинина в моче или отношение клиренса мочевой кислоты к СКФ, определенное однократно, не позволяет судить об интенсивности синтеза мочевой кислоты. Однако это важный показатель для оценки состояния больного при ОПН и подозрении на острую мочекислую нефропатию.
VII. В зависимости от суточного выделения мочевой кислоты выделяют 3 группы больных: “гиперпродукторы” и “гипоэкскреторы”, смешанные дефекты.
Гиперпродукторы.
1. Составляют 10 % больных подагрой.
2. Они выделяют более 750-1000 мг мочевой кислоты в сутки при обычной диете.
3. У них повышенное образование мочевой кислоты происходит при катаболизме нуклеиновых кислот.
Первичная причина повышенного образования мочевой кислоты связана с дефектами ферментной системы синтеза мочевой кислоты.
Причиной заболевания является первичная гиперурикемия. У больных имеется так называемый конституциональный диспуринизм, семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами (какими именно генами, пока не установлено). Имеются семьи, в которых подагра встречается чаще. У 20% членов семей больных обнаруживается гиперурикемия. Конституциональный диспуринизм связан с определенными дефектами ферментов, которые участвуют в пуриновом обмене.
1) Полный дефицит гипоксантин-гуанин-фосфорибозил-трансферазы (ГГФРТ) наряду с картиной подагрического артрита приводит к выраженным психоневрологическим нарушениям — умственной отсталости, аутоагрессивности, хореоатетозу. Такой симптомокомлекс получил название синдрома Леша – Найхена.
2) Развитие семейной подагры, обусловленное генетическим дефектом Х-хромосомы, наблюдается при частичном дефиците ГГФРТ (с-м Келли-Зигмиллера). При наследственно обусловленной подагре редко встречается уролитиазная форма нефропатии, чаще выявляется очаговый гломерулонефрит с изменениями в канальцах, строме и сосудах. Особенностью течения данной формы подагры является то, что она обычно не связана с полом и проявляется в молодом возрасте.
3) Проявлению скрытых, генетически обусловленных ферментативных дефектов способствуют экзогенные факторы: переедание, чрезмерное употребление продуктов, содержащих пуриновые основания, злоупотребление алкоголем, переохлаждение и др. Имеет значение высокая калорийность пищи в сочетании с низкой физической активностью.
Врожденные нарушения пуринового обмена
| Фермент |
Нарушение |
Тип
наследования |
Клиническая картина |
| Гипоксантин-фосфорибозил-трансфераза |
Отсутствие фермента
Недостаточность |
Х-сцепленный рецессивный
Х-сцепленный рецессивный |
Агрессивное поведение, склонность к самоповреждению, хореоатетоз, гипер-урикемия, подагра и уратные мочевые камни
Гиперурикемия, подагра и уратные мочевые камни |
| Фосфорибозил-пирофосфатсинтетаза |
Избыточная активность |
Х-сцепленный рецессивный |
Гиперурикемия, подагра, уратные мочевые камни и глухота |
| Аденинфосфорибозил-трансфераза |
Недостаточность |
Аутосомно-рецессивный |
Мочевые камни, состоящие из 2,8-дигидроксиаденина |
| Ксантиноксидаза |
Недостаточность |
Аутосомно-рецессивный |
Ксантинурия и ксантиновые мочевые камни |
| Аденилосукцинатлиаза |
Недостаточность |
Аутосомно-рецессивный |
Аутизм и психомоторная заторможенность |
| АМФ-дезаминаза |
Недостаточность |
Аутосомно-рецессивный |
Бессимптомное течение или миопатии с непереносимостью физической нагрузки |
| Аденозиндезаминаза |
Недостаточность |
Аутосомно-рецессивный |
Комбинированный иммунодефицит, иногда с нарушением развития скелета |
| Пуриннуклеозид-фосфорилаза |
Недостаточность |
Аутосомно-рецессивный |
Недостаточность клеточного иммунитета |
Вторичная причина связана с повышенным распадом клеток при алкоголизме, болезнях крови, хроническом гемолизе или проведении противоопухолевой химиотерапии.
1) Причиной гиперурикемии может быть повышение катаболизма пуриновых нуклеотидов при усиленной пролиферации, массовой гибели и распаде клеток, например при бластном кризе, химиотерапии злокачественных новообразований (синдром распада опухоли), гемолизе и рабдомиолизе. Нуклеиновые кислоты, высвобождаемые из погибающих клеток, распадаются под действием нуклеаз и фосфодиэстераз до нуклеозидмонофосфатов, которые последовательно превращаются в нуклеозиды, азотистые основания и мочевую кислоту. Усиленный распад мышечного АТФ при тяжелой физической нагрузке, эпилептическом статусе и гликогенозах типов III, V и VII тоже может привести к гиперурикемии.
2) Возможно, что гиперурикемия при инфаркте миокарда, отравлении продуктами горения и острой дыхательной недостаточности также связана с распадом АТФ.
Гипоэкскреторы
1. Составляют 90% больных подагрой.
2. Они выделяют менее 700 мг мочевой кислоты в сутки.
3. Причиной гиперурикемии в подобных случаях считают снижение выделения мочевой кислоты почками вследствие эффекта диуретиков алкоголя, малых доз аспирина, а также заболеваний почек (хроническая почечная недостаточность, свинцовая нефропатия).
1) Почечная недостаточность всегда сопровождается гиперурикемией, но подагрический артрит наблюдается только у 1% больных с ХПН. Как упоминалось выше, первый приступ подагры обычно возникает после многих лет стойкой гиперурикемии, поэтому у большинства больных с ХПН просто не успевает накопиться достаточное количество мочевой кислоты для развития подагры. Кроме того, при ХПН снижается интенсивность воспалительной реакции при п/к введении уратных кристаллов. По неясным причинам исключение составляет поликистоз почек, который сопровождается подагрой в 24—36% случаев.
После многократного проведения гемодиализа иногда развивается рецидивирующий артрит или периартрит вследствие кристаллизации уратов, фосфата кальция или оксалата кальция.
2) Экскреция мочевой кислоты может уменьшаться в результате снижения СКФ, уменьшения секреции или повышения реабсорбции. Снижение СКФ вряд ли может вызвать первичную гиперурикемию, но способствует развитию вторичной гиперурикемии при почечной недостаточности. Хронические заболевания почек всегда сопровождаются гиперурикемией, но при этом нет прямой зависимости между концентрацией мочевой кислоты в сыворотке, с одной стороны, и АМК и концентрацией креатинина – с другой. При ХПН отношение клиренса мочевой кислоты к СКФ постепенно повышается, канальцевая секреция не меняется, реабсорбция снижается, и по мере усугубления почечной недостаточности все больше мочевой кислоты выводится с калом.
3) Подагра — частое осложнение после трансплантации почки. Подагрический артрит наблюдается у 7 – 12% больных, получающих иммуносупрессивную терапию циклоспорином и глюкокортикоидами, и еще чаще — при одновременном назначении диуретиков; между операцией и первым приступом подагры проходит в среднем 17 мес. При лечении азатиоприном и глюкокортикоидами подагра встречается намного реже. У больных, получающих циклоспорин, синтез мочевой кислоты не усиливается, но ее экскреция ниже, чем у тех, кто получает азатиоприн.
4) Снижение секреции мочевой кислоты в проксимальных канальцах может привести к гиперурикемии и при нормальной скорости образования мочевой кислоты. Этим объясняется вторичная гиперурикемия при ацидозе. Диабетический кетоацидоз, голодание, лактацидоз, отравление этанолом или салицилатами приводят к накоплению органических кислот (b-оксимасляной, ацетоуксусной, молочной, салициловой), которые конкурируют с мочевой кислотой за транспортные системы, обеспечивающие секрецию. Усиление реабсорбции в дистальных отделах проксимальных канальцев также может привести к гиперурикемии и подагре. Это наблюдается при снижении объема внеклеточной жидкости, например при несахарном диабете или приеме диуретиков.
 У больных встречают и комбинированные дефекты
У больных встречают и комбинированные дефекты
То есть «гиперпродукторы» могут одновременно быть и «гипоэкскреторами».
Смешанная гиперурикемия. Иногда причиной гиперурикемии бывает сочетание повышенного образования мочевой кислоты и сниженного ее выведения.
1. При гликогенозе типа I (недостаточности глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу) уже в грудном возрасте появляется гиперурикемия и рано развивается подагра.
Повышение продукции мочевой кислоты в этом случае связано с распадом АТФ во время или гипогликемии. Кроме того, у таких больных снижена концентрация нуклеозидмонофосфатов, что приводит к уменьшению их ингибирующего действия на амидофосфорибозилтрансферазу и усилению образования пуринов. Наконец, у них часто возрастает концентрация молочной кислоты в крови, а это сопровождается угнетением канальцевой секреции мочевой кислоты.
2. Оба механизма развития гиперурикемии действуют и при непереносимости фруктозы, связанной с недостаточностью фруктозодифосфатальдолазы. У таких больных прием фруктозы приводит к накоплению фруктозо-1-фосфата, истощению запасов АТФ, усилению катаболизма пуриновых нуклеотидов и гиперурикемии. Лактацидоз и почечный канальцевый ацидоз приводят к задержке мочевой кислоты в организме. У гомозигот после приема фруктозы наблюдаются рвота, гипогликемия, а продолжительное потребление фруктозы приводит к печеночной недостаточности и нарушению функции почечных канальцев. У гетерозигот развивается; гиперурикемия, а примерно у трети из них — подагра. По-видимому, это довольно частая причина семейной подагры, так как распространенность гетерозигот составляет 1:80 – 1:250.
3. Злоупотребление алкоголем также вызывает смешанную гиперурикемию путем:
1) стимуляции распада АТФ и усиления образования мочевой кислоты в печени
2) нарушения секреции мочевой кислоты в почках за счет ацидоза
3) кроме того, в некоторых спиртных напитках, например в пиве, содержится много пуринов.
Сопутствующие подагре состояния.
Приводимые ниже состояния часто наблюдаются у больных подагрой, но их связь с возникновением подагры не установлена.
1. Ожирение
Гиперурикемия зависит от массы тела. Подагру значительно чаще встречают у лиц с избыточной массой тела.
2. Сахарный диабет
Нарушение толерантности к глюкозе часто определяют у больных подагрой, что может быть следствием ожирения.
3. Артериальная гипертензия
У больных подагрой нередко имеется артериальная гипертензия, но прямая зависимость повышения уровня мочевой кислоты от артериального давления отсутствует.
Возможно наличие корреляции между ожирением и гипертензией.
4. Гиперлипедемии
При подагре II и IV типы гиперлипидемии часты.
5. Атеросклероз
Смерть больных подагрой обычно наступает вследствие сердечно- сосудистого заболевания.
Перечисленные выше факторы риска объясняют тенденцию к развитию атеросклероза.
Патогенез подагрического артрита
Клинические проявления подагры связаны с отложением в тканях кристаллов мочевой кислоты. Механизм отложения уратов до конца не выяснен.
1. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
2. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру, рН сыворотки крови и наличие субстанций, удерживающих ураты в жидкости — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0 – 13,0, что невозможно
in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
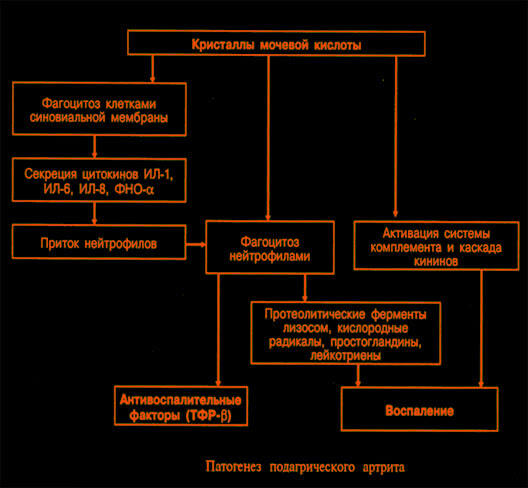
3. Итак, основные этапы патогенеза:
- Стимуляция под влиянием уратных кристаллов синтеза провоспалительных медиаторов (циклооксигеназные и липоксигеназные метаболиты арахидоновой кислоты, фосфолипипаза А2, ИЛ-1, ИЛ-8, ФНО, ИЛ-6, анафилатоксины, кинины и др.) фагоцитами, синовиальными клетками и другими компонентами сустава.
- Адгезия нейтрофилов к эндотелию и поступление нейтрофилов в полость суставов.
- Поступление провоспалительных медиаторов в кровяное русло.
- Развитие системных проявлений, характерных для острого подагрического артрита.
Классификация.
1. По этиопатогенетическому признаку выделяют:
- первичную (идиопатическую) подагру,
- вторичную подагру (вызванную другим заболеванием или медикаментами).
2. По механизму накопления мочевой кислоты подагра может быть:
- метаболического типа,
- гипоэкскреторного типа,
- смешанного типа.
3. По клиническому течению выделяют следующие формы заболевания (Американская ассоциация ревматологов):
- бессимптомная гиперурикемия,
- острый подагрический артрит,
- подагра с развитием тофусов,
- мочекаменный уролитиаз и другая, ассоциированная с подагрой патология почек.
4. По течению заболевания среди суставных вариантов выделяют:
- острый подагрический артрит,
- интермиттирующий артрит,
- хронический артрит с отложением параартикулярных тофусов.
5. По течению.
- Лёгкое
- Средне-тяжёлое.
- Тяжёлое течение.
Клиника
Клиническая картина складывается из поражений суставов и подагрических висцеропатий.
ЧАСТОТА ПРИСТУПОВ ПОДАГРИЧЕСКОГО АРТРИТА В ЗАВИСИМОСТИ ОТ УРОВНЯ УРАТОВ
| Концентрация уратов в сыворотке (мг%) |
Частота подагрического артрита (% в год) |
| < 7,0 |
0,1 – 0,5 |
| 7,0 – 8,9 |
0,5 – 1,2 |
| > 9,0 |
4,9 – 5,7 |
I стадия. Асимптоматическая гиперурикемия (продромальный период: диспептические явления, подавленное настроение, полиурия). Может быть психоэмоциональное возбуждение. Образно об этом сказал Сидеман – «яркое солнце перед бурей».
Это повышенное содержание мочевой кислоты в крови при отсутствии клинических признаков отложения кристаллов (т.е. без артрита, тофусов, нефропатии или уратных камней).
1. Гиперурикемия увеличивает риск развития подагры и нефролитиаза, однако во многих случаях гиперурикемии подобных поражений нет.
2. Гиперурикозурия.
— Риск формирования уратных камней значительно повышен у лиц с экскрецией мочевой кислоты более 1000 мг/сутки.
— У таких больных возможна острая обструкция мочевых путей – одна из форм острой почечной недостаточности, часто сопровождающая противоопухолевую химиотерапию. Другие лекарственные препараты, способствующие гиперурикозурии, представлены в таблице, приведенной ранее.
— Большая нагрузка пуриновыми основаниями приводит к внезапному повышению содержания мочевой кислоты в крови с последующим выпадением кристаллов в мочевых путях.
II стадия. Острый подагрический артрит.
Поражение суставов является основным клиническим проявлением подагры. Оно может проявляться острым подагрическим артритом, интермиттирующим артритом или хроническим артритом с отложением периартикулярных тофусов.
Итак, процессы отложения солей мочевой кислоты в тканях определяют клинические проявления подагры. Наиболее ярким из них является острый подагрический артрит. Непосредственной причиной воспаления служит кристаллизация мочевой кислоты в полости сустава, наступающая под действием провоцирующих факторов.
Активация калликреиновой и кининовой систем, увеличение проницаемости сосудистой стенки, активация системы комплемента, усиливая хемотаксис лейкоцитов к кристаллам уратов, поддерживают воспалительный процесс. В очаге воспаления снижается рН среды, что способствует еще большей кристаллизации уратов. Создается патогенетический порочный круг.
Самостоятельное стихание воспалительного процесса в суставе при подагре определяется способностью фагоцитов переваривать кристаллы и выделять ряд антивоспалительных факторов, в частности ТФР-b.
1. Чаще эта первая манифестная форма подагры.
1) Приступ развивается у большинства больных (80-90%) среднего или старческого возраста с предшествующей в течение 20-30 лет асимптоматической гиперурикемией.
2) Провоцировать приступ острого артрита может переедание, употребление алкоголя, физическая или психоэмоциональная перегрузка, травма, переохлаждение.
Может иметь значение нагрузка пищевыми продуктами, содержащими большое количество пуринов (печень, почки, телятина, молодая баранина).
Небольшая травма сустава, приводящая к внутрисуставному отеку. В состоянии покоя происходит интенсивный отток жидкости из сустава, что приводит к быстрому локальному увеличению концентрации мочевой кислоты.
Прием алкоголя, особенно пива (оно содержит много гуанозина — предшественника мочевой кислоты), погрешности в диете.
3) Причиной приступа может послужить любой фактор, вызывающий резкие колебания концентрации мочевой кислоты в сыворотке, в основном — ее уменьшение. Теоретически, внезапное увеличение концентрации мочевой кислоты может привести к образованию новых кристаллов, в то время как снижение концентрации мочевой кислоты в сыворотке и межклеточной жидкости — к частичному растворению и фрагментации ранее образованных кристаллов. Другие предрасполагающие факторы — это инфекции, хирургические вмешательства, пребывание в больнице, голодание, похудание, переедание, и прием лекарственных средств. Наибольшее значение имеют пребывание в больнице и прием лекарственных средств. У 20 – 86% больных подагрой при госпитализации развивается острый артрит. Причинами его могут быть тяжелые сопутствующие болезни, назначение новых лекарственных средств, водно-электролитные нарушения и общая анестезия. Приступ подагры может развиться при лечении тиазидными диуретиками, вызывающими гиперурикемию, и в начале лечения аллопуринолом и другими гипоурикемическими средствами, низкими дозами ацетилсалициловой кислоты.
4) Иногда острые приступы подагры развиваются и без гиперурикемии. По-видимому, большинство этих приступов связано с резким снижением концентрации мочевой кислоты в сыворотке. Иногда гиперурикемию так и не удается подтвердить, несмотря на многократные попытки. Теоретически, к острому артриту могут привести любые факторы, вызывающие перенасыщение синовиальной жидкости мочевой кислотой. При травмах и отеках объем синовиальной жидкости с нормальной концентрацией мочевой кислоты увеличивается. В ходе лечения вода покидает суставную полость намного быстрее, чем мочевая кислота, поэтому ее концентрация в синовиальной жидкости временно возрастает, создавая условия для кристаллизации и развития острого артрита.
5) До менопаузы женщины болеют редко, возможно, за счёт эффекта эстрогенов на выведение мочевой кислоты.
У женщин в начале заболевания чаще развивается олиго-полиартрит (по-видимому, связано с возрастными особенностями, поскольку у женщин подагра развивается в более пожилом возрасте), чаще поражаются суставы кистей.
6) Острый приступ подагры редко наблюдается у подростков и молодого возраста людей, обычно он вызван первичным или вторичным дефектом синтеза мочевой кислоты.
2. Типичный приступ.
Более половины больных указывают на характерные ощущения, которые предшествуют острому приступу подагры. В продромальный период могут наблюдаться психоэмоциональные расстройства (ухудшение настроения вплоть до депрессии, беспокойство, чувство страха, явления повышенной возбудимости, нервозность и др.), возможны диспепсические нарушения (потеря аппетита, гиперсаливация, обложенность языка, отрыжка, боли и тяжесть в эпигастрии, неустойчивый стул). У части больных в качестве предвестников могут быть чувство разбитости и ломоты в теле, быстрая утомляемость, дизурические расстройства, боли в области сердца, повышение артериального давления. Многие из перечисленных симптомов и синдромов отмечаются и в период остроге приступа.
Проявления:
а) Чаще происходит поражение одного сустава на ногах, причём у 50 % больных страдает первый плюснефаланговый сустав (что, собственно, и называют подагрой).
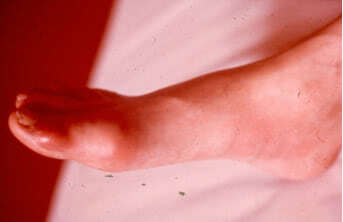
б) Большинство подагрических атак происходит ночью с быстрым нарастанием эритемы и температуры вокруг сустава, отёчности и болезненности. Боль резкая, усиливающаяся при опускании конечности.
в) Воспаление может перейти и на мягкие ткани, формируя клиническую картину целлюлита или флебита.
г) Тяжёлые случаи сопровождает лихорадочная реакция (38-39°С), наблюдается лейкоцитоз, повышение СОЭ.
Течение подагрического приступ:.
а) Обычная продолжительность приступа – несколько дней, реже — несколько недель (2-3 дня, а затем медленно уменьшается в течение 7-10 дней).
б) В некоторых случаях возможен и полиартикулярный вариант:
— могут поражаться суставы свода стопы, голеностопный – “подагрическая стопа”.
— Реже наблюдаются внесуставная локализация воспаления, например, подошвенный фасциит, ахиллобурсит, воспаление узелков Гебердена. Сакроилеит, спондилоартрит и поражение синхондроза рукоятки грудины встречаются редко.
— Все компоненты острого воспаления в поражённых суставах обычно резко выражены, движения в суставах практически невозможны.
в) По мере прогрессирования болезни увеличивается длительность приступов острого артрита, укорачиваются промежутки между ними, моноартрит переходит постепенно в полиартрит (могут вовлекаться коленные, голеностопные, мелкие суставы кистей).
г) Характерная особенность острого подагрического артрита — полное спонтанное выздоровление и отсутствие симптомов между приступами до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующими заболеваниями суставов, наиболее часто — остеоартрозом.
д) Подагрический артрит у женщин возникает в основном в период менопаузы, течение заболевания более мягкое и доброкачественное, редко отмечаются типичные острые приступы. Диагностика подагры
в подобных случаях затрудняется из-за отсутствия выраженных экссудативных явлений в пораженных суставах, могут отмечаться лишь артралгии.
е) Поражение суставов имеет чаще асимметричный характер (интермиттирующая подагра).
Патогенез подагрического приступа:
1. Микротофусы (небольшие кристаллические скопления) в синовиальной мембране и хряще возникают в результате длительной гиперурикемии. Вследствие травмы, повышения температуры в суставе и изменения концентрации мочевой кислоты в крови или синовиальной жидкости микротофусы разрушаются, и кристаллы выходят в суставную полость.
2. Острый приступ подагры вызывает реакция нейтрофилов на уратные кристаллы, приводящая к активации гуморальных и клеточных механизмов воспаления. Уратные кристаллы активируют комплемент, как по классическому, так и по альтернативному пути. Кроме того, происходит контактная активация фактора свертывания XII (фактора Хагемана), стимулирующего образование брадикинина, калликреина и плазмина. Ig и компоненты комплемента опсонизируют (обволакивают) ураты, стимулируя фагоцитарную активность нейтрофилов. Под действием уратных кристаллов из нейтрофилов высвобождаются лизосомные ферменты, свободные радикалы кислорода, метаболиты лейкотриенов и простагландинов, коллагеназа и другие протеазы. Фагосомы нейтрофилов, поглотивших кристаллы, сливаются с лизосомами, а лизосомальные ферменты разрушают белковую оболочку кристаллов. Кристаллы повреждают нейтрофилы, а выделяющиеся в синовиальную полость лизосомальные ферменты потенцируют воспаление.
3. Со временем на смену нейтрофилам приходят макрофаги. Под действием уратных кристаллов из макрофагов высвобождаются простагландины (простагландин Е
2), лизосомные ферменты, ФНО-a, ИЛ-1 и ИЛ-6. Синовиоциты тоже участвуют в развитии воспаления, выделяя ИЛ-8 и другие цитокины. В связи с тем, что под действием мочевой кислоты возможно высвобождение медиаторов воспаления из синовиальных макрофагов, происходит вовлечение в процесс других суставов и мягких тканей.
4. Некоторые белки плазмы влияют на способность уратных кристаллов вызывать воспаление.
5. При воспалении проницаемость синовиальной оболочки повышается, и крупные молекулы, включая липопротеиды, проникают в полость сустава, связываются с уратными кристаллами и, возможно, способствуют прекращению приступа.
Однако есть мнение, что липопротеины способны проникать через воспалённую синовиальную мембрану, взаимодействовать с кристаллами и модулировать воспаление.
 III стадия
III стадия.
Межприступный период.
Выделение межприступного периода имеет принципиальное практическое значение, поскольку систематическое лечение в этот период позволяет не только предотвратить дальнейшее прогрессирование болезни, но и будет способствовать обратному развитию уже образовавшихся тофусов.
Наступает после окончания первого приступа и может прерваться следующей острой атакой. Но и в межприступный период подагра продолжает прогрессировать.
Повторные моноартикулярные атаки
Примерно у 7% больных после первого эпизода подагры повторных атак не отмечают.
Некоторые больные подагрой испытывают приступ лишь однажды в жизни, другие — многократно. Хотя между первым и вторым приступом иногда проходит 40 лет и более, у 75% больных второй приступ наблюдается в течение 2 лет после первого. В межприступном периоде боль в суставах отсутствует.
Однако у 62% повторные приступы возникают в течение первого года болезни.
В типичных случаях в межприступном периоде пациенты не предъявляют жалоб, но если больной не получает лечения, то каждая последующая атака протекает тяжелее и межприступный период укорачивается.
Прогрессирование болезни.
Со временем приступы становятся тяжелее и приобретают характер полиартрита.
Часто сочетаются с более выраженными системными проявлениями.
Отмечается воспаление периартикулярных тканей (связки, суставные сумки). Нередко наблюдается образование единичных тофусов в тканях, обычно безболезненных.
В тяжелых случаях, особенно в отсутствие лечения, со временем развивается хронический подагрический артрит. Промежутки между приступами укорачиваются, а сами приступы становятся более продолжительными, носят мигрирующий характер и поражают уже не один, а несколько суставов, хотя боль может быть и не столь сильной. Хроническая подагра представляет собой полиартрит с постоянной неинтенсивной болью и острым или подострым воспалением. При физикальном исследовании обнаруживают тофусы. Скорость кристаллизации уратов, а также деструкции суставов зависит от тяжести и продолжительности гиперурикемии. Обычно между первым приступом подагры и появлением тофусов проходит около 10 лет. В это время происходит постепенная деструкция хрящевой и костной тканей, признаки которой можно обнаружить при рентгенологическом исследовании.
У некоторых больных быстро, практически без ремиссий, развивается хронический подагрический артрит; в подобных случаях проводят дифференциальную диагностику с РА.
IV стадия (финальная). Хроническая тофусная подагра.
При
хронической подагре симптомы в пораженных суставах полностью не ликвидируются. При этой форме заболевания характерно появление тофусов, хроническое течение артрита.
Хронический подагрический артрит развивается в тех суставах, где ранее отмечалось несколько острых подагрических приступов, проходивших без остаточных явлений.
Чаще наблюдается как результат недостаточного лечения острых приступов или, особенно, лечения в межприступный период.
Тофусы
Иногда, главным образом у женщин пожилого возраста с почечной недостаточностью, принимающих диуретики, тофусы образуются до развития артрита.
Раннее появление тофусов наблюдается:
- при некоторых формах ювенильной подагры,
- у женщин пожилого возраста, принимающих диуретики,
- при миелопролиферативных заболеваниях,
- при некоторых заболеваниях почек, приводящих к ярко выраженной гиперурикемии.
Тофус – это скопление уратных кристаллов, окруженных воспалительными клетками и фиброзными массами.
Типичная локализация тофусов.

- Тофусы часто обнаруживают над поражёнными суставами, в субхондральных отделах суставных поверхностей, на разгибательной поверхности предплечья, в области локтя, над ахилловым и подколенным сухожилиями.
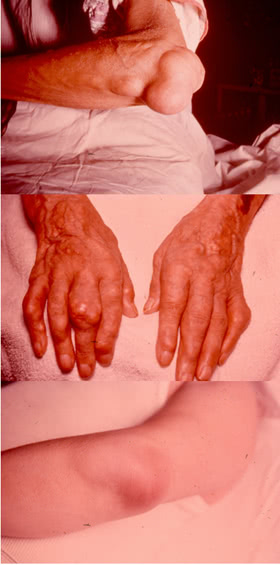
- Могут образовываться практически на любых участках тела и во внутренних органах.
- У женщин в постменопаузе тофусы нередко располагаются в области узелков Гебердена.
Патогенез тофусной подагры.
1. Микротофусы могут образовываться в суставах на ранних стадиях болезни, но пальпируемые большие скопления уратов формируются на протяжении нескольких лет.
Скорость формирования тофусов прямо зависит от тяжести течения болезни и длительности гиперурикемии.
— При
лёгком течении болезни, когда приступы артрита возникают 1-2 раза в год, характерны моноартритические поражения, лишь единичные тофусы, рентгенологические изменения в суставах минимальны.
— При
средней тяжести течения частота приступов артрита достигает 3-4 в год, чаще наблюдается олигоартрит, тофусы, отчётливы рентгенологические изменения суставов, выраженная нефропатия.
— При
тяжёлом течении процесс быстро охватывает несколько суставов (полиартрит), частота приступов превышает 4 в год, характерные множественные тофусы, выражены внесуставные поражения.
На фоне хронического подагрического артрита периодически могут возникать острые приступы, продолжающиеся несколько недель. При этом наблюдается наиболее тяжелая клиническая картина так называемого подагрического статуса, когда непрерывные интенсивные приступы моно, олиго- или полиартрита с умеренно выраженной воспалительной реакцией могут наблюдаться до нескольких месяцев.
При асимптоматической гиперурикемии тофусы не формируются.
2. Эрозии суставного хряща и подлежащей костной ткани возникают за счёт смещения тофусами нормальной ткани и последующей воспалительной реакции.
3. Свищи.
Тофусы иногда размягчаются, самопроизвольно вскрываются, образуются свищи, через которые выделяется беловатая, напоминающая зубную пасту, масса.
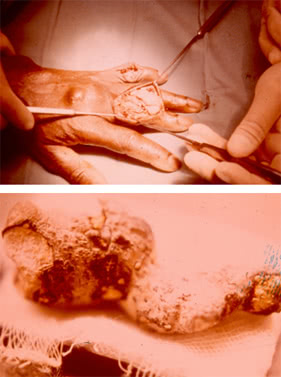
При микроскопическом исследовании последней обнаруживаются кристаллы мочекислого натрия.
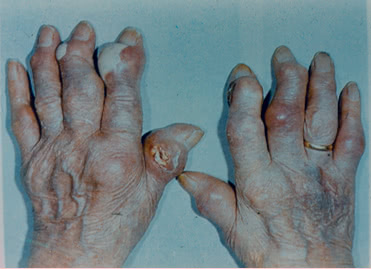
Свищи редко инфицируются, что связывают с бактерицидным действием содержимого тофусов, но заживают медленно.
С течением времени в пораженных суставах возникают явления ОА, что способствует развитию функциональной недостаточности суставов.
4. Постепенно нарастают стойкие изменения суставов,
признаки хронического полиартрита развивается полиартрит, включающий в себя не только плюснефаланговые суставы, но и крупные суставы (коленные, локтевые, плечевые). Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны (чаще поражаются суставы ног).
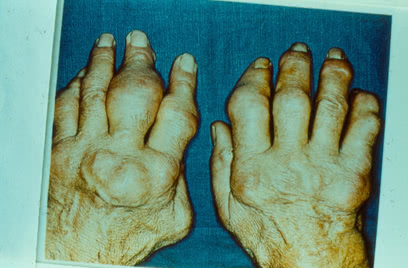
С течением времени возникают:
- дефигурация суставов,
- ограничение подвижности,
- деформация вследствие узелковых отложений, костных разрастаний, сначала фиброзный, затем костный анкилоз,
- подвывихи пальцев,
- контрактуры,
- грубый хруст в коленных и голеностопных суставах.
Такие больные с трудом передвигаются, трудоспособность их снижена, а иногда утрачена.
Внесуставные поражения при подагре.
Больные с подагрой имеют характерную внешность – одутловатость, пастозность лица, гиперемия верхней половины туловища, ожирение.
 Поражение почек.
Поражение почек.
Из подагрических висцеропатий наиболее часто встречается
поражение почек. При нарушении пуринового обмена почки являются органами – мишенями. Частота поражения почек у больных подагрой колеблется в широких пределах — от 30 до 75%.
При использовании радиоизотопной ренографии нарушение функции почек выявляется у 93% больных.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома. Они могут появиться на любой стадии подагры. Прогностически поражение почек при подагре очень неблагоприятно, поэтому большое значение имеет своевременная диагностика подагрической нефропатии.
Подагрическая нефропатия – собирательное понятие, включающее всю почечную патологию, наблюдаемую при подагре (тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз, артериосклероз и артериосклероз с развитием нефросклероза).
Можно выделить
три варианта поражения почек при подагре:
- медленно развивающийся хронический интерстициальный процесс,
- образование камней,
- острая блокада почек мочевой кислотой с развитием острой почечной недостаточности.
Изучены следующие
типы течения подагрической нефропатии.
- Протеинурический (с ранним появлением стойкой протеинурии, иногда с развитием нефротического синдрома) – чаще наблюдается при тофусной подагре.
- Латентный (с переходящим мочевым синдромом или без последнего).
- Уролитиазный (чаще с вторичным пиелонефритом). Может возникать задолго до появления подагрического артрита.
- Гипертензивный (с ранней упорной артериальной гипертензией).
- Смешанный.
Наиболее неблагоприятно течение болезни при протеинурическом типе нефропатии.
У части больных с поражением почек постепенно и бессимптомно может появиться
хроническая почечная недостаточность, что служит непосредственной причиной смерти почти каждого пятого больного подагрой.
В некоторых случаях при подагре в почках выявляются изменения, характерные для гломерулонефрита. Клинически он характеризуется латентным течением с преобладанием гематурии и неуклонным прогрессированием в сторону хронической почечной недостаточности. Особенностью гломерулонефрита при подагре являются эпизоды обратимого нарушения функции почек.
В основе подагрической почки лежит отложение уратов в интерстициальной ткани почки.
Отложения имеют очаговый характер, располагаются чаще в межуточной ткани, иногда в просвете канальцев, вокруг них возникает воспалительная реакция.
В 40% случаев образование мочевых камней предшествует появлению артрита. Риск мочекаменной болезни при подагре зависит от концентрации мочевой кислоты в сыворотке и моче. Мочевые камни обнаруживают примерно у 50% больных, у которых концентрация мочевой кислоты в сыворотке превышает 770 мкмоль/л (13 мг%), а ей суточная экскреция — 6,5 ммоль (110 мг).
При подагре образуются не только уратные мочевые камни, состоящие из мочевой кислоты и ее солей. Примерно у 15% больных обнаруживают оксалатные, фосфатные или смешанные мочевые камни. Мочевая кислота может составлять ядро, на котором осаждается оксалат кальция, или ускорять кристаллизацию оксалата кальция. Более того, уратные камни обнаруживают и в отсутствие других проявлений подагры, причем у 80% таких больных даже нет гиперурикемии. Иногда гиперурикемию и повышение концентрации мочевой кислоты в моче обнаруживают у людей с оксалатными камнями в почках, но без признаков подагры.
Уратная нефропатия. Это позднее проявление тяжелой подагры, приводящее к развитию ХПН. При гистологическом исследовании в интерстициальной ткани и почечных пирамидах обнаруживают скопления кристаллов мононатриевой соли мочевой кислоты в окружении гигантских клеток. Эта форма поражения почек встречается редко, и в отсутствие подагрического артрита диагностика ее невозможна. Она может протекать бессимптомно или проявляться протеинурией, артериальной гипертонией и почечной недостаточностью.
Раньше, когда не было гипоурикемических средств и было не принято активно лечить бессимптомную артериальную гипертонию, 25% больных подагрой умирали от почечной недостаточности. При аутопсии в почках обнаруживали уратные кристаллы, пиелонефрит и изменения сосудов. В настоящее время функция почек при подагре обычно нарушается из-за возрастных изменений или поражения почек другого происхождения (например, при артериальной гипертонии и других сердечно-сосудистых заболеваниях).
При
подагрической нефропатии поражаются сосуды – от начального фиброза до выраженного нефроангиосклероза.
В редких случаях на первый план выступают изменения клубочков. Отмечается утолщение стенок капилляров клубочка, клеточная пролиферация, склероз клубочков, гиалиновые отложения.
При исследовании нефробиоптатов у всех больных подагрой без исключения обнаруживались морфологические признаки, сходные с таковыми при первичном гломерулонефрите. В происхождении последнего доказана роль иммунокомплексных механизмов.
Поражение сосудов почек при подагрё также связано со сдвигами в иммунной системе вследствие активации кристаллами мочевой кислоты комплемента, лейкоцитов и тромбоцитов, а также с изменениями липидного
обмена и предрасположенностью к атеросклерозу.
Нет строгого параллелизма между выраженностью и быстротой прогрессирования нефропатии и развитием суставного синдрома.
Острая мочекислая нефропатия. Заболевание обусловлено кристаллизацией мочевой кислоты в почечных канальцах и собирательных трубочках, что приводит к нарушению уродинамики и обратимой ОПН. Причины острой мочекислой нефропатии — это внезапное усиление образования мочевой кислоты и резкое повышение ее концентрации в моче. Обезвоживание и ацидоз способствуют кристаллизации мочевой кислоты. Острая мочекислая нефропатия наблюдается при бластном кризе, лечении цитостатиками (синдром распада опухоли), после эпилептических припадков, интенсивной физической нагрузки и перегревания. При аутопсии обнаруживают отложения мочевой кислоты в канальцах и трубочках, расширение проксимальных канальцев и неизмененные клубочки. Считается, что развитие патологического процесса начинается с обструкции дистальных канальцев и собирательных трубочек.
Своевременное выявление и лечение позволяют снизить смертность при острой мочекислой нефропатии с 50% практически до нуля. При диагностике нельзя ориентироваться на концентрацию мочевой кислоты в сыворотке, которая может колебаться от 720 до 4800 мкмоль/л (12—80 мг%). Основной диагностический признак — это концентрация мочевой кислоты в моче. В большинстве случаев ОПН, сопровождающейся олигурией, эта концентрация нормальная или сниженная, а отношение массовых концентраций мочевой кислоты и креатинина меньше единицы. При острой мочекислой нефропатии это отношение в любой пробе мочи или в суточной моче всегда больше единицы.
Таким образом, массивная экскреция мочевой кислоты приводит к поражению тубулярного аппарата почек и вторично — интерстиции почек. В процессе прогрессирования заболевания происходит повреждение клубочков с развитием иммунокомплексного гломерулонефрита. Поражение клубочкового аппарата и включение иммунных, в том числе перекрестно-реагирующих, реакций приводит к прогрессированию тубулопатии и поражению почечных клубочков.
Подагрическая почка — наиболее частый и значимый вариант подагрической висцеропатии.
Однако кроме этого, в период острых приступов подагрического артрита иногда отмечаются:
Гепатопатия
Она обусловлена образованием подагрических узлов в печени; специфические
Поражения глаз
Протекают по типу ирита, иридоциклита, конъюнктивита.
Приступы мигрени
Аллергические проявления
В форме экземы или бронхоспастического синдрома.
Подагрические флебиты
Поражения спинного мозга
На аутопсии нередко выявляется отложение масс кристаллов мочевой кислоты в области спинного мозга.
Поражения сердца и сосудов
Описаны случаи тяжелого поражения клапанного аппарата сердца вследствие отложения уратов на створках клапанов. Еще в 1954 г. M.Prinzmetal приводил сведения о нормализации сердечного ритма и купировании явлений перикардита на фоне лечения больных подагрой препаратами, нормализующими уровень мочевой кислоты. Склонность к артериальной гипертензии, коронарной недостаточности, тромбозам, атеросклерозу.
Метаболическая форма подагры может быть причиной нарушения микроциркуляции с расширением венул, поражением артериол и капилляров.
Поражения нервной системы
На фоне классического приступа подагрической атаки с помощью рентгенологических и сцинтиграфических методов диагностики установлен случай дистрофии симпатической нервной системы, описывается атипичное внекостное расположение тофусов, обнаруженное у больных в начале заболевания. Могут развиваться острые формы люмбаго и радикулиты за счет отложения уратов в зоне межпозвонковых суставов, что ведет к локальному воспалению и раздражению нервных корешков.
Нередко возникают миозиты, тендиниты, тевдовагиниты.
Часто те или иные висцеральные проявления подагры обнаруживают еще до развития типичного подагрического артрита.
Возможны специфические ангины, бронхиты, хронические колиты, ириты, иридоциклиты.
Рентгенологические изменения
Характерные для подагры рентгенологические изменения развиваются обычно не ранее 3 лет с начала заболевания. При этом одновременно можно наблюдать признаки деструкции, дегенерации и регенерации.
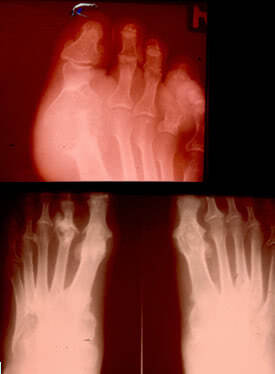
При остром артрите специфических изменений не рентгенограммах не выявляется.
1. Крупные штампованные дефекты эпифизов костей, окружённые склеротической каймой, симптом «пробойника».
2. Кистовидные (крупной или овальной формы) дефекты, которые могут разрушать кортикальный слой кости, симптом «вздутия костного края». Наличие этих патологических явлений связывают с образованием костных тофусов.
3. Иногда обнаруживают костные эрозии – интраартикулярные и периартикулярные, центральные и краевой локализации.
4. В редких случаях наблюдается крупные эрозии костей с остеолизом эпифиза и диафиза, возможно замещение их уратными массами.
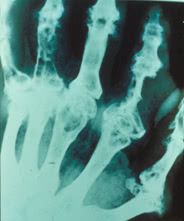
Все выше указанные изменения находят чаще всего в первом плюснефаланговом суставе и фалангах пальцев, однако их можно встретить и в любых суставах.
Однако указанная рентгенологическая картина подагры встречается в настоящее время редко – при большой длительности заболевания, а также при тяжёлых формах болезни у лиц молодого возраста.
В большинстве же случаев при достоверной подагре рентгенологическая картина соответствует явлениям остеоартроза или не обнаруживает каких-либо изменений.
5. Утолщение и расширение тени мягких тканей при подагре обусловлены отложением в них уратов и образованием подагрических узелков.
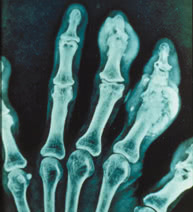
На основании этих изменений выделяют
три рентгенологические стадии хронического подагрического артрита (Кавеноки—Минц Э., 1987):
I стадия. Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
II стадия. Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
III стадия. Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лабораторные данные
1. При повышении активности: в-липопротеинемия, ↑ СОЭ, лейкоцитоз, ↑ a
2-глобулинов, ↑ фибриногена, ДФА-пробы, серомукоидов.
2. Гиперурикемия.
Для подагры характерна гиперурикемия свыше 6-7 мг%, особенно на фоне диеты с ограничением пуринов в течение 3-5 дней.
Однако, необходимо отметить, что в 10% случаев при подагре содержание мочевой кислоты не превышает физиологических величин, поэтому этот показатель не считают специфичным для острого подагрического артрита.
3. В синовиальной жидкости находят уратные кристаллы.
Причём, наибольшее диагностическое значение имеют игольчатые кристаллы, расположенные внутриклеточно и двоякопреломляющие свет при исследовании в поляризационном микроскопе.
Кристаллы обычно наблюдаются в нейтрофилах в период острого подагрического артрита. Цитоз 10000-60000 клеток на мм
3 (преимущественно нейтрофилы).
4. Аспирация содержимого тофусов позволяет обнаружить кристаллы
мочевой кислоты.
5. В моче – кристаллы уратов.
Диагноз
Диагноз подагры основывается на клинических, лабораторных и рентгеновском методах исследования.
Клинико-лабораторные критерии.
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры.
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости суставов или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1.- 2 нед.
Диагноз подагры считается достоверным при наличии, по крайней мере, двух из четырех приведенных критериев.
Критерии SL.Wallace и соавт. (1997 г.), рекомендованные ВОЗ в 2000 г
В последнее время данные критерии все большее распространение приобретают для широкой клинической практики в связи с решением ООН и ВОЗ о проведении международной декады костей и суставов (2000-2010), основная цель которой – раннее распознавание, лечение и предупреждение наиболее распространенных костно-суставных болезней.
Классификационные критерии диагноза подагры
(Wallace и соавт., 1997г.)
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
- Максимальное воспаление сустава в 1 день.
- Наличие более чем 1 атаки артрита.
- Моноартрит.
- Покраснение суставов.
- Боль и воспаление плюснефалангового сустава (ПФС) 1 пальца.
- Асимметричное воспаление ПФС.
- Одностороннее поражение тарзальных суставов.
- Подозрение на тофусы.
- Гиперурикемия.
10. Асимметричное воспаление суставов.
11. Субкортикальные кисты без эрозий при рентгенологическом исследовании.
12. Отсутствие микроорганизмов в культуре синовиальной жидкости.
Обсуждая представленные критерии диагноза подагры, необходимо обратить внимание, что наиболее достоверное диагностическое значение предоставлено обнаружению характерных кристаллов в синовиальной жидкости. В то время как в Римских критериях диагноза подагры (1961 г.) на первое место выдвигалась гиперурикемия, «передвинутая» по диагностическому значению к концу XX века практически в конец перечисленных клинических, лабораторных, рентгенологических признаков.
К ошибкам в диагностике подагры ведет незнание того факта, что во время острого приступа уровень мочевой кислоты у многих больных (39-42%) снижается до нормальных цифр.
Среди инструментальных методов диагностики
рентгенологическое исследование имеет наибольшее значение.
Незаменимое значение в диагностике подагры имеет
исследование состава синовиальной жидкости. Обнаружение кристаллов уратов в синовиальной жидкости, и особенно в лейкоцитах, является специфичным для подагры. Частота внутриклеточно расположенных уратов ассоциируется с остротой заболевания. Наличие кристаллов мочевой кислоты в свежей синовиальной жидкости определяется с помощью поляризационного светового микроскопа. Кристаллы имеют иглообразную форму и отличительные светооптические свойства – отрицательное двойное лучепреломление. Пороговая концентрация кристаллов уратов в синовиальной жидкости, доступная для идентификации, составляет около 10 мкг/мл. Таким образом, исследование синовиальной
жидкости позволяет более достоверно устанавливать диагноз подагры даже в атипичных случаях.
Но нужно принимать во внимание относительно невысокую чувствительность этого метода исследования (69%), зависимость результатов от опытности и тщательности микроскописта, а также от количества кристаллов и их размеров. Кристаллы моноурата натрия в синовиальной жидкости можно обнаружить (как правило, вне клеток) у больных с поражением суставов другой этиологии при одновременно существующей бессимптомной гиперурикемии, например, при псориатическом артрите, гиперпаратиреозе, саркоидозе, злокачественных опухолях, почечной недостаточности.
Яркий эффект колхицина, ранее считавшийся диагностическим признаком подагры, теперь в качестве такового не рассматривается, так как может наблюдаться при псевдоподагре и ряде других острых артритах.
Дифференциальный диагноз
При типичном дебюте диагноз подагры не вызывает трудностей. Затруднения при диагностике возникают тогда, когда острый подагрический артрит в дебюте протекает атипично (примерно 1/3 пациентов), еще отсутствуют тофусы, не развились типичные рентгенологические признаки.
I. Острый суставной ревматизм, палиндромный ревматизм.
Ревматизмом чаще болеют дети и подростки. Заболевание начинается, как правило, через 2 нед после перенесенной ангины. Типично наряду с явлениями артрита и поражение сердца. В крови обнаруживается повышение титра противострептококковых антител. Суставной синдром быстро ликвидируется под влиянием терапии салицилатами.
При подагре – отсутствие ревмокардита, кристаллы мочевой кислоты – везде.
II. Ревматоидный артрит.
Для РА характерно постепенное развитие болезни с поражением проксимальных межфаланговых и пястно-фаланговых суставов кистей. При нем наблюдается симметричность вовлечения суставов в патологический процесс, утренняя скованность, быстро развивающиеся мышечные атрофии, нарушение функции суставов, ревматоидная кисть. Из лабораторных показателей для РА характерно стойкое и отчетливое СОЭ, выявление ревматоидного фактора, через несколько месяцев от начала заболевания – типичные рентгенологические признаки I стадии РА. Необходимо учитывать, что ускорение СОЭ может быть и на фоне подагрической атаки, кроме того, у 30% больных подагрическим артритом выявляется ревматоидный фактор в низких титрах.
1. При подагре нет утренней скованности.
2. Иногда с тофусами путают и ревматоидные узелки, чаще располагающиеся периостально вблизи локтевого отростка.
3. Случаи сочетания РА и подагры (сосуществование двух форм) встречаются редко, описания их весьма немногочисленны. Высказывается мнение, что гиперурикемия и подагра препятствуют развитию РА.
Сочетание подагры и ревматоидного артрита (чаще серонегативного) характеризуется более мягким клиническим течением, что объясняется иммунодепрессивньгм действием мочевой кислоты. Аналогичный вариант течения болезни имеет место при сочетании подагры с болезнью Бехтерева.
4. Отсутствие эффекта от применения колхицина.
III. Рожистое воспаление.
Рожистое воспаление обычно начинается с лихорадки, озноба, головной боли, миалгии, и только через 10—24 ч от начала заболевания появляется боль в пораженной конечности. Решающее значение имеет определение уровня мочевой кислоты в крови.
Против «рожи» свидетельствуют:
1. Нечёткость воспаления при подагре.
2. Отмечается бесполезность антибактериальной терапии при подагре.
3. Незаинтересованность лимфатических сосудов при подагре.
IV. Остеоартроз.
1. Одной из важных отличительных особенностей подагры от ОА является отсутствие при последнем выраженных воспалительных явлений в суставах и местной гиперемии кожи. Болевой синдром при остеоартрозе нарастает к вечеру, после физических нагрузок, наблюдаются «стартовые» боли, часто встречаются геберденовские узелки.
2. Иногда типичные для остеоартроза узлы Гебердена расценивают как подагрические узлы, тофусы.
3. При остеоартрозе – остеофиты, локализующиеся на боковых поверхностях эпифизов, признаки субхондрального остеосклероза, сужение суставных щелей, отсутствует стойкая и значительная гиперурикемия.
V. Инфекционные артриты.
VI Псориатический артрит.
Как для подагры, так и для псориатической артропатии, характерна гиперемия пораженных суставов. Однако при псориазе поражение суставов симметрично, характерны мышечные атрофии, быстрое нарушение функции сустава. В патологический процесс вовлекаются дистальные межфаланговые суставы кистей, болевой синдром не носит приступообразный характер, характерны псориатические высыпания на коже.
VII. Реактивные артриты.
При реактивном артрите
суставной синдром обычно стойкий, но при этом отсутствует гиперурикемия. Реактивные артриты обычно развиваются на фоне инфекционного заболевания или сразу после него. Важным в диагностическом плане является выявление в крови больного повышенного титра антител к таким инфекционным возбудителям, как, иерсиния, токсоплазма, гонококк, хламидия и др.
VIII. Гонорейный артрит.
IX. Травматический артрит.
X. Интермиттирующий гидроартроз.
XI. Псевдоподагра (хондракальциноз).
Дифференциальная диагностика подагры и хондрокальциноза наиболее трудна.
1. Это пирофосфатная артропатия (ПФА).
2. Накопление кристаллов пирофосфата кальция в хрящах и околосуставных тканях может приводить к возникновению гаммы суставных проявлений – от асимптоматических до острого или хронического артрита.
При этом заболевании также отмечаются приступообразные боли в суставах. Однако суставные кризы при хондрокальцинозе более продолжительные (от 1 до 5 – 6 нед). Редко отмечается гиперемия пораженных суставов. Чаще поражаются коленные, лучезапястные и голеностопные суставы. Отсутствует гиперурикемия.
3. Итак,
псевдоподагра – острая форма болезни отложения кристаллов пирофосфата кальция. Абсолютным признаком хондрокальциноза является обнаружение в синовиальной жидкости или в синовиальной оболочке сустава кристаллов кальция пирофосфата.
Следовательно, для диагностики необходима пункция сустава и микроскопическое исследование синовиальной жидкости и/или биопсия синовиальной оболочки.
4. Рентгенологически псевдоподагра проявляется и кальцификацией менисков коленных суставов или отложением кальция на гиалиновое вещество суставного хряща (обызвествление хрящей). В подобных случаях на рентгенограмме виден двойной контур края кости. Отложение кальция может быть и в сухожилиях.
ХII. С подагрой иногда отождествляют деформацию стопы типа halux valgus,
При этом заболевании с внешней стороны I пальца, возле плюснефалангового сустава, обычно образуются омозолелости и бурсит.
ХIII. Подагру следует дифференцировать с ксантоматозом,
При этом заболевании наблюдаются сходные с тофусами мелкие узелки. Биопсия узелков и их гистологическое исследование позволяют в подобных случаях уточнить диагноз.
Лечение
Цели лечения:
- быстрое и безопасное купирование острого подагрического артрита,
- предупреждение рецидивов,
- предотвращение перехода болезни в хроническую стадию, сопровождающуюся образованием тофусов, поражением почек и деструкцией суставов.
Вопросам лечения подагры посвящено множество трудов, начиная с работ Гиппократа. Казалось бы, в лечении подагры – все ясно и понятно. На самом деле, за последнюю четверть века не было создано ни одного нового противоподагрического препарата. Тем не менее, далеко не все вопросы терапии решены. До сих пор не существует единых унифицированных терапевтических рекомендаций ни по проведению собственно подагрической терапии, ни по купированию острого приступа. На это есть ряд причин, основными из которых, на наш взгляд, являются следующие:
1. Индивидуальные особенности каждого пациента, обусловленные:
гетерогенностью собственно заболевания (течение болезни с/без поражения почек, наличие сопутствующей патологии, уровень гиперурикемии и клиренса креатинина, частота артритов и т.д.),
образом жизни, питания и послушанием пациента.
2. Особенность препаратов, применяющихся для лечения подагры: в частности, изменение их фармакодинамики при наличии поражения почек и печени и побочные реакции, частота которых увеличивается при указанных состояниях.
3. Индивидуальное пристрастие врача к тому или иному препарату.
Демонстрацией последнего факта являются исследования, проведенные в Америке, Канаде, Франции, в которых было показано, что в острую стадию большинство американских и канадских ревматологов назначают нестероидные противовоспалительные препараты (НПВП) и, наоборот, 63% ревматологов Франции отдают предпочтение колхицину. Тем не менее, при всей индивидуальности терапии, на современном этапе разработаны определенные подходы к методам купирования острого приступа, каждый из которых имеет свое место и показывает эффективность при соблюдении конкретных правил назначения и непременном контроле побочных эффектов. Различия заключаются только в скорости наступления эффекта и переносимости, а общая закономерность – отсутствие влияния на гиперурикемию.
 Бессимптомная гиперурикемия.
Бессимптомная гиперурикемия.
Многие годы страх перед мнениями заставлял врачей назначать гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с некачественными новообразованиями при назначении цитостатиков.
Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры. Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих больных мочекаменной болезнью имеется гиперурикемия, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие, как артериальная гипертония, гиперхолестеринемия, сахарный диабет и ожирение.
Выводы:
1. Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения.
2. У пациентов с длительно повышенным (до 10 мг%) уровнем мочевой кислоты в крови риск развития острого приступа подагры увеличен на 90%, однако многие врачи назначают лечение до развития подагрической атаки.
3. Необходима только коррекция предрасполагающих факторов. На этой стадий подагры, как и на всех других стадиях, необходимо контролировать вторичную гиперурикемию.
4. На этой стадии (особенно) правильное питание – основа лечения.
Диета
Диета при подагре преследует целью ограничить поступление пуринов в организм с пищей, что позволяет уменьшить дозы лекарственных препаратов. Предпочтительна преимущественно молочно-растительная диета (стол № 6 по Певзнеру).
1. Потребность организма в калориях должна удовлетворяться в основном за счет углеводов, однако, общую калорийность пищи у тучных больных следует ограничить.
2. Из рациона исключают богатые пуринами продукты (печень, почки, мозги, легкие, крепкие мясные бульоны, жареное мясо). Ограничивают употребление бобовых, шпината, салата, щавеля, баклажанов, редиса, цветной капусты, отварного мяса, рыбы, шоколада, кофе, какао.
3. Ограничивают употребление жира (не должно превышать 1 г/кг). Мясо или рыбу употребляют не больше 1 раза в день, в более тяжёлых случаях – 2 -3 дня в неделю.
В небольших количествах в рационе могут присутствовать яйца, мучные и крупяные блюда, нежирные сорта рыбы, говядина, баранина. Рыбу и мясные блюда следует употреблять в отварном виде. В минимальном количестве пуриновые основания и мочевая кислота содержатся в молоке и молочных продуктах, хлебе, картофеле, моркови, капусте, орехах, яблоках, грушах, сливах, вишнях, арбузах, дынях, огурцах, луке, апельсинах, абрикосах, персиках, лимонах и винограде. Пища должна содержать необходимое количество витаминов, особенно аскорбиновой кислоты, рутина, рибофлавина. Поэтому полезны отвары шиповника, лимоны, яблоки, черная смородина.
4. Количество белков уменьшают до 0,5-1г/кг, поваренную соль ограничивают до 2-4 г в день.
5. Показано обильное питьё 1,5-2 литра жидкости в день с включением щелочных минеральных вод или ощелачивающих средств. В отдельных случаях количество жидкости желательно увеличить до 2-3 литров в день (рецидивирующая почечная колика, острый подагрический артрит).
6. Категорически запрещаются алкогольные напитки, поскольку алкоголь увеличивает образование мочевой кислоты в организме и блокирует её экскрецию почками.
Однако хочется ещё раз подчеркнуть, что соблюдение диеты для снижения уровня урикемии бывает достаточно лишь в начальных фазах болезни.
Острый подагрический артрит.
Наиболее эффективно лечение острого подагрического артрита в самом раннем периоде.
1. Начало — с принятия общих мер, направленных на смягчение проявлений суставного синдрома: полный покой, возвышенное положение конечности, местно — холод. Обильное питье (2-2,5 л жидкости в день) — щелочные растворы, разведенный лимонный сок, молоко, кефир, кисели, компоты. Рекомендуются овощные супы, жидкие каши.
2. Ограничить все субпродукты (печень, почки, мозги, язык), все сорта мяса, особенно молодых животных, рыбы и птицы, копчености, консервы, мясные и рыбные бульоны; растительные белки (бобовые, грибы), редис, цветная капуста, шоколад. Стоит также ограничить употребление чая, кофе, какао, всех алкогольных напитков, особенно шампанского. Назначают обычный приём щелочных вод, диету с ограничением пуринов. Следует предостеречь больных от полного голодания из-за опасности увеличения урикемии вторичного характера (усиленный распад белков при голодании).
3. Как и во всех других случаях артритов, важно обеспечить покой и иммобилизацию больного сустава.
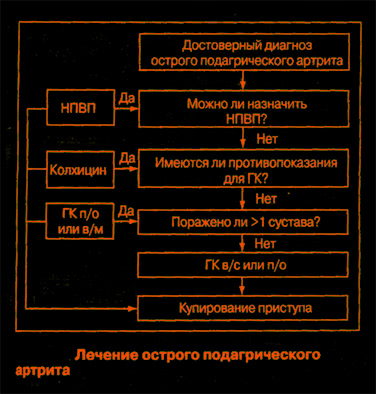
Существует два классических медикаментозных подхода к купированию приступа подагры:
I. Назначение колхицина
II. Назначение нестероидных противовоспалительных препаратов (НПВП).
В настоящее время признано, что в целом эффективность этих двух методов одинакова. Различия заключаются только в скорости наступления эффекта и переносимости. Колхицин начинает действовать быстрее: между 12 и 48 ч (НПВП – между 24 и 48 ч), но несомненно чаще вызывает побочные явления.
Колхицин
Колхицин является мощным ингибитором фосфатазы, тормозит процессы деления клеток. Показано, что при контакте нейтрофилов с уратными кристаллами происходит фосфорилирование остатков тирозина в белках этих клеток. Колхицин, традиционно применяемый для лечения подагры, препятствует активации нейтрофилов, угнетая фосфорилирование тирозина.
1. Назначение колхицина в первые часы подагрического криза позволяет купировать последний либо значительно ослабить его.
2. Препарат обладает способностью блокировать фагоцитоз и деление клеток, что препятствует высвобождению медиаторов воспаления из нейтрофилов и синовиоцитов.
3. Его назначают в/в, но из-за токсичности препарата следует соблюдать осторожность при лечении пожилых людей и больных с заболеваниями почек и печени. Поэтому его назначают при неэффективности НПВП или при наличии противопоказаний для их назначения.
Разовую дозу (1 – 2 мг) разводят в 20 мл физиологического раствора (в/в – в течение 20-30 мин). Через 6 – 12 ч можно ввести еще 1 мг. Абсолютные противопоказания к в/в введению колхицина — это угнетение кроветворения, нарушение функции почек (СКФ менее 10 мл/мин, олигурия или анурия), болезни печени (биохимические показатели функции печени в 2 раза превышают верхнюю границу нормы) и сепсис.
Колхицин можно назначать и перорально по 0,6 – 1,2 мг каждый час или каждые 2 часа в 1-е сутки до исчезновения симптомов или появления побочных эффектов со стороны ЖКТ. В отсутствие эффекта препарат отменяют через 10 ч (в этом случае диагноз подагры ставится под сомнение)
или более безопасная схема:
первый день — Колхицин внутрь по 1 мг 3 р/сут после еды
второй день — Колхицин внутрь по 1 мг утром и вечером
затем — Колхицин внутрь по 1 г/сут
Нередко уже к концу первого дня наступает терапевтический эффект, после чего дозу препарата уменьшают до 1-0,5 мг в сутки.
4. Длительность лечения может быть непродолжительной – 2 – 4 суток.
5.При пероральном назначении колхицина возможны также побочные явления:
- Токсическое влияние на ЦНС, печень, почки, костный мозг.
- Тошнота.
- Рвота.
- Диарея.
- Боли в животе, что связано с воздействием препарата, на гладкую мускулатуру ЖКТ.
- Длительное его применение может приводить к развитию нейромышечных нарушений, в частности миопатии, напоминающей полимиозит.
Необходимо отметить, что эти явления могут возникать иногда до появления клинического эффекта. Кроме того, при длительном лечении возможны гематологические осложнения:
- лейкопения,
- тромбоцитопения.
6. Чтобы избежать этих явлений, рекомендуется строго придерживаться следующих правил (S.Wallace и J.Singer):
- однократная доза не должна превышать 2 мг, а суммарная – 4 мг (обычно сначала вводят 1 мг колхицина, растворенного в 20 мл изотонического раствора хлорида натрия, в течение не менее 10 мин);
- если накануне данный пациент получал колхицин внутрь, применять этот препарат внутривенно не следует; после внутривенного введения полной дозы нельзя применять колхицин ни в каком виде как минимум 7 дней;
- при наличии заболеваний почек или печени доза колхицина должна быть уменьшена (наполовину, если клиренс креатинина ниже 50 мл/мин; если же этот показатель ниже 10 мл/мин, колхицин не применяют); у пациентов пожилого возраста перед внутривенным применением колхицина желательно исследовать клиренс креатинина (если это невозможно, дозу снижают вдвое);
Абсолютным противопоказанием для его назначения является сочетание почечной и печеночной недостаточности, выраженное снижение клубочковой фильтрации и внепеченочная биллиарная обструкция.
Следует принимать меры предосторожности для устранения опасности попадания колхицина вне вены. Начало действия внутривенно вводимого колхицина отмечается в пределах 6-12 ч.
7. Действие колхицина настолько специфично для подагры, что в сомнительных случаях назначают пробное лечение этим препаратом: его положительный эффект сам по себе является диагностическим критерием.
Однако, колхицин эффективен и при других болезнях, особенно при псевдоподагре (с отложением кристаллов дигидрата пирофосфата кальция) и апатитной болезни (с отложением основного фосфата кальция или гидроксиапатита). Эти болезни клинически неотличимы от подагрического артрита, причем могут наблюдаться и у больных с гиперурикемией.
НПВС.
- Применяют в больших дозах и коротким курсом.
- Используют любые препараты этой группы, но рекомендуют избегать препаратов, влияющих на выведение мочевой кислоты (салицилаты, дифлунизал). Ацетилсалициловая кислота в малых дозах, блокируя экскрецию уратов, способствует возникновению гиперурикемии, в связи с чем при обострениях подагрического артрита её нужно применять в дозе не менее 4 г в сутки. С осторожностью назначают НПВС при заболеваниях ЖКТ, печени, почек.
1) Методом выбора при остром подагрическом артрите является индометацин (в первые сутки – до 300 мг, в дальнейшем суточная доза может не превышать 75-100 мг.
2) Ингибиторы ЦОГ-2 (найз, мовалис, целебрекс).
3) Пиразолоновые производные:
– реопирин;
– бутадион (на высоте приступа можно до 0,9 г бутадиона в сутки – он увеличивает выделение мочевой кислоты). В дальнейшем дозу бутадиона снижают до 0,15 г 2-3 раза в сутки;
– в случае большой интенсивности воспалительных явлений в области суставов можно применять пиразолоновые производные парентерально.
4) Для снятия острых болей — кеторол (мощный ненаркотический аналгетический препарат) в/м по 1 мл (30 мг) каждые 4-6 час.
Кортикостероиды.
Хороший эффект применения глюкокортикоидов (ГК) при остром приступе известен давно, метод считается безопасным и показан при невозможности применения НПВП или колхицина из-за непереносимости препаратов, наличия почечной недостаточности, язвенного поражения ЖКТ. ГК применялись различными способами: наиболее популярно – внутрисуставное введение их.
1. Внутрисуставное введение глюкокортикоидов с обязательным предварительным промыванием сустава — чрезвычайно эффективный метод купирования острого подагрического артрита:
В крупные суставы 10—40 мг;
В мелкие суставы 5—20 мг
2. Однако частота применения их парентерально также неуклонно увеличивается. D.Werlen и соавт. было показано, что эффект от их введения бывает быстрым и стойким, даже при применении единичных внутримышечных доз (7 мг бетаметазона) или внутривенном введении 125 мг метилпреднизолона. Возможен прием их внутрь: преднизолон в начальной суточной дозе –30-50 мг, через 1-2 дня дозу быстро снижают, примерно через 10 дней препарат отменяют.
Триамцинолон ацетонид в/м 60 мг, при необходимости введение повторить через 24 ч.
Переносятся препараты хорошо, частота побочных реакций в целом невелика, возможны единичные случаи преходящей гипергликемии.
3. Наряду с изолированным применением ГК был показан значительный терапевтический эффект сочетания ГКС с небольшими дозами колхицина, при этом по сравнению с индометацином побочных эффектов было значительно меньше.
Препараты, снижающие концентрацию мочевой кислоты
(аллопуринол, пробенецид).
1. В остром периоде подагрического артрита не назначают, так как любые изменения содержания уратов в крови способны пролонгировать подагрическую атаку.
2. Но если до развития острого подагрического артрита больной принимал эти препараты, режим приёма не изменяют.
Местное лечение
Наружно на область воспалённых суставов назначают компрессы с 50% раствором диметилсульфоксида, оказывающие противовоспалительное действие (компрессы накладывают на два сустава одновременно, длительностью не более 40 минут).
Межприступный период.
В промежутках между приступами подагры больной не испытывает никаких неприятных ощущений. Среди врачей нет единого мнения о том, когда следует назначать гипоурикемические средства. Все авторы соглашаются, что это нужно делать при рецидивирующем артрите, хронической подагре и появлении тофусов, а также при остром подагрическом артрите и мочекаменной болезни. Некоторые настаивают, что, уже первый приступ подагры — достаточное основание для начала лечения. По мнению других, поскольку первый приступ подагры излечивается легко, быстро и с небольшими затратами, то гипоурикемические средства стоит назначать 1—2 повторных приступов.
Терапия межприступной подагры по существу направлена на предупреждение прогрессирования болезни. Особое значение придается отношению к болезни и развитие у страдающего человека понимания возможности не только прекращения прогрессирования, но и обратного развития признаков хронизации подагры.
- В этом отношении большое значение имеют уменьшение массы тела, умеренность в еде, отказ от алкоголя.
- Пища должна содержать малопуриновые продукты, с достаточным питьевым режимом до 2-3 л жидкости в день, умеренной физической активностью.
- Таким образом, соблюдение здорового образа жизни – главное направление лечения в межприступные периоды.
- Профилактику острого приступа при подагре осуществляют назначением малых доз колхицина или НПВП. Такая терапия может использоваться перед назначением гипоурикемических препаратов в целях уменьшения опасности острой атаки до нормализации уровня мочевой кислоты в крови.
Механизм его действия в данном случае следующий: колхицин снижает количество воспалительных клеток в синовиальной жидкости у пациентов в межприступный период, уменьшая субклиническое воспаление. Тем не менее, вопросы длительности и необходимости такой терапии не совсем решены. Сообщалось о развитии побочных эффектов даже на небольшой дозе препарата, что коррелировало с низким клиренсом креатинина. НПВП также применяются в этих целях. Серьезного исследования по сравнению профилактического действия не проводилось, мнения по поводу полезности такой терапии расходятся, учитывая факт превосходства НПВП по сравнению с колхицином по побочным эффектам.
Переносимость длительного приема колхицина в этих дозах, как правило, удовлетворительная, побочные явления (преимущественно диарея) наблюдаются лишь у 4% пациентов. Частота осложнений возрастает в случае нарушений функции почек. Именно у таких больных чаще развиваются угнетение кроветворения, проксимальная миопатия (слабость в проксимальных группах мышц и повышение креатинфосфокиназы) и периферическая нейропатия. К 1990 г. известны 16 случаев смерти от осложнений терапии колхицином в небольших дозах. Рекомендуется соблюдать осторожность и у пациентов с нарушениями функции печени, а также при одновременном применении циметидина, толбутамида и эритромицина (замедляют метаболизм колхицина).
5. Терапия в этом периоде должна быть направлена на достижение нормальной урикемии. Цель лечения в этой стадии – снижение концентрации мочевой кислоты менее 6 мг%.
Собственно противоподагрическая терапия.
При начале собственно противоподагрической терапии важность приобретают несколько аспектов.
1. У пациентов с частыми (3 – 4 раза в год) приступами острого подагрического артрита и особенно с хронической подагрой и нефролитиазом абсолютно показано проведение противоподагрической терапии, направленной на нормализацию уровня мочевой кислоты.
2. Она основана на комбинации немедикамеентозных (снижение веса, диета, отказ от приема алкоголя, диуретической терапии) медикаментозных методов лечения (ингибитор ксантиноксидазы — аллопуринол и урикозурические ЛС).
3. Терапию этими ЛС следует начинать только после полного купирования приступа острого артрита и для профилактики обострений в течение первых нескольких месяцев после окончания приступа, сочетать с приемом небольших доз колхицина или НПВП.
4. Когда начинать терапию? Ответ на этот вопрос отнюдь не однозначный. Однако существует несколько безусловных показаний. Одно из них – наличие тофусов. При выявлении тофусов целесообразно относить к ним не только подкожные узелки, но и тофусы других локализаций. В частности деструктивные изменения суставов, выявляемые при рентгенологическом обследовании суставов в виде симптома «пробойника». Характерные изменения почек (уратная нефропатия, уролитиаз) также рекомендуется относить к тофусному поражению. Необходимо тщательное соответствующее обследование пациента для выявления указанных состояний.
5. При бестофусной подагре решить вопрос о назначении специфической терапии не всегда просто. Одним из других безусловных показаний является частота острого артрита в год: 3-4 атаки в течение года являются обоснованием для назначения специфической терапии.
6.Упомянутые показания для начала терапии являются безусловными, но не единственными. По мнению некоторых авторов, терапия должна быть более активной и ранней.
1) Так, например, стойкая гиперурикемия даже при наличии в анамнезе лишь одного приступа артрита или сокращение светлых промежутков между приступами являются показаниями для начала терапии.
2) Еще одним доводом, говорящим о рациональности раннего начала терапии, является уже упомянутый нами факт персистенции кристаллов в межприступный период. При этом, чем дольше проводится специфическая терапия, тем реже обнаруживаются кристаллы в суставах. Более того, уровень мочевой кислоты в крови прямо коррелирует с обнаружением кристаллов в суставах у больных с подагрой. По мнению же Wyngaarden и Кеlley, сам факт стойкой гиперурикемии уже требует терапевтической коррекции.
3) Наконец, о целесообразности такого подхода может свидетельствовать следующий факт. У пациентов с соответствующим контролем гиперурикемии и атак артрита в течение 1 года после назначения гипоурикемической терапии, отмечается улучшение почечной функции. Так, средний клиренс креатинина у 87 пациентов, включенных в это исследование, вырос с 94 до 104 мл/мин, причем значительное улучшение клиренса креатинина отмечалось изначальном его значении менее 80 мл/мин.
7. Следующим важным вопросом является правильный выбор между аллопуринолом и урикозурическими препаратами.
Аллопуринол
Лучше всего подавляет синтез мочевой кислоты у пациентов с ее гиперпродукцией (> 800 мг/24 ч или 4,76 ммоль в сут). На фоне лечения аллопуринолом сывороточный уровень мочевой кислоты начинает снижаться уже в течение первых 2 дней, стабильный максимальный эффект развивается через 2 недели.
ДОЗА АЛЛОПУРИНОЛА В ЗАВИСИМОСТИ ОТ ФУНКЦИИ ПОЧЕК
Клубочковая фильтрация
|
Доза
|
| > 100 мл/мин |
300 мг/сут и при необходимости выше |
| 80 – 100 мл/мин |
250 мг/сут |
| 60 – 80 мл/мин |
200 мг/сут |
| 40 – 60 мл/мин |
150 мг/сут |
| 20 – 40 мл/мин |
100 мг/сут |
| 10 – 20 мл/мин |
100 мг/сут |
| < 10 мл/мин |
100 мг/сут |
Доводы за аллопуринол (является ингибитором ксантиноксидазы):
1) Выявление одного камня или более в почках любого типа, так как на 80% они состоят из мочевой кислоты и имеют уратное ядро.
2) Гиперэкскреция мочевой кислоты (более 800 мг в сутки – без диеты и более 600 мг – на малопуриновой диете).
3) Поражение почек со снижением клиренса креатинина ниже 80 мл/мин (урикозурические агенты неэффективны в этом случае в обычных дозах, а ниже 30 мл/мин – неэффективны в любых дозах).
4) Тяжелая тофусная подагра, даже если клиренс креатинина выше 80 мл/мин.
5) Подагра, неконтролируемая урикозурическими агентами и колхицином, манифестирующая продленными атаками и/или неконтролируемой гиперурикемией.
6) Непереносимость урикозурических препаратов.
7) Выявление признаков подагрической нефропатии:
- при мочекаменной болезни и суточной экскреции мочевой кислоты более 3,6 ммоль (600 мг);
- при мочевых камнях, состоящих из 2,8-дигидроксиаденина;
- при острой мочекислой нефропатии или угрозе ее развития.
- Проведение цитотоксической терапии или рентгенотерапии по поводу лимфопролиферативных опухолей.
Считается, что у таких больных должен применяться только аллопуринол, а урикозурические препараты опасны из-за повышенного риска развития нефропатии и уролитиаза.
Необходимо придерживаться следующих основных принципов при терапии аллопуринолом:
1) Не рекомендуется начинать терапию аллопуринолом при наличии острой суставной атаки, необходимо купировать полностью суставной синдром. Если же приступ артрита развился на фоне терапии аллопуринолом, то можно снизить дозу и не отменять его полностью.
2) Следует помнить, что во время приступа артрита уровень мочевой кислоты обычно ниже, чем в межприступном периоде, поэтому требуются повторные исследования ее уровня уже после реализации артрита.
3) Для профилактики острых приступов артрита, изредка возникающих в начале приема препарата, и возникновения аллергических, и тяжелых побочных реакций рекомендуется начинать терапию с небольшой дозы (чаще 100 мг в сутки и до 300 мг.). Максимальный эффект достигается не позже, чем через 14 дней.
Рекомендуемая доза зависит от количества и размеров тофусов и от функции почек. Доза 400 мг почти всегда обладает достаточным гипоурикемическим эффектом; по достижении эффекта назначается поддерживающая доза – 100-200 мг/сут. Отсутствие эффекта скорее всего означает, что больной нерегулярно принимает препарат. Аллопуринол можно назначать 1 раз в сутки в связи с большим Т
1/2 оксипуринола. При почечной недостаточности дозу уменьшают.
Отражением правильного подбора дозы препарата является скорость снижения уровня гиперурикемии – не более 0,6-0,8 мг% или 0,1-0,6 мг/дл, или 10% от исходных цифр в течение 1 мес. терапии. По мнению многих авторов, в данном случае правильным является следующий подход: «чем медленнее, тем лучше».
4) Общепринято адаптировать дозу по клиренсу креатинина:
NB! При уровне ниже 30 мл/мин целесообразно снижение дозы аллопуринола до 50-100 мг в день из-за замедления периода полувыведения и увеличения частоты побочных реакций.
5) Для профилактики острого приступа в начале приема аллопуринола возможно применение низких доз колхицина или НПВП.
6) При отмене аллопуринола уровень мочевой кислоты нарастает быстро (3-4 дня).
7) При параллельном приеме антикоагулянтов непрямого действия или цитостатиков дозу этих препаратов целесообразно уменьшить.
8 Побочные явления отмечаются примерно у 5-20% пациентов, причем отмена аллопуринола требуется почти у половины из них.
- Наиболее часты аллергические кожные сыпи (обычно макулопапулезного характера), диспепсические явления, диарея и головная боль.
- Серьезные осложнения редки, они учащаются при почечной недостаточности и у пациентов, принимающих тиазидные диуретики. Назначение аллопуринола при почечной недостаточности или в сочетании с тиазидными диуретиками может вызвать алопецию, лихорадку, увеличение лимфоузлов, угнетение кроветворения, токсический гепатит, интерстициальный нефрит, почечную недостаточность, аллергический васкулит и даже привести к смерти. К счастью, подобные реакции бывают редко.
- Наибольшую опасность представляет симптомокомплекс, считающийся отражением гиперчувствительности к аллопуринолу: сочетание дерматита, признаков повреждения печени, нарушений функций почек, лейкоцитоза, эозинофилии или угнетения кроветворения (по типу синдрома Лайелла).
- При назначении аллопуринола следует учитывать лекарственные взаимодействия. Меркаптопурин и азатиоприн активируются ксантиноксидазой, поэтому прием аллопуринола, подавляя метаболизм этих препаратов, усиливает их терапевтическое и токсическое действие. Токсичность цигофосфамида также усиливается. У больных, которым назначают аллопуринол, в 3 раза чаще наблюдается сыпь при лечении ампициллином или амоксициллином.
9) Поскольку у ряда больных аллопуринол является единственным эффективным препаратом в лечении подагры, в случае развития гиперчувствительности к нему может оказаться необходимым проведение «десенсибилизации», иногда позволяющей возобновить терапию. Такая процедура целесообразна при развитии нетяжелых реакций, преимущественно рецидивирующего дерматита. Готовят водные суспензии препарата очень небольших концентраций (0,05 мг в 1 мл). Медленно (1 раз в 3 дня) и постепенно (каждый раз не более чем в 2 раза) концентрации аллопуринола повышают. Вся процедура “оральной десенсибилизации” занимает около 30 дней (Т. Gillott и соавт.).
ПРОТОКОЛ ДЕСЕНСИБИЛИЗАЦИИ
| Дни |
Доза аллопуринола |
Лекарственная форма |
| 1 – 3 |
50 мкг |
0,75 мл суспензии |
| 4 – 6 |
100 мкг |
0,5 мл мл суспензии |
| 7 – 9 |
200 мкг |
1 мл суспензии |
| 10 – 12 |
500 мкг |
2,5 мл суспензии |
| 13 – 15 |
1 мг |
5 мл суспензии |
| 16 – 18 |
5 мг |
25 мл суспензии |
| 19 – 21 |
10 мг |
50 мл суспензии |
| 22 – 24 |
25 мг |
125 мл суспензии (1/4 таблетки 100 мг) |
| 25 – 27 |
50 мг |
125 мл суспензии (1/2 таблетки 100 мг) |
| 28 и далее |
100 мг |
1 таблетка 100 мг |
Если нет гиперурикозурии, аллопуринол и урикозурические препараты показаны в равной степени, выбор между ними определяется в основном личными предпочтениями и опытом врача. Объективных сравнений, позволяющих в полной мере взвесить все достоинства и недостатки этих двух групп средств, почти не проводилось. Известно мнение о предпочтительности назначения урикозурических средств пациентам в возрасте не старше 60 лет, при удовлетворительной функции почек (клиренс креатинина не менее 50 мл/мин) и при отсутствии мочекаменной болезни.
Урикозурические препараты
Усиливают выведение уратов почками в основном за счет ингибирования канальцевой реабсорбции. Целью терапии является удержание мочевой кислоты на уровне 5 мг/100 мл. Необходимо помнить, что данные препараты заведомо неэффективны при тофусной подагре с уровнем мочевой кислоты более 7 мг/100 мл, они противопоказаны при уролитиазе, более того, способствуют уролитиазу и не улучшают почечную функцию в отличие, от аллопуринола, т.е. их применение значительно ограничено.
1) Итак, эти препараты назначают при подагре, если:
- наблюдается почечная гиперурикемия: суточная экскреция мочевой кислоты менее 4,8 ммоль (800 мг) при обычном рационе или 3,6 ммоль (600 мг) при ограничении потребления пуринов;
- возраст моложе 60 лет;
- СКФ более 80 мл/мин
- в анамнезе отсутствуют указания на мочекаменную болезнь.
2) Урикозурические средства эффективны у 70 – 80% больных. Если же эффект отсутствует, то скорее всего больной плохо переносит препарат, не выполняет назначения врача, одновременно принимает салицилаты или у него нарушена функция почек. Ослабление действия урикозурических средств под действием салицилатов, по-видимому, связано с угнетением секреции мочевой кислоты. Урикозурические средства перестают действовать при СКФ менее 30 мл/мин.
3) Основные побочные эффекты — это аллергические реакции, сыпь и нарушения функции ЖКТ. Тяжелые токсические реакции, такие, как некроз печени и нефротический синдром, возникают редко.
Бензбромарон
Бензбромарону уделяется наибольшее внимание по следующим причинам:
- он не только усиливает выведение уратов почками (тормозит канальцевую реабсорбцию), но также тормозит синтез пуриновых оснований и всасывание мочевой кислоты из кишечника;
- его дозу можно не уменьшать при умеренной почечной недостаточности (в отличие от аллопуринола);
- ему не присущи серьезные побочные реакции (у 3-4% пациентов развивается диарея и зудящие кожные сыпи);
- препарат удобен в применении (суточная доза, составляющая обычно 100-200 мг, принимается однократно).
В ряде исследований показано его преимущество по сравнению с аллопуринолом. Однако препарат не доступен во многих странах, в том числе и в России.
Пробенецид
Является другим известным препаратом, который помимо урикозурического действия уменьшает воспалительные явления в суставах.
Пробенецид можно назначать пациентам с рецидивирующим подагрическим артритом, с гипоэкскрецией мочевой кислоты (< 800 мг/24 ч уратов) и имеющих клиренс креатинина > 60 мл/мин.
При применении пробенецида имеется высокий риск кристаллурии и уратного криза, поэтому необходимо рекомендовать больному обильный питьевой режим, особенно на ночь, контроль рН мочи не ниже 6,5 с назначением 20 г в день соды или 20-60 г в день цитрата. Показано, что в 10% случаев отмечаются обострения артрита, в 9% возникает уролитиаз. В 10% случаев возникают побочные эффекты: гиперчувствительность, лихорадка, 5% -кожные сыпи, 8% – желудочно-кишечные осложнения. Среди редких серьезных побочных реакций описаны некроз печени, нефротический синдром и апластическая анемия. Пробенецид может удлинять действие пенициллина, цефалоспоринов, рифампицина и ряда других лекарственных средств, а также повышает концентрацию в крови напроксена и индометацина. Ацетилсалициловая кислота полностью блокирует урикозурический эффект пробенецида, поэтому препарат несовместим с салицилатами.
Пробенецид назначают в первоначальной дозе 0,25 г 2 раза в день. При достаточном снижении уровня мочевой кислоты в крови каждые 1-2 нед дозу препарата повышают на 0,5 г (максимальная суточная доза составляет 3 г). Недостатками пробенецида считается нередко развивающаяся резистентность, а также относительно частое возникновение нежелательных явлений.
Сульфинпиразон
Можно использовать у пациентов с рецидивирующим подагрическим артритом, нуждающихся в проведении антитромбоцитарной терапии с гипоэкскрецией уратов.
Сульфинпиразон является аналогом метаболита фенилбутазона, что объясняет возможность развития таких побочных эффектов, как угнетение кроветворения и нарушения функции печени, и привело к постепенному урежению использования этого препарата. Начальная суточная доза сульфинпиразона составляет 100 мг, ее разделяют на 2 приема в течение дня. Через 3-4 дня, при отсутствии достаточного снижения уровня мочевой кислоты в крови, суточную дозу постепенно (каждую неделю) повышают на 100 мг (но не более 800 мг).
Поддерживающая доза –300-400 мг/сут. В 3-4 приема.
Препарат способен тормозить агрегацию тромбоцитов, что ценно, учитывая частое наличие у больных подагрой сердечно-сосудистых заболеваний. Наиболее частым побочным эффектом является желудочная диспепсия.
Кетазон
Таблетки по 0,25 г, эффективная доза – 1 г, поддерживающая – 0,25 (обычно 1 таблетка в сутки).
Алломарон
Оказывает выраженное нормализующее влияние на нарушенный пуриновый обмен, обладает одновременно и урикозурическим, и урикодепрессивным эффектами.
Ингибитор синтеза мочевой кислоты и урикозурическое средство — алломарон: в 1 таблетке содержится 0,1 г аллопуринола и 0,02 г бензбромарона. Суточная доза — 1 таблетка в день после еды, запивать небольшим количеством жидкости, в тяжелых случаях можно принимать до 3 таблеток в день.
Лозартан (антагонист рецепторов ангиотензина II)
Обладает определенным урикозурическим эффектом.
Его применение особенно целесообразно при гиперурикемии, индуцированной приемом тиазидных диуретиков.
Комбинация аллопуринола с урикозурическими средствами (обычно с сульфинпиразоном или бензбромароном, но не с пробенецидом).
Такой метод оправдан у особо тяжелых больных, после установления торпидности к монотерапии. В этих случаях требуется тщательный подбор доз отдельных препаратов, так как урикозурические средства усиливают экскрецию аллопуринола. Возможна также и комбинация отдельных урикозурических средств. Специальных исследований, оценивающих достоинства и недостатки подобных комбинаций противоподагрических препаратов, не проводилось.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА,
ОБЛАДАЮЩИЕ УРИКОЗУРИЧЕСКИМ ДЕЙСТВИЕМ
| Азауридин
Аскорбиновая кислота
Ацетогексамид
Бензбромарон
Галофенат
Гвайфенезин
Гликопиррония бромид
Глюкокортикоиды
Дикумарол
Дифлунизал
Зоксазоламин
Кальтцитонин
|
Контрастные вещества
Кортикотропин
Меклофенамовая кислота
Пробенецид
Салицилаты (> 2 г/сут)
Сульфинпиразон
Тетрациклин с истекшим сроком годности
Фенилбутазон
Фенолсульфонфталеин
Хлорпротиксен
Цитраты
Эстрогены
|
При назначении как аллопуринола, так и урикозурических средств следует помнить о
двух важных обстоятельствах.
I. Вследствие увеличения выведения мочевой кислоты уже в первые дни применения этих препаратов повышается риск образования камней и развития уратной нефропатии. В связи с этим необходимо предварительное обследование состояния почек и мочевыводящих путей (определение уровня креатинина, его клиренса, ультразвуковое исследование почек), а также исследование рН мочи. Для исследования рН мочи можно использовать бумажные анализаторы, обычно прилагаемые к коммерческим цитратным препаратам. У пациентов со стойко низким рН мочи (меньше 6) перед назначением антиподагрических препаратов желательно добиться ее ощелачивания путем применения цитратов, бикарбоната натрия или ацетозоламида (ингибитора карбоангидразы). Эти препараты применяют, регулярно проверяя рН мочи, оптимальный уровень которого составляет 6,2 – 6,6. В целях профилактики камнеобразования необходимо также обильное питье (диурез должен составлять не менее 2 л в сутки). Превентивные меры предпринимаются в течение всего времени подбора оптимальной дозы противоподагрического препарата (обычно не менее 1-2 мес.).
II
. После назначения противоподагрических средств на протяжении 6-12 мес. повышается риск развития атак подагры. Поэтому, как правило, рекомендуется не начинать терапию при еще не закончившемся артрите и использовать в течение нескольких месяцев с профилактической целью колхицин в небольших дозах (0,5-1,5 мг в день) или НПВП. Показано, что применение колхицина позволяет предупредить возникновение острых артритов примерно у 85% пациентов, которым начата антиподагрическая терапия. Вместе с тем ряд специалистов высказывают сомнение в целесообразности обязательного применения профилактической терапии, указывая на относительно небольшой риск обострения подагры и потенциальную токсичность колхицина.
Критерии эффективности противоподагрической терапии
1. В первые месяцы терапии основным критерием эффективности считается достижение оптимального уровня мочевой кислоты в крови. Он составляет не более 6 мг% (у мужчин), а в идеале – 4-5 мг%. Если концентрация мочевой кислоты не падает ниже 6,8 мг%, растворение уратов во внеклеточной жидкости и тканях не происходит, и сохраняется опасность прогрессирования подагры.
2. После 6 мес. терапии ее эффективность определяется также урежением приступов подагры, рассасыванием подкожных тофусов, сохранностью функции почек и отсутствием прогрессирования уролитиаза.
Мочекаменная болезнь
1. Гипоурикемические средства показаны, если подагра сопровождается образованием уратных или кальциевых мочевых камней, причиной которых обычно является повышение концентрации мочевой кислоты в моче.
2. Независимо от природы камней, больной должен пить столько, чтобы суточный диурез превышал 2 л.
3. Иногда для увеличения растворимости мочевой кислоты проводят ощелачивание мочи при помощи бикарбоната натрия или ацетазоламида.
4. Специфическая терапия при уратных камнях обязательно должна включать аллопуринол для снижения концентрации мочевой кислоты в моче. Кроме того, аллопуринол уменьшает риск образования оксалатных мочевых камней у больных подагрой или при бессимптомном повышении концентрации мочевой кислоты в сыворотке и моче. Аллопуринол применяют и при наличии мочевых камней, состоящих из 2,8-дигидроксиаденина.
5. Альтернативное средство при уратных или уратно-кальциевых мочевых камнях — это цитрат калия (30 – 80 ммоль/сут в несколько приемов).
Острая мочекислая нефропатия.
Заболевание обычно можно предотвратить, а при своевременном лечении смертность от него практически равна нулю.
1. Для снижения концентрации мочевой кислоты в почечных канальцах вводят в/в большое количество жидкости и назначают фуросемид, чтобы диурез был выше 100 мл/ч.
2. Прием 240 – 500 мг ацетазоламида внутрь каждые 6 – 8 ч и введение в/в бикарбоната натрия (2 ампулы по 44,6 ммоль бикарбоната на 1 л 5% глюкозы) ощелачивают мочу и увеличивают растворимость мочевой кислоты. Важно не допускать гиперволемии и снижения рН мочи ниже 7.
3. Кроме того, для уменьшения притока мочевой кислоты в почки назначают аллопуринол в разовой дозе 8 мг/кг. Если функция почек не восстанавливается, последующие дозы уменьшают до 100—200 мг/сут, так как активный метаболит аллопуринола, оксипуринол, накапливается при почечной недостаточности.
4. При неэффективности вышеприведенных мероприятий проводят гемодиализ.
Подагрические тофусы
Обладают тенденцией к самопроизвольному вскрытию и образованию свищей с выделением кристаллов мочевой кислоты.
– В таких случаях рекомендуется применять ванночки с гипертоническим раствором.
– Тофусы обычно не нагнаиваются вследствие бактерицидных свойств мочевой кислоты.
– Хирургические вмешательства в области тофусов нежелательны из-за плохого заживления ран.
Эфферентная терапия
Энтеросорбция,
Цель её применения – уменьшение реабсорбции мочевой кислоты в желудочно-кишечном тракте. Получены данные, свидетельствующие о снижении содержания мочевой кислоты в крови, при приёме энтеросорбента в течение 2-3 недель.
В качестве энтеросорбента применяют полифепам, энтеродез, активированный уголь (10-15 г утром за 2 часа до приёма пищи).
Экстракорпоральная гемокоррекция.
Предпочтительно применение плазмообмена экстракорпорально модифицированной аутоплазмой (ПОЭМП). Метод разработан на основе технологии криоплазмосорбции. Плазму крови получают при проведении аппаратного пламафереза, при лечении больных обычно проводят 4-5 сеансов ПОЭМП, интервалы между операциями составляют 2-3 дня. Этот вариант экстракорпоральной гемокоррекции, сочетающий температурную и сорбционную технологию, позволяет эффективно элиминировать не только мочевую кислоту, но и целый ряд веществ, участвующих в патогенезе подагры и подагрической нефропатии: циркулирующие иммунные комплексы, иммуноглобулины и др. Целесообразно проводить повторные курсы ПОЭМП через 6-8 мес, что позволяет значительно снизить клинико-лабораторную активность заболевания, улучшить некоторые показатели функции почек.
Эфферентная терапия является методом выбора при непереносимости
противоподагрических медикаментозных препаратов, при резистентности
к этим лекарственным средствам, а также при прогрессировании подагрической нефропатии на фоне длительного приема традиционных препаратов.
Хирургические методы
Применяются хирургические методы удаления отложений мочевой кислоты в мягких тканях и артропластика. При хронической подагре, особенно при нарушении функции суставов применяется ортопедо-хирургическое лечение.
Физиотерапевтическое лечение
Назначается в межприступном периоде, значительно облегчает самочувствие:
- Сероводородные ванны.
- Чередовать с парафино-озокеритовыми или грязевыми аппликациями.
- При болевом синдроме возможны радоновые ванны.
- Ультразвук
- УФО
- Диадинамические токи
- Электрофорез с новокаином или гистамином или КJ, фонофорез с гидрокортизоном.
- Массаж.
- ЛФК
Санаторно-курортное лечение.
Является важным компонентом в комплексной терапии подагры. Показаны курорты с сероводородными ваннами, радоновыми источниками (Горячий Ключ, Пятигорск, Минеральные воды, Сочи-Мацеста), грязевые (Анапа, Евпатория, Старая Руса), бальнеотерапевтические, где имеются питьевые минеральные источники (Ессентуки, Железноводск, Феодосия и др.). Характер санаторно-курортного лечения больных подагрой необходимо согласовывать с нефрологом, так как неадекватное лечение может способствовать прогрессированию подагрической нефропатии.
Профилактика.
I. Первичная.
Актуальны выявление бессимптомной гиперурикемии у родственников больных подагрой и ее коррекция диетическими мероприятиями или при большой ее величине применение аллопуринола для предупреждения развития острого подагрического приступа
1. Заключается, прежде всего, в рациональном питании, в первую очередь в семьях, где имеются случаи подагры.
2. Запрещение алкоголя, особенно красных вин, шампанского.
3. Предупреждение ожирения и др.
4. Адекватные физические нагрузки.
5. Избегать переохлаждения.
II. Вторичная.
1. Предусматривает раннее выявление и лечение подагры.
2. Предупреждение повторных подагрических кризов.
3. Борьба с внесуставными проявлениями болезни, особенно с нефропатиями.
Прогноз.
I. Определяется сопутствующими поражениями сердечно-сосудистой системы и почечной недостаточностью. Однако в 20-50% случаев развиваемся уролитиаз, а причиной смерти 18-25% больных подагрой является почечная недостаточность.
II. Поражение суставов, однако, может значительно снижать трудоспособность больных, а в отдельных случаях приводить к инвалидности.
III. При хорошей экскреции уратов почками подагра многие годы может протекать легко: без образования тофусов, без формирования функциональной недостаточности суставов.
IV. В более тяжелых случаях в течение нескольких лет может наступить инвалидизация больного. Прогрессирующая нефропатия, особенно в сочетании с артериальной гипертензией и сахарным диабетом, является наиболее прогностически неблагоприятным фактором.
 Концентрация насыщенного раствора мочевой кислоты в сыворотке при температуре 37°С составляет 416 мкмоль/л (7 мг%). Превышение этого порога создает предпосылку для кристаллизации уратов. Однако в крови содержатся вещества, которые увеличивают растворимость, поэтому обычно кристаллизации не происходит даже при концентрации мочевой кислоты в сыворотке 4800 мкмоль/л (80 мг%).
Мочевая кислота растворяется в моче лучше, чем в воде, возможно, из-за присутствия мочевины, белков и гликозаминогликанов. Ее растворимость зависит от рН. При рН, равном 5, растворимость мочевой кислоты в моче составляет 360—900 мкмоль/л (6—15 мг%), а при рН, равном 7, – 9480—12000 мкмоль/л (158—200 мг%). Часть мочевой кислоты находится в моче в виде солей: мононатриевой, динатриевой, калиевой, аммониевой и кальциевой.
Синтез и распад пуринов происходят во всех тканях, но мочевая кислота образуется только там, где есть ксантиноксидаза, прежде всего в печени и тонкой кишке. Количество мочевой кислоты в организме определяется соотношением скоростей образования мочевой кислоты и ее выведения. Скорость образования мочевой кислоты зависит от количества пуринов в рационе и скоростей синтеза, регенерации и распада пуринов. В норме 66—75% мочевой кислоты выводится с мочой, а оставшаяся часть — в основном с калом.
Приблизительно 98 – 100% мочевой кислоты из клубочкового фильтрата реабсорбируется в проксимальных канальцах, но половина этого количества секретируется в этих канальцах обратно, а затем около 40% снова подвергается реабсорбции. В результате в мочу попадает лишь 8 – 12% отфильтровавшейся мочевой кислоты.
Концентрация мочевой кислоты в сыворотке зависит от пола и возраста, а у взрослых — от роста, веса, АД, функции почек и употребления спиртных напитков. У большинства детей она составляет 180 – 240 мкмоль/л (3 – 4 мг%). По мере полового созревания у мужчин концентрация нарастает, а у женщин остается низкой до наступления менопаузы. Причина такого различия окончательно не установлена. Верхняя граница нормальной концентрации мочевой кислоты в сыворотке у женщин детородного возраста и у взрослых мужчин составляет соответственно 360 и 416 мкмоль/л (6 и 7 мг%). В постменопаузе концентрация мочевой кислоты в сыворотке у женщин увеличивается и приближается к концентрации, характерной для мужчин.
Концентрация насыщенного раствора мочевой кислоты в сыворотке при температуре 37°С составляет 416 мкмоль/л (7 мг%). Превышение этого порога создает предпосылку для кристаллизации уратов. Однако в крови содержатся вещества, которые увеличивают растворимость, поэтому обычно кристаллизации не происходит даже при концентрации мочевой кислоты в сыворотке 4800 мкмоль/л (80 мг%).
Мочевая кислота растворяется в моче лучше, чем в воде, возможно, из-за присутствия мочевины, белков и гликозаминогликанов. Ее растворимость зависит от рН. При рН, равном 5, растворимость мочевой кислоты в моче составляет 360—900 мкмоль/л (6—15 мг%), а при рН, равном 7, – 9480—12000 мкмоль/л (158—200 мг%). Часть мочевой кислоты находится в моче в виде солей: мононатриевой, динатриевой, калиевой, аммониевой и кальциевой.
Синтез и распад пуринов происходят во всех тканях, но мочевая кислота образуется только там, где есть ксантиноксидаза, прежде всего в печени и тонкой кишке. Количество мочевой кислоты в организме определяется соотношением скоростей образования мочевой кислоты и ее выведения. Скорость образования мочевой кислоты зависит от количества пуринов в рационе и скоростей синтеза, регенерации и распада пуринов. В норме 66—75% мочевой кислоты выводится с мочой, а оставшаяся часть — в основном с калом.
Приблизительно 98 – 100% мочевой кислоты из клубочкового фильтрата реабсорбируется в проксимальных канальцах, но половина этого количества секретируется в этих канальцах обратно, а затем около 40% снова подвергается реабсорбции. В результате в мочу попадает лишь 8 – 12% отфильтровавшейся мочевой кислоты.
Концентрация мочевой кислоты в сыворотке зависит от пола и возраста, а у взрослых — от роста, веса, АД, функции почек и употребления спиртных напитков. У большинства детей она составляет 180 – 240 мкмоль/л (3 – 4 мг%). По мере полового созревания у мужчин концентрация нарастает, а у женщин остается низкой до наступления менопаузы. Причина такого различия окончательно не установлена. Верхняя граница нормальной концентрации мочевой кислоты в сыворотке у женщин детородного возраста и у взрослых мужчин составляет соответственно 360 и 416 мкмоль/л (6 и 7 мг%). В постменопаузе концентрация мочевой кислоты в сыворотке у женщин увеличивается и приближается к концентрации, характерной для мужчин.
 II. Возникновение подагры связывают как с генетической обусловленностью, так и с алиментарными причинами.
Среди населения в целом распространенность гиперурикемии составляет 2 – 13,2%, а подагры — 1,3 – 3,7%. Чем выше концентрация мочевой кислоты в сыворотке, тем больше вероятность подагры. Согласно одному из исследований, заболеваемость подагрой при концентрации мочевой кислоты в сыворотке более 540 мкмоль/л (9 мг%) составила 4,9%, а при концентрации 415 – 535 мкмоль/л (7 – 9 мг%) — 0,5%. Течение подагры зависит от продолжительности и тяжести гиперурикемии. Первый приступ подагры чаще всего возникает через 20—40 лет стойкой гиперурикемии; у мужчин это обычно происходит в возрасте 40—60 лет, а у женщин – после наступления менопаузы.
III. Однако, необходимо особо подчеркнуть, что выявления гиперурикемии недостаточно для установления диагноза, так как лишь около 10% больных гиперурикемией страдают подагрой. В этой связи важно подчеркнуть парадокс XX века – у всех больных с подагрой определяется гиперурикемия, но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита. А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающееся воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия – необходимое, но недостаточное предшествующее явление для развития уратной микрокристаллической болезни, а, следовательно, гиперурикемия – отличный от подагры клинический синдром.
IV. Следовательно, в развитии подагры наряду с гиперурикемией важное значение имеют другие факторы.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом “антивоспалительных” медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста-В и др.).
V. До настоящего времени неизвестны факторы, предрасполагающие к отложению уратов и воспалению суставов у лиц с гиперурикемией (за исключением семейных случаев).
КЛАССИФИКАЦИЯ ПРИЧИН ГИПЕРУРИКЕМИИ
II. Возникновение подагры связывают как с генетической обусловленностью, так и с алиментарными причинами.
Среди населения в целом распространенность гиперурикемии составляет 2 – 13,2%, а подагры — 1,3 – 3,7%. Чем выше концентрация мочевой кислоты в сыворотке, тем больше вероятность подагры. Согласно одному из исследований, заболеваемость подагрой при концентрации мочевой кислоты в сыворотке более 540 мкмоль/л (9 мг%) составила 4,9%, а при концентрации 415 – 535 мкмоль/л (7 – 9 мг%) — 0,5%. Течение подагры зависит от продолжительности и тяжести гиперурикемии. Первый приступ подагры чаще всего возникает через 20—40 лет стойкой гиперурикемии; у мужчин это обычно происходит в возрасте 40—60 лет, а у женщин – после наступления менопаузы.
III. Однако, необходимо особо подчеркнуть, что выявления гиперурикемии недостаточно для установления диагноза, так как лишь около 10% больных гиперурикемией страдают подагрой. В этой связи важно подчеркнуть парадокс XX века – у всех больных с подагрой определяется гиперурикемия, но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита. А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающееся воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия – необходимое, но недостаточное предшествующее явление для развития уратной микрокристаллической болезни, а, следовательно, гиперурикемия – отличный от подагры клинический синдром.
IV. Следовательно, в развитии подагры наряду с гиперурикемией важное значение имеют другие факторы.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом “антивоспалительных” медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста-В и др.).
V. До настоящего времени неизвестны факторы, предрасполагающие к отложению уратов и воспалению суставов у лиц с гиперурикемией (за исключением семейных случаев).
КЛАССИФИКАЦИЯ ПРИЧИН ГИПЕРУРИКЕМИИ
 У больных встречают и комбинированные дефекты
То есть «гиперпродукторы» могут одновременно быть и «гипоэкскреторами».
Смешанная гиперурикемия. Иногда причиной гиперурикемии бывает сочетание повышенного образования мочевой кислоты и сниженного ее выведения.
1. При гликогенозе типа I (недостаточности глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу) уже в грудном возрасте появляется гиперурикемия и рано развивается подагра.
Повышение продукции мочевой кислоты в этом случае связано с распадом АТФ во время или гипогликемии. Кроме того, у таких больных снижена концентрация нуклеозидмонофосфатов, что приводит к уменьшению их ингибирующего действия на амидофосфорибозилтрансферазу и усилению образования пуринов. Наконец, у них часто возрастает концентрация молочной кислоты в крови, а это сопровождается угнетением канальцевой секреции мочевой кислоты.
2. Оба механизма развития гиперурикемии действуют и при непереносимости фруктозы, связанной с недостаточностью фруктозодифосфатальдолазы. У таких больных прием фруктозы приводит к накоплению фруктозо-1-фосфата, истощению запасов АТФ, усилению катаболизма пуриновых нуклеотидов и гиперурикемии. Лактацидоз и почечный канальцевый ацидоз приводят к задержке мочевой кислоты в организме. У гомозигот после приема фруктозы наблюдаются рвота, гипогликемия, а продолжительное потребление фруктозы приводит к печеночной недостаточности и нарушению функции почечных канальцев. У гетерозигот развивается; гиперурикемия, а примерно у трети из них — подагра. По-видимому, это довольно частая причина семейной подагры, так как распространенность гетерозигот составляет 1:80 – 1:250.
3. Злоупотребление алкоголем также вызывает смешанную гиперурикемию путем:
1) стимуляции распада АТФ и усиления образования мочевой кислоты в печени
2) нарушения секреции мочевой кислоты в почках за счет ацидоза
3) кроме того, в некоторых спиртных напитках, например в пиве, содержится много пуринов.
Сопутствующие подагре состояния.
Приводимые ниже состояния часто наблюдаются у больных подагрой, но их связь с возникновением подагры не установлена.
1. Ожирение
Гиперурикемия зависит от массы тела. Подагру значительно чаще встречают у лиц с избыточной массой тела.
2. Сахарный диабет
Нарушение толерантности к глюкозе часто определяют у больных подагрой, что может быть следствием ожирения.
3. Артериальная гипертензия
У больных подагрой нередко имеется артериальная гипертензия, но прямая зависимость повышения уровня мочевой кислоты от артериального давления отсутствует.
Возможно наличие корреляции между ожирением и гипертензией.
4. Гиперлипедемии
При подагре II и IV типы гиперлипидемии часты.
5. Атеросклероз
Смерть больных подагрой обычно наступает вследствие сердечно- сосудистого заболевания.
Перечисленные выше факторы риска объясняют тенденцию к развитию атеросклероза.
Патогенез подагрического артрита
Клинические проявления подагры связаны с отложением в тканях кристаллов мочевой кислоты. Механизм отложения уратов до конца не выяснен.
1. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
2. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру, рН сыворотки крови и наличие субстанций, удерживающих ураты в жидкости — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0 – 13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
3. Итак, основные этапы патогенеза:
У больных встречают и комбинированные дефекты
То есть «гиперпродукторы» могут одновременно быть и «гипоэкскреторами».
Смешанная гиперурикемия. Иногда причиной гиперурикемии бывает сочетание повышенного образования мочевой кислоты и сниженного ее выведения.
1. При гликогенозе типа I (недостаточности глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу) уже в грудном возрасте появляется гиперурикемия и рано развивается подагра.
Повышение продукции мочевой кислоты в этом случае связано с распадом АТФ во время или гипогликемии. Кроме того, у таких больных снижена концентрация нуклеозидмонофосфатов, что приводит к уменьшению их ингибирующего действия на амидофосфорибозилтрансферазу и усилению образования пуринов. Наконец, у них часто возрастает концентрация молочной кислоты в крови, а это сопровождается угнетением канальцевой секреции мочевой кислоты.
2. Оба механизма развития гиперурикемии действуют и при непереносимости фруктозы, связанной с недостаточностью фруктозодифосфатальдолазы. У таких больных прием фруктозы приводит к накоплению фруктозо-1-фосфата, истощению запасов АТФ, усилению катаболизма пуриновых нуклеотидов и гиперурикемии. Лактацидоз и почечный канальцевый ацидоз приводят к задержке мочевой кислоты в организме. У гомозигот после приема фруктозы наблюдаются рвота, гипогликемия, а продолжительное потребление фруктозы приводит к печеночной недостаточности и нарушению функции почечных канальцев. У гетерозигот развивается; гиперурикемия, а примерно у трети из них — подагра. По-видимому, это довольно частая причина семейной подагры, так как распространенность гетерозигот составляет 1:80 – 1:250.
3. Злоупотребление алкоголем также вызывает смешанную гиперурикемию путем:
1) стимуляции распада АТФ и усиления образования мочевой кислоты в печени
2) нарушения секреции мочевой кислоты в почках за счет ацидоза
3) кроме того, в некоторых спиртных напитках, например в пиве, содержится много пуринов.
Сопутствующие подагре состояния.
Приводимые ниже состояния часто наблюдаются у больных подагрой, но их связь с возникновением подагры не установлена.
1. Ожирение
Гиперурикемия зависит от массы тела. Подагру значительно чаще встречают у лиц с избыточной массой тела.
2. Сахарный диабет
Нарушение толерантности к глюкозе часто определяют у больных подагрой, что может быть следствием ожирения.
3. Артериальная гипертензия
У больных подагрой нередко имеется артериальная гипертензия, но прямая зависимость повышения уровня мочевой кислоты от артериального давления отсутствует.
Возможно наличие корреляции между ожирением и гипертензией.
4. Гиперлипедемии
При подагре II и IV типы гиперлипидемии часты.
5. Атеросклероз
Смерть больных подагрой обычно наступает вследствие сердечно- сосудистого заболевания.
Перечисленные выше факторы риска объясняют тенденцию к развитию атеросклероза.
Патогенез подагрического артрита
Клинические проявления подагры связаны с отложением в тканях кристаллов мочевой кислоты. Механизм отложения уратов до конца не выяснен.
1. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
2. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру, рН сыворотки крови и наличие субстанций, удерживающих ураты в жидкости — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0 – 13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
3. Итак, основные этапы патогенеза:
 б) Большинство подагрических атак происходит ночью с быстрым нарастанием эритемы и температуры вокруг сустава, отёчности и болезненности. Боль резкая, усиливающаяся при опускании конечности.
в) Воспаление может перейти и на мягкие ткани, формируя клиническую картину целлюлита или флебита.
г) Тяжёлые случаи сопровождает лихорадочная реакция (38-39°С), наблюдается лейкоцитоз, повышение СОЭ.
Течение подагрического приступ:.
а) Обычная продолжительность приступа – несколько дней, реже — несколько недель (2-3 дня, а затем медленно уменьшается в течение 7-10 дней).
б) В некоторых случаях возможен и полиартикулярный вариант:
— могут поражаться суставы свода стопы, голеностопный – “подагрическая стопа”.
— Реже наблюдаются внесуставная локализация воспаления, например, подошвенный фасциит, ахиллобурсит, воспаление узелков Гебердена. Сакроилеит, спондилоартрит и поражение синхондроза рукоятки грудины встречаются редко.
— Все компоненты острого воспаления в поражённых суставах обычно резко выражены, движения в суставах практически невозможны.
в) По мере прогрессирования болезни увеличивается длительность приступов острого артрита, укорачиваются промежутки между ними, моноартрит переходит постепенно в полиартрит (могут вовлекаться коленные, голеностопные, мелкие суставы кистей).
г) Характерная особенность острого подагрического артрита — полное спонтанное выздоровление и отсутствие симптомов между приступами до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующими заболеваниями суставов, наиболее часто — остеоартрозом.
д) Подагрический артрит у женщин возникает в основном в период менопаузы, течение заболевания более мягкое и доброкачественное, редко отмечаются типичные острые приступы. Диагностика подагры
в подобных случаях затрудняется из-за отсутствия выраженных экссудативных явлений в пораженных суставах, могут отмечаться лишь артралгии.
е) Поражение суставов имеет чаще асимметричный характер (интермиттирующая подагра).
Патогенез подагрического приступа:
1. Микротофусы (небольшие кристаллические скопления) в синовиальной мембране и хряще возникают в результате длительной гиперурикемии. Вследствие травмы, повышения температуры в суставе и изменения концентрации мочевой кислоты в крови или синовиальной жидкости микротофусы разрушаются, и кристаллы выходят в суставную полость.
2. Острый приступ подагры вызывает реакция нейтрофилов на уратные кристаллы, приводящая к активации гуморальных и клеточных механизмов воспаления. Уратные кристаллы активируют комплемент, как по классическому, так и по альтернативному пути. Кроме того, происходит контактная активация фактора свертывания XII (фактора Хагемана), стимулирующего образование брадикинина, калликреина и плазмина. Ig и компоненты комплемента опсонизируют (обволакивают) ураты, стимулируя фагоцитарную активность нейтрофилов. Под действием уратных кристаллов из нейтрофилов высвобождаются лизосомные ферменты, свободные радикалы кислорода, метаболиты лейкотриенов и простагландинов, коллагеназа и другие протеазы. Фагосомы нейтрофилов, поглотивших кристаллы, сливаются с лизосомами, а лизосомальные ферменты разрушают белковую оболочку кристаллов. Кристаллы повреждают нейтрофилы, а выделяющиеся в синовиальную полость лизосомальные ферменты потенцируют воспаление.
3. Со временем на смену нейтрофилам приходят макрофаги. Под действием уратных кристаллов из макрофагов высвобождаются простагландины (простагландин Е2), лизосомные ферменты, ФНО-a, ИЛ-1 и ИЛ-6. Синовиоциты тоже участвуют в развитии воспаления, выделяя ИЛ-8 и другие цитокины. В связи с тем, что под действием мочевой кислоты возможно высвобождение медиаторов воспаления из синовиальных макрофагов, происходит вовлечение в процесс других суставов и мягких тканей.
4. Некоторые белки плазмы влияют на способность уратных кристаллов вызывать воспаление.
5. При воспалении проницаемость синовиальной оболочки повышается, и крупные молекулы, включая липопротеиды, проникают в полость сустава, связываются с уратными кристаллами и, возможно, способствуют прекращению приступа.
Однако есть мнение, что липопротеины способны проникать через воспалённую синовиальную мембрану, взаимодействовать с кристаллами и модулировать воспаление.
б) Большинство подагрических атак происходит ночью с быстрым нарастанием эритемы и температуры вокруг сустава, отёчности и болезненности. Боль резкая, усиливающаяся при опускании конечности.
в) Воспаление может перейти и на мягкие ткани, формируя клиническую картину целлюлита или флебита.
г) Тяжёлые случаи сопровождает лихорадочная реакция (38-39°С), наблюдается лейкоцитоз, повышение СОЭ.
Течение подагрического приступ:.
а) Обычная продолжительность приступа – несколько дней, реже — несколько недель (2-3 дня, а затем медленно уменьшается в течение 7-10 дней).
б) В некоторых случаях возможен и полиартикулярный вариант:
— могут поражаться суставы свода стопы, голеностопный – “подагрическая стопа”.
— Реже наблюдаются внесуставная локализация воспаления, например, подошвенный фасциит, ахиллобурсит, воспаление узелков Гебердена. Сакроилеит, спондилоартрит и поражение синхондроза рукоятки грудины встречаются редко.
— Все компоненты острого воспаления в поражённых суставах обычно резко выражены, движения в суставах практически невозможны.
в) По мере прогрессирования болезни увеличивается длительность приступов острого артрита, укорачиваются промежутки между ними, моноартрит переходит постепенно в полиартрит (могут вовлекаться коленные, голеностопные, мелкие суставы кистей).
г) Характерная особенность острого подагрического артрита — полное спонтанное выздоровление и отсутствие симптомов между приступами до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующими заболеваниями суставов, наиболее часто — остеоартрозом.
д) Подагрический артрит у женщин возникает в основном в период менопаузы, течение заболевания более мягкое и доброкачественное, редко отмечаются типичные острые приступы. Диагностика подагры
в подобных случаях затрудняется из-за отсутствия выраженных экссудативных явлений в пораженных суставах, могут отмечаться лишь артралгии.
е) Поражение суставов имеет чаще асимметричный характер (интермиттирующая подагра).
Патогенез подагрического приступа:
1. Микротофусы (небольшие кристаллические скопления) в синовиальной мембране и хряще возникают в результате длительной гиперурикемии. Вследствие травмы, повышения температуры в суставе и изменения концентрации мочевой кислоты в крови или синовиальной жидкости микротофусы разрушаются, и кристаллы выходят в суставную полость.
2. Острый приступ подагры вызывает реакция нейтрофилов на уратные кристаллы, приводящая к активации гуморальных и клеточных механизмов воспаления. Уратные кристаллы активируют комплемент, как по классическому, так и по альтернативному пути. Кроме того, происходит контактная активация фактора свертывания XII (фактора Хагемана), стимулирующего образование брадикинина, калликреина и плазмина. Ig и компоненты комплемента опсонизируют (обволакивают) ураты, стимулируя фагоцитарную активность нейтрофилов. Под действием уратных кристаллов из нейтрофилов высвобождаются лизосомные ферменты, свободные радикалы кислорода, метаболиты лейкотриенов и простагландинов, коллагеназа и другие протеазы. Фагосомы нейтрофилов, поглотивших кристаллы, сливаются с лизосомами, а лизосомальные ферменты разрушают белковую оболочку кристаллов. Кристаллы повреждают нейтрофилы, а выделяющиеся в синовиальную полость лизосомальные ферменты потенцируют воспаление.
3. Со временем на смену нейтрофилам приходят макрофаги. Под действием уратных кристаллов из макрофагов высвобождаются простагландины (простагландин Е2), лизосомные ферменты, ФНО-a, ИЛ-1 и ИЛ-6. Синовиоциты тоже участвуют в развитии воспаления, выделяя ИЛ-8 и другие цитокины. В связи с тем, что под действием мочевой кислоты возможно высвобождение медиаторов воспаления из синовиальных макрофагов, происходит вовлечение в процесс других суставов и мягких тканей.
4. Некоторые белки плазмы влияют на способность уратных кристаллов вызывать воспаление.
5. При воспалении проницаемость синовиальной оболочки повышается, и крупные молекулы, включая липопротеиды, проникают в полость сустава, связываются с уратными кристаллами и, возможно, способствуют прекращению приступа.
Однако есть мнение, что липопротеины способны проникать через воспалённую синовиальную мембрану, взаимодействовать с кристаллами и модулировать воспаление.
 III стадия. Межприступный период.
Выделение межприступного периода имеет принципиальное практическое значение, поскольку систематическое лечение в этот период позволяет не только предотвратить дальнейшее прогрессирование болезни, но и будет способствовать обратному развитию уже образовавшихся тофусов.
Наступает после окончания первого приступа и может прерваться следующей острой атакой. Но и в межприступный период подагра продолжает прогрессировать.
Повторные моноартикулярные атаки
Примерно у 7% больных после первого эпизода подагры повторных атак не отмечают.
Некоторые больные подагрой испытывают приступ лишь однажды в жизни, другие — многократно. Хотя между первым и вторым приступом иногда проходит 40 лет и более, у 75% больных второй приступ наблюдается в течение 2 лет после первого. В межприступном периоде боль в суставах отсутствует.
Однако у 62% повторные приступы возникают в течение первого года болезни.
В типичных случаях в межприступном периоде пациенты не предъявляют жалоб, но если больной не получает лечения, то каждая последующая атака протекает тяжелее и межприступный период укорачивается.
Прогрессирование болезни.
Со временем приступы становятся тяжелее и приобретают характер полиартрита.
III стадия. Межприступный период.
Выделение межприступного периода имеет принципиальное практическое значение, поскольку систематическое лечение в этот период позволяет не только предотвратить дальнейшее прогрессирование болезни, но и будет способствовать обратному развитию уже образовавшихся тофусов.
Наступает после окончания первого приступа и может прерваться следующей острой атакой. Но и в межприступный период подагра продолжает прогрессировать.
Повторные моноартикулярные атаки
Примерно у 7% больных после первого эпизода подагры повторных атак не отмечают.
Некоторые больные подагрой испытывают приступ лишь однажды в жизни, другие — многократно. Хотя между первым и вторым приступом иногда проходит 40 лет и более, у 75% больных второй приступ наблюдается в течение 2 лет после первого. В межприступном периоде боль в суставах отсутствует.
Однако у 62% повторные приступы возникают в течение первого года болезни.
В типичных случаях в межприступном периоде пациенты не предъявляют жалоб, но если больной не получает лечения, то каждая последующая атака протекает тяжелее и межприступный период укорачивается.
Прогрессирование болезни.
Со временем приступы становятся тяжелее и приобретают характер полиартрита.


 При микроскопическом исследовании последней обнаруживаются кристаллы мочекислого натрия.
При микроскопическом исследовании последней обнаруживаются кристаллы мочекислого натрия.
 Свищи редко инфицируются, что связывают с бактерицидным действием содержимого тофусов, но заживают медленно.
С течением времени в пораженных суставах возникают явления ОА, что способствует развитию функциональной недостаточности суставов.
4. Постепенно нарастают стойкие изменения суставов, признаки хронического полиартрита развивается полиартрит, включающий в себя не только плюснефаланговые суставы, но и крупные суставы (коленные, локтевые, плечевые). Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны (чаще поражаются суставы ног).
Свищи редко инфицируются, что связывают с бактерицидным действием содержимого тофусов, но заживают медленно.
С течением времени в пораженных суставах возникают явления ОА, что способствует развитию функциональной недостаточности суставов.
4. Постепенно нарастают стойкие изменения суставов, признаки хронического полиартрита развивается полиартрит, включающий в себя не только плюснефаланговые суставы, но и крупные суставы (коленные, локтевые, плечевые). Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны (чаще поражаются суставы ног).
 С течением времени возникают:
С течением времени возникают:
 Поражение почек.
Из подагрических висцеропатий наиболее часто встречается поражение почек. При нарушении пуринового обмена почки являются органами – мишенями. Частота поражения почек у больных подагрой колеблется в широких пределах — от 30 до 75%.
При использовании радиоизотопной ренографии нарушение функции почек выявляется у 93% больных.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома. Они могут появиться на любой стадии подагры. Прогностически поражение почек при подагре очень неблагоприятно, поэтому большое значение имеет своевременная диагностика подагрической нефропатии.
Подагрическая нефропатия – собирательное понятие, включающее всю почечную патологию, наблюдаемую при подагре (тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз, артериосклероз и артериосклероз с развитием нефросклероза).
Можно выделить три варианта поражения почек при подагре:
Поражение почек.
Из подагрических висцеропатий наиболее часто встречается поражение почек. При нарушении пуринового обмена почки являются органами – мишенями. Частота поражения почек у больных подагрой колеблется в широких пределах — от 30 до 75%.
При использовании радиоизотопной ренографии нарушение функции почек выявляется у 93% больных.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома. Они могут появиться на любой стадии подагры. Прогностически поражение почек при подагре очень неблагоприятно, поэтому большое значение имеет своевременная диагностика подагрической нефропатии.
Подагрическая нефропатия – собирательное понятие, включающее всю почечную патологию, наблюдаемую при подагре (тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз, артериосклероз и артериосклероз с развитием нефросклероза).
Можно выделить три варианта поражения почек при подагре:
 При остром артрите специфических изменений не рентгенограммах не выявляется.
1. Крупные штампованные дефекты эпифизов костей, окружённые склеротической каймой, симптом «пробойника».
2. Кистовидные (крупной или овальной формы) дефекты, которые могут разрушать кортикальный слой кости, симптом «вздутия костного края». Наличие этих патологических явлений связывают с образованием костных тофусов.
3. Иногда обнаруживают костные эрозии – интраартикулярные и периартикулярные, центральные и краевой локализации.
4. В редких случаях наблюдается крупные эрозии костей с остеолизом эпифиза и диафиза, возможно замещение их уратными массами.
При остром артрите специфических изменений не рентгенограммах не выявляется.
1. Крупные штампованные дефекты эпифизов костей, окружённые склеротической каймой, симптом «пробойника».
2. Кистовидные (крупной или овальной формы) дефекты, которые могут разрушать кортикальный слой кости, симптом «вздутия костного края». Наличие этих патологических явлений связывают с образованием костных тофусов.
3. Иногда обнаруживают костные эрозии – интраартикулярные и периартикулярные, центральные и краевой локализации.
4. В редких случаях наблюдается крупные эрозии костей с остеолизом эпифиза и диафиза, возможно замещение их уратными массами.
 Все выше указанные изменения находят чаще всего в первом плюснефаланговом суставе и фалангах пальцев, однако их можно встретить и в любых суставах.
Однако указанная рентгенологическая картина подагры встречается в настоящее время редко – при большой длительности заболевания, а также при тяжёлых формах болезни у лиц молодого возраста.
В большинстве же случаев при достоверной подагре рентгенологическая картина соответствует явлениям остеоартроза или не обнаруживает каких-либо изменений.
5. Утолщение и расширение тени мягких тканей при подагре обусловлены отложением в них уратов и образованием подагрических узелков.
Все выше указанные изменения находят чаще всего в первом плюснефаланговом суставе и фалангах пальцев, однако их можно встретить и в любых суставах.
Однако указанная рентгенологическая картина подагры встречается в настоящее время редко – при большой длительности заболевания, а также при тяжёлых формах болезни у лиц молодого возраста.
В большинстве же случаев при достоверной подагре рентгенологическая картина соответствует явлениям остеоартроза или не обнаруживает каких-либо изменений.
5. Утолщение и расширение тени мягких тканей при подагре обусловлены отложением в них уратов и образованием подагрических узелков.
 На основании этих изменений выделяют три рентгенологические стадии хронического подагрического артрита (Кавеноки—Минц Э., 1987):
I стадия. Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
II стадия. Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
III стадия. Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лабораторные данные
1. При повышении активности: в-липопротеинемия, ↑ СОЭ, лейкоцитоз, ↑ a2-глобулинов, ↑ фибриногена, ДФА-пробы, серомукоидов.
2. Гиперурикемия.
Для подагры характерна гиперурикемия свыше 6-7 мг%, особенно на фоне диеты с ограничением пуринов в течение 3-5 дней.
Однако, необходимо отметить, что в 10% случаев при подагре содержание мочевой кислоты не превышает физиологических величин, поэтому этот показатель не считают специфичным для острого подагрического артрита.
3. В синовиальной жидкости находят уратные кристаллы.
Причём, наибольшее диагностическое значение имеют игольчатые кристаллы, расположенные внутриклеточно и двоякопреломляющие свет при исследовании в поляризационном микроскопе.
На основании этих изменений выделяют три рентгенологические стадии хронического подагрического артрита (Кавеноки—Минц Э., 1987):
I стадия. Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
II стадия. Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
III стадия. Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лабораторные данные
1. При повышении активности: в-липопротеинемия, ↑ СОЭ, лейкоцитоз, ↑ a2-глобулинов, ↑ фибриногена, ДФА-пробы, серомукоидов.
2. Гиперурикемия.
Для подагры характерна гиперурикемия свыше 6-7 мг%, особенно на фоне диеты с ограничением пуринов в течение 3-5 дней.
Однако, необходимо отметить, что в 10% случаев при подагре содержание мочевой кислоты не превышает физиологических величин, поэтому этот показатель не считают специфичным для острого подагрического артрита.
3. В синовиальной жидкости находят уратные кристаллы.
Причём, наибольшее диагностическое значение имеют игольчатые кристаллы, расположенные внутриклеточно и двоякопреломляющие свет при исследовании в поляризационном микроскопе.
 Кристаллы обычно наблюдаются в нейтрофилах в период острого подагрического артрита. Цитоз 10000-60000 клеток на мм3 (преимущественно нейтрофилы).
4. Аспирация содержимого тофусов позволяет обнаружить кристаллы мочевой кислоты.
5. В моче – кристаллы уратов.
Диагноз
Диагноз подагры основывается на клинических, лабораторных и рентгеновском методах исследования.
Клинико-лабораторные критерии.
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры.
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости суставов или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1.- 2 нед.
Диагноз подагры считается достоверным при наличии, по крайней мере, двух из четырех приведенных критериев.
Критерии SL.Wallace и соавт. (1997 г.), рекомендованные ВОЗ в 2000 г
В последнее время данные критерии все большее распространение приобретают для широкой клинической практики в связи с решением ООН и ВОЗ о проведении международной декады костей и суставов (2000-2010), основная цель которой – раннее распознавание, лечение и предупреждение наиболее распространенных костно-суставных болезней.
Классификационные критерии диагноза подагры
(Wallace и соавт., 1997г.)
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
Кристаллы обычно наблюдаются в нейтрофилах в период острого подагрического артрита. Цитоз 10000-60000 клеток на мм3 (преимущественно нейтрофилы).
4. Аспирация содержимого тофусов позволяет обнаружить кристаллы мочевой кислоты.
5. В моче – кристаллы уратов.
Диагноз
Диагноз подагры основывается на клинических, лабораторных и рентгеновском методах исследования.
Клинико-лабораторные критерии.
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры.
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости суставов или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1.- 2 нед.
Диагноз подагры считается достоверным при наличии, по крайней мере, двух из четырех приведенных критериев.
Критерии SL.Wallace и соавт. (1997 г.), рекомендованные ВОЗ в 2000 г
В последнее время данные критерии все большее распространение приобретают для широкой клинической практики в связи с решением ООН и ВОЗ о проведении международной декады костей и суставов (2000-2010), основная цель которой – раннее распознавание, лечение и предупреждение наиболее распространенных костно-суставных болезней.
Классификационные критерии диагноза подагры
(Wallace и соавт., 1997г.)
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
 Бессимптомная гиперурикемия.
Многие годы страх перед мнениями заставлял врачей назначать гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с некачественными новообразованиями при назначении цитостатиков.
Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры. Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих больных мочекаменной болезнью имеется гиперурикемия, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие, как артериальная гипертония, гиперхолестеринемия, сахарный диабет и ожирение.
Выводы:
1. Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения.
2. У пациентов с длительно повышенным (до 10 мг%) уровнем мочевой кислоты в крови риск развития острого приступа подагры увеличен на 90%, однако многие врачи назначают лечение до развития подагрической атаки.
3. Необходима только коррекция предрасполагающих факторов. На этой стадий подагры, как и на всех других стадиях, необходимо контролировать вторичную гиперурикемию.
4. На этой стадии (особенно) правильное питание – основа лечения.
Диета
Диета при подагре преследует целью ограничить поступление пуринов в организм с пищей, что позволяет уменьшить дозы лекарственных препаратов. Предпочтительна преимущественно молочно-растительная диета (стол № 6 по Певзнеру).
1. Потребность организма в калориях должна удовлетворяться в основном за счет углеводов, однако, общую калорийность пищи у тучных больных следует ограничить.
2. Из рациона исключают богатые пуринами продукты (печень, почки, мозги, легкие, крепкие мясные бульоны, жареное мясо). Ограничивают употребление бобовых, шпината, салата, щавеля, баклажанов, редиса, цветной капусты, отварного мяса, рыбы, шоколада, кофе, какао.
3. Ограничивают употребление жира (не должно превышать 1 г/кг). Мясо или рыбу употребляют не больше 1 раза в день, в более тяжёлых случаях – 2 -3 дня в неделю.
В небольших количествах в рационе могут присутствовать яйца, мучные и крупяные блюда, нежирные сорта рыбы, говядина, баранина. Рыбу и мясные блюда следует употреблять в отварном виде. В минимальном количестве пуриновые основания и мочевая кислота содержатся в молоке и молочных продуктах, хлебе, картофеле, моркови, капусте, орехах, яблоках, грушах, сливах, вишнях, арбузах, дынях, огурцах, луке, апельсинах, абрикосах, персиках, лимонах и винограде. Пища должна содержать необходимое количество витаминов, особенно аскорбиновой кислоты, рутина, рибофлавина. Поэтому полезны отвары шиповника, лимоны, яблоки, черная смородина.
4. Количество белков уменьшают до 0,5-1г/кг, поваренную соль ограничивают до 2-4 г в день.
5. Показано обильное питьё 1,5-2 литра жидкости в день с включением щелочных минеральных вод или ощелачивающих средств. В отдельных случаях количество жидкости желательно увеличить до 2-3 литров в день (рецидивирующая почечная колика, острый подагрический артрит).
6. Категорически запрещаются алкогольные напитки, поскольку алкоголь увеличивает образование мочевой кислоты в организме и блокирует её экскрецию почками.
Однако хочется ещё раз подчеркнуть, что соблюдение диеты для снижения уровня урикемии бывает достаточно лишь в начальных фазах болезни.
Острый подагрический артрит.
Наиболее эффективно лечение острого подагрического артрита в самом раннем периоде.
1. Начало — с принятия общих мер, направленных на смягчение проявлений суставного синдрома: полный покой, возвышенное положение конечности, местно — холод. Обильное питье (2-2,5 л жидкости в день) — щелочные растворы, разведенный лимонный сок, молоко, кефир, кисели, компоты. Рекомендуются овощные супы, жидкие каши.
2. Ограничить все субпродукты (печень, почки, мозги, язык), все сорта мяса, особенно молодых животных, рыбы и птицы, копчености, консервы, мясные и рыбные бульоны; растительные белки (бобовые, грибы), редис, цветная капуста, шоколад. Стоит также ограничить употребление чая, кофе, какао, всех алкогольных напитков, особенно шампанского. Назначают обычный приём щелочных вод, диету с ограничением пуринов. Следует предостеречь больных от полного голодания из-за опасности увеличения урикемии вторичного характера (усиленный распад белков при голодании).
3. Как и во всех других случаях артритов, важно обеспечить покой и иммобилизацию больного сустава.
Существует два классических медикаментозных подхода к купированию приступа подагры:
I. Назначение колхицина
II. Назначение нестероидных противовоспалительных препаратов (НПВП).
В настоящее время признано, что в целом эффективность этих двух методов одинакова. Различия заключаются только в скорости наступления эффекта и переносимости. Колхицин начинает действовать быстрее: между 12 и 48 ч (НПВП – между 24 и 48 ч), но несомненно чаще вызывает побочные явления.
Колхицин
Колхицин является мощным ингибитором фосфатазы, тормозит процессы деления клеток. Показано, что при контакте нейтрофилов с уратными кристаллами происходит фосфорилирование остатков тирозина в белках этих клеток. Колхицин, традиционно применяемый для лечения подагры, препятствует активации нейтрофилов, угнетая фосфорилирование тирозина.
1. Назначение колхицина в первые часы подагрического криза позволяет купировать последний либо значительно ослабить его.
2. Препарат обладает способностью блокировать фагоцитоз и деление клеток, что препятствует высвобождению медиаторов воспаления из нейтрофилов и синовиоцитов.
3. Его назначают в/в, но из-за токсичности препарата следует соблюдать осторожность при лечении пожилых людей и больных с заболеваниями почек и печени. Поэтому его назначают при неэффективности НПВП или при наличии противопоказаний для их назначения.
Разовую дозу (1 – 2 мг) разводят в 20 мл физиологического раствора (в/в – в течение 20-30 мин). Через 6 – 12 ч можно ввести еще 1 мг. Абсолютные противопоказания к в/в введению колхицина — это угнетение кроветворения, нарушение функции почек (СКФ менее 10 мл/мин, олигурия или анурия), болезни печени (биохимические показатели функции печени в 2 раза превышают верхнюю границу нормы) и сепсис.
Колхицин можно назначать и перорально по 0,6 – 1,2 мг каждый час или каждые 2 часа в 1-е сутки до исчезновения симптомов или появления побочных эффектов со стороны ЖКТ. В отсутствие эффекта препарат отменяют через 10 ч (в этом случае диагноз подагры ставится под сомнение)
или более безопасная схема:
первый день — Колхицин внутрь по 1 мг 3 р/сут после еды
второй день — Колхицин внутрь по 1 мг утром и вечером
затем — Колхицин внутрь по 1 г/сут
Нередко уже к концу первого дня наступает терапевтический эффект, после чего дозу препарата уменьшают до 1-0,5 мг в сутки.
4. Длительность лечения может быть непродолжительной – 2 – 4 суток.
5.При пероральном назначении колхицина возможны также побочные явления:
Бессимптомная гиперурикемия.
Многие годы страх перед мнениями заставлял врачей назначать гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с некачественными новообразованиями при назначении цитостатиков.
Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры. Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих больных мочекаменной болезнью имеется гиперурикемия, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие, как артериальная гипертония, гиперхолестеринемия, сахарный диабет и ожирение.
Выводы:
1. Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения.
2. У пациентов с длительно повышенным (до 10 мг%) уровнем мочевой кислоты в крови риск развития острого приступа подагры увеличен на 90%, однако многие врачи назначают лечение до развития подагрической атаки.
3. Необходима только коррекция предрасполагающих факторов. На этой стадий подагры, как и на всех других стадиях, необходимо контролировать вторичную гиперурикемию.
4. На этой стадии (особенно) правильное питание – основа лечения.
Диета
Диета при подагре преследует целью ограничить поступление пуринов в организм с пищей, что позволяет уменьшить дозы лекарственных препаратов. Предпочтительна преимущественно молочно-растительная диета (стол № 6 по Певзнеру).
1. Потребность организма в калориях должна удовлетворяться в основном за счет углеводов, однако, общую калорийность пищи у тучных больных следует ограничить.
2. Из рациона исключают богатые пуринами продукты (печень, почки, мозги, легкие, крепкие мясные бульоны, жареное мясо). Ограничивают употребление бобовых, шпината, салата, щавеля, баклажанов, редиса, цветной капусты, отварного мяса, рыбы, шоколада, кофе, какао.
3. Ограничивают употребление жира (не должно превышать 1 г/кг). Мясо или рыбу употребляют не больше 1 раза в день, в более тяжёлых случаях – 2 -3 дня в неделю.
В небольших количествах в рационе могут присутствовать яйца, мучные и крупяные блюда, нежирные сорта рыбы, говядина, баранина. Рыбу и мясные блюда следует употреблять в отварном виде. В минимальном количестве пуриновые основания и мочевая кислота содержатся в молоке и молочных продуктах, хлебе, картофеле, моркови, капусте, орехах, яблоках, грушах, сливах, вишнях, арбузах, дынях, огурцах, луке, апельсинах, абрикосах, персиках, лимонах и винограде. Пища должна содержать необходимое количество витаминов, особенно аскорбиновой кислоты, рутина, рибофлавина. Поэтому полезны отвары шиповника, лимоны, яблоки, черная смородина.
4. Количество белков уменьшают до 0,5-1г/кг, поваренную соль ограничивают до 2-4 г в день.
5. Показано обильное питьё 1,5-2 литра жидкости в день с включением щелочных минеральных вод или ощелачивающих средств. В отдельных случаях количество жидкости желательно увеличить до 2-3 литров в день (рецидивирующая почечная колика, острый подагрический артрит).
6. Категорически запрещаются алкогольные напитки, поскольку алкоголь увеличивает образование мочевой кислоты в организме и блокирует её экскрецию почками.
Однако хочется ещё раз подчеркнуть, что соблюдение диеты для снижения уровня урикемии бывает достаточно лишь в начальных фазах болезни.
Острый подагрический артрит.
Наиболее эффективно лечение острого подагрического артрита в самом раннем периоде.
1. Начало — с принятия общих мер, направленных на смягчение проявлений суставного синдрома: полный покой, возвышенное положение конечности, местно — холод. Обильное питье (2-2,5 л жидкости в день) — щелочные растворы, разведенный лимонный сок, молоко, кефир, кисели, компоты. Рекомендуются овощные супы, жидкие каши.
2. Ограничить все субпродукты (печень, почки, мозги, язык), все сорта мяса, особенно молодых животных, рыбы и птицы, копчености, консервы, мясные и рыбные бульоны; растительные белки (бобовые, грибы), редис, цветная капуста, шоколад. Стоит также ограничить употребление чая, кофе, какао, всех алкогольных напитков, особенно шампанского. Назначают обычный приём щелочных вод, диету с ограничением пуринов. Следует предостеречь больных от полного голодания из-за опасности увеличения урикемии вторичного характера (усиленный распад белков при голодании).
3. Как и во всех других случаях артритов, важно обеспечить покой и иммобилизацию больного сустава.
Существует два классических медикаментозных подхода к купированию приступа подагры:
I. Назначение колхицина
II. Назначение нестероидных противовоспалительных препаратов (НПВП).
В настоящее время признано, что в целом эффективность этих двух методов одинакова. Различия заключаются только в скорости наступления эффекта и переносимости. Колхицин начинает действовать быстрее: между 12 и 48 ч (НПВП – между 24 и 48 ч), но несомненно чаще вызывает побочные явления.
Колхицин
Колхицин является мощным ингибитором фосфатазы, тормозит процессы деления клеток. Показано, что при контакте нейтрофилов с уратными кристаллами происходит фосфорилирование остатков тирозина в белках этих клеток. Колхицин, традиционно применяемый для лечения подагры, препятствует активации нейтрофилов, угнетая фосфорилирование тирозина.
1. Назначение колхицина в первые часы подагрического криза позволяет купировать последний либо значительно ослабить его.
2. Препарат обладает способностью блокировать фагоцитоз и деление клеток, что препятствует высвобождению медиаторов воспаления из нейтрофилов и синовиоцитов.
3. Его назначают в/в, но из-за токсичности препарата следует соблюдать осторожность при лечении пожилых людей и больных с заболеваниями почек и печени. Поэтому его назначают при неэффективности НПВП или при наличии противопоказаний для их назначения.
Разовую дозу (1 – 2 мг) разводят в 20 мл физиологического раствора (в/в – в течение 20-30 мин). Через 6 – 12 ч можно ввести еще 1 мг. Абсолютные противопоказания к в/в введению колхицина — это угнетение кроветворения, нарушение функции почек (СКФ менее 10 мл/мин, олигурия или анурия), болезни печени (биохимические показатели функции печени в 2 раза превышают верхнюю границу нормы) и сепсис.
Колхицин можно назначать и перорально по 0,6 – 1,2 мг каждый час или каждые 2 часа в 1-е сутки до исчезновения симптомов или появления побочных эффектов со стороны ЖКТ. В отсутствие эффекта препарат отменяют через 10 ч (в этом случае диагноз подагры ставится под сомнение)
или более безопасная схема:
первый день — Колхицин внутрь по 1 мг 3 р/сут после еды
второй день — Колхицин внутрь по 1 мг утром и вечером
затем — Колхицин внутрь по 1 г/сут
Нередко уже к концу первого дня наступает терапевтический эффект, после чего дозу препарата уменьшают до 1-0,5 мг в сутки.
4. Длительность лечения может быть непродолжительной – 2 – 4 суток.
5.При пероральном назначении колхицина возможны также побочные явления:
 Концентрация насыщенного раствора мочевой кислоты в сыворотке при температуре 37°С составляет 416 мкмоль/л (7 мг%). Превышение этого порога создает предпосылку для кристаллизации уратов. Однако в крови содержатся вещества, которые увеличивают растворимость, поэтому обычно кристаллизации не происходит даже при концентрации мочевой кислоты в сыворотке 4800 мкмоль/л (80 мг%).
Мочевая кислота растворяется в моче лучше, чем в воде, возможно, из-за присутствия мочевины, белков и гликозаминогликанов. Ее растворимость зависит от рН. При рН, равном 5, растворимость мочевой кислоты в моче составляет 360—900 мкмоль/л (6—15 мг%), а при рН, равном 7, – 9480—12000 мкмоль/л (158—200 мг%). Часть мочевой кислоты находится в моче в виде солей: мононатриевой, динатриевой, калиевой, аммониевой и кальциевой.
Синтез и распад пуринов происходят во всех тканях, но мочевая кислота образуется только там, где есть ксантиноксидаза, прежде всего в печени и тонкой кишке. Количество мочевой кислоты в организме определяется соотношением скоростей образования мочевой кислоты и ее выведения. Скорость образования мочевой кислоты зависит от количества пуринов в рационе и скоростей синтеза, регенерации и распада пуринов. В норме 66—75% мочевой кислоты выводится с мочой, а оставшаяся часть — в основном с калом.
Приблизительно 98 – 100% мочевой кислоты из клубочкового фильтрата реабсорбируется в проксимальных канальцах, но половина этого количества секретируется в этих канальцах обратно, а затем около 40% снова подвергается реабсорбции. В результате в мочу попадает лишь 8 – 12% отфильтровавшейся мочевой кислоты.
Концентрация мочевой кислоты в сыворотке зависит от пола и возраста, а у взрослых — от роста, веса, АД, функции почек и употребления спиртных напитков. У большинства детей она составляет 180 – 240 мкмоль/л (3 – 4 мг%). По мере полового созревания у мужчин концентрация нарастает, а у женщин остается низкой до наступления менопаузы. Причина такого различия окончательно не установлена. Верхняя граница нормальной концентрации мочевой кислоты в сыворотке у женщин детородного возраста и у взрослых мужчин составляет соответственно 360 и 416 мкмоль/л (6 и 7 мг%). В постменопаузе концентрация мочевой кислоты в сыворотке у женщин увеличивается и приближается к концентрации, характерной для мужчин.
Концентрация насыщенного раствора мочевой кислоты в сыворотке при температуре 37°С составляет 416 мкмоль/л (7 мг%). Превышение этого порога создает предпосылку для кристаллизации уратов. Однако в крови содержатся вещества, которые увеличивают растворимость, поэтому обычно кристаллизации не происходит даже при концентрации мочевой кислоты в сыворотке 4800 мкмоль/л (80 мг%).
Мочевая кислота растворяется в моче лучше, чем в воде, возможно, из-за присутствия мочевины, белков и гликозаминогликанов. Ее растворимость зависит от рН. При рН, равном 5, растворимость мочевой кислоты в моче составляет 360—900 мкмоль/л (6—15 мг%), а при рН, равном 7, – 9480—12000 мкмоль/л (158—200 мг%). Часть мочевой кислоты находится в моче в виде солей: мононатриевой, динатриевой, калиевой, аммониевой и кальциевой.
Синтез и распад пуринов происходят во всех тканях, но мочевая кислота образуется только там, где есть ксантиноксидаза, прежде всего в печени и тонкой кишке. Количество мочевой кислоты в организме определяется соотношением скоростей образования мочевой кислоты и ее выведения. Скорость образования мочевой кислоты зависит от количества пуринов в рационе и скоростей синтеза, регенерации и распада пуринов. В норме 66—75% мочевой кислоты выводится с мочой, а оставшаяся часть — в основном с калом.
Приблизительно 98 – 100% мочевой кислоты из клубочкового фильтрата реабсорбируется в проксимальных канальцах, но половина этого количества секретируется в этих канальцах обратно, а затем около 40% снова подвергается реабсорбции. В результате в мочу попадает лишь 8 – 12% отфильтровавшейся мочевой кислоты.
Концентрация мочевой кислоты в сыворотке зависит от пола и возраста, а у взрослых — от роста, веса, АД, функции почек и употребления спиртных напитков. У большинства детей она составляет 180 – 240 мкмоль/л (3 – 4 мг%). По мере полового созревания у мужчин концентрация нарастает, а у женщин остается низкой до наступления менопаузы. Причина такого различия окончательно не установлена. Верхняя граница нормальной концентрации мочевой кислоты в сыворотке у женщин детородного возраста и у взрослых мужчин составляет соответственно 360 и 416 мкмоль/л (6 и 7 мг%). В постменопаузе концентрация мочевой кислоты в сыворотке у женщин увеличивается и приближается к концентрации, характерной для мужчин.
 II. Возникновение подагры связывают как с генетической обусловленностью, так и с алиментарными причинами.
Среди населения в целом распространенность гиперурикемии составляет 2 – 13,2%, а подагры — 1,3 – 3,7%. Чем выше концентрация мочевой кислоты в сыворотке, тем больше вероятность подагры. Согласно одному из исследований, заболеваемость подагрой при концентрации мочевой кислоты в сыворотке более 540 мкмоль/л (9 мг%) составила 4,9%, а при концентрации 415 – 535 мкмоль/л (7 – 9 мг%) — 0,5%. Течение подагры зависит от продолжительности и тяжести гиперурикемии. Первый приступ подагры чаще всего возникает через 20—40 лет стойкой гиперурикемии; у мужчин это обычно происходит в возрасте 40—60 лет, а у женщин – после наступления менопаузы.
III. Однако, необходимо особо подчеркнуть, что выявления гиперурикемии недостаточно для установления диагноза, так как лишь около 10% больных гиперурикемией страдают подагрой. В этой связи важно подчеркнуть парадокс XX века – у всех больных с подагрой определяется гиперурикемия, но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита. А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающееся воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия – необходимое, но недостаточное предшествующее явление для развития уратной микрокристаллической болезни, а, следовательно, гиперурикемия – отличный от подагры клинический синдром.
IV. Следовательно, в развитии подагры наряду с гиперурикемией важное значение имеют другие факторы.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом “антивоспалительных” медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста-В и др.).
V. До настоящего времени неизвестны факторы, предрасполагающие к отложению уратов и воспалению суставов у лиц с гиперурикемией (за исключением семейных случаев).
КЛАССИФИКАЦИЯ ПРИЧИН ГИПЕРУРИКЕМИИ
II. Возникновение подагры связывают как с генетической обусловленностью, так и с алиментарными причинами.
Среди населения в целом распространенность гиперурикемии составляет 2 – 13,2%, а подагры — 1,3 – 3,7%. Чем выше концентрация мочевой кислоты в сыворотке, тем больше вероятность подагры. Согласно одному из исследований, заболеваемость подагрой при концентрации мочевой кислоты в сыворотке более 540 мкмоль/л (9 мг%) составила 4,9%, а при концентрации 415 – 535 мкмоль/л (7 – 9 мг%) — 0,5%. Течение подагры зависит от продолжительности и тяжести гиперурикемии. Первый приступ подагры чаще всего возникает через 20—40 лет стойкой гиперурикемии; у мужчин это обычно происходит в возрасте 40—60 лет, а у женщин – после наступления менопаузы.
III. Однако, необходимо особо подчеркнуть, что выявления гиперурикемии недостаточно для установления диагноза, так как лишь около 10% больных гиперурикемией страдают подагрой. В этой связи важно подчеркнуть парадокс XX века – у всех больных с подагрой определяется гиперурикемия, но подавляющее большинство людей с гиперурикемией никогда не переносили приступов острого артрита. А это означает, что развитие подагры обусловлено патофизиологическими особенностями, определяющими отложение уратных кристаллов в тканях, сопровождающееся воспалением и последующими дегенеративными изменениями. Таким образом, гиперурикемия – необходимое, но недостаточное предшествующее явление для развития уратной микрокристаллической болезни, а, следовательно, гиперурикемия – отличный от подагры клинический синдром.
IV. Следовательно, в развитии подагры наряду с гиперурикемией важное значение имеют другие факторы.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом “антивоспалительных” медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста-В и др.).
V. До настоящего времени неизвестны факторы, предрасполагающие к отложению уратов и воспалению суставов у лиц с гиперурикемией (за исключением семейных случаев).
КЛАССИФИКАЦИЯ ПРИЧИН ГИПЕРУРИКЕМИИ
 У больных встречают и комбинированные дефекты
То есть «гиперпродукторы» могут одновременно быть и «гипоэкскреторами».
Смешанная гиперурикемия. Иногда причиной гиперурикемии бывает сочетание повышенного образования мочевой кислоты и сниженного ее выведения.
1. При гликогенозе типа I (недостаточности глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу) уже в грудном возрасте появляется гиперурикемия и рано развивается подагра.
Повышение продукции мочевой кислоты в этом случае связано с распадом АТФ во время или гипогликемии. Кроме того, у таких больных снижена концентрация нуклеозидмонофосфатов, что приводит к уменьшению их ингибирующего действия на амидофосфорибозилтрансферазу и усилению образования пуринов. Наконец, у них часто возрастает концентрация молочной кислоты в крови, а это сопровождается угнетением канальцевой секреции мочевой кислоты.
2. Оба механизма развития гиперурикемии действуют и при непереносимости фруктозы, связанной с недостаточностью фруктозодифосфатальдолазы. У таких больных прием фруктозы приводит к накоплению фруктозо-1-фосфата, истощению запасов АТФ, усилению катаболизма пуриновых нуклеотидов и гиперурикемии. Лактацидоз и почечный канальцевый ацидоз приводят к задержке мочевой кислоты в организме. У гомозигот после приема фруктозы наблюдаются рвота, гипогликемия, а продолжительное потребление фруктозы приводит к печеночной недостаточности и нарушению функции почечных канальцев. У гетерозигот развивается; гиперурикемия, а примерно у трети из них — подагра. По-видимому, это довольно частая причина семейной подагры, так как распространенность гетерозигот составляет 1:80 – 1:250.
3. Злоупотребление алкоголем также вызывает смешанную гиперурикемию путем:
1) стимуляции распада АТФ и усиления образования мочевой кислоты в печени
2) нарушения секреции мочевой кислоты в почках за счет ацидоза
3) кроме того, в некоторых спиртных напитках, например в пиве, содержится много пуринов.
Сопутствующие подагре состояния.
Приводимые ниже состояния часто наблюдаются у больных подагрой, но их связь с возникновением подагры не установлена.
1. Ожирение
Гиперурикемия зависит от массы тела. Подагру значительно чаще встречают у лиц с избыточной массой тела.
2. Сахарный диабет
Нарушение толерантности к глюкозе часто определяют у больных подагрой, что может быть следствием ожирения.
3. Артериальная гипертензия
У больных подагрой нередко имеется артериальная гипертензия, но прямая зависимость повышения уровня мочевой кислоты от артериального давления отсутствует.
Возможно наличие корреляции между ожирением и гипертензией.
4. Гиперлипедемии
При подагре II и IV типы гиперлипидемии часты.
5. Атеросклероз
Смерть больных подагрой обычно наступает вследствие сердечно- сосудистого заболевания.
Перечисленные выше факторы риска объясняют тенденцию к развитию атеросклероза.
Патогенез подагрического артрита
Клинические проявления подагры связаны с отложением в тканях кристаллов мочевой кислоты. Механизм отложения уратов до конца не выяснен.
1. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
2. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру, рН сыворотки крови и наличие субстанций, удерживающих ураты в жидкости — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0 – 13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
3. Итак, основные этапы патогенеза:
У больных встречают и комбинированные дефекты
То есть «гиперпродукторы» могут одновременно быть и «гипоэкскреторами».
Смешанная гиперурикемия. Иногда причиной гиперурикемии бывает сочетание повышенного образования мочевой кислоты и сниженного ее выведения.
1. При гликогенозе типа I (недостаточности глюкозо-6-фосфатазы, катализирующей превращение глюкозо-6-фосфата в глюкозу) уже в грудном возрасте появляется гиперурикемия и рано развивается подагра.
Повышение продукции мочевой кислоты в этом случае связано с распадом АТФ во время или гипогликемии. Кроме того, у таких больных снижена концентрация нуклеозидмонофосфатов, что приводит к уменьшению их ингибирующего действия на амидофосфорибозилтрансферазу и усилению образования пуринов. Наконец, у них часто возрастает концентрация молочной кислоты в крови, а это сопровождается угнетением канальцевой секреции мочевой кислоты.
2. Оба механизма развития гиперурикемии действуют и при непереносимости фруктозы, связанной с недостаточностью фруктозодифосфатальдолазы. У таких больных прием фруктозы приводит к накоплению фруктозо-1-фосфата, истощению запасов АТФ, усилению катаболизма пуриновых нуклеотидов и гиперурикемии. Лактацидоз и почечный канальцевый ацидоз приводят к задержке мочевой кислоты в организме. У гомозигот после приема фруктозы наблюдаются рвота, гипогликемия, а продолжительное потребление фруктозы приводит к печеночной недостаточности и нарушению функции почечных канальцев. У гетерозигот развивается; гиперурикемия, а примерно у трети из них — подагра. По-видимому, это довольно частая причина семейной подагры, так как распространенность гетерозигот составляет 1:80 – 1:250.
3. Злоупотребление алкоголем также вызывает смешанную гиперурикемию путем:
1) стимуляции распада АТФ и усиления образования мочевой кислоты в печени
2) нарушения секреции мочевой кислоты в почках за счет ацидоза
3) кроме того, в некоторых спиртных напитках, например в пиве, содержится много пуринов.
Сопутствующие подагре состояния.
Приводимые ниже состояния часто наблюдаются у больных подагрой, но их связь с возникновением подагры не установлена.
1. Ожирение
Гиперурикемия зависит от массы тела. Подагру значительно чаще встречают у лиц с избыточной массой тела.
2. Сахарный диабет
Нарушение толерантности к глюкозе часто определяют у больных подагрой, что может быть следствием ожирения.
3. Артериальная гипертензия
У больных подагрой нередко имеется артериальная гипертензия, но прямая зависимость повышения уровня мочевой кислоты от артериального давления отсутствует.
Возможно наличие корреляции между ожирением и гипертензией.
4. Гиперлипедемии
При подагре II и IV типы гиперлипидемии часты.
5. Атеросклероз
Смерть больных подагрой обычно наступает вследствие сердечно- сосудистого заболевания.
Перечисленные выше факторы риска объясняют тенденцию к развитию атеросклероза.
Патогенез подагрического артрита
Клинические проявления подагры связаны с отложением в тканях кристаллов мочевой кислоты. Механизм отложения уратов до конца не выяснен.
1. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
2. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру, рН сыворотки крови и наличие субстанций, удерживающих ураты в жидкости — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0 – 13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
3. Итак, основные этапы патогенеза:
 б) Большинство подагрических атак происходит ночью с быстрым нарастанием эритемы и температуры вокруг сустава, отёчности и болезненности. Боль резкая, усиливающаяся при опускании конечности.
в) Воспаление может перейти и на мягкие ткани, формируя клиническую картину целлюлита или флебита.
г) Тяжёлые случаи сопровождает лихорадочная реакция (38-39°С), наблюдается лейкоцитоз, повышение СОЭ.
Течение подагрического приступ:.
а) Обычная продолжительность приступа – несколько дней, реже — несколько недель (2-3 дня, а затем медленно уменьшается в течение 7-10 дней).
б) В некоторых случаях возможен и полиартикулярный вариант:
— могут поражаться суставы свода стопы, голеностопный – “подагрическая стопа”.
— Реже наблюдаются внесуставная локализация воспаления, например, подошвенный фасциит, ахиллобурсит, воспаление узелков Гебердена. Сакроилеит, спондилоартрит и поражение синхондроза рукоятки грудины встречаются редко.
— Все компоненты острого воспаления в поражённых суставах обычно резко выражены, движения в суставах практически невозможны.
в) По мере прогрессирования болезни увеличивается длительность приступов острого артрита, укорачиваются промежутки между ними, моноартрит переходит постепенно в полиартрит (могут вовлекаться коленные, голеностопные, мелкие суставы кистей).
г) Характерная особенность острого подагрического артрита — полное спонтанное выздоровление и отсутствие симптомов между приступами до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующими заболеваниями суставов, наиболее часто — остеоартрозом.
д) Подагрический артрит у женщин возникает в основном в период менопаузы, течение заболевания более мягкое и доброкачественное, редко отмечаются типичные острые приступы. Диагностика подагры
в подобных случаях затрудняется из-за отсутствия выраженных экссудативных явлений в пораженных суставах, могут отмечаться лишь артралгии.
е) Поражение суставов имеет чаще асимметричный характер (интермиттирующая подагра).
Патогенез подагрического приступа:
1. Микротофусы (небольшие кристаллические скопления) в синовиальной мембране и хряще возникают в результате длительной гиперурикемии. Вследствие травмы, повышения температуры в суставе и изменения концентрации мочевой кислоты в крови или синовиальной жидкости микротофусы разрушаются, и кристаллы выходят в суставную полость.
2. Острый приступ подагры вызывает реакция нейтрофилов на уратные кристаллы, приводящая к активации гуморальных и клеточных механизмов воспаления. Уратные кристаллы активируют комплемент, как по классическому, так и по альтернативному пути. Кроме того, происходит контактная активация фактора свертывания XII (фактора Хагемана), стимулирующего образование брадикинина, калликреина и плазмина. Ig и компоненты комплемента опсонизируют (обволакивают) ураты, стимулируя фагоцитарную активность нейтрофилов. Под действием уратных кристаллов из нейтрофилов высвобождаются лизосомные ферменты, свободные радикалы кислорода, метаболиты лейкотриенов и простагландинов, коллагеназа и другие протеазы. Фагосомы нейтрофилов, поглотивших кристаллы, сливаются с лизосомами, а лизосомальные ферменты разрушают белковую оболочку кристаллов. Кристаллы повреждают нейтрофилы, а выделяющиеся в синовиальную полость лизосомальные ферменты потенцируют воспаление.
3. Со временем на смену нейтрофилам приходят макрофаги. Под действием уратных кристаллов из макрофагов высвобождаются простагландины (простагландин Е2), лизосомные ферменты, ФНО-a, ИЛ-1 и ИЛ-6. Синовиоциты тоже участвуют в развитии воспаления, выделяя ИЛ-8 и другие цитокины. В связи с тем, что под действием мочевой кислоты возможно высвобождение медиаторов воспаления из синовиальных макрофагов, происходит вовлечение в процесс других суставов и мягких тканей.
4. Некоторые белки плазмы влияют на способность уратных кристаллов вызывать воспаление.
5. При воспалении проницаемость синовиальной оболочки повышается, и крупные молекулы, включая липопротеиды, проникают в полость сустава, связываются с уратными кристаллами и, возможно, способствуют прекращению приступа.
Однако есть мнение, что липопротеины способны проникать через воспалённую синовиальную мембрану, взаимодействовать с кристаллами и модулировать воспаление.
б) Большинство подагрических атак происходит ночью с быстрым нарастанием эритемы и температуры вокруг сустава, отёчности и болезненности. Боль резкая, усиливающаяся при опускании конечности.
в) Воспаление может перейти и на мягкие ткани, формируя клиническую картину целлюлита или флебита.
г) Тяжёлые случаи сопровождает лихорадочная реакция (38-39°С), наблюдается лейкоцитоз, повышение СОЭ.
Течение подагрического приступ:.
а) Обычная продолжительность приступа – несколько дней, реже — несколько недель (2-3 дня, а затем медленно уменьшается в течение 7-10 дней).
б) В некоторых случаях возможен и полиартикулярный вариант:
— могут поражаться суставы свода стопы, голеностопный – “подагрическая стопа”.
— Реже наблюдаются внесуставная локализация воспаления, например, подошвенный фасциит, ахиллобурсит, воспаление узелков Гебердена. Сакроилеит, спондилоартрит и поражение синхондроза рукоятки грудины встречаются редко.
— Все компоненты острого воспаления в поражённых суставах обычно резко выражены, движения в суставах практически невозможны.
в) По мере прогрессирования болезни увеличивается длительность приступов острого артрита, укорачиваются промежутки между ними, моноартрит переходит постепенно в полиартрит (могут вовлекаться коленные, голеностопные, мелкие суставы кистей).
г) Характерная особенность острого подагрического артрита — полное спонтанное выздоровление и отсутствие симптомов между приступами до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующими заболеваниями суставов, наиболее часто — остеоартрозом.
д) Подагрический артрит у женщин возникает в основном в период менопаузы, течение заболевания более мягкое и доброкачественное, редко отмечаются типичные острые приступы. Диагностика подагры
в подобных случаях затрудняется из-за отсутствия выраженных экссудативных явлений в пораженных суставах, могут отмечаться лишь артралгии.
е) Поражение суставов имеет чаще асимметричный характер (интермиттирующая подагра).
Патогенез подагрического приступа:
1. Микротофусы (небольшие кристаллические скопления) в синовиальной мембране и хряще возникают в результате длительной гиперурикемии. Вследствие травмы, повышения температуры в суставе и изменения концентрации мочевой кислоты в крови или синовиальной жидкости микротофусы разрушаются, и кристаллы выходят в суставную полость.
2. Острый приступ подагры вызывает реакция нейтрофилов на уратные кристаллы, приводящая к активации гуморальных и клеточных механизмов воспаления. Уратные кристаллы активируют комплемент, как по классическому, так и по альтернативному пути. Кроме того, происходит контактная активация фактора свертывания XII (фактора Хагемана), стимулирующего образование брадикинина, калликреина и плазмина. Ig и компоненты комплемента опсонизируют (обволакивают) ураты, стимулируя фагоцитарную активность нейтрофилов. Под действием уратных кристаллов из нейтрофилов высвобождаются лизосомные ферменты, свободные радикалы кислорода, метаболиты лейкотриенов и простагландинов, коллагеназа и другие протеазы. Фагосомы нейтрофилов, поглотивших кристаллы, сливаются с лизосомами, а лизосомальные ферменты разрушают белковую оболочку кристаллов. Кристаллы повреждают нейтрофилы, а выделяющиеся в синовиальную полость лизосомальные ферменты потенцируют воспаление.
3. Со временем на смену нейтрофилам приходят макрофаги. Под действием уратных кристаллов из макрофагов высвобождаются простагландины (простагландин Е2), лизосомные ферменты, ФНО-a, ИЛ-1 и ИЛ-6. Синовиоциты тоже участвуют в развитии воспаления, выделяя ИЛ-8 и другие цитокины. В связи с тем, что под действием мочевой кислоты возможно высвобождение медиаторов воспаления из синовиальных макрофагов, происходит вовлечение в процесс других суставов и мягких тканей.
4. Некоторые белки плазмы влияют на способность уратных кристаллов вызывать воспаление.
5. При воспалении проницаемость синовиальной оболочки повышается, и крупные молекулы, включая липопротеиды, проникают в полость сустава, связываются с уратными кристаллами и, возможно, способствуют прекращению приступа.
Однако есть мнение, что липопротеины способны проникать через воспалённую синовиальную мембрану, взаимодействовать с кристаллами и модулировать воспаление.
 III стадия. Межприступный период.
Выделение межприступного периода имеет принципиальное практическое значение, поскольку систематическое лечение в этот период позволяет не только предотвратить дальнейшее прогрессирование болезни, но и будет способствовать обратному развитию уже образовавшихся тофусов.
Наступает после окончания первого приступа и может прерваться следующей острой атакой. Но и в межприступный период подагра продолжает прогрессировать.
Повторные моноартикулярные атаки
Примерно у 7% больных после первого эпизода подагры повторных атак не отмечают.
Некоторые больные подагрой испытывают приступ лишь однажды в жизни, другие — многократно. Хотя между первым и вторым приступом иногда проходит 40 лет и более, у 75% больных второй приступ наблюдается в течение 2 лет после первого. В межприступном периоде боль в суставах отсутствует.
Однако у 62% повторные приступы возникают в течение первого года болезни.
В типичных случаях в межприступном периоде пациенты не предъявляют жалоб, но если больной не получает лечения, то каждая последующая атака протекает тяжелее и межприступный период укорачивается.
Прогрессирование болезни.
Со временем приступы становятся тяжелее и приобретают характер полиартрита.
III стадия. Межприступный период.
Выделение межприступного периода имеет принципиальное практическое значение, поскольку систематическое лечение в этот период позволяет не только предотвратить дальнейшее прогрессирование болезни, но и будет способствовать обратному развитию уже образовавшихся тофусов.
Наступает после окончания первого приступа и может прерваться следующей острой атакой. Но и в межприступный период подагра продолжает прогрессировать.
Повторные моноартикулярные атаки
Примерно у 7% больных после первого эпизода подагры повторных атак не отмечают.
Некоторые больные подагрой испытывают приступ лишь однажды в жизни, другие — многократно. Хотя между первым и вторым приступом иногда проходит 40 лет и более, у 75% больных второй приступ наблюдается в течение 2 лет после первого. В межприступном периоде боль в суставах отсутствует.
Однако у 62% повторные приступы возникают в течение первого года болезни.
В типичных случаях в межприступном периоде пациенты не предъявляют жалоб, но если больной не получает лечения, то каждая последующая атака протекает тяжелее и межприступный период укорачивается.
Прогрессирование болезни.
Со временем приступы становятся тяжелее и приобретают характер полиартрита.


 При микроскопическом исследовании последней обнаруживаются кристаллы мочекислого натрия.
При микроскопическом исследовании последней обнаруживаются кристаллы мочекислого натрия.
 Свищи редко инфицируются, что связывают с бактерицидным действием содержимого тофусов, но заживают медленно.
С течением времени в пораженных суставах возникают явления ОА, что способствует развитию функциональной недостаточности суставов.
4. Постепенно нарастают стойкие изменения суставов, признаки хронического полиартрита развивается полиартрит, включающий в себя не только плюснефаланговые суставы, но и крупные суставы (коленные, локтевые, плечевые). Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны (чаще поражаются суставы ног).
Свищи редко инфицируются, что связывают с бактерицидным действием содержимого тофусов, но заживают медленно.
С течением времени в пораженных суставах возникают явления ОА, что способствует развитию функциональной недостаточности суставов.
4. Постепенно нарастают стойкие изменения суставов, признаки хронического полиартрита развивается полиартрит, включающий в себя не только плюснефаланговые суставы, но и крупные суставы (коленные, локтевые, плечевые). Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны (чаще поражаются суставы ног).
 С течением времени возникают:
С течением времени возникают:
 Поражение почек.
Из подагрических висцеропатий наиболее часто встречается поражение почек. При нарушении пуринового обмена почки являются органами – мишенями. Частота поражения почек у больных подагрой колеблется в широких пределах — от 30 до 75%.
При использовании радиоизотопной ренографии нарушение функции почек выявляется у 93% больных.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома. Они могут появиться на любой стадии подагры. Прогностически поражение почек при подагре очень неблагоприятно, поэтому большое значение имеет своевременная диагностика подагрической нефропатии.
Подагрическая нефропатия – собирательное понятие, включающее всю почечную патологию, наблюдаемую при подагре (тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз, артериосклероз и артериосклероз с развитием нефросклероза).
Можно выделить три варианта поражения почек при подагре:
Поражение почек.
Из подагрических висцеропатий наиболее часто встречается поражение почек. При нарушении пуринового обмена почки являются органами – мишенями. Частота поражения почек у больных подагрой колеблется в широких пределах — от 30 до 75%.
При использовании радиоизотопной ренографии нарушение функции почек выявляется у 93% больных.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома. Они могут появиться на любой стадии подагры. Прогностически поражение почек при подагре очень неблагоприятно, поэтому большое значение имеет своевременная диагностика подагрической нефропатии.
Подагрическая нефропатия – собирательное понятие, включающее всю почечную патологию, наблюдаемую при подагре (тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз, артериосклероз и артериосклероз с развитием нефросклероза).
Можно выделить три варианта поражения почек при подагре:
 При остром артрите специфических изменений не рентгенограммах не выявляется.
1. Крупные штампованные дефекты эпифизов костей, окружённые склеротической каймой, симптом «пробойника».
2. Кистовидные (крупной или овальной формы) дефекты, которые могут разрушать кортикальный слой кости, симптом «вздутия костного края». Наличие этих патологических явлений связывают с образованием костных тофусов.
3. Иногда обнаруживают костные эрозии – интраартикулярные и периартикулярные, центральные и краевой локализации.
4. В редких случаях наблюдается крупные эрозии костей с остеолизом эпифиза и диафиза, возможно замещение их уратными массами.
При остром артрите специфических изменений не рентгенограммах не выявляется.
1. Крупные штампованные дефекты эпифизов костей, окружённые склеротической каймой, симптом «пробойника».
2. Кистовидные (крупной или овальной формы) дефекты, которые могут разрушать кортикальный слой кости, симптом «вздутия костного края». Наличие этих патологических явлений связывают с образованием костных тофусов.
3. Иногда обнаруживают костные эрозии – интраартикулярные и периартикулярные, центральные и краевой локализации.
4. В редких случаях наблюдается крупные эрозии костей с остеолизом эпифиза и диафиза, возможно замещение их уратными массами.
 Все выше указанные изменения находят чаще всего в первом плюснефаланговом суставе и фалангах пальцев, однако их можно встретить и в любых суставах.
Однако указанная рентгенологическая картина подагры встречается в настоящее время редко – при большой длительности заболевания, а также при тяжёлых формах болезни у лиц молодого возраста.
В большинстве же случаев при достоверной подагре рентгенологическая картина соответствует явлениям остеоартроза или не обнаруживает каких-либо изменений.
5. Утолщение и расширение тени мягких тканей при подагре обусловлены отложением в них уратов и образованием подагрических узелков.
Все выше указанные изменения находят чаще всего в первом плюснефаланговом суставе и фалангах пальцев, однако их можно встретить и в любых суставах.
Однако указанная рентгенологическая картина подагры встречается в настоящее время редко – при большой длительности заболевания, а также при тяжёлых формах болезни у лиц молодого возраста.
В большинстве же случаев при достоверной подагре рентгенологическая картина соответствует явлениям остеоартроза или не обнаруживает каких-либо изменений.
5. Утолщение и расширение тени мягких тканей при подагре обусловлены отложением в них уратов и образованием подагрических узелков.
 На основании этих изменений выделяют три рентгенологические стадии хронического подагрического артрита (Кавеноки—Минц Э., 1987):
I стадия. Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
II стадия. Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
III стадия. Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лабораторные данные
1. При повышении активности: в-липопротеинемия, ↑ СОЭ, лейкоцитоз, ↑ a2-глобулинов, ↑ фибриногена, ДФА-пробы, серомукоидов.
2. Гиперурикемия.
Для подагры характерна гиперурикемия свыше 6-7 мг%, особенно на фоне диеты с ограничением пуринов в течение 3-5 дней.
Однако, необходимо отметить, что в 10% случаев при подагре содержание мочевой кислоты не превышает физиологических величин, поэтому этот показатель не считают специфичным для острого подагрического артрита.
3. В синовиальной жидкости находят уратные кристаллы.
Причём, наибольшее диагностическое значение имеют игольчатые кристаллы, расположенные внутриклеточно и двоякопреломляющие свет при исследовании в поляризационном микроскопе.
На основании этих изменений выделяют три рентгенологические стадии хронического подагрического артрита (Кавеноки—Минц Э., 1987):
I стадия. Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
II стадия. Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
III стадия. Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лабораторные данные
1. При повышении активности: в-липопротеинемия, ↑ СОЭ, лейкоцитоз, ↑ a2-глобулинов, ↑ фибриногена, ДФА-пробы, серомукоидов.
2. Гиперурикемия.
Для подагры характерна гиперурикемия свыше 6-7 мг%, особенно на фоне диеты с ограничением пуринов в течение 3-5 дней.
Однако, необходимо отметить, что в 10% случаев при подагре содержание мочевой кислоты не превышает физиологических величин, поэтому этот показатель не считают специфичным для острого подагрического артрита.
3. В синовиальной жидкости находят уратные кристаллы.
Причём, наибольшее диагностическое значение имеют игольчатые кристаллы, расположенные внутриклеточно и двоякопреломляющие свет при исследовании в поляризационном микроскопе.
 Кристаллы обычно наблюдаются в нейтрофилах в период острого подагрического артрита. Цитоз 10000-60000 клеток на мм3 (преимущественно нейтрофилы).
4. Аспирация содержимого тофусов позволяет обнаружить кристаллы мочевой кислоты.
5. В моче – кристаллы уратов.
Диагноз
Диагноз подагры основывается на клинических, лабораторных и рентгеновском методах исследования.
Клинико-лабораторные критерии.
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры.
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости суставов или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1.- 2 нед.
Диагноз подагры считается достоверным при наличии, по крайней мере, двух из четырех приведенных критериев.
Критерии SL.Wallace и соавт. (1997 г.), рекомендованные ВОЗ в 2000 г
В последнее время данные критерии все большее распространение приобретают для широкой клинической практики в связи с решением ООН и ВОЗ о проведении международной декады костей и суставов (2000-2010), основная цель которой – раннее распознавание, лечение и предупреждение наиболее распространенных костно-суставных болезней.
Классификационные критерии диагноза подагры
(Wallace и соавт., 1997г.)
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
Кристаллы обычно наблюдаются в нейтрофилах в период острого подагрического артрита. Цитоз 10000-60000 клеток на мм3 (преимущественно нейтрофилы).
4. Аспирация содержимого тофусов позволяет обнаружить кристаллы мочевой кислоты.
5. В моче – кристаллы уратов.
Диагноз
Диагноз подагры основывается на клинических, лабораторных и рентгеновском методах исследования.
Клинико-лабораторные критерии.
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры.
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости суставов или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1.- 2 нед.
Диагноз подагры считается достоверным при наличии, по крайней мере, двух из четырех приведенных критериев.
Критерии SL.Wallace и соавт. (1997 г.), рекомендованные ВОЗ в 2000 г
В последнее время данные критерии все большее распространение приобретают для широкой клинической практики в связи с решением ООН и ВОЗ о проведении международной декады костей и суставов (2000-2010), основная цель которой – раннее распознавание, лечение и предупреждение наиболее распространенных костно-суставных болезней.
Классификационные критерии диагноза подагры
(Wallace и соавт., 1997г.)
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
 Бессимптомная гиперурикемия.
Многие годы страх перед мнениями заставлял врачей назначать гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с некачественными новообразованиями при назначении цитостатиков.
Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры. Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих больных мочекаменной болезнью имеется гиперурикемия, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие, как артериальная гипертония, гиперхолестеринемия, сахарный диабет и ожирение.
Выводы:
1. Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения.
2. У пациентов с длительно повышенным (до 10 мг%) уровнем мочевой кислоты в крови риск развития острого приступа подагры увеличен на 90%, однако многие врачи назначают лечение до развития подагрической атаки.
3. Необходима только коррекция предрасполагающих факторов. На этой стадий подагры, как и на всех других стадиях, необходимо контролировать вторичную гиперурикемию.
4. На этой стадии (особенно) правильное питание – основа лечения.
Диета
Диета при подагре преследует целью ограничить поступление пуринов в организм с пищей, что позволяет уменьшить дозы лекарственных препаратов. Предпочтительна преимущественно молочно-растительная диета (стол № 6 по Певзнеру).
1. Потребность организма в калориях должна удовлетворяться в основном за счет углеводов, однако, общую калорийность пищи у тучных больных следует ограничить.
2. Из рациона исключают богатые пуринами продукты (печень, почки, мозги, легкие, крепкие мясные бульоны, жареное мясо). Ограничивают употребление бобовых, шпината, салата, щавеля, баклажанов, редиса, цветной капусты, отварного мяса, рыбы, шоколада, кофе, какао.
3. Ограничивают употребление жира (не должно превышать 1 г/кг). Мясо или рыбу употребляют не больше 1 раза в день, в более тяжёлых случаях – 2 -3 дня в неделю.
В небольших количествах в рационе могут присутствовать яйца, мучные и крупяные блюда, нежирные сорта рыбы, говядина, баранина. Рыбу и мясные блюда следует употреблять в отварном виде. В минимальном количестве пуриновые основания и мочевая кислота содержатся в молоке и молочных продуктах, хлебе, картофеле, моркови, капусте, орехах, яблоках, грушах, сливах, вишнях, арбузах, дынях, огурцах, луке, апельсинах, абрикосах, персиках, лимонах и винограде. Пища должна содержать необходимое количество витаминов, особенно аскорбиновой кислоты, рутина, рибофлавина. Поэтому полезны отвары шиповника, лимоны, яблоки, черная смородина.
4. Количество белков уменьшают до 0,5-1г/кг, поваренную соль ограничивают до 2-4 г в день.
5. Показано обильное питьё 1,5-2 литра жидкости в день с включением щелочных минеральных вод или ощелачивающих средств. В отдельных случаях количество жидкости желательно увеличить до 2-3 литров в день (рецидивирующая почечная колика, острый подагрический артрит).
6. Категорически запрещаются алкогольные напитки, поскольку алкоголь увеличивает образование мочевой кислоты в организме и блокирует её экскрецию почками.
Однако хочется ещё раз подчеркнуть, что соблюдение диеты для снижения уровня урикемии бывает достаточно лишь в начальных фазах болезни.
Острый подагрический артрит.
Наиболее эффективно лечение острого подагрического артрита в самом раннем периоде.
1. Начало — с принятия общих мер, направленных на смягчение проявлений суставного синдрома: полный покой, возвышенное положение конечности, местно — холод. Обильное питье (2-2,5 л жидкости в день) — щелочные растворы, разведенный лимонный сок, молоко, кефир, кисели, компоты. Рекомендуются овощные супы, жидкие каши.
2. Ограничить все субпродукты (печень, почки, мозги, язык), все сорта мяса, особенно молодых животных, рыбы и птицы, копчености, консервы, мясные и рыбные бульоны; растительные белки (бобовые, грибы), редис, цветная капуста, шоколад. Стоит также ограничить употребление чая, кофе, какао, всех алкогольных напитков, особенно шампанского. Назначают обычный приём щелочных вод, диету с ограничением пуринов. Следует предостеречь больных от полного голодания из-за опасности увеличения урикемии вторичного характера (усиленный распад белков при голодании).
3. Как и во всех других случаях артритов, важно обеспечить покой и иммобилизацию больного сустава.
Существует два классических медикаментозных подхода к купированию приступа подагры:
I. Назначение колхицина
II. Назначение нестероидных противовоспалительных препаратов (НПВП).
В настоящее время признано, что в целом эффективность этих двух методов одинакова. Различия заключаются только в скорости наступления эффекта и переносимости. Колхицин начинает действовать быстрее: между 12 и 48 ч (НПВП – между 24 и 48 ч), но несомненно чаще вызывает побочные явления.
Колхицин
Колхицин является мощным ингибитором фосфатазы, тормозит процессы деления клеток. Показано, что при контакте нейтрофилов с уратными кристаллами происходит фосфорилирование остатков тирозина в белках этих клеток. Колхицин, традиционно применяемый для лечения подагры, препятствует активации нейтрофилов, угнетая фосфорилирование тирозина.
1. Назначение колхицина в первые часы подагрического криза позволяет купировать последний либо значительно ослабить его.
2. Препарат обладает способностью блокировать фагоцитоз и деление клеток, что препятствует высвобождению медиаторов воспаления из нейтрофилов и синовиоцитов.
3. Его назначают в/в, но из-за токсичности препарата следует соблюдать осторожность при лечении пожилых людей и больных с заболеваниями почек и печени. Поэтому его назначают при неэффективности НПВП или при наличии противопоказаний для их назначения.
Разовую дозу (1 – 2 мг) разводят в 20 мл физиологического раствора (в/в – в течение 20-30 мин). Через 6 – 12 ч можно ввести еще 1 мг. Абсолютные противопоказания к в/в введению колхицина — это угнетение кроветворения, нарушение функции почек (СКФ менее 10 мл/мин, олигурия или анурия), болезни печени (биохимические показатели функции печени в 2 раза превышают верхнюю границу нормы) и сепсис.
Колхицин можно назначать и перорально по 0,6 – 1,2 мг каждый час или каждые 2 часа в 1-е сутки до исчезновения симптомов или появления побочных эффектов со стороны ЖКТ. В отсутствие эффекта препарат отменяют через 10 ч (в этом случае диагноз подагры ставится под сомнение)
или более безопасная схема:
первый день — Колхицин внутрь по 1 мг 3 р/сут после еды
второй день — Колхицин внутрь по 1 мг утром и вечером
затем — Колхицин внутрь по 1 г/сут
Нередко уже к концу первого дня наступает терапевтический эффект, после чего дозу препарата уменьшают до 1-0,5 мг в сутки.
4. Длительность лечения может быть непродолжительной – 2 – 4 суток.
5.При пероральном назначении колхицина возможны также побочные явления:
Бессимптомная гиперурикемия.
Многие годы страх перед мнениями заставлял врачей назначать гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с некачественными новообразованиями при назначении цитостатиков.
Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры. Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих больных мочекаменной болезнью имеется гиперурикемия, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие, как артериальная гипертония, гиперхолестеринемия, сахарный диабет и ожирение.
Выводы:
1. Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения.
2. У пациентов с длительно повышенным (до 10 мг%) уровнем мочевой кислоты в крови риск развития острого приступа подагры увеличен на 90%, однако многие врачи назначают лечение до развития подагрической атаки.
3. Необходима только коррекция предрасполагающих факторов. На этой стадий подагры, как и на всех других стадиях, необходимо контролировать вторичную гиперурикемию.
4. На этой стадии (особенно) правильное питание – основа лечения.
Диета
Диета при подагре преследует целью ограничить поступление пуринов в организм с пищей, что позволяет уменьшить дозы лекарственных препаратов. Предпочтительна преимущественно молочно-растительная диета (стол № 6 по Певзнеру).
1. Потребность организма в калориях должна удовлетворяться в основном за счет углеводов, однако, общую калорийность пищи у тучных больных следует ограничить.
2. Из рациона исключают богатые пуринами продукты (печень, почки, мозги, легкие, крепкие мясные бульоны, жареное мясо). Ограничивают употребление бобовых, шпината, салата, щавеля, баклажанов, редиса, цветной капусты, отварного мяса, рыбы, шоколада, кофе, какао.
3. Ограничивают употребление жира (не должно превышать 1 г/кг). Мясо или рыбу употребляют не больше 1 раза в день, в более тяжёлых случаях – 2 -3 дня в неделю.
В небольших количествах в рационе могут присутствовать яйца, мучные и крупяные блюда, нежирные сорта рыбы, говядина, баранина. Рыбу и мясные блюда следует употреблять в отварном виде. В минимальном количестве пуриновые основания и мочевая кислота содержатся в молоке и молочных продуктах, хлебе, картофеле, моркови, капусте, орехах, яблоках, грушах, сливах, вишнях, арбузах, дынях, огурцах, луке, апельсинах, абрикосах, персиках, лимонах и винограде. Пища должна содержать необходимое количество витаминов, особенно аскорбиновой кислоты, рутина, рибофлавина. Поэтому полезны отвары шиповника, лимоны, яблоки, черная смородина.
4. Количество белков уменьшают до 0,5-1г/кг, поваренную соль ограничивают до 2-4 г в день.
5. Показано обильное питьё 1,5-2 литра жидкости в день с включением щелочных минеральных вод или ощелачивающих средств. В отдельных случаях количество жидкости желательно увеличить до 2-3 литров в день (рецидивирующая почечная колика, острый подагрический артрит).
6. Категорически запрещаются алкогольные напитки, поскольку алкоголь увеличивает образование мочевой кислоты в организме и блокирует её экскрецию почками.
Однако хочется ещё раз подчеркнуть, что соблюдение диеты для снижения уровня урикемии бывает достаточно лишь в начальных фазах болезни.
Острый подагрический артрит.
Наиболее эффективно лечение острого подагрического артрита в самом раннем периоде.
1. Начало — с принятия общих мер, направленных на смягчение проявлений суставного синдрома: полный покой, возвышенное положение конечности, местно — холод. Обильное питье (2-2,5 л жидкости в день) — щелочные растворы, разведенный лимонный сок, молоко, кефир, кисели, компоты. Рекомендуются овощные супы, жидкие каши.
2. Ограничить все субпродукты (печень, почки, мозги, язык), все сорта мяса, особенно молодых животных, рыбы и птицы, копчености, консервы, мясные и рыбные бульоны; растительные белки (бобовые, грибы), редис, цветная капуста, шоколад. Стоит также ограничить употребление чая, кофе, какао, всех алкогольных напитков, особенно шампанского. Назначают обычный приём щелочных вод, диету с ограничением пуринов. Следует предостеречь больных от полного голодания из-за опасности увеличения урикемии вторичного характера (усиленный распад белков при голодании).
3. Как и во всех других случаях артритов, важно обеспечить покой и иммобилизацию больного сустава.
Существует два классических медикаментозных подхода к купированию приступа подагры:
I. Назначение колхицина
II. Назначение нестероидных противовоспалительных препаратов (НПВП).
В настоящее время признано, что в целом эффективность этих двух методов одинакова. Различия заключаются только в скорости наступления эффекта и переносимости. Колхицин начинает действовать быстрее: между 12 и 48 ч (НПВП – между 24 и 48 ч), но несомненно чаще вызывает побочные явления.
Колхицин
Колхицин является мощным ингибитором фосфатазы, тормозит процессы деления клеток. Показано, что при контакте нейтрофилов с уратными кристаллами происходит фосфорилирование остатков тирозина в белках этих клеток. Колхицин, традиционно применяемый для лечения подагры, препятствует активации нейтрофилов, угнетая фосфорилирование тирозина.
1. Назначение колхицина в первые часы подагрического криза позволяет купировать последний либо значительно ослабить его.
2. Препарат обладает способностью блокировать фагоцитоз и деление клеток, что препятствует высвобождению медиаторов воспаления из нейтрофилов и синовиоцитов.
3. Его назначают в/в, но из-за токсичности препарата следует соблюдать осторожность при лечении пожилых людей и больных с заболеваниями почек и печени. Поэтому его назначают при неэффективности НПВП или при наличии противопоказаний для их назначения.
Разовую дозу (1 – 2 мг) разводят в 20 мл физиологического раствора (в/в – в течение 20-30 мин). Через 6 – 12 ч можно ввести еще 1 мг. Абсолютные противопоказания к в/в введению колхицина — это угнетение кроветворения, нарушение функции почек (СКФ менее 10 мл/мин, олигурия или анурия), болезни печени (биохимические показатели функции печени в 2 раза превышают верхнюю границу нормы) и сепсис.
Колхицин можно назначать и перорально по 0,6 – 1,2 мг каждый час или каждые 2 часа в 1-е сутки до исчезновения симптомов или появления побочных эффектов со стороны ЖКТ. В отсутствие эффекта препарат отменяют через 10 ч (в этом случае диагноз подагры ставится под сомнение)
или более безопасная схема:
первый день — Колхицин внутрь по 1 мг 3 р/сут после еды
второй день — Колхицин внутрь по 1 мг утром и вечером
затем — Колхицин внутрь по 1 г/сут
Нередко уже к концу первого дня наступает терапевтический эффект, после чего дозу препарата уменьшают до 1-0,5 мг в сутки.
4. Длительность лечения может быть непродолжительной – 2 – 4 суток.
5.При пероральном назначении колхицина возможны также побочные явления:


