2019 Обновление Объединенной европейской лиги против ревматизма и Европейской ассоциации почек-Европейской ассоциации диализа и трансплантации (EULAR/ERA-EDTA) рекомендаций по ведению волчаночного нефрита
Annals of the Rheumatic Diseases March 2020. http://dx.doi.org/10.1136/annrheumdis-2020-216924
Дата публикации март 2020
Резюме.
Цель Обновление рекомендаций EULAR/ERA-EDTA 2012 года по ведению волчаночного нефрита lupus nephritis (LN).
Методы Следуя стандартизированным протоколам EULAR, были проведены систематические обзоры литературы. Члены многопрофильной Целевой группы проголосовали независимо на уровне согласия с подписанием заявлений.
Результаты Изменения включают рекомендации для целей лечения, использование глюкокортикоидов и ингибиторов кальциневрина calcineurin inhibitors (CNIs) и ведения конечной стадии заболевания почек end-stage kidney disease (ESKD). Целью терапии является полный ответ (протеинурия <0,5-0,7 г/24 часов g/24 hours с (около) нормальной гломерулярной скоростью фильтрации) за 12 месяцев, но это может быть продлено у пациентов с базовым нефротическим диапазоном протеинурии. Гидроксихлорохин рекомендуется с регулярным офтальмологическим мониторингом. При активном пролиферативном LN, начальном (индукционном) лечении микофенолатом мофетилом (ММФ 2-3 г/день или микофенолильной кислотой (MPA) в эквивалентной дозе) или низкой дозой внутривенного циклофосфамида (CY; 500 мг х 6 раз каждые две недели 500 mg × 6 biweekly doses ), как в сочетании с глюкокортикоидов (пульсы внутривенного метилпреднизолона, затем орально преднизон 0,3-0,5 мг/кг /день) рекомендуется. ММФ/CNI (особенно такролимус) комбинация и высокие дозы CY являются альтернативами, для пациентов с нефротическим уровнем протеинурии и неблагоприятными прогностическими факторами. Последующее длительное поддерживающее лечение ММФ или азатиоприном следует назначать, без или с низкими доз (<7,5 мг/день) глюкокортикоидов. Выбор препарата зависит от первоначального режима и планов беременности. При отсутствии ответа на терапию non-responding заболевания рекомендуется переключать индукционные режимы или ритуксимаб. В чистом мембранозном LN с нефротическим обусловленной протеинурии или протеинурии >1 г/24 часов, несмотря на ренин-ангиотензин-альдостерон ингибиторы, MMF в сочетании с глюкокортикоидов является предпочтительным. Оценка активности заболеваний почек и активности заболевания вне почек extra-renal disease activity, а также управление сопутствующими заболеваниями на протяжении всей жизни с повторной биопсией почек в случаях неполного ответа на терапию или nephritic flares почечных атаках. В ESKD трансплантация является предпочтительным вариантом замены почек с иммуносупрессией, руководствуясь протоколами трансплантации и/или экстра-почечными проявлениями. Лечение LN у детей следует тем же принципам, что и болезнь взрослых.
Выводы Мы обновили рекомендации EULAR по управлению LN для облегчения унификации терапии пациентов.
Введение
До 40% пациентов с системной красной волчанкой (СКВ) развиваются заболевания почек, которая является основной причиной заболеваемости. В 2012 году Европейская лига против ревматизма-Европейская ассоциация почечной и трансплантационной ассоциации (EULAR/ERA-EDTA) разработала совместные рекомендации по нефриту волчанки (LN), с участием группы ревматологов, нефрологов, почечных патологоанатомов и педиатров. С тех пор появились новые данные, которые включают в себя использование ингибиторов кальциневрина (CNIs) и “многоцелевой”‘multitarget’ терапии, мониторинга заболеваний и цели лечения. Поэтому мы стремились обновить рекомендации по управлению ЛН.
Методы
После одобрения Исполнительными комитетами EULAR и ERA/EDTA, созывы (DTB, DJ) пригласили многопрофильную группу из 11 ревматологов, 11 нефрологов, 1 нефропатолога, 1 детского ревматолога, 1 педиатрического нефролога, 1 смежных медицинских работников и 2 представителя от пациентов. Соблюдались стандартизированные процедуры для исследований EULAR, и использовался инструмент оценки руководящих принципов исследований.
Результаты
Всеобъемлющие принципы и конкретные рекомендации, содержащиеся в соответствующих LoE, GoR и LoA, перечислены в таблице 2.
Таблица 2
Всеобъемлющие принципы и рекомендации по ведению пациентов с LN
|
Всеобъемлющие принципы |
||
|
Вовлечение почек в СКВ, основной причина заболеваемости и смертности, что приводит к высоким медицинским и социальным издержкам, лучше всего контролируется при междисциплинарном подходе при общих решениях пациента и врача. |
||
|
Настороженность по симптомам и признакам, указывающих на вовлечение почек, гистологическая оценка нефропатологов и вклад специализированных центров обеспечивают оптимальные результаты. |
||
|
Цели лечения включают выживание пациентов, долгосрочное сохранение функции почек, профилактику вспышек болезней, профилактику повреждения органов, лечение сопутствующих заболеваний и улучшение качества жизни, связанного с болезнями. |
||
|
Управление активными фазами LN включает в себя начальный период интенсивной иммуносупрессивной терапии для контроля активности заболеваний, а затем более длительный период обычно менее интенсивной терапии для консолидации ответа и предотвращения рецидивов. |
||
|
Рекомендация/заявление |
LoE/GoR |
LoA, среднее (SD) |
|
1. Обследование пациента с подозрением на LN |
||
|
1.1 Биопсия почек должна быть рассмотрена при наличии доказательств поражения почек, особенно при наличии стойких протеинурий 0,5 г/24 часа (или UPCR ≥500 mg/g утренней первой порции мочи), |
2b/B |
9.84 (0.54) |
|
и/или необъяснимое снижение СКФ. |
2б/С |
|
|
1.2 Биопсия почек остается незаменимой, и ее диагностическое и прогностическое значение не может быть заменено другими клиническими или лабораторными методами. |
2b/B |
9.96 (0.20) |
|
2. Патологическая оценка биопсии почек
|
||
|
2.1 Рекомендуется использовать систему классификации Международного общества нефрологии/почечной патологии ISN/RPS 2003, |
2a/B |
9.56 (0.94) |
|
с дополнительной оценкой показателей активности и индекса хронизации, |
1b/A |
|
|
а также тромботических и сосудистых поражений, связанных с AФС/синдромом. |
2б/С |
|
|
3. Показания для иммуносупрессивного лечения |
||
|
3.1 Иммуносупрессивные средства, вводимые в сочетании с глюкокортикоидами, рекомендуются в классе IIIA или IIIA/C (±V) и IVA или IVA/C(±V) нефрита. |
1a/A |
9.96 (0.20) |
|
3.2 В чистом классе V нефрит, глюкокортикоиды и иммуносупрессия рекомендуются в случаях нефротического уровня протеинурии, |
2b/B |
9.04 (1.80) |
|
или когда UPCR превышает 1000 мг/г, несмотря на оптимальное использование блокаторов системы ренин-ангиотензин-альдостерон |
5/D |
|
|
4. Лечение LN у взрослых |
||
|
Цели лечения |
||
|
4.1 Лечение направлено на оптимизацию (сохранение или улучшение) функции почек, сопровождающееся сокращением протеинурии не менее чем на 25% на 3 месяца, |
2b/D |
|
|
50% к 6 месяцам, |
2a/B |
9.60 (0.63) |
|
и целевой показатель UPCR ниже 500–700 мг/г на 12 месяцев (полный клинический ответ). |
2a/B |
|
|
4.2 Пациентам с нефротическим и протеинурией на базисной? baseline терапии может потребоваться дополнительно 6-12 месяцев, чтобы достичь полной клинической реакции; в таких случаях, быстрые переключатели терапии не являются необходимыми, если протеинурия улучшается. |
2a/C |
9.68 (0.68) |
|
Начальное Initial лечение |
||
|
4.3 Для пациентов с III или IV классом (±V) LN, MMF (целевая доза: от 2 до 3 г/день, или MPA в эквивалентной дозе) |
1a/A |
9.84 (0.37) |
|
или низкие дозы внутривенного CY (500 мг каждые 2 недели в общей сложности 6 доз) |
1a/A |
|
|
в сочетании с глюкокортикоидами, рекомендуется, поскольку они имеют наилучшую эффективность / токсичность соотношение. |
||
|
4.4 Комбинация ММФ (целевая доза: от 1 до 2 г/день, или MPA в эквивалентной дозе) с CNI (особенно TAC) является альтернативой, особенно у пациентов с нефротическим уровнем протеинурии. |
1а/Б |
9.32 (0.93) |
|
4.5 Пациенты с высоким риском почечной недостаточности (снижение СКФ, гистологическое присутствие полумесяцев или фибриноидный некроз или тяжелое интерстициальное воспаление) можно лечить как в 4.3-4.4, |
2b/B |
8.88 (1.56) |
|
но также можно рассматривать высокодозную в/венно CY (0,5-0,75 г/м2 ежемесячно в течение 6 месяцев). |
1а/Б |
|
|
4.6 Для уменьшения кумулятивной дозы глюкокортикоидов рекомендуется применение внутривенных пульсов метилпреднизолона (общая доза 500-2500 мг, в зависимости от тяжести заболевания), за которым следует пероральный преднизон (0,3-0,5 мг/кг/день) в течение 4 недель, снижающийся до 7,5 мг/день на 3-6 месяцев. |
2б/С |
9.48 (0.90) |
|
4.7 В изолированном? отдельном pure классе V нефрит, ММФ (целевая доза от 2 до 3 г/день; или MPA в эквивалентной дозе), |
2a/B |
|
|
в сочетании с импульсом внутривенного метилпреднизолона (общая доза 500-2500 мг, в зависимости от тяжести заболевания), а затем оральный преднизон (20 мг/день, снижается tapered до 5 мг/день на 3 месяца) |
2б/С |
9.28 (0.96) |
|
рекомендуется в качестве первоначального лечения в связи с наилучшим соотношением эффективности/токсичности. |
||
|
4.8 Альтернативные(дополнительные) варианты нефрита для класса V включают внутривенные CY, |
2b/B |
9.28 (0.92) |
|
или CNIs (особенно TAC) в монотерапии |
2b/B |
|
|
или в сочетании с MMF/MPA, особенно у пациентов с нефротическим уровнем протеинурии. |
1b/B |
|
|
4.9 HCQ следует назначить, |
2a/B |
9.28 (1.40) |
|
в дозе, не превышающей 5 мг/кг/день и с поправкой на СКФ. |
3b/C |
|
|
Последующее лечение |
||
|
4.10 Если улучшение после первоначального лечения достигается, последующее иммуносупрессия рекомендуется либо с ММФ / MPA (доза: от 1 до 2 г/день) – особенно, если он был использован в качестве первоначального лечения- |
1a/A |
9.80 (0.49) |
|
или АЗА (2 мг/кг/день) – предпочтительнее, если беременность предусмотрена – в сочетании с низкодозированным преднизоном (2,5-5 мг/день) при необходимости контроля за активностью заболевания. |
1a/A |
|
|
4.11 Постепенный отказ от лечения (сначала глюкокортикоиды, затем иммуносупрессивные препараты) можно попытаться по крайней мере 3-5 лет терапии в полной клинической реакции. HCQ следует продолжать в долгосрочной перспективе. |
2б/С |
9.40 (0.75) |
|
4.12 Продолжение, переключение или добавление CNIs (особенно TAC) можно рассматривать в изолированном классе V нефрита при самой низкой эффективной дозе и после рассмотрения рисков нефротоксичности. |
2b/B |
9.28 (1.15) |
|
Неотвечающие Non-responding/рефрактерные заболевания
|
||
|
4.13 В случае невыполнения целей лечения рекомендуется тщательная оценка возможных причин, включая оценку соблюдения лечения и терапевтического мониторинга лекарственных препаратов. |
5/D |
9.84 (0.46) |
|
4.14 При активном неотвечающем/рефрактерном заболевании лечение может быть переключено на одну из альтернативных первоначальных методов лечения, упомянутых выше, |
2b/B-C |
9.64 (0.62) |
|
или RTX (1000 мг в дни 0 и 14) может быть применен. |
2б/С |
|
|
5. Адъюнкт Adjunct(дополнительное) -лечение |
||
|
5.1 Ангиотензин-преобразующих ингибиторы фермента или блокаторы рецепторов ангиотензина рекомендуются для всех пациентов с UPCR >500 мг/г или артериальной гипертензией. |
5/D |
9.84 (0.37) |
|
5.2 Статины рекомендуются на основе уровня липидов и предполагаемого 10-летнего риска сердечно-сосудистых заболеваний с использованием Systematic Coronary Risk Evaluation риска или других проверенных инструментов. |
5/D |
9.52 (0.75) |
|
5.3 Защита костей (добавки кальция/витамина D и/или антирезорбтивные средства) и иммунизация неживыми вакцинами могут привести к снижению связанных с лечением и связанных с болезнями сопутствующих заболеваний и рекомендуются. |
5/D |
9.68 (0.61) |
|
5.4 Если aPL (определяется как в международном консенсусном заявлении для определенных критериев классификации антифосфолипидного синдрома) являются положительными, и на основе профиля aPL, ацетилсалициловая кислота (80-100 мг/день) может быть использована после взвешивания преимуществ и риска кровотечения. |
2a/C |
9.28 (1.25) |
|
5.5 Антикоагулянт лечение следует рассматривать в случаях нефротического синдрома с сывороточным альбумином <20 г/л. |
5/D |
9.76 (0.43) |
|
5.6 Белимумаб может рассматриваться как дополнительное лечение, чтобы содействовать щадящему применению глюкокортикоидов, контролировать активность внепочечной волчанки и уменьшить риск внепочечных кризов. |
2a/C |
8.48 (1.92) |
|
6. Мониторинг и прогноз LN |
||
|
6.1 Посещения должны быть запланированы каждые 2-4 недели в течение первых 2-4 месяцев после постановки диагноза или обострения, а затем, в соответствии с ответом на лечение. Мониторинг активности почек, внепочечных заболеваний и сопутствующих заболеваний является пожизненным. |
5/D |
9.40 (0.69) |
|
6.2 При каждом посещении, вес тела, кровяное давление (в том числе вне офиса(домашнее) измерение), по оценкам GFR, сыворотки альбумина, протеинурия (UPCR или 24 часа сбора мочи), эритроциты мочи или осадок и полный подсчет клеток крови должны быть оценены, когда нефрит активен и реже, если стабильный. |
2b/B |
9.64 (0.69) |
|
Уровни сыворотки C3/C4 и анти-Двуспиральной ДНК периодически контролируются. |
2б/С |
|
|
6.3 Повторная биопсия почек должна рассматриваться в отдельных случаях, таких как ухудшение параметры функции почек, нечувствительность к иммуносупрессивному или биологическому лечению (как определено выше); или при рецидиве, чтобы продемонстрировать возможный гистологический переход класса или изменение показателей хроники и активности; предоставление прогностической информации; и выявлять другие патологии. |
2b/B |
9.84 (0.37) |
|
7. Ведение ESKD при LN |
||
|
7.1 Все методы заместительного лечения почек могут быть использованы у пациентов с СКВ. |
2b/B |
9.96 (0.20) |
|
7.2 Иммуносупрессия в ESKD на диализе должна основываться на внепочечных проявлениях. |
2б/С |
9.76 (0.59) |
|
7.3 Трансплантация может быть предпочтительнее по сравнению с другими вариантами замены почек и должна рассматриваться, когда внепочечная волчанка клинически (и в идеале, серологически) неактивна в течение по крайней мере 6 месяцев; лучше с живым донором и упреждающей (превентивной) pre-emptive трансплантации. |
2б/С |
9.84 (0.37) |
|
7.4 APL следует определять во время подготовки к трансплантации, так как они связаны с повышенным риском сосудистых событий в пересаженной почки. |
2б/С |
9.48 (1.10) |
|
8. Антифосфолипидный синдром и LN |
||
|
8.1 У пациентов с антифосфолипидным синдромом, связанным с нефропатией, антитромбоцитарно/антикоагулянтное лечение может быть рассмотрено, в дополнение к HCQ. |
2б/С |
9.68 (0.55) |
|
9. LN и беременность |
||
|
9.1 Беременность может быть запланирована у стабильных пациентов с неактивным LN. |
1b/A |
9.56 (0.80) |
|
Оптимально, UPCR должно быть ниже 500 мг/г в течение предыдущих 6 месяцев, с GFR >50 мл/ мин. |
2б/С |
|
|
9.2 Сочетание лекарства, таких как HCQ, |
1b/B |
9.76 (0.51) |
|
преднизон, АЗА и/или CNIs (особенно TAC) |
3b/C для всех |
|
|
должны быть продолжены в безопасных дозах на протяжении всей беременности и лактации. |
||
|
9.3 MMF/MPA должны быть сняты по крайней мере 3-6 месяцев до зачатия планируется, чтобы гарантировать, что альтернативный иммуносупрессивный агент не приводит к рецидиву. |
5/D |
9.29 (0.93) |
|
9.4 Во время беременности рекомендуется ацетилсалициловая кислота для снижения риска преэклампсии. |
2б/С |
9.64 (0.62) |
|
9.5 Пациенты должны осматриваться по крайней мере каждые 4 недели, предпочтительно многопрофильной командой включая акушера эксперта в заболевании. |
5/D |
9.56 (0.80) |
|
9.6 Обострения LN во время беременности можно лечить с приемлемыми лекарствами, указанными выше, и пульсами внутривенного MPA, в зависимости от тяжести обострения. |
3b/C |
9.56 (1.39) |
|
10.Ведение педиатрических пациентов |
||
|
10.1 LN у детей чаще встречается в дебюте и более серьезен с нарастанием повреждения; диагноз, ведение и мониторинг аналогичны диагнозу взрослых. |
3b/C |
9.68 (0.68) |
|
10.2 Скоординированная программа перехода к взрослым специалистам имеет важное значение для обеспечения соблюдения терапии и оптимизации долгосрочных результатов. |
5/D |
9.84 (0.37) |
- LoE, GoR и final LoA показаны жирным шрифтом для каждой рекомендации.
- aPL, antiphospholipid antibodies, аФЛ, антифосфолипидные антитела; AZA, azathioprine, АЗА, азатиоприн; CNI, calcineurin inhibitor ингибитор кальциневрина; CY, cyclophosphamide циклофосфамид; ESKD, end-stage kidney disease; болезнь почек терминальная стадию; GFR, glomerular filtration rate гломерулярная скорость фильтрации; GOR, grading of recommendation оценка рекомендации; HCQ, hydroxychloroquine;, гидроксихлорохин; ISN/RPS, International Society of Nephrology/Renal Pathology Society Международное общество нефрологии/Общества патологии почек; LN, lupus nephritis волчаночный нефрит; LoA, level of agreement; уровень согласия; LoE, level of evidence уровень доказательств; MMF, mycophenolate mofetil миофенолат мофетил; MPA, mycophenolic acid микофенолиновая кислота; RTX, rituximab ритуксимаб; SLE СКВ, системная красная волчанка; TAC, tacrolimus такролимус; UPCR, urine protein–creatine ratio соотношение белка моча и креатинина.
Всеобъемлющие принципы
Несмотря на улучшенный прогноз на протяжении последних десятилетий, LN создает терапевтические проблемы и связи с увеличением заболеваемости, смертности и расходов на здравоохранение. Характер заболевания (вовлечение почек в контексте системного аутоиммунного заболевания) требует многопрофильного подхода ревматологов и нефрологов, после гистологического подтверждения и оценки LN нефропатологом. В этой связи рекомендуется проводить оценку или периодически проводить оценку этих пациентов в центрах, имеющих опыт работы. Принятие решений требует, чтобы пациент был надлежащим образом информирован о характере и естественном течении заболевания и терапевтических возможностях.
Рекомендации
Обследование пациента с подозрением на LN
Пациенты с СКВ с любыми признаками участия в почках (гломерулярная гематурия и/или клеточные слепки, протеинурия йgt;0.5 г/24 часа (или пятно мочеиспускания к креатину отношение (UPCR) Мягкие клинические презентации (например, субнефротическая протеинурия), тем не менее, могут быть связаны с активными гистологическими поражениями.9-11 В обзоре биопсии почек, проведенном в 1970-2016 годах, Более раннее использование биопсии на основе аномалий мочевыводящих путей, как это было сделано с 2001 по 2016 год, было связано с улучшением исходов, несмотря на аналогичные показатели тяжелой гистологии.12 Преимущества гистологической оценки должны быть сбалансированы против повышенного риска кровотечения у отдельных пациентов, таких как лица, получающие антикоагуляцию. Все пациенты с СКВ, особенно с подозрением на участие в почках, должны быть проверены на антифосфолипидные антитела (APL), так как почечные проявления антифосфолипидного синдрома, такие как тромбоtic микроангиопатия (ТМА), могут нести прогноститические последствия. Тестирование на анти-DsDNA и anti-C1q (когда это доступно) аутоантител следует рассматривать у пациентов с подозрением на LN, наряду с уровнями дополнения (C3 и C4).13
Оценка биопсии почек патологами
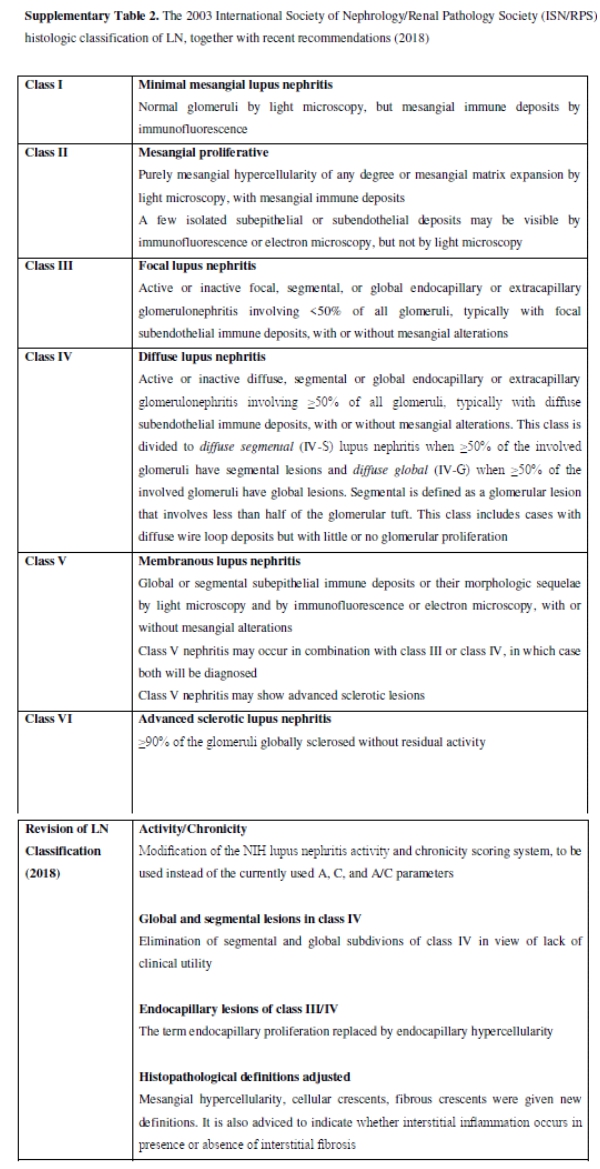
2003 Международное общество нефрологии / почечной патологии общества (ISN / RPS) классификации по-прежнему представляет собой золотой стандарт для оценки биопсии почек в LN (онлайн дополнительная таблица 2). TMA поражений, хотя и не патогномонические, должны вызвать подозрение антифосфолипидного синдрома нефропатии и, таким образом, быстрое aPL (повторно) тестирование. Хотя TMA было сообщено в до 25% биопсий LN, его прогностические последствия остаются неясными. Тубулоинтерстициальные поражений, таких как интерстициальный фиброз и трубной атрофии, связаны с плохим прогнозом. Пересмотр 2003 ISN / RPS классификации недавно было предложено и ждет одобрения.
Показания иммуносупрессивного лечения при LN
Иммуносупрессивное лечение рекомендуется в активном классе III или IV LN, с или без сосуществующей гистологической хроники. Для чистого класса V LN, рекомендация для иммуносупрессии относится к пациентам с нефротическим уровнем протеинурии, которая связана с худшим прогнозом, в дополнение к случаям с протеинурией >,1 г/24 часов, несмотря на оптимальное использование блокаторов системы ренин-ангиотензин-альдостерон в течение разумного периода времени (например, не менее 3 месяцев). Класс II LN обычно не нуждается в специфической иммуносупрессивной терапии, но может быть склонен к гистологической трансформации к более агрессивной болезни при повторной биопсии. Наличие значительной протеинурии должно подтолкнуть гистологическую переоценку для обнаружения пролиферативных изменений, которые, возможно, были упущены из виду.
Лечение LN у взрослых
Цели лечения
По сравнению с предыдущими рекомендациями, цели лечения были дополнительно определены в зависимости от времени с момента начала лечения. Пост hoc анализы от MAINTAIN и Euro-Lupus Nephritis Испытаний показывают, что протеинурия в течение 12 месяцев представляет собой лучший один предиктор для долгосрочного почечного исхода (т. е. риск для конечной стадии заболевания почек (ESKD) или удвоение сыворотки креатина после 10 лет). Терапия должна быть направлена на протеинурию <0,5-0,7 г/24 часов на 12 месяцев (полный клинический ответ) (complete clinical response), хотя до 50% пациентов, не достигнув этой вехой все еще могут иметь стабильную функцию почек. Свидетельство улучшения в протеинурии (с нормализацией GFR / стабилизация) должны быть отмечены через 3 месяца, и по крайней мере 50% частичное сокращение протеинурии к 6 месяцам (частичный клинический ответ (partial clinical response)). Для пациентов с нефротическим уровне протеинурии на исходном уровне, вышеупомянутые сроки могут быть продлены на 6-12 месяцев, из-за более медленного восстановления протеинурии. Таким образом, рассмотрение уменьшения протеинурии может избежать преждевременных изменений лечения. Поскольку СКВ является системным заболеванием, иммуносупрессивная терапия должна также ориентироваться на ремиссию или низкую активность заболевания во внепочечных областях.
Начальное лечение Initial treatment
В классе III-IV LN, обновленный Кокрановский систематический обзор предложил аналогичную эффективность миофенолат мофетил / микофенолатная кислота (MMF/MPA) по сравнению с циклофосфамид (CY), с возможными этническими / расовыми различиями, то есть, ММФ потенциально более эффективным в афро-американцев. 10-летний Евро-lupus Nephritis исследование данные показали равную эффективность низкой дозы CY по сравнению с высокой дозой CY, и низко -дозовый режим был использован у неевропейских населения. Следовательно, как ММФ / MPA и низких доз CY рекомендуется в качестве первой линии first-line для начального (индукционного) initial (induction) лечения. Рекомендуемая целевая доза ММФ теперь изменена до 2-3 г/день (MPA 1,44-2,16 г/день), на основе доказательств того, что терапевтическая доза препарата может варьироваться от 1 до 3 г/день. Доза может быть скорректирована в соответствии с толерантностью / неблагоприятными эффектами, эффективностью и уровнем MPA в крови. Высокие дозы внутривенного CY (0,5-0,75 г/м2 ежемесячно в течение 6 месяцев) можно рассматривать у пациентов с неблагоприятными клиническими (нефритические осадок мочи и нарушение функции почек с СКФ между 25 и 80 мл/мин) или гистологических (полумесяцы или некроз в гломерулах) прогностических факторов.
Развитие побочных эффектов долгосрочного лечения глюкокортикоидов, наряду с появляющимися доказательствами того, что после первоначального пульс внутривенного метилпреднизолона, более низкая начальная доза глюкокортикоидов (0,5 мг/кг/день) может быть столь же эффективной, как и более высокая доза, , что привело Целевую группу к рекомендации, что общая внутривенная доза метилпреднизолона может варьироваться от 500 до 2500 мг (позволяет гибкое дозирование в зависимости от тяжести заболевания), а начало орального преднизона может быть 0.3–0.5 mg/kg/day со снижением до 7,5 мг/день за 3-6 месяцев.
Основное внимание было уделено использованию ингибиторов кальциневрина (CNI, такролимус (TAC) и циклоспорин A (CsA)), либо в качестве монотерапии или в сочетании с MMF/MPA. Рандомизированное контролируемое испытание (RCT) в 362 китайских пациентов обнаружили, что сочетание TAC/MMF будет превосходить CY в краткосрочной перспективе. циклоспорин аналог, voclosporin в сочетании с MMF был связан с более высокой частотой полного ответа за 6 месяцев по сравнению с MMF в монотерапии, хотя больше побочных эффектов и смертей произошло в предыдущей группе. Ряд мета-анализов показывают, что CNI (изолированно или в рамках многоцелевого режима) может иметь благоприятный коэффициент эффективности / токсичности при LN, и, таким образом, в новой рекомендации (4.4) , сочетание MMF с CNI (особенно TAC) включен в качестве терапевтического варианта, особенно в случаях с нефротическим уровнем протеинурии. До тех пор, пока не будут получены дополнительные данные о неазиатских группах населения и исследования с более длительным наблюдением и о результатах почек, таких как профилактика недостаточности/отказ почек, CNI и режим “многоцелевой” не могут быть повсеместно рекомендованы в качестве лечения первой линии. Кроме того, нефротоксичность и другие побочные эффекты использования CNI следует учитывать при выборе режима на основе CNI.
В чистом классе V LN за последние 7 лет не появилось никаких высококачественных доказательств. MMF/MPA рекомендуется в качестве первого выбора в тех же дозах, что и в III/IV классе болезни. CY и CNI (особенно TAC), последние как монотерапия или в сочетании с MMF, являются альтернативными вариантами. Подобно для класса III/IV LN, ритуксимаб (RTX) зарезервирован для не-ответчиков в классе V LN (см. ниже), хотя последние RCT при идиопатической мембранозной нефропатии, которые продемонстрировали краткосрочное превосходство над CsA, может оправдать модификацию, как только аналогичные данные появятся при LN.
Гидроксихлорохин (HCQ) рекомендуется всем пациентам с LN при отсутствии противопоказаний. Использование HCQ связано со снижением риска возникновения обострения почек, ESKD и смерти. В свете новых данных о токсичности для глаз с более чувствительными методами скрининга, и в соответствии с пересмотренным заявлением Американской академии офтальмологии, суточная доза HCQ не должна превышать 5 мг/кг фактической массы тела и должна продолжаться бесконечно с регулярным офтальмологическим скринингом (после 5 лет на HCQ и ежегодно после этого, или ежегодно после дебюта в присутствии факторов риска). Корректировки доз (50% снижение) и ежегодный мониторинг глаз с самого начала рекомендуется для пациентов с СКФ <30 ml/min.
Последующее лечение Subsequent treatment
ММФ/МПА и азатиоприн (АЗА) остаются препаратами, которые можно выбрать для последующего иммуносупрессивного лечения, после адекватного реагирования на начальном этапе. Два режима не отличаются с точки зрения обострения почек в 10-летний наблюдении в MAINTAIN исследовании, в отличие от Aspreva lupus исследование (ALMS), которые показали превосходство MMF. На основе доказательств, показывающих увеличение рецидивов, когда MMF / MPA следует за АЗА, мы рекомендуем чтобы за индукцией MMF / MPA следовало поддерживающая терапия MMF / MPA. За индукцией CY может последовать либо ММФ/МПА, либо АЗА; последний агент является предпочтительным, если беременность предусмотрена или более высокая стоимость ММФ является проблемой. CNI может быть использован в классе V LN на самой низкой эффективной дозе, так как постоянное использование этих агентов может увеличить риск побочных эффектов почек.
Большинство почечных обострений происходит в течение первых 5-6 лет после начала лечения. Поэтому для большинства пациентов рекомендуется не прекращать иммуносупрессию до этого времени. Терапия деэскалации следует рассматривать у пациентов, которые достигли устойчивого полного почечного ответа complete renal response и глюкокортикоидов (ГК) должны быть снижены в первую очередь. Постепенное снижение иммуносупрессивных препаратов рекомендуется до полной отмены. Как более длительная продолжительность лечения, так и более длительная продолжительность ремиссии были связаны со снижением риска возникновения обострения почек у пациентов, прекративших иммуносупрессивную терапию после 6 лет лечения. В заключении продолжительность иммуносупрессивной терапии должна быть индивидуализирована в зависимости от времени и результатов ответа, продолжительности без обострений flare-free, активности внепочечных проявлений СКВ и предпочтений пациента.
Неотвечающие/рефракткрные заболевания Non-responding/refractory disease
Неудачи в достижении описанных выше целей лечения повышает вероятность не-ответчиков или рефрактерных заболеваний. В этом контексте кинетика протеинурии имеют важное значение в результатах снижения протеинурии-до уровня еще не отвечают этим целям, что может оправдать дальнейшее ожидание до смены терапии, особенно у пациентов с нефротической уровнем протеинурии на исходном уровне, при условии, что функция почек является стабильной. Тщательная оценка, включая соблюдение лечения с измерением концентрации лекарственных средств, где это возможно, является оправданной об объявления не-отвечающей/рефрактернойболезни (роль повторной биопсии почек обсуждается ниже).
Все методы лечения первой линии, включая MMF/MPA (2-3 г/день), CY и CNI (особенно TAC) в качестве монотерапии или “многоцелевой” терапии, рекомендуется при не-отвечающей болезни. B-клеток истощения терапии, такие как RTX, хотя и off-labe, также показаны либо как монотерапия или как дополнительная терапия мМФ / MPA или CY; полное истощение циркулирующих B-клеток предсказал клинической ремиссии на 76 неделе. Это недавно было поддержано успешным испытанием obinutuzumab. После ответа на RTX, рецидивы не являются частыми, но могут происходить в различной продолжительности времени. Повторная доза может рассматриваться для предотвращения или лечения рецидива. Хотя belimumab официально не указано для лечения LN, после hoc анализы из РКИ и наблюдательных исследований показывают, что, при добавлении к стандарту лечения standard-of-care (в том числе MMF), он может постепенно уменьшить протеинурия и риск обострения почек. Важно, положительные результаты от фазы III RCT belimumab как дополнение терапии в LN были опубликованы. Сочетание RTX и белимумаб недавно был использован в рефрактерном заболевании. Высокие дозы внутривенного иммуноглобулина (2 г/кг) может быть рассмотрен, когда есть противопоказания к увеличению глюкокортикоидов или иммуносупрессивных препаратов, таких как инфекция, в то время как плазма обмен редко указывается.
Дополнительное (Адъюнкт-)лечение у пациентов с LN
Adjunct treatment in patients with LN
Ренин-ангиотензин-альдостерон системы блокады рекомендуется (у небеременных пациентов) из-за его антипротеинурических и антигипертензивных эффектов; разумное использование и доза титрации является оправданным в случаях нарушения функции почек. Гипертония должна контролироваться до значений ниже 130/80 мм Hg. Общие меры защиты почек (например, избегание нестероидных противовоспалительных препаратов) не может быть чрезмерно преувеличено. Следует пересмотреть статус вакцинации и соответствующим образом вакцинировать пациентов неживыми вакцинами. настоятельно рекомендуется вакцинировать против гриппа и стрептококковую пневмонию; что касается вакцинации против герпеса zoster, имеющиеся данные свидетельствуют о приемлемом профиле безопасности живой аттенуированной вакцины (доступной в большинстве стран) у пациентов с волчанкой. Решение должно быть индивидуальным с учетом возраста пациента и состояния иммуносупрессии. Пациенты с менее интенсивной иммуносупрессией могут быть более подходящими для вакцинации.
Статин терапии следует рассматривать на основе уровня липидов и наличие других сердечно-сосудистых факторов риска; расчет 10-летнего риска сердечно-сосудистых заболеваний с помощью Systematic Coronary Risk Evaluation, QRisk3, или другой проверенный шкалы рекомендуется, чтобы помочь этому решению, принимая во внимание, что такие баллы могут недооценивать фактический риск, особенно у молодых пациентов с SLE . Первичная профилактика тромбоза с низкими дозами аспирина рекомендуется в присутствии высокого риска aPL профиль, балансируя между риском тромбоза и кровотечения. Защита костей и профилактика остеопороза должны следовать нефармакологическим (выполнение физических упражнений, поддержание нормального индекса массы тела), а также фармакологические меры, в зависимости от риска перелома.
Мониторинг и прогноз LN
Пациенты должны периодически оцениваться в центрах с опытными клиницистами интерпретации микроскопии мочи, серологии и гистологии. Кинетика протеинурии и сыворотки креатинина в течение первых 6-12 месяцев более чувствительны, чем гематурия в prred после балансировки редактирования долгосрочного прогноза. Количественная оценка протеинурии может быть сделано с помощью пятна UPCR, так как его корреляция с 24-часовой набор белка мочи высока в большинстве исследований (хотя ниже, когда моча белка <1000 мг/24 часов). 24-часовой белок мочи может быть предпочтительным для терапевтических решений. Анализ мочи должно быть включено при каждом посещении; появление гломерулярной гематурии или клеточных слепков может быть предиктором надвигающейся обострения почек. Сыворотка C3/C4 и анти-dsDNA должны контролироваться; хотя рост анти-dsDNA титр был связан с предстоящей обострением, специфичность ограничена. Анти-C1q антитела имеют самую высокую корреляцию с активностью LN и может также предсказать рецидив.
Повторная биопсия почек может рассматриваться в случаях нереагирования на иммуносупрессивное лечение, чтобы различать текущую активность и необратимые повреждения, или в случаях рецидива. После обострения LN, гистологический переход находится в 40%-76%, как правило, для класса V до III-IV формы. Per protocol/ повторной биопсии после иммуносупрессивного лечения часто показывают дистортантность между клинической и гистологической реакцией, когда 30% полных ответчиков имеют продолжающуюся гистологическую активность. Значение протокола ребиопсии для определения необходимости непрерывного лечения было изучено в проспективном исследовании 36 пациентов с LN, которые находились в полной ремиссии в течение 12 месяцев, после 3 лет иммуносупрессивной терапии. Продолжающаяся гистологическая активность была сильно предсказывает последующее обострение почек при снижении иммуносупрессии.
Ведение ESKD при LN
Недавние исследования показывают, что риск ESKD в LN снизилась до 10% в 15 лет. Тем не менее, некоторые пациенты будут прогрессировать до необратимого повреждения почек, которое несет повышенный риск заболеваемости и смертности. После заместительной почечной терапии болезнь обычно следует спокойным курсом и обострения (почечные и экстра-почечные) менее часты, но все еще могут произойти. Среди методов замены почек гемодиализ и непрерывный перитонеальный диализ сопровождаются аналогичными показателями выживаемости пациентов в сравнительных ретроспективных исследованиях. В отличие от этого трансплантация почки связана с более высокими 10-летними показателями выживаемости пациентов; данные из регистра почек США показали 70% снижение смертности среди пациентов с LN-ESKD, которые подверглись трансплантации по сравнению с не-трансплантированных аналогов. В обновленном заявлении в настоящее время подчеркивается, что “трансплантация может быть предпочтительнее по сравнению с другими вариантами замены почек и должны быть рассмотрены, когда внепочечная волчанка клинически (и в идеале, серологически) неактивна, по крайней мере 6 месяцев. В настоящее время лишь небольшая часть пациентов проходит упреждающую трансплантацию, хотя эта стратегия имеет наиболее благоприятный исход (10-летний уровень выживаемости пациентов 94%, 76% и 42%, для перитонеального диализа и гемодиализа, соответственно). Трансплантация не должна откладываться и может быть безопасно выполнена в присутствии изолированной серологической активности. Рецидивирующая LN в пересаженной почки редко имеет клинически важное значение. Пациенты с пересаженные LN подвергаются повышенному риску оппортунистических инфекций из-за их предыдущих воздействия лекарств.
Антифосфолипидный синдром и LN
Антифосфолипидный синдром связанных нефропатии представляет собой редкий, но четкий тип aPL-индуцированной сосудистой нефропатии. Хотя считается отличительной чертой антифосфолипидного синдрома связанных нефропатии, TMA не патогномонические, потому что аналогичные поражения находятся при тромбоцитопенический пурпура / гемолитический уремический синдром, злокачественная гипертензия или комплемент-опосредованную TMA. Нет контролируемых исследований для руководства по лечению антифосфолипидного синдрома -ассоциированного с нефропатией. В дополнение к HCQ рекомендуются антитромбоцитарные средства или антикоагулянты (если соответствуют критерии антифосфолипидного синдрома). Блокада системы Ренин-ангиотензин-альдостерон может задержать прогрессирование заболевания.
LN и беременность
Рекомендации EULAR 2017 по управлению планированием семьи при СКВ и антифосфолипидным синдромом полностью охватывают вопрос о беременности, включая вспомогательное оплодотворение, в контексте LN. В отсутствие новых доказательств заявления 2012 рекомендации по беременности LN остались неизменными. UPCR следует контролировать (в идеале, до 500 мг/г) без использования ингибиторов системы ренин-ангиотензин-альдостерон, которые противопоказаны в первом триместре из-за тератогенности. Совместимые препараты включают глюкокортикоиды, АЗА и CNI, и HCQ, которые должны быть продолжены в безопасных дозах на протяжении всей беременности и лактации. Отмена ММФ на более длительный период, например, за 6 месяцев до попыток зачатия, дает время для оценки переносимости и эффективности альтернативного иммуносупрессии. Тяжелые обострения во время беременности, не отвечающие на приемлемые препараты с приемлемым профилем безопасности – заслуживает направления к междисциплинарному специалисту; иногда прерывание беременности и/или использование эмбриото-токсических препаратов могут рассматриваться после взвешивания соотношения риска и пользы.
Ведение педиатрического LN
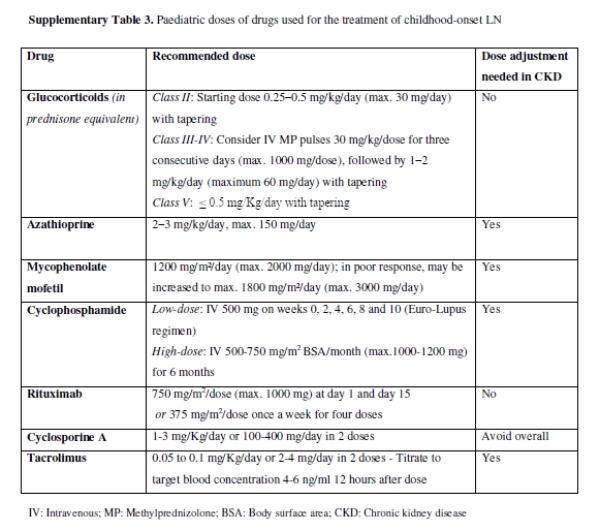
Вовлечение почек чаще встречается в детстве по сравнению со взрослым -дебютом СКВ adult-onset SLE, часто в качестве презентационного проявления, в то время как почечные обострения наблюдаются у более чем 50% пациентов. С 2012 года рекомендации EULAR/ERA-EDTA, американские и европейские группы экспертов в педиатрическом СКВ и LN опубликовали рекомендации по управлению дебютом LN в детстве childhood-onset LN ; оба эти заявления в значительной степени основаны на экстраполяции данных, полученных в ходе исследований, проведенных среди взрослых. Несмотря на различия между детьми и взрослыми, соответствующие заявления, содержащиеся в рекомендациях 2012 года, остались неизменными; диагностика, лечение (педиатрические дозы лекарств, онлайн дополнительная таблица 3) и мониторинг должны следовать тем же принципам, что и при взрослой болезни. Для детей в подростковом возрасте рекомендуется переходная программа для обеспечения соблюдения и оптимальных результатов.
Дополнительные моменты для рассмотрения и программы исследований в LN отображаются в box 1.
Box 1 Исследование повестки дня в волчанка нефрита
Диагноз
- Клиническое представление, гистопатологические особенности, реакция на лечение, прогностические факторы и генетический фон (например, APOL1) в различных этнических группах.
- Пересмотр критериев классификации Международного общества нефрологии/почечной патологии (в настоящее время).
- Атипичный волчаночный нефрит: подоцитопатии и пауци-иммунная нефрит, другие формы.
- Подход к не-волчанка (или антиядерных антител отрицательный) full-house полный набор гломенулонефрит.
- Утвержденное определение обострение почек.
Существующие методы лечения и мониторинга заболеваний
- Эффективность ингибитора кальциневрина у неазиатских пациентов.
- B-клеток ориентации терапии (например, белимумаб, сочетание ритуксимаб и белимумаб, obinutuzumab) и цитокинов ингибиторы в волчанки нефрита.
- Визуализация фиброза почек.
- Длительность и отмена терапии.
- Повреждения, накапливаемые при длительном течении заболевания.
- Протоколированная повторная биопсия: значение ранней (против поздней) повторной биопсии.
- Неиммунные механизмы в прогрессировании нефрита волчанки, такие как гипертония, ожирение, дислипидемия.
- Влияние образовательных программ для пациентов.
- Роль экулизумаб в антифосфолипидном синдроме, связанном с нефропатией.
Патофизиология и биомаркеры
- Риск стратификации подгрупп на основе молекулярных знаков или других биомаркеров.
- Исследуйте неинвазивные средства для классификации типов нефрита волчанки и состояния активности (клетки мочи, omics и т.д.).
- progenitor Клетки почечного прародителя и их пролиферация при волчаночном нефрите.
- Восстановление почек при волчанке нефрита.
- Биомаркеры для жидкой биопсии.
Дизайн исследования люпус нефрита
- Риск стратификации подгрупп на основе молекулярных знаков или биомаркеров.
- Дизайн инновационных исследований.
- Оптимизация «стандартного лечения» (фонового) лечения.
- Лучшее определение конечных точек клинических испытаний.

Обсуждение
Недавние знания в LN потребовали обновления рекомендаций EULAR-ERA/EDTA, которые были разработаны большой группой врачей из разных специальностей и медсестер, ухаживающих за LN, с участием пациентов, и дополнить недавно обновленные рекомендации по SLE. Включение всех участвующих медицинских дисциплин является преимуществом и соглашениями о многодисциплинарной помощи, в чем эти пациенты нуждаются. Эти рекомендации предназначены для информирования ревматологов, нефрологов, пациентов, национальных профессиональных обществ, должностных лиц больниц, учреждений социального обеспечения и регулирующих органов о лечении LN на основе самых последних данных, чтобы обеспечить оптимальные результаты с существующими терапии. Помимо качества фактических данных о рисках и выгодах, были также учтены наличие и стоимость лечения.
Сложной проблемой является отсутствие лицензированных лекарств для LN, несмотря на высококачественные доказательства, подтверждающие использование существующих препаратов. Опять же, в этих рекомендациях, ММФ и низкие дозы внутривенных CY рекомендуется в качестве препаратов первого выбора на основе их лучшего профиля токсичности, в то время как это оставляет пространство для использования высоких доз внутривенного CY для отдельных пациентов с агрессивным заболеванием, особенно если гонадо токсичность не рассматривается. CNI, особенно TAC, в сочетании с глюкокортикоидов и ММФ в так называемой “многоцелевой” терапии, были включены. Отсутствие надежных доказательств по CNI в неазиатских популяций и их потенциал для почечной токсичности с длительным использованием привело комитет принять более осторожное отношение, рекомендуя их для пациентов с нефротической уровнем протеинурии или не отвечающих на начальную терапию. Глюкокортикоид использования, в связи с их вкладом в повреждения при СКВ, получил особое внимание в этих рекомендациях с комитетом рекомендовать использование пульс глюкокортикоидов, а затем более низкие дозы суточной глюкокортикоидов, чтобы уменьшить кумулятивную дозу. Снижение глюкокортикоидов получает повышенное внимание в последние годы, используется в качестве показателя результатов в испытаниях СКВ.
Разработка новых критериев классификации СКВ с повышенным весом при заболеваниях почек будет способствовать включению большего числа пациентов в LN исследования. Новые препараты в разработке для LN, в том числе новые CNI, B-клеточные ингибирующие и истощающие агенты, ингибиторы киназы, ингибиторы костимуляции, ингибиторы активации комплемента , в сочетании с улучшенным дизайном испытания, могут обеспечить дополнительные средства в ближайшем будущем.

Авторы:
Antonis Fanouriakis1,2, Myrto Kostopoulou3, Kim Cheema4, Hans-Joachim Anders5, Martin Aringer6, Ingeborg Bajema7, John Boletis8, Eleni Frangou9, Frederic A Houssiau10, Jane Hollis11, Adexandre Karras12, Francesca Marchiori13, Stephen D Marks14, Gabriella Moroni15, Marta Mosca16, Ioannis Parodis17, Manuel Praga18, Matthias Schneider19, Josef S Smolen20, Vladimir Tesar21, Maria Trachana22, Ronald F van Vollenhoven23, Alexandre E Voskuyl24, Y K Onno Teng25, Bernadette van Leew26, George Bertsias27, David Jayne4, Dimitrios T Boumpas1,28
Медицинские учреждения
Rheumatology and Clinical Immunology Unit, “Attikon” University Hospital, Athens, Greece
Department of Rheumatology, “Asklepieion” General Hospital, Athens, Greece
Department of Nephrology, “G. Gennimatas” General Hospital, Athens, Greece
Department of Medicine, Cambridge University, Cambridge, UK
Division of Nephrology, Department of Medicine IV, University Hospital LMU Munich, Munich, Germany
Division of Rheumatology, Department of Medicine III, University Medical Center & Faculty of Medicine Carl Gustav Carus at the TU Dresden, Dresden, Germany
Department of Pathology, Leiden University Medical Center, Leiden, The Netherlands
Nephrology Department and Renal Transplantation Unit, “Laikon” Hospital, National and Kapodistrian University of Athens, Medical School, Athens, Greece
Department of Nephrology, Limassol General Hospital, Limassol, Cyprus
Cliniques Universitaires Saint-Luc, Université catholique de Louvain, Brussels, Belgium
Lupus nurse specialist, Addenbrooke’s Hospital, Cambridge, UK
Department of Nephrology, Hôpital Européen Georges Pompidou, Assistance Publique-Hôpitaux de Paris, Paris, France
Lupus Europe, Rome, Italy
University College London Great Ormond Street Institute of Child Health, NIHR Great Ormond Street Hospital Biomedical Research Centre, London, UK
Nephrology Unit, Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milan, Italy
Rheumatology Unit, Department of Clinical and Experimental Medicine, University of Pisa, Pisa, Italy
Division of Rheumatology, Department of Medicine Solna, Karolinska Institutet and Rheumatology, Karolinska University Hospital, Stockholm, Sweden
Nephrology Department, Research Institute Hospital Universitario 12 de Octubre (i+12), Department of Medicine, Complutense University of Madrid, Madrid, Spain
Department of Rheumatology & Hiller Research Unit Rheumatology, UKD, Heinrich-Heine University, Duesseldorf, Germany
Division of Rheumatology, Department of Medicine 3, Medical University of Vienna, Vienna, Austria
Department of Nephrology, 1st Faculty of Medicine and General University Hospital, Charles University, Prague, Czech Republic
Pediatric Immunology and Rheumatology Referral Center, First Pediatric Clinic, Hippokration Hospital, Aristotle University of Thessaloniki, Thessaloniki, Greece
Department of Rheumatology and Clinical Immunology, Amsterdam University Medical Center, Amsterdam, The Netherlands
Rheumatology and Immunology Center, Amsterdam University Medical Center, Amsterdam, The Netherlands
Centre of expertise for Lupus-, Vasculitis- and Complement-mediated Systemic autoimmune diseases, Department of Internal Medicine – section Nephrology, Leiden University Medical Center, Leiden, The Netherlands
Lupus Europe, Essex, UK
Rheumatology, Clinical Immunology and Allergy, University Hospital of Heraklion, Heraklion, Greece
Laboratory of Autoimmunity and Inflammation, Biomedical Research Foundation of the Academy of Athens, Athens, Greece
Для связи;
Dimitrios T Boumpas, Rheumatology and Clinical Immunology Unit, “Attikon” University Hospital, Athens 124 62, Greece; boumpasd@uoc.gr