Болезнь Бехтерева (идиопатический анкилозирующий спондилоартрит): патогенез, диагностика и лечение.
к.м.н. Дятчина Л.И.
Хронические воспалительные заболеваний суставов (ХВЗС) включают в себя более 150 различных нозологических форм и синдромов (XIII класс болезней согласно Международной классификации болезней X пересмотра). Общим и наиболее характерным признаком этих заболеваний является поражение суставов и/или позвоночника воспалительного характера. Основными представителями этой группы заболеваний являются ревматоидный артрит (РА), ювенильный хронический артрит, идиопатический анкилозирующий спондилоартрит (болезнь Бехтерева – ББ) и артриты, сочетающиеся со спондилитом (псориатический артрит- ПА), реактивные артриты, артриты при хронических воспалительных заболеваниях кишечника.
Идиопатический анкилозирующий спондилоартрит (ИАС) является основной формой воспалительных заболеваний позвоночника. Заболевание характеризуется хроническим прогрессирующим течением и приводит к анкилозированию илеосакральных и межпозвонковых суставов, обызвествлению спинальных связок и ограничению подвижности позвоночника. Для ИАС характерны и разнообразные системные проявления, которые в ряде случаев определяют прогноз заболевания и его исходы.
Интерес к ИАС существенно возрос после выделения Moll J.M.H. группы заболеваний, названных им серонегативные спондилоартриты – спондилоартропатии (ССА). ССА объединяет большое число перекрестных симптомов и также ассоциирован с HLA-B27. К этой группе, помимо ИАС, относятся также реактивные артриты, псориатический артрит, поражения суставов при неспецифическом язвенном колите и болезни Крона и недифференцированный спондилоартрит. Автономность других форм, входящих в группу спондилоартритов, а именно, синдрома SAPHO, острого переднего увеита и SEA-синдрома, пока полностью не решена.
Распространенность спондилоартритов в целом составляет 0,6-13%, а распространенность ИАС колеблется, по данным разных авторов, от 0.1 до 1,4%. ИАС чаще встречается у мужчин, соотношение мужчин к женщинам составляет 2:1 или 3:1. Распространенность ИАС ассоциируется с частотой встречаемости HLA-B27. Она варьирует в широких пределах – от 0,15% в Финляндии до 1,4% в Норвегии и даже до 2,5% среди взрослого населения эскимосов Аляски, но в целом составляет 1:200 взрослого населения, т.е. 0,05%. У женщин, как правило, не наблюдается выраженной деформации позвоночника даже при наличии множественного синдесмофитоза. В то же время поражение периферических" суставов, как и заинтересованность шейного отдела позвоночника и симфиза, напротив, чаще встречается у женщин. Ассоциация с HLA-B27 не связана с половой принадлежностью больных. Считается, что истинная распространенность идиопатических анкилозирующих спондилоартритов более высокая, чем это приводится, так как нет общепринятых диагностических критериев некоторых нозологических форм, входящих в эту группу, что и затрудняет их распознавание. Лидирующее положение среди ССА занимает ИАС (болезнь Бехтерева), который является моделью для разработки методов терапии, пригодных и для других заболеваний этой группы. Социальное значение ИАС подчеркивается тем обстоятельством, что эта болезнь начинается в молодом возрасте, а пик ее заболеваемости падает на возраст 15-30 лет, причем средний возраст начала болезни соответствует 24 годам.
Воспалительный процесс в позвоночнике проявляется двусторонним сакроилеитом, который является основным и наиболее ранним признаком заболевания. При развитии сакроилеита выявляется также оссификация связок позвоночника и/или наружных отделов фиброзного кольца с формированием единичных или множественных синдесмофитов, эрозирование передних углов позвонков с изменением их формы, развитием деструкции дисков и их оссификацией. Отмечается не деструктивный краевой склероз тел позвонков, неровность суставных поверхностей и остеосклерозм межпозвонковых и реберно – позвонковых суставов, формируется остеопения и остеопороз позвоночника.
Таблица №1. Патоморфология ИАС
- Хронический синовит пролиферативного типа;
- Воспалительный процесс в сухожильно-связочных образованиях и бурсах;
- Остит;
- Хондроидная метаплазия суставной капсулы и синовиальной оболочки с последующей их оссификацией;
- Хондроидная метаплазия связок, сухожилий и энтезов с исходом в их обызвествление как на периферии, так и в осевом скелете;
- Анкилозирование периферических суставов без предшествующего синовита.
Патоморфология ИАС имеет существенные отличия от патоморфологии ревматоидного артрита, что, по-видимому, и определяет особенности ответа на лекарственную терапию (таблица № 1). Если при ревматоидном артрите воспалительный процесс начинается с синовиальной оболочки, то при ИАС первично поражаются энтезы и кость в области прикрепления к ней энтезов и лишь позднее, вторично, воспалительный процесс распространяется на синовиальную оболочку. Эти особенности развития воспаления относятся не только к корневым и периферическим суставам, но и к поражению позвоночника, где формируются синдесмофиты, которые можно рассматривать как частный вариант генерализованной энтезопатии.
Наряду с поражением осевого скелета нередко наблюдаются артриты грудино-реберных, грудино-ключичных и височно-нижнечелюстных суставов, а также артриты периферических суставов, за исключением межфаланговых, пястно- и плюснефаланговых. Нередко в патологический процесс вовлекаются корневые суставы, и прежде всего тазобедренные. В ряде случаях при ИАС наблюдается значительное ограничение подвижности тазобедренного сустава, или какого-либо другого сустава, без рентгенологических признаков деструкции суставных поверхностей или даже сужения суставной щели. В таких случаях функциональная недостаточность сустава является следствием капсулита, который начинается с области прикрепления капсулы сустава непосредственно к кости. Поражение тазобедренных суставов отмечается у трети больных и всегда является показателем неблагоприятного прогноза и ранней инвалидизации больных. Нередко клинико-рентгенологическую симптоматику определяют, имеющиеся у больных, энтезопатии. В частности, талалгия, капсулиты тазобедренных суставов, эрозии, остеосклероз, остеофитоз, периостальные наслоения на пяточных костях или костях таза также являются проявлениями энтезопатии. Морфологические изменения при ИАС находят свое отображение в рентгенологической картине. Анализ рентгенограмм суставов и позвоночника позволяет выявить объем и степень выраженности патологических стигматов и верифицировать диагноз (таблица № 2).
При развитии ИАС, наряду с поражением опорно-двигательного аппарата, возможно развитие системных проявлений, таких как амилоидная нефропатия и др., которые нередко определяют прогноз заболевания и его исходы. Амилоидная нефропатия может сопровождаться появлением тяжелой почечной недостаточности. Возможно также развитие аортита, тяжелые нарушения проводимости (атрио-вентрикулярные блокады II и III степени), арахноидита нижней части спинного мозга с чувствительными и двигательными нарушениями и расстройством тазовых органов, которые подчас определяют прогноз заболевания и его исходы
Таблица №2. Рентгенологическая симптоматика ИАС
- Двусторонний сакроилеит 2 стадии и /или односторонний 3-4 стадии;
- Оссификация связок позвоночника и/или наружных отделов фиброзного кольца (единичные или множественные синдесмофиты, симптом «бамбука»);
- Одно- и/или двусторонний коксит;
- Передний спондилит (зрозирование передних углов позвонков и их квадратизация);
- Деструкция дисков и их оссификация;
- Недеструктивный краевой склероз тел позвонков;
- Оссифицирующий капсулит;
- Остеопения/остеопороз позвонков;
- Неровность суставных поверхностей и остеосклероз межпозвонковых и реберно-позвонковых суставов;
- Эрозии, остеосклероз, остеофитоз, периостальные наслоения пяточных костей и костей таза.
Клиническая картина ИАС характеризуется выраженной гетерогенностью. Заболевание может протекать в виде изолированного поражения позвоночника (центральная форма), с одновременным поражением позвоночника и корневых суставов, прежде всего тазобедренных (ризомелическая форма) или периферических суставов (периферическая форма). Характерным во всех случаях является прогрессирующее поражение осевого скелета с нарастающим ограничением подвижности позвоночника и его деформацией. При поражении тазобедренных суставов наблюдается особенно неблагоприятный прогноз с ранней и стойкой инвалидизацией больных. Нередко при наличии коксита возникает необходимость в проведении эндопротезирования пораженного сустава.
В целом, по своей суммарной оценке тяжелые случаи ИАС протекают с таким же низким качеством жизни, как и тяжелые случаи ревматоидного артрита. По данным Ward М.М., низкое качество жизни объясняется выраженной скованностью, наблюдающейся при этом заболевании у 90% пациентов, болью (83%), повышенной утомляемостью (62%), плохим сном (54%), тревогой за будущее (50%) и побочными явлениями, возникающими при проведении медикаментозной терапии (41 %).
Тяжесть ИАС определяется также по большому проценту больных, имеющих стойкую потерю трудоспособности, которая наступает в среднем спустя 15,6 лет от начала болезни. Имеются доказательства, что темпы прогрессирования ИАС наиболее выражены в первые 10 лет болезни от начала заболевания. Инвалидность при этом заболевании ассоциируется с низким уровнем образования, практически полной оссификацией позвоночника, наличием острого переднего увеита, женским полом и наличием сопутствующих заболеваний. Относительный риск летальных исходов при ИАС выше по сравнению с общей популяцией на 50%. Основной причиной летальности является желудочно-кишечные осложнения, которые встречаются в 4 раза чаще, чем в популяции, увеличение частоты смертности от несчастных случаев – в 2 раза, от суицида – в 2 раза, от цереброваскулярной недостаточности – в 2 раза, от циркуляторных нарушений. – в 1,4 раза.
Amor В. и соавт. при изучении 328 больных ИАС выявили 7 показателей дебюта заболевания, которые коррелировали с последующим тяжелым его течением. Среди этих показателей фигурируют не только артрит тазобедренных суставов (относительный риск 23), СОЭ выше 30 мм/ч (относительный риск 7), начало болезни до 16 лет (относительный риск 3), ограничение подвижности в поясничном отделе позвоночника (относительный риск 7), но и сосискообразные пальцы (относительный риск, олигоартрит (относительный риск 4). Неэффективность или низкая эффективность НПВС также является фактором, определяющим неблагоприятное течение ИАС (относительный риск 8).
При отсутствии приведенных факторов в дебюте заболевания отмечается более легкое течение в продвинутой стадии заболевания. Чувствительность представленных показателей составляет 92,5%, а специфичность – 78%. Тяжелое течение ИАС наблюдается у 50% больных с артритом тазобедренных суставов вначале заболевания или при наличии каких-либо трех из перечисленных выше факторов.
Предикторами тяжелого течения ИАС являются большое число клинико-рентгенологических, лабораторных и генетических факторов, которые следует учитывать при определении терапевтической тактики лечения данного заболевания (таблица № 3).
Таблица №3. Факторы риска тяжелого течения ИАС
- Мужской пол,
- Развитие болезни в возрасте до 19 лет,
- Ограничение подвижности позвоночника вначале заболевания (первые 2 года болезни),
- Возникновение артрита тазобедренных суставов в дебюте АС,
- Сочетание периферического артрита с выраженными энтезитами (первые 2 года болезни),
- Высокие значения СОЭ и СРБ в течение многих месяцев,
- HLA-B27+,
- Неблагоприятный семейный анамнез (наличие заболеваний из группы серонегативных спондилоартритов).
Конкретное содержание терапии ИАС определяется клинической формой заболевания, степенью активности воспалительного процесса, наличием и выраженностью системных проявлений, функциональной способностью суставов и позвоночника. Несмотря на большое значение физических методов лечения и широкий диапазон реабилитационных мероприятий, направленных на профилактику деформации позвоночника и ограничение его подвижности, а также на коррекцию уже развившихся изменений, медикаментозная терапия у таких больных имеет первостепенное значение (таблица № 4).
Таблица №4. Медикаментозная терапия ИАС
Симптоматическая терапия:
- Нестероидные противовоспалительные средства (НПВС);
- Глюкокортикостероиды – ГКС (системная, локальная и интенсивная терапия);
- Простые анальгетики;
- Миорелаксанты (толперазон, баклофен, тизанидин).
Терапия системных проявлений
- J-стимуляторы, колхицин, дексаметазон субконьюнктивально и т.д.
Базисная противовоспалительная терапия:
- Сульфасалазин;
- Метотрексат;
- Комбинированная терапия (сульфасалазин + метотрексат);
- Лефлуномид;
- Бисфосфонаты (памидронат).
Препараты биологического действия:
- Ингибиторы фактора некроза опухоли и его растворимого рецептора (этанерцепт, инфликсимаб);
- Ингибитор растворимого рецептора интерлейкина-1 (анакинра).
В настоящее время не существует этиологического лечения ИАС. Основными принципами терапии ИАС являются комплексное воздействие на различные звенья патогенеза заболевания, разработка индивидуального подхода к лечению больных на разных этапах терапии. При проведении патогенетической терапии чрезвычайно важным является раннее назначение препаратов, снижающих вероятность необратимого повреждения суставов, позвоночника и внутренних органов, а также постоянный контроль эффективности проводимых мероприятий, возможного развития побочных реакций и своевременная коррекция программы лечения.
Основные направления медикаментозной терапии направлены на купирование болевого синдрома (симптоматическая терапия), подавление активности воспалительного процесса и снижение темпов прогрессирования заболевания, профилактику прогрессирования структурных изменений. В каждом конкретном случае объем проводимой лекарственной терапии определяется клинической формой заболевания, степенью выраженности воспалительного процесса, наличием или отсутствием системных проявлений, функциональной способностью суставов и позвоночника.
Противовоспалительная терапия включает симптом-модифицирующие (СМАРП) и болезнь-модифицирующие (БМАРП) антиревматические препараты. К препаратам первой группы относятся нестероидные противовоспалительные средства (НПВС) и ГКС, которые не оказывают влияние или мало влияют на темпы прогрессирования костно-хрящевой деструкции. Болезнь-модифицирующие (БМАРП) антиревматические препараты способны активно вмешиваться в течение ХВЗС, задерживать и даже предотвращать эрозирование и анкилозирование суставов, а значит, способствовуют сохранению функционального состояния суставов и позвоночника в течение длительного периода. Препараты этой группы можно рассматривать как болезнь контролирующие антиревматические препараты.
Терапия НПВС
Симптоматическая терапия ИАС предусматривает, в первую очередь, применение нестероидных противовоспалительных препаратов (НПВС), которые являются лекарствами первой линии и необходимым компонентом комбинированной терапии ИАС, причем больные принимают их беспрерывно в течение многих месяцев и даже лет. НПВС воздействуют на два основных проявления этого заболевания – боль, припухлость суставов и ригидность. Известно, что боль воспалительного типа в позвоночнике (боль в ранние утренние часы на протяжении трех и более месяцев, не уменьшающаяся в покое и ослабевающая на фоне двигательной нагрузки) входит в диагностические критерии ИАС.
Механизм действия НПВС связан со снижением активности ферментативных систем, участвующих в синтезе, депонировании, высвобождении и превращении биологически активных аминов (гистамина, серотонина, кининов, в частности брадикинина и, особенно, простагландинов). Наряду с влиянием на медиаторные системы НПВС оказывают мембраностабилизирующее действие, снижают проницаемость клеточных и субклеточных мембран. Предполагается, что, являясь анионными липофильными молекулами, НПВС могут проникать в фосфолипидный биослой и изменять вязкость биомембран. Благодаря снижению проницаемости мембран митохондрий уменьшается поступление энергии в очаг воспаления. При этом возникает нарушение взаимодействия процессов гликолиза и окислительного фосфорилирования, что приводит к недостатку макроэргических субстратов (АТФ) в зоне воспаления. Стабилизация мембран лизосом препятствует высвобождению из них протеолитических ферментов (гидролаз). НПВС уменьшают также сосудистую проницаемость.
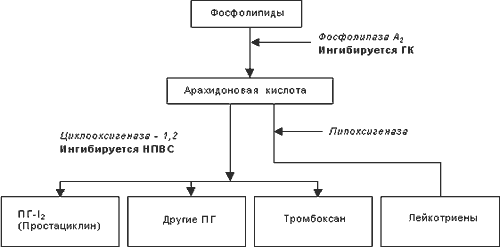
В 1971 r. J. Vane впервые обнаружил, что ацетилсалициловая кислота и индометацин в низких концентрациях проявляют свое противовоспалительное, анальгезирующее и жаропонижающее действие за счет подавления активности фермента циклооксигеназы (ЦОГ), которая участвует в превращениях арахидоновой кислоты и в биосинтезе простагландинов (ПГ). С тех пор точка зрения, согласно которой фармакологические эффекты НПВС связаны, в первую очередь, с подавлением синтеза ПГ, считается общепринятой. В меньшей степени НПВС влияют на активность других ферментов, которые также участвуют в ее метаболизме (фосфолипаза А, липоксигеназа). В результате биологических превращений арахидоновой кислоты из пероксидов происходит образование ряда провоспалительных простагландинов, а также тромбоксана А2 (TxА2). ПГ являются медиаторами воспалительной реакции, в частности, вызывают локальное расширение сосудов, отек, экссудацию, миграцию лейкоцитов и другие эффекты (в основном ПГ-Е2 и ПГ-I2). Они активируют также процессы перекисного окисления липидов в очаге воспаления, способствуют образованию свободных радикалов. Поэтому НПВС, устраняя их эффекты, предупреждают образование и освобождение свободных радикалов и, тем самым, ограничивают воспалительный процесс.
Метаболизм арахидоновой кислоты.
Степень ингибирования циклооксигеназы АСК принята за 1 единицу, бутадион эффективнее в 5 раз, мефенамовая кислота в 52 раза, индометацин в 217 раз. Наиболее мощные препараты – индометацин, диклофенак, фенилбутазон – действуют также на фазу пролиферации (уменьшая синтез коллагена и образование соединительной ткани), но слабее, чем на экссудативную фазу. На фазу альтерации НПВС практически не влияют. По противовоспалительной активности все НПВС уступают глюкокортикостероидам (ГКС). Метаболизм арахидоновой кислоты представлен на рис.1.
Подавление синтеза ПГ может приводить к появлению вторичных фармакологических эффектов НПВС, в том числе связанных с изменением функции нейтрофилов, Т- и В-лимфоцитов, синтезом ЛТ и др. Кроме того, антипростагландиновая активность НПВС объясняет их сосудистые эффекты, в частности, снижение интенсивности индуцированного ПГ отека и эритемы, а также анальгезирующее действие и основные побочные реакции, такие как, развитие пептической язвы, нарушение функции тромбоцитов, бронхоспазм, гипертензию, нарушения клубочковой фильтрации почек.
В последние годы существенно расширились и уточнились представления о точках приложения НПВС в регуляции синтеза ПГ. Ранее считалось, что ЦОГ является единственным ферментом, подавление активности которого снижает синтез ПГ, как участвующих в развитии воспаления, так и ПГ, регулирующих нормальные физиологические функции, в частности, функцию желудка, почек и других органов. Сравнительно недавно были открыты две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), играющих различную роль в регуляции синтеза ПГ. Считается, что ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и другие). Было показано, что ЦОГ-2 регулирует преимущественно синтез ПГ, вызванный различными провоспалительными стимулами. Активность ЦОГ-1 определяет продукцию ПГ, принимающих участие в регуляции нормальных физиологических клеточных процессах, которые не связанны с развитием воспаления. Таким образом, предполагается, что противовоспалительное действие НПВС обусловлено ингибированием ЦОГ-2, а их нежелательные реакции связаны с ингибированием ЦОГ-1. Эффекты, возникающие при блокаде ЦОГ, представлены в таблице №5.
|
Таблица №5. Эффекты, возникающие при блокаде ЦОГ
|
||
|
Блокада ЦОГ-1 |
|
|
|
Блокада ЦОГ-2 |
|
|
|
Блокада ЦОГ |
|
|
Эти исследования важны для понимания особенностей фармакологической активности НПВС. Так в результате блокады ЦОГ-2 снижается синтез ПГ, которые принимают участие в развитии воспаления, боли и лихорадки. Хорошо известно, что ПГ-Е2 и ПГ-I2 оказывают протективное действие на слизистую желудка, что связывают с их способностью снижать секрецию соляной кислоты и увеличивать синтез цитопротективных веществ. Предполагается, что желудочно-кишечные осложнения НПВС связаны с подавлением активности ЦОГ-1. Другим циклооксигеназным продуктом является тромбоксан А2, синтез которого подавляют НПВС. При этом нарушается агрегация тромбоцитов, снижается свертывающий потенциал крови и возможно появление кровоточивости. Кроме того, ПГ играют важную роль в регуляции клубочковой фильтрации, секреции ренина и поддержании водно-электролитного баланса в почках. Очевидно, что нарушение синтеза ПГ может приводить к разнообразным нарушениям функции почек, особенно у больных с сопутствующей почечной патологии. Наконец, подавление циклооксигеназной активности может потенциально способствовать переключению метаболизма арахидоновой кислоты на липооксигеназный путь, вызывая повышение продукции лейкотриенов (ЛТ). Гиперпродукция лейкотриенов обуславливает развитие у некоторых больных, получающих НПВС, бронхоспазма и других реакций немедленной гиперчувствительности.
Обезболивающий эффект всех НПВС проявляется в дозах меньших, чем их противовоспалительный эффект. Одним из основных принципов терапии боли при воспалительных заболеваниях является также устранение гипералгезии, возникающей в очагах воспаления вследствие образования в них ПГ-Е2 и ПГ-I2. Последние потенциируют раздражение чувствительных рецепторов, вызываемое другими медиаторами воспаления: брадикинином, гистамином, серотонином. Кроме того, если в начале заболевания боль может иметь ноцицептивную природу, то изменение ее интенсивности и длительности нередко наблюдается при отсутствии очевидных ноцицептивпых стимулов. Причиной этого могут быть сопутствующие аффективные расстройства (тревога, депрессия).
В настоящее время имеются данные о влиянии НПВС на центральные механизмы боли, не связанные с угнетением синтеза ПГ. Показано, что диклофенак оказывает лечебный эффект путем воздействия на ноцицепторы, отвечающие за болевую чувствительность в ЦНС, а также оказывает центральное опиоидноподобное антиноцицептивное действие.
Анальгезирующий эффект НПВС в большей степени проявляется при болях слабой и средней интенсивности, которые локализуются в мышцах, суставах, сухожилиях, нервных стволах, а также при головной или зубной боли. При сильных висцеральных болях большинство НПВС менее эффективны и уступают по силе анальгезирующего действия препаратам группы морфина (наркотическим анальгетикам).
Природа болей при ИАС, связана с наличием воспалительного процесса виде сакроилеита, протекающего с оссификацией связок позвоночника и/или наружных отделов фиброзного кольца, формированием единичных или множественных синдесмофитов, эрозированием передних углов позвонков, деструкцией дисков и их оссификацией, поражением корневых и периферических суставов, энтезитами, т.е. имеет воспалительный, биомеханический или неврогенный характер. НПВС воздействуют на болевой синдром, воспалительные изменения в суставах виде припухлости и ригидность.
Большинство современных НПВС блокирует обе изоформы ЦОГ и обладают сбалансированной активностью в отношении ингибиции изоферментов ЦОГ. В таблице № 6 представлена классификация НПВС.
|
Таблица №6. Классификация НПВС по селективности в отношении различных форм ЦОГ (Drugs Therapy Perspectives, 2000, с дополнениями) |
|
|
Выраженная селективность в отношении ЦОГ-1 |
|
|
Умеренная селективность в отношении ЦОГ-1 |
Диклофенак |
|
Примерно равноценное ингибирование ЦОГ-1 и |
|
|
Умеренная селективность в отношении ЦОГ-2 |
Этодолак |
|
Выраженная селективность в отношении ЦОГ-2 |
|
Дифференцированный выбор НПВС основывается на знании фармакокинетических и фармакодинамических особенностей действия отдельных препаратов и носит, в целом, эмпирический характер.
При выборе «стандартных» НПВС для лечения ИАС предпочтение следует отдавать препаратам производным индолуксусной кислоты – индометацину (Метиндолу), активность которых при наличии у больных спондилита выше, чем при применении других препаратов. Некоторые больные принимают эти препараты в дозе 100-150 мг/сут на протяжении многих месяцев и даже лет. Однако производные индола обладают широким спектром побочных реакций, включая поражение почек, желудочно-кишечную токсичность, задержку жидкости, токсические явления со стороны центральной нервной системы, что ограничивает их применение у ряда пациентов.
Многие авторы отмечают, что переносимость препаратов второй генерации (диклофенак натрия, кетопрофен, флурбипрофен и др.) у больных с ИАС и другими спондилоартритами обычно лучше, чем у больных с другими заболеваниями. Поэтому они также широко применяются для лечения данного заболевания. При лечении больных ИАС, как и многими другими заболеваниями, следует учитывать индивидуальные вариации ответа больных на НПВС.
В настоящее время «золотым стандартом» среди НПВС по противовоспалительной активности считается диклофенак натрия. По отношению к нему, чаще всего, оценивается эффективность других НПВС. Диклофенак натрия в суточной дозе 100-150 мг в 2-3 приема, обладает также высокой анальгезирующей активностью. Наиболее хорошо изученным НПВС, обладающим селективностью в отношении ЦОГ-2, является мелоксикам. Анальгетическая активность мелоксикама сравнима с анальгетической активностью диклофенака, напроксена и пироксикама, но он реже вызывал развитие НПВС-гастропатии, а также ее тяжелых осложнений (перфорации, язвы, кровотечения). Мелоксикам в рекомендуемых дозах практически не оказывает влияние на агрегацию тромбоцитов и почечный кровоток даже у больных с нарушением функции почек и не взаимодействовует с метотрексатом.
Одним из наиболее существенных достижений в фармакотерапии боли и воспаления явилась разработка нового класса НПВС, так называемых коксибов, или «специфических ингибиторов циклооксигеназы». Целекоксиб – первый коксиб, внедренный в клиническую практику. Препарат продемонстрировал достоверное снижение частоты симптоматических и тяжелых гастроэнтерологических побочных эффектов (эндоскопически выявляемые язвы) и осложнений (перфоративные язвы, обструкция, кровотечение) на фоне лечения целекоксибом по сравнению с другими НПВС, такими как диклофенак и ибупрофен. Результаты, касающиеся применения целекоксиба в течение первых 6 месяцев после регистрации в США, показали, что частота гастроэнтерологических побочных эффектов (0,01% на 100 пациентов в год) была сопоставима с таковой у больных, которые вообще не принимали НПВС (данные системы регистрации побочных эффектов лекарственных препаратов Комитета по контролю за лекарственными препаратами). Отмечена крайне низкая частота печеночных, которые нередко являются причиной прерывания лечения нимесулидами, а также кардиальных и почечных нежелательных (побочных) эффектов. Общая частота прерывания лечения и связи с неэффективностью или развитием побочных эффектов была достоверно ниже у больных, принимавших целекоксиб, чем другие НПВС.
Мета-анализ 1000 проведенных рандомизированных контролируемых клинических исследований эффективности применения различных НПВС не выявил достоверных различий между ними, однако эти различия могут оказаться значимыми при оценке эффективности препаратов у отдельных больных. Разработка патогенетически обоснованной терапии воспалительных заболеваний предполагает возможность целенаправленного использования отдельных препаратов, в зависимости от этиологии, фазы процесса, его течения, а также с учетом особенностей организма больного, функциональной активности его органов и систем.
При лечении ИАС отмечается быстрый и отчетливый положительный эффект НПВС на субъективные симптомы спондилоартрита (уменьшение боли, припухлости суставов и ригидности) в течение первых 48 часов от начала их приема. При изучении 741 больного с болями в позвоночнике оказалось, что такой быстрый эффект имел место у преобладающего большинства больных, страдающих ИАС, и только у 15% пациентов при наличии болей в позвоночнике, обусловленных другими патологическими состояниями. У больных с наличием ИАС чувствительность этого симптома составляет 77%, а специфичность – 85%. Интересно, что если интенсивность болей в спине не уменьшается от приема НПВС в течение первых 48 часов от начала приема препаратов, то вероятность ИАС составляет всего 3%.
Остается неясным вопрос о возможности активного влияния НПВС на прогноз ИАС, включая и лиц, у которых удается контролировать воспалительную активность с помощью этих препаратов. Следует иметь в виду, что после отмены НПВС симптомы воспаления (боль, припухлость суставов и скованность) обычно вновь нарастают спустя несколько дней, а то и нескольких часов. Кроме того, устранение мышечного гипертонуса способствует снижению интенсивности боли, поскольку он наряду со структурными изменениями также формирует деформацию позвоночника. Полагают, что эти препараты не влияют на темпы прогрессирования структурных изменений в позвоночнике, в том числе и у больных, у которых наблюдается выраженный противовоспалительный эффект.
У некоторых больных выраженные боли в суставах или позвоночнике не удается купировать НПВС, при этом их интенсивность не соответствует степени активности воспаления. В таких случаях целесообразно комбинировать прием НПВС с простыми анальгетиками, и прежде всего парацетамолом. Парацетамол обычно назначается на короткий период, и после стихания интенсивных болей его снимают. Назначение анальгетиков улучшает сон в ночные и ранние утренние часы у больных с ярко выраженным болевым синдромом.
При лечении НПВС возможно появление побочных реакций с развитием симптоматических и тяжелых гастроэнтерологических осложнений, кровоточивости, медикаментозной нефропатии, кардио- и гепатотоксичности, а также повышение артериального давления, появление отеков и усугубление имеющейся сердечной недостаточности, церебральные нарушения, аллергические реакции, торможение костномозгового кроветворения.
Для снижения частоты и интенсивности побочных реакций при применении НПВС следует придерживаться следующих основных принципов:
– начинать выбор препарата, используя ЛС с наименьшей токсичностью;
– проводить постепенное титрование доз;
– регулярно контролировать эффективность терапии;
– проводить подбор оптимального препарата каждому конкретному больному;
– назначать НПВС в соответствии с суточным ритмом болей и утренней скованности;
– учитывать фармакокинетику препаратов;
– дозировать НПВС с учетом лекарственных взаимодействий,
– наличия патологии печени, почек, сердечно-сосудистой системы;
– комбинировать НПВС с простыми анальгетиками;
– не назначать одновременно два и более НПВС независимо от пути их введения.
Терапия глюкокортикостероидами (ГКС).
Системная терапия ГКС – один из наиболее эффективных методов лечения ревматических заболеваний. Применение стероидов позволяет существенно улучшить прогноз и увеличить продолжительность жизни пациентов. При проведении системной терапии ГКС необходимо соблюдать общие принципы фармакотерапии, следование которым позволяет повысить эффективность и безопасность лечения, а также уменьшить частоту нежелательных побочных эффектов.
Терапию ГКС следует начинать только при наличии строгих показаний. При этом гормональная терапия должна применяться вместе с обычной терапией, а не назначаться вместо нее. Рациональная терапия предполагает использование ГКС короткого действия в оптимальной дозе и, по возможности, на срок, который необходим для контролирования активности процесса. Гормонотерапия должна проводиться при наличии строгого врачебного контроля их применения с целью раннего выявления побочных эффектов и их коррекции. Назначая гормонотерапию, не только врач, но и больной должны быть детально информированы о возможностях и осложнениях данного метода лечения.
Системное применение ГКС применяется с целью уменьшения симптомов при серонегативных спондилоартритах (ССА), но требуют индивидуального подбора доз и не может назначаться стандартно. Системная терапия ГКС назначается больным ИАС при наличии множественного поражения суставов экссудативного характера, упорном коксите, рефрактерном к другим видам медикаментозной терапии, а также у больных с серьезными системными проявлениями (аортите с симптомокомплексом стенокардии, формировании пороков сердца, болезни Берже, синдроме «конского хвоста»). Как правило, у больных отмечаются также высокие концентрации острофазовых белков и сохраняется активность воспалительного процесса на протяжении трех и более месяцев.
В ревматологии эталоном среди ГКС считается преднизолон, хотя в настоящее время достаточно часто используется метилпреднизолон. Вначале лечения дневную дозу препарата, как правило, делят на 3 приема (фаза индукции), затем переходят на однократный прием препарата в утренние часы (фаза консолидации). В случаях, когда предполагается длительный прием ГКС, следует, как можно быстрее, перевести больных на однократный прием всей дозы в утренние часы.
Выбор начальной дозы ГКС, определение продолжительности терапии и темпов снижения дозы следует проводить не эмпирически, а с учетом стандартизированных клинико-лабораторных показателей активности процесса и характера заболевания. При назначении ГКС-терапии необходимая суточная доза должна подбираться индивидуально, начиная с минимaльных среднетерапевтических доз, обычно рекомендуемых при данном заболевании. При лечении ИАС не следует начинать лечение сразу с больших доз и длительным курсом. При наступлении ремиссии печение ГКС желательно прекратить.
В процессе гормонотерапии в периферической крови отмечается уменьшение числа эозинофилов, лимфоцитов, эритроцитов, снижение уровня гемоглобина при одновременном увеличении содержания лейкоцитов за счет нейтрофилов (до 12000). Такая гемограмма может быть ошибочно истолкована как продолжение обострения процесса. В тоже время, указанные изменения следует считать благоприятными и свидетельствующими о достаточной дозировке ГКС.
После достижения клинического эффекта следует уменьшить дозу ГКС до поддерживающей дозы. Для этого начальную дозу ГКС постепенно снижают до минимального уровня, при котором сохраняется полученный положительный эффект. Если суточная доза проводимого курса лечения находится в пределах 15-40 мг/сутки в пересчете на преднизолон, то отмена должна осуществляться по 2,5-5 мг каждые 5-7 дней до достижения физиологической дозы. Такая тактика позволяет создать условия для восстановления функциональных возможностей гипоталамо-гипофизарно-надпочечниковой системы уже во время отмены препарата. В тех случаях, когда не удается полностью уйти от глюкокортикостероидной терапии следует переводить больных на поддерживаюшие дозы гормонов, индивидуальные для каждого пациента и соответствующие, как правило, заместительным дозам. из расчета 5-15 мг преднизолона в сутки. Имеются данные об отсутствии существенного угнетения гипоталамо-гипофизарно-надпочечниковой оси, если доза преднизолона не превышает 10 мг в сутки. Развитие побочных эффектов и осложнений при системной глюкокортикоидной терапии чаще наблюдается при длительном курсовом лечении и применении ГКС в дозах, превышающих 10-15 мг в пересчете на преднизолон. Риск развития побочных эффектов меньше при снижении обшей дозы преднизолона и приеме препарата в определенное время. Прием гормонов должен проводиться в утренние часы (с 6 до 9 часов утра) с учетом естественного биоритма их выделения.
С целью уменьшения дозы ГКС рекомендуется их комбинировать с НПВС, средствами базисной терапии. Однако при этом увеличивается вероятность развития язвенных поражений ЖКТ.
При ИАС ГКС-терапия менее эффективна, чем при других ревматических болезнях. Для достижения контроля над симптомами ИАС в период высокой активности процесса требуются более высокие дозы ГКС. При этом отмечается большая вероятность по сравнению с другими ревматическими заболеваниями развития остеопороза и патологических переломов. Считается, что лечение низкими дозами ГКС может снизить потенциальный риск остеопороза за счет ингибиции синтеза ИЛ-6. Это особенно важно, поскольку ИАС ассоциируется с ускоренной потерей костной массы и риском переломов вследствие развития спинального анкилозирования (ограничение подвижности больных).
Впервые метод пульс-терапии при лечении ревматических заболеваний был применен Е.Cathcart et al. в 1976 году. Под пульс-терапией обычно подразумевают быстрое (в течение 30 – 60 мин) внутривенное введение больших доз ГКС (около 1000 мг в пересчете на метилпреднизолон) 1 раз в день на протяжении 1 – 3 суток. Лучшим препаратом для пульс-терапии является Солю-медрол (метилпреднизолона натрия сукцинат), который хорошо растворим, быстро метаболизируется в организме и вызывает минимальное количество осложнений или метилпреднизолон гемисукцинат натрия (МП), реже Целестон (бетаметазона фосфат).
Использования для «пульс-терапии» метилпреднизолона связано с особенностями его фармакокинетики. При изучении фармакокинетики МП было обнаружено, что уровень препарата в плазме при внутривенном введении в течение 1 часа достигает максимума и быстро снижается в течение последующих 6-7 часов. Через 4 дня в периферической крови обнаруживаются только следовые количества активного метилпреднизолона. В тоже время меченный изотопами МП может активно накапливаться в различных тканях, особенно в эритроцитах и головном мозге. Имеются данные о том, что МП может депонироваться в воспаленных тканях в большей степени, чем в нормальных тканях. Эти фармакологические свойства МП, а также незначительная минералокортикоидная активность позволяют рассматривать его как средство выбора при проведении пульс-терапии. Пульс-терапия может приводить к снижению уровня кортизола, что отражает супрессию надпочечников. На восстановление функции надпочечников требуется примерно 1-2 недели, а клинический эффект пульс-терапии сохраняется от 4 до 12 и более недель.
Основные показания к назначению пульс-терапии («мега-дозы» ГКС) являются критические жизнеугрожающие состояния, тяжелое течение заболеваний, если они не контролируются среднетерапевтическими дозами ГКС, невозможность снизить поддерживающую дозу и наличие рефрактерности к предшествующей терапии.
Пульс-терапия может проводиться по классической схеме. При этом метипред в дозе 1000 мг вводится внутривенно капельно в 250-500 мл изотонического раствора глюкозы или физиологического раствора в течение 1-3 ч., суммарная курсовая доза 1-3 г, либо одновременно с введением 1000 мг циклофосфана (ЦФ) внутривенно капельно в первые сутки лечения. Для предотвращения тромбоэмболических осложнений рекомендуется добавить в капельницу 5000—10000 ЕД гепарината натрия. В ряде случаев дополнительно показано применение плазмафереза перед введением ГКС. Показано, что однократное введение высоких до ГКС обычно не ведет к развитию тяжелых побочных эффектов. Применение ГКС в течение нескольких дней, как правило, также не сопровождается развитием тяжелых побочных реакций.
Классический вариант пульс – терапии при ИАС приводит к быстрому и значительному снижению воспалительного процесса в периферических суставах и в меньшей степени – в позвоночнике. Но положительный эффект держится небольшой период, и уже спустя 3 месяца показатели воспалительной активности достигают прежнего уровня. Применение высокой (1000) и низкой (375) дозы метилпреднизолона на протяжении 1 – 3 суток способствует достоверному уменьшению интенсивности боли и увеличению подвижности в поясничном отделе позвоночника. Кроме того, лечение сверхвысокими дозами способствует более продолжительной ремиссии по сравнению с лечением низкими дозами.
Локальная терапия ГКС применяется при лечении воспалительных поражений суставов и патологии мягких тканей с 1951 года, когда J. Hollander et al. впервые ввели гидрокортизон в коленный сустав больного РА. Накопленный за эти годы опыт подтвердил противовоспалительный и анальгезирующий эффект локальной терапии, а также безопасность повторных инъекций препаратов. Эффективность локальной терапии ГКС зависит от целого ряда факторов, к которым следует отнести корректную оценку показаний и противопоказаний, правильный выбор препарата, его дозировки, и, наконец, техники проведения манипуляции и строгого соблюдения правил асептики и антисептики. Клинический эффект при внутрисуставном введении ГКС сопровождается уменьшением синовиального объема и признаков воспаления. Одним из показаний для локальной терапии ГКС является ИАС.
В тоже время следует учитывать, что внутрисуставное введение ГКС противопоказано при наличии у больных инфекционного артрита, бактериемии, периартикулярного целлюлита с изъязвлением, остеомиелита, инфекционного эндокардита, асептического некроза в прилежащих эпифизах, неконтролируемого кровотечения, гиперчувствительности к лекарствам. С осторожностью следует применять ГКС у пациентов с гемартрозом, при нестабильности суставов, сахарном диабете, на фоне проведения антикоагулянтной терапии, при отсутствии эффекта от предшествующих 2-х инъекций.
Локальное применение ГКС при ИАС более эффективно по сравнению с системным применением препаратов. Положительный эффект ГКС в большей степени направлен на подавление воспалительного процесса в периферических суставах, чем в позвоночнике. Хороший эффект дает локальное применение пролонгированных ГК (например, бетаметазон) у больных с персистирующим синовитом или упорными энтезитами. Предпринимаются успешные попытки введения локальных ГК в крестцово-подвздошные суставы под контролем магнитно-резонансной или компьютерной томографии, при этом удается получить ремиссию до 7-9 месяцев.
При длительном применении ГКС следует учитывать их переносимость. Поддерживающая доза преднизолона для длительного системного применения при ИАС обычно не превышает 10-15 мг в сутки. При коротких курсах гормонотерапии (до 1 месяца) серьезных побочных эффектов практически не бывает. У ряда больных может отмечаться повышение аппетита, прибавка массы тела, округление лица, повышение возбудимости, резкие перепады настроения, бессонница, эйфория, появление акне. Иногда, преимущественно у больных, страдающих гастритами с повышенной кислотностью или язвенной болезнью в анамнезе, появляются тяжесть и боль в эпигастральной области, изжога. Это может быть связано с развитием медикаментозного эрозивного гастродуоденита.
При длительном применении ГКС, особенно в суточных дозировках, превышающих 30 мг, частота побочных эффектов может существенно возрастать. Первый тип осложнений связан с гиперкортицизмом и развитием синдрома Яценко-Кушинга, который проявляется в виде задержки натрия и жидкости в организме, усиления выведения калия, лунообразного округления лица и нарушений жирового обмена (ожирение), гипертрихоза, появления акне, астенизации.
Нарушения обмена воды и натрия приводит к появлению отеков, артериальной гипертонии. Возможно также развитие психических нарушений от эйфории до бессонницы, резкие изменения настроения, развитие выраженной депрессии и явных психических проявлений (эпилептиформные судороги, изменения личности).
У ряда больных отмечается развитие сахарного диабета, связанного с нарушением утилизации глюкозы тканями и функциональной недостаточностью инсулярного аппарата поджелудочной железы. Возможны нарушения менструального цикла и бесплодие у женщин.
Ульцерогенное действие ГКС проявляется развитием язв, чаще всего в 12-перстной кишке, реже в желудке и, гораздо реже, в других отделах кишечника. Распознавание «стероидных» язв нередко представляет значительные трудности для диагностики ввиду подавления гормонами воспалительной реакции и незначительной выраженности болевого синдрома.
При применении глюкокортикостероидов у ряда больных вследствие повышенного катаболизма белков развиваются атрофии мышц и кожи (стрии), миокардиодистрофия, отмечаются нарушения роста хрящевой ткани и костной ткани, замедление скорости заживления ран, возникают остеопорозы и патологические переломы костей.
Гормонотерапия вследствие иммунодепрессивного действия может вызвать обострение хронических инфекций, в том числе латентно протекающего туберкулеза, развитие оппортунистических инфекций и т.д.
Возможные осложнения длительной ГКС – терапии представлены в таблице №6.
|
Таблица №6. Возможные осложнения при длительной ГКС – терапии |
|
|
Костно-мышечные нарушения
|
|
|
Желудочно-кишечные нарушения
|
|
|
Метаболические нарушения
|
|
|
Нарушения со стороны ЦНС
|
|
|
Офтальмологические нарушения
|
|
|
Эндокринные нарушения
|
|
|
Сердечно-сосудистые и почечные осложнения
|
|
|
Подавление фиброплазии
|
|
|
Подавление иммунного ответа
|
|
При применении пульс-терапии возможно также развитие геморрагических панкреатитов (редко), глаукомы с последующей слепотой, повышение внутричерепного давления, увеличение риска возникновения тромбозов и тромбоэмболий.
Длительное (более 6 месяцев) применение ГКС вызывает угнетение функции коры надпочечников с подавлением биосинтеза гормонов и приводит в дальнейшем к атрофии коры надпочечников. При внезапном прекращении введения ГКС развивается синдром отмены, в виде обострения воспалительного процесса, а при длительных курсах – острая надпочечниковая недостаточность.
С целью профилактики побочных явлений, вызываемых ГКС, следует вводить в организм достаточное количество полноценного белка, калия до 1,5-2 г в сутки, ограничить употребление проваренной соли и жидкости. Необходимо постоянно следить за артериальным давлением, содержанием сахара. Среди препаратов для профилактики и лечения остеопорозов рекомендуют лососевый кальцитонин, длительный прием препаратов кальция, витамина Д3. Применение данных лекарственных средств позволяет снизить частоту и тяжесть осложнений ГКС – терапии, особенно связанных с нарушением кальциевого обмена.
Мидокалм (толперизон) является миорелаксантом центрального действия. Препарат оказывает мембраностабилизирующее действие, тормозит проводимость импульсов в первичных афферентных волокнах и двигательных нейронах. Торможение проводимости приводит к блокировке спинномозговых моно- и полисинаптических рефлексов. Так, в стволе мозга Мидокалм воздействует на проведение возбуждения по ретикулоспинальному пути. Он оказывает избирательное влияние на каудальную часть ретикулярной формации мозга, блокирует спиномозговые моно- и полисинаптические рефлексы. Препарат вторично тормозит выделение медиаторов путем торможения поступления Са2+ в синапсы. Мидокалм оказывает также местноанестезирующее действие. Усиливает периферический кровоток независимо от влияния на ЦНС. В развитии этого эффекта большую роль играет центральное Н-холиноблокирующее действие, наличие слабой спазмолитической и сосудорасширяющей активности.
Мидокалм назначается при наличии выраженной ригидности, повышенного тонуса и мышечных спазмов, а также мышечных контрактур. В большинстве случаев Мидокалм применяется внутрь. Препарат быстро всасывается из желудочно-кишечного тракта и его действие начинается спустя 30 мин. после приема. Лечение следует проводить при выраженной утренней скованности или наличии яркого спастического синдрома.
Мидокалм при лечении ИАС, применяется с целью купирования боли вертеброгенного происхождения. Препарат прерывает патологическую рефлекторную дугу и разрывает порочный круг, возникающий при хронической боли. В результате вазодилатации и улучшения микроциркуляции в спазмированных, ишемизированных мышцах препарат уменьшает выраженность отеков, устраняет дисбаланс кининов и повышает порог болевой чувствительности.
У большинства больных ИАС Мидокалм назначают в суточной дозе 100-150 мг. Суточная доза в ряде случаев может быть увеличена до 450 мг в сутки: по 150 мг в три приема в течение дня. Более быстрый и отчетливый эффект наблюдается при внутримышечном введении препарата. Мидокалм характеризуется хорошей переносимостью и может применяться на протяжении ряда месяцев без нарастания токсичности. В комбинации с НПВС возможно уменьшение дозы последних, в результате чего снижается риск развития побочных эффектов НПВС.
Болезнь-модифицирующие (БМАРП) антиревматические препараты (препараты, модифицирующие заболевание, медленно действующие препараты, иммунотропные препараты) активно вмешиваются в течение ХВЗС. Они уменьшают выраженность суставного синдрома, включая боли и экссудативный компонент воспаления, снижают лабораторные показатели активности и улучшают функцию пораженных суставов. Но самое важное их свойство заключается в том, что они тормозят иммунологические проявления заболевания и активно влияют на темпы прогрессирования костно-хрящевой деструкции. БМАРП способны вызвать частичную или полную клинико-лабораторную ремиссию заболевания. Эти препараты обладают кумулятивным действием, и при их приеме лечебный эффект наступает медленно (спустя 1-6 мес. от начала терапии). В тоже время при их отмене длительно (на протяжении ряда месяцев и даже лет) сохраняется отчетливое улучшение.
БМАРП должны назначаться всем больным с ХВЗС сразу же после верификации диагноза. Их применение показано при наличии яркой субъективной и объективной симптоматики: полиартрита или спондилоартрита в сочетании с системными проявлениями, включая генерализованный васкулит, синдром Фелти или синдром Стилла, при высоких концентрациях острофазовых белков и сохранении активности воспалительного процесса на протяжении трех и более месяцев.
Эффективность терапии БМАРП при серонегативных спондилоартритов (ССА), недостаточная, а оценка ее эффективности во многом затруднена. Такая терапия, в первую очередь, показана больным ИАС с умеренной и высокой активностью воспалительного процесса, развитием рефрактерности к НПВС и ГКС или при наличии серьезных побочных реакций на эти препараты, а также больным с факторами риска дальнейшего неблагоприятного течения заболевания.
БМАРП должна проводиться всем больным ИАС с целью предотвращения прогрессирования структурных изменений в суставах и позвоночнике или снижения темпов такого прогрессирования. При ИАС важным аспектом является раннее назначение БМАРП, т.к. известно, что формирование синдесмофитов и анкилозов межпозвонковых и реберно-позвонковых суставов особенно активно происходит вначале заболевания (первые 2 года болезни).
Спектр препаратов для проведения БМАРП у больных ИАС ограничен. В частности, неэффективными или малоэффективными при лечении ИАС оказались хинолиновые производные, Д-пеницилламин, соли золота. Низкая терапевтическая активность и высокая токсичность азатиоприна является поводом к прерыванию лечения у 68% больных (по данным двойного слепого контролируемого исследования).
В качестве базисного препарата при лечении ИАС широко используется сульфасалазин. По химическому строению он является азосоединением сульфапиридина (сульфидина) с салициловой кислотой. Противовоспалительный эффект препарата обусловлен сульфапиридином. Механизм действия сульфасалазина не совсем ясен. Предполагают, что он обладает умеренным антипролиферативным и иммуносупрессивным действием. В частности, он является антагонистом фолиевой кислоты, подавляет синтез фактора некроза опухоли, и, посредством индукции апоптоза макрофагов, ингибирует ядерный фактор транскрипции. Ядерный фактор транскрипции регулирует транскрипцию генов многих медиаторов, принимающих участие в иммунном ответе и воспалении. Недавно был опубликован анализ многочисленных контролированных 36-недельных исследований по изучению эффективности сульфасалазина у 619 больных серонегативными спондилоартритами, из них 264 – больные ИАС. Среди больных серонегативными спондилоартритами (ССА) у 187 была центральная форма заболевания и у 432 – периферическая. Была показана высокая эффективность сульфасалазина при наличии у больных периферического артрита и меньшая – при воспалительном процессе в позвоночнике. Из этого следует, что сульфасалазин должен применяться при периферической или ризомелической форме ИАС и преимущественно у больных с небольшой давностью заболевания. Имеющиеся в настоящее время данные свидетельствуют о клинической эффективности сульфасалазина (2 мета – анализа) при ССА. В первом мета анализе: сульфасалазин уменьшал интенсивность боли – на 27%, продолжительность утренней скованности – на 28%, выраженность утренней скованности – на 30%, улучшалось общее самочувствие – у 7% пациентов, отмечалось снижение СОЭ – на 9% в сравнении с плацебо. Был сделан вывод о безопасности и эффективности препарата для кратковременного (непродолжительного) лечения идиопатического анкилозирующего спондилоартрита. Это исследование было проведено на 272 пациентах, что недостаточно для длительного большого рандомизированного исследования. Второй мета-анализ посвящен 11 рандомизированным контролируемым исследованиям с хорошей статистикой, из которых 8 являлись двойными плацебоконтролируемыми исследованиями и включали 895 пациентов с ССА. Сроки наблюдения при лечении салазопирадазином составляли обычно 6 месяцев, в ряде исследований – от 12 недель до 3 лет. Статистически достоверным явилось снижение СОЭ утренней скованности по шкале 100 на 13,9 пунктов в сравнении с плацебо. В тоже время улучшения по функциональным способностям (подвижность позвоночника, спинальная скованность, боль) и общему самочувствию не наблюдалось. Это совпадало с большими по обьему и более продолжительными исследованиями, которые показали улучшение у пациентов с периферическими артритами – на 30,2%. Только одно исследование показало эффект при наличии болей в спине, экскурсии легких, пробы затылка, и общему самочувствию. Был сделан вывод о том, что на ранней стадии при идиопатическом анкилозирующем спондилоартрите (болезнь Бехтерева – ББ) у пациентов с высоким СОЭ и периферическим артритом сульфасалазин являлся эффективным.
В последних вышедших рекомендациях ASAS/EULAR подчеркивается, что сульфасалазин не оказывает влияние на спинальные эффекты, но может применяться при периферическом артрите у больных с идиопатическим анкилозирующим спондилоартритом (болезнь Бехтерева – ББ). Были предприняты попытки использовать при лечении ИАС месалазин, который имеет меньше нежелательных (побочных) эффектов, чем сульфасалазин. Месалазин является препаратом 5-аминосалициловой кислоты. Опубликованы результаты рандомизированного контролируемого исследования, которое проводилось на 90 больных с идиопатическим анкилозирующим спондилоартритом. Пациенты были разделены на 3 группы: 1-группа пациентов получала 5-аминосалициловую кислоту в дозе 800 мг в сутки в виде таблетированного препарата Asacol, 2-ая группа – сульфапиридин (1,25 г в сутки), 3-ья группа – сульфасалазин (2г в сутки). Срок наблюдения – 26 недель. Отмечена более высокая эффективность при назначении сульфасалазина и сульфапиридина. Месалазин не вызвал улучшения ни по одному из контролируемых параметров. Напротив, другое открытое исследование, продолжавшееся в течение 16 недель с использованием Pentasa (1500 г/с) показало клиническую эффективность препарата в виде уменьшения утренней скованности, функционального индекса Дугласа, отмечалось улучшение самочувствия и снижение СОЭ у 29 из 30 пациентов. Улучшение было достигнуто как у пациентов с наличием болей в шейном отделе позвоночника, так и при болях, связанных с поражением периферических суставов, энтезитами. Открытое исследование также показало положительные результаты у 20 пациентов с активным спондилоартритом, которые перешли с лечения сульфасалазином на месалазин. Другая группа пациентов из 19 пациентов получала месалазин без предварительного лечения сульфасалазином. В первой клинической группе положительный результат был достигнут – у 85%, во второй группе – у 89% пациентов. В первой группе статистически значимого эффекта на СОЭ отмечено не было, во второй СОЭ снизилось в среднем на 3 мм. Побочные эффекты при применении месалазина наблюдались редко. По контрасту с этим исследованием, в другом 24 – недельном открытом исследовании у 24 пациентов с ИАС с использованием месалазина (Салофальк) в больших дозах 2-4 г/сут. отмечалась низкая эффективность с большим количеством побочных эффектов. Месалазин не давал эффекта ни по BASDAI, BASFI, BASMI, ни по улучшению общего самочувствия. Статистически достоверно снижалась СОЭ. Побочные эффекты: со стороны ЖКТ (тошнота, боли в животе, диарея) наблюдались у 20 больных (75% больных), у 4 – неврологические симптомы (головокружение, головная боль). У 1 пациента развился тубулоинтерстициальный нефрит. Таким образом, в данном исследовании не было получено подтверждения, что месалазин обладает большей эффективностью и безопасностью, чем сульфосалазин.
Метотрексат является «золотым» стандартом в лечении РА, однако эффективность его при идиопатическом анкилозирующем спондилоартрите изучена недостаточно. Оценка эффективности метотрексата при терапии ИАС проводилась лишь в открытых испытаниях на небольшом клиническом материале. В исследовании Samhaio-Barros P.D. и соавт. приводятся результаты лечения метотрексатом 34 больных ИАС. Препарат назначался внутримышечно по 12,5 мг в неделю на протяжении года. Все больные были рефрактерны к терапии НПВС. К концу наблюдения у 53% больных зафиксировано снижение СОЭ – на 25% и более, а также уменьшение суточной потребности в НПВС – на 50% по сравнению с исходным уровнем. Препарат активно воздействовал на проявления периферического артрита, но не спондилита. В другом исследовании получен хороший эффект лечения метотрексатом при его назначении по 7,5 мг в неделю в течение 3 лет. Такая терапия привела к восстановлению функциональной недостаточности опорно-двигательного аппарата, существенному снижению СОЭ и СРБ. Некоторые авторы полагают, что если у больных отмечается отсутствие эффекта при применении НПВС и сульфасалазина, то они не будут отвечать и на терапию метотрексатом. В настоящее время отсутствуют многоцентровые контролируемые исследования по изучению эффективности метотрексата при ИАС ввиде монотерапии, так и в комбинации его с сульфасалазином, не изучены эффекты лечения высокими дозами метотрексата, в качестве составной части интенсивной терапии тяжелого ИАС.
Одним из направлений БМАРП при ИАС является применение бисфосфонатов. Бифосфонаты обладают высоким сродством к минеральным компонентам костной ткани. Они подавляют активность остеокластов и уменьшают опосредованную ими резорбцию костной ткани. На модели ревматоидного артрита было показано, что бифосфанаты обладают противовоспалительным потенциалом.
Эффективность памидроната у больных ИАС доказана как в открытых, так и в рандомизированных двойных слепых исследованиях. Лечение этим препаратом по 60 мг в месяц внутривенно на протяжении 4 месяцев приводит к достоверному снижению воспалительной активности и улучшению функции суставов и позвоночника (по показателю индекса BASDAI и BASFI, уменьшению числа воспаленных и болезненных суставов – на 93,8% и 98,2% соответственно), а также значительному снижению СОЭ. После отмены препарата его положительное действие длится еще на протяжении 4 месяцев. В настоящее время нет убедительных данных о том, что памидронат влияет на структурные изменения при ИАС и обладает болезнь-модифицирующим действием.
Коррекция терапии ИАС необходима при наличии системных проявлений. В частности, развитие вторичного амилоидоза требует назначения колхицина. При хорошей переносимости их следует применять по 1,0 мг 2 раза в день. При лечении острого переднего увеита препаратом выбора является дексаметазон, который вводится субъконьюнктивально. Лечение должно проводиться совместно с окулистом. Развитие миокардиопатия сопровождается тяжелыми нарушениями проводимости по типу блокад 2 и 3 степени, что диктует необходимость назначения (ß-стимуляторов, ГКС, а в некоторых случаях- имплантации кардиостимулятора). При рестриктивной или (реже) обструктивной дыхательной недостаточности важным является установление причины ее развития, исключение возможности нежелательных (побочных) реакций проводимой медикаментозной терапии, запрещение курения. Лечение рестриктивной дыхательной недостаточности, в основном, симптоматическое. При синдроме «конского хвоста» необходимо применение сверхвысоких доз метилпреднизолона, как единственно эффективного средства.
Наиболее существенным достижением ревматологии последнего десятилетия является внедрение в клиническую практику группы препаратов, объединяющихся общим термином – биологические» агенты («biologics»). В отличие от традиционных БМАРП, для которых характерны неспецифические противовоспалительные и/или иммуносупрессивные эффекты, биологические агенты оказывают избирательное (и более мощное) ингибирующее действие на синтез «провоспалительных» медиаторов воспаления.
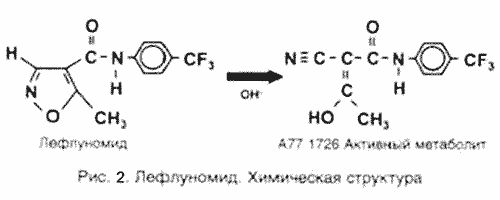
К числу новых перспективных препаратов относится лефлуномид (Arava, Aventis, Германия). После приема внутрь лефлуномид адсорбируется из ЖКТ – на 82-95%. По химической структуре лефлуномид представляет собой низкомолекулярное синтетическое производное изоксазола и является «пролекарством», которое в желудочно-кишечном тракте и плазме быстро превращается в активный метаболит малононитриламид (А77 1726) (рис. 1). А77 1726 связывается с белками плазмы более чем на 99% и имеет длительный период полувыведения Т1/2 (15-18 дней), что, как полагают, связано с интенсивной энтеропеченочной рециркуляцией. Связывание более вариабельно и несколько снижается у больных РА или при почечной недостаточности. Большая часть А77 1726 подвергается экскреции с мочой и калом. Химическая структура лефлуномида и его метаболита представлена на рис.2.
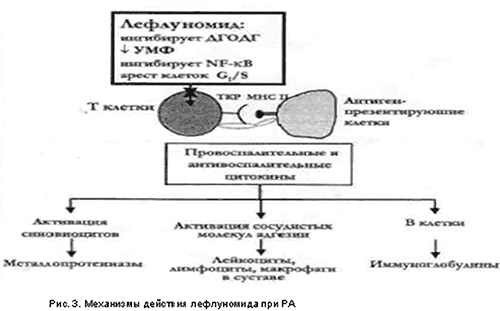
Лефлуномид обладает несколькими уникальными молекулярными механизмами, которые определяют его мощную противовоспалительную, антипролиферативную и иммуномодулирующую активность, и позволяют рассматривать его, как средство патогенетической терапии при ревматических заболеваниях (рис. 3).
Основной механизм действия: подавление синтеза пиримидиновых нуклеотидов (уридинмонофосфата – УМФ) в поздней фазе (G1) клеточного цикла. Синтез пиримидиновых оснований наиболее выражен в активированных Т-лимфоцитах, которые играют фундаментальную роль в иммунопатогенезе РА. Подавление синтеза пиримидиновых нуклеотидов связано с тем, что А77 1726 (активный метаболит) подавляет активность дигидрооротатдегидрогеназы (ДГОДГ) – основного фермента, регулирующего синтез пиримидинов в организме. При РА лефлуномид уменьшает число макрофагов и Т- клеток, инфильтрирующих синовию, подавляет экспрессию молекул адгезии, образование провоспалительных цитокинов и медиаторов деструкции суставов, таких как металлопротеаз. Имеются теоретические данные о возможности комбинированной терапии лефлуномидом и метотрексатом у больных РА, которые не отвечают на монотерапию лефлуномидом. Это связано с тем, что меторексат in vitro также тормозит вызванную митогенами пролиферацию и синтез ДНК Т-лимфоцитами путем подавления активности дегидрофолатредуктазы – фермента, регулирующего синтез пуринов.
При сравнении различных доз лефлуномида (5, 10, и 25 мг в день) установлено, что стабильный уровень в сыворотке А77 1726 достигается примерно через 24 дня и четко зависит от принимаемой дозы препарата. При приеме лефлуномида в дозе 20 мг/сут у большинства пациентов стабильная сывороточная концентрация А77 1726 составляла 35 мкг/мл, что соответствует достижению клинического эффекта. Дальнейшее увеличение дозы препарата обычно не приводит к нарастанию терапевтического эффекта. Сходные данные были получены в процессе двойного слепого контролируемого исследования (200 пациентов с РА получали лефлуномид 10 мг/сут, а 202 – 20 мг/сут), в котором было показано, что суточная доза лефлуномида 20 мг/сут была более эффективна, чем 10 мг/сутки. Поэтомурекомендуемая поддерживающая доза лефлуномида составляет 20 мг/сут, однако в случае развития побочных эффектов возможно временное снижение дозы до 10 мг/сут.
Быстрый клинический эффект при использовании «насыщающей» дозы (100 мг/сут в течение 3-х дней) коррелирует с достижением «терапевтического порога» в течение более короткого времени, чем при назначении лефлуномида в дозе 20 мг/сут. В тоже время при использовании этого режима дозирования существенно возрастает риск прерывания лечения из-за развития побочных эффектов и требуется тщательный мониторинг побочных реакций. Поэтому в настоящее время большинство ревматологов предпочитают не использовать «насыщающую» дозу 100 мг/сут., а начинать лечение лефлуномидом с 20 мг/сут (или даже 10 мг/сут). При этом более медленное нарастание клинического эффекта можно компенсировать путем кратковременного назначения низких доз глюкокортикостероидов.
Тем не менее, поиск оптимального режима дозирования лефлуномида является актуальным. Так, предварительные результаты свидетельствуют о целесообразности увеличения дозы лефлуномида до 40 мг/сут. при хорошей переносимости, но недостаточной клинической эффективности препарата в меньшей дозе. Изучается возможность интермитирующего назначения лефлуномида в дозе 100 мг в неделю, напоминающего схему применения метотрексата.
Клинический эффект даже при использовании «насыщающей» дозы лефлуномида нарастает постепенно и нередко достигает максимума только к 4-6 месяцев. Отсутствие тенденции к улучшению после начала лечения в течение первых 3-4 месяца свидетельствует о неэффективности монотерапии лефлуномидом и является основанием для выбора альтернативного метода терапии, например, комбинированной терапии с метотрексатом или другими БМАРП.
Результаты контролируемых исследований и пострегистрационного применения лефлуномида (более 80000 пациентов-год) свидетельствует о хорошем соотношении «польза – риск». Оценка безопасности препарата показала, что частота печеночной недостаточности составляет 14 на 100000 пациентов-год или 0,02%. Частота других тяжелых побочных эффектов (поражение ЖКТ, системы кроветворения, сердечно-сосудистой системы, со стороны обмена веществ, костно-мышечной системы, дерматологические проявления, аллергические реакции и др.), а также инфекционных осложнений такая же, как на фоне лечения другими БМАРП. Для снижения риска развития отдельных побочных эффектов разработаны рекомендации, которые суммированы в таблице №7. Необходимо детально информировать пациентов о характере побочных эффектов на фоне лечения лефлуномидом.
Для снижения риска развития побочных эффектов в процессе лечения лефлуномидом необходимо проводить тщательный лабораторный мониторинг (таблица №7).
|
Таблица №7. Побочные эффекты лефлуномида |
||
|
Побочные эффекты |
Частота |
Комментарии |
|
Желудочно-кишечные |
1-10% |
Противорвотные средства. Требуется снижение дозы. |
|
Нарушение функции печени |
1-10% |
Увеличение концентрации АЛТ, реже в сочетании с ACT (но не изолированное увеличение ACT). |
|
Аллопеция |
1-10% |
Снижение дозы или отмена (в зависимости от выраженности). |
|
Кожная сыпь |
1-10% |
Снижение дозы или отмена (в зависимости от выраженности); антигистаминные препараты. |
|
Дестабилизация артериальной гипертензии |
1-10% |
Коррекция антигипертензивной терапии. |
|
Гематологические
|
0,01-1% |
Прекратить лечение если:
|
|
Снижение веса |
0,01-1% |
|
|
Желтуха/печеночная недостаточность |
<0,01% |
Прекратить лечение. |
|
Тяжелое поражение слизистых оболочек; высокая лихорадка; распространенная кожная сыпь; ангионевротический отек; выраженная аллопеция. |
<0,01% |
Прекратить лечение; провести процедуру |
Как уже отмечалось, комбинированная терапия лефлуномидом и метотрексатом патогенетически хорошо обоснована. Это послужило основанием для проведения серии специальных клинических исследований, в подавляющем большинстве из которых лефлуномид назначали пациентам с РА, у которых монотерапия метотрексатом была недостаточно эффективна. По данным многоцентрового двойного слепого контролируемое исследование (n=263), в котором 130 пациентов (группа I) получали лефлуномид и метотрексат, а 133 получали метотрексат и плацебо (группа II). Через 24 недели клинический эффект в первой группе (46,2%) был достоверно выше, чем во второй (19,5%) (p<0,001). В открытой фазе этого исследования (длительность 24 недель), пациенты группы I продолжили прием метотрексата и лефлуномида, а пациентам II группы, вместо плацебо, был назначен лефлуномид. У пациентов I группы сохранялось улучшение, достигнутое в течение предыдущих месяцев комбинированной терапии, а у пациентов группы II наблюдалось нарастание эффекта до уровня, сопоставимого с тем, который имел место у пациентов первой группы. Частота побочных эффектов на фоне комбинированной терапии была примерно такая же, как и на фоне монотерапии, и постепенно снижалась в течение последующих 6 мес. терапии.
Сходные результаты были получены в открытом исследовании (продолжительность 40 недель), в котором оценивалась эффективность комбинированной терапии метотрексатом и лефлуномидом у пациентов с недостаточной эффективностью монотерапии лефлуномидом. В исследование вошло 103 пациента, которым в качестве «первого» БМАРП был назначен лефлуномид по стандартной схеме. Через 16 недель пациентам, у которых сохранялась активность заболевания, был назначен метотрексат (7,5-20 мг/сут) в течение последующих 24 недель. К концу 40-й недели эффективность лечения у пациентов, «ответивших» на монотерапию лефлуномидом, и у пациентов, получающих комбинированную терапию лефлуномидом и метотрексатом, была сходной.
Показанием к применению лефлуномида является РА, но в последние два года появились сообщения о возможности его применения при других ХВЗС, включая ИАС. Механизмы воспаления и деструкции суставов при ИАС еще недостаточно понятны. В биоптатах илеосакрального сочления у 32 пациентов с ИАС Т- клетки и макрофаги были доминирующими, что указывает на их важную роль в патогенезе данного заболевания. Кроме того, терапия, блокирующая фактор некроза опухоли при ИАС, снижает уровень цитокинов, продуцируемых Т- клетками, и уровень металлопротеаз в синовии. Исходя из этого, эффективность лефлуномида при идиопатическом анкилозирующем спондилоартрите ожидаема. Интересно, что концентрация металлопротеаз-3 в сыворотке выше при ИАС у пациентов с периферическим артритом по сравнению с пациентами, у которых имеются только спинальные симптомы. Эти данные указывают на возможный позитивный эффект лефлуномида в случаях ИАС с периферическим артритом.
Целью 6 месячного номерного открытого исследования явилась оценка потенциального терапевтического эффекта лефлуномида при высокой активном идиопатического анкилозирующего спондилита у 20 пациентов. Лефлуномид был назначен на 6 месяцев. Результаты оценивались по индексу активности (BASDAI), функциональными возможностями (BASFI), метрология по (BASMI), суставной счет, качество жизни по вопроснику (SF-36), боль по шкале ВАШ и CРБ. Первичной конечной точкой было снижение активности как уменьшение показателя активности по BASDAI –на 25% за 6 месяцев. Согласно полученным результатам 25% улучшение по BASDAI – у 5/20 (25%), 50% улучшение – у 4/20 (20%). Абсолютные значения статистически достоверно за 24 недели наблюдения индекса BASDAI в абсолютных цифрах от исходного уровня 4,9-4,3 не изменялись. Значимых изменений по BASFI, SF-36, СРБ, объективно по глобальным тестам не было. У 10 больных с периферическим артритом суставной счет снизился с 1,7 до 0,9 за 12 недель и до 0,2 за 24 недели. Данные были статистически достоверными. При терапии лефлуномидом получены положительные результаты только у больных ИАС с периферическими артритами. Улучшения аксиальных симптомов достигнуто не было. Лефлуномид был эффективен только у 5 (25%) пациентов. 50% пациентов не закончили исследования из-за неэффективности, развития побочных эффектов и отсутствия комплаентности.
Двойное слепое рандомизированное плацебо-контролируемое исследование лефлуномида при ИАС было посвящено изучению эффективности и безопасности лефлуномида в 24 недельном пилотном исследовании в сравнении с плацебо. Количество пациентов с активным ИАС, участвующих в исследовании – 45. Активным считался ИАС при Bath (индекс активности ИАС) ³ 4 (0-10), боли ³4 по визуально аналоговой шкале (0-10). Первичный эффект оценивался через 24 недели при 20% улучшении. Вторичный ответ оценивался по улучшению общего самочувствия, метрологический индекс, подсчет опухших суставов, СОЭ и СРБ. Больные были разделены на 2 группы демографически и клинически одинаковые по составу. Доля больных с 20% ответом значительно не отличалась: 27% – среди получавших лефлуномид и 20% – пациентов в группе плацебо (95% доверительный интервал – 32% до 19%). Значимой разницы в группах не было и по результатам вторичной оценки 11 пациентов выбыли из исследования из-за побочных эффектов, 3 – из-за отсутствия эффекта, 1 – из-за отсутствия комплаентности. Среди побочных эффектов наиболее часто встречались гастроэнтерологические проблемы и кожные поражения. Таким образом, лефлуномид не показал значительного клинического эффекта в сравнении с плацебо. Доля пациентов с 20% улучшением была выше у лефлуномида, чем плацебо, но статистически недостоверно. Результаты по вторичному ответу были сравнимы. Очень важно, что серьезных или неожиданных побочных эффектов не было. Таким образом, в первом, двойном, слепом, плацебо контролируемом исследовании лефлуномида при лечении ИАС не удалось показать эффективность лефлуномида в сравнении с плацебо.
Результаты, закончившегося недавно исследования RELIEF, (Rheumatoid Arthritis Evaluation of Leflunomide: Further Insights into its Efficacy) свидетельствовали о сходной эффективности и безопасности комбинированной терапии лефлуномидом и сульфасалазином при ИАС.
Обширный клинический опыт накоплен в отношении препарата (Ремикейд, фармацевтическая компания Шеринг-Плау) при ССА. Инфликсимаб представляет собой химерные моноклональные антитела к фактору некроза опухоли (ФНО)-α, который является одним из центральных медиаторов воспалительной реакции. При ИАС и других серонегативных спондилоартритов наблюдается дисбаланс между про- и противовоспалительными цитокинами, среди которых центральное место занимает ФНО-а. Braun J. и соавт. показали экспрессию ФНО-а и его мРНК в крестцово-подвздошных суставах при ИАС. Повышенный уровень этого цитокина обнаруживается и в плазме больных, причем его повышенные значения коррелируют с индексом активности ИАС (BASDAI). Эти данные дали основание к проведению антицитокиновой терапии при идиопатическом АС, тем более, что при этом заболевании также имеют место воспалительные изменения в кишечнике, сходные с теми изменениями, которые выявляются при болезни Крона. Именно при болезни Крона продемонстрирован высокий терапевтический потенциал ингибиторов ФНО-а.
В настоящее время проведено несколько открытых и плацебо-контролируемых, рандомизированных мультицентровых исследований по изучению эффективности инфликсимаба при лечении ИАС. Критериями включения пациентов в эти исследования было сохранение высокой активности процесса, несмотря на применение НПВС, ГКС, а в некоторых случаях – метотрексата и сульфасалазина. Анализ этих исследований показал, что эффективность препарата при ИАС и серонегативных спондилоартритах выше, чем при РА.
Положительная динамика в виде существенного уменьшения утренней скованности, болей в суставах и позвоночнике, вплоть до полного их прекращения наблюдается после введения инфликсимаба в дозе 5 мг/кг уже к концу первого дня и более ярко – на следующий день. На фоне лечения отмечалось снижение острофазовых показателей и улучшение параметров, отражающих качество жизни, наблюдалось замедление прогрессирования как периферического артрита, так и вероятно, поражения крестцово-подвздошных суставов и позвоночника. У 53% больных на 12 неделе лечения наблюдается снижение суммарного индекса активности BASDAI на 53% по сравнению с 9% в группе плацебо. К 48 неделе половина больных соответствовала 50% снижению критериев ASAS, что расценивается как индуцирование ремиссии заболевания. В эти критерии, разработанные Рабочей группой ASAS (Assessments in Ankylosing Spondylitis), входит оценка выраженности воспаления, интенсивности боли, функции локомоторного аппарата и глобальная оценка болезни пациентом, при этом должно быть улучшение не менее чем на 20% как минимум трех из четырех показателей и не допускается ухудшение ни одного из них.
На фоне проводимой терапии достоверно больше было больных с частичной ремиссией ИАС (по сравнению с группой плацебо). Инфликсимаб активно воздействовал на все проявления ИАС, включая положительное влияние на проявления спондилита, артрита, энтезита, острого переднего увеита, поражение кожи при синдроме SAPHO. Достигнутый результат лечения продолжался и после прекращения терапии инфликсимабом.
Предварительные результаты подтверждают эффективность локального введения инфликсимаба в область крестцово-подвздошных сочленений. Не случайно именно анкилозирующий спондилит стал вторым (после РА) официальным показанием для применения инфликсимаба в ревматологии.
Роль энтерогенной инфекции (Klebsiella pneumoniae и Escherichia coli) в качестве триггерной инфекции остается предметом дискуссии, а назначение антибиотиков на любом этапе развития ИАС, включая дебют заболевания, не дает положительного результата.