Просмотров: 84 932
Артриты, связанные с инфекцией. Лечение.
К.м.н., ассистент курса клинической фармакологии Дятчина Л.И.
Симптомокомплекс с поражением суставов как осложнение бациллярной дизентерии описал в V века Сеlius Avrelianus как «reumatismus intestinalis сum u1сеrа». В 1965 году А.И.Нестеровым был предложен термин «инфекционно-аллергический полиартрит» для обозначения артритов (артропатий), возникающих на фоне (или после) носоглоточной инфекции. В настоящее время по МКБ-10 инфекционно-аллергические, а также аллергические и поствакцинальные артриты относят к «постинфекционным». Термин «реактивный артрит» (РеА) впервые был предложен в 1969 году финскими исследователями Р. Аhvоnen, К. Siеvегs и К. Аhо, описавшими артрит при энтероколите иерсиниозной этиологии. При этом подразумевалось, что РеА — это асептический воспалительный процесс в суставе, при котором инфекционные агенты и их антигены отсутствуют. Использование современных методов иммунологического анализа и молекулярных технологий позволяет обнаружить в синовиоцитах у ряда больных РеА не только бактериальные антигены, но и микроорганизмы, способные к размножению (у некоторых больных удается определить бактериальную ДНК). Поэтому более точное определение РеА – это «артрит, ассоциированный с инфекцией». В современном понимании РеА – это иммунновоспалительное заболевание суставов, которое возникает во время или после кишечного или мочеполового воспалительного процесса (обычно не позже чем через 4-6 недель). Заболевание ассоциированно с антигенами гистосовместимости HLA B-27 и развивается преимущественно у генетически предрасположенных лиц. РеА является системным клиническим проявлением ассоциированной с ним инфекции, относится к группе спондилоартритов. Термин «реактивный артрит» в настоящее время считается общепринятым и используется в классификациях большинства стран. При этом выделяют эпидемическую форму заболевания, вызываемую иерсиниями, шигеллами, сальмонеллами и др., и спорадическую (венерическую), которая развивается при инфицировании Chlamidia trachomatis. Поэтому по этиологии выделяют постэнтероколитические и урогенитальные РеА. Болезнь Рейтера (БР, уретро-окулосиновиальный синдром) в настоящее время рассматривается как вариант РеА ассоциированный с хламидийной инфекцией. В тоже время синдром Рейтера может развиваться и после перенесенной кишечной инфекции. Понятие «реактивный артрит» иногда используют для определения артритов, развитие которых связано со стрептококковой, бореллиозной, бруцеллезной, вирусной и другими видами инфекций. Однако связь с НLА-В27 в этих случаях, как правило, отсутствует, не характерными являются спондилоартропатии, поэтому, согласно современной классификации, эти состояния не относятся к РеА. Классификафия РеА По этиологии:- постэнтероколитические (после перенесенной иерсиниозной, сальмонеллезной, кампилобактерной или шигеллезной инфекции);
- урогенитальные (хламидийные – Chlamidia trachomatis, уреаплазменные, микоплазменные).
- острые (в 10 – 15% случаев) – (длительность первичной суставной атаки менее 6 мес., затем симптомы бесследно регрессируют);
- затяжные (до 1 года);
- хронические (протекает без ремиссии, клинические проявления сохраняются свыше 1 года);
- рецидивирующие (с повторными суставными атаками, которые возникают спонтанно после ремиссии заболевания длительностью не менее 6 мес., в связи с обострением уретрита или хламидийной реинфекцией ).
- низкая (I);
- средняя (II);
- высокая (III);
- ремиссия (0);
- I – профессиональная способность сохранена;
- II – профессиональная способность утрачена;
- III – утрачена способность к самообслуживанию.
- Заболевания глаз (трахома) – серотипы от A, В, C;
- Поражения урогенитального тракта – серотипы D, E, F, G, H, I, J, К
- Лимфогранулема венерическая – серотипы L1 – L3
- Прямая или непрямая иммунофлюоресценция (ПИФ или НПИФ) с культурой клеток или ПЦР-анализ – при диагностики выраженных форм заболевания;
- ИФА для определения бессимптомных или осложненных форм хламидиоза обязательно в комплексе с культурой клеток или ПЦР.
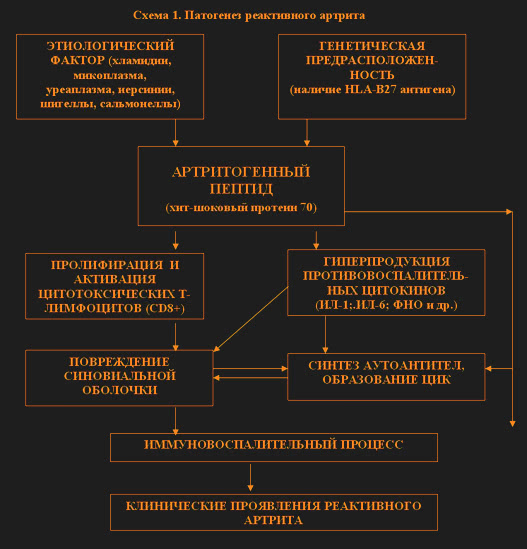 Таким образом, внутриклеточные микроорганизмы могут вызывать повреждение тканей как путем прямого токсического воздействия на клетку-хозяина (цитопатический эффект), так и за счет инициации гипериммунного ответа, который сам индуцирует повреждение тканей (нецитопатический эффект). При этом в отношении самого возбудителя – Chlаmidia trachomatis иммунные реакции оказываются неэффективными. Поэтому при РеА, вызванных Chlаmidia trachomatis, в синовиальных выстилках нередко выявляются жизнеспособные и метаболически активных хламидии.
Кроме того, белок теплового шока – 60 является одним из первых белков, которые синтезируются в организме женщины эпителиальными клетками decidua bazalis после оплодотворения. Поэтому нарушение репродуктивной функции при хламидийной инфекции обусловлено не только нарушением трубной проходимости в результате воспаления, но и специфическим аутоиммунным механизмом, препятствующим развитию плода.
В настоящее время в патогенезе РеА условно выделяют 3 фазы развития: фазу инициации, фазу острого РеА и фазу хронического РеА. В фазу инициации пациент подвергается воздействию провоцирующих бактерий. Клинически это проявляется в виде первичной инфекции (энтероколит или уретрит) с характерной симптоматикой. Полное излечение наблюдается у большинства больных, однако у некоторых развивается РеА. Для фазы острого РеА характерно возникновение периферического синовита. Спондилоартропатии развиваются в основном у носителей HLA-В27 антигена. В фазу хронического РеА, по-прежнему, сохраняется разделение между НLА-В27 положительными и HLА-В27-отрицательными пациентами, но у НLА-В27+ больных имеет место большая вероятность развития рецидивирующих форм заболевания. Кроме того, персистенция инфекции также способствует рецидивированию и хронизации суставного процесса при РеА. Возможна многолетняя персистенция хламидий в полости сустава и поражение ими клеток суставного хряща, которая поддерживает воспалительный процесс и делает малоэффективной стандартную противовоспалительную терапию артрита.
Патоморфология.
Морфологические изменения в синовиальной мембране в острой стадии напоминают инфекционный артрит: отек, гиперемия, инфильтрация нейтрофильными лимфоцитами. В хронических случаях имеется картина неспецифического синовита с умеренным скоплением лимфоидных и плазматических клеток. Синовиальная жидкость содержит от 10000 до 50000 клеток в 1 мл, среди них преобладают нейтрофильные лейкоциты, встречаются цитофагоцитирующие макрофаги, не обладающие какой-либо специфичностью, но названные в свое время «клетками Рейтера».
Терапия реактивных артритов
Принципы терапии РеА ассоциированного с инфекцией вытекают из механизма развития суставного синдрома. Во-первых, необходима санация инфекционного очага в желудочно-кишечном и/или урогенитальном тракте. Во-вторых, следует проводить патогенетическое лечение артрита, включающее в себя неспецифическую противовоспалительную терапию, применение базисных противоревматических средств, иммуномодуляторов и методов локальной терапии.
Требования, предъявляемые к «идеальному» антибиотику для лечения постэнтероколитических и урогенитальных инфекций, следующие:
1) высокая активность в отношении возбудителей (хламидий, уреаплазм, иерсиний и т.д.);
2) накопление препарата в высокой концентрации в тканях;
3) значительная внутриклеточная проницаемость;
4) простота и удобство применения, комплаентность;
5) безопасность применения;
6) экономическая доступность.
Антибактериальная терапия назначается после перенесенной острой кишечной или урогенитальной инфекции с учетом чувствительности к ним выделенных микроорганизмов.
При иерсиниозе используют левомицетин по 2 г/сут, гентамицин по 0,16—0,24 г/сут, тетрациклин по 0,8 г/сут. При шигеллезе применяют левомицетин, сульфаниламидные и нитрофурановые препараты, при сальмонеллезе — левомицетин. Следует отметить, что при лечении левомицетином необходим регулярный контроль показателей крови, так как препарат может вызывать лейкопению. Курс антибактериальной терапии строго индивидуальный и составляет в среднем 2—4 нед. Как правило, при длительной антибактериальной терапии одновременно с профилактической целью назначают противогрибковые препараты (нистатин, пимафуцин, низорал и др.).
Для санации инфекционного очага в урогенитальном тракте используются антибиотики, проявляющие активность в отношении хламидий и микоплазм. В отношении хламидий доказанную эффективность проявляют тетрациклины, макролиды, азалиды и фторхинолоны, в меньшей степени – хлорамфеникол, рифампицин. В отношении уреаплазм наиболее активны макролиды, азалиды и тетрациклины.
Тетрациклины – первая группа антибиотиков, которая стала применяться для лечения хламидиоза и уреаплазмоза. Препараты группы тетрациклина имеют широкий спектр антибактериальной активности, обладают бактериостатическим типом действия, механизм которого связан с нарушением синтеза белка в микробной клетке путем связывания с 30 S – субъединицей РНК рибосом.
Терапия тетрациклином в суточной дозе 1,5-2г в комбинации с нистатином на протяжении 4-6 недель приводила к положительной клинической динамике хламидийного артрита у подавляющего большинства больных. При этом длительное применение высоких суточных доз (до 2 г/сут) тетрациклина в свежих случаях болезни Рейтера давало значительно лучший лечебный эффект, чем при использовании относительно малых доз (до 1 г/сут).
При длительном приеме тетрациклина в высоких дозах нередко возникают побочные эффекты в виде анорексии, тошноты, рвоты, поноса, дисфагии, отмечается повышение активности печеночных ферментов в крови; появление папуллезной и эритематозной кожной сыпи и наблюдается повышенная чувствительность кожи к солнечному свету, проявляющаяся в чрезмерном загаре. Возможно развитие аллергических реакций в виде крапивницы, артралгии (суставная боль) и крайне редко – анафилактический (аллергического) шок. Учитывая возможность проникновения тетрациклинов через плаценту, а также в грудное молоко, они противопоказаны при беременности и в период лактации. Их не рекомендуется назначать детям до 8 лет, поскольку они могут вызвать замедление роста костей, изменение цвета зубов, гипоплазию эмали.
Доксициклин – полусинтетический антибиотик из группы тетрациклинов – был создан в 1967 г. и, по сравнению с тетрациклином, имеет ряд фармакокинетических преимуществ. В частности, доксициклин практически полностью всасывается в ЖКТ, и прием пищи и молочных продуктов меньше влияет на процессы всасывания препарата. У него более длительный, чем у тетрациклина период полувыведения (назначается 1–2 раза в сутки), и хорошее проникновение в различные ткани вследствие липофильности. Доксициклин выводится почками на 40%. В тоже время отсутствует кумуляции препарата в крови при нарушении функции почек, вследствие возрастания выведения его с калом и усиления метаболизма, что дает возможность применять доксициклин у больных с почечной недостаточностью. Благодаря своим особым фармакокинетическим свойствам, доксициклин реже дает побочные эффекты, поэтому препарат более безопасен, чем тетрациклин. При приеме доксициклина моногидрата (препарат «Юнидокс Солютаб») побочные эффекты встречаются еще реже, поскольку доксициклин моногидрат имеет нейтральную реакцию и не вызывает развития эзофагитов, часто встречающихся при применении других форм препарата. При этом диспергируемая форма обеспечивает максимальное удобство пациенту, так как таблетку можно разжевать, проглотить целиком, или растворить в небольшом количестве воды. Доксициклин нашел широкое применение при лечении болезней, передаваемых половым путем, в частности, для лечения больных с острым негонококковым уретритом препарат применяют по 100 мг внутрь дважды в сутки в течение 7 дней. Доксициклин и азитромицин являются препаратами первого ряда при лечении хламидийных инфекций, потекающих бессимптомно, особенно у женщин. Эффективность доксициклина в дозе 200 мг в сутки эквивалентна приему азитромицина в дозе 1 г внутрь однократно, но стоимость лечения азитромицином значительно выше, чем доксициклина. При приеме доксициклина эрадикация хламидий достигается в 100% случаев, а клиническая эффективность препарата составляет 98%. Доксициклин применяют в комбинации с другими антибиотиками (ампициллин/сульбактам, ципрофлоксацин, метронидазол) для лечения воспалительных заболеваний органов малого таза, а также у больных сифилисом при непереносимости β–лактамных антибиотиков.
В литературе имеются сообщения об успешном применении доксициклина у больных ревматологического профиля. Применение этого препарата в дозе 150 мг/сут в течение 3 мес. у больных ревматоидным артритом привело к явной положительной динамике по ряду показателей (суставной счет, интенсивность боли, определяемая по визуальной аналоговой шкале, снижение активности коллагеназы в слюне, различные психопатологические параметры). В ходе пилотного 6–месячного исследования, включавшего 23 больных ревматоидным артритом, эффективность доксициклина была сопоставима с таковой при лечении метотрексатом. Поэтому в настоящее время имеются достаточно веские доказательства, свидетельствующие о целесообразности применения тетрациклинов, в том числе доксициклина, в качестве базисных средств при лечении ревматоидного артрита и остеоартроза. Перспективность работ в данном направлении заслуживает серьезного внимания.
Эффективность других тетрациклиновых препаратов при ревматоидном артрите была изучена в серии клинических исследований. Наиболее демонстративными являются данные двух крупных, выполненных в двойном слепом режиме испытаний полусинтетического тетрациклинового антибиотика миноциклина (Миноцин) у 299 больных ревматоидным артритом. Показано, что назначение миноциклина по 100 мг внутрь дважды в сутки на срок от 24 до 48 недель приводило к статистически значимому улучшению ряда клинических и лабораторных параметров активности болезни (индекс Ричи, число воспаленных суставов, уровень гемоглобина, СОЭ, С-реактивный белок, IgM-ревматоидный фактор) по сравнению с группой больных, получавших индифферентные вещества. Данные результаты заслуживают серьезного внимания и свидетельствуют о явной перспективности работ в этом направлении. Препарат следует принимать за 1 ч до еды или через 2 ч после еды. Пациентам с выраженными нарушениями функции почек и/или печени необходимо назначать препарат в меньшей дозе.
Макролиды рассматриваются как препараты выбора в лечении урогенитального хламидиоза и уреаплазмоза. С этой целью наиболее часто применяются эритромицин, альтернативными препаратами считаются другие макролиды 2 поколения: мидекамицин (макропен), рокситромицин (рулид), спирамицин (ровамицин), джозамицин (вильпрофен). В качестве одного из наиболее безопасных антибиотиков рассматривается эритромицин, который, как и другие макролиды, обладает выраженной бактерицидной активностью в отношении хламидий и микоплазм, вызывающих воспалительные заболевания мочеполовой сферы. Способность макролидов накапливаться в высоких концентрациях в воспалительном очаге, в том числе в полости суставов, связана с тем, что они могут аккумулироваться фагоцитами, которые непосредственно доставляют их в ткани, где имеется воспалительный процесс, наличием «иммуномодулирующего» эффекта, проявляющимся увеличением хемотаксиса фагоцитов, постантибактериальной активностью. Вместе с тем, при энтеральном приеме эритромицина только около 4,5% от введенной дозы выводится в неизмененном виде почками. При внутривенном введении концентрация эритромицина в моче значительно выше, т.к. в этом случае до 15% дозы выводится почками в неизмененном виде. При неосложненом урогенитальном хламидиозе эритромицин назначается по 500мг 4 раза в сутки курсом 7 дней, при воспалительных заболеваниях органов малого таза, ассоциированных с хламидиозом или уреаплазмозом, продолжительность лечения увеличивается до 14 дней. Эритромицин обладает достаточно высокой эффективностью, обеспечивая эрадикацию и излечение больных в 83 – 95% случаев. Курс лечения эритромицином при урогенных артритах должен быть длительным – не менее 4-х недель. Однако в виду частого развития нежелательных реакций со стороны ЖКТ, которые наблюдаются у 38-58% пациенток, они нередко отказываются от его приема. Кроме того, высокая курсовая доза и необходимость 4-хкратного приема снижает комплаентность больных, ограничивает применение эритромицина.
Кларитромицин по своей активности в отношении C.trachomatis и U.urealyticum превосходит эритромицин примерно в 8 раз и обладает улучшенными фармакокинетическими характеристиками. Препарат быстро и полно всасывается в кишечнике, имея большой период полувыведения, длительно циркулирует в плазме в терапевтических концентрациях. Кларитромицин хорошо проникает в ткани с созданием высоких концентраций, значительно превышающих таковые в плазме крови. Препарат выводится с мочой в неизмененном виде (до 20% от введенной дозы). Имеется форма выпуска кларитромицина – СР 500 мг (таблетки медленного высвобождения), которые обеспечивают терапевтическую концентрацию при приеме 1 раз в сутки.
Кларитромицин обладает иммуномодулирующим действием, связанным с активацией моноцитарно-макрофагальной системы, Т-киллеров и ряда ферментов, участвующих в разрушении патогенных бактерий. В нескольких исследованиях была показана эффективность кларитромицина в лечении неосложненных острых уретритов и цервицитов хламидийной и уреаплазменной этиологии. В тоже время терапевтический эффект был гораздо ниже при уретритах смешанной этиологии. Кроме того, при применении кларитромицина отмечен факт нормализации соотношения провоспалительных и регуляторных цитокинов, что выражается в снижении уровней фактора некроза опухоли-α, интерлейкина-8, интерлейкина-6 и повышении уровня интерлейкина-10. Учитывая тот факт, что у пациенток с привычным невынашиванием беременности отмечается нарушение цитокининового баланса в сторону преобладания провоспалительных цитокининов, перспективным является использование данного препарата в качестве предгестационной подготовки у женщин с хроническим воспалительным процессом органов малого таза.
Европейские стандарты лечения хламидийной инфекции предусматривают применение в качестве альтернативного средства рокситромицина по 150мг 2 раза в день. Рокситромицин является 14-членным макролидом, по действию на C.trachomatis и U.urealyticum превосходит эритромицин, тетрациклин и доксициклин. Рокситромицин по степени кумуляции в нейтрофилах превосходит эритромицин и джозамицин. Он способен усиливать фагоцитоз нейтрофилов, ингибирует окислительный «взрыв», в процессе которого в фагоцитах резко нарастает продукция свободных радикалов. При этом отмечается улучшение показателей активности фагоцитов, их переваривающей способности и, в, конечном итоге – завершенного фагоцитоза. Противовоспалительная активность рокситромицина связана с его антиоксидантными свойствами и способностью ингибировать выработку провоспалительных цитокинов – интерлейкина-3, интерлейкина-4, фактора некроза опухоли-α. По выраженности противовоспалительного эффекта он превосходит кларитромицин и азитромицин. Препарат хорошо накапливается в тканях предстательной железы, миометрия, эндометрия. С мочой в неизмененном виде выделяется до 10% препарата. Длительный период полувыведения позволяет назначать препарат в дозе 300 мг 1 раз в сутки. Показана высокая эффективность этого препарата в лечении урогенитальных инфекций. В частности, при негонорейных уретритах рокситромицин применяется в суточной дозе 300мг, продолжительность лечения до 10 дней. Клиническая эффективность при хламидийных уретритах – 75-100%.
Учитывая тот факт, что урогенитальные артриты требуют более длительной антибактериальной терапии, может быть рекомендован повторный курс лечения рокситромицином с интервалом в 5-7 дней. Значительным преимуществом этого препарата является его хорошая переносимость при применении, как у взрослых, так и у детей. Нежелательные реакции развиваются у 3-4% пациентов преимущественно в виде диспептических явлений – боли в животе, тошнота, диарея. Изредка отмечаются головная боль, головокружения, сыпь, лимфопения, эозинофилия, обратимые изменения трансаминаз.
Была также показана высокая эффективность спирамицина (ровамицина) в комплексной терапии урогенитального артрита (Белов Б.С., 1997). Предложены две равнозначные схемы лечения: 1) 6 млн МЕ внутривенно + 3 млн МЕ per os ежедневно в течение 3-х дней, затем по 9 млн МЕ per os в течение 25 дней; 2) 9 млн МЕ per os ежедневно в течение 28 дней.
При соблюдении данных схем лечения хламидийного артрита спирамицином положительная динамика клинических проявлений заболевания наблюдалась у большинства больных, однако эрадикация хламидий при повторном бактериологическом контроле наступила только в 68% случаев. Кроме того, у 8% пациентов отмечались побочные реакции в виде парестезии, развития анемии, аллергического дерматита. Хотя in vitro спирамицин проявляет меньшую, чем эритромицин, активность против C.trachomatis и U.urealyticum, однако его высокая эффективность при лечении РеА, по-видимому, объясняется более высокой концентрацией в моче при внутривенном введении, а также тем, что препарат не взаимодействуют системой цитохромов Р445-Р455. Спирамицин активно проникает внутрь клетки, накапливается в высокой концентрации в тканях половых органов и оказывает длительный постантибиотический эффект. Препарат может применяться у беременных.
Показан хороший клинический эффект макролидов в лечении урогенитальных артритов у детей. В частности им рекомендуется проводить два 7-дневных курса мидекамицина (Макропена) с интервалом в 5 дней (Коровина Н.А. и соавт., 1997). Такая схема по своей эффективности не уступает месячному курсу лечения доксициклином при лечении артритов, ассоциированных с хламидийной инфекцией у детей.
Оценивая эффективность макролидов в лечении урогенитальных артритов, необходимо остановиться на отдельной группе этих препаратов – азалидах, которая представлена азитромицином (Сумамед). В настоящее время азитромицин рассматривается как ведущий препарат, которому отдается предпочтение в лечении урогенитального хламидиоза и уреаплазмоза. Высокий клинический эффект азитромицина во многом обусловлен его фармакокинетическими особенностями, в частности, 1) высокой биодоступностью (не разрушается под действием желудочного сока); 2) высокой липофильностью (концентрация препарата в тканях в десятки и, даже сотни раз, выше, чем в плазме крови); 3) длинным периодом полувыведения – до 3-х суток; 4) высокой внутриклеточной аккумуляцией; 5) более длительным постантибиотическим эффектом.
Благодаря тому, что азитромицин активно аккумулируется в фагоцитах, он переносится ими в очаг воспаления. Концентрация азитромицина в тканях после однократного приема дозы 1 г сохраняется достаточно высокой в течение 10 дней. Важным преимуществом препарата является его хорошая переносимость: частота побочных эффектов не превышает 6%. Среди побочных эффектов преобладают диспептические нарушения. Это делает возможным широкое применение азитромицина в педиатрической и акушерско-гинекологической практике при лечении урогенитального хламидиоза и уреаплазмоза. Многочисленными контролируемыми исследованиями показано, что однократный прием 1г азитромицина приводит к эрадикации хламидий и уреаплазм в 85-100% случаев при остром неосложненном воспалительном процессе. При хроническом урогенитальном хламидиозе применяется курсовая доза 3г по схеме: 1г однократно в 1-й день, затем по 0,5 г в течение последующих 4-х дней. Эрадикационная эффективность азитромицина превосходит таковую при курсовом лечении доксициклином, тетрациклином, эритромицином. В терапии урогенитальных артритов требуются более высокие курсовые дозы азитромицина: 9-12 г в течение 26 дней с различными интервалами. Поэтому несомненный интерес представляют исследования, в которых антибактериальные препараты при лечении урогенитального хламидиоза при РеА применяются прерывистыми курсами,
Эволюция антибиотикочувствительности микоплазм с 2001по 2003 годы показывает рост числа резистентных штаммов к азитромицину, рокситромицину, клиндамицину. В тоже время частота антибиотикоустойчивости к джозамицину, доксициклину и миноциклину не изменилась. Поэтому сравнительные рандомизированные исследования фторхинолонов нового поколения (гатифлокацин, левофлоксацин, моксифлоксацин и др.) с большей в сравнении с ципрофлоксацином и офлоксацином активностью в отношении хламидий и микоплазм, являются актуальными. По активности в отношении хламидий новые фторхинолоны сравнимы с макролидами, а в отношениии микоплазм и уреаплазм столь же эффективны как тетрациклины. Подтверждена эффективность фторхинолонов нового поколения в терапии урогенитального хламидиоза, у лиц, страдающих воспалительными заболеваниями мочеполовой системы с профилактической целью, что представляется особенно важным для комплексной терапии РеА. При лечении неосложненных форм воспалительных заболеваний органов малого таза у женщин моксифлоксацин применяется по 400 мг 1 раз в сутки курсом 14дней. По своей эффективности препарат был равен комбинации ципрофлоксацина (500мг оджнократно), доксициклина 100 мг 2 раза в сутки и метронидазола 500 мг 3 раза в сутки в течение 14 дней при сравнимой эффективности микробиологической эффективности соответственно 92.5% и 88,2%.
Побочные эффекты являются типичными для всех представителей фторхинолонов (встречаются у 27,4% пролеченных больных): 1) со стороны центральной нервной системы – головокружение, рассеянность внимания, головная боль; 2) со стороны желудочно-кишечного тракта – сухость и «металлический» привкус во рту, чувство дискомфорта в эпигастрии, тошнота; 3) явления фотосенсибилизации и кожная сыпь с зудом. Кроме того, частота их возникновения может зависеть от совместного применения с другими лекарственными препаратами, которые также используются при лечении РеА, в частности с НПВП. Вследствие выраженности побочных эффектов препараты были отменены у 3,8% больных.
При лечении хламидиозной инфекции при беременности рекомендованы следующие препараты: эритромицин 500мг 4 раза в день 7 дней, амоксициллин 500 мг внутрь 3 раза в сутки 7 дней или джозамицин 750 мг 2 раза в сутки в течение 7 дней.
Амоксициллин является полусинтетическим антибиотиком из группы пенициллинов широкого спектра действия. Применение пенициллинов во время беременности имеет почти 50-летнюю историю, поэтому безопасность их не вызывает сомнений. Амоксициллин не обладает нефро- и гепатотоксическим действием. Пенициллины не действуют на C. Trachomatis, но могут частично проникать внутрь клетки,где их концентрация составляет 60% от концентрации в плазме крови. Тем не менее, в сравнительном исследовании азитромицина с 7-дневный курсом лечения амоксициллином по 500мг 3 раза в сутки были показаны сходные результаты, как в оценке эффективности, так и переносимости. Рекомендации CDC (Атланта, США) состоят в применении амоксициллина в случае неэффективности лечения эритромицином.
С 2001 г. Европейское руководство по лечению инфекций, передающихся половым путем, предусматривает применение джозамицина для лечения хламидийной инфекции у беременных. Молекула джозамицина имеет 16-членное лактонное кольцо. Джозамицин обладает менее выраженными нежелательными реакциями по сравнению с другими макролидами, так как он не связывается с цитохромами Р445 –Р455 и не угнетает их активность. Поэтому препарат не имеет побочных эффектов со стороны ЖКТ и не оказывает гепатотоксического действия. Джозамицин после приема быстро распределяется в тканях, а также в макрофагах периферической крови. Его способность проникать внутрь клетки в 20 раз выше, чем во внеклеточном пространстве. Высокая эффективность при лечении хламидийной инфекции у беременных достигается при применении препарата в дозе 750мг 2 раза в сутки 7 дней.
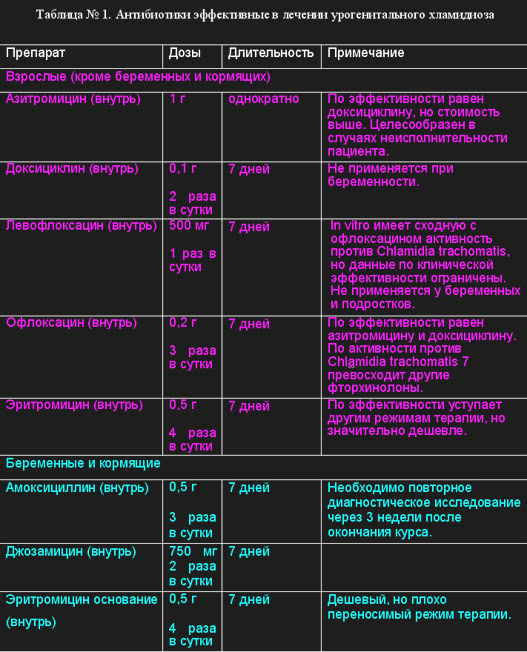
В настоящее время федерального протокола лечения хламидиоза не существует, связи с чем, используется шаблон комплексного лечения, который включает применение 2-3 антибактериальных препаратов, интерферонов, иммуномодуляторов, «системной энзимотерапии», антиоксидантов и витаминов. Антибиотики эффективные в лечении неосложненных форм уретрального, цервикального и ректального хламидиоза представлены в таблице №1.
Таким образом, внутриклеточные микроорганизмы могут вызывать повреждение тканей как путем прямого токсического воздействия на клетку-хозяина (цитопатический эффект), так и за счет инициации гипериммунного ответа, который сам индуцирует повреждение тканей (нецитопатический эффект). При этом в отношении самого возбудителя – Chlаmidia trachomatis иммунные реакции оказываются неэффективными. Поэтому при РеА, вызванных Chlаmidia trachomatis, в синовиальных выстилках нередко выявляются жизнеспособные и метаболически активных хламидии.
Кроме того, белок теплового шока – 60 является одним из первых белков, которые синтезируются в организме женщины эпителиальными клетками decidua bazalis после оплодотворения. Поэтому нарушение репродуктивной функции при хламидийной инфекции обусловлено не только нарушением трубной проходимости в результате воспаления, но и специфическим аутоиммунным механизмом, препятствующим развитию плода.
В настоящее время в патогенезе РеА условно выделяют 3 фазы развития: фазу инициации, фазу острого РеА и фазу хронического РеА. В фазу инициации пациент подвергается воздействию провоцирующих бактерий. Клинически это проявляется в виде первичной инфекции (энтероколит или уретрит) с характерной симптоматикой. Полное излечение наблюдается у большинства больных, однако у некоторых развивается РеА. Для фазы острого РеА характерно возникновение периферического синовита. Спондилоартропатии развиваются в основном у носителей HLA-В27 антигена. В фазу хронического РеА, по-прежнему, сохраняется разделение между НLА-В27 положительными и HLА-В27-отрицательными пациентами, но у НLА-В27+ больных имеет место большая вероятность развития рецидивирующих форм заболевания. Кроме того, персистенция инфекции также способствует рецидивированию и хронизации суставного процесса при РеА. Возможна многолетняя персистенция хламидий в полости сустава и поражение ими клеток суставного хряща, которая поддерживает воспалительный процесс и делает малоэффективной стандартную противовоспалительную терапию артрита.
Патоморфология.
Морфологические изменения в синовиальной мембране в острой стадии напоминают инфекционный артрит: отек, гиперемия, инфильтрация нейтрофильными лимфоцитами. В хронических случаях имеется картина неспецифического синовита с умеренным скоплением лимфоидных и плазматических клеток. Синовиальная жидкость содержит от 10000 до 50000 клеток в 1 мл, среди них преобладают нейтрофильные лейкоциты, встречаются цитофагоцитирующие макрофаги, не обладающие какой-либо специфичностью, но названные в свое время «клетками Рейтера».
Терапия реактивных артритов
Принципы терапии РеА ассоциированного с инфекцией вытекают из механизма развития суставного синдрома. Во-первых, необходима санация инфекционного очага в желудочно-кишечном и/или урогенитальном тракте. Во-вторых, следует проводить патогенетическое лечение артрита, включающее в себя неспецифическую противовоспалительную терапию, применение базисных противоревматических средств, иммуномодуляторов и методов локальной терапии.
Требования, предъявляемые к «идеальному» антибиотику для лечения постэнтероколитических и урогенитальных инфекций, следующие:
1) высокая активность в отношении возбудителей (хламидий, уреаплазм, иерсиний и т.д.);
2) накопление препарата в высокой концентрации в тканях;
3) значительная внутриклеточная проницаемость;
4) простота и удобство применения, комплаентность;
5) безопасность применения;
6) экономическая доступность.
Антибактериальная терапия назначается после перенесенной острой кишечной или урогенитальной инфекции с учетом чувствительности к ним выделенных микроорганизмов.
При иерсиниозе используют левомицетин по 2 г/сут, гентамицин по 0,16—0,24 г/сут, тетрациклин по 0,8 г/сут. При шигеллезе применяют левомицетин, сульфаниламидные и нитрофурановые препараты, при сальмонеллезе — левомицетин. Следует отметить, что при лечении левомицетином необходим регулярный контроль показателей крови, так как препарат может вызывать лейкопению. Курс антибактериальной терапии строго индивидуальный и составляет в среднем 2—4 нед. Как правило, при длительной антибактериальной терапии одновременно с профилактической целью назначают противогрибковые препараты (нистатин, пимафуцин, низорал и др.).
Для санации инфекционного очага в урогенитальном тракте используются антибиотики, проявляющие активность в отношении хламидий и микоплазм. В отношении хламидий доказанную эффективность проявляют тетрациклины, макролиды, азалиды и фторхинолоны, в меньшей степени – хлорамфеникол, рифампицин. В отношении уреаплазм наиболее активны макролиды, азалиды и тетрациклины.
Тетрациклины – первая группа антибиотиков, которая стала применяться для лечения хламидиоза и уреаплазмоза. Препараты группы тетрациклина имеют широкий спектр антибактериальной активности, обладают бактериостатическим типом действия, механизм которого связан с нарушением синтеза белка в микробной клетке путем связывания с 30 S – субъединицей РНК рибосом.
Терапия тетрациклином в суточной дозе 1,5-2г в комбинации с нистатином на протяжении 4-6 недель приводила к положительной клинической динамике хламидийного артрита у подавляющего большинства больных. При этом длительное применение высоких суточных доз (до 2 г/сут) тетрациклина в свежих случаях болезни Рейтера давало значительно лучший лечебный эффект, чем при использовании относительно малых доз (до 1 г/сут).
При длительном приеме тетрациклина в высоких дозах нередко возникают побочные эффекты в виде анорексии, тошноты, рвоты, поноса, дисфагии, отмечается повышение активности печеночных ферментов в крови; появление папуллезной и эритематозной кожной сыпи и наблюдается повышенная чувствительность кожи к солнечному свету, проявляющаяся в чрезмерном загаре. Возможно развитие аллергических реакций в виде крапивницы, артралгии (суставная боль) и крайне редко – анафилактический (аллергического) шок. Учитывая возможность проникновения тетрациклинов через плаценту, а также в грудное молоко, они противопоказаны при беременности и в период лактации. Их не рекомендуется назначать детям до 8 лет, поскольку они могут вызвать замедление роста костей, изменение цвета зубов, гипоплазию эмали.
Доксициклин – полусинтетический антибиотик из группы тетрациклинов – был создан в 1967 г. и, по сравнению с тетрациклином, имеет ряд фармакокинетических преимуществ. В частности, доксициклин практически полностью всасывается в ЖКТ, и прием пищи и молочных продуктов меньше влияет на процессы всасывания препарата. У него более длительный, чем у тетрациклина период полувыведения (назначается 1–2 раза в сутки), и хорошее проникновение в различные ткани вследствие липофильности. Доксициклин выводится почками на 40%. В тоже время отсутствует кумуляции препарата в крови при нарушении функции почек, вследствие возрастания выведения его с калом и усиления метаболизма, что дает возможность применять доксициклин у больных с почечной недостаточностью. Благодаря своим особым фармакокинетическим свойствам, доксициклин реже дает побочные эффекты, поэтому препарат более безопасен, чем тетрациклин. При приеме доксициклина моногидрата (препарат «Юнидокс Солютаб») побочные эффекты встречаются еще реже, поскольку доксициклин моногидрат имеет нейтральную реакцию и не вызывает развития эзофагитов, часто встречающихся при применении других форм препарата. При этом диспергируемая форма обеспечивает максимальное удобство пациенту, так как таблетку можно разжевать, проглотить целиком, или растворить в небольшом количестве воды. Доксициклин нашел широкое применение при лечении болезней, передаваемых половым путем, в частности, для лечения больных с острым негонококковым уретритом препарат применяют по 100 мг внутрь дважды в сутки в течение 7 дней. Доксициклин и азитромицин являются препаратами первого ряда при лечении хламидийных инфекций, потекающих бессимптомно, особенно у женщин. Эффективность доксициклина в дозе 200 мг в сутки эквивалентна приему азитромицина в дозе 1 г внутрь однократно, но стоимость лечения азитромицином значительно выше, чем доксициклина. При приеме доксициклина эрадикация хламидий достигается в 100% случаев, а клиническая эффективность препарата составляет 98%. Доксициклин применяют в комбинации с другими антибиотиками (ампициллин/сульбактам, ципрофлоксацин, метронидазол) для лечения воспалительных заболеваний органов малого таза, а также у больных сифилисом при непереносимости β–лактамных антибиотиков.
В литературе имеются сообщения об успешном применении доксициклина у больных ревматологического профиля. Применение этого препарата в дозе 150 мг/сут в течение 3 мес. у больных ревматоидным артритом привело к явной положительной динамике по ряду показателей (суставной счет, интенсивность боли, определяемая по визуальной аналоговой шкале, снижение активности коллагеназы в слюне, различные психопатологические параметры). В ходе пилотного 6–месячного исследования, включавшего 23 больных ревматоидным артритом, эффективность доксициклина была сопоставима с таковой при лечении метотрексатом. Поэтому в настоящее время имеются достаточно веские доказательства, свидетельствующие о целесообразности применения тетрациклинов, в том числе доксициклина, в качестве базисных средств при лечении ревматоидного артрита и остеоартроза. Перспективность работ в данном направлении заслуживает серьезного внимания.
Эффективность других тетрациклиновых препаратов при ревматоидном артрите была изучена в серии клинических исследований. Наиболее демонстративными являются данные двух крупных, выполненных в двойном слепом режиме испытаний полусинтетического тетрациклинового антибиотика миноциклина (Миноцин) у 299 больных ревматоидным артритом. Показано, что назначение миноциклина по 100 мг внутрь дважды в сутки на срок от 24 до 48 недель приводило к статистически значимому улучшению ряда клинических и лабораторных параметров активности болезни (индекс Ричи, число воспаленных суставов, уровень гемоглобина, СОЭ, С-реактивный белок, IgM-ревматоидный фактор) по сравнению с группой больных, получавших индифферентные вещества. Данные результаты заслуживают серьезного внимания и свидетельствуют о явной перспективности работ в этом направлении. Препарат следует принимать за 1 ч до еды или через 2 ч после еды. Пациентам с выраженными нарушениями функции почек и/или печени необходимо назначать препарат в меньшей дозе.
Макролиды рассматриваются как препараты выбора в лечении урогенитального хламидиоза и уреаплазмоза. С этой целью наиболее часто применяются эритромицин, альтернативными препаратами считаются другие макролиды 2 поколения: мидекамицин (макропен), рокситромицин (рулид), спирамицин (ровамицин), джозамицин (вильпрофен). В качестве одного из наиболее безопасных антибиотиков рассматривается эритромицин, который, как и другие макролиды, обладает выраженной бактерицидной активностью в отношении хламидий и микоплазм, вызывающих воспалительные заболевания мочеполовой сферы. Способность макролидов накапливаться в высоких концентрациях в воспалительном очаге, в том числе в полости суставов, связана с тем, что они могут аккумулироваться фагоцитами, которые непосредственно доставляют их в ткани, где имеется воспалительный процесс, наличием «иммуномодулирующего» эффекта, проявляющимся увеличением хемотаксиса фагоцитов, постантибактериальной активностью. Вместе с тем, при энтеральном приеме эритромицина только около 4,5% от введенной дозы выводится в неизмененном виде почками. При внутривенном введении концентрация эритромицина в моче значительно выше, т.к. в этом случае до 15% дозы выводится почками в неизмененном виде. При неосложненом урогенитальном хламидиозе эритромицин назначается по 500мг 4 раза в сутки курсом 7 дней, при воспалительных заболеваниях органов малого таза, ассоциированных с хламидиозом или уреаплазмозом, продолжительность лечения увеличивается до 14 дней. Эритромицин обладает достаточно высокой эффективностью, обеспечивая эрадикацию и излечение больных в 83 – 95% случаев. Курс лечения эритромицином при урогенных артритах должен быть длительным – не менее 4-х недель. Однако в виду частого развития нежелательных реакций со стороны ЖКТ, которые наблюдаются у 38-58% пациенток, они нередко отказываются от его приема. Кроме того, высокая курсовая доза и необходимость 4-хкратного приема снижает комплаентность больных, ограничивает применение эритромицина.
Кларитромицин по своей активности в отношении C.trachomatis и U.urealyticum превосходит эритромицин примерно в 8 раз и обладает улучшенными фармакокинетическими характеристиками. Препарат быстро и полно всасывается в кишечнике, имея большой период полувыведения, длительно циркулирует в плазме в терапевтических концентрациях. Кларитромицин хорошо проникает в ткани с созданием высоких концентраций, значительно превышающих таковые в плазме крови. Препарат выводится с мочой в неизмененном виде (до 20% от введенной дозы). Имеется форма выпуска кларитромицина – СР 500 мг (таблетки медленного высвобождения), которые обеспечивают терапевтическую концентрацию при приеме 1 раз в сутки.
Кларитромицин обладает иммуномодулирующим действием, связанным с активацией моноцитарно-макрофагальной системы, Т-киллеров и ряда ферментов, участвующих в разрушении патогенных бактерий. В нескольких исследованиях была показана эффективность кларитромицина в лечении неосложненных острых уретритов и цервицитов хламидийной и уреаплазменной этиологии. В тоже время терапевтический эффект был гораздо ниже при уретритах смешанной этиологии. Кроме того, при применении кларитромицина отмечен факт нормализации соотношения провоспалительных и регуляторных цитокинов, что выражается в снижении уровней фактора некроза опухоли-α, интерлейкина-8, интерлейкина-6 и повышении уровня интерлейкина-10. Учитывая тот факт, что у пациенток с привычным невынашиванием беременности отмечается нарушение цитокининового баланса в сторону преобладания провоспалительных цитокининов, перспективным является использование данного препарата в качестве предгестационной подготовки у женщин с хроническим воспалительным процессом органов малого таза.
Европейские стандарты лечения хламидийной инфекции предусматривают применение в качестве альтернативного средства рокситромицина по 150мг 2 раза в день. Рокситромицин является 14-членным макролидом, по действию на C.trachomatis и U.urealyticum превосходит эритромицин, тетрациклин и доксициклин. Рокситромицин по степени кумуляции в нейтрофилах превосходит эритромицин и джозамицин. Он способен усиливать фагоцитоз нейтрофилов, ингибирует окислительный «взрыв», в процессе которого в фагоцитах резко нарастает продукция свободных радикалов. При этом отмечается улучшение показателей активности фагоцитов, их переваривающей способности и, в, конечном итоге – завершенного фагоцитоза. Противовоспалительная активность рокситромицина связана с его антиоксидантными свойствами и способностью ингибировать выработку провоспалительных цитокинов – интерлейкина-3, интерлейкина-4, фактора некроза опухоли-α. По выраженности противовоспалительного эффекта он превосходит кларитромицин и азитромицин. Препарат хорошо накапливается в тканях предстательной железы, миометрия, эндометрия. С мочой в неизмененном виде выделяется до 10% препарата. Длительный период полувыведения позволяет назначать препарат в дозе 300 мг 1 раз в сутки. Показана высокая эффективность этого препарата в лечении урогенитальных инфекций. В частности, при негонорейных уретритах рокситромицин применяется в суточной дозе 300мг, продолжительность лечения до 10 дней. Клиническая эффективность при хламидийных уретритах – 75-100%.
Учитывая тот факт, что урогенитальные артриты требуют более длительной антибактериальной терапии, может быть рекомендован повторный курс лечения рокситромицином с интервалом в 5-7 дней. Значительным преимуществом этого препарата является его хорошая переносимость при применении, как у взрослых, так и у детей. Нежелательные реакции развиваются у 3-4% пациентов преимущественно в виде диспептических явлений – боли в животе, тошнота, диарея. Изредка отмечаются головная боль, головокружения, сыпь, лимфопения, эозинофилия, обратимые изменения трансаминаз.
Была также показана высокая эффективность спирамицина (ровамицина) в комплексной терапии урогенитального артрита (Белов Б.С., 1997). Предложены две равнозначные схемы лечения: 1) 6 млн МЕ внутривенно + 3 млн МЕ per os ежедневно в течение 3-х дней, затем по 9 млн МЕ per os в течение 25 дней; 2) 9 млн МЕ per os ежедневно в течение 28 дней.
При соблюдении данных схем лечения хламидийного артрита спирамицином положительная динамика клинических проявлений заболевания наблюдалась у большинства больных, однако эрадикация хламидий при повторном бактериологическом контроле наступила только в 68% случаев. Кроме того, у 8% пациентов отмечались побочные реакции в виде парестезии, развития анемии, аллергического дерматита. Хотя in vitro спирамицин проявляет меньшую, чем эритромицин, активность против C.trachomatis и U.urealyticum, однако его высокая эффективность при лечении РеА, по-видимому, объясняется более высокой концентрацией в моче при внутривенном введении, а также тем, что препарат не взаимодействуют системой цитохромов Р445-Р455. Спирамицин активно проникает внутрь клетки, накапливается в высокой концентрации в тканях половых органов и оказывает длительный постантибиотический эффект. Препарат может применяться у беременных.
Показан хороший клинический эффект макролидов в лечении урогенитальных артритов у детей. В частности им рекомендуется проводить два 7-дневных курса мидекамицина (Макропена) с интервалом в 5 дней (Коровина Н.А. и соавт., 1997). Такая схема по своей эффективности не уступает месячному курсу лечения доксициклином при лечении артритов, ассоциированных с хламидийной инфекцией у детей.
Оценивая эффективность макролидов в лечении урогенитальных артритов, необходимо остановиться на отдельной группе этих препаратов – азалидах, которая представлена азитромицином (Сумамед). В настоящее время азитромицин рассматривается как ведущий препарат, которому отдается предпочтение в лечении урогенитального хламидиоза и уреаплазмоза. Высокий клинический эффект азитромицина во многом обусловлен его фармакокинетическими особенностями, в частности, 1) высокой биодоступностью (не разрушается под действием желудочного сока); 2) высокой липофильностью (концентрация препарата в тканях в десятки и, даже сотни раз, выше, чем в плазме крови); 3) длинным периодом полувыведения – до 3-х суток; 4) высокой внутриклеточной аккумуляцией; 5) более длительным постантибиотическим эффектом.
Благодаря тому, что азитромицин активно аккумулируется в фагоцитах, он переносится ими в очаг воспаления. Концентрация азитромицина в тканях после однократного приема дозы 1 г сохраняется достаточно высокой в течение 10 дней. Важным преимуществом препарата является его хорошая переносимость: частота побочных эффектов не превышает 6%. Среди побочных эффектов преобладают диспептические нарушения. Это делает возможным широкое применение азитромицина в педиатрической и акушерско-гинекологической практике при лечении урогенитального хламидиоза и уреаплазмоза. Многочисленными контролируемыми исследованиями показано, что однократный прием 1г азитромицина приводит к эрадикации хламидий и уреаплазм в 85-100% случаев при остром неосложненном воспалительном процессе. При хроническом урогенитальном хламидиозе применяется курсовая доза 3г по схеме: 1г однократно в 1-й день, затем по 0,5 г в течение последующих 4-х дней. Эрадикационная эффективность азитромицина превосходит таковую при курсовом лечении доксициклином, тетрациклином, эритромицином. В терапии урогенитальных артритов требуются более высокие курсовые дозы азитромицина: 9-12 г в течение 26 дней с различными интервалами. Поэтому несомненный интерес представляют исследования, в которых антибактериальные препараты при лечении урогенитального хламидиоза при РеА применяются прерывистыми курсами,
Эволюция антибиотикочувствительности микоплазм с 2001по 2003 годы показывает рост числа резистентных штаммов к азитромицину, рокситромицину, клиндамицину. В тоже время частота антибиотикоустойчивости к джозамицину, доксициклину и миноциклину не изменилась. Поэтому сравнительные рандомизированные исследования фторхинолонов нового поколения (гатифлокацин, левофлоксацин, моксифлоксацин и др.) с большей в сравнении с ципрофлоксацином и офлоксацином активностью в отношении хламидий и микоплазм, являются актуальными. По активности в отношении хламидий новые фторхинолоны сравнимы с макролидами, а в отношениии микоплазм и уреаплазм столь же эффективны как тетрациклины. Подтверждена эффективность фторхинолонов нового поколения в терапии урогенитального хламидиоза, у лиц, страдающих воспалительными заболеваниями мочеполовой системы с профилактической целью, что представляется особенно важным для комплексной терапии РеА. При лечении неосложненных форм воспалительных заболеваний органов малого таза у женщин моксифлоксацин применяется по 400 мг 1 раз в сутки курсом 14дней. По своей эффективности препарат был равен комбинации ципрофлоксацина (500мг оджнократно), доксициклина 100 мг 2 раза в сутки и метронидазола 500 мг 3 раза в сутки в течение 14 дней при сравнимой эффективности микробиологической эффективности соответственно 92.5% и 88,2%.
Побочные эффекты являются типичными для всех представителей фторхинолонов (встречаются у 27,4% пролеченных больных): 1) со стороны центральной нервной системы – головокружение, рассеянность внимания, головная боль; 2) со стороны желудочно-кишечного тракта – сухость и «металлический» привкус во рту, чувство дискомфорта в эпигастрии, тошнота; 3) явления фотосенсибилизации и кожная сыпь с зудом. Кроме того, частота их возникновения может зависеть от совместного применения с другими лекарственными препаратами, которые также используются при лечении РеА, в частности с НПВП. Вследствие выраженности побочных эффектов препараты были отменены у 3,8% больных.
При лечении хламидиозной инфекции при беременности рекомендованы следующие препараты: эритромицин 500мг 4 раза в день 7 дней, амоксициллин 500 мг внутрь 3 раза в сутки 7 дней или джозамицин 750 мг 2 раза в сутки в течение 7 дней.
Амоксициллин является полусинтетическим антибиотиком из группы пенициллинов широкого спектра действия. Применение пенициллинов во время беременности имеет почти 50-летнюю историю, поэтому безопасность их не вызывает сомнений. Амоксициллин не обладает нефро- и гепатотоксическим действием. Пенициллины не действуют на C. Trachomatis, но могут частично проникать внутрь клетки,где их концентрация составляет 60% от концентрации в плазме крови. Тем не менее, в сравнительном исследовании азитромицина с 7-дневный курсом лечения амоксициллином по 500мг 3 раза в сутки были показаны сходные результаты, как в оценке эффективности, так и переносимости. Рекомендации CDC (Атланта, США) состоят в применении амоксициллина в случае неэффективности лечения эритромицином.
С 2001 г. Европейское руководство по лечению инфекций, передающихся половым путем, предусматривает применение джозамицина для лечения хламидийной инфекции у беременных. Молекула джозамицина имеет 16-членное лактонное кольцо. Джозамицин обладает менее выраженными нежелательными реакциями по сравнению с другими макролидами, так как он не связывается с цитохромами Р445 –Р455 и не угнетает их активность. Поэтому препарат не имеет побочных эффектов со стороны ЖКТ и не оказывает гепатотоксического действия. Джозамицин после приема быстро распределяется в тканях, а также в макрофагах периферической крови. Его способность проникать внутрь клетки в 20 раз выше, чем во внеклеточном пространстве. Высокая эффективность при лечении хламидийной инфекции у беременных достигается при применении препарата в дозе 750мг 2 раза в сутки 7 дней.
В настоящее время федерального протокола лечения хламидиоза не существует, связи с чем, используется шаблон комплексного лечения, который включает применение 2-3 антибактериальных препаратов, интерферонов, иммуномодуляторов, «системной энзимотерапии», антиоксидантов и витаминов. Антибиотики эффективные в лечении неосложненных форм уретрального, цервикального и ректального хламидиоза представлены в таблице №1.
 Лечение осложненных форм хламидиоза представляет сложную задачу, поскольку практически у всех больных воспалительный процесс не ограничивается уретрой, а распространяется на вышележащие отделы урогенитального тракта, что значительно затрудняет достижение эрадикации возбудителя. Кроме того, в последние годы активно нарастает резистентность хламидийной инфекции и артритов к проводимой антибактериальной терапии. Известно, что носителями видовых признаков хламидий являются мобильные структуры, представляющие собой замкнутые кольца двухнитиевой ДНК – их называют плазмидами. Плазмиды изначально невосприимчивы к нескольким антибиотикам или к целой их группе, в частности к β-лактамным антибиотикам. Плазмиды могут интегрироваться в хромосому и реплицироваться с ней. Благодаря этому информация о резистентности к ряду антибиотиков передается непосредственно в генетический аппарат хламидийной клетки и хламидия становится нечувствительной к данным препаратам. Это обстоятельство может служить объяснением того факта, что 7 дневные курсы антибиотикотерапии, применяемые для лечения неосложненного урогенитального хламидиоза, совершенно неэффективны при воспалительных заболеваниях малого таза и РеА, ассоциированном с хламидийной инфекцией.
В таблице №2 даны режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
Таблица №2 Режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
Лечение осложненных форм хламидиоза представляет сложную задачу, поскольку практически у всех больных воспалительный процесс не ограничивается уретрой, а распространяется на вышележащие отделы урогенитального тракта, что значительно затрудняет достижение эрадикации возбудителя. Кроме того, в последние годы активно нарастает резистентность хламидийной инфекции и артритов к проводимой антибактериальной терапии. Известно, что носителями видовых признаков хламидий являются мобильные структуры, представляющие собой замкнутые кольца двухнитиевой ДНК – их называют плазмидами. Плазмиды изначально невосприимчивы к нескольким антибиотикам или к целой их группе, в частности к β-лактамным антибиотикам. Плазмиды могут интегрироваться в хромосому и реплицироваться с ней. Благодаря этому информация о резистентности к ряду антибиотиков передается непосредственно в генетический аппарат хламидийной клетки и хламидия становится нечувствительной к данным препаратам. Это обстоятельство может служить объяснением того факта, что 7 дневные курсы антибиотикотерапии, применяемые для лечения неосложненного урогенитального хламидиоза, совершенно неэффективны при воспалительных заболеваниях малого таза и РеА, ассоциированном с хламидийной инфекцией.
В таблице №2 даны режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
Таблица №2 Режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
 Хотя убедительных данных о влиянии антибиотиков на течение суставного синдрома не получено, тем не менее, при устранении хламидийной инфекции реже возникают рецидивы и хроническое течение заболевания. Поэтому обоснованным считается раннее назначение антибактериальной терапии, что позволяет в ряде случаев предупредить развитие урогенитальных артритов. При неосложненном хламидиозе следует минимизировать объем терапии и назначать только препараты направленного действия, эффективность которых в лечении хламидиоза имеет доказательную базу. Только при отсутствии эффекта от рекомендованных стандартных схем рекомендуется применять комбинированную терапию. В случаях неосложненного хламидиоза применение комбинированной антибактериальной терапии не обосновано, так как нет убедительных доказательств ее эффективности. В тоже время частота бактериологических неудач при лечении болезни Рейтера может достигать 40%, поэтому приходится нередко применять схемы, включающие 2-3 антибактериальных препарата, особенно при лечении рецидивирующих и хронических форм хламидиоза.
В тоже время для ревматологов интерес к антибактериальным препаратам отнюдь не ограничивается их непосредственным противомикробным действием. Не меньшего внимания заслуживают неспецифические противовоспалительные эффекты, которыми обладает ряд антибактериальных препаратов.
В настоящее время имеются убедительные доказательства способности тетрациклинов ингибироать матриксные металлопротеиназы – специфические цинкозависимые ферменты (коллагеназы, желатиназы, стромелизины и др.), которые играют важную роль в разрушении макромолекул внеклеточного матрикса соединительной ткани. Предполагают, что при ревматоидном артрите и остеоартрозе имеются локальные нарушения баланса между продукцией активированных форм металлопротеиназ и их тканевыми ингибиторами. Следует также учитывать высокую степень проникновения тетрациклинов и особенно доксициклина в хрящевую ткань, субхондральный костный слой и синовиальную оболочку в присутствии флурбипрофена и возрастание его концентрации в тканях при длительном применении (от 12 до 18 мес).
Результаты многочисленных экспериментальных и клинических работ показывают, что макролиды также обладают противовоспалительным действием, не связанным с их антибактериальной активностью. Это выражается в ингибировании продукции нейтрофильных протеиназ и экспрессии клеточных молекул адгезии на нейтрофилах, в подавлении синтеза провоспалительных цитокинов, угнетении активации энергетического метаболизма в фагоцитирующих клетках (подавление окислительного стресса). Макролиды уменьшают образование кислородных свободных радикалов при сохранении бактерицидной активности нейтрофилов, а также росте эндогенной продукции глюкокортикостероидов. При этом макролиды хорошо переносятся больными и редко дают серьезные побочные эффекты, требующие отмены препаратов, что позволяет применять их в течение достаточно длительного времени (до 12 месяцев и более).
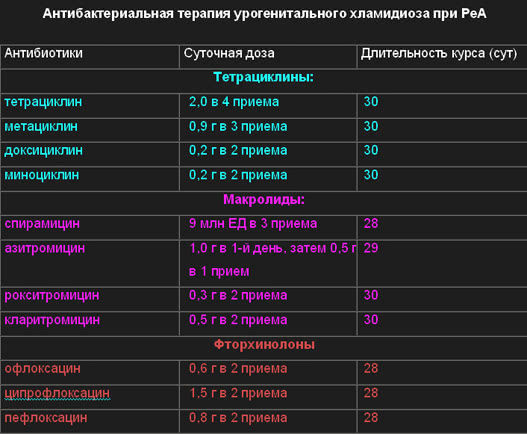
В таблице №3 представлены антибиотики, обладающие наиболее высокой антихламидийной активностью, которые применяются в комплексном лечении урогенитальных РеА и продолжительность их применения.
Таблица№3
Хотя убедительных данных о влиянии антибиотиков на течение суставного синдрома не получено, тем не менее, при устранении хламидийной инфекции реже возникают рецидивы и хроническое течение заболевания. Поэтому обоснованным считается раннее назначение антибактериальной терапии, что позволяет в ряде случаев предупредить развитие урогенитальных артритов. При неосложненном хламидиозе следует минимизировать объем терапии и назначать только препараты направленного действия, эффективность которых в лечении хламидиоза имеет доказательную базу. Только при отсутствии эффекта от рекомендованных стандартных схем рекомендуется применять комбинированную терапию. В случаях неосложненного хламидиоза применение комбинированной антибактериальной терапии не обосновано, так как нет убедительных доказательств ее эффективности. В тоже время частота бактериологических неудач при лечении болезни Рейтера может достигать 40%, поэтому приходится нередко применять схемы, включающие 2-3 антибактериальных препарата, особенно при лечении рецидивирующих и хронических форм хламидиоза.
В тоже время для ревматологов интерес к антибактериальным препаратам отнюдь не ограничивается их непосредственным противомикробным действием. Не меньшего внимания заслуживают неспецифические противовоспалительные эффекты, которыми обладает ряд антибактериальных препаратов.
В настоящее время имеются убедительные доказательства способности тетрациклинов ингибироать матриксные металлопротеиназы – специфические цинкозависимые ферменты (коллагеназы, желатиназы, стромелизины и др.), которые играют важную роль в разрушении макромолекул внеклеточного матрикса соединительной ткани. Предполагают, что при ревматоидном артрите и остеоартрозе имеются локальные нарушения баланса между продукцией активированных форм металлопротеиназ и их тканевыми ингибиторами. Следует также учитывать высокую степень проникновения тетрациклинов и особенно доксициклина в хрящевую ткань, субхондральный костный слой и синовиальную оболочку в присутствии флурбипрофена и возрастание его концентрации в тканях при длительном применении (от 12 до 18 мес).
Результаты многочисленных экспериментальных и клинических работ показывают, что макролиды также обладают противовоспалительным действием, не связанным с их антибактериальной активностью. Это выражается в ингибировании продукции нейтрофильных протеиназ и экспрессии клеточных молекул адгезии на нейтрофилах, в подавлении синтеза провоспалительных цитокинов, угнетении активации энергетического метаболизма в фагоцитирующих клетках (подавление окислительного стресса). Макролиды уменьшают образование кислородных свободных радикалов при сохранении бактерицидной активности нейтрофилов, а также росте эндогенной продукции глюкокортикостероидов. При этом макролиды хорошо переносятся больными и редко дают серьезные побочные эффекты, требующие отмены препаратов, что позволяет применять их в течение достаточно длительного времени (до 12 месяцев и более).
В таблице №3 представлены антибиотики, обладающие наиболее высокой антихламидийной активностью, которые применяются в комплексном лечении урогенитальных РеА и продолжительность их применения.
Таблица№3
 Лечение РеА обычно начинают одним из антибиотиков из группы макролидов или тетрациклинов, а фторхинолоны используют в качестве препаратов второго ряда. Курс лечения должен составлять не менее 4 недель с последующим ежемесячным (как минимум трехкратным) бактериологическим контролем. При выявлении сопутствующей патогенной или условно-патогенной микрофлоры мочеполового тракта возможно одновременное или последовательное назначение двух или даже трех антибиотиков. В тоже время применение β-лактамных препаратов (пенициллины, цефалоспорины), сульфаниламидов, низких доз гамма-интерферона, неоправданно коротких курсов и низких доз антибиотиков может способствовать образованию L-подобных форм хламидий, резистентных практически ко всем известным антибактериальным средствам.
С целью предотвращения формирования антибиотикорезистентности при проведении повторных курсов лечения необходима смена препаратов. При применении макролидов рекомендуется назначение рациональных комбинаций антибиотиков (макролиды + доксициклин), назначение достаточных по длительности сроков антибактериальной терапии лечение обоих половых партнеров с использованием одинаковых комбинаций антибиотиков.
Таким образом, лечение РеА артритов представляет трудную задачу, решение которой, вместе с тем, возможно при соблюдении определенных условий:
1.Своевременное проведение адекватной антибактериальной терапии с учетом современных рекомендаций по длительности применения антибиотиков. Обязательный контроль эффективности лечения РеА и достижение эрадикации возбудителя;
2.Индивидульный подбор нестероидных противовоспалительных препаратов (НПВП) с учетом клинического эффекта и переносимости препарата;
3.Локальная терапия глюкокортикростероидов (ГКС) при наличии высокой активности артрита;
4.Применение базисных препаратов при затяжном и хроническом течении артрита;
5.Активное применение локальной терапии ДМСО на ранних сроках заболевания;
6.Включение ФТЛ, ЛФК, санаторно-курортного лечения в комплекс реабилитационных мероприятий.
Фармакотерапия суставного синдрома при РеА должна начинаться с применения нестероидных противовоспалительных препаратов.
Выбор НПВП осуществляется эмпирически, однако при подборе того или иного препарата важную роль играет индивидуальная чувствительность и переносимость. Хорошо зарекомендовали себя в лечении РеА производные индолуксусной кислоты (индометацин, сулиндак). Они обладают высокой противовоспалительной активностью, накапливаются в синовиальной жидкости в высокой концентрации, превышающей в несколько раз концентрацию их в плазме крови. Препараты данной группы рассматриваются некоторыми авторами как препараты первого ряда в лечении серонегативных спондилоартропатий. При лечении РеА широко применяются также НПВП из группы производных пропионовой кислоты (ибупрофен, напроксен, кетопрофен, флугалин, тиапрофеновая кислота), производные арилуксусной кислоты (диклофенак), оксикамы (пироксикам, мелоксикам, лорноксикам) в стандартных суточных дозах. Однако при лечении РеА противовоспалительный эффект НПВП, в отличие от аналгетического и жаропонижающего, развивается только через 10–14 дней от начала регулярного приема, а при назначении пироксикама или других оксикамов еще позднее. Рекомендуется начинать прием любого НПВП начинать с наименьшей терапевтической дозы, рекомендуемой при данном заболевании. При хорошей переносимости, обычно через 2–3 дня, следует постепенно увеличивать (титровать) суточную дозировку в течение 1–2 недель до эффективной терапевтической дозы. При этом доза НПВП, получаемая больным, не должна превышать максимально рекомендуемую суточную дозу. Увеличение суточных доз НПВП более чем в 2 раза, как правило, не сопровождается пропорциональным нарастанием противовоспалительного действия, но быстро приводит к развитию нежелательных дозозависимых побочных эффектов. Поэтому при отсутствии эффекта от НПВП необходимо решать вопрос о переводе больного на другие препараты, в частности подключении ГКС, базисных противоревматических препаратов. При необходимости длительного курсового назначения (например, в ревматологии) НПВП следует назначать после приема пищи. Важна также синхронизация назначения НПВП с ритмом клинической активности процесса, что позволяет, используя меньшие дозы НПВП, повысить эффективность лечения, особенно при применении короткоживущих препаратов с периодом полувыведения 4–5 час. Момент приема НПВП может определяться также временем максимальной выраженности симптомов заболевания (боль, скованность в суставах). При этом можно назначать НПВП в любое время суток, отходя от общепринятых схем введения, что позволяет достигать большего лечебного эффекта при назначении препарата в меньшей суточной дозе. При приеме НПВП предпочтение следует отдавать монотерапии. Одновременное применение двух или более НПВП нецелесообразно по следующим причинам. Во-первых, эффективность комбинированного применения НПВП объективно не доказана. Только у некоторых больных в порядке исключения и при хорошей переносимости можно применять два НПВП, которые в этих случаях назначают в разное время суток, например быстровсасывающийся – утром и днем, а длительнодействующий – вечером. Однако в ряде подобных случаев отмечалось снижение концентрации препаратов в крови (например, АСК снижает концентрацию индометацина, диклофенака, ибупрофена, напроксена, пироксикама), что вело к ослаблению их эффекта. Во-вторых, возрастает опасность развития нежелательных реакций. Исключением является возможность назначения парацетамола в сочетании с НПВП для усиления аналгетического эффекта. При применении НПВП отмечается высокий риск развития нежелательных реакций со стороны ЖКТ, в частности характерно развитие специфического синдрома – НПВП-гастропатии, связанного не столько с локальным повреждающим влиянием НПВП (большинство из них – органические кислоты) на слизистую оболочку желудка, но в основном обусловленного системным действием препаратов. Поэтому НПВП-гастропатия может развиваться не только при приеме внутрь, но и при парентеральном или ректальном введении НПВП. Чаще всего имеет место повреждение слизистой ЖКТ в антральном и препилорическом отделе желудка (эритема слизистой оболочки, эрозии, язвы, кровоизлияния).
К факторам риска НПВП-гастропатии относят:
Лечение РеА обычно начинают одним из антибиотиков из группы макролидов или тетрациклинов, а фторхинолоны используют в качестве препаратов второго ряда. Курс лечения должен составлять не менее 4 недель с последующим ежемесячным (как минимум трехкратным) бактериологическим контролем. При выявлении сопутствующей патогенной или условно-патогенной микрофлоры мочеполового тракта возможно одновременное или последовательное назначение двух или даже трех антибиотиков. В тоже время применение β-лактамных препаратов (пенициллины, цефалоспорины), сульфаниламидов, низких доз гамма-интерферона, неоправданно коротких курсов и низких доз антибиотиков может способствовать образованию L-подобных форм хламидий, резистентных практически ко всем известным антибактериальным средствам.
С целью предотвращения формирования антибиотикорезистентности при проведении повторных курсов лечения необходима смена препаратов. При применении макролидов рекомендуется назначение рациональных комбинаций антибиотиков (макролиды + доксициклин), назначение достаточных по длительности сроков антибактериальной терапии лечение обоих половых партнеров с использованием одинаковых комбинаций антибиотиков.
Таким образом, лечение РеА артритов представляет трудную задачу, решение которой, вместе с тем, возможно при соблюдении определенных условий:
1.Своевременное проведение адекватной антибактериальной терапии с учетом современных рекомендаций по длительности применения антибиотиков. Обязательный контроль эффективности лечения РеА и достижение эрадикации возбудителя;
2.Индивидульный подбор нестероидных противовоспалительных препаратов (НПВП) с учетом клинического эффекта и переносимости препарата;
3.Локальная терапия глюкокортикростероидов (ГКС) при наличии высокой активности артрита;
4.Применение базисных препаратов при затяжном и хроническом течении артрита;
5.Активное применение локальной терапии ДМСО на ранних сроках заболевания;
6.Включение ФТЛ, ЛФК, санаторно-курортного лечения в комплекс реабилитационных мероприятий.
Фармакотерапия суставного синдрома при РеА должна начинаться с применения нестероидных противовоспалительных препаратов.
Выбор НПВП осуществляется эмпирически, однако при подборе того или иного препарата важную роль играет индивидуальная чувствительность и переносимость. Хорошо зарекомендовали себя в лечении РеА производные индолуксусной кислоты (индометацин, сулиндак). Они обладают высокой противовоспалительной активностью, накапливаются в синовиальной жидкости в высокой концентрации, превышающей в несколько раз концентрацию их в плазме крови. Препараты данной группы рассматриваются некоторыми авторами как препараты первого ряда в лечении серонегативных спондилоартропатий. При лечении РеА широко применяются также НПВП из группы производных пропионовой кислоты (ибупрофен, напроксен, кетопрофен, флугалин, тиапрофеновая кислота), производные арилуксусной кислоты (диклофенак), оксикамы (пироксикам, мелоксикам, лорноксикам) в стандартных суточных дозах. Однако при лечении РеА противовоспалительный эффект НПВП, в отличие от аналгетического и жаропонижающего, развивается только через 10–14 дней от начала регулярного приема, а при назначении пироксикама или других оксикамов еще позднее. Рекомендуется начинать прием любого НПВП начинать с наименьшей терапевтической дозы, рекомендуемой при данном заболевании. При хорошей переносимости, обычно через 2–3 дня, следует постепенно увеличивать (титровать) суточную дозировку в течение 1–2 недель до эффективной терапевтической дозы. При этом доза НПВП, получаемая больным, не должна превышать максимально рекомендуемую суточную дозу. Увеличение суточных доз НПВП более чем в 2 раза, как правило, не сопровождается пропорциональным нарастанием противовоспалительного действия, но быстро приводит к развитию нежелательных дозозависимых побочных эффектов. Поэтому при отсутствии эффекта от НПВП необходимо решать вопрос о переводе больного на другие препараты, в частности подключении ГКС, базисных противоревматических препаратов. При необходимости длительного курсового назначения (например, в ревматологии) НПВП следует назначать после приема пищи. Важна также синхронизация назначения НПВП с ритмом клинической активности процесса, что позволяет, используя меньшие дозы НПВП, повысить эффективность лечения, особенно при применении короткоживущих препаратов с периодом полувыведения 4–5 час. Момент приема НПВП может определяться также временем максимальной выраженности симптомов заболевания (боль, скованность в суставах). При этом можно назначать НПВП в любое время суток, отходя от общепринятых схем введения, что позволяет достигать большего лечебного эффекта при назначении препарата в меньшей суточной дозе. При приеме НПВП предпочтение следует отдавать монотерапии. Одновременное применение двух или более НПВП нецелесообразно по следующим причинам. Во-первых, эффективность комбинированного применения НПВП объективно не доказана. Только у некоторых больных в порядке исключения и при хорошей переносимости можно применять два НПВП, которые в этих случаях назначают в разное время суток, например быстровсасывающийся – утром и днем, а длительнодействующий – вечером. Однако в ряде подобных случаев отмечалось снижение концентрации препаратов в крови (например, АСК снижает концентрацию индометацина, диклофенака, ибупрофена, напроксена, пироксикама), что вело к ослаблению их эффекта. Во-вторых, возрастает опасность развития нежелательных реакций. Исключением является возможность назначения парацетамола в сочетании с НПВП для усиления аналгетического эффекта. При применении НПВП отмечается высокий риск развития нежелательных реакций со стороны ЖКТ, в частности характерно развитие специфического синдрома – НПВП-гастропатии, связанного не столько с локальным повреждающим влиянием НПВП (большинство из них – органические кислоты) на слизистую оболочку желудка, но в основном обусловленного системным действием препаратов. Поэтому НПВП-гастропатия может развиваться не только при приеме внутрь, но и при парентеральном или ректальном введении НПВП. Чаще всего имеет место повреждение слизистой ЖКТ в антральном и препилорическом отделе желудка (эритема слизистой оболочки, эрозии, язвы, кровоизлияния).
К факторам риска НПВП-гастропатии относят:
- пожилой возраст (риск развития язвенных поражений желудка у таких пациентов в 4 раза выше, чем у молодых людей);
- женский пол (НПВП-гастропатия у женщин встречается в 2–3 раза чаще, чем у мужчин);
- предшествующие и сопутствующие заболевания (язвенная болезнь, пептическая язва, цирроз печени, заболевания сердечно-сосудистой системы);
- одновременный прием других препаратов (антикоагулянтов, иммуносупрессантов, глюкокортикостероидов, длительная терапия НПВП, особенно их прием в больших дозах и/или одновременный прием двух или более препаратов этой группы);
- курение (особенно при наличии язвенной болезни в анамнезе);
- употребление алкоголя (данный фактор повышает риск возникновения желудочно-кишечных кровотечений более чем в 2 раза);
- носительство Helicobacter pylori.
- Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. Издание 2-е исправленное и дополненное. М.: Универсум Паблишинг, 1997.
- Бельгов А.Ю.Реактивные артриты: диагностика и лечение. Лечебное дело, 2009, №2
- Бертман Г., Катцунг Базисная и клиническая фармакология. Т. 1, 2. М.: Бином, 1998.
- Дятчина Л.И., Борщев П.М., Телеснин Е.А. Клиническая фармакология нестероидных противовоспалительных средств и рациональная тактика их применения. Ростов-на-Дону, 2009.
- Ивашкин В. Т., Шептулин А.А.Влияние анальгетиков на слизистую оболочку желудка и состояние печени. Клиническая фармакология и терапия. 2003; 12 (1).
- Кукес В.Г. Клиническая фармакология. М.: ГЭОТАР-Медиа, 2004.
- Кукес В.Г., Сычев Д.А. Клиническая фармакология ненаркотических анальгетиков. Клиническая фармакология и терапия. 2002; 11 (5).
- Лебедева Р.П., Николаев В.В. Фармакотерапия острой боли. М., 1998.
- Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология: В 2 томах. Т. 1, 2. М.: Медицина, 1993.


