Клинические и эпидемиологические исследования
Расширенный отчет
Lack of placental transfer of certolizumab pegol during pregnancy: results from CRIB, a prospective, postmarketing, pharmacokinetic study
Published first 13 October 2017
Авторы Xavier Mariette
1, Frauke Förger
2, Bincy Abraham
3, Ann D Flynn
4, Anna Moltó
5, René-Marc Flipo
6, Astrid van Tubergen
7, Laura Shaughnessy
8, Jeff Simpson
8, Marie Teil
9, Eric Helmer
10, Maggie Wang
8, Eliza F Chakravarty
11
Медицинские учреждения:
1 Université Paris-Sud, Hôpitaux Universitaires Paris-Sud, INSERM, Le Kremlin-Bicêtre, France
2 Inselspital, University Hospital and University of Bern, Bern, Switzerland
3 Houston Methodist Hospital, Houston, Texas, USA
4 University of Utah Health, Salt Lake City, Utah, USA
5 Department of Rheumatology, Hôpital Cochin, Assistance Publique – Hôpitaux de Paris, INSERM, Paris, France
6 Centre Hospitalier Regional Universitaire de Lille, Lille, Nord-Pas-de-Calais, France
7 Department of Medicine, Division of Rheumatology and CAPHRI – Care and Public Health Research Institute Maastricht, Maastricht University Medical Center, Maastricht, Netherlands
8 UCB Pharma, Raleigh, North Carolina, USA
9 UCB Pharma, Slough, UK
10 UCB Pharma, Brussels, Belgium
11 Oklahoma Medical Research Foundation, Oklahoma City, Oklahoma, USA
Для связи: Profesor Xavier Mariette, Université Paris-Sud, Hôpitaux Universitaires Paris-Sud, INSERM U1184, 63, rue Gabriel-Péri, 94270 Le Kremlin-Bicêtre, France;
xavier.mariette@aphp.fr
Аннотация
Цели Существует необходимость для эффективного и безопасного лечения во время беременности у женщин с хроническими воспалительными заболеваниями. Это исследование оценены плацентарной передачи certolizumab pegol (CZP), Fc- свободный антиопухоли некроза фактор лекарства Fc-free anti-tumour necrosis factor drug, от CZP-леченных беременных женщин их младенцам.
Методы CRIB был фармакокинетические исследования (ФKИ*) pharmacokinetic (PK) study женщин ≥30 недель беременности, получение коммерческих CZP локально утвержденных указания (последняя доза ≤35 дней перед родами). Образцы крови были собраны от матерей, пуповины и младенцев во время родов и новорожденных снова в 4 и 8 недель после родов. CZP плазменные концентрации были измерены с весьма тщательно и CZP-специфичных electrochemiluminescence иммуноанализа (нижний предел квантификации 0,032 мкг / мл).
Результаты Шестнадцать женщин вступил и завершила исследование. CZP плазменные концентрации матерей были в пределах ожидаемого терапевтического диапазона (медиана [уровень] 24,4 [5.0 – 49.4] мкг/мл). 16 детей, 2 были исключены из набора-протокол: 1 из-за недостающих данных при рождении и 1 из-за неправдоподобную PK данных. Оставшиеся 14 младенцев, 13 было не поддающихся количественной оценке уровней CZP при рождении (<0,032 мкг/мл), и 1 имел минимальный уровень CZP 0,042 мкг/мл (коэффициент младенческой/мать плазмы 0,0009); не один из младенцев не имел количественно CZP уровни в 4 и 8 недель. Имелись 16 образцов пуповины, 1 был исключен из-за недостающих данных; 3/15 имели поддающийся количественному определению CZP уровни (максимальная 0,048 мкг/мл).
Выводы Не было даже минимальной плацентарной передачи CZP от матерей к младенцам , предполагая отсутствие воздействия на плод
в утробе матери во время третьего триместра. Эти результаты подтверждают продолжение CZP лечения во время беременности, когда считается необходимым.
Введение
Большинство хронических воспалительных заболеваний chronic inflammatory diseases (CIDs) более распространены среди женщин. Заболевания, как правило, совпадают с пик репродуктивного возраста, и женщин с CIDs все чаще выбирают иметь детей после диагноза. Адекватный контроль болезни имеет решающее значение для обеспечения лучших здоровья плода и матери, поскольку высокая активность болезни связана с повышенным риском неблагоприятных исходов беременности, включая выкидыша, преждевременных родов и низкого веса при рождении. В то время как активность заболевания может спонтанно улучшаться во время беременности, примерно 50% женщин с ревматическими CIDs необходимо эффективное терапевтическое вмешательство и сталкиваются с сложные вопросы относительно влияния активного заболевания на плод и безопасность различных видов терапии во время беременности.
Антифактор Некроза опухоли (Anti-tumour necrosis factor (anti-TNF)) лекарства обеспечивают эффективное терапевтическое вариант, который значительно улучшает признаки и симптомы CIDs. Однако, анти ФНО терапии часто прекращается после первого триместра для ограничения плацентарной передачи ЛС к плоду. Активный transplacental транспорт иммуноглобулина G (IgG) от матери к ребенку при посредничестве неонатальной фрагмент кристаллизирующихся fragment crystallisable (Fc) рецептор) receptor (FcRn), процесс, который имеет место в основном во втором и третьем триместрах беременности. Certolizumab pegol (CZP) является Пегилированный, Fc свободный Анти ФНО одобрен для лечения ревматоидного артрита (РА), осевого спондилоартриты/анкилозирующий спондилоартрит (axSpA/AS), псориатический артрит (PsA) и крона болезнь (CD). Поскольку он не имеет IgG Fc зоны, в отличие от других анти ФТП, CZP не связывают FcRn и поэтому не ожидается, что произойдет FcRn опосредованной передачи через плаценту. Доклинические данные и выводы двух инициированных исследований беременных женщин, леченных anti-TNFs, поддерживают гипотезу о том, что существует минимальная плацентарная передача CZP в организме человека. Однако, enzyme-linked immunosorbent assay (ELISA) анализ используется для измерения уровней CZP плазмы в этих исследованиях не был специфичным для CZP, и он не был разработан для измерения низких концентрациях CZP, ожидаемые от плацентарной передачи. Следовательно, существует необходимость в более точной и надежной информации для принятия терапевтических решений у женщин с CIDs CZP лечения во время беременности.
CRIB -это первое исследование под эгидой промышленности, предназначенный для оценки плацентарной передачи CZP от матерей младенцев, используя весьма чувствительной и конкретных пробы для точного измерения концентрации плазмы CZP матерей, пуповины и младенцев во время родов и у грудных детей снова в 4 и 8 недель после родов.
Методы
Дизайн исследования и пациентов
CRIB (ClinicalTrials.gov,
NCT02019602) был перспективных, пострегистрационные, мультицентровое, фармакокинетические (PK) исследование, предназначенный для оценки плацентарной передачи CZP от матерей младенцам (
рис. 1). Это исследование было проведено в период января 2014 года и ноября 2016 в 11 регионах во Франции, Нидерландах, Швейцарии и США и был одобрен местные институциональные наблюдательные советы. Все женщины получают информированное согласие на участие и, совместно с назначенными держатель родительских прав, зачислять их младенца в исследовании.

Рисунок 1
Дизайн исследования CRIB
Последний certolizumab pegol (CZP) вводился за 35 дней до родов.
Подобранные женщины были ≥30 недель беременности на момент информированного согласия. Поскольку CRIB postmarketing исследование, всех женщин, зачисленных лечили коммерческим CZP по утвержденных показаниям (RA, axSpA/как, PsA и CD), как это предусмотрено их лечащим врачам. Пациенты должны были получать CZP дозы в течение 35 дней до родов. Решение продолжить CZP лечение во время беременности было принято лечащими врачами до и независимо от участия в исследовании. CZP был не предоставляются спонсором исследования.
У больных с любых связанных с беременностью, клинически значимых аномалий, отмеченными на акушерское УЗИ или другими методами изображений, с значительных лабораторных отклонений во время беременности, или любые признаки хронического или острого uteroplacental недостаточность имели право участвовать. Матерей, которые получали лечение с любым биологическим или каких-либо анти ФНО помимо CZP во время беременности были исключены, поскольку были матерями, которые принимают или приняла какие-либо лекарства с сильным риском тератогенности человеческого плода во время беременности. Также исключается были матерями с положительным или неопределенного туберкулез (ТБ) тест на скрининг, с активной или латентной инфекцией ТБ или с высоким риском инфекции ТБ.
Процедуры изучения
Матери получили коммерческие CZP или в 2 недели доза (CZP 200 мг каждые 2 недели [Q2W]) или 4-еженедельник доза режима (CZP 400 мг каждые 4 недели [Q4W]), по усмотрению их назначающих.
Образцы крови матери (≤4 мл на пробу) были собраны в течение 24 часов до или после родов. Образцы пуповинной (≤4 мл на сэмпл) были собраны в течение 1 часа после рождения. Образцы детской крови (≤1.2 мл на сэмпл) были собраны в течение 24 часов после рождения и на 4 и 8 послеродовой недели (
рис. 1). Образцы, собранные при доставке/рождении были получены в больнице параметр, в то время как посещений на дому патронажными медсестрами на 4 и 8 недель для минимизации нагрузки на матерей.
CZP концентрация была измерена во всех образцах плазмы. Объем Разрешительные, анти CZP антител и общая полиэтиленгликоля (PEG) уровнях (нативный CZP, deconjugated PEG или других источников PEG) также были измерены. CZP и анти CZP уровни были измерены в Covance Inc. (Шантильи, VA, США). Общий уровень PEG были измерены в Intertek фармацевтические услуги (Манчестер, Великобритания).
CZP концентрации были измерены с помощью иммуноферментного анализа electrochemiluminescence, проверяются в плазме крови человека. Количественный анализ был разработан для оптимальной чувствительности и специфичности: CZP был захвачен TNF-покрытием multiarray электрода и обнаружены антитела анти PEG до чтения MESO SCALE DISCOVERY платформы (MSD; Роквилл, MD, США). Количественный анализ специфичный для CZP и > 10 раз более чувствительной (нижний предел квантификации [LLOQ] 0,032 мкг/мл) чем предыдущая ELISA используется в других исследованиях CZP PK. Анти-CZP антитела были измерены с помощью ранее утвержденных ELISA (образцы были положительными, если уровни антител анти CZP > 2,4 единиц/мл). Общая PEG концентрация определяется спектроскопия ядерного магнитного резонанса (LLOQ 2,5 мкг/мл).
Конечными точками исследования
Первичной конечной точкой была концентрация CZP в плазме крови новорожденных при рождении. CZP и анти CZP уровни антител в плазме и пуповины матерей были вторичными (средними) конечными точками. Произвольное конечные точки включают CZP уровень в плазме крови новорожденных на недели 4 и 8, уровни антител анти CZP в плазме крови новорожденных при рождении и 4 и 8 недели и PEG концентрации в плазме матери, пуповине и младенцев.
Анализ безопасности включены все матери, которые получили по крайней мере одна доза CZP, включая ошибки отбора и детей всех матерей, которые попали в период выборки. Неблагоприятные события (AEs) были учтены от времени осознанного согласия до последующих мер безопасности (5 weeks±5 дней после окончательного пробы /отмены) и были закодированы с помощью MedDRA V.18.1.
Статистический анализ
Не были выполнены расчеты размера формальных выборки, как не какие статистические гипотезы были протестированы. Размер запланированной выборки был 20 пар мать – новорожденный. Все переменные PK были основаны на наблюдаемых значений; условный расчет не использован.
Результаты
Описание пациентов и базовые характеристики
В общей сложности 21 CZP-лечение беременных женщин включены в скрининг. Пять женщин прекращен скрининг, один из-за серьезных AEs (SAEs) плацентарной недостаточности и недоношенного младенца и четыре из-за несоответствия. На основе предварительных PK и анализа безопасности, которые показали последовательных данных для первоначального пар мать- новорожденный поступил в исследовании, окончательное число 16 беременных женщин была сочтена достаточной для оценки основной цель.
Все 16 матерей, которые вступили в период выборки завершил исследование (не пропустил посещений); 15 были на CZP 200 мг Q2W и один на CZP 400 мг Q4W. Среднее время между последней дозы CZP и родами было 11 дней (в диапазоне 1 – 27 дней). В
таблице 1показаны базовые характеристики всех участвующих матерей и их младенцев. Гестационный возраст и вес при рождении 16 младенцев был в ожидаемом диапазоне для здоровых младенцев.
Таблица 1
Базовые характеристики матерей и младенцев
Table 1
Baseline characteristics of mothers and infants
| Median (min, max), unless stated otherwise |
Mothers (n=16) a |
| Age, years |
31 (18, 40) |
| Mother’s indication for CZP treatment, n |
| Rheumatoid arthritis |
11 |
| Crohn’s disease |
3 |
| Psoriatic arthritis |
1 |
| Axial spondyloarthritis/ankylosing spondylitis |
1 |
| Delivery type, n |
| Vaginal |
14 |
| Caesarean section |
2 |
CZP плазменные концентрации
Медиана CZP плазменный уровень при родах для всех 16 участвующих матерей было 24,4 мкг/мл (диапазон 5.0 – 49.4 мкг/мл). Из 16 пуповины образцов, один был исключен (образец не собирался). Из 15 оставшихся образцов пуповины только три имели количественно CZP уровни (0,035 мкг/мл, 0.040 мкг/мл и 0,048 мкг/мл); Максимальная пуповина/мать соотношение плазмы для этих трех пуповин составляло 0.0025.
Из 16 детей, два были исключены из набора-протокола: один из-за недостающих данных при рождении и одно из-за неправдоподобную PK данных. Последний ребенок показал высокий плазменную концентрацию CZP при рождении (0,485 мкг/мл), вовремя 4 недели и неделя 8 образец результаты были ниже пробы LLOQ (<0,032 мкг/мл). С помощью двух различных PK подходов к моделированию, была весьма низкой вероятностью (<0,1%) ребенка с этой CZP концентрации при рождении для отображения уровней ниже LLOQ на 4 недели (Смотри онлайн
дополнительное приложение полного исследования).
Дополнительный файл 1
[SP1.pdf]
Из 14 младенцев в наборе-протокол, 13 имели не поддающихся количественной оценке CZP плазме крови при рождении (<0,032 мкг/мл), и один ребенок имел минимальный уровень CZP при рождении составляет 0,042 мкг/мл (соотношение 0,0009 младенческой/мать плазмы). Ни у одного ребенка не было количественно CZP плазменные уровни на 4 недели (два образца отсутствует) и на 8 недели (
рис. 2; онлайн
Дополнительная таблица 1). Девять матерей продолжал CZP послеродовой и кормили грудью их младенцев; ни один из этих детей не имел количественно CZP плазменные уровни.
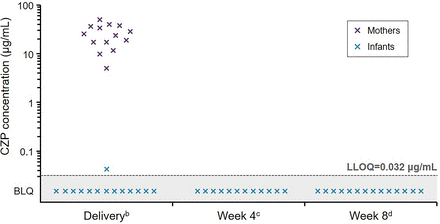
Рисунок 2
CZP концентрации в плазме в матерей и младенцев (n = 14 пар мать- новорожденный
a). a Два из 16 младенцев были исключены из набора заключительного протокола: один из-за недостающих данных при рождении и из-за недостоверный PK данные (т.е., не согласуется с педиатрической CZP PK модель, основанную на ожидаемый диапазон выделения , объем распределения и последующих период полувыведения; Смотреть онлайн
дополнительное приложение);
bМладенческой образцы были собраны в течение 24 часов после родов, в то время как мать образцы могут быть собраны в течение 24 часов до или после родов;
c±7 дней (два образца отсутствует);
d±7 дней. BLQ, ниже LLOQ (< 0,032 мкг/мл); CZP, certolizumab pegol; LLOQ, нижний предел количественного определения.
PEG концентрации в плазме
Медиана PEG плазменный уровень при родах для всех 16 матерей было 30.0 мкг/мл (диапазон 10.1-59,9 мкг/мл). Из 15 образцов доступных пуповины 14 были не поддающихся количественной оценке PEG; оставшиеся пуповины был 9,8 мкг/мл PEG (соответствующий CZP уровень был ниже LLOQ). Младенческой данные были не интерпретированы , из-за загрязнения PEG пробирки (Смотри онлайн
дополнительное приложение).
Анализ безопасности и иммуногенности
Наблюдение безопасности (до 5 weeks±5 дней после финальной пробы/завершение) включены 21 отобранных CZP-леченных матерей и 16 детей всех участвующие матерей. В целом, 15 матери (71,4%) имели 34 AEs и 5 младенцев (31,3%) испытывали 13 AEs; большинство AEs были легкой до умеренной (
Таблица 2). Две матери сообщили тяжелой AEs (ограничение трудоспособности и длительной потери трудоспособности), которые также были классифицированы как SAEs. Все SAEs матерей были разрешены, за исключением преждевременных родов младенца. Тяжелой AE инфекции было сообщено в одного ребенка, который также был SAE (
Таблица 2). Этот младенец имел неуточненную инфекцию, проявившуюся повышением белых кровяных телец без клинических признаков. Все SAEs младенца были решены. Аномалии развития не были замечены. Нет антител анти CZP были обнаружены у матерей, пуповине или у младенцев в любое время в ходе исследования.
Таблица 2
Обзор безопасности
Table 2
Safety overview
| n (%)a |
Mothers (n=21)b |
Infants (n=16) |
| Any TEAEs |
15 (71.4) |
5 (31.3) |
| Mild TEAEs |
4 (19.0) |
2 (12.5) |
| Moderate TEAEs |
9 (42.9) |
2 (12.5) |
| Severe TEAEs |
2 (9.5) |
1 (6.3) |
| Discontinuation due to TEAEs |
2 (9.5) |
0 |
| Drug-related TEAEs |
3 (14.3) |
1 (6.3) |
| Serious TEAEsc |
7 (33.3) |
2 (12.5) |
| Deaths |
0 |
0 |
| Serious TEAEs by mother–infant pair |
| SF |
Placental insufficiency
Premature baby |
N/A |
| 1 |
Arrested labour |
None |
| 2 |
Arrested labour |
None |
| 3 |
Prolonged labour |
None |
| 4 |
Gestational diabetes
Polyhydramnios |
None |
| 5 |
None |
Hypoglycaemia
Infection |
| 6 |
Perineal abscess |
None |
| 7 |
Vaginal laceration |
Macrosomia
Meconium in amniotic fluid |
ТЕАЕ были определены как любое неблагоприятное событие (НС) adverse event (AE), зафиксированное с момента получения осознанного согласия до принятия последующих мер по обеспечению безопасности; жирный текст указывает на серьезные ТЕАЕ.
а число матерей и младенцев с доложенным по крайней мере один AE для указанной категории.
b Комплекс безопасности для матерей (включает пять невключение по результатам предварительного обследования, отсеивание по результатам скрининга).
с серьезным TEAEs были классифицированы, используя Соединенные Штаты пищевых продуктов и медикаментов администрации определения серьезных AEs.
TEAE, treatment-emergent adverse event неблагоприятные события возникающим во время лечения; SF, screen failure невключение по результатам предварительного обследования, отсеивание по результатам скрининга; N/A, not applicable не применимо.
Обсуждение
Женщины с диагнозом CIDs в репродуктивном возрасте может понадобиться эффективного лечения для контроля активности болезни во время беременности. Однако ограниченные данные, опубликованные до настоящего времени ставят женщин и лечащих врачи в сложной ситуации, решая, следует ли продолжать анти ФНО терапии во время беременности. Хотя некоторые недавние рекомендации по лечению в ревматологии и гастроэнтерологии заявить, что CZP может продолжаться на протяжении беременности, осуществление в клинической практике значительно варьируется в разные специальности, участвующих в уход за беременными женщинами. Обострение болезни во время беременности связаны с повышенным риском выкидыша, преждевременных родов и низкого веса при рождении, и может быть более пагубным для неонатальных исходов, чем любые потенциальные риски, связанные с анти ФНО терапии. Таким образом активность болезни должны контролироваться через оптимизированную медицинской терапии во время беременности, принимая во внимание возможное влияние анти ФТП на иммунный ответ
в утробе матери подвергаются младенцев.
CRIB был первым под эгидой промышленности PK исследование оценки плацентарной передачи биологических, CZP, от матерей к их младенцам. Матери CZP плазменные концентрации находились в пределах ожидаемого терапевтического, подтверждает, что все матери в исследовании CRIB надлежащим образом подвергаются действию CZP ко времени родов. Используя новые, весьма чувствительной и CZP-специфические пробы, 13 из 14 младенцев не имели поддающихся количественной оценке CZP плазменные уровни при рождении. В одного ребенка при измерении уровня при рождении CZP концентрация составляла 0,09% уровня материнской CZP плазмы, которая вряд ли будет иметь любой клинической значимости. К 4 и 8 недели, после родов были не поддающихся количественной оценке уровней CZP в плазме крови новорожденных. Результаты данные пуповины согласовывались с младенческой плазмой. AEs на матерей согласуются с известных безопасности профиля CZP и ожидается во время беременности в наблюдавшее женщин с этих основных CIDs события. AEs опытных младенцев не показали каких-либо моделей или кластеры событий, предлагая специфические сигнал безопасности у детей.
На сегодняшний день, были опубликованы два исследования по плацентарной передачи анти ФТП: одна у женщин с CD на Mahadevan et al
. (матери, пуповины и младенческой пробы при рождении) и одна из женщин с РА и axSpA, Förger
и др. (материнской и пуповинной образцы, собранные при рождении). CRIB значительно расширяет на имеющихся данных, потому что он был призван оценить плацентарной передачи CZP и дальнейшего понять PK профиль CZP на 4 и 8 недель у младенца
в утробе матери, в случае плацентарной передачи. Кроме того, для повышения точности измерения CZP, была разработана новая проба electrochemiluminescence. Эта технология предложили значительно улучшилась специфичность и чувствительность над ELISA, ранее используемые Mahadevan
et al. и Förger
и др.
ELISAs обеспечивают сравнительно простой, высокопроизводительный метод измерения концентрации препарата в крови человека. Используя такой тип анализа, Mahadevan
et al. показал низкий уровень передачи плацентарной CZP (средний пуповина/мать процент 3,9%), по сравнению с adalimumab (средний пуповина/мать процент 153%) и инфликсимаб (средний пуповина/мать процент 160%). Förger
et al. сообщили аналогичные выводы для CZP (максимальная пуповина/мать процент 3,8%). Хотя ELISA используется в этих двух исследованиях соответствует нормативным требованиям и протестирована для измерения концентрации терапевтического спектра CZP, обычно в лечение взрослых, он не был разработан для измерения низких концентрациях CZP особенно при плацентарной передаче (LLOQ ИФА 0,41 мкг/мл). Кроме того, обнаруживаем реагентом , было человеческое антитело лёгкие цепи Каппа, который не является специфичным для CZP и может обнаружить другие TNF-связанные антител, такие как естественные аутоантитела к TNFα, или другие терапевтические анти ФНО антител, которые можно найти как у больных с CIDs и здоровых людей. Напротив, новый electrochemiluminescence проба используется в CRIB весьма специфический для CZP, так как он использует TNF-покрытием электрода для захвата CZP и антитело против PEG как реагент обнаружения. Кроме того, в LLOQ 0,032 мкг/мл, новая проба более чем в 10 раз более чувствителен, чем предыдущая ELISA. Следовательно, этот проба позволило нам предоставлять гораздо более точные данные относительно плацентарной передачи CZP, которое может быть переведено с большей уверенностью в научно обоснованной клинической практике.
Одно ограничение CRIB исследования является тот факт, что профиль PK CZP у беременных женщин не характеризовался полностью во время беременности, поскольку матери образцы были собраны только при родах. Было бы полезно для измерения материнской CZP концентрации ранее во время беременности и для изучения потенциального воздействия нагрузочной дозы (CZP 400 мг на 0, 2 и 4 недель) при инициировании CZP лечения во время беременности женщин. Чтобы ответить на эти вопросы необходимы дальнейшие исследования.
Было высказано предположение о том, что TNFα могут играть определенную роль в нормальное развитие иммунной системы. Однако, TNFα-недостаточным мышей, созданных генным таргетированием, имеют нормальный вторичных лимфоидных органов, предполагая, что TNFα не является необходимым для лимфоидных органогенеза. Удивительно, у этих мышей отсутствует первичных B клеток фолликулов в селезенке, хотя этого функционального дефекта может быть избавлен комплементарностью TNFα экспрессии. В то время как у грызунов развиваются зародышевых центров и B клеток фолликулов в начале беременности, в организме человека, этот процесс начинается в третьем триместре беременности и продолжается через 8 недель после родов. Результаты исследования CRIB предложили минимальной плацентарной передачи CZP во время третьего триместра беременности, и минимальный уровень обнаружен у одного ребенка при рождении (<0,1% от взрослого терапевтического уровня) может быть предполагается, не влияет на иммунную систему развития. Кроме того, исследование беременных макаки обезьян изучить эффект анти ФНО golimumab органогенеза и перинатальной/послеродового периода. Golimumab, который имеет Fc часть и, как ожидается, поэтому активно проникает через плаценту, был найден в высоких концентрациях в неонатальной макак и сохраняется в течение 6 месяцев после родов. Однако были не существенные последствия на лимфоидные органы развития и иммунной функции, предложив еще раз, что TNFα может быть необязательным для развития иммунной системы во время беременности.
Люди рождаются с незрелой иммунной системой и имеют повышенный риск инфекции, по сравнению с взрослыми, полагаясь на врожденные иммунные реакции и материнских антител, переданных через плаценту и через грудное молоко. Пока мало исследований изучили долгосрочной безопасности анти TNFs внутриутробно подвергнутых воздействию детей. За исключением CZP все утвержденные анти TNFs (инфликсимаб, adalimumab, golimumab и этанерцепт) содержат IgG1 Fc фрагмент , который позволяет FcRn опосредованный транспорт через плаценту. В рамках проспективного исследования детей, рожденных от матерей, получавших анти TNFs во время беременности, adalimumab и инфликсимаб могут быть обнаружены в крови младенцев до 12 месяцев, благодаря IgG рециркуляции новорожденных через FcRn. Это вызывает озабоченность в отношении потенциальный риск инфекции и проблемы вакцинация новорожденных подвержены анти TNFs
в утробе матери. Напротив, в CRIB, там были не поддающихся количественной оценке уровней CZP в плазме крови новорожденных через 4 и 8 недель после рождения, и AEs опытных младенцев не предлагают конкретных безопасности сигнал. Хотя эти результаты можно считать обнадеживающими, долгосрочные обсервационные исследования необходимы для полностью характеризуют профиль безопасности CZP грудных детей облученных матерей.
Помимо влияния анти TNFs на новорожденных иммунной системы, важно также принимать во внимание потенциальное воздействие внутриутробного воздействия ранее во время беременности, особенно в первом триместре, прежде чем полностью формируется плацента и когда происходит органогенеза. Последние систематические обзоры и мета анализы не нашли ассоциации анти TNF экспозиции в первом триместре с неблагоприятных исходов беременности. Кроме того, доказательства, собранные через фармаконадзора отчетности, поддерживает вывод, что матери CZP экспозиции в первом триместре, по-видимому, не увеличивают риск нежелательных неонатальных исходов или основных пороков развития. На заметку, 10 из 14 детей в CRIB родились от матерей, подвергающихся лечению в первом триместре.
В заключение наши данные не обнаружили минимальный плацентарной передачи CZP от матери ребенку, предполагая отсутствие воздействия, на плод
в утробе матери в третьем триместре. В сочетании с имеющейся в настоящее время относительно исходов беременности у женщин подвергается CZP во время первого триместра, которые не указывают увеличилась частоты основных пороков, результаты CRIB исследования поддерживают продолжение лечения CZP во время беременности, когда считается что это необходимым для контроля активности заболевания.

 Рисунок 1
Дизайн исследования CRIB
Последний certolizumab pegol (CZP) вводился за 35 дней до родов.
Подобранные женщины были ≥30 недель беременности на момент информированного согласия. Поскольку CRIB postmarketing исследование, всех женщин, зачисленных лечили коммерческим CZP по утвержденных показаниям (RA, axSpA/как, PsA и CD), как это предусмотрено их лечащим врачам. Пациенты должны были получать CZP дозы в течение 35 дней до родов. Решение продолжить CZP лечение во время беременности было принято лечащими врачами до и независимо от участия в исследовании. CZP был не предоставляются спонсором исследования.
У больных с любых связанных с беременностью, клинически значимых аномалий, отмеченными на акушерское УЗИ или другими методами изображений, с значительных лабораторных отклонений во время беременности, или любые признаки хронического или острого uteroplacental недостаточность имели право участвовать. Матерей, которые получали лечение с любым биологическим или каких-либо анти ФНО помимо CZP во время беременности были исключены, поскольку были матерями, которые принимают или приняла какие-либо лекарства с сильным риском тератогенности человеческого плода во время беременности. Также исключается были матерями с положительным или неопределенного туберкулез (ТБ) тест на скрининг, с активной или латентной инфекцией ТБ или с высоким риском инфекции ТБ.
Процедуры изучения
Матери получили коммерческие CZP или в 2 недели доза (CZP 200 мг каждые 2 недели [Q2W]) или 4-еженедельник доза режима (CZP 400 мг каждые 4 недели [Q4W]), по усмотрению их назначающих.
Образцы крови матери (≤4 мл на пробу) были собраны в течение 24 часов до или после родов. Образцы пуповинной (≤4 мл на сэмпл) были собраны в течение 1 часа после рождения. Образцы детской крови (≤1.2 мл на сэмпл) были собраны в течение 24 часов после рождения и на 4 и 8 послеродовой недели (рис. 1). Образцы, собранные при доставке/рождении были получены в больнице параметр, в то время как посещений на дому патронажными медсестрами на 4 и 8 недель для минимизации нагрузки на матерей.
CZP концентрация была измерена во всех образцах плазмы. Объем Разрешительные, анти CZP антител и общая полиэтиленгликоля (PEG) уровнях (нативный CZP, deconjugated PEG или других источников PEG) также были измерены. CZP и анти CZP уровни были измерены в Covance Inc. (Шантильи, VA, США). Общий уровень PEG были измерены в Intertek фармацевтические услуги (Манчестер, Великобритания).
CZP концентрации были измерены с помощью иммуноферментного анализа electrochemiluminescence, проверяются в плазме крови человека. Количественный анализ был разработан для оптимальной чувствительности и специфичности: CZP был захвачен TNF-покрытием multiarray электрода и обнаружены антитела анти PEG до чтения MESO SCALE DISCOVERY платформы (MSD; Роквилл, MD, США). Количественный анализ специфичный для CZP и > 10 раз более чувствительной (нижний предел квантификации [LLOQ] 0,032 мкг/мл) чем предыдущая ELISA используется в других исследованиях CZP PK. Анти-CZP антитела были измерены с помощью ранее утвержденных ELISA (образцы были положительными, если уровни антител анти CZP > 2,4 единиц/мл). Общая PEG концентрация определяется спектроскопия ядерного магнитного резонанса (LLOQ 2,5 мкг/мл).
Конечными точками исследования
Первичной конечной точкой была концентрация CZP в плазме крови новорожденных при рождении. CZP и анти CZP уровни антител в плазме и пуповины матерей были вторичными (средними) конечными точками. Произвольное конечные точки включают CZP уровень в плазме крови новорожденных на недели 4 и 8, уровни антител анти CZP в плазме крови новорожденных при рождении и 4 и 8 недели и PEG концентрации в плазме матери, пуповине и младенцев.
Анализ безопасности включены все матери, которые получили по крайней мере одна доза CZP, включая ошибки отбора и детей всех матерей, которые попали в период выборки. Неблагоприятные события (AEs) были учтены от времени осознанного согласия до последующих мер безопасности (5 weeks±5 дней после окончательного пробы /отмены) и были закодированы с помощью MedDRA V.18.1.
Статистический анализ
Не были выполнены расчеты размера формальных выборки, как не какие статистические гипотезы были протестированы. Размер запланированной выборки был 20 пар мать – новорожденный. Все переменные PK были основаны на наблюдаемых значений; условный расчет не использован.
Результаты
Описание пациентов и базовые характеристики
В общей сложности 21 CZP-лечение беременных женщин включены в скрининг. Пять женщин прекращен скрининг, один из-за серьезных AEs (SAEs) плацентарной недостаточности и недоношенного младенца и четыре из-за несоответствия. На основе предварительных PK и анализа безопасности, которые показали последовательных данных для первоначального пар мать- новорожденный поступил в исследовании, окончательное число 16 беременных женщин была сочтена достаточной для оценки основной цель.
Все 16 матерей, которые вступили в период выборки завершил исследование (не пропустил посещений); 15 были на CZP 200 мг Q2W и один на CZP 400 мг Q4W. Среднее время между последней дозы CZP и родами было 11 дней (в диапазоне 1 – 27 дней). В таблице 1показаны базовые характеристики всех участвующих матерей и их младенцев. Гестационный возраст и вес при рождении 16 младенцев был в ожидаемом диапазоне для здоровых младенцев.
Таблица 1
Базовые характеристики матерей и младенцев
Table 1
Baseline characteristics of mothers and infants
Рисунок 1
Дизайн исследования CRIB
Последний certolizumab pegol (CZP) вводился за 35 дней до родов.
Подобранные женщины были ≥30 недель беременности на момент информированного согласия. Поскольку CRIB postmarketing исследование, всех женщин, зачисленных лечили коммерческим CZP по утвержденных показаниям (RA, axSpA/как, PsA и CD), как это предусмотрено их лечащим врачам. Пациенты должны были получать CZP дозы в течение 35 дней до родов. Решение продолжить CZP лечение во время беременности было принято лечащими врачами до и независимо от участия в исследовании. CZP был не предоставляются спонсором исследования.
У больных с любых связанных с беременностью, клинически значимых аномалий, отмеченными на акушерское УЗИ или другими методами изображений, с значительных лабораторных отклонений во время беременности, или любые признаки хронического или острого uteroplacental недостаточность имели право участвовать. Матерей, которые получали лечение с любым биологическим или каких-либо анти ФНО помимо CZP во время беременности были исключены, поскольку были матерями, которые принимают или приняла какие-либо лекарства с сильным риском тератогенности человеческого плода во время беременности. Также исключается были матерями с положительным или неопределенного туберкулез (ТБ) тест на скрининг, с активной или латентной инфекцией ТБ или с высоким риском инфекции ТБ.
Процедуры изучения
Матери получили коммерческие CZP или в 2 недели доза (CZP 200 мг каждые 2 недели [Q2W]) или 4-еженедельник доза режима (CZP 400 мг каждые 4 недели [Q4W]), по усмотрению их назначающих.
Образцы крови матери (≤4 мл на пробу) были собраны в течение 24 часов до или после родов. Образцы пуповинной (≤4 мл на сэмпл) были собраны в течение 1 часа после рождения. Образцы детской крови (≤1.2 мл на сэмпл) были собраны в течение 24 часов после рождения и на 4 и 8 послеродовой недели (рис. 1). Образцы, собранные при доставке/рождении были получены в больнице параметр, в то время как посещений на дому патронажными медсестрами на 4 и 8 недель для минимизации нагрузки на матерей.
CZP концентрация была измерена во всех образцах плазмы. Объем Разрешительные, анти CZP антител и общая полиэтиленгликоля (PEG) уровнях (нативный CZP, deconjugated PEG или других источников PEG) также были измерены. CZP и анти CZP уровни были измерены в Covance Inc. (Шантильи, VA, США). Общий уровень PEG были измерены в Intertek фармацевтические услуги (Манчестер, Великобритания).
CZP концентрации были измерены с помощью иммуноферментного анализа electrochemiluminescence, проверяются в плазме крови человека. Количественный анализ был разработан для оптимальной чувствительности и специфичности: CZP был захвачен TNF-покрытием multiarray электрода и обнаружены антитела анти PEG до чтения MESO SCALE DISCOVERY платформы (MSD; Роквилл, MD, США). Количественный анализ специфичный для CZP и > 10 раз более чувствительной (нижний предел квантификации [LLOQ] 0,032 мкг/мл) чем предыдущая ELISA используется в других исследованиях CZP PK. Анти-CZP антитела были измерены с помощью ранее утвержденных ELISA (образцы были положительными, если уровни антител анти CZP > 2,4 единиц/мл). Общая PEG концентрация определяется спектроскопия ядерного магнитного резонанса (LLOQ 2,5 мкг/мл).
Конечными точками исследования
Первичной конечной точкой была концентрация CZP в плазме крови новорожденных при рождении. CZP и анти CZP уровни антител в плазме и пуповины матерей были вторичными (средними) конечными точками. Произвольное конечные точки включают CZP уровень в плазме крови новорожденных на недели 4 и 8, уровни антител анти CZP в плазме крови новорожденных при рождении и 4 и 8 недели и PEG концентрации в плазме матери, пуповине и младенцев.
Анализ безопасности включены все матери, которые получили по крайней мере одна доза CZP, включая ошибки отбора и детей всех матерей, которые попали в период выборки. Неблагоприятные события (AEs) были учтены от времени осознанного согласия до последующих мер безопасности (5 weeks±5 дней после окончательного пробы /отмены) и были закодированы с помощью MedDRA V.18.1.
Статистический анализ
Не были выполнены расчеты размера формальных выборки, как не какие статистические гипотезы были протестированы. Размер запланированной выборки был 20 пар мать – новорожденный. Все переменные PK были основаны на наблюдаемых значений; условный расчет не использован.
Результаты
Описание пациентов и базовые характеристики
В общей сложности 21 CZP-лечение беременных женщин включены в скрининг. Пять женщин прекращен скрининг, один из-за серьезных AEs (SAEs) плацентарной недостаточности и недоношенного младенца и четыре из-за несоответствия. На основе предварительных PK и анализа безопасности, которые показали последовательных данных для первоначального пар мать- новорожденный поступил в исследовании, окончательное число 16 беременных женщин была сочтена достаточной для оценки основной цель.
Все 16 матерей, которые вступили в период выборки завершил исследование (не пропустил посещений); 15 были на CZP 200 мг Q2W и один на CZP 400 мг Q4W. Среднее время между последней дозы CZP и родами было 11 дней (в диапазоне 1 – 27 дней). В таблице 1показаны базовые характеристики всех участвующих матерей и их младенцев. Гестационный возраст и вес при рождении 16 младенцев был в ожидаемом диапазоне для здоровых младенцев.
Таблица 1
Базовые характеристики матерей и младенцев
Table 1
Baseline characteristics of mothers and infants
 Рисунок 2
CZP концентрации в плазме в матерей и младенцев (n = 14 пар мать- новорожденныйa). a Два из 16 младенцев были исключены из набора заключительного протокола: один из-за недостающих данных при рождении и из-за недостоверный PK данные (т.е., не согласуется с педиатрической CZP PK модель, основанную на ожидаемый диапазон выделения , объем распределения и последующих период полувыведения; Смотреть онлайн дополнительное приложение); bМладенческой образцы были собраны в течение 24 часов после родов, в то время как мать образцы могут быть собраны в течение 24 часов до или после родов; c±7 дней (два образца отсутствует); d±7 дней. BLQ, ниже LLOQ (< 0,032 мкг/мл); CZP, certolizumab pegol; LLOQ, нижний предел количественного определения.
PEG концентрации в плазме
Медиана PEG плазменный уровень при родах для всех 16 матерей было 30.0 мкг/мл (диапазон 10.1-59,9 мкг/мл). Из 15 образцов доступных пуповины 14 были не поддающихся количественной оценке PEG; оставшиеся пуповины был 9,8 мкг/мл PEG (соответствующий CZP уровень был ниже LLOQ). Младенческой данные были не интерпретированы , из-за загрязнения PEG пробирки (Смотри онлайн дополнительное приложение).
Анализ безопасности и иммуногенности
Наблюдение безопасности (до 5 weeks±5 дней после финальной пробы/завершение) включены 21 отобранных CZP-леченных матерей и 16 детей всех участвующие матерей. В целом, 15 матери (71,4%) имели 34 AEs и 5 младенцев (31,3%) испытывали 13 AEs; большинство AEs были легкой до умеренной (Таблица 2). Две матери сообщили тяжелой AEs (ограничение трудоспособности и длительной потери трудоспособности), которые также были классифицированы как SAEs. Все SAEs матерей были разрешены, за исключением преждевременных родов младенца. Тяжелой AE инфекции было сообщено в одного ребенка, который также был SAE (Таблица 2). Этот младенец имел неуточненную инфекцию, проявившуюся повышением белых кровяных телец без клинических признаков. Все SAEs младенца были решены. Аномалии развития не были замечены. Нет антител анти CZP были обнаружены у матерей, пуповине или у младенцев в любое время в ходе исследования.
Таблица 2
Обзор безопасности
Table 2
Safety overview
Рисунок 2
CZP концентрации в плазме в матерей и младенцев (n = 14 пар мать- новорожденныйa). a Два из 16 младенцев были исключены из набора заключительного протокола: один из-за недостающих данных при рождении и из-за недостоверный PK данные (т.е., не согласуется с педиатрической CZP PK модель, основанную на ожидаемый диапазон выделения , объем распределения и последующих период полувыведения; Смотреть онлайн дополнительное приложение); bМладенческой образцы были собраны в течение 24 часов после родов, в то время как мать образцы могут быть собраны в течение 24 часов до или после родов; c±7 дней (два образца отсутствует); d±7 дней. BLQ, ниже LLOQ (< 0,032 мкг/мл); CZP, certolizumab pegol; LLOQ, нижний предел количественного определения.
PEG концентрации в плазме
Медиана PEG плазменный уровень при родах для всех 16 матерей было 30.0 мкг/мл (диапазон 10.1-59,9 мкг/мл). Из 15 образцов доступных пуповины 14 были не поддающихся количественной оценке PEG; оставшиеся пуповины был 9,8 мкг/мл PEG (соответствующий CZP уровень был ниже LLOQ). Младенческой данные были не интерпретированы , из-за загрязнения PEG пробирки (Смотри онлайн дополнительное приложение).
Анализ безопасности и иммуногенности
Наблюдение безопасности (до 5 weeks±5 дней после финальной пробы/завершение) включены 21 отобранных CZP-леченных матерей и 16 детей всех участвующие матерей. В целом, 15 матери (71,4%) имели 34 AEs и 5 младенцев (31,3%) испытывали 13 AEs; большинство AEs были легкой до умеренной (Таблица 2). Две матери сообщили тяжелой AEs (ограничение трудоспособности и длительной потери трудоспособности), которые также были классифицированы как SAEs. Все SAEs матерей были разрешены, за исключением преждевременных родов младенца. Тяжелой AE инфекции было сообщено в одного ребенка, который также был SAE (Таблица 2). Этот младенец имел неуточненную инфекцию, проявившуюся повышением белых кровяных телец без клинических признаков. Все SAEs младенца были решены. Аномалии развития не были замечены. Нет антител анти CZP были обнаружены у матерей, пуповине или у младенцев в любое время в ходе исследования.
Таблица 2
Обзор безопасности
Table 2
Safety overview

 Рисунок 1
Дизайн исследования CRIB
Последний certolizumab pegol (CZP) вводился за 35 дней до родов.
Подобранные женщины были ≥30 недель беременности на момент информированного согласия. Поскольку CRIB postmarketing исследование, всех женщин, зачисленных лечили коммерческим CZP по утвержденных показаниям (RA, axSpA/как, PsA и CD), как это предусмотрено их лечащим врачам. Пациенты должны были получать CZP дозы в течение 35 дней до родов. Решение продолжить CZP лечение во время беременности было принято лечащими врачами до и независимо от участия в исследовании. CZP был не предоставляются спонсором исследования.
У больных с любых связанных с беременностью, клинически значимых аномалий, отмеченными на акушерское УЗИ или другими методами изображений, с значительных лабораторных отклонений во время беременности, или любые признаки хронического или острого uteroplacental недостаточность имели право участвовать. Матерей, которые получали лечение с любым биологическим или каких-либо анти ФНО помимо CZP во время беременности были исключены, поскольку были матерями, которые принимают или приняла какие-либо лекарства с сильным риском тератогенности человеческого плода во время беременности. Также исключается были матерями с положительным или неопределенного туберкулез (ТБ) тест на скрининг, с активной или латентной инфекцией ТБ или с высоким риском инфекции ТБ.
Процедуры изучения
Матери получили коммерческие CZP или в 2 недели доза (CZP 200 мг каждые 2 недели [Q2W]) или 4-еженедельник доза режима (CZP 400 мг каждые 4 недели [Q4W]), по усмотрению их назначающих.
Образцы крови матери (≤4 мл на пробу) были собраны в течение 24 часов до или после родов. Образцы пуповинной (≤4 мл на сэмпл) были собраны в течение 1 часа после рождения. Образцы детской крови (≤1.2 мл на сэмпл) были собраны в течение 24 часов после рождения и на 4 и 8 послеродовой недели (рис. 1). Образцы, собранные при доставке/рождении были получены в больнице параметр, в то время как посещений на дому патронажными медсестрами на 4 и 8 недель для минимизации нагрузки на матерей.
CZP концентрация была измерена во всех образцах плазмы. Объем Разрешительные, анти CZP антител и общая полиэтиленгликоля (PEG) уровнях (нативный CZP, deconjugated PEG или других источников PEG) также были измерены. CZP и анти CZP уровни были измерены в Covance Inc. (Шантильи, VA, США). Общий уровень PEG были измерены в Intertek фармацевтические услуги (Манчестер, Великобритания).
CZP концентрации были измерены с помощью иммуноферментного анализа electrochemiluminescence, проверяются в плазме крови человека. Количественный анализ был разработан для оптимальной чувствительности и специфичности: CZP был захвачен TNF-покрытием multiarray электрода и обнаружены антитела анти PEG до чтения MESO SCALE DISCOVERY платформы (MSD; Роквилл, MD, США). Количественный анализ специфичный для CZP и > 10 раз более чувствительной (нижний предел квантификации [LLOQ] 0,032 мкг/мл) чем предыдущая ELISA используется в других исследованиях CZP PK. Анти-CZP антитела были измерены с помощью ранее утвержденных ELISA (образцы были положительными, если уровни антител анти CZP > 2,4 единиц/мл). Общая PEG концентрация определяется спектроскопия ядерного магнитного резонанса (LLOQ 2,5 мкг/мл).
Конечными точками исследования
Первичной конечной точкой была концентрация CZP в плазме крови новорожденных при рождении. CZP и анти CZP уровни антител в плазме и пуповины матерей были вторичными (средними) конечными точками. Произвольное конечные точки включают CZP уровень в плазме крови новорожденных на недели 4 и 8, уровни антител анти CZP в плазме крови новорожденных при рождении и 4 и 8 недели и PEG концентрации в плазме матери, пуповине и младенцев.
Анализ безопасности включены все матери, которые получили по крайней мере одна доза CZP, включая ошибки отбора и детей всех матерей, которые попали в период выборки. Неблагоприятные события (AEs) были учтены от времени осознанного согласия до последующих мер безопасности (5 weeks±5 дней после окончательного пробы /отмены) и были закодированы с помощью MedDRA V.18.1.
Статистический анализ
Не были выполнены расчеты размера формальных выборки, как не какие статистические гипотезы были протестированы. Размер запланированной выборки был 20 пар мать – новорожденный. Все переменные PK были основаны на наблюдаемых значений; условный расчет не использован.
Результаты
Описание пациентов и базовые характеристики
В общей сложности 21 CZP-лечение беременных женщин включены в скрининг. Пять женщин прекращен скрининг, один из-за серьезных AEs (SAEs) плацентарной недостаточности и недоношенного младенца и четыре из-за несоответствия. На основе предварительных PK и анализа безопасности, которые показали последовательных данных для первоначального пар мать- новорожденный поступил в исследовании, окончательное число 16 беременных женщин была сочтена достаточной для оценки основной цель.
Все 16 матерей, которые вступили в период выборки завершил исследование (не пропустил посещений); 15 были на CZP 200 мг Q2W и один на CZP 400 мг Q4W. Среднее время между последней дозы CZP и родами было 11 дней (в диапазоне 1 – 27 дней). В таблице 1показаны базовые характеристики всех участвующих матерей и их младенцев. Гестационный возраст и вес при рождении 16 младенцев был в ожидаемом диапазоне для здоровых младенцев.
Таблица 1
Базовые характеристики матерей и младенцев
Table 1
Baseline characteristics of mothers and infants
Рисунок 1
Дизайн исследования CRIB
Последний certolizumab pegol (CZP) вводился за 35 дней до родов.
Подобранные женщины были ≥30 недель беременности на момент информированного согласия. Поскольку CRIB postmarketing исследование, всех женщин, зачисленных лечили коммерческим CZP по утвержденных показаниям (RA, axSpA/как, PsA и CD), как это предусмотрено их лечащим врачам. Пациенты должны были получать CZP дозы в течение 35 дней до родов. Решение продолжить CZP лечение во время беременности было принято лечащими врачами до и независимо от участия в исследовании. CZP был не предоставляются спонсором исследования.
У больных с любых связанных с беременностью, клинически значимых аномалий, отмеченными на акушерское УЗИ или другими методами изображений, с значительных лабораторных отклонений во время беременности, или любые признаки хронического или острого uteroplacental недостаточность имели право участвовать. Матерей, которые получали лечение с любым биологическим или каких-либо анти ФНО помимо CZP во время беременности были исключены, поскольку были матерями, которые принимают или приняла какие-либо лекарства с сильным риском тератогенности человеческого плода во время беременности. Также исключается были матерями с положительным или неопределенного туберкулез (ТБ) тест на скрининг, с активной или латентной инфекцией ТБ или с высоким риском инфекции ТБ.
Процедуры изучения
Матери получили коммерческие CZP или в 2 недели доза (CZP 200 мг каждые 2 недели [Q2W]) или 4-еженедельник доза режима (CZP 400 мг каждые 4 недели [Q4W]), по усмотрению их назначающих.
Образцы крови матери (≤4 мл на пробу) были собраны в течение 24 часов до или после родов. Образцы пуповинной (≤4 мл на сэмпл) были собраны в течение 1 часа после рождения. Образцы детской крови (≤1.2 мл на сэмпл) были собраны в течение 24 часов после рождения и на 4 и 8 послеродовой недели (рис. 1). Образцы, собранные при доставке/рождении были получены в больнице параметр, в то время как посещений на дому патронажными медсестрами на 4 и 8 недель для минимизации нагрузки на матерей.
CZP концентрация была измерена во всех образцах плазмы. Объем Разрешительные, анти CZP антител и общая полиэтиленгликоля (PEG) уровнях (нативный CZP, deconjugated PEG или других источников PEG) также были измерены. CZP и анти CZP уровни были измерены в Covance Inc. (Шантильи, VA, США). Общий уровень PEG были измерены в Intertek фармацевтические услуги (Манчестер, Великобритания).
CZP концентрации были измерены с помощью иммуноферментного анализа electrochemiluminescence, проверяются в плазме крови человека. Количественный анализ был разработан для оптимальной чувствительности и специфичности: CZP был захвачен TNF-покрытием multiarray электрода и обнаружены антитела анти PEG до чтения MESO SCALE DISCOVERY платформы (MSD; Роквилл, MD, США). Количественный анализ специфичный для CZP и > 10 раз более чувствительной (нижний предел квантификации [LLOQ] 0,032 мкг/мл) чем предыдущая ELISA используется в других исследованиях CZP PK. Анти-CZP антитела были измерены с помощью ранее утвержденных ELISA (образцы были положительными, если уровни антител анти CZP > 2,4 единиц/мл). Общая PEG концентрация определяется спектроскопия ядерного магнитного резонанса (LLOQ 2,5 мкг/мл).
Конечными точками исследования
Первичной конечной точкой была концентрация CZP в плазме крови новорожденных при рождении. CZP и анти CZP уровни антител в плазме и пуповины матерей были вторичными (средними) конечными точками. Произвольное конечные точки включают CZP уровень в плазме крови новорожденных на недели 4 и 8, уровни антител анти CZP в плазме крови новорожденных при рождении и 4 и 8 недели и PEG концентрации в плазме матери, пуповине и младенцев.
Анализ безопасности включены все матери, которые получили по крайней мере одна доза CZP, включая ошибки отбора и детей всех матерей, которые попали в период выборки. Неблагоприятные события (AEs) были учтены от времени осознанного согласия до последующих мер безопасности (5 weeks±5 дней после окончательного пробы /отмены) и были закодированы с помощью MedDRA V.18.1.
Статистический анализ
Не были выполнены расчеты размера формальных выборки, как не какие статистические гипотезы были протестированы. Размер запланированной выборки был 20 пар мать – новорожденный. Все переменные PK были основаны на наблюдаемых значений; условный расчет не использован.
Результаты
Описание пациентов и базовые характеристики
В общей сложности 21 CZP-лечение беременных женщин включены в скрининг. Пять женщин прекращен скрининг, один из-за серьезных AEs (SAEs) плацентарной недостаточности и недоношенного младенца и четыре из-за несоответствия. На основе предварительных PK и анализа безопасности, которые показали последовательных данных для первоначального пар мать- новорожденный поступил в исследовании, окончательное число 16 беременных женщин была сочтена достаточной для оценки основной цель.
Все 16 матерей, которые вступили в период выборки завершил исследование (не пропустил посещений); 15 были на CZP 200 мг Q2W и один на CZP 400 мг Q4W. Среднее время между последней дозы CZP и родами было 11 дней (в диапазоне 1 – 27 дней). В таблице 1показаны базовые характеристики всех участвующих матерей и их младенцев. Гестационный возраст и вес при рождении 16 младенцев был в ожидаемом диапазоне для здоровых младенцев.
Таблица 1
Базовые характеристики матерей и младенцев
Table 1
Baseline characteristics of mothers and infants
 Рисунок 2
CZP концентрации в плазме в матерей и младенцев (n = 14 пар мать- новорожденныйa). a Два из 16 младенцев были исключены из набора заключительного протокола: один из-за недостающих данных при рождении и из-за недостоверный PK данные (т.е., не согласуется с педиатрической CZP PK модель, основанную на ожидаемый диапазон выделения , объем распределения и последующих период полувыведения; Смотреть онлайн дополнительное приложение); bМладенческой образцы были собраны в течение 24 часов после родов, в то время как мать образцы могут быть собраны в течение 24 часов до или после родов; c±7 дней (два образца отсутствует); d±7 дней. BLQ, ниже LLOQ (< 0,032 мкг/мл); CZP, certolizumab pegol; LLOQ, нижний предел количественного определения.
PEG концентрации в плазме
Медиана PEG плазменный уровень при родах для всех 16 матерей было 30.0 мкг/мл (диапазон 10.1-59,9 мкг/мл). Из 15 образцов доступных пуповины 14 были не поддающихся количественной оценке PEG; оставшиеся пуповины был 9,8 мкг/мл PEG (соответствующий CZP уровень был ниже LLOQ). Младенческой данные были не интерпретированы , из-за загрязнения PEG пробирки (Смотри онлайн дополнительное приложение).
Анализ безопасности и иммуногенности
Наблюдение безопасности (до 5 weeks±5 дней после финальной пробы/завершение) включены 21 отобранных CZP-леченных матерей и 16 детей всех участвующие матерей. В целом, 15 матери (71,4%) имели 34 AEs и 5 младенцев (31,3%) испытывали 13 AEs; большинство AEs были легкой до умеренной (Таблица 2). Две матери сообщили тяжелой AEs (ограничение трудоспособности и длительной потери трудоспособности), которые также были классифицированы как SAEs. Все SAEs матерей были разрешены, за исключением преждевременных родов младенца. Тяжелой AE инфекции было сообщено в одного ребенка, который также был SAE (Таблица 2). Этот младенец имел неуточненную инфекцию, проявившуюся повышением белых кровяных телец без клинических признаков. Все SAEs младенца были решены. Аномалии развития не были замечены. Нет антител анти CZP были обнаружены у матерей, пуповине или у младенцев в любое время в ходе исследования.
Таблица 2
Обзор безопасности
Table 2
Safety overview
Рисунок 2
CZP концентрации в плазме в матерей и младенцев (n = 14 пар мать- новорожденныйa). a Два из 16 младенцев были исключены из набора заключительного протокола: один из-за недостающих данных при рождении и из-за недостоверный PK данные (т.е., не согласуется с педиатрической CZP PK модель, основанную на ожидаемый диапазон выделения , объем распределения и последующих период полувыведения; Смотреть онлайн дополнительное приложение); bМладенческой образцы были собраны в течение 24 часов после родов, в то время как мать образцы могут быть собраны в течение 24 часов до или после родов; c±7 дней (два образца отсутствует); d±7 дней. BLQ, ниже LLOQ (< 0,032 мкг/мл); CZP, certolizumab pegol; LLOQ, нижний предел количественного определения.
PEG концентрации в плазме
Медиана PEG плазменный уровень при родах для всех 16 матерей было 30.0 мкг/мл (диапазон 10.1-59,9 мкг/мл). Из 15 образцов доступных пуповины 14 были не поддающихся количественной оценке PEG; оставшиеся пуповины был 9,8 мкг/мл PEG (соответствующий CZP уровень был ниже LLOQ). Младенческой данные были не интерпретированы , из-за загрязнения PEG пробирки (Смотри онлайн дополнительное приложение).
Анализ безопасности и иммуногенности
Наблюдение безопасности (до 5 weeks±5 дней после финальной пробы/завершение) включены 21 отобранных CZP-леченных матерей и 16 детей всех участвующие матерей. В целом, 15 матери (71,4%) имели 34 AEs и 5 младенцев (31,3%) испытывали 13 AEs; большинство AEs были легкой до умеренной (Таблица 2). Две матери сообщили тяжелой AEs (ограничение трудоспособности и длительной потери трудоспособности), которые также были классифицированы как SAEs. Все SAEs матерей были разрешены, за исключением преждевременных родов младенца. Тяжелой AE инфекции было сообщено в одного ребенка, который также был SAE (Таблица 2). Этот младенец имел неуточненную инфекцию, проявившуюся повышением белых кровяных телец без клинических признаков. Все SAEs младенца были решены. Аномалии развития не были замечены. Нет антител анти CZP были обнаружены у матерей, пуповине или у младенцев в любое время в ходе исследования.
Таблица 2
Обзор безопасности
Table 2
Safety overview



