Целенаправленный анализ HLA у европиодной расы с миозитом выявляет значительные ассоциации с подгруппами аутоантител
Focused HLA analysis in Caucasians with myositis identifies significant associations with autoantibody subgroups.
Online issue publication June 12, 2019
Перевод:
Кудинова Эльвира Евгеньевна
Заведующая зональной лабораторией иммунологического типирования тканей
Государственное бюджетное учреждение Ростовской области «Станция переливания крови»
Ключевое заявление
Что уже известно об этом предмете?
► Считается, что самый сильный генетический риск среди пациентов с идиопатическими воспалительными миопатиями (IIM) находится в области человеческого лейкоцитарного антигена (HLA) в подгруппах, определенных аутоантителами.
Что добавляет это исследование?
► Данное исследование впервые показывает генетические различия между взрослыми и молодыми пациентами с аутоантителами к tif1.
► Аминокислотное вменение идентифицирует новые ассоциации с аутоантителами, которые сильнее, чем классические ассоциации HLA, указывая ключевые позиции в молекулах HLA, которые могут создавать риск.
Как это может повлиять на клиническую практику или будущие разработки?
► Различные ассоциации в взрослом и ювенильном дебюте заболевании с таким же аутоантителом предлагают различные этиологии и механизмы заболеванием.
► Поскольку аутоантитела при миозите коррелируют с конкретными клиническими особенностями заболевания, понимание генетического риска, лежащего в основе развития определенных профилей аутоантител, будет иметь значение для будущих исследований в ИВМ.

Аннотация
Цель: Идиопатические воспалительные миопатии (ИВM) представляют собой спектр редких аутоиммунных заболеваний, которые клинически характеризуются мышечной слабостью и поражением гетерогенных системных органов. Самый сильный генетический риск находится в пределах основного комплекса гистосовместимости major histocompatibility complex ( (MHC). Поскольку наличие аутоантител определяет специфические клинические подгруппы IIM, мы стремились соотнести серотип и генотип, чтобы идентифицировать новые варианты риска в области MHC, которые встречаются с аутоантителами IIM.
Методы Мы собрали доступные данные аутоантител в нашей когорте из 2582 кавказских пациентов с IIM. Аллели человеческого лейкоцитарного антигена высокого разрешения (HLA) и соответствующие аминокислотные последовательности были добавлены с использованием SNP2HLA из существующих данных генотипирования и тестированы на ассоциацию с 12 подгруппами аутоантител.
Результаты Мы сообщаем об ассоциациях с восемью аутоантителами, которые достигли уровня значимости в нашем исследовании p <2.9 × 10–5. Связи с 8,1 наследственным гаплотипом были обнаружены с анти-Jo-1 (HLA-B * 08: 01, p = 2,28 × 10–53 и HLA-DRB1 * 03: 01, p = 3,25 × 10–9), анти- PM / Scl (HLA-DQB1 * 02: 01, p = 1,47 × 10–26) и аутоантитела против cN1A (HLA-DRB1 * 03: 01, p = 1,40 × 10–11). Ассоциации, независимые от этого гаплотипа, были обнаружены с анти-Mi-2 (HLA-DRB1 * 07: 01, p = 4.92 × 10–13) и анти-HMGCR аутоантителами (HLA-DRB1 * 11, p = 5.09 × 10–6) , Аминокислотные положения могут быть более тесно связаны, чем классические ассоциации HLA; например, с аутоантителами против Jo-1 и положением 74 HLA-DRB1 (p = 3,47 × 10–64) и положением 9 HLA-B (p = 7,03 × 10–11). Мы сообщаем о новых генетических ассоциациях с HLA-DQB1 анти-TIF1 аутоантителами и идентифицируем гаплотипы, которые могут различаться у взрослых и ювенильных пациентов с этими аутоантителами.
Заключение Эти данные дают новое представление о функциональных последствиях генетических полиморфизмов в МНС. Поскольку аутоантитела в IIM коррелируют с конкретными клиническими особенностями заболевания, понимание генетического риска, лежащего в основе развития профилей аутоантител, имеет значение для будущих исследований.
Введение
Идиопатические воспалительные миопатии idiopathic inflammatory myopathies (IIM) представляют собой спектр редких аутоиммунных заболеваний, которые клинически характеризуются мышечной слабостью и поражением системных органов. Клинически IIM являются гетерогенными и могут быть классифицированы как дерматомиозит (СД), миозит с включением тела (IBM), иммуноопосредованная некротизирующая миопатия, полимиозит (ТЧ) и синдром антисинтетазы.
Аутоантитела к миозиту могут быть обнаружены приблизительно у 60–70% детей и взрослых с IIM3. 4 Аутоантитела, уникальные для IIM, известны как миозит-специфические аутоантитела (MSA), причем у пациентов редко имеется более одного MSA.5 Аутоантитела, которые присутствуют у пациентов с миозитом в сочетании с другим заболеванием соединительной ткани известны как аутоантитела, связанные с миозитом (MAA).
Клиническая классификация IIM может привести к гетерогенным подгруппам, однако, некоторые MSA-позитивные подгруппы имеют специфические клинические особенности и могут по-разному реагировать на лечение. Следовательно, статус аутоантител может быть более осмысленным для характеристики пациентов, чтобы понять патогенез и предсказать прогноз. Например, пациенты с антигистидил-тРНК-синтетазой (анти-Jo-1) обычно имеют миозит, феномен Рейно, полиартрит и высокую частоту интерстициальных заболеваний легких. У пациентов с аутоантителами, направленными против анти-Mi-2, присутствуют характерные кожные проявления СД, как правило, более мягкий миозит и благоприятный ответ на иммуносупрессивное лечение.
Считается, что IIM является сложным генетическим заболеванием, инициируемым иммунной активацией после специфических экологических событий у генетически предрасположенных людей. Основной комплекс гистосовместимости (MHC), также известный как человеческий лейкоцитарный антиген (HLA), последовательно идентифицируется как самый сильный фактор риска для IIM и клинических подгрупп. Исследования показали, что самые сильные ассоциации HLA среди пациентов с IIM обнаружены при расславанию по статусу аутоантител.
В частности, наибольший риск связан с гаплотипом предков 8,1 ancestral haplotype (предковый гаплотип )(AH 8,1), распространенным гаплотипом неравновесного экстенсивного сцепления (LD) в популяциях европиодов, который придает чувствительность к IIM и многим другим аутоиммунным или иммуноопосредованным заболеваниям.
Также сообщалось об ассоциациях с аллелями, независимыми от 8,1 АН. С тех пор были открыты новые MSA и MAA, и в небольших исследованиях были выявлены потенциальные ассоциации HLA с этими аутоантителами, например, HLA-DRB1 * 11: 01 у пациентов с 3-гидрокси-3-метилглутарил-кофермент А-редуктаза (анти-HMGCR) аутоантитела при заболевании у взрослых.
Здесь мы стремились соотнести серотип с генотипом у пациентов с IIM с достаточной статистической мощностью, чтобы идентифицировать новые варианты риска в области MHC, которые придают чувствительность к аутоантителам IIM, и обеспечить определенную когорту репликации для ранее сообщенных ассоциаций.
Методы
Популяционные исследования
Через Консорциум генетики миозита (MYOGEN) было набрано 2582 кавказских случая из 14 стран. Пациенты были зачислены в MYOGEN, если они удовлетворяли критериям Бохана и Питера для PM и СД у взрослых и несовершеннолетних, или по Григгсу, Совету по медицинским исследованиям (MRC) или Европейскому нервно-мышечному центру (ENMC) для пациентов с IBM. Общие контрольные генотипы были взяты из пула из 15 651 человека из 12 стран, как описано ранее. Генотипы еще от 19 британских пациентов с ювенильным возрастом были включены в исследование и репозиторий когортных биомаркеров ювенильного дерматомиозита. Пациенты были классифицированы как имеющие ювенильный IIM, если возраст начала был <16 лет, за исключением США, где ювенильный возраст был 18 лет.
Тестирование антител.
Соответствующие миозиту аутоантитела были обнаружены с использованием иммунопреципитации (IP), линейного блоттинга или ELISA, как подробно описано в дополнительной онлайн-таблице 2. Дополнительные подробности описаны в дополнительном онлайн-методе.
Генотипирование
Генотипирование проводилось в соответствии с британскими и американскими протоколами Illumina (Центр исследований генетики и геномики, артрит Великобритании, Манчестерский университет; Институт Файнштейна, Нью-Йорк; Университетский колледж Лондона, Лондон, Великобритания). Стандартный контроль качества (КК) был выполнен, как описано ранее.
Выполнение HLA.
Классические аллели HLA и соответствующие аминокислотные последовательности были включены с использованием SNP2HLA со справочными данными, собранными Консорциумом по генетике диабета 1 типа. Случаи и контроли были соединены вместе. После контроля качества были удалены варианты с частотой аллелей менее 0,01 и варианты с информационной оценкой менее 0,8.
Статистический анализ
Мы использовали дизайн исследования случай-контроль в каждом анализе подгруппы аутоантител. Контроли были сопоставлены по этнической принадлежности с использованием анализа основных компонентов (PCA) из-за отсутствия географически сопоставленных контролей для каждой когорты IIM. Четыре здоровых контроля для каждого случая были сопоставлены по этнической принадлежности с использованием (PCA) координат с использованием метода, описанного ранее. Анализ был выполнен в R (V.3.1.0) для дозировки вариантов (вероятности генотипа), которая учитывает неопределенность вменения. Была проведена ассоциация с одним тестом для аллелей HLA и комплексные тесты для многоядерных мест. Для многоаллельных мест, таких как аминокислоты, мы определили наиболее распространенный остаток или аллель в контрольной популяции, который будет выбран в качестве эталона. Логистическая регрессия предполагает, что для проверки связи использовалась аддитивная модель, пол и 10 основных компонентов были включены в качестве ковариат. Последующая пошаговая логистическая регрессия была использована для проверки независимых эффектов, зависящих от варианта интереса. Соотношения ORs были получены с помощью многомерной логистической регрессии. Значимость определяли как p <2,9 × 10–5 на основе поправки Бонферрони к вариантам до QC 1700, определенным SNP2HLA.
Результаты
Частоты аутоантител в изучаемой популяции
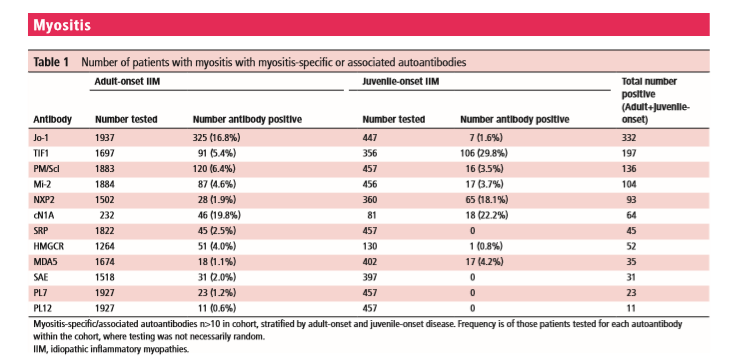
Генетические данные были доступны для 2582 пациентов с IIM, большинство из которых были проверены по крайней мере для одного аутоантитела. Количество положительных случаев аутоантител в когорте показано в таблице 1 для групп, где n> 10. Частоты аутоантител в процентах от таковых у испытуемых и не обязательно отражают распространенность аутоантител в популяции IIM.
Таблица 1 число больных миозитом с миозит-специфическими или ассоциированными аутоантителами
Сильные классические ассоциации HLA наблюдаются в подгруппах аутоантител IIM
Качество данных оценивалось после включения путем определения соответствия между вмененными аллелями и существующим типированием HLA по технологии секвенирования следующего поколения (HistoGenetics, Нью-Йорк, США) для 162 человек. Был высокий уровень согласованности во всех локусах как для 2-значных (96,6–100%), так и для 4-значных (94,8–100%) аллелей (дополнительная онлайн-таблица 3). После строгого контроля качества, удаляющего варианты с низкой частотой (<0,01) и низкой точностью вменения (r2 <0,8), наш анализ включал 509 классических аллелей HLA и аминокислот. В первичном анализе случаи заболевания у взрослых и у детей были объединены и проанализированы вместе в сопоставимых здоровых контролях. Ассоциации аутоантител, достигающие значимости р <2,9 × 10–5 для всего исследования, приведены в таблице 2.
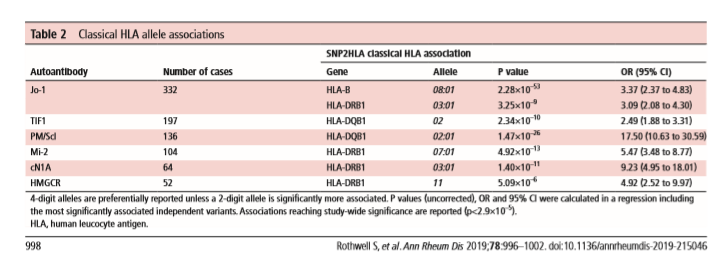
Самая сильная связь HLA была обнаружена с аутоантителами против Jo-1 и HLA-B * 08: 01 (р = 2,28 × 10–53, OR = 3,37, 95% ДИ от 2,37 до 4,83). Кондиционирование на HLA-B * 08: 01 в модели ступенчатой логистической регрессии выявило независимую связь с HLA-DRB1 * 03: 01 (p = 3,25 × 10–9, OR = 3,09, 95% ДИ от 2,08 до 4,30). Мы проанализировали пациентов, позитивных по антисинтетазным аутоантителам, как группу (n = 381), и сила ассоциации стала сильнее (HLA-B * 08: 01, p = 1,79 × 10–56, OR = 3,14, 95% ДИ от 2,27 до 4,38 и HLA-DRB1 * 03: 01, р = 3,31 × 10–9, OR = 2,73, 95% ДИ от 1,96 до 3,80). Мы не обнаружили ассоциаций с более редкими аминоацил-тРНК-синтетазами по отдельности, вероятно, из-за небольшого размера выборки. Однако в небольшом размере выборки из 23 пациентов только 30,4% пациентов с антителами против PL7 несли HLA-DRB1 * 03: 01 по сравнению с 79,2% пациентов с аутоантителами против Jo-1 и 23% здоровых контрольных пациентов. (онлайн дополнительная таблица 4). Это может свидетельствовать о том, что не все антисинтетазные аутоантитела имеют одинаковые ассоциации с 8,1 АГ. Необработанные генотипы HLA «фазового гаплотипа» у пациентов с более редкими аутоантителами к антисинтетазе включены в дополнительные онлайн таблицы 5-10.
Сильная ассоциация HLA наблюдалась у пациентов с аутоантителами против TIF1 с группой HLA-аллелей DQB1 * 02 (р = 2,34 × 10–10, OR = 2,49, 95% ДИ 1,88–3,31). В этой аллельной группе были ассоциации с HLA-DQB1 * 02: 01 (p = 1,69 × 10–5) и HLA-DQB1 * 02: 02 (p = 1,04 × 10–4).
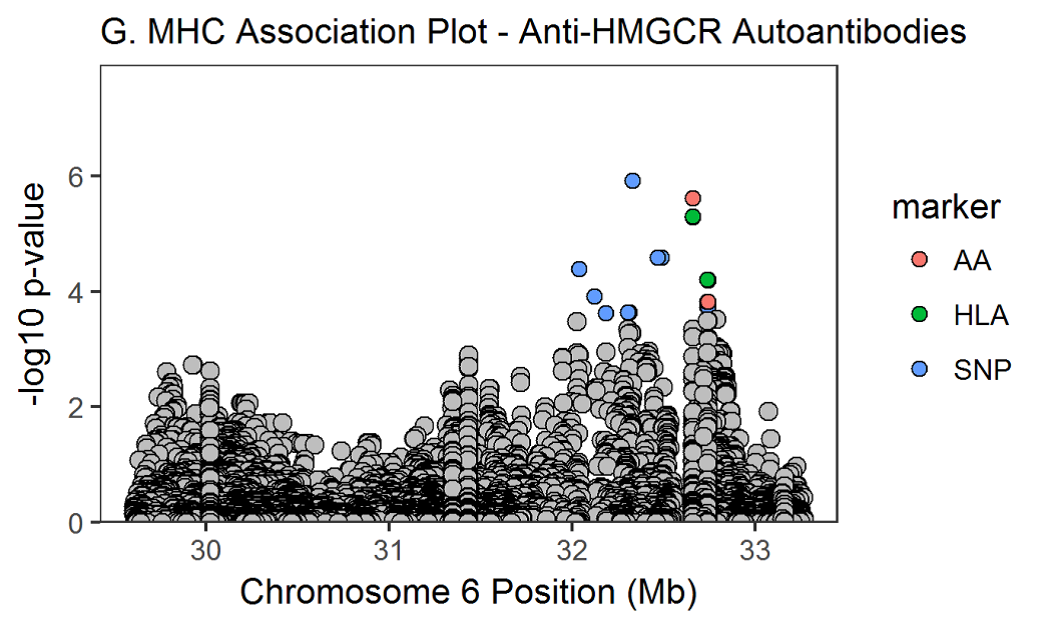
Ассоциации с аллелями класса II 8,1 АГ наблюдались для пациентов с анти-Jo-1, анти-PM / Scl и анти-cN1A. Анти-HMGCR и анти-Mi-2 были единственными протестированными аутоантителами, которые были связаны с аллелями HLA, не входящими в 8,1 АГ. Хотя сильная связь с аутоантителами к анти-HMGCR и HLA-DRB1 * 11 была подтверждена у взрослых пациентов, более сильная связь наблюдалась с 4-значным аллелем HLA-DRB1 * 11: 01 (p = 3,22 × 10–7, ИЛИ = 11,90, 95% ДИ от 4,72 до 31,85) до того, как аллель был удален из первоначального анализа из-за низкой точности вменения (r2 = 0,75).
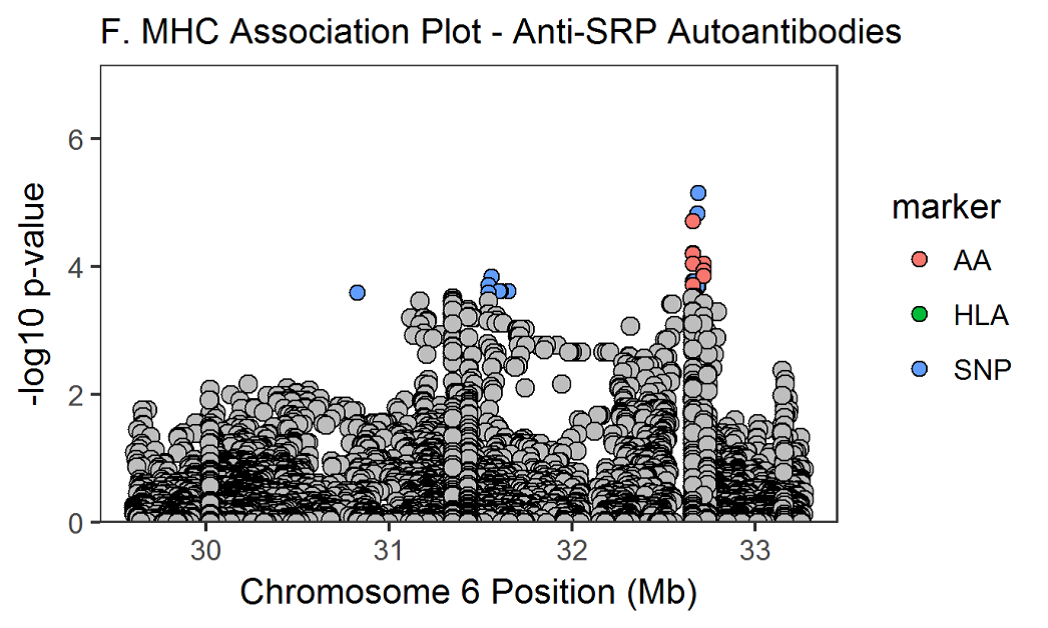
При использовании более консервативного порогового значения, корректирующего количество анализируемых антител (p <2,4 × 10–6), связь с HLA-DRB * 11 и аутоантителами к анти-HMGCR не достигла нашего порога значимости. Не было никаких существенных ассоциаций с классическими аллелями HLA и аутоантителами анти-NXP2, анти-SRP, анти-MDA5 или анти-SAE.
Аминокислотные позиции могут быть более тесно связаны, чем классические аллели HLA
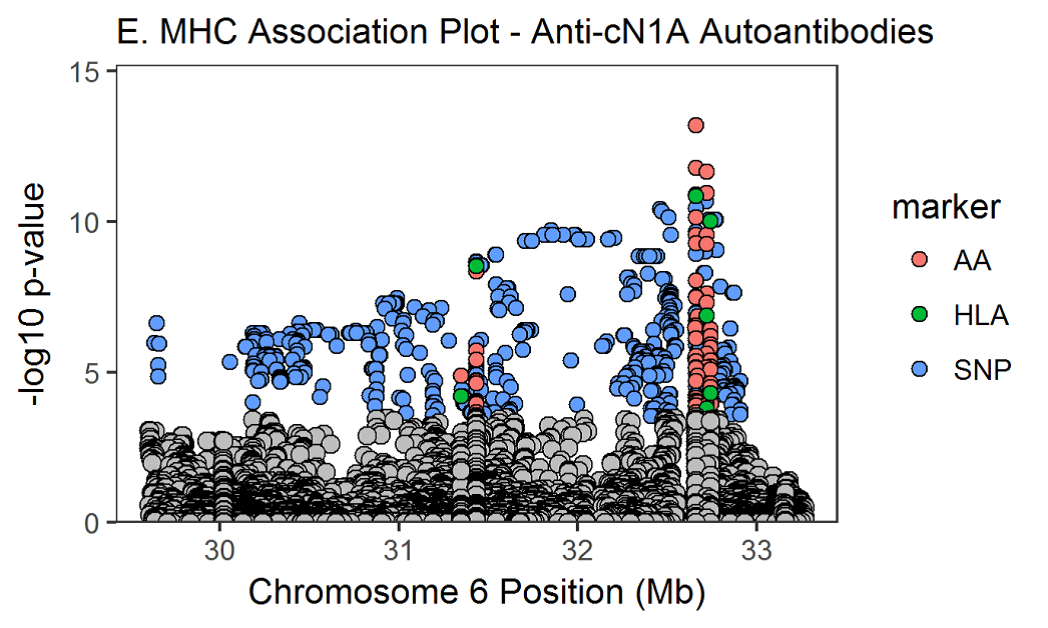
SNP2HLA был использован для определения положения аминокислот. Мы использовали схему исследования случай-контроль в каждом анализе подгруппы аутоантител, а аутоантитела со значительными аминокислотными ассоциациями представлены в таблице 3.
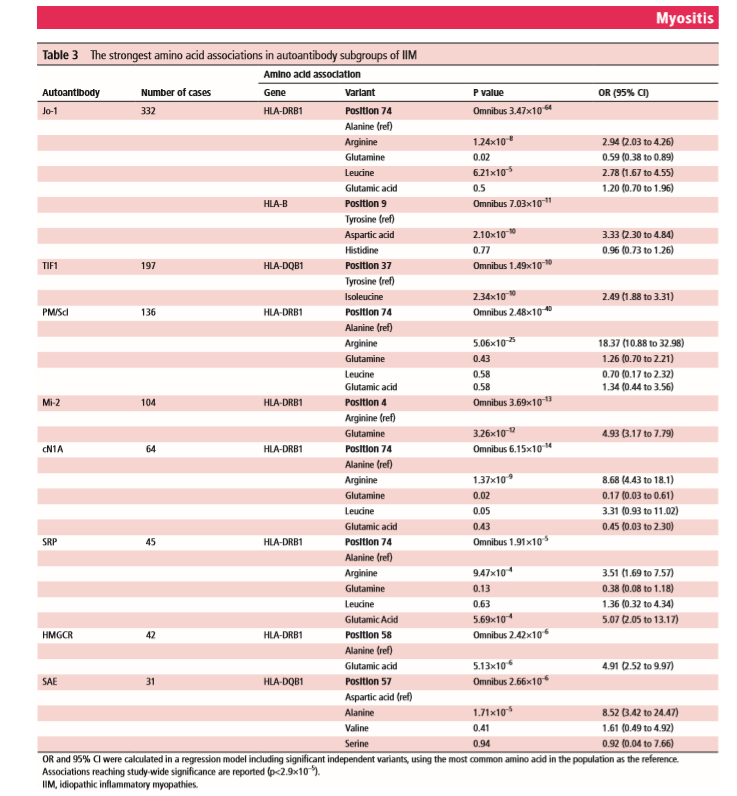
Значение p в омнибусе сообщает о значении положения аминокислоты, а размеры эффекта потенциальных аминокислот в этом месте были рассчитаны в регрессионной модели. Расположение ассоциированных аминокислот в трехмерной структуре молекул HLA показано на дополнительной онлайн-фигуре 1. Для некоторых аутоантител, таких как анти-Jo-1, анти-PM / Scl и анти-cN1A, аминокислотные ассоциации были заметно сильнее, чем классические ассоциации HLA, представленные в таблице 2. Графики региональных ассоциаций для аутоантител со значительными ассоциациями показаны на дополнительной онлайн-фигуре 2A-H. При использовании более консервативного порогового значения, корректирующего количество анализируемых антител (р <2,4 × 10–6), ассоциации с аминокислотами и аутоантителами анти-SRP, анти-HMGCR и анти-SAE не достигли порогового значения.
Для аутоантител анти-Jo-1, анти-PM / Scl, анти-cN1A и анти-SRP наиболее сильная ассоциация была с положением 74 HLA-DRB1 (таблица 3). Для аутоантител анти-Jo-1, анти-PM / Scl и анти-cN1A аргинин в положении 74 HLA-DRB1 представлял самый сильный риск. У пациентов с аутоантителами против PM / Scl и против cN1A аргинин приписывал весь риск в этой позиции, тогда как у пациентов с аутоантителами против Jo-1 были также доказательства риска, связанного с другими аминокислотами.
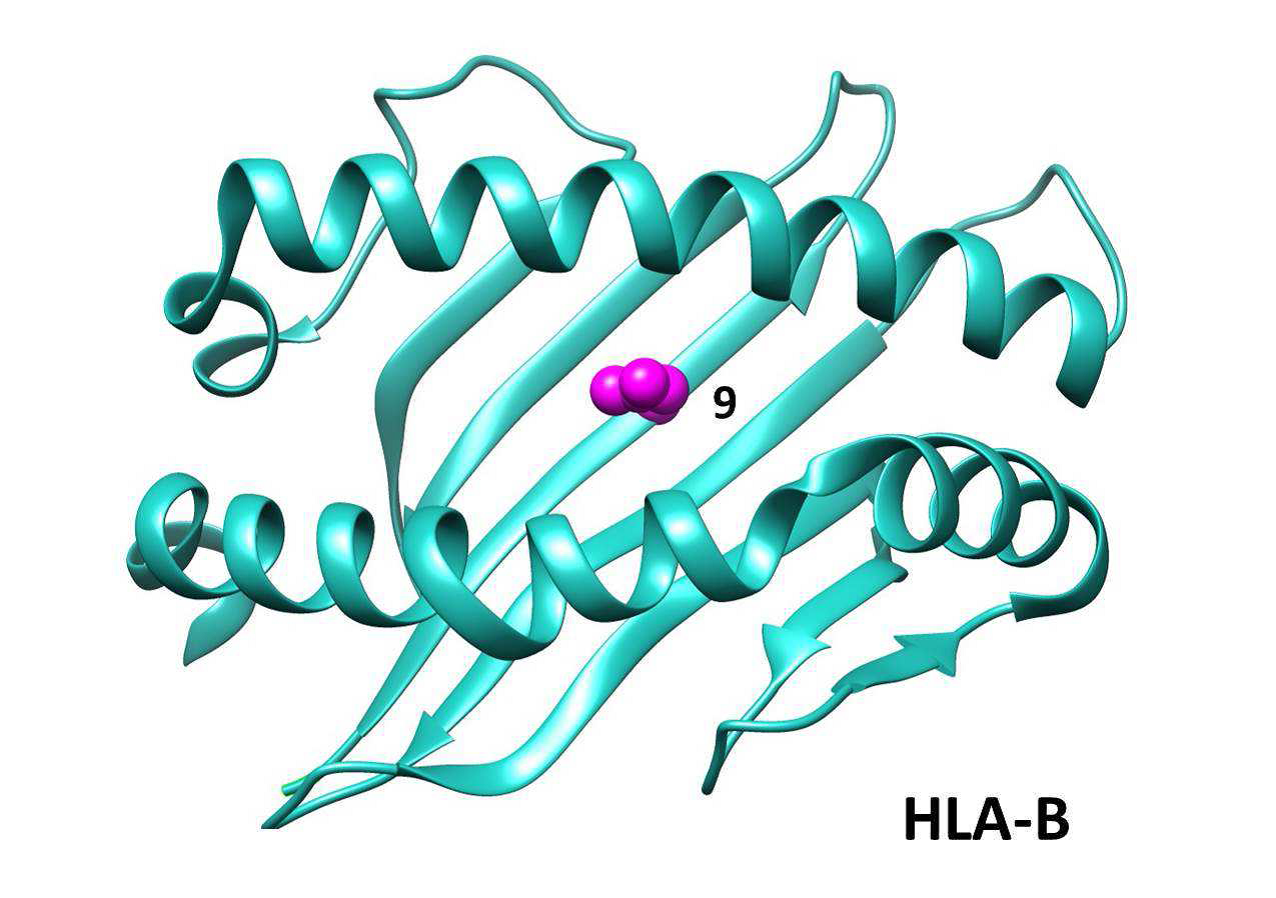
Пошаговый условный анализ показал наличие нескольких независимых эффектов в области HLA с анти-Jo-1; положение 74 HLA-DRB1 и положение 9 HLA-B. Они были связаны на одинаковом уровне значимости (p = 3,47 × 10–64 против p = 5,25 × 10–64) и оставались значимыми после кондиционирования в любом положении. Анализ группы пациентов с положительными антисинтетазными аутоантителами в группе увеличил силу ассоциации с этими независимыми аминокислотными позициями (HLA-DRB1, позиция 74, p = 5,69 × 10–67 и HLA-B, позиция 9, p = 8,63 × 10–11).
Аллели HLA могут дифференцировать взрослых и молодых пациентов с аутоантителами против TIF1
Что касается аутоантител, которые встречаются с высокой частотой как у взрослых, так и у подростков с IIM, когорта была стратифицирована для изучения потенциальных различий в ассоциациях HLA между этими популяциями. Пациенты с анти-TIF1-аутоантителами были стратифицированы до начала заболевания у взрослых (n = 91) и заболевания у подростков (n = 106). Из них все, кроме шести взрослых пациентов, были зарегистрированы как имеющие СД. Ассоциация в локусе HLA-DQB1 различалась у пациентов с взрослой и ювенильной фазами (таблица 4).

В IIM у взрослых самая сильная 4-значная ассоциация HLA была с HLA-DQB1 * 02: 02 (p = 2,96 × 10–5, OR = 3,31, 95% ДИ от 1,89 до 5,84). Напротив, у ювенильных пациентов наблюдалась сильная связь с HLA-DQB1 * 02: 01, но наиболее сильная связь была с HLA-DRB1 * 03: 01 (р = 6,21 × 10–6, OR = 2,69, 95 % CI 1,75 до 4,15), который имеет тот же гаплотип, что и HLA-DQB1 * 02: 01.
Чтобы гарантировать, что это различие не было связано с эффектами различных методов обнаружения аутоантител, анализ был ограничен британскими пациентами, серотипированными с использованием IP в том же центре в Университете Бата. В исследование были включены 19 дополнительных пациентов с ювенильным заболеванием, недавно генотипированных с помощью исследования и репозитория когортных биомаркеров ювенильного дерматомиозита. В этот субанализ были включены взрослые (n = 40) и юношеские (n = 48) пациенты с аутоантителами против TIF1. Наиболее сильные ассоциации у пациентов с ювенильным началом были с аллелями 8.1 АГ, которые не были значимыми в когорте взрослых. Например, HLA-DQB1 * 02: 01 имел более сильную связь в когорте с ювенильным возрастом (р = 0,004, ИЛИ = 2,48, 95% ДИ от 1,33 до 4,61) по сравнению с когортой у взрослых (р = 0,11, ИЛИ = 1,69, 95% ДИ от 0,87 до 3,20). И наоборот, HLA-DQB1 * 02: 02 был более тесно связан с началом у взрослого (p = 0,01, OR = 2,38, 95% CI от 1,16 до 4,76), чем при ювенильном заболевании (p = 0,09, OR = 1,85, 95% ДИ от 0,89 до 3,64), таким образом, воспроизводя тенденции из исходной когорты. Однако из-за уменьшенного размера выборки эти ассоциации не достигли значимости для всего исследования. Эти тенденции были также замечены при ограничении анализа пациентами с ювенильным началом в США с аутоантителами против TIF1 (n = 70); связь с HLA-DQB1 * 02: 01 (р = 0,01, OR = 2,05, 95% ДИ от 1,18 до 3,54) была сильнее, чем с HLA-DQB1 * 02: 02 (р = 0,76, OR = 0,89, 95% ДИ 0,40 до 1,81).
Не было значительных классических HLA или аминокислотных ассоциаций ни у взрослых, ни у молодых пациентов с аутоантителами против NXP2 или против MDA5. Для анти-Jo-1, анти-PM / Scl, анти-Mi-2 и анти-cN1A числа в когортах с ювенильным возрастом были слишком малы, чтобы достичь значения для нашего исследования. Тем не менее, для аллелей, связанных в общей когорте, тенденции для ассоциации были в том же направлении в IIM ювенильного начала (дополнительная таблица онлайн 11).
Обсуждение
Мы использовали включение HLA, чтобы найти ассоциации с аутоантителами IIM и классическими аллелями HLA и позициями аминокислот, которые могут создавать риск. Применяя этот новый подход, мы сообщаем о первых генетических различиях между взрослыми и ювенильными анти-TIF1-положительными пациентами. Существуют независимые ассоциации HLA-DRB1 и HLA-B для развития аутоантител против анти-Jo-1, которые имеют множественные генетические особенности 8.1 AH. Вменение аминокислот выявило новые ассоциации с аутоантителами, которые сильнее классической аллельной ассоциации HLA, что указывает на ключевые позиции в молекулах HLA, которые могут создавать риск для различных антител.
Для некоторых аутоантител самые сильные аминокислотные ассоциации были на том же уровне значимости, что и самые сильные специфические ассоциации HLA (дополнительная онлайновая фигура 2А-Н). Эти аминокислоты могут действовать как прокси для аллеля риска из-за переноса гаплотипов риска. В других случаях аминокислотные ассоциации были заметно более значимыми, чем любой аллель HLA. Например, у пациентов с аутоантителами против PM / Scl аминокислотная позиция 74 HLA-DRB1 имела более сильную ассоциацию (p = 2,48 × 10–40), чем любая аллельная ассоциация (p = 1,47 × 10–26). Для пациентов с аутоантителами против Jo-1, поэтапный поэтапный условный анализ предполагал наличие независимых ассоциаций в пределах 8,1 AH HLA-B * 08: 01 и HLA-DRB1 * 03: 01. Другие MSA могут иметь несколько независимых ассоциаций в пределах области HLA, которые мы были не в состоянии обнаружить, в соответствии с другими серопозитивными аутоиммунными заболеваниями.
Имплантация классических аллелей HLA подтвердила сильную связь между аллелями 8.1 AH и анти-Jo-1, анти-PM / Scl и анти-cN1A-антителами. Считается, что специфические аллели HLA нацелены на конкретные аутоантигены, что приводит к нарушению иммунологической толерантности к аутоантигенам. Тем не менее, исследования показали, что существуют дополнительные генетические особенности 8,1 АГ, которые предрасполагают людей к иммуноопосредованным заболеваниям, такие как полиморфизмы NF-kappaB и TNF-альфа и варианты вариантов количества копий генов генов комплемента. Аллели, независимые от 8,1 AH с анти-Mi-2 и анти-HMGCR, а также обнаружение того, что некоторые аутоантитела не имеют сильных ассоциаций HLA, позволяют предположить, что не все пациенты с IIM имеют общий генетический риск. 8.1 AH может быть более критичным для генерации определенного репертуара аутоантител, чем для развития IIM. Триггеры заболевания могут способствовать возникновению экологических факторов, включая вирусы, инфекции, ультрафиолетовое излучение, лекарства и дополнительные генетические факторы риска.
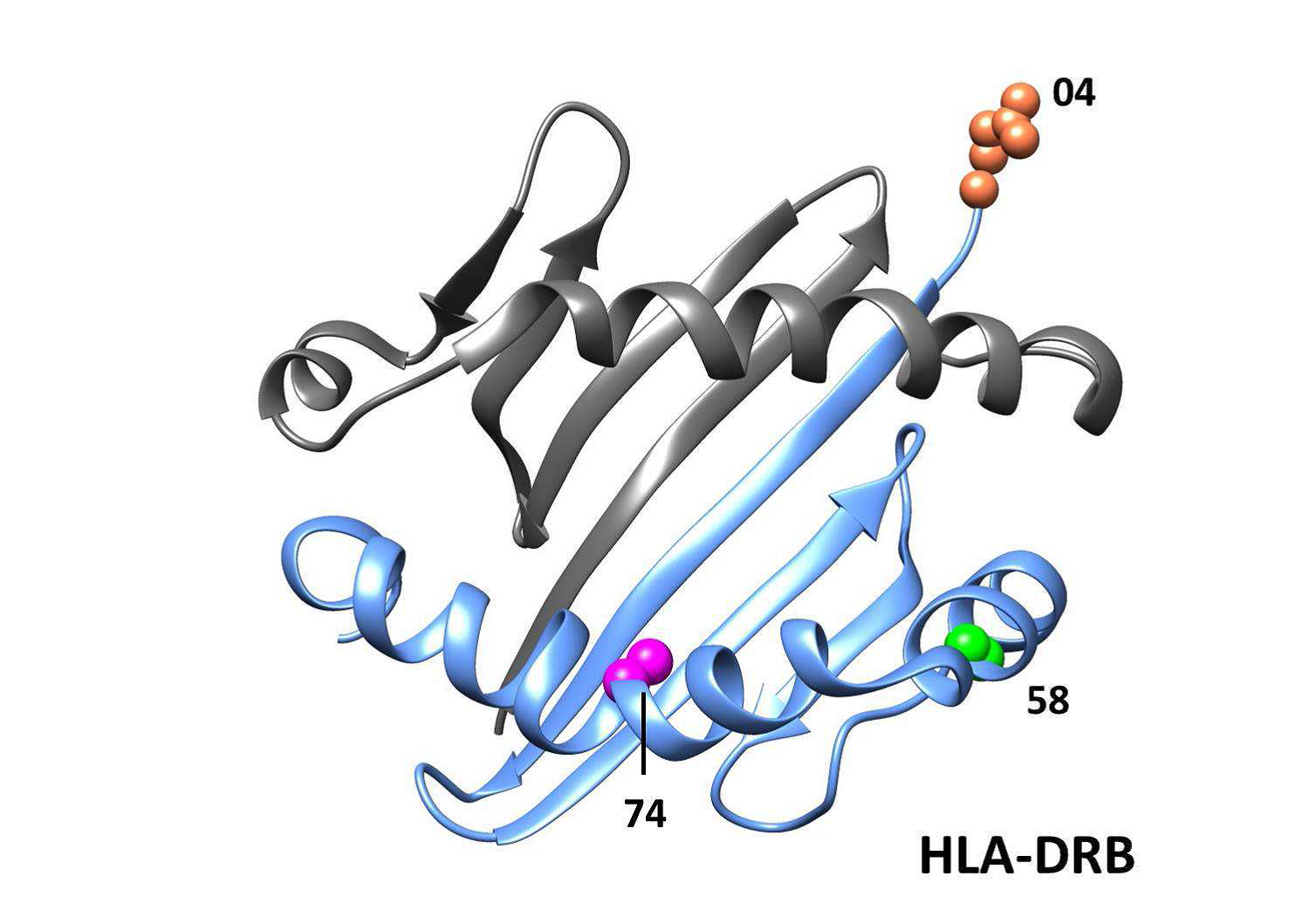
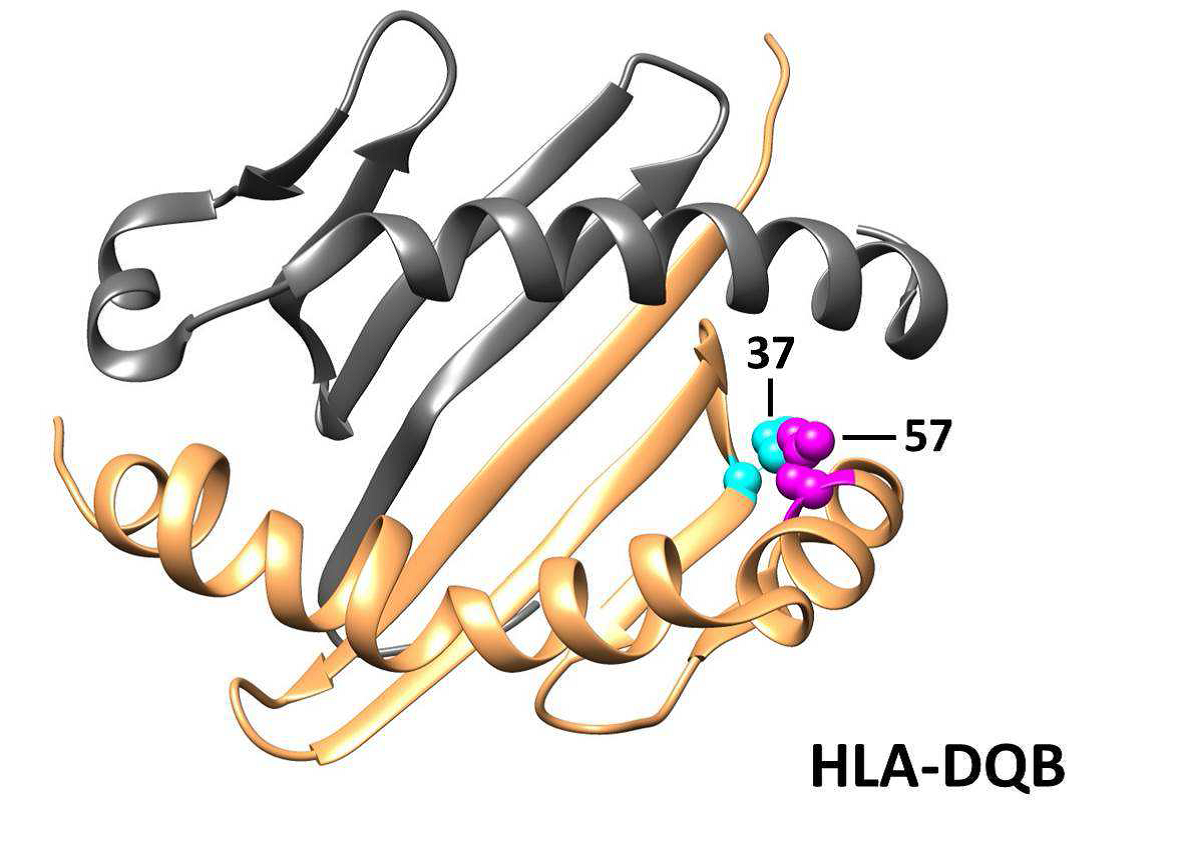
Положение аминокислот может дать представление о том, являются ли эти ассоциации функционально важными. Например, аминокислотное положение 74 обращено внутрь пептидсвязывающей канавки в молекулах HLA DR и может изменить структуру для размещения аутоантигенных пептидов, тогда как аминокислотное положение 4 находится вне пептидсвязывающей канавки (дополнительная фигура 1). Аргинин в положении 74 HLA-DRB1 был наиболее сильно ассоциированным аминокислотным положением у пациентов с аутоантителами против Jo-1, анти-PM / Scl и против cN1A и был вовлечен в другие аутоиммунные заболевания у людей кавказского происхождения. Arg -74 почти исключительно находится на аллелях HLA-DRB1 * 03, что может объяснить сильную связь со многими аутоантителами IIM и HLA-DRB1 * 03: 01. Будет интересно выяснить, имеют ли аллели риска в других этнических популяциях те же аминокислоты, что и в кавказских популяциях. Наш метод анализа не смог определить, был ли риск вызван аминокислотными мотивами или отдельными аминокислотными положениями из-за высокого уровень LD внутри этих молекул. Предыдущие исследования идентифицировали HLA-DRB1 мотив 9EYSTS13 как риск для IIM, 23 и HLA-DRB1 мотив 70QKXXR74 для пациентов с аутоантителами против Jo-1 и против PM / Scl. Однако в обоих этих случаях мотивы не сильнее, чем классическая ассоциация с HLA-DRB1 * 03: 01 или даже с аргинином в положении 74 HLA-DRB1.
Мы нашли доказательства различных гаплотипических ассоциаций у взрослых и ювенильных пациентов с аутоантителами против TIF1. После стратификации по возрасту была выявлена связь между аутоантителами против TIF1 и 8,1 АГ у пациентов с ювенильным началом, которая отсутствовала у пациентов с началом у взрослых. Различия в ассоциации могут быть вызваны различной этиологией или распространением эпитопов. Ассоциация анти-TIF1-аутоантител с раком при заболевании у взрослых не проявляется при юношеском заболевании. Рак-ассоциированный миозит может развиваться как паранеопластический процесс, при этом неоантигены в раке вызывают аутоиммунитет у взрослых. – у пациентов с аутоантителами против TIF1, однако, связь с 8,1 AH может указывать на другую этиологию, при которой факторы риска, связанные с окружающей средой, такие как инфекции, воздействие УФ-излучения или другие, могут инициировать заболевание. Недавно были описаны различия в ассоциации с аутоантителами к анти-HMGCR с дебютом у взрослых (HLA-DRB1 * 11: 01) и у пациентов с ювенильным началом (HLA * DRB1 * 07: 01).
Есть некоторые ограничения в нашем исследовании. Из-за характера этой большой многоцентровой коллекции не все пациенты были протестированы с использованием золотого стандарта IP. Альтернативно, пациенты были включены, если у них был положительный результат на аутоантитело с помощью коммерчески доступного блоттинга. Хотя соответствие между этими различными методами не было всесторонне изучено, есть доказательства того, что эти анализы являются надежными. Субанализ с аутоантителами против Jo-1 и против PM / Scl, серотипированных с использованием блоттинга линии EUROIMMUN, привел к тем же ассоциациям как серотипированные по IP (данные не показаны). Другим ограничением является потенциальная неправильная характеристика пациентов как антител отрицательных. Пациенты могут иметь редкие аутоантитела, которые в настоящее время не включены в коммерчески доступные линейные блоты, необнаруженные антитела, не обнаруживаемые в клеточных линиях, используемых для IP, или низкие / отрицательные титры антител во время ремиссии заболевания. Неправильная характеристика пациентов как отрицательных по антителам может привести к ошибке 2 типа и не должна влиять на наши основные результаты. По этим причинам мы не сравнивали антитела, положительные в отношении групп пациентов с отрицательными антителами.
В заключение эти результаты подтверждают тесную связь между аллелями HLA и специфичностью аутоантител, присутствующих у пациентов европиодной расы с IIM. Наряду с сильными ассоциациями с 8,1 AH мы показываем, что существуют ассоциации, не зависящие от этого гаплотипа, и что риск в этом регионе может различаться у взрослых с началом и у подростков с аутоантителами против TIF1. Поскольку аутоантитела при миозите коррелируют с конкретными клиническими особенностями заболевания, понимание механизмов, лежащих в основе развития различных аутоантител, должно быть предметом постоянных исследований.
Дополнительный Рис. 1. Положение связанных положений аминокислоты внутри структура 3D HLA молекулы. Структуры протеина паза пептида HLA связывая показаны для HLA-DRB (голубого) и HLA DQB (оранжевый) и HLA-B (бирюзовый). Положения связанных аминокислот для различного времени аутоантитела помечены.
Дополнительные рисунки 2A-H. региональные ассоциативные графики для аутоантител со значительными ассоциациями. Аминокислоты (AA), классические аллели HLA и SNPs окрашены в красный, зеленый и синий маркеры соответственно. Незначимые варианты окрашены в серый цвет (p>2.9х10-5). Расположение HLA и аминокислот построены по координатам соответствующих генов.