Просмотров: 4 909
Рекомендации Европейского кардиологического общества (второе издание, 2016г ) по диагностике и лечению фибрилляции предсердий (ФП). 17 простых правил по контролю фибрилляции предсердий для ревматологов. Часть 1.
Рекомендации Европейского кардиологического общества (второе издание) по диагностике и лечению фибрилляции предсердий (ФП).
(впервые опубликовано 27 августа 2016)
2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS
17 простых правил по контролю фибрилляции предсердий для ревматологов
2016 ESC (Европейское общество кардиологов) руководящие принципы управления фибрилляция предсердий, разработанного в сотрудничестве с EACTS
АКТУАЛЬНОСТЬ ДЛЯ РЕВМАТОЛОГОВ
Подагра связана с повышенным риском ФП
У пациентов с подагрой имеется больше сопутствующих заболеваний, чем при ее отсутствии. Оказалось, что подагра также выступает фактором риска развития фибрилляции предсердий (ФП), особенно у молодых пациентов.
Основные выводы
 Таблица 2 Классы рекомендаций
Таблица 2 Классы рекомендаций
 Задача разработки ESC и EACTS руководство охватывает не только интеграцию самых последних исследований, но и создание учебных пособий и программ, популяризации идей рекомендаций. Для реализации руководящих принципов, предлагаются краткие карманные руководства, электронные версии, сводные слайды, буклеты с основными положениями, сводные карты для неспециалистов и электронная версия для цифровых приложений (например, смартфоны). Эти версии являются сокращениями, но, в случае необходимости, всегда имеется ссылка на полный текст, который находится в свободном доступе на веб-сайтеESC. Осуществления программ необходимы, поскольку было доказано, что тщательное применение клинических рекомендаций могут благоприятно повлиять исход заболевания.
Обследования и реестры необходимы для проверки в реальной жизни и повседневной практике того, что рекомендуется в руководящих принципах, тем самым завершая цикл между клиническими исследованиями, написанием руководящих принципов, их распространением и реализацией их в клиническую практику.
Специалистам в области здравоохранения рекомендуется принять ESC и EACTS руководящие принципы полностью, учитывать их при осуществлении их клинического суждения, а также в определении и осуществлении профилактических, диагностических или терапевтических медицинских стратегий. Однако ESC и EACTS руководящие принципы не ограничивают каким-либо образом индивидуальную ответственность медицинских работников за принятия соответствующих и точных решений с учетом состояния здоровья каждого пациента и в консультации с пациентом и социальным работником при необходимости.
Задача разработки ESC и EACTS руководство охватывает не только интеграцию самых последних исследований, но и создание учебных пособий и программ, популяризации идей рекомендаций. Для реализации руководящих принципов, предлагаются краткие карманные руководства, электронные версии, сводные слайды, буклеты с основными положениями, сводные карты для неспециалистов и электронная версия для цифровых приложений (например, смартфоны). Эти версии являются сокращениями, но, в случае необходимости, всегда имеется ссылка на полный текст, который находится в свободном доступе на веб-сайтеESC. Осуществления программ необходимы, поскольку было доказано, что тщательное применение клинических рекомендаций могут благоприятно повлиять исход заболевания.
Обследования и реестры необходимы для проверки в реальной жизни и повседневной практике того, что рекомендуется в руководящих принципах, тем самым завершая цикл между клиническими исследованиями, написанием руководящих принципов, их распространением и реализацией их в клиническую практику.
Специалистам в области здравоохранения рекомендуется принять ESC и EACTS руководящие принципы полностью, учитывать их при осуществлении их клинического суждения, а также в определении и осуществлении профилактических, диагностических или терапевтических медицинских стратегий. Однако ESC и EACTS руководящие принципы не ограничивают каким-либо образом индивидуальную ответственность медицинских работников за принятия соответствующих и точных решений с учетом состояния здоровья каждого пациента и в консультации с пациентом и социальным работником при необходимости.
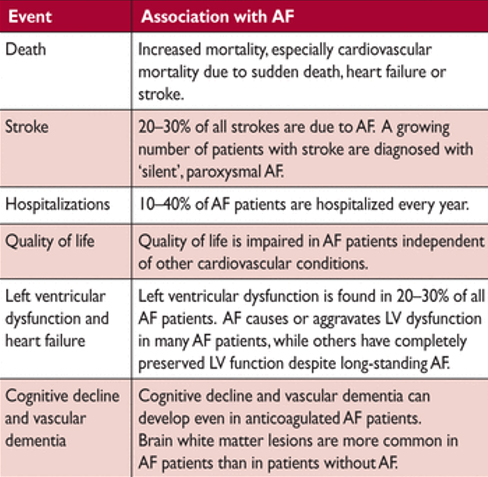 Сердечно-сосудистая заболеваемость и смертность, связанная с мерцательной аритмией
Сердечно-сосудистая заболеваемость и смертность, связанная с мерцательной аритмией
 Рисунок 1
Хронология результатов изучения ФП, включает лечение сопутствующих заболеваний, профилактику (зеленый), антикоагуляционную терапию (синий), контроль частоты сердечных сокращений (оранжевый), контроль ритма (красный) и хирургическое лечение фибрилляции предсердий (фиолетовый).
В современных, хорошо контролируемых рандомизированных клинических исследованиях средний годовой темп прироста случаев ФП составляет около 1,5%, а показатель смертности составляет около 3% при проведении антикоагулянной терапии пациентам с AF. В реальной жизни, показатели годовой смертности могут быть разными (как выше, так и ниже). Меньшинство этих смертей связаны инсульта, в то время как внезапная сердечная смерть и смерть от прогрессивного сердечной недостаточности являются более частыми, подчеркивает необходимость дополнительных вмешательств кроме антикоагуляции. Кроме того, AF связана также с высокими показателями госпитализации, обычно для лечения AF, но часто также сердечной недостаточности, инфарктов миокарда и лечения связанных осложнений.
3.4 Пол
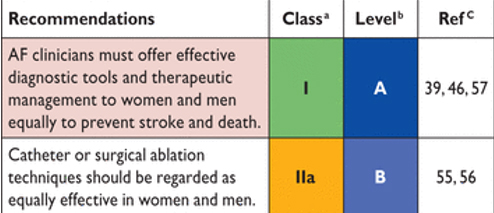
Как в развитых, так и в развивающихся стран, скорректированные по возрасту заболеваемость и распространенность AF ниже у женщин, в то время как риск смерти у женщин с AF аналогичный или выше, чем у мужчин с AF. Женщины с AF, которые имеют дополнительные факторы риска инсульта (особенно в пожилом возрасте), также подвергаются большему риску инсульта, чем мужчины, даже те, кто получает антикоагулянт варфарин (см. главу 9 для деталей). Женщины с диагнозом AF имеют больше симптомов, чем мужчины и как правило они старше, и имеют больше сопутствующих заболеваний. Риск антикоагуляционных кровотечений одинаков у обоих полов. Однако женщины реже получают консультации специалисов социального ухода и терапию контроля ритма, хотя результаты катетерной абляции AF хирургии сопоставимы у мужчин. Эти наблюдения свидетельствуют о необходимости предложить эффективные средства диагностики и терапевтических подходы одинаково для мужчин и женщин.
Рисунок 1
Хронология результатов изучения ФП, включает лечение сопутствующих заболеваний, профилактику (зеленый), антикоагуляционную терапию (синий), контроль частоты сердечных сокращений (оранжевый), контроль ритма (красный) и хирургическое лечение фибрилляции предсердий (фиолетовый).
В современных, хорошо контролируемых рандомизированных клинических исследованиях средний годовой темп прироста случаев ФП составляет около 1,5%, а показатель смертности составляет около 3% при проведении антикоагулянной терапии пациентам с AF. В реальной жизни, показатели годовой смертности могут быть разными (как выше, так и ниже). Меньшинство этих смертей связаны инсульта, в то время как внезапная сердечная смерть и смерть от прогрессивного сердечной недостаточности являются более частыми, подчеркивает необходимость дополнительных вмешательств кроме антикоагуляции. Кроме того, AF связана также с высокими показателями госпитализации, обычно для лечения AF, но часто также сердечной недостаточности, инфарктов миокарда и лечения связанных осложнений.
3.4 Пол
Как в развитых, так и в развивающихся стран, скорректированные по возрасту заболеваемость и распространенность AF ниже у женщин, в то время как риск смерти у женщин с AF аналогичный или выше, чем у мужчин с AF. Женщины с AF, которые имеют дополнительные факторы риска инсульта (особенно в пожилом возрасте), также подвергаются большему риску инсульта, чем мужчины, даже те, кто получает антикоагулянт варфарин (см. главу 9 для деталей). Женщины с диагнозом AF имеют больше симптомов, чем мужчины и как правило они старше, и имеют больше сопутствующих заболеваний. Риск антикоагуляционных кровотечений одинаков у обоих полов. Однако женщины реже получают консультации специалисов социального ухода и терапию контроля ритма, хотя результаты катетерной абляции AF хирургии сопоставимы у мужчин. Эти наблюдения свидетельствуют о необходимости предложить эффективные средства диагностики и терапевтических подходы одинаково для мужчин и женщин.
 AF = фибрилляция предсердий.
aКласс рекомендации.
bУровень доказательства.
cАртикул(ы), поддерживая рекомендации.
Рекомендации, касающиеся гендерных факторов
AF = фибрилляция предсердий.
aКласс рекомендации.
bУровень доказательства.
cАртикул(ы), поддерживая рекомендации.
Рекомендации, касающиеся гендерных факторов
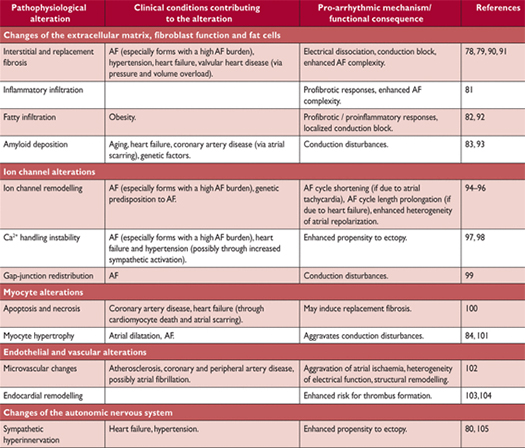 Патофизиологические изменения в предсердной ткани, связанные с мерцательной аритмией и клинических условиях, которые могли бы способствовать таким изменениям
Патофизиологические изменения в предсердной ткани, связанные с мерцательной аритмией и клинических условиях, которые могли бы способствовать таким изменениям
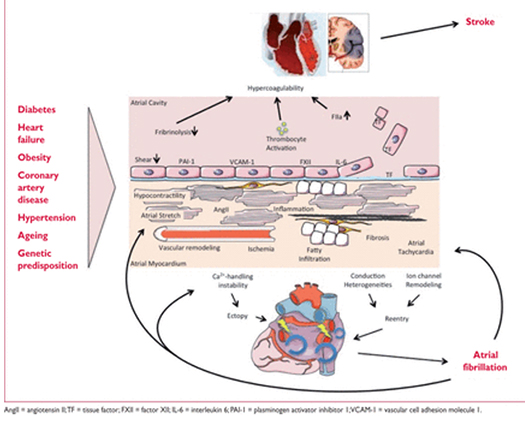 Рисунок 2 Основные механизмы, вызывающие фибрилляцию предсердий, которые можно учитывать при выборе терапии.
Различные этиологические факторы (слева) вызывают сложный массив патофизиологических изменений в предсердия, включая индуцированной фибрилляцией фиброз за счет перерастяжения, гипокинезию, жировую инфильтрацию, воспаление, реваскуляризация, ишемия, дисфункцию ионного канала и Ca2 +-нестабильность. Эти изменения повышают эктопию и расстройства проводимости, увеличивая чувствительность предсердия к возникновению или поддержанию AF. В то же время некоторые из этих изменений участвуют в возникновении гиперкоагуляции, состоянию связанным с AF. Например гипокинезия уменьшает местное эндотелиальное напряжение поперечно-полосатой мускулатуры, что увеличивает выработку PAI-1, а ишемически- индуцированное воспаление, усиливает экспрессию молекул эндотелиальной адгезии или способствует пролиферации эндотелиальных клеток, в результате чего тканевой фактор воздействует на поток крови. Эти изменения способствуют тромбогенности внутри предсердия пациентов AF. AF само по себе может усугубить многие указанные механизмы, что может объяснить прогрессивный характер аритмии.
Функциональные и структурные изменения в предсердии миокарда и stasis крови, особенно в ушке левого предсердия ( LAA), предрасполагают к образованию тромбов е. Кроме того даже короткие эпизоды AF приводят к повреждению миокарда и влиянию протромботических факторов на поверхность предсердного эндотелия наряду с активацией тромбоцитов и воспалительных клеток и способствует повышенному протромботическому статусу. Предсердная и системная активация свертывающей системы может частично объяснить, почему короткие эпизоды AF имеют долгосрочный риск инсульта.
4.2.2 Электрофизиологических механизмы фибрилляции предсердий
AF вызывает сокращение рефрактерный периода предсердий и продолжительность цикла укорочения AF в первые дни аритмии, главным образом из-за резкого уменьшения downregulation потоков Ca2 +-внутрь и upregulation внутрь потоков K+. Структурные болезни сердца, в отличие от этого, как правило, продлевают рефрактерный период ФП, иллюстрирующие неоднородный характер механизмов, которые вызывают AF у разных пациентов. Гиперфосфолирирование различных Са 2 +– белков может способствовать спонтанному выходу Ca2 + и повышает триггерную активность, таким образом, вызывая эктопию и развитию AF. Хотя концепция Ca2 + нестабильности была оспорена в последнее время, это может способствовать развитию AF в структурно реконструированном предсердии и объяснить, как измененная вегетативная система может спровоцировать AF.
4.2.2.1 Локальный очаг возбуждения и поддержание фибрилляции предсердий
Локальный очаг возбуждения в легочные вены может вызвать AF, а удаление этого источника может подавить рецидивирующую AF. Механизм локальной активности может включать триггерную активность и механизм re–entry. Иерархическая организация AF с быстрым активированием области водителя аритмии были задокументированы в больных с пароксизмальной AF, но это менее очевидно у пациентов с стойкой AF.
4.2.2.2 Гипотезы множественных волн низкой амплитуды и кругового возбуждения как источников мерцательной аритмии
Предположено, что AF может сохраняться при непрерывном проведении нескольких независимых волн низкой амплитуды, распространяющихся через мышцы предсердия хаотичным образом. До тех пор, пока количество волн не превышает нижнего критического уровня, они будут способны поддерживать аритмию. Несколько гипотез представлены источником 115 «The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. JThorac Cardiovasc Surg 1991;101:406–426. Все локализованные очаги AF (эктопические очаги, «роторы» и re–entry) вызывающие ФП трудно выделить среди множества фибрилляций, или через данный феномен любое из этих явлений может генерировать «роторы» внутри сердечной мышцы, которые можно зарегистрировать на поверхности тела.
Рисунок 2 Основные механизмы, вызывающие фибрилляцию предсердий, которые можно учитывать при выборе терапии.
Различные этиологические факторы (слева) вызывают сложный массив патофизиологических изменений в предсердия, включая индуцированной фибрилляцией фиброз за счет перерастяжения, гипокинезию, жировую инфильтрацию, воспаление, реваскуляризация, ишемия, дисфункцию ионного канала и Ca2 +-нестабильность. Эти изменения повышают эктопию и расстройства проводимости, увеличивая чувствительность предсердия к возникновению или поддержанию AF. В то же время некоторые из этих изменений участвуют в возникновении гиперкоагуляции, состоянию связанным с AF. Например гипокинезия уменьшает местное эндотелиальное напряжение поперечно-полосатой мускулатуры, что увеличивает выработку PAI-1, а ишемически- индуцированное воспаление, усиливает экспрессию молекул эндотелиальной адгезии или способствует пролиферации эндотелиальных клеток, в результате чего тканевой фактор воздействует на поток крови. Эти изменения способствуют тромбогенности внутри предсердия пациентов AF. AF само по себе может усугубить многие указанные механизмы, что может объяснить прогрессивный характер аритмии.
Функциональные и структурные изменения в предсердии миокарда и stasis крови, особенно в ушке левого предсердия ( LAA), предрасполагают к образованию тромбов е. Кроме того даже короткие эпизоды AF приводят к повреждению миокарда и влиянию протромботических факторов на поверхность предсердного эндотелия наряду с активацией тромбоцитов и воспалительных клеток и способствует повышенному протромботическому статусу. Предсердная и системная активация свертывающей системы может частично объяснить, почему короткие эпизоды AF имеют долгосрочный риск инсульта.
4.2.2 Электрофизиологических механизмы фибрилляции предсердий
AF вызывает сокращение рефрактерный периода предсердий и продолжительность цикла укорочения AF в первые дни аритмии, главным образом из-за резкого уменьшения downregulation потоков Ca2 +-внутрь и upregulation внутрь потоков K+. Структурные болезни сердца, в отличие от этого, как правило, продлевают рефрактерный период ФП, иллюстрирующие неоднородный характер механизмов, которые вызывают AF у разных пациентов. Гиперфосфолирирование различных Са 2 +– белков может способствовать спонтанному выходу Ca2 + и повышает триггерную активность, таким образом, вызывая эктопию и развитию AF. Хотя концепция Ca2 + нестабильности была оспорена в последнее время, это может способствовать развитию AF в структурно реконструированном предсердии и объяснить, как измененная вегетативная система может спровоцировать AF.
4.2.2.1 Локальный очаг возбуждения и поддержание фибрилляции предсердий
Локальный очаг возбуждения в легочные вены может вызвать AF, а удаление этого источника может подавить рецидивирующую AF. Механизм локальной активности может включать триггерную активность и механизм re–entry. Иерархическая организация AF с быстрым активированием области водителя аритмии были задокументированы в больных с пароксизмальной AF, но это менее очевидно у пациентов с стойкой AF.
4.2.2.2 Гипотезы множественных волн низкой амплитуды и кругового возбуждения как источников мерцательной аритмии
Предположено, что AF может сохраняться при непрерывном проведении нескольких независимых волн низкой амплитуды, распространяющихся через мышцы предсердия хаотичным образом. До тех пор, пока количество волн не превышает нижнего критического уровня, они будут способны поддерживать аритмию. Несколько гипотез представлены источником 115 «The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. JThorac Cardiovasc Surg 1991;101:406–426. Все локализованные очаги AF (эктопические очаги, «роторы» и re–entry) вызывающие ФП трудно выделить среди множества фибрилляций, или через данный феномен любое из этих явлений может генерировать «роторы» внутри сердечной мышцы, которые можно зарегистрировать на поверхности тела.
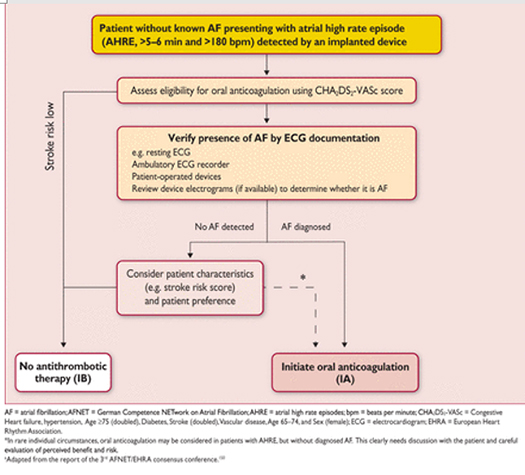 Рисунок 3
Тактика при AHRE, обнаруженных с помощью имплантированных устройств.
5.2.4 Обнаружение фибрилляции предсердий у перенесших инсульт
Целевой мониторинг ЭКГ обнаружил AF в 24% (95% ДИ 17-31) выживших после инсульта, и в 11,5% (95% ДИ 8,9% – 14,3%) в другом исследовании, с большими вариациями в зависимости от сроков, продолжительности и метод мониторинга. Обнаружение AF не является редкостью в общей, невыбранной популяции больных (6,2%, 95% ДИ 4.4 – 8,3), но чаще всего, у больных с криптогенным инсультом с имплантированными с рекордерами или при мониторировании ЭКГ в течение нескольких недель. Cryptogenic(криптогенный) инсульт определяется как инсульт, в котором причины не могут быть определены после тщательного обследования. Более широкое определение имеет Эмболический инсульт без неопределенного источника. Несколько исследований нашлиAF у пациентов, в которых был другая конкурирующая причина инсульта (например, АГ или стеноз сонной артерии). Таким образом длительный мониторинг ЭКГ представляется разумным у всех выживших после ишемических инсульта без установленного диагноза AF.
Рисунок 3
Тактика при AHRE, обнаруженных с помощью имплантированных устройств.
5.2.4 Обнаружение фибрилляции предсердий у перенесших инсульт
Целевой мониторинг ЭКГ обнаружил AF в 24% (95% ДИ 17-31) выживших после инсульта, и в 11,5% (95% ДИ 8,9% – 14,3%) в другом исследовании, с большими вариациями в зависимости от сроков, продолжительности и метод мониторинга. Обнаружение AF не является редкостью в общей, невыбранной популяции больных (6,2%, 95% ДИ 4.4 – 8,3), но чаще всего, у больных с криптогенным инсультом с имплантированными с рекордерами или при мониторировании ЭКГ в течение нескольких недель. Cryptogenic(криптогенный) инсульт определяется как инсульт, в котором причины не могут быть определены после тщательного обследования. Более широкое определение имеет Эмболический инсульт без неопределенного источника. Несколько исследований нашлиAF у пациентов, в которых был другая конкурирующая причина инсульта (например, АГ или стеноз сонной артерии). Таким образом длительный мониторинг ЭКГ представляется разумным у всех выживших после ишемических инсульта без установленного диагноза AF.
 AF = фибрилляция предсердий; AHRE = эпизоды предсердной тахикардии; ЭКГ = Электрокардиограмма; ICD = Вживляемый кардиовертер-дефибриллятор; TIA = транзиторная ишемическая атака .
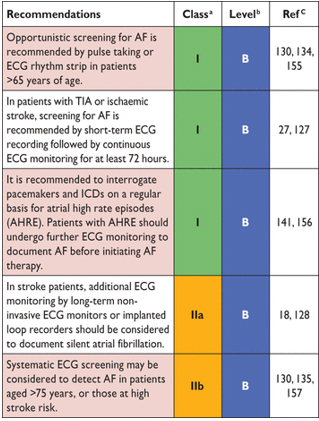
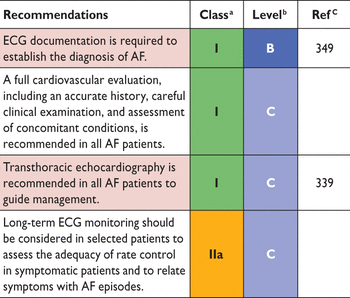
Рекомендации для скрининга фибрилляции предсердий
5.3 Электрокардиографическое обнаружение трепетания предсердий
Правопредсердные трепетания предсердий имеют типичную ЭКГ картину и ЧСС. Распространенность трепетания предсердий составляет менее одной десятой распространенности AF. Трепетание предсердий часто сосуществует с или предшествует AF. В типичных случаях P волны имеют вид «пила зуб», особенно в нижних отведениях ( II, III, aVF). ЧСС может быть переменной (обычное отношение сокращений предсердий к желудочкам 4:1 до 1:2, в редких случаях 1:1) и при макро macro–re–entrant тахикардии проведение импульсов 2:1. Вагусная стимуляция или внутривенное введение аденозина, может «оборвать» трепетания предсердий. В главе 13.7 рассматривается лечебная тактика при трепетания предсердий. Лево- или правопредсердная macro-re–entrant тахикардия главным образом встречается у пациентов после катетерной абляцией при AF, AF хирургии, или после операции на открытом сердце.
AF = фибрилляция предсердий; AHRE = эпизоды предсердной тахикардии; ЭКГ = Электрокардиограмма; ICD = Вживляемый кардиовертер-дефибриллятор; TIA = транзиторная ишемическая атака .
Рекомендации для скрининга фибрилляции предсердий
5.3 Электрокардиографическое обнаружение трепетания предсердий
Правопредсердные трепетания предсердий имеют типичную ЭКГ картину и ЧСС. Распространенность трепетания предсердий составляет менее одной десятой распространенности AF. Трепетание предсердий часто сосуществует с или предшествует AF. В типичных случаях P волны имеют вид «пила зуб», особенно в нижних отведениях ( II, III, aVF). ЧСС может быть переменной (обычное отношение сокращений предсердий к желудочкам 4:1 до 1:2, в редких случаях 1:1) и при макро macro–re–entrant тахикардии проведение импульсов 2:1. Вагусная стимуляция или внутривенное введение аденозина, может «оборвать» трепетания предсердий. В главе 13.7 рассматривается лечебная тактика при трепетания предсердий. Лево- или правопредсердная macro-re–entrant тахикардия главным образом встречается у пациентов после катетерной абляцией при AF, AF хирургии, или после операции на открытом сердце.
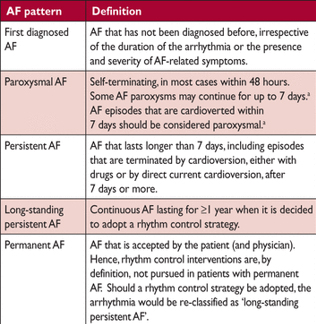 Критерии фибрилляции предсердий
AF = фибрилляция предсердий.
Различия между пароксизмальной и персистирующей AF часто проводится без проведения долгосрочного мониторинга. Таким образом эта классификация недостаточна для выбора конкретных методов лечения. Если присутствуют как постоянные, так и пароксизмальная эпизоды, следует руководствоваться критериями классификации.
Предполагается что AF может влиять на риск инсульта и результаты антиаритмической терапии. Но доказательства этого являются слабыми. Таким образом AF не должно быть основным фактором в принятии решения о целесообразности лечебного вмешательства, которое должно опираться на другие факторы.
6.2 Типы фибрилляции, отражающие различные причины аритмии
Риск развития AF увеличивается при различных физиологических и болезненных состояний (рис. 2) и исторический термин «изолированная AF» вероятно вводит в заблуждение и его следует избегать. Хотя модель AF может быть такой же, механизмы, лежащие в основе AF существенно, различаются между пациентами (Таблица 6). Это говорит о том, что нужно стратифицировать пациентов с AF подчеркивая движущие причины (драйверы) AF разделяя болезни сердца и системные сопутствующие заболевания (например, диабет и ожирение), факторы образа жизни (например, уровень активности, курение, употребление алкоголя), маркеры сердечного ремоделирования (например, фиброз или составляющие электрокардиографические параметры AF), или генетический фон. В таблице 6 приводится подобная систематика, составленная консенсусом экспертов, но без очевидных доказательств, для того чтобы подвести фундамент использования в клинической практике. Систематические исследования, определение основных драйверов AF явно Для более четко разделения различных типов AF необходимы клинические исследования для определения главных движущих сил возникновения ФП.
Таблица 6
Критерии фибрилляции предсердий
AF = фибрилляция предсердий.
Различия между пароксизмальной и персистирующей AF часто проводится без проведения долгосрочного мониторинга. Таким образом эта классификация недостаточна для выбора конкретных методов лечения. Если присутствуют как постоянные, так и пароксизмальная эпизоды, следует руководствоваться критериями классификации.
Предполагается что AF может влиять на риск инсульта и результаты антиаритмической терапии. Но доказательства этого являются слабыми. Таким образом AF не должно быть основным фактором в принятии решения о целесообразности лечебного вмешательства, которое должно опираться на другие факторы.
6.2 Типы фибрилляции, отражающие различные причины аритмии
Риск развития AF увеличивается при различных физиологических и болезненных состояний (рис. 2) и исторический термин «изолированная AF» вероятно вводит в заблуждение и его следует избегать. Хотя модель AF может быть такой же, механизмы, лежащие в основе AF существенно, различаются между пациентами (Таблица 6). Это говорит о том, что нужно стратифицировать пациентов с AF подчеркивая движущие причины (драйверы) AF разделяя болезни сердца и системные сопутствующие заболевания (например, диабет и ожирение), факторы образа жизни (например, уровень активности, курение, употребление алкоголя), маркеры сердечного ремоделирования (например, фиброз или составляющие электрокардиографические параметры AF), или генетический фон. В таблице 6 приводится подобная систематика, составленная консенсусом экспертов, но без очевидных доказательств, для того чтобы подвести фундамент использования в клинической практике. Систематические исследования, определение основных драйверов AF явно Для более четко разделения различных типов AF необходимы клинические исследования для определения главных движущих сил возникновения ФП.
Таблица 6
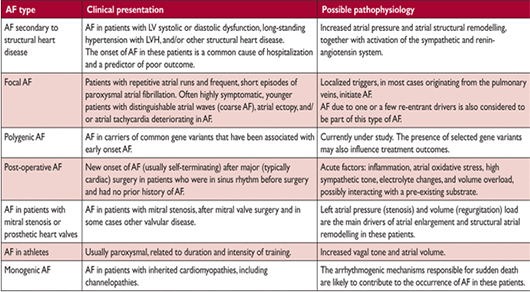 Клинические виды фибрилляции предсердий
AF = фибрилляция предсердий; LV = левого желудочка; ГЛЖ = левого желудочка гипертрофия. Признается, что эти типы AF будут пересекаться в клинической практике, и что их значение для контроля необходимо систематически оценивать.
6.3 Угрожающие симптомы при предсердной фибрилляции
У пациентов с AF качество жизни значительно беднее, чем у здоровых из-за различных симптомов , включая летаргия, сердцебиение, одышка, чувство стеснения в груди, нарушение сна и психосоциального стресса. Фармакологическая и интервенционная терапия улучшает качество жизни. Однако данных по сравнению преимуществ различных методов лечения мало. Оценка качества жизни также сдерживается отсутствием перекрестной проверки различных шкал, по оценке качества жизни. Что касается оценки симптомов EHRA, предложена шкала EHRA симптомов (Таблица 7), чтобы разделить тяжесть симптомов у пациентов AF. EHRA шкала используется и проверена в Канаде. В 2014 году шкала модифицирована, с подразделением класса 2 EHRA на мягкую (2a) и умеренную (2b.). Симптомы в классе 2b («тревожные» симптомы) позволяют выделить пациентов с положительной динамикой здоровья при контроле ритма. Это изменение может предоставить информацию для потенциального решения о лечении, но ожидает независимой проверки. Хотя некоторые AF пациенты не имели или имели минимальные симптомы (25-40%), многие (15 – 30 процентов) сообщают о тяжелых или выводящих из строя симптомах. Модифицированную шкалу EHRA следует использовать для симптом- ориентированного лечения и для лонгитюдного исследования пациентов.
Таблица 7
Клинические виды фибрилляции предсердий
AF = фибрилляция предсердий; LV = левого желудочка; ГЛЖ = левого желудочка гипертрофия. Признается, что эти типы AF будут пересекаться в клинической практике, и что их значение для контроля необходимо систематически оценивать.
6.3 Угрожающие симптомы при предсердной фибрилляции
У пациентов с AF качество жизни значительно беднее, чем у здоровых из-за различных симптомов , включая летаргия, сердцебиение, одышка, чувство стеснения в груди, нарушение сна и психосоциального стресса. Фармакологическая и интервенционная терапия улучшает качество жизни. Однако данных по сравнению преимуществ различных методов лечения мало. Оценка качества жизни также сдерживается отсутствием перекрестной проверки различных шкал, по оценке качества жизни. Что касается оценки симптомов EHRA, предложена шкала EHRA симптомов (Таблица 7), чтобы разделить тяжесть симптомов у пациентов AF. EHRA шкала используется и проверена в Канаде. В 2014 году шкала модифицирована, с подразделением класса 2 EHRA на мягкую (2a) и умеренную (2b.). Симптомы в классе 2b («тревожные» симптомы) позволяют выделить пациентов с положительной динамикой здоровья при контроле ритма. Это изменение может предоставить информацию для потенциального решения о лечении, но ожидает независимой проверки. Хотя некоторые AF пациенты не имели или имели минимальные симптомы (25-40%), многие (15 – 30 процентов) сообщают о тяжелых или выводящих из строя симптомах. Модифицированную шкалу EHRA следует использовать для симптом- ориентированного лечения и для лонгитюдного исследования пациентов.
Таблица 7
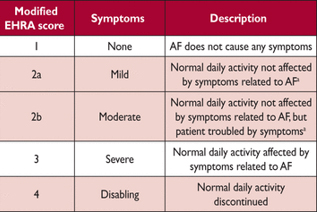 Модифицированная шкала симптомов Европейской ассоциации ритма сердца ( modified from Wynn et al.199)
AF = фибрилляция предсердий; EHRA = Ассоциация Европейского сердечного ритма.
EHRA класс 2a и 2b можно различать, оценивая имеют ли пациенты функциональные нарушения при симптомах AF. Наиболее частыми симптомами , связанными с AF являются слабость/ усталость и затрудненное дыхание, или менее частое сердцебиение и боль в груди.
Модифицированная шкала симптомов Европейской ассоциации ритма сердца ( modified from Wynn et al.199)
AF = фибрилляция предсердий; EHRA = Ассоциация Европейского сердечного ритма.
EHRA класс 2a и 2b можно различать, оценивая имеют ли пациенты функциональные нарушения при симптомах AF. Наиболее частыми симптомами , связанными с AF являются слабость/ усталость и затрудненное дыхание, или менее частое сердцебиение и боль в груди.
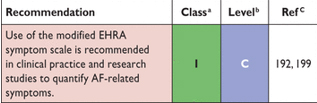 Рекомендация об использовании модифицированной шкалы симптомов Европейской ассоциации ритма сердца
Рекомендация об использовании модифицированной шкалы симптомов Европейской ассоциации ритма сердца
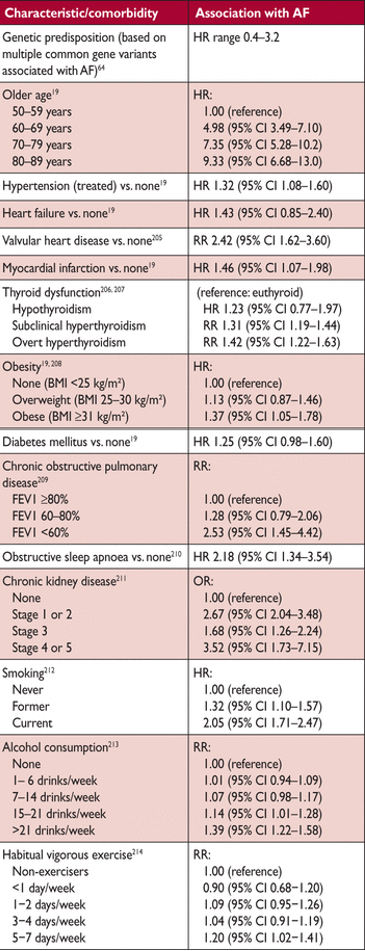 Сердечно-сосудистые и другие условия, самостоятельно связанные с мерцательной аритмией
AF = фибрилляция предсердий; ИМТ = индекс массы тела; CI = доверительный интервал; ОФВ1 = принудительного выдоха объем в 1 секунду; HR = соотношение риска; ИЛИ = отношение шансов; RR = коэффициент риска.
7.1 Сердечная недостаточность
Сердечная недостаточность и AF сочетаются у многих пациентов. Они связаны с аналогичными факторами риска и практически общей патофизиологией. Сердечная недостаточность и AF может вызвать и усиливать друг друга через такие механизмы, как структурная перестройка сердца, активация нейрогормональних механизмов, связанных с скорость нарушения функции левого желудочка (LV). Пациенты с AF и сопутствующей сердечной недостаточности, как с сохранившимися фракцией выброса [LV фракция выброса (ФВЛЖ) ≥50%] и снижением Фракции выброса (ФВЛЖ < 40%),имеют худший прогноз, включая увеличение смертности. Недавно руководством ESC по сердечной недостаточности также введена новая категория сердечной недостаточности с средней фракции выброса (HFmrEF; ФВЛЖ 40 – 49 процентов), хотя данные о пациентах AF в этой группе ограничены. Предотвращение неблагоприятных исходов и поддержание хорошего качества жизни являются целями наблюдения, у всех пациентов с AF и сопутствующей сердечной недостаточности, независимо от ФВЛЖ. Общий подход к терапии AF не отличается между пациентами сердечной недостаточности и другими, но имеет некоторые отличия. На заметку, единственная терапия с проверенным прогностическое значением у этих пациентов антикоагуляция, всем пациентам с риском инсульта должны быть назначены оральные антикоагулянты (см. главу 9).
7.1.1 Пациенты с мерцательной аритмией и сердечной недостаточностью со сниженной фракцией выброса
В дополнение к ОАС, стандартную терапию сердечной недостаточности следует использовать у пациентов с СН с сниженной фракцией выброса (HFrEF), как указано в руководящих принципах ESC. Это включает ингибиторы ангиотензин превращающего фермента (ACE) или блокаторы рецепторов ангиотензина (ARBs), антагонисты альдостерона, дефибрилляторы, сердечная ресинхронизирующая терапия, и комбинированные ингибиторы ангиотензиновых рецепторов neprilysin (ARNI) для пациентов, которые переносят ингибиторы АПФ или БРА с сохраняющимися симптомами.
Контроль ЧСС AF подробно рассматривается в главе 10. Короче говоря только бета-блокаторы и дигоксин целесообразны в HFrEF из-за отрицательных инотропных эффектов верапамила и Дилтиазема . Бета-блокаторы, как правило, препарат первой линии у больных с клинически стабильным HFrEF, хотя мета анализ с использованием индивидуальных данных пациента из рандомизированных контролируемых испытаний (РКИ) обнаружили не снижение показателей смертности от бета-блокаторов против плацебо в тех с AF на базовом (HR 0,97, 95% ДИ 0,83 – 1.14). Дигоксин обычно назначают в клинической практике, но сравнений в РКИ у пациентов с AF не проводилось. В мета анализе обсервационных исследований, дигоксин имеет нейтральный эффект на смертность у больных с AF и сопутствующей сердечной недостаточностью (скорректированы обсервационные исследования HR 0,90, 95% ДИ 0,70 – 1,16; соответствует склонность обсервационных исследований ОР 1,08, 95% ДИ 0,93 – 1,26). Таким образом в начальной и комбированной терапии по контролю ЧСС при AF с HFrEF следует учитывать индивидуальные особенности пациента и симптомы; назначение бета-блокаторов должно быть отложено, у больных с острой декомпенсацией сердечной недостаточности, а дигоксин может накапливаться и спровоцировать неблагоприятные эффекты у больных с нарушениями функции почек (см. главу 10).
Пациенты с AF и HFrEF, с выраженными симптомами может потребоваться не только терапия контроля ЧСС, но и терапия ритма сердца. Для пациентов, у которых HFrEF развивается в результате тахисистолии AF (tachycardiomyopathy) стратегия контроля ритма является предпочтительной , по данным нескольких относительно небольших когорт пациентов , где в исследованиях отмечалось улучшение LV функции ЛЖ после восстановления синусового ритма. Диагноз tachycardiomyopathy наблюдения, а иногда требует восстановления синусового ритма. Катетерная абляция может быть полезным методом для восстановления функции LV и качества жизни пациентов AF с HFrEF, но необходимы дополнительные данные. На рисунке 4приведена сводные данные по тактике ведения пациентов с AF и сердечной недостаточностью.
Рисунок 4
Сердечно-сосудистые и другие условия, самостоятельно связанные с мерцательной аритмией
AF = фибрилляция предсердий; ИМТ = индекс массы тела; CI = доверительный интервал; ОФВ1 = принудительного выдоха объем в 1 секунду; HR = соотношение риска; ИЛИ = отношение шансов; RR = коэффициент риска.
7.1 Сердечная недостаточность
Сердечная недостаточность и AF сочетаются у многих пациентов. Они связаны с аналогичными факторами риска и практически общей патофизиологией. Сердечная недостаточность и AF может вызвать и усиливать друг друга через такие механизмы, как структурная перестройка сердца, активация нейрогормональних механизмов, связанных с скорость нарушения функции левого желудочка (LV). Пациенты с AF и сопутствующей сердечной недостаточности, как с сохранившимися фракцией выброса [LV фракция выброса (ФВЛЖ) ≥50%] и снижением Фракции выброса (ФВЛЖ < 40%),имеют худший прогноз, включая увеличение смертности. Недавно руководством ESC по сердечной недостаточности также введена новая категория сердечной недостаточности с средней фракции выброса (HFmrEF; ФВЛЖ 40 – 49 процентов), хотя данные о пациентах AF в этой группе ограничены. Предотвращение неблагоприятных исходов и поддержание хорошего качества жизни являются целями наблюдения, у всех пациентов с AF и сопутствующей сердечной недостаточности, независимо от ФВЛЖ. Общий подход к терапии AF не отличается между пациентами сердечной недостаточности и другими, но имеет некоторые отличия. На заметку, единственная терапия с проверенным прогностическое значением у этих пациентов антикоагуляция, всем пациентам с риском инсульта должны быть назначены оральные антикоагулянты (см. главу 9).
7.1.1 Пациенты с мерцательной аритмией и сердечной недостаточностью со сниженной фракцией выброса
В дополнение к ОАС, стандартную терапию сердечной недостаточности следует использовать у пациентов с СН с сниженной фракцией выброса (HFrEF), как указано в руководящих принципах ESC. Это включает ингибиторы ангиотензин превращающего фермента (ACE) или блокаторы рецепторов ангиотензина (ARBs), антагонисты альдостерона, дефибрилляторы, сердечная ресинхронизирующая терапия, и комбинированные ингибиторы ангиотензиновых рецепторов neprilysin (ARNI) для пациентов, которые переносят ингибиторы АПФ или БРА с сохраняющимися симптомами.
Контроль ЧСС AF подробно рассматривается в главе 10. Короче говоря только бета-блокаторы и дигоксин целесообразны в HFrEF из-за отрицательных инотропных эффектов верапамила и Дилтиазема . Бета-блокаторы, как правило, препарат первой линии у больных с клинически стабильным HFrEF, хотя мета анализ с использованием индивидуальных данных пациента из рандомизированных контролируемых испытаний (РКИ) обнаружили не снижение показателей смертности от бета-блокаторов против плацебо в тех с AF на базовом (HR 0,97, 95% ДИ 0,83 – 1.14). Дигоксин обычно назначают в клинической практике, но сравнений в РКИ у пациентов с AF не проводилось. В мета анализе обсервационных исследований, дигоксин имеет нейтральный эффект на смертность у больных с AF и сопутствующей сердечной недостаточностью (скорректированы обсервационные исследования HR 0,90, 95% ДИ 0,70 – 1,16; соответствует склонность обсервационных исследований ОР 1,08, 95% ДИ 0,93 – 1,26). Таким образом в начальной и комбированной терапии по контролю ЧСС при AF с HFrEF следует учитывать индивидуальные особенности пациента и симптомы; назначение бета-блокаторов должно быть отложено, у больных с острой декомпенсацией сердечной недостаточности, а дигоксин может накапливаться и спровоцировать неблагоприятные эффекты у больных с нарушениями функции почек (см. главу 10).
Пациенты с AF и HFrEF, с выраженными симптомами может потребоваться не только терапия контроля ЧСС, но и терапия ритма сердца. Для пациентов, у которых HFrEF развивается в результате тахисистолии AF (tachycardiomyopathy) стратегия контроля ритма является предпочтительной , по данным нескольких относительно небольших когорт пациентов , где в исследованиях отмечалось улучшение LV функции ЛЖ после восстановления синусового ритма. Диагноз tachycardiomyopathy наблюдения, а иногда требует восстановления синусового ритма. Катетерная абляция может быть полезным методом для восстановления функции LV и качества жизни пациентов AF с HFrEF, но необходимы дополнительные данные. На рисунке 4приведена сводные данные по тактике ведения пациентов с AF и сердечной недостаточностью.
Рисунок 4
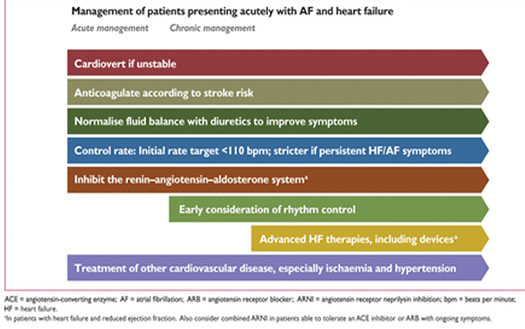 Тактика ведения больных с мерцательной аритмией и сердечной недостаточностью . (Adapted from Kotecha and Piccini. 128)
7.1.2 Фибрилляции предсердий у пациентов с сердечной недостаточностью с сохранившейся фракцией выброса
Диагностика сердечной недостаточности с сохранившимися ФВ (HFpEF) у больных с AF является проблематичным из-за трудности разделения симптомов, которые связаны с ФВ от тех, при AF. Хотя диагностические дифференциация может быть достигнуто путем кардиоверсии и клинической переоценки, но должно быть разделено симптоматическое улучшение от специфической терапии, которая улучшает прогноз при HFpEF. Эхокардиография может помочь обнаружению HFpEF у больных с симптоматической AF путем предоставления доказательств соответствующих структурных болезней сердца [, например, LV гипертрофия (ГЛЖ)] и/или обнаружения диастолической дисфункции. Снижение раннего диастолического размера миокарда скорость e’ ткань Doppler отражает нарушение LV релаксации, в то время как соотношение E/e ‘ коррелирует с инвазивным измерением давления наполнения ЛЖ. Уровень натрийуретического пептида являются частью диагностической оценки HFpEF, хотя уровень натрийуретического пептида повышен у AF пациентов, а размах оптимальных диагностических границ до сих пор неизвестен. При лечении пациентов с AF и сочетанной HFpEF следует сосредоточиться на контроле баланса жидкости и сопутствующих состояний, таких, как гипертония и ишемия миокарда.
7.1.3 Фибрилляции предсердий у пациентов с сердечной недостаточностью со средней фракции выброса
HFmrEF является недавно предложенным определеннием , и описывает пациентов с симптомами и признаками сердечной недостаточности, ФВЛЖ 40 – 49%, повышенным уровнем натрийуретических пептидов и LV гипертрофией , расширением левого предсердия (LA) или наличием диастолической дисфункции. Однако диагноз сложнее у больных с AF, когда натрийуретические пептидов повышены при AF и имеется LA дилатация, независимо от сопутствующей сердечной недостаточности. ФВЛЖ также является переменной и её трудно оценить при AF у пациентов из-за AF-индуцированной снижение систолической функции LV и различной длительности сердечного цикла. Требуется дальнейшее изучение этой группы требуется, прежде чем рекомендовать стратегии лечения пациентов AF с HFmrEF.
7.1.4 Профилактика фибрилляции предсердий при сердечной недостаточности
Ретроспективный анализ из крупных рандомизированных испытаний сообщили о меньшей частоте AF впервые возникшей у пациентов, получавших ингибиторы АПФ/БРА по сравнению с плацебо. Эффект снижения заболеваемости AF с ингибиторами АПФ /БРА менее очевиден у пациентов с HFpEF и потеряется у пациентав без сердечной недостаточности. Neprilysin ингибиция, не добавляет этот эффект. Бета-блокатор терапия была связана с 33% снижением скорректированного шансы возникновения AF у HFrEF пациентов, предварительно принимавших с ингибиторы АПФ/БРА, повышающее значимость бета-блокатор терапии у больных HFrEF с синусовым ритмом. Eplerenone, антагонист рецепторов минералокортикоида, также снижает риск возникновения AF у больных с ФВЛЖ ≤35%, Нью-Йорк ассоциации сердца (NYHA) класс II, при добавлении к ингибиторам АПФ/БРА и бета-блокаторам.
7.2 Гипертоническая болезнь
Гипертония является фактором риска инсульта при AF; неконтролируемое высокое кровяное давление, повышает риск инсульта и кровотечения и может привести к рецидивирующий AF. Таким образом тщательный контроль кровяного давления должен стать неотъемлемой частью наблюдения AF пациентов. Ингибирование активности ренин ангиотензин альдостероновой системы может предотвратить ремоделирование и рецидивирующую AF. Прием различных антигипертензивных препаратов уменьшает возникновение AF, а также предлагается положительный эффект ингибиторов АПФ или БРА. Прием ингибиторов АПФ или БРА у больных с сердечной недостаточностью или ГЛЖ показывают низкий уровень возникновения новых AF.У пациентов с установленной AF, но без LV дисфункции или сердечной недостаточности БРА не предотвращают рецидивирующий характер AF лучше, чем плацебо. Ингибиторы АПФ или БРА могут уменьшить рецидивирование AF после кардиоверсии когда имеется совместная антиаритмическиая лекарственной терапии, по сравнению только с катетерной абляцией.
7.3 Клапанные болезни сердца
Пороки сердца самостоятельно связаны с возникновением AF. Примерно 30% пациентов с AF имеют некоторые формы клапанной болезни сердца, часто обнаруживаемых только при эхокардиографии. AF ухудшает прогноз у больных с тяжелой клапанной болезнью сердца, в том числе получивших хирургические или транскатетерное вмешательства в связи с поражением аортального или митрального клапана. С клапанной болезнью сердца могут быть связаны с повышенные риски тромбоэмболий, который вероятно также повышают риск инсульта у пациентов AF. Подобно сердечной недостаточности, клапанные й болезни и AF взаимодействуют с и поддерживать друг друга через перегрузку давлением, tachycardiomyopathy, и нейрогуморальные факторы. Когда дисфункция клапана тяжелой, AF можно рассматривать в качестве маркера прогрессивания заболевания, и потребности протезирования клапанов или его замены.
Традиционно пациентов с AF были делят на «клапанную» и «non клапанную» AF. Хотя были использованы несколько различных определений, клапанная AF главным образом относится к AF пациентам, которые имеют ревматические пороки (большей частью митральный стеноз) или механические клапаны. В самом деле, в то время как AF подразумевает добавочный риск тромбоэмболии у больных ос стенозом митрального клапана, нет никаких четких доказательств того, что другие клапанной болезни, включая митральной регургитацию или болезнь аортального клапана, нужно учитывать при выборе антикоагулянтов или действительно оценить риск инсульта при AF. Поэтому мы решили заменить исторический термин «non клапанной» АФ со ссылкой на конкретные условия.
Тактика ведения больных с мерцательной аритмией и сердечной недостаточностью . (Adapted from Kotecha and Piccini. 128)
7.1.2 Фибрилляции предсердий у пациентов с сердечной недостаточностью с сохранившейся фракцией выброса
Диагностика сердечной недостаточности с сохранившимися ФВ (HFpEF) у больных с AF является проблематичным из-за трудности разделения симптомов, которые связаны с ФВ от тех, при AF. Хотя диагностические дифференциация может быть достигнуто путем кардиоверсии и клинической переоценки, но должно быть разделено симптоматическое улучшение от специфической терапии, которая улучшает прогноз при HFpEF. Эхокардиография может помочь обнаружению HFpEF у больных с симптоматической AF путем предоставления доказательств соответствующих структурных болезней сердца [, например, LV гипертрофия (ГЛЖ)] и/или обнаружения диастолической дисфункции. Снижение раннего диастолического размера миокарда скорость e’ ткань Doppler отражает нарушение LV релаксации, в то время как соотношение E/e ‘ коррелирует с инвазивным измерением давления наполнения ЛЖ. Уровень натрийуретического пептида являются частью диагностической оценки HFpEF, хотя уровень натрийуретического пептида повышен у AF пациентов, а размах оптимальных диагностических границ до сих пор неизвестен. При лечении пациентов с AF и сочетанной HFpEF следует сосредоточиться на контроле баланса жидкости и сопутствующих состояний, таких, как гипертония и ишемия миокарда.
7.1.3 Фибрилляции предсердий у пациентов с сердечной недостаточностью со средней фракции выброса
HFmrEF является недавно предложенным определеннием , и описывает пациентов с симптомами и признаками сердечной недостаточности, ФВЛЖ 40 – 49%, повышенным уровнем натрийуретических пептидов и LV гипертрофией , расширением левого предсердия (LA) или наличием диастолической дисфункции. Однако диагноз сложнее у больных с AF, когда натрийуретические пептидов повышены при AF и имеется LA дилатация, независимо от сопутствующей сердечной недостаточности. ФВЛЖ также является переменной и её трудно оценить при AF у пациентов из-за AF-индуцированной снижение систолической функции LV и различной длительности сердечного цикла. Требуется дальнейшее изучение этой группы требуется, прежде чем рекомендовать стратегии лечения пациентов AF с HFmrEF.
7.1.4 Профилактика фибрилляции предсердий при сердечной недостаточности
Ретроспективный анализ из крупных рандомизированных испытаний сообщили о меньшей частоте AF впервые возникшей у пациентов, получавших ингибиторы АПФ/БРА по сравнению с плацебо. Эффект снижения заболеваемости AF с ингибиторами АПФ /БРА менее очевиден у пациентов с HFpEF и потеряется у пациентав без сердечной недостаточности. Neprilysin ингибиция, не добавляет этот эффект. Бета-блокатор терапия была связана с 33% снижением скорректированного шансы возникновения AF у HFrEF пациентов, предварительно принимавших с ингибиторы АПФ/БРА, повышающее значимость бета-блокатор терапии у больных HFrEF с синусовым ритмом. Eplerenone, антагонист рецепторов минералокортикоида, также снижает риск возникновения AF у больных с ФВЛЖ ≤35%, Нью-Йорк ассоциации сердца (NYHA) класс II, при добавлении к ингибиторам АПФ/БРА и бета-блокаторам.
7.2 Гипертоническая болезнь
Гипертония является фактором риска инсульта при AF; неконтролируемое высокое кровяное давление, повышает риск инсульта и кровотечения и может привести к рецидивирующий AF. Таким образом тщательный контроль кровяного давления должен стать неотъемлемой частью наблюдения AF пациентов. Ингибирование активности ренин ангиотензин альдостероновой системы может предотвратить ремоделирование и рецидивирующую AF. Прием различных антигипертензивных препаратов уменьшает возникновение AF, а также предлагается положительный эффект ингибиторов АПФ или БРА. Прием ингибиторов АПФ или БРА у больных с сердечной недостаточностью или ГЛЖ показывают низкий уровень возникновения новых AF.У пациентов с установленной AF, но без LV дисфункции или сердечной недостаточности БРА не предотвращают рецидивирующий характер AF лучше, чем плацебо. Ингибиторы АПФ или БРА могут уменьшить рецидивирование AF после кардиоверсии когда имеется совместная антиаритмическиая лекарственной терапии, по сравнению только с катетерной абляцией.
7.3 Клапанные болезни сердца
Пороки сердца самостоятельно связаны с возникновением AF. Примерно 30% пациентов с AF имеют некоторые формы клапанной болезни сердца, часто обнаруживаемых только при эхокардиографии. AF ухудшает прогноз у больных с тяжелой клапанной болезнью сердца, в том числе получивших хирургические или транскатетерное вмешательства в связи с поражением аортального или митрального клапана. С клапанной болезнью сердца могут быть связаны с повышенные риски тромбоэмболий, который вероятно также повышают риск инсульта у пациентов AF. Подобно сердечной недостаточности, клапанные й болезни и AF взаимодействуют с и поддерживать друг друга через перегрузку давлением, tachycardiomyopathy, и нейрогуморальные факторы. Когда дисфункция клапана тяжелой, AF можно рассматривать в качестве маркера прогрессивания заболевания, и потребности протезирования клапанов или его замены.
Традиционно пациентов с AF были делят на «клапанную» и «non клапанную» AF. Хотя были использованы несколько различных определений, клапанная AF главным образом относится к AF пациентам, которые имеют ревматические пороки (большей частью митральный стеноз) или механические клапаны. В самом деле, в то время как AF подразумевает добавочный риск тромбоэмболии у больных ос стенозом митрального клапана, нет никаких четких доказательств того, что другие клапанной болезни, включая митральной регургитацию или болезнь аортального клапана, нужно учитывать при выборе антикоагулянтов или действительно оценить риск инсульта при AF. Поэтому мы решили заменить исторический термин «non клапанной» АФ со ссылкой на конкретные условия.
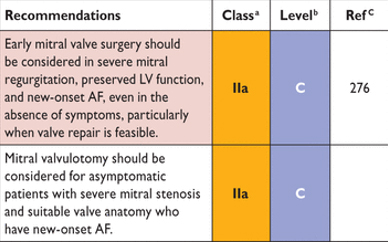 AF = фибрилляция предсердий; LV = левого желудочка.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с клапанной болезнью сердца и фибрилляцией предсердий
7.4 Сахарный диабет
Диабет и AF часто сосуществуют из-за ассоциаций с другими факторами риска. Диабет является фактором риска инсульта и других осложнений в AF. У больных с AF длительность диабета создает более высокий риск тромбоэмболии, хотя и без большей опасности связанных с антикоагулянтной терапией кровотечений. К сожалению интенсивный гликемический контроль не влияет на возникновение ФП, в то время как лечение метформином, как представляется, связано со снижение долгосрочного риска AF у больных сахарным диабетом и даже может быть связано с более низким долгосрочным риском инсульта. Диабетическая ретинопатия, является мерой тяжести заболевания, но не увеличивает риск глазных кровотечений у пациентов, получающих антикоагулянты.
7.5 Ожирение и потеря веса
7.5.1 Ожирение как фактор риска
Ожирение увеличивает риск для AF (Таблица 8 ) с прогрессивным увеличением при росте индекса массы тела (ИМТ). Пациенты с ожирением чаще могут иметь LV диастолическую дисфункцию, увеличение симпатической активности и воспаление и увеличение жировой инфильтрации предсердий. Ожирение также может быть фактором риска ишемического инсульта, тромбоэмболии и смерти пациентов AF.
7.5.2 Снижение веса при ожирении у пациентов с мерцательной аритмией
Интенсивное похудание в дополнение к контролю других сердечно-сосудистых факторов риска (в диапазоне 10 – 15 кг веса достигнута), привело к уменьшению рецидивов AF и симптомов, по сравнению с подходом, основанным на общих советов при ожирении пациентов с AF. Кардиореспираторной фитнес может уменьшить тяжесть AF при ожирении пациентов с AF. Хотя результаты в этих исследованиях должны быть подтверждены, они поддерживают положительный эффект снижения веса у тучных пациентов AF.
7.5.3 Катетерная абляция у пациентов с ожирением
Ожирение может ускорить рецидив ФП после катетерной абляции, особенно с обструктивным апноэ как важного потенциального сопутствующего фактора. Ожирение также связано с более высокой дозой облучения и осложнений во время AF абляции. В частности, симптоматическое улучшение после Катетерной абляции AF у пациентов, страдающих ожирением, как представляется, сопоставимо с улучшением при нормализации веса пациентов. Результаты сокращения AF эпизодов при снижении веса (см. главу 7.5.2.) Следует предлагать AF абляцию пациентам, страдающих ожирением, в сочетании с изменением образа жизни, которые приводят к снижению веса.
AF = фибрилляция предсердий; LV = левого желудочка.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с клапанной болезнью сердца и фибрилляцией предсердий
7.4 Сахарный диабет
Диабет и AF часто сосуществуют из-за ассоциаций с другими факторами риска. Диабет является фактором риска инсульта и других осложнений в AF. У больных с AF длительность диабета создает более высокий риск тромбоэмболии, хотя и без большей опасности связанных с антикоагулянтной терапией кровотечений. К сожалению интенсивный гликемический контроль не влияет на возникновение ФП, в то время как лечение метформином, как представляется, связано со снижение долгосрочного риска AF у больных сахарным диабетом и даже может быть связано с более низким долгосрочным риском инсульта. Диабетическая ретинопатия, является мерой тяжести заболевания, но не увеличивает риск глазных кровотечений у пациентов, получающих антикоагулянты.
7.5 Ожирение и потеря веса
7.5.1 Ожирение как фактор риска
Ожирение увеличивает риск для AF (Таблица 8 ) с прогрессивным увеличением при росте индекса массы тела (ИМТ). Пациенты с ожирением чаще могут иметь LV диастолическую дисфункцию, увеличение симпатической активности и воспаление и увеличение жировой инфильтрации предсердий. Ожирение также может быть фактором риска ишемического инсульта, тромбоэмболии и смерти пациентов AF.
7.5.2 Снижение веса при ожирении у пациентов с мерцательной аритмией
Интенсивное похудание в дополнение к контролю других сердечно-сосудистых факторов риска (в диапазоне 10 – 15 кг веса достигнута), привело к уменьшению рецидивов AF и симптомов, по сравнению с подходом, основанным на общих советов при ожирении пациентов с AF. Кардиореспираторной фитнес может уменьшить тяжесть AF при ожирении пациентов с AF. Хотя результаты в этих исследованиях должны быть подтверждены, они поддерживают положительный эффект снижения веса у тучных пациентов AF.
7.5.3 Катетерная абляция у пациентов с ожирением
Ожирение может ускорить рецидив ФП после катетерной абляции, особенно с обструктивным апноэ как важного потенциального сопутствующего фактора. Ожирение также связано с более высокой дозой облучения и осложнений во время AF абляции. В частности, симптоматическое улучшение после Катетерной абляции AF у пациентов, страдающих ожирением, как представляется, сопоставимо с улучшением при нормализации веса пациентов. Результаты сокращения AF эпизодов при снижении веса (см. главу 7.5.2.) Следует предлагать AF абляцию пациентам, страдающих ожирением, в сочетании с изменением образа жизни, которые приводят к снижению веса.
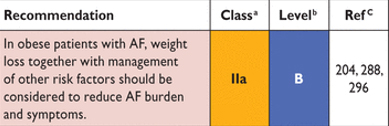 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендацию.
Рекомендация для страдающих ожирением пациентов с мерцательной аритмией
7.6 Хроническая обструктивная болезнь легких, апноэ сна и другие респираторных заболеваний
AF ассоциируется с обструктивным апноэ. Множественные патофизиологические механизмы могут способствовать возникновению AF при обструктивном апноэ, включая вегетативную дисфункцию, гипоксию, гиперкапнию и воспаление. Обструктивное апноэ повышает внутригрудное давление, которые само по себе и через вагусную активацию может провоцировать всплеск потенциала сокращения предсердий и вызвать AF. Снижение факторов риска и улучшение вентиляции может уменьшить рецидивы AF. Представляется разумным рассматривать обструктивное апноэ для скрининга AF у пациентов с факторами риска. Лечение обструктивного апноэ должны быть оптимизировано для улучшения результатов лечения AF у соответствующих пациентов. Прессотерапию с поддержкой сервоприводом не следует использовать у HFrEF пациентов с преобладающим ночного апноэ центрального происхождения (из которых 25% имели сочетанную AF).
Пациенты с хронической обструктивной болезнью легких часто страдают от предсердной тахикардии, которую необходимо отдифференцировать от AF по ЭКГ. Препараты, используемые для облегчения бронхоспазма, особенно теофиллин и бета-агонисты, могут спровоцировать AF и сделать контроль ритма желудочков затруднительным. Неселективные бета-блокаторы, соталол, пропафенон и аденозин следует использовать с осторожностью у пациентов со значительным бронхоспазмом, в то время как они могут безопасно использоваться у пациентов с хронической обструктивной болезнью легких. Селективные Блокаторы бета-1 (например, бисопролол, метопролола и Небиволол), дилтиазем и верапамил обычно хорошо переносятся и эффективны (см. главу 10).
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендацию.
Рекомендация для страдающих ожирением пациентов с мерцательной аритмией
7.6 Хроническая обструктивная болезнь легких, апноэ сна и другие респираторных заболеваний
AF ассоциируется с обструктивным апноэ. Множественные патофизиологические механизмы могут способствовать возникновению AF при обструктивном апноэ, включая вегетативную дисфункцию, гипоксию, гиперкапнию и воспаление. Обструктивное апноэ повышает внутригрудное давление, которые само по себе и через вагусную активацию может провоцировать всплеск потенциала сокращения предсердий и вызвать AF. Снижение факторов риска и улучшение вентиляции может уменьшить рецидивы AF. Представляется разумным рассматривать обструктивное апноэ для скрининга AF у пациентов с факторами риска. Лечение обструктивного апноэ должны быть оптимизировано для улучшения результатов лечения AF у соответствующих пациентов. Прессотерапию с поддержкой сервоприводом не следует использовать у HFrEF пациентов с преобладающим ночного апноэ центрального происхождения (из которых 25% имели сочетанную AF).
Пациенты с хронической обструктивной болезнью легких часто страдают от предсердной тахикардии, которую необходимо отдифференцировать от AF по ЭКГ. Препараты, используемые для облегчения бронхоспазма, особенно теофиллин и бета-агонисты, могут спровоцировать AF и сделать контроль ритма желудочков затруднительным. Неселективные бета-блокаторы, соталол, пропафенон и аденозин следует использовать с осторожностью у пациентов со значительным бронхоспазмом, в то время как они могут безопасно использоваться у пациентов с хронической обструктивной болезнью легких. Селективные Блокаторы бета-1 (например, бисопролол, метопролола и Небиволол), дилтиазем и верапамил обычно хорошо переносятся и эффективны (см. главу 10).
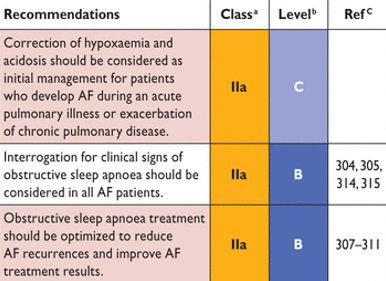 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания , поддерживающие рекомендации.
Рекомендации для пациентов с мерцательной аритмией и респираторными заболеваниями
7.7 Хроническая болезнь почек
AF присутствует в 15 – 20% больных с ХБП. Определение ХПБ в большинстве исследований по AF является довольно строгим. Для установления диагноза ХПБ использовался уровень клиренса креатинина (CrCl) < 60 мл/мин, но в ряде исследований пациенты с AF имели CrCl < 50 мл/мин по формуле Cockroft–Gault для адаптации дозы антикоагулянтов NOAC. CrCl у AF пациентов может ухудшаться с течением времени. В главе 9.2.4 рассматривается методика применения оральных коагулянтов у пациентов с ХБП.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с заболеванием почек и фибрилляцией предсердий
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания , поддерживающие рекомендации.
Рекомендации для пациентов с мерцательной аритмией и респираторными заболеваниями
7.7 Хроническая болезнь почек
AF присутствует в 15 – 20% больных с ХБП. Определение ХПБ в большинстве исследований по AF является довольно строгим. Для установления диагноза ХПБ использовался уровень клиренса креатинина (CrCl) < 60 мл/мин, но в ряде исследований пациенты с AF имели CrCl < 50 мл/мин по формуле Cockroft–Gault для адаптации дозы антикоагулянтов NOAC. CrCl у AF пациентов может ухудшаться с течением времени. В главе 9.2.4 рассматривается методика применения оральных коагулянтов у пациентов с ХБП.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с заболеванием почек и фибрилляцией предсердий
 Рекомендации по острым и хроническим состояниям у пациентов с ФП, отдаленные кардиоваскулярные результаты, и состояние здоровья пациентов
Таблица 9
Рекомендации по острым и хроническим состояниям у пациентов с ФП, отдаленные кардиоваскулярные результаты, и состояние здоровья пациентов
Таблица 9
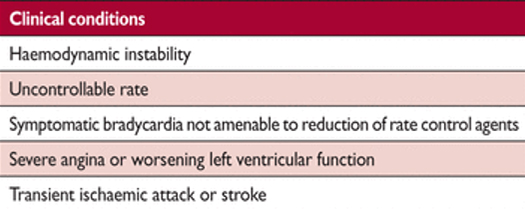 Клинические ситуации, требующие неотложной помощи специалистов службы ФП
A Антикоагуляцию следует начать как можно раньше у всех подходящих пациентов и обычно не требует привлечения специалиста.
Рисунок 6
Клинические ситуации, требующие неотложной помощи специалистов службы ФП
A Антикоагуляцию следует начать как можно раньше у всех подходящих пациентов и обычно не требует привлечения специалиста.
Рисунок 6
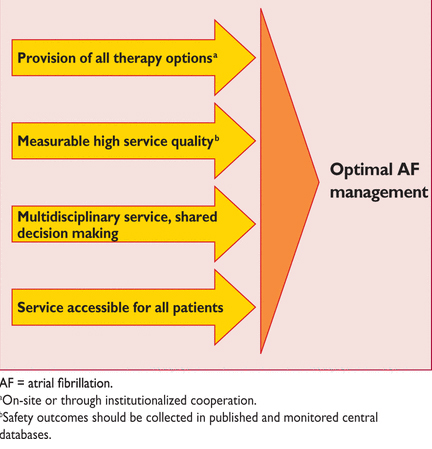 Достижение оптимального наблюдения пациентов с ФП
Рисунок 7
Достижение оптимального наблюдения пациентов с ФП
Рисунок 7
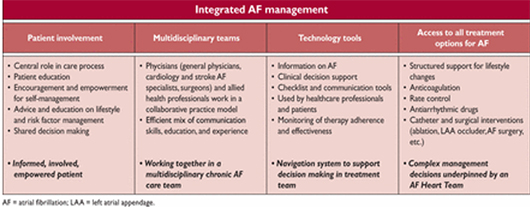 Основы комплексной медицинской помощи пациентам ФП.
8.1 Доказательства в поддержку комплексного наблюдения фибрилляции
Комплексный подход в сравнении с обычным уменьшает примерно на треть число госпитализации и сердечно-сосудистой смертей при наблюдении в течении 22 месяцев (14,3% против 20,8%, HR 0,65; 95% ДИ 0,45 – 0,93; P = 0,017). Комплексный подход ФП представляется экономически эффективным. в этом исследовании.
8.2 Компоненты комплексного наблюдения ФП
8.2.1 Участие больного
Пациенты должны занимать центральную роль в процессе лечения. Лечение AF требует от пациентов, изменение образа жизни и приверженности к лечению, порой без ощутимых сразу результатов, но пациенты должны понимать свои обязанности в процессе лечения. Врачи и социальные работники отвечают за обеспечение доступа к научно обоснованной терапии, но выполнение назначений является в конечном счете ответственностью информированных и самостоятельных пациентов, лучше всего описанное как «общая ответственность». Следовательно, информация и образование пациентов и часто их партнеров и родственников, является непременным условием для поощрения личного участия и расширения возможностей пациентов участвовать в принятии общих решений, и поддерживать понимание болезни и предлагаемого лечения.
8.2.2 Междисциплинарные подходы при фибрилляции
Делегирование задач от специалистов врачам общей практике и от терапевтов к врачам смежных специальностей является базовой концепцией модели комплексной медицинской помощи. Междисциплинарный подход команды AF включает эффективное сочетание межличностного общения и навыков общения, образования и опыт в ведении ФП, а также принципа приверженности лечению. Такой подход подчеркивает важность реорганизации повседневной практике в поощрении не- специалистов и врачей смежных специальностей, в просвещении пациентов и координации помощи, в то время как врачам специалистам остаются медицинские вопросы. Культурные и региональные различия, будет определять состав команд AF.
8.2.3 Роль не- специалистов (non–specialists)
Некоторые не- специалисты медико-санитарной помощи, например врачи первичной медицинской помощи имеют большой опыт в профилактике инсульта и первоначальном ведении AF пациентов. Другие могут пройти обучение для приобретения таких знаний. Другие компоненты ведения AF (например, оценка сопутствующих сердечно-сосудистых заболеваний, антиаритмическая лекарственная терапия или интервенционное лечение) часто требуют привлечения врача-специалиста. Организация помощи AF должна поддерживать инициирование лечения не специалистами, где это уместно и обеспечить беспрепятственный доступ к консультации врачей – специалистов для оптимизации лечения AF.
8.2.4 Софт-Технологии при комплексном наблюдении фибрилляции
Технологии, такие, как подготовка программного обеспечения, имеет потенциал для повышения эффективности научно обоснованной медицинской помощи и улучшить отдаленные результаты, когда они построены на экспертных заключениях. Электронные средства могут также обеспечить последовательные коммуникации в команде AF. В целях поддержки более широкого использования такой технологии Целевая группа предоставляет инструменты цифрового общения в виде свободно доступных смартфон приложений, для AF медицинских работников и пациентов AF.
Основы комплексной медицинской помощи пациентам ФП.
8.1 Доказательства в поддержку комплексного наблюдения фибрилляции
Комплексный подход в сравнении с обычным уменьшает примерно на треть число госпитализации и сердечно-сосудистой смертей при наблюдении в течении 22 месяцев (14,3% против 20,8%, HR 0,65; 95% ДИ 0,45 – 0,93; P = 0,017). Комплексный подход ФП представляется экономически эффективным. в этом исследовании.
8.2 Компоненты комплексного наблюдения ФП
8.2.1 Участие больного
Пациенты должны занимать центральную роль в процессе лечения. Лечение AF требует от пациентов, изменение образа жизни и приверженности к лечению, порой без ощутимых сразу результатов, но пациенты должны понимать свои обязанности в процессе лечения. Врачи и социальные работники отвечают за обеспечение доступа к научно обоснованной терапии, но выполнение назначений является в конечном счете ответственностью информированных и самостоятельных пациентов, лучше всего описанное как «общая ответственность». Следовательно, информация и образование пациентов и часто их партнеров и родственников, является непременным условием для поощрения личного участия и расширения возможностей пациентов участвовать в принятии общих решений, и поддерживать понимание болезни и предлагаемого лечения.
8.2.2 Междисциплинарные подходы при фибрилляции
Делегирование задач от специалистов врачам общей практике и от терапевтов к врачам смежных специальностей является базовой концепцией модели комплексной медицинской помощи. Междисциплинарный подход команды AF включает эффективное сочетание межличностного общения и навыков общения, образования и опыт в ведении ФП, а также принципа приверженности лечению. Такой подход подчеркивает важность реорганизации повседневной практике в поощрении не- специалистов и врачей смежных специальностей, в просвещении пациентов и координации помощи, в то время как врачам специалистам остаются медицинские вопросы. Культурные и региональные различия, будет определять состав команд AF.
8.2.3 Роль не- специалистов (non–specialists)
Некоторые не- специалисты медико-санитарной помощи, например врачи первичной медицинской помощи имеют большой опыт в профилактике инсульта и первоначальном ведении AF пациентов. Другие могут пройти обучение для приобретения таких знаний. Другие компоненты ведения AF (например, оценка сопутствующих сердечно-сосудистых заболеваний, антиаритмическая лекарственная терапия или интервенционное лечение) часто требуют привлечения врача-специалиста. Организация помощи AF должна поддерживать инициирование лечения не специалистами, где это уместно и обеспечить беспрепятственный доступ к консультации врачей – специалистов для оптимизации лечения AF.
8.2.4 Софт-Технологии при комплексном наблюдении фибрилляции
Технологии, такие, как подготовка программного обеспечения, имеет потенциал для повышения эффективности научно обоснованной медицинской помощи и улучшить отдаленные результаты, когда они построены на экспертных заключениях. Электронные средства могут также обеспечить последовательные коммуникации в команде AF. В целях поддержки более широкого использования такой технологии Целевая группа предоставляет инструменты цифрового общения в виде свободно доступных смартфон приложений, для AF медицинских работников и пациентов AF.
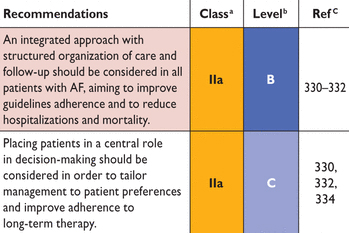 AF = фибрилляции предсердий
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по комплексному подходу к оказанию медицинской помощи
8.3 Диагностическое обследование пациентов с ФП
AF часто встречается у пациентов с другими, временами недиагностированными, сердечно-сосудистыми заболеваниями. Таким образом все пациенты AF выиграют от квалифицированной кардиологической помощи.
8.3.1 Стандарт обследования пациентов с ФП
Следует собрать полный анамнез истории болезни, и все пациенты должны пройти полное клиническое обследование, которое включает тщательную оценку сопутствующих заболеваний, создать модель AF, оценить риск инсульта и связанных с AF симптомов и оценить опасность осложнений, связанных с нарушением сердечного ритма, например, тромбоэмболиями или дисфункции ЛЖ(LV). 12-ЭКГ отведениях рекомендуется при подозрении диагноза AF, определения ЧСС AF и выполнить скрининг нарушений проводимости, ишемии и признаков структурных болезни сердца. Первоначальными анализами крови следует оценить функцию щитовидной железы и функции почек, а также электролиты сыворотки и полный анализ крови. Трансторакальная эхокардиография рекомендуется всем пациентам AF для решения о лечении. Трансторакальная эхокардиография следует использовать для выявления структурных заболеваний (например, клапанной болезни) и оценить размер LV и функции (систолической и диастолической), предсердий размеры и функцию правого сердца. Хотя биомаркеры такие как натрийуретический пептид повышены у AF пациентов, нет достаточных данных, чтобы предположить, что параметры крови могут быть независимыми маркерами для AF.
8.3.2 2 Дополнительные исследования у отдельных пациентов с мерцательной аритмией
Амбулаторная ЭКГ при мониторинге пациентов AF может оценить адекватность контроля ЧСС, симптомы рецидивирования AF и обнаруживатьфокальные эктопические очаги индуцирующие приступы пароксизмальная AF. Трансэзофагеальная эхокардиография (TOE) является полезным для оценки клапанной болезни сердца и исключения внутрисердечной тромбов, особенно в ушке левого предсердия LAA для проведения ранних кардиоверсии или Катетерной абляция. Пациенты с симптомами или признаки ишемия миокарда должны подвергаться коронарной ангиографии или стресс-тестирования при необходимости. У больных с AF и признаки церебральной ишемии или инсульта компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга рекомендуется для обнаружения инсульта и выработки решений, касающихся неотложного и долгосрочного назначения антикоагулянтов. МРТ левого предсердия с контрастированием, с использованием гадолиния в качестве контраста, в режиме T1 визуализирует сердце, а внутрисердечной эхо может помочь в решении о лечении в AF, но требуют проверки в многоцентровых исследованиях.
8.4 Система контроля
AF = фибрилляции предсердий
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по комплексному подходу к оказанию медицинской помощи
8.3 Диагностическое обследование пациентов с ФП
AF часто встречается у пациентов с другими, временами недиагностированными, сердечно-сосудистыми заболеваниями. Таким образом все пациенты AF выиграют от квалифицированной кардиологической помощи.
8.3.1 Стандарт обследования пациентов с ФП
Следует собрать полный анамнез истории болезни, и все пациенты должны пройти полное клиническое обследование, которое включает тщательную оценку сопутствующих заболеваний, создать модель AF, оценить риск инсульта и связанных с AF симптомов и оценить опасность осложнений, связанных с нарушением сердечного ритма, например, тромбоэмболиями или дисфункции ЛЖ(LV). 12-ЭКГ отведениях рекомендуется при подозрении диагноза AF, определения ЧСС AF и выполнить скрининг нарушений проводимости, ишемии и признаков структурных болезни сердца. Первоначальными анализами крови следует оценить функцию щитовидной железы и функции почек, а также электролиты сыворотки и полный анализ крови. Трансторакальная эхокардиография рекомендуется всем пациентам AF для решения о лечении. Трансторакальная эхокардиография следует использовать для выявления структурных заболеваний (например, клапанной болезни) и оценить размер LV и функции (систолической и диастолической), предсердий размеры и функцию правого сердца. Хотя биомаркеры такие как натрийуретический пептид повышены у AF пациентов, нет достаточных данных, чтобы предположить, что параметры крови могут быть независимыми маркерами для AF.
8.3.2 2 Дополнительные исследования у отдельных пациентов с мерцательной аритмией
Амбулаторная ЭКГ при мониторинге пациентов AF может оценить адекватность контроля ЧСС, симптомы рецидивирования AF и обнаруживатьфокальные эктопические очаги индуцирующие приступы пароксизмальная AF. Трансэзофагеальная эхокардиография (TOE) является полезным для оценки клапанной болезни сердца и исключения внутрисердечной тромбов, особенно в ушке левого предсердия LAA для проведения ранних кардиоверсии или Катетерной абляция. Пациенты с симптомами или признаки ишемия миокарда должны подвергаться коронарной ангиографии или стресс-тестирования при необходимости. У больных с AF и признаки церебральной ишемии или инсульта компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга рекомендуется для обнаружения инсульта и выработки решений, касающихся неотложного и долгосрочного назначения антикоагулянтов. МРТ левого предсердия с контрастированием, с использованием гадолиния в качестве контраста, в режиме T1 визуализирует сердце, а внутрисердечной эхо может помочь в решении о лечении в AF, но требуют проверки в многоцентровых исследованиях.
8.4 Система контроля
 Большинство пациентов AF нужны регулярное наблюдение для обеспечения дальнейшего оптимального лечения. Последующая деятельность может осуществляться при первичной медицинской помощи, специально обученными медсестрами, кардиологами или AF специалистами. Специалист должен координировать помощь и последующие мероприятия. Последующая деятельность должна обеспечить осуществление плана лечения, продолжение участия пациента и адаптация терапии при необходимости.
AF = фибрилляция предсердий; ЭКГ = электрокардиограмму.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по диагностике в системе контроля пациентов с ФП
8.5 5 Определение целей рационального ведения пациентов с ФП
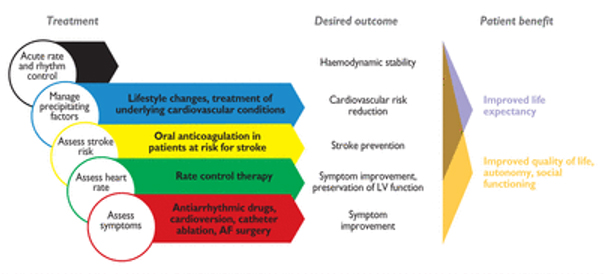
AF управление включает терапию с прогностическим воздействием (антикоагуляционную и лечение сердечно-сосудистых заболеваний) и терапию, главным образом обеспечивающую симптоматические эффекты (контроль ЧСС и ритма, Таблица 10). Суть терапия с прогностической пользой нужно тщательно объяснять пациентам, когда её преимущества и эффекты непосредственно не чувствуются. Ритм контроля терапии может быть успешным, если симптомы контролируются, даже когда AF повторяется. Объясняя ожидаемые выгоды каждому пациенту в начале управления AF будет предотвращать необоснованные ожидания и иметь потенциал для оптимизации качества жизни.
Таблица 10
Большинство пациентов AF нужны регулярное наблюдение для обеспечения дальнейшего оптимального лечения. Последующая деятельность может осуществляться при первичной медицинской помощи, специально обученными медсестрами, кардиологами или AF специалистами. Специалист должен координировать помощь и последующие мероприятия. Последующая деятельность должна обеспечить осуществление плана лечения, продолжение участия пациента и адаптация терапии при необходимости.
AF = фибрилляция предсердий; ЭКГ = электрокардиограмму.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по диагностике в системе контроля пациентов с ФП
8.5 5 Определение целей рационального ведения пациентов с ФП
AF управление включает терапию с прогностическим воздействием (антикоагуляционную и лечение сердечно-сосудистых заболеваний) и терапию, главным образом обеспечивающую симптоматические эффекты (контроль ЧСС и ритма, Таблица 10). Суть терапия с прогностической пользой нужно тщательно объяснять пациентам, когда её преимущества и эффекты непосредственно не чувствуются. Ритм контроля терапии может быть успешным, если симптомы контролируются, даже когда AF повторяется. Объясняя ожидаемые выгоды каждому пациенту в начале управления AF будет предотвращать необоснованные ожидания и иметь потенциал для оптимизации качества жизни.
Таблица 10
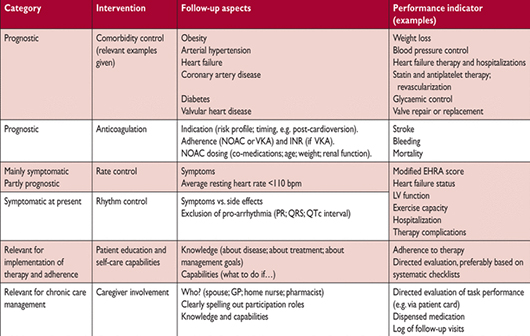 Последующая деятельность на основе целей управления ФП
BPM = ударов в минуту; Шкала симптомов mEHRA = изменение масштаба симптомов Европейской ассоциации ритма сердца; GP general practitioner– семейный врач; INR = международное нормализованное отношение; LV = левый желудочек; NOAC = антагонист витамина К орального антикоагулянта; VKA = антагонист витамина К.
Последующая деятельность на основе целей управления ФП
BPM = ударов в минуту; Шкала симптомов mEHRA = изменение масштаба симптомов Европейской ассоциации ритма сердца; GP general practitioner– семейный врач; INR = международное нормализованное отношение; LV = левый желудочек; NOAC = антагонист витамина К орального антикоагулянта; VKA = антагонист витамина К.
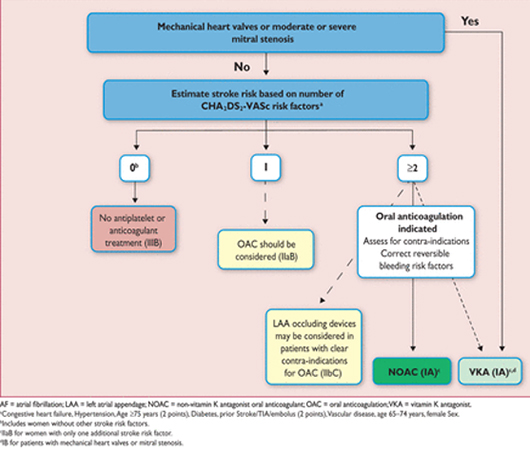 Профилактика инсульта при фибрилляции предсердий.
9.1 Прогнозирование инсульта и риск кровотечения
9.1.1 Оценка клинического риска инсульта и системной эмболии
Простые, клинически применимые схемы стратификации риска инсульта у AF пациентов были разработаны в конце 1990-х в небольших когортных исследованиях и позднее были уточнены и проверены в больших популяциях. Введение шкалы ЧА2DS2-VASc (Таблица 11) упростило первоначальное решение по ОАС у AF пациентов. С момента первого включения в руководящие принципы ESC в 2010 году, это широко используется. Мы рекомендуем оценить риск инсульта у пациентов AF, основанные на шкале ЧА2DS2-VASc. Как правило пациентам без клинических факторов риска инсульта не нужна антитромботическая терапия, в то время как пациенты с факторами риска инсульта (т. е. ЧА2DS2-VASc счёт 1 или больше для мужчин и 2 или больше для женщин), могут извлечь выгоду из ОАС.
Таблица 11
Профилактика инсульта при фибрилляции предсердий.
9.1 Прогнозирование инсульта и риск кровотечения
9.1.1 Оценка клинического риска инсульта и системной эмболии
Простые, клинически применимые схемы стратификации риска инсульта у AF пациентов были разработаны в конце 1990-х в небольших когортных исследованиях и позднее были уточнены и проверены в больших популяциях. Введение шкалы ЧА2DS2-VASc (Таблица 11) упростило первоначальное решение по ОАС у AF пациентов. С момента первого включения в руководящие принципы ESC в 2010 году, это широко используется. Мы рекомендуем оценить риск инсульта у пациентов AF, основанные на шкале ЧА2DS2-VASc. Как правило пациентам без клинических факторов риска инсульта не нужна антитромботическая терапия, в то время как пациенты с факторами риска инсульта (т. е. ЧА2DS2-VASc счёт 1 или больше для мужчин и 2 или больше для женщин), могут извлечь выгоду из ОАС.
Таблица 11
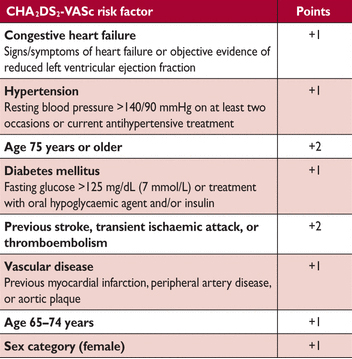 Клинические факторы риска инсульта, переходных ишемических атак и системных эмболий по шкале ЧА2DS2-VASc
ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (двойной счет), диабет, инсульт (двойной счет), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
Другие, менее установленные факторы риска инсульта включают нестабильное международное нормализованное отношение (INR) и низкое время в терапевтических диапазоне (TTR) пациентов, получающих VKAs; предыдущие предыдущие кровотечения или анемии; избыток алкоголя и других маркеров при снижении приверженности терапии; ХБП; повышенные тропонина как маркера высокой чувствительности; и повышенных N-концевого pro-B-тип натрийуретического пептида.
9.1.2 Антикоагуляция у больных с ЧА2DS2-VASc 1 балл у мужчин и 2 женщины
Есть веские доказательства того, что пациенты с шкалой оценки риска ЧА2DS2 – VASc 2 балла или более мужчин и 3 или более женщин, показаны ОАС. Показатели инсульта и тромбоэмболий значительно различаются у больных с ЧА2DS2- VASc 1 или 2 из-за различий в результатах, в связи с населением и антисвертывающим статусом. ОАС у мужчин с ЧА2DS2-VASc 1 баллом и женщин с 2 баллами, предотвращает инсульт, риск кровотечения и учитывает предпочтения пациента. Важно отметить, что возраст (65 лет и старше) связан со сравнительно высоким и постоянно растущим риском инсульта, что также потенцирует и другие факторы риска (например, сердечная недостаточность и секс). Таким образом индивидуальное взвешивание риска, а также предпочтения пациента, должны помочь в решение антикоагуляции пациентам с только один ЧА2DS2-VASc фактор риска, помимо женского пола. Женский секс не повышают риск инсульта в отсутствие других факторов риска инсульта.
Измерение сердечного тропонина (высокая чувствительность тропонина T или I) и N-концевого pro-B-тип натрийуретического пептида может предоставить дополнительную прогностическую информацию у отдельных пациентов AF. Оценки рисков на основе биомаркеров в будущем, может оказаться полезным для лучшего стратифицировать пациентов (например, по действительно низкому риску инсульта).
9.1.3 Оценка клинического риска кровотечения
Были разработаны несколько шкал оценки риска кровотечения, главным образом у пациентов на VKAs. Они включают в себя HAS–BLED [гипертоническая болезнь, нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним , лабильный МНО( INR), пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующе обстоятельства (1 балл каждый)], ORBIT (результаты реестра для лучшего проинформирования лечения фибрилляция предсердий) ( Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) и более поздние ABC (возраст, биомаркеры, анамнез)шкала кровотечения, который также использует выбранные биомаркеры. Факторы риска инсульта и кровотечения перекрываются (сравнить таблицы 11 и 12). Например, возраст является одним из наиболее важных предикторов как ишемических инсульта и кровотечения у пациентов AF. Высокая оценка риска кровотечения вообще не должна препятствовать проведению ОАС. Скорее следует выявить факторы риска кровотечения и по возможности медикаментозно скорректировать (см. главу 8.5). В таблице 12 приводится подробная информация о модифицируемых факторах риска кровотечения.
Таблица 12
Клинические факторы риска инсульта, переходных ишемических атак и системных эмболий по шкале ЧА2DS2-VASc
ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (двойной счет), диабет, инсульт (двойной счет), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
Другие, менее установленные факторы риска инсульта включают нестабильное международное нормализованное отношение (INR) и низкое время в терапевтических диапазоне (TTR) пациентов, получающих VKAs; предыдущие предыдущие кровотечения или анемии; избыток алкоголя и других маркеров при снижении приверженности терапии; ХБП; повышенные тропонина как маркера высокой чувствительности; и повышенных N-концевого pro-B-тип натрийуретического пептида.
9.1.2 Антикоагуляция у больных с ЧА2DS2-VASc 1 балл у мужчин и 2 женщины
Есть веские доказательства того, что пациенты с шкалой оценки риска ЧА2DS2 – VASc 2 балла или более мужчин и 3 или более женщин, показаны ОАС. Показатели инсульта и тромбоэмболий значительно различаются у больных с ЧА2DS2- VASc 1 или 2 из-за различий в результатах, в связи с населением и антисвертывающим статусом. ОАС у мужчин с ЧА2DS2-VASc 1 баллом и женщин с 2 баллами, предотвращает инсульт, риск кровотечения и учитывает предпочтения пациента. Важно отметить, что возраст (65 лет и старше) связан со сравнительно высоким и постоянно растущим риском инсульта, что также потенцирует и другие факторы риска (например, сердечная недостаточность и секс). Таким образом индивидуальное взвешивание риска, а также предпочтения пациента, должны помочь в решение антикоагуляции пациентам с только один ЧА2DS2-VASc фактор риска, помимо женского пола. Женский секс не повышают риск инсульта в отсутствие других факторов риска инсульта.
Измерение сердечного тропонина (высокая чувствительность тропонина T или I) и N-концевого pro-B-тип натрийуретического пептида может предоставить дополнительную прогностическую информацию у отдельных пациентов AF. Оценки рисков на основе биомаркеров в будущем, может оказаться полезным для лучшего стратифицировать пациентов (например, по действительно низкому риску инсульта).
9.1.3 Оценка клинического риска кровотечения
Были разработаны несколько шкал оценки риска кровотечения, главным образом у пациентов на VKAs. Они включают в себя HAS–BLED [гипертоническая болезнь, нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним , лабильный МНО( INR), пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующе обстоятельства (1 балл каждый)], ORBIT (результаты реестра для лучшего проинформирования лечения фибрилляция предсердий) ( Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) и более поздние ABC (возраст, биомаркеры, анамнез)шкала кровотечения, который также использует выбранные биомаркеры. Факторы риска инсульта и кровотечения перекрываются (сравнить таблицы 11 и 12). Например, возраст является одним из наиболее важных предикторов как ишемических инсульта и кровотечения у пациентов AF. Высокая оценка риска кровотечения вообще не должна препятствовать проведению ОАС. Скорее следует выявить факторы риска кровотечения и по возможности медикаментозно скорректировать (см. главу 8.5). В таблице 12 приводится подробная информация о модифицируемых факторах риска кровотечения.
Таблица 12
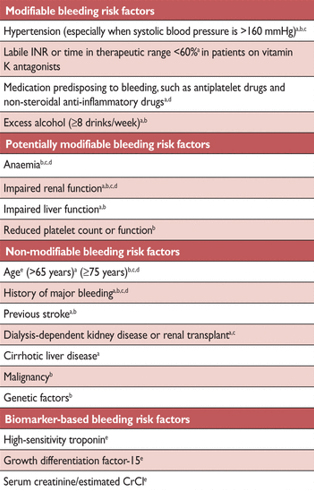 Модифицируемые и немодифицируемые факторы риска кровотечения при антикоагуляции пациентов на основе оценки риска кровотечения
ABC = возраст, биомаркеры, клинической истории; ATRIA = антикоагуляционную и факторы риска в фибрилляция предсердий; ХБП = хронические заболевания почек; CrCl = клиренса креатинина; HAS–BLED = гипертоническая болезнь , нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним, лабильной INR, пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующие обстоятельств (1 очко каждый); HEMORR2HAGES = печеночной или почечной болезни, злоупотребление этанолом, злокачественноые опухоли, старше (возраст > 75), снижение количества тромбоцитов или функции, rebleeding риск повторного кровотечения (предыдущее кровотечение; 2 балла), гипертония (неконтролируемая), анемия, генетические факторы (CYP 2 c 9 полиморфизмы), высокий риск падений (в том числе психоневрологические заболевания) и инсульта; INR = международное нормализованное отношение; ORBIT = результаты реестра для более осознанного лечения фибрилляции предсердий; TTR = время в терапевтических диапазоне; VKA = антагонист витамина К.
A Производный от HAS-БЛЕД оценка.
B Производные от HEMORR2HAGES оценка.
C Производные от ATRIA балла.
D Производные шкалы ORBIT
E Производные от ABC кровотечения шкалы оценка кровотечения.
Модифицируемые и немодифицируемые факторы риска кровотечения при антикоагуляции пациентов на основе оценки риска кровотечения
ABC = возраст, биомаркеры, клинической истории; ATRIA = антикоагуляционную и факторы риска в фибрилляция предсердий; ХБП = хронические заболевания почек; CrCl = клиренса креатинина; HAS–BLED = гипертоническая болезнь , нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним, лабильной INR, пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующие обстоятельств (1 очко каждый); HEMORR2HAGES = печеночной или почечной болезни, злоупотребление этанолом, злокачественноые опухоли, старше (возраст > 75), снижение количества тромбоцитов или функции, rebleeding риск повторного кровотечения (предыдущее кровотечение; 2 балла), гипертония (неконтролируемая), анемия, генетические факторы (CYP 2 c 9 полиморфизмы), высокий риск падений (в том числе психоневрологические заболевания) и инсульта; INR = международное нормализованное отношение; ORBIT = результаты реестра для более осознанного лечения фибрилляции предсердий; TTR = время в терапевтических диапазоне; VKA = антагонист витамина К.
A Производный от HAS-БЛЕД оценка.
B Производные от HEMORR2HAGES оценка.
C Производные от ATRIA балла.
D Производные шкалы ORBIT
E Производные от ABC кровотечения шкалы оценка кровотечения.
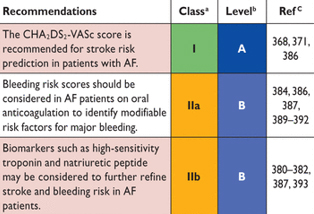 AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт или переходных ишемических атак или системной эмболии (два балла ), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для прогнозирования инсульта и риска кровотечения
AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт или переходных ишемических атак или системной эмболии (два балла ), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для прогнозирования инсульта и риска кровотечения
- У пациентов с подагрой заболеваемость ФП составила 4,61 % в сравнении с 3,04 % у пациентов без подагры (P <0,001).
- У пациентов с подагрой скорректированный риск ФП возрастает на 38 %.
- Риск уменьшается с возрастом; у молодых людей с подагрой скорректированное ОР для ФП составляло 1,62 (95 % ДИ: 1,52–1,82); скорректированное ОР у лиц пожилого возраста (≥ 65 лет) с подагрой составило 1,25.
- 63 264 страдающих подагрой; 63 264 без подагры, подобранных по возрасту/полу.
- Системное воспаление, связанное с подагрой, может быть связано с повышенным риском ФП.
- Руководящие принципы
- Фибрилляция предсердий
- Антикоагуляция
- Антагонисты витамина К
- Пероральные антикоагулянты НЕ ( Non )-антагонисты витамина K
- Контроль ЧСС
- Кардиоверсия
- Контроль ритма сердца
- Антиаритмические препараты
- Вверх по течению терапия ( Upstream therapy)-патогенетическая терапия
- Катетерная абляция
- Радио(низкочастотная) хирургия
- Пластика клапана
- Изоляция легочной вены
- Аблация левого предсердия
- Guidelines
- Atrial fibrillation
- Anticoagulation
- Vitamin K antagonists
- Non-vitamin K antagonist oral anticoagulants
- Left atrial appendage occlusion
- Rate control
- Cardioversion
- Rhythm control
- Antiarrhythmic drugs
- Upstream therapy
- Catheter ablation
- AF surgery
- Valve repair
- Pulmonary vein isolation
- Left atrial ablation
- Преамбула
 Таблица 2 Классы рекомендаций
Таблица 2 Классы рекомендаций
 Задача разработки ESC и EACTS руководство охватывает не только интеграцию самых последних исследований, но и создание учебных пособий и программ, популяризации идей рекомендаций. Для реализации руководящих принципов, предлагаются краткие карманные руководства, электронные версии, сводные слайды, буклеты с основными положениями, сводные карты для неспециалистов и электронная версия для цифровых приложений (например, смартфоны). Эти версии являются сокращениями, но, в случае необходимости, всегда имеется ссылка на полный текст, который находится в свободном доступе на веб-сайтеESC. Осуществления программ необходимы, поскольку было доказано, что тщательное применение клинических рекомендаций могут благоприятно повлиять исход заболевания.
Обследования и реестры необходимы для проверки в реальной жизни и повседневной практике того, что рекомендуется в руководящих принципах, тем самым завершая цикл между клиническими исследованиями, написанием руководящих принципов, их распространением и реализацией их в клиническую практику.
Специалистам в области здравоохранения рекомендуется принять ESC и EACTS руководящие принципы полностью, учитывать их при осуществлении их клинического суждения, а также в определении и осуществлении профилактических, диагностических или терапевтических медицинских стратегий. Однако ESC и EACTS руководящие принципы не ограничивают каким-либо образом индивидуальную ответственность медицинских работников за принятия соответствующих и точных решений с учетом состояния здоровья каждого пациента и в консультации с пациентом и социальным работником при необходимости.
Задача разработки ESC и EACTS руководство охватывает не только интеграцию самых последних исследований, но и создание учебных пособий и программ, популяризации идей рекомендаций. Для реализации руководящих принципов, предлагаются краткие карманные руководства, электронные версии, сводные слайды, буклеты с основными положениями, сводные карты для неспециалистов и электронная версия для цифровых приложений (например, смартфоны). Эти версии являются сокращениями, но, в случае необходимости, всегда имеется ссылка на полный текст, который находится в свободном доступе на веб-сайтеESC. Осуществления программ необходимы, поскольку было доказано, что тщательное применение клинических рекомендаций могут благоприятно повлиять исход заболевания.
Обследования и реестры необходимы для проверки в реальной жизни и повседневной практике того, что рекомендуется в руководящих принципах, тем самым завершая цикл между клиническими исследованиями, написанием руководящих принципов, их распространением и реализацией их в клиническую практику.
Специалистам в области здравоохранения рекомендуется принять ESC и EACTS руководящие принципы полностью, учитывать их при осуществлении их клинического суждения, а также в определении и осуществлении профилактических, диагностических или терапевтических медицинских стратегий. Однако ESC и EACTS руководящие принципы не ограничивают каким-либо образом индивидуальную ответственность медицинских работников за принятия соответствующих и точных решений с учетом состояния здоровья каждого пациента и в консультации с пациентом и социальным работником при необходимости.
- Введение
- эпидемиология и последствия для пациентов
 Сердечно-сосудистая заболеваемость и смертность, связанная с мерцательной аритмией
Сердечно-сосудистая заболеваемость и смертность, связанная с мерцательной аритмией
- AF = фибрилляция предсердий; LV = левый желудочек.
 Рисунок 1
Хронология результатов изучения ФП, включает лечение сопутствующих заболеваний, профилактику (зеленый), антикоагуляционную терапию (синий), контроль частоты сердечных сокращений (оранжевый), контроль ритма (красный) и хирургическое лечение фибрилляции предсердий (фиолетовый).
В современных, хорошо контролируемых рандомизированных клинических исследованиях средний годовой темп прироста случаев ФП составляет около 1,5%, а показатель смертности составляет около 3% при проведении антикоагулянной терапии пациентам с AF. В реальной жизни, показатели годовой смертности могут быть разными (как выше, так и ниже). Меньшинство этих смертей связаны инсульта, в то время как внезапная сердечная смерть и смерть от прогрессивного сердечной недостаточности являются более частыми, подчеркивает необходимость дополнительных вмешательств кроме антикоагуляции. Кроме того, AF связана также с высокими показателями госпитализации, обычно для лечения AF, но часто также сердечной недостаточности, инфарктов миокарда и лечения связанных осложнений.
3.4 Пол
Как в развитых, так и в развивающихся стран, скорректированные по возрасту заболеваемость и распространенность AF ниже у женщин, в то время как риск смерти у женщин с AF аналогичный или выше, чем у мужчин с AF. Женщины с AF, которые имеют дополнительные факторы риска инсульта (особенно в пожилом возрасте), также подвергаются большему риску инсульта, чем мужчины, даже те, кто получает антикоагулянт варфарин (см. главу 9 для деталей). Женщины с диагнозом AF имеют больше симптомов, чем мужчины и как правило они старше, и имеют больше сопутствующих заболеваний. Риск антикоагуляционных кровотечений одинаков у обоих полов. Однако женщины реже получают консультации специалисов социального ухода и терапию контроля ритма, хотя результаты катетерной абляции AF хирургии сопоставимы у мужчин. Эти наблюдения свидетельствуют о необходимости предложить эффективные средства диагностики и терапевтических подходы одинаково для мужчин и женщин.
Рисунок 1
Хронология результатов изучения ФП, включает лечение сопутствующих заболеваний, профилактику (зеленый), антикоагуляционную терапию (синий), контроль частоты сердечных сокращений (оранжевый), контроль ритма (красный) и хирургическое лечение фибрилляции предсердий (фиолетовый).
В современных, хорошо контролируемых рандомизированных клинических исследованиях средний годовой темп прироста случаев ФП составляет около 1,5%, а показатель смертности составляет около 3% при проведении антикоагулянной терапии пациентам с AF. В реальной жизни, показатели годовой смертности могут быть разными (как выше, так и ниже). Меньшинство этих смертей связаны инсульта, в то время как внезапная сердечная смерть и смерть от прогрессивного сердечной недостаточности являются более частыми, подчеркивает необходимость дополнительных вмешательств кроме антикоагуляции. Кроме того, AF связана также с высокими показателями госпитализации, обычно для лечения AF, но часто также сердечной недостаточности, инфарктов миокарда и лечения связанных осложнений.
3.4 Пол
Как в развитых, так и в развивающихся стран, скорректированные по возрасту заболеваемость и распространенность AF ниже у женщин, в то время как риск смерти у женщин с AF аналогичный или выше, чем у мужчин с AF. Женщины с AF, которые имеют дополнительные факторы риска инсульта (особенно в пожилом возрасте), также подвергаются большему риску инсульта, чем мужчины, даже те, кто получает антикоагулянт варфарин (см. главу 9 для деталей). Женщины с диагнозом AF имеют больше симптомов, чем мужчины и как правило они старше, и имеют больше сопутствующих заболеваний. Риск антикоагуляционных кровотечений одинаков у обоих полов. Однако женщины реже получают консультации специалисов социального ухода и терапию контроля ритма, хотя результаты катетерной абляции AF хирургии сопоставимы у мужчин. Эти наблюдения свидетельствуют о необходимости предложить эффективные средства диагностики и терапевтических подходы одинаково для мужчин и женщин.
 AF = фибрилляция предсердий.
aКласс рекомендации.
bУровень доказательства.
cАртикул(ы), поддерживая рекомендации.
Рекомендации, касающиеся гендерных факторов
AF = фибрилляция предсердий.
aКласс рекомендации.
bУровень доказательства.
cАртикул(ы), поддерживая рекомендации.
Рекомендации, касающиеся гендерных факторов
- Патофизиологические и генетические аспекты при создании рекомендаций
 Патофизиологические изменения в предсердной ткани, связанные с мерцательной аритмией и клинических условиях, которые могли бы способствовать таким изменениям
Патофизиологические изменения в предсердной ткани, связанные с мерцательной аритмией и клинических условиях, которые могли бы способствовать таким изменениям
- AF = фибрилляция предсердий; CAD = заболевание коронарной артерии.
 Рисунок 2 Основные механизмы, вызывающие фибрилляцию предсердий, которые можно учитывать при выборе терапии.
Различные этиологические факторы (слева) вызывают сложный массив патофизиологических изменений в предсердия, включая индуцированной фибрилляцией фиброз за счет перерастяжения, гипокинезию, жировую инфильтрацию, воспаление, реваскуляризация, ишемия, дисфункцию ионного канала и Ca2 +-нестабильность. Эти изменения повышают эктопию и расстройства проводимости, увеличивая чувствительность предсердия к возникновению или поддержанию AF. В то же время некоторые из этих изменений участвуют в возникновении гиперкоагуляции, состоянию связанным с AF. Например гипокинезия уменьшает местное эндотелиальное напряжение поперечно-полосатой мускулатуры, что увеличивает выработку PAI-1, а ишемически- индуцированное воспаление, усиливает экспрессию молекул эндотелиальной адгезии или способствует пролиферации эндотелиальных клеток, в результате чего тканевой фактор воздействует на поток крови. Эти изменения способствуют тромбогенности внутри предсердия пациентов AF. AF само по себе может усугубить многие указанные механизмы, что может объяснить прогрессивный характер аритмии.
Функциональные и структурные изменения в предсердии миокарда и stasis крови, особенно в ушке левого предсердия ( LAA), предрасполагают к образованию тромбов е. Кроме того даже короткие эпизоды AF приводят к повреждению миокарда и влиянию протромботических факторов на поверхность предсердного эндотелия наряду с активацией тромбоцитов и воспалительных клеток и способствует повышенному протромботическому статусу. Предсердная и системная активация свертывающей системы может частично объяснить, почему короткие эпизоды AF имеют долгосрочный риск инсульта.
4.2.2 Электрофизиологических механизмы фибрилляции предсердий
AF вызывает сокращение рефрактерный периода предсердий и продолжительность цикла укорочения AF в первые дни аритмии, главным образом из-за резкого уменьшения downregulation потоков Ca2 +-внутрь и upregulation внутрь потоков K+. Структурные болезни сердца, в отличие от этого, как правило, продлевают рефрактерный период ФП, иллюстрирующие неоднородный характер механизмов, которые вызывают AF у разных пациентов. Гиперфосфолирирование различных Са 2 +– белков может способствовать спонтанному выходу Ca2 + и повышает триггерную активность, таким образом, вызывая эктопию и развитию AF. Хотя концепция Ca2 + нестабильности была оспорена в последнее время, это может способствовать развитию AF в структурно реконструированном предсердии и объяснить, как измененная вегетативная система может спровоцировать AF.
4.2.2.1 Локальный очаг возбуждения и поддержание фибрилляции предсердий
Локальный очаг возбуждения в легочные вены может вызвать AF, а удаление этого источника может подавить рецидивирующую AF. Механизм локальной активности может включать триггерную активность и механизм re–entry. Иерархическая организация AF с быстрым активированием области водителя аритмии были задокументированы в больных с пароксизмальной AF, но это менее очевидно у пациентов с стойкой AF.
4.2.2.2 Гипотезы множественных волн низкой амплитуды и кругового возбуждения как источников мерцательной аритмии
Предположено, что AF может сохраняться при непрерывном проведении нескольких независимых волн низкой амплитуды, распространяющихся через мышцы предсердия хаотичным образом. До тех пор, пока количество волн не превышает нижнего критического уровня, они будут способны поддерживать аритмию. Несколько гипотез представлены источником 115 «The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. JThorac Cardiovasc Surg 1991;101:406–426. Все локализованные очаги AF (эктопические очаги, «роторы» и re–entry) вызывающие ФП трудно выделить среди множества фибрилляций, или через данный феномен любое из этих явлений может генерировать «роторы» внутри сердечной мышцы, которые можно зарегистрировать на поверхности тела.
Рисунок 2 Основные механизмы, вызывающие фибрилляцию предсердий, которые можно учитывать при выборе терапии.
Различные этиологические факторы (слева) вызывают сложный массив патофизиологических изменений в предсердия, включая индуцированной фибрилляцией фиброз за счет перерастяжения, гипокинезию, жировую инфильтрацию, воспаление, реваскуляризация, ишемия, дисфункцию ионного канала и Ca2 +-нестабильность. Эти изменения повышают эктопию и расстройства проводимости, увеличивая чувствительность предсердия к возникновению или поддержанию AF. В то же время некоторые из этих изменений участвуют в возникновении гиперкоагуляции, состоянию связанным с AF. Например гипокинезия уменьшает местное эндотелиальное напряжение поперечно-полосатой мускулатуры, что увеличивает выработку PAI-1, а ишемически- индуцированное воспаление, усиливает экспрессию молекул эндотелиальной адгезии или способствует пролиферации эндотелиальных клеток, в результате чего тканевой фактор воздействует на поток крови. Эти изменения способствуют тромбогенности внутри предсердия пациентов AF. AF само по себе может усугубить многие указанные механизмы, что может объяснить прогрессивный характер аритмии.
Функциональные и структурные изменения в предсердии миокарда и stasis крови, особенно в ушке левого предсердия ( LAA), предрасполагают к образованию тромбов е. Кроме того даже короткие эпизоды AF приводят к повреждению миокарда и влиянию протромботических факторов на поверхность предсердного эндотелия наряду с активацией тромбоцитов и воспалительных клеток и способствует повышенному протромботическому статусу. Предсердная и системная активация свертывающей системы может частично объяснить, почему короткие эпизоды AF имеют долгосрочный риск инсульта.
4.2.2 Электрофизиологических механизмы фибрилляции предсердий
AF вызывает сокращение рефрактерный периода предсердий и продолжительность цикла укорочения AF в первые дни аритмии, главным образом из-за резкого уменьшения downregulation потоков Ca2 +-внутрь и upregulation внутрь потоков K+. Структурные болезни сердца, в отличие от этого, как правило, продлевают рефрактерный период ФП, иллюстрирующие неоднородный характер механизмов, которые вызывают AF у разных пациентов. Гиперфосфолирирование различных Са 2 +– белков может способствовать спонтанному выходу Ca2 + и повышает триггерную активность, таким образом, вызывая эктопию и развитию AF. Хотя концепция Ca2 + нестабильности была оспорена в последнее время, это может способствовать развитию AF в структурно реконструированном предсердии и объяснить, как измененная вегетативная система может спровоцировать AF.
4.2.2.1 Локальный очаг возбуждения и поддержание фибрилляции предсердий
Локальный очаг возбуждения в легочные вены может вызвать AF, а удаление этого источника может подавить рецидивирующую AF. Механизм локальной активности может включать триггерную активность и механизм re–entry. Иерархическая организация AF с быстрым активированием области водителя аритмии были задокументированы в больных с пароксизмальной AF, но это менее очевидно у пациентов с стойкой AF.
4.2.2.2 Гипотезы множественных волн низкой амплитуды и кругового возбуждения как источников мерцательной аритмии
Предположено, что AF может сохраняться при непрерывном проведении нескольких независимых волн низкой амплитуды, распространяющихся через мышцы предсердия хаотичным образом. До тех пор, пока количество волн не превышает нижнего критического уровня, они будут способны поддерживать аритмию. Несколько гипотез представлены источником 115 «The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. JThorac Cardiovasc Surg 1991;101:406–426. Все локализованные очаги AF (эктопические очаги, «роторы» и re–entry) вызывающие ФП трудно выделить среди множества фибрилляций, или через данный феномен любое из этих явлений может генерировать «роторы» внутри сердечной мышцы, которые можно зарегистрировать на поверхности тела.
- Диагностика и своевременное выявление фибрилляции предсердий
 Рисунок 3
Тактика при AHRE, обнаруженных с помощью имплантированных устройств.
5.2.4 Обнаружение фибрилляции предсердий у перенесших инсульт
Целевой мониторинг ЭКГ обнаружил AF в 24% (95% ДИ 17-31) выживших после инсульта, и в 11,5% (95% ДИ 8,9% – 14,3%) в другом исследовании, с большими вариациями в зависимости от сроков, продолжительности и метод мониторинга. Обнаружение AF не является редкостью в общей, невыбранной популяции больных (6,2%, 95% ДИ 4.4 – 8,3), но чаще всего, у больных с криптогенным инсультом с имплантированными с рекордерами или при мониторировании ЭКГ в течение нескольких недель. Cryptogenic(криптогенный) инсульт определяется как инсульт, в котором причины не могут быть определены после тщательного обследования. Более широкое определение имеет Эмболический инсульт без неопределенного источника. Несколько исследований нашлиAF у пациентов, в которых был другая конкурирующая причина инсульта (например, АГ или стеноз сонной артерии). Таким образом длительный мониторинг ЭКГ представляется разумным у всех выживших после ишемических инсульта без установленного диагноза AF.
Рисунок 3
Тактика при AHRE, обнаруженных с помощью имплантированных устройств.
5.2.4 Обнаружение фибрилляции предсердий у перенесших инсульт
Целевой мониторинг ЭКГ обнаружил AF в 24% (95% ДИ 17-31) выживших после инсульта, и в 11,5% (95% ДИ 8,9% – 14,3%) в другом исследовании, с большими вариациями в зависимости от сроков, продолжительности и метод мониторинга. Обнаружение AF не является редкостью в общей, невыбранной популяции больных (6,2%, 95% ДИ 4.4 – 8,3), но чаще всего, у больных с криптогенным инсультом с имплантированными с рекордерами или при мониторировании ЭКГ в течение нескольких недель. Cryptogenic(криптогенный) инсульт определяется как инсульт, в котором причины не могут быть определены после тщательного обследования. Более широкое определение имеет Эмболический инсульт без неопределенного источника. Несколько исследований нашлиAF у пациентов, в которых был другая конкурирующая причина инсульта (например, АГ или стеноз сонной артерии). Таким образом длительный мониторинг ЭКГ представляется разумным у всех выживших после ишемических инсульта без установленного диагноза AF.
 AF = фибрилляция предсердий; AHRE = эпизоды предсердной тахикардии; ЭКГ = Электрокардиограмма; ICD = Вживляемый кардиовертер-дефибриллятор; TIA = транзиторная ишемическая атака .
Рекомендации для скрининга фибрилляции предсердий
5.3 Электрокардиографическое обнаружение трепетания предсердий
Правопредсердные трепетания предсердий имеют типичную ЭКГ картину и ЧСС. Распространенность трепетания предсердий составляет менее одной десятой распространенности AF. Трепетание предсердий часто сосуществует с или предшествует AF. В типичных случаях P волны имеют вид «пила зуб», особенно в нижних отведениях ( II, III, aVF). ЧСС может быть переменной (обычное отношение сокращений предсердий к желудочкам 4:1 до 1:2, в редких случаях 1:1) и при макро macro–re–entrant тахикардии проведение импульсов 2:1. Вагусная стимуляция или внутривенное введение аденозина, может «оборвать» трепетания предсердий. В главе 13.7 рассматривается лечебная тактика при трепетания предсердий. Лево- или правопредсердная macro-re–entrant тахикардия главным образом встречается у пациентов после катетерной абляцией при AF, AF хирургии, или после операции на открытом сердце.
AF = фибрилляция предсердий; AHRE = эпизоды предсердной тахикардии; ЭКГ = Электрокардиограмма; ICD = Вживляемый кардиовертер-дефибриллятор; TIA = транзиторная ишемическая атака .
Рекомендации для скрининга фибрилляции предсердий
5.3 Электрокардиографическое обнаружение трепетания предсердий
Правопредсердные трепетания предсердий имеют типичную ЭКГ картину и ЧСС. Распространенность трепетания предсердий составляет менее одной десятой распространенности AF. Трепетание предсердий часто сосуществует с или предшествует AF. В типичных случаях P волны имеют вид «пила зуб», особенно в нижних отведениях ( II, III, aVF). ЧСС может быть переменной (обычное отношение сокращений предсердий к желудочкам 4:1 до 1:2, в редких случаях 1:1) и при макро macro–re–entrant тахикардии проведение импульсов 2:1. Вагусная стимуляция или внутривенное введение аденозина, может «оборвать» трепетания предсердий. В главе 13.7 рассматривается лечебная тактика при трепетания предсердий. Лево- или правопредсердная macro-re–entrant тахикардия главным образом встречается у пациентов после катетерной абляцией при AF, AF хирургии, или после операции на открытом сердце.
- Классификация фибрилляции предсердий
 Критерии фибрилляции предсердий
AF = фибрилляция предсердий.
Различия между пароксизмальной и персистирующей AF часто проводится без проведения долгосрочного мониторинга. Таким образом эта классификация недостаточна для выбора конкретных методов лечения. Если присутствуют как постоянные, так и пароксизмальная эпизоды, следует руководствоваться критериями классификации.
Предполагается что AF может влиять на риск инсульта и результаты антиаритмической терапии. Но доказательства этого являются слабыми. Таким образом AF не должно быть основным фактором в принятии решения о целесообразности лечебного вмешательства, которое должно опираться на другие факторы.
6.2 Типы фибрилляции, отражающие различные причины аритмии
Риск развития AF увеличивается при различных физиологических и болезненных состояний (рис. 2) и исторический термин «изолированная AF» вероятно вводит в заблуждение и его следует избегать. Хотя модель AF может быть такой же, механизмы, лежащие в основе AF существенно, различаются между пациентами (Таблица 6). Это говорит о том, что нужно стратифицировать пациентов с AF подчеркивая движущие причины (драйверы) AF разделяя болезни сердца и системные сопутствующие заболевания (например, диабет и ожирение), факторы образа жизни (например, уровень активности, курение, употребление алкоголя), маркеры сердечного ремоделирования (например, фиброз или составляющие электрокардиографические параметры AF), или генетический фон. В таблице 6 приводится подобная систематика, составленная консенсусом экспертов, но без очевидных доказательств, для того чтобы подвести фундамент использования в клинической практике. Систематические исследования, определение основных драйверов AF явно Для более четко разделения различных типов AF необходимы клинические исследования для определения главных движущих сил возникновения ФП.
Таблица 6
Критерии фибрилляции предсердий
AF = фибрилляция предсердий.
Различия между пароксизмальной и персистирующей AF часто проводится без проведения долгосрочного мониторинга. Таким образом эта классификация недостаточна для выбора конкретных методов лечения. Если присутствуют как постоянные, так и пароксизмальная эпизоды, следует руководствоваться критериями классификации.
Предполагается что AF может влиять на риск инсульта и результаты антиаритмической терапии. Но доказательства этого являются слабыми. Таким образом AF не должно быть основным фактором в принятии решения о целесообразности лечебного вмешательства, которое должно опираться на другие факторы.
6.2 Типы фибрилляции, отражающие различные причины аритмии
Риск развития AF увеличивается при различных физиологических и болезненных состояний (рис. 2) и исторический термин «изолированная AF» вероятно вводит в заблуждение и его следует избегать. Хотя модель AF может быть такой же, механизмы, лежащие в основе AF существенно, различаются между пациентами (Таблица 6). Это говорит о том, что нужно стратифицировать пациентов с AF подчеркивая движущие причины (драйверы) AF разделяя болезни сердца и системные сопутствующие заболевания (например, диабет и ожирение), факторы образа жизни (например, уровень активности, курение, употребление алкоголя), маркеры сердечного ремоделирования (например, фиброз или составляющие электрокардиографические параметры AF), или генетический фон. В таблице 6 приводится подобная систематика, составленная консенсусом экспертов, но без очевидных доказательств, для того чтобы подвести фундамент использования в клинической практике. Систематические исследования, определение основных драйверов AF явно Для более четко разделения различных типов AF необходимы клинические исследования для определения главных движущих сил возникновения ФП.
Таблица 6
 Клинические виды фибрилляции предсердий
AF = фибрилляция предсердий; LV = левого желудочка; ГЛЖ = левого желудочка гипертрофия. Признается, что эти типы AF будут пересекаться в клинической практике, и что их значение для контроля необходимо систематически оценивать.
6.3 Угрожающие симптомы при предсердной фибрилляции
У пациентов с AF качество жизни значительно беднее, чем у здоровых из-за различных симптомов , включая летаргия, сердцебиение, одышка, чувство стеснения в груди, нарушение сна и психосоциального стресса. Фармакологическая и интервенционная терапия улучшает качество жизни. Однако данных по сравнению преимуществ различных методов лечения мало. Оценка качества жизни также сдерживается отсутствием перекрестной проверки различных шкал, по оценке качества жизни. Что касается оценки симптомов EHRA, предложена шкала EHRA симптомов (Таблица 7), чтобы разделить тяжесть симптомов у пациентов AF. EHRA шкала используется и проверена в Канаде. В 2014 году шкала модифицирована, с подразделением класса 2 EHRA на мягкую (2a) и умеренную (2b.). Симптомы в классе 2b («тревожные» симптомы) позволяют выделить пациентов с положительной динамикой здоровья при контроле ритма. Это изменение может предоставить информацию для потенциального решения о лечении, но ожидает независимой проверки. Хотя некоторые AF пациенты не имели или имели минимальные симптомы (25-40%), многие (15 – 30 процентов) сообщают о тяжелых или выводящих из строя симптомах. Модифицированную шкалу EHRA следует использовать для симптом- ориентированного лечения и для лонгитюдного исследования пациентов.
Таблица 7
Клинические виды фибрилляции предсердий
AF = фибрилляция предсердий; LV = левого желудочка; ГЛЖ = левого желудочка гипертрофия. Признается, что эти типы AF будут пересекаться в клинической практике, и что их значение для контроля необходимо систематически оценивать.
6.3 Угрожающие симптомы при предсердной фибрилляции
У пациентов с AF качество жизни значительно беднее, чем у здоровых из-за различных симптомов , включая летаргия, сердцебиение, одышка, чувство стеснения в груди, нарушение сна и психосоциального стресса. Фармакологическая и интервенционная терапия улучшает качество жизни. Однако данных по сравнению преимуществ различных методов лечения мало. Оценка качества жизни также сдерживается отсутствием перекрестной проверки различных шкал, по оценке качества жизни. Что касается оценки симптомов EHRA, предложена шкала EHRA симптомов (Таблица 7), чтобы разделить тяжесть симптомов у пациентов AF. EHRA шкала используется и проверена в Канаде. В 2014 году шкала модифицирована, с подразделением класса 2 EHRA на мягкую (2a) и умеренную (2b.). Симптомы в классе 2b («тревожные» симптомы) позволяют выделить пациентов с положительной динамикой здоровья при контроле ритма. Это изменение может предоставить информацию для потенциального решения о лечении, но ожидает независимой проверки. Хотя некоторые AF пациенты не имели или имели минимальные симптомы (25-40%), многие (15 – 30 процентов) сообщают о тяжелых или выводящих из строя симптомах. Модифицированную шкалу EHRA следует использовать для симптом- ориентированного лечения и для лонгитюдного исследования пациентов.
Таблица 7
 Модифицированная шкала симптомов Европейской ассоциации ритма сердца ( modified from Wynn et al.199)
AF = фибрилляция предсердий; EHRA = Ассоциация Европейского сердечного ритма.
EHRA класс 2a и 2b можно различать, оценивая имеют ли пациенты функциональные нарушения при симптомах AF. Наиболее частыми симптомами , связанными с AF являются слабость/ усталость и затрудненное дыхание, или менее частое сердцебиение и боль в груди.
Модифицированная шкала симптомов Европейской ассоциации ритма сердца ( modified from Wynn et al.199)
AF = фибрилляция предсердий; EHRA = Ассоциация Европейского сердечного ритма.
EHRA класс 2a и 2b можно различать, оценивая имеют ли пациенты функциональные нарушения при симптомах AF. Наиболее частыми симптомами , связанными с AF являются слабость/ усталость и затрудненное дыхание, или менее частое сердцебиение и боль в груди.
 Рекомендация об использовании модифицированной шкалы симптомов Европейской ассоциации ритма сердца
Рекомендация об использовании модифицированной шкалы симптомов Европейской ассоциации ритма сердца
- Обнаружение и контроль факторов риска и сопутствующих сердечно-сосудистых заболеваний
 Сердечно-сосудистые и другие условия, самостоятельно связанные с мерцательной аритмией
AF = фибрилляция предсердий; ИМТ = индекс массы тела; CI = доверительный интервал; ОФВ1 = принудительного выдоха объем в 1 секунду; HR = соотношение риска; ИЛИ = отношение шансов; RR = коэффициент риска.
7.1 Сердечная недостаточность
Сердечная недостаточность и AF сочетаются у многих пациентов. Они связаны с аналогичными факторами риска и практически общей патофизиологией. Сердечная недостаточность и AF может вызвать и усиливать друг друга через такие механизмы, как структурная перестройка сердца, активация нейрогормональних механизмов, связанных с скорость нарушения функции левого желудочка (LV). Пациенты с AF и сопутствующей сердечной недостаточности, как с сохранившимися фракцией выброса [LV фракция выброса (ФВЛЖ) ≥50%] и снижением Фракции выброса (ФВЛЖ < 40%),имеют худший прогноз, включая увеличение смертности. Недавно руководством ESC по сердечной недостаточности также введена новая категория сердечной недостаточности с средней фракции выброса (HFmrEF; ФВЛЖ 40 – 49 процентов), хотя данные о пациентах AF в этой группе ограничены. Предотвращение неблагоприятных исходов и поддержание хорошего качества жизни являются целями наблюдения, у всех пациентов с AF и сопутствующей сердечной недостаточности, независимо от ФВЛЖ. Общий подход к терапии AF не отличается между пациентами сердечной недостаточности и другими, но имеет некоторые отличия. На заметку, единственная терапия с проверенным прогностическое значением у этих пациентов антикоагуляция, всем пациентам с риском инсульта должны быть назначены оральные антикоагулянты (см. главу 9).
7.1.1 Пациенты с мерцательной аритмией и сердечной недостаточностью со сниженной фракцией выброса
В дополнение к ОАС, стандартную терапию сердечной недостаточности следует использовать у пациентов с СН с сниженной фракцией выброса (HFrEF), как указано в руководящих принципах ESC. Это включает ингибиторы ангиотензин превращающего фермента (ACE) или блокаторы рецепторов ангиотензина (ARBs), антагонисты альдостерона, дефибрилляторы, сердечная ресинхронизирующая терапия, и комбинированные ингибиторы ангиотензиновых рецепторов neprilysin (ARNI) для пациентов, которые переносят ингибиторы АПФ или БРА с сохраняющимися симптомами.
Контроль ЧСС AF подробно рассматривается в главе 10. Короче говоря только бета-блокаторы и дигоксин целесообразны в HFrEF из-за отрицательных инотропных эффектов верапамила и Дилтиазема . Бета-блокаторы, как правило, препарат первой линии у больных с клинически стабильным HFrEF, хотя мета анализ с использованием индивидуальных данных пациента из рандомизированных контролируемых испытаний (РКИ) обнаружили не снижение показателей смертности от бета-блокаторов против плацебо в тех с AF на базовом (HR 0,97, 95% ДИ 0,83 – 1.14). Дигоксин обычно назначают в клинической практике, но сравнений в РКИ у пациентов с AF не проводилось. В мета анализе обсервационных исследований, дигоксин имеет нейтральный эффект на смертность у больных с AF и сопутствующей сердечной недостаточностью (скорректированы обсервационные исследования HR 0,90, 95% ДИ 0,70 – 1,16; соответствует склонность обсервационных исследований ОР 1,08, 95% ДИ 0,93 – 1,26). Таким образом в начальной и комбированной терапии по контролю ЧСС при AF с HFrEF следует учитывать индивидуальные особенности пациента и симптомы; назначение бета-блокаторов должно быть отложено, у больных с острой декомпенсацией сердечной недостаточности, а дигоксин может накапливаться и спровоцировать неблагоприятные эффекты у больных с нарушениями функции почек (см. главу 10).
Пациенты с AF и HFrEF, с выраженными симптомами может потребоваться не только терапия контроля ЧСС, но и терапия ритма сердца. Для пациентов, у которых HFrEF развивается в результате тахисистолии AF (tachycardiomyopathy) стратегия контроля ритма является предпочтительной , по данным нескольких относительно небольших когорт пациентов , где в исследованиях отмечалось улучшение LV функции ЛЖ после восстановления синусового ритма. Диагноз tachycardiomyopathy наблюдения, а иногда требует восстановления синусового ритма. Катетерная абляция может быть полезным методом для восстановления функции LV и качества жизни пациентов AF с HFrEF, но необходимы дополнительные данные. На рисунке 4приведена сводные данные по тактике ведения пациентов с AF и сердечной недостаточностью.
Рисунок 4
Сердечно-сосудистые и другие условия, самостоятельно связанные с мерцательной аритмией
AF = фибрилляция предсердий; ИМТ = индекс массы тела; CI = доверительный интервал; ОФВ1 = принудительного выдоха объем в 1 секунду; HR = соотношение риска; ИЛИ = отношение шансов; RR = коэффициент риска.
7.1 Сердечная недостаточность
Сердечная недостаточность и AF сочетаются у многих пациентов. Они связаны с аналогичными факторами риска и практически общей патофизиологией. Сердечная недостаточность и AF может вызвать и усиливать друг друга через такие механизмы, как структурная перестройка сердца, активация нейрогормональних механизмов, связанных с скорость нарушения функции левого желудочка (LV). Пациенты с AF и сопутствующей сердечной недостаточности, как с сохранившимися фракцией выброса [LV фракция выброса (ФВЛЖ) ≥50%] и снижением Фракции выброса (ФВЛЖ < 40%),имеют худший прогноз, включая увеличение смертности. Недавно руководством ESC по сердечной недостаточности также введена новая категория сердечной недостаточности с средней фракции выброса (HFmrEF; ФВЛЖ 40 – 49 процентов), хотя данные о пациентах AF в этой группе ограничены. Предотвращение неблагоприятных исходов и поддержание хорошего качества жизни являются целями наблюдения, у всех пациентов с AF и сопутствующей сердечной недостаточности, независимо от ФВЛЖ. Общий подход к терапии AF не отличается между пациентами сердечной недостаточности и другими, но имеет некоторые отличия. На заметку, единственная терапия с проверенным прогностическое значением у этих пациентов антикоагуляция, всем пациентам с риском инсульта должны быть назначены оральные антикоагулянты (см. главу 9).
7.1.1 Пациенты с мерцательной аритмией и сердечной недостаточностью со сниженной фракцией выброса
В дополнение к ОАС, стандартную терапию сердечной недостаточности следует использовать у пациентов с СН с сниженной фракцией выброса (HFrEF), как указано в руководящих принципах ESC. Это включает ингибиторы ангиотензин превращающего фермента (ACE) или блокаторы рецепторов ангиотензина (ARBs), антагонисты альдостерона, дефибрилляторы, сердечная ресинхронизирующая терапия, и комбинированные ингибиторы ангиотензиновых рецепторов neprilysin (ARNI) для пациентов, которые переносят ингибиторы АПФ или БРА с сохраняющимися симптомами.
Контроль ЧСС AF подробно рассматривается в главе 10. Короче говоря только бета-блокаторы и дигоксин целесообразны в HFrEF из-за отрицательных инотропных эффектов верапамила и Дилтиазема . Бета-блокаторы, как правило, препарат первой линии у больных с клинически стабильным HFrEF, хотя мета анализ с использованием индивидуальных данных пациента из рандомизированных контролируемых испытаний (РКИ) обнаружили не снижение показателей смертности от бета-блокаторов против плацебо в тех с AF на базовом (HR 0,97, 95% ДИ 0,83 – 1.14). Дигоксин обычно назначают в клинической практике, но сравнений в РКИ у пациентов с AF не проводилось. В мета анализе обсервационных исследований, дигоксин имеет нейтральный эффект на смертность у больных с AF и сопутствующей сердечной недостаточностью (скорректированы обсервационные исследования HR 0,90, 95% ДИ 0,70 – 1,16; соответствует склонность обсервационных исследований ОР 1,08, 95% ДИ 0,93 – 1,26). Таким образом в начальной и комбированной терапии по контролю ЧСС при AF с HFrEF следует учитывать индивидуальные особенности пациента и симптомы; назначение бета-блокаторов должно быть отложено, у больных с острой декомпенсацией сердечной недостаточности, а дигоксин может накапливаться и спровоцировать неблагоприятные эффекты у больных с нарушениями функции почек (см. главу 10).
Пациенты с AF и HFrEF, с выраженными симптомами может потребоваться не только терапия контроля ЧСС, но и терапия ритма сердца. Для пациентов, у которых HFrEF развивается в результате тахисистолии AF (tachycardiomyopathy) стратегия контроля ритма является предпочтительной , по данным нескольких относительно небольших когорт пациентов , где в исследованиях отмечалось улучшение LV функции ЛЖ после восстановления синусового ритма. Диагноз tachycardiomyopathy наблюдения, а иногда требует восстановления синусового ритма. Катетерная абляция может быть полезным методом для восстановления функции LV и качества жизни пациентов AF с HFrEF, но необходимы дополнительные данные. На рисунке 4приведена сводные данные по тактике ведения пациентов с AF и сердечной недостаточностью.
Рисунок 4
 Тактика ведения больных с мерцательной аритмией и сердечной недостаточностью . (Adapted from Kotecha and Piccini. 128)
7.1.2 Фибрилляции предсердий у пациентов с сердечной недостаточностью с сохранившейся фракцией выброса
Диагностика сердечной недостаточности с сохранившимися ФВ (HFpEF) у больных с AF является проблематичным из-за трудности разделения симптомов, которые связаны с ФВ от тех, при AF. Хотя диагностические дифференциация может быть достигнуто путем кардиоверсии и клинической переоценки, но должно быть разделено симптоматическое улучшение от специфической терапии, которая улучшает прогноз при HFpEF. Эхокардиография может помочь обнаружению HFpEF у больных с симптоматической AF путем предоставления доказательств соответствующих структурных болезней сердца [, например, LV гипертрофия (ГЛЖ)] и/или обнаружения диастолической дисфункции. Снижение раннего диастолического размера миокарда скорость e’ ткань Doppler отражает нарушение LV релаксации, в то время как соотношение E/e ‘ коррелирует с инвазивным измерением давления наполнения ЛЖ. Уровень натрийуретического пептида являются частью диагностической оценки HFpEF, хотя уровень натрийуретического пептида повышен у AF пациентов, а размах оптимальных диагностических границ до сих пор неизвестен. При лечении пациентов с AF и сочетанной HFpEF следует сосредоточиться на контроле баланса жидкости и сопутствующих состояний, таких, как гипертония и ишемия миокарда.
7.1.3 Фибрилляции предсердий у пациентов с сердечной недостаточностью со средней фракции выброса
HFmrEF является недавно предложенным определеннием , и описывает пациентов с симптомами и признаками сердечной недостаточности, ФВЛЖ 40 – 49%, повышенным уровнем натрийуретических пептидов и LV гипертрофией , расширением левого предсердия (LA) или наличием диастолической дисфункции. Однако диагноз сложнее у больных с AF, когда натрийуретические пептидов повышены при AF и имеется LA дилатация, независимо от сопутствующей сердечной недостаточности. ФВЛЖ также является переменной и её трудно оценить при AF у пациентов из-за AF-индуцированной снижение систолической функции LV и различной длительности сердечного цикла. Требуется дальнейшее изучение этой группы требуется, прежде чем рекомендовать стратегии лечения пациентов AF с HFmrEF.
7.1.4 Профилактика фибрилляции предсердий при сердечной недостаточности
Ретроспективный анализ из крупных рандомизированных испытаний сообщили о меньшей частоте AF впервые возникшей у пациентов, получавших ингибиторы АПФ/БРА по сравнению с плацебо. Эффект снижения заболеваемости AF с ингибиторами АПФ /БРА менее очевиден у пациентов с HFpEF и потеряется у пациентав без сердечной недостаточности. Neprilysin ингибиция, не добавляет этот эффект. Бета-блокатор терапия была связана с 33% снижением скорректированного шансы возникновения AF у HFrEF пациентов, предварительно принимавших с ингибиторы АПФ/БРА, повышающее значимость бета-блокатор терапии у больных HFrEF с синусовым ритмом. Eplerenone, антагонист рецепторов минералокортикоида, также снижает риск возникновения AF у больных с ФВЛЖ ≤35%, Нью-Йорк ассоциации сердца (NYHA) класс II, при добавлении к ингибиторам АПФ/БРА и бета-блокаторам.
7.2 Гипертоническая болезнь
Гипертония является фактором риска инсульта при AF; неконтролируемое высокое кровяное давление, повышает риск инсульта и кровотечения и может привести к рецидивирующий AF. Таким образом тщательный контроль кровяного давления должен стать неотъемлемой частью наблюдения AF пациентов. Ингибирование активности ренин ангиотензин альдостероновой системы может предотвратить ремоделирование и рецидивирующую AF. Прием различных антигипертензивных препаратов уменьшает возникновение AF, а также предлагается положительный эффект ингибиторов АПФ или БРА. Прием ингибиторов АПФ или БРА у больных с сердечной недостаточностью или ГЛЖ показывают низкий уровень возникновения новых AF.У пациентов с установленной AF, но без LV дисфункции или сердечной недостаточности БРА не предотвращают рецидивирующий характер AF лучше, чем плацебо. Ингибиторы АПФ или БРА могут уменьшить рецидивирование AF после кардиоверсии когда имеется совместная антиаритмическиая лекарственной терапии, по сравнению только с катетерной абляцией.
7.3 Клапанные болезни сердца
Пороки сердца самостоятельно связаны с возникновением AF. Примерно 30% пациентов с AF имеют некоторые формы клапанной болезни сердца, часто обнаруживаемых только при эхокардиографии. AF ухудшает прогноз у больных с тяжелой клапанной болезнью сердца, в том числе получивших хирургические или транскатетерное вмешательства в связи с поражением аортального или митрального клапана. С клапанной болезнью сердца могут быть связаны с повышенные риски тромбоэмболий, который вероятно также повышают риск инсульта у пациентов AF. Подобно сердечной недостаточности, клапанные й болезни и AF взаимодействуют с и поддерживать друг друга через перегрузку давлением, tachycardiomyopathy, и нейрогуморальные факторы. Когда дисфункция клапана тяжелой, AF можно рассматривать в качестве маркера прогрессивания заболевания, и потребности протезирования клапанов или его замены.
Традиционно пациентов с AF были делят на «клапанную» и «non клапанную» AF. Хотя были использованы несколько различных определений, клапанная AF главным образом относится к AF пациентам, которые имеют ревматические пороки (большей частью митральный стеноз) или механические клапаны. В самом деле, в то время как AF подразумевает добавочный риск тромбоэмболии у больных ос стенозом митрального клапана, нет никаких четких доказательств того, что другие клапанной болезни, включая митральной регургитацию или болезнь аортального клапана, нужно учитывать при выборе антикоагулянтов или действительно оценить риск инсульта при AF. Поэтому мы решили заменить исторический термин «non клапанной» АФ со ссылкой на конкретные условия.
Тактика ведения больных с мерцательной аритмией и сердечной недостаточностью . (Adapted from Kotecha and Piccini. 128)
7.1.2 Фибрилляции предсердий у пациентов с сердечной недостаточностью с сохранившейся фракцией выброса
Диагностика сердечной недостаточности с сохранившимися ФВ (HFpEF) у больных с AF является проблематичным из-за трудности разделения симптомов, которые связаны с ФВ от тех, при AF. Хотя диагностические дифференциация может быть достигнуто путем кардиоверсии и клинической переоценки, но должно быть разделено симптоматическое улучшение от специфической терапии, которая улучшает прогноз при HFpEF. Эхокардиография может помочь обнаружению HFpEF у больных с симптоматической AF путем предоставления доказательств соответствующих структурных болезней сердца [, например, LV гипертрофия (ГЛЖ)] и/или обнаружения диастолической дисфункции. Снижение раннего диастолического размера миокарда скорость e’ ткань Doppler отражает нарушение LV релаксации, в то время как соотношение E/e ‘ коррелирует с инвазивным измерением давления наполнения ЛЖ. Уровень натрийуретического пептида являются частью диагностической оценки HFpEF, хотя уровень натрийуретического пептида повышен у AF пациентов, а размах оптимальных диагностических границ до сих пор неизвестен. При лечении пациентов с AF и сочетанной HFpEF следует сосредоточиться на контроле баланса жидкости и сопутствующих состояний, таких, как гипертония и ишемия миокарда.
7.1.3 Фибрилляции предсердий у пациентов с сердечной недостаточностью со средней фракции выброса
HFmrEF является недавно предложенным определеннием , и описывает пациентов с симптомами и признаками сердечной недостаточности, ФВЛЖ 40 – 49%, повышенным уровнем натрийуретических пептидов и LV гипертрофией , расширением левого предсердия (LA) или наличием диастолической дисфункции. Однако диагноз сложнее у больных с AF, когда натрийуретические пептидов повышены при AF и имеется LA дилатация, независимо от сопутствующей сердечной недостаточности. ФВЛЖ также является переменной и её трудно оценить при AF у пациентов из-за AF-индуцированной снижение систолической функции LV и различной длительности сердечного цикла. Требуется дальнейшее изучение этой группы требуется, прежде чем рекомендовать стратегии лечения пациентов AF с HFmrEF.
7.1.4 Профилактика фибрилляции предсердий при сердечной недостаточности
Ретроспективный анализ из крупных рандомизированных испытаний сообщили о меньшей частоте AF впервые возникшей у пациентов, получавших ингибиторы АПФ/БРА по сравнению с плацебо. Эффект снижения заболеваемости AF с ингибиторами АПФ /БРА менее очевиден у пациентов с HFpEF и потеряется у пациентав без сердечной недостаточности. Neprilysin ингибиция, не добавляет этот эффект. Бета-блокатор терапия была связана с 33% снижением скорректированного шансы возникновения AF у HFrEF пациентов, предварительно принимавших с ингибиторы АПФ/БРА, повышающее значимость бета-блокатор терапии у больных HFrEF с синусовым ритмом. Eplerenone, антагонист рецепторов минералокортикоида, также снижает риск возникновения AF у больных с ФВЛЖ ≤35%, Нью-Йорк ассоциации сердца (NYHA) класс II, при добавлении к ингибиторам АПФ/БРА и бета-блокаторам.
7.2 Гипертоническая болезнь
Гипертония является фактором риска инсульта при AF; неконтролируемое высокое кровяное давление, повышает риск инсульта и кровотечения и может привести к рецидивирующий AF. Таким образом тщательный контроль кровяного давления должен стать неотъемлемой частью наблюдения AF пациентов. Ингибирование активности ренин ангиотензин альдостероновой системы может предотвратить ремоделирование и рецидивирующую AF. Прием различных антигипертензивных препаратов уменьшает возникновение AF, а также предлагается положительный эффект ингибиторов АПФ или БРА. Прием ингибиторов АПФ или БРА у больных с сердечной недостаточностью или ГЛЖ показывают низкий уровень возникновения новых AF.У пациентов с установленной AF, но без LV дисфункции или сердечной недостаточности БРА не предотвращают рецидивирующий характер AF лучше, чем плацебо. Ингибиторы АПФ или БРА могут уменьшить рецидивирование AF после кардиоверсии когда имеется совместная антиаритмическиая лекарственной терапии, по сравнению только с катетерной абляцией.
7.3 Клапанные болезни сердца
Пороки сердца самостоятельно связаны с возникновением AF. Примерно 30% пациентов с AF имеют некоторые формы клапанной болезни сердца, часто обнаруживаемых только при эхокардиографии. AF ухудшает прогноз у больных с тяжелой клапанной болезнью сердца, в том числе получивших хирургические или транскатетерное вмешательства в связи с поражением аортального или митрального клапана. С клапанной болезнью сердца могут быть связаны с повышенные риски тромбоэмболий, который вероятно также повышают риск инсульта у пациентов AF. Подобно сердечной недостаточности, клапанные й болезни и AF взаимодействуют с и поддерживать друг друга через перегрузку давлением, tachycardiomyopathy, и нейрогуморальные факторы. Когда дисфункция клапана тяжелой, AF можно рассматривать в качестве маркера прогрессивания заболевания, и потребности протезирования клапанов или его замены.
Традиционно пациентов с AF были делят на «клапанную» и «non клапанную» AF. Хотя были использованы несколько различных определений, клапанная AF главным образом относится к AF пациентам, которые имеют ревматические пороки (большей частью митральный стеноз) или механические клапаны. В самом деле, в то время как AF подразумевает добавочный риск тромбоэмболии у больных ос стенозом митрального клапана, нет никаких четких доказательств того, что другие клапанной болезни, включая митральной регургитацию или болезнь аортального клапана, нужно учитывать при выборе антикоагулянтов или действительно оценить риск инсульта при AF. Поэтому мы решили заменить исторический термин «non клапанной» АФ со ссылкой на конкретные условия.
 AF = фибрилляция предсердий; LV = левого желудочка.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с клапанной болезнью сердца и фибрилляцией предсердий
7.4 Сахарный диабет
Диабет и AF часто сосуществуют из-за ассоциаций с другими факторами риска. Диабет является фактором риска инсульта и других осложнений в AF. У больных с AF длительность диабета создает более высокий риск тромбоэмболии, хотя и без большей опасности связанных с антикоагулянтной терапией кровотечений. К сожалению интенсивный гликемический контроль не влияет на возникновение ФП, в то время как лечение метформином, как представляется, связано со снижение долгосрочного риска AF у больных сахарным диабетом и даже может быть связано с более низким долгосрочным риском инсульта. Диабетическая ретинопатия, является мерой тяжести заболевания, но не увеличивает риск глазных кровотечений у пациентов, получающих антикоагулянты.
7.5 Ожирение и потеря веса
7.5.1 Ожирение как фактор риска
Ожирение увеличивает риск для AF (Таблица 8 ) с прогрессивным увеличением при росте индекса массы тела (ИМТ). Пациенты с ожирением чаще могут иметь LV диастолическую дисфункцию, увеличение симпатической активности и воспаление и увеличение жировой инфильтрации предсердий. Ожирение также может быть фактором риска ишемического инсульта, тромбоэмболии и смерти пациентов AF.
7.5.2 Снижение веса при ожирении у пациентов с мерцательной аритмией
Интенсивное похудание в дополнение к контролю других сердечно-сосудистых факторов риска (в диапазоне 10 – 15 кг веса достигнута), привело к уменьшению рецидивов AF и симптомов, по сравнению с подходом, основанным на общих советов при ожирении пациентов с AF. Кардиореспираторной фитнес может уменьшить тяжесть AF при ожирении пациентов с AF. Хотя результаты в этих исследованиях должны быть подтверждены, они поддерживают положительный эффект снижения веса у тучных пациентов AF.
7.5.3 Катетерная абляция у пациентов с ожирением
Ожирение может ускорить рецидив ФП после катетерной абляции, особенно с обструктивным апноэ как важного потенциального сопутствующего фактора. Ожирение также связано с более высокой дозой облучения и осложнений во время AF абляции. В частности, симптоматическое улучшение после Катетерной абляции AF у пациентов, страдающих ожирением, как представляется, сопоставимо с улучшением при нормализации веса пациентов. Результаты сокращения AF эпизодов при снижении веса (см. главу 7.5.2.) Следует предлагать AF абляцию пациентам, страдающих ожирением, в сочетании с изменением образа жизни, которые приводят к снижению веса.
AF = фибрилляция предсердий; LV = левого желудочка.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с клапанной болезнью сердца и фибрилляцией предсердий
7.4 Сахарный диабет
Диабет и AF часто сосуществуют из-за ассоциаций с другими факторами риска. Диабет является фактором риска инсульта и других осложнений в AF. У больных с AF длительность диабета создает более высокий риск тромбоэмболии, хотя и без большей опасности связанных с антикоагулянтной терапией кровотечений. К сожалению интенсивный гликемический контроль не влияет на возникновение ФП, в то время как лечение метформином, как представляется, связано со снижение долгосрочного риска AF у больных сахарным диабетом и даже может быть связано с более низким долгосрочным риском инсульта. Диабетическая ретинопатия, является мерой тяжести заболевания, но не увеличивает риск глазных кровотечений у пациентов, получающих антикоагулянты.
7.5 Ожирение и потеря веса
7.5.1 Ожирение как фактор риска
Ожирение увеличивает риск для AF (Таблица 8 ) с прогрессивным увеличением при росте индекса массы тела (ИМТ). Пациенты с ожирением чаще могут иметь LV диастолическую дисфункцию, увеличение симпатической активности и воспаление и увеличение жировой инфильтрации предсердий. Ожирение также может быть фактором риска ишемического инсульта, тромбоэмболии и смерти пациентов AF.
7.5.2 Снижение веса при ожирении у пациентов с мерцательной аритмией
Интенсивное похудание в дополнение к контролю других сердечно-сосудистых факторов риска (в диапазоне 10 – 15 кг веса достигнута), привело к уменьшению рецидивов AF и симптомов, по сравнению с подходом, основанным на общих советов при ожирении пациентов с AF. Кардиореспираторной фитнес может уменьшить тяжесть AF при ожирении пациентов с AF. Хотя результаты в этих исследованиях должны быть подтверждены, они поддерживают положительный эффект снижения веса у тучных пациентов AF.
7.5.3 Катетерная абляция у пациентов с ожирением
Ожирение может ускорить рецидив ФП после катетерной абляции, особенно с обструктивным апноэ как важного потенциального сопутствующего фактора. Ожирение также связано с более высокой дозой облучения и осложнений во время AF абляции. В частности, симптоматическое улучшение после Катетерной абляции AF у пациентов, страдающих ожирением, как представляется, сопоставимо с улучшением при нормализации веса пациентов. Результаты сокращения AF эпизодов при снижении веса (см. главу 7.5.2.) Следует предлагать AF абляцию пациентам, страдающих ожирением, в сочетании с изменением образа жизни, которые приводят к снижению веса.
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендацию.
Рекомендация для страдающих ожирением пациентов с мерцательной аритмией
7.6 Хроническая обструктивная болезнь легких, апноэ сна и другие респираторных заболеваний
AF ассоциируется с обструктивным апноэ. Множественные патофизиологические механизмы могут способствовать возникновению AF при обструктивном апноэ, включая вегетативную дисфункцию, гипоксию, гиперкапнию и воспаление. Обструктивное апноэ повышает внутригрудное давление, которые само по себе и через вагусную активацию может провоцировать всплеск потенциала сокращения предсердий и вызвать AF. Снижение факторов риска и улучшение вентиляции может уменьшить рецидивы AF. Представляется разумным рассматривать обструктивное апноэ для скрининга AF у пациентов с факторами риска. Лечение обструктивного апноэ должны быть оптимизировано для улучшения результатов лечения AF у соответствующих пациентов. Прессотерапию с поддержкой сервоприводом не следует использовать у HFrEF пациентов с преобладающим ночного апноэ центрального происхождения (из которых 25% имели сочетанную AF).
Пациенты с хронической обструктивной болезнью легких часто страдают от предсердной тахикардии, которую необходимо отдифференцировать от AF по ЭКГ. Препараты, используемые для облегчения бронхоспазма, особенно теофиллин и бета-агонисты, могут спровоцировать AF и сделать контроль ритма желудочков затруднительным. Неселективные бета-блокаторы, соталол, пропафенон и аденозин следует использовать с осторожностью у пациентов со значительным бронхоспазмом, в то время как они могут безопасно использоваться у пациентов с хронической обструктивной болезнью легких. Селективные Блокаторы бета-1 (например, бисопролол, метопролола и Небиволол), дилтиазем и верапамил обычно хорошо переносятся и эффективны (см. главу 10).
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендацию.
Рекомендация для страдающих ожирением пациентов с мерцательной аритмией
7.6 Хроническая обструктивная болезнь легких, апноэ сна и другие респираторных заболеваний
AF ассоциируется с обструктивным апноэ. Множественные патофизиологические механизмы могут способствовать возникновению AF при обструктивном апноэ, включая вегетативную дисфункцию, гипоксию, гиперкапнию и воспаление. Обструктивное апноэ повышает внутригрудное давление, которые само по себе и через вагусную активацию может провоцировать всплеск потенциала сокращения предсердий и вызвать AF. Снижение факторов риска и улучшение вентиляции может уменьшить рецидивы AF. Представляется разумным рассматривать обструктивное апноэ для скрининга AF у пациентов с факторами риска. Лечение обструктивного апноэ должны быть оптимизировано для улучшения результатов лечения AF у соответствующих пациентов. Прессотерапию с поддержкой сервоприводом не следует использовать у HFrEF пациентов с преобладающим ночного апноэ центрального происхождения (из которых 25% имели сочетанную AF).
Пациенты с хронической обструктивной болезнью легких часто страдают от предсердной тахикардии, которую необходимо отдифференцировать от AF по ЭКГ. Препараты, используемые для облегчения бронхоспазма, особенно теофиллин и бета-агонисты, могут спровоцировать AF и сделать контроль ритма желудочков затруднительным. Неселективные бета-блокаторы, соталол, пропафенон и аденозин следует использовать с осторожностью у пациентов со значительным бронхоспазмом, в то время как они могут безопасно использоваться у пациентов с хронической обструктивной болезнью легких. Селективные Блокаторы бета-1 (например, бисопролол, метопролола и Небиволол), дилтиазем и верапамил обычно хорошо переносятся и эффективны (см. главу 10).
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания , поддерживающие рекомендации.
Рекомендации для пациентов с мерцательной аритмией и респираторными заболеваниями
7.7 Хроническая болезнь почек
AF присутствует в 15 – 20% больных с ХБП. Определение ХПБ в большинстве исследований по AF является довольно строгим. Для установления диагноза ХПБ использовался уровень клиренса креатинина (CrCl) < 60 мл/мин, но в ряде исследований пациенты с AF имели CrCl < 50 мл/мин по формуле Cockroft–Gault для адаптации дозы антикоагулянтов NOAC. CrCl у AF пациентов может ухудшаться с течением времени. В главе 9.2.4 рассматривается методика применения оральных коагулянтов у пациентов с ХБП.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с заболеванием почек и фибрилляцией предсердий
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания , поддерживающие рекомендации.
Рекомендации для пациентов с мерцательной аритмией и респираторными заболеваниями
7.7 Хроническая болезнь почек
AF присутствует в 15 – 20% больных с ХБП. Определение ХПБ в большинстве исследований по AF является довольно строгим. Для установления диагноза ХПБ использовался уровень клиренса креатинина (CrCl) < 60 мл/мин, но в ряде исследований пациенты с AF имели CrCl < 50 мл/мин по формуле Cockroft–Gault для адаптации дозы антикоагулянтов NOAC. CrCl у AF пациентов может ухудшаться с течением времени. В главе 9.2.4 рассматривается методика применения оральных коагулянтов у пациентов с ХБП.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для пациентов с заболеванием почек и фибрилляцией предсердий
- Комплексное наблюдение пациентов с мерцательной аритмией
 Рекомендации по острым и хроническим состояниям у пациентов с ФП, отдаленные кардиоваскулярные результаты, и состояние здоровья пациентов
Таблица 9
Рекомендации по острым и хроническим состояниям у пациентов с ФП, отдаленные кардиоваскулярные результаты, и состояние здоровья пациентов
Таблица 9
 Клинические ситуации, требующие неотложной помощи специалистов службы ФП
A Антикоагуляцию следует начать как можно раньше у всех подходящих пациентов и обычно не требует привлечения специалиста.
Рисунок 6
Клинические ситуации, требующие неотложной помощи специалистов службы ФП
A Антикоагуляцию следует начать как можно раньше у всех подходящих пациентов и обычно не требует привлечения специалиста.
Рисунок 6
 Достижение оптимального наблюдения пациентов с ФП
Рисунок 7
Достижение оптимального наблюдения пациентов с ФП
Рисунок 7
 Основы комплексной медицинской помощи пациентам ФП.
8.1 Доказательства в поддержку комплексного наблюдения фибрилляции
Комплексный подход в сравнении с обычным уменьшает примерно на треть число госпитализации и сердечно-сосудистой смертей при наблюдении в течении 22 месяцев (14,3% против 20,8%, HR 0,65; 95% ДИ 0,45 – 0,93; P = 0,017). Комплексный подход ФП представляется экономически эффективным. в этом исследовании.
8.2 Компоненты комплексного наблюдения ФП
8.2.1 Участие больного
Пациенты должны занимать центральную роль в процессе лечения. Лечение AF требует от пациентов, изменение образа жизни и приверженности к лечению, порой без ощутимых сразу результатов, но пациенты должны понимать свои обязанности в процессе лечения. Врачи и социальные работники отвечают за обеспечение доступа к научно обоснованной терапии, но выполнение назначений является в конечном счете ответственностью информированных и самостоятельных пациентов, лучше всего описанное как «общая ответственность». Следовательно, информация и образование пациентов и часто их партнеров и родственников, является непременным условием для поощрения личного участия и расширения возможностей пациентов участвовать в принятии общих решений, и поддерживать понимание болезни и предлагаемого лечения.
8.2.2 Междисциплинарные подходы при фибрилляции
Делегирование задач от специалистов врачам общей практике и от терапевтов к врачам смежных специальностей является базовой концепцией модели комплексной медицинской помощи. Междисциплинарный подход команды AF включает эффективное сочетание межличностного общения и навыков общения, образования и опыт в ведении ФП, а также принципа приверженности лечению. Такой подход подчеркивает важность реорганизации повседневной практике в поощрении не- специалистов и врачей смежных специальностей, в просвещении пациентов и координации помощи, в то время как врачам специалистам остаются медицинские вопросы. Культурные и региональные различия, будет определять состав команд AF.
8.2.3 Роль не- специалистов (non–specialists)
Некоторые не- специалисты медико-санитарной помощи, например врачи первичной медицинской помощи имеют большой опыт в профилактике инсульта и первоначальном ведении AF пациентов. Другие могут пройти обучение для приобретения таких знаний. Другие компоненты ведения AF (например, оценка сопутствующих сердечно-сосудистых заболеваний, антиаритмическая лекарственная терапия или интервенционное лечение) часто требуют привлечения врача-специалиста. Организация помощи AF должна поддерживать инициирование лечения не специалистами, где это уместно и обеспечить беспрепятственный доступ к консультации врачей – специалистов для оптимизации лечения AF.
8.2.4 Софт-Технологии при комплексном наблюдении фибрилляции
Технологии, такие, как подготовка программного обеспечения, имеет потенциал для повышения эффективности научно обоснованной медицинской помощи и улучшить отдаленные результаты, когда они построены на экспертных заключениях. Электронные средства могут также обеспечить последовательные коммуникации в команде AF. В целях поддержки более широкого использования такой технологии Целевая группа предоставляет инструменты цифрового общения в виде свободно доступных смартфон приложений, для AF медицинских работников и пациентов AF.
Основы комплексной медицинской помощи пациентам ФП.
8.1 Доказательства в поддержку комплексного наблюдения фибрилляции
Комплексный подход в сравнении с обычным уменьшает примерно на треть число госпитализации и сердечно-сосудистой смертей при наблюдении в течении 22 месяцев (14,3% против 20,8%, HR 0,65; 95% ДИ 0,45 – 0,93; P = 0,017). Комплексный подход ФП представляется экономически эффективным. в этом исследовании.
8.2 Компоненты комплексного наблюдения ФП
8.2.1 Участие больного
Пациенты должны занимать центральную роль в процессе лечения. Лечение AF требует от пациентов, изменение образа жизни и приверженности к лечению, порой без ощутимых сразу результатов, но пациенты должны понимать свои обязанности в процессе лечения. Врачи и социальные работники отвечают за обеспечение доступа к научно обоснованной терапии, но выполнение назначений является в конечном счете ответственностью информированных и самостоятельных пациентов, лучше всего описанное как «общая ответственность». Следовательно, информация и образование пациентов и часто их партнеров и родственников, является непременным условием для поощрения личного участия и расширения возможностей пациентов участвовать в принятии общих решений, и поддерживать понимание болезни и предлагаемого лечения.
8.2.2 Междисциплинарные подходы при фибрилляции
Делегирование задач от специалистов врачам общей практике и от терапевтов к врачам смежных специальностей является базовой концепцией модели комплексной медицинской помощи. Междисциплинарный подход команды AF включает эффективное сочетание межличностного общения и навыков общения, образования и опыт в ведении ФП, а также принципа приверженности лечению. Такой подход подчеркивает важность реорганизации повседневной практике в поощрении не- специалистов и врачей смежных специальностей, в просвещении пациентов и координации помощи, в то время как врачам специалистам остаются медицинские вопросы. Культурные и региональные различия, будет определять состав команд AF.
8.2.3 Роль не- специалистов (non–specialists)
Некоторые не- специалисты медико-санитарной помощи, например врачи первичной медицинской помощи имеют большой опыт в профилактике инсульта и первоначальном ведении AF пациентов. Другие могут пройти обучение для приобретения таких знаний. Другие компоненты ведения AF (например, оценка сопутствующих сердечно-сосудистых заболеваний, антиаритмическая лекарственная терапия или интервенционное лечение) часто требуют привлечения врача-специалиста. Организация помощи AF должна поддерживать инициирование лечения не специалистами, где это уместно и обеспечить беспрепятственный доступ к консультации врачей – специалистов для оптимизации лечения AF.
8.2.4 Софт-Технологии при комплексном наблюдении фибрилляции
Технологии, такие, как подготовка программного обеспечения, имеет потенциал для повышения эффективности научно обоснованной медицинской помощи и улучшить отдаленные результаты, когда они построены на экспертных заключениях. Электронные средства могут также обеспечить последовательные коммуникации в команде AF. В целях поддержки более широкого использования такой технологии Целевая группа предоставляет инструменты цифрового общения в виде свободно доступных смартфон приложений, для AF медицинских работников и пациентов AF.
 AF = фибрилляции предсердий
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по комплексному подходу к оказанию медицинской помощи
8.3 Диагностическое обследование пациентов с ФП
AF часто встречается у пациентов с другими, временами недиагностированными, сердечно-сосудистыми заболеваниями. Таким образом все пациенты AF выиграют от квалифицированной кардиологической помощи.
8.3.1 Стандарт обследования пациентов с ФП
Следует собрать полный анамнез истории болезни, и все пациенты должны пройти полное клиническое обследование, которое включает тщательную оценку сопутствующих заболеваний, создать модель AF, оценить риск инсульта и связанных с AF симптомов и оценить опасность осложнений, связанных с нарушением сердечного ритма, например, тромбоэмболиями или дисфункции ЛЖ(LV). 12-ЭКГ отведениях рекомендуется при подозрении диагноза AF, определения ЧСС AF и выполнить скрининг нарушений проводимости, ишемии и признаков структурных болезни сердца. Первоначальными анализами крови следует оценить функцию щитовидной железы и функции почек, а также электролиты сыворотки и полный анализ крови. Трансторакальная эхокардиография рекомендуется всем пациентам AF для решения о лечении. Трансторакальная эхокардиография следует использовать для выявления структурных заболеваний (например, клапанной болезни) и оценить размер LV и функции (систолической и диастолической), предсердий размеры и функцию правого сердца. Хотя биомаркеры такие как натрийуретический пептид повышены у AF пациентов, нет достаточных данных, чтобы предположить, что параметры крови могут быть независимыми маркерами для AF.
8.3.2 2 Дополнительные исследования у отдельных пациентов с мерцательной аритмией
Амбулаторная ЭКГ при мониторинге пациентов AF может оценить адекватность контроля ЧСС, симптомы рецидивирования AF и обнаруживатьфокальные эктопические очаги индуцирующие приступы пароксизмальная AF. Трансэзофагеальная эхокардиография (TOE) является полезным для оценки клапанной болезни сердца и исключения внутрисердечной тромбов, особенно в ушке левого предсердия LAA для проведения ранних кардиоверсии или Катетерной абляция. Пациенты с симптомами или признаки ишемия миокарда должны подвергаться коронарной ангиографии или стресс-тестирования при необходимости. У больных с AF и признаки церебральной ишемии или инсульта компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга рекомендуется для обнаружения инсульта и выработки решений, касающихся неотложного и долгосрочного назначения антикоагулянтов. МРТ левого предсердия с контрастированием, с использованием гадолиния в качестве контраста, в режиме T1 визуализирует сердце, а внутрисердечной эхо может помочь в решении о лечении в AF, но требуют проверки в многоцентровых исследованиях.
8.4 Система контроля
AF = фибрилляции предсердий
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по комплексному подходу к оказанию медицинской помощи
8.3 Диагностическое обследование пациентов с ФП
AF часто встречается у пациентов с другими, временами недиагностированными, сердечно-сосудистыми заболеваниями. Таким образом все пациенты AF выиграют от квалифицированной кардиологической помощи.
8.3.1 Стандарт обследования пациентов с ФП
Следует собрать полный анамнез истории болезни, и все пациенты должны пройти полное клиническое обследование, которое включает тщательную оценку сопутствующих заболеваний, создать модель AF, оценить риск инсульта и связанных с AF симптомов и оценить опасность осложнений, связанных с нарушением сердечного ритма, например, тромбоэмболиями или дисфункции ЛЖ(LV). 12-ЭКГ отведениях рекомендуется при подозрении диагноза AF, определения ЧСС AF и выполнить скрининг нарушений проводимости, ишемии и признаков структурных болезни сердца. Первоначальными анализами крови следует оценить функцию щитовидной железы и функции почек, а также электролиты сыворотки и полный анализ крови. Трансторакальная эхокардиография рекомендуется всем пациентам AF для решения о лечении. Трансторакальная эхокардиография следует использовать для выявления структурных заболеваний (например, клапанной болезни) и оценить размер LV и функции (систолической и диастолической), предсердий размеры и функцию правого сердца. Хотя биомаркеры такие как натрийуретический пептид повышены у AF пациентов, нет достаточных данных, чтобы предположить, что параметры крови могут быть независимыми маркерами для AF.
8.3.2 2 Дополнительные исследования у отдельных пациентов с мерцательной аритмией
Амбулаторная ЭКГ при мониторинге пациентов AF может оценить адекватность контроля ЧСС, симптомы рецидивирования AF и обнаруживатьфокальные эктопические очаги индуцирующие приступы пароксизмальная AF. Трансэзофагеальная эхокардиография (TOE) является полезным для оценки клапанной болезни сердца и исключения внутрисердечной тромбов, особенно в ушке левого предсердия LAA для проведения ранних кардиоверсии или Катетерной абляция. Пациенты с симптомами или признаки ишемия миокарда должны подвергаться коронарной ангиографии или стресс-тестирования при необходимости. У больных с AF и признаки церебральной ишемии или инсульта компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга рекомендуется для обнаружения инсульта и выработки решений, касающихся неотложного и долгосрочного назначения антикоагулянтов. МРТ левого предсердия с контрастированием, с использованием гадолиния в качестве контраста, в режиме T1 визуализирует сердце, а внутрисердечной эхо может помочь в решении о лечении в AF, но требуют проверки в многоцентровых исследованиях.
8.4 Система контроля
 Большинство пациентов AF нужны регулярное наблюдение для обеспечения дальнейшего оптимального лечения. Последующая деятельность может осуществляться при первичной медицинской помощи, специально обученными медсестрами, кардиологами или AF специалистами. Специалист должен координировать помощь и последующие мероприятия. Последующая деятельность должна обеспечить осуществление плана лечения, продолжение участия пациента и адаптация терапии при необходимости.
AF = фибрилляция предсердий; ЭКГ = электрокардиограмму.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по диагностике в системе контроля пациентов с ФП
8.5 5 Определение целей рационального ведения пациентов с ФП
AF управление включает терапию с прогностическим воздействием (антикоагуляционную и лечение сердечно-сосудистых заболеваний) и терапию, главным образом обеспечивающую симптоматические эффекты (контроль ЧСС и ритма, Таблица 10). Суть терапия с прогностической пользой нужно тщательно объяснять пациентам, когда её преимущества и эффекты непосредственно не чувствуются. Ритм контроля терапии может быть успешным, если симптомы контролируются, даже когда AF повторяется. Объясняя ожидаемые выгоды каждому пациенту в начале управления AF будет предотвращать необоснованные ожидания и иметь потенциал для оптимизации качества жизни.
Таблица 10
Большинство пациентов AF нужны регулярное наблюдение для обеспечения дальнейшего оптимального лечения. Последующая деятельность может осуществляться при первичной медицинской помощи, специально обученными медсестрами, кардиологами или AF специалистами. Специалист должен координировать помощь и последующие мероприятия. Последующая деятельность должна обеспечить осуществление плана лечения, продолжение участия пациента и адаптация терапии при необходимости.
AF = фибрилляция предсердий; ЭКГ = электрокардиограмму.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по диагностике в системе контроля пациентов с ФП
8.5 5 Определение целей рационального ведения пациентов с ФП
AF управление включает терапию с прогностическим воздействием (антикоагуляционную и лечение сердечно-сосудистых заболеваний) и терапию, главным образом обеспечивающую симптоматические эффекты (контроль ЧСС и ритма, Таблица 10). Суть терапия с прогностической пользой нужно тщательно объяснять пациентам, когда её преимущества и эффекты непосредственно не чувствуются. Ритм контроля терапии может быть успешным, если симптомы контролируются, даже когда AF повторяется. Объясняя ожидаемые выгоды каждому пациенту в начале управления AF будет предотвращать необоснованные ожидания и иметь потенциал для оптимизации качества жизни.
Таблица 10
 Последующая деятельность на основе целей управления ФП
BPM = ударов в минуту; Шкала симптомов mEHRA = изменение масштаба симптомов Европейской ассоциации ритма сердца; GP general practitioner– семейный врач; INR = международное нормализованное отношение; LV = левый желудочек; NOAC = антагонист витамина К орального антикоагулянта; VKA = антагонист витамина К.
Последующая деятельность на основе целей управления ФП
BPM = ударов в минуту; Шкала симптомов mEHRA = изменение масштаба симптомов Европейской ассоциации ритма сердца; GP general practitioner– семейный врач; INR = международное нормализованное отношение; LV = левый желудочек; NOAC = антагонист витамина К орального антикоагулянта; VKA = антагонист витамина К.
- Профилактики инсульта у пациентов с фибрилляцией предсердий
 Профилактика инсульта при фибрилляции предсердий.
9.1 Прогнозирование инсульта и риск кровотечения
9.1.1 Оценка клинического риска инсульта и системной эмболии
Простые, клинически применимые схемы стратификации риска инсульта у AF пациентов были разработаны в конце 1990-х в небольших когортных исследованиях и позднее были уточнены и проверены в больших популяциях. Введение шкалы ЧА2DS2-VASc (Таблица 11) упростило первоначальное решение по ОАС у AF пациентов. С момента первого включения в руководящие принципы ESC в 2010 году, это широко используется. Мы рекомендуем оценить риск инсульта у пациентов AF, основанные на шкале ЧА2DS2-VASc. Как правило пациентам без клинических факторов риска инсульта не нужна антитромботическая терапия, в то время как пациенты с факторами риска инсульта (т. е. ЧА2DS2-VASc счёт 1 или больше для мужчин и 2 или больше для женщин), могут извлечь выгоду из ОАС.
Таблица 11
Профилактика инсульта при фибрилляции предсердий.
9.1 Прогнозирование инсульта и риск кровотечения
9.1.1 Оценка клинического риска инсульта и системной эмболии
Простые, клинически применимые схемы стратификации риска инсульта у AF пациентов были разработаны в конце 1990-х в небольших когортных исследованиях и позднее были уточнены и проверены в больших популяциях. Введение шкалы ЧА2DS2-VASc (Таблица 11) упростило первоначальное решение по ОАС у AF пациентов. С момента первого включения в руководящие принципы ESC в 2010 году, это широко используется. Мы рекомендуем оценить риск инсульта у пациентов AF, основанные на шкале ЧА2DS2-VASc. Как правило пациентам без клинических факторов риска инсульта не нужна антитромботическая терапия, в то время как пациенты с факторами риска инсульта (т. е. ЧА2DS2-VASc счёт 1 или больше для мужчин и 2 или больше для женщин), могут извлечь выгоду из ОАС.
Таблица 11
 Клинические факторы риска инсульта, переходных ишемических атак и системных эмболий по шкале ЧА2DS2-VASc
ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (двойной счет), диабет, инсульт (двойной счет), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
Другие, менее установленные факторы риска инсульта включают нестабильное международное нормализованное отношение (INR) и низкое время в терапевтических диапазоне (TTR) пациентов, получающих VKAs; предыдущие предыдущие кровотечения или анемии; избыток алкоголя и других маркеров при снижении приверженности терапии; ХБП; повышенные тропонина как маркера высокой чувствительности; и повышенных N-концевого pro-B-тип натрийуретического пептида.
9.1.2 Антикоагуляция у больных с ЧА2DS2-VASc 1 балл у мужчин и 2 женщины
Есть веские доказательства того, что пациенты с шкалой оценки риска ЧА2DS2 – VASc 2 балла или более мужчин и 3 или более женщин, показаны ОАС. Показатели инсульта и тромбоэмболий значительно различаются у больных с ЧА2DS2- VASc 1 или 2 из-за различий в результатах, в связи с населением и антисвертывающим статусом. ОАС у мужчин с ЧА2DS2-VASc 1 баллом и женщин с 2 баллами, предотвращает инсульт, риск кровотечения и учитывает предпочтения пациента. Важно отметить, что возраст (65 лет и старше) связан со сравнительно высоким и постоянно растущим риском инсульта, что также потенцирует и другие факторы риска (например, сердечная недостаточность и секс). Таким образом индивидуальное взвешивание риска, а также предпочтения пациента, должны помочь в решение антикоагуляции пациентам с только один ЧА2DS2-VASc фактор риска, помимо женского пола. Женский секс не повышают риск инсульта в отсутствие других факторов риска инсульта.
Измерение сердечного тропонина (высокая чувствительность тропонина T или I) и N-концевого pro-B-тип натрийуретического пептида может предоставить дополнительную прогностическую информацию у отдельных пациентов AF. Оценки рисков на основе биомаркеров в будущем, может оказаться полезным для лучшего стратифицировать пациентов (например, по действительно низкому риску инсульта).
9.1.3 Оценка клинического риска кровотечения
Были разработаны несколько шкал оценки риска кровотечения, главным образом у пациентов на VKAs. Они включают в себя HAS–BLED [гипертоническая болезнь, нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним , лабильный МНО( INR), пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующе обстоятельства (1 балл каждый)], ORBIT (результаты реестра для лучшего проинформирования лечения фибрилляция предсердий) ( Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) и более поздние ABC (возраст, биомаркеры, анамнез)шкала кровотечения, который также использует выбранные биомаркеры. Факторы риска инсульта и кровотечения перекрываются (сравнить таблицы 11 и 12). Например, возраст является одним из наиболее важных предикторов как ишемических инсульта и кровотечения у пациентов AF. Высокая оценка риска кровотечения вообще не должна препятствовать проведению ОАС. Скорее следует выявить факторы риска кровотечения и по возможности медикаментозно скорректировать (см. главу 8.5). В таблице 12 приводится подробная информация о модифицируемых факторах риска кровотечения.
Таблица 12
Клинические факторы риска инсульта, переходных ишемических атак и системных эмболий по шкале ЧА2DS2-VASc
ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (двойной счет), диабет, инсульт (двойной счет), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
Другие, менее установленные факторы риска инсульта включают нестабильное международное нормализованное отношение (INR) и низкое время в терапевтических диапазоне (TTR) пациентов, получающих VKAs; предыдущие предыдущие кровотечения или анемии; избыток алкоголя и других маркеров при снижении приверженности терапии; ХБП; повышенные тропонина как маркера высокой чувствительности; и повышенных N-концевого pro-B-тип натрийуретического пептида.
9.1.2 Антикоагуляция у больных с ЧА2DS2-VASc 1 балл у мужчин и 2 женщины
Есть веские доказательства того, что пациенты с шкалой оценки риска ЧА2DS2 – VASc 2 балла или более мужчин и 3 или более женщин, показаны ОАС. Показатели инсульта и тромбоэмболий значительно различаются у больных с ЧА2DS2- VASc 1 или 2 из-за различий в результатах, в связи с населением и антисвертывающим статусом. ОАС у мужчин с ЧА2DS2-VASc 1 баллом и женщин с 2 баллами, предотвращает инсульт, риск кровотечения и учитывает предпочтения пациента. Важно отметить, что возраст (65 лет и старше) связан со сравнительно высоким и постоянно растущим риском инсульта, что также потенцирует и другие факторы риска (например, сердечная недостаточность и секс). Таким образом индивидуальное взвешивание риска, а также предпочтения пациента, должны помочь в решение антикоагуляции пациентам с только один ЧА2DS2-VASc фактор риска, помимо женского пола. Женский секс не повышают риск инсульта в отсутствие других факторов риска инсульта.
Измерение сердечного тропонина (высокая чувствительность тропонина T или I) и N-концевого pro-B-тип натрийуретического пептида может предоставить дополнительную прогностическую информацию у отдельных пациентов AF. Оценки рисков на основе биомаркеров в будущем, может оказаться полезным для лучшего стратифицировать пациентов (например, по действительно низкому риску инсульта).
9.1.3 Оценка клинического риска кровотечения
Были разработаны несколько шкал оценки риска кровотечения, главным образом у пациентов на VKAs. Они включают в себя HAS–BLED [гипертоническая болезнь, нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним , лабильный МНО( INR), пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующе обстоятельства (1 балл каждый)], ORBIT (результаты реестра для лучшего проинформирования лечения фибрилляция предсердий) ( Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) и более поздние ABC (возраст, биомаркеры, анамнез)шкала кровотечения, который также использует выбранные биомаркеры. Факторы риска инсульта и кровотечения перекрываются (сравнить таблицы 11 и 12). Например, возраст является одним из наиболее важных предикторов как ишемических инсульта и кровотечения у пациентов AF. Высокая оценка риска кровотечения вообще не должна препятствовать проведению ОАС. Скорее следует выявить факторы риска кровотечения и по возможности медикаментозно скорректировать (см. главу 8.5). В таблице 12 приводится подробная информация о модифицируемых факторах риска кровотечения.
Таблица 12
 Модифицируемые и немодифицируемые факторы риска кровотечения при антикоагуляции пациентов на основе оценки риска кровотечения
ABC = возраст, биомаркеры, клинической истории; ATRIA = антикоагуляционную и факторы риска в фибрилляция предсердий; ХБП = хронические заболевания почек; CrCl = клиренса креатинина; HAS–BLED = гипертоническая болезнь , нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним, лабильной INR, пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующие обстоятельств (1 очко каждый); HEMORR2HAGES = печеночной или почечной болезни, злоупотребление этанолом, злокачественноые опухоли, старше (возраст > 75), снижение количества тромбоцитов или функции, rebleeding риск повторного кровотечения (предыдущее кровотечение; 2 балла), гипертония (неконтролируемая), анемия, генетические факторы (CYP 2 c 9 полиморфизмы), высокий риск падений (в том числе психоневрологические заболевания) и инсульта; INR = международное нормализованное отношение; ORBIT = результаты реестра для более осознанного лечения фибрилляции предсердий; TTR = время в терапевтических диапазоне; VKA = антагонист витамина К.
A Производный от HAS-БЛЕД оценка.
B Производные от HEMORR2HAGES оценка.
C Производные от ATRIA балла.
D Производные шкалы ORBIT
E Производные от ABC кровотечения шкалы оценка кровотечения.
Модифицируемые и немодифицируемые факторы риска кровотечения при антикоагуляции пациентов на основе оценки риска кровотечения
ABC = возраст, биомаркеры, клинической истории; ATRIA = антикоагуляционную и факторы риска в фибрилляция предсердий; ХБП = хронические заболевания почек; CrCl = клиренса креатинина; HAS–BLED = гипертоническая болезнь , нарушение функции почек/печени (1 балл каждый), инсульт, кровотечения в анамнезе или предрасположенность к ним, лабильной INR, пожилые люди (> 65 лет), наркотики/алкоголь как сопутствующие обстоятельств (1 очко каждый); HEMORR2HAGES = печеночной или почечной болезни, злоупотребление этанолом, злокачественноые опухоли, старше (возраст > 75), снижение количества тромбоцитов или функции, rebleeding риск повторного кровотечения (предыдущее кровотечение; 2 балла), гипертония (неконтролируемая), анемия, генетические факторы (CYP 2 c 9 полиморфизмы), высокий риск падений (в том числе психоневрологические заболевания) и инсульта; INR = международное нормализованное отношение; ORBIT = результаты реестра для более осознанного лечения фибрилляции предсердий; TTR = время в терапевтических диапазоне; VKA = антагонист витамина К.
A Производный от HAS-БЛЕД оценка.
B Производные от HEMORR2HAGES оценка.
C Производные от ATRIA балла.
D Производные шкалы ORBIT
E Производные от ABC кровотечения шкалы оценка кровотечения.
 AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт или переходных ишемических атак или системной эмболии (два балла ), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для прогнозирования инсульта и риска кровотечения
AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт или переходных ишемических атак или системной эмболии (два балла ), сосудистые заболевания, возраст 65 – 74 и пол (женщины).
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для прогнозирования инсульта и риска кровотечения


