Просмотров: 3 972
Рекомендации Европейского кардиологического общества (второе издание, 2016г ) по диагностике и лечению фибрилляции предсердий (ФП). 17 простых правил по контролю фибрилляции предсердий для ревматологов. Часть 4.
11.3 Катетерная абляция
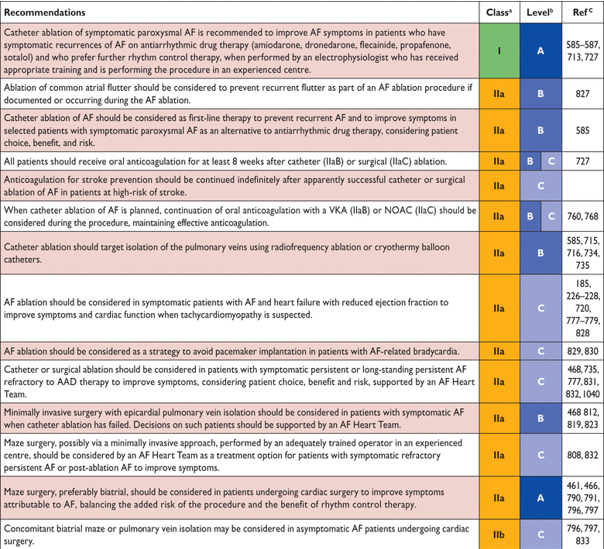
Поскольку первоначальное описание триггеров в легочные вены, которые инициируют пароксизмальная AF, Катетерная абляция AF разработана от специализированной экспериментальной процедуры в общую процедуру для предотвращения рецидивирующий AF. Это в первую очередь обеспечивается за счет изоляции легочных вен, вероятно, требующих полной изоляции для полной эффективности, и дополнительные абляции в задние стенки левого предсердий. AF абляции, при в опытных центрах надлежащим образом подготовленных групп, является более эффективным, чем антиаритмические лекарственной терапии в деле поддержания синусового ритма, а процент осложнений, хотя и не незначительный, похож на процент осложнений для антиаритмических препаратов.
11.3.1 Показания
Катетерная абляция AF является эффективным в деле восстановления и поддержания синусового ритма у больных с симптоматическим пароксизмальная, стойкие и вероятно давно стойких AF, в целом, как второй линии лечения после неэффективности или непереносимости к антиаритмической лекарственной терапии. У таких пациентов катетерная абляция является более эффективным, чем антиаритмическая лекарственная терапия. В качестве первой линии лечения пароксизмальной AF рандомизированные клинические испытания показали лишь скромное улучшение ритма при катетерной аблации, по сравнению с антиаритмическиой лекарственной терапией. Осложнения были похожи, когда абляция выполнялась в экспертных центрах, обосновывая катетерную абляцию в качестве первой линии терапии у отдельных пациентов с пароксизмальной AF, которые показана инвазивная терапия. Небольшое количество данных в доступных отчетах по эффективности и безопасности катетерной абляция у пациентов со стойкими или давние стойких AF, на все точки более низких показателей рецидивов после катетерной абляция, по сравнению с антиаритмические лекарственной терапии или без кардиоверсии (веб-рис. 2). У пациентов, которые испытывают симптоматическая рецидивы AF несмотря на антиаритмические лекарственной терапии все РКИ показали лучший контроль синусового ритма при катетерной аблации чем на антиаритмические препараты. Нет никаких текущих указаний по катетерной абляция по предотвращению сердечно-сосудистые событий (или желаемый отход от антикоагуляции) или уменьшить госпитализации.
11.3.2 Методы и технологии
Полная изоляция (PVI) легочной вены на предсердном уровне является наиболее документированной мишенью для катетерной абляция, достижимой по пунктам радиочастотной абляция, линейные разрезы обводящие легочные вены или криобаллонная абляция с аналогичными результатами. Полная изоляция легочных вен имеет лучший результаты по контролю ритма, чем неполной изоляции. PVI первоначально был испытан у больных с пароксизмальной AF, но как представляется, не уступает более обширной абляции при стойких AF. Более обширные аблаций были использованы в пациентах со стойкими AF, но есть еще недостаточно данных для использования их в настоящее время. Расширенные абляции процедуры (помимо PVI) постоянно требуют более длительной по времени процедуры и более мощных источников ионизирующего излучения, потенциально создавая риск для пациентов. Левожелудочковые реентерные тахикардии встречаются сравнительно редко после PVI (≈5%). Это также является редким после криобаллонной абляции, но это может произойти у до 25% пациентов после модифицированной абляции левого предсердия, часто из-за неполной абляции проводящих путей. Таким образом для пациентов с стойких AF, абляции комплекса фракционированных электрограмм, абляции узлов или обычного пересечения проводящих путей или других дополнительных аблаций не представляется оправданной при первой процедуре. Однако дополнительные абляции на верхушке PVI могут быть рассмотрены в больных с рецидивирующий AF после процедуры первоначальной абляции. У пациентов с документально подтвержденной право предсердной истмус- зависимых преходящих AF абляции рекомендуется право предсердная абляция перешейка(истмуса). Аденозин, применяемый для тестирования выявления пациентов, нуждающихся в дополнительных абляции, остается спорным после оценки в нескольких докладах. Абляция так называемых «роторов» (узлов), проецируемая на поверхность тела или карту поверхности эндокарда, находится в стадии оценки и не может быть рекомендована для обычного клинического использования в настоящее время.
11.3.3 Результаты и осложнения
11.3.3.1 Результаты катетерной абляция для фибрилляции предсердий
Результаты восстановления ритма после катетерной абляция AF трудно предсказать, у отдельных пациентов. Большинство пациентов требуют более одной процедуры для обеспечения контроля симптомов. В общем лучшие результаты и меньшее число осложнений, связанных с процедурой можно ожидать у молодых пациентов с короткой историей AF и частыми, короткими эпизодами AF при отсутствии значительных структурных сердечных заболеваний. Катетерная абляция является более эффективным, чем антиаритмические лекарственной терапии в деле поддержания синусового ритма (веб-рис. 2). Синусовый ритм без выраженных симптомов рецидивирования AF отмечается у до 70% больных с пароксизмальной AF и около 50% при постоянных AF. Очень поздний рецидив AF после многих лет синусовый ритм не является редкостью и может отражать развитие болезни с важными последствиями для продолжения терапии AF. Несколько переменных были определены в качестве факторов риска рецидива после катетерная абляция AF, но их прогностической сила является слабой. Решение для выполнения катетерной абляции, таким образом, должно основываться на общем процессе принятия решений747 (см. гл. 8), после тщательное объяснение потенциальных выгод и рисков и альтернатив, таких как антиаритмические препараты или принятие текущих симптомов без терапии контроля ритма .
11.3.3.2 Осложнения катетерной абляции при фибрилляции предсердий
Существует явная необходимость систематического выявления осложнений в клинической практике для повышения качества процедур AF абляции. Средняя продолжительность пребывания в стационаре у AF пациентов, перенесших их первую абляцию в рамках EURObservational Research Programme (EORP), 3 дня (межквартильный диапазон 2 – 4 дня), на основе данных из 1391 пациентов из больниц, выполняющих 50 аблаций в год. 5 – 7 процентов пациентов будут иметь тяжелые осложнения после катетерной абляции AF, и 2 – 3% будут испытывать угрозу для жизни, но обычно с осложнениями, поддающимися лечению. Оl смерти во время процедуры сообщалось, но редко (< 0,2%). Наиболее важными тяжелыми осложнениями являются инсульт/TIA (<1%), тампонада сердца (1 – 2%), стеноз легочной вены и тяжелой травмы пищевода, ведущих к предсердно- пищеводным свищам в течении недели после абляции (Таблица 18). «Silent strokes» (немые инсульты) (то есть поражения белого вещества мозга обнаруживаемая МРТ) наблюдались в примерно 10% пациентов, получавших радиочастотных и криобаллонные абляции. Клиническое значение этого наблюдения является неясным. После процедуры, осложнения включают инсульт, с высоким риском в течение первой недели, поздняя тампонада перикарда через несколько дней после катетерной абляция и свищи пищевода, которые обычно становятся очевидными через 7-30 дней после абляции. Своевременное выявление предсердно- пищеводных свищей может быть спасением жизни и должны основываться на типичной триаде инфекции без четкой локализации, загрудинной боли и инсульта или ТИА.
Таблица 18
Осложнения, связанные с катетерной абляцией фибрилляции предсердий
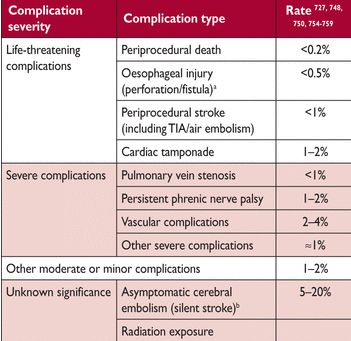 TIA =преходящие ишемические атаки.
A Свищи пищевода следует подозревать, в больных с триадой неспецифических признаков инфекции, боль в груди и инсульта или TIA в первые недели после процедуры аблации. Они требует немедленного лечения.
B < 10% для криобаллонной или радиочастотная абляция, > 20% для поэтапного радиочастотная абляция.
11.3.4 Антикоагуляция: до, во время и после аблации
Антикоагуляция пациентов с VKAs должна продолжаться при абляции (с INR 2 – 3). Антикоагуляция с NOACs является альтернативой для варфарина. Нет информации о безопасности при наблюдении когорт, при лечении с непрерывной NOAC терапией, переживших катетерную абляция в квалифицированных центрах. Во время абляции, гепарин следует поддерживать активированное время свертывания> 300 с. антикоагуляцию следует сохранить по крайней мере 8 недель после абляции для всех пациентов. Истинное число измерители тромбоэмболические события после катетерной абляция никогда не были изучены систематически и риск ожидаемого инсульта был принят в когорте non аблация AF. В отсутствие контролируемых испытаний данных ОАС после катетерная абляция должны следовать общим антисвертывающим рекомендации, вне зависимости от исхода предполагаемого ритма.
11.3.5 Абляция фибрилляции предсердий у пациентов с сердечной недостаточностью
Катетерная абляция, по сравнению с терапией амиодарона, значительно снижает рецидивирующий AF у AF пациентов с HFrEF. У пациентов с HFrEF и AF можно добиться восстановления систолической функции ЛЖ после катетерной абляции (вероятно в связи с тахикардиомиопатией). Несколько небольших испытаний показывают улучшение функции ЛЖ после катетерная абляция в HFrEF пациентов и снижение госпитализаций, особенно у пациентов без предыдущего инфаркта миокарда. Более крупные испытания требуются для подтверждения этих результатов. Катетерная абляция может потребовать у этих пациентов. Таким образом показания к катетерная абляция у HFrEF пациентов должны быть тщательно сбалансированы, и процедуры выполняются в специализированных центрах.
11.3.6 Последующие мероприятия после катетерной абляции
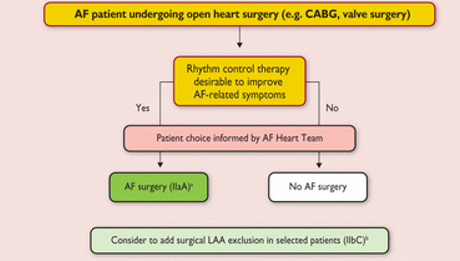
Пациенты и врачи участвующие в наблюдении после катетерной абляция должны знать признаки и симптомы поздних осложнений, чтобы позволить быстрое направления на лечение (таблица 18). Пациенты также должны знать, что возможны симптоматические, так и бессимптомные AF рецидивы частые после катетерной аблации. В соответствии с основной целью контроля терапии ритма бессимптомная эпизоды вообще не должно спровоцировать дальнейшее назначение ритм контроля терапии при рутинной медицинской помощи. Пациенты должны осматриваться по крайней мере один раз специалистом аритмологом в первые 12 месяцев после абляции. Следует рассматривать дальнейшие варианты контроля ритма у больных с симптоматическими рецидивами, включая обсуждение в команде Heart Team (рис. 17, рис. 19).
11.4 хирургическое лечении ФП
11.4.1 Дополнительное хирургическое лечение ФП
Процедура лабиринт Кокс впервые была проведена 30 лет назад как «вырезать и шить» (‘cut-and-sew’) техника, включает изоляции заднюю часть левого предсердия, соединение к задней части митрального кольца, кавотрикуспидального истмуса, кавокавальное соединение и исключение LAA (рисунок 18). Таким образом процедура лабиринт Кокс создает электрический лабиринт проходов, через которые импульсы синоатриального узла находит маршрут к атриовентрикулярному узлу предотвращая фибриляторную кондукцию. Кокс лабиринт процедуры и другие, часто проще, формы хирургии AF использовались, главным образом, у пациентов, перенесших другие открытые сердца хирургические процедуры. В систематический обзор, для этих руководящих принципов выполняя сопутствующие операции AF повлекло за собой расширение свободы от AF, трепетания предсердий, предсердная тахикардия, по сравнению с пациентами без сопутствующей хирургии AF (ОР 1.94; 95% ДИ 1,51 – 2,49; n = 554 из семи РКИ) (веб-рис. 3). Пациенты, перенесшие Кокс лабиринт процедура требует вживления водителя ритма чаще (ОР 1,69; 95% ДИ 1,12 – 2,54; n = 1631 от 17 РКИ), без обнаруживаемая разницы в других результатов или осложнений. Эти выводы подкрепляются анализ базы данных общества торакальных хирургов, включающей 67 389 пациентов AF, перенесших операцию на открытом сердце: смертности и тяжелой заболеваемости не зависит от сопутствующей хирургии AF (скорректированное или 1,00; 95% ДИ 0,83 – 1,20), но вживления водителя ритма было более частым (скорректированное или 1,26; 95% ДИ 1,07-1,49). Предикторы AF рецидивов после операции включают дилатацию левого предсердий, пожилой возраст, > 10-летнюю историю AF и non пароксизмальная AF. Что касается типа AF хирургические PVI кажется эффективным в пароксизмальная AF. Бипредсердная хирургия может быть более эффективными в постоянных и давние стойких AF. Предлагаемое управление симптомами,у пациентов связанных с AF, включает хирургию сердца отображается на рисунке 19, является важным вкладом команды AF Heart Team для консультирования и информирования пациентов по выбору лечения.
Рисунок 18
TIA =преходящие ишемические атаки.
A Свищи пищевода следует подозревать, в больных с триадой неспецифических признаков инфекции, боль в груди и инсульта или TIA в первые недели после процедуры аблации. Они требует немедленного лечения.
B < 10% для криобаллонной или радиочастотная абляция, > 20% для поэтапного радиочастотная абляция.
11.3.4 Антикоагуляция: до, во время и после аблации
Антикоагуляция пациентов с VKAs должна продолжаться при абляции (с INR 2 – 3). Антикоагуляция с NOACs является альтернативой для варфарина. Нет информации о безопасности при наблюдении когорт, при лечении с непрерывной NOAC терапией, переживших катетерную абляция в квалифицированных центрах. Во время абляции, гепарин следует поддерживать активированное время свертывания> 300 с. антикоагуляцию следует сохранить по крайней мере 8 недель после абляции для всех пациентов. Истинное число измерители тромбоэмболические события после катетерной абляция никогда не были изучены систематически и риск ожидаемого инсульта был принят в когорте non аблация AF. В отсутствие контролируемых испытаний данных ОАС после катетерная абляция должны следовать общим антисвертывающим рекомендации, вне зависимости от исхода предполагаемого ритма.
11.3.5 Абляция фибрилляции предсердий у пациентов с сердечной недостаточностью
Катетерная абляция, по сравнению с терапией амиодарона, значительно снижает рецидивирующий AF у AF пациентов с HFrEF. У пациентов с HFrEF и AF можно добиться восстановления систолической функции ЛЖ после катетерной абляции (вероятно в связи с тахикардиомиопатией). Несколько небольших испытаний показывают улучшение функции ЛЖ после катетерная абляция в HFrEF пациентов и снижение госпитализаций, особенно у пациентов без предыдущего инфаркта миокарда. Более крупные испытания требуются для подтверждения этих результатов. Катетерная абляция может потребовать у этих пациентов. Таким образом показания к катетерная абляция у HFrEF пациентов должны быть тщательно сбалансированы, и процедуры выполняются в специализированных центрах.
11.3.6 Последующие мероприятия после катетерной абляции
Пациенты и врачи участвующие в наблюдении после катетерной абляция должны знать признаки и симптомы поздних осложнений, чтобы позволить быстрое направления на лечение (таблица 18). Пациенты также должны знать, что возможны симптоматические, так и бессимптомные AF рецидивы частые после катетерной аблации. В соответствии с основной целью контроля терапии ритма бессимптомная эпизоды вообще не должно спровоцировать дальнейшее назначение ритм контроля терапии при рутинной медицинской помощи. Пациенты должны осматриваться по крайней мере один раз специалистом аритмологом в первые 12 месяцев после абляции. Следует рассматривать дальнейшие варианты контроля ритма у больных с симптоматическими рецидивами, включая обсуждение в команде Heart Team (рис. 17, рис. 19).
11.4 хирургическое лечении ФП
11.4.1 Дополнительное хирургическое лечение ФП
Процедура лабиринт Кокс впервые была проведена 30 лет назад как «вырезать и шить» (‘cut-and-sew’) техника, включает изоляции заднюю часть левого предсердия, соединение к задней части митрального кольца, кавотрикуспидального истмуса, кавокавальное соединение и исключение LAA (рисунок 18). Таким образом процедура лабиринт Кокс создает электрический лабиринт проходов, через которые импульсы синоатриального узла находит маршрут к атриовентрикулярному узлу предотвращая фибриляторную кондукцию. Кокс лабиринт процедуры и другие, часто проще, формы хирургии AF использовались, главным образом, у пациентов, перенесших другие открытые сердца хирургические процедуры. В систематический обзор, для этих руководящих принципов выполняя сопутствующие операции AF повлекло за собой расширение свободы от AF, трепетания предсердий, предсердная тахикардия, по сравнению с пациентами без сопутствующей хирургии AF (ОР 1.94; 95% ДИ 1,51 – 2,49; n = 554 из семи РКИ) (веб-рис. 3). Пациенты, перенесшие Кокс лабиринт процедура требует вживления водителя ритма чаще (ОР 1,69; 95% ДИ 1,12 – 2,54; n = 1631 от 17 РКИ), без обнаруживаемая разницы в других результатов или осложнений. Эти выводы подкрепляются анализ базы данных общества торакальных хирургов, включающей 67 389 пациентов AF, перенесших операцию на открытом сердце: смертности и тяжелой заболеваемости не зависит от сопутствующей хирургии AF (скорректированное или 1,00; 95% ДИ 0,83 – 1,20), но вживления водителя ритма было более частым (скорректированное или 1,26; 95% ДИ 1,07-1,49). Предикторы AF рецидивов после операции включают дилатацию левого предсердий, пожилой возраст, > 10-летнюю историю AF и non пароксизмальная AF. Что касается типа AF хирургические PVI кажется эффективным в пароксизмальная AF. Бипредсердная хирургия может быть более эффективными в постоянных и давние стойких AF. Предлагаемое управление симптомами,у пациентов связанных с AF, включает хирургию сердца отображается на рисунке 19, является важным вкладом команды AF Heart Team для консультирования и информирования пациентов по выбору лечения.
Рисунок 18
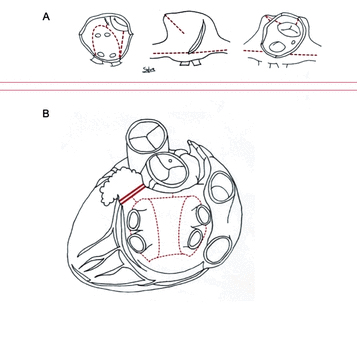 А: хирургические подходы для билатеральной процедуры лабиринт кокса. Хирургические левопредсердные разрезы показаны (левая панель) и правопредсердные разрезы (средняя и правая панель). Б: левопредсердный разрез при торакоскопической минимальной инвазивной хирургической процедура (пунктирные линии), включая выключение придатка левого предсердия (двойная линия).
Рисунок 19
А: хирургические подходы для билатеральной процедуры лабиринт кокса. Хирургические левопредсердные разрезы показаны (левая панель) и правопредсердные разрезы (средняя и правая панель). Б: левопредсердный разрез при торакоскопической минимальной инвазивной хирургической процедура (пунктирные линии), включая выключение придатка левого предсердия (двойная линия).
Рисунок 19
 Хирургический контроль ритма у больных с мерцательной аритмией, прошедших кардиохирургическое лечение
11.4.2 Автономный хирургический контроль ритма
Современные технологии (например, биполярный радиочастотный или криотерапия) делает Кокс лабиринт процедуру легче и более воспроизводимой, и практически осуществимой, через мини-торакотомия. Торакоскопическая PVI с биполярной радиочастоты предотвращает повторение пароксизмальная AF (69 – 91% без аритмий в течении 1 год, см. рисунок 18B для линий разреза) и, кажется, эффективен у пациентов, рефрактернных к катетерной аблации. Средняя продолжительность пребывания в больнице для торакоскопическая абляции варьируется от 3,6 до 6,0 дней. В исследовании FAST (Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment) и более мелких, высказано предположение о том, что операции торакоскопическая AF может быть более эффективным, чем Катетерная абляция для поддержания синусового ритма, но а также вызывает больше осложнений (Таблица 19). Для улучшения результатов, предлагаются более обширные разрезы, включая соединительные линии между PVI («box разрезы») (“box lesion”) и линии к митральному кольцу. Для улучшения модели Трансмуральных разрезов, недавно были предложены стратегии Эндо- эпикардиальной абляции. Хотя предварительный опыт работы с гибридной одновремоментной абляции выглядит т обещающим, время операции и число геморрагических осложнений выше.
Таблица 19
Осложнения торакоскопической хирургии фибрилляции предсердий
Хирургический контроль ритма у больных с мерцательной аритмией, прошедших кардиохирургическое лечение
11.4.2 Автономный хирургический контроль ритма
Современные технологии (например, биполярный радиочастотный или криотерапия) делает Кокс лабиринт процедуру легче и более воспроизводимой, и практически осуществимой, через мини-торакотомия. Торакоскопическая PVI с биполярной радиочастоты предотвращает повторение пароксизмальная AF (69 – 91% без аритмий в течении 1 год, см. рисунок 18B для линий разреза) и, кажется, эффективен у пациентов, рефрактернных к катетерной аблации. Средняя продолжительность пребывания в больнице для торакоскопическая абляции варьируется от 3,6 до 6,0 дней. В исследовании FAST (Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment) и более мелких, высказано предположение о том, что операции торакоскопическая AF может быть более эффективным, чем Катетерная абляция для поддержания синусового ритма, но а также вызывает больше осложнений (Таблица 19). Для улучшения результатов, предлагаются более обширные разрезы, включая соединительные линии между PVI («box разрезы») (“box lesion”) и линии к митральному кольцу. Для улучшения модели Трансмуральных разрезов, недавно были предложены стратегии Эндо- эпикардиальной абляции. Хотя предварительный опыт работы с гибридной одновремоментной абляции выглядит т обещающим, время операции и число геморрагических осложнений выше.
Таблица 19
Осложнения торакоскопической хирургии фибрилляции предсердий
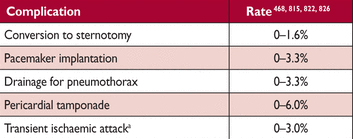 a Скорость бессимптомной церебральной эмболии неизвестна.
11.5 Выбор контроля ритма после неудачного лечения
Нет достаточных доказательств, лежащих в основе четких рекомендаций о том, как лечить пациентов с рецидивирующий AF после катетерной аблации. Ранние рецидивы AF или предсердная тахикардия после абляции (происходит в течение 8 недель) можно лечить кардиоверсией. Многие из опубликованных данных по пациентам, перенесших AF абляции включались те, у кого антиаритмическая лекарственная терапия была неэффективна. Таким образом применение абляции у пациентов, которые имеют симптоматические рецидивы на фоне антиаритмической лекарственной терапии, часто является разумным. Кроме того, в качестве альтернативы можно считать назначение другого антиаритмического препарата. Сочетание антиаритмические препарат с абляции («гибридная терапия», см. главу 12) следует рассматривать на основе различных и возможно синергического воздействия этих препаратов с AF абляции, с возможным положительным эффектом у пациентов, у которых однокомпонентное лечение было ранее неэффективным. Контроль ЧСС без контроля ритма, хирургическая аблация , или повторная Катетерная абляция так же следует рассматривать как вариант (рис. 20). Предпочтения пациента и доступ к терапии являются важными факторами для информирования по выбору терапии у пациентов, которые нуждаются в дальнейшем ритм контроля терапии после неудачи начальной терапии.
Рисунок 20
Выбор терапии контроля ритма после неудачного лечения.
a Скорость бессимптомной церебральной эмболии неизвестна.
11.5 Выбор контроля ритма после неудачного лечения
Нет достаточных доказательств, лежащих в основе четких рекомендаций о том, как лечить пациентов с рецидивирующий AF после катетерной аблации. Ранние рецидивы AF или предсердная тахикардия после абляции (происходит в течение 8 недель) можно лечить кардиоверсией. Многие из опубликованных данных по пациентам, перенесших AF абляции включались те, у кого антиаритмическая лекарственная терапия была неэффективна. Таким образом применение абляции у пациентов, которые имеют симптоматические рецидивы на фоне антиаритмической лекарственной терапии, часто является разумным. Кроме того, в качестве альтернативы можно считать назначение другого антиаритмического препарата. Сочетание антиаритмические препарат с абляции («гибридная терапия», см. главу 12) следует рассматривать на основе различных и возможно синергического воздействия этих препаратов с AF абляции, с возможным положительным эффектом у пациентов, у которых однокомпонентное лечение было ранее неэффективным. Контроль ЧСС без контроля ритма, хирургическая аблация , или повторная Катетерная абляция так же следует рассматривать как вариант (рис. 20). Предпочтения пациента и доступ к терапии являются важными факторами для информирования по выбору терапии у пациентов, которые нуждаются в дальнейшем ритм контроля терапии после неудачи начальной терапии.
Рисунок 20
Выбор терапии контроля ритма после неудачного лечения.
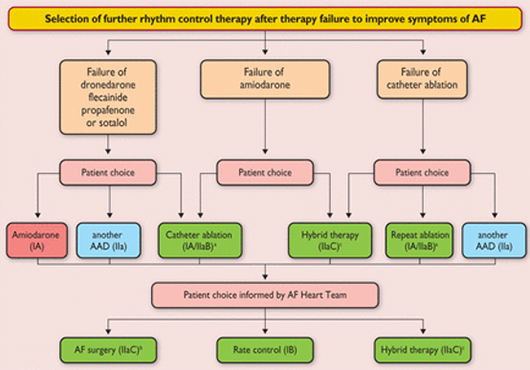 11.6 Группа по ФП
С учетом сложности лечения различных вариантов в пациентах с неудачной ритм контроля терапией , которые по-прежнему необходима или требуется дальнейший контроль ритма, эта Целевая группа предлагает, что решения, связанные с AF хирургии или обширные AF абляции должны основываться на советы от команды AF Heart Team.. Это также относится к полной перемене стратегии контроля у больных с тяжелой симптомами AF (EHRA III или IV). AF сердце команда должна состоять из кардиолога с опытом антиаритмической лекарственной терапии, интервенционного электрофизиолога и кардиохирурга с опытом соответствующего отбора пациентов, методов и технологий для интервенционных или хирургической аблации AF (рис. 20). Такие команды сердца AF — и совместная инфраструктура , поддерживающей постоянное взаимодействие между врачами наблюдающих пациентов, AF кардиологов, интервенционных электрофизиологов и AF хирургов — следует создать для предоставления оптимальных консультаций, и в конечном итоге улучшить ритм исходы для пациентов которым показаны передовые и сложных ритм мероприятий.
Рекомендации по катетерной абляции фибрилляции предсердий и хирургии фибрилляции предсердий
11.6 Группа по ФП
С учетом сложности лечения различных вариантов в пациентах с неудачной ритм контроля терапией , которые по-прежнему необходима или требуется дальнейший контроль ритма, эта Целевая группа предлагает, что решения, связанные с AF хирургии или обширные AF абляции должны основываться на советы от команды AF Heart Team.. Это также относится к полной перемене стратегии контроля у больных с тяжелой симптомами AF (EHRA III или IV). AF сердце команда должна состоять из кардиолога с опытом антиаритмической лекарственной терапии, интервенционного электрофизиолога и кардиохирурга с опытом соответствующего отбора пациентов, методов и технологий для интервенционных или хирургической аблации AF (рис. 20). Такие команды сердца AF — и совместная инфраструктура , поддерживающей постоянное взаимодействие между врачами наблюдающих пациентов, AF кардиологов, интервенционных электрофизиологов и AF хирургов — следует создать для предоставления оптимальных консультаций, и в конечном итоге улучшить ритм исходы для пациентов которым показаны передовые и сложных ритм мероприятий.
Рекомендации по катетерной абляции фибрилляции предсердий и хирургии фибрилляции предсердий
 AF = фибрилляция предсердий; VT = желудочковая тахикардия.
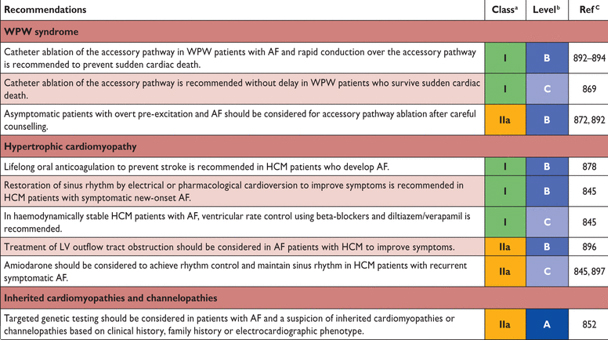
13.2.1 Вольф – Паркинсона – Уайта синдром
Пациенты с предварительно возбуждением и AF подвергаются риску быстрой проводимости через дополнительные пути проведения что приводит к желудочковой тахикардии, возможному трепетанию желудочков и внезапной смерти. У AF пациентов с признаками антеградных путей проведения рекомендуется использовать Катетерную абляция дополнительных путей проведения. Эта процедура является безопасной и эффективной и может рассматриваться в качестве стратегии профилактического лечения. У AF пациентов, выживших после внезапной смерти событие с очевидным наличием дополнительных путей проведения, рекомендуется срочно катетерная абляция дополнительных путей. А документально зарегистрированные короткие интервалы предварительного возбужденных RR (< 250 мс) во время самопроизвольной или индуцированной AF является одним из маркеров риска внезапной смерти при синдроме (WPW) Вольфа-Паркинсона-Уайта, в дополнение к анамнезу с симптоматическими тахикардиями, наличие дополнительных путей проведения и аномалией Эбштейна. Внутривенной прокаинамид, пропафенон или аджмалин может использоваться при остро возникшей желудочковой брадикардии, в то время как дигоксин, верапамил и Дилтиазем противопоказаны. Внутривенной амиодарона следует использовать с осторожностью, так как описаны случаи ускоренного желудочкового ритма и фибрилляция предсердий у пациентов с предварительно возбуждением AF, получавших внутривенную инфузию амиодарона.
13.2.2 Гипертрофическая кардиомиопатия
AF является наиболее распространенной аритмией у больных с гипертрофической кардиомиопатией, затрагивающих примерно одной четверти населения. Данные наблюдений подчеркивают риск высокого инсульта у больных гипертрофической кардиомиопатией с AF, подтверждающие необходимость в ОАС. Хотя нет большого опыта применения VKAs, нет и данных полагать, что NOACs нельзя использовать у этих пациентов. Исследований по контролю ЧСС или ритма у больных с гипертрофической кардиомиопатией относительно редко. Бета-блокаторы и Дилтиазем или верапамил кажутся разумные методы лечения для контроля ЧСС у этих пациентов. При отсутствие значительной обструкции оттока тракта ЛЖ дигоксин может использоваться самостоятельно или в комбинации с бета-блокаторами. Амиодарон кажется безопасным препаратом при AF пациентов с гипертрофической кардиомиопатией, и экспертное заключение свидетельствует о том, что disopyramide(дизопирамид) может быть полезным при обструкции выносящего тракта. AF абляции является эффективным для подавления рецидивирования симптоматической AF. Хирургическое лечение AF может быть уместным в больных с гипертрофической кардиомиопатией, перенесших операцию (например, при обструкции выносящего тракта ЛЖ или операции на митральном клапане), но опыт носит ограниченный характер.
13.2.3 3 Каналлопатии и аритмогенные кардиомиопатии правого желудочка
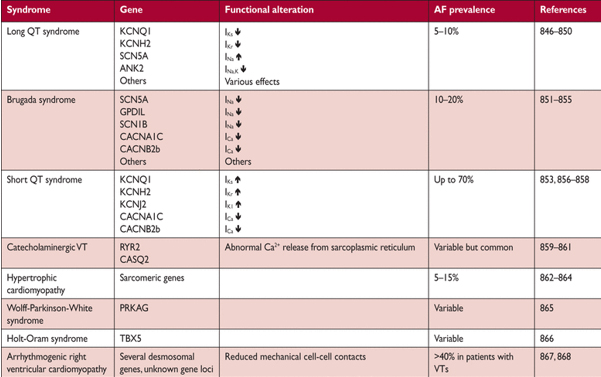
Многие каналопатии и унаследованные кардиомиопатии связаны с AF. AF распространенность колеблется от 5 – 20% больных с синдромом удлинения QT или синдром Бругада и до 70% в синдром короткого интервала QT (Таблица 20). Пенетрантностью (частота или вероятность проявления гена) фенотипа болезни, включая AF является вариабельной. В обоих случаях, как укорочение, так и удлинение потенциала действия желудочков были продемонстрированы как вероятно, лежащие в основе AF при этих заболеваниях. Представляется целесообразным рассмотреть антиаритмические препараты, которые уменьшают предполагаемого канальцевый дефект у AF пациентов с наследственной кардиомиопатии (например, блокатор натрия канала в LQT3, или хинидин при синдроме Бругада). Для предотвращения возникновения AF у молодых, у здоровых людей должны проводиться тщательный поиск таких наследственных факторов, включая клинической истории, истории семьи, ЭКГ фенотип и эхокардиография и/или других кардиологические исследования.
Моногенные дефекты составляют только 3-5% всех пациентов с AF, даже в более молодых группах населения. Кроме того, нет никакой четкой связи между обнаруженными мутации, конкретных результатов или клинических проявлений. По этим причинам генетическое тестирование не рекомендуется в целом AF. Другие руководящие принципы описывают показания для генетического тестирования у больных с заболеваниями унаследованных Аритмогенное.
Рекомендации для наследственных кардиомиопатий
AF = фибрилляция предсердий; VT = желудочковая тахикардия.
13.2.1 Вольф – Паркинсона – Уайта синдром
Пациенты с предварительно возбуждением и AF подвергаются риску быстрой проводимости через дополнительные пути проведения что приводит к желудочковой тахикардии, возможному трепетанию желудочков и внезапной смерти. У AF пациентов с признаками антеградных путей проведения рекомендуется использовать Катетерную абляция дополнительных путей проведения. Эта процедура является безопасной и эффективной и может рассматриваться в качестве стратегии профилактического лечения. У AF пациентов, выживших после внезапной смерти событие с очевидным наличием дополнительных путей проведения, рекомендуется срочно катетерная абляция дополнительных путей. А документально зарегистрированные короткие интервалы предварительного возбужденных RR (< 250 мс) во время самопроизвольной или индуцированной AF является одним из маркеров риска внезапной смерти при синдроме (WPW) Вольфа-Паркинсона-Уайта, в дополнение к анамнезу с симптоматическими тахикардиями, наличие дополнительных путей проведения и аномалией Эбштейна. Внутривенной прокаинамид, пропафенон или аджмалин может использоваться при остро возникшей желудочковой брадикардии, в то время как дигоксин, верапамил и Дилтиазем противопоказаны. Внутривенной амиодарона следует использовать с осторожностью, так как описаны случаи ускоренного желудочкового ритма и фибрилляция предсердий у пациентов с предварительно возбуждением AF, получавших внутривенную инфузию амиодарона.
13.2.2 Гипертрофическая кардиомиопатия
AF является наиболее распространенной аритмией у больных с гипертрофической кардиомиопатией, затрагивающих примерно одной четверти населения. Данные наблюдений подчеркивают риск высокого инсульта у больных гипертрофической кардиомиопатией с AF, подтверждающие необходимость в ОАС. Хотя нет большого опыта применения VKAs, нет и данных полагать, что NOACs нельзя использовать у этих пациентов. Исследований по контролю ЧСС или ритма у больных с гипертрофической кардиомиопатией относительно редко. Бета-блокаторы и Дилтиазем или верапамил кажутся разумные методы лечения для контроля ЧСС у этих пациентов. При отсутствие значительной обструкции оттока тракта ЛЖ дигоксин может использоваться самостоятельно или в комбинации с бета-блокаторами. Амиодарон кажется безопасным препаратом при AF пациентов с гипертрофической кардиомиопатией, и экспертное заключение свидетельствует о том, что disopyramide(дизопирамид) может быть полезным при обструкции выносящего тракта. AF абляции является эффективным для подавления рецидивирования симптоматической AF. Хирургическое лечение AF может быть уместным в больных с гипертрофической кардиомиопатией, перенесших операцию (например, при обструкции выносящего тракта ЛЖ или операции на митральном клапане), но опыт носит ограниченный характер.
13.2.3 3 Каналлопатии и аритмогенные кардиомиопатии правого желудочка
Многие каналопатии и унаследованные кардиомиопатии связаны с AF. AF распространенность колеблется от 5 – 20% больных с синдромом удлинения QT или синдром Бругада и до 70% в синдром короткого интервала QT (Таблица 20). Пенетрантностью (частота или вероятность проявления гена) фенотипа болезни, включая AF является вариабельной. В обоих случаях, как укорочение, так и удлинение потенциала действия желудочков были продемонстрированы как вероятно, лежащие в основе AF при этих заболеваниях. Представляется целесообразным рассмотреть антиаритмические препараты, которые уменьшают предполагаемого канальцевый дефект у AF пациентов с наследственной кардиомиопатии (например, блокатор натрия канала в LQT3, или хинидин при синдроме Бругада). Для предотвращения возникновения AF у молодых, у здоровых людей должны проводиться тщательный поиск таких наследственных факторов, включая клинической истории, истории семьи, ЭКГ фенотип и эхокардиография и/или других кардиологические исследования.
Моногенные дефекты составляют только 3-5% всех пациентов с AF, даже в более молодых группах населения. Кроме того, нет никакой четкой связи между обнаруженными мутации, конкретных результатов или клинических проявлений. По этим причинам генетическое тестирование не рекомендуется в целом AF. Другие руководящие принципы описывают показания для генетического тестирования у больных с заболеваниями унаследованных Аритмогенное.
Рекомендации для наследственных кардиомиопатий
 AF = фибрилляция предсердий; HCM = гипертрофической кардиомиопатии; LV = левый желудочек; WPW = синдром Вольфа-Паркинсона-Уайта.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.3 Спорт и фибрилляция предсердий
Физическая активность улучшает здоровье сердечно-сосудистой системы, что означает более низкий риск AF. Таким образом физическая активность является краеугольным камнем предотвращения AF. Интенсивная спортивная нагрузка, особенно способность переносить интенсивные спортивные нагрузки (> 1500 h спортивной физической нагрузки), увеличивает риск AF с возрастом, вероятно, опосредовано изменяя состояние вегетативного фона, объем нагрузки во время тренировок, гипертрофию желудочков и дилатации. Это приводит к в U-образная взаимосвязь физической активности и инцидента AF. Детренеровка может уменьшить AF на моделях и уменьшает желудочковых аритмии у спортсменов, но роль летренерованности при AF у спортсменов неизвестна. Подходы к спортсменам с AF похожи на общий контроль AF, но требует несколько специальных соображений. Клинические факторы риска будут определять потребность в антикоагуляции. Спорт с прямым физическим контактом или повышенным травматизмом следует избегать у пациентов на ОАС. Бета-блокаторы не хорошо переносится и порой запрещены, и дигоксина, верапамил и Дилтиазем часто не являются достаточно мощными, чтобы контролировать (замедлять) пульс во время физического напряжения при AF. Катетерная абляция для AF, вероятно, имеет аналогичные результаты в спортсменов, как и не у спортсменов, но необходимы дополнительные данные. «Pill-in-the-pocket therapy» Таблетки в кармане- терапия используется также. После употребления флекаинид или пропафенон как «карманных таблеток» пациенты должны воздерживаться от спорта до тех пор, пока сохраняется AF и до истечения 2-х периодов полувыведения антиаритмических лекарства. Профилактическое абляция дополнительных путей проведения может быть рассмотрены у спортсменов, получавших блокаторы каналов натрия.
AF = фибрилляция предсердий; HCM = гипертрофической кардиомиопатии; LV = левый желудочек; WPW = синдром Вольфа-Паркинсона-Уайта.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.3 Спорт и фибрилляция предсердий
Физическая активность улучшает здоровье сердечно-сосудистой системы, что означает более низкий риск AF. Таким образом физическая активность является краеугольным камнем предотвращения AF. Интенсивная спортивная нагрузка, особенно способность переносить интенсивные спортивные нагрузки (> 1500 h спортивной физической нагрузки), увеличивает риск AF с возрастом, вероятно, опосредовано изменяя состояние вегетативного фона, объем нагрузки во время тренировок, гипертрофию желудочков и дилатации. Это приводит к в U-образная взаимосвязь физической активности и инцидента AF. Детренеровка может уменьшить AF на моделях и уменьшает желудочковых аритмии у спортсменов, но роль летренерованности при AF у спортсменов неизвестна. Подходы к спортсменам с AF похожи на общий контроль AF, но требует несколько специальных соображений. Клинические факторы риска будут определять потребность в антикоагуляции. Спорт с прямым физическим контактом или повышенным травматизмом следует избегать у пациентов на ОАС. Бета-блокаторы не хорошо переносится и порой запрещены, и дигоксина, верапамил и Дилтиазем часто не являются достаточно мощными, чтобы контролировать (замедлять) пульс во время физического напряжения при AF. Катетерная абляция для AF, вероятно, имеет аналогичные результаты в спортсменов, как и не у спортсменов, но необходимы дополнительные данные. «Pill-in-the-pocket therapy» Таблетки в кармане- терапия используется также. После употребления флекаинид или пропафенон как «карманных таблеток» пациенты должны воздерживаться от спорта до тех пор, пока сохраняется AF и до истечения 2-х периодов полувыведения антиаритмических лекарства. Профилактическое абляция дополнительных путей проведения может быть рассмотрены у спортсменов, получавших блокаторы каналов натрия.
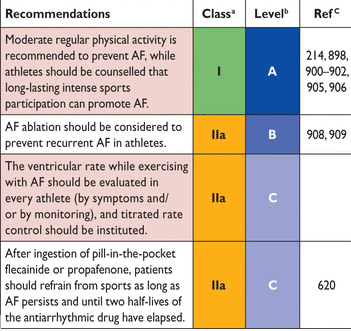 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по физической активности у больных с мерцательной аритмией
13.4 Беременность
AF у беременных женщин редко и обычно ассоциируется с уже существующими заболеваниями сердца. AF связано с повышенной осложнения для матери и плода. Лучшее лечение врожденных пороков сердца, вероятно, повышает возникновения AF во время беременности в будущем. Беременные женщины с AF следует вести как с высокой степенью риска беременности в тесном сотрудничестве с кардиологами, гинекологов и неонатологов.
13.4.1 Контроль частоты сердечных сокращений
Из-за отсутствия специфических данных, бета-блокаторы, верапамил, дилтиазем и дигоксин, все по классификации американского агентства FDA США для беременных по безопасности относятся к категории C (преимущества могут перевесить риск), за исключением Атенолол (Категория D: имеются доказательства риска). Их использование должно быть в низких дозах и коротким курсом. Ни один из агентов не обладает тератогенным действием, но они легко проникает через плаценту. Бета-блокаторы широко используются у беременных женщин с сердечно-сосудистых заболеваний (например, для управления артериальной гипертонией беременных и при преэклампсии), но может быть связано с задержкой внутриутробного развития, и таким образом после 20 недель беременности рекомендуется определять размеры плода. Дигоксин считается безопасным при аритмиях матери и плода. Недостаточно данных, чтобы комментировать Дилтиазем или верапамил, поэтому необходим контроль ЧСС с использованием бета-блокаторами и/или дигоксин. Что касается грудного вскармливания все прпараты по контролю ЧСС присутствует в грудном молоке, хотя уровень бета-блокаторов, дигоксина и верапамил являются слишком низкими, чтобы считаться вредными. Дилтиазем будет присутствовать на высоком уровне и должны рассматриваться препаратом второй линии лечения.
13.4. Контроль ритма
О контроле ритма терапии у беременных больных с AF сообщалось только в тематических исследованиях. Амиодарон связано с серьезными неблагоприятные фетальные побочными эффекты и должны рассматриваться только для чрезвычайных ситуаций. Флекаинид и соталол может использоваться для конверсии эмбриональных аритмий без основных побочных эффектов, и таким образом, вероятно, быть безопасными для лечения материнской симптоматическая AF. Электрическая кардиоверсия может быть эффективным для восстановления синусового ритма, когда тахиаритмия является причиной нестабильности гемодинамическими, с низкими показателями неблагоприятных исходов для матери и плода. Однако с учетом риска дистресса плода, Электрическая кардиоверсия следует выполнять только, где имеются возможности для фетальные мониторинга и возможности неотложного кесарева сечения. Как и при других чрезвычайных ситуациях во время беременности, пациенты должны получать 100% кислорода, внутривенный доступ должен быть создан как можно раньше, и мать должны быть расположены в левой боковой(латеральной) позиции для улучшения венозного возврата.
13.4.3 Антикоагуляция
VKAs следует избегать в первом триместре беременности из-за тератогенного воздействия и за 2-4 недель, до родов, чтобы избежать фетальные кровотечения. Низкий молекулярный вес гепаринов делает их безопасной субстанцией, поскольку они не проникают через плаценту. В третьем триместре беременности необходимы частые лабораторные анализы для контроля адекватной антикоагуляции (например, каждые 10-14 дней) и соответствующие корректировки дозы рекомендуется, учитывая, что в некоторых женщин высокие дозы VKA и гепарином могут быть необходимы для поддержания адекватной антикоагуляции. Беременных больных с AF и механических протезов клапанов, которые решили прекратить лечение VKA после консультации со своими специалистами между 6-12 недель беременности, должны получать непрерывный, коррегированную дозу т нефракционированного гепарина или коррегированную дозу гепарина низким молекулярным весом подкожно. Поскольку имеются лишь ограниченные данные о тератогенности NOACs, эти препараты следует избегать во время беременности.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по физической активности у больных с мерцательной аритмией
13.4 Беременность
AF у беременных женщин редко и обычно ассоциируется с уже существующими заболеваниями сердца. AF связано с повышенной осложнения для матери и плода. Лучшее лечение врожденных пороков сердца, вероятно, повышает возникновения AF во время беременности в будущем. Беременные женщины с AF следует вести как с высокой степенью риска беременности в тесном сотрудничестве с кардиологами, гинекологов и неонатологов.
13.4.1 Контроль частоты сердечных сокращений
Из-за отсутствия специфических данных, бета-блокаторы, верапамил, дилтиазем и дигоксин, все по классификации американского агентства FDA США для беременных по безопасности относятся к категории C (преимущества могут перевесить риск), за исключением Атенолол (Категория D: имеются доказательства риска). Их использование должно быть в низких дозах и коротким курсом. Ни один из агентов не обладает тератогенным действием, но они легко проникает через плаценту. Бета-блокаторы широко используются у беременных женщин с сердечно-сосудистых заболеваний (например, для управления артериальной гипертонией беременных и при преэклампсии), но может быть связано с задержкой внутриутробного развития, и таким образом после 20 недель беременности рекомендуется определять размеры плода. Дигоксин считается безопасным при аритмиях матери и плода. Недостаточно данных, чтобы комментировать Дилтиазем или верапамил, поэтому необходим контроль ЧСС с использованием бета-блокаторами и/или дигоксин. Что касается грудного вскармливания все прпараты по контролю ЧСС присутствует в грудном молоке, хотя уровень бета-блокаторов, дигоксина и верапамил являются слишком низкими, чтобы считаться вредными. Дилтиазем будет присутствовать на высоком уровне и должны рассматриваться препаратом второй линии лечения.
13.4. Контроль ритма
О контроле ритма терапии у беременных больных с AF сообщалось только в тематических исследованиях. Амиодарон связано с серьезными неблагоприятные фетальные побочными эффекты и должны рассматриваться только для чрезвычайных ситуаций. Флекаинид и соталол может использоваться для конверсии эмбриональных аритмий без основных побочных эффектов, и таким образом, вероятно, быть безопасными для лечения материнской симптоматическая AF. Электрическая кардиоверсия может быть эффективным для восстановления синусового ритма, когда тахиаритмия является причиной нестабильности гемодинамическими, с низкими показателями неблагоприятных исходов для матери и плода. Однако с учетом риска дистресса плода, Электрическая кардиоверсия следует выполнять только, где имеются возможности для фетальные мониторинга и возможности неотложного кесарева сечения. Как и при других чрезвычайных ситуациях во время беременности, пациенты должны получать 100% кислорода, внутривенный доступ должен быть создан как можно раньше, и мать должны быть расположены в левой боковой(латеральной) позиции для улучшения венозного возврата.
13.4.3 Антикоагуляция
VKAs следует избегать в первом триместре беременности из-за тератогенного воздействия и за 2-4 недель, до родов, чтобы избежать фетальные кровотечения. Низкий молекулярный вес гепаринов делает их безопасной субстанцией, поскольку они не проникают через плаценту. В третьем триместре беременности необходимы частые лабораторные анализы для контроля адекватной антикоагуляции (например, каждые 10-14 дней) и соответствующие корректировки дозы рекомендуется, учитывая, что в некоторых женщин высокие дозы VKA и гепарином могут быть необходимы для поддержания адекватной антикоагуляции. Беременных больных с AF и механических протезов клапанов, которые решили прекратить лечение VKA после консультации со своими специалистами между 6-12 недель беременности, должны получать непрерывный, коррегированную дозу т нефракционированного гепарина или коррегированную дозу гепарина низким молекулярным весом подкожно. Поскольку имеются лишь ограниченные данные о тератогенности NOACs, эти препараты следует избегать во время беременности.
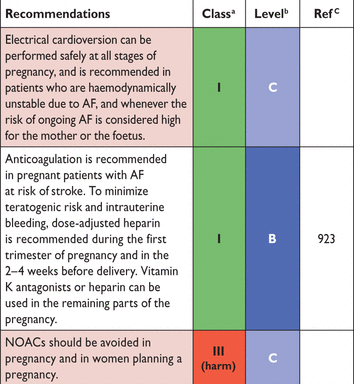 NOAC = антагонист витамина К пероральный антикоагулянт.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации во время беременности
13.5 Послеоперационная фибрилляция предсердий
AF обычно возникает после сердечной хирургии (происходящих в 15 – 45% больных), и ассоциируется с повышенной продолжительности пребывания в стационаре и более высокие показатели осложнений и смертности. Послеоперационное AF также не является редкостью после других крупных операции, особенно у пожилых пациентов. Лечение послеоперационного AF главным образом основывается на данных лечения пациентов, перенесших сердечную хирургии, с гораздо меньшими доказательствами у тех, кто не оперирован.
13.5.1 Профилактика послеоперационных фибрилляции предсердий
Бета-блокаторы уменьшают послеоперационное AF и суправентрикулярные тахикардии, хотя и с высокой гетерогенностью и умеренный риск систематической ошибки в систематическом обзоре опубликованных исследований. Наиболее часто изучаемым препаратом был пропранолол, с AF в 16,3% группы лечения против 31,7% в контрольной группе. В большинстве этих исследований, бета-блокаторы назначались постоперационно. Амиодарон снижал частоту послеоперационных AF по сравнению с бета-блокаторами в нескольких мета анализ, также сокращал пребывание в больнице.
Несмотря на первоначальные доклады по мета анализам, предоперационное назначение статинов не предотвращало послеоперационные AF в проспективном контролируемом исследовании . Другие виды терапии также были изучены в небольших, гипотезогенерированных испытаниях, но не продемонстрировали четкие благотворное воздействие. К ним относятся магний, n-3 полиненасыщенные жирные кислоты, Колхицин, кортикостероиды, и задняя перикардэктомия. Послеоперационные бижелудочковая овердрайв электрокардиостимуляция не получил широкое применение, несмотря на некоторые предложения профилактических эффектов.
13.5.2 Антикоагуляция
Послеоперационное AF ассоциируется с более ранним риском инсульта, повышенной заболеваемостью и смертности в 30 дней. В долгосрочной перспективе пациенты с эпизодом послеоперационной AF имеют два раза увеличение сердечно-сосудистой смертности и значительно повышенный риск будущего AF и ишемических инсульта, по сравнению с пациентами, которых сохраняется синусовый ритм после операции. ОАС связано с сокращением долгосрочной смертности у больных с послеоперационной AF, без доказательств в контролируемых испытаний. Необходимы убедительные данные для определения может ли долгосрочная антикоагуляция предотвратить инсульт у пациентов с послеоперационным AF на фоне высокого риск инсульта, и оценить могут ли короткие эпизоды послеоперационного AF (например, <48 h) носить аналогичный риск как при длительных эпизодах. Индикация и сроки ОАС в послеоперационное AF пациенты должны принимать во внимание риск послеоперационного кровотечения.
13.5.3 3 Контроль ритма при послеоперационной фибрилляции
У гемодинамически нестабильных пациентов кардиоверсия и рассмотрение приема антиаритмические препараты рекомендуется. Амиодарон или вернакалант ( vernakalant) были эффективны при преобразовании послеоперационной AF в синусовый ритм. Последние среднего размера исследования рандомизированных пациентов с послеоперационным AF любая терапия ритм контроля амиодарон или ЧСС не нашли разницу в госпитализации в течение последующих 60 дней, подчеркивая, что цель ритм контроля терапии является улучшить симптомы, связанные с AF при послеоперационной AF. У бессимптомных пациентов и тех, с приемлемыми симптомами контроль ЧСС или отсроченной кардиоверсией с предшествующей антикоагуляцией, является разумным подходом.
NOAC = антагонист витамина К пероральный антикоагулянт.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации во время беременности
13.5 Послеоперационная фибрилляция предсердий
AF обычно возникает после сердечной хирургии (происходящих в 15 – 45% больных), и ассоциируется с повышенной продолжительности пребывания в стационаре и более высокие показатели осложнений и смертности. Послеоперационное AF также не является редкостью после других крупных операции, особенно у пожилых пациентов. Лечение послеоперационного AF главным образом основывается на данных лечения пациентов, перенесших сердечную хирургии, с гораздо меньшими доказательствами у тех, кто не оперирован.
13.5.1 Профилактика послеоперационных фибрилляции предсердий
Бета-блокаторы уменьшают послеоперационное AF и суправентрикулярные тахикардии, хотя и с высокой гетерогенностью и умеренный риск систематической ошибки в систематическом обзоре опубликованных исследований. Наиболее часто изучаемым препаратом был пропранолол, с AF в 16,3% группы лечения против 31,7% в контрольной группе. В большинстве этих исследований, бета-блокаторы назначались постоперационно. Амиодарон снижал частоту послеоперационных AF по сравнению с бета-блокаторами в нескольких мета анализ, также сокращал пребывание в больнице.
Несмотря на первоначальные доклады по мета анализам, предоперационное назначение статинов не предотвращало послеоперационные AF в проспективном контролируемом исследовании . Другие виды терапии также были изучены в небольших, гипотезогенерированных испытаниях, но не продемонстрировали четкие благотворное воздействие. К ним относятся магний, n-3 полиненасыщенные жирные кислоты, Колхицин, кортикостероиды, и задняя перикардэктомия. Послеоперационные бижелудочковая овердрайв электрокардиостимуляция не получил широкое применение, несмотря на некоторые предложения профилактических эффектов.
13.5.2 Антикоагуляция
Послеоперационное AF ассоциируется с более ранним риском инсульта, повышенной заболеваемостью и смертности в 30 дней. В долгосрочной перспективе пациенты с эпизодом послеоперационной AF имеют два раза увеличение сердечно-сосудистой смертности и значительно повышенный риск будущего AF и ишемических инсульта, по сравнению с пациентами, которых сохраняется синусовый ритм после операции. ОАС связано с сокращением долгосрочной смертности у больных с послеоперационной AF, без доказательств в контролируемых испытаний. Необходимы убедительные данные для определения может ли долгосрочная антикоагуляция предотвратить инсульт у пациентов с послеоперационным AF на фоне высокого риск инсульта, и оценить могут ли короткие эпизоды послеоперационного AF (например, <48 h) носить аналогичный риск как при длительных эпизодах. Индикация и сроки ОАС в послеоперационное AF пациенты должны принимать во внимание риск послеоперационного кровотечения.
13.5.3 3 Контроль ритма при послеоперационной фибрилляции
У гемодинамически нестабильных пациентов кардиоверсия и рассмотрение приема антиаритмические препараты рекомендуется. Амиодарон или вернакалант ( vernakalant) были эффективны при преобразовании послеоперационной AF в синусовый ритм. Последние среднего размера исследования рандомизированных пациентов с послеоперационным AF любая терапия ритм контроля амиодарон или ЧСС не нашли разницу в госпитализации в течение последующих 60 дней, подчеркивая, что цель ритм контроля терапии является улучшить симптомы, связанные с AF при послеоперационной AF. У бессимптомных пациентов и тех, с приемлемыми симптомами контроль ЧСС или отсроченной кардиоверсией с предшествующей антикоагуляцией, является разумным подходом.
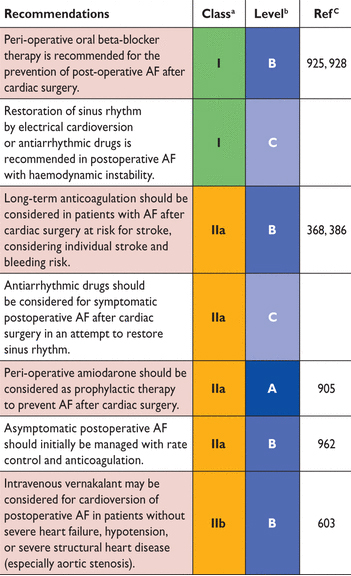 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для предотвращения послеоперационной фибрилляции предсердий
13.6 Предсердные аритмии у взрослых пациентов с врожденными пороками сердца
Предсердные аритмия (AF, трепетание предсердий, предсердная тахикардия) часто возникают после хирургического лечения врожденных пороков сердца, происходящих у 15-40% взрослых пациентов с врожденными пороками сердца (grown-up patients with congenital heart disease (GUCH)). Они связаны с сердечной недостаточностью, синкопальным состоянием, тромбоэмболическими событиями и внезапной смертью. Патофизиологические субстрат является комплексным, связанный с гипертрофией, фиброз, гипоксемии, хронические гемодинамическими перегрузками и хирургическими рубцами и патчами (накладками). Кроме того, первичные аномалии путей проведения могут привести к reentrant ре-ентерной предсердной и желудочковой тахикардии, блокадам сердца и синусового узла дисфункции. Мерцательная предсердная тахикардия или атипичное трепетание предсердий может наблюдаться после любой хирургической процедуры, связанных с атриотомией или предсердными патчами.
13.6.1 Рекомендации при мерцательной аритмии у взрослых пациентов с врожденными пороками сердца
Факторы риска обычных инсульта следует использовать для принятия решений о долгосрочной антикоагуляции у GUCH пациентов с AF. Кроме того, антикоагуляцию следует рассматривать у GUCH пациентов с предсердными аритмиями, когда они возникают при внутрисердечных вмешательствах, цианоз, паллиативной операции Fontan или относятся к правому желудочку. Можно использовать бета-блокаторами, верапамил, дилтиазем и препараты наперстянки. При терапии избегать брадикардии и гипотензии.
Блокаторы кальциевых каналов натрия подавляют примерно половину мерцательной аритмии у Fontan пациентов. Амиодарон является более эффективным, но длительное лечение несет высокий риск Внесердечные побочных эффектов особенно у молодых пациентов. Внутрисердечный тромбов широко распространены у GUCH пациентов, перенесших кардиоверсия в связи с ФП, но и у больных с предсердными тахикардиями или трепетанием предсердий. Таким образом следует рассматривать как TOE, так и в антикоагуляцию за несколько недель до запланированной кардиоверсии. Радиочастотная абляция может быть хорошим вариантом для симптоматического у GUCH пациентов с предсердными аритмиями, особенно, с трепетанием предсердий и других мерцательных реентерных тахикардиях. Лечебные мероприятия должны осуществляться специализированными группами в надлежащим образом квалифицированных центрах.
13.6.2 Предсердные тахиаритмии и дефекты межпредсердной перегородки
Трепетание предсердий и желудочков происходят в 14 – 22% взрослых с неуперированных предсердных септальных дефектах, особенно у пожилых пациентов, и может привести к сердечной недостаточности. Раннее оперирование может уменьшить, но не устранить риск AF. l Перегрузка объемом обех предсердий, легочная гипертензия, и возможно аритмогенное действие предсердных патчей могут способствовать этим аритмий. Антикоагуляцию должна быть принята с учетом факторов риска инсульта. У пациентов с историей пароксизмальная или стойких AF AF хирургия может рассматриваться во время хирургического закрытия или катетерной абляция во время интервенционного закрытия дефект межпредсердной перегородки. Катетерная абляция при поздних предсердных аритмиях было показано, быть эффективными в небольшой когорте больных после хирургического лкчения дефекта межпредсердной перегородки.
13.6.3 Предсердные тахиаритмии после операции по Фонтену
Предсердные аритмии встречаются в до 40% пациентов с циркуляции Fontan и может проявляться как трепетания предсердий, первичный предсердная тахикардия, AF и ускоренным узловым ритмом или узловой тахикардией с или без дисфункции синоатриального узла. Скорее всего, развитие долгосрочных предсердных аритмии имеется у больных с предсерднолегочными анастомозами (возможно, из-за перегрузки предсердий объемом и давлением) и в раннем послеоперационном периоде. Предсердные аритмии могут быть первым проявлением обструкции предсерднолегочных анастомозов, осложнение, которое должно быть диагносцировано. Образование тромбов правом предсердии часто встречается у оперированных Fontan пациентов с предсердными аритмиями и требует оральных антикоагулянтов. Оперативная трансформация общей кавопульмональный артерии в сочетании с хирургическим лечением аритмии может у некоторых пациентов, улучшить симптомы сердечной недостаточности и уменьшить рецидивированные аритмий, с низким уровнем рецидивирования клинически очевидной мерцательной аритмии в первые несколько лет после повторной операции. Катетерная абляция предсердных аритмии у больных Fontan была успешной у отдельных пациентов.
13.6.4 Предсердные тахиаритмии после коррекции Тетрады Фалло
После коррекции Тетрады Фалло примерно у трети пациентов развились предсердные аритмии, включая интра-предсердные реэентерные предсердные тахикардии, фокальные предсердные тахикардии и AF. Схемы с подходом кавотрикуспидального перешейка и области хирургической рубцовой трансформации правого предсердия были описаны как ответственные за предсердные аритмии.
Рекомендации взрослым пациентам с врождёнными пороками сердца
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для предотвращения послеоперационной фибрилляции предсердий
13.6 Предсердные аритмии у взрослых пациентов с врожденными пороками сердца
Предсердные аритмия (AF, трепетание предсердий, предсердная тахикардия) часто возникают после хирургического лечения врожденных пороков сердца, происходящих у 15-40% взрослых пациентов с врожденными пороками сердца (grown-up patients with congenital heart disease (GUCH)). Они связаны с сердечной недостаточностью, синкопальным состоянием, тромбоэмболическими событиями и внезапной смертью. Патофизиологические субстрат является комплексным, связанный с гипертрофией, фиброз, гипоксемии, хронические гемодинамическими перегрузками и хирургическими рубцами и патчами (накладками). Кроме того, первичные аномалии путей проведения могут привести к reentrant ре-ентерной предсердной и желудочковой тахикардии, блокадам сердца и синусового узла дисфункции. Мерцательная предсердная тахикардия или атипичное трепетание предсердий может наблюдаться после любой хирургической процедуры, связанных с атриотомией или предсердными патчами.
13.6.1 Рекомендации при мерцательной аритмии у взрослых пациентов с врожденными пороками сердца
Факторы риска обычных инсульта следует использовать для принятия решений о долгосрочной антикоагуляции у GUCH пациентов с AF. Кроме того, антикоагуляцию следует рассматривать у GUCH пациентов с предсердными аритмиями, когда они возникают при внутрисердечных вмешательствах, цианоз, паллиативной операции Fontan или относятся к правому желудочку. Можно использовать бета-блокаторами, верапамил, дилтиазем и препараты наперстянки. При терапии избегать брадикардии и гипотензии.
Блокаторы кальциевых каналов натрия подавляют примерно половину мерцательной аритмии у Fontan пациентов. Амиодарон является более эффективным, но длительное лечение несет высокий риск Внесердечные побочных эффектов особенно у молодых пациентов. Внутрисердечный тромбов широко распространены у GUCH пациентов, перенесших кардиоверсия в связи с ФП, но и у больных с предсердными тахикардиями или трепетанием предсердий. Таким образом следует рассматривать как TOE, так и в антикоагуляцию за несколько недель до запланированной кардиоверсии. Радиочастотная абляция может быть хорошим вариантом для симптоматического у GUCH пациентов с предсердными аритмиями, особенно, с трепетанием предсердий и других мерцательных реентерных тахикардиях. Лечебные мероприятия должны осуществляться специализированными группами в надлежащим образом квалифицированных центрах.
13.6.2 Предсердные тахиаритмии и дефекты межпредсердной перегородки
Трепетание предсердий и желудочков происходят в 14 – 22% взрослых с неуперированных предсердных септальных дефектах, особенно у пожилых пациентов, и может привести к сердечной недостаточности. Раннее оперирование может уменьшить, но не устранить риск AF. l Перегрузка объемом обех предсердий, легочная гипертензия, и возможно аритмогенное действие предсердных патчей могут способствовать этим аритмий. Антикоагуляцию должна быть принята с учетом факторов риска инсульта. У пациентов с историей пароксизмальная или стойких AF AF хирургия может рассматриваться во время хирургического закрытия или катетерной абляция во время интервенционного закрытия дефект межпредсердной перегородки. Катетерная абляция при поздних предсердных аритмиях было показано, быть эффективными в небольшой когорте больных после хирургического лкчения дефекта межпредсердной перегородки.
13.6.3 Предсердные тахиаритмии после операции по Фонтену
Предсердные аритмии встречаются в до 40% пациентов с циркуляции Fontan и может проявляться как трепетания предсердий, первичный предсердная тахикардия, AF и ускоренным узловым ритмом или узловой тахикардией с или без дисфункции синоатриального узла. Скорее всего, развитие долгосрочных предсердных аритмии имеется у больных с предсерднолегочными анастомозами (возможно, из-за перегрузки предсердий объемом и давлением) и в раннем послеоперационном периоде. Предсердные аритмии могут быть первым проявлением обструкции предсерднолегочных анастомозов, осложнение, которое должно быть диагносцировано. Образование тромбов правом предсердии часто встречается у оперированных Fontan пациентов с предсердными аритмиями и требует оральных антикоагулянтов. Оперативная трансформация общей кавопульмональный артерии в сочетании с хирургическим лечением аритмии может у некоторых пациентов, улучшить симптомы сердечной недостаточности и уменьшить рецидивированные аритмий, с низким уровнем рецидивирования клинически очевидной мерцательной аритмии в первые несколько лет после повторной операции. Катетерная абляция предсердных аритмии у больных Fontan была успешной у отдельных пациентов.
13.6.4 Предсердные тахиаритмии после коррекции Тетрады Фалло
После коррекции Тетрады Фалло примерно у трети пациентов развились предсердные аритмии, включая интра-предсердные реэентерные предсердные тахикардии, фокальные предсердные тахикардии и AF. Схемы с подходом кавотрикуспидального перешейка и области хирургической рубцовой трансформации правого предсердия были описаны как ответственные за предсердные аритмии.
Рекомендации взрослым пациентам с врождёнными пороками сердца
 AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт (два раза), сосудистые заболевания, возраст 65 – 74 и пол (женский); GUCH = взрослые пациенты с врожденными пороками сердца; ОАС = оральные антикоагулянты; TOE = трансэзофагеальная эхокардиография.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.7 Рекомендации при трепетании предсердий
Цели управления трепетания предсердий, аналогичны для AF. Основываясь на имеющихся доказательствах, риск инсульта у больных с трепетания предсердий не сильно отличается от того, при AF. Кроме того, у многих пациентов с диагнозом трепетания предсердий развивается AF. Таким образом антикоагуляцию следует использовать у пациентов с трепетания предсердий похоже, как у больных с AF. Контроль ЧСС при трепетании предсердий достигается с помощью же лекарства как и AF, но часто более трудно достижим. Флекаинид, пропафенон, dofetilide и внутривенное введение дофетилид полезны для кардиоверсия фибрилляции предсердий. Они должны комбинироваться с препаратами контроля ЧСС, чтобы избежать замедления волн трепетание желудочков проведение 1:1. Дофетилид является более эффективным для преобразования трепетания предсердий, чем AF, в то время как vernakalant менее эффективен при преобразовании типичного трепетания предсердий. Электрическая кардиоверсия фибрилляции предсердий может производиться с использованием более низких энергий (50 – 100 J) чем для AF. Предсердное искусственное ускорение сердечного ритма с целью подавления эктопических очагов автоматизма через Электрокардиостимулятор приводится или через эндокард, или Чреспищеводные катетеры которые могут преобразовать трепетания предсердий в синусового ритма. Антикоагуляционную и трансэзофагальную эхокардиографию после кардиоверсии или овердрайв электрокардиостимуляции должны использоваться аналогично, как при AF.
Абляция кавотрикуспидального перешейка при истсмус -зависимых правопредсердных трепетаниях предсердий (более характерное против часовой стрелки трепетания предсердий или менее общее по часовой стрелке трепетания предсердий) восстанавливает и поддерживает синусовый ритм с успеха 90 – 95%. Это может также уменьшить AF повторений у отдельных пациентов, и помочь предотвратить госпитализаций. Абляция перешейка является сравнительно безопасным и более эффективным, чем антиаритмические лекарственной терапии и рекомендуется при рецидивирующих трепетаних предсердий. Катетерная абляция левого предсердия при macroreentrant( макро реентерные) тахикардия является более сложным, с более низким ставкам успеха и более высокие показатели повторения.
AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт (два раза), сосудистые заболевания, возраст 65 – 74 и пол (женский); GUCH = взрослые пациенты с врожденными пороками сердца; ОАС = оральные антикоагулянты; TOE = трансэзофагеальная эхокардиография.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.7 Рекомендации при трепетании предсердий
Цели управления трепетания предсердий, аналогичны для AF. Основываясь на имеющихся доказательствах, риск инсульта у больных с трепетания предсердий не сильно отличается от того, при AF. Кроме того, у многих пациентов с диагнозом трепетания предсердий развивается AF. Таким образом антикоагуляцию следует использовать у пациентов с трепетания предсердий похоже, как у больных с AF. Контроль ЧСС при трепетании предсердий достигается с помощью же лекарства как и AF, но часто более трудно достижим. Флекаинид, пропафенон, dofetilide и внутривенное введение дофетилид полезны для кардиоверсия фибрилляции предсердий. Они должны комбинироваться с препаратами контроля ЧСС, чтобы избежать замедления волн трепетание желудочков проведение 1:1. Дофетилид является более эффективным для преобразования трепетания предсердий, чем AF, в то время как vernakalant менее эффективен при преобразовании типичного трепетания предсердий. Электрическая кардиоверсия фибрилляции предсердий может производиться с использованием более низких энергий (50 – 100 J) чем для AF. Предсердное искусственное ускорение сердечного ритма с целью подавления эктопических очагов автоматизма через Электрокардиостимулятор приводится или через эндокард, или Чреспищеводные катетеры которые могут преобразовать трепетания предсердий в синусового ритма. Антикоагуляционную и трансэзофагальную эхокардиографию после кардиоверсии или овердрайв электрокардиостимуляции должны использоваться аналогично, как при AF.
Абляция кавотрикуспидального перешейка при истсмус -зависимых правопредсердных трепетаниях предсердий (более характерное против часовой стрелки трепетания предсердий или менее общее по часовой стрелке трепетания предсердий) восстанавливает и поддерживает синусовый ритм с успеха 90 – 95%. Это может также уменьшить AF повторений у отдельных пациентов, и помочь предотвратить госпитализаций. Абляция перешейка является сравнительно безопасным и более эффективным, чем антиаритмические лекарственной терапии и рекомендуется при рецидивирующих трепетаних предсердий. Катетерная абляция левого предсердия при macroreentrant( макро реентерные) тахикардия является более сложным, с более низким ставкам успеха и более высокие показатели повторения.
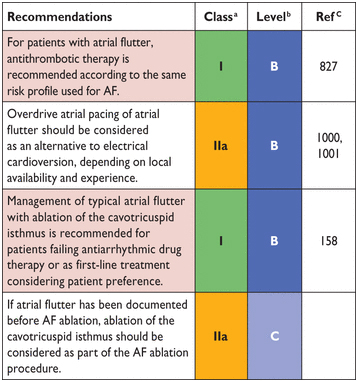 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по контролю трепетания предсердий
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по контролю трепетания предсердий
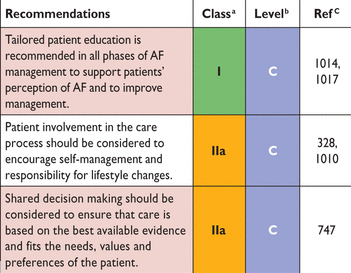 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации в отношении участия пациента, образования и самоуправления
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации в отношении участия пациента, образования и самоуправления
 TIA =преходящие ишемические атаки.
A Свищи пищевода следует подозревать, в больных с триадой неспецифических признаков инфекции, боль в груди и инсульта или TIA в первые недели после процедуры аблации. Они требует немедленного лечения.
B < 10% для криобаллонной или радиочастотная абляция, > 20% для поэтапного радиочастотная абляция.
11.3.4 Антикоагуляция: до, во время и после аблации
Антикоагуляция пациентов с VKAs должна продолжаться при абляции (с INR 2 – 3). Антикоагуляция с NOACs является альтернативой для варфарина. Нет информации о безопасности при наблюдении когорт, при лечении с непрерывной NOAC терапией, переживших катетерную абляция в квалифицированных центрах. Во время абляции, гепарин следует поддерживать активированное время свертывания> 300 с. антикоагуляцию следует сохранить по крайней мере 8 недель после абляции для всех пациентов. Истинное число измерители тромбоэмболические события после катетерной абляция никогда не были изучены систематически и риск ожидаемого инсульта был принят в когорте non аблация AF. В отсутствие контролируемых испытаний данных ОАС после катетерная абляция должны следовать общим антисвертывающим рекомендации, вне зависимости от исхода предполагаемого ритма.
11.3.5 Абляция фибрилляции предсердий у пациентов с сердечной недостаточностью
Катетерная абляция, по сравнению с терапией амиодарона, значительно снижает рецидивирующий AF у AF пациентов с HFrEF. У пациентов с HFrEF и AF можно добиться восстановления систолической функции ЛЖ после катетерной абляции (вероятно в связи с тахикардиомиопатией). Несколько небольших испытаний показывают улучшение функции ЛЖ после катетерная абляция в HFrEF пациентов и снижение госпитализаций, особенно у пациентов без предыдущего инфаркта миокарда. Более крупные испытания требуются для подтверждения этих результатов. Катетерная абляция может потребовать у этих пациентов. Таким образом показания к катетерная абляция у HFrEF пациентов должны быть тщательно сбалансированы, и процедуры выполняются в специализированных центрах.
11.3.6 Последующие мероприятия после катетерной абляции
Пациенты и врачи участвующие в наблюдении после катетерной абляция должны знать признаки и симптомы поздних осложнений, чтобы позволить быстрое направления на лечение (таблица 18). Пациенты также должны знать, что возможны симптоматические, так и бессимптомные AF рецидивы частые после катетерной аблации. В соответствии с основной целью контроля терапии ритма бессимптомная эпизоды вообще не должно спровоцировать дальнейшее назначение ритм контроля терапии при рутинной медицинской помощи. Пациенты должны осматриваться по крайней мере один раз специалистом аритмологом в первые 12 месяцев после абляции. Следует рассматривать дальнейшие варианты контроля ритма у больных с симптоматическими рецидивами, включая обсуждение в команде Heart Team (рис. 17, рис. 19).
11.4 хирургическое лечении ФП
11.4.1 Дополнительное хирургическое лечение ФП
Процедура лабиринт Кокс впервые была проведена 30 лет назад как «вырезать и шить» (‘cut-and-sew’) техника, включает изоляции заднюю часть левого предсердия, соединение к задней части митрального кольца, кавотрикуспидального истмуса, кавокавальное соединение и исключение LAA (рисунок 18). Таким образом процедура лабиринт Кокс создает электрический лабиринт проходов, через которые импульсы синоатриального узла находит маршрут к атриовентрикулярному узлу предотвращая фибриляторную кондукцию. Кокс лабиринт процедуры и другие, часто проще, формы хирургии AF использовались, главным образом, у пациентов, перенесших другие открытые сердца хирургические процедуры. В систематический обзор, для этих руководящих принципов выполняя сопутствующие операции AF повлекло за собой расширение свободы от AF, трепетания предсердий, предсердная тахикардия, по сравнению с пациентами без сопутствующей хирургии AF (ОР 1.94; 95% ДИ 1,51 – 2,49; n = 554 из семи РКИ) (веб-рис. 3). Пациенты, перенесшие Кокс лабиринт процедура требует вживления водителя ритма чаще (ОР 1,69; 95% ДИ 1,12 – 2,54; n = 1631 от 17 РКИ), без обнаруживаемая разницы в других результатов или осложнений. Эти выводы подкрепляются анализ базы данных общества торакальных хирургов, включающей 67 389 пациентов AF, перенесших операцию на открытом сердце: смертности и тяжелой заболеваемости не зависит от сопутствующей хирургии AF (скорректированное или 1,00; 95% ДИ 0,83 – 1,20), но вживления водителя ритма было более частым (скорректированное или 1,26; 95% ДИ 1,07-1,49). Предикторы AF рецидивов после операции включают дилатацию левого предсердий, пожилой возраст, > 10-летнюю историю AF и non пароксизмальная AF. Что касается типа AF хирургические PVI кажется эффективным в пароксизмальная AF. Бипредсердная хирургия может быть более эффективными в постоянных и давние стойких AF. Предлагаемое управление симптомами,у пациентов связанных с AF, включает хирургию сердца отображается на рисунке 19, является важным вкладом команды AF Heart Team для консультирования и информирования пациентов по выбору лечения.
Рисунок 18
TIA =преходящие ишемические атаки.
A Свищи пищевода следует подозревать, в больных с триадой неспецифических признаков инфекции, боль в груди и инсульта или TIA в первые недели после процедуры аблации. Они требует немедленного лечения.
B < 10% для криобаллонной или радиочастотная абляция, > 20% для поэтапного радиочастотная абляция.
11.3.4 Антикоагуляция: до, во время и после аблации
Антикоагуляция пациентов с VKAs должна продолжаться при абляции (с INR 2 – 3). Антикоагуляция с NOACs является альтернативой для варфарина. Нет информации о безопасности при наблюдении когорт, при лечении с непрерывной NOAC терапией, переживших катетерную абляция в квалифицированных центрах. Во время абляции, гепарин следует поддерживать активированное время свертывания> 300 с. антикоагуляцию следует сохранить по крайней мере 8 недель после абляции для всех пациентов. Истинное число измерители тромбоэмболические события после катетерной абляция никогда не были изучены систематически и риск ожидаемого инсульта был принят в когорте non аблация AF. В отсутствие контролируемых испытаний данных ОАС после катетерная абляция должны следовать общим антисвертывающим рекомендации, вне зависимости от исхода предполагаемого ритма.
11.3.5 Абляция фибрилляции предсердий у пациентов с сердечной недостаточностью
Катетерная абляция, по сравнению с терапией амиодарона, значительно снижает рецидивирующий AF у AF пациентов с HFrEF. У пациентов с HFrEF и AF можно добиться восстановления систолической функции ЛЖ после катетерной абляции (вероятно в связи с тахикардиомиопатией). Несколько небольших испытаний показывают улучшение функции ЛЖ после катетерная абляция в HFrEF пациентов и снижение госпитализаций, особенно у пациентов без предыдущего инфаркта миокарда. Более крупные испытания требуются для подтверждения этих результатов. Катетерная абляция может потребовать у этих пациентов. Таким образом показания к катетерная абляция у HFrEF пациентов должны быть тщательно сбалансированы, и процедуры выполняются в специализированных центрах.
11.3.6 Последующие мероприятия после катетерной абляции
Пациенты и врачи участвующие в наблюдении после катетерной абляция должны знать признаки и симптомы поздних осложнений, чтобы позволить быстрое направления на лечение (таблица 18). Пациенты также должны знать, что возможны симптоматические, так и бессимптомные AF рецидивы частые после катетерной аблации. В соответствии с основной целью контроля терапии ритма бессимптомная эпизоды вообще не должно спровоцировать дальнейшее назначение ритм контроля терапии при рутинной медицинской помощи. Пациенты должны осматриваться по крайней мере один раз специалистом аритмологом в первые 12 месяцев после абляции. Следует рассматривать дальнейшие варианты контроля ритма у больных с симптоматическими рецидивами, включая обсуждение в команде Heart Team (рис. 17, рис. 19).
11.4 хирургическое лечении ФП
11.4.1 Дополнительное хирургическое лечение ФП
Процедура лабиринт Кокс впервые была проведена 30 лет назад как «вырезать и шить» (‘cut-and-sew’) техника, включает изоляции заднюю часть левого предсердия, соединение к задней части митрального кольца, кавотрикуспидального истмуса, кавокавальное соединение и исключение LAA (рисунок 18). Таким образом процедура лабиринт Кокс создает электрический лабиринт проходов, через которые импульсы синоатриального узла находит маршрут к атриовентрикулярному узлу предотвращая фибриляторную кондукцию. Кокс лабиринт процедуры и другие, часто проще, формы хирургии AF использовались, главным образом, у пациентов, перенесших другие открытые сердца хирургические процедуры. В систематический обзор, для этих руководящих принципов выполняя сопутствующие операции AF повлекло за собой расширение свободы от AF, трепетания предсердий, предсердная тахикардия, по сравнению с пациентами без сопутствующей хирургии AF (ОР 1.94; 95% ДИ 1,51 – 2,49; n = 554 из семи РКИ) (веб-рис. 3). Пациенты, перенесшие Кокс лабиринт процедура требует вживления водителя ритма чаще (ОР 1,69; 95% ДИ 1,12 – 2,54; n = 1631 от 17 РКИ), без обнаруживаемая разницы в других результатов или осложнений. Эти выводы подкрепляются анализ базы данных общества торакальных хирургов, включающей 67 389 пациентов AF, перенесших операцию на открытом сердце: смертности и тяжелой заболеваемости не зависит от сопутствующей хирургии AF (скорректированное или 1,00; 95% ДИ 0,83 – 1,20), но вживления водителя ритма было более частым (скорректированное или 1,26; 95% ДИ 1,07-1,49). Предикторы AF рецидивов после операции включают дилатацию левого предсердий, пожилой возраст, > 10-летнюю историю AF и non пароксизмальная AF. Что касается типа AF хирургические PVI кажется эффективным в пароксизмальная AF. Бипредсердная хирургия может быть более эффективными в постоянных и давние стойких AF. Предлагаемое управление симптомами,у пациентов связанных с AF, включает хирургию сердца отображается на рисунке 19, является важным вкладом команды AF Heart Team для консультирования и информирования пациентов по выбору лечения.
Рисунок 18
 А: хирургические подходы для билатеральной процедуры лабиринт кокса. Хирургические левопредсердные разрезы показаны (левая панель) и правопредсердные разрезы (средняя и правая панель). Б: левопредсердный разрез при торакоскопической минимальной инвазивной хирургической процедура (пунктирные линии), включая выключение придатка левого предсердия (двойная линия).
Рисунок 19
А: хирургические подходы для билатеральной процедуры лабиринт кокса. Хирургические левопредсердные разрезы показаны (левая панель) и правопредсердные разрезы (средняя и правая панель). Б: левопредсердный разрез при торакоскопической минимальной инвазивной хирургической процедура (пунктирные линии), включая выключение придатка левого предсердия (двойная линия).
Рисунок 19
 Хирургический контроль ритма у больных с мерцательной аритмией, прошедших кардиохирургическое лечение
11.4.2 Автономный хирургический контроль ритма
Современные технологии (например, биполярный радиочастотный или криотерапия) делает Кокс лабиринт процедуру легче и более воспроизводимой, и практически осуществимой, через мини-торакотомия. Торакоскопическая PVI с биполярной радиочастоты предотвращает повторение пароксизмальная AF (69 – 91% без аритмий в течении 1 год, см. рисунок 18B для линий разреза) и, кажется, эффективен у пациентов, рефрактернных к катетерной аблации. Средняя продолжительность пребывания в больнице для торакоскопическая абляции варьируется от 3,6 до 6,0 дней. В исследовании FAST (Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment) и более мелких, высказано предположение о том, что операции торакоскопическая AF может быть более эффективным, чем Катетерная абляция для поддержания синусового ритма, но а также вызывает больше осложнений (Таблица 19). Для улучшения результатов, предлагаются более обширные разрезы, включая соединительные линии между PVI («box разрезы») (“box lesion”) и линии к митральному кольцу. Для улучшения модели Трансмуральных разрезов, недавно были предложены стратегии Эндо- эпикардиальной абляции. Хотя предварительный опыт работы с гибридной одновремоментной абляции выглядит т обещающим, время операции и число геморрагических осложнений выше.
Таблица 19
Осложнения торакоскопической хирургии фибрилляции предсердий
Хирургический контроль ритма у больных с мерцательной аритмией, прошедших кардиохирургическое лечение
11.4.2 Автономный хирургический контроль ритма
Современные технологии (например, биполярный радиочастотный или криотерапия) делает Кокс лабиринт процедуру легче и более воспроизводимой, и практически осуществимой, через мини-торакотомия. Торакоскопическая PVI с биполярной радиочастоты предотвращает повторение пароксизмальная AF (69 – 91% без аритмий в течении 1 год, см. рисунок 18B для линий разреза) и, кажется, эффективен у пациентов, рефрактернных к катетерной аблации. Средняя продолжительность пребывания в больнице для торакоскопическая абляции варьируется от 3,6 до 6,0 дней. В исследовании FAST (Atrial Fibrillation Catheter Ablation vs. Surgical Ablation Treatment) и более мелких, высказано предположение о том, что операции торакоскопическая AF может быть более эффективным, чем Катетерная абляция для поддержания синусового ритма, но а также вызывает больше осложнений (Таблица 19). Для улучшения результатов, предлагаются более обширные разрезы, включая соединительные линии между PVI («box разрезы») (“box lesion”) и линии к митральному кольцу. Для улучшения модели Трансмуральных разрезов, недавно были предложены стратегии Эндо- эпикардиальной абляции. Хотя предварительный опыт работы с гибридной одновремоментной абляции выглядит т обещающим, время операции и число геморрагических осложнений выше.
Таблица 19
Осложнения торакоскопической хирургии фибрилляции предсердий
 a Скорость бессимптомной церебральной эмболии неизвестна.
11.5 Выбор контроля ритма после неудачного лечения
Нет достаточных доказательств, лежащих в основе четких рекомендаций о том, как лечить пациентов с рецидивирующий AF после катетерной аблации. Ранние рецидивы AF или предсердная тахикардия после абляции (происходит в течение 8 недель) можно лечить кардиоверсией. Многие из опубликованных данных по пациентам, перенесших AF абляции включались те, у кого антиаритмическая лекарственная терапия была неэффективна. Таким образом применение абляции у пациентов, которые имеют симптоматические рецидивы на фоне антиаритмической лекарственной терапии, часто является разумным. Кроме того, в качестве альтернативы можно считать назначение другого антиаритмического препарата. Сочетание антиаритмические препарат с абляции («гибридная терапия», см. главу 12) следует рассматривать на основе различных и возможно синергического воздействия этих препаратов с AF абляции, с возможным положительным эффектом у пациентов, у которых однокомпонентное лечение было ранее неэффективным. Контроль ЧСС без контроля ритма, хирургическая аблация , или повторная Катетерная абляция так же следует рассматривать как вариант (рис. 20). Предпочтения пациента и доступ к терапии являются важными факторами для информирования по выбору терапии у пациентов, которые нуждаются в дальнейшем ритм контроля терапии после неудачи начальной терапии.
Рисунок 20
Выбор терапии контроля ритма после неудачного лечения.
a Скорость бессимптомной церебральной эмболии неизвестна.
11.5 Выбор контроля ритма после неудачного лечения
Нет достаточных доказательств, лежащих в основе четких рекомендаций о том, как лечить пациентов с рецидивирующий AF после катетерной аблации. Ранние рецидивы AF или предсердная тахикардия после абляции (происходит в течение 8 недель) можно лечить кардиоверсией. Многие из опубликованных данных по пациентам, перенесших AF абляции включались те, у кого антиаритмическая лекарственная терапия была неэффективна. Таким образом применение абляции у пациентов, которые имеют симптоматические рецидивы на фоне антиаритмической лекарственной терапии, часто является разумным. Кроме того, в качестве альтернативы можно считать назначение другого антиаритмического препарата. Сочетание антиаритмические препарат с абляции («гибридная терапия», см. главу 12) следует рассматривать на основе различных и возможно синергического воздействия этих препаратов с AF абляции, с возможным положительным эффектом у пациентов, у которых однокомпонентное лечение было ранее неэффективным. Контроль ЧСС без контроля ритма, хирургическая аблация , или повторная Катетерная абляция так же следует рассматривать как вариант (рис. 20). Предпочтения пациента и доступ к терапии являются важными факторами для информирования по выбору терапии у пациентов, которые нуждаются в дальнейшем ритм контроля терапии после неудачи начальной терапии.
Рисунок 20
Выбор терапии контроля ритма после неудачного лечения.
 11.6 Группа по ФП
С учетом сложности лечения различных вариантов в пациентах с неудачной ритм контроля терапией , которые по-прежнему необходима или требуется дальнейший контроль ритма, эта Целевая группа предлагает, что решения, связанные с AF хирургии или обширные AF абляции должны основываться на советы от команды AF Heart Team.. Это также относится к полной перемене стратегии контроля у больных с тяжелой симптомами AF (EHRA III или IV). AF сердце команда должна состоять из кардиолога с опытом антиаритмической лекарственной терапии, интервенционного электрофизиолога и кардиохирурга с опытом соответствующего отбора пациентов, методов и технологий для интервенционных или хирургической аблации AF (рис. 20). Такие команды сердца AF — и совместная инфраструктура , поддерживающей постоянное взаимодействие между врачами наблюдающих пациентов, AF кардиологов, интервенционных электрофизиологов и AF хирургов — следует создать для предоставления оптимальных консультаций, и в конечном итоге улучшить ритм исходы для пациентов которым показаны передовые и сложных ритм мероприятий.
Рекомендации по катетерной абляции фибрилляции предсердий и хирургии фибрилляции предсердий
11.6 Группа по ФП
С учетом сложности лечения различных вариантов в пациентах с неудачной ритм контроля терапией , которые по-прежнему необходима или требуется дальнейший контроль ритма, эта Целевая группа предлагает, что решения, связанные с AF хирургии или обширные AF абляции должны основываться на советы от команды AF Heart Team.. Это также относится к полной перемене стратегии контроля у больных с тяжелой симптомами AF (EHRA III или IV). AF сердце команда должна состоять из кардиолога с опытом антиаритмической лекарственной терапии, интервенционного электрофизиолога и кардиохирурга с опытом соответствующего отбора пациентов, методов и технологий для интервенционных или хирургической аблации AF (рис. 20). Такие команды сердца AF — и совместная инфраструктура , поддерживающей постоянное взаимодействие между врачами наблюдающих пациентов, AF кардиологов, интервенционных электрофизиологов и AF хирургов — следует создать для предоставления оптимальных консультаций, и в конечном итоге улучшить ритм исходы для пациентов которым показаны передовые и сложных ритм мероприятий.
Рекомендации по катетерной абляции фибрилляции предсердий и хирургии фибрилляции предсердий

- AF = фибрилляция предсердий; NOAC = антагонист не- витамина К оральный антикоагулянт; VKA = антагонист витамина К.
- a Класс рекомендации.
- b Уровень доказательства.
- c Упоминания, поддерживающие рекомендации.
- Гибридная терапия контроля ритма сердца
- Конкретные клинические ситуации
 AF = фибрилляция предсердий; VT = желудочковая тахикардия.
13.2.1 Вольф – Паркинсона – Уайта синдром
Пациенты с предварительно возбуждением и AF подвергаются риску быстрой проводимости через дополнительные пути проведения что приводит к желудочковой тахикардии, возможному трепетанию желудочков и внезапной смерти. У AF пациентов с признаками антеградных путей проведения рекомендуется использовать Катетерную абляция дополнительных путей проведения. Эта процедура является безопасной и эффективной и может рассматриваться в качестве стратегии профилактического лечения. У AF пациентов, выживших после внезапной смерти событие с очевидным наличием дополнительных путей проведения, рекомендуется срочно катетерная абляция дополнительных путей. А документально зарегистрированные короткие интервалы предварительного возбужденных RR (< 250 мс) во время самопроизвольной или индуцированной AF является одним из маркеров риска внезапной смерти при синдроме (WPW) Вольфа-Паркинсона-Уайта, в дополнение к анамнезу с симптоматическими тахикардиями, наличие дополнительных путей проведения и аномалией Эбштейна. Внутривенной прокаинамид, пропафенон или аджмалин может использоваться при остро возникшей желудочковой брадикардии, в то время как дигоксин, верапамил и Дилтиазем противопоказаны. Внутривенной амиодарона следует использовать с осторожностью, так как описаны случаи ускоренного желудочкового ритма и фибрилляция предсердий у пациентов с предварительно возбуждением AF, получавших внутривенную инфузию амиодарона.
13.2.2 Гипертрофическая кардиомиопатия
AF является наиболее распространенной аритмией у больных с гипертрофической кардиомиопатией, затрагивающих примерно одной четверти населения. Данные наблюдений подчеркивают риск высокого инсульта у больных гипертрофической кардиомиопатией с AF, подтверждающие необходимость в ОАС. Хотя нет большого опыта применения VKAs, нет и данных полагать, что NOACs нельзя использовать у этих пациентов. Исследований по контролю ЧСС или ритма у больных с гипертрофической кардиомиопатией относительно редко. Бета-блокаторы и Дилтиазем или верапамил кажутся разумные методы лечения для контроля ЧСС у этих пациентов. При отсутствие значительной обструкции оттока тракта ЛЖ дигоксин может использоваться самостоятельно или в комбинации с бета-блокаторами. Амиодарон кажется безопасным препаратом при AF пациентов с гипертрофической кардиомиопатией, и экспертное заключение свидетельствует о том, что disopyramide(дизопирамид) может быть полезным при обструкции выносящего тракта. AF абляции является эффективным для подавления рецидивирования симптоматической AF. Хирургическое лечение AF может быть уместным в больных с гипертрофической кардиомиопатией, перенесших операцию (например, при обструкции выносящего тракта ЛЖ или операции на митральном клапане), но опыт носит ограниченный характер.
13.2.3 3 Каналлопатии и аритмогенные кардиомиопатии правого желудочка
Многие каналопатии и унаследованные кардиомиопатии связаны с AF. AF распространенность колеблется от 5 – 20% больных с синдромом удлинения QT или синдром Бругада и до 70% в синдром короткого интервала QT (Таблица 20). Пенетрантностью (частота или вероятность проявления гена) фенотипа болезни, включая AF является вариабельной. В обоих случаях, как укорочение, так и удлинение потенциала действия желудочков были продемонстрированы как вероятно, лежащие в основе AF при этих заболеваниях. Представляется целесообразным рассмотреть антиаритмические препараты, которые уменьшают предполагаемого канальцевый дефект у AF пациентов с наследственной кардиомиопатии (например, блокатор натрия канала в LQT3, или хинидин при синдроме Бругада). Для предотвращения возникновения AF у молодых, у здоровых людей должны проводиться тщательный поиск таких наследственных факторов, включая клинической истории, истории семьи, ЭКГ фенотип и эхокардиография и/или других кардиологические исследования.
Моногенные дефекты составляют только 3-5% всех пациентов с AF, даже в более молодых группах населения. Кроме того, нет никакой четкой связи между обнаруженными мутации, конкретных результатов или клинических проявлений. По этим причинам генетическое тестирование не рекомендуется в целом AF. Другие руководящие принципы описывают показания для генетического тестирования у больных с заболеваниями унаследованных Аритмогенное.
Рекомендации для наследственных кардиомиопатий
AF = фибрилляция предсердий; VT = желудочковая тахикардия.
13.2.1 Вольф – Паркинсона – Уайта синдром
Пациенты с предварительно возбуждением и AF подвергаются риску быстрой проводимости через дополнительные пути проведения что приводит к желудочковой тахикардии, возможному трепетанию желудочков и внезапной смерти. У AF пациентов с признаками антеградных путей проведения рекомендуется использовать Катетерную абляция дополнительных путей проведения. Эта процедура является безопасной и эффективной и может рассматриваться в качестве стратегии профилактического лечения. У AF пациентов, выживших после внезапной смерти событие с очевидным наличием дополнительных путей проведения, рекомендуется срочно катетерная абляция дополнительных путей. А документально зарегистрированные короткие интервалы предварительного возбужденных RR (< 250 мс) во время самопроизвольной или индуцированной AF является одним из маркеров риска внезапной смерти при синдроме (WPW) Вольфа-Паркинсона-Уайта, в дополнение к анамнезу с симптоматическими тахикардиями, наличие дополнительных путей проведения и аномалией Эбштейна. Внутривенной прокаинамид, пропафенон или аджмалин может использоваться при остро возникшей желудочковой брадикардии, в то время как дигоксин, верапамил и Дилтиазем противопоказаны. Внутривенной амиодарона следует использовать с осторожностью, так как описаны случаи ускоренного желудочкового ритма и фибрилляция предсердий у пациентов с предварительно возбуждением AF, получавших внутривенную инфузию амиодарона.
13.2.2 Гипертрофическая кардиомиопатия
AF является наиболее распространенной аритмией у больных с гипертрофической кардиомиопатией, затрагивающих примерно одной четверти населения. Данные наблюдений подчеркивают риск высокого инсульта у больных гипертрофической кардиомиопатией с AF, подтверждающие необходимость в ОАС. Хотя нет большого опыта применения VKAs, нет и данных полагать, что NOACs нельзя использовать у этих пациентов. Исследований по контролю ЧСС или ритма у больных с гипертрофической кардиомиопатией относительно редко. Бета-блокаторы и Дилтиазем или верапамил кажутся разумные методы лечения для контроля ЧСС у этих пациентов. При отсутствие значительной обструкции оттока тракта ЛЖ дигоксин может использоваться самостоятельно или в комбинации с бета-блокаторами. Амиодарон кажется безопасным препаратом при AF пациентов с гипертрофической кардиомиопатией, и экспертное заключение свидетельствует о том, что disopyramide(дизопирамид) может быть полезным при обструкции выносящего тракта. AF абляции является эффективным для подавления рецидивирования симптоматической AF. Хирургическое лечение AF может быть уместным в больных с гипертрофической кардиомиопатией, перенесших операцию (например, при обструкции выносящего тракта ЛЖ или операции на митральном клапане), но опыт носит ограниченный характер.
13.2.3 3 Каналлопатии и аритмогенные кардиомиопатии правого желудочка
Многие каналопатии и унаследованные кардиомиопатии связаны с AF. AF распространенность колеблется от 5 – 20% больных с синдромом удлинения QT или синдром Бругада и до 70% в синдром короткого интервала QT (Таблица 20). Пенетрантностью (частота или вероятность проявления гена) фенотипа болезни, включая AF является вариабельной. В обоих случаях, как укорочение, так и удлинение потенциала действия желудочков были продемонстрированы как вероятно, лежащие в основе AF при этих заболеваниях. Представляется целесообразным рассмотреть антиаритмические препараты, которые уменьшают предполагаемого канальцевый дефект у AF пациентов с наследственной кардиомиопатии (например, блокатор натрия канала в LQT3, или хинидин при синдроме Бругада). Для предотвращения возникновения AF у молодых, у здоровых людей должны проводиться тщательный поиск таких наследственных факторов, включая клинической истории, истории семьи, ЭКГ фенотип и эхокардиография и/или других кардиологические исследования.
Моногенные дефекты составляют только 3-5% всех пациентов с AF, даже в более молодых группах населения. Кроме того, нет никакой четкой связи между обнаруженными мутации, конкретных результатов или клинических проявлений. По этим причинам генетическое тестирование не рекомендуется в целом AF. Другие руководящие принципы описывают показания для генетического тестирования у больных с заболеваниями унаследованных Аритмогенное.
Рекомендации для наследственных кардиомиопатий
 AF = фибрилляция предсердий; HCM = гипертрофической кардиомиопатии; LV = левый желудочек; WPW = синдром Вольфа-Паркинсона-Уайта.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.3 Спорт и фибрилляция предсердий
Физическая активность улучшает здоровье сердечно-сосудистой системы, что означает более низкий риск AF. Таким образом физическая активность является краеугольным камнем предотвращения AF. Интенсивная спортивная нагрузка, особенно способность переносить интенсивные спортивные нагрузки (> 1500 h спортивной физической нагрузки), увеличивает риск AF с возрастом, вероятно, опосредовано изменяя состояние вегетативного фона, объем нагрузки во время тренировок, гипертрофию желудочков и дилатации. Это приводит к в U-образная взаимосвязь физической активности и инцидента AF. Детренеровка может уменьшить AF на моделях и уменьшает желудочковых аритмии у спортсменов, но роль летренерованности при AF у спортсменов неизвестна. Подходы к спортсменам с AF похожи на общий контроль AF, но требует несколько специальных соображений. Клинические факторы риска будут определять потребность в антикоагуляции. Спорт с прямым физическим контактом или повышенным травматизмом следует избегать у пациентов на ОАС. Бета-блокаторы не хорошо переносится и порой запрещены, и дигоксина, верапамил и Дилтиазем часто не являются достаточно мощными, чтобы контролировать (замедлять) пульс во время физического напряжения при AF. Катетерная абляция для AF, вероятно, имеет аналогичные результаты в спортсменов, как и не у спортсменов, но необходимы дополнительные данные. «Pill-in-the-pocket therapy» Таблетки в кармане- терапия используется также. После употребления флекаинид или пропафенон как «карманных таблеток» пациенты должны воздерживаться от спорта до тех пор, пока сохраняется AF и до истечения 2-х периодов полувыведения антиаритмических лекарства. Профилактическое абляция дополнительных путей проведения может быть рассмотрены у спортсменов, получавших блокаторы каналов натрия.
AF = фибрилляция предсердий; HCM = гипертрофической кардиомиопатии; LV = левый желудочек; WPW = синдром Вольфа-Паркинсона-Уайта.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.3 Спорт и фибрилляция предсердий
Физическая активность улучшает здоровье сердечно-сосудистой системы, что означает более низкий риск AF. Таким образом физическая активность является краеугольным камнем предотвращения AF. Интенсивная спортивная нагрузка, особенно способность переносить интенсивные спортивные нагрузки (> 1500 h спортивной физической нагрузки), увеличивает риск AF с возрастом, вероятно, опосредовано изменяя состояние вегетативного фона, объем нагрузки во время тренировок, гипертрофию желудочков и дилатации. Это приводит к в U-образная взаимосвязь физической активности и инцидента AF. Детренеровка может уменьшить AF на моделях и уменьшает желудочковых аритмии у спортсменов, но роль летренерованности при AF у спортсменов неизвестна. Подходы к спортсменам с AF похожи на общий контроль AF, но требует несколько специальных соображений. Клинические факторы риска будут определять потребность в антикоагуляции. Спорт с прямым физическим контактом или повышенным травматизмом следует избегать у пациентов на ОАС. Бета-блокаторы не хорошо переносится и порой запрещены, и дигоксина, верапамил и Дилтиазем часто не являются достаточно мощными, чтобы контролировать (замедлять) пульс во время физического напряжения при AF. Катетерная абляция для AF, вероятно, имеет аналогичные результаты в спортсменов, как и не у спортсменов, но необходимы дополнительные данные. «Pill-in-the-pocket therapy» Таблетки в кармане- терапия используется также. После употребления флекаинид или пропафенон как «карманных таблеток» пациенты должны воздерживаться от спорта до тех пор, пока сохраняется AF и до истечения 2-х периодов полувыведения антиаритмических лекарства. Профилактическое абляция дополнительных путей проведения может быть рассмотрены у спортсменов, получавших блокаторы каналов натрия.
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по физической активности у больных с мерцательной аритмией
13.4 Беременность
AF у беременных женщин редко и обычно ассоциируется с уже существующими заболеваниями сердца. AF связано с повышенной осложнения для матери и плода. Лучшее лечение врожденных пороков сердца, вероятно, повышает возникновения AF во время беременности в будущем. Беременные женщины с AF следует вести как с высокой степенью риска беременности в тесном сотрудничестве с кардиологами, гинекологов и неонатологов.
13.4.1 Контроль частоты сердечных сокращений
Из-за отсутствия специфических данных, бета-блокаторы, верапамил, дилтиазем и дигоксин, все по классификации американского агентства FDA США для беременных по безопасности относятся к категории C (преимущества могут перевесить риск), за исключением Атенолол (Категория D: имеются доказательства риска). Их использование должно быть в низких дозах и коротким курсом. Ни один из агентов не обладает тератогенным действием, но они легко проникает через плаценту. Бета-блокаторы широко используются у беременных женщин с сердечно-сосудистых заболеваний (например, для управления артериальной гипертонией беременных и при преэклампсии), но может быть связано с задержкой внутриутробного развития, и таким образом после 20 недель беременности рекомендуется определять размеры плода. Дигоксин считается безопасным при аритмиях матери и плода. Недостаточно данных, чтобы комментировать Дилтиазем или верапамил, поэтому необходим контроль ЧСС с использованием бета-блокаторами и/или дигоксин. Что касается грудного вскармливания все прпараты по контролю ЧСС присутствует в грудном молоке, хотя уровень бета-блокаторов, дигоксина и верапамил являются слишком низкими, чтобы считаться вредными. Дилтиазем будет присутствовать на высоком уровне и должны рассматриваться препаратом второй линии лечения.
13.4. Контроль ритма
О контроле ритма терапии у беременных больных с AF сообщалось только в тематических исследованиях. Амиодарон связано с серьезными неблагоприятные фетальные побочными эффекты и должны рассматриваться только для чрезвычайных ситуаций. Флекаинид и соталол может использоваться для конверсии эмбриональных аритмий без основных побочных эффектов, и таким образом, вероятно, быть безопасными для лечения материнской симптоматическая AF. Электрическая кардиоверсия может быть эффективным для восстановления синусового ритма, когда тахиаритмия является причиной нестабильности гемодинамическими, с низкими показателями неблагоприятных исходов для матери и плода. Однако с учетом риска дистресса плода, Электрическая кардиоверсия следует выполнять только, где имеются возможности для фетальные мониторинга и возможности неотложного кесарева сечения. Как и при других чрезвычайных ситуациях во время беременности, пациенты должны получать 100% кислорода, внутривенный доступ должен быть создан как можно раньше, и мать должны быть расположены в левой боковой(латеральной) позиции для улучшения венозного возврата.
13.4.3 Антикоагуляция
VKAs следует избегать в первом триместре беременности из-за тератогенного воздействия и за 2-4 недель, до родов, чтобы избежать фетальные кровотечения. Низкий молекулярный вес гепаринов делает их безопасной субстанцией, поскольку они не проникают через плаценту. В третьем триместре беременности необходимы частые лабораторные анализы для контроля адекватной антикоагуляции (например, каждые 10-14 дней) и соответствующие корректировки дозы рекомендуется, учитывая, что в некоторых женщин высокие дозы VKA и гепарином могут быть необходимы для поддержания адекватной антикоагуляции. Беременных больных с AF и механических протезов клапанов, которые решили прекратить лечение VKA после консультации со своими специалистами между 6-12 недель беременности, должны получать непрерывный, коррегированную дозу т нефракционированного гепарина или коррегированную дозу гепарина низким молекулярным весом подкожно. Поскольку имеются лишь ограниченные данные о тератогенности NOACs, эти препараты следует избегать во время беременности.
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания поддерживающие рекомендации.
Рекомендации по физической активности у больных с мерцательной аритмией
13.4 Беременность
AF у беременных женщин редко и обычно ассоциируется с уже существующими заболеваниями сердца. AF связано с повышенной осложнения для матери и плода. Лучшее лечение врожденных пороков сердца, вероятно, повышает возникновения AF во время беременности в будущем. Беременные женщины с AF следует вести как с высокой степенью риска беременности в тесном сотрудничестве с кардиологами, гинекологов и неонатологов.
13.4.1 Контроль частоты сердечных сокращений
Из-за отсутствия специфических данных, бета-блокаторы, верапамил, дилтиазем и дигоксин, все по классификации американского агентства FDA США для беременных по безопасности относятся к категории C (преимущества могут перевесить риск), за исключением Атенолол (Категория D: имеются доказательства риска). Их использование должно быть в низких дозах и коротким курсом. Ни один из агентов не обладает тератогенным действием, но они легко проникает через плаценту. Бета-блокаторы широко используются у беременных женщин с сердечно-сосудистых заболеваний (например, для управления артериальной гипертонией беременных и при преэклампсии), но может быть связано с задержкой внутриутробного развития, и таким образом после 20 недель беременности рекомендуется определять размеры плода. Дигоксин считается безопасным при аритмиях матери и плода. Недостаточно данных, чтобы комментировать Дилтиазем или верапамил, поэтому необходим контроль ЧСС с использованием бета-блокаторами и/или дигоксин. Что касается грудного вскармливания все прпараты по контролю ЧСС присутствует в грудном молоке, хотя уровень бета-блокаторов, дигоксина и верапамил являются слишком низкими, чтобы считаться вредными. Дилтиазем будет присутствовать на высоком уровне и должны рассматриваться препаратом второй линии лечения.
13.4. Контроль ритма
О контроле ритма терапии у беременных больных с AF сообщалось только в тематических исследованиях. Амиодарон связано с серьезными неблагоприятные фетальные побочными эффекты и должны рассматриваться только для чрезвычайных ситуаций. Флекаинид и соталол может использоваться для конверсии эмбриональных аритмий без основных побочных эффектов, и таким образом, вероятно, быть безопасными для лечения материнской симптоматическая AF. Электрическая кардиоверсия может быть эффективным для восстановления синусового ритма, когда тахиаритмия является причиной нестабильности гемодинамическими, с низкими показателями неблагоприятных исходов для матери и плода. Однако с учетом риска дистресса плода, Электрическая кардиоверсия следует выполнять только, где имеются возможности для фетальные мониторинга и возможности неотложного кесарева сечения. Как и при других чрезвычайных ситуациях во время беременности, пациенты должны получать 100% кислорода, внутривенный доступ должен быть создан как можно раньше, и мать должны быть расположены в левой боковой(латеральной) позиции для улучшения венозного возврата.
13.4.3 Антикоагуляция
VKAs следует избегать в первом триместре беременности из-за тератогенного воздействия и за 2-4 недель, до родов, чтобы избежать фетальные кровотечения. Низкий молекулярный вес гепаринов делает их безопасной субстанцией, поскольку они не проникают через плаценту. В третьем триместре беременности необходимы частые лабораторные анализы для контроля адекватной антикоагуляции (например, каждые 10-14 дней) и соответствующие корректировки дозы рекомендуется, учитывая, что в некоторых женщин высокие дозы VKA и гепарином могут быть необходимы для поддержания адекватной антикоагуляции. Беременных больных с AF и механических протезов клапанов, которые решили прекратить лечение VKA после консультации со своими специалистами между 6-12 недель беременности, должны получать непрерывный, коррегированную дозу т нефракционированного гепарина или коррегированную дозу гепарина низким молекулярным весом подкожно. Поскольку имеются лишь ограниченные данные о тератогенности NOACs, эти препараты следует избегать во время беременности.
 NOAC = антагонист витамина К пероральный антикоагулянт.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации во время беременности
13.5 Послеоперационная фибрилляция предсердий
AF обычно возникает после сердечной хирургии (происходящих в 15 – 45% больных), и ассоциируется с повышенной продолжительности пребывания в стационаре и более высокие показатели осложнений и смертности. Послеоперационное AF также не является редкостью после других крупных операции, особенно у пожилых пациентов. Лечение послеоперационного AF главным образом основывается на данных лечения пациентов, перенесших сердечную хирургии, с гораздо меньшими доказательствами у тех, кто не оперирован.
13.5.1 Профилактика послеоперационных фибрилляции предсердий
Бета-блокаторы уменьшают послеоперационное AF и суправентрикулярные тахикардии, хотя и с высокой гетерогенностью и умеренный риск систематической ошибки в систематическом обзоре опубликованных исследований. Наиболее часто изучаемым препаратом был пропранолол, с AF в 16,3% группы лечения против 31,7% в контрольной группе. В большинстве этих исследований, бета-блокаторы назначались постоперационно. Амиодарон снижал частоту послеоперационных AF по сравнению с бета-блокаторами в нескольких мета анализ, также сокращал пребывание в больнице.
Несмотря на первоначальные доклады по мета анализам, предоперационное назначение статинов не предотвращало послеоперационные AF в проспективном контролируемом исследовании . Другие виды терапии также были изучены в небольших, гипотезогенерированных испытаниях, но не продемонстрировали четкие благотворное воздействие. К ним относятся магний, n-3 полиненасыщенные жирные кислоты, Колхицин, кортикостероиды, и задняя перикардэктомия. Послеоперационные бижелудочковая овердрайв электрокардиостимуляция не получил широкое применение, несмотря на некоторые предложения профилактических эффектов.
13.5.2 Антикоагуляция
Послеоперационное AF ассоциируется с более ранним риском инсульта, повышенной заболеваемостью и смертности в 30 дней. В долгосрочной перспективе пациенты с эпизодом послеоперационной AF имеют два раза увеличение сердечно-сосудистой смертности и значительно повышенный риск будущего AF и ишемических инсульта, по сравнению с пациентами, которых сохраняется синусовый ритм после операции. ОАС связано с сокращением долгосрочной смертности у больных с послеоперационной AF, без доказательств в контролируемых испытаний. Необходимы убедительные данные для определения может ли долгосрочная антикоагуляция предотвратить инсульт у пациентов с послеоперационным AF на фоне высокого риск инсульта, и оценить могут ли короткие эпизоды послеоперационного AF (например, <48 h) носить аналогичный риск как при длительных эпизодах. Индикация и сроки ОАС в послеоперационное AF пациенты должны принимать во внимание риск послеоперационного кровотечения.
13.5.3 3 Контроль ритма при послеоперационной фибрилляции
У гемодинамически нестабильных пациентов кардиоверсия и рассмотрение приема антиаритмические препараты рекомендуется. Амиодарон или вернакалант ( vernakalant) были эффективны при преобразовании послеоперационной AF в синусовый ритм. Последние среднего размера исследования рандомизированных пациентов с послеоперационным AF любая терапия ритм контроля амиодарон или ЧСС не нашли разницу в госпитализации в течение последующих 60 дней, подчеркивая, что цель ритм контроля терапии является улучшить симптомы, связанные с AF при послеоперационной AF. У бессимптомных пациентов и тех, с приемлемыми симптомами контроль ЧСС или отсроченной кардиоверсией с предшествующей антикоагуляцией, является разумным подходом.
NOAC = антагонист витамина К пероральный антикоагулянт.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации во время беременности
13.5 Послеоперационная фибрилляция предсердий
AF обычно возникает после сердечной хирургии (происходящих в 15 – 45% больных), и ассоциируется с повышенной продолжительности пребывания в стационаре и более высокие показатели осложнений и смертности. Послеоперационное AF также не является редкостью после других крупных операции, особенно у пожилых пациентов. Лечение послеоперационного AF главным образом основывается на данных лечения пациентов, перенесших сердечную хирургии, с гораздо меньшими доказательствами у тех, кто не оперирован.
13.5.1 Профилактика послеоперационных фибрилляции предсердий
Бета-блокаторы уменьшают послеоперационное AF и суправентрикулярные тахикардии, хотя и с высокой гетерогенностью и умеренный риск систематической ошибки в систематическом обзоре опубликованных исследований. Наиболее часто изучаемым препаратом был пропранолол, с AF в 16,3% группы лечения против 31,7% в контрольной группе. В большинстве этих исследований, бета-блокаторы назначались постоперационно. Амиодарон снижал частоту послеоперационных AF по сравнению с бета-блокаторами в нескольких мета анализ, также сокращал пребывание в больнице.
Несмотря на первоначальные доклады по мета анализам, предоперационное назначение статинов не предотвращало послеоперационные AF в проспективном контролируемом исследовании . Другие виды терапии также были изучены в небольших, гипотезогенерированных испытаниях, но не продемонстрировали четкие благотворное воздействие. К ним относятся магний, n-3 полиненасыщенные жирные кислоты, Колхицин, кортикостероиды, и задняя перикардэктомия. Послеоперационные бижелудочковая овердрайв электрокардиостимуляция не получил широкое применение, несмотря на некоторые предложения профилактических эффектов.
13.5.2 Антикоагуляция
Послеоперационное AF ассоциируется с более ранним риском инсульта, повышенной заболеваемостью и смертности в 30 дней. В долгосрочной перспективе пациенты с эпизодом послеоперационной AF имеют два раза увеличение сердечно-сосудистой смертности и значительно повышенный риск будущего AF и ишемических инсульта, по сравнению с пациентами, которых сохраняется синусовый ритм после операции. ОАС связано с сокращением долгосрочной смертности у больных с послеоперационной AF, без доказательств в контролируемых испытаний. Необходимы убедительные данные для определения может ли долгосрочная антикоагуляция предотвратить инсульт у пациентов с послеоперационным AF на фоне высокого риск инсульта, и оценить могут ли короткие эпизоды послеоперационного AF (например, <48 h) носить аналогичный риск как при длительных эпизодах. Индикация и сроки ОАС в послеоперационное AF пациенты должны принимать во внимание риск послеоперационного кровотечения.
13.5.3 3 Контроль ритма при послеоперационной фибрилляции
У гемодинамически нестабильных пациентов кардиоверсия и рассмотрение приема антиаритмические препараты рекомендуется. Амиодарон или вернакалант ( vernakalant) были эффективны при преобразовании послеоперационной AF в синусовый ритм. Последние среднего размера исследования рандомизированных пациентов с послеоперационным AF любая терапия ритм контроля амиодарон или ЧСС не нашли разницу в госпитализации в течение последующих 60 дней, подчеркивая, что цель ритм контроля терапии является улучшить симптомы, связанные с AF при послеоперационной AF. У бессимптомных пациентов и тех, с приемлемыми симптомами контроль ЧСС или отсроченной кардиоверсией с предшествующей антикоагуляцией, является разумным подходом.
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для предотвращения послеоперационной фибрилляции предсердий
13.6 Предсердные аритмии у взрослых пациентов с врожденными пороками сердца
Предсердные аритмия (AF, трепетание предсердий, предсердная тахикардия) часто возникают после хирургического лечения врожденных пороков сердца, происходящих у 15-40% взрослых пациентов с врожденными пороками сердца (grown-up patients with congenital heart disease (GUCH)). Они связаны с сердечной недостаточностью, синкопальным состоянием, тромбоэмболическими событиями и внезапной смертью. Патофизиологические субстрат является комплексным, связанный с гипертрофией, фиброз, гипоксемии, хронические гемодинамическими перегрузками и хирургическими рубцами и патчами (накладками). Кроме того, первичные аномалии путей проведения могут привести к reentrant ре-ентерной предсердной и желудочковой тахикардии, блокадам сердца и синусового узла дисфункции. Мерцательная предсердная тахикардия или атипичное трепетание предсердий может наблюдаться после любой хирургической процедуры, связанных с атриотомией или предсердными патчами.
13.6.1 Рекомендации при мерцательной аритмии у взрослых пациентов с врожденными пороками сердца
Факторы риска обычных инсульта следует использовать для принятия решений о долгосрочной антикоагуляции у GUCH пациентов с AF. Кроме того, антикоагуляцию следует рассматривать у GUCH пациентов с предсердными аритмиями, когда они возникают при внутрисердечных вмешательствах, цианоз, паллиативной операции Fontan или относятся к правому желудочку. Можно использовать бета-блокаторами, верапамил, дилтиазем и препараты наперстянки. При терапии избегать брадикардии и гипотензии.
Блокаторы кальциевых каналов натрия подавляют примерно половину мерцательной аритмии у Fontan пациентов. Амиодарон является более эффективным, но длительное лечение несет высокий риск Внесердечные побочных эффектов особенно у молодых пациентов. Внутрисердечный тромбов широко распространены у GUCH пациентов, перенесших кардиоверсия в связи с ФП, но и у больных с предсердными тахикардиями или трепетанием предсердий. Таким образом следует рассматривать как TOE, так и в антикоагуляцию за несколько недель до запланированной кардиоверсии. Радиочастотная абляция может быть хорошим вариантом для симптоматического у GUCH пациентов с предсердными аритмиями, особенно, с трепетанием предсердий и других мерцательных реентерных тахикардиях. Лечебные мероприятия должны осуществляться специализированными группами в надлежащим образом квалифицированных центрах.
13.6.2 Предсердные тахиаритмии и дефекты межпредсердной перегородки
Трепетание предсердий и желудочков происходят в 14 – 22% взрослых с неуперированных предсердных септальных дефектах, особенно у пожилых пациентов, и может привести к сердечной недостаточности. Раннее оперирование может уменьшить, но не устранить риск AF. l Перегрузка объемом обех предсердий, легочная гипертензия, и возможно аритмогенное действие предсердных патчей могут способствовать этим аритмий. Антикоагуляцию должна быть принята с учетом факторов риска инсульта. У пациентов с историей пароксизмальная или стойких AF AF хирургия может рассматриваться во время хирургического закрытия или катетерной абляция во время интервенционного закрытия дефект межпредсердной перегородки. Катетерная абляция при поздних предсердных аритмиях было показано, быть эффективными в небольшой когорте больных после хирургического лкчения дефекта межпредсердной перегородки.
13.6.3 Предсердные тахиаритмии после операции по Фонтену
Предсердные аритмии встречаются в до 40% пациентов с циркуляции Fontan и может проявляться как трепетания предсердий, первичный предсердная тахикардия, AF и ускоренным узловым ритмом или узловой тахикардией с или без дисфункции синоатриального узла. Скорее всего, развитие долгосрочных предсердных аритмии имеется у больных с предсерднолегочными анастомозами (возможно, из-за перегрузки предсердий объемом и давлением) и в раннем послеоперационном периоде. Предсердные аритмии могут быть первым проявлением обструкции предсерднолегочных анастомозов, осложнение, которое должно быть диагносцировано. Образование тромбов правом предсердии часто встречается у оперированных Fontan пациентов с предсердными аритмиями и требует оральных антикоагулянтов. Оперативная трансформация общей кавопульмональный артерии в сочетании с хирургическим лечением аритмии может у некоторых пациентов, улучшить симптомы сердечной недостаточности и уменьшить рецидивированные аритмий, с низким уровнем рецидивирования клинически очевидной мерцательной аритмии в первые несколько лет после повторной операции. Катетерная абляция предсердных аритмии у больных Fontan была успешной у отдельных пациентов.
13.6.4 Предсердные тахиаритмии после коррекции Тетрады Фалло
После коррекции Тетрады Фалло примерно у трети пациентов развились предсердные аритмии, включая интра-предсердные реэентерные предсердные тахикардии, фокальные предсердные тахикардии и AF. Схемы с подходом кавотрикуспидального перешейка и области хирургической рубцовой трансформации правого предсердия были описаны как ответственные за предсердные аритмии.
Рекомендации взрослым пациентам с врождёнными пороками сердца
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации для предотвращения послеоперационной фибрилляции предсердий
13.6 Предсердные аритмии у взрослых пациентов с врожденными пороками сердца
Предсердные аритмия (AF, трепетание предсердий, предсердная тахикардия) часто возникают после хирургического лечения врожденных пороков сердца, происходящих у 15-40% взрослых пациентов с врожденными пороками сердца (grown-up patients with congenital heart disease (GUCH)). Они связаны с сердечной недостаточностью, синкопальным состоянием, тромбоэмболическими событиями и внезапной смертью. Патофизиологические субстрат является комплексным, связанный с гипертрофией, фиброз, гипоксемии, хронические гемодинамическими перегрузками и хирургическими рубцами и патчами (накладками). Кроме того, первичные аномалии путей проведения могут привести к reentrant ре-ентерной предсердной и желудочковой тахикардии, блокадам сердца и синусового узла дисфункции. Мерцательная предсердная тахикардия или атипичное трепетание предсердий может наблюдаться после любой хирургической процедуры, связанных с атриотомией или предсердными патчами.
13.6.1 Рекомендации при мерцательной аритмии у взрослых пациентов с врожденными пороками сердца
Факторы риска обычных инсульта следует использовать для принятия решений о долгосрочной антикоагуляции у GUCH пациентов с AF. Кроме того, антикоагуляцию следует рассматривать у GUCH пациентов с предсердными аритмиями, когда они возникают при внутрисердечных вмешательствах, цианоз, паллиативной операции Fontan или относятся к правому желудочку. Можно использовать бета-блокаторами, верапамил, дилтиазем и препараты наперстянки. При терапии избегать брадикардии и гипотензии.
Блокаторы кальциевых каналов натрия подавляют примерно половину мерцательной аритмии у Fontan пациентов. Амиодарон является более эффективным, но длительное лечение несет высокий риск Внесердечные побочных эффектов особенно у молодых пациентов. Внутрисердечный тромбов широко распространены у GUCH пациентов, перенесших кардиоверсия в связи с ФП, но и у больных с предсердными тахикардиями или трепетанием предсердий. Таким образом следует рассматривать как TOE, так и в антикоагуляцию за несколько недель до запланированной кардиоверсии. Радиочастотная абляция может быть хорошим вариантом для симптоматического у GUCH пациентов с предсердными аритмиями, особенно, с трепетанием предсердий и других мерцательных реентерных тахикардиях. Лечебные мероприятия должны осуществляться специализированными группами в надлежащим образом квалифицированных центрах.
13.6.2 Предсердные тахиаритмии и дефекты межпредсердной перегородки
Трепетание предсердий и желудочков происходят в 14 – 22% взрослых с неуперированных предсердных септальных дефектах, особенно у пожилых пациентов, и может привести к сердечной недостаточности. Раннее оперирование может уменьшить, но не устранить риск AF. l Перегрузка объемом обех предсердий, легочная гипертензия, и возможно аритмогенное действие предсердных патчей могут способствовать этим аритмий. Антикоагуляцию должна быть принята с учетом факторов риска инсульта. У пациентов с историей пароксизмальная или стойких AF AF хирургия может рассматриваться во время хирургического закрытия или катетерной абляция во время интервенционного закрытия дефект межпредсердной перегородки. Катетерная абляция при поздних предсердных аритмиях было показано, быть эффективными в небольшой когорте больных после хирургического лкчения дефекта межпредсердной перегородки.
13.6.3 Предсердные тахиаритмии после операции по Фонтену
Предсердные аритмии встречаются в до 40% пациентов с циркуляции Fontan и может проявляться как трепетания предсердий, первичный предсердная тахикардия, AF и ускоренным узловым ритмом или узловой тахикардией с или без дисфункции синоатриального узла. Скорее всего, развитие долгосрочных предсердных аритмии имеется у больных с предсерднолегочными анастомозами (возможно, из-за перегрузки предсердий объемом и давлением) и в раннем послеоперационном периоде. Предсердные аритмии могут быть первым проявлением обструкции предсерднолегочных анастомозов, осложнение, которое должно быть диагносцировано. Образование тромбов правом предсердии часто встречается у оперированных Fontan пациентов с предсердными аритмиями и требует оральных антикоагулянтов. Оперативная трансформация общей кавопульмональный артерии в сочетании с хирургическим лечением аритмии может у некоторых пациентов, улучшить симптомы сердечной недостаточности и уменьшить рецидивированные аритмий, с низким уровнем рецидивирования клинически очевидной мерцательной аритмии в первые несколько лет после повторной операции. Катетерная абляция предсердных аритмии у больных Fontan была успешной у отдельных пациентов.
13.6.4 Предсердные тахиаритмии после коррекции Тетрады Фалло
После коррекции Тетрады Фалло примерно у трети пациентов развились предсердные аритмии, включая интра-предсердные реэентерные предсердные тахикардии, фокальные предсердные тахикардии и AF. Схемы с подходом кавотрикуспидального перешейка и области хирургической рубцовой трансформации правого предсердия были описаны как ответственные за предсердные аритмии.
Рекомендации взрослым пациентам с врождёнными пороками сердца
 AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт (два раза), сосудистые заболевания, возраст 65 – 74 и пол (женский); GUCH = взрослые пациенты с врожденными пороками сердца; ОАС = оральные антикоагулянты; TOE = трансэзофагеальная эхокардиография.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.7 Рекомендации при трепетании предсердий
Цели управления трепетания предсердий, аналогичны для AF. Основываясь на имеющихся доказательствах, риск инсульта у больных с трепетания предсердий не сильно отличается от того, при AF. Кроме того, у многих пациентов с диагнозом трепетания предсердий развивается AF. Таким образом антикоагуляцию следует использовать у пациентов с трепетания предсердий похоже, как у больных с AF. Контроль ЧСС при трепетании предсердий достигается с помощью же лекарства как и AF, но часто более трудно достижим. Флекаинид, пропафенон, dofetilide и внутривенное введение дофетилид полезны для кардиоверсия фибрилляции предсердий. Они должны комбинироваться с препаратами контроля ЧСС, чтобы избежать замедления волн трепетание желудочков проведение 1:1. Дофетилид является более эффективным для преобразования трепетания предсердий, чем AF, в то время как vernakalant менее эффективен при преобразовании типичного трепетания предсердий. Электрическая кардиоверсия фибрилляции предсердий может производиться с использованием более низких энергий (50 – 100 J) чем для AF. Предсердное искусственное ускорение сердечного ритма с целью подавления эктопических очагов автоматизма через Электрокардиостимулятор приводится или через эндокард, или Чреспищеводные катетеры которые могут преобразовать трепетания предсердий в синусового ритма. Антикоагуляционную и трансэзофагальную эхокардиографию после кардиоверсии или овердрайв электрокардиостимуляции должны использоваться аналогично, как при AF.
Абляция кавотрикуспидального перешейка при истсмус -зависимых правопредсердных трепетаниях предсердий (более характерное против часовой стрелки трепетания предсердий или менее общее по часовой стрелке трепетания предсердий) восстанавливает и поддерживает синусовый ритм с успеха 90 – 95%. Это может также уменьшить AF повторений у отдельных пациентов, и помочь предотвратить госпитализаций. Абляция перешейка является сравнительно безопасным и более эффективным, чем антиаритмические лекарственной терапии и рекомендуется при рецидивирующих трепетаних предсердий. Катетерная абляция левого предсердия при macroreentrant( макро реентерные) тахикардия является более сложным, с более низким ставкам успеха и более высокие показатели повторения.
AF = фибрилляция предсердий; ЧА2DS2-VASc = застойная сердечная недостаточность, гипертонической болезни, возраст ≥75 (два раза), диабет, инсульт (два раза), сосудистые заболевания, возраст 65 – 74 и пол (женский); GUCH = взрослые пациенты с врожденными пороками сердца; ОАС = оральные антикоагулянты; TOE = трансэзофагеальная эхокардиография.
A Класс рекомендации.
B Уровень доказательства.
C Упоминания поддерживающие рекомендации.
13.7 Рекомендации при трепетании предсердий
Цели управления трепетания предсердий, аналогичны для AF. Основываясь на имеющихся доказательствах, риск инсульта у больных с трепетания предсердий не сильно отличается от того, при AF. Кроме того, у многих пациентов с диагнозом трепетания предсердий развивается AF. Таким образом антикоагуляцию следует использовать у пациентов с трепетания предсердий похоже, как у больных с AF. Контроль ЧСС при трепетании предсердий достигается с помощью же лекарства как и AF, но часто более трудно достижим. Флекаинид, пропафенон, dofetilide и внутривенное введение дофетилид полезны для кардиоверсия фибрилляции предсердий. Они должны комбинироваться с препаратами контроля ЧСС, чтобы избежать замедления волн трепетание желудочков проведение 1:1. Дофетилид является более эффективным для преобразования трепетания предсердий, чем AF, в то время как vernakalant менее эффективен при преобразовании типичного трепетания предсердий. Электрическая кардиоверсия фибрилляции предсердий может производиться с использованием более низких энергий (50 – 100 J) чем для AF. Предсердное искусственное ускорение сердечного ритма с целью подавления эктопических очагов автоматизма через Электрокардиостимулятор приводится или через эндокард, или Чреспищеводные катетеры которые могут преобразовать трепетания предсердий в синусового ритма. Антикоагуляционную и трансэзофагальную эхокардиографию после кардиоверсии или овердрайв электрокардиостимуляции должны использоваться аналогично, как при AF.
Абляция кавотрикуспидального перешейка при истсмус -зависимых правопредсердных трепетаниях предсердий (более характерное против часовой стрелки трепетания предсердий или менее общее по часовой стрелке трепетания предсердий) восстанавливает и поддерживает синусовый ритм с успеха 90 – 95%. Это может также уменьшить AF повторений у отдельных пациентов, и помочь предотвратить госпитализаций. Абляция перешейка является сравнительно безопасным и более эффективным, чем антиаритмические лекарственной терапии и рекомендуется при рецидивирующих трепетаних предсердий. Катетерная абляция левого предсердия при macroreentrant( макро реентерные) тахикардия является более сложным, с более низким ставкам успеха и более высокие показатели повторения.
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по контролю трепетания предсердий
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации по контролю трепетания предсердий
- Активное привлечение пациентов, образование и самоконтроль
 AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации в отношении участия пациента, образования и самоуправления
AF = фибрилляция предсердий.
a Класс рекомендации.
b Уровень доказательства.
c Упоминания, поддерживающие рекомендации.
Рекомендации в отношении участия пациента, образования и самоуправления
- Пробелы в доказательствах
- Делать и не делать обязательными положения рекомендаций
- Краткое резюме рекомендаций по ФП
- Используйте ЭКГ обследование уязвимых групп населения для AF, особенно выживших после инсульта и пожилых людей.
- Документируйте AF методом ЭКГ перед началом лечения.
- Обследуйте всех пациентов AF клинически, ЭКГ и эхокардиографически для выявления основных сердечно-сосудистых заболеваний, таких как гипертония, сердечная недостаточность, пороки сердца и др.
- Предоставляйте AF пациентам информацию и проводите обучение для улучшения приверженности к лечению.
- Предложите изменить образ жизни для всех подходящих пациентов AF для повышения эффективности лечения.
- Лечить основных сердечно-сосудистых заболеваний надлежащим образом, например, коррекция или замена клапана у AF пациентов с значительными пороками сердца, лечение сердечной недостаточности или контроль гипертонической болезни, среди прочих.
- Используйте оральные антикоагулянты у всех пациентов AF, если они имеют низкий риск инсульта, основанный на шкале CHA2DS2VASc или определите абсолютные противопоказания для антикоагулянтной терапии.
- Антикоагуляция для пациентов с трепетанием предсердий похожа при AF. Предложите абляция перешейка пациентам с симптомами трепетания.
- Уменьшить все модифицируемые факторы риска кровотечения у всех пациентов AF при оральной антикоагуляции, например, при лечении гипертонической болезни, сведения к минимуму продолжительности и интенсивности сочетанной антиагрегантов и нестероидной противовоспалительной лекарственной терапии, лечение анемии и устранение причин потери крови, поддержание стабильных МНО значений у пациентов на VKAs и снижение потребления алкоголя.
- Проверьте частоту сокращения желудочков у всех пациентов AF и используйте лекарства для контроля ЧСС с достижением приемлемой скорости.
- Оцените связанные с AF симптомы у всех пациентов AF, используя шкалу симптомов EHRA. Всякий раз, когда пациенты имеют симптомы, связанные с AF, проводите лечение для уменьшения степени выраженности симптомов путем контроля ЧСС и предлагая антиаритмические препараты, кардиоверсию, или катетерную или хирургическую аблации.
- Выберите Антиаритмические препараты, на основе их профиля безопасности и рассмотрете возможность катетерной или хирургической аблации при неэффективности антиаритмических препаратов.
- Не предлагают обычные генетическое тестирование пациентам AF, кроме случаев если есть подозрение наследственное заболевание сердца.
- Не используйте антитромбоцитарную терапию для профилактики инсульта при AF.
- Не прекращайте постоянный прием оральных антикоагулянтов у пациентов AF с повышенным рисом к инсульту если такое решение не принято многодисциплинарной группой.
- Не используйте терапию контроля ритма у бессимптомных пациентов AF, за исключением больных с перманентной ФП.
- Не выполняйте кардиоверсию или катетерную абляцию без антикоагулянтов , за исключением случаев когда тромбоз предсердия исключен трансэзофагеальной эхокардиографией.


