Просмотров: 3 824
Рекомендации EULAR по лечению АНЦА- ассоциированных васкулитов -2016г (Дайджест)
EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis
Получено 5 января 2016 года. Опубликованные в Интернете впервые 23 июня 2016 г.
Аннотация
Новые рекомендации Европейской лиги против ревматизма (EULAR) обновляют рекомендации 2009 года по лечению первичных васкулитов сосудов мелкого и среднего калибра (ANCA-associated vasculitis (AAV). Рекомендации охватывают общие аспекты, такие, как достижение ремиссии и необходимость общего принятия решений между врачами и пациентами. Более конкретные пункты относятся к началу иммуносупрессивной терапии в сочетании с глюкокортикоидов для достижения ремиссии; контролю ремиссии; индукции ремиссии в ситуациях, угрожающих жизни или при поражении органов -мишеней с помощью циклофосфамида(ЦФ) и ритуксимаба показавшими аналогичную эффективность; результативности плазмофереза при быстром прогрессировании почечной недостаточности или острого диффузного легочного кровотечения. Эти рекомендации предназначены для врачей -лечебников, преподавателям медицинских институтов, студентам -медикам, фармацевтам и специалистам по контролю за оборотом ЛС.
Введение
К васкулитам связанными с антинейтрофильными цитоплазматическими антителами (АНЦА)( antineutrophil cytoplasmic antibody (ANCA) ) относится Гранулематоз с полиангиитом (ГПА, гранулематоз Вегенера) (GPA, Wegener’s granulomatosis), Микроскопический полиангиит (МПА) microscopic polyangiitis (MPA) и Полиартериит с поражением легких(Синдром Чарджа – Стросса, Аллергический гранулематозный ангиит, Эозинофильный гранулематоз с полиангиитом (ЭГПA, синдром Чарджа-Стросса)( eosinophilic granulomatosis with polyangiitis (, EGPA Churg-Strauss syndrome). Показатели ежегодной заболеваемости на миллион жителей в Европе МПА и ЭГПА составляют по ГПА 2.1 – 14,4, МПА 2,4 – 10.1 и ЭГПА 0,5 – 3,7. Реальная распространенность AAV оценивается в 46 – 184 случая на миллион. По оценкам, 5-летняя выживаемость для ГПА составляет 74-91%, МПА 45-76% и ЭГПА 60 – 97%, соответственно.
Примечание переводчика. При переводе и адаптации текста использовались сокращения авторов статьи, которые не всегда совпадают с российскими. Так же рядом с названием васкулитов приводится английское название заболеваний и их сокращения. В текст также вставляются англ. сокращения, удачно отражающиеся суть и сокращающие размер предложения.
Справочная информация и обоснование
Рекомендации составлены на основании 1691 публикации за последние 5 лет в журналах по первичным системным васкулитам во внутренней медицине, ревматологии и нефрологии. Целевая группа состояла из 21 члена, включавших: пациента (Джон Миллс), медсестры (Janice Муни), патологоаната, оториноларинголога, пульмонолога, иммунолога, офтальмолога ,2-х общих интернистов, 6 нефрологов и 6 ревматологов с академическим и/или клинический опытом в области васкулитов.
Заявления
Заявления в этой рукописи называются «рекомендации», а не «руководящие принципы» или «вопросы для рассмотрения» потому, что они предлагают рекомендации, которые должны быть адаптированы для конкретной клинической ситуации (Таблица 1)
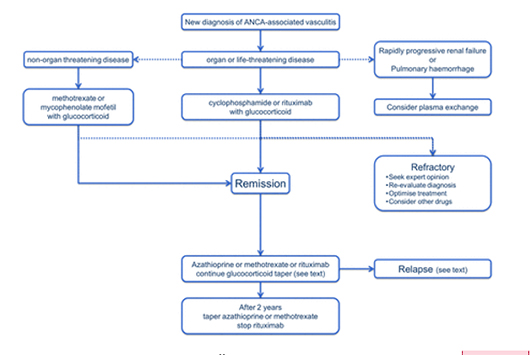
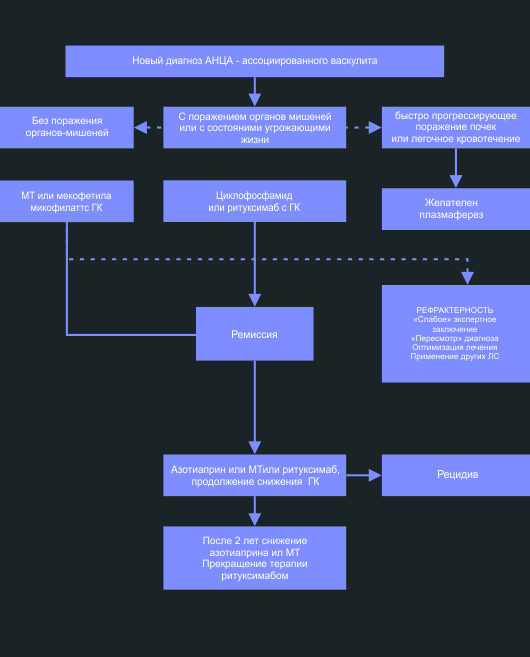 Таблица 1. Алгоритм для контроля ANCA-связанных васкулитов. Пунктирные линии указывают на альтернативные или дополнительные меры для рассмотрения.
AAV-как болезнь очень изменчива, непредсказуема и потенциально опасна для жизни. Лечение обычно включает в себя мощные иммунодепресанты, часто с риском значительных побочных эффектов. Возможно добиться ремиссии и даже полностью прекратить прием ЛС, но рецидив закономерен. Кроме того, AAV отрицательно влияет на качество жизни даже у пациентов, находящихся в клинической ремиссии. Это может быть следствием как самого заболевания, так и результатом его лечения. Мы рекомендуем основополагающий принцип лечения – совместное принятия решения пациентом и специалистом.
Рекомендация 1
Мы рекомендуем пациентам с AAV обращаться или тесно сотрудничать с центрами по лечению РЗ.
(Уровень доказательства III; класс рекомендации C; Сила – 100% голосов)
Редкость AAV создает трудности в его лечении. Ведение таких пациентов требует экспертного сопровождения для дифференциального диагноза обострения васкулита от травмы или инфекции. Пациентам могут потребоваться консультации специалистов с опытом ведения AAV, иммунологический мониторинг, использование ритуксимаба при рефрактерном течении, специализированная рентгенография, привлечения окулиста, локальные инъекции при подсвязочном стенозе и почечная трансплантация. Для пациентов с рефрактерным течением болезни лучшим вариантом может быть лечение в центрах, участвующих в клинических испытаниях. При AAV может наступить рецидив после нескольких лет ремиссии, с поражением органов и систем, ранее не вовлеченных в воспалительный процесс. У пациентов могут развиться осложнения от лечения через много лет после его прекращения. Все пациенты с AAV должны быть обеспечены долгосрочным наблюдением и иметь быстрый доступ к специалистам при необходимости.
Рекомендация 2
Положительный результат биопсии подтверждает диагноз васкулита. Биопсия рекомендуется при установлении диагноза впервые и при ведении пациентов, с подозрением на рецидив васкулита. (Уровень доказательства III; класс рекомендации C; сила голосования 81%)
Положительная биопсия при AAV полезна при установлении первоначального диагноза или его рецидива. Гистопатологические доказательства васкулита, такие как «пауси-иммунный гломерулонефрит» или «малоиммунный гломерулонефрит»( pauci-immune glomerulonephritis) или некротизирующий васкулит в любом органе, остается золотым стандартом для диагностики. Диагностическая ценность биопсии варьируется и зависит от органа – мишени. У больных ГПА при поражении почек диагностическая ценность биопсии почек самая высокая и достигает 91,5%. При ЛОР- осмотре больных с ГПА часто обнаруживается патология и биопсия из этих областей информативна в 68,4%. При 60 биопсиях носа, 27 придаточных пазух носа, 17 гортани, 5 периорбитальной области, 5 ротовой полости, 4 среднего уха, 3 сосцевидного отростка, 2 наружного уха и 3 биопсий слюнной железы были обнаружены признаки неспецифического хронического воспаления, а гранулемы и васкулит обнаруживались реже, чем при биопсии других тканях. Биопсия легкого имеет различную диагностическую чувствительность, от 12% при трансбронхиальной биопсии альвеолярной ткани при ГПА и 66,7% для ЭГПА. Открытая биопсия легкого, хотя и более травматична, но обеспечивают более высокий диагностический результат.
Чрескожную биопсию почек следует выполнять под ультразвуковым контролем, что обеспечивает низкий риск осложнений, включая кровотечения. Риск кровотечения при чрескожной биопсии почек выше у пациентов, получавших плазмаферез. Общие факторы, связанные с повышенным риском кровотечения, требующие последующих переливания крови включают старость, повышение систолического артериального давления и нарушение функции почек.
Существующие гистологические классификации требуют дальнейшего совершенствования, но такие изменения как клубочковой склероз имеют очевидные отрицательные прогностическое значение для пациентов с AAV.
Рекомендация 3
Для индукции ремиссии, впервые выявленном случае поражения органа или в случае угрозы жизни, при AAV мы рекомендуем лечение комбинацией глюкокортикоидов с либо циклофосфамидом или Ритуксимабом.
Циклофосфамид(ЦФ)
уровень доказательства 1A для ГПА и MПA (класс рекомендации A; сила 100% голосов)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 88%)
Ритуксимаб
уровень доказательства 1B для ГПА и МПА (класс рекомендации A; сила голосования 82%)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 59%)
Начиная с 1970-х годов терапия, состоящая из комбинации ГК (1 мг/кг/день — максимальная суточная доза-80 мг) с ЦФ (2 мг/кг/сут — максимум 200 мг/день) была использована для индукции ремиссии при AAV. Из-за опасения по поводу кумулятивного действия ЦФ, дозировки для пульс -терапии при внутривенном введении, схемы терапии были разработаны и испытаны в крупнейшем исследовании CYCLOPS (randomised trial of daily oral versus pulse Cyclophosphamide as therapy for ANCA-associated Systemic Vasculitis) . Было доказано, что пульс терапия ЦФ позволяла чаще достичь ремиссии и была связана с меньшим количеством побочных эффектов, чем прием ЦФ per os. Долгосрочное наблюдение этой когорты показало, что доля участников с хотя бы с одним рецидивом была выше у лиц, получивших пульс -терапию ЦФ, но статистически достоверной разницы по выживанию, функции почек к концу исследования или неблагоприятных событий между двумя группами не было. Однако, в импульсных схемах предпочтение отдается пульс – терапии из-за снижения суммарной дозы ЦФ и снижения риска осложнений, связанных с мочевым пузырем (геморрагический цистит).
Оценка доказательств для использования ЦФ при ЭГПА ниже, чем при ГПА/МПА.В одном исследовании сравнивались дозы ЦФ с разным интервалом введения: (0,6 мг/м2) был первоначально использован каждые 2 недели в течение месяца, а затем каждые 4 недели. Одна группа получила шесть пульсов, другая 12. В обеих группах за одинаковое время (21/23 в первой группе, 21/25 в другой) была достигнута полная ремиссия.
Противорвотная терапия должно осуществляться регулярно при внутривенном введении ЦФ. Метаболиты ЦФ являются токсичными для уроэпителия и могут вызвать геморрагический цистит в краткосрочной перспективе и злокачественные опухоли в долгосрочной перспективе. Клинически целесообразно рекомендовать пациентам пить много жидкости или вводить ее в/в в день инфузии для разбавления метаболитов в моче. Пациентам, получающим пульс терапию ЦФ можно рекомендовать орально или внутривенно 2-меркаптоэтансульфонат натрия (МЕSNА), который связывается с акролеином, токсическим метаболитом ЦФ и делает его нетоксичным. МЕSNА также тормозит химическое разложение 4-гидроксиметаболитов, что в дальнейшем сокращает количество токсичных продуктов акролеина в моче. МЕSNА также может быть полезна у пациентов, получающих длительно таблетки ЦФ.
Мониторинг пациентов, получающих ЦФ должен проводиться по стандартным протоколам. В процессе лечения возможно изменения дозы или прекращение приема ЦФ в случае острой лейкопении или её нарастания с течением времени. В случае стабильной лейкопении можно продолжать иммуносупрессию под «жестким» мониторингом картины крови. Мы рекомендуем профилактику инфекции Pneumocystis jirovecii триметопримом /сульфаметоксазол (800/160 мг через день или 400/80 мг ежедневно) у всех пациентов получающих ЦФ, при отсутствии противопоказаний. Использование вдыхаемого ежемесячно пентамидина в случае негативной реакции или противопоказаний к триметоприм/сульфаметоксазолу может быть полезным, но не является экономически эффективным и обычно строго не регламентируется. Другие альтернативы включают Дапсон(dapsone) и атовакон(atovaquone).
Ритуксимаб при AAV был протестирован в двух РКИ при лечении ЭГПА и МПА в сравнении со стандартным режимом ЦФ/азатиоприн в лечении активных, «генерализованных» AVV. В обоих исследованиях пациентs первоначально получили высокие дозы ГК с последующим снижением дозы. Доза Ритуксимаба в обоих исследованиях было 375 мг/м2, один раз в неделю. Всего четыре инфузии. В обоих испытаниях rituximab не уступал ЦФ и был более эффективным при рецидивирующем течении заболевания. Ретроспективный анализ наблюдения 41 пациентов с ЭГПА, которые получили различные схемы rituximab показал, что в 34% достигнута полная ремиссия за 6 месяцев и 49% за 12 месяцев.
Из-за высокой стоимости Ритуксимаба, его использование ограничено в некоторых странах, и поэтому возможно только в специализированных центрах. Но могут быть ещё индивидуальные случаи, когда предпочтительнее Ритуксимаб чем ЦФ, например, у пациентов, которые хотят сохранить свои репродуктивные потенциал. Прием ЦФ связан с сокращением овариальный запаса, недостаточность яичников и мужским бесплодием. Долгосрочные последствия rituximab на фертильность не были изучены, и сообщений по данной проблеме не поступало. У больных с тяжелой формой болезни лечение не должно быть отложено, но обсуждение этих вопросов должно происходить.
Сравнивались дозы 7,5 мг и 10 мг преднизолона (или эквивалент) после 3 месяцев (12 недель) лечения. Обзор схемы сокращения приема преднизолона показал, что в среднем дозу 10 мг была достигнута после 19 недель, а в дозе 7,5 мг после 21 недель (рис. 2). Хотя целевой дозы преднизолона 7,5-10 мг желательно достичь за 3 месяца, на практике это может быть и 5 месяцев.
Таблица 1. Алгоритм для контроля ANCA-связанных васкулитов. Пунктирные линии указывают на альтернативные или дополнительные меры для рассмотрения.
AAV-как болезнь очень изменчива, непредсказуема и потенциально опасна для жизни. Лечение обычно включает в себя мощные иммунодепресанты, часто с риском значительных побочных эффектов. Возможно добиться ремиссии и даже полностью прекратить прием ЛС, но рецидив закономерен. Кроме того, AAV отрицательно влияет на качество жизни даже у пациентов, находящихся в клинической ремиссии. Это может быть следствием как самого заболевания, так и результатом его лечения. Мы рекомендуем основополагающий принцип лечения – совместное принятия решения пациентом и специалистом.
Рекомендация 1
Мы рекомендуем пациентам с AAV обращаться или тесно сотрудничать с центрами по лечению РЗ.
(Уровень доказательства III; класс рекомендации C; Сила – 100% голосов)
Редкость AAV создает трудности в его лечении. Ведение таких пациентов требует экспертного сопровождения для дифференциального диагноза обострения васкулита от травмы или инфекции. Пациентам могут потребоваться консультации специалистов с опытом ведения AAV, иммунологический мониторинг, использование ритуксимаба при рефрактерном течении, специализированная рентгенография, привлечения окулиста, локальные инъекции при подсвязочном стенозе и почечная трансплантация. Для пациентов с рефрактерным течением болезни лучшим вариантом может быть лечение в центрах, участвующих в клинических испытаниях. При AAV может наступить рецидив после нескольких лет ремиссии, с поражением органов и систем, ранее не вовлеченных в воспалительный процесс. У пациентов могут развиться осложнения от лечения через много лет после его прекращения. Все пациенты с AAV должны быть обеспечены долгосрочным наблюдением и иметь быстрый доступ к специалистам при необходимости.
Рекомендация 2
Положительный результат биопсии подтверждает диагноз васкулита. Биопсия рекомендуется при установлении диагноза впервые и при ведении пациентов, с подозрением на рецидив васкулита. (Уровень доказательства III; класс рекомендации C; сила голосования 81%)
Положительная биопсия при AAV полезна при установлении первоначального диагноза или его рецидива. Гистопатологические доказательства васкулита, такие как «пауси-иммунный гломерулонефрит» или «малоиммунный гломерулонефрит»( pauci-immune glomerulonephritis) или некротизирующий васкулит в любом органе, остается золотым стандартом для диагностики. Диагностическая ценность биопсии варьируется и зависит от органа – мишени. У больных ГПА при поражении почек диагностическая ценность биопсии почек самая высокая и достигает 91,5%. При ЛОР- осмотре больных с ГПА часто обнаруживается патология и биопсия из этих областей информативна в 68,4%. При 60 биопсиях носа, 27 придаточных пазух носа, 17 гортани, 5 периорбитальной области, 5 ротовой полости, 4 среднего уха, 3 сосцевидного отростка, 2 наружного уха и 3 биопсий слюнной железы были обнаружены признаки неспецифического хронического воспаления, а гранулемы и васкулит обнаруживались реже, чем при биопсии других тканях. Биопсия легкого имеет различную диагностическую чувствительность, от 12% при трансбронхиальной биопсии альвеолярной ткани при ГПА и 66,7% для ЭГПА. Открытая биопсия легкого, хотя и более травматична, но обеспечивают более высокий диагностический результат.
Чрескожную биопсию почек следует выполнять под ультразвуковым контролем, что обеспечивает низкий риск осложнений, включая кровотечения. Риск кровотечения при чрескожной биопсии почек выше у пациентов, получавших плазмаферез. Общие факторы, связанные с повышенным риском кровотечения, требующие последующих переливания крови включают старость, повышение систолического артериального давления и нарушение функции почек.
Существующие гистологические классификации требуют дальнейшего совершенствования, но такие изменения как клубочковой склероз имеют очевидные отрицательные прогностическое значение для пациентов с AAV.
Рекомендация 3
Для индукции ремиссии, впервые выявленном случае поражения органа или в случае угрозы жизни, при AAV мы рекомендуем лечение комбинацией глюкокортикоидов с либо циклофосфамидом или Ритуксимабом.
Циклофосфамид(ЦФ)
уровень доказательства 1A для ГПА и MПA (класс рекомендации A; сила 100% голосов)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 88%)
Ритуксимаб
уровень доказательства 1B для ГПА и МПА (класс рекомендации A; сила голосования 82%)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 59%)
Начиная с 1970-х годов терапия, состоящая из комбинации ГК (1 мг/кг/день — максимальная суточная доза-80 мг) с ЦФ (2 мг/кг/сут — максимум 200 мг/день) была использована для индукции ремиссии при AAV. Из-за опасения по поводу кумулятивного действия ЦФ, дозировки для пульс -терапии при внутривенном введении, схемы терапии были разработаны и испытаны в крупнейшем исследовании CYCLOPS (randomised trial of daily oral versus pulse Cyclophosphamide as therapy for ANCA-associated Systemic Vasculitis) . Было доказано, что пульс терапия ЦФ позволяла чаще достичь ремиссии и была связана с меньшим количеством побочных эффектов, чем прием ЦФ per os. Долгосрочное наблюдение этой когорты показало, что доля участников с хотя бы с одним рецидивом была выше у лиц, получивших пульс -терапию ЦФ, но статистически достоверной разницы по выживанию, функции почек к концу исследования или неблагоприятных событий между двумя группами не было. Однако, в импульсных схемах предпочтение отдается пульс – терапии из-за снижения суммарной дозы ЦФ и снижения риска осложнений, связанных с мочевым пузырем (геморрагический цистит).
Оценка доказательств для использования ЦФ при ЭГПА ниже, чем при ГПА/МПА.В одном исследовании сравнивались дозы ЦФ с разным интервалом введения: (0,6 мг/м2) был первоначально использован каждые 2 недели в течение месяца, а затем каждые 4 недели. Одна группа получила шесть пульсов, другая 12. В обеих группах за одинаковое время (21/23 в первой группе, 21/25 в другой) была достигнута полная ремиссия.
Противорвотная терапия должно осуществляться регулярно при внутривенном введении ЦФ. Метаболиты ЦФ являются токсичными для уроэпителия и могут вызвать геморрагический цистит в краткосрочной перспективе и злокачественные опухоли в долгосрочной перспективе. Клинически целесообразно рекомендовать пациентам пить много жидкости или вводить ее в/в в день инфузии для разбавления метаболитов в моче. Пациентам, получающим пульс терапию ЦФ можно рекомендовать орально или внутривенно 2-меркаптоэтансульфонат натрия (МЕSNА), который связывается с акролеином, токсическим метаболитом ЦФ и делает его нетоксичным. МЕSNА также тормозит химическое разложение 4-гидроксиметаболитов, что в дальнейшем сокращает количество токсичных продуктов акролеина в моче. МЕSNА также может быть полезна у пациентов, получающих длительно таблетки ЦФ.
Мониторинг пациентов, получающих ЦФ должен проводиться по стандартным протоколам. В процессе лечения возможно изменения дозы или прекращение приема ЦФ в случае острой лейкопении или её нарастания с течением времени. В случае стабильной лейкопении можно продолжать иммуносупрессию под «жестким» мониторингом картины крови. Мы рекомендуем профилактику инфекции Pneumocystis jirovecii триметопримом /сульфаметоксазол (800/160 мг через день или 400/80 мг ежедневно) у всех пациентов получающих ЦФ, при отсутствии противопоказаний. Использование вдыхаемого ежемесячно пентамидина в случае негативной реакции или противопоказаний к триметоприм/сульфаметоксазолу может быть полезным, но не является экономически эффективным и обычно строго не регламентируется. Другие альтернативы включают Дапсон(dapsone) и атовакон(atovaquone).
Ритуксимаб при AAV был протестирован в двух РКИ при лечении ЭГПА и МПА в сравнении со стандартным режимом ЦФ/азатиоприн в лечении активных, «генерализованных» AVV. В обоих исследованиях пациентs первоначально получили высокие дозы ГК с последующим снижением дозы. Доза Ритуксимаба в обоих исследованиях было 375 мг/м2, один раз в неделю. Всего четыре инфузии. В обоих испытаниях rituximab не уступал ЦФ и был более эффективным при рецидивирующем течении заболевания. Ретроспективный анализ наблюдения 41 пациентов с ЭГПА, которые получили различные схемы rituximab показал, что в 34% достигнута полная ремиссия за 6 месяцев и 49% за 12 месяцев.
Из-за высокой стоимости Ритуксимаба, его использование ограничено в некоторых странах, и поэтому возможно только в специализированных центрах. Но могут быть ещё индивидуальные случаи, когда предпочтительнее Ритуксимаб чем ЦФ, например, у пациентов, которые хотят сохранить свои репродуктивные потенциал. Прием ЦФ связан с сокращением овариальный запаса, недостаточность яичников и мужским бесплодием. Долгосрочные последствия rituximab на фертильность не были изучены, и сообщений по данной проблеме не поступало. У больных с тяжелой формой болезни лечение не должно быть отложено, но обсуждение этих вопросов должно происходить.
Сравнивались дозы 7,5 мг и 10 мг преднизолона (или эквивалент) после 3 месяцев (12 недель) лечения. Обзор схемы сокращения приема преднизолона показал, что в среднем дозу 10 мг была достигнута после 19 недель, а в дозе 7,5 мг после 21 недель (рис. 2). Хотя целевой дозы преднизолона 7,5-10 мг желательно достичь за 3 месяца, на практике это может быть и 5 месяцев.
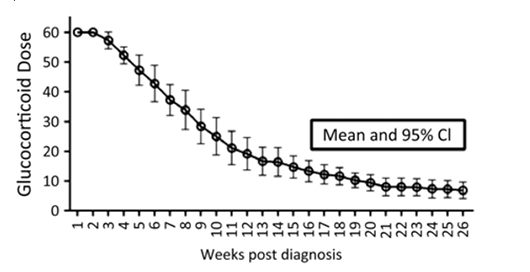 Рисунок 2
Протокол достижения целевой дозы преднизолона по данным клинических исследований при АНЦА -ассоциированных васкулитах.
AAVs имеют многообразный спектр проявлений, от вялотекущих до угрожающих жизни. Настоящие рекомендации следуют существующей системе классификации, но в долгосрочной перспективе и будущем, с учетом данных по результатам фенотипов, сегодняшние ориентиры могут измениться.
Рекомендация 4
Для индукции ремиссии AAV, без поражения внутренних органов, мы рекомендуем лечение комбинацией глюкокортикоидов и или метотрексата или Микофенолата мофетила.
Метотрексат
Уровень доказательства 1B; класс рекомендации B; сила голосования 77%.
Микофенолата мофетил (ММФ)
Уровень доказательства 1B; класс рекомендации C; сила голосования 65%.
Подчеркивается, что МТ или ММФ не должны использоваться для индукции ремиссии в следующих клинических ситуациях:
Менингеальные поражения
Ретро -орбитальная болезнь
Поражение сердца
Мезентериальные (брыжеечные) поражение
Острое начало множественного мононеврита
Легочного кровотечения любой тяжести*
*противопоказания для МТ И ММФ при AVV
МТ (20-25 мг в неделю, табл или парентерально) может использоваться в качестве альтернативы ЦФ в больных с менее тяжелым течением заболеваниями и при нормальной функции почек. В РКИ сравнивалось использование МТ или ММФ для индукции ремиссии у больных с AAV. Таблетки МТ 20-25 мг в неделю не уступали табл ЦФ при 6 мес приеме. Но долгосрочные наблюдения показали, что МТ менее эффективно контролировал заболевание чем ЦФ. МТ рекомендуется только в случаях без поражения внутренних органов. Рекомендуются следующие показания к применению, но при отсутствии поражения почек.
Рисунок 2
Протокол достижения целевой дозы преднизолона по данным клинических исследований при АНЦА -ассоциированных васкулитах.
AAVs имеют многообразный спектр проявлений, от вялотекущих до угрожающих жизни. Настоящие рекомендации следуют существующей системе классификации, но в долгосрочной перспективе и будущем, с учетом данных по результатам фенотипов, сегодняшние ориентиры могут измениться.
Рекомендация 4
Для индукции ремиссии AAV, без поражения внутренних органов, мы рекомендуем лечение комбинацией глюкокортикоидов и или метотрексата или Микофенолата мофетила.
Метотрексат
Уровень доказательства 1B; класс рекомендации B; сила голосования 77%.
Микофенолата мофетил (ММФ)
Уровень доказательства 1B; класс рекомендации C; сила голосования 65%.
Подчеркивается, что МТ или ММФ не должны использоваться для индукции ремиссии в следующих клинических ситуациях:
Менингеальные поражения
Ретро -орбитальная болезнь
Поражение сердца
Мезентериальные (брыжеечные) поражение
Острое начало множественного мононеврита
Легочного кровотечения любой тяжести*
*противопоказания для МТ И ММФ при AVV
МТ (20-25 мг в неделю, табл или парентерально) может использоваться в качестве альтернативы ЦФ в больных с менее тяжелым течением заболеваниями и при нормальной функции почек. В РКИ сравнивалось использование МТ или ММФ для индукции ремиссии у больных с AAV. Таблетки МТ 20-25 мг в неделю не уступали табл ЦФ при 6 мес приеме. Но долгосрочные наблюдения показали, что МТ менее эффективно контролировал заболевание чем ЦФ. МТ рекомендуется только в случаях без поражения внутренних органов. Рекомендуются следующие показания к применению, но при отсутствии поражения почек.

 Таблица 1. Алгоритм для контроля ANCA-связанных васкулитов. Пунктирные линии указывают на альтернативные или дополнительные меры для рассмотрения.
AAV-как болезнь очень изменчива, непредсказуема и потенциально опасна для жизни. Лечение обычно включает в себя мощные иммунодепресанты, часто с риском значительных побочных эффектов. Возможно добиться ремиссии и даже полностью прекратить прием ЛС, но рецидив закономерен. Кроме того, AAV отрицательно влияет на качество жизни даже у пациентов, находящихся в клинической ремиссии. Это может быть следствием как самого заболевания, так и результатом его лечения. Мы рекомендуем основополагающий принцип лечения – совместное принятия решения пациентом и специалистом.
Рекомендация 1
Мы рекомендуем пациентам с AAV обращаться или тесно сотрудничать с центрами по лечению РЗ.
(Уровень доказательства III; класс рекомендации C; Сила – 100% голосов)
Редкость AAV создает трудности в его лечении. Ведение таких пациентов требует экспертного сопровождения для дифференциального диагноза обострения васкулита от травмы или инфекции. Пациентам могут потребоваться консультации специалистов с опытом ведения AAV, иммунологический мониторинг, использование ритуксимаба при рефрактерном течении, специализированная рентгенография, привлечения окулиста, локальные инъекции при подсвязочном стенозе и почечная трансплантация. Для пациентов с рефрактерным течением болезни лучшим вариантом может быть лечение в центрах, участвующих в клинических испытаниях. При AAV может наступить рецидив после нескольких лет ремиссии, с поражением органов и систем, ранее не вовлеченных в воспалительный процесс. У пациентов могут развиться осложнения от лечения через много лет после его прекращения. Все пациенты с AAV должны быть обеспечены долгосрочным наблюдением и иметь быстрый доступ к специалистам при необходимости.
Рекомендация 2
Положительный результат биопсии подтверждает диагноз васкулита. Биопсия рекомендуется при установлении диагноза впервые и при ведении пациентов, с подозрением на рецидив васкулита. (Уровень доказательства III; класс рекомендации C; сила голосования 81%)
Положительная биопсия при AAV полезна при установлении первоначального диагноза или его рецидива. Гистопатологические доказательства васкулита, такие как «пауси-иммунный гломерулонефрит» или «малоиммунный гломерулонефрит»( pauci-immune glomerulonephritis) или некротизирующий васкулит в любом органе, остается золотым стандартом для диагностики. Диагностическая ценность биопсии варьируется и зависит от органа – мишени. У больных ГПА при поражении почек диагностическая ценность биопсии почек самая высокая и достигает 91,5%. При ЛОР- осмотре больных с ГПА часто обнаруживается патология и биопсия из этих областей информативна в 68,4%. При 60 биопсиях носа, 27 придаточных пазух носа, 17 гортани, 5 периорбитальной области, 5 ротовой полости, 4 среднего уха, 3 сосцевидного отростка, 2 наружного уха и 3 биопсий слюнной железы были обнаружены признаки неспецифического хронического воспаления, а гранулемы и васкулит обнаруживались реже, чем при биопсии других тканях. Биопсия легкого имеет различную диагностическую чувствительность, от 12% при трансбронхиальной биопсии альвеолярной ткани при ГПА и 66,7% для ЭГПА. Открытая биопсия легкого, хотя и более травматична, но обеспечивают более высокий диагностический результат.
Чрескожную биопсию почек следует выполнять под ультразвуковым контролем, что обеспечивает низкий риск осложнений, включая кровотечения. Риск кровотечения при чрескожной биопсии почек выше у пациентов, получавших плазмаферез. Общие факторы, связанные с повышенным риском кровотечения, требующие последующих переливания крови включают старость, повышение систолического артериального давления и нарушение функции почек.
Существующие гистологические классификации требуют дальнейшего совершенствования, но такие изменения как клубочковой склероз имеют очевидные отрицательные прогностическое значение для пациентов с AAV.
Рекомендация 3
Для индукции ремиссии, впервые выявленном случае поражения органа или в случае угрозы жизни, при AAV мы рекомендуем лечение комбинацией глюкокортикоидов с либо циклофосфамидом или Ритуксимабом.
Циклофосфамид(ЦФ)
уровень доказательства 1A для ГПА и MПA (класс рекомендации A; сила 100% голосов)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 88%)
Ритуксимаб
уровень доказательства 1B для ГПА и МПА (класс рекомендации A; сила голосования 82%)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 59%)
Начиная с 1970-х годов терапия, состоящая из комбинации ГК (1 мг/кг/день — максимальная суточная доза-80 мг) с ЦФ (2 мг/кг/сут — максимум 200 мг/день) была использована для индукции ремиссии при AAV. Из-за опасения по поводу кумулятивного действия ЦФ, дозировки для пульс -терапии при внутривенном введении, схемы терапии были разработаны и испытаны в крупнейшем исследовании CYCLOPS (randomised trial of daily oral versus pulse Cyclophosphamide as therapy for ANCA-associated Systemic Vasculitis) . Было доказано, что пульс терапия ЦФ позволяла чаще достичь ремиссии и была связана с меньшим количеством побочных эффектов, чем прием ЦФ per os. Долгосрочное наблюдение этой когорты показало, что доля участников с хотя бы с одним рецидивом была выше у лиц, получивших пульс -терапию ЦФ, но статистически достоверной разницы по выживанию, функции почек к концу исследования или неблагоприятных событий между двумя группами не было. Однако, в импульсных схемах предпочтение отдается пульс – терапии из-за снижения суммарной дозы ЦФ и снижения риска осложнений, связанных с мочевым пузырем (геморрагический цистит).
Оценка доказательств для использования ЦФ при ЭГПА ниже, чем при ГПА/МПА.В одном исследовании сравнивались дозы ЦФ с разным интервалом введения: (0,6 мг/м2) был первоначально использован каждые 2 недели в течение месяца, а затем каждые 4 недели. Одна группа получила шесть пульсов, другая 12. В обеих группах за одинаковое время (21/23 в первой группе, 21/25 в другой) была достигнута полная ремиссия.
Противорвотная терапия должно осуществляться регулярно при внутривенном введении ЦФ. Метаболиты ЦФ являются токсичными для уроэпителия и могут вызвать геморрагический цистит в краткосрочной перспективе и злокачественные опухоли в долгосрочной перспективе. Клинически целесообразно рекомендовать пациентам пить много жидкости или вводить ее в/в в день инфузии для разбавления метаболитов в моче. Пациентам, получающим пульс терапию ЦФ можно рекомендовать орально или внутривенно 2-меркаптоэтансульфонат натрия (МЕSNА), который связывается с акролеином, токсическим метаболитом ЦФ и делает его нетоксичным. МЕSNА также тормозит химическое разложение 4-гидроксиметаболитов, что в дальнейшем сокращает количество токсичных продуктов акролеина в моче. МЕSNА также может быть полезна у пациентов, получающих длительно таблетки ЦФ.
Мониторинг пациентов, получающих ЦФ должен проводиться по стандартным протоколам. В процессе лечения возможно изменения дозы или прекращение приема ЦФ в случае острой лейкопении или её нарастания с течением времени. В случае стабильной лейкопении можно продолжать иммуносупрессию под «жестким» мониторингом картины крови. Мы рекомендуем профилактику инфекции Pneumocystis jirovecii триметопримом /сульфаметоксазол (800/160 мг через день или 400/80 мг ежедневно) у всех пациентов получающих ЦФ, при отсутствии противопоказаний. Использование вдыхаемого ежемесячно пентамидина в случае негативной реакции или противопоказаний к триметоприм/сульфаметоксазолу может быть полезным, но не является экономически эффективным и обычно строго не регламентируется. Другие альтернативы включают Дапсон(dapsone) и атовакон(atovaquone).
Ритуксимаб при AAV был протестирован в двух РКИ при лечении ЭГПА и МПА в сравнении со стандартным режимом ЦФ/азатиоприн в лечении активных, «генерализованных» AVV. В обоих исследованиях пациентs первоначально получили высокие дозы ГК с последующим снижением дозы. Доза Ритуксимаба в обоих исследованиях было 375 мг/м2, один раз в неделю. Всего четыре инфузии. В обоих испытаниях rituximab не уступал ЦФ и был более эффективным при рецидивирующем течении заболевания. Ретроспективный анализ наблюдения 41 пациентов с ЭГПА, которые получили различные схемы rituximab показал, что в 34% достигнута полная ремиссия за 6 месяцев и 49% за 12 месяцев.
Из-за высокой стоимости Ритуксимаба, его использование ограничено в некоторых странах, и поэтому возможно только в специализированных центрах. Но могут быть ещё индивидуальные случаи, когда предпочтительнее Ритуксимаб чем ЦФ, например, у пациентов, которые хотят сохранить свои репродуктивные потенциал. Прием ЦФ связан с сокращением овариальный запаса, недостаточность яичников и мужским бесплодием. Долгосрочные последствия rituximab на фертильность не были изучены, и сообщений по данной проблеме не поступало. У больных с тяжелой формой болезни лечение не должно быть отложено, но обсуждение этих вопросов должно происходить.
Сравнивались дозы 7,5 мг и 10 мг преднизолона (или эквивалент) после 3 месяцев (12 недель) лечения. Обзор схемы сокращения приема преднизолона показал, что в среднем дозу 10 мг была достигнута после 19 недель, а в дозе 7,5 мг после 21 недель (рис. 2). Хотя целевой дозы преднизолона 7,5-10 мг желательно достичь за 3 месяца, на практике это может быть и 5 месяцев.
Таблица 1. Алгоритм для контроля ANCA-связанных васкулитов. Пунктирные линии указывают на альтернативные или дополнительные меры для рассмотрения.
AAV-как болезнь очень изменчива, непредсказуема и потенциально опасна для жизни. Лечение обычно включает в себя мощные иммунодепресанты, часто с риском значительных побочных эффектов. Возможно добиться ремиссии и даже полностью прекратить прием ЛС, но рецидив закономерен. Кроме того, AAV отрицательно влияет на качество жизни даже у пациентов, находящихся в клинической ремиссии. Это может быть следствием как самого заболевания, так и результатом его лечения. Мы рекомендуем основополагающий принцип лечения – совместное принятия решения пациентом и специалистом.
Рекомендация 1
Мы рекомендуем пациентам с AAV обращаться или тесно сотрудничать с центрами по лечению РЗ.
(Уровень доказательства III; класс рекомендации C; Сила – 100% голосов)
Редкость AAV создает трудности в его лечении. Ведение таких пациентов требует экспертного сопровождения для дифференциального диагноза обострения васкулита от травмы или инфекции. Пациентам могут потребоваться консультации специалистов с опытом ведения AAV, иммунологический мониторинг, использование ритуксимаба при рефрактерном течении, специализированная рентгенография, привлечения окулиста, локальные инъекции при подсвязочном стенозе и почечная трансплантация. Для пациентов с рефрактерным течением болезни лучшим вариантом может быть лечение в центрах, участвующих в клинических испытаниях. При AAV может наступить рецидив после нескольких лет ремиссии, с поражением органов и систем, ранее не вовлеченных в воспалительный процесс. У пациентов могут развиться осложнения от лечения через много лет после его прекращения. Все пациенты с AAV должны быть обеспечены долгосрочным наблюдением и иметь быстрый доступ к специалистам при необходимости.
Рекомендация 2
Положительный результат биопсии подтверждает диагноз васкулита. Биопсия рекомендуется при установлении диагноза впервые и при ведении пациентов, с подозрением на рецидив васкулита. (Уровень доказательства III; класс рекомендации C; сила голосования 81%)
Положительная биопсия при AAV полезна при установлении первоначального диагноза или его рецидива. Гистопатологические доказательства васкулита, такие как «пауси-иммунный гломерулонефрит» или «малоиммунный гломерулонефрит»( pauci-immune glomerulonephritis) или некротизирующий васкулит в любом органе, остается золотым стандартом для диагностики. Диагностическая ценность биопсии варьируется и зависит от органа – мишени. У больных ГПА при поражении почек диагностическая ценность биопсии почек самая высокая и достигает 91,5%. При ЛОР- осмотре больных с ГПА часто обнаруживается патология и биопсия из этих областей информативна в 68,4%. При 60 биопсиях носа, 27 придаточных пазух носа, 17 гортани, 5 периорбитальной области, 5 ротовой полости, 4 среднего уха, 3 сосцевидного отростка, 2 наружного уха и 3 биопсий слюнной железы были обнаружены признаки неспецифического хронического воспаления, а гранулемы и васкулит обнаруживались реже, чем при биопсии других тканях. Биопсия легкого имеет различную диагностическую чувствительность, от 12% при трансбронхиальной биопсии альвеолярной ткани при ГПА и 66,7% для ЭГПА. Открытая биопсия легкого, хотя и более травматична, но обеспечивают более высокий диагностический результат.
Чрескожную биопсию почек следует выполнять под ультразвуковым контролем, что обеспечивает низкий риск осложнений, включая кровотечения. Риск кровотечения при чрескожной биопсии почек выше у пациентов, получавших плазмаферез. Общие факторы, связанные с повышенным риском кровотечения, требующие последующих переливания крови включают старость, повышение систолического артериального давления и нарушение функции почек.
Существующие гистологические классификации требуют дальнейшего совершенствования, но такие изменения как клубочковой склероз имеют очевидные отрицательные прогностическое значение для пациентов с AAV.
Рекомендация 3
Для индукции ремиссии, впервые выявленном случае поражения органа или в случае угрозы жизни, при AAV мы рекомендуем лечение комбинацией глюкокортикоидов с либо циклофосфамидом или Ритуксимабом.
Циклофосфамид(ЦФ)
уровень доказательства 1A для ГПА и MПA (класс рекомендации A; сила 100% голосов)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 88%)
Ритуксимаб
уровень доказательства 1B для ГПА и МПА (класс рекомендации A; сила голосования 82%)
уровень доказательства 3 для ЭГПА (класс рекомендации C; сила голосования 59%)
Начиная с 1970-х годов терапия, состоящая из комбинации ГК (1 мг/кг/день — максимальная суточная доза-80 мг) с ЦФ (2 мг/кг/сут — максимум 200 мг/день) была использована для индукции ремиссии при AAV. Из-за опасения по поводу кумулятивного действия ЦФ, дозировки для пульс -терапии при внутривенном введении, схемы терапии были разработаны и испытаны в крупнейшем исследовании CYCLOPS (randomised trial of daily oral versus pulse Cyclophosphamide as therapy for ANCA-associated Systemic Vasculitis) . Было доказано, что пульс терапия ЦФ позволяла чаще достичь ремиссии и была связана с меньшим количеством побочных эффектов, чем прием ЦФ per os. Долгосрочное наблюдение этой когорты показало, что доля участников с хотя бы с одним рецидивом была выше у лиц, получивших пульс -терапию ЦФ, но статистически достоверной разницы по выживанию, функции почек к концу исследования или неблагоприятных событий между двумя группами не было. Однако, в импульсных схемах предпочтение отдается пульс – терапии из-за снижения суммарной дозы ЦФ и снижения риска осложнений, связанных с мочевым пузырем (геморрагический цистит).
Оценка доказательств для использования ЦФ при ЭГПА ниже, чем при ГПА/МПА.В одном исследовании сравнивались дозы ЦФ с разным интервалом введения: (0,6 мг/м2) был первоначально использован каждые 2 недели в течение месяца, а затем каждые 4 недели. Одна группа получила шесть пульсов, другая 12. В обеих группах за одинаковое время (21/23 в первой группе, 21/25 в другой) была достигнута полная ремиссия.
Противорвотная терапия должно осуществляться регулярно при внутривенном введении ЦФ. Метаболиты ЦФ являются токсичными для уроэпителия и могут вызвать геморрагический цистит в краткосрочной перспективе и злокачественные опухоли в долгосрочной перспективе. Клинически целесообразно рекомендовать пациентам пить много жидкости или вводить ее в/в в день инфузии для разбавления метаболитов в моче. Пациентам, получающим пульс терапию ЦФ можно рекомендовать орально или внутривенно 2-меркаптоэтансульфонат натрия (МЕSNА), который связывается с акролеином, токсическим метаболитом ЦФ и делает его нетоксичным. МЕSNА также тормозит химическое разложение 4-гидроксиметаболитов, что в дальнейшем сокращает количество токсичных продуктов акролеина в моче. МЕSNА также может быть полезна у пациентов, получающих длительно таблетки ЦФ.
Мониторинг пациентов, получающих ЦФ должен проводиться по стандартным протоколам. В процессе лечения возможно изменения дозы или прекращение приема ЦФ в случае острой лейкопении или её нарастания с течением времени. В случае стабильной лейкопении можно продолжать иммуносупрессию под «жестким» мониторингом картины крови. Мы рекомендуем профилактику инфекции Pneumocystis jirovecii триметопримом /сульфаметоксазол (800/160 мг через день или 400/80 мг ежедневно) у всех пациентов получающих ЦФ, при отсутствии противопоказаний. Использование вдыхаемого ежемесячно пентамидина в случае негативной реакции или противопоказаний к триметоприм/сульфаметоксазолу может быть полезным, но не является экономически эффективным и обычно строго не регламентируется. Другие альтернативы включают Дапсон(dapsone) и атовакон(atovaquone).
Ритуксимаб при AAV был протестирован в двух РКИ при лечении ЭГПА и МПА в сравнении со стандартным режимом ЦФ/азатиоприн в лечении активных, «генерализованных» AVV. В обоих исследованиях пациентs первоначально получили высокие дозы ГК с последующим снижением дозы. Доза Ритуксимаба в обоих исследованиях было 375 мг/м2, один раз в неделю. Всего четыре инфузии. В обоих испытаниях rituximab не уступал ЦФ и был более эффективным при рецидивирующем течении заболевания. Ретроспективный анализ наблюдения 41 пациентов с ЭГПА, которые получили различные схемы rituximab показал, что в 34% достигнута полная ремиссия за 6 месяцев и 49% за 12 месяцев.
Из-за высокой стоимости Ритуксимаба, его использование ограничено в некоторых странах, и поэтому возможно только в специализированных центрах. Но могут быть ещё индивидуальные случаи, когда предпочтительнее Ритуксимаб чем ЦФ, например, у пациентов, которые хотят сохранить свои репродуктивные потенциал. Прием ЦФ связан с сокращением овариальный запаса, недостаточность яичников и мужским бесплодием. Долгосрочные последствия rituximab на фертильность не были изучены, и сообщений по данной проблеме не поступало. У больных с тяжелой формой болезни лечение не должно быть отложено, но обсуждение этих вопросов должно происходить.
Сравнивались дозы 7,5 мг и 10 мг преднизолона (или эквивалент) после 3 месяцев (12 недель) лечения. Обзор схемы сокращения приема преднизолона показал, что в среднем дозу 10 мг была достигнута после 19 недель, а в дозе 7,5 мг после 21 недель (рис. 2). Хотя целевой дозы преднизолона 7,5-10 мг желательно достичь за 3 месяца, на практике это может быть и 5 месяцев.
 Рисунок 2
Протокол достижения целевой дозы преднизолона по данным клинических исследований при АНЦА -ассоциированных васкулитах.
AAVs имеют многообразный спектр проявлений, от вялотекущих до угрожающих жизни. Настоящие рекомендации следуют существующей системе классификации, но в долгосрочной перспективе и будущем, с учетом данных по результатам фенотипов, сегодняшние ориентиры могут измениться.
Рекомендация 4
Для индукции ремиссии AAV, без поражения внутренних органов, мы рекомендуем лечение комбинацией глюкокортикоидов и или метотрексата или Микофенолата мофетила.
Метотрексат
Уровень доказательства 1B; класс рекомендации B; сила голосования 77%.
Микофенолата мофетил (ММФ)
Уровень доказательства 1B; класс рекомендации C; сила голосования 65%.
Подчеркивается, что МТ или ММФ не должны использоваться для индукции ремиссии в следующих клинических ситуациях:
Менингеальные поражения
Ретро -орбитальная болезнь
Поражение сердца
Мезентериальные (брыжеечные) поражение
Острое начало множественного мононеврита
Легочного кровотечения любой тяжести*
*противопоказания для МТ И ММФ при AVV
МТ (20-25 мг в неделю, табл или парентерально) может использоваться в качестве альтернативы ЦФ в больных с менее тяжелым течением заболеваниями и при нормальной функции почек. В РКИ сравнивалось использование МТ или ММФ для индукции ремиссии у больных с AAV. Таблетки МТ 20-25 мг в неделю не уступали табл ЦФ при 6 мес приеме. Но долгосрочные наблюдения показали, что МТ менее эффективно контролировал заболевание чем ЦФ. МТ рекомендуется только в случаях без поражения внутренних органов. Рекомендуются следующие показания к применению, но при отсутствии поражения почек.
Рисунок 2
Протокол достижения целевой дозы преднизолона по данным клинических исследований при АНЦА -ассоциированных васкулитах.
AAVs имеют многообразный спектр проявлений, от вялотекущих до угрожающих жизни. Настоящие рекомендации следуют существующей системе классификации, но в долгосрочной перспективе и будущем, с учетом данных по результатам фенотипов, сегодняшние ориентиры могут измениться.
Рекомендация 4
Для индукции ремиссии AAV, без поражения внутренних органов, мы рекомендуем лечение комбинацией глюкокортикоидов и или метотрексата или Микофенолата мофетила.
Метотрексат
Уровень доказательства 1B; класс рекомендации B; сила голосования 77%.
Микофенолата мофетил (ММФ)
Уровень доказательства 1B; класс рекомендации C; сила голосования 65%.
Подчеркивается, что МТ или ММФ не должны использоваться для индукции ремиссии в следующих клинических ситуациях:
Менингеальные поражения
Ретро -орбитальная болезнь
Поражение сердца
Мезентериальные (брыжеечные) поражение
Острое начало множественного мононеврита
Легочного кровотечения любой тяжести*
*противопоказания для МТ И ММФ при AVV
МТ (20-25 мг в неделю, табл или парентерально) может использоваться в качестве альтернативы ЦФ в больных с менее тяжелым течением заболеваниями и при нормальной функции почек. В РКИ сравнивалось использование МТ или ММФ для индукции ремиссии у больных с AAV. Таблетки МТ 20-25 мг в неделю не уступали табл ЦФ при 6 мес приеме. Но долгосрочные наблюдения показали, что МТ менее эффективно контролировал заболевание чем ЦФ. МТ рекомендуется только в случаях без поражения внутренних органов. Рекомендуются следующие показания к применению, но при отсутствии поражения почек.
- Болезни носа и придаточных пазух без поражения скелета (эрозии) или хрящей или обонятельной дисфункцией, или глухотой
- Поражение кожи без изъязвлений
- Миозит (только с поражением скелетных мышц)
- Гранулемы/инфильтраты в легких без распада и без кровохарканья
- Когда ЦФ или Ритуксимаб не доступны или противопоказаны, или пациент самостоятельно делает выбор
- Отсутствие эффекта или повышение активности заболевания при остром AAV после 4 недель лечения со стандартной схемы острого AAV, или
- Отсутствие ответа, определяется как < 50% снижение активности болезни по шкале (например Бирмингемский индекс активности васкулиов, Birmingham Vasculitis Activity Score (BVAS) или BVAS/Wegener’s granulomatosis (WG) для гранулематоза Вегенера после 6 недель лечения, или
- Хронические, рефрактерное заболевания определяется как болезнь, имеющая хотя бы один большой или три малых пункта индекса активности болезни после> 12 недель лечения.
- Пересмотр первичного диагноза; реально имеется рефрактерносить — вообще имеется ли AAV?
- Достаточно ли оптимизирован режим лечения, достигнуты целевые дозы ЛС?
- Проявления заболевания- это васкулит или это реакция на инфекцию или другие коморбидные или злокачественные заболевания?
- Критерии диагностики и классификации связанных АНЦА васкулитов (AAV).
- Идентификация биомаркеров для AAV.
- Дополнительные лечебные мероприятия при повышении креатинина сыворотки – плазмаферез.
- Показания к применению
- Клинические испытания новых биологических агентов для лечения рефрактерных AAV.
- Рандомизированные контролируемые исследования по эозинофильному гранулематозу с полиангиитом.
- Долгосрочные результаты наблюдения AAV.


