Просмотров: 2 314
Радиосиновэктомия – метод лечения воспалительных заболеваний суставов с помощью изотопов
А.В. Зверев1, В.В. Крылов 2, А.Г. Ханов 3, Т.Ю. Кочетова 2
1 Завод «Медрадиопрепарат» – филиал ФГУП «Федеральный центр по проектированию и развитию объектов ядерной медицины» ФМБА России
2 МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
3 ГБУ РО «Областная клиническая больница № 2», Ростов-на-Дону
РЕЗЮМЕ
Одним из эффективных методов лечения воспалительных заболеваний суставов является радиосиновэктомия (радиосиновиортез). Метод основан на внутрисуставном введении радиофармпрепаратов (РФП), содержащих бета-излучающие изотопы. При локальном введении РФП в сустав происходит воздействие на синовиальную оболочку сустава, что ведет к формированию ее поверхностного фиброза и подавлению воспаления. В зависимости от размеров пораженного сустава применяются РФП, отличающиеся мощностью излучения изотопа, входящего в его состав. В мировой практике накоплен богатый опыт применения препаратов для радиосиновэктомии начиная с 1923 г. Представленный обзор литературы подтверждает эффективность и безопасность данного метода. Положительный ответ при ревматоидном артрите может достигать 85%.
При гемофилической артропатии он бывает еще выше. Общая лучевая нагрузка не представляет опасности для здоровых органов и тканей. В России ведутся разработки инновационных препаратов для радиосиновэктомии на основе рения-188, одного из самых перспективных медицинских изотопов.
Ключевые слова: радиосиновэктомия, радиосиновиортез, синовит, ревматоидный артрит, рений-188.
Для цитирования: Зверев А.В., Крылов В.В., Ханов, А.Г. Кочетова Т.Ю. Радиосиновэктомия – метод лечения воспалительных заболеваний суставов с помощью изотопов // РМЖ. 2017. № 25. С. 1–1.
ABSTRACT
Radiosynovectomy – a method of inflammatory joints diseases treatment with the use of isotopes
Zverev A.V.1, Krylov V.V.2, Khanov A.G.3, Kochetova T.Yu.2
1 «Medradiopreparat» factory – branch of «Federal center for design and development of nuclear medicine facilities» of Federal Medical and Biological
Agency of Russia
2 Medical Radiological Research Center named after A. Tsyb – branch of «National Medical Research Radiological Center»
3 Regional Clinical Hospital No. 2, Rostov-on-Don
Radiosynovectomy is one of the effective methods of treatment of inflammatory joints diseases. The method is based on the intra-articular introduction of
radiopharmaceuticals (RFAs) containing beta-emitting isotopes. When the RFA is locally introduced into the joint, it affects the synovium of the joint, which
leads to the formation of its superficial fibrosis and the suppression of inflammation. The choice of a particular RFA with the certain radiation power of
isotope, which is part of its composition, depends on the size of the tender joint. A large world practice experience in the use of radiopharmaceutical agents
has been accumulated since 1923. The presented literature review confirms the effectiveness and safety of this method. A positive response in rheumatoid
arthritis can reach 85%. It can be even higher in hemophilic arthropathy. The total radiation load does not pose a risk to healthy organs and tissues. Russian
scientists are developing the innovative preparations for radiosynovectomy based on rhenium-188 as one of the most promising medical isotopes.
Key words: radiosynovectomy, radiosynoviorthosis, synovitis, rheumatoid arthritis, rhenium-188.
For citation: Zverev A.V., Krylov V.V., Khanov A.G., Kochetova T.Yu. Radiosynovectomy – a method of inflammatory joints diseases treatment with the use of
isotopes // RMJ. 2017. № 25. P. 1–1.
Радиосиновэктомия или радиосиновиортез (РСО) – метод с доказанной эффективностью для местного лечения хронических воспалительных заболеваний суставов. При локальном введении радиоактивного вещества в сустав происходит воздействие на синовиальную оболочку сустава, что ведет к формированию ее поверхностного фиброза и стойкому подавлению воспаления. Метод является альтернативой хирургической синовэктомии и предназначен для местного лечения практически всех видов хронических синовитов, за исключением инфекционного. Показаниями для РСО являются различные синовиты: при ревматоидном
артрите (РА), серонегативных артритах, гемофилической артропатии, рецидивирующих внутрисуставных выпотах
после внутрисуставных вмешательств, пигментном виллонодулярном синовите, остеоартрозе, после суставного
протезирования.
Термин «радиосиновиортез» был предложен Delbarre et al. [1] и означает восстановление (ортез) синовиальной
оболочки с помощью радионуклидов. Вводимые в пораженный воспалением сустав в виде коллоидов или микросфер радиофармпрепараты (РФП) распределяются по поверхности синовиальной оболочки, захватываются макрофагами и вызывают поверхностный фиброз синовии, что ведет к подавлению воспаления. Это дает эффект, сравнимый с эффектом хирургической синовэктомии, однако собственно эктомии, т. е. удаления ткани при этом не происходит. В англо-американской литературе используется термин «радиосиновэктомия» или «радиационная синовэктомия», а в немецкой – «радиосиновиортез».
Первые упоминания в литературе о воздействии радиоактивных элементов на ткани суставов относятся к 1923 г.
и принадлежат C. Ishido [2]. Его работа называлась «О действии радиоактивного тория на суставы» и была посвящена
изучению влияния на суставы лабораторных животных изотопа тория (228Th). Это была «эпоха радия», когда радиоактивные элементы использовались в совершенно неожиданных сферах. Промышленно производились мыло и шампуни с радием, губные помады, пудры и даже шоколад. Презервативы, обработанные радием, считались средством особой силы, предотвращающим заболевания, передаваемые половым путем, а «радиевая вода» была «эликсиром жизненной энергии». Она стоила очень дорого, но богатые люди тогда могли позволить себе употреблять ее, в т. ч. при болезнях суставов. Позже, в 1952 г., К. Fellinger и J. Schmid
впервые применили внутрисуставное введение изотопов в качестве средства локальной терапии у пациентов, страдающих ревматическими заболеваниями [3]. В 1960-х гг. для РСО использовались изотопы золота (198Au), испускающие не только бета-частицы, но и обладающие мощным гамма-излучением. Их применение было сопряжено с высоким риском облучения персонала и требовало изоляции пациентов в специальных палатах [4]. С 1990-х гг. в Германии было начато широкое использование РСО, в т. ч. и в амбулаторном режиме, поскольку при внутрисуставных введениях бета-излучающих препаратов опасность облучения окружающих людей с превышением дозы в 1,5 мЗв за календарный год на расстоянии 1 м является практически нереальной. Иными словами,
РСО с использованием бета-излучателей не вызывает радиационной опасности ни для людей, ни для окружающей
среды. Радионуклид проникает в ткани сустава на несколько миллиметров и практически не выводится из организма. Таким образом, основанием для госпитализации пациентов могут явиться медицинские показания, а не требования радиационной безопасности. В настоящее время в Германии примерно 63 тыс. суставов в год подвергаются
РСО. Это число превосходит количество процедур радио-
йодтерапии при заболеваниях щитовидной железы [5].
В России метод успешно применялся до 1990-х гг. При-
чем даже наиболее старый препарат – радиоколлоид на
основе золота (198Au) показывал хорошую результатив-
ность [6]. Однако, к сожалению, на сегодняшний день дан-
ный метод в нашей стране недоступен, и пациенты вынуж-
дены проходить лечение за рубежом.
Показания и противопоказания к РСО
Метод РСО показан для местного лечения многих видов
хронических синовитов [7–18]. Показания для РСО с каж-
дым годом дополняются и совершенствуются. С учетом
немецких методических рекомендаций и рекомендаций
Европейской ассоциации ядерной медицины РСО приме-
няются для локальной терапии синовитов при таких забо-
леваниях, как [19, 20]:
• РА;
• серонегативные спондилоартропатии (т. е. реактив-
ный артрит, псориатический артрит);
• гемартроз при гемофилии;
• рецидивирующий внутрисуставной выпот (после арт-
роскопии);
• пигментный виллонодулярный синовит;
• остеоартроз (ОА);
• недифференцированные артриты, сопровождающие-
ся синовитами и суставными выпотами;
• После суставного протезирования: стойкие выпоты,
так называемая «полиэтиленовая болезнь» (термин, по-
явившийся за рубежом и означающий появление стойкого
воспаления после эндопротезирования сустава из поли-
этиленового материала).
К противопоказаниям относятся:
• инфекционный артрит;
• детский возраст;
• беременность;
• лактация.
В зависимости от размеров суставов рекомендуются
разные РФП, основанные на радионуклидах с различной
энергией бета-частиц и разной длиной их пробега в тканях
организма.
Для оказания корректной медицинской помощи не-
обходимо тесное сотрудничество специалистов ядерной
медицины с ревматологами и ортопедами. Чаще всего РСО
рекомендуют применять в тех случаях, когда методы кон-
сервативной терапии исчерпаны, и внутрисуставное вве-
дение кортикостероидов также не дает необходимых ре-
зультатов.
Обзор существующих и разрабатываемых РФП
Одно из первых сообщений о применении изотопов для
терапии было опубликовано в 1952 г. (Fellinger K., Schmid J.)
[3]. Механизм действия заключается в следующем. Связы-
ваясь с недиффундирующим коллоидом размером
1–20 микрон, радиоизотоп остается в синовиальной жид-
кости, а затем фагоцитируется макрофагами синовиаль-
ной оболочки, оказывая локальное лучевое воздействие.
Облучение клеток-мишеней синовиальной оболочки пер-
воначально останавливает воспалительный ответ и впо-
следствии приводит к регрессу синовиальной пролифера-
ции с последующим формированием поверхностного
фиброза синовии. В результате это приводит к стойкому
подавлению воспаления в суставе, значительному сниже-
нию артралгий, улучшению функции сустава.
РФП для РСО состоят из нерастворимых коллоидов,
меченных β-излучающими радиоизотопами, или микро-
сфер (макроагрегатов), содержащих изотопы. Благодаря
правильному подбору РФП возможно избежать необосно-
ванной лучевой нагрузки на соседние ткани. Коллоидный
раствор иттрия-90 (90Y) со средней длиной пробега β-ча-
стиц в мягких тканях 2,8 мм применяется для терапии
крупных суставов (например, коленных). Коллоидный рас-
твор рения-186 (186Re) с длиной пробега β-частиц, равной
1,0 мм, используется для лечения средних суставов (на-
пример, локтевых). А коллоидный раствор эрбия-169
(169Er) с длиной пробега β-частиц 0,3 мм – для лечения
мелких суставов пальцев кистей и стоп. Количество радио-
активных изотопов (активность) также зависит от размера
пораженного сустава. Так, например, в коленный сустав
РМЖ, 2017 № 20 3
Ревматология Оригинальные статьи
вводят до 185 МБк 90Y, а в межфаланговые суставы паль-
цев кисти – по 15 МБк 169Er [21]. В таблице 1 представлены
некоторые изотопы, входящие в состав коммерчески до-
ступных РФП, применяемых для РСО.
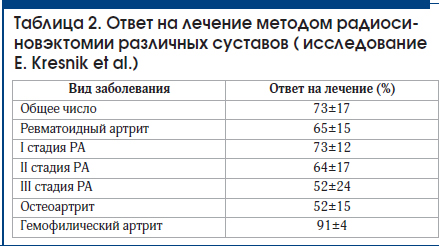
Е. Kresnik et al. [22] было проведено большое исследо-
вание по анализу результатов РСО 2190 суставов. Оно по-
казало высокую терапевтическую эффективность метода
(73±17%). Наибольшее число положительных ответов на
лечение было получено при гемофилическом артрите. По-
мимо уменьшения симптомов артрита, РСО позволяет
привести к уменьшению гиперваскуляризации синовиаль-
ной оболочки с последующим значительным снижением
числа эпизодов внутрисуставных кровотечений. Число по-
зитивных ответов при РА было ниже и сильно зависело от
стадии деструктивных изменений. Так, при начальной ста-
дии (стадия I по Штейнброкеру) эффективность составила
73±12%, тогда как при выраженных деструкциях (стадия
III по Штейнброкеру) эффект был только у 52±24% паци-
ентов. В таблице 2 представлены данные по ответам на те-
рапию в зависимости от стадии заболевания.
Как следует из представленных в таблицы 2 данных, для
получения наилучшего ответа на РСО его следует провести
пациенту до развития деструктивных изменений в суста-
вах.
В различных литературных обзорах начиная с 1950-х гг.
положительные ответы на лечение отмечены в 55–79%
случаев для межфаланговых суставов пальцев, в 60–83%
– для суставов средних размеров (запястье, локоть, плечо
и лодыжка), в 40–85% – для коленных [23]. Диапазон по-
ложительных ответов велик, что связано с различиями в
критериях оценки ответа на терапию.
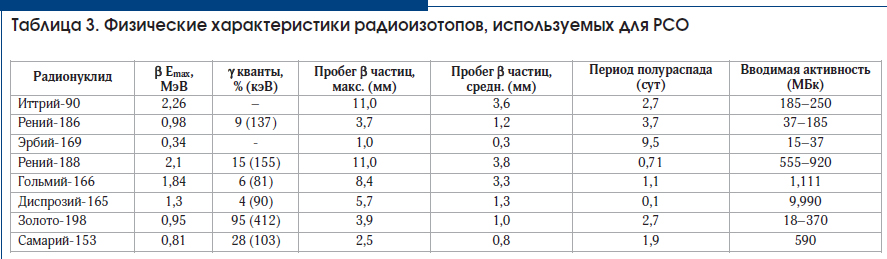
Ограниченная доступность РФП для РСО является ос-
новным недостатком метода, что не позволяет его широко
использовать как стандартную клиническую процедуру.
Различные бета-излучающие радионуклиды, которые при-
менялись для мечения коллоидов и потенциально могут
быть использованы для проведения РСО, представлены в
таблице 3.
В странах Азии и Южной Америке широко применяется
РФП на основе коллоида фосфора-32 (32P), причем основ-
ная группа пациентов – дети, страдающие гемофилией
[24]. В условиях жесткого дефицита фактора свертывания
это является важным способом решения проблем лечения
таких пациентов.
Рений-188
Все представленные в таблице 3 РФП, кроме рения-
188, производятся на радиофармацевтических заводах и
доставляются в клиники по предварительным заказам, что
в совокупности с быстрыми периодами полураспада ра-
дионуклидов и невозможностью хранения готового РФП
сильно осложняет логистику и весь клинико-технологиче-
ский цикл терапии. Генератор вольфрам-188/рений-188
(188W/188Re) позволяет получать 188Re непосредственно в
клинике. Рений-188 – дочерний нуклид, образующийся
при распаде 188W, который, в свою очередь, является реак-
торным продуктом с физическим периодом полураспада
(T½) 69 дней. Это дает возможность использовать генера-
тор непосредственно в клинике для приготовления РФП
фактически под каждого конкретного больного до 6 мес.
при достаточно высокой исходной активности. Коллоид-
ные композиции, меченные генераторным радионуклидом
188Re, способны заменить 90Y для лечения коленного суста-
ва. Максимальная энергия бета-распада этих радионукли-
дов схожа, однако благодаря наличию мягкого гамма-из-
лучения (155 кэВ) становится возможным получение сцинления препарата. Ввиду того, что период полураспада у 188Re значительно короче, чем у 90Y, вводимые активностимогут быть больше. Активность, применяемая для взрослых, варьировалась от 555 до 917 МБк по 188Re [25], соответственно, для детей использовали меньшие дозировки [26].

 Первый коллоид на основе 188Re для РСО был описан в
1995 г. Исследования, проведенные на коллоиде серы с
188Re, показали стабильность 95% in vitro в течение 3 дней
[27]. Фармакокинетические исследования микросфер с ре-
нием-188 (с размером частиц 15 мкм) показали следую-
щие результаты удерживания в коленном суставе кролика:
98,7, 94,6 и 93,6% после 1, 24 и 48 ч соответственно [28].
Данные фармакокинетики показали очень низкое распро-
странение радиоактивности по всем органам в течение ис-
следования, что указывает на минимальную утечку РФП из
коленного сустава животного. Авторы пришли к выводу,
что микросферы с 188Re являются потенциальным канди-
датом для радиосиновэктомии. Микросферы, меченные
рением-188, были стабильны in vitro на протяжении 3 дней
на уровне 98%. Две недели спустя после инъекции в колен-
ный сустав кроликов в синовиальной оболочке произошли
увеличение фибробластов и фиброзные изменения в си-
новиальной сумке. Также обнаружилось дополнительное
закупоривание сосудов и капилляров в ответ на радиа-
ционное облучение синовиальной оболочки [29].
Е.В. Lee et al. изучали оловянный коллоид, меченный
рением-188 [30]. В сравнении с коллоидом на основе серы
[29, 31] он продемонстрировал лучшие показатели объ-
емного и поверхностного распределения [32]. Первый
опыт применения у пациентов был получен Р. Li et al. [25]
при лечении 29 больных гемофилией. Длительность после-
дующего наблюдения составила 18 мес. В зависимости от
толщины синовиальной оболочки, установленной при
МРТ, были использованы 3 уровня активностей: 555 МБк
(15 мКи), 687 МБк (19 мКи) и 917 МБк (25 мКи). Размеры
частиц коллоида сульфида рения (188Re) составили от 2 до
20 мкм.
Отличные результаты в ближайшем периоде были по-
лучены у 75%, а сокращение частоты кровотечений – у
100% пациентов. На 18-м мес. исследования эффект со-
хранялся у 71%. Зависимости между вводимой актив-
ностью и терапевтической эффективностью установлено
не было. В оценке МРТ были установлены значительное
уменьшение толщины синовиальной оболочки и пролифе-
рация синовиальных ворсинок после лечения. Никаких
подтверждений повреждения суставного хряща найдено
не было. Данные о биораспределении с использованием
сцинтиграфии указывают на отсутствие значимых актив-
ностей в мочевом пузыре, костном мозге, печени, селезен-
ке и региональных лимфатических узлах, также уровень
активности в крови был незначительным. Эти данные об-
основаны высокой in vitro стабильностью коллоидов с ре-
нием-188 и низким уровнем высвобождения изотопа из
препарата.
Под эгидой Международного агентства по атомной
энергии (МАГАТЭ) в 2001 г. было проведено сравнитель-
ное исследование радиофармацевтических препаратов,
предназначенных для радиосиновэктомии [33]. Цель дан-
ного исследования заключалась в оценке терапевтической
эффективности, выраженной в контроле болевого синдро-
ма коленного сустава у пациентов с РА или гемофильным
артритом, при использовании коммерчески доступного
радиоколлоида с 90Y, по сравнению с эффективностью пре-
паратов на основе 188Re и 32P. Стратегия заключалась в том,
чтобы оценить перспективность использования 188Re и 32Р
с целью улучшения доступности РСО во всем мире, осо-
бенно в Азии и Южной Америке. Изучая биокинетику,
фиксировали процент от введенной активности коллоида
с 188Re в крови на 4-й, 12-й, 24-й и 72-й ч. Были получены
следующие значения: 0,06±0,05; 0,12±0,09; 0,21±0,19;
0,14±0,08% соответственно. Содержание выведенной ак-
тивности с 188Re с мочой составило 1,65±3,00% через 72 ч
после терапии. Процент содержания в крови от введенной
активности для коллоида с 32Р был значительно выше:
5,8±3,1; 5,7±2,8; 4,4±3,3; 3,8±3,4 после 1, 2, 3 и 24 ч соот-
ветственно [33]. Степень высвобождения препарата зави-
сит от размера частиц в составе препарата. Такие различия
в содержании активности в крови и моче на двух препара-
тах могут объясняться более коротким периодом полурас-
пада у рения-188 и более мелким размером частиц в кол-
лоиде 32Р (0,2 0,35 мкм у коллоида с 32Р по сравнению с
1–10 мкм коллоида олова, меченного 188Re). Эти биокине-
тические исследования указывают на то, что 188Re является
наиболее подходящим для РСО. В этом исследовании 96
детей в возрасте от 4 до 12 лет, страдающих гемофиличе-
скими артопатиями, были пролечены препаратами на ос-
нове 188Re, 32Р, 90Y с активностями, соответствующими их
возрасту. Было показано, что после проведения РСО коли-
чество кровотечений значительно уменьшилось. До про-
ведения РСО в исследуемой группе отмечалось высокое
число кровотечений (391 в течение 1 мес.). Спустя 1 мес.
после РСО было отмечено уменьшение числа кровотече-
ний до 53 случаев, до 50 – спустя 3 мес., 32 случая – через
6 мес. после РСО. В течение 6 мес. после РСО 48% пациен-
тов вообще не имели внутрисуставных кровотечений
(100% снижение), у 38% число кровотечений снизилось на
80%, в 14% случаев – на 50%. По показаниям детей и их
опекунов зафиксированы значительное улучшение каче-
ства жизни, подтвержденное улучшенной подвижностью,
и значительное уменьшение количества пропущенных
учебных дней. Исследованная подгруппа из 13 пациентов
с гемофилией, пролеченных коллоидом с 188Re, показала
схожие результаты [33].
Исследование по лечению коллоидом на основе 188Re
16 больных РА также проводилось под эгидой МАГАТЭ.
Уровень болей был документирован по 10-балльной шка-
ле. Облегчение боли было значительно выше у пациентов,
получавших коллоид 188Re, по сравнению с контрольной
группой, получавшей внутрисуставные введения глюко-
кортикоидов [34]. За исключением 1 случая с контуриро-
ванным и обратимым некрозом кожи в месте введения
РФП или обратимого набухания коленного сустава ника-
ких других серьезных побочных эффектов зарегистриро-
вано не было [26, 35]. Данные о биокинетике и проведен-
ные клинические исследования подтверждают, что кол-
лоиды с 188Re являются безопасными и эффективными в
лечении гемофилии и РА. Однако имеющихся данных еще
недостаточно.
Обычно препараты на основе 188Re используют для вве-
дения в крупные суставы, однако исследователи из Индии
опубликовали работу об успешном применении коллоида
188Re для РСО мелкого сустава при РА [36]. 45-летняя па-
циентка, страдающая РА, жаловалась на отек и боль в су-
ставе безымянного пальца правой руки на протяжении
6 мес. Консервативная терапия была неэффективна. Ей был введен препарат на основе коллоида олова, меченный
188Re, общей активностью 370 МБк. Палец пациентки был
зафиксирован на 48 ч. В течение следующих 3-х мес. отек
спал, а боли значительно уменьшились.
Лютеций-177
Одним из весьма перспективных изотопов для приме-
нения в радионуклидной терапии является лютеций-177
(Lu-177). Его физические характеристики позволяют ис-
пользовать его для внутрисуставных введений. Наличие
гамма-излучения дает возможность следить за распреде-
лением препарата с помощью гамма-камеры.
Были проведены исследования по оценке эффективно-
сти РСО с препаратом гидроксиапатит (ГАП), меченным
Lu-177, в лечении рецидивирующего синовита, сопровож-
дающегося выпотом в коленных суставах при РА [37]. Де-
сяти пациентам, страдающим стойкими синовитами ко-
ленных суставов, был введен ГАП, содержащий Lu-177, ак-
тивностью по 333±46 МБк. Мониторинг распределения
препарата проводили на гамма-камере при сканировании
всего тела и гамма-томографической визуализации колен-
ного сустава. Состояние пациентов оценивалось клиниче-
ски (перед РСО и через 6 мес.). Использовались следую-
щие параметры: индекс учета боли по 100-балльной визу-
альной аналоговой шкале (ВАШ), оценка улучшения по-
движности коленных суставов и учет интенсивности ноч-
ных болей. Ответ на РСЭ был классифицирован как плохой
при динамике ВАШ на менее чем 25 пунктов, как средний
– при динамике ВАШ на ≥ 25–50, как хороший – при ди-
намике ВАШ на ≥ 50–75, как отличный – при снижении
ВАШ на 75 и более пунктов. У всех 10 пациентов при ска-
нировании всего тела не было отмечено никакой «утечки»
введенной активности в нецелевые органы. Сканирование
сустава через 1 мес. после лечения показало полное сохра-
нение ГАП Lu-177 в суставах. У всех пациентов после 6 мес.
наблюдения констатированы уменьшение боле и проявле-
ний синовитов, увеличение подвижности суставов. Про-
цент улучшения ВАШ от исходных значений спустя 6 мес.
после РСО – 79,5±20,0%. Это в значительной степени было
связано с возрастом пациентов (р = 0,01) и длительностью
заболевания (р = 0,03). В коленных суставах с 0 и I стадией
заболевания по Штейнброкеру отмечен результат значи-
тельно лучше, чем в суставах с более выраженными изме-
нениями (стадии III и IV по Штейнброкеру), и получен бо-
лее стойкий ответ. Клиническая динамика по ВАШ соста-
вила 75% против 45,8%. Общий показатель ответа на тера-
пию (ВАШ ≥ 50) составил 80%. Ремиссия боли в течение
ночи была достигнута в 100% случаев, а у 80% пациентов
улучшилась подвижность коленных суставов. Препарат
ГАП Lu-177 был оценен при применении у пациентов с
хроническими синовитами коленных суставов ревматоид-
ного происхождения как безопасный и эффективный. РСО
с лютецием-177 продемонстрировал высокий терапевти-
ческий эффект в течение 6 мес. без каких-либо значимых
побочных эффектов. Предварительные исследования по-
казывают, что меченные Lu-177 частицы ГАП являются
перспективными и экономически оправданными средства-
ми для РСО.
Иттрий-90
Радиоколлоиды на основе иттрия-90 (Y-90) широко и
давно применяются для введения в крупные суставы. Бла-
годаря тому, что Y-90 является «чистым» бета-эмиттером,
он безопасен для окружающих, однако это затрудняет его
визуализацию после введения пациенту. Группа польских
исследователей опубликовала результаты своего опыта
применения РСО [38]. В данном исследовании авторы оце-
нивали эффективность применения Y-90 у нескольких
групп пациентов с различными заболеваниями суставов. В
исследование вошли 70 пациентов в возрасте от 29 до 65
лет, страдающие РА, спондилоартропатиями (СА) и остео-
артритом (ОА) с экссудативными синовитами коленных
суставов. С лечебной целью внутрисуставно вводили ра-
диофармацевтический коллоид с Y-90 активностью 185–
222 МБк в объеме 2–3 мл, затем суставы иммобилизиро-
вали на 72 ч. В динамике оценивали скорость оседания
эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ),
а также проводили УЗИ коленных суставов. Наиболее су-
щественная динамика состояния синовиальной оболочки
до и после процедуры была получена в группе больных РА.
Уменьшение объема суставного выпота до и после про-
цедуры была статистически значимой во всех группах и со-
поставимой между группами. Наибольшее снижение вос-
палительных параметров до и через 4 нед. после РСО на-
блюдалась у пациентов с РА.
Важно отметить, что не в каждом случае суставного вы-
пота следует применять РСО. Неудачи могут быть связаны
с неверным выбором показаний. Так, в одной работе был
проанализирован случай неудачного применения РСО [39].
Лечение проводилось у больного с выпотом коленного су-
става и гистологически доказанным неспецифическим арт-
ритом. Первоначально был получен частичный ответ на
РСО, но позже был отмечен рецидив с выпотом и артрал-
гиями. Последующая хирургическая синовэктомия и ги-
стопатологическая экспертиза показали, что заболевание
имело туберкулезное происхождение. Таким образом, в
странах, эндемичных по туберкулезу, следует иметь в виду
возможную инфекционную этиологию заболевания, преж-
де чем использовать РСО.
Заключение
РСО – это простой, быстрый и безболезненный для па-
циента метод лечения различных синовитов. Благопри-
ятный эффект отмечается в 50–80% случаев. Лечение
должно проводиться по возможности до развития значи-
тельных деструктивных изменений. РСО при РА не заме-
няет базисную терапию, а действует локально. Однако за
счет стойкого подавления хронического суставного воспа-
ления это лечение препятствует активации системного
воспалительного ответа. Действие базисной терапии и РСО
является синергичным и предполагает совместное участие
ревматологов и врачей ядерной медицины. Таким обра-
зом, метод РСО по своей эффективности сходен с хирур-
гической синовэктомией, однако не требует длительной
госпитализации и последующей реабилитации.
Анализируя возможные перспективы развития метода,
точнее сказать, возрождение его на новом уровне разви-
тия, следует отметить, что использование препаратов на
основе рения-188 представляется наиболее универсаль-
ным путем решения этой задачи. Опираясь на его физиче-
ские характеристики, учитывая уже имеющийся научный
опыт, изложенный в публикациях, можно рекомендовать
Re-188 в качества оптимального средства для РСО круп-
ных суставов. Однако, как отмечалось в одной из работ,
можно рассмотреть возможность его применения и в суставах самого разного размера [36]. Лечение препаратами
на основе Re-188 можно было бы использовать в соответ-
ствии с методическими рекомендациями Европейской ас-
социации ядерной медицины [40]. С учетом высокой стои-
мости и ограниченной распространенности препаратов
для РСО генераторное получение 188Re без носителя поз-
волит приготавливать препарат непосредственно в клини-
ке перед введением пациенту.
В МРНЦ им. А.Ф. Цыба (Обнинск) создан новый ориги-
нальный препарат для РСЭ на основе 188Re, помещенного в
микросферы альбумина с размерами частиц 5–10 мкм. В
доклинических исследованиях показано, что при внутри-
суставном введении достигается полное удержание в ко-
ленном суставе, печени и других органах и тканях – следо-
вое накопление. Поглощенная доза в синовии – 240 Гр
(при введении 3 МБк). Через 21 сут отмечается подавление
воспаления, вызванного экспериментальным синовитом
[41, 42]. Развитие этого метода в России позволит нашим
пациентам получать лечение, доступное сейчас только за
рубежом.
Литература
1. Delbarre F., Cayla J., Menkes C. J. et al. La synoviorth se par les radioisotopes. Book La
synoviorth se par les radioisotopes // EditorPresse Med.1968. P. 1045–1050.
2. Ishido C. Über die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie. Book
ber die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie // Editor. 1923.
P. 537–544.
3. Fellinger K., Schmid J. Die lokale Behandlung der rheumatischen Erkrankungen // Wien
Z Inn Med. 1952. T. 33, № 9. P. 351–363.
4. Ansell B.M., Crook A., Mallard J.R., Bywaters E.G.L. Evaluation of Intra-articular Colloidal
Gold Au 198 in the Treatment of Persistent Knee Effusions // Annals of the Rheumatic
Diseases. 1963. Vol 22 (6). P. 435–439.
5. Mödder G. Radiosynoviorthesis (Radiation Synovectomy) // Clinical Nuclear Medicine
Biersack H.-J., Freeman L. M. Berlin, Heidelberg: Springer Berlin Heidelberg. 2007.
P. 512–518.
6. Дроздовский Б.Я., Иконников А.И., Крылов В.В. Радиосиновиортез в лечении
больных ревматоидным артритом // Медицинская радиология. 1990. T. 7. C. 6–9
[Drozdovskij B.Ja., Ikonnikov A.I., Krylov V.V. Radiosinoviortez v lechenii bol’nyh revmatoidnym
artritom // Medicinskaja radiologija. 1990. T. 7. C. 6–9 (in Russian).]
7. Mödder G. Radiosynoviorthesis. Involvement of nuclear medicine in rheumatology
and orthopaedics // Meckenheim. 1995.
8. Mödder G. Nuklearmedizinische Therapy (RadioSynoviorthese) in Rheumatologie und
Orthopaedie. Der Nuklearmediziner. 1995. Vol. 18. P. 15–32.
9. Kampen W.U., Brenner W., Kroeger S. et al. Long-term results of radiation synovectomy:
a clinical follow-up study // Nucl Med Commun. 2001. Vol. 22(2). P. 239–246.
10. Kampen W.U., Brenner W., Czech N., Henze E. Intraarticular application of unsealed
beta-emitting radionuclides in the treatment course of inflammatory joint disorders. Book
Intraarticular application of unsealed beta-emitting radionuclides in the treatment
course of inflammatory joint disorders // Editor. 2002. P. 77–87.
11. Kampen W.U., Voth M., Pinkert J., Krause A.Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Book Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in
rheumatoid arthritis and related indications // Editor. 2007. P. 16–24.
12. Fischer M., Mödder G. Radionuclide therapy of inflammatory joint diseases // Nucl
Med Commun. 2002. Vol. 23 (9). P. 829–831.
13. Hoefnagel C.A., Clarke S.E.M., Fischer M. et al. Radionuclide therapy practice and facilities
in Europe // European Journal of Nuclear Medicine. 1999. Vol. 26 (3). P. 277–282.
14. Farahati J., Schneider P., Reiners C. Radionuklidtherapie bei entz ndlichen Gelenkerkrankungen:
Schlusswort // Dtsch Arztebl International. 2006. Vol. 103 (41). P. 2719.
15. Brenner W. Grundlagen und Technik der Radiosynoviorthese // Nuklearmediziner.
2006. Vol. 29 (01). P. 5–14.
16. Das B.K., Mödder G., Pradhan P.K., Shukla A.K. Concept of radiosynovectomy. A novel
approach in the treatment of joint disorders // Book Concept of radiosynovectomy.
A novel approach in the treatment of joint disorders // Editor. 2004. P. 1–5.
17. Mödder G., Mödder-Reese R. Radiosynoviorthesis (radiation synovectomy): State
of the Art 2011 // Book Radiosynoviorthesis (radiation synovectomy): State of the Art
2011 // Editor. 2011. P. 154–155.
18. Kampen W.U., Voth M., Pinkert J., Krause A. Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Rheumatology (Oxford). 2007. Vol. 46. P. 16–24.
19. Farahati J., Reiners C., Fischer M. et al. Leitlinie für die Radiosynoviorthese // Nuclear-
Medizin. 1999. Vol. 38 (6A). P. 254–255.
20. Clunie G., Fischer M., EANM EANM Procedure Guidelines for Radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30. P. 12–16.
21. Liepe K., Крылов В.В. Радиосиновиортез в лечении воспалительных заболеваний
суставов // Научно-практическая ревматология. 2013. № 6. C. 7 [Liepe K., Krylov V.V.
Radiosynoviorthez v lechenii vospalitelnih zabolevanii sustavov // Nauchno-prakticheskaya
revmatologiya 2013. № 6. S. 7 (in Russian)].
22. Kresnik E., Mikosch P., Gallowitsch H.J. et al. Clinical outcome of radiosynoviorthesis:
A meta-analysis including 2190 treated joints // Nucl Med Commun. 2002. Vol. 23.
P. 683–688.
23. Deutsch E., Brodack J.W., Deutsch K.F. Radiation synovectomy revisited // Eur J Nucl
Med. 1993. Vol. 20 (11). P. 1113–1127.
24. Soroa V.E., del Huerto Velazquez Espeche M., Giannone C. et al. Effects of radiosynovectomy
with p-32 colloid therapy in hemophilia and rheumatoid arthritis // Cancer Biother
Radiopharm. 2005. T. 20, № 3. C. 344–3448.
25. Li P., Chen G., Zhang H., Shen Z. Radiation synovectomy by 188Re-Sulfide in haemophilic
synovitis // Haemophilia. 2004. Vol. 10 (5). P. 422–427.
26. Liepe K., Zaknun J. J., Padhy A. et al. Radiosynovectomy using yttrium-90, phosphorus-
32 or rhenium-188 radiocolloids versus corticoid instillation for rheumatoid arthritis
of the knee // Ann Nucl Med. 2011. Vol. 25 (5). P. 317–323.
27. Wang S. J., Lin W. Y., Hsieh B. T. et al. Jr. Rhenium-188 sulphur colloid as a radiation
synovectomy agent // Eur J Nucl Med. 1995. Vol. 22 (6). P. 505–507.
28. Wang S.J., Lin W.Y., Chen M.N. et al. Intratumoral injection of rhenium-188 microspheres
into an animal model of hepatoma // J Nucl Med. 1998. Vol. 39 (10). P. 1752–1757.
29. Wang S.J., Lin W.Y., Chen M.N. et al. Histologic study of effects of radiation synovectomy
with Rhenium-188 microsphere // Nucl Med Biol. 2001. Vol. 28 (6). P. 727–732.
30. Lee E. B., Shin K. C., Lee Y. J. et al. 188Re-tin-colloid as a new therapeutic agent for
rheumatoid arthritis // Nucl Med Commun. 2003.Vol. 24 (6). P. 689–696.
31. Li P., Yu J., Chen G. et al. Applied radioactivity in radiation synovectomy with
(188Re)rhenium sulfide suspension // Nucl Med Commun. 2006.Vol. 27 (8). P. 603–609.
32. Ures M., Savio E., Malanga A. et al. Physico-chemical characterisation and biological
evaluation of 188-Rhenium colloids for radiosynovectomy // BMC Nucl Med. 2002.
Vol. 2 (1). P. 1.
33. Zaknun J.J., Liepe K., Gaudiano J. et al. Blood and urine biokinetics of rhenium-188-
in and phosphorus-32 colloids in radiosynovectomy // Eur J Nucl Med Mol Imaging. Vol.
34. Springer 233 spring street, New York, NY 10013 USA, 2007. P. S359–S359.
34. Liepe K., Faulhaber D., Wunderlich G. et al. Radiation Pneumopathy in the Rat After
Intravenous Application of 188 Re-Labeled Microspheres // International Journal of Radiation
Oncology Biology Physics. 2011. Vol. 81 (2). P. 529–536.
35. Zaknun J.J., Liepe K., Soroa V. et al. Management of haemarthrosis applying radiosynovectomy
in haemophilia patients with emphasis on developing countries // Eur J Nucl
Med Mol Imaging. 2007. Vol. 34 P. S352.
36. Kamaleshwaran K.K., Rajamani V., Krishnan B. et al. Radiosynovectomy of Proximal
Interphalangeal Joint Synovitis in Rheumatoid Arthritis Treated with Rhenium-188 Labeled
Tin-colloid and Imaging with Single-photon Emission Computerized Tomography
/ Computed Tomography: A First Case Report // World Journal of Nuclear Medicine (Online).
2015. Vol. 14 (3). P. 216–218.
37. Shinto A.S., Kamaleshwaran K.K., Chakraborty S. et al. Radiosynovectomy of Painful
Synovitis of Knee Joints Due to Rheumatoid Arthritis by Intra-Articular Administration
of 177Lu-Labeled Hydroxyapatite Particulates: First Human Study and Initial Indian Experience
// World Journal of Nuclear Medicine (Online). 2015. Vol. 14 (2). P. 81–88.
38. Zalewska J., Wegierska M., Barczynska T. et al. Efficacy of radiation synovectomy (radiosynovectomy
or radiosynoviorthesis) with yttrium-90 in exudative inflammation of
synovial membrane of knee joints in patients with rheumatic diseases – preliminary report
// Reumatologia. 2016. Vol. 54 (1). P. 3–9.
39. Sood A., Sharma A., Chouhan D.K. et al. Failed Radiation Synovectomy in Diseased
Knee Joint with Missed Tuberculous Synovitis // World J Nucl Med. 2016. Vol. 15 (3).
P. 206–208.
40. Clunie G., Fischer M., Eanm. EANM procedure guidelines for radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30 (3). P. 12–16.
41. Петриев В.М. Закономерности образования комплексного соединения 188Re с
микросферами альбумина крови человека // Радиохимия. 2009. T. 51, № 5.
C. 446–451 [Petriev V. M. Zakonomernosti obrazovanija kompleksnogo soedinenija 188Re
s mikrosferami al’bumina krovi cheloveka // Radiohimija. 2009. T. 51, № 5. C. 446–451
(in Russian)].
42. Скворцов В.Г., Степаненко В.Ф., Петриев В.М. и др. Фармакокинетические и до-
зиметрические характеристики нового радиофармпрепарата Re-188-микросферы
альбумина // Радиационная биология. Радиоэкология. 2010. T. 50, № 6. C. 703–711
[Skvorcov V. G., Stepanenko V. F., Petriev V. M. i dr. Farmakokineticheskie i dozimetricheskie
harakteristiki novogo radiofarmpreparata Re-188-mikrosfery al’bumina // Radiacionnaja
biologija Radiojekologija. 2010. T. 50, № 6. C. 703–711 (in Russian)].
Первый коллоид на основе 188Re для РСО был описан в
1995 г. Исследования, проведенные на коллоиде серы с
188Re, показали стабильность 95% in vitro в течение 3 дней
[27]. Фармакокинетические исследования микросфер с ре-
нием-188 (с размером частиц 15 мкм) показали следую-
щие результаты удерживания в коленном суставе кролика:
98,7, 94,6 и 93,6% после 1, 24 и 48 ч соответственно [28].
Данные фармакокинетики показали очень низкое распро-
странение радиоактивности по всем органам в течение ис-
следования, что указывает на минимальную утечку РФП из
коленного сустава животного. Авторы пришли к выводу,
что микросферы с 188Re являются потенциальным канди-
датом для радиосиновэктомии. Микросферы, меченные
рением-188, были стабильны in vitro на протяжении 3 дней
на уровне 98%. Две недели спустя после инъекции в колен-
ный сустав кроликов в синовиальной оболочке произошли
увеличение фибробластов и фиброзные изменения в си-
новиальной сумке. Также обнаружилось дополнительное
закупоривание сосудов и капилляров в ответ на радиа-
ционное облучение синовиальной оболочки [29].
Е.В. Lee et al. изучали оловянный коллоид, меченный
рением-188 [30]. В сравнении с коллоидом на основе серы
[29, 31] он продемонстрировал лучшие показатели объ-
емного и поверхностного распределения [32]. Первый
опыт применения у пациентов был получен Р. Li et al. [25]
при лечении 29 больных гемофилией. Длительность после-
дующего наблюдения составила 18 мес. В зависимости от
толщины синовиальной оболочки, установленной при
МРТ, были использованы 3 уровня активностей: 555 МБк
(15 мКи), 687 МБк (19 мКи) и 917 МБк (25 мКи). Размеры
частиц коллоида сульфида рения (188Re) составили от 2 до
20 мкм.
Отличные результаты в ближайшем периоде были по-
лучены у 75%, а сокращение частоты кровотечений – у
100% пациентов. На 18-м мес. исследования эффект со-
хранялся у 71%. Зависимости между вводимой актив-
ностью и терапевтической эффективностью установлено
не было. В оценке МРТ были установлены значительное
уменьшение толщины синовиальной оболочки и пролифе-
рация синовиальных ворсинок после лечения. Никаких
подтверждений повреждения суставного хряща найдено
не было. Данные о биораспределении с использованием
сцинтиграфии указывают на отсутствие значимых актив-
ностей в мочевом пузыре, костном мозге, печени, селезен-
ке и региональных лимфатических узлах, также уровень
активности в крови был незначительным. Эти данные об-
основаны высокой in vitro стабильностью коллоидов с ре-
нием-188 и низким уровнем высвобождения изотопа из
препарата.
Под эгидой Международного агентства по атомной
энергии (МАГАТЭ) в 2001 г. было проведено сравнитель-
ное исследование радиофармацевтических препаратов,
предназначенных для радиосиновэктомии [33]. Цель дан-
ного исследования заключалась в оценке терапевтической
эффективности, выраженной в контроле болевого синдро-
ма коленного сустава у пациентов с РА или гемофильным
артритом, при использовании коммерчески доступного
радиоколлоида с 90Y, по сравнению с эффективностью пре-
паратов на основе 188Re и 32P. Стратегия заключалась в том,
чтобы оценить перспективность использования 188Re и 32Р
с целью улучшения доступности РСО во всем мире, осо-
бенно в Азии и Южной Америке. Изучая биокинетику,
фиксировали процент от введенной активности коллоида
с 188Re в крови на 4-й, 12-й, 24-й и 72-й ч. Были получены
следующие значения: 0,06±0,05; 0,12±0,09; 0,21±0,19;
0,14±0,08% соответственно. Содержание выведенной ак-
тивности с 188Re с мочой составило 1,65±3,00% через 72 ч
после терапии. Процент содержания в крови от введенной
активности для коллоида с 32Р был значительно выше:
5,8±3,1; 5,7±2,8; 4,4±3,3; 3,8±3,4 после 1, 2, 3 и 24 ч соот-
ветственно [33]. Степень высвобождения препарата зави-
сит от размера частиц в составе препарата. Такие различия
в содержании активности в крови и моче на двух препара-
тах могут объясняться более коротким периодом полурас-
пада у рения-188 и более мелким размером частиц в кол-
лоиде 32Р (0,2 0,35 мкм у коллоида с 32Р по сравнению с
1–10 мкм коллоида олова, меченного 188Re). Эти биокине-
тические исследования указывают на то, что 188Re является
наиболее подходящим для РСО. В этом исследовании 96
детей в возрасте от 4 до 12 лет, страдающих гемофиличе-
скими артопатиями, были пролечены препаратами на ос-
нове 188Re, 32Р, 90Y с активностями, соответствующими их
возрасту. Было показано, что после проведения РСО коли-
чество кровотечений значительно уменьшилось. До про-
ведения РСО в исследуемой группе отмечалось высокое
число кровотечений (391 в течение 1 мес.). Спустя 1 мес.
после РСО было отмечено уменьшение числа кровотече-
ний до 53 случаев, до 50 – спустя 3 мес., 32 случая – через
6 мес. после РСО. В течение 6 мес. после РСО 48% пациен-
тов вообще не имели внутрисуставных кровотечений
(100% снижение), у 38% число кровотечений снизилось на
80%, в 14% случаев – на 50%. По показаниям детей и их
опекунов зафиксированы значительное улучшение каче-
ства жизни, подтвержденное улучшенной подвижностью,
и значительное уменьшение количества пропущенных
учебных дней. Исследованная подгруппа из 13 пациентов
с гемофилией, пролеченных коллоидом с 188Re, показала
схожие результаты [33].
Исследование по лечению коллоидом на основе 188Re
16 больных РА также проводилось под эгидой МАГАТЭ.
Уровень болей был документирован по 10-балльной шка-
ле. Облегчение боли было значительно выше у пациентов,
получавших коллоид 188Re, по сравнению с контрольной
группой, получавшей внутрисуставные введения глюко-
кортикоидов [34]. За исключением 1 случая с контуриро-
ванным и обратимым некрозом кожи в месте введения
РФП или обратимого набухания коленного сустава ника-
ких других серьезных побочных эффектов зарегистриро-
вано не было [26, 35]. Данные о биокинетике и проведен-
ные клинические исследования подтверждают, что кол-
лоиды с 188Re являются безопасными и эффективными в
лечении гемофилии и РА. Однако имеющихся данных еще
недостаточно.
Обычно препараты на основе 188Re используют для вве-
дения в крупные суставы, однако исследователи из Индии
опубликовали работу об успешном применении коллоида
188Re для РСО мелкого сустава при РА [36]. 45-летняя па-
циентка, страдающая РА, жаловалась на отек и боль в су-
ставе безымянного пальца правой руки на протяжении
6 мес. Консервативная терапия была неэффективна. Ей был введен препарат на основе коллоида олова, меченный
188Re, общей активностью 370 МБк. Палец пациентки был
зафиксирован на 48 ч. В течение следующих 3-х мес. отек
спал, а боли значительно уменьшились.
Лютеций-177
Одним из весьма перспективных изотопов для приме-
нения в радионуклидной терапии является лютеций-177
(Lu-177). Его физические характеристики позволяют ис-
пользовать его для внутрисуставных введений. Наличие
гамма-излучения дает возможность следить за распреде-
лением препарата с помощью гамма-камеры.
Были проведены исследования по оценке эффективно-
сти РСО с препаратом гидроксиапатит (ГАП), меченным
Lu-177, в лечении рецидивирующего синовита, сопровож-
дающегося выпотом в коленных суставах при РА [37]. Де-
сяти пациентам, страдающим стойкими синовитами ко-
ленных суставов, был введен ГАП, содержащий Lu-177, ак-
тивностью по 333±46 МБк. Мониторинг распределения
препарата проводили на гамма-камере при сканировании
всего тела и гамма-томографической визуализации колен-
ного сустава. Состояние пациентов оценивалось клиниче-
ски (перед РСО и через 6 мес.). Использовались следую-
щие параметры: индекс учета боли по 100-балльной визу-
альной аналоговой шкале (ВАШ), оценка улучшения по-
движности коленных суставов и учет интенсивности ноч-
ных болей. Ответ на РСЭ был классифицирован как плохой
при динамике ВАШ на менее чем 25 пунктов, как средний
– при динамике ВАШ на ≥ 25–50, как хороший – при ди-
намике ВАШ на ≥ 50–75, как отличный – при снижении
ВАШ на 75 и более пунктов. У всех 10 пациентов при ска-
нировании всего тела не было отмечено никакой «утечки»
введенной активности в нецелевые органы. Сканирование
сустава через 1 мес. после лечения показало полное сохра-
нение ГАП Lu-177 в суставах. У всех пациентов после 6 мес.
наблюдения констатированы уменьшение боле и проявле-
ний синовитов, увеличение подвижности суставов. Про-
цент улучшения ВАШ от исходных значений спустя 6 мес.
после РСО – 79,5±20,0%. Это в значительной степени было
связано с возрастом пациентов (р = 0,01) и длительностью
заболевания (р = 0,03). В коленных суставах с 0 и I стадией
заболевания по Штейнброкеру отмечен результат значи-
тельно лучше, чем в суставах с более выраженными изме-
нениями (стадии III и IV по Штейнброкеру), и получен бо-
лее стойкий ответ. Клиническая динамика по ВАШ соста-
вила 75% против 45,8%. Общий показатель ответа на тера-
пию (ВАШ ≥ 50) составил 80%. Ремиссия боли в течение
ночи была достигнута в 100% случаев, а у 80% пациентов
улучшилась подвижность коленных суставов. Препарат
ГАП Lu-177 был оценен при применении у пациентов с
хроническими синовитами коленных суставов ревматоид-
ного происхождения как безопасный и эффективный. РСО
с лютецием-177 продемонстрировал высокий терапевти-
ческий эффект в течение 6 мес. без каких-либо значимых
побочных эффектов. Предварительные исследования по-
казывают, что меченные Lu-177 частицы ГАП являются
перспективными и экономически оправданными средства-
ми для РСО.
Иттрий-90
Радиоколлоиды на основе иттрия-90 (Y-90) широко и
давно применяются для введения в крупные суставы. Бла-
годаря тому, что Y-90 является «чистым» бета-эмиттером,
он безопасен для окружающих, однако это затрудняет его
визуализацию после введения пациенту. Группа польских
исследователей опубликовала результаты своего опыта
применения РСО [38]. В данном исследовании авторы оце-
нивали эффективность применения Y-90 у нескольких
групп пациентов с различными заболеваниями суставов. В
исследование вошли 70 пациентов в возрасте от 29 до 65
лет, страдающие РА, спондилоартропатиями (СА) и остео-
артритом (ОА) с экссудативными синовитами коленных
суставов. С лечебной целью внутрисуставно вводили ра-
диофармацевтический коллоид с Y-90 активностью 185–
222 МБк в объеме 2–3 мл, затем суставы иммобилизиро-
вали на 72 ч. В динамике оценивали скорость оседания
эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ),
а также проводили УЗИ коленных суставов. Наиболее су-
щественная динамика состояния синовиальной оболочки
до и после процедуры была получена в группе больных РА.
Уменьшение объема суставного выпота до и после про-
цедуры была статистически значимой во всех группах и со-
поставимой между группами. Наибольшее снижение вос-
палительных параметров до и через 4 нед. после РСО на-
блюдалась у пациентов с РА.
Важно отметить, что не в каждом случае суставного вы-
пота следует применять РСО. Неудачи могут быть связаны
с неверным выбором показаний. Так, в одной работе был
проанализирован случай неудачного применения РСО [39].
Лечение проводилось у больного с выпотом коленного су-
става и гистологически доказанным неспецифическим арт-
ритом. Первоначально был получен частичный ответ на
РСО, но позже был отмечен рецидив с выпотом и артрал-
гиями. Последующая хирургическая синовэктомия и ги-
стопатологическая экспертиза показали, что заболевание
имело туберкулезное происхождение. Таким образом, в
странах, эндемичных по туберкулезу, следует иметь в виду
возможную инфекционную этиологию заболевания, преж-
де чем использовать РСО.
Заключение
РСО – это простой, быстрый и безболезненный для па-
циента метод лечения различных синовитов. Благопри-
ятный эффект отмечается в 50–80% случаев. Лечение
должно проводиться по возможности до развития значи-
тельных деструктивных изменений. РСО при РА не заме-
няет базисную терапию, а действует локально. Однако за
счет стойкого подавления хронического суставного воспа-
ления это лечение препятствует активации системного
воспалительного ответа. Действие базисной терапии и РСО
является синергичным и предполагает совместное участие
ревматологов и врачей ядерной медицины. Таким обра-
зом, метод РСО по своей эффективности сходен с хирур-
гической синовэктомией, однако не требует длительной
госпитализации и последующей реабилитации.
Анализируя возможные перспективы развития метода,
точнее сказать, возрождение его на новом уровне разви-
тия, следует отметить, что использование препаратов на
основе рения-188 представляется наиболее универсаль-
ным путем решения этой задачи. Опираясь на его физиче-
ские характеристики, учитывая уже имеющийся научный
опыт, изложенный в публикациях, можно рекомендовать
Re-188 в качества оптимального средства для РСО круп-
ных суставов. Однако, как отмечалось в одной из работ,
можно рассмотреть возможность его применения и в суставах самого разного размера [36]. Лечение препаратами
на основе Re-188 можно было бы использовать в соответ-
ствии с методическими рекомендациями Европейской ас-
социации ядерной медицины [40]. С учетом высокой стои-
мости и ограниченной распространенности препаратов
для РСО генераторное получение 188Re без носителя поз-
волит приготавливать препарат непосредственно в клини-
ке перед введением пациенту.
В МРНЦ им. А.Ф. Цыба (Обнинск) создан новый ориги-
нальный препарат для РСЭ на основе 188Re, помещенного в
микросферы альбумина с размерами частиц 5–10 мкм. В
доклинических исследованиях показано, что при внутри-
суставном введении достигается полное удержание в ко-
ленном суставе, печени и других органах и тканях – следо-
вое накопление. Поглощенная доза в синовии – 240 Гр
(при введении 3 МБк). Через 21 сут отмечается подавление
воспаления, вызванного экспериментальным синовитом
[41, 42]. Развитие этого метода в России позволит нашим
пациентам получать лечение, доступное сейчас только за
рубежом.
Литература
1. Delbarre F., Cayla J., Menkes C. J. et al. La synoviorth se par les radioisotopes. Book La
synoviorth se par les radioisotopes // EditorPresse Med.1968. P. 1045–1050.
2. Ishido C. Über die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie. Book
ber die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie // Editor. 1923.
P. 537–544.
3. Fellinger K., Schmid J. Die lokale Behandlung der rheumatischen Erkrankungen // Wien
Z Inn Med. 1952. T. 33, № 9. P. 351–363.
4. Ansell B.M., Crook A., Mallard J.R., Bywaters E.G.L. Evaluation of Intra-articular Colloidal
Gold Au 198 in the Treatment of Persistent Knee Effusions // Annals of the Rheumatic
Diseases. 1963. Vol 22 (6). P. 435–439.
5. Mödder G. Radiosynoviorthesis (Radiation Synovectomy) // Clinical Nuclear Medicine
Biersack H.-J., Freeman L. M. Berlin, Heidelberg: Springer Berlin Heidelberg. 2007.
P. 512–518.
6. Дроздовский Б.Я., Иконников А.И., Крылов В.В. Радиосиновиортез в лечении
больных ревматоидным артритом // Медицинская радиология. 1990. T. 7. C. 6–9
[Drozdovskij B.Ja., Ikonnikov A.I., Krylov V.V. Radiosinoviortez v lechenii bol’nyh revmatoidnym
artritom // Medicinskaja radiologija. 1990. T. 7. C. 6–9 (in Russian).]
7. Mödder G. Radiosynoviorthesis. Involvement of nuclear medicine in rheumatology
and orthopaedics // Meckenheim. 1995.
8. Mödder G. Nuklearmedizinische Therapy (RadioSynoviorthese) in Rheumatologie und
Orthopaedie. Der Nuklearmediziner. 1995. Vol. 18. P. 15–32.
9. Kampen W.U., Brenner W., Kroeger S. et al. Long-term results of radiation synovectomy:
a clinical follow-up study // Nucl Med Commun. 2001. Vol. 22(2). P. 239–246.
10. Kampen W.U., Brenner W., Czech N., Henze E. Intraarticular application of unsealed
beta-emitting radionuclides in the treatment course of inflammatory joint disorders. Book
Intraarticular application of unsealed beta-emitting radionuclides in the treatment
course of inflammatory joint disorders // Editor. 2002. P. 77–87.
11. Kampen W.U., Voth M., Pinkert J., Krause A.Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Book Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in
rheumatoid arthritis and related indications // Editor. 2007. P. 16–24.
12. Fischer M., Mödder G. Radionuclide therapy of inflammatory joint diseases // Nucl
Med Commun. 2002. Vol. 23 (9). P. 829–831.
13. Hoefnagel C.A., Clarke S.E.M., Fischer M. et al. Radionuclide therapy practice and facilities
in Europe // European Journal of Nuclear Medicine. 1999. Vol. 26 (3). P. 277–282.
14. Farahati J., Schneider P., Reiners C. Radionuklidtherapie bei entz ndlichen Gelenkerkrankungen:
Schlusswort // Dtsch Arztebl International. 2006. Vol. 103 (41). P. 2719.
15. Brenner W. Grundlagen und Technik der Radiosynoviorthese // Nuklearmediziner.
2006. Vol. 29 (01). P. 5–14.
16. Das B.K., Mödder G., Pradhan P.K., Shukla A.K. Concept of radiosynovectomy. A novel
approach in the treatment of joint disorders // Book Concept of radiosynovectomy.
A novel approach in the treatment of joint disorders // Editor. 2004. P. 1–5.
17. Mödder G., Mödder-Reese R. Radiosynoviorthesis (radiation synovectomy): State
of the Art 2011 // Book Radiosynoviorthesis (radiation synovectomy): State of the Art
2011 // Editor. 2011. P. 154–155.
18. Kampen W.U., Voth M., Pinkert J., Krause A. Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Rheumatology (Oxford). 2007. Vol. 46. P. 16–24.
19. Farahati J., Reiners C., Fischer M. et al. Leitlinie für die Radiosynoviorthese // Nuclear-
Medizin. 1999. Vol. 38 (6A). P. 254–255.
20. Clunie G., Fischer M., EANM EANM Procedure Guidelines for Radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30. P. 12–16.
21. Liepe K., Крылов В.В. Радиосиновиортез в лечении воспалительных заболеваний
суставов // Научно-практическая ревматология. 2013. № 6. C. 7 [Liepe K., Krylov V.V.
Radiosynoviorthez v lechenii vospalitelnih zabolevanii sustavov // Nauchno-prakticheskaya
revmatologiya 2013. № 6. S. 7 (in Russian)].
22. Kresnik E., Mikosch P., Gallowitsch H.J. et al. Clinical outcome of radiosynoviorthesis:
A meta-analysis including 2190 treated joints // Nucl Med Commun. 2002. Vol. 23.
P. 683–688.
23. Deutsch E., Brodack J.W., Deutsch K.F. Radiation synovectomy revisited // Eur J Nucl
Med. 1993. Vol. 20 (11). P. 1113–1127.
24. Soroa V.E., del Huerto Velazquez Espeche M., Giannone C. et al. Effects of radiosynovectomy
with p-32 colloid therapy in hemophilia and rheumatoid arthritis // Cancer Biother
Radiopharm. 2005. T. 20, № 3. C. 344–3448.
25. Li P., Chen G., Zhang H., Shen Z. Radiation synovectomy by 188Re-Sulfide in haemophilic
synovitis // Haemophilia. 2004. Vol. 10 (5). P. 422–427.
26. Liepe K., Zaknun J. J., Padhy A. et al. Radiosynovectomy using yttrium-90, phosphorus-
32 or rhenium-188 radiocolloids versus corticoid instillation for rheumatoid arthritis
of the knee // Ann Nucl Med. 2011. Vol. 25 (5). P. 317–323.
27. Wang S. J., Lin W. Y., Hsieh B. T. et al. Jr. Rhenium-188 sulphur colloid as a radiation
synovectomy agent // Eur J Nucl Med. 1995. Vol. 22 (6). P. 505–507.
28. Wang S.J., Lin W.Y., Chen M.N. et al. Intratumoral injection of rhenium-188 microspheres
into an animal model of hepatoma // J Nucl Med. 1998. Vol. 39 (10). P. 1752–1757.
29. Wang S.J., Lin W.Y., Chen M.N. et al. Histologic study of effects of radiation synovectomy
with Rhenium-188 microsphere // Nucl Med Biol. 2001. Vol. 28 (6). P. 727–732.
30. Lee E. B., Shin K. C., Lee Y. J. et al. 188Re-tin-colloid as a new therapeutic agent for
rheumatoid arthritis // Nucl Med Commun. 2003.Vol. 24 (6). P. 689–696.
31. Li P., Yu J., Chen G. et al. Applied radioactivity in radiation synovectomy with
(188Re)rhenium sulfide suspension // Nucl Med Commun. 2006.Vol. 27 (8). P. 603–609.
32. Ures M., Savio E., Malanga A. et al. Physico-chemical characterisation and biological
evaluation of 188-Rhenium colloids for radiosynovectomy // BMC Nucl Med. 2002.
Vol. 2 (1). P. 1.
33. Zaknun J.J., Liepe K., Gaudiano J. et al. Blood and urine biokinetics of rhenium-188-
in and phosphorus-32 colloids in radiosynovectomy // Eur J Nucl Med Mol Imaging. Vol.
34. Springer 233 spring street, New York, NY 10013 USA, 2007. P. S359–S359.
34. Liepe K., Faulhaber D., Wunderlich G. et al. Radiation Pneumopathy in the Rat After
Intravenous Application of 188 Re-Labeled Microspheres // International Journal of Radiation
Oncology Biology Physics. 2011. Vol. 81 (2). P. 529–536.
35. Zaknun J.J., Liepe K., Soroa V. et al. Management of haemarthrosis applying radiosynovectomy
in haemophilia patients with emphasis on developing countries // Eur J Nucl
Med Mol Imaging. 2007. Vol. 34 P. S352.
36. Kamaleshwaran K.K., Rajamani V., Krishnan B. et al. Radiosynovectomy of Proximal
Interphalangeal Joint Synovitis in Rheumatoid Arthritis Treated with Rhenium-188 Labeled
Tin-colloid and Imaging with Single-photon Emission Computerized Tomography
/ Computed Tomography: A First Case Report // World Journal of Nuclear Medicine (Online).
2015. Vol. 14 (3). P. 216–218.
37. Shinto A.S., Kamaleshwaran K.K., Chakraborty S. et al. Radiosynovectomy of Painful
Synovitis of Knee Joints Due to Rheumatoid Arthritis by Intra-Articular Administration
of 177Lu-Labeled Hydroxyapatite Particulates: First Human Study and Initial Indian Experience
// World Journal of Nuclear Medicine (Online). 2015. Vol. 14 (2). P. 81–88.
38. Zalewska J., Wegierska M., Barczynska T. et al. Efficacy of radiation synovectomy (radiosynovectomy
or radiosynoviorthesis) with yttrium-90 in exudative inflammation of
synovial membrane of knee joints in patients with rheumatic diseases – preliminary report
// Reumatologia. 2016. Vol. 54 (1). P. 3–9.
39. Sood A., Sharma A., Chouhan D.K. et al. Failed Radiation Synovectomy in Diseased
Knee Joint with Missed Tuberculous Synovitis // World J Nucl Med. 2016. Vol. 15 (3).
P. 206–208.
40. Clunie G., Fischer M., Eanm. EANM procedure guidelines for radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30 (3). P. 12–16.
41. Петриев В.М. Закономерности образования комплексного соединения 188Re с
микросферами альбумина крови человека // Радиохимия. 2009. T. 51, № 5.
C. 446–451 [Petriev V. M. Zakonomernosti obrazovanija kompleksnogo soedinenija 188Re
s mikrosferami al’bumina krovi cheloveka // Radiohimija. 2009. T. 51, № 5. C. 446–451
(in Russian)].
42. Скворцов В.Г., Степаненко В.Ф., Петриев В.М. и др. Фармакокинетические и до-
зиметрические характеристики нового радиофармпрепарата Re-188-микросферы
альбумина // Радиационная биология. Радиоэкология. 2010. T. 50, № 6. C. 703–711
[Skvorcov V. G., Stepanenko V. F., Petriev V. M. i dr. Farmakokineticheskie i dozimetricheskie
harakteristiki novogo radiofarmpreparata Re-188-mikrosfery al’bumina // Radiacionnaja
biologija Radiojekologija. 2010. T. 50, № 6. C. 703–711 (in Russian)].


 Первый коллоид на основе 188Re для РСО был описан в
1995 г. Исследования, проведенные на коллоиде серы с
188Re, показали стабильность 95% in vitro в течение 3 дней
[27]. Фармакокинетические исследования микросфер с ре-
нием-188 (с размером частиц 15 мкм) показали следую-
щие результаты удерживания в коленном суставе кролика:
98,7, 94,6 и 93,6% после 1, 24 и 48 ч соответственно [28].
Данные фармакокинетики показали очень низкое распро-
странение радиоактивности по всем органам в течение ис-
следования, что указывает на минимальную утечку РФП из
коленного сустава животного. Авторы пришли к выводу,
что микросферы с 188Re являются потенциальным канди-
датом для радиосиновэктомии. Микросферы, меченные
рением-188, были стабильны in vitro на протяжении 3 дней
на уровне 98%. Две недели спустя после инъекции в колен-
ный сустав кроликов в синовиальной оболочке произошли
увеличение фибробластов и фиброзные изменения в си-
новиальной сумке. Также обнаружилось дополнительное
закупоривание сосудов и капилляров в ответ на радиа-
ционное облучение синовиальной оболочки [29].
Е.В. Lee et al. изучали оловянный коллоид, меченный
рением-188 [30]. В сравнении с коллоидом на основе серы
[29, 31] он продемонстрировал лучшие показатели объ-
емного и поверхностного распределения [32]. Первый
опыт применения у пациентов был получен Р. Li et al. [25]
при лечении 29 больных гемофилией. Длительность после-
дующего наблюдения составила 18 мес. В зависимости от
толщины синовиальной оболочки, установленной при
МРТ, были использованы 3 уровня активностей: 555 МБк
(15 мКи), 687 МБк (19 мКи) и 917 МБк (25 мКи). Размеры
частиц коллоида сульфида рения (188Re) составили от 2 до
20 мкм.
Отличные результаты в ближайшем периоде были по-
лучены у 75%, а сокращение частоты кровотечений – у
100% пациентов. На 18-м мес. исследования эффект со-
хранялся у 71%. Зависимости между вводимой актив-
ностью и терапевтической эффективностью установлено
не было. В оценке МРТ были установлены значительное
уменьшение толщины синовиальной оболочки и пролифе-
рация синовиальных ворсинок после лечения. Никаких
подтверждений повреждения суставного хряща найдено
не было. Данные о биораспределении с использованием
сцинтиграфии указывают на отсутствие значимых актив-
ностей в мочевом пузыре, костном мозге, печени, селезен-
ке и региональных лимфатических узлах, также уровень
активности в крови был незначительным. Эти данные об-
основаны высокой in vitro стабильностью коллоидов с ре-
нием-188 и низким уровнем высвобождения изотопа из
препарата.
Под эгидой Международного агентства по атомной
энергии (МАГАТЭ) в 2001 г. было проведено сравнитель-
ное исследование радиофармацевтических препаратов,
предназначенных для радиосиновэктомии [33]. Цель дан-
ного исследования заключалась в оценке терапевтической
эффективности, выраженной в контроле болевого синдро-
ма коленного сустава у пациентов с РА или гемофильным
артритом, при использовании коммерчески доступного
радиоколлоида с 90Y, по сравнению с эффективностью пре-
паратов на основе 188Re и 32P. Стратегия заключалась в том,
чтобы оценить перспективность использования 188Re и 32Р
с целью улучшения доступности РСО во всем мире, осо-
бенно в Азии и Южной Америке. Изучая биокинетику,
фиксировали процент от введенной активности коллоида
с 188Re в крови на 4-й, 12-й, 24-й и 72-й ч. Были получены
следующие значения: 0,06±0,05; 0,12±0,09; 0,21±0,19;
0,14±0,08% соответственно. Содержание выведенной ак-
тивности с 188Re с мочой составило 1,65±3,00% через 72 ч
после терапии. Процент содержания в крови от введенной
активности для коллоида с 32Р был значительно выше:
5,8±3,1; 5,7±2,8; 4,4±3,3; 3,8±3,4 после 1, 2, 3 и 24 ч соот-
ветственно [33]. Степень высвобождения препарата зави-
сит от размера частиц в составе препарата. Такие различия
в содержании активности в крови и моче на двух препара-
тах могут объясняться более коротким периодом полурас-
пада у рения-188 и более мелким размером частиц в кол-
лоиде 32Р (0,2 0,35 мкм у коллоида с 32Р по сравнению с
1–10 мкм коллоида олова, меченного 188Re). Эти биокине-
тические исследования указывают на то, что 188Re является
наиболее подходящим для РСО. В этом исследовании 96
детей в возрасте от 4 до 12 лет, страдающих гемофиличе-
скими артопатиями, были пролечены препаратами на ос-
нове 188Re, 32Р, 90Y с активностями, соответствующими их
возрасту. Было показано, что после проведения РСО коли-
чество кровотечений значительно уменьшилось. До про-
ведения РСО в исследуемой группе отмечалось высокое
число кровотечений (391 в течение 1 мес.). Спустя 1 мес.
после РСО было отмечено уменьшение числа кровотече-
ний до 53 случаев, до 50 – спустя 3 мес., 32 случая – через
6 мес. после РСО. В течение 6 мес. после РСО 48% пациен-
тов вообще не имели внутрисуставных кровотечений
(100% снижение), у 38% число кровотечений снизилось на
80%, в 14% случаев – на 50%. По показаниям детей и их
опекунов зафиксированы значительное улучшение каче-
ства жизни, подтвержденное улучшенной подвижностью,
и значительное уменьшение количества пропущенных
учебных дней. Исследованная подгруппа из 13 пациентов
с гемофилией, пролеченных коллоидом с 188Re, показала
схожие результаты [33].
Исследование по лечению коллоидом на основе 188Re
16 больных РА также проводилось под эгидой МАГАТЭ.
Уровень болей был документирован по 10-балльной шка-
ле. Облегчение боли было значительно выше у пациентов,
получавших коллоид 188Re, по сравнению с контрольной
группой, получавшей внутрисуставные введения глюко-
кортикоидов [34]. За исключением 1 случая с контуриро-
ванным и обратимым некрозом кожи в месте введения
РФП или обратимого набухания коленного сустава ника-
ких других серьезных побочных эффектов зарегистриро-
вано не было [26, 35]. Данные о биокинетике и проведен-
ные клинические исследования подтверждают, что кол-
лоиды с 188Re являются безопасными и эффективными в
лечении гемофилии и РА. Однако имеющихся данных еще
недостаточно.
Обычно препараты на основе 188Re используют для вве-
дения в крупные суставы, однако исследователи из Индии
опубликовали работу об успешном применении коллоида
188Re для РСО мелкого сустава при РА [36]. 45-летняя па-
циентка, страдающая РА, жаловалась на отек и боль в су-
ставе безымянного пальца правой руки на протяжении
6 мес. Консервативная терапия была неэффективна. Ей был введен препарат на основе коллоида олова, меченный
188Re, общей активностью 370 МБк. Палец пациентки был
зафиксирован на 48 ч. В течение следующих 3-х мес. отек
спал, а боли значительно уменьшились.
Лютеций-177
Одним из весьма перспективных изотопов для приме-
нения в радионуклидной терапии является лютеций-177
(Lu-177). Его физические характеристики позволяют ис-
пользовать его для внутрисуставных введений. Наличие
гамма-излучения дает возможность следить за распреде-
лением препарата с помощью гамма-камеры.
Были проведены исследования по оценке эффективно-
сти РСО с препаратом гидроксиапатит (ГАП), меченным
Lu-177, в лечении рецидивирующего синовита, сопровож-
дающегося выпотом в коленных суставах при РА [37]. Де-
сяти пациентам, страдающим стойкими синовитами ко-
ленных суставов, был введен ГАП, содержащий Lu-177, ак-
тивностью по 333±46 МБк. Мониторинг распределения
препарата проводили на гамма-камере при сканировании
всего тела и гамма-томографической визуализации колен-
ного сустава. Состояние пациентов оценивалось клиниче-
ски (перед РСО и через 6 мес.). Использовались следую-
щие параметры: индекс учета боли по 100-балльной визу-
альной аналоговой шкале (ВАШ), оценка улучшения по-
движности коленных суставов и учет интенсивности ноч-
ных болей. Ответ на РСЭ был классифицирован как плохой
при динамике ВАШ на менее чем 25 пунктов, как средний
– при динамике ВАШ на ≥ 25–50, как хороший – при ди-
намике ВАШ на ≥ 50–75, как отличный – при снижении
ВАШ на 75 и более пунктов. У всех 10 пациентов при ска-
нировании всего тела не было отмечено никакой «утечки»
введенной активности в нецелевые органы. Сканирование
сустава через 1 мес. после лечения показало полное сохра-
нение ГАП Lu-177 в суставах. У всех пациентов после 6 мес.
наблюдения констатированы уменьшение боле и проявле-
ний синовитов, увеличение подвижности суставов. Про-
цент улучшения ВАШ от исходных значений спустя 6 мес.
после РСО – 79,5±20,0%. Это в значительной степени было
связано с возрастом пациентов (р = 0,01) и длительностью
заболевания (р = 0,03). В коленных суставах с 0 и I стадией
заболевания по Штейнброкеру отмечен результат значи-
тельно лучше, чем в суставах с более выраженными изме-
нениями (стадии III и IV по Штейнброкеру), и получен бо-
лее стойкий ответ. Клиническая динамика по ВАШ соста-
вила 75% против 45,8%. Общий показатель ответа на тера-
пию (ВАШ ≥ 50) составил 80%. Ремиссия боли в течение
ночи была достигнута в 100% случаев, а у 80% пациентов
улучшилась подвижность коленных суставов. Препарат
ГАП Lu-177 был оценен при применении у пациентов с
хроническими синовитами коленных суставов ревматоид-
ного происхождения как безопасный и эффективный. РСО
с лютецием-177 продемонстрировал высокий терапевти-
ческий эффект в течение 6 мес. без каких-либо значимых
побочных эффектов. Предварительные исследования по-
казывают, что меченные Lu-177 частицы ГАП являются
перспективными и экономически оправданными средства-
ми для РСО.
Иттрий-90
Радиоколлоиды на основе иттрия-90 (Y-90) широко и
давно применяются для введения в крупные суставы. Бла-
годаря тому, что Y-90 является «чистым» бета-эмиттером,
он безопасен для окружающих, однако это затрудняет его
визуализацию после введения пациенту. Группа польских
исследователей опубликовала результаты своего опыта
применения РСО [38]. В данном исследовании авторы оце-
нивали эффективность применения Y-90 у нескольких
групп пациентов с различными заболеваниями суставов. В
исследование вошли 70 пациентов в возрасте от 29 до 65
лет, страдающие РА, спондилоартропатиями (СА) и остео-
артритом (ОА) с экссудативными синовитами коленных
суставов. С лечебной целью внутрисуставно вводили ра-
диофармацевтический коллоид с Y-90 активностью 185–
222 МБк в объеме 2–3 мл, затем суставы иммобилизиро-
вали на 72 ч. В динамике оценивали скорость оседания
эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ),
а также проводили УЗИ коленных суставов. Наиболее су-
щественная динамика состояния синовиальной оболочки
до и после процедуры была получена в группе больных РА.
Уменьшение объема суставного выпота до и после про-
цедуры была статистически значимой во всех группах и со-
поставимой между группами. Наибольшее снижение вос-
палительных параметров до и через 4 нед. после РСО на-
блюдалась у пациентов с РА.
Важно отметить, что не в каждом случае суставного вы-
пота следует применять РСО. Неудачи могут быть связаны
с неверным выбором показаний. Так, в одной работе был
проанализирован случай неудачного применения РСО [39].
Лечение проводилось у больного с выпотом коленного су-
става и гистологически доказанным неспецифическим арт-
ритом. Первоначально был получен частичный ответ на
РСО, но позже был отмечен рецидив с выпотом и артрал-
гиями. Последующая хирургическая синовэктомия и ги-
стопатологическая экспертиза показали, что заболевание
имело туберкулезное происхождение. Таким образом, в
странах, эндемичных по туберкулезу, следует иметь в виду
возможную инфекционную этиологию заболевания, преж-
де чем использовать РСО.
Заключение
РСО – это простой, быстрый и безболезненный для па-
циента метод лечения различных синовитов. Благопри-
ятный эффект отмечается в 50–80% случаев. Лечение
должно проводиться по возможности до развития значи-
тельных деструктивных изменений. РСО при РА не заме-
няет базисную терапию, а действует локально. Однако за
счет стойкого подавления хронического суставного воспа-
ления это лечение препятствует активации системного
воспалительного ответа. Действие базисной терапии и РСО
является синергичным и предполагает совместное участие
ревматологов и врачей ядерной медицины. Таким обра-
зом, метод РСО по своей эффективности сходен с хирур-
гической синовэктомией, однако не требует длительной
госпитализации и последующей реабилитации.
Анализируя возможные перспективы развития метода,
точнее сказать, возрождение его на новом уровне разви-
тия, следует отметить, что использование препаратов на
основе рения-188 представляется наиболее универсаль-
ным путем решения этой задачи. Опираясь на его физиче-
ские характеристики, учитывая уже имеющийся научный
опыт, изложенный в публикациях, можно рекомендовать
Re-188 в качества оптимального средства для РСО круп-
ных суставов. Однако, как отмечалось в одной из работ,
можно рассмотреть возможность его применения и в суставах самого разного размера [36]. Лечение препаратами
на основе Re-188 можно было бы использовать в соответ-
ствии с методическими рекомендациями Европейской ас-
социации ядерной медицины [40]. С учетом высокой стои-
мости и ограниченной распространенности препаратов
для РСО генераторное получение 188Re без носителя поз-
волит приготавливать препарат непосредственно в клини-
ке перед введением пациенту.
В МРНЦ им. А.Ф. Цыба (Обнинск) создан новый ориги-
нальный препарат для РСЭ на основе 188Re, помещенного в
микросферы альбумина с размерами частиц 5–10 мкм. В
доклинических исследованиях показано, что при внутри-
суставном введении достигается полное удержание в ко-
ленном суставе, печени и других органах и тканях – следо-
вое накопление. Поглощенная доза в синовии – 240 Гр
(при введении 3 МБк). Через 21 сут отмечается подавление
воспаления, вызванного экспериментальным синовитом
[41, 42]. Развитие этого метода в России позволит нашим
пациентам получать лечение, доступное сейчас только за
рубежом.
Литература
1. Delbarre F., Cayla J., Menkes C. J. et al. La synoviorth se par les radioisotopes. Book La
synoviorth se par les radioisotopes // EditorPresse Med.1968. P. 1045–1050.
2. Ishido C. Über die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie. Book
ber die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie // Editor. 1923.
P. 537–544.
3. Fellinger K., Schmid J. Die lokale Behandlung der rheumatischen Erkrankungen // Wien
Z Inn Med. 1952. T. 33, № 9. P. 351–363.
4. Ansell B.M., Crook A., Mallard J.R., Bywaters E.G.L. Evaluation of Intra-articular Colloidal
Gold Au 198 in the Treatment of Persistent Knee Effusions // Annals of the Rheumatic
Diseases. 1963. Vol 22 (6). P. 435–439.
5. Mödder G. Radiosynoviorthesis (Radiation Synovectomy) // Clinical Nuclear Medicine
Biersack H.-J., Freeman L. M. Berlin, Heidelberg: Springer Berlin Heidelberg. 2007.
P. 512–518.
6. Дроздовский Б.Я., Иконников А.И., Крылов В.В. Радиосиновиортез в лечении
больных ревматоидным артритом // Медицинская радиология. 1990. T. 7. C. 6–9
[Drozdovskij B.Ja., Ikonnikov A.I., Krylov V.V. Radiosinoviortez v lechenii bol’nyh revmatoidnym
artritom // Medicinskaja radiologija. 1990. T. 7. C. 6–9 (in Russian).]
7. Mödder G. Radiosynoviorthesis. Involvement of nuclear medicine in rheumatology
and orthopaedics // Meckenheim. 1995.
8. Mödder G. Nuklearmedizinische Therapy (RadioSynoviorthese) in Rheumatologie und
Orthopaedie. Der Nuklearmediziner. 1995. Vol. 18. P. 15–32.
9. Kampen W.U., Brenner W., Kroeger S. et al. Long-term results of radiation synovectomy:
a clinical follow-up study // Nucl Med Commun. 2001. Vol. 22(2). P. 239–246.
10. Kampen W.U., Brenner W., Czech N., Henze E. Intraarticular application of unsealed
beta-emitting radionuclides in the treatment course of inflammatory joint disorders. Book
Intraarticular application of unsealed beta-emitting radionuclides in the treatment
course of inflammatory joint disorders // Editor. 2002. P. 77–87.
11. Kampen W.U., Voth M., Pinkert J., Krause A.Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Book Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in
rheumatoid arthritis and related indications // Editor. 2007. P. 16–24.
12. Fischer M., Mödder G. Radionuclide therapy of inflammatory joint diseases // Nucl
Med Commun. 2002. Vol. 23 (9). P. 829–831.
13. Hoefnagel C.A., Clarke S.E.M., Fischer M. et al. Radionuclide therapy practice and facilities
in Europe // European Journal of Nuclear Medicine. 1999. Vol. 26 (3). P. 277–282.
14. Farahati J., Schneider P., Reiners C. Radionuklidtherapie bei entz ndlichen Gelenkerkrankungen:
Schlusswort // Dtsch Arztebl International. 2006. Vol. 103 (41). P. 2719.
15. Brenner W. Grundlagen und Technik der Radiosynoviorthese // Nuklearmediziner.
2006. Vol. 29 (01). P. 5–14.
16. Das B.K., Mödder G., Pradhan P.K., Shukla A.K. Concept of radiosynovectomy. A novel
approach in the treatment of joint disorders // Book Concept of radiosynovectomy.
A novel approach in the treatment of joint disorders // Editor. 2004. P. 1–5.
17. Mödder G., Mödder-Reese R. Radiosynoviorthesis (radiation synovectomy): State
of the Art 2011 // Book Radiosynoviorthesis (radiation synovectomy): State of the Art
2011 // Editor. 2011. P. 154–155.
18. Kampen W.U., Voth M., Pinkert J., Krause A. Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Rheumatology (Oxford). 2007. Vol. 46. P. 16–24.
19. Farahati J., Reiners C., Fischer M. et al. Leitlinie für die Radiosynoviorthese // Nuclear-
Medizin. 1999. Vol. 38 (6A). P. 254–255.
20. Clunie G., Fischer M., EANM EANM Procedure Guidelines for Radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30. P. 12–16.
21. Liepe K., Крылов В.В. Радиосиновиортез в лечении воспалительных заболеваний
суставов // Научно-практическая ревматология. 2013. № 6. C. 7 [Liepe K., Krylov V.V.
Radiosynoviorthez v lechenii vospalitelnih zabolevanii sustavov // Nauchno-prakticheskaya
revmatologiya 2013. № 6. S. 7 (in Russian)].
22. Kresnik E., Mikosch P., Gallowitsch H.J. et al. Clinical outcome of radiosynoviorthesis:
A meta-analysis including 2190 treated joints // Nucl Med Commun. 2002. Vol. 23.
P. 683–688.
23. Deutsch E., Brodack J.W., Deutsch K.F. Radiation synovectomy revisited // Eur J Nucl
Med. 1993. Vol. 20 (11). P. 1113–1127.
24. Soroa V.E., del Huerto Velazquez Espeche M., Giannone C. et al. Effects of radiosynovectomy
with p-32 colloid therapy in hemophilia and rheumatoid arthritis // Cancer Biother
Radiopharm. 2005. T. 20, № 3. C. 344–3448.
25. Li P., Chen G., Zhang H., Shen Z. Radiation synovectomy by 188Re-Sulfide in haemophilic
synovitis // Haemophilia. 2004. Vol. 10 (5). P. 422–427.
26. Liepe K., Zaknun J. J., Padhy A. et al. Radiosynovectomy using yttrium-90, phosphorus-
32 or rhenium-188 radiocolloids versus corticoid instillation for rheumatoid arthritis
of the knee // Ann Nucl Med. 2011. Vol. 25 (5). P. 317–323.
27. Wang S. J., Lin W. Y., Hsieh B. T. et al. Jr. Rhenium-188 sulphur colloid as a radiation
synovectomy agent // Eur J Nucl Med. 1995. Vol. 22 (6). P. 505–507.
28. Wang S.J., Lin W.Y., Chen M.N. et al. Intratumoral injection of rhenium-188 microspheres
into an animal model of hepatoma // J Nucl Med. 1998. Vol. 39 (10). P. 1752–1757.
29. Wang S.J., Lin W.Y., Chen M.N. et al. Histologic study of effects of radiation synovectomy
with Rhenium-188 microsphere // Nucl Med Biol. 2001. Vol. 28 (6). P. 727–732.
30. Lee E. B., Shin K. C., Lee Y. J. et al. 188Re-tin-colloid as a new therapeutic agent for
rheumatoid arthritis // Nucl Med Commun. 2003.Vol. 24 (6). P. 689–696.
31. Li P., Yu J., Chen G. et al. Applied radioactivity in radiation synovectomy with
(188Re)rhenium sulfide suspension // Nucl Med Commun. 2006.Vol. 27 (8). P. 603–609.
32. Ures M., Savio E., Malanga A. et al. Physico-chemical characterisation and biological
evaluation of 188-Rhenium colloids for radiosynovectomy // BMC Nucl Med. 2002.
Vol. 2 (1). P. 1.
33. Zaknun J.J., Liepe K., Gaudiano J. et al. Blood and urine biokinetics of rhenium-188-
in and phosphorus-32 colloids in radiosynovectomy // Eur J Nucl Med Mol Imaging. Vol.
34. Springer 233 spring street, New York, NY 10013 USA, 2007. P. S359–S359.
34. Liepe K., Faulhaber D., Wunderlich G. et al. Radiation Pneumopathy in the Rat After
Intravenous Application of 188 Re-Labeled Microspheres // International Journal of Radiation
Oncology Biology Physics. 2011. Vol. 81 (2). P. 529–536.
35. Zaknun J.J., Liepe K., Soroa V. et al. Management of haemarthrosis applying radiosynovectomy
in haemophilia patients with emphasis on developing countries // Eur J Nucl
Med Mol Imaging. 2007. Vol. 34 P. S352.
36. Kamaleshwaran K.K., Rajamani V., Krishnan B. et al. Radiosynovectomy of Proximal
Interphalangeal Joint Synovitis in Rheumatoid Arthritis Treated with Rhenium-188 Labeled
Tin-colloid and Imaging with Single-photon Emission Computerized Tomography
/ Computed Tomography: A First Case Report // World Journal of Nuclear Medicine (Online).
2015. Vol. 14 (3). P. 216–218.
37. Shinto A.S., Kamaleshwaran K.K., Chakraborty S. et al. Radiosynovectomy of Painful
Synovitis of Knee Joints Due to Rheumatoid Arthritis by Intra-Articular Administration
of 177Lu-Labeled Hydroxyapatite Particulates: First Human Study and Initial Indian Experience
// World Journal of Nuclear Medicine (Online). 2015. Vol. 14 (2). P. 81–88.
38. Zalewska J., Wegierska M., Barczynska T. et al. Efficacy of radiation synovectomy (radiosynovectomy
or radiosynoviorthesis) with yttrium-90 in exudative inflammation of
synovial membrane of knee joints in patients with rheumatic diseases – preliminary report
// Reumatologia. 2016. Vol. 54 (1). P. 3–9.
39. Sood A., Sharma A., Chouhan D.K. et al. Failed Radiation Synovectomy in Diseased
Knee Joint with Missed Tuberculous Synovitis // World J Nucl Med. 2016. Vol. 15 (3).
P. 206–208.
40. Clunie G., Fischer M., Eanm. EANM procedure guidelines for radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30 (3). P. 12–16.
41. Петриев В.М. Закономерности образования комплексного соединения 188Re с
микросферами альбумина крови человека // Радиохимия. 2009. T. 51, № 5.
C. 446–451 [Petriev V. M. Zakonomernosti obrazovanija kompleksnogo soedinenija 188Re
s mikrosferami al’bumina krovi cheloveka // Radiohimija. 2009. T. 51, № 5. C. 446–451
(in Russian)].
42. Скворцов В.Г., Степаненко В.Ф., Петриев В.М. и др. Фармакокинетические и до-
зиметрические характеристики нового радиофармпрепарата Re-188-микросферы
альбумина // Радиационная биология. Радиоэкология. 2010. T. 50, № 6. C. 703–711
[Skvorcov V. G., Stepanenko V. F., Petriev V. M. i dr. Farmakokineticheskie i dozimetricheskie
harakteristiki novogo radiofarmpreparata Re-188-mikrosfery al’bumina // Radiacionnaja
biologija Radiojekologija. 2010. T. 50, № 6. C. 703–711 (in Russian)].
Первый коллоид на основе 188Re для РСО был описан в
1995 г. Исследования, проведенные на коллоиде серы с
188Re, показали стабильность 95% in vitro в течение 3 дней
[27]. Фармакокинетические исследования микросфер с ре-
нием-188 (с размером частиц 15 мкм) показали следую-
щие результаты удерживания в коленном суставе кролика:
98,7, 94,6 и 93,6% после 1, 24 и 48 ч соответственно [28].
Данные фармакокинетики показали очень низкое распро-
странение радиоактивности по всем органам в течение ис-
следования, что указывает на минимальную утечку РФП из
коленного сустава животного. Авторы пришли к выводу,
что микросферы с 188Re являются потенциальным канди-
датом для радиосиновэктомии. Микросферы, меченные
рением-188, были стабильны in vitro на протяжении 3 дней
на уровне 98%. Две недели спустя после инъекции в колен-
ный сустав кроликов в синовиальной оболочке произошли
увеличение фибробластов и фиброзные изменения в си-
новиальной сумке. Также обнаружилось дополнительное
закупоривание сосудов и капилляров в ответ на радиа-
ционное облучение синовиальной оболочки [29].
Е.В. Lee et al. изучали оловянный коллоид, меченный
рением-188 [30]. В сравнении с коллоидом на основе серы
[29, 31] он продемонстрировал лучшие показатели объ-
емного и поверхностного распределения [32]. Первый
опыт применения у пациентов был получен Р. Li et al. [25]
при лечении 29 больных гемофилией. Длительность после-
дующего наблюдения составила 18 мес. В зависимости от
толщины синовиальной оболочки, установленной при
МРТ, были использованы 3 уровня активностей: 555 МБк
(15 мКи), 687 МБк (19 мКи) и 917 МБк (25 мКи). Размеры
частиц коллоида сульфида рения (188Re) составили от 2 до
20 мкм.
Отличные результаты в ближайшем периоде были по-
лучены у 75%, а сокращение частоты кровотечений – у
100% пациентов. На 18-м мес. исследования эффект со-
хранялся у 71%. Зависимости между вводимой актив-
ностью и терапевтической эффективностью установлено
не было. В оценке МРТ были установлены значительное
уменьшение толщины синовиальной оболочки и пролифе-
рация синовиальных ворсинок после лечения. Никаких
подтверждений повреждения суставного хряща найдено
не было. Данные о биораспределении с использованием
сцинтиграфии указывают на отсутствие значимых актив-
ностей в мочевом пузыре, костном мозге, печени, селезен-
ке и региональных лимфатических узлах, также уровень
активности в крови был незначительным. Эти данные об-
основаны высокой in vitro стабильностью коллоидов с ре-
нием-188 и низким уровнем высвобождения изотопа из
препарата.
Под эгидой Международного агентства по атомной
энергии (МАГАТЭ) в 2001 г. было проведено сравнитель-
ное исследование радиофармацевтических препаратов,
предназначенных для радиосиновэктомии [33]. Цель дан-
ного исследования заключалась в оценке терапевтической
эффективности, выраженной в контроле болевого синдро-
ма коленного сустава у пациентов с РА или гемофильным
артритом, при использовании коммерчески доступного
радиоколлоида с 90Y, по сравнению с эффективностью пре-
паратов на основе 188Re и 32P. Стратегия заключалась в том,
чтобы оценить перспективность использования 188Re и 32Р
с целью улучшения доступности РСО во всем мире, осо-
бенно в Азии и Южной Америке. Изучая биокинетику,
фиксировали процент от введенной активности коллоида
с 188Re в крови на 4-й, 12-й, 24-й и 72-й ч. Были получены
следующие значения: 0,06±0,05; 0,12±0,09; 0,21±0,19;
0,14±0,08% соответственно. Содержание выведенной ак-
тивности с 188Re с мочой составило 1,65±3,00% через 72 ч
после терапии. Процент содержания в крови от введенной
активности для коллоида с 32Р был значительно выше:
5,8±3,1; 5,7±2,8; 4,4±3,3; 3,8±3,4 после 1, 2, 3 и 24 ч соот-
ветственно [33]. Степень высвобождения препарата зави-
сит от размера частиц в составе препарата. Такие различия
в содержании активности в крови и моче на двух препара-
тах могут объясняться более коротким периодом полурас-
пада у рения-188 и более мелким размером частиц в кол-
лоиде 32Р (0,2 0,35 мкм у коллоида с 32Р по сравнению с
1–10 мкм коллоида олова, меченного 188Re). Эти биокине-
тические исследования указывают на то, что 188Re является
наиболее подходящим для РСО. В этом исследовании 96
детей в возрасте от 4 до 12 лет, страдающих гемофиличе-
скими артопатиями, были пролечены препаратами на ос-
нове 188Re, 32Р, 90Y с активностями, соответствующими их
возрасту. Было показано, что после проведения РСО коли-
чество кровотечений значительно уменьшилось. До про-
ведения РСО в исследуемой группе отмечалось высокое
число кровотечений (391 в течение 1 мес.). Спустя 1 мес.
после РСО было отмечено уменьшение числа кровотече-
ний до 53 случаев, до 50 – спустя 3 мес., 32 случая – через
6 мес. после РСО. В течение 6 мес. после РСО 48% пациен-
тов вообще не имели внутрисуставных кровотечений
(100% снижение), у 38% число кровотечений снизилось на
80%, в 14% случаев – на 50%. По показаниям детей и их
опекунов зафиксированы значительное улучшение каче-
ства жизни, подтвержденное улучшенной подвижностью,
и значительное уменьшение количества пропущенных
учебных дней. Исследованная подгруппа из 13 пациентов
с гемофилией, пролеченных коллоидом с 188Re, показала
схожие результаты [33].
Исследование по лечению коллоидом на основе 188Re
16 больных РА также проводилось под эгидой МАГАТЭ.
Уровень болей был документирован по 10-балльной шка-
ле. Облегчение боли было значительно выше у пациентов,
получавших коллоид 188Re, по сравнению с контрольной
группой, получавшей внутрисуставные введения глюко-
кортикоидов [34]. За исключением 1 случая с контуриро-
ванным и обратимым некрозом кожи в месте введения
РФП или обратимого набухания коленного сустава ника-
ких других серьезных побочных эффектов зарегистриро-
вано не было [26, 35]. Данные о биокинетике и проведен-
ные клинические исследования подтверждают, что кол-
лоиды с 188Re являются безопасными и эффективными в
лечении гемофилии и РА. Однако имеющихся данных еще
недостаточно.
Обычно препараты на основе 188Re используют для вве-
дения в крупные суставы, однако исследователи из Индии
опубликовали работу об успешном применении коллоида
188Re для РСО мелкого сустава при РА [36]. 45-летняя па-
циентка, страдающая РА, жаловалась на отек и боль в су-
ставе безымянного пальца правой руки на протяжении
6 мес. Консервативная терапия была неэффективна. Ей был введен препарат на основе коллоида олова, меченный
188Re, общей активностью 370 МБк. Палец пациентки был
зафиксирован на 48 ч. В течение следующих 3-х мес. отек
спал, а боли значительно уменьшились.
Лютеций-177
Одним из весьма перспективных изотопов для приме-
нения в радионуклидной терапии является лютеций-177
(Lu-177). Его физические характеристики позволяют ис-
пользовать его для внутрисуставных введений. Наличие
гамма-излучения дает возможность следить за распреде-
лением препарата с помощью гамма-камеры.
Были проведены исследования по оценке эффективно-
сти РСО с препаратом гидроксиапатит (ГАП), меченным
Lu-177, в лечении рецидивирующего синовита, сопровож-
дающегося выпотом в коленных суставах при РА [37]. Де-
сяти пациентам, страдающим стойкими синовитами ко-
ленных суставов, был введен ГАП, содержащий Lu-177, ак-
тивностью по 333±46 МБк. Мониторинг распределения
препарата проводили на гамма-камере при сканировании
всего тела и гамма-томографической визуализации колен-
ного сустава. Состояние пациентов оценивалось клиниче-
ски (перед РСО и через 6 мес.). Использовались следую-
щие параметры: индекс учета боли по 100-балльной визу-
альной аналоговой шкале (ВАШ), оценка улучшения по-
движности коленных суставов и учет интенсивности ноч-
ных болей. Ответ на РСЭ был классифицирован как плохой
при динамике ВАШ на менее чем 25 пунктов, как средний
– при динамике ВАШ на ≥ 25–50, как хороший – при ди-
намике ВАШ на ≥ 50–75, как отличный – при снижении
ВАШ на 75 и более пунктов. У всех 10 пациентов при ска-
нировании всего тела не было отмечено никакой «утечки»
введенной активности в нецелевые органы. Сканирование
сустава через 1 мес. после лечения показало полное сохра-
нение ГАП Lu-177 в суставах. У всех пациентов после 6 мес.
наблюдения констатированы уменьшение боле и проявле-
ний синовитов, увеличение подвижности суставов. Про-
цент улучшения ВАШ от исходных значений спустя 6 мес.
после РСО – 79,5±20,0%. Это в значительной степени было
связано с возрастом пациентов (р = 0,01) и длительностью
заболевания (р = 0,03). В коленных суставах с 0 и I стадией
заболевания по Штейнброкеру отмечен результат значи-
тельно лучше, чем в суставах с более выраженными изме-
нениями (стадии III и IV по Штейнброкеру), и получен бо-
лее стойкий ответ. Клиническая динамика по ВАШ соста-
вила 75% против 45,8%. Общий показатель ответа на тера-
пию (ВАШ ≥ 50) составил 80%. Ремиссия боли в течение
ночи была достигнута в 100% случаев, а у 80% пациентов
улучшилась подвижность коленных суставов. Препарат
ГАП Lu-177 был оценен при применении у пациентов с
хроническими синовитами коленных суставов ревматоид-
ного происхождения как безопасный и эффективный. РСО
с лютецием-177 продемонстрировал высокий терапевти-
ческий эффект в течение 6 мес. без каких-либо значимых
побочных эффектов. Предварительные исследования по-
казывают, что меченные Lu-177 частицы ГАП являются
перспективными и экономически оправданными средства-
ми для РСО.
Иттрий-90
Радиоколлоиды на основе иттрия-90 (Y-90) широко и
давно применяются для введения в крупные суставы. Бла-
годаря тому, что Y-90 является «чистым» бета-эмиттером,
он безопасен для окружающих, однако это затрудняет его
визуализацию после введения пациенту. Группа польских
исследователей опубликовала результаты своего опыта
применения РСО [38]. В данном исследовании авторы оце-
нивали эффективность применения Y-90 у нескольких
групп пациентов с различными заболеваниями суставов. В
исследование вошли 70 пациентов в возрасте от 29 до 65
лет, страдающие РА, спондилоартропатиями (СА) и остео-
артритом (ОА) с экссудативными синовитами коленных
суставов. С лечебной целью внутрисуставно вводили ра-
диофармацевтический коллоид с Y-90 активностью 185–
222 МБк в объеме 2–3 мл, затем суставы иммобилизиро-
вали на 72 ч. В динамике оценивали скорость оседания
эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ),
а также проводили УЗИ коленных суставов. Наиболее су-
щественная динамика состояния синовиальной оболочки
до и после процедуры была получена в группе больных РА.
Уменьшение объема суставного выпота до и после про-
цедуры была статистически значимой во всех группах и со-
поставимой между группами. Наибольшее снижение вос-
палительных параметров до и через 4 нед. после РСО на-
блюдалась у пациентов с РА.
Важно отметить, что не в каждом случае суставного вы-
пота следует применять РСО. Неудачи могут быть связаны
с неверным выбором показаний. Так, в одной работе был
проанализирован случай неудачного применения РСО [39].
Лечение проводилось у больного с выпотом коленного су-
става и гистологически доказанным неспецифическим арт-
ритом. Первоначально был получен частичный ответ на
РСО, но позже был отмечен рецидив с выпотом и артрал-
гиями. Последующая хирургическая синовэктомия и ги-
стопатологическая экспертиза показали, что заболевание
имело туберкулезное происхождение. Таким образом, в
странах, эндемичных по туберкулезу, следует иметь в виду
возможную инфекционную этиологию заболевания, преж-
де чем использовать РСО.
Заключение
РСО – это простой, быстрый и безболезненный для па-
циента метод лечения различных синовитов. Благопри-
ятный эффект отмечается в 50–80% случаев. Лечение
должно проводиться по возможности до развития значи-
тельных деструктивных изменений. РСО при РА не заме-
няет базисную терапию, а действует локально. Однако за
счет стойкого подавления хронического суставного воспа-
ления это лечение препятствует активации системного
воспалительного ответа. Действие базисной терапии и РСО
является синергичным и предполагает совместное участие
ревматологов и врачей ядерной медицины. Таким обра-
зом, метод РСО по своей эффективности сходен с хирур-
гической синовэктомией, однако не требует длительной
госпитализации и последующей реабилитации.
Анализируя возможные перспективы развития метода,
точнее сказать, возрождение его на новом уровне разви-
тия, следует отметить, что использование препаратов на
основе рения-188 представляется наиболее универсаль-
ным путем решения этой задачи. Опираясь на его физиче-
ские характеристики, учитывая уже имеющийся научный
опыт, изложенный в публикациях, можно рекомендовать
Re-188 в качества оптимального средства для РСО круп-
ных суставов. Однако, как отмечалось в одной из работ,
можно рассмотреть возможность его применения и в суставах самого разного размера [36]. Лечение препаратами
на основе Re-188 можно было бы использовать в соответ-
ствии с методическими рекомендациями Европейской ас-
социации ядерной медицины [40]. С учетом высокой стои-
мости и ограниченной распространенности препаратов
для РСО генераторное получение 188Re без носителя поз-
волит приготавливать препарат непосредственно в клини-
ке перед введением пациенту.
В МРНЦ им. А.Ф. Цыба (Обнинск) создан новый ориги-
нальный препарат для РСЭ на основе 188Re, помещенного в
микросферы альбумина с размерами частиц 5–10 мкм. В
доклинических исследованиях показано, что при внутри-
суставном введении достигается полное удержание в ко-
ленном суставе, печени и других органах и тканях – следо-
вое накопление. Поглощенная доза в синовии – 240 Гр
(при введении 3 МБк). Через 21 сут отмечается подавление
воспаления, вызванного экспериментальным синовитом
[41, 42]. Развитие этого метода в России позволит нашим
пациентам получать лечение, доступное сейчас только за
рубежом.
Литература
1. Delbarre F., Cayla J., Menkes C. J. et al. La synoviorth se par les radioisotopes. Book La
synoviorth se par les radioisotopes // EditorPresse Med.1968. P. 1045–1050.
2. Ishido C. Über die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie. Book
ber die Wirkung des Radiothoriums auf die Gelenke.Strahlentherapie // Editor. 1923.
P. 537–544.
3. Fellinger K., Schmid J. Die lokale Behandlung der rheumatischen Erkrankungen // Wien
Z Inn Med. 1952. T. 33, № 9. P. 351–363.
4. Ansell B.M., Crook A., Mallard J.R., Bywaters E.G.L. Evaluation of Intra-articular Colloidal
Gold Au 198 in the Treatment of Persistent Knee Effusions // Annals of the Rheumatic
Diseases. 1963. Vol 22 (6). P. 435–439.
5. Mödder G. Radiosynoviorthesis (Radiation Synovectomy) // Clinical Nuclear Medicine
Biersack H.-J., Freeman L. M. Berlin, Heidelberg: Springer Berlin Heidelberg. 2007.
P. 512–518.
6. Дроздовский Б.Я., Иконников А.И., Крылов В.В. Радиосиновиортез в лечении
больных ревматоидным артритом // Медицинская радиология. 1990. T. 7. C. 6–9
[Drozdovskij B.Ja., Ikonnikov A.I., Krylov V.V. Radiosinoviortez v lechenii bol’nyh revmatoidnym
artritom // Medicinskaja radiologija. 1990. T. 7. C. 6–9 (in Russian).]
7. Mödder G. Radiosynoviorthesis. Involvement of nuclear medicine in rheumatology
and orthopaedics // Meckenheim. 1995.
8. Mödder G. Nuklearmedizinische Therapy (RadioSynoviorthese) in Rheumatologie und
Orthopaedie. Der Nuklearmediziner. 1995. Vol. 18. P. 15–32.
9. Kampen W.U., Brenner W., Kroeger S. et al. Long-term results of radiation synovectomy:
a clinical follow-up study // Nucl Med Commun. 2001. Vol. 22(2). P. 239–246.
10. Kampen W.U., Brenner W., Czech N., Henze E. Intraarticular application of unsealed
beta-emitting radionuclides in the treatment course of inflammatory joint disorders. Book
Intraarticular application of unsealed beta-emitting radionuclides in the treatment
course of inflammatory joint disorders // Editor. 2002. P. 77–87.
11. Kampen W.U., Voth M., Pinkert J., Krause A.Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Book Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in
rheumatoid arthritis and related indications // Editor. 2007. P. 16–24.
12. Fischer M., Mödder G. Radionuclide therapy of inflammatory joint diseases // Nucl
Med Commun. 2002. Vol. 23 (9). P. 829–831.
13. Hoefnagel C.A., Clarke S.E.M., Fischer M. et al. Radionuclide therapy practice and facilities
in Europe // European Journal of Nuclear Medicine. 1999. Vol. 26 (3). P. 277–282.
14. Farahati J., Schneider P., Reiners C. Radionuklidtherapie bei entz ndlichen Gelenkerkrankungen:
Schlusswort // Dtsch Arztebl International. 2006. Vol. 103 (41). P. 2719.
15. Brenner W. Grundlagen und Technik der Radiosynoviorthese // Nuklearmediziner.
2006. Vol. 29 (01). P. 5–14.
16. Das B.K., Mödder G., Pradhan P.K., Shukla A.K. Concept of radiosynovectomy. A novel
approach in the treatment of joint disorders // Book Concept of radiosynovectomy.
A novel approach in the treatment of joint disorders // Editor. 2004. P. 1–5.
17. Mödder G., Mödder-Reese R. Radiosynoviorthesis (radiation synovectomy): State
of the Art 2011 // Book Radiosynoviorthesis (radiation synovectomy): State of the Art
2011 // Editor. 2011. P. 154–155.
18. Kampen W.U., Voth M., Pinkert J., Krause A. Therapeutic status of radiosynoviorthesis
of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications //
Rheumatology (Oxford). 2007. Vol. 46. P. 16–24.
19. Farahati J., Reiners C., Fischer M. et al. Leitlinie für die Radiosynoviorthese // Nuclear-
Medizin. 1999. Vol. 38 (6A). P. 254–255.
20. Clunie G., Fischer M., EANM EANM Procedure Guidelines for Radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30. P. 12–16.
21. Liepe K., Крылов В.В. Радиосиновиортез в лечении воспалительных заболеваний
суставов // Научно-практическая ревматология. 2013. № 6. C. 7 [Liepe K., Krylov V.V.
Radiosynoviorthez v lechenii vospalitelnih zabolevanii sustavov // Nauchno-prakticheskaya
revmatologiya 2013. № 6. S. 7 (in Russian)].
22. Kresnik E., Mikosch P., Gallowitsch H.J. et al. Clinical outcome of radiosynoviorthesis:
A meta-analysis including 2190 treated joints // Nucl Med Commun. 2002. Vol. 23.
P. 683–688.
23. Deutsch E., Brodack J.W., Deutsch K.F. Radiation synovectomy revisited // Eur J Nucl
Med. 1993. Vol. 20 (11). P. 1113–1127.
24. Soroa V.E., del Huerto Velazquez Espeche M., Giannone C. et al. Effects of radiosynovectomy
with p-32 colloid therapy in hemophilia and rheumatoid arthritis // Cancer Biother
Radiopharm. 2005. T. 20, № 3. C. 344–3448.
25. Li P., Chen G., Zhang H., Shen Z. Radiation synovectomy by 188Re-Sulfide in haemophilic
synovitis // Haemophilia. 2004. Vol. 10 (5). P. 422–427.
26. Liepe K., Zaknun J. J., Padhy A. et al. Radiosynovectomy using yttrium-90, phosphorus-
32 or rhenium-188 radiocolloids versus corticoid instillation for rheumatoid arthritis
of the knee // Ann Nucl Med. 2011. Vol. 25 (5). P. 317–323.
27. Wang S. J., Lin W. Y., Hsieh B. T. et al. Jr. Rhenium-188 sulphur colloid as a radiation
synovectomy agent // Eur J Nucl Med. 1995. Vol. 22 (6). P. 505–507.
28. Wang S.J., Lin W.Y., Chen M.N. et al. Intratumoral injection of rhenium-188 microspheres
into an animal model of hepatoma // J Nucl Med. 1998. Vol. 39 (10). P. 1752–1757.
29. Wang S.J., Lin W.Y., Chen M.N. et al. Histologic study of effects of radiation synovectomy
with Rhenium-188 microsphere // Nucl Med Biol. 2001. Vol. 28 (6). P. 727–732.
30. Lee E. B., Shin K. C., Lee Y. J. et al. 188Re-tin-colloid as a new therapeutic agent for
rheumatoid arthritis // Nucl Med Commun. 2003.Vol. 24 (6). P. 689–696.
31. Li P., Yu J., Chen G. et al. Applied radioactivity in radiation synovectomy with
(188Re)rhenium sulfide suspension // Nucl Med Commun. 2006.Vol. 27 (8). P. 603–609.
32. Ures M., Savio E., Malanga A. et al. Physico-chemical characterisation and biological
evaluation of 188-Rhenium colloids for radiosynovectomy // BMC Nucl Med. 2002.
Vol. 2 (1). P. 1.
33. Zaknun J.J., Liepe K., Gaudiano J. et al. Blood and urine biokinetics of rhenium-188-
in and phosphorus-32 colloids in radiosynovectomy // Eur J Nucl Med Mol Imaging. Vol.
34. Springer 233 spring street, New York, NY 10013 USA, 2007. P. S359–S359.
34. Liepe K., Faulhaber D., Wunderlich G. et al. Radiation Pneumopathy in the Rat After
Intravenous Application of 188 Re-Labeled Microspheres // International Journal of Radiation
Oncology Biology Physics. 2011. Vol. 81 (2). P. 529–536.
35. Zaknun J.J., Liepe K., Soroa V. et al. Management of haemarthrosis applying radiosynovectomy
in haemophilia patients with emphasis on developing countries // Eur J Nucl
Med Mol Imaging. 2007. Vol. 34 P. S352.
36. Kamaleshwaran K.K., Rajamani V., Krishnan B. et al. Radiosynovectomy of Proximal
Interphalangeal Joint Synovitis in Rheumatoid Arthritis Treated with Rhenium-188 Labeled
Tin-colloid and Imaging with Single-photon Emission Computerized Tomography
/ Computed Tomography: A First Case Report // World Journal of Nuclear Medicine (Online).
2015. Vol. 14 (3). P. 216–218.
37. Shinto A.S., Kamaleshwaran K.K., Chakraborty S. et al. Radiosynovectomy of Painful
Synovitis of Knee Joints Due to Rheumatoid Arthritis by Intra-Articular Administration
of 177Lu-Labeled Hydroxyapatite Particulates: First Human Study and Initial Indian Experience
// World Journal of Nuclear Medicine (Online). 2015. Vol. 14 (2). P. 81–88.
38. Zalewska J., Wegierska M., Barczynska T. et al. Efficacy of radiation synovectomy (radiosynovectomy
or radiosynoviorthesis) with yttrium-90 in exudative inflammation of
synovial membrane of knee joints in patients with rheumatic diseases – preliminary report
// Reumatologia. 2016. Vol. 54 (1). P. 3–9.
39. Sood A., Sharma A., Chouhan D.K. et al. Failed Radiation Synovectomy in Diseased
Knee Joint with Missed Tuberculous Synovitis // World J Nucl Med. 2016. Vol. 15 (3).
P. 206–208.
40. Clunie G., Fischer M., Eanm. EANM procedure guidelines for radiosynovectomy //
Eur J Nucl Med Mol Imaging. 2003. Vol. 30 (3). P. 12–16.
41. Петриев В.М. Закономерности образования комплексного соединения 188Re с
микросферами альбумина крови человека // Радиохимия. 2009. T. 51, № 5.
C. 446–451 [Petriev V. M. Zakonomernosti obrazovanija kompleksnogo soedinenija 188Re
s mikrosferami al’bumina krovi cheloveka // Radiohimija. 2009. T. 51, № 5. C. 446–451
(in Russian)].
42. Скворцов В.Г., Степаненко В.Ф., Петриев В.М. и др. Фармакокинетические и до-
зиметрические характеристики нового радиофармпрепарата Re-188-микросферы
альбумина // Радиационная биология. Радиоэкология. 2010. T. 50, № 6. C. 703–711
[Skvorcov V. G., Stepanenko V. F., Petriev V. M. i dr. Farmakokineticheskie i dozimetricheskie
harakteristiki novogo radiofarmpreparata Re-188-mikrosfery al’bumina // Radiacionnaja
biologija Radiojekologija. 2010. T. 50, № 6. C. 703–711 (in Russian)]. 

