Патогенные коронавирусные инфекции человека: причины и последствия цитокинового шторма и иммунопатология. ОБЗОР

Аннотация
Коронавирусы человека Human coronaviruses (hCoVs) можно разделить на низкопатогенные и высокопатогенные коронавирусы. Наиболее патогенные CoVs заражают верхние дыхательные пути и вызывают легкие, простудоподобные cold-like респираторные заболевания. Напротив, высокопатогенные hCoVs, вызывают такие, как тяжелый острый респираторный синдром CoV severe acute respiratory syndrome CoV (SARS-CoV) и ближневосточный респираторный синдром CoV Middle East respiratory syndrome CoV (MERS-CoV), преимущественно поражают нижние дыхательные пути и вызывают смертельную пневмонию. Тяжелая пневмония, вызванная патогенными hCoVs, часто ассоциируется с быстрой репликацией вируса, массивной воспалительной клеточной инфильтрацией и повышенными провоспалительными цитокиновыми / хемокиновыми реакциями, приводящими к острому повреждению легких acute lung injury (ALI) (ALI) и острому респираторному дистресс-синдрому (acute respiratory distress syndrome (ARDS). Недавние исследования на экспериментально зараженных животных убедительно свидетельствуют о решающей роли вирусно-индуцированных иммунопатологических событий в возникновении фатальной пневмонии после hcov-инфекций. Здесь же следует отметить, что нарушение регуляции иммунного ответа может вызвать иммунопатологию легких, приводящую к неблагоприятным клиническим проявлениям после патогенных hcov-инфекций.
Вступление
Коронавирусы относятся к семейству вирусов Coronaviridae и представляют собой РНК-вирусы. Геном коронавируса составляет приблизительно 31 Кб, что делает эти вирусы самыми крупными известными РНК-вирусами [1, 2]. Коронавирусы заражают различные виды хозяев, включая человека и несколько других позвоночных животных. Эти вирусы преимущественно вызывают инфекции дыхательных путей и кишечника и индуцируют широкий спектр клинических проявлений [3, 4]. Коронавирусы, поражающие дыхательные пути, уже давно признаны значимыми патогенами у домашних и домашних животных, которые живут в доме, а также причиной легких и тяжелых респираторных заболеваний у человека [4, 5]. В целом коронавирусы, инфицирующие человека, можно классифицировать на низкопатогенные hcov, к которым относятся HCoV-229E, HCoVOC43, HCoV-NL63 и HCoV-HKU, а также на высокопатогенные CoV severe acute respiratory syndromecov(SARSCoV) и ближневосточный респираторный синдром CoV (MERSCoV) [6, 7]. Низкопатогенный hCoV поражает верхние дыхательные пути и вызывает сезонные легкие или средней тяжести простудоподобные заболевания дыхательных путей у здоровых людей. Напротив, высокопатогенные hcov (далее-патогенные hCoV или в дальнейшем hCoV) поражают нижние дыхательные пути и вызывают тяжелую пневмонию, которая иногда приводит к фатальному острому повреждению легких (ALI) и острому респираторному дистресс-синдрому ((ARDS), приводящему к высокой заболеваемости и смертности [8-12]. Высокопатогенные hCoV представляют существенную угрозу для здоровья населения. Во время эпидемии SARS-CoV в 2002-2003 годах было инфицировано около 8400 человек с общим уровнем смертности 9,6% [13, 14]. Совсем недавно MERS-CoV поразил 1936 индивидов, что привело к 690 смертям (∼36% смертности) по состоянию на 5 апреля 2017 года [15, 16]. Недавняя идентификация коронавирусов, подобных SARS-likе, у летучих мышей и одомашненных верблюдов с MERS-CoV делает вероятным, что эти вирусы будут продолжать пересекать видовые барьеры и вызывать дополнительные вспышки в человеческих популяциях [17-20]. Эти высокопатогенные hCoVs вызывают широкий спектр клинических проявлений у человека, причем у значительной части пациентов развивается короткий период умеренного клинического заболевания и незначительное количество пациентов с хроническими заболеваниями, характеризующимися ALI и ARDS [21-23, 10]. Таким образом, существует в основном две группы больных: те, у кого развивается более легкое заболевание, которое разрешилось, и те, у кого тяжелое заболевание, которое было обычно смертельным. Тяжесть заболевания в патогенезе hcov инфекции определяется многими факторами — это начальные вирусные титры в дыхательных путях и возрастные и коморбидные состояния инфицированного индивидуума. В то время как более молодые люди в возрасте до 18 лет испытывают клинические заболевания легкой и средней степени тяжести, пожилые люди демонстрируют худшие исходы после заражения SARS-CoV or MERS-CoV [22, 10, 24]. Кроме того, лица с коморбидными состояниями, такими как диабет, ожирение, сердечная недостаточность, почечная недостаточность и другие сопутствующие заболевания, особенно после MERS-CoV инфекции [25, 26]. Несмотря на несколько лет исследований, конкретные факторы, вызывающие необычайно высокую заболеваемость и смертность после патогенных hCoV, до конца не изучены. Считается, что вирусно-индуцированные прямые цитопатические эффекты и уклонение вируса от иммунных реакций хозяина играют важную роль в тяжести заболевания. Однако исследования людей, умерших от SARS, и более поздние исследования на животных моделях показали, что происходит нарушение регуляции иммунного ответа, что приводит к обильному воспалению и смертельному заболеванию. В этом обзоре мы обсуждаем последние достижения в нашем понимании патогенеза hCoV, уделяя особое внимание цитокиновому шторму и иммунопатологии как причинам вредных последствий при hcov-инфекциях.
Клинические особенности высокопатогенной CoV инфекции у человека
SARS- CoV инфекция человека, вызванная ОРЗ заболеванием, которое варьировало от легкой лихорадочной болезни до ALI, а в некоторых случаях ARDS и смерти [27, 10]. Клиническое течение SARS протекает в три четко выраженные фазы. Начальная фаза характеризовалась интенсивной репликацией вируса, сопровождавшейся лихорадкой, кашлем и другими симптомами, которые через несколько дней исчезли. Вторая клиническая фаза ассоциируется с высокой температурой, гипоксемией и прогрессированием до пневмония-подобных симптомов, несмотря на то, что в этой фазе наблюдалась прогрессирующая снижение титров вирусов к окончанию этой фазы [28].Во время третьей фазы заболевания∼20%пациентов прогрессировали до ARDS, что часто приводило к летальному исходу [29, 30]. Из-за прогрессирующего снижения титров вирусов третья фаза, как полагают, возникла в результате избыточных воспалительных реакций хозяина. Наиболее распространенными клиническими проявлениями MERS являются гриппоподобные симптомы, такие как лихорадка, боль в горле, непродуктивный кашель, миалгия, одышка и одышка, которые быстро прогрессируют до пневмонии [25, 21]. Другие атипичные проявления включают легкие респираторные заболевания без лихорадки, озноба, хрипов и учащенного сердцебиения. MERS-CoV у людей также вызывает желудочно-кишечные симптомы, такие как боль в животе, рвота и диарея. Большинство больных MERS с одышкой прогрессируют до развития тяжелой пневмонии и требуют госпитализации в отделение интенсивной терапии (ОИТ) intensive care unit (ICU). Хотя большинство здоровых людей имеют респираторные заболевания легкой и средней степени тяжести, иммунокомпрометированные и лица с коморбидными состояниями испытывают тяжелое респираторное заболевание, которое часто прогрессирует до ARDS [21].В целом MERS-CoV вызывает тяжелое заболевание первично в отдельных случаях , иммунокомпрометированных индивидуумах и у пациентов с коморбидными состояниями, но вторичные случаи при бытовых контактах с медицинскими и социальными работниками были в основном бессимптомными или проявлялись легкими респираторными заболеваниями.
Легочная патология при hCo инфекциях
Макро-и микроскопическая патология при SARS
Как правило, исследование легких у пациентов, перенесших SARS, показали консолидацию легких и отек с плевральными выпотами, очаговыми кровоизлияниями и слизисто-гнойным материалом в трахеобронхиальном дереве. Диффузное альвеолярное поражение (Diffuse alveolar damage (DAD)) было характерным гистологическим признаком при SARS легких [31, 32]. Другие изменения включали поражение гиалиновой мембраны, альвеолярное кровоизлияние и фибринэкссудацию альвеолярных пространств с эпителиальным и альвеолярным фиброзом, наблюдавшимися на более поздних стадиях [32, 33]. Окрашивание на вирусный антиген выявило инфицирование дыхательных путей и альвеолярных эпителиоцитов, сосудистых эндотелиоцитов и макрофагов [31, 32]. Кроме того, вирусные частицы SARS-CoV и вирусный геном были также обнаружены в моноцитах и лимфоцитах [31]. В дополнение к этим изменениям при гистологическом исследовании легких у больных, умерших от SARS, были выявлены обширные клеточные инфильтраты-интерстициума и альвеол. Эти клеточные инфильтраты включали нейтрофилы и макрофаги с макрофагами, обладающими доминирующим типом клеток [31,32].Эти результаты коррелировали с повышением количества нейтрофилов и моноцитов и снижением содержания CD4 и CD8 Tклеток в образцах периферической крови пациентов с летальным исходом SARS [34-36].
Макро- и микроскопическая патология при MERS
Несмотря на многочисленные лабораторно подтвержденные случаи заболевания и летальные исходы, вызванные MERS-CoV инфекциями в разных странах, только один отчет об аутопсии MERS является достоверным. Анализ легочной ткани этого пациента показал наличие плеврального, перикардиального и абдоминального выпота, связанного с генерализованным застоем, отеком и консолидацией легких [37]. Подобно SARS-CoV инфекции, DAD был заметной особенностью в легких. Кроме того, отмечались эпителиальный некроз клеток, отслоение бронхиолярного эпителия, альвеолярный отек и утолщение альвеолярных перегородок. Иммуногистохимическое исследование показало, что MERS-CoV преимущественно инфицирует дыхательные пути и альвеолярные эпителиальные клетки, а также эндотелиальные клетки и макрофаги. Тяжесть поражения легких коррелирует с интенсивной инфильтрацией нейтрофилов и макрофагов в легких и более высоким количеством этих клеток в периферической крови больных MERS [37].
Цитокиновые и хемокиновые реакции при патогенных hCoV инфекциях
Долгое время считалось, что цитокины и хемокины играют важную роль в иммунитете и иммунопатологии при вирусных инфекциях. Быстрый и хорошо скоординированный врожденный иммунный ответ на первичные иммунодефицитные инфекции, но дисрегулированные и чрезмерные иммунорефлексии могут вызывать иммунопатологию[38-40].Несмотря на то, что существуют данные о вовлечении провоспалительных цитокинов и хемокинов в патологию легких при SARS and MERS, корреляционные данные от пациентов с тяжелым течением заболевания свидетельствуют о роли гипервоспалительных реакций в патогенезе hCoV.
Цитокиновые и хемокиновые реакции на SARS-CoV инфекцию
В то время как SARS-CoV продуктивно поражает клетки дыхательных путей и альвеолярного эпителия, инфекция гемопоэтических клеток, таких как дендритные клетки (ДК), моноцитарно-макрофаги и другие PBMC (peripheral blood mononuclear )cell derived cells периферические мононуклеарные клетки подавлены. SARS-CoV инфекция DCs вызывает низкий уровень экспрессии противовирусных цитокинов IFN-αβ, умеренную регуляции провоспалительных цитокинов TNF и IL-6, и значительное регуляции воспалительных хемокинов CCL3, CCL5, CCL2, и CXCL10 [41, 42]. Аналогичным образом, инфицированные SARS-CoV макрофаги демонстрируют замедленный, но повышенный уровень IFN и других провоспалительных цитокинов [42]. Кроме того, инфицированные SARS-CoV эпителиальные клетки дыхательных путей (AECs) также продуцируют большое количество CCL3, CCL5, CCL2 и CXCL10 [43]. Считается, что замедленная, но чрезмерная выработка этих цитокинов и хемокинов индуцирует дисрегуляцию врожденного иммунного ответа на SARS-CoV инфекцию. Высокие сывороточные уровни провоспалительных цитокинов (IFN-γ, IL-1, IL-6, IL-12 и TGFß) и хемокинов (CCL2, CXCL10, CXCL9 и IL-8) были обнаружены у больных SARS с тяжелой формой заболевания по сравнению с лицами с неосложненной SARS [44-47]. И наоборот, у больных SARS с тяжелым течением заболевания повышается уровень анти-воспалительного цитокина, Ил-10 [44]. В дополнение к провоспалительным цитокинам и хемокинам у лиц с летальным исходом атипичной пневмонии наблюдались повышенные уровни IFN (IFN-α и IFN-γ) и IFN-стимулированных генов (ISGs)(Cxcl10 и Cccl-2)по сравнению с контрольными группами пациентов с умеренной степенбю болезни[48-51].Эти результаты были первыми, которые предположили возможную роль IFNs и ISGs в иммунопатогенезе атипичной пневмонии у человека. Таким образом, из этих исследований следует, что дисрегулированные и / или избыточные цитокиновые и хемокиновые реакции инфицированных SARS-CoV AECs, DCs, и макрофаги могут иметь важную роль в патогенезе SARS.
Цитокиновые и хемокиновые реакции на инфекцию MERS-CoV
Как и при SARS, MERS-CoV инфекция эпителиальных клеток дыхательных путей человека индуцирует значительные, но замедленные реакции на IFN и провоспалительные цитокины (Ил-1β, ИЛ-6 и ИЛ-8) [52].В то время как MERS-Cov реплицируются как в наивных так и активированные человеческие моноциты-макрофаги и DCs, только активированные Т-клетки поддерживают MERS-CoV репликацию [53-55]. Это отличает SARS-CoV, которые активно поражают моноциты-макрофаги, DCs и Т-клетки. Инфицирование MERS-CoV THP-1 клетки, моноцитарной клеточной линии и моноцитарные макрофагами периферической крови человека и дендритными клетками индуцировали замедленный, но повышенный уровень провоспалительных цитокинов и хемокинов, таких как CCL-2, CCL-3, CCL-5, IL-2 и IL-8 [54, 55]. Однако продукция IFN -α / β моноцито-макрофагами и DCs не была существенной, за исключением плазмацитоидных дендритных клеток, которые продуцировали обильное количество IFNs при инфицировании MERS-CoV [56]. Недавние исследования показали повышенный уровень сывороточных провоспалительных цитокинов (IL-6 и IFN-α) и хемокинов (IL-8, CXCL10 и CCL5) у лиц с тяжелым MERS по сравнению с лицами с легкой и умеренной степенью заболевания [57, 58]. Высокие уровни сывороточных цитокинов и хемокинов у больных MERS коррелируют с повышением уровня нейтрофильных и моноцитарных клеток в периферической крови, что позволяет предположить возможную роль этих клеток в патологии легких [57, 58, 37].
Цитокины/хемокины и иммунопатология на животных моделях
Дизрегуляции воспалительной реакции в животных моделях SARS-CoV инфекции
Several inbred mouse strains have been evaluated to study SARS-CoV pathogenesis. Mice infected with the human strain of SARS-CoV (SARS-CoV-Urbani) were permissive to virus replication but developed only mild lung pathology and clinical illness [59]. Subsequently, isolation of mouseadapted strains of SARS-CoV (e.g., SARS-CoV-MA15) allowedstudiesoflethalSARS[60–62].MA15infectsairway andalveolarepithelialcellsandepithelialcellsofotherorgans [62]. Young mice of many strains (e.g., C57BL/6, 129) support MA15 replication in the lungs but are resistant to developing significant clinical disease [63, 64]. In contrast, young BALB/c mice infected with MA15 develop lethal disease characterized by diffuse alveolar damage, enhanced monocyte/macrophage and neutrophil accumulation, pulmonary edema, and hyaline membrane formation [62].
Furthermore, aged mice of all strains develop lethal clinical disease and succumb to infection [65, 66, 64]. In addition to mousemodels,SARS-CoVinfectionofagedrhesusmacaques resulted in significantly more pathology than young adult animals [67]. These animal models replicated several key features of SARS-CoVinfection in humans and were thus useful for investigating SARS pathogenesis. Studies in animal models have been particularly useful in elucidatingtheroleofcytokinesandchemokinesinmediating lung immunopathology following hCoVinfections. Infection of non-human primates (NHPs) with SARS-CoV induced a dysregulated immune response resulting in increased disease severity in aged but not young NHPs, despite similar viral titers in the airways [67]. Since enhanced expression of genes regulating inflammation but not virus titers correlated with disease severity, an exaggerated immune response is thought to induce lethal disease in aged NHPs [67]. Similarly, in SARS-CoV-infected BALB/c mice, disease severity in aged mice correlated with early and disproportionately strong upregulation of ARDS-associated inflammatory gene signatures [66].Inarecentstudy,weidentifiedapathogenicroleforIFNI in mice infected with MA15. Our results showed that rapid SARS-CoV replication in BALB/c mice induced a delayed IFN-α/β response accompanied by an excessive influx of pathogenic inflammatory monocyte-macrophages (IMMs) [38]. The accumulating IMMs themselves produced additionallevelsofmonocytechemo-attractantssuchasCCL2,CCL7, andCCL12 (through IFN-α/βreceptorstimulation),resulting in further accumulation of pathogenic IMMs, which in turn enhanced disease severity. These infiltrating IMMs produced elevated levels of pro-inflammatory cytokines such as TNF, IL-6, IL1-β, and iNOS. Blocking IFN signaling, depleting IMMs, or neutralizing a single inflammatory cytokine, TNF, protected mice from lethal SARS-CoV infection. Additionally, IFN-α/β or IMM-derived pro-inflammatory cytokinessensitizedTcellstoundergoapoptosis,furtherimpeding virus clearance [38]. In another study of SARS-CoV infection, loss of TIR-domain-containing adapter-inducing interferon-β (TRIF), an adapter molecule for TLR3 and TLR4 signaling, resulted in a distinct inflammatory signature characterized by neutrophil and other inflammatory cell infiltration [68]. A dysregulated immune response to SARS-CoV in TRIF-deficient mice was associated with aberrant antiviral IFN (IFN-α and IFNβ), pro-inflammatory cytokine and chemokine (IL-6, TNF, IFN-γ, and CCL5), and interferonstimulated gene (RSAD2, IFIT1, and CXCL10) responses. Notably, virus titers were significantly higher in TLR3−/− and TRIF−/− mice compared to their WT controls [68]. Although the viral factors regulating the pro-inflammatory response of neutrophils and monocyte-macrophages remain to be identified, the E protein of SARS-CoV has been shown to enhance pro-inflammatory cytokine and chemokine and inflammasome activity via its ion channel activity [69–71].
These results support the notion that higher virus titers and dysregulated cytokine/chemokine responses cause a Bcytokinestorm^ withlungimmunopathologicalchanges following SARS-CoVinfection.
Animal models ofMERS-CoVinfection and lethal disease
Animal models employed to study MERS include rhesus macaques, rabbits, marmosets, and mice among others. MERS-CoV challenged rhesus macaques developed mild to moderate disease [72]. Similarly, MERS-CoV-infected rabbits displayed mild clinical disease with mild-moderate perivascular, peribronchiolar infiltration, and to a lesser extent lung interstitial inflammation [73, 74]. In contrast, marmosets displayed moderate-severe respiratory disease characterized by broncho-interstitial pneumonia, alveolar edema, and fibrin deposition [75]. Marmosets with severe disease showed increased neutrophil and macrophage infiltration in alveoli and interstitial septa, although whether marmosets develop severe disease remains controversial [75, 76]. Although gross and histological lesions and inflammatory cell infiltration in MERS-CoV infected marmosets resemble human disease, there are no data available describing cytokine and chemokine responses in these animals. Small laboratory animals, particularly rodents, do not support MERS-CoV replication due to inability of MERSCoV-spike protein to bind to human DPP4 (hDPP4) orthologs in these animals [77]. The first mouse model to study MERS was generated by intranasal transduction of adenovirus encoding hDPP4. These mice developed mild to moderate pneumonia, especially in immunodeficient mice [78]. Several hDPP4 transgenic mouse models developed thereafter exhibited variable organ tropism and disease severity, depending on the promoter driving the hDPP4 expression [79, 80]. More recently, hDPP4 knock-in mice in which hDPP4 is expressed under the mouse hDPP4 promoter have also been described. These mice also developed moderate clinical disease after infection with human isolates of MERS-CoV [81]. We and others recently developed a similar mouse model and showed that serial passage of human isolate of MERSCoV resulted in mouse adaptation. Mice infected with this adapted virus caused lethal respiratory illness and will be useful for studies of pathogenesis [82, 83]. Overall, delayed and aberrant antiviral and proinflammatory cytokine production in MERS-CoV-infected human macrophages and dendritic cells and high serum proinflammatory cytokine levels in patients with severe disease compared to mild-moderate clinical disease suggesting that possible dysregulated and enhanced cytokine responses promote lung pathology following MERS-CoV infection.
CoV антагонизм ответа IFN и тяжесть заболевания
Чтобы противостоять врожденным противовирусным цитокиновым реакциям, SARS-CoV и MERS-CoV перекодирует несколько структурных и неструктурных белков (NSP), которые противодействуют противовирусному иммунному ответу. SARS-CoV кодирует nsp1, nsp3-макродомен, nsp3-deubiquitinase (DUB) и ORF3b, ORF6 и ORF9b подрывают противовирусный ответ, антагонизируя ответы IFN и ISG [84-89]. В то время как nsp3 ухудшает реакцию IFN по неизвестному механизму, nsp1 ингибирует реакцию IFN, блокируя фосфорилирование STAT1 [90, 91]. Кроме того, структурные протеины такие как мембранные(M)и нуклеокапсидные(N)белки подавляют сигнализацию IFN путем ингибирования TBK1/IKKe и неизвестными механизмами соответственно [92-95]. Аналогичным образом, структурные белки M и N MERSCoV и вспомогательные белки orf3, orf4a и orf4b антагонизируют реакции IFN [85, 96, 97]. Следует отметить, что большинство, если не все из этих предполагаемых противовирусных механизмов были подвергнуты анализу на трансцендентную экспрессию и являются ли они на самом деле важными в контексте инфекционного вируса, еще предстоит определить. Структурный и неструктурный белковый антагонизм ответов IFN дополнительно усиливает воспалительные реакции, способствуя безудержной репликации вируса, что приводит к увеличению вирусных PAMPs, которые еще больше ослабляют сигнализацию IFN(интерферонов) и стимулируют PRRs индуцировать аберрантную воспалительную реакцию. Отсутствие IFN-сигнализации также приводит к чрезмерному накоплению Ly6C снижая моноциты и нейтрофилы.
Причины избыточного воспалительного ответа
Несмотря на несколько лет исследований, изучающих патогенез SARS and MERS, специфические факторы хозяина, приводящие к развитию патологии легких после hCoV инфекции, относительно неизвестны. Однако тщательный обзор литературы, связанной с патогенезом SARS-CoV and MERS-CoV инфекции у людей и животных, позволяет выделить несколько ключевых факторов, которые могут играть решающую роль в инициации и прогрессировании избыточных воспалительных реакций.
- Быстрая репликация вируса: заметная особенность патогенных коронавирусов человека, таких как SARS-CoV и MERSCoVis, что оба вируса реплицируются до высоких титров очень рано после заражения как in vitro, так и in vivo [38, 98-100, 28]. Эта высокая репликация может привести к усилению цитопатических эффектов и продуцированию более высоких уровней провоспалительных цитокинов и хемокинов инфицированными эпителиальными клетками [99,68,12]. Эти цитокины и хемокины, в свою очередь, способствуют массивной инфильтрации воспалительных клеток легких [38]. Исследования инфекций hCoV у людей и экспериментальных животных показали, что сильная корреляция между высокими титрами SARS-CoVand MERSCoV и тяжестью заболевания.
- hCoV инфекция дыхательных путей и / или альвеолярных эпителиальных клеток:
исследования на животных моделях, особенно на мышиных моделях, дают коррелятивные доказательства для дифференциального исхода заболевания, если вирусы преимущественно заражают эпителиальные клетки дыхательных путей против обоих дыхательных путей и альвеолярных эпителиальных (тип II и пневмоциты типа II) клеток. У штаммов В6 и 129, оба из которых позволяют репликацию вируса, но устойчивы к развитию клинической болезни, антигены вируса доминантно расположены в эпителиальных клетках дыхательных путей в ранние сроки после заражения. Напротив, у высокочувствительных мышей BALB/c вирусный антиген обнаруживается в легочных дыхательных путях и в альвеолярных пневмоцитах I и II типов (рис. 1). Эти результаты свидетельствуют о критической роли hcov-инфицированных пневмоцитов I и II типов в опосредовании легочной патологии и восприимчивости хозяина.
- Отсроченные ответы IFN: Как упоминалось в предыдущих разделах, как SARS-CoVand MERS-CoV перекодируют множественные структурные и неструктурные белки, которые антагонизируют ответы на интерфирон. hCoV достигают высоких титров очень рано после заражения и содержат множество белков, которые ингибируют ответ IFN, предполагая, что ранний антагонизм ответа IFN может задержать или уклониться от врожденного иммунного ответа. Замедленная сигнализация IFN дополнительно организует IMM реакции и сенсибилизирует Т-клетки к апоптозу, что приводит к нарушению регуляции воспалительного ответа [38].
- Накопление моноцитов-макрофагов и нейтрофилов: как человеческие, так и животные исследования демонстрируют накопление воспалительных моноцитов-макрофагов и нейтрофилов в легких после hcov-инфекции. Эти клетки являются преобладающим источником цитокинов и хемокинов, ассоциированных с летальным заболеванием hCoV, наблюдаемым как на моделях человека, так и на животных [38, 32].
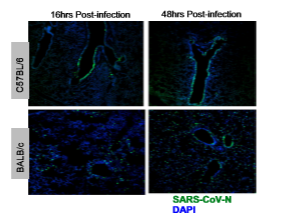
Рис. 1 Окрашивание на антиген SARS-CoV-N в легких мышей C57BL / 6 и BALB/c через 16 и 48 ч после заражения
Последствия цитокинового шторма и иммунопатологии
- Апоптоз эпителиальных и эндотелиальных клеток и сосудистая проницаемость: одним из самых ранних последствий быстрой репликации вируса и обильных провоспалительных реакций цитокинов/ хемокинов является апоптоз эпителиальных и эндотелиальных клеток легких. IFN -αβ и IFN -γ индуцируют воспалительную клеточную инфильтрацию и вызывают апоптоз клеток дыхательных путей и альвеолярного эпителия через FAS – FasL-или TRAIL-DR5-зависимые механизмы [101-103]. Кроме того, ФНО, высвобождаемый IMMs, также способствует апоптозу как эпителиальных клеток легких, так и эндотелиальных клеток (неопубликованное наблюдение). Апоптоз эпителиальных и эндотелиальных клеток компрометирует легочных сосудов микроциркуляторного русла и альвеолярных эпителиальных клеток барьер, приводящих к сосудистой проницаемости и альвеолярному отеку в конце концов результирующихся в гипоксию.
- Субоптимальный ответ T клеток: специфичные CoV T клетки имеют решающее значение для клиренса вируса и ограничивают дальнейшее повреждение хозяина [64, 104]. Кроме того, Т-клеточные реакции также ослабляют гиперактивные врожденные иммунные реакции [105, 106]. Избыточные воспалительные реакции, вызванные патогенными hCoV, уменьшают ответ T клеток, в случае инфекции SARSCoV через TNF-опосредованный апоптоз Т-клеток, что приводит к неконтролируемому воспалительному ответу.
- Накопление интерстициально активированных макрофагов и изменение тканевого гомеостаза: у некоторых больных SARS с длительной продолжительностью заболевания DAD сопровождалось фиброзом интерстициальных и альвеолярных пространств и гиперплазией пневмоцитов. Аналогичные гистологические особенности были замечены в легких мышей с атипичной пневмонией STAT-/-класса на фоне В6 и 129. В легких этих мышей обнаружена усиленная периваскулярная инфильтрация альтернативно активированных макрофагов, нейтрофилов и фибробластов, сопровождающаяся обширным отложением фибрина и альвеолярным коллапсом, что наблюдается при терминальной стадии ALI и ARDS у человека [63, 107]. Дальнейшие исследования показали, что отмена сигнализации STAT1, особенно в миелоидных клетках, приводит к альтернативной активации макрофагов [108]. Кроме того, тонкий баланс между процессами свертывания крови хозяина и фибринолиза регулирует ремоделирование тканей и ALI [109].
- ARDS: медиаторы воспаления играют ключевую роль в патогенезе ARDS, являясь основной причиной смерти пациентов, инфицированных SARS-CoV or MERS-CoV [110, 111]. Ряд провоспалительных цитокинов, включая IL6, IL-8, IL-1β и GM-CSF, активные формы кислорода и хемокины, такие как CCL2, CCL-5, IP-10 и CCL3, способствуют развитию ARDS [48, 112, 113]. Кроме того, неконтролируемая пролиферация эпителиальных клеток и нарушение ремоделирования тканей на более поздних стадиях индуцируют ARDS, приводящие к легочному фиброзу и смерти.
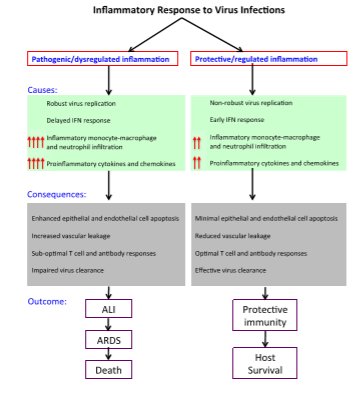
Краткое изложение причин и следствий цитокинового шторма и иммунопатологии патогенеза заболевания представлено на Рис.1. 2.
Терапевтические подходы
Высокие титры вирусов и последующие обильные воспалительные цитокиновые и хемокиновый ответ коррелируют с высокой заболеваемостью и смертностью наблюдаемых патогенетических инфекций. Систематический обзор терапевтических эффектов ряда широко используемых противовирусных и иммуномодулирующих средств, используемых во время вспышки SARS, показал неубедительные результаты [114]. Аналогичным образом, терапевтические вмешательства, направленные на снижение вирусной нагрузки, были в некоторой степени полезны при раннем введении, но не вовремя поздних стадий MERS-CoV инфекций [115-117]. Эти результаты свидетельствуют о том, что новые стратегии, направленные на ослабление воспалительных реакций, вероятно, улучшат клинические исходы, контролируя вирусную нагрузку. Здесь мы описываем агенты, которые обладают потенциалом для смягчения hcov-индуцированного воспаления.
Обычно используемая терапия
Кортикостероидная терапия. Кортикостероиды — это класс стероидных гормонов, которые оказывают противовоспалительные функции и обычно используются для подавления воспалительных состояний. Во время эпидемии SARS 2003 года кортикостероиды были основой иммуномодулирующей терапии. Своевременное назначение кортикостероидов часто приводит к раннему улучшению в плане снижения температуры, разрешения рентгенографических инфильтратов легких и лучшей оксигенации [118-120]. Однако, в то время как некоторые исследования не показали никакого положительного эффекта, другие продемонстрировали неблагоприятные исходы после кортикостероидной терапии во время инфекции SARS-CoV у людей. Раннее лечение кортикостероидами у больных SARS усиливало вирусную нагрузку плазмы крови у пациентов, не находящихся в отделении интенсивной терапии, что приводило к обострению заболевания [118]. В целом эти результаты показывают, что сроки, дозировка и продолжительность терапии кортикостероидами имеют решающее значение, если это вмешательство должно быть полезным при инфекциях hCoV. В целом кортикостероидная терапия не рекомендуется для лечения респираторных инфекций hCoV.
Интерфероны Пегилированные и непегилированные интерфероны были исследованы в терапевтических целях у hCoV инфицированных индивидах. Одн SARS ако терапевтическое применение этих агентов дало неоднозначные результаты как на человеческих, так и на животных моделях hCoV инфекции. Раннее введение IFN было незначительно полезно для снижения вирусной нагрузки и приводило к умеренному улучшению клинических проявлений. В отличие от этого, отсроченное введение IFN не имело никакого преимущества по сравнению с контролем плацебо. Аналогичным образом, раннее введение комбинация IFN и рибавирина незначительно улучшала тяжесть заболевания, но не влияла на смертность [115, 121, 117, 122].
Рис. 2 схематическое представление защитных и патогенных воспалительных реакций на патогенные инфекции hCoV
Другие возможные терапевтические средства
IFN-aß ингибиторы и IFN-λ IFN-aß ингибиторы ограничивают репликацию вируса через индукцию ISGs. Однако IFN -αβ может также усугублять заболевание, усиливая рекрутирование и функцию IMMs и других врожденных иммунных клеток. В то время как ранний интерфероновый ответ был защитным у мышей, инфицированных SARS-CoV, отсроченный сигнал дизрегулировал IFN-aß anti-SARS-CoV иммунный ответ предполагается, что сроки терапии IFN имеют решающее значение для определения исхода заболевания. Исходя из этих результатов, назначение блокаторов или антагонистов рецепторов ИФН-αβ должно было бы способствовать развитию стойких воспалительных реакций на более поздних стадиях тяжелого заболевания, особенно при SARS [38]. В отличие от ИФН-αβ, ИФН-λ в основном активирует эпителиальные клетки и не обладает опосредованной моноцитемакрофагами провоспалительной активностью ИФН-αβ [123]. Кроме того, IFN-λ подавляет рекрутирование нейтрофилов в очаг воспаления [124]. Так как SARS-CoV and MERS-CoV предоминантно инфецирует AECs and IFN-λ стимулируя противовирусный ген в эпителиальных клетках без чрезмерной стимуляции иммунной системы, использование IFN-λ может быть идеальным терапевтическим вариантом.
Супрессия окисленных фосфолипидов Окисленные фосфолипиды Oxidized phospholipids (OxPL)имеют тенденцию к увеличению продукции цитокинов/хемокинов макрофагами легких через сигнализацию TLR4TRIF у мышей, инфицированных вирусом гриппа А (IAV) [125]. В недавнем исследовании терапевтическое введение антагониста TLR4, Эриторана, Eritoran защищало мышей от смертельной инфекции IAV за счет снижения уровней OxPL и воспалительных цитокинов и хемокинов [126]. Несмотря на мощные иммуномодулирующие функции, Эриторан не обладает прямой противовирусной активностью, что позволяет предположить его применение для улучшения воспалительных реакций. Поскольку патогенные коронавирусы человека вызывают острое повреждение легких и стимулируют выработку OxPL в легких [125], стратегии подавления OxPL либо с помощью Эриторана, либо с помощью других подобных соединений могут быть полезны для подавления hcov iиндуцированного воспаления.
Терапия агонистами сфингозин-1-фосфатного рецептора 1 у мышей, инфицированных IAV, сфингозин-1-фосфатный рецептор 1
(S1P1) сигнализирует в эндотелиальных клетках, вызывающих патогенные воспалительные реакции [127]. Таргетный агонизм S1P1 сдерживал чрезмерную вербовку воспалительных клеток, подавлял провоспалительные цитокины и хемокины, а также снижал индуцированную IAV заболеваемость и смертность [127, 128]. SARS-CoV инфицирует эпителиальные клетки легких и эндотелиальные клетки человека и NHPs [29], так что SARS-CoV-инфекция эндотелиальных клеток может стимулировать s1p1-опосредованные воспалительные цитокиновые/хемокиновые реакции и накопление нейтрофилов и макрофагов. Таким образом, агонизм S1P1 может быть потенциальным терапевтическим агентом у пациентов с hCoV для подавления патогенных цитокиновых и хемокиновых реакций, если будет продемонстрирована роль чрезмерного иммунного ответа этими клетками.
Ингибиторы моноцитарного синтеза и функции Изучение на моделях животных продемонстрировало патогенетическую роль IMMs во время смертельной инфекции hCoV. В мышиной модели сердечного воспаления системная доставка оптимизированных липидных наночастиц, содержащих CCR2-silencing short interfering RNA (siRNA) эффективно разлагает CCR2mRNA и нарушает подбор IMM в местах воспаления, что приводит к улучшению исхода заболевания [129, 130]. Поскольку hCoVs являются одноцепочечными вирусами РНК (ssRNA) и стимуляция IMMs агонистом TLR7, R837 (синтетический имитатор ssRNA), индуцирует сильные воспалительные реакции, возможно, что IMM-специфическая сигнализация TLR-7 способствует чрезмерному воспалению в ответ на инфекцию hCoV. Таким образом, направленный на антагонистTLR7 подход к смягчению воспаления может оказаться полезным.
Другие иммуномодулирующие агенты Некоторые другие иммуномодулирующие агенты, которые могут улучшить воспалительные реакции после патогенных инфекций hCoV, включают ингибиторы цитокинов/хемокинов и связанные с danger-associated molecular pattern (DAMP) антагонистами [131]. Исследования на животных моделях показывают значительный вклад ФНО в острое повреждение легких и нарушение Т-клеточных реакций у мышей с атипичной пневмонией. In vivo нейтрализация активности TNF или инфицирование мышей, лишенных TNFR, обеспечивает защиту от индуцированной SARS-CoV заболеваемости и смертности [38, 132]. Однако следует отметить, что ФНО не был обнаружен в сыворотке крови больных SARS, по крайней мере, на более поздних стадиях инфекции.
Заключение
Воспаление является непременной частью эффективного иммунного ответа, без которого успешная элиминация инфекционного агента затруднена. Воспалительный ответ происходит при первоначальном распознавании патогена, который затем опосредует иммунокомпетентность, элиминирует патогены и в итоге приводит к восстановлению тканей и возвращению к гомеостазу. Однако, некоторые вирусы, такие как высокопатогенные CoVs, IAV и вирусы Эболы, вызывают чрезмерную и длительную реакцию цитокинов/ хемокинов, известную как «цитокиновые штормы», что приводит к высокой заболеваемости и смертности из-за иммунопатологии. Хотя исследования, рассмотренные в этой рукописи, дают доказательства того, что «цитокиновые штормы» и иммунопатология могут возникать во время патогенных hCOV инфекций, у нас пока нет достаточного понимания специфического фактора/ответа на бурные воспалительные реакции. Исследования аутопсий человека и животных моделей убедительно свидетельствуют о патогенной роли воспалительных цитокинов / хемокинов, полученных из IMM и нейтрофилов. Таким образом, терапевтическая интервенция, направленная на эти провоспалительные цитокины и хемокины, может оказаться полезной в улучшении нежелательных воспалительных реакций. Кроме того, поскольку высокие титры вируса на ранних и поздних стадиях инфекции сильно коррелируют с тяжестью заболевания у человека, стратегии, направленные на контроль вирусной нагрузки, а также ослабление воспалительных реакций, могут быть эффективны. Поэтому будущие исследования должны быть сосредоточены на выявлении специфических сигнальных путей, которые опосредуют воспалительные реакции у пациентов с hCoV-инфекцией и животных.
ГЛОССАРИЙ*
*добавлено автором
Гиперцитокинемия (цитокиновый шторм, цитокиновый каскад) — это потенциально летальная реакция иммунной системы, суть которой состоит в неконтролируемой и не несущей защитной функции активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов, вследствие наличия прямой связи между этими процессами. Порочный круг вызывает разрушение тканей очага воспаления, одновременно реакция распространяется на соседние ткани и по мере развития приобретает системный характер, охватывая весь организм в целом.
Цитокиновый шторм характеризуется системным воспалением, может протекать в тяжёлой форме и приводить к полиорганной недостаточности, гиперферритинемии, при отсутствии лечения — часто к смерти. Может возникнуть в результате инфекции, аутоиммунных расстройств и других заболеваний, а также после некоторых типов иммунотерапий.
Первое появление термина «цитокиновый шторм» в литературе было предположительно в 1993 году при описании реакции трансплантата против хозяина .В исследованиях инфекций термин начал использоваться с сообщений о цитомегаловирусе в 2000 году, а позже — в сообщениях про связанный с вирусом Эпштейна-Барра гемофагоцитарный лимфогистиоцитоз, стрептококковую инфекция группы А , вирусы гриппа, натуральную оспу и тяжёлый острый респираторный синдром. В научной литературе термин стал чаще встречаться с 2005 в контексте птичьего гриппа.
В борьбе с вирусом иммунные клетки выделяют особые вещества — цитокины. Это низкомолекулярные белки активированных клеток иммунной системы, которые обеспечивают межклеточные взаимодействия. К цитокинам, в частности, относятся интерфероны, интерлейкины, хемокины, факторы некроза опухоли и т. д. Сегодня ученым известно более ста цитокинов. Эти белки действуют по эстафетному принципу: воздействие цитокина на клетку вызывает образование ею других цитокинов, если реакция иммунной системы очень бурная, возникает так называемый цитокиновый шторм: активированные иммунные клетки вырабатывают все новые и новые порции этих белков.
Цитокиновый шторм проявляется лихорадкой, рвотой, диареей, слабостью, болями в мышцах и снижением кислорода крови.
В лабораторных анализах цитопения, лимфопения, повышение уровня ферритина. Отмечается высокий уровень интерлейкина 2, фактора некроза альфа.


