К.м.н. Дятчина Л.И.
К ревматическим болезням (РБ) относятся болезни костно-мышечной системы и соединительной ткани, объединяющие более 150 различных нозологических форм и синдромов (XIII класс болезней согласно Международной классификации болезней X пересмотра). Общим и наиболее характерным признаком этих заболеваний является поражение суставов и/или позвоночника воспалительного характера. РБ отличаются широкой распространенностью, поражением людей различных возрастных групп, длительным прогрессирующим характером течения, нередко приводят больных к потере трудоспособности и ранней инвалидности. Основными представителями этой группы заболеваний являются ревматоидный артрит (РА), ювенильный хронический артрит, идиопатический анкилозирующий спондилоартрит (болезнь Бехтерева), подагрический и псориатический артриты, а также реактивные артриты, например при воспалительных заболеваниях кишечника.
При всем многообразии вышеназванных заболеваний, каждое из которых имеет особенности патогенеза, патоморфологии, клинической картины, течения и исходов, их прежде всего, сближает хронический воспалительный характер патологического процесса с его обострениями и ремиссиями. Этиотропная терапия хронических воспалительных заболеваний суставов (ХВЗС), за редким исключением, невозможна, так как у большинства из них до настоящего времени не выявлен этиологический фактор. Именно поэтому, основным направлением в лечении ХВЗС является воздействие на хроническое воспаление, лежащее в основе их патогенеза.
Противовоспалительная терапия включает симптом-модифицирующие (СМАРП) и болезнь-модифицирующие (БМАРП) антиревматические препараты. К препаратам первой группы относятся нестероидные противовоспалительные препараты (НПВП). НПВП относятся к быстродействующим неспецифическим средствам, которые предотвращают развитие или снижают интенсивность воспаления, а также оказывают анальгезирующий и жаропонижающий эффекты. НПВП нередко применяют не только при ревматических болезнях, но и при целом ряде других заболеваний, при которых имеет место боль и повышение температуры.
В настоящее время существует более 50 различающихся по химической структуре лекарственных форм, относящихся к НПВП. Более тридцати миллионов людей в мире ежедневно принимают НПВП и среди них около 20% стационарных больных, преимущественно пожилого возраста (около 40% этих пациентов, имеют возраст старше 60 лет).
Классификация НПВП
Классификация НПВП, основанная на их химической структуре, представлена в таблице №1.
| Таблица №1. Классификация НПВП |
| I. Кислотные производные |
| 1.1 Арилкарбоновые кислоты
|
Салициловая кислота:
- ацетилсалициловая кислота (Аспирин, Аспро, Колфарит);
- дифлунисал;
- трисалицилат;
- бенорилат;
- салицилат натрия;
- лизинмоноацетилсалицилат (Аспизол, Ласпал).
Антраниловая кислота:
- флуфенамовая кислота (Арлеф);
- мефенамовая кислота (Понстал);
- меклофенамовая кислота
|
| 1.2 Арилалкановые кислоты |
Арилуксусная кислота:
- диклофенак натрия (Вольтарен®, Дикловит, Диклак);
- диклофенак калия (Вольтарен®Акти, Раптен Рапид);
- фенклофенак;
- фентиазак;
- оксапрозин
Арилпропионовая кислота:
- ибупрофен (Бруфен, Бурана®, Ибупрофен-Хемофарм, Ибуфен®, МИГ®, Мотрин, Нурофен®);
- кетопрофен (Кетонал®, Кнавон, Орудие, Профенид, Флексен, Артрозилен, ОКИ);
- декскетопрофен (Дексалгин®));
- флурбипрофен (Ансейд, Флугалин, Фробен);
- напроксен натрий (Алив, Апранакс, Напросин, Налгезин).
Гетероарилуксусная кислота:
- фенопрофен;
- толметин;
- фенбуфен;
- зомепирак;
- супрофен;
- клоперак;
- индопрофен;
- кеторолак (Кетанов, Укторол, Торадол, Кетродол, Кеторол);
- триметамин;
- тиапрофеновая кислота (Сургам);
- беноксапрофен.
Индол/инденуксусные кислоты:
- пирпрофен (Ренгазил);
- индометацин (Индометацин Берлин-Хеми, Индоцид, Индобене, Метиндол, Эльметацин);
- сулиндак (Клинорил);
- этодолак (Эльдерин).
|
| 1.3 Эноликовая кислота
|
Пиразолидиндионы:
- фенилбутазон (Бутадион);
- оксифенилбутазон;
- азапропазон;
- фепразон:
- метамизол (Анальгин, Баралгин М, Девалгин, Новалгин, Торалгин);
- аминофеназон (Амидопирин).
Оксикамы:
- пироксикам (Пирокам, Ревмадор, Фельден, Фелдорал, Эразон);
- изоксикам;
- лорноксикам (Ксефокам);
- мелоксикам (Артрозан®, Би-Ксикам, Мирлокс®, Мовалис®, Мовасин®, Матарен®, Мелокан®);
- судоксикам.
|
| 2. Некислотные производные |
| 2.1 Алканоны
2.2 Производные сульфонамида |
- проквазон;
- тиарамид;
- буфексамак;
- набуметон;
- флюрпроквазон;
- тиноридин;
- колхицин.
- нимесулид (Кокстрал, Нимесил ®, Найз ®, Нимика);
- целекоксиб (Целебрекс ®).
|
| 3. Комбинированные препараты |
|
- Амбене (фенилбутазон + дексаметазон);
- Алка-Зельтцер (аспирин + лимонная кислота+ натрия бикарбонат);
- Ибуклин (ибупрофен +парацетамол);
- Новиган® (ибупрофен + питофенон + фенпивериниум).Реопирин (бутадион, или фенилбутазон + амидопирин, или аминофеназон);
- Пенталгин Н (метамизол + напроксен + кофеин +
- Артротек (диклофенак + мизопростол);
фенобарбитал +кодеин);
|
Классификация НПВП по селективности в отношении различных форм циклооксигеназы (ЦОГ) представлена в таблице №2.
| Таблица №2. Классификация НПВП, принятая в РФ |
| Выраженная селективность в отношении ЦОГ-1 |
АСК,
индометацин,
пироксикам. |
| Неселективные ингибиторы ЦОГ-1/ЦОГ-2 |
Большинство НПВП. |
| Умеренная селективность в отношении ЦОГ-2 |
мелоксикам,
нимесулид. |
| Выраженная селективность в отношении ЦОГ-2 |
целекоксиб. |
Механизм действия НПВП
Большинство НПВП являются органическими кислотами и имеют низкие значения рН. Благодаря этому, они активно связываются с белками плазмы и накапливаются в очаге воспаления, для которого также характерно сравнительно низкое рН.
В 1971 r. J. Vane впервые обнаружил, что ацетилсалициловая кислота и индометацин в низких концентрациях проявляют свое противовоспалительное, анальгезирующее и жаропонижающее действие за счет подавления активности фермента циклооксигеназы (ЦОГ), которая участвует в превращениях арахидоновой кислоты и в биосинтезе простагландинов (ПГ). С тех пор точка зрения, согласно которой фармакологические эффекты НПВП связаны, в первую очередь, с подавлением синтеза ПГ, считается общепринятой. В меньшей степени НПВП влияют на активность других ферментов, которые также участвуют в ее метаболизме (фосфолипаза А, липоксигеназа). Метаболизм арахидоновой кислоты представлен на рис.1. В результате биологических превращений арахидоновой кислоты из пероксидов происходит образование провоспалительных простагландинов, а также тромбоксана А
2 (TxА
2).
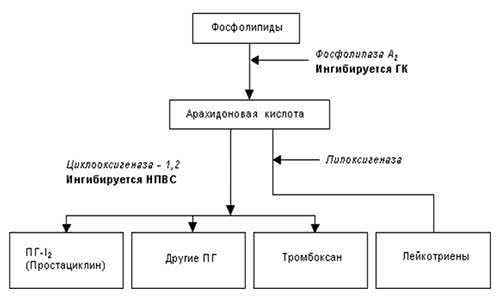
Рис. 1. Метаболизм арахидоновой кислоты
В последние годы существенно расширились и уточнились представления о точках приложения НПВП в регуляции синтеза ПГ. Ранее считалось, что ЦОГ является единственным ферментом, подавление активности которого снижает синтез ПГ, как участвующих в развитии воспаления, так и ПГ, регулирующих нормальные физиологические функции, в частности, функцию желудка, почек и других органов. Сравнительно недавно были открыты две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), играющих различную роль в регуляции синтеза ПГ.
Было показано, что ЦОГ-2 регулирует преимущественно синтез ПГ, вызванный различными провоспалительными стимулами. Считается, что ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и другие). В результате блокады ЦОГ-2 снижается синтез ПГ, которые принимают участие в развитии воспаления, боли и лихорадки. Активность ЦОГ-1 определяет продукцию ПГ, принимающих участие в регуляции нормальных физиологических клеточных процессах, которые не связанны с развитием воспаления. В частности, предполагается, что желудочно-кишечные осложнения НПВП связаны с подавлением активности ЦОГ-1. Хорошо известно, что ПГ-Е
2 и ПГ-I
2 оказывают протективное действие на слизистую желудка, что связывают с их способностью снижать секрецию соляной кислоты и увеличивать синтез цитопротективных веществ. Другим циклооксигеназным продуктом является тромбоксан А
2, синтез которого подавляют НПВП. При этом снижается агрегация тромбоцитов, нарушается свертывающий потенциал крови и, возможно, появление кровоточивости. Кроме того, ПГ играют важную роль в регуляции клубочковой фильтрации, секреции ренина и поддержании водно-электролитного баланса в почках. Очевидно, что нарушение синтеза ПГ может приводить к разнообразным нарушениям функции почек, особенно у больных с сопутствующей почечной патологией. Известно также, что ПГ-Е
2 обладает способностью подавлять активацию нейтрофилов, предотвращать прилипание нейтрофилов, подавлять синтез лейкотриенов (ЛТ) нейтрофилами. Таким образом, предполагается, что противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а их нежелательные реакции связаны с ингибированием ЦОГ-1.Точки приложения НПВП в регуляции синтеза ПГ представлены в таблице №3.
|
Таблица №3. Точки приложения НПВП в регуляции синтеза ПГ |
|
Циклооксигеназа-1 (ЦОГ – 1) |
Принимает участие в нормальных физиологических клеточных реакциях и регулирует функцию желудка, почек и других органов.
Гомеостатическая
- активация тромбоцитов,
- регуляция функции почек,
- цитопротективная,
- дифференцировка макрофагов.
Патологическая
|
|
Циклооксигеназа-2 (ЦОГ – 2) |
Принимает участие в синтезе провоспалительных ПГ.
Патологическая
- воспаление,
- боль,
- лихорадка,
- нарушение пролиферации.
Гомеостатическая
- репаративные процессы в тканях,
- физиологическая репродукция функции почек,
- ремоделирование костной ткани,
- функции поджелудочной железы,
- сосудистый тонус.
|
|
|
|
|
|
|
Наконец, подавление циклооксигеназной активности может потенциально способствовать переключению метаболизма арахидоновой кислоты на липооксигеназный путь, вызывая повышение продукции лейкотриенов (ЛТ). Гиперпродукция ЛТ обуславливает развитие у некоторых больных, получающих НПВП, бронхоспазма и других реакций немедленной гиперчувствительности. Полагают, что гиперпродукция ЛТ В
4 в желудке может являться одной из причин развития сосудистого воспалительного компонента язвенного поражения ЖКТ. Это объясняет мощный профилактический эффект синтетического простагландина (мизопростола) при НПВП – индуцированных гастропатиях.
Эффекты, возникающие при блокаде ЦОГ, представлены в таблице №4.
| Таблица №4. Эффекты, возникающие при блокаде ЦОГ |
| Блокада ЦОГ-1
|
- Нарушение слизисто-бикарбонатного барьера, снижение репаративных процессов в слизистой (за счет подавления синтеза простагландинов в желудке);
- Нарушение агрегации тромбоцитов, кровоточивость (вследствие подавления синтеза тромбоксана А2);
- Разнообразные нарушения функции почек, особенно у больных с сопутствующей почечной патологией (за счет подавления синтеза почечных ПГ).
|
| Блокада ЦОГ-2
|
- Подавление воспаления, боли, лихорадки (снижение синтеза ПГ, участвующих в развитии воспаления);
- Сосудистые эффекты (подавление синтеза ПГ-I2 клетками сосудистого эпителия и отсутствие влияния на синтез TxА2) противоположны действию низких доз аспирина;
- Нарушение физиологической регуляции электролитного баланса.
|
| Блокада ЦОГ |
- Переключение метаболизма арахидоновой кислоты с циклооксигеназного на липоксигеназный путь (при этом увеличивается продукция ЛТ);
- Развитие бронхоспазма и других реакций немедленной гиперчувствительности (за счет гиперпродукции ЛТ);
- Способствует возникновению сосудистого воспалительного компонента язвы, замедляет процессы рубцевания язв.
|
Наряду с влиянием на медиаторные системы НПВП оказывают мембраностабилизирующее действие, снижают проницаемость клеточных и субклеточных мембран, уменьшают сосудистую проницаемость. Предполагается, что, являясь анионными липофильными молекулами, НПВП проникают в фосфолипидный биослой и изменять вязкость клеточных мембран. Благодаря снижению проницаемости мембран митохондрий уменьшается поступление энергии в очаг воспаления. При этом возникает нарушение взаимодействия процессов гликолиза и окислительного фосфорилирования, что приводит к недостатку макроэргических субстратов (АТФ) в зоне воспаления. Стабилизация мембран лизосом препятствует высвобождению из них протеолитических ферментов (гидролаз).
К эффектам НПВП, которые, как полагают, непосредственно не связаны с их антипростагландиновой активностью, относятся также следующие:
1) подавление воспалительного процесса в тканях за счет воздействия НПВП на центральные механизмы развития периферического воспаления, а также пирогенные реакции. В частности, показано, что ацетилсалициловая кислота и салициловый натрий (но не индометацин) подавляют развитие воспалительного отека конечностей при введении препаратов в латеральный желудочек мозга. Аналогичные дозы салицилатов и индометацина в кровяном русле не оказывали противовоспалительного действия. Этот эффект не был связан с системным антипростагландиновым действием;
2) усиление Т-клеточной пролиферации и синтеза ИЛ-2 лимфоцитами, что сочетается с повышением уровня внутриклеточного кальция;
3) подавление хемотаксиса и агрегации нейтрофилов, угнетение образования супероксидных радикалов лейкоцитами. Считается, что НПВП могут предотвращать клеточную активацию лейкоцитов на ранних этапах воспаления, проникая в фосфолипидный биослой и изменяя вязкость их клеточных мембран. Этот эффект может реализовываться за счет прерывания передачи активационных сигналов на уровне G- аденозинтрифосфатсвязывающего белка;
4) подавление активности фосфолипазы А и синтеза ИЛ-1 моноцитами.
5) некоторые токсические реакции, такие, как гепатит, реакции со стороны ЦНС (шум в ушах, депрессия, менингит, дезориентация) и почек (интерстициальный нефрит) также не связаны с ПГ-зависимыми механизмами действия НПВП.
Таким образом, противовоспалительный эффект НПВП опосредуется двумя независимыми механизмами: при низких концентрациях НПВП – за счет подавления активности фермента циклооксигеназы (ЦОГ), а в высоких (противовоспалительных) концентрациях за счет блокады комплекса арахидоната с G-аденозинсвязывающим белком и подавления клеточной активации. На фазу альтерации НПВП практически не влияют.
В последние годы был установлен новый молекулярный механизм действия НПВП, возможно, имеющий наиболее важное значение в реализации противовоспалительной и иммуномодулирующсй активности этих препаратов (исследования Е. Корр и S. Ghosh, 1994). Оказалось, что салициловая кислота и аспирин в терапевтических концентрациях подавляют активацию фактора транскрипции (NF-kB) в Т-лимфоцитах. Известно, что фактор транскрипции NF-kB, присутствует и в цитоплазме эукариотических клеток. Под влиянием различных провоспалительных стимулов, таких как, бактериального липополисахарида, ИЛ-1, ФНО и других происходит перемещение фактора транскрипции NF-kB из цитоплазмы в ядро, где NF-B связывается с ДНК и регулирует транскрипцию нескольких генов. Большинство из этих генов кодируют синтез молекул, принимающих участие в развитии воспаления и иммунных реакциях, в частности, цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ИФ-g, ФНО-α) и молекул клеточной адгезии (межклеточной молекула адгезии-1 (ICAM-l), эндотелиально-лейкоцитарная молекула адгезии-1 (ЕLAM-1), сосудистая молекула адгезии-1 (VCAM-1). Примечательно, что подобный механизм действия имеют ГКС, что позволяет по-новому оценить терапевтические возможности использования НПВП.
Фармакодинамические эффекты НПВП
Все НПВП обладают одинаковыми фармакологическими свойствами: неспецифическим противовоспалительным действием, которое не зависит от этиологии и нозологии воспалительного процесса, жаропонижающим и анальгезирующим (обезболивающим) эффектами. Они оказывают тормозящее влияние на агрегацию тромбоцитов. Основные эффекты и механизмы, лежащие в их основе, отражены в таблице №5.
Противовоспалительное действие НПВП проявляется преимущественно в виде антиэкссудативного эффекта. Их действие обусловлено преимущественно влиянием на обмен биологически активных аминов. К биологически активным аминам относят гистамин, серотонин, кинины, простагландины. НПВП блокируют соответствующие рецепторы, являясь конкурентами по отношению к биологически активным аминам, либо снижают активность ферментативных систем, участвующих в синтезе, депонировании, высвобождении и превращении этих веществ. Антипролиферативная активность НПВП связана с их способностью подавлять синтез белков соединительной ткани, в частности, синтез нуклеиновых кислот и коллагена. Это приводит к нарушению образования соединительной ткани и торможению образования ревматических гранулем. Антипролиферативное действие НПВП объясняется также тем, что, ограничивая экссудацию, они препятствуют попаданию в ткань факторов плазмы крови, которые стимулируют повышение активности гуанилатциклазы и накопление цГМФ и увеличивают синтез коллагена фибробластами. Кроме того, они ограничивают активность в очаге воспаления серотонина и брадикинина, которые также стимулируют образование фибробластов. НПВП снижают синтез кислых мукополисахаридов, предотвращая оседание на их поверхности белков экссудата (альбуминов, фибриногена), а, следовательно, препятствуют развитию гиалиноза, фибриноидной фазы воспаления и дезорганизации соединительной ткани. По выраженности противовоспалительного действия НПВП уступают ГКС.
Жаропонижающий эффект
Развитие гипертермии (лихорадки) является следствием повышенного образования и накопления ПГ-Е
1 в цереброспинальной жидкости, который повышает активность аденилатциклазы мембран нейронов гипоталамуса. Усиление активности аденилатциклазы приводит к накоплению в нейронах гипоталамуса цАМФ, повышает функциональную их активность и, тем самым, способствует повышению температуры. Повышение температуры может отмечаться также в результате активности пирогенов, которые образуются в гранулоцитах, моноцитах, звездчатых ретикулоэндотелиоцитах при взаимодействии с вирусами, микроорганизмами и их токсинами. Оказалось, что многие цитокины, включая ИЛ-l, ФНО-α, ИЛ-6, макрофагальный воспалительный белок-1 и ИФ-g, также обладают активностью эндогенных пирогенов, и увеличение синтеза одного или нескольких из перечисленных выше цитокинов может индуцировать лихорадку. Эффект цитокинов опосредован через синтез ПГ, предполагается, что жаропонижающий эффект НПВП обусловлен их антицитокиновой и антипростагландиновой активностью. Жаропонижающий эффект НПВП заключается в снижении повышенной, но не нормальной температуры тела. Этим действие НПВП отличается от гипотермических эффектов аминазина, галоперидола и других лекарственных средств, которые снижают как повышенную, так и нормальную температуру тела. Механизмы жаропонижающего действия НПВП представлены в таблице №5.
| Таблица №5. Фармакодинамические эффекты НПВП |
|
Эффекты
|
Механизмы, лежащие в основе данного эффекта
|
| Противовоспалительное действие
1.1 Антиэкссудативный эффект
|
- Угнетение синтеза простагландинов за счет блокады ЦОГ;
- Угнетение синтеза гистамина путем подавления активности гистидиндекарбоксилазы;
- Угнетение синтеза серотонина за счет снижения активности 5-гидроксилтриптофандекарбоксилазы;
- Угнетение синтеза кининов, в частности брадикинина;
- Снижение проницаемости сосудистой стенки, в частности, капилляров;
- Уменьшение выброса биологически активных аминов (гистамина, серотонина, кининов и простагландинов) из тучных клеток;
- Снижение интенсивности процессов энергообразования в очаге воспаления;
- Мембраностабилизирующее действие, за счет повышения вязкости биомембран;
- Подавление периферического воспаления за счет центральных механизмов;
- Усиление Т- клеточной пролиферации и синтеза ИЛ-2 лимфоцитами;
- Подавление активации нейтрофилов и клеточной активации за счет блокады комплекса арахидоната с G-аденозинсвязывающим белком;
- Подавление активации фактора транскрипции (NF-kB) в Т-лимфоцитах, что нарушает синтез молекул, принимающих участие в развитии воспаления и иммунных реакциях, в частности, цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ИФ-g, ФНО-а) и молекул клеточной адгезии (межклеточной молекулы адгезии – 1 (ICAM – l), эндотелиально-лейкоцитарной молекулы адгезии-1(ЕLAM-1), сосудистой молекулы адгезии-1 (VCAM-1).
|
| 1.2 Антипролиферативный эффект (при применении НПВП в больших дозах).
|
- Нарушение метаболизма белков соединительной ткани, в частности, синтеза нуклеиновых кислот и коллагена, что приводит к нарушению образование соединительной ткани и торможению образования ревматических гранулем.
|
| 2.Жаропонижающий эффект.
|
- За счет снижения образования и накопления ПГ-Е1 в цереброспинальной жидкости. При их накоплении активируется аденилатциклаза мембран нейронов гипоталамуса, повышается их функциональная активность и, тем самым, повышается температура;
- Путем подавления активности пирогенов в гранулоцитах, моноцитах, звездчатых ретикулоэндотелиоцитах при взаимодействии с вирусами, микроорганизмами и их токсинами;
- За счет снижения синтеза цитокинов, включая ИЛ-l, ФНО-α, ИЛ-6, макрофагальный воспалительный белок-1 и ИФ-g, обладаюших активностыо эндогенных пирогенов.
|
| 3.Анальгезирующий
|
- Снижение чувствительности болевых рецепторов (ноцицепторов) к медиаторам боли (брадикинину, гистамину, серотонину). Это связывают с подавлением образования и накопления ПГ-Е2 и простациклина, которые стимулируют в мембране чувствительных окончаний накопление аденилатциклазы и цАМФ, что ведет к накоплению в окончаниях ионов кальция и обуславливает поступление болевых импульсов в ЦНС;
- Влияние на центральные механизмы боли.
|
| 4.Антиагрегационный |
- Подавление адгезии и агрегации тромбоцитов.
|
Анальгезирующий эффект
Боль при ревматических и других заболеваниях определяется двумя основными механизмами: раздражением свободных нервных окончаний (ноцицепторов) медиаторами, высвобождающимися при повреждении тканей и/или патологическими нарушениями в нервной системе. Ноцицепторы представляют собой свободные нервные окончания периферических А-дельта и С-волокон, тела которых располагаются преимущественно в спинномозговых узлах и узле тройничного нерва. Прямыми стимуляторами, действующими непосредственно на ноцицепторы, являются брадикинин, гистамин, серотонин, ионы кальция, водорода, ПГ-Е
2, ПГ-Е
1,
ПГ-I
2, аденозин. Веществами, которые увеличивают чувствительность ноцицепторов к «болевым» стимулам (опосредованное влияние) – брадикинин, норадреналин, лейкотриен В
4, ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α, аминотерминальный октапептид фактора роста нервов. В составе задних корешков с помощью слабомиелинезированных А-дельта и демиелинизированных волокон – С-афферентов возбуждение направляется в спинной и продолговатый мозг, где происходит его передача на ноцицепторы 2 порядка. Субстанции, участвующие в передаче болевых ощущений на ноцицепторы 2 порядка, включают субстанцию-Р, серотонин, энкефалины, нейрокинины А и В, пептид, связанный с геном кальцитонина (кокальцигенин), некоторые возбуждающие аминокислоты (глютаминовая, аспарагиновая). Субстанция Р обнаруживается более, чем в 90% нейронов, содержащих глутаминовую кислоту, и является ключевым медиатором боли в ноцицептивных нейронах задних рогов спинного мозга (полимодальных ноцицепторы). К эндогенным опиоидным пептидам относят энкефалины, бетаэндорфин, динорфин. Примечательно, что многие из них играют фундаментальную роль в развитии воспаления при ревматических заболеваниях. Ноцицептивные нейроны дорзальных рогов спинного мозга формируют восходящие тракты (спиноталамический, спиноретикулярный, спиномезенцефалический), осуществляющие проведение ноцицептивных сигналов к различным подкорковым отделам головного мозга и ядрам таламуса, где находятся центры болевой чувствительности. От таламических ядер болевые сигналы поступают в кору больших полушарий (соматосенсорная зона, кора островка, передняя часть поясной извилины, переднелобные отделы коры больших полушарий и заднюю часть теменной коры), которая является высшим интегративным звеном нолцицептивной системы и осуществляет оценку болевых сигналов, формируя ощущения, связанные с локализацией, интенсивностью и характером болевого ощущения. Ассоциативные области коры больших полущарий (кора островка, передняя часть поясной извилины, префронтальная кора и задняя часть теменной коры),обеспечивают формирование психических компонентов боли и связанного с ней адекватного поведения. В свою очередь имеются двухсторонние связи между корой и таламусом, структурами лимбической системы, ретикулярной формацией мозга, гипоталамусом, что обеспечивает включение не только сенсорных и мотивационно – эффективных механизмов, но также и памяти, вегетативные реакции.
Ноцицептивные болевые синдромы возникают вследствие активации ноцицепторов при травме, воспалении, ишемии, отеке тканей. Клинически среди них выделяют посттравматический и послеоперационный болевой синдромы, боли при воспалении суставов, миофасциальные болевые синдромы, сосудистую боль, боли у онкологических пациентов другие. Механизмы анальгезирующего действия НПВП представлены в таблице №5. Обезболивающий эффект всех НПВП проявляется в дозах меньших, чем их противовоспалительный эффект.
Несмотря на традиционное стремление ревматологов рассматривать боль лишь как клинический симптом определенного патологического состояния, во многих случаях природа болевых ощущений не поддается четкой нозологической трактовке. Хорошо известно отсутствие четкой связи между интенсивностью боли и объективными признаками поражения органов и тканей. Например, выраженностью болей в суставах и позвоночнике и рентгенологическими изменениями или активностью синовита, миалгией и выраженностью воспаления и некроза в мышечной ткани. Природа болей при некоторых ревматических заболеваниях (фибромиалгия, миофасциальный болевой синдром и др.) не ясна и, вероятно, связана с нарушением механизмов восприятия боли на уровне ЦНС или имеет психогенную основу. Кроме того, в начале заболевания боль может иметь ноцицептивную природу, но ее персистирование и изменение интенсивности нередко наблюдаются в отсутствии очевидных ноцицептивпых стимулов и могут быть связаны с аффективными расстройствами (тревога, депрессия).
По характеру условно выделяют боли: острые, хронические не злокачественные и хронические злокачественные. При ревматических заболеваниях боль наиболее четко соответствует характеристикам первых двух категорий. Боль обычно сочетается с признаками воспаления суставов, мягких тканей и/или мест прикрепления сухожилия к кости, реже имеет биомеханический или неврогенный характер. Характеристика болей при заболеваниях опорно-двигательного аппарата представлена в таблице №6.
| Таблица №6. Характеристика болей при заболеваниях опорно-двигательного аппарата |
| Характеристика болей |
Заболевания опорно-двигательного аппарата |
| Начало болей |
Варианты заболевания |
| острое |
- “несуставной” ревматизм (тендинит, бурсит, травма),
- микрокристаллические артриты (подагра, псевдоподагра),
- септический артрит,
- анкилозирующий спондилоартрит (нередко постепенно с болей в спине) – болезнь Бехтерева,
- болезнь Рейтера,
- псориатический артрит,
- ревматическая лихорадка.
|
| постепенное |
- ревматоидный артрит (в 10% случаев острое начало),
- остеоартроз
|
| Продолжительность болевого синдрома |
| 1-2 дня |
- травма,
- подагра,
- псевдоподагра,
- инфекционный артрит,
- палиндромный ревматизм,
- болезнь Рейтера
|
| 2-7 дней |
- ревматоидный артрит,
- остеоартроз
|
| >7 дней |
- ревматоидный артрит,
- остеоартроз,
- ревматическая лихорадка,
- фибромиалгия
|
| Характеристика артрита |
| Моноартрит |
- травма
- подагра
- псевдоподагра,
- инфекционный артрит (включая гонококковый),
- ювенильный ревматоидный артрит,
- остеоартроз,
- артрит, связанный с травмой
|
| Полиартрит
симетричный |
- ревматоидный артрит,
- генарализованный остеоартроз.
|
| несимметричный |
- подагра,
- псориатический артрит,
- остеоартроз,
- болезнь Рейтера,
- травма,
- инфекционный артрит.
|
| мигрирующий |
|
Однако во многих случаях при ревматических заболеваниях боль связана одновременно с несколькими механизмами. Например, при остеоартрозе боль нередко имеет как биомеханическую, а также воспалительную и сосудистую природу и может ассоциироваться с психоэмоциональными нарушениями. Механизмы развития болей при остеоартрозе представлены в таблице №7.
| Таблица №7. Механизм развития боли при остеоартрозе |
| Ткань |
Механизм боли |
| субхондральная кость |
медулярная гипертензия, микропереломы,
воспаление |
| остеофиты |
растяжение нервных окончаний в периостиуме |
| связки |
растяжение |
| энтезисы |
воспаление |
| суставная капсула |
воспаление, растяжение |
| околосуставные мышцы |
спазм |
| синовиальная оболочка |
воспаление |
Одним из основных принципов терапии боли при воспалительных заболеваниях суставов является также устранение гиперальгезии, возникающей в очагах воспаления вследствие образования в очагах воспаления ПГ-Е
2 и ПГ-I
2 (простациклин). Последние потенциируют раздражение чувствительных рецепторов, вызываемое другими медиаторами воспаления: брадикинином, гистамином, серотонином. ПГ-Е
2 и простациклин стимулируют в мембране чувствительных окончаний аденилатциклазу. При этом увеличивается содержание цАМФ в чувствительных рецепторах, что приводит к накоплению в окончаниях ионов кальция и способствует поступлению болевых импульсов в ЦНС.
Следует отметить, что анальгетическое действие некоторых НПВП, в отличие от их противовоспалительного эффекта, не может быть полностью объяснено только подавлением синтеза простагландинов. Имеются данные о влиянии НПВП на центральные механизмы боли, не связанные с угнетением синтеза ПГ. Показано, что диклофенак вызывает лечебный эффект путем воздействия на ноцицепторы, отвечающие за болевую чувствительность в ЦНС, а также оказывает центральное опиоидноподобное антиноцицептивное действие.
Анальгезирующий эффект НПВП в большей степени проявляется при болях слабой и средней интенсивности, которые локализуются в мышцах, суставах, сухожилиях, нервных стволах, а также при головной или зубной боли. При сильных висцеральных болях большинство НПВП менее эффективны и уступают по силе анальгезирующего действия препаратам группы морфина (наркотическим анальгетикам).
В то же время, в ряде контролируемых исследований показана достаточно высокая анальгетическая активность
диклофенака,
кеторолака,
кетопрофена,
метамизола при коликах и послеоперационных болях. Эффективность НПВП при почечной колике, возникающей у больных мочекаменной болезнью, во многом связана с торможением продукции ПГ-E
2 в почках, снижением почечного кровотока и образования мочи. Это ведет к уменьшению давления в почечных лоханках и мочеточниках выше места обструкции и обеспечивает длительный анальгезирующий эффект. Преимуществом НПВП перед наркотическими анальгетиками является то, что они не угнетают дыхательный центр, не вызывают эйфорию и лекарственную зависимость, а при коликах имеет значение еще и то, что они не обладают спазмолитическим действием.
Антитромбоцитарный эффект
Под влиянием АСК и в значительно меньшей степени других НПВП ослабляется агрегационный ответ тромбоцитов на различные тромбогенные стимулы, такие как, АДФ, коллаген, норадреналин и арахидонат. АСК в тромбоцитах блокирует синтез тромбоксана А
2 (ТхА
2).
ТхА
2 является мощным эндогенным вазоконстриктором и способствует агрегации тромбоцитов. АСК. напротив, необратимо подавляет активность ЦОГ и гидропероксида, необходимых для синтеза тромбоксана А
2. Установлено, что тромбоциты особенно чувствительны к АСК. Так однократный прием 100 мг аспирина приводит к снижению сывороточной концентрации тромбоксана на 98% в течение 1 часа. Полагают, что, кроме антиагрегационного действия, аспирин подавляет синтез витамин-К-зависимых факторов свертывания, стимулирует фибринолиз. В тоже время АСК угнетает ЦОГ – зависимую продукцию простациклина эндотелием сосудистой стенки. Снижение выработки простациклина может ухудшать тромборезистивную функцию сосудистой стенки. Однако в отличие от ЦОГ тромбоцитов синтез простациклина после приема аспирина восстанавливается (обратимое действие). Все это, вместе взятое, создало предпосылки к использованию именно АСК для профилактики тромботических нарушений при различных заболеваниях.
Влияние НПВП на клетки иммунной системы
НПВП снижают фагоцитарную активность нейтрофилов, макрофагов, тормозят их миграцию в очаг воспаления, ингибируют выработку провоспалительных цитокинов и медиаторов. Снижая проницаемость капилляров, НПВП затрудняют контакт иммунокомпетентных клеток с антигеном и контакт антител с субстратом. Таким образом, иммуносупрессивный эффект имеет “вторичный” характер, выражен умеренно и проявляется только при длительном применении.
Влияние НПВП на функцию хондроцитов.
Все НПВП по влиянию на процессы биосинтеза хряща делятся на 3 группы: оказывающие стимулирующие действие (сургам, целекоксиб), нейтральные (диклофенак, пироксикам, ибупрофен, парацетамол) и угнетающие синтез хрящевой ткани (аспирин, индометацин, бутадион, Реопирин).
Фармакокинетика НПВП
НПВП являются в большинстве случаев производными слабых органических кислот и обладают общими фармакологическими характеристиками. В частности, они хорошо всасываются в ЖКТ. Все НПВП (кроме салицилатов и индометацина), более чем на 98% связываются с альбумином плазмы, вытесняя при этом некоторые другие лекарственные средства, а у новорожденных – билирубин, что может привести к развитию билирубиновой энцефалопатии. В этом отношении наиболее «опасными» считаются салицилаты и
фенилбутазон.. Поэтому при развитии гипоальбуминемии, печеночной или почечной недостаточности необходимо уменьшать дозу препарата. Метаболизм большинства НПВП происходит в печени с образованием метаболитов, часть из которых может обладать противовоспалительной активностью (например, сулиндак) и выделяются через почки частично в виде метаболитов и в неизмененном виде.Основные фармакокинетические параметры НПВП представлены в таблице №8.
| Таблица№8. Фармакокинетические параметры НПВП |
Препарат
|
Связь с белками, % |
Vd*, л/кг |
Т1/2 ,час |
Экскреция, % |
Биотрансфор-мация |
| ацеклофенак |
99 |
0,25 |
4 |
с мочой 40-65, с калом-20 |
в печени |
| диклофенак |
99 |
0,12 |
2-3 |
с с мочой 40-65, с калом -35 |
в печени |
| индометацин |
90 |
0,12 |
6 |
с мочой-60, неизмен.-20 |
в печени |
| ибупрофен |
99 |
– |
2-2,5 |
с мочой -1 |
в печени |
| кетопрофен |
98,7 |
0,11 |
1,5 |
с мочой -80 |
в печени |
| напроксен |
99 |
0,10 |
12-15 |
с мочой -95 |
в печени |
| пироксикам |
99 |
0.12-0.15 |
45 |
с мочой -66 |
в печени |
| сулиндак |
95 |
– |
16 |
– |
– |
| флурбипрофен |
99 |
0,10 |
3-4 |
с мочой -90 |
в печени |
| фенилбутазон |
98-99 |
0,17 |
50-100 |
– |
– |
Vd*-условный параметр, характеризующий степень захвата препарата тканями из плазмы крови.
Известно, что НПВП являются рацематическими смесями лево (S) – и правовращающих (R) изомеров, и их фармакологические свойства могут отличаться и зависеть от соотношения энантиомеров. Например, ибупрофен является рацемической смесью лево- и правовращающих изомеров, причем R-изомер в основном и определяет анальгезирующий потенциал препарата. S-изомер флурбипрофена проявляет сильную анальгезирующую активность, но слабо подавляет синтез ПГ, а R-изомер, напротив, обладает более высокой противоспалительной активностью. В тоже время клиническое значение существования различных изомеров НПВП до конца не выяснено.
Фармакокинетика НПВП при их применении описывается двухкамерной моделью, где одной из камер являются ткани, а другой – синовиальная жидкость, Большинство НПВП хорошо проникают в синовиальную жидкость суставов (таблица №9). Как правило, НПВП в несколько раз медленнее накапливаются в полости пораженного сустава, но и элиминация препаратов из суставов также замедленна. Кинетика препаратов у больных ревматическими заболеваниями отличается от кинетики тех же НПВП у здоровых лиц. При этом эффективность препарата непосредственно связана с созданием оптимальных концентраций лекарственного средства в пораженном суставе.
| Таблица№9. Концентрация НПВП в синовиальной жидкости при ревматических заболеваниях |
| Название
НПВП |
Заболевание |
Коэффициент
синовиальная жидкость/
плазма, мин
|
Период полувыведения
синовиальная жидкость/
плазма, мин. |
| АСК |
РА |
45/30 |
36/16 |
| ибупрофен |
РА/ОА |
210\90 |
180\130 |
| флурбипрофен |
РА |
360/90 |
230\230 |
| кетопрофен |
РА |
180-360/60 |
Не известно/100 |
| напроксен |
РА/ОА |
– |
– |
| индометацин |
РА |
120/60 |
540/60 |
| диклофенак |
РА/ОА |
240/60 |
– |
Все НПВП принято разделять на две основные категории: короткоживущие (Т
1/2 не более 4-5ч.) и длительноживущие (Т
1\2 – 12ч. и более.). Короткоживущие НПВП способствуют более быстрому наступлению клинического эффекта, чем длительноживущие. При этом синовиальная концентрация длительноживущих препаратов коррелирует с уровнем в сыворотке, а при приеме короткоживущих препаратов она сначала низкая, но затем существенно нарастает и может превышать сывороточную концентрацию. Поэтому короткоживущие препараты длительно сохраняют клиническую эффективность.
Показания к клиническому применению НПВП
1. Ревматические заболевания: ревматизм (ревматическая лихорадка), ревматоидный артрит (РА), подагрический и псориатический артриты, анкилозирующий спондилит (болезнь Бехтерева), синдром Рейтера.
Следует учитывать, что при ревматоидном артрите НПВП оказывают преимущественно симптоматический эффект, не влияя на течение заболевания. Они не способны приостановить прогрессирование процесса, вызвать ремиссию и предупредить развитие деформации суставов, поэтому относятся к . В то же время, облегчение, которое НПВП приносят больным ревматоидным артритом, настолько существенно, что ни один из них не может обойтись без этих препаратов. При больших коллагенозах (системная красная волчанка, склеродермия и другие) НПВП часто малоэффективны.
2. Неревматические заболевания опорно-двигательного аппарата – остеоартроз, миозит, тендовагинит, травма (бытовая, спортивная). Нередко при этих состояниях эффективно применение местных лекарственных форм НПВП (мази, кремы, гели).
Основные показания к назначению НПВП в качестве средств патогенетической терапии представлены в таблице № 10.
| Таблица №10. Патогенетическая терапия НПВП |
Острый артрит
- Подагра;
- Псевдоподагра;
- Обострение хронических заболеваний суставов (РА, остеоартроз, спондилоартриты):
- Острый артрит при неревматических заболеваниях.
Хронический артрит
- Остеоартроз;
- Ревматоидный артрит (РА);
- Серонегативные спондилоартриты;
- Артриты при других ревматических болезнях и неревматических заболеваниях.
|
| Симптоматическая терапия |
- Неврологические заболевания. Невралгия, радикулит, ишиас, люмбаго;
- Почечная и печеночная колика;
- Болевой синдром различной этиологии (головная и зубная боль, послеоперационные боли, дисменорея, при воспалительных офтальмологических заболеваниях, шоке, периодонтите, спортивных травмах и лечении осложнений химиотерапии злокачественных новообразований);
- Дисменорея;
- Мигрень;
- Лихорадка (как правило, при температуре тела выше 38,5°С);
- Профилактика артериальных тромбозов.
Дополнительные показания
- Плеврит;
- Перикардит;
- Узловая эритема;
- Поликистоз легких;
- Полипоз толстой кишки;
- Болезнь Альцгеймера.
|
Симптоматическая терапия различных болевых синдромов.
1. НПВП широко используются в лечении мигрени. Полагают, что они являются средством выбора у больных с умеренными или выраженными мигренозными атаками, так как могут уменьшать тяжесть и продолжителыность головных болей и фотофобии. В этом отношении напроксен оказался более эффективным, чем эрготамин. Сходный эффект дают аспирин и другие НПВП. Для достижения более выраженного действия в отношении тошноты и рвоты рекомендуется комбинировать НПВП с метоклопрамидом, ускоряющим их абсорбцию. Для быстрого купирования мигренозных приступов рекомендуется также кеторолак. Препарат можно вводить парентерально. Предполагается, что эффективность НПВП при мигрени связана с их способностью, подавляя синтез ПГ, снижать интенсивность нейрогенного воспаления или уменьшать выраженность сосудистого спазма.
2. При дисменорее НПВП применяют для уменьшения выраженности менструальных спастических реакций, связанных с повышением тонуса матки, вследствие гиперпродукции ПГ-Е
2.
Помимо анальгезирующего действия НПВП уменьшают объем кровопотери. Хороший клинический эффект отмечен при применении напроксена, диклофенака, ибупрофена и кетопрофена. НПВП назначают при первом появлении болей 3-х-дневным курсом накануне месячных. Нежелательные реакции, учитывая кратковременный их прием отмечаются редко.
Противопоказания для применения НПВП
- Эрозивно-язвенные поражения желудочно-кишечного тракта, особенно в стадии обострения;
- При выраженных нарушениях функции печени и почек;
- Цитопении, тромбоцитопении, анемии;
- При индивидуальной непереносимости;
- Беременность. При необходимости, наиболее безопасными (но не перед родами!) являются небольшие дозы аспирина.
Предупреждения
- НПВП должны с осторожностью назначаться больным бронхиальной астмой, а также лицам, у которых ранее выявлялись нежелательные реакции при приеме любых других НПВП.
- Для больных гипертензией или сердечной недостаточностью следует выбирать те НПВП, которые в наименьшей степени влияют на почечный кровоток.
- У лиц пожилого возраста необходимо стремиться к назначению минимальных эффективных доз и коротких курсов НПВП.
- Индометацин и фенилбутазон не следует назначать амбулаторно лицам, профессии которых требуют повышенного внимания.
Тактика применения НПВП
Выбор НПВП
Дифференцированный выбор НПВП основывается на знании фармакокинетических и фармакодинамических особенностей действия отдельных препаратов и носит, в целом, эмпирический характер. При лечении РА принципиальным является назначение препаратов, обладающих выраженной противовоспалительной активностью (диклофенак натрия, индометацин и т.д.). Хотя достоверных различий между аспирином и другими НПВП при РА не выявлено, однако они становятся значимыми при анализе эффективности различных НПВП у отдельных больных.
При выборе “стандартных” НПВП для лечения ОА предпочтение следует отдавать препаратам, которые обладают высокой анальгезирующей активностью и низкой токсичностью. До настоящего времени современным мировым стандартом лечения и препаратом сравнения при проведении сравнительных клинических исследований при ОА считается диклофенак (75-150 мг/день). В тоже время при выборе НПВП для лечения ОА, который преимущественно развивается у лиц пожилого возраста, следует учитывать факторы риска возникновения побочных реакций. В частности, наличие “язвенного” анамнеза, сердечной недостаточности, артериальной гипертензии, прием непрямых антикоагулянтов и низких доз аспирина, а также возможное негативное влияние препарата на хрящевую ткань, совместимость с другими лекарственными средствами. Хотя единого мнения о воздействии НПВП на гиалиновый хрящ нет, но по последним обобщенным данным, индометацин и салицилат натрия подавляют синтез компонентов матрикса хряща, а мелоксикам, нимесулид, целекоксиб увеличивают синтез компонентов матрикса хряща и предотвращают апоптоз хондроцитов. Наибольшими негативными свойствами на хрящевую ткань среди НПВП обладает пироксикам и индометацин, в связи с чем, их применение следует максимально ограничить при наличии хотя бы одного из перечисленных факторов риска побочных реакций. В клинических исследованиях отрицательное влияние на течение ОА подтверждено только для индометацина, в связи с чем, он не показан для терапии данного заболевания. Очень высок риск возникновсния тяжелых гастроэнтерологических осложнений у кеторолака триметамина, поэтому его постоянное применение с целью уменьшения “хронической” боли нежелательно.
При наличии болевого синдрома при ОА следует, в первую очередь, назначать препараты короткого действия, которые обладают высокой анальгезирующей активностью и умеренной токсичностью. Этим критериям соответствуют: калиевая соль диклофенака, кетопрофен, лорноксикам, напроксен-натрий, ибупрофен. Для этих препаратов характерно быстрое всасывание (пиковая концентрация в плазме достигается через 1-1,5 ч), короткий период полувыведения (около 5 ч.), отсутствие кумуляции и энтеропеченочной рециркуляции, легкое проникновение и длительное накопление в зоне воспаления, “сбалансированное” ингибирование ЦОГ-1 и ЦОГ-2, а также наличие центрального анальгезирующего действия. Эти так называемые, «неселективные» НПВС предназначены, в первую очередь, больным при наличии выраженного болевого синдрома (хронических и особенно острых болях) при отсутствии у них факторов риска развития нежелательных побочных эффектов, прежде всего со стороны ЖКТ и почек. При выборе НПВП следует обязательно учитывать не только наиболее эффективный препарат, но оценивать его переносимость.
Одним из наиболее существенных достижений в фармакотерапии боли и воспаления явилась разработка нового класса НПВП, так называемых коксибов или «специфических ингибиторов ЦОГ-2». Целекоксиб – первый коксиб, внедренный в клиническую практику. Результаты исследования, в которое было включено 8000 больных остеоартрозом и ревматоидным артритом, свидетельствовали об очень высокой безопасности и эффективности целекоксиба. Препарат продемонстрировал достоверное снижение частоты симптоматических и тяжелых гастроэнтерологических побочных эффектов (эндоскопически выявляемые язвы) и осложнений (перфоративные язвы, обструкция, кровотечение) на фоне лечения целекоксибом. По сравнению с другими НПВП, такими как диклофенак и ибупрофен, отмечена крайне низкая частота печеночных и почечных побочных эффектов, которые нередко являлись причиной прерывания лечения нимесулидами. Общая частота прерывания лечения и связи с неэффективностью или развитием побочных эффектов была достоверно ниже у больных, принимавших целекоксиб, чем другие НПВП. Результаты, касающиеся применения целекоксиба в течение первых 6 месяцев после регистрации в США, показали, что частота гастроэнтерологических побочных эффектов (0,01% на 100 пациентов в год) была сопоставима с таковой у больных, которые вообще не принимали НПВП (данные системы регистрации побочных эффектов лекарственных препаратов Комитета по контролю за лекарственными препаратами). Специфические ингибиторы ЦОГ-2 (целекоксиб) и селективные ингибиторы ЦОГ-2 – нимесулид, мелоксикам показаны больным с хроническими болями и высоким риском развития побочных эффектов (препараты выбора), особенно при наличии патологии со стороны ЖКТ (эрозивно-язвенные поражения желудка и 12-перстной кишки в анамнезе).
НПВП наиболее эффективные при лечении остеоартроза, отражены в таблице №11.
| Таблица №11. НПВП наиболее эффективные при лечении остеоартроза |
|
| Название |
Фармакокинетика |
Диапазон
доз, мг/день
|
Совмести-
мость с
другими
препаратами |
Кратность
приема |
|
| Начало действия, мин |
|
| диклофенак ибупрофен кетопрофен лорноксикам мелоксикам напроксен
нимесулид целекоксиб |
30
30
60-90
60-90
30-45
120-240
60-90
28-30 |
7 75-150
1200-2000
100-200
8-16
7,5-15
500-750
100-200
100-200 |
[3,5,6,7]*
[2,3,4,6,7]
[2,5,6]*
[2,3,4,5,6,7]
[1,2,3,4,5,6,7]
[1,2,3,4,5,6,7]
[3, 5]*
[2]* |
2-3
3-4
2-3
2
1
2-3
1-2
1-2 |
Примечание.
[ ]* – при совместном использовании необходим клинический и лабораторный мониторинг:
1 – антидепрессанты; 2 – непрямые антикоагулянты; 3 – бета-блокаторы; 4- оральные гипогликемические препараты; 5 – гипотензивные средства; 6 – диуретики; 7- сердечные гликозиды.
Все вышеизложенное диктует необходимость индивидуального подбора НПВП для каждого больного. При этом следует учитывать, что у больных, имеющих различные ревматические заболевания, наблюдаются существенные колебания в “ответе” на тот или иной препарат. Поскольку чувствительность больных к НПВП даже одной химической группы может варьировать в широких пределах, то неэффективность одного из препаратов еще не говорит о неэффективности других препаратов и группы в целом. При использовании НПВП в ревматологии, особенно при замене одного препарата другим, необходимо учитывать, что развитие противовоспалительного эффекта отстает по времени от появления анальгезирующего действия. Если анальгезирующий эффект отмечается в первые часы, то противовоспалительный – через 10-14 дней регулярного приема, а при назначении пироксикама или других оксикамов еще позднее.
Характеристика НПВП по выраженности анальгетической активности представлена в таблице №12.
| Таблица №12. Сравнительная характеристика анальгезирующего действия НПВП Drugs of Choice from the Medical Letter, 1995 |
| Препарат |
Разовая доза |
Интервал |
Макси-мальная сут.доза |
Примечание |
|
| АСК |
внутрь
500-1000 мг |
4-6 часов |
4000 мг |
Продолжительность действия после однократного приема 4 ч. |
|
| парацетамол |
внутрь
500-1000 мг |
4-6 часов |
4000 мг |
По эффективности равен АСК; 1000 мг обычно эффективнее, чем 650 мг; продолжительность действия 4 часа. |
|
| дифлунизал |
Внутрь
1-я доза – 1000 мг, далее по 500 мг |
8-12 часов |
1500 мг |
500 мг дифлунизала > 650 мг АСК или парацетамола, примерно равны комбинации парацетамол/кодеин; действует медленно, но продолжительно. |
|
| диклофенак-калий |
внутрь
50 мг |
8 часов |
150 мг |
Сравним с АСК, более длительное действие. |
|
| этодолак |
внутрь
200-400 мг |
6-8 часов |
1200 мг |
200 мг примерно равны 650 мг АСК, 400 мг > 650 мг АСК. |
|
| фенопрофен |
внутрь
200 мг |
4-6 часов |
1200 мг |
Сравним с АСК. |
|
| флурбипрофен |
внутрь
50-100 мг |
6-8 часов |
300 мг |
50 мг > 650 мг АСК;
100 мг > комбинации парацетамол/кодеин. |
|
| ибупрофен |
внутрь
200-400 мг |
4-8 часов
|
2400 мг |
200 мг = 650 мг АСК или парацетамола;
400 мг = комбинации парацетамол/кодеин. |
|
| кетопрофен |
внутрь
25-75 мг |
4-8 часов |
300 мг |
25 мг = 400 мг ибупрофена и > 650 мг АСК;50 мг>комбинации парацетамол/кодеин. |
|
| кеторолак |
внутримышечно
30-60 мг |
6 часов |
120 мг |
Сравним с 12 мг морфина, более длительное действие, курс не более 5 дней. |
|
| мефенамовая кислота |
внутрь
1-я доза -500 мг, далее 250 мг |
6 часов |
1250 мг |
Сравнима с АСК, но более эффективна при дисменорее, курс не более 7 дней. |
|
| напроксен |
внутрь
1-я доза – 500 мг, далее по 250 мг |
6-12 часов |
1500 мг |
250 мг примерно равны 650 мг аспирина, более медленное,но длительное действие;500 мг > 650 мг АСК, быстрота эффекта такая же, как у АСК. |
|
| напроксен-натрий |
внутрь
1-я доза – 550 мг, далее по 275 мг |
6-12 часов |
1375 мг |
275 мг примерно равны 650 мг АСК, более медленное, но длительное действие;
550 мг > 650 мг АСК, быстрота эффекта макая же, как у АСК. |
|
ДозировкаПрием любого НПВП в начале курса лечения следует начинать с наименьшей дозы, рекомендуемой при данном заболевании. При хорошей переносимости, обычно через 2-3 дня, суточную дозировку можно постепенно увеличивать (титровать) в течение 1 – 2 недель до эффективной дозы. При этом доза НПВП, которую получает больной, не должна превышать максимально рекомендуемые дозы. Увеличение суточных доз НПВП более чем в 2 раза, как правило, не сопровождается пропорциональным нарастанием противовоспалительного действия, но быстро приводит к развитию нежелательных побочных эффектов, которые носят дозозависимый характер. Поэтому при отсутствии эффекта от НПВП, необходимо решать вопрос о переводе больного на другие препараты, возможно также дополнительное назначение простых анальгетиков (парацетамола), что позволяет уменьшить потребность в НПВП. Рекомендуемые суточные дозы НПВП и кратность приема представлены в таблице № 13.
| Таблица № 13. Рекомендуемые дозы НПВП |
| Препарат |
Дозы (мг/день) |
Кратность приема |
| АСК |
1000 – 6000 |
2–4 |
| ацеклофенак |
200 |
2 |
| диклофенак натрия |
75 – 150 |
2–3 |
| диклофенак калия |
75 – 150 |
2–3 |
| диклофенак + мизопростол |
1 таблетка |
2–3 |
| ибупрофен |
1200 –2400 |
3-6 |
| индометацин |
50 – 200 |
2–4 |
| кетопрофен |
100 – 300 |
3–4 |
| кеторолак |
200 – 800 |
1–4 |
| лорноксикам |
8-16 |
2 |
| мелоксикам |
7,5-15 |
1 |
| напроксен |
500 –1 500 |
2-3 |
| нимесулид |
100-200 |
2 |
| пироксикам |
20-40 |
1 |
| сулиндак |
200 – 400 |
2 |
| флюрбипрофен |
100-300 |
3–4 |
| фенилбутазон |
300 – 800 |
1–4 |
| целекоксиб |
100-400 |
1–2 |
Время приема
При необходимости длительного курсового назначения (например, в ревматологии) НПВП следует назначать после приема пищи. Если препарат применяется для получения быстрого анальгезирующего или жаропонижающего эффекта предпочтительнее назначать их за 30 минут до или через 2 часа после еды, запивая 1/2-1 стаканом воды. В целях профилактики развития эзофагита после приема препарата в течение 15 минут желательно не ложиться.
Важным является также синхронизация назначения НПВП с ритмом клинической активности процесса. Это позволяет, используя меньшие дозы НПВП, повысить эффективность лечения, особенно при назначении препаратов с коротким периодом полувыведения. Момент приема НПВП может определяться также временем максимальной выраженности симптомов заболевания (боль, скованность в суставах), то есть с учетом хронофармакологии препаратов. При этом можно отходить от общепринятых схем (2-3 раза в день) и назначать НПВП в любое время суток, что нередко позволяет достичь большего лечебного эффекта при меньшей суточной дозе.
Например, при РА максимальная интенсивность скованности, болей в суставах и снижение силы сжатия кисти наблюдаются в утренние часы, в то время как при остеоартрозе симптомы усиливаются к вечеру. Имеются данные о том, что при РА прием флурбипрофсна ночное время дает более сильный обезболивающий эффект, чем в утреннее, дневное время или днем и вечером. При выраженной утренней скованности целесообразен, как можно более ранний (непосредственно после пробуждения), прием быстровсасывающихся НПВП или назначение длительнодействующих препаратов на ночь. Наибольшей быстротой всасывания в ЖКТ и, следовательно, более быстрым наступлением эффекта обладают
напроксен-натрий,
диклофенак-калий, водорастворимый (“шипучий”)
аспирин,
кетопрофен. Больным с ОА, у которых выраженность болей максимальна вечером и ранним утром, предпочтительнее назначать препараты с длительным периодом полувыведения перед сном. При этом НПВП следует назначать незадолго до максимального нарастания симптомов. Примечательно, что такой ритм приема приводит к существенному снижению частоты побочных эффектов НПВП.
Монотерапия
При приеме НПВП предпочтение следует отдавать монотерапии. Одновременное применение двух или более НПВП нецелесообразно по следующим причинам:
– эффективность таких комбинаций объективно не доказана;
– в ряде подобных случаев отмечается снижение концентрации препаратов в крови (например, АСК снижает концентрацию
индометацина,
диклофенака,
ибупрофена,
напроксена,
пироксикама), что ведет к ослаблению их эффекта;
– возрастает опасность развития нежелательных реакций. Исключением является возможность применения
парацетамола в сочетании с НПВП для усиления анальгезирующего эффекта. У некоторых больных два НПВП могут назначаться в разное время суток, например, быстровсасывающийся – утром и днем, а длительнодействующий – вечером.
Нежелательные побочные эффекты НПВП
Нежелательные эффекты НПВП могут быть связаны: (1) с основным механизмом действия ненаркотических анальгетиков – угнетением синтеза простагландинов путем ингибирования ЦОГ-1 (ульцерогенность, антиагрегантное действие, бронхоспазм, нефротоксическое и токолитическое действие); (2) с токсичностью молекул НПВП или их метаболитов (нефротоксичность фенацетина, гематотоксичность метамизола). Нежелательные (побочные ) эффекты НПВП представлены в таблице №14.
| Таблица №14.Нежелательные (побочные) эффекты НПВП |
| Побочный эффект |
Частота, % |
Комментарий |
| Со стороны пищеварительной системы
|
| Диспепсия: тошнота, рвота, чувство тяжести, боли в эпигастральной области. |
10-30 |
Частая причина прерывания лечения в первые месяцы (8-10%). Не коррелирует с эндоскопическими изменениями и тяжелым ЖК-осложнениями. |
| Бессимптомные язвы и эрозии слизистой оболочки верхних отделов ЖКТ. |
10-50 |
Клиническое значение «эндоскопических» язв до конца не ясно. Локализуются преимущественно в антральном отделе желудка. |
| Тяжелые осложнения (кровотечение, перфорация, пенетрация, симптоматичес-кие язвы). |
0,5-4 больных за 1 год |
В зависимости от наличия факторов риска. |
| Поражения кишечника |
1-5 |
Одна из причин развития железодефицитной анемии (существенно реже возникает при приеме целекоксиба). |
|
|
| Бессимптомное повышение активности АлТ, АсТ, щелочной фосфатазы |
1-5 |
Клиническое значение не ясно. |
| Острый лекарственный гепатит, печеночная недостаточность |
0,01-0.05 |
Редкое, но потенциально фатальное осложнение. |
- Поражение пищевода (эрозивный эзофагит, кровотечение, стриктура)
|
<1 |
Развивается у больных с ГЭРБ. |
|
|
Любые НПВП, особенно в больших дозах. |
| Нарушение клубочковой фильтрации. |
1-5 |
| Повышение АД |
1-10 |
| Сосочковый некроз |
<1 |
| Интерстициальный нефрит |
<1 |
- Сердечно-сосудистые (риск тромбозов, декомпенсация СН, снижение антитромбоцитарного эффекта АСК).
|
1-5 |
Любые НПВП в больших дозах и при длительном приеме.Ибупрофен |
|
|
1-5 |
Наиболее часто индометацин, ибупрофен, кетопрофен, флурбипрофен, напроксен. |
| Головная боль |
<1 |
| Асептический менингит |
<0,01 |
|
(зуд, кожная сыпь). |
<1 |
Реже мелоксикам |
|
(агранулоцитоз). |
<1 |
Наиболее часто фенилбутазон, редко индометацин. |
- Гиперчувствительность (бронхиальная астма, крапивница, пневмонит).
|
<1 |
Наиболее часто АСК. |
|
|
| Ототоксичность |
<1 |
Наиболее часто АСК. в высоких дозах. |
| Бесплодие у женщин |
<1 |
| Стоматит, кардит, васкулит, панкреатит. |
<1 |
Наиболее часто фенилбутазон |
| Сульфонамидная аллергия |
<1 |
Целекоксиб (назначение препарата противопоказано). |
| Бронхоспазм |
<1 |
Селективные НПВП реже, чем АСК и неселективные НПВП., |
НПВП – гастропатии
При применении НПВП отмечается высокий риск развития нежелательных реакций со стороны желудочно-кишечного тракта, в частности характерно развитие специфического синдрома – НПВП -гастропатия, который
связан не столько с локальным повреждающим влиянием НПВП (большинство из них – органические кислоты) на слизистую, но, в основном, обусловлен системным действием препаратов. Поэтому НПВП -гастропатия может развиваться также при парентеральном или ректальном введении НПВП
. Чаще всего имеет место повреждение слизистой ЖКТ в антральном и препилорическом отделе желудка (эритема слизистой оболочки, эрозии, язвы, кровоизлияния). Гистологически слизистая вокруг язвы, вызванной НПВП, обычно нормальная или только слегка воспалена в отличие от хронического гастрита при типичных хронических язвах желудка. Существуют определенные отличия между язвами, вызванными приёмом НПВП, и спонтанно возникшими (при язвенной болезни). Язвы, вызванные приёмом НПВП, нередко протекают бессимптомно (особенно у пожилых пациентов), и диагноз во многих случаях устанавливают при фиброгастродуоденоскопии. Частота возникновения НПВП -гастропатии наиболее высокая в первый месяц лечения, затем она постепенно снижается и остается стабильной, начиная с 4-го месяца лечения. При непрерывном применении НПВП на протяжении 6 месяцев, как показало эндоскопическое исследование, только у 32% пациентов слизистая желудка остаётся в норме. У остальных 68% больных выявляются те или иные патологические изменения слизистой.
К факторам риска НПВП -гастропатии относят:
– пожилой возраст (риск развития язвенных поражений желудка у таких пациентов в 4 раза выше, чем у молодых людей);
– женский пол (НПВП -гастропатия у женщин встречается в 2-3 раза чаще, чем у мужчин);
– предшествующие и сопутствующие заболевания (язвенная болезнь, пептическая язва, цирроз печени, заболевания сердечно-сосудистой системы);
-одновременный прием других препаратов (антикоагулянтов, иммуносупрессантов, глюкокортикостероидов, длительная терапия НПВП, особенно их приём в больших дозах и/или одновременный приём двух или более препаратов этой группы);
– курение (особенно при наличии язвенной болезни в анамнезе);
– употребление алкоголя (данный фактор повышает риск возникновения желудочно-кишечных кровотечений более чем в 2 раза).
Наличие одновременно нескольких факторов риска значительно увеличивает вероятность развития НПВП -гастропатии и ее осложнений. Так пожилой возраст больного и наличие язвенной болезни в анамнезе повышают риск желудочно-кишечных кровотечений при приеме НПВП в 17 раз. Наиболее высокий риск развития язв при приеме традиционных неселективных препаратов отмечался при применении пироксикама, кетопрофена, а наименьший – ибупрофена и диклофенака (таблица №15). Определенное значение играет доза НПВП и продолжительность лечения. При увеличении дозы возрастает и риск развития НПВП -гастропатии. Однако повышенная частота желудочно-кишечных кровотечений (в 3,5 раза чаще)
сохраняется даже при применении малых доз аспирина (75-150 мг/сут) с целью профилактики тромбообразования у больных ишемической болезнью сердца.
| Таблица №15. Риск возникновения эрозий и язв при приёме различных НПВП по данным метаанализа (Garcia Rodriguez A., 1998) |
| Препарат |
Число работ, взятых для метаанализа |
Относительный риск |
| ибупрофен |
11 |
1,0 ± 0 |
| диклофенак |
8 |
2,3 ± 0,5 |
| дифлунизал |
2 |
3,5 ± 0,5 |
| фенопрофен |
2 |
3,5 ± 1,2 |
| аспирин |
6 |
4,8 ± 0,5 |
| сулиндак |
5 |
6,0 ± 0 |
| напроксен |
10 |
7,0 ± 0 |
| индометацин |
11 |
8,0 ± 0 |
| пироксикам |
10 |
9,0 ± 0 |
| кетопрофен |
7 |
10,3 ± 0,5 |
| толметин |
2 |
11,0 ± 0,9 |
| азапропазон |
2 |
11,7 ± 0,5 |
Индекс гастроинтестинальной токсичности НПВП (соотношение доз, вызывающих в 50% случаев противовоспалительный и ульцерогенный эффекты) представлен в таблице № 16.
| Таблица №16.Индекс гастроинтестинальной токсичности различных НПВП, рассчитанный на основе банка данных ARAMIS. |
| Препарат |
Число больных |
Индекс токсичности |
| салицилат натрия |
187 |
0,81 ± 0,51 |
| ибупрофен |
577 |
1,13 ± 0,29 |
| аспирин |
1521 |
1,18 ± 0,18 |
| сулиндак |
562 |
1,68 ± 0,29 |
| диклофенак |
415 |
1,81 ± 0,35 |
| напроксен |
1062 |
1,91 ± 0,21 |
| толметин |
243 |
2,02 ± 0,44 |
| пироксикам |
814 |
2,03 ± 0,24 |
| фенопрофен |
158 |
2,35 ± 0,55 |
| индометацин |
418 |
2,39 ± 0,34 |
| кетопрофен |
259 |
2,65 ± 0,43 |
| меклофенамовая кислота |
165 |
3,91 ± 0,54 |
Профилактика эрозивно-язвенных поражений ЖКТ при приеме НПВП
Наиболее перспективными считаются синтетические аналоги простагландинов, которые можно рассматривать в качестве средств заместительной терапии. Для профилактики эрозивно-язвенных поражений СОЖ применяется мизопростол, который не только тормозит секрецию соляной кислоты, но и оказывает цитопротективное действие, стимулируя образование слизи и бикарбоната. Мизопростол в дозе 200 мкг 4 раза в сутки существенно снижает частоту изъязвлений слизистой оболочки желудка у больных, длительно принимавших НПВП. В настоящее время создан комбинированный препарат Артротек, в состав которого входит диклофенак (50 мг) и мизопростол (200 мкг).
Для снижения гастротоксичности НПВП возможно использование НПВП в виде пролекарств. В частности, сулиндак не обладает противовоспалительной активностью, но в результате биотрансформации в печени превращается в активные метаболиты, теряя способность накапливаться в кардиальном отделе желудка.
В ряде исследований отмечалось, что минимальное ульцерогенное действие при использовании АСК в качестве антитромбоцитарных средств оказывает АСК с кишечнорастворимым покрытием или одновременно с гидроокисью магния (Кардиомагнил). Однако ряд экспертов считает, что частота эрозивно-язвенных поражений и желудочно-кишечных кровотечений при длительном применении не зависит от лекарственной формы ацетилсалициловой кислоты. По-видимому, желудочно-кишечные расстройства обусловлены не местным воздействием НПВП на слизистую оболочку желудка и двенадцатиперстной кишки, а системным их эффектом.
Улучшение переносимости НПВП может быть достигнуто также путём изменения тактики их применения, в частности:
а) снижения дозы препарата (использование минимальных эффективных доз):
б) одновременным применением НПВП и парацетамола. Показано, что одновременный прием парацетамола и НПВП уменьшает вероятность появления ульцерогенного эффекта, поскольку парацетамол оказывает антиоксидантное действие и стимулирует биосинтез ПГ. При необходимости кратковременного (в течение нескольких дней) назначения анальгетиков и антипиретиков парацетамол может считаться препаратом выбора. Как показали сравнительные исследования, частота желудочно-кишечных осложнений при лечении парацетамолом (4 г/сут) заметно ниже, чем при применении безрецептурных форм различных НПВП (АСК, ибупрофена, напроксена, кетопрофена) и существенно не отличается от таковой при приеме плацебо.
В настоящее время при наличии в анамнезе заболеваний желудочно-кишечного тракта рекомендуется применение специфического ингибитора ЦОГ-2 – целекоксиба, который может назначаться во всем диапазоне рекомендованных доз, и селективных ингибиторов ЦОГ-2, в частности, мелоксикама (в дозе не выше 7,5 мг) и нимесулида (до 200 мг). Применение данных препаратов сопровождается меньшей частотой возникновения НПВП -гастропатии. Вместе с тем, безопасность мелоксикама в более высоких суточных дозах (15 мг) в отношении слизистой оболочки желудка оказалась не столь высокой, как предполагалось.
Лечение НПВП -гастропатии включает в себя применение в течение 4-8 недель блокаторов протонного насоса (омепразол, пантопразол, эзомепразол, лансопразол) в стандартных дозах, а в осложненных случаях (например, при желудочно-кишечных кровотечениях, труднорубцуюшихся язвах) – в удвоенных. Блокаторы Н
2-рецепторов при лечении НПВП-гастропатии оказались менее эффективны. При развитии у больного язвы желудка необходима отмена всех НПВП.
В настоящее время обсуждается целесообразность проведения эрадикационной антигеликобактерной терапии у Helicobacter pylori (Hp)-положительных больных, получающих НПВП. Наличие НР в слизистой оболочке желудка повышает риск возникновения эрозивно-язвенных поражений при приеме НПВП в 1,5-1,8 раза. Согласительная конференция европейской группы по изучению Helicobacter pylori (Маастрихт, 1996г.) рекомендовала применение у данной категории больных эрадикационной антигеликобактерной терапии.
НПВП могут вызывать развитие НПВП-энтеропатии, которая возникает в более поздние сроки. Среди пациентов, получающих НПВП, частота энтеропатий увеличивается в 14 раз. Клинические признаки НПВП -индуцированной энтеропатии: боли в животе, кишечная диспепсия, не «отвечающая» на ИПП, железодефицитная анемия, не поддающаяся лечению препаратами железа, гипоальбуминемия.
Гепатотоксичность НПВП
Гепатотоксическое действие НПВП может развиваться по иммуноаллергическому, токсическому или смешанному механизму. Для иммуноаллергических гепатитов характерно развитие в начале приёма (производных пиразолона, отсутствие связи между дозой и тяжестью клинической симптоматики. АСК и другие НПВП, в меньшей степени напроксен, также оказывают гепатотоксическое действие, механизм которого может быть связан не только с возникновением реакций гиперчувствительности, но и развитием метаболических расстройств, а также нарушением синтеза АТФ в митохондриях гепатоцитов. Лекарственный гепатит, обусловленный приемом НПВП, может развиться через несколько дней или недель после начала лечения и часто протекать малосимптомно, проявляясь только повышением уровня трансаминаз (иногда в 5-10 раз). Риск развития гепатотоксического эффекта возрастает у женщин (особенно старше 50 лет), при длительном применении НПВП, особенно в высоких дозах, наличии сопутствующих ревматических или других аутоиммунных заболеваний. Применение указанных препаратов у больных с наличием заболеваний печени является крайне нежелательным, т.к. значительно повышает риск возникновения желудочно-кишечных кровотечений, учитывая высокую вероятность наличия у больных гастропатии и снижения выработки факторов свертывания крови.
Токсический гепатит развивается на фоне длительного приема (несколько месяцев) НПВП и, как правило, проявляется желтухой. Более часто эти осложнения развиваются при использовании фенилбутазона, сулиндака и диклофенака натрия, крайне редко – при лечении мефенамовой кислотой.
Особую актуальность эта проблема приобретает у лиц, злоупотребляющих алкоголем, поскольку алкоголь может усиливать неблагоприятное влияние на печень лекарственных веществ.
Гепатотоксичность является наиболее серьезным нежелательным эффектом парацетамола и развивается при передозировке препарата (более 15 г в сутки или 150 мг/кг). При приеме парацетамола в терапевтических дозах его метаболиты не являются токсичными. Парацетамол метаболизируется в печени тремя путями: с помощью глюкуронизации (60% от принятой дозы), сульфатирования (35%) и под действием ферментов системы цитохрома Р
450 (около 5%). Однако при приеме чрезмерно высоких доз парацетамола (более 15 г или 30 таблеток по 500 мг) запасы глутатиона в печени могут оказаться недостаточными. При снижении содержания последнего более чем на 70-90%, образующийся реактивный метаболит парацетамола – N-ацетил-р-бензохинонимин, связывается с макромолекулами гепатоцитов, вызывая в конечном итоге их некроз и апоптоз. Гепатотоксичность парацетамола возрастает при одновременном приеме лекарственных препаратов, которые подвергаются метаболизму с помощью ферментов системы цитохрома Р
450 (например, фенитоина, рифампицина и др.). Таким образом, отрицательное действие парацетамола на функцию печени проявляется только при его приеме в чрезмерно высоких дозах (не менее 15г, или 150-200 мг/кг), которые в несколько раз превышают терапевтические суточные дозы 4 г.
Мнения об опасности передозировки парацетамола нередко значительно преувеличиваются. Сведения о частоте передозировки парацетамола в целом по России в доступной литературе отсутствуют. Частота отравлений парацетамолом составляет 0,04-0,08% в год. При этом летальных исходов в результате передозировки парацетамола зарегистрировано не было.
Хорошие результаты лечения поражений печени, вызванных передозировкой парацетамола, связаны с наличием специфического антидота — N – ацетилцистеина, который является донатором свободной SН – группы. Его введение, особенно впервые 8-10 часов после отравления, позволяет предотвратить тяжелое поражение печени и снизить уровень трансаминаз, уже в течение первых 24-48 ч. Полное восстановление функции печени происходит обычно через 1-3 недели.
Прием алкоголя потенциально способствует усилению гепатотоксичности парацетамола, что обусловлено отрицательным влиянием этанола на метаболизм данного препарата. Воздействуя на систему цитохрома Р
450, алкоголь стимулирует образование токсичных метаболитов парацетамола, ограничивает возможности метаболизма парацетамола путем его коньюгации с глюкуроновой кислотой. Кроме того, недостаточное питание, которое часто сопутствует алкоголизму, приводит к снижению содержания глутатиона в печени, способствует снижению порога гепатотоксичности парацетамола при его передозировке. Но при этом алкоголь не потенциирует неблагоприятное действие парацетамола на печень.
В терапевтических дозах парацетамол не оказывает отрицательного влияния на функцию печени у больных хроническим гепатитом или циррозом печени. Более того, он используется при лечении вирусного гепатита С при купировании лихорадочной реакции и головных болей, возникающих после введения интерферона.
Таким образом, аспирин и другие НПВП обладают гепатотоксичностью в терапевтических дозах, которая качественно выражена в разной степени. Кроме того, их применение у больных с заболеваниями печени, а также людей, злоупотребляющих алкоголем, нежелательно из-за высокого риска желудочно-кишечных кровотечений.
Нефротоксичность
Нефротоксичность является второй по значимости группой нежелательных реакций НПВП. Выявлены два основных механизма отрицательного влияния НПВП на почки.
I. Блокируя синтез ПГ-Е2 и простациклина в почках, НПВП вызывают сужение сосудов и ухудшают почечный кровоток.
Это ведёт к развитию ишемических изменений в почках, снижению клубочковой фильтрации и объёма диуреза. В результате могут происходить нарушения водно-электролитного обмена: задержка воды, отёки, гипернатриемия, гиперкалиемия, повышаться уровень креатинина в сыворотке, возможен рост артериального давления.Наиболее выраженным влиянием на почечный кровоток обладают индометацин и фенилбутазон, АСК.
II. НПВП могут оказывать прямое воздействие на паренхиму почек вплоть до развития тяжёлой почечной недостаточности, вызывая развитие интерстициального нефрита
(так называемая «анальгетическая нефропатия»). Наиболее опасным и в этом отношении являются фенацетин, бутадион, анальгин, индометацин, ибупрофен. В отличие от функциональной почечной недостаточности, органическое поражение развивается при длительном приёме НПВП (3-6 месяцев). После отмены препаратов возможен регресс патологических симптомов.
Факторы риска нефротоксичности: возраст старше 65 лет, заболевания печени (особенно цирроз), предшествующая почечная патология, снижение объёма циркулирующей крови, гипонатриемия, длительный приём НПВП, сопутствующий приём диуретиков, сердечная недостаточность, артериальная гипертензия (особенно симптоматические формы), избыточная масса тела, алкоголизм, состояние после оперативных вмешательств.
Гематоксичность и коагулопатии
Гематотоксичность является самым опасным нежелательным эффектом производных пиразолона (метамизола, амидопирина, бутадиона). В России, где метамизол (Анальгин) широко используется в качестве анальгетика, эта проблема приобрела особую актуальность. Более чем в 30 странах применение метамизола резко ограничено или вообще запрещено. Это решение основывалось на Международном исследовании по агранулоцитозу, в котором было продемонстрировано, что при применении метамизола риск развития агранулоцитоза возрастает в 16 раз.
Гематологические осложнения при приёме НПВП проявляются развитием гипохромной микроцитарной анемии, гемолитической анемии, тромбоцитопении (последние две формы имеют иммуноаллергическую природу). Прежде всего, эти осложнения развиваются на фоне приёма производных пиразолона, индометацина и АСК. Отмена препарата приводит к нормализации гемограммы в течение 1-2 недель. Более тяжело протекают осложнения, связанные с угнетением кроветворения в костном мозге, которые клинически проявляются лейкопенией, агранулоцитозом, тромбоцитопенией. Высокая степень риска развития этих осложнений связана с приемом метамизола, фенацетина, единичные случаи описаны при приёме фенилбутазона и индометацина.
НПВП тормозят агрегацию тромбоцитов и оказывают умеренный антикоагулянтный эффект за счёт торможения образования протромбина в печени. В результате могут развиваться кровотечения, чаще из ЖКТ.
Нейротоксичность
Нейротоксические эффекты отмечаются при использовании НПВП, которые хорошо проникают через ГЭБ (в 1-6%), особенно часто – при применении индометацина – до 10% случаев. В основном, они проявляются головокружением, головными болями, чувством утомления и расстройствами сна. Для индометацина характерно развитие ретинопатии и кератопатии (отложение препарата в сетчатке и роговице). Длительный прием ибупрофена может привести к развитию неврита зрительного нерва. Нарушения психики могут проявляться в виде галлюцинаций, спутанности сознания (до 1,5-4% случаев на фоне приема индометацина), что связано с высокой степенью проникновения препарата в ЦНС. Возможно транзиторное снижение остроты слуха при приёме АСК, индометацина, ибупрофена и препаратов группы пиразолона.
Аллергические реакции
Наиболее частым проявлением аллергических реакций является появление зудящей сыпи (скарлатино – и кореподобной), фотосенсибилизации, либо крапивницей, которая обычно сопровождается отёком. Проявления со стороны кожи и слизистых оболочек составляют 12-15% всех побочных реакций (чаще отмечаются при использовании пиразолонов и пиразолидинов). Обычно кожные проявления возникают на 1-3-й неделе лечения, а при повторном применении препарата – практически сразу, в первые же дни от начала приема. Эти осложнения чаще имеют доброкачественный характер. К более тяжелым кожным проявлениям относятся полиморфная эритема (на фоне любого НПВП), пигментная фиксированная эритема (специфичная для препаратов пиразолонового ряда), синдром Стивенса-Джонсона-Лайела. Приём пиразолона, оксикамов может осложниться токсикодермией, развитием пемфигуса и обострением течения псориаза, ибупрофена – развитием аллопеции.
При приёме НПВП (особенно АСК) могут развиваться аллергические реакции в виде ринита, конъюнктивита, синдрома Видаля (сочетание ринита, полипоза слизистой носа, бронхиальной астмы и крапивницы), сопровождающиеся гиперэозинофилией. Чрезвычайно редко развиваются анафилактический шок и отёк Квинке (0,01-0,5% всех осложнений).
Частота реакций гиперчувствительности при терапии НПВП убывает в следущей последовательности (Commitee on Safety of Medicines, 1986):диклофенак > напроксен > пироксикам > ибупрофен > индометацин > кетопрофен.
Бронхоспастические реакции
Бронхоспазм при приеме НПВП, как правило, развивается у больных бронхиальной астмой и, чаще всего, при приёме АСК. Его причинами могут быть аллергические механизмы, торможение синтеза простагландина – ПГ-Е2, который является эндогенным бронходилататором, а также преобладание альтернативного пути метаболизма арахидоновой кислоты, завершающегося образованием лейкотриенов (ЛТ-С4, Д4, Е4), вызывающих бронхоспазм.
Тератогенность
Некоторые НПВП обладают тератогенным действием. Например, приём АСК (особенно в первом триместре беременности) приводит к развитию расщепления верхнего неба у плода (8-14 случаев на 100 наблюдений). Приём НПВП в последние недели беременности (особенно индометацина) провоцирует торможение родовой деятельности. В этой же ситуации индометацин может привести к преждевременному закрытию артериального протока у плода, что вызывает гиперплазию лёгочных сосудов и гипертензию в малом круге кровообращения.
Мутагенность, канцерогенность
Описаны случаи развития острого лейкоза у 0,8% больных, принимавших в течение 6-12 месяцев бутадион в суточной дозе более 0,45 г. Частые и серьезные осложнения привели к запрету на применение в ряде стран флуфенамовой кислоты, индопрофена, беноксапрофена, зомакса, оксифенбутазона, изоксикама. Исключён из медицинского применения амидопирин в виду его возможного канцерогенного действия. При приеме препарата в ЖКТ происходит образование соединений амидопирина с нитрозаминами, обладающими канцерогенными свойствами. Несмотря на это в аптечную сеть продолжают поступать препараты, содержащие амидопирин (Пирабутол, Реопирин).
Выявлены также канцерогенные свойства (развитие рака мочевого пузыря) у фенацетина. Во многих странах фенацетин запрещён к применению.
Пролонгация беременности и замедление родов
Данный эффект связан с тем, что простагландины (ПГ-Е2 и ПГ-F2a) стимулируют миометрий, и подавление их активности сопровождается расслаблением миометрия.
Нарушение катаболизма хрящевой ткани
В связи с тем, что не все НПВП имеют одинаковый фармакологический профиль, некоторые из них могут провоцировать дегенеративные процессы в хрящевой ткани.
По влиянию на процессы биосинтеза хряща все НПВП делятся на 3 группы: 1) оказывающие стимулирующие действие (сургам, парацетамол), 2) нейтральные (диклофенак, пироксикам и ибупрофен) и 3) угнетающие синтез хрящевой ткани (аспирин, индометацин, бутадион, реопирин).
Редким, но прогностически неблагоприятным осложнением терапии АСК, является развитие синдрома Рея. Синдром Рея представляет собой острое заболевание, характеризующееся тяжелой энцефалопатией в сочетании с жировой дегенерацией печени и почек. Развитие синдрома Рея связано с применением АСК, как правило, после перенесенных вирусных инфекций (гриппа, ветряной оспы и т.д.). Чаще всего синдром Рея развивается у детей с возрастным пиком в 6 лет. При синдроме Рея отмечается высокая летальность, которая может достигать 50%.
Меры контроля при длительном применении НПВП
Желудочно-кишечный тракт
Больных необходимо предупреждать о возможных нежелательных побочных эффектах НПВП. В частности, о симптомах поражения желудочно-кишечного тракта. Каждые 1-3 месяца следует проводить анализ кала на скрытую кровь (
таблица №17). При необходимости проводить фиброгастродуоденоскопию.
Ректальные свечи с НПВП целесообразно использовать у больных, перенесших операции на верхних отделах желудочно-кишечного тракта, и у пациентов, одновременно получающих несколько лекарственных средств. Они не должны применяться при воспалении прямой кишки или ануса, а также после недавно перенесенных аноректальных кровотечений.
| Таблица №17.Лабораторный контроль при длительном назначении НПВП |
| Вид исследования |
Каждые 2-3 недели |
Каждые 1-3 месяца |
| Общий анализ крови |
+ |
– |
| Общий анализ мочи |
+ |
– |
| Анализ кала на скрытую кровь |
– |
+ |
| Клиренс креатинина |
– |
+ |
| Функциональные пробы печени |
– |
+ |
Кроветворение
Наряду с клиническим наблюдением следует один раз в 2-3 недели делать общий анализ крови. Особый контроль необходим при назначении производных пиразолона и пиразолидина.
Почки
Необходимо следить за появлением отеков, измерять артериальное давление, особенно у больных с артериальной гипертензией. Проведение исследования – общий анализ мочи – 1 раз в 3 недели. Каждые 1-3 месяца необходимо определять уровень креатинина сыворотки и рассчитывать его клиренс.
Печень
При длительном применении НПВП необходимо активно выявлять наличие у больного клинических признаков поражения печени и каждые 1-3 месяца следует определять активность трансаминаз и билирубина.
Взаимодействие НПВП с другими лекарственными средствами
Взаимодействие НПВП с другими лекарственными средствами отражено в таблице №18.
| Таблица №18. Взаимодействие НПВП с другими лекарственными средствами |
| Препарат А |
Препарат Б |
Механизмы. Проявления взаимодействия |
Рекомендации |
|
| НПВП |
НПВП другие |
Усиливают нежелательные побочные эффекты НПВП. |
Избегать одновремен-ного назначения. |
|
| Все НПВП |
Непрямые антикоагулянты |
Увеличение риска желудочно-кишечных кровотечений вследствие повреждения слизистой и торможения агрегации тромбоцитов. |
Избегать НПВП, если возможно, или проводить строгий контроль. |
|
| Все НПВП |
Антибиотики группы аминогликозидов |
Торможение почечной экскреции аминогликозидов, повышение их концентрации в крови. |
Строгий контроль концентрации аминогликозидов в крови. |
|
| Все НПВП |
Антидепрессанты (моклобемид) |
Повышает эффекты НПВП |
|
|
| Все НПВП |
Бета-адреноблокаторы |
Снижается гипотензивный эффект бета-блокаторов. |
|
|
| Все НПВП |
Бифосфонаты (тилудроновая кислота) |
Биодоступность повышается для тилудроновой кислоты. |
|
|
| Все НПВП |
Бифосфонаты (алендроновая кислота) |
Алендроновая кислота, возможно, усиливает нежелательные побочные эффекты НПВП. |
|
|
| Все НПВП |
ГКС |
Повышает риск ЖК- кровотечений и образования язв. |
|
|
| Все НПВП |
Литий, препараты лития |
Торможение почечной экскреции лития, повышение его концентрации в крови и токсичности. |
Использовать АСК или сулиндак, если необходимо назначение НПВП. Строгий контроль концентрации лития в крови. |
|
| Все НПВП |
Метотрексат (высокие «неревматологи-ческие» дозы) |
Торможение почечной экскреции метотрексата, повышение его концентрации в крови и токсичности (взаимодействие с “ревматологической” дозой метотрексата не отмечается). |
Одновременное назначение противопоказано. Допустимо использование НПВП в промежутках химиотерапии. |
|
| Все НПВП, особенно АСК |
Мифепристон |
Не рекомендуют принимать АСК и НПВП ранее 8-12 суток после отмены М. |
|
|
| Все НПВП |
Пробенецид |
Задерживает экскрецию индометацина, кетопрофена, кеторолака, напроксена, повышаются плазменные концентрации НПВП. |
|
|
| Все НПВП, особенно аспирин |
Пероральные гипогликемические препараты производные сульфонилмочевины |
Вытеснение из связи белками плазмы, усиление гипогликемического эффекта. |
Избегать НПВП, если возможно, или контролировать уровень глюкозы в крови. |
|
| Все НПВП |
Сердечные гликозиды |
Торможение почечной экскреции дигоксина при нарушении функции почек (особенно у детей младшего возраста и пожилых), повышение его концентрации в крови, увеличение токсичности При нормальной функции почек взаимодействие менее вероятно. Обострение сердечной недостаточности снижение клубочковой фильтрации, повышение плазменной концентрации СГ, увеличение его токсичности. |
Избегать НПВП, если возможно, или строго контролировать клиренс креатинина и концентрацию дигоксина в крови. |
|
| Все НПВП |
Фенитоин |
Торможение метаболизма, повышение концентрации в крови и токсичности. |
Избегать этих НПВП, если возможно, или контролировать концентрацию фенитоина в крови. |
|
| Диклофенак и кеторолак (парентераль-но) |
Антикоагулянты прямого действия (гепарин) |
Повышается риск кровотечений. |
|
|
| Диклофенак натрия |
Соли лития |
Уменьшение клиренса лития на 25-60%, возможна интоксикация литием. |
|
|
| Диклофенак натрия |
Циклоспорин |
Повышается риск нефротоксичности. Плазменные концентрации Д. возрастают в 2 раза. |
|
|
| Ибупрофен |
Миорелаксанты (баклофен) |
Снижают выделение Б. почками. |
|
|
| Индометацин |
Антипсихотичес-кие (галоперидол) |
Выраженная сонливость. |
|
|
| В наибольшей степени – индометацин, фенилбутазон
В наименьшей – сулиндак |
Антигипертензив-ные препараты
Бета-блокаторы
Диуретики
Ингибиторы АПФ |
Ослабление гипотензивного действия за счёт торможения синтеза ПГ в почках (задержка натрия и воды) и сосудах (вазоконстрикция). |
Использовать сулиндак и избегать, по-возможности, других НПВП при гипертензии. Строгий контроль АД. Может потребоваться усиление антигипер-тензивной терапии.
|
|
| В наибольшей степени – индометацин, фенилбутазон
В наименьшей – сулиндак |
Все диуретики |
Ослабление диуретического и натрийуретического действия, ухудшение состояния при сердечной недостаточности.
|
Избегать НПВП (кроме сулиндака) при сердечной недостаточности, строгий контроль за состоянием пациента. |
|
| Индометацин |
Десмопрессин |
Потенциируется действие Д. |
|
|
| Индометацин |
Пробенецид |
Повышает уровень И. в крови. |
|
|
| Индометацин |
Соли лития |
Уменьшение клиренса лития на 25-60%, возможна интоксикация Л. |
|
|
| Кеторолак |
Ингибиторы АПФ |
Ослабление гипотензивного действия ингибиторов АПФ, повышается риск почечной недостаточности и гиперкалиемии. |
|
|
| Пироксикам |
Противовирусные средства (Ритонавир) |
Повышаются плазменные концентрации НПВП. |
|
|
| Салицилаты (натрия салицилат, салициламид) |
Антикоагулянты |
Вытеснение из связи с белками плазмы, усиление антикоагулянтного эффекта |
|
|
| Фенилбутазон |
Антиконвульсанты (фенитоин) |
Усиливаются эффекты фенитоина. |
|
|
| Фенилбутазон |
Мизопростол |
Повышается риск токсического действия Ф. на ЦНС. |
|
|
| Фенилбутазон |
Противодиабети-ческие препараты, производные сульфонилмочевины. |
Торможение метаболизма в печени, усиление гипогликемического эффекта. |
|
|
| Фенилбутазон |
Тироксин |
Ложнонизкие концентрации Т. |
|
|
| Фенилбутазон |
Холестирамин |
Снижает абсорбцию фенилбутазона.
|
|
|
| Фенилбутазон
Оксифенбу-тазон |
Непрямые антикоагулянты |
Торможение метаболизма в печени, усиление антикоагулянтного эффекта. |
Избегать этих НПВП, если возможно, или проводить строгий контроль. |
|
| Комбинации повышенного риска |
|
|
| Все НПВП (в меньшей степени – сулиндак) |
Все диуретики |
Высокий риск развития почечной недостаточности. |
Комбинация противопоказана. |
|
| Все НПВП |
Калийсберегающие диуретики (спиронолактон, амилорид, триамтерен). |
Гиперкалиемия, парестезии, нарушение атриовентрикуляр-ной и вентрикулярной проводимости с фибриляцией желудочков или асистолией. |
Избегать таких комбинаций или строгий контроль за уровнем калия в плазме. |
|
| Индометацин |
Триамтерен |
Высокий риск развития острой почечной недостаточности. |
Комбинация противопоказана. |
|
Библиография
1. Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. Издание 2-е исправленное и дополненное. Универсум Паблишинг, Москва, 1997.
2. Бертман Г., Катцунг Базисная и клиническая фармакология. Том 1 и 2. Бином. Москва. 1998.
3. Ивашкин В. Т., Шептулин А.А.Влияние анальгетиков на слизистую оболочку желудка и состояние печени. Клиническая фармакология и терапия, 2003, 12 (1).
4. Каркищенко Н.Н.,Хоронько В.В. Фармакокинетика. Феникс. Ростов н/Д,2000.
5. Кукес В.Г. Клиническая фармакология. ГЭОТАР Медицина. Москва, 2004.
6. Кукес В.Г., Сычев Д.А. Клиническая фармакология ненаркотических анальгетиков. Клиническая фармакология и терапия, 2002, 11 (5).
7. Лебедева Р.П., Никола В.В. Фармакотерапия острой боли. Москва, 1998.
8. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология: В 2-х томах. Т. 1. 2. Медицина. Москва, 1993.
9. Машковский М.Д. Лекарственные средства: В 2-х гомах. 14-е издание. Новая Волна. Москва, 2000.
10. Насонов Е.Л. Противовоспалительная терапия ревматических болезней. М. М-Сити. 1996; 345.
11. Насонова В.А. Гастропатии, связанные с приемом нестероидных противовоспалительных препаратов. Российский журнал гастроэнтерологии, гепатологии. 1994; 1: 7-10.
12. Окороков А.Н. Лечение болезней внутренних органов: В 3-х томах. Вышейшая школа. Минск, 1997.
13. Рациональная фармакотерапия ревматических заболеваний. Руководство для практикующих врачей. // Под общей редакцией В.А.Насоновой, Е.Л.Насонова.–М., “Литтерра”, 2003
14. Справочник Видаль. Лекарственные препараты в России. АсграФармСервис. Москва, 2009.
15. Федеральное руководство для врачей по использованию лекарственных средств (Формулярная система). Москва, 2000.
16. Харкевич Д.А. Фармакология, ГЭОТАР Медицина. Москва,2003.
Условные сокращения
АСК – ацетилсалициловая кислота
БМАРП – болезнь-модифицирующие антиревматические препараты
VCAM-1 – сосудистая молекула адгезии-1
ГКС – глюкокортикостероиды
ИЛ – интерлейкин
ИФ-g – интерферонноген
ICAM-1 – межклеточная молекула адгезии
ЕLAM-1 – эндотелиально-лейкоцитарная молекула адгезии
ЛТ – лейкотриен
ЛС – лекарственные средства
НПВП – нестероидные противовоспалительные средства
ОА – остеоартроз
ПГ – простагландин
РБ – ревматические болезни
РА – ревматоидный артрит
РФ – ревматоидный фактор
СОЖ– слизистая оболочка желудка
СМАРП – симптом-модифицирующие антиревматические препараты
ТФР – трансформирующий фактор роста
TxА
2 – тромбоксана А
2
ФНО – фактор некроза опухоли
ФРФб – фактор роста фибробластов
ХВЗС – хронических воспалительных заболеваний суставов
ЦОГ – циклооксигеназа
цАМФ – циклический аденозинмонофосфат
 Рис. 1. Метаболизм арахидоновой кислоты
В последние годы существенно расширились и уточнились представления о точках приложения НПВП в регуляции синтеза ПГ. Ранее считалось, что ЦОГ является единственным ферментом, подавление активности которого снижает синтез ПГ, как участвующих в развитии воспаления, так и ПГ, регулирующих нормальные физиологические функции, в частности, функцию желудка, почек и других органов. Сравнительно недавно были открыты две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), играющих различную роль в регуляции синтеза ПГ.
Было показано, что ЦОГ-2 регулирует преимущественно синтез ПГ, вызванный различными провоспалительными стимулами. Считается, что ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и другие). В результате блокады ЦОГ-2 снижается синтез ПГ, которые принимают участие в развитии воспаления, боли и лихорадки. Активность ЦОГ-1 определяет продукцию ПГ, принимающих участие в регуляции нормальных физиологических клеточных процессах, которые не связанны с развитием воспаления. В частности, предполагается, что желудочно-кишечные осложнения НПВП связаны с подавлением активности ЦОГ-1. Хорошо известно, что ПГ-Е2 и ПГ-I2 оказывают протективное действие на слизистую желудка, что связывают с их способностью снижать секрецию соляной кислоты и увеличивать синтез цитопротективных веществ. Другим циклооксигеназным продуктом является тромбоксан А2, синтез которого подавляют НПВП. При этом снижается агрегация тромбоцитов, нарушается свертывающий потенциал крови и, возможно, появление кровоточивости. Кроме того, ПГ играют важную роль в регуляции клубочковой фильтрации, секреции ренина и поддержании водно-электролитного баланса в почках. Очевидно, что нарушение синтеза ПГ может приводить к разнообразным нарушениям функции почек, особенно у больных с сопутствующей почечной патологией. Известно также, что ПГ-Е2 обладает способностью подавлять активацию нейтрофилов, предотвращать прилипание нейтрофилов, подавлять синтез лейкотриенов (ЛТ) нейтрофилами. Таким образом, предполагается, что противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а их нежелательные реакции связаны с ингибированием ЦОГ-1.Точки приложения НПВП в регуляции синтеза ПГ представлены в таблице №3.
Рис. 1. Метаболизм арахидоновой кислоты
В последние годы существенно расширились и уточнились представления о точках приложения НПВП в регуляции синтеза ПГ. Ранее считалось, что ЦОГ является единственным ферментом, подавление активности которого снижает синтез ПГ, как участвующих в развитии воспаления, так и ПГ, регулирующих нормальные физиологические функции, в частности, функцию желудка, почек и других органов. Сравнительно недавно были открыты две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), играющих различную роль в регуляции синтеза ПГ.
Было показано, что ЦОГ-2 регулирует преимущественно синтез ПГ, вызванный различными провоспалительными стимулами. Считается, что ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и другие). В результате блокады ЦОГ-2 снижается синтез ПГ, которые принимают участие в развитии воспаления, боли и лихорадки. Активность ЦОГ-1 определяет продукцию ПГ, принимающих участие в регуляции нормальных физиологических клеточных процессах, которые не связанны с развитием воспаления. В частности, предполагается, что желудочно-кишечные осложнения НПВП связаны с подавлением активности ЦОГ-1. Хорошо известно, что ПГ-Е2 и ПГ-I2 оказывают протективное действие на слизистую желудка, что связывают с их способностью снижать секрецию соляной кислоты и увеличивать синтез цитопротективных веществ. Другим циклооксигеназным продуктом является тромбоксан А2, синтез которого подавляют НПВП. При этом снижается агрегация тромбоцитов, нарушается свертывающий потенциал крови и, возможно, появление кровоточивости. Кроме того, ПГ играют важную роль в регуляции клубочковой фильтрации, секреции ренина и поддержании водно-электролитного баланса в почках. Очевидно, что нарушение синтеза ПГ может приводить к разнообразным нарушениям функции почек, особенно у больных с сопутствующей почечной патологией. Известно также, что ПГ-Е2 обладает способностью подавлять активацию нейтрофилов, предотвращать прилипание нейтрофилов, подавлять синтез лейкотриенов (ЛТ) нейтрофилами. Таким образом, предполагается, что противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а их нежелательные реакции связаны с ингибированием ЦОГ-1.Точки приложения НПВП в регуляции синтеза ПГ представлены в таблице №3.


