
 Андреева Ирина Ивановна (врач, к.м.н., доцент кафедры иммунологии и аллергологии ФПК и ППС Ростовского государственного медицинского университета)
Сологуб Елена Николаевна (кандидат биологических наук)
Глава 1. Принципы организации и функционирования иммунной системы
1.1. Неспецифическая резистентность и адаптивный иммунитет.
Андреева Ирина Ивановна (врач, к.м.н., доцент кафедры иммунологии и аллергологии ФПК и ППС Ростовского государственного медицинского университета)
Сологуб Елена Николаевна (кандидат биологических наук)
Глава 1. Принципы организации и функционирования иммунной системы
1.1. Неспецифическая резистентность и адаптивный иммунитет.
Иммунная система, наряду с нервной и эндокринной, сохраняет и поддерживает постоянство, устойчивость и состав организма, то есть обеспечивает гомеостаз. Способность иммунной системы поддерживать неизмененный антигенный состав позволяет каждому человеку сохранить свою антигенную индивидуальность посредством
- защиты от возбудителей инфекционных заболеваний
- противоопухолевого иммунологического надзора
- создания условий для внутриутробного развития плода
- своевременного удаления состарившихся структур
- отторжения пересаживаемых органов, тканей и клеток.
В решении указанных проблем участвует множество разнообразных клеток и гуморальных продуктов их жизнедеятельности. Условно принято выделять 2 варианта их реализации:
Антигеннеспецифические реакции – при этом нейтрализация, разрушение и вывод из организма чужеродных веществ происходит без узнавания и запоминания особенностей строения. Это так называемые доиммунные механизмы резистентности. В осуществлении реакций врожденного иммунитета участвуют
клетки
– пограничных тканей (кожа, слизистая ЖКТ, дыхательных путей и урогенитального тракта)
– крови: полиморфноядерные лейкоциты, моноциты, натуральные киллеры
– эндотелия сосудов
– резидентные макрофаги
и
гуморальные факторы
– белки острой фазы: ЦРБ (С-реактивный белок), МСЛ (маннозосвязывавающий лектин) – синтезируются в печени до появления специфических антител
– лизоцим
– комплемент и его компоненты
Антигенспецифические (АГ-специфические) реакции или антиген – специфическая защита, наиболее эффективна, осуществляется системой лимфоцитарного иммунитета. Они обладают способностью узнавать и запоминать пространственную конфигурацию антигена и защищать организм при повторном его введении – иммунологическая память. Такая форма защиты осуществляется
клетками иммунной системы и
гуморальными факторами – антителами.
1.2. Центральные и периферические органы иммунной системы
Анатомо-функциональный принцип устройства иммунной системы – органно-циркуляторный. Это значит, что клетки иммунной системы организованы в специализированные структуры, называемые органами иммунной системы. При этом клетки не находятся в них постоянно, а интенсивно циркулируют между лимфоидными органами и нелимфоидными тканями через лимфатические сосуды и кровь, а процесс миграции не носит характер случайного передвижения.
Схема 3. Строение иммунной системы.
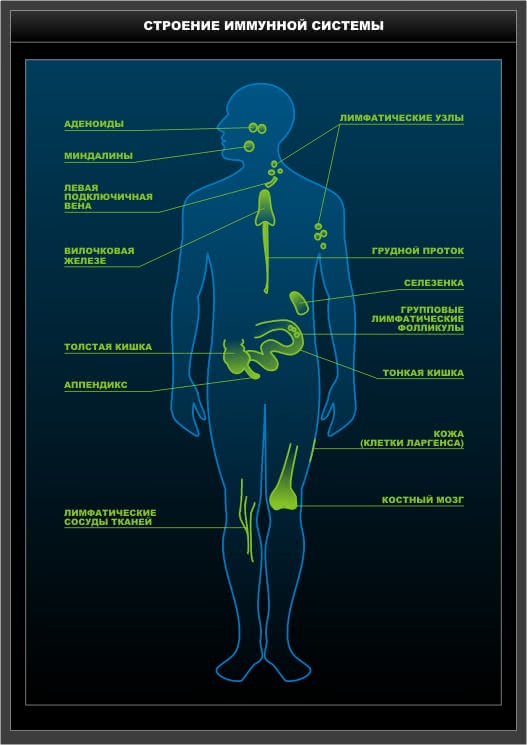
Красный костный мозг и тимус относят к центральным органам. Центральные (или первичные) органы иммунной системы находятся на защищенной от внешних воздействий территории: тимус – за грудиной, костный мозг – в костных полостях. Центральные органы иммунной системы – «инкубатор, а не поле битвы», место созревания, дифференцировки, развития (образования и воспитания) иммуноцитов – или иммунокомпетентых клеток, заселяющих периферические органы. Все клетки иммунной системы, также как и все клетки крови имеют общего предшественника – полипотентную стволовую кроветворную клетку (ПСКК). Основным местом пребывания ПСКК является костный мозг.
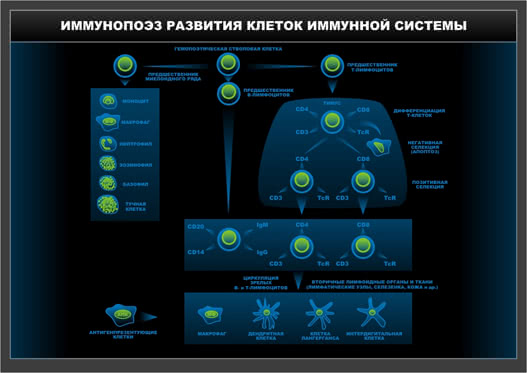
Схема 4. Иммунопоэз развития клеток иммунной системы.
 Костный мозг
Костный мозг – центральный орган кроветворения. Структурно состоит из компактной кости, стромы, костномозговых синусов, генеративной зоны и зоны созревания. Считается, что все элементы костного мозга участвуют в формировании и регуляции
- эритропоэза (заканчивается образованием эритроцитов),
- миелопоэза (образуются базофилы, эозинофилы, моноциты),
- мегакариоцитопоэза (формируются тромбоциты),
- дифференцировки дендритных клеток,
- полного лимфопоэза так называемых «классических» В-2 – лимфоцитов. Коммитированный (запрограммированный) к дифференцировке в Т-лимфоциты потомок СКК мигрирует из костного мозга в тимус.
Тимус – специализированный лимфоидный орган, в котором проходит развитие и образование б
ольшей части Т-лимфоцитов. Тимус расположен в переднем верхнем средостении, за грудиной, над сердцем. Существенная роль в функционировании тимуса отводится его эпителиальным клеткам (ЭК), классифицированным на 3 типа. 1 тип – секреторные, выделяют тимические гормоны (тимозин, тимулин, тимопоэтин), им принадлежит важная роль в посттимусном развитиии и дозревании Т-лимфоцитов. Кроме гормонов, эпителиальные клетки секретируют цитокины, при этом ведущая роль в созревании тимоцитов отводится интерлейкину (ИЛ) -7. Особый эпителиальный компонент микроокружения тимоцитов – «клетки-няньки» (nurse cells) – имеют характерную морфологию и специализированную функцию, продуцируя разнообразные факторы, обеспечивая селекцию и дифференцировку Т-клеток. Мигрируя из коркового слоя в мозговой, предшественники Т-клеток дифференцируются в зрелые Т-лимфоциты, для которых характерно: дифференцировка на субпопуляции и наличие полноценного Т-клеточного рецептора (ТКР), способного распознать чужеродный антиген.
От других лимфоидных органов тимус отличается особой постнатальной динамикой развития. Тимус достигает наибольшей величины и активности (образование гормонов, поддержание дифференцировки и пролиферации тимоцитов) в возрасте 1 года. Считается, что возрастная инволюция тимуса определяет старение иммунной системы, а через нее – в значительной степени старение всего организма.
Вторичные или периферические органы иммунной системы представлены селезенкой, лимфоузлами и лимфоидной тканью, ассоциированной
– с желудочно-кишечным трактом: миндалины, аденоиды, аппендикс, пейеровы бляшки (особо следует отметить внутриэпителиальные лимфоциты слизистой оболочки кишки)
– бронхами и бронхиолами (в том числе эпителиальные лимфоциты слизистой оболочки дыхательной системы)
– урогенитальным трактом.
Следует также подчеркнуть значимость так называемой лимфоидной подсистемы кожи, включающей в себя популяцию внутриэпителиальных лимфоцитов, регионарные лимфатические узлы и сосуды лимфодренажа. Немаловажная роль отводится и периферической крови как транспортно-коммуникационному компоненту иммунной системы.
Лимфатические узлы (ЛУ) – множественные, симметрично расположенные по всему телу инкапсулированные лимфоидные органы бобовидной формы с размерами, варьирующими в норме от 0,5 до 1,5 см в длину. Лимфатический узел – основное образование периферических лимфоидных органов, в котором происходит распознавание антигена, взаимодействие Т- В лимфоцитов и формирование специфического иммунного ответа. ЛУ расположены регионарно и называются в соответствии с той зоной, которую обслуживают – околоушные, паховые и т.д. Их функциональное предназначение – фильтрация лимфы и дренаж тканевой жидкости из всех барьерных тканей, в результате чего лимфоузлы «контролируют» все антигены, попадающие во внутреннюю среду через покровные ткани. Из ЛУ лимфа попадает в грудной лимфатический проток, далее в нижнюю полую вену и вливается в системный кровоток. В каждом лимфоузле выделяют корковую и медулярную зоны. Корковая часть разделена на сектора, в которых расположены лимфоидные фолликулы (В-лимфоцитарная зона). В паракортикальной зоне ЛУ локализованы Т-лимфоциты (Т-зона) и венулы, через которые лимфоциты мигрируют в лимфоузел из крови. В медуллярной зоне содержатся макрофаги, плазматические клетки, Т и В лимфоциты. При активном иммунном ответе количество плазматических, нелимфоидных клеток и рециркулирующих лимфоцитов резко возрастает. Процесс сопровождается отеком ткани, что создает эффект увеличенного лимфоузла.
Селезенка – инкапсулированный лимфоидный орган, содержит до 25% от общего числа лимфоцитов. Паренхима представлена белой и красной пульпой. В белой пульпе выделяют тимусзависимую область, состоящую из Т-лимфоцитов, расположенную вокруг артериол, и В-зависимую область, представленную В-лимфоцитами. Белая пульпа – место реализации иммунного ответа на антигены, попадающие из крови. В селезенке созданы оптимальные условия для формирования иммунного ответа по гуморальному типу. Красная пульпа – депо эритроцитов, содержит большое количество плазматических клеток, макрофагов. Четкой границы между областями нет, что и обеспечивает возможность активной миграции клеточных элементов.
Особая роль в обеспечении функциональных задач иммунной системы принадлежит
печени. Этот орган не относится в строгом смысле к органам иммунной системы, тем не менее, здесь локализована большая часть натуральных киллеров (NK), содержатся особые Т-лимфоциты, обеспечивающие толерантность к антигенам пищевых продуктов. В печени едва ли не половина всех тканевых макрофагов. В синусах печени, так же как в синусах селезенки, макрофаги фагоцитируют и расщепляют иммунные комплексы.
Далее следует остановиться на характеристике
неинкапсулированной лимфоидной ткани слизистых. Общая площадь поверхности слизистых у человека составляет 400 м², в ней выделяют структурированную лимфоидную ткань – фолликулы, организованные формирования лимфоидной ткани, а также единичные клетки эпителиального (Т-лимфоциты) и подслизистого (В-лимфоциты) слоев. Классическим примером организованного лимфоидного образования является пейерова бляшка (групповой лимфатический фолликул). Каждая бляшка примыкает к эпителию кишки под М – эпителиальными клетками, лишенными ворсинок. Эти клетки и обеспечивают функцию входных ворот для антигенов. В – лимфоциты составляют до 70% всех клеток пейеровой бляшки, от 10 до 30% приходится на долю Т-клеток. Основное функциональное предназначение пейеровых бляшек – поддержание иммуногенеза В-лимфоцитов и обеспечение синтеза секреторного иммуноглобулина А и Ig Е.
Лимфоидная ткань, ассоциированная с кожей, представлена исключительно Т-лимфоцитами. Обсуждается возможная роль кожи как места внетимусного развития Т-лимфоцитов.
Таким образом, вполне оправдано существование таких понятий и, соответственно, функций, как иммунная подсистема слизистой или кожи. Каждый лимфоидный орган периферической иммунной системы контролирует определенную часть тела, от которого к нему поступает лимфа (лимфоузлы), кровь (селезенка) или же непосредственно контактирует с барьерами, ограничивающими внешнюю среду от внутренней – лимфоидная ткань, ассоциированная с кожей и слизистыми. Все вторичные органы иммунной системы объединены посредством рециркуляции лимфоцитов. Под рециркуляцией понимают процесс перехода клеток из кровяного русла в органы, оттуда – в лимфу, а из нее – в кровоток. Считается, что в среднем зрелые лимфоциты поступают из органов в циркуляцию и обратно 1-2 раза в день. При этом следует отметить, что в каждой ткани лимфоциты имеют свои особенности, а миграция лимфоцитов между лимфоидными и нелимфоидными образованиями, то есть органно-циркуляторный принцип, обеспечен наличием строго определенных молекул адгезии и хоминг-рецепторов. Т-лимфоциты рециркулируют более интенсивно, нежели В-клетки, причем наибольшую активность проявляют Т-хелперы. Особо следует подчеркнуть, что полноценная иммунная реакция развивается непосредственно только в периферических лимфоидных органах, имеющих для этого оптимальную структурную организацию.
В последнее время дискутируется термин «третичные» органы иммунной системы, под которым подразумевается лимфоидная ткань, формирующаяся в результате инфильтрации иммунными лимфоцитами (например, лимфоклеточная инфильтрация щитовидной железы при аутоиммунном тиреоидите). Третичные органы могут утрачиваться при исчезновении соответствующего патологического антигена.
1.3. Клетки иммунной системы
Иммунная система, функционирующая в условиях нормы, постоянно готова к защите внутренней среды от вторжения чужеродных антигенов или сформировавшихся внутри организма измененных структур. В основе всех вариантов защиты лежит взаимодействие клеток иммунной системы. Принято выделять 3 категории клеток, участвующих в формировании иммунных реакций:
Клетки стромы – фибробласты, коллагеновые волокна, эндотелий сосудов. Основное их предназначение – обеспечение межклеточных контактов, направленной миграции, обмен сигналами между клетками благодаря наличию молекул адгезии, а также формирование особого микроокружения, то есть создание условий для развития и поддержания функциональной активности всех участников иммунных процессов.
Вторая группа –
вспомогательные (антигенпрезинтирующие) клетки – элементы мононуклеарной фагоцитарной системы (МФС), дендритные клетки (ДК). Их задача состоит в первичной переработке антигена и создании условий для его распознавания и формирования иммунитета.
Макрофаги – широко распространенная и морфологически гетерогенная группе клеток, объединенная в самостоятельную систему мононуклерных фагоцитов. Основными критериями принадлежности клеток к МФС являются
- Способность к фаго- и пиноцитозу
- Прикрепление к стеклу
- Общность происхождения и морфологии
Макрофаги – гетерогенная группа клеток, однако если морфологически характеризовать «усредненный» макрофаг- это крупная клетка, с эксцентрически расположенным ядром неправильной формы, «пенистой», за счет большого количества лизосомальных гранул, цитоплазмой. Термин «общность происхождения» отражает тот факт, что все клетки МФС дифференцированы из полипотентной стволовой клетки (ПСКК) и имеют единые этапы развития. В костном мозге из ПСКК образуется монобласт – затем промоноцит – затем моноцит, который на этой стадии дифференцировки приобретает параметры моноцита периферической крови. Этот этап для элементов МФС – промежуточный (транспортный). Средняя длительность пребывания моноцита в кровотоке составляет 2-4 дня, после чего он мигрирует в ткани, превращаясь в макрофаг, а в зависимости от микроокружения приобретает различные характеристики, что позволяет говорить о гетерогенности этих клеток, отраженной в их названии:
- макрофаги печени – Купферовские клетки (составляют около половины всех тканевых или резидентных макрофагов)
- макрофаги серозных полостей – перитонеальные и плевральные
- альвеолярные макрофаги
- остеокласты (макрофаги костной ткани)
- суставные макрофаги или синовиальные клетки А типа
- микроглиоциты мозга
- мезангиальные клетки почек
- макрофаги лимфоидных органов
Продолжительность жизни тканевых макрофагов составляет от 20 суток до 7 месяцев, при этом отличительной чертой этих клеток является тот факт, что они не пролиферируют, а увеличение пула при необходимости осуществляется благодаря привлечению подвижной группы моноцитов – способных к миграции – в отличие от тканевых (резидентных).
Несмотря на характерные особенности, зачастую лишь морфологические признаки недостаточны для идентификации этих клеток. Секреторная активность – наиболее характерный признак клеток макрофагального ряда. Считается, что макрофаги секретируют свыше 40 биологически активных веществ. Помимо ферментов, это
- Вещества, обеспечивающие кислородзависимый и кислороднезависмый бактерицидный эффект
- Продукты метаболизма арахидоновой кислоты или биогенные липиды
- Компоненты комплемента
- Вещества, обеспечивающие эритропоэз – эритропоэтин
- Цитокины, в том числе ИЛ-1, ИЛ-6, ФНОα, КСФ, ИФНα, ИЛ-12.
Кроме характеристики секреторной активности, для идентификации макрофагов и изучения их функциональной активности используют поверхностные рецепторы.
1. Структуры, ответственные за межклеточные взаимодействия – наиболее характерный представитель – FcR (рецетор для Fc фрагмента иммуноглобулина). Так, для IgG на клеточной мембране макрофагов предсуществует 3 типа рецепторов: FcγR I (CD64), обеспечивает связь с иммунными комплексами и с мономерами IgG.
FcγR II – CD 32 – сорбирует лишь иммунные комплексы
FcγR III – CD 16 связывает мономеры субклассов G1 и G3.
Экспрессированы также и рецепторы для Fc фрагментов Ig А (FcάR), Ig М (FcμR), Ig Е (FcεR). Взаимодействие рецепторов для Fc фрагментов на поверхности макрофагов с соответствующим иммуноглобулином приводит к активации клеток, росту их метаболической, поглотительной, бактерицидной и (или) цитотоксической активности.
2. Поверхностные рецепторы для комплемента (CR) и его компонентов предназначены для распознавания иммунных комплексов с целью их последующего фагоцитоза.
3. Адгезивные молкулы – название связано со способностью этих структур обеспечивать прикрепление (адгезию) клеток между собой для выполнения своих функций. Молекулы адгезии либо постоянно существуют на клеточной мембране, либо появляются на ней в ответ на стимуляцию. На макрофагальных клетках существуют и широко используются с целью их функциональной характеристики такие группы молекул адгезии, как интегрины (необходимы для взаимодействия с молекулами межклеточного матрикса) – MAC-1 (monocyte adhesion complex), CD 18, CD 11а, CD 11в, CD 11с. Селектины – специфичны для углеводных остатков, оголяющихся при старении и в процессе гибели клеток, через эти рецепторы макрофаги «узнают» стареющую или апоптотирующую клетку (более подробная характристика адгезивных молекул в приложении)
4. Рецепторы для микробных патогенов. В соответствии с современными представлениями (Ch. Janeway, 2001) существуют так называемые патоген-ассоциированные молекулы – паттерны (PAMP) – консервативный рисунок аминокислотных последовательностей, характерный для большинства микроорганизмов и не встречающийся у многоклеточных. Примерами PAMP являются
- пептидогликаны клеточной стенки бактерий (МДП)
- тейхоевые кислоты Грам + бактерий
- ЛПС Грам – бактерий
- полисахариды (зимозан дрожжей, маннаны грибов)
- белки бактериальные и вирусные – флагеллин
- двуспиральная вирусная ДНК и РНК бактерий, содержащая немитилированные цитозин-гуанин последовательности (CpG)
Эти структуры взаимодействуют со специализированными паттерн-распознающими (PRR) рецепторами на поверхности клеток доиммунного воспаления (макрофаг, дендритные клетки). Основные функции PRR
- опсонизация
- активация комплемента
- синтез провоспалительных цитокинов
- индукция апоптоза
- фагоцитоз
Схема 5. Пути активации комплемента.
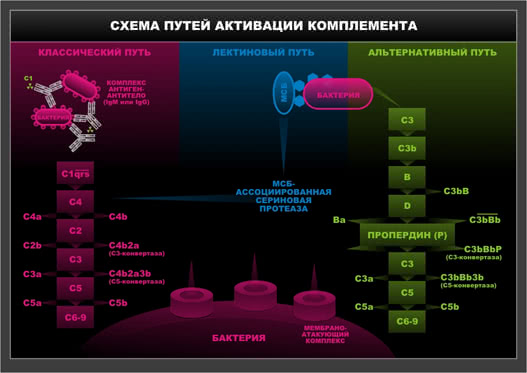
К числу PRR относится CD 14 – один из маркеров клеток миелоидного ряда, он же рецептор для липополисахаридов (ЛПС) Гр- бактерий. Все более пристальное внимание привлекают к себе TLR – TOLL-подобные рецепторы («TOLL» – дверной звонок, свидетельствующий о приходе чужих) – представители трансмембранных белков, экспрессированных на клетках МФС и ДК.
5. Рецепторы для цитокинов – ИЛ –2 (CD 25), ИЛ-1 (CD 121), ИЛ-6 (CD 126), гормонов, нейромедиаторов.
6. Антигены HLA (главного комплекса гистосовместимости) I класса, впрочем, как и на всех ядросодержащих клетках, кроме того, на активированных макрофагах экспрессируются HLA DR, обеспечивающие процессы распознавания и индукции специфического иммунного ответа.
7. Особо следует отметить наличие на поверхности клеток
моноцитарно-макрофагального ряда CD4 («входные ворота» для ВИЧ).
8. Хеморецепторы или рецепторы для хематтрактантов (продукты жизнедеятельности микроорганизмов, цитокины, фрагменты иммуноглобулинов). Взаимодействие хематтрактант – хеморецептор обеспечивает направленное движение клеток – хемотаксис. Уже в процессе хемотаксиса активируются клетки, усиливаются их метаболизм и функциональная активность, а также экспрессия биологически активных веществ. Таким образом реализуется 1 этап фагоцитоза – свойства, определяющего и все многообразие функциональных потенций клеток МФС, и их название.
Следующим за хемотаксисом этапом фагоцитарной реакции является адгезия. В основе ее лежит взаимодействие с соответствующими рецепторами, а результатом служит «контактная активация». Объективным лабораторным тестом, позволяющим оценить степень адгезивной активности макрофагов является метод «распластывания» на стекле, при котором учитываются размеры и количество клеток, прикрепившихся к стеклу.
Далее происходит погружение присоединившейся к клетке частицы, образование фагосомы и фаголизосомы – специализированной внутриклеточной гранулы для расщепления патогена. Здесь включаются механизмы внутриклеточного киллинга (убийства). Кислородзависимый механизм данного процесса получил название «кислородный взрыв», так как при этом активируется продукция атомарного кислорода, гидроксильного радикала, перекисей и прочих продуктов частичного восстановления кислорода, обладающих существенной разрушающей активностью. Объективно фиксирует процесс «окислительного взрыва» методический прием, получивший название НСТ-теста. НСТ – нитросиний тетразолий – краситель, содержащий диформазан, который под влиянием активных форм кислорода восстанавливается в формазан, меняя при этом свой цвет. По интенсивности изменения цвета судят об активности кислородзависимого метаболизма фагоцитирующей клетки. Кислороднезависимый механизм киллинга также весьма важен в реализации эффектов клеток макрофагальной линии, при этом особое внимание последнее время уделяется характеристике азотного метаболизма. Вследствие реализации макрофагами фагоцитарных свойств возможен как полный гидролиз антигена, так и неполный, с представлением фрагментов антигена на мембране (презентация).
Благодаря фагоцитозу – интегративному процессу деятельности клеток макрофагального ряда – осуществляются такие эффекторные реакции, как бактерицидность и цитотоксичность. При реализации этих свойств макрофаги выступают в роли клеток-мусорщиков, неспецифически защищая от инфекционных агентов, состарившихся и трансформированных собственных клеток, а также обеспечивают доиммунные механизмы защиты (врожденный иммунитет). В то же время без макрофагов и их участия в
- рецепции,
- переработке (процессинге),
- презентации (представлении информации об антигене),
- цитокиновой регуляции
невозможен запуск и формирование специфической (адаптивной) защиты. Таким образом, макрофаг и инициатор, и регулятор, и исполнитель иммунных реакций. Периодически в литературе появляются публикации, в которых авторы пытаются выделить субпопуляции клеток МФС. Однако в настоящее время признана точка зрения о том, что гетерогенность макрофагов – не генетически закрепленный признак, морфологическое и функциональное многообразие этих клеток определяется стадией их дифференцировки (гетерогенность «по вертикали»), местом обитания (гетерогенность «по горизонтали»), степенью активации (неактивированные, премированные, активированные). В группе вспомогательных, а на самом деле клеток, во многом определяющих развитие специфических иммунных реакций, макрофаги не одиноки. Все более пристальное внимание, все большее число публикаций в настоящее время отводится их союзникам в распознавании и инициации специфического иммунитета – дендритным клеткам.
ДК – «профессиональные» антигенпредставляющие клетки (АПК). Профессиональные – термин, характеризующий клетки, способные индуцировать иммунный ответ благодаря способности передавать (представлять или презентировать) Т-лимфоцитам два активационных сигнала – информацию об антигене и антигеннеспецифический или ко-стимулирующий сигнал.
Определены 2 состояния ДК – незрелые и зрелые. Незрелые локализованы в местах контакта с чужеродными внешними агентами: в коже и слизистой, маргинальных слоях белой пульпы селезенки. Незрелые дендритные клетки активно поглащают АГ путем фаго- и пиноцитоза. Для этой цели на их поверхности предсуществуют рецепторы распознавания паттернов (PRR, TLR), опсонинов (FcR, CR). Находясь в местах инвазии инфекционного агента, опухолевого роста или некроза ткани, поглащая АГ, под действием разнообразных факторов микроокружения, ДК созревают и приобретают свойство представлять АГ Т-клеткам и индуцировать специфический иммунный ответ.
Схема 6. Противовирусный иммунитет.
 Схема 7. Противобактериальный иммунитет.
Схема 7. Противобактериальный иммунитет.
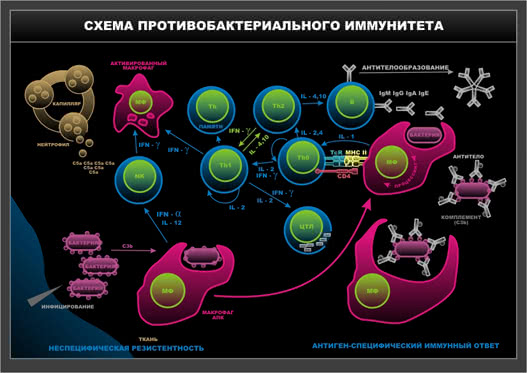 Лимфоциты
Лимфоциты
Ключевым структурным и функциональным элементом иммунной системы является лимфоцит. Морфологически – это округлые клетки диаметром 7-9 микрон с плотным ядром и узким ободком цитоплазмы. Наиболее характерной чертой этой популяции является способность распознавать собственные и чужеродные антигены. Лимфоцит – носитель рецептора для антигена, в случае контакта с которым происходит активация, пролиферация и дифференцировка в эффекторные или регуляторные участники иммунных процессов. В соответствии с
- Происхождением
- Этапами созревания
- Особенностями строения рецептора, распознающего антигены
- Функциональными возможностями
в настоящее время выделяют 3 популяции лимфоцитов:
Т-лимфоциты – название определено местом созревания и дифференцировки (тимус).
В-лимфоциты, получившие название от места своего формирования и развития – bursa (лат) у птиц и bone marrow (англ.- костный мозг) у млекопитающих.
NK – натуральные (нормальные) киллеры или лимфоциты, не несущие антиген – распознающий рецептор.
Несмотря на принципиально различные механизмы формирования иммунных процессов разными популяциями лимфоцитов, долгое время не удавалось найти четких критериев, по которым можно было бы различить эти типы клеток. К 60-м годам прошлого столетия стало ясно, что существуют определенные поверхностные структуры – маркеры, связанные с особенностями функции, этапом развития или функционального состояния. Иначе клеточные маркеры называют клеточными антигенами или рецепторами.
Развитие гибридомной технологии привело к тому, что с помощью моноклональных антител (МкАТ) появилась возможность идентифицировать эти рецепторы. В различных лабораториях были получены моноклональные антитела к одним и тем же антигенам, а авторы присвоили им свои собственные названия. Это привело к номенклатурной путанице. В 1983 году было созвано первое международное рабочее совещание по характеристике антигенов лимфоцитов человека, на которм предложили объединить МкАТ в группы (или кластеры), исходя из того, какую антигенную структуру на клеточной поверхности они распознают. Первоначальный смысл понятия “кластер дифференцировки” или его английская аббревиатура – CD – это набор МкАТ, которые распознают одну и ту же, строго определенную структуру на клеточной поверхности. Со временем понятие приобрело другой смысл, под CD стали подразумевать структуру клеточной поверхности. Обобщенный анализ известных CD молекул в настоящем этапе развития клинической иммунологии необходим, опираясь на их характеристику, можно определить принадлежность лимфоцита к определенной популяции, стадию дифференцировки, степень активации. CD – это «фамилия, имя и отчество» лимфоцита. Данные параметры являются неотъемлемым этапом работы современных иммунологов- аллергологов (см. приложение). С другой стороны, CD-маркеры – это «органы чувств», посредством которых осуществляются межклеточные контакты с целью формирования невосприимчивости к чужеродным антигенам.
Т-лимфоциты: основной чертой является способ распознавания антигена посредством специализированного антигенспецифического Т-клеточного рецептора (ТКР или TCR – англ. аббревиатура). ТКР имеет сложную структуру, состоит из 2 полипептидных цепей, в зависимости от их строения выделяют αβ (1 тип) и γδ (2тип) ТКР. Помимо этого Т-клеточный рецептор включает в себя и другие поверхностные молекулы, например, CD3. Именно CD3 принято использовать в качестве основного маркера зрелого Т-лимфоцита.
Т-лимфоциты происходят от ПСКК, в костном мозге формируются ранние предшественники Т-лимфоцитов, которые на стадии преТ-клеток покидают костный мозг и через кровяное русло мигрируют в тимус. Поверхностный репертуар этой стадии характеризуется наличием CD 34 –маркера ПСКК, CD 38 – рецептор, характеризующий промежуточные стадии дифференцировки клеток различных линий, CD 44 – хоминг-рецептор, позволяющий преодолевать базальную мембрану и направленно мигрировать в тимус. Лимфоциты тимуса называют тимоцитами – это Т-клетки разной стадии дифференцировки. Пре Т-лимфоциты экспрессируют CD2,CD5,CD7 (пан-Т-клеточные маркеры, существующие также и на стадии зрелых внетимусных Т-лимфоцитов). На этом этапе дифференцировки отсутствуют поверхностные CD4 и CD 8 маркеры, что определяет название – стадия двойных негативных Т-лимфоцитов, в отличие от следующей стадии – этапа двойных позитивных Т-лимфоцитов с одновременной экспрессией и CD4, и CD8. Эту стадию также принято называть этапом «позитивной» селекции тимоцитов: выживают только те Т-лимфоциты, которые способны позитивно отреагировать на сигнал «Я свой», то есть узнать собственные антигены. При этом те тимоциты, которые реагируют с антигенами главного комплекса гистосовместимости 1 класса сохраняют CD8 и теряют CD4, а распознающие антигены HLA II класса сохраняют CD4, но теряют CD8 рецепторы. В то же время происходит выбраковка Т-лимфоцитов, чей ТКР соответствует собственным антигенам, т.е. гибнут аутореактивные Т-лимфоциты – процесс, получивший определение «негативная селекция». В результате остается лишь 2% от исходного количества тимоцитов. Гибель остальных клеток происходит вследствие апоптоза. Поэтому на поверхности клеток в значительной мере экспрессирован CD95R (FAS-R), что служит свидетельством особой чувствительности к действию индукторов апоптоза. Таким образом, в тимусе, на границе коркового и мозгового слоя происходит формирование субпопуляций (типы клеток со специализированными свойствами) Т-лимфоцитов:
- Экспрессирующие полноценный Т-клеточный рецептор, распознающий чужеродные антигены в комплексе с антигенами HLA II класса (CD3+CD4+ субпопуляция Т-хелперов-индукторов).
- Экспрессирующие полноценный Т-клеточный рецептор, распознающий чужеродные антигены в комплексе с антигенами HLA I класса (CD3+CD8+ субпопуляция цитотоксических Т- лимфоцитов).
По своим основным свойствам тимоциты медулярного слоя идентичны зрелым периферическим Т-клеткам. Поступающие в кровоток лимфоциты становятся частью циркулирующих Т-лимфоцитов. До встречи с антигеном, к которому предсуществует ТКР, Т-клетки экспрессируют изоформу CD45RA и носят название неиммунных или «наивных» Т-лимфоцитов. При контакте с соответствующим Т-клеточному рецептору антигеном, Т-лимфоциты вовлекаются в процесс активации, пролиферации, дифференцировки в функциональные эффекторы – иммунные Т-лимфоциты или поколение клеток, имевших контакт с антигеном. Для них характерен фенотип CD45R0, высокий процент адгезивных молекул и экспрессия активационных маркеров. По окончании специфической иммунной реакции и элиминации антигена, вызвавшего формирование эффекторных Т-лимфоцитов, в течение нескольких дней гибнет 90% этих клеток, а в циркуляции остаются лишь клетки памяти соответствующей специфичности.
Помимо классических альфа-бетта Т-лимфоцитов существуют Т-лимфоциты, антигенраспознающий рецептор которых имеет другую форму – гамма-дельта. Отличительной чертой этих клеток является преимущественная локализация в эпителиальной ткани (интраэпителиальные Т-лимфоциты), в то время как в периферической крови их не более 10%. Гамма-дельта Т-лимфоциты – это сторожевые клетки эпителиальной ткани, первая линия защиты, занимают промежуточное положение между доиммунными и иммунными механизмами резистентности.
В-лимфоциты. Главным отличительным признаком этой популяции лимфоцитов является присутствие на их поверхности В-клеточного рецептора (BCR). По своей структуре BCR – это мономерный IgМ, встроенный в мембрану клетки. В результате взаимодействия BCR с соответствующим антигеном, В-лимфоциты дифференцируются в плазматические клетки, секретирующие иммуноглобулины, то есть молекулы, связывающие антигены и называющиеся антителами. Таким образом, В-лимфоциты – это клеточный субстрат гуморального иммунного ответа, заключающегося в выработке специфических антител, способных нейтрализовать антиген. Первая стадия развития или стадия про-В-клеток фенотипически характеризуется появлением CD19 –самого раннего пан В-клеточного маркера.
Следующий этап – пре-пре-В-лимфоциты отличается появлением HLA DR и внутриклеточной (цитоплазматической) формы CD22.
Далее следует пре-В-лимфоцитарная стадия – характерные признаки – появление таких В-клеточных маркеров, как CD20, CD22, CD72, цитоплазматической формы IgМ.
Стадия незрелых В-лимфоцитов характеризуется присутствием полноценного или зрелого поверхностного IgМ и вспомогательных молекул. На этом этапе происходит селекция или отбраковка потенциально агрессивных аутоклонов, в результате чего гибнет до 90 % незрелых, аутоактивных В-клеток.
Процесс окончательного созревания В-лимфоцитов завершается экспрессией мембранной формы IgD. IgМ
+ IgD
+ – основные фенотипические критерии зрелой В-клетки. На этом этапе дифференцировки В-лимфоциты током крови переносятся из костного мозга в периферические лимфоидные органы, где и выполняют свои специфические функции. Продолжительность жизни большинства зрелых В-лимфоцитов в В-зависимых зонах без антигенного стимула составляет несколько месяцев. При контакте со специфическим антигеном В-лимфоцит отвечает активацией и дифференцировкой в иммуноглобулин-продуцирующую плазматическую клетку. В настоящее время принято выделять 2 субпопуляции В-лимфоцитов, фенотипически отличающиеся наличием CD5 поверхностного маркера(табл.1).. Основные или так называемые «обычные» В-2 лимфоциты не экспрессируют CD5. Этот поверхностный маркер присутствует на лимфоцитах В-1 фракции, доля которых в периферической крови составляет не более 20% от общего числа В-клеток. Однако в брюшной и других серозных полостях данный тип В-лимфоцитов доминирует. Эти клетки образуются в костном мозге на раннем этапе онтогенеза, далее мигрируют в брюшную полость, где и сохраняют способность к самоподдержанию. В1-лимфоциты служат источником естественных аутоантител и играют принципиально значимую роль в формировании аутоиммунной и лимфопролиферативной патологии. В-клетка памяти фенотипически характеризуется экспрессией HLA DR, IgA, IgG, IgE (но не IgM и IgD), а также CD 19,20,21,40.
Таблица 1. Характеристика субпопуляций В-лимфоцитов. (А.А.Ярилин, 1999г.)
| Признаки и свойства |
Субпопуляция В1 |
Субпопуляция В2 (“обычные” В-клетки) |
|
| Происхождение (у взрослых) |
Из сальника, самопод- держиваются в брюшной полости |
Из костного мозга |
|
| Локализация |
Преобладают в брюшной полости и миндалинах. В крови, селезенке (маргинальная зона), ЛУ – 25-35% |
В крови, селезенке (фолликулы), ЛУ – 65-75% |
|
| Маркеры |
CD5+IgM+IgD+ CD45+CD23–IL-5R+ |
CD5-IgM+IgD+ CD45+CD23+IL-5– |
|
| Селекция клонов |
Нет |
Есть |
|
| Класс образуемых антител |
IgM, IgA |
IgM, затем IgG и другие классы |
|
| Аффинитет антител |
Низкий, не повышается в процессе ответа |
Повышается (“созревает”) в процессе ответа |
|
| Аутоареактивность |
Есть |
Нет |
|
Как уже отмечалось, в периферическом пуле лимфоцитов присутствует фракция, лишенная и Т, и В клеточных рецепторов –
NK. Впервые эти клетки были описаны морфологически как большие гранулярные лимфоциты (БГЛ), способные в условиях in vitro спонтанно (без предварительной индукции иммунитета) убивать клетки, трансформированные опухолевым ростом или инфицированные вирусами. Позже выяснилось, что БГЛ не единственная форма NK, морфологически они могут выглядеть и как малые лимфоциты.
Дифференциация NK осуществляется из общего лимфоидного предшественника, поэтому эти лимфоциты в определенной степени похожи на Т-клетки, в частности, наличием общего поверхностного маркера CD2, общих «ростовых» факторов (ИЛ-2, ИЛ-1), сходным механизмом разрушения клетки – мишени. В то же время принципиально важным отличием является отсутствие специализированных рецепторов, механизм распознавания ориентирован лишь на измененное свое. NK составляют 10-15% от всего числа лимфоцитов периферической крови. Морфологически – это клетки до 15 микрон в диаметре, с плотностью ниже, чем у малых лимфоцитов. В первую очередь данное свойство определяется наличием в цитоплазме NK большого количества гранул. В их составе перфорин – белок, образующий поры в мембране клеток-мишеней и гранзимы – ферменты, индуцирующие апоптоз клеток – мишеней. Особенностью NK является тот факт, что эти клетки, в отличие от Т или В лимфоцитов не рециркулируют между лимфой и кровью, находятся лишь в кровяном русле, а также в таких органах, как печень, слизистые оболочки. Весьма значительно представлены в селезенке, существующие микроокружение в которой создает оптимальные условия для завершения их развития. Основное функциональное предназначение NK лимфоцитов определяется их цитотоксической активностью по отношению к собственным клеткам с измененной антигенной структурой. Это так называемая функция иммунологического надзора. Помимо этого, NK- мощные производители цитокинов, таких как фактор некроза опухоли (ФНО), ИЛ-8 и т.д. Под действием ряда цитокинов, в первую очередь ИЛ-2, повышаются функциональные параметры NK, связанные с их литической активностью, формируются ЛАК (лимфокин-активированные киллеры). К стимулирующим функцию NK также относят ИФН-гамма, ИЛ-12. Маркерами натуральных киллеров признаны CD56 и CD57 – адгезивные молекулы, необходимые для реализации наиболее тесного контакта с клетками-мишенями. Среди поверхностных рецепторов NK, во многом определяющих их свойства, следует отметить FcR 3-его типа – CD 16. Клетки, несущие данный маркер, составляют
субпопуляцию К-клеток: CD16
+ CD56
+, их до 75 % в периферической крови. Посредством CD16 осуществляется антителозависимая клеточная цитотоксичность – АЗКЦ. В этом случае клетки-мишени покрыты (опсонизированы) антителами. Истинные NK осуществляют антитело
независимый лизис – безусловные убийцы – они обладают возможностью лизировать клетки лишь по причине их генетической чужеродности. CD16
– CD56
+ субпопуляция NК преобладает в печени, слизистых, в периферической крови их принципиально меньше. Кроме перечисленных маркеров, на NK экспрессировано большое количество интегринов – рецепторов межклеточного взаимодействия. Таким образом, в фило- и онтогенезе данная система защиты появляется раньше, чем реакции, обусловленные Т и В лимфоцитами, ответственными за адаптивный иммунитет. Содержание основных популяций и субпопуляций лимфоцитов приведены в табл.2.
Таблица 2. Нормальные показатели содержания в крови взрослого человека основных популяций и субпопуляций лимфоцитов (Филатов А.В. 2004)
| Антиген |
Процент от числа мононуклеаров, М+./-m |
|
| CD2 |
80±7 |
|
| CD3 |
72±7 |
|
| CD4 |
39±5 |
|
| CD8 |
23±4 |
|
| CD11b |
21±6 |
|
| CD16 |
12±6 |
|
| CD19 |
9±6 |
|
| CD20 |
9±6 |
|
| CD23 |
3±3 |
|
| CD25 |
0 |
|
| CD38 |
23±6 |
|
| CD45 |
100 |
|
| CD45RA |
64±10 |
|
| CD54 |
22±8 |
|
| CD72 |
9±6 |
|
| CD95 |
52±11 |
|
| HLA-DR |
14±7 |
|
1.4. Основные представления об иммуногенетике
Современная клиническая иммунология – наука, углубившаяся до изучения процессов, происходящих на молекулярном уровне. Одним из сложных, но необходимых для понимания современного клинического иммунолога феноменом является иммуногенетика. Иммуногенетика – относительно новая наука, ее основанием следует считать 1936 год. Открытие главного комплекса гистосовместимости человека (а было это в 1958 году и связано с именем французского исследователя G.Dausset) положило начало клинической иммуногенетике. В настоящее время иммуногенетика человека сосредоточена в основном вокруг двух больших разделов:
- -генетика групповых антигенов эритроцитов (система АВО, резус, минорные системы)
- -генетика антигенов лейкоцитов, называемая также антигенами тканевой совместимости (ГКГС), аббревиатура английского варианта названия – МНС (Major Histocompatibility Complex) У человека этот комплекс генов носит название системы HLA (Human Leukocyte Antigen).
ГКГС – одно из самых трудных понятий, причиной тому может быть оторванность названия от природного предназначения этих структур. Функции системы гораздо шире, чем реализация лишь процессов трансплантологии.
HLA принадлежит существенная роль
- в определении предрасположенности человека к заболеваниям
- в репродукции потомства
- в продолжительности жизни людей.
Главный комплекс гистосовместимости (ГКГС) человека (система HLA) представляет собой комплекс генов, при этом гены основных локусов имеют свое представительство на поверхности клетки в виде антигена HLA. Эти гены сами по себе и через кодируемые ими продукты (антигены) выполняют ряд важных биологических функций:
- генетический контроль силы иммунного ответа
- взаимодействие различных клеток в динамике формирования иммунного ответа
- регуляцию эмбриогенеза
Антигены ГКГС – генетический (иммунный) паспорт, стоящий на охране человеческого вида. Структурно гены ГКГС (или HLA гены) расположены на коротком плече 6 пары хромосом человека.
В соответствии с современными представлениями гены HLA делятся на 3 класса:
I класс – гены областей (или локусов), поименованные буквами латинского алфавита: А В, С (классические, в отличием от открытых недавно локусов E, F, G).
II класс- это D – фрагмент или область, который в свою очередь состоит из нескольких сублокусов: HLA DR, HLA DQ , HLA DР. Недавно были обнаружены еще два гена – DMA и DMB, расположенные между HLA-DP и HLA-DQ. Функция генов локуса DM заключается в обеспечении корректного транспорта молекул II класса из эндоплазматического ретикулума и стабильного связывания альфа-бета гетеродимеров со специфическими пептидами
III класс – полиморфные гены, кодирующие синтез компонентов комплемента, пропердинового фактора и др.
При открытии, изучении и идентификации каждому гену и соответствующему антигену определяется порядковый номер. В случае, когда данные не полные, перед порядковым номером ставят символ «w» (workshop).
Несмотря на сравнительно короткий период изучения системы HLA, она является на сегодняшний день самой хорошо изученной генетической системой не только в геноме человека, но и у млекопитающих в целом. Во многом этому способствовал беспрецедентно высокий уровень научной кооперации в исследовании HLA, где даже не принято патентование результатов. Один из основателей современной иммуногенетики Ж. Доссе в своей Нобелевской речи назвал изучение HLA самым ярким примером гуманитарного сотрудничества в истории человечества.
Ранее существовала возможность изучать полиморфизм HLA только на уровне белковых молекул (HLA – антигенов), экспонированных на мембранах клеток. В последние годы появилась возможность исследования HLA на качественно новом молекулярно-генетическом уровне при помощи полимеразной цепной реакции (ПЦР). Принципиальным отличием новых методов явилось использование в качестве объекта исследования непосредственно генетического материала (участков ДНК, определяющих аллельный полиморфизм системы HLA).
Результатом этого стало заметное увеличение количества известных аллелей HLA – со 150 в 1991 году, 472 в 1998 году до примерно 1500 (данные на январь 2002 года) аллелей. Из них около 900 – аллели HLA I класса, 600 – II класса. Наиболее полиморфны локусы HLA-B и DRB1 – 501 и 316 аллелей соответственно. При этом среди вновь открытых аллелей установлены аллели чрезвычайно высокого уровня ассоциации с заболеваниями (Алексеев и др., 2003).
Антигены HLA –А, В, С, HLA DR, HLA DQ выявляются серологически в стандартном микролимфоцитотоксическом тесте по Терасаки. Иммунные сыворотки с четко установленной HLA-специфичностью получают от женщин с повторными беременостями или путем искусственной иммунизации добровольцев, в последнее время – с помощью моноклональных антител. Внедрение в исследование системы HLA метода ПЦР позволило выявить новые субтипы антигенов. Поэтому в настоящее время применяют четырехзначное обозначение антигенов системы гистосовместимости, например, HLA А0201.
Антигены I класса- А, В и С экспрессированы на всех ядросодержащих клетках организма. HLA I класса необходимы для взаимодействия не только между иммунокомпетентными клетками, но и для обеспечения контакта между всеми другими клетками, вплоть до взаимодействия нейрон-синапс. Структура молекул I класса устроена таким образом, что позволяет презентировать (представлять) на поверхность клеток пептиды, которые несут информацию о всех эндогенных белках конкретной клетки, как нормальных, так и измененных в результате мутации или модификации вирусами или любыми внутриклеточными паразитами. Данный комплекс: пептид – антиген HLA I класса – необходим для контакта с CD8
+ Т-лимфоцитами. Учитывая тот факт, что «классические» HLA I класса представлены на всех клетках, становится понятным, насколько важен подобный цензорный механизм контроля антигенного постоянства организма.
Функции молекул II класса специализированы и строго связаны с иммунным ответом
. Гены II класса HLA системы – это гены иммунного ответа – IR (Immune Response) – гены, отвечающие за реализацию и силу иммунного ответа.
Антигены II класса обеспечивают взаимодействие ИКК между собой и представлены на МФ, ДК, В-лимфоцитах. При воздействии некоторых цитокинов, например ИФН-γ, молекулы HLA II класса экспрессируются и на других клетках, таких как эпителиальные и эндотелиальные, Т-лимфоциты. Антигены HLA II представляют пептиды экзогенных антигенов, подвергшихся деградации в лизосомах. Образующийся комплекс HLA II+пептид транспортируется на поверхность клеток и представляется для распознавания Т-лимфоцитам-хелперам.
Таким образом,
- функциональная активность Т и В-лимфоцитов,
- киллерная активность NK,
- поглотительно-метаболическая активность фагоцитов,
- уровень иммуноглобулинов –
являются наследственными факторами и находятся в ассоциативной связи с определенными HLA-антигенами. Например, для носителей HLA В 8, DR 3 и А 2, В12 характерен сильный иммунный ответ, а для HLA В7, В18, В35 – слабый. Генетически детерминированные различия в силе иммунного ответа не меняются в течение жизни. Иммуногенетические возможности организма определяют возможное начало, течение и исход патологических процессов.
Следующее направление иммуногенетики определяются постулатом: гены, кодирующие антигены гистосовместимости, связаны с предрасположенностью к определенным заболеваниям. К настоящему времени описано более 200 заболеваний на предмет повышенной экспрессии того или иного антигена. Для большинства из них найдены ассоциативные связи различной степени выраженности. Исключение составляют антигены В27, для которого с анкилозирующим спондилоартритом выявлена самая сильная ассоциация из всех ныне существующих. Редкость сильных ассоциативных связей между АГ ГКГС и заболеваниями можно объяснить с помощью концепции вымирания в процессе отбора особей с низкой резистентностью организма к патологическим факторам. Поэтому не удивительно, что практически при всех патологических состояниях, которые подвергались исследованию, выявлены слабые ассоциативные связи. Тем не менее, установленные закономерности вполне можно использовать для определения степени риска возможных заболеваний у каждого человека. При этом важное значение приобретает изучение HLA-антигенов, характерных для того или иного заболевания в совокупности с клиническими, биохимическими, иммунологическими критериями. Это значительно повышает прогностическую ценность антигенов ГКГС в развитии различных болезней. Следует помнить, что развитие (при наличии определенной предрасположенности) конкретного заболевания зависит от воздействия окружающей среды. Неблагоприятные факторы могут ускорить или усилить прогрессирование болезни, их отсутствие – отменить или изменить течение болезни. При выявлении иммуногенетических маркеров заболеваний следует учитывать национальный состав обследуемых групп людей.
Другим немаловажным постулатом является тот факт, что простое присутствие определенных HLA-антигенов в фенотипе не приводит к развитию заболевания точно также как и отсутствие этих антигенов не является гарантией невозможности возникновения болезни. Тем не менее, наличие HLA-ассоциированных заболеваний говорит о том, что антигены ГКГС играют решающую, а не случайную роль в развитии болезни. Пример – установлено увеличение частоты гаплотипа А1, В8, DR3 у больных с аутоиммунными заболеваниями. Механизм этих процессов определяется значительным снижением супрессорной функции Т-лимфоцитов и высоким иммунным ответ на стимуляцию поликлональными антигенами( табл.3).
Таблица 3. HLA-зависимые болезни (Г.Н.Дранник, 2003)
| Заболевание |
Антиген, на который развивается иммунный ответ |
HLA |
|
| Целиакия |
Альфа-глиадин |
DR3; DR7 |
|
| Синдром Гудпасчера |
Коллаген базальной мембраны клубочков почки |
DR2 |
|
| Болезнь Грейвса |
Тиротропный рецептор |
DR3; DR5 |
|
| Зоб Хашимото |
Тироглобулин |
DR3; DR5 |
|
| Инсулинзависимый сахарный диабет |
Декарбоксилаза глутаминовой кислоты (ДГК-65 и ДГК-67); инсулиновый рецептор; тирозин-фосфатаза IA-2 альфа и IA-2 бета |
DR3; DR4 |
|
| Рассеянный склероз |
Основной белок миелина |
DR3; DR4 |
|
| Тяжелая миастения |
Рецептор к ацителхолину |
DR3 |
|
| Болезнь Бехтерева |
Неизвестен |
B27 |
|
| Синдром Рейтера |
Неизвестен |
B27 |
|
| Пернициозная анемия |
Н+/К+АТФаза; внутренний фактор |
DR5 |
|
| Нарколепсия |
Неизвестен |
DR2 |
|
| Системная склеродермия |
ДНК-топоизомераза; РНК-полимераза |
DR5 |
|
| Псориаз вульгарный |
Неизвестен |
DR7 |
|
| Ревматоидный артрит |
Fc-фрагмент Ig; коллаген; кальпастатин |
DR7; DR21 |
|
| Ювенильный ревматоидный артрит |
Fc-фрагмент Ig; коллаген |
DR5; |
|
| Системная красная волчанка |
Двуспиральная ДНК |
DR3; DR2 |
|
| Витилиго |
Тирозиназа |
DR4 |
|
| Герпетиформный дерматит |
Неизвестен |
DR3 |
|
| Пузырчатка обыкновенная |
«Ре – V антигенный комплекс» |
DR4; DRw6 Fc-фрагмент Ig; коллаген; |
|
Многие исследователи не обнаружили взаимосвязи между возникновением злокачественных новообразований и антигенами ГКГС. В то же время существует огромное количество работ, свидетельствующих о повышенной частоте встречаемости тех или иных антигенов при различных опухолевых процессах. Более значимый момент – это количественная экспрессия антигенов ГКГС. Установлено, что гетерозиготы более жизнеспособны и устойчивы, чем гомозиготы. Полная потеря экспрессии АГ I класса («лысые» клетки) ведет к развитию онкозаболеваний – карциномы, меланомы, лимфомы. Вирусные онкогены, такие как папилломавирусы, могут уменьшать экспрессию АГ I класса. С другой стороны, чрезмерная экспрессия антигенов II класса может стать причиной индукции аутоиммунной патологии. Научиться влиять на эти процессы – возможность решения проблем онкозащиты и аутоагрессии.
Иммуногенетика беременности – совместимость супругов по нескольким антигенам ГКГС может вызывать возникновение спонтанных абортов, токсикозов. Совпадение по 3 и более АГ определяет неблагоприятный акушерский анамнез, а нормальное развитие плода обусловлено степенью антигенного различия родителей. На основании HLA- типирования возможно установление отцовства, материнства, замены детей. В мировой практике судебно-медицинской экспертизы спорного отцовства широко применяется обследование родителей по антигенам I класса ГКГС исходя из следующих постулатов:
– наследование антигенов HLA-А,В,С происходит по аутосомно-доминантному признаку
– антигены HLA- А,В,С представляют собой постоянные иммуногенетические маркеры, полностью сформированные к моменту рождения ребенка и неизменные в течение всей жизни .
– определение антигенов HLA-А, В, С на лимфоцитах периферической крови с помощью стандартного микролимфоцитотоксического теста является относительно простой, хорошо отработанной и воспроизводимой методикой (достоверность исключения отцовства составляет 99,94%)
Одним из значительных достижений теоретической и клинической медицины на сегодняшний день является аллогенная трансплантация. Установлено, что основная роль в развитии реакции отторжения трансплантата принадлежит HLA-антигенам. Основная цель подбора пар донор-реципиент состоит в устранении несовместимости по наиболее активным антигенам. Подбор 1 донора, идентичного реципиенту по антигенам HLA А, В, С, DR теоретически возможен из 40 тысяч обследованных
– Совместимость по антигенам I класса не оказывает заметного влияния на выживаемость трансплантата в течение 5 лет
– Идентичность донора и реципиента по HLA DR локусу увеличивает 5-летнюю выживаемость в 2 раза
– HLA-системе принадлежит двойная роль в судьбе трансплантата: совместимость по HLA способствует длительному приживлению трансплантата, но индуцирует другие механизмы иммунного повреждения (например, аутоиммунную патологию)
Развитие любого заболевания происходит в результате взаимодействия экзогенных и эндогенных факторов. Наличие генетической предрасположенности к какому-либо заболеванию не обязательно должно привести к развитию этой патологии у человека. Важное влияние на развитие патологического процесса оказывают разнообразные внешние факторы. Поэтому на основании HLA-фенотипа можно рекомендовать определенный образ жизни, климатические условия, профессию, которые могли бы избежать воздействия внешних факторов, способствующих возникновению определенного патологического процесса.
1.5. Антигены
Первоначально термин АНТИГЕН (от английского
antibody
generator) применяли для обозначения любой молекулы, индуцирующей образование антител. В настоящее время этот термин имеет более широкий смысл и характеристика антигена осуществляется с 2 позиций
- генетически чужеродный агент, участник иммунного процесса
- биологический маркер организма (существуют такие понятия как антигены эритроцитов, лимфоцитов, генетические маркеры).
АНТИГЕНАМИ называю вещества или те формы веществ, которые несут признаки генетической чужеродности и способны индуцировать на себя иммунный ответ в виде выработки специфических антител и (или) иммунных Т-лимфоцитов.
Главные свойства, определяющие вещество как антиген: Антигенность (иммуногенность) и специфичность.
Антигенность или иммуногенность – способность индуцировать иммунный ответ, т.е. быть доступными для распознавания лимфоцитами. При этом Т-лимфоцит с αβ- типом Т-клеточного рецептора способен распознать АГ только после его контакта и обработки в антигенпредставляющих клетках, когда он становится «видимым». Иммуноголобулины распознают, то есть связывают антигенные детерминанты и на нативных, непереработанных антигенах. Процедура попадания АГ в организм называется иммунизация, а второе название АГ – иммуноген. Иммуногенность зависит от свойств антигена, дозы, способа введения, а также от индивидуальных особенностей реципиента. Основные свойства АГ, определяющие его иммуногенность:
- ЧУЖЕРОДНОСТЬ. Если вещество не несет генетически чужеродной информации для данного организма, то антигеном быть не может, это свойство заложено в самом названии .
- МОЛЕКУЛЯРНАЯ МАССА Чем больше масса молекулы, тем более она иммуногеннна. Повышение полимерности белков сопровождается повышением их иммуногенности. Установлено, что вещества с относительно низкой молекулярной массой (менее 1 тысячи дальтон) – моносахариды, аминокислоты, липиды неиммуногенны, крайняя граница – 8-10 килодальтон.
- Структура антигена – или конформационные особенности –пространственное расположение различных структур одной молекулы.. В результате тепловой обработки происходит изменение конформации молекул и усиление его иммуногенных свойств. Конформационные изменения собственных молекул, например, IgG, способствуют появлению иммуногенного эффекта и формированию анти IgG-антител, развитию аутоиммунных процессов.
- Доза введения АГ играет существенную роль в развитии иммунного ответа.
Малые дозы вызывают слабый иммунный ответ, средние – нормальный, большие – способствуют формированию толерантности
ТОЛЕРОГЕННОСТЬ – свойство антигена не воспроизводить иммунный ответ.
Антигенная
специфичность – способность взаимодействовать с продуктами иммунных реакций (антитела, специфические Т-лимфоциты). Антитела взаимодействуют с определенной областью молекулы антигена, названной эпитопом. Один антиген может иметь несколько различных или повторяющихся эпитопов. Антитела специфичны именно к эпитопам, но не ко всей целостной молекуле антигена.
В зависимости от наличия или сочетания иммуногенности и специфичности все АГ делятся на
ПОЛНОЦЕННЫЕ – обладают двумя характеристиками одномоментно, а именно – обеспечивают и запуск иммунного ответа, и взаимодействие с продуктами иммунных реакций.
НЕПОЛНОЦЕННЫЕ антигены или ГАПТЕНЫ – не обладают способностью вызывать иммунный ответ самостоятельно, но взаимодействуют с продуктами иммунных реакций. Таким образом, характеризуются лишь одной из двух основных функций. Свойство полноценного антигена приобретают лишь при соединении с крупномолекулярными веществами –носителями или адъювантами.
Классификации:
1.По способности включать в иммунный процесс разные популяции лимфоцитов
антигены делятся на тимусзависимые и тимуснезависимые. Большинство природных антигенов являются Т- зависимыми, то есть при форировании иммунного ответах необходимо участие клеток Т-ряда. Т-независимые антигены характеризуются многократным повторением одинаковых антигенных детерминант (эпитопов) и способны включать В-клетки к производству специфических антител без участия Т-лимфоцитов-хелперов. Однако в этом случае синтезируются лишь иммуноглобулины класса М и не формируются клетки памяти.
Схема 8. Антителообразование при первичном и вторичном иммунном ответе.
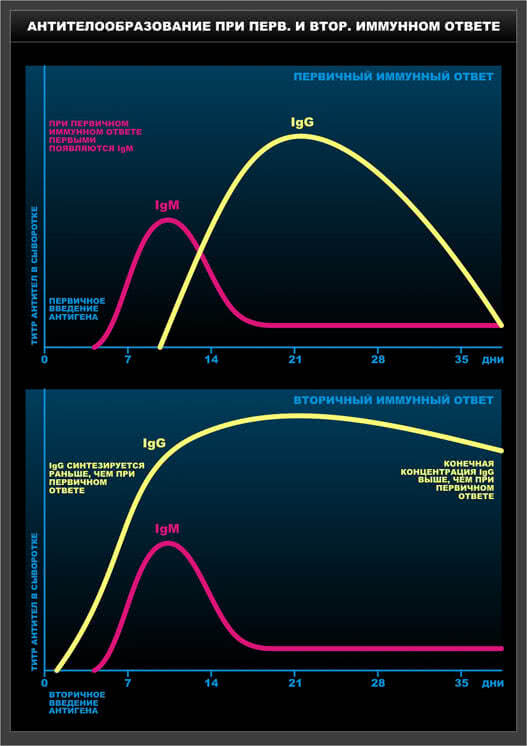 2. По химической природе
Белки.
2. По химической природе
Белки. Например, белки сыворотки, микробные токсины и белковые комплексы – компоненты клеточных мембран, антигены группы крови системы АВО
Полисахариды – в первую очередь – капсулы бактерий
Фосфолипиды – клеточные стенки бактерий
3.По происхождению –
Природные
Модифицированные
Синтетические
Неорганические соединения (бром, йод)
Металлы (никель).
4. В практическом варианте антигены классифицируют в соответствии с теми свойствами, которые важны для конкретного прикладного аспекта.
Например, аллергологи классифицируют антигены (аллергены) в соответствии с источниками происхождения и путями проникновения в организм – пищевые, пыльцевые, бытовые и.т.д.
Микробиологи классифицируют АГ микроорганизмов в соответвсвии с таксономической классификацией последних – видо-, типо-, субтипо специфичные.
Трансплантологи выделяют тканевые антигены, которые далее классифицируются как аллоантигены – общие в пределах одного биологического вида, ксеноантигены – АГ другого биологического вида, сингенные – АГ генетически тождественных организмов, например, АГ однояйцевых близнецов.
Классифицируют также
Постоянно присутствующие – нормальные или естественные антигены, такие как АГ АВО, ГКГС, а также антигены так называемых «забарьерных» органов и тканей, которые в процессе эмбриогенеза были недоступны для контакта, поэтому при нарушении биологичексих барьеров могут стать причиной возникновения аутоимунной патологии.
Временно присутствующие АГ – эмбриональные, патологические (холодовые, лучевые, ожоговые, белки теплового шока), АГ беременности, периода лактации и т.д.
В последние десятилетия появился новый термин – суперантигены, относящийся к некоторым белкам микробного происхождения, их особенность – поликлональная стимуляция лимфоцитов. К таким антигенам относят энтеротоксин стафилококка, ВИЧ, вирус Эпштейна-Барр и т.д.
Таким образом, вне зависимости от области изучения и особенностей характеристики и классификации, основные характеристики антигена – иммуногенность и специфичность, то есть способность вызывать иммунный ответ со всеми присущими ему признаками. При этом всегда следует помнить, что развитие специфических иммунных реакций зависит не только от антигена, но и от «иммунокомпетентности» организма. К примеру, известно позитивное действие вакцин, обеспечивающих профилактику инфекционных заболеваний, но тем не менее стандартные вакцины не могут исправить несоответствие гена иммунного ответа какому-либо конкретному антигену и не будут одинаково подходить всем и каждому, несмотря на абсолютную полноценность антигена.
1.6. Антитела
Антитела– эффекторные продукты специфического иммунного ответа по гуморальному типу, синтезируются плазматическими клетками, образующимися при дифференцировке В-лимфоцитов.
Антитела – это особые растворимые белки с определенной биохимической структурой (иммуноглобулины), которые присутствуют в сыворотке крови и других биологических жидкостях, и которые организм вырабатывает для связывания антигенов. Международная аббревиатура иммуноглобулинов – Ig. Заглавная латинская буква рядом обозначает один из пяти существующих у всех млекопитающих классов иммуноглобулинов – М, А, G, E, D. Последующая арабская цифра обозначает субкласс. Субклассы есть лишь у иммуноглобулинов класса G – G 1,2,3,4 и Ig А – A1, А2. Классы и подклассы, вместе взятые, называют изотипами. Таким образом, классов иммуноглобулинов 5, а изотипов – 9.
В 1959 R. Porter подверг Ig G кролика протеолизу и получил 3 фрагмента, два из них были одинаковыми и сохраняли способность связывать антиген – Fab – (fragment antigen binding). Третий фрагмент отличался от первых двух и имел свойство легко кристаллизоваться, он был обозначен как Fс. Впоследствии стало известно, что Fс фрагменты иммуноглобулинов в пределах одного изотипа у конкретного индивида строго идентичны и независимы от специфичности. За это постоянство их впоследствии и стали называть константными. Основной структурной единицей иммуноглобулинов является комплекс, состоящий их двух идентичных легких (Light) и двух тяжелых (Heavy) полипептидных цепей. Цепи Ig свернуты в глобулярные структуры, называемые доменами. Легкие цепи образуют по 2 домена. Тяжелые – 4 или 5, в зависимости от класса иммуноглобулина. Концевые области цепей составляют вариабельный и константный участки. Вариабельный участок образует 2 антигенсвязывающих центра. Все, что ниже вариабельных участков, называеся С (константной) областью. Классы иммуноглобулинов отличаются друг от друга по структуре тяжелых цепей, эти цепи, в зависимости от класса обозначены строчными буквами греческого алфавита для A –альфа, Ig М –мю, IgG –гамма, IgD –дельта, IgЕ –эпсилон.
Следует отметить 2 основные функции, присущие каждому иммуноглобулину
Во-первых, это блокирование антигена посредством активных центров (участвуют Fab –фрагменты).
Во-вторых, удаление антигена, то есть осуществление эффекта элиминации (реализуется Fc фрагментом). Fc фрагменты иммуноглобулинов обеспечивают взаимодействие комплексов АГ- антитело с «санирующими» структурами, то есть с клетками, обеспечивающими деструкцию и удаление АГ из организма. Для этого существуют Fc рецепторы для иммуноглобулинов различных классов на поверхности макрофагов, лимфоцитов, нейтрофилов, эозино- и базофилов, тучных клеток, NK. Взаимодействуя с Fc областью иммуноглобулина, рецепторы стимулируют фагоцитоз, противоопухолевую активность, дегрануляцию тучных клеток.
В качестве типичной иммуноглобулиновой молекулы можно рассматривать молекулу
Ig G. На долю Ig G приходится до 80% всех иммуноглобулинов сыворотки. Концентрация IgG возрастает при инфекционных заболеваниях, болезнях печени, аутоиммунной патологии. Ig G, связывая соответствующие им по специфичности антигены, образуют иммунные комплексы и через Fc-гамма рецепторы адсорбируются на фагоцитах, которые их и расщепляют. Возможен и вариант фиксации антигенраспознающего участка Ig G к инфицированным клеткам, при этом через Fc фрагмент происходит контакт с NK клетками, индуцирующими апоптоз клетки-мишени.
Ig М у человека представлен пентамером, то есть состоит из 5 классических четырехцепочечных единиц. Субъединицы пентамера соединены дисульфидными связями между доменами. При этом в молекуле этого иммуноглобулина имеется добавочная пептидная J – цепь (от англ Joint – связь). Эта цепь и связывает конечные цистеины на С-концах тяжелых цепей. Ig М первым появляется и в процессе эволюции, и в период внутриутробного развития, и при формировании первичного иммунного ответа на антиген. В сыворотке составляет 10-15% от общего количества Ig. Активирует комплемент, через плаценту не проникает. Обеспечивает защиту от бактериальных инфекций. IgM в составе иммунных комплексов фиксируют C3b, C4b компоненты комплемента, для них на поверхности эритроцитов существуют рецепторы. Связав образовавшиеся иммунные комплексы – антиген-иммуноглобулин-комплемент, эритроциты транспортируют их в печень и селезенку, где происходит поглащение макрофагами.
Ig А в сыворотке составляет до 20% от общего количества иммуноглобулинов. Представлен мономером, однако в секреторных жидкостях (слеза, слюна, молозиво, кишечный сок и т.д.) – димер, состоящий из 2 классических молекул, объединенных J цепью. Секреторный вариант иммуноглобулина А имеет еще одно дополнительное образование – секреторный компонент (CК). Cекреторный компонент синтезируется не в плазматических клетках, как все компоненты иммуноглобулинов, а в эпителиальных. При прохождении димера Ig А, удерживаемого J связью, через эпителиальный покров, происходит присоединение СК. Существует 2 изотипа Ig А. Преобладающим подклассом иммуноглобулина А как в сыворотке, так и в секретах является А1 (90 и 95% соответственно). Однако в просвете толстой кишки около 60% IgА составляют подкласс IgА2. Следует подчеркнуть важность присутствия Ig А в молозиве и грудном молоке, защищающего новорожденного от патогенов. Ig А активирует комплемент по альтернативному пути, обладает способностью нейтрализовывать бактерии и вирусы. При нарушении биоценоза слизистой нейтрализующая функция иммуноглобулина А секретов резко снижается. Дефицит IgА способствует развитию хронического воспаления и аллергических заболеваний.. Низкие концентрации Ig А в крови не означают, что организм продуцирует Ig А меньше, чем иммуноглобулины других классов. Димеры IgA «пытаются» перехватить антигены еще во внешней среде, не дав им проникнуть во внутреннюю. Кроме того, на эозинофилах существуют рецепторы для IgA, через которые они связывают IgA с соответствующим антигеном. В этом случае эозинофил начинает синтезировать белковые токсины, обладающие антигельминтной активностью – IgA-опосредованная АЗКЦ.
IgD составляет менее 1% всех иммуноглобулинов сыворотки. Его физиологическая функция изучена недостаточно, но известно, что мембранный IgD вместе с Ig М являются критерием зрелости В-лимфоцитов. Предполагается роль IgD в формировании местного иммунитета, дифференцировке лимфоцитов.
IgЕ состоит из более крупных тяжелых цепей, содержащих не 4, а 5 доменов. Прежде всего, IgЕ – это поверхностный клеточный рецептор. В сыворотке он пребывает транзиторно при передвижении от плазматических к тучным клеткам и базофилам. Принципиально важна роль в антигельминтной защите. В работах последних лет появились сообщения о том, что IgЕ более чем на 90 % секретируются в слизистый экзосекрет ЖКТ. Высокоафинные рецепторы для IgE присутствуют на тучных клетках, базофилах, связывание через этот рецептор комплекса IgE-антиген приводит к дегрануляции медиаторов, что формирует сосудистые реакции, спазм бронхов, ЖКТ и т.д. Кроме того, на эозинофилах присутствуют низкоафинные R Fс-эпсилон-2, через этот рецептор происходит формирование комплекса: антиген-иммуноглобулин Е- эозинофил. Типичный антиген для инициации IgE ответа – гельминты. Эозинофил, вступивший в подобную связь, синтезирует белковые токсины, убивающие гельминтов (IgЕ опосредованная АЗКЦ).
Существенным и уникальным свойством антител, отличающим их от других иммуноглобулин-подобных структур, является способность взаимодействия с цельными (нативными или необработанными) АГ. Следовательно, не требуется время на предварительную обработку и эффекторная функция осуществляется немедленно. Антитела – единственный фактор безотлагательной защиты организма, например, от сильных ядов
Сродство между антигеном и соответствующим ему антителом количественно и качественно характеризуют такими понятиями, как аффинность и авидность. Сила химической связи одного антигенного эпитопа с одним из активных центров молекулы иммуноглобулина называют аффинностью.
Силу связи цельной молекулы антитела со всеми, которые ей удалось связать, антигенными эпитопами, называют авидностью .
Молекулы иммуноглобулина одной и той же специфичности по антигену присутствуют в организме в трех формах:
– растворимой (кровь и другие биологические жидкости)
– на мембране В-лимфоцита в составе рецептора для антигена – BCR
– в связи с клетками, но не в трансмембранном варианте, а связанными за Fc – фрагмент Fc-рецептором клетки.
Каждый единичный В лимфоцит оказывается способным к синтезу единственного варианта антитела по признаку своего BCR. В динамике иммунного ответа, по мере дифференцировки В-лимфоцитов происходит переключение синтеза изотипов иммуноглобулинов, но остается неизменной специфичность, то есть структура антигенсвязывающего центра. Вся совокупность В-лимфоцитов организма способна синтезировать около 10 в 16 степени вариантов разнообразных по специфичности АТ. Каждому единичному В-лимфоциту и его дочерним лимфоцитам (клону) на роду написано обслужить некоторое множество антигенов. Продолжительность жизни большинства зрелых В-лимфоцитов составляет без антигенной стимуляции несколько месяцев. Продолжительность жизни плазматической клетки –4-7 суток.
1.7. Взаимодействия клеток в динамике формирования иммунного ответа.
Сам факт установления необходимости последовательного взаимодействия клеток в динамике иммунного ответа является одним из принципиально важных достижений современной иммунологии. В 1966 году H.N. Glaman первым пришел к этому выводу, основанному на экспериментах с линейными (без антигенных различий) мышами и продемонстрировал необходимость участия клеток как Т, так и В ряда в формировании гуморального иммунного ответа. В 1968 г. D.Mosier и A. Coppleson, отрабатывая условия культивирования иммунокомпетентных клеток in vitro выявили еще одного участника в реакциях формирования полноценного иммунного ответа – антигенпредставляющие (вспомогательные) клетки. Совокупность полученных данных послужила основой формирования представлений о трехклеточной системе кооперации. В настоящее время роль каждого участника системы межклеточного взаимодействия определена довольно четко.
Первый этап определяется возможностями вспомогательных клеток – макрофагов и ДК. Их функция состоит в захвате антигена (здесь следует вспомнить о паттернраспознающих рецепторах – PRR), его переработке и приведению в иммуногенной форме на свою поверхность (презентация).
Схема 9. Центральная роль макрофага в иммунитете.
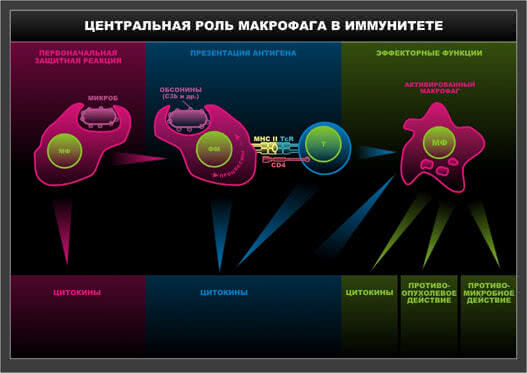
Следующий этап – распознавание антигена. Для этого антиген представлен на поверхности презентирующей вспомогательной клетки в контексте с антигенами HLA II класса. В этом случае контакт CD4 поверхностного рецептора Т-лимфоцита с антигенами HLA обеспечивает сигнал «Я свой», необходимый для последующего взаимодействия антигена и соответстующего ему Т-клеточного рецептора. Распознавание «чужого через свое» или «измененное свое» – один из основных постулатов современной клинической иммунологии. Передача информации о характере антигена, то есть взаимодействие антиген – ТКР – это так называемый специфический сигнал (или приказ) о необходимости действия. Однако полноценного иммунного ответа не произойдет без создания условий для его выполнения. Эти условия обеспечиваются цитокинами, продуцируемыми антигенпредставляющими клетками: ИЛ-1, ИЛ-6, ФНО. Кроме того, в случае исходного поглощения патогенов через паттерн-распознающие рецепторы и особенно при контакте с ТOLL -подобными рецепторами резко усиливается экспрессия костимулирующих молекул на поверхности антигенпредставляющих клеток, что обеспечивает максимально близкий контакт между вспомогательными и антигенраспознающими клетками и служит условием формирования полноценного иммунного ответа.
Схема 10. Гуморальный иммунный ответ.
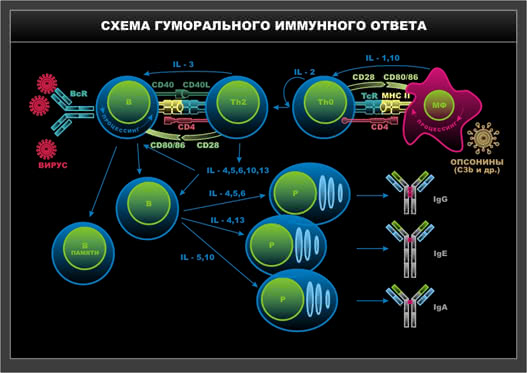
В случае формирования иммунного ответа по гуморальному типу следующий этап межклеточного взаимодействия состоит в контакте между ТКР и ВКР одинаковой специфичности, то есть Т-лимфоцит – хелпер передает информацию об антигене В-лимфоциту, реализуя таким образом специфический сигнал. Источником неспецифического сигнала также являются CD4 Т-клетки. Они продуцируют спектр цитокинов для трансформации В-клетки в плазматическую, синтезирующую антитела. В том случае, когда формируется иммунный ответ по клеточному типу,
Схема 11. Клеточный иммунный ответ.
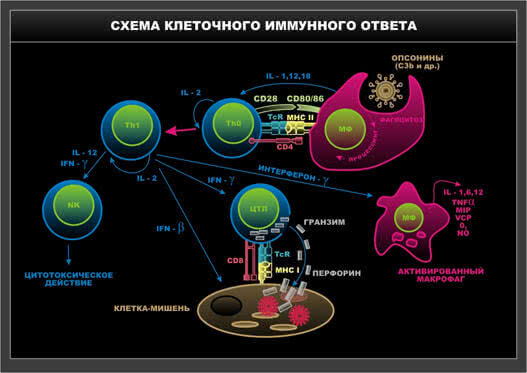
Т-лимфоцит хелпер взаимодействует с соответствующим по структуре ТКР цитотоксическим Т-лимфоцитом. Соответствующие цитокины, продуцируемые CD4
+ Т-клетками-индукторами, создают условия для формирования иммунного ответа по клеточному типу. В этом случае образуется клон цитотоксических CD8
+Т-лимфоцитов, направленных на разрушение клеток-мишеней. Вся совокупность описанных последовательных реакций определяется как «Двухсигнальная система трехклеточной кооперации формирования специфического иммунного ответа» (Р.В.Петров, 1983). При этом необходимо участие
Трех типов клеток
- Вспомогательных (антигенпредставляющих)
- Индукторных (распознающих чужеродную субстанцию и запускающих иммунный ответ)
- Эффекторных (реализующих иммунную реакцию, удаляя чужеродный антиген посредством антител или специфических цитотоксических Т-лимфоцитов)
И двух вариантов сигналов
- Специфического (информация о характере антигена)
- Неспецифического (продукция цитокинов, определяющих условия для реализации специфического сигнала).
Таблица 4. Этапы развития иммунного ответа (Игнатьева Г.А.,2003)
| Иммунный = ответ |
Первичное узнавание
чужого рецепторами клеток доиммунного воспаления (PRR,TOLL, BCR) Развитие доиммунного воспаления. → |
Представление комплексов МНС с пептидом
Т-лимфоцитам. Рас-познавание Т-лимфоцитами по-врежденного «своего» → |
Развитие иммуного ответа (пролиферация лимфоцитов и продукция ими провоспалительных цитокинов и иных эффекторных молекул) → |
Миграция иммунных лимфоцитов в ткани, пораженные патогеном; развитие там иммунного воспаления; деструкция тканей, повреденных патогеном |
|
Существенное значение в теории иммунологии имели работы, посвященные расшифровке механизмов формирования иммунитета по гуморальному или клеточному типу в зависимости от типов Т-индукторов. В последнее время стало очевидным существование, по крайней мере, 4 типов Т-хелперов, обозначаемых как Th0,Th1, Th2, Th3. «Внешне», то есть по фенотипической характеристике, эти клетки не отличаются или, по крайней мере, в настоящее время неизвестны отличительные мембранные структуры, однако типы лимфоцитов-хелперов различны по набору секретируемых ими цитокинов. При этом для Th0 характерна слабая «следовая» секреторная активность и эти клетки готовы трансформироваться в Th1 или Th2 типа. В том случае, если в качестве антигена выступают вирусы и любые микроорганизмы с внутриклеточным паразитизмом, макрофаги в ответ на стимуляцию антигеном помимо перечисленных выше «основных» цитокинов – ИЛ-1, ИЛ-6, ФНО, продуцируют ИЛ-12. Этот медиатор, воздействуя на Th0, стимулирует их к выработке ИЛ-2 и ИФН-γ, что и обеспечивает трансформацию Th0 в Th1. Кроме того, ИЛ-12 макрофагального происхождения ингибирует переход Th0 в Th2. Итак, Th1становятся источником ИЛ-2, ИФН-γ, ФНО. Эти медиаторы служат неспецифическим сигналом (необходимым условием) пролиферации цитотоксических Т-клеток и формирования иммунного ответа по клеточному типу. Под влиянием Th1 также в небольшой степени формируется продукция антител, в основном IgG2, необходимых в реализации АЗКЦ.
В случае, если антиген представлен аллергенами, гельминтами, внеклеточными микроорганизмами, прежде всего кокковой природы, в процессе их переработки АПК не продуцируется ИЛ-12, а вырабатывают лишь ИЛ-1, ИЛ-6, ФНО. В отсутствие ИЛ-12 происходит дифференцировка Th 0 в Th2. Образовавшиеся Th2 проявляют себя как хелперы для продукции В-лимфоцитами Ig всех классов. Основным медиатором выступает ИЛ-4, запуская иммунный ответ по гуморальному типу, обладает способностью ингибировать синтез макрофагального ИЛ-12. Помимо ИЛ 4, Th2 продуцируют ИЛ-10 (ингибитор синтеза ИФН-γ), ИЛ-5, ИЛ-13, ИЛ-3.
Таким образом, характер антигена определяет судьбу иммунного ответа. В зависимости от вида антигена формируется тот или иной тип цитокиновой реакции, обеспечивающий дифференцировку Th.(табл.5). Что касается Th 3, то в литературе данных об этом варианте Т-хелперов немного, однако известно, что они продуцируют трансформирующий фактор роста (ТФР-β), супрессирующий функцию как Th1, так и Th2.
Таблица 5. Типы Т-хелперов и их связь с системой цитокинов (А.А.Ярилин,1999)
| Тип Т-хелперов |
Секретируемые цитокины |
Ответ на действие цитокинов |
|
| Th0 |
ИЛ-2, слабо – ИЛ: 3,4,5,6,10,13, ИФНg, ФНО a и b, ГМ-КСФ |
ИЛ-12 и ИФНg индуцирует раз- витие в направлении Th1, ИЛ-4 и ТФРb – в направлении Th2 |
|
| Th1 |
ИФНg, ИЛ-2, ФНО a и b, ИЛ-3, ГМ-КСФ, хемокины |
ИЛ-2 – фактор роста, ИЛ-10 – ингибитор |
|
| Th2 |
ИЛ: 4,5,6,9,10,13,3, ГМ-КСФ, хемокины |
ИЛ-2 и ИЛ-4 – факторы роста, ИФНg и ИЛ-10 – ингибиторы |
|
В заключение следует уделить внимание существованию промежуточных иммунных реакций, получивших свое название в связи с тем, что они развиваются не по механизму доиммунной защиты и не по принципу лимфоцитарных иммунных реакций. Эти реакции определяются функциональными возможностями следующих типов клеток (Игнатьева Г.А., 2003):
- NK – на их поверхности отсутствуют антигенраспознающие рецепторы, однако экспрессированы особые структуры, взаимодействующие с HLA I класса
- внутриэпителиальные лимфоциты с ТКР гамма-дельта.
- В1-лимфоциты брюшной и плевральной полостей
Эти лимфоциты не пролиферируют после связывания антигена, но в них быстро продуцируются эффекторные молекулы. Ответ не слишком специфичный, однако, наступает быстрее, чем истинно лимфоцитотропный, но иммунной памяти нет.
1.8. Гормоны и медиаторы иммунной системы
Еще до открытия роли Т- и В-лимфоцитов в формировании специфических иммунных реакций, то есть в начале 60-х годов прошлого века, стало известно, что особые вещества, выделяемые из тимуса и названные гормонами, оказывают корригирующее действие при некоторых формах иммунодефицитов.
Гормоны и медиаторы иммунной системы – это субстанции, обеспечивающие процессы
- Созревания и развития иммунокомпетентных клеток (ИКК)
- Взаимодействия ИКК между собой
- Взаимодействие ИС с другими системами организма
Гормоны – производные тимуса и костного мозга, выработка которых происходит без антигенного стимула
Медиаторы – сложный динамический комплекс белков крови, секретов ИКК, регулирующих функции не только ИКК, но и других клеток организма. К медиатором следует относить и цитокины.
Цитокины – более узкое понятие, гуморальная составляющая межклеточных взаимодействий в иммунной системе.
Гормоны тимуса.
Тимозин (фракция 5), состоит из полипептидов различной молекулярной массы, представленных
- продуктами разрушения тимоцитов
- веществами, которые продуцируют тимоциты
- истинные гормоны, секрет эпителиальных клеток тимуса.
Тимозин – 5, формирует лимфоцитоз, стимулирует антителообразование, противоопухолевый иммунитет.
Тимопоэтин. Известны 2 его фракции, отличные по аминокислотным последовательностям. Истинный иммуномодулятор, способный в зависимости от исходного функционального уровня подавлять или активировать Т-клетки, не имея непосредственного воздействия на В-лимфоциты.
Тимический гуморальный фактор (ТГФ) – полипептид, обладает стимулирующей активностью в отношении Т-клеток. Механизм действия общий для пептидных гормонов и опосредован эффектами аденилатциклазы.
Тимулин, он же сывороточный тимический фактор (СТФ). Выделен из сыворотки крови, у человека в норме его уровень после 20 ле снижается, а к 50 годам исчезает полностью. В синтезе этого фактора обязательно участие цинка.
В настоящее время благодаря различным биотехнологическим приемам из тимуса получен ряд иммунологически активных веществ: Т-активин, тималин, тимоптин, тимопоэтин. Эти факторы способны повышать качество Т-лимфоцитов и их функциональную активность, способствуют трансформации незрелых клеток в зрелые, стимулируют распознавание Т-зависимых антигенов, хелперную и киллерную активность, повышают выработку интерфероноф (ИФН), интенсифицуруют фагоцитоз, неспецифическую резистентность, процессы регенерации тканей.
Миелопептиды или пептиды костного мозга – синтезируются клетками костного мозга, не имеют аллогенного (внутри вида) или ксенногенного (различные виды) ограничения. Представляют собой комплекс пептидов, не способных самостоятельно индуцировать иммунный ответ, но обладающих иммунорегуляторными свойствами. Мишенями их эффектов являются лимфоциты и макрофаги. Помимо этого, миелопептиды обладают опиатоподобной активностью, вызывают анальгетический эффект, связываются с опиатными рецепторами мембран лимфоцитов и нейронов, участвуя, таким образом в нейроиммунном взаимодействии. В настоящее время в составе миелопептидов выделено и охарактеризовано несколько классов пептидов.
Цитокины (ЦК) – факторы полипептидной природы, не относящиеся к иммуноглобулинам, синтезируются лимфоидными и не лимфоидными клетками, обладают прямым действием на функциональную активность иммунокомпетентных клеток . ЦК не способны самостоятельно индуцировать иммунный ответ, но обеспечивают его регуляцию. Цитокины – это медиаторы межклеточных взаимодействий при иммунном ответе, гемопоэзе, воспалительных реакциях, осуществляют эффекторные функции реакций иммунитета и служат связующим звеном между иммунной и другими системами организма. В 1979 году на международном симпозиуме была сформулирована концепция и принципы классификации интерлейкинов. Проблема цитокинов находится в центре внимания практически всех медицинских дисциплин, при этом особые надежды возлагаются на возможное лечебное использование ЦК или их антагонистов.
Цитокины – это «эсперанто» в межклеточном общении, так как
- одинаковые цитокины продуцируются клетками разной тканевой дифференцировки.
- рецепторы для одноименных цитокинов экспрессируются на различных клетках.
Посредством ЦК и их рецепторов клетки не только «говорят» друг с другом, но и «могут быть услышаны» друг другом. Цитокины лимфоцитов обеспечивают взаимодействие лимфоцитарного иммунитета с другими системами резистентности.
В настоящее время приято выделять следующие группы цитокинов
1. Интерлейкины – секреторные белки иммунной системы, обеспечивают взаимодействие ИКК между собой и связь иммунной системы с другими системами организма.
2. Интерфероны – открыты как продукты инфицированных вирусом клеток, отсюда и название: Interfere with – мешать (репликации вирусов). Несмотря на общее родовое название, между известными типами ИФН есть существенные различия.
3.Факторы некроза опухоли (ФНО) – цитокины с выраженным цитотоксическим и регуляторным эффектом. Описаны ФНО-α и ФНО-β, он же лимфотоксин.
4.Колониестимулирующие факторы (КСФ) – обеспечивают рост и направленную дифференцировку стволовой кроветворной клетки.
5.Хемокины – необходимы для направленного движения лейкоцитов, хемоаттрактанты.
6. Факторы роста – полипептиды, обеспечивающие рост, дифференцировку, функциональную активность клеток различной тканевой принадлежности, в связи с чем выделяют фактор роста фибробластов, фактор роста нервов и т.д., отдельно представлен трансформирующий фактор роста – ТФР.
Несмотря на существующие различия, связанные со строением, биологической активностью, цитокины обладают общими свойствами:
- это полипептиды со средней молекулярной массой (не более 30 кД)
- вырабатываются клетками иммунной системы и некоторыми другими клетками в ответ на активацию
- участники иммунных и воспалительных реакций
- регулируют их силу и длительность
- секреция цитокинов занимает крайне малый временной промежуток
- их синтез всегда начинается с транскрипции генов
- вырабатываются в крайне низких концентрациях (пг/мл)
- одни и те же цитокины продуцируются различными типами клеток –феномен избыточности (например, ИФНγ продуцируется и Тh1, и цитотоксическими лимфоцитами (ЦТЛ), и NK)
- одни и те же ЦК действуют на различные клетки-мишени – плейотропность (ИФН-γ обладает стимулирующей активностью в отношении ЦТЛ, моноцитов-макрофагов, NK, угнетает активность Тh2)
- свои эффекты все цитокины опосредуют через рецепторы на клетках-мишенях. Связывание цитокином комплиментарного рецептора приводит к реализации соответствующего эффекта (активация, пролиферация, дифференцировка или гибель клетки)
- цитокины действуют по принципу сети. Так, они могут работать
1) согласованно – синергизм действия, когда эффект является результатом совестного действия нескольких цитокинов (например, провоспалительный эффект, обусловленный ИЛ-1, ИЛ-6, ФНО-α или синтез IgE, опосредуемый совместными эффектами ИЛ-4, ИЛ-5, ИЛ-13).
2) каскадно – одни цитокины обеспечивают синтез других (например, без ИЛ-12 нет продукции ИФН-γ)
3) антагонистично (ИЛ-4 ингибирует синтез ИФН-γ, ИЛ-12 препятствует выработке ИЛ-4 и т.д.)
- a. Цитокиновая регуляция функций клеток-мишеней осуществляется
1.
Аутокринно – цитокин воздействует сам на себя: клетка- продуцент цитокина в этом же цитокине нуждается. Так, макрофаги – продуценты и потребители ИЛ-1, а ИФН-γ, продуцируемый Тh1, необходим для его полноценного функционирования.
2.
Паракринно – наиболее часто осуществляемый принцип, клетка – продуцент находится в контакте с клеткой-мишенью. В качестве примера можно привести взаимодействие между АПК и Тh 0, Тh1-ЦТЛ.
3.
Эндокринно – в результате эффект цитокинов реализуется на расстоянии от места его продукции, через систему циркуляции. В частности, пирогенные эффекты ИЛ-1 обеспечиваются его взаимодействием с соответствующими рецепторами в гипоталамической области.
В настоящее время клетки-продуценты, собственно цитокины, а также их антагонисты, специфичные для них рецепторы на клетках-мишенях объединены в единую систему – систему цитокинов.
При этом выделяют 3 группы клеток-продуцентов цитокинов.
- Стромальные соединительнотканные клетки, вырабатывают цитокины, ответственные преимущественно за гемопоэз
- Моноциты-макрофаги, в основном продуцируют цитокины —медиаторы воспаления
- Лимфоциты – их цитокины способствуют развитию антигенспецифического иммунного ответа.
Биологические эффекты основных цитокинов приведены в табл.6,7.
Таблица 6. Биологические эффекты основных цитокинов (Л.В. Ковальчук,1999)
| Клетки-продуценты цитокинов |
Спектр цитокинов
|
Биологические эффекты
|
|
| 1) Лимфоциты:
Т-хелперы(CD4+)
Th0
Th1
Th2 |
ИЛ-2, ИФ-γ, ИЛ-3, ФНО-β, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-3, ИЛ-10, ИЛ-13.
ИЛ-2, ИФ-γ, ИЛ-3, ФНО-β.
ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-3, ИЛ-10, ИЛ-13 |
Т-клеточный иммунный ответ (на вирусные и внутриклеточные АГ)
Гуморальный иммунный ответ
(на аллергены, гельминты и некоторые бактериальные АГ) |
|
| Т-цитоксические (CD8+)
Естественные киллеры |
ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-10, ФНО-α, ИФ-γ
ФНО-бетта, ИЛ-1, ИФ-γ, ГМ-КСФ |
Цитоксическая активность
Цитоксическая активность |
|
| 2) Фагоциты и дендритные клетки: |
ИЛ-1,ФНО-α, ИЛ-6, ИЛ-8, ИФ-α, ТФР-β, М-КСФ, ИЛ-12, ГМ-КСФ, Г-КСФ |
Индукция иммунного ответа, воспаление, регенерация. |
|
| 3)Клетки, не относящиеся к иммунной системе:
а) клетки соединительной ткани
б) эндотелий
в) эпителий |
ИЛ-6, ИЛ-7, ИЛ-11, ГМ-КСФ, М-КСФ, Г-КСФ
ИЛ-1, ИЛ-6, ИЛ-7, ФНО-α |
Пролиферация и дифференцировка гемопоэтических клеток. |
|
Таблица 7. Системные проявления (синдромы) токсического действия цитокинов (А.А.Ярилин,1999)
| Название синдрома |
Основные проявления |
Описан при введении: |
Цитокины, участвующие в реализации |
|
| Гриппоподо-бный синдром |
Недомогание, потеря аппетита, тошнота, утомляемость,адинамия, мышчные боли |
ИФНa, ИФНg, ГМ-Г-КСФ, ИЛ-1,2,3 |
|
|
| Синдром протекания капилляров |
Повышение проницае- мости капилляров, по- теря жидкой части кро-
ви,жажда,отеки (в т.ч.- отек легких) |
ИЛ-2, ГМ-КСФ |
ФНОa, ИЛ-1, хемокины |
|
| Синдром, подобный септическому шоку |
Падение кровяного дав- ления, лихорадка, мета- болич.ацидоз, диссеми-
нированная внутрисосу- дистая коагуляция без бактеремии |
ФНОa, ИЛ-1 |
ФНОa, ИЛ-1, ИЛ-6 |
|
В основе патогенеза многих заболеваний лежит активация цитокинового каскада, который включает с одной стороны провоспалительные, а с другой – противовоспалительные медиаторы (табл.8,9). Баланс между двумя оппозитными группами во многом определяет характер течения и исход патологического процесса. Возможность управления цитокиновым балансом рассматривается в настоящее время как точка приложения терапевтических средств при лечении различных заболеваний.
Таблица 8. Провоспалительные цитокины (А.А. Тотолян, И.С. Фрейдлин, 2000)
| Цитокин |
Продуцент |
Основные эффекты |
|
| Интерлейкин 1 (ИЛ-1) |
Моноциты, макрфаги и др. |
Индуцирует лихорадку. Повышает: продукцию гепатоцитами острофазных белков, продукцию и секрецию других цитокинов теми же или другими клетками, пролиферацию фибробластов и др. клеток, экспрессию интегринов на эндотелиальных клетках, хемотаксис гранулоцитов. |
|
| Интерлейкин 6 ( ИЛ-6) |
Моноциты, макрофаги, Т-лимфоциты |
Индуцирует синтез острофазных белков гепатоцитами, лихорадку. Ингибирует полиферацию и активацию макрофагов. |
|
| Интерлейкин 8 (ИЛ-8) |
Моноциты, макрофаги и др. |
Индуцирует хемотаксис и дегрануляцию гранулоцитов, экспрессию адгезионных молекул, усиливает ангиогенез |
|
| Интерлейкин 12 (ИЛ-12) |
Моноциты, макрофаги, В-лимфоциты |
Активирует естественные киллеры, их пролиферацию и продукцию ими гамма-интерферона, способствует дифференцировке Th0 в Th1 |
|
| Интерлейкин 18 (ИЛ-18) |
Моноциты, макрофаги и др. |
В кооперации с IL-12 стимулирует продукцию IFN-гамма, экспрессию FasL на ЕК и Th1, способствует дифференцировке Th0 в Th1 |
|
| Фактор некроза опухоли (ФНО-α) |
Моноциты, макрофаги и др. |
Индуцирует лихорадку, лейкоцитоз, анорексию, кахексию, септический шок синтез острофазных белков гепатоцитами, экспрессию адгезионных молекул на эндотелиальных клетках, продукцию и секрецию ряда цитокинов. Активирует гранулоциты, моноциты, макрофаги. Оказывает цитоксическое действие на некоторые клетки-мишени |
|
| Интерферон α (ИФН-α) |
Моноциты, макрофаги, гранулоциты. |
Активирует естественные киллеры. Повышает экспрессию МНС 1 класса. Ингибирует продукцию IL-12 и IFN-гамма при вирусной инфекции |
|
| Моноцитарный хемотаксический протеин (МСР-1=MCAF) |
Моноциты, опухолевые клетки, фибробласты, эндотелиальные клетки |
Обладает селективной хемотаксической активностью по отношению к моноцитам, усиливает цитостатическую противоопухолевую активность человеческих моноцитов, секрецию им лизосомных ферментов и продукцию супероксидных радикалов |
|
Таблица 9. Противовоспалителдьные цитокины (А.А. Тотолян, И.С. Фрейдлин, 2000)
| Цитокин |
Продуцент |
Основные эффекты |
|
| Интерлейкин 10 (ИЛ-10) |
Макрофаги, Т-лимфоциты |
Ингибирует функции моноцитов, макрофагов, продукцию ими супероксидных и нитроксидных радикалов, продукцию провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, Г-КСФ, ГМ-КСФ, ФНО-альфа, ИФН-гамма) разными клетками. Усиливает продукцию ИЛ-1ра активированными макрофагами |
|
| Трансформирующий ростовой фактор (ТФР-β) |
Моноциты, макрофаги, Т-лимфоциты |
Ингибирует активацию моноцитов, макрофагов, пролиферацию естественных киллеров и их цитотоксическую функцию, но активирует фибробласты и способствует процессам заживления ран |
|

 Андреева Ирина Ивановна (врач, к.м.н., доцент кафедры иммунологии и аллергологии ФПК и ППС Ростовского государственного медицинского университета)
Сологуб Елена Николаевна (кандидат биологических наук)
Глава 1. Принципы организации и функционирования иммунной системы
1.1. Неспецифическая резистентность и адаптивный иммунитет.
Иммунная система, наряду с нервной и эндокринной, сохраняет и поддерживает постоянство, устойчивость и состав организма, то есть обеспечивает гомеостаз. Способность иммунной системы поддерживать неизмененный антигенный состав позволяет каждому человеку сохранить свою антигенную индивидуальность посредством
Андреева Ирина Ивановна (врач, к.м.н., доцент кафедры иммунологии и аллергологии ФПК и ППС Ростовского государственного медицинского университета)
Сологуб Елена Николаевна (кандидат биологических наук)
Глава 1. Принципы организации и функционирования иммунной системы
1.1. Неспецифическая резистентность и адаптивный иммунитет.
Иммунная система, наряду с нервной и эндокринной, сохраняет и поддерживает постоянство, устойчивость и состав организма, то есть обеспечивает гомеостаз. Способность иммунной системы поддерживать неизмененный антигенный состав позволяет каждому человеку сохранить свою антигенную индивидуальность посредством
 Красный костный мозг и тимус относят к центральным органам. Центральные (или первичные) органы иммунной системы находятся на защищенной от внешних воздействий территории: тимус – за грудиной, костный мозг – в костных полостях. Центральные органы иммунной системы – «инкубатор, а не поле битвы», место созревания, дифференцировки, развития (образования и воспитания) иммуноцитов – или иммунокомпетентых клеток, заселяющих периферические органы. Все клетки иммунной системы, также как и все клетки крови имеют общего предшественника – полипотентную стволовую кроветворную клетку (ПСКК). Основным местом пребывания ПСКК является костный мозг.
Схема 4. Иммунопоэз развития клеток иммунной системы.
Красный костный мозг и тимус относят к центральным органам. Центральные (или первичные) органы иммунной системы находятся на защищенной от внешних воздействий территории: тимус – за грудиной, костный мозг – в костных полостях. Центральные органы иммунной системы – «инкубатор, а не поле битвы», место созревания, дифференцировки, развития (образования и воспитания) иммуноцитов – или иммунокомпетентых клеток, заселяющих периферические органы. Все клетки иммунной системы, также как и все клетки крови имеют общего предшественника – полипотентную стволовую кроветворную клетку (ПСКК). Основным местом пребывания ПСКК является костный мозг.
Схема 4. Иммунопоэз развития клеток иммунной системы.
 Костный мозг – центральный орган кроветворения. Структурно состоит из компактной кости, стромы, костномозговых синусов, генеративной зоны и зоны созревания. Считается, что все элементы костного мозга участвуют в формировании и регуляции
Костный мозг – центральный орган кроветворения. Структурно состоит из компактной кости, стромы, костномозговых синусов, генеративной зоны и зоны созревания. Считается, что все элементы костного мозга участвуют в формировании и регуляции
 К числу PRR относится CD 14 – один из маркеров клеток миелоидного ряда, он же рецептор для липополисахаридов (ЛПС) Гр- бактерий. Все более пристальное внимание привлекают к себе TLR – TOLL-подобные рецепторы («TOLL» – дверной звонок, свидетельствующий о приходе чужих) – представители трансмембранных белков, экспрессированных на клетках МФС и ДК.
5. Рецепторы для цитокинов – ИЛ –2 (CD 25), ИЛ-1 (CD 121), ИЛ-6 (CD 126), гормонов, нейромедиаторов.
6. Антигены HLA (главного комплекса гистосовместимости) I класса, впрочем, как и на всех ядросодержащих клетках, кроме того, на активированных макрофагах экспрессируются HLA DR, обеспечивающие процессы распознавания и индукции специфического иммунного ответа.
7. Особо следует отметить наличие на поверхности клеток моноцитарно-макрофагального ряда CD4 («входные ворота» для ВИЧ).
8. Хеморецепторы или рецепторы для хематтрактантов (продукты жизнедеятельности микроорганизмов, цитокины, фрагменты иммуноглобулинов). Взаимодействие хематтрактант – хеморецептор обеспечивает направленное движение клеток – хемотаксис. Уже в процессе хемотаксиса активируются клетки, усиливаются их метаболизм и функциональная активность, а также экспрессия биологически активных веществ. Таким образом реализуется 1 этап фагоцитоза – свойства, определяющего и все многообразие функциональных потенций клеток МФС, и их название.
Следующим за хемотаксисом этапом фагоцитарной реакции является адгезия. В основе ее лежит взаимодействие с соответствующими рецепторами, а результатом служит «контактная активация». Объективным лабораторным тестом, позволяющим оценить степень адгезивной активности макрофагов является метод «распластывания» на стекле, при котором учитываются размеры и количество клеток, прикрепившихся к стеклу.
Далее происходит погружение присоединившейся к клетке частицы, образование фагосомы и фаголизосомы – специализированной внутриклеточной гранулы для расщепления патогена. Здесь включаются механизмы внутриклеточного киллинга (убийства). Кислородзависимый механизм данного процесса получил название «кислородный взрыв», так как при этом активируется продукция атомарного кислорода, гидроксильного радикала, перекисей и прочих продуктов частичного восстановления кислорода, обладающих существенной разрушающей активностью. Объективно фиксирует процесс «окислительного взрыва» методический прием, получивший название НСТ-теста. НСТ – нитросиний тетразолий – краситель, содержащий диформазан, который под влиянием активных форм кислорода восстанавливается в формазан, меняя при этом свой цвет. По интенсивности изменения цвета судят об активности кислородзависимого метаболизма фагоцитирующей клетки. Кислороднезависимый механизм киллинга также весьма важен в реализации эффектов клеток макрофагальной линии, при этом особое внимание последнее время уделяется характеристике азотного метаболизма. Вследствие реализации макрофагами фагоцитарных свойств возможен как полный гидролиз антигена, так и неполный, с представлением фрагментов антигена на мембране (презентация).
Благодаря фагоцитозу – интегративному процессу деятельности клеток макрофагального ряда – осуществляются такие эффекторные реакции, как бактерицидность и цитотоксичность. При реализации этих свойств макрофаги выступают в роли клеток-мусорщиков, неспецифически защищая от инфекционных агентов, состарившихся и трансформированных собственных клеток, а также обеспечивают доиммунные механизмы защиты (врожденный иммунитет). В то же время без макрофагов и их участия в
К числу PRR относится CD 14 – один из маркеров клеток миелоидного ряда, он же рецептор для липополисахаридов (ЛПС) Гр- бактерий. Все более пристальное внимание привлекают к себе TLR – TOLL-подобные рецепторы («TOLL» – дверной звонок, свидетельствующий о приходе чужих) – представители трансмембранных белков, экспрессированных на клетках МФС и ДК.
5. Рецепторы для цитокинов – ИЛ –2 (CD 25), ИЛ-1 (CD 121), ИЛ-6 (CD 126), гормонов, нейромедиаторов.
6. Антигены HLA (главного комплекса гистосовместимости) I класса, впрочем, как и на всех ядросодержащих клетках, кроме того, на активированных макрофагах экспрессируются HLA DR, обеспечивающие процессы распознавания и индукции специфического иммунного ответа.
7. Особо следует отметить наличие на поверхности клеток моноцитарно-макрофагального ряда CD4 («входные ворота» для ВИЧ).
8. Хеморецепторы или рецепторы для хематтрактантов (продукты жизнедеятельности микроорганизмов, цитокины, фрагменты иммуноглобулинов). Взаимодействие хематтрактант – хеморецептор обеспечивает направленное движение клеток – хемотаксис. Уже в процессе хемотаксиса активируются клетки, усиливаются их метаболизм и функциональная активность, а также экспрессия биологически активных веществ. Таким образом реализуется 1 этап фагоцитоза – свойства, определяющего и все многообразие функциональных потенций клеток МФС, и их название.
Следующим за хемотаксисом этапом фагоцитарной реакции является адгезия. В основе ее лежит взаимодействие с соответствующими рецепторами, а результатом служит «контактная активация». Объективным лабораторным тестом, позволяющим оценить степень адгезивной активности макрофагов является метод «распластывания» на стекле, при котором учитываются размеры и количество клеток, прикрепившихся к стеклу.
Далее происходит погружение присоединившейся к клетке частицы, образование фагосомы и фаголизосомы – специализированной внутриклеточной гранулы для расщепления патогена. Здесь включаются механизмы внутриклеточного киллинга (убийства). Кислородзависимый механизм данного процесса получил название «кислородный взрыв», так как при этом активируется продукция атомарного кислорода, гидроксильного радикала, перекисей и прочих продуктов частичного восстановления кислорода, обладающих существенной разрушающей активностью. Объективно фиксирует процесс «окислительного взрыва» методический прием, получивший название НСТ-теста. НСТ – нитросиний тетразолий – краситель, содержащий диформазан, который под влиянием активных форм кислорода восстанавливается в формазан, меняя при этом свой цвет. По интенсивности изменения цвета судят об активности кислородзависимого метаболизма фагоцитирующей клетки. Кислороднезависимый механизм киллинга также весьма важен в реализации эффектов клеток макрофагальной линии, при этом особое внимание последнее время уделяется характеристике азотного метаболизма. Вследствие реализации макрофагами фагоцитарных свойств возможен как полный гидролиз антигена, так и неполный, с представлением фрагментов антигена на мембране (презентация).
Благодаря фагоцитозу – интегративному процессу деятельности клеток макрофагального ряда – осуществляются такие эффекторные реакции, как бактерицидность и цитотоксичность. При реализации этих свойств макрофаги выступают в роли клеток-мусорщиков, неспецифически защищая от инфекционных агентов, состарившихся и трансформированных собственных клеток, а также обеспечивают доиммунные механизмы защиты (врожденный иммунитет). В то же время без макрофагов и их участия в
 Схема 7. Противобактериальный иммунитет.
Схема 7. Противобактериальный иммунитет.
 Лимфоциты
Ключевым структурным и функциональным элементом иммунной системы является лимфоцит. Морфологически – это округлые клетки диаметром 7-9 микрон с плотным ядром и узким ободком цитоплазмы. Наиболее характерной чертой этой популяции является способность распознавать собственные и чужеродные антигены. Лимфоцит – носитель рецептора для антигена, в случае контакта с которым происходит активация, пролиферация и дифференцировка в эффекторные или регуляторные участники иммунных процессов. В соответствии с
Лимфоциты
Ключевым структурным и функциональным элементом иммунной системы является лимфоцит. Морфологически – это округлые клетки диаметром 7-9 микрон с плотным ядром и узким ободком цитоплазмы. Наиболее характерной чертой этой популяции является способность распознавать собственные и чужеродные антигены. Лимфоцит – носитель рецептора для антигена, в случае контакта с которым происходит активация, пролиферация и дифференцировка в эффекторные или регуляторные участники иммунных процессов. В соответствии с
 2. По химической природе
Белки. Например, белки сыворотки, микробные токсины и белковые комплексы – компоненты клеточных мембран, антигены группы крови системы АВО
Полисахариды – в первую очередь – капсулы бактерий
Фосфолипиды – клеточные стенки бактерий
2. По химической природе
Белки. Например, белки сыворотки, микробные токсины и белковые комплексы – компоненты клеточных мембран, антигены группы крови системы АВО
Полисахариды – в первую очередь – капсулы бактерий
Фосфолипиды – клеточные стенки бактерий
 Следующий этап – распознавание антигена. Для этого антиген представлен на поверхности презентирующей вспомогательной клетки в контексте с антигенами HLA II класса. В этом случае контакт CD4 поверхностного рецептора Т-лимфоцита с антигенами HLA обеспечивает сигнал «Я свой», необходимый для последующего взаимодействия антигена и соответстующего ему Т-клеточного рецептора. Распознавание «чужого через свое» или «измененное свое» – один из основных постулатов современной клинической иммунологии. Передача информации о характере антигена, то есть взаимодействие антиген – ТКР – это так называемый специфический сигнал (или приказ) о необходимости действия. Однако полноценного иммунного ответа не произойдет без создания условий для его выполнения. Эти условия обеспечиваются цитокинами, продуцируемыми антигенпредставляющими клетками: ИЛ-1, ИЛ-6, ФНО. Кроме того, в случае исходного поглощения патогенов через паттерн-распознающие рецепторы и особенно при контакте с ТOLL -подобными рецепторами резко усиливается экспрессия костимулирующих молекул на поверхности антигенпредставляющих клеток, что обеспечивает максимально близкий контакт между вспомогательными и антигенраспознающими клетками и служит условием формирования полноценного иммунного ответа.
Схема 10. Гуморальный иммунный ответ.
Следующий этап – распознавание антигена. Для этого антиген представлен на поверхности презентирующей вспомогательной клетки в контексте с антигенами HLA II класса. В этом случае контакт CD4 поверхностного рецептора Т-лимфоцита с антигенами HLA обеспечивает сигнал «Я свой», необходимый для последующего взаимодействия антигена и соответстующего ему Т-клеточного рецептора. Распознавание «чужого через свое» или «измененное свое» – один из основных постулатов современной клинической иммунологии. Передача информации о характере антигена, то есть взаимодействие антиген – ТКР – это так называемый специфический сигнал (или приказ) о необходимости действия. Однако полноценного иммунного ответа не произойдет без создания условий для его выполнения. Эти условия обеспечиваются цитокинами, продуцируемыми антигенпредставляющими клетками: ИЛ-1, ИЛ-6, ФНО. Кроме того, в случае исходного поглощения патогенов через паттерн-распознающие рецепторы и особенно при контакте с ТOLL -подобными рецепторами резко усиливается экспрессия костимулирующих молекул на поверхности антигенпредставляющих клеток, что обеспечивает максимально близкий контакт между вспомогательными и антигенраспознающими клетками и служит условием формирования полноценного иммунного ответа.
Схема 10. Гуморальный иммунный ответ.
 В случае формирования иммунного ответа по гуморальному типу следующий этап межклеточного взаимодействия состоит в контакте между ТКР и ВКР одинаковой специфичности, то есть Т-лимфоцит – хелпер передает информацию об антигене В-лимфоциту, реализуя таким образом специфический сигнал. Источником неспецифического сигнала также являются CD4 Т-клетки. Они продуцируют спектр цитокинов для трансформации В-клетки в плазматическую, синтезирующую антитела. В том случае, когда формируется иммунный ответ по клеточному типу,
Схема 11. Клеточный иммунный ответ.
В случае формирования иммунного ответа по гуморальному типу следующий этап межклеточного взаимодействия состоит в контакте между ТКР и ВКР одинаковой специфичности, то есть Т-лимфоцит – хелпер передает информацию об антигене В-лимфоциту, реализуя таким образом специфический сигнал. Источником неспецифического сигнала также являются CD4 Т-клетки. Они продуцируют спектр цитокинов для трансформации В-клетки в плазматическую, синтезирующую антитела. В том случае, когда формируется иммунный ответ по клеточному типу,
Схема 11. Клеточный иммунный ответ.
 Т-лимфоцит хелпер взаимодействует с соответствующим по структуре ТКР цитотоксическим Т-лимфоцитом. Соответствующие цитокины, продуцируемые CD4+ Т-клетками-индукторами, создают условия для формирования иммунного ответа по клеточному типу. В этом случае образуется клон цитотоксических CD8+Т-лимфоцитов, направленных на разрушение клеток-мишеней. Вся совокупность описанных последовательных реакций определяется как «Двухсигнальная система трехклеточной кооперации формирования специфического иммунного ответа» (Р.В.Петров, 1983). При этом необходимо участие
Трех типов клеток
Т-лимфоцит хелпер взаимодействует с соответствующим по структуре ТКР цитотоксическим Т-лимфоцитом. Соответствующие цитокины, продуцируемые CD4+ Т-клетками-индукторами, создают условия для формирования иммунного ответа по клеточному типу. В этом случае образуется клон цитотоксических CD8+Т-лимфоцитов, направленных на разрушение клеток-мишеней. Вся совокупность описанных последовательных реакций определяется как «Двухсигнальная система трехклеточной кооперации формирования специфического иммунного ответа» (Р.В.Петров, 1983). При этом необходимо участие
Трех типов клеток


