Лечение ревматоидного артрита: тактические вопросы в практике клинициста.
Н. В. Чичасова
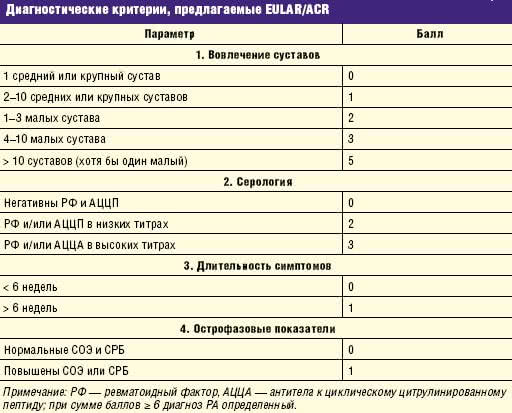
д.м.н., профессор кафедры ревматологии ММА им. Сеченова Течение ревматоидного артрита (РА) весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно. Диагностические критерии, предложенные Американским колледжем ревматологов (ACR) в 1987 году, не отвечают требованиям ранней диагностики РА. Поэтому в последние годы совместными усилиями Европейской антиревматической лиги (EULAR) и ACR разрабатываются новые критерии, ориентированные на как можно более раннее установление диагноза РА. Известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания. В крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) [1] (рис. 1).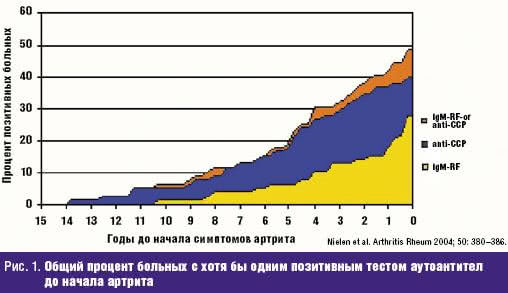 Морфологическое исследование синовиальной оболочки, полученной при биопсии у больных в первые месяцы после дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у большей части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [2]. Таким образом, даже в дебюте развития суставного поражения болезнь может представлять хроническую стадию. Поэтому задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) ухудшает отдаленный прогноз РА, как функциональный, так и жизненный. Для новых диагностических критериев EULAR/ACR выбраны четыре группы параметров, а каждый параметр на основании многомерного статического анализа получил балльную выраженность (табл. 1), при сумме баллов 6 и более устанавливается определенный диагноз РА.
Таблица 1. Диагностические критерии, предлагаемые EULAR/ACR
Морфологическое исследование синовиальной оболочки, полученной при биопсии у больных в первые месяцы после дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у большей части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [2]. Таким образом, даже в дебюте развития суставного поражения болезнь может представлять хроническую стадию. Поэтому задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) ухудшает отдаленный прогноз РА, как функциональный, так и жизненный. Для новых диагностических критериев EULAR/ACR выбраны четыре группы параметров, а каждый параметр на основании многомерного статического анализа получил балльную выраженность (табл. 1), при сумме баллов 6 и более устанавливается определенный диагноз РА.
Таблица 1. Диагностические критерии, предлагаемые EULAR/ACR
 В последние годы постоянно обсуждается вопрос, когда врач имеет право назначить БПВП. В соответствии с рекомендациями Ассоциации ревматологов России [3] основной группой препаратов для лечения РА (категория доказательности А) являются метотрексат (МТ) и другие широко назначаемые препараты — лефлуномид и сульфасалазин, БПВП следует назначать как можно раньше (в пределах 3–6 месяцев от первого появления симптомов), даже если пациенты формально не соответствуют диагностическим критериям 1987 г. В рекомендациях Европейской антиревматической лиги (EULAR) 2007 года [4] указывается, что при риске развития персистирующего эрозивного артрита, даже если больной не отвечает классификационным критериям РА, показано назначение БПВП. Первым должен назначаться метотрексат, а при невозможности его назначения препаратами первой линии считаются лефлуномид, сульфасалазин и соли золота [4]. По рекомендациям ACR 2008 года [5] БПВП должны назначаться как можно раньше после дебюта симптомов артрита и препаратами первой линии считаются метотрексат и лефлуномид.
Далее во всех современных рекомендациях обращается внимание, что тактика лечения больного РА зависит от адекватности (или неадекватности) лечения. Таким образом, перед клиницистом стоят три задачи: выбор препарата, оценка адекватности терапии на ее этапах и своевременная коррекция лечения.
Последние рекомендации ACR (2008) [5] по лечению больных РА БПВП и ГИБП включают в себя определение основных параметров, которые следует учитывать при назначении препаратов. К ним относятся:
Длительность РА, которая подразделяется на ранний РА (длительность болезни < 6 месяцев), средняя длительность болезни (6–24 месяца) и устоявшийся (длительный) РА при длительности симптомов более 24 месяцев.
Активность болезни, которая подразделяется при помощи различных индексов (табл. 2, табл. 3).
Таблица 2 Индексы для оценки активности РА
В последние годы постоянно обсуждается вопрос, когда врач имеет право назначить БПВП. В соответствии с рекомендациями Ассоциации ревматологов России [3] основной группой препаратов для лечения РА (категория доказательности А) являются метотрексат (МТ) и другие широко назначаемые препараты — лефлуномид и сульфасалазин, БПВП следует назначать как можно раньше (в пределах 3–6 месяцев от первого появления симптомов), даже если пациенты формально не соответствуют диагностическим критериям 1987 г. В рекомендациях Европейской антиревматической лиги (EULAR) 2007 года [4] указывается, что при риске развития персистирующего эрозивного артрита, даже если больной не отвечает классификационным критериям РА, показано назначение БПВП. Первым должен назначаться метотрексат, а при невозможности его назначения препаратами первой линии считаются лефлуномид, сульфасалазин и соли золота [4]. По рекомендациям ACR 2008 года [5] БПВП должны назначаться как можно раньше после дебюта симптомов артрита и препаратами первой линии считаются метотрексат и лефлуномид.
Далее во всех современных рекомендациях обращается внимание, что тактика лечения больного РА зависит от адекватности (или неадекватности) лечения. Таким образом, перед клиницистом стоят три задачи: выбор препарата, оценка адекватности терапии на ее этапах и своевременная коррекция лечения.
Последние рекомендации ACR (2008) [5] по лечению больных РА БПВП и ГИБП включают в себя определение основных параметров, которые следует учитывать при назначении препаратов. К ним относятся:
Длительность РА, которая подразделяется на ранний РА (длительность болезни < 6 месяцев), средняя длительность болезни (6–24 месяца) и устоявшийся (длительный) РА при длительности симптомов более 24 месяцев.
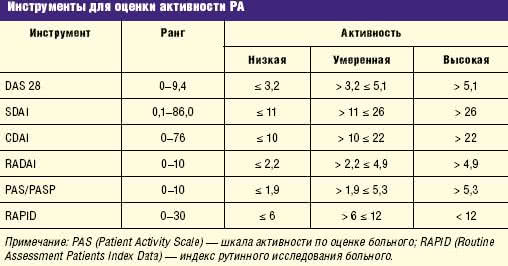
Активность болезни, которая подразделяется при помощи различных индексов (табл. 2, табл. 3).
Таблица 2 Индексы для оценки активности РА
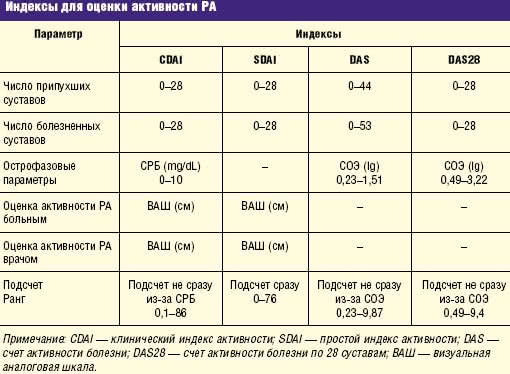 Таблица 3 Инструменты для оценки активности РА
Таблица 3 Инструменты для оценки активности РА
 Наличие прогностически неблагоприятных признаков: активная болезнь (большое число болезненных и припухших суставов), наличие эрозий на ранней стадии, повышение РФ и/или АЦЦП [6, 7], повышение СОЭ и/или С-реактивного белка (СРБ) [8, 9]. Плохой прогноз при РА означает рентгенологическое прогрессирование деструкции суставов, утрату функции и увеличение смертности, а также увеличение риска необходимости проведения хирургических операций на суставах.
В соответствии с рекомендациями ACR (2008 г.) [5] лечение БПВП проводится в виде монотерапии или двойных и тройных комбинаций (рис. 2А, Б, В) в зависимости от длительности терапии и наличия факторов неблагоприятного прогноза.
Наличие прогностически неблагоприятных признаков: активная болезнь (большое число болезненных и припухших суставов), наличие эрозий на ранней стадии, повышение РФ и/или АЦЦП [6, 7], повышение СОЭ и/или С-реактивного белка (СРБ) [8, 9]. Плохой прогноз при РА означает рентгенологическое прогрессирование деструкции суставов, утрату функции и увеличение смертности, а также увеличение риска необходимости проведения хирургических операций на суставах.
В соответствии с рекомендациями ACR (2008 г.) [5] лечение БПВП проводится в виде монотерапии или двойных и тройных комбинаций (рис. 2А, Б, В) в зависимости от длительности терапии и наличия факторов неблагоприятного прогноза.
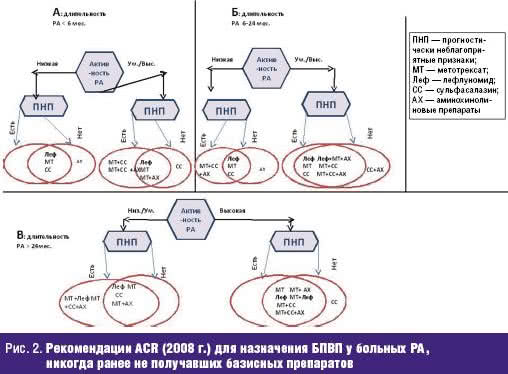 Метотрексат и лефлуномид — БПВП 1-й линии для монотерапии, назначаются при любой длительности и любой активности, при наличии прогностически неблагоприятных признаков.
Гидроксихлорохин (Плаквенил) — назначается больным без признаков неблагоприятного прогноза и при длительности РА ≤ 4 месяца.
Сульфасалазин — назначается при любой активности РА [10, 11] больным без наличия прогностически неблагоприятных признаков либо при умеренной активности РА с отсутствием признаков плохого прогноза [12].
Рекомендации ACR в отношении места комбинированного лечения 2–3 БПВП опираются на данные нескольких рандомизированных клинических исследований, в которых комбинация БПВП была более эффективна, чем монотерапия (исследования COBRA, BeST и др.) [13, 14, 15]. В качестве эффективных предлагаются следующие комбинации БПВП.
Двойная комбинация БПВП — используется при высокой активности РА у больных с наличием признаков плохого прогноза [16, 17]. Комбинация метотрексата и гидроксихлорохина рекомендуется при большой длительности РА и низкой активности (уровень доказательности С). Комбинацию метотрексата и лефлуномида рекомендуется назначать при средней длительности (> 6 месяцев) и наличии факторов плохого прогноза и проводить терапию так долго, как долго будет сохраняться высокая активность [18]. Метотрексат в комбинации с сульфасалазином предлагается назначать при любой длительности РА, высокой активности, наличии признаков плохого прогноза (уровень доказательности А для длительности РА < 6 месяцев и более 24 месяцев; уровень доказательности С для средней длительности РА) [10, 12, 19]. Комбинация сульфасалазина и гидроксихлорохин в соответствии с этими рекомендациями используется только в одной ситуации: средняя длительность РА (6–24 месяца) с высокой активностью, но без наличия признаков плохого прогноза.
Тройная комбинация БПВП — метотрексат + гидроксихлорохин + сульфасалазин — назначается при наличии факторов плохого прогноза и при умеренной/высокой активности болезни независимо от длительности болезни [20].
Другие БПВП являются препаратами 2-й и 3-й линии и используются при неэффективности или непереносимости этих четырех БПВП.
Рекомендации EULAR 2010 года несколько отличаются от рекомендаций ACR (2008 г.):
Как только больному устанавливается диагноз РА, ему сразу должно быть назначено лечение синтетическим БПВП.
Цель лечения. Как можно более быстрое достижение ремиссии или низкой активности болезни у каждого пациента; если эта цель не достигается, необходим подбор терапии путем частого и непосредственного мониторинга (каждые 1–3 месяца).
Первый БПВП. Метотрексат должен быть частью первой стратегической схемы лечения у больных активным РА.
Альтернативные первые БПВП. В случае противопоказаний к назначению метотрексата (или его непереносимости) следующие БПВП должны обсуждаться в качестве (первой) стратегии лечения: сульфасалазин, лефлуномид и соли золота (инъекции).
Монотерапия или комбинация. Для больных, ранее не получавших БПВП, рекомендуется монотерапия, а не комбинированная терапия синтетическими БПВП.
Мы считаем, что начало терапии РА, тем более на ранней стадии болезни, должно начинаться с монотерапии. А дальнейшая тактика врача зависит от результата терапии. При лечении любым БПВП возможно несколько вариантов результата лечения: 1) снижение активности РА до низкой или достижение ремиссии; 2) снижение активности без достижения низкого ее уровня; 3) минимальное улучшение или его отсутствие. Первый и третий вариант не вызывают трудностей: терапия продолжается без изменений (1-й вариант) и препарат отменяется (3-й вариант). Наибольшие сложности представляет 2-й вариант — то есть развитие частичного эффекта на лечение БПВП. В этой ситуации возможна как замена БПВП, если степень достигнутого улучшения параметров активности не превышает 40–50% или присоединение к БПВП при 50% и более улучшении другого лекарственного средства (БПВП или генно-инженерного биологического препарата — ГИБП.
Использование комбинации двух и более БПВП является принятым при РА, когда у пациента развивается частичный ответ на препарат (более 20% и менее 50% улучшения). Наличие у лефлуномида уникального механизма действия и прием его однократно в день создает предпосылки для использования его в комбинации с другими БПВП. При назначении лефлуномида в комбинации с БПВП некоторые авторы рекомендуют использовать его в более низкой дозе или более редко для лучшей переносимости [21, 22]. К 2005 году по данным базы CORONA, в которую вошли 5436 больных, получавших БПВП между октябрем 2001 года и мартом 2004 года, 88% больных получали монотерапию БПВП и 12% комбинации БПВП [22]. Из них 597 больных получали лефлуномид, и 2/3 этих больных принимали его в комбинации с другими БПВП, что позволило повысить общую эффективность лечения.
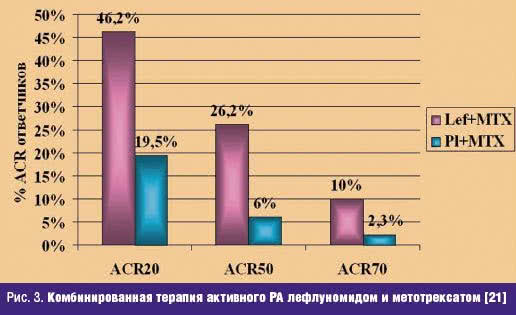
Лефлуномид в комбинации с метотрексатом. Метотрексат является БПВП, который часто используют в комбинированной базисной терапии РА. В открытом исследовании лефлуномида у 30 больных РА комбинация его с метотрексатом показала ee перспективность [23]. С учетом этого было проведено многоцентровое РКИ исследование эффективности комбинации метотрексата с лефлуномидом или плацебо у 263 больных с персистирующей активностью РА в течение последних 6 месяцев монотерапии метотрексатом [21, 24]. Дозы метотрексата были 15–20 мг/нед (или 10–15 мг/нед при непереносимости более высоких доз), начальная доза лефлуномида была 10 мг/сутки, при отсутствии эффекта через 8 недель дозу его увеличивали до 20 мг/сутки. Через 24 недели число ответивших по критериям ACR20, ACR50 и ACR70 было значительно больше при комбинации лефлуномида и метотрексата, чем при монотерапии метотрексатом (рис. 3.)
Метотрексат и лефлуномид — БПВП 1-й линии для монотерапии, назначаются при любой длительности и любой активности, при наличии прогностически неблагоприятных признаков.
Гидроксихлорохин (Плаквенил) — назначается больным без признаков неблагоприятного прогноза и при длительности РА ≤ 4 месяца.
Сульфасалазин — назначается при любой активности РА [10, 11] больным без наличия прогностически неблагоприятных признаков либо при умеренной активности РА с отсутствием признаков плохого прогноза [12].
Рекомендации ACR в отношении места комбинированного лечения 2–3 БПВП опираются на данные нескольких рандомизированных клинических исследований, в которых комбинация БПВП была более эффективна, чем монотерапия (исследования COBRA, BeST и др.) [13, 14, 15]. В качестве эффективных предлагаются следующие комбинации БПВП.
Двойная комбинация БПВП — используется при высокой активности РА у больных с наличием признаков плохого прогноза [16, 17]. Комбинация метотрексата и гидроксихлорохина рекомендуется при большой длительности РА и низкой активности (уровень доказательности С). Комбинацию метотрексата и лефлуномида рекомендуется назначать при средней длительности (> 6 месяцев) и наличии факторов плохого прогноза и проводить терапию так долго, как долго будет сохраняться высокая активность [18]. Метотрексат в комбинации с сульфасалазином предлагается назначать при любой длительности РА, высокой активности, наличии признаков плохого прогноза (уровень доказательности А для длительности РА < 6 месяцев и более 24 месяцев; уровень доказательности С для средней длительности РА) [10, 12, 19]. Комбинация сульфасалазина и гидроксихлорохин в соответствии с этими рекомендациями используется только в одной ситуации: средняя длительность РА (6–24 месяца) с высокой активностью, но без наличия признаков плохого прогноза.
Тройная комбинация БПВП — метотрексат + гидроксихлорохин + сульфасалазин — назначается при наличии факторов плохого прогноза и при умеренной/высокой активности болезни независимо от длительности болезни [20].
Другие БПВП являются препаратами 2-й и 3-й линии и используются при неэффективности или непереносимости этих четырех БПВП.
Рекомендации EULAR 2010 года несколько отличаются от рекомендаций ACR (2008 г.):
Как только больному устанавливается диагноз РА, ему сразу должно быть назначено лечение синтетическим БПВП.
Цель лечения. Как можно более быстрое достижение ремиссии или низкой активности болезни у каждого пациента; если эта цель не достигается, необходим подбор терапии путем частого и непосредственного мониторинга (каждые 1–3 месяца).
Первый БПВП. Метотрексат должен быть частью первой стратегической схемы лечения у больных активным РА.
Альтернативные первые БПВП. В случае противопоказаний к назначению метотрексата (или его непереносимости) следующие БПВП должны обсуждаться в качестве (первой) стратегии лечения: сульфасалазин, лефлуномид и соли золота (инъекции).
Монотерапия или комбинация. Для больных, ранее не получавших БПВП, рекомендуется монотерапия, а не комбинированная терапия синтетическими БПВП.
Мы считаем, что начало терапии РА, тем более на ранней стадии болезни, должно начинаться с монотерапии. А дальнейшая тактика врача зависит от результата терапии. При лечении любым БПВП возможно несколько вариантов результата лечения: 1) снижение активности РА до низкой или достижение ремиссии; 2) снижение активности без достижения низкого ее уровня; 3) минимальное улучшение или его отсутствие. Первый и третий вариант не вызывают трудностей: терапия продолжается без изменений (1-й вариант) и препарат отменяется (3-й вариант). Наибольшие сложности представляет 2-й вариант — то есть развитие частичного эффекта на лечение БПВП. В этой ситуации возможна как замена БПВП, если степень достигнутого улучшения параметров активности не превышает 40–50% или присоединение к БПВП при 50% и более улучшении другого лекарственного средства (БПВП или генно-инженерного биологического препарата — ГИБП.
Использование комбинации двух и более БПВП является принятым при РА, когда у пациента развивается частичный ответ на препарат (более 20% и менее 50% улучшения). Наличие у лефлуномида уникального механизма действия и прием его однократно в день создает предпосылки для использования его в комбинации с другими БПВП. При назначении лефлуномида в комбинации с БПВП некоторые авторы рекомендуют использовать его в более низкой дозе или более редко для лучшей переносимости [21, 22]. К 2005 году по данным базы CORONA, в которую вошли 5436 больных, получавших БПВП между октябрем 2001 года и мартом 2004 года, 88% больных получали монотерапию БПВП и 12% комбинации БПВП [22]. Из них 597 больных получали лефлуномид, и 2/3 этих больных принимали его в комбинации с другими БПВП, что позволило повысить общую эффективность лечения.
Лефлуномид в комбинации с метотрексатом. Метотрексат является БПВП, который часто используют в комбинированной базисной терапии РА. В открытом исследовании лефлуномида у 30 больных РА комбинация его с метотрексатом показала ee перспективность [23]. С учетом этого было проведено многоцентровое РКИ исследование эффективности комбинации метотрексата с лефлуномидом или плацебо у 263 больных с персистирующей активностью РА в течение последних 6 месяцев монотерапии метотрексатом [21, 24]. Дозы метотрексата были 15–20 мг/нед (или 10–15 мг/нед при непереносимости более высоких доз), начальная доза лефлуномида была 10 мг/сутки, при отсутствии эффекта через 8 недель дозу его увеличивали до 20 мг/сутки. Через 24 недели число ответивших по критериям ACR20, ACR50 и ACR70 было значительно больше при комбинации лефлуномида и метотрексата, чем при монотерапии метотрексатом (рис. 3.)
 Число отмен и побочных реакций было одинаковым в обеих группах. В группе получавших комбинацию БПВП более часто отмечались диарея и тошнота, но было зарегистрировано меньше инфекционных осложнений. Кратковременный подъем уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) отмечался при использовании комбинации, нормализация концентрации трансаминаз происходила в большинстве случаев без изменений терапии, по три пациента каждой группы выбыли из исследования из-за увеличения уровня печеночных ферментов. При продолжении этого исследования (открытая фаза) до 48 недель у пациентов, принимающих комбинацию этих двух базисных препаратов, было замечено, что побочные реакции (подъем АЛТ, диарея и тошнота) реже отмечались у больных, не получавших насыщающей дозы лефлуномида [25].
Данные проспективного 24-месячного исследования эффективности и переносимости комбинации лефлуномида и метотрексата показали хорошую ее переносимость [25]: 72,4% больных закончили 6-месячный прием двух БПВП и далее отмен из-за симптомов непереносимости не было. В недавнем 5-летнем исследовании по безопасности этой комбинации было показано отсутствие увеличения серьезных побочных реакций или смертности [26] по сравнению с монотерапией лефлуномидом.
Лефлуномид в комбинации с сульфасалазином. Изучение данной комбинации БПВП было проведено в контролируемом рандомизированном исследовании (2-й этап которого был плацебо-контролируемым) RELIEF, дизайн которого представлен на рис. 4.
Число отмен и побочных реакций было одинаковым в обеих группах. В группе получавших комбинацию БПВП более часто отмечались диарея и тошнота, но было зарегистрировано меньше инфекционных осложнений. Кратковременный подъем уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) отмечался при использовании комбинации, нормализация концентрации трансаминаз происходила в большинстве случаев без изменений терапии, по три пациента каждой группы выбыли из исследования из-за увеличения уровня печеночных ферментов. При продолжении этого исследования (открытая фаза) до 48 недель у пациентов, принимающих комбинацию этих двух базисных препаратов, было замечено, что побочные реакции (подъем АЛТ, диарея и тошнота) реже отмечались у больных, не получавших насыщающей дозы лефлуномида [25].
Данные проспективного 24-месячного исследования эффективности и переносимости комбинации лефлуномида и метотрексата показали хорошую ее переносимость [25]: 72,4% больных закончили 6-месячный прием двух БПВП и далее отмен из-за симптомов непереносимости не было. В недавнем 5-летнем исследовании по безопасности этой комбинации было показано отсутствие увеличения серьезных побочных реакций или смертности [26] по сравнению с монотерапией лефлуномидом.
Лефлуномид в комбинации с сульфасалазином. Изучение данной комбинации БПВП было проведено в контролируемом рандомизированном исследовании (2-й этап которого был плацебо-контролируемым) RELIEF, дизайн которого представлен на рис. 4.
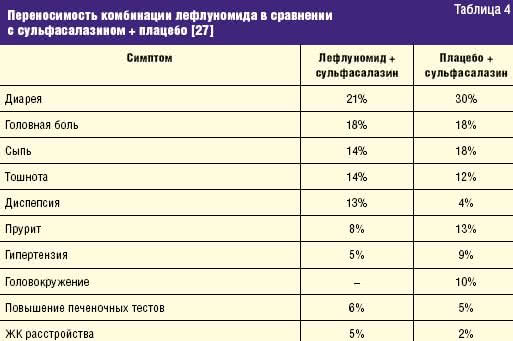
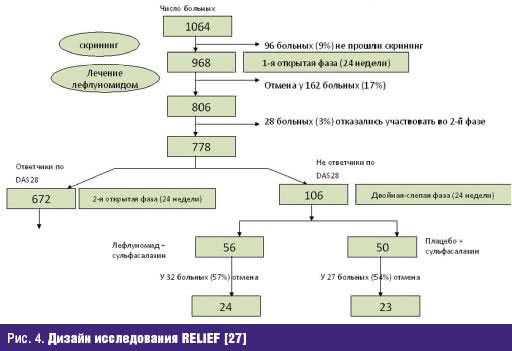 Как видно из дизайна исследования, комбинация лефлуномида и сульфасалазина или лефлуномида и плацебо назначалась больным, не ответившим на монотерапию лефлуномидом, что составило 13% от общего числа больных, включенных в исследование и пролечившихся 24 недели [27]. Число больных с ответом по критериям ACR20 и DAS28 было несколько выше при использовании комбинации лефлуномида и БПВП, при использовании комбинации лефлуномида и сульфасалазина удалось достичь 50% улучшения по критериям ACR у 9% больных против 0% в группе больных, получавших лефлуномид и плацебо. Переносимость терапии была одинакова в обеих группах (табл. 4).
Как видно из дизайна исследования, комбинация лефлуномида и сульфасалазина или лефлуномида и плацебо назначалась больным, не ответившим на монотерапию лефлуномидом, что составило 13% от общего числа больных, включенных в исследование и пролечившихся 24 недели [27]. Число больных с ответом по критериям ACR20 и DAS28 было несколько выше при использовании комбинации лефлуномида и БПВП, при использовании комбинации лефлуномида и сульфасалазина удалось достичь 50% улучшения по критериям ACR у 9% больных против 0% в группе больных, получавших лефлуномид и плацебо. Переносимость терапии была одинакова в обеих группах (табл. 4).
 При РА очень важен принцип длительного непрерывного лечения БПВП. Поэтому врач должен быть хорошо ориентирован в спектре возможных побочных реакций того или иного БПВП для организации правильного мониторинга за переносимостью лечения: кратности осмотров, проведения лабораторных анализов или инструментальных обследований и т. д. Необоснованная отмена БПВП и следующий за этим перерыв в базисной терапии приводят к обострению воспаления, которое не всегда удается подавить при возобновлении приема препарата через несколько месяцев, что ухудшает течение болезни. К сожалению, нередко врачи окончательно отменяют метотрексат или лефлуномид при развитии банальной вирусной респираторной инфекции, когда вполне достаточно прервать прием препарата до купирования катаральных явлений.
Развитие неосложненной пневмонии или другой неосложненной инфекции (цистита, бронхита и т. п.) также не является причиной для окончательной отмены цитостатика. Если больной получает не только базисные, но и симптоматические средства, следует дифференцировать, с каким именно препаратом связано развитие побочной реакции. Многие годы считалось, что базисная терапия имеет большой спектр нежелательных реакций, а нестероидные противовоспалительные (НПВП) считались более безопасными средствами. Однако внедрение в практику клинициста эндоскопических, радионуклидных методов оценки безопасности лечения показало, что НПВП обладают большой частотой развития тяжелых, потенциально жизнеопасных побочных проявлений, вызывая повреждение слизистой желудочно-кишечного тракта у 30–40% больных, отрицательно влияя на функцию почек, печени, тромбоцитов. Смертность вследствие применения НПВП по зарубежным данным сопоставима по частоте со смертностью из-за лейкемий и СПИДа [28]. Базисная терапия с этих позиций является более безопасным видом терапии.
Но даже при грамотном подходе к лечению больных РА классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности, прогрессирования болезни, переносимостью лечения) тяжелый вариант болезни все, же развивается. По нашим данным и данным литературы у 15–25% больных последовательно назначаемые БПВП не приводят к развитию выраженного эффекта (хороший эффект по критериям EULAR либо более чем 50% улучшение по критериям ACR) или приводят к развитию побочных реакций, требующих отмену базисного средства. Создание ГИБП позволило в значительной степени оптимизировать лечение больных РА.
С учетом высокой стоимости ГИБП большое значение имеет отбор больных, нуждающихся в таком лечении. В первую очередь — это больные, у которых, несмотря на применение БПВП, сохраняется высокий темп прогрессирования либо риск быстрого прогрессирования, то есть высокий уровень СРБ, сохранение припухлости в суставах и т. п.
Как было показано в исследовании BeST [14], при неэффективности двух последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы одним из критериев отбора больных для назначения ГИБП является неэффективность двух БПВП.
Особый интерес представляет опыт использования лефлуномида в сочетании с биологическими агентами, в первую очередь с ингибиторами фактора некроза опухоли альфа (ФНО-альфа). Такая комбинация имеет теоретическое обоснование, так как лефлуномид в основном действует на Т-клетки — ключевые клетки, которые передают сигнал на макрофаги, что сопровождается выбросом провоспалительных цитокинов, и на фибробласты, продуцирующие медиаторы работы хондроцитов [29].
До настоящего времени рандомизированных контролируемых исследований комбинации лефлуномида и инфликсимаба не проводилось. В ретроспективных исследованиях комбинация лефлуномида и инфликсимаба показала некоторое клиническое превосходство перед монотерапией, а побочные эффекты соответствовали известному для каждого из этих препаратов профилю переносимости [30–32]. Есть данные, что при комбинации лефлуномида с инфликсимабом число ответивших по критериям ACR20 достигает 100% [33].
В открытых проспективных исследованиях комбинация лефлуномида и инфликсимаба ассоциировалась с большим числом побочных реакций, но данных за синергизм развития симптомов непереносимости не было получено [31, 34–36]. Сыпь была наиболее частым побочным явлением в одном из них [36], чего не наблюдалось другими авторами [34, 35]. Такое расхождение данных может быть связано с тем, что в первом исследовании инфликсимаб добавлялся к двухнедельному лечению лефлуномидом, а в остальных пациенты получали лефлуномид в течение 16 недель до начала комбинированной терапии, так что пациенты с гиперчувствительностью к лефлуномиду не вошли в группу комбинированной терапии. Все три открытых исследования свидетельствуют о прекрасной клинической активности такой комбинации у большинства больных. Так, в исследовании Antoni C. и соавт. [35] (n = 72) ответивших по критериям ACR20 было 47,1% через 30 недель лечения, а число ответивших по критериям ACR50 достигло 21,4%. Частота побочных эффектов и их спектр при назначении комбинации инфликсимаба с лефлуномидом или инфликсимаба с другими БПВП по данным Голландского регистра больных [36], получающих биологические агенты, представлены в табл. 5.
Таблица 5.
При РА очень важен принцип длительного непрерывного лечения БПВП. Поэтому врач должен быть хорошо ориентирован в спектре возможных побочных реакций того или иного БПВП для организации правильного мониторинга за переносимостью лечения: кратности осмотров, проведения лабораторных анализов или инструментальных обследований и т. д. Необоснованная отмена БПВП и следующий за этим перерыв в базисной терапии приводят к обострению воспаления, которое не всегда удается подавить при возобновлении приема препарата через несколько месяцев, что ухудшает течение болезни. К сожалению, нередко врачи окончательно отменяют метотрексат или лефлуномид при развитии банальной вирусной респираторной инфекции, когда вполне достаточно прервать прием препарата до купирования катаральных явлений.
Развитие неосложненной пневмонии или другой неосложненной инфекции (цистита, бронхита и т. п.) также не является причиной для окончательной отмены цитостатика. Если больной получает не только базисные, но и симптоматические средства, следует дифференцировать, с каким именно препаратом связано развитие побочной реакции. Многие годы считалось, что базисная терапия имеет большой спектр нежелательных реакций, а нестероидные противовоспалительные (НПВП) считались более безопасными средствами. Однако внедрение в практику клинициста эндоскопических, радионуклидных методов оценки безопасности лечения показало, что НПВП обладают большой частотой развития тяжелых, потенциально жизнеопасных побочных проявлений, вызывая повреждение слизистой желудочно-кишечного тракта у 30–40% больных, отрицательно влияя на функцию почек, печени, тромбоцитов. Смертность вследствие применения НПВП по зарубежным данным сопоставима по частоте со смертностью из-за лейкемий и СПИДа [28]. Базисная терапия с этих позиций является более безопасным видом терапии.
Но даже при грамотном подходе к лечению больных РА классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности, прогрессирования болезни, переносимостью лечения) тяжелый вариант болезни все, же развивается. По нашим данным и данным литературы у 15–25% больных последовательно назначаемые БПВП не приводят к развитию выраженного эффекта (хороший эффект по критериям EULAR либо более чем 50% улучшение по критериям ACR) или приводят к развитию побочных реакций, требующих отмену базисного средства. Создание ГИБП позволило в значительной степени оптимизировать лечение больных РА.
С учетом высокой стоимости ГИБП большое значение имеет отбор больных, нуждающихся в таком лечении. В первую очередь — это больные, у которых, несмотря на применение БПВП, сохраняется высокий темп прогрессирования либо риск быстрого прогрессирования, то есть высокий уровень СРБ, сохранение припухлости в суставах и т. п.
Как было показано в исследовании BeST [14], при неэффективности двух последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы одним из критериев отбора больных для назначения ГИБП является неэффективность двух БПВП.
Особый интерес представляет опыт использования лефлуномида в сочетании с биологическими агентами, в первую очередь с ингибиторами фактора некроза опухоли альфа (ФНО-альфа). Такая комбинация имеет теоретическое обоснование, так как лефлуномид в основном действует на Т-клетки — ключевые клетки, которые передают сигнал на макрофаги, что сопровождается выбросом провоспалительных цитокинов, и на фибробласты, продуцирующие медиаторы работы хондроцитов [29].
До настоящего времени рандомизированных контролируемых исследований комбинации лефлуномида и инфликсимаба не проводилось. В ретроспективных исследованиях комбинация лефлуномида и инфликсимаба показала некоторое клиническое превосходство перед монотерапией, а побочные эффекты соответствовали известному для каждого из этих препаратов профилю переносимости [30–32]. Есть данные, что при комбинации лефлуномида с инфликсимабом число ответивших по критериям ACR20 достигает 100% [33].
В открытых проспективных исследованиях комбинация лефлуномида и инфликсимаба ассоциировалась с большим числом побочных реакций, но данных за синергизм развития симптомов непереносимости не было получено [31, 34–36]. Сыпь была наиболее частым побочным явлением в одном из них [36], чего не наблюдалось другими авторами [34, 35]. Такое расхождение данных может быть связано с тем, что в первом исследовании инфликсимаб добавлялся к двухнедельному лечению лефлуномидом, а в остальных пациенты получали лефлуномид в течение 16 недель до начала комбинированной терапии, так что пациенты с гиперчувствительностью к лефлуномиду не вошли в группу комбинированной терапии. Все три открытых исследования свидетельствуют о прекрасной клинической активности такой комбинации у большинства больных. Так, в исследовании Antoni C. и соавт. [35] (n = 72) ответивших по критериям ACR20 было 47,1% через 30 недель лечения, а число ответивших по критериям ACR50 достигло 21,4%. Частота побочных эффектов и их спектр при назначении комбинации инфликсимаба с лефлуномидом или инфликсимаба с другими БПВП по данным Голландского регистра больных [36], получающих биологические агенты, представлены в табл. 5.
Таблица 5.
 Более частым симптомом непереносимости комбинации лефлуномида и инфликсимаба также была кожная сыпь, частота других нежелательных симптомов была сходной в обеих группах.
Открытые исследования показали эффективность и безопасность комбинации лефлуномида и адалимумаба [37, 38]. В первом исследовании пациенты с активным РА были рандомизированы на две группы: терапия адалимумабом + плацебо или терапия адалимумабом в комбинации с ранее назначенными БПВП. Группа больных, в которой адалимумаб добавлялся к БПВП, продемонстрировала достоверно большее клиническое улучшение, чем группа с монотерапией адалимумабом и плацебо. Комбинация лефлуномида и адалимумаба была столь же эффективна, как и комбинация метотрексата и адалимумаба [37]. Всего во втором исследовании [38] (n = 318) 88 больных получали лефлуномид, к сожалению, авторы не дают данных по эффективности и переносимости каждой из комбинаций адалимумаба и БПВП.
Комбинация лефлуномида и этанерцепта была оценена в открытом исследовании, в котором пациенты до начала комбинированной терапии получали лефлуномид ≥ 16 недель. Эта комбинация была эффективной: 8 из 11 больных к концу 24-недельного лечения ответили по критериям ACR20. При этом было зарегистрировано два серьезных побочных эффекта и одна смерть (оцененные как не имеющие связи с препаратами) [30].
В совещании 18 экспертов [33] было высказано мнение об эффективности и переносимости комбинации лефлуномида и биологических агентов (табл. 6).
Таблица 6.
Более частым симптомом непереносимости комбинации лефлуномида и инфликсимаба также была кожная сыпь, частота других нежелательных симптомов была сходной в обеих группах.
Открытые исследования показали эффективность и безопасность комбинации лефлуномида и адалимумаба [37, 38]. В первом исследовании пациенты с активным РА были рандомизированы на две группы: терапия адалимумабом + плацебо или терапия адалимумабом в комбинации с ранее назначенными БПВП. Группа больных, в которой адалимумаб добавлялся к БПВП, продемонстрировала достоверно большее клиническое улучшение, чем группа с монотерапией адалимумабом и плацебо. Комбинация лефлуномида и адалимумаба была столь же эффективна, как и комбинация метотрексата и адалимумаба [37]. Всего во втором исследовании [38] (n = 318) 88 больных получали лефлуномид, к сожалению, авторы не дают данных по эффективности и переносимости каждой из комбинаций адалимумаба и БПВП.
Комбинация лефлуномида и этанерцепта была оценена в открытом исследовании, в котором пациенты до начала комбинированной терапии получали лефлуномид ≥ 16 недель. Эта комбинация была эффективной: 8 из 11 больных к концу 24-недельного лечения ответили по критериям ACR20. При этом было зарегистрировано два серьезных побочных эффекта и одна смерть (оцененные как не имеющие связи с препаратами) [30].
В совещании 18 экспертов [33] было высказано мнение об эффективности и переносимости комбинации лефлуномида и биологических агентов (табл. 6).
Таблица 6.
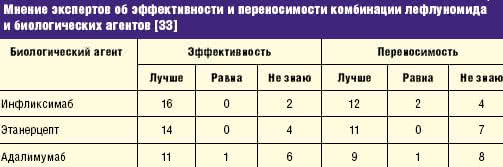 Эксперты обсудили возможные ситуации для назначения комбинации лефлуномида и биологических агентов:
Эксперты обсудили возможные ситуации для назначения комбинации лефлуномида и биологических агентов:
- при раннем тяжелом РА (5 из 18 экспертов);
- при быстром прогрессировании РА (14 из 18);
- при плохом прогнозе (4 из 18);
- при отсутствии ответа на БПВП (все 18);
- при отсутствии ответа на биологические агенты (11 из 19);
- при множественной непереносимости БПВП (14 из 18).

- Таким образом, проведенные исследования, касающиеся комбинированной терапии лефлуномидом и биологическими агентами (ингибиторами ФНО-альфа), позволяет сделать следующие выводы [29, 30]:
- Комбинированная терапия лефлуномидом с инфликсимабом и другими биологическими агентами весьма эффективна, хорошо переносится и может быть рекомендована пациентам, не отвечающим на монотерапию БПВП, или при быстром прогрессировании костной деструкции.
- Мониторинг комбинированной терапии должен быть тщательным, так как возможно увеличение частоты побочных реакций.
- При использовании комбинации лефлуномида и ингибиторов ФНО следует:
- не использовать насыщающую (100 мг/сутки в течение трех дней) дозу лефлуномида;
- не назначать лефлуномид и ингибитор ФНО одновременно;
- при низком риске развития побочных эффектов лефлуномид используют в дозе 20 мг/сутки;
- при риске развития побочных эффектов или при назначении лефлуномида на фоне терапии ингибиторами ФНО лечение следует начинать с дозы 10 мг/сутки с последующим увеличением дозы.
- Таким образом, для больных с неадекватным ответом на монотерапию БПВП комбинация с лефлуномидом позволяет увеличить эффективность лечения. Для уточнения места лефлуномида в комбинированной терапии РА необходимы дополнительные контролируемые исследования, поскольку это может улучшить прогноз у больных с тяжелым вариантом течения РА.
- Литература
- Nielen M. M., van Schaadenburg D., Reesnik H. W. et al. Specific autoantibodies precede the symptoms of rheumatoid arthritis: A study of serial measurement in blood donors // Arthr. Rheum., 2004, V. 50: 380–386.
- Шехтер А. Б., Крель А. А., Чичасова Н. В. Клинико-морфологические сопоставления при различных вариантах ревматоидного артрита (по данным пункционных биопсий синовиальной оболочки) // Терапевтический архив, 1985, № 8, 90–100.
- Ревматология. Клинические рекомендации. Под ред. акад. РАМН Е. Л. Насонова. 2-е изд., исправ. и доп. М.: Издательская группа «ГЭОТАР-Медиа», 2010, с. 111–112.
- Combe B., Landewe R., Lukas C. et al. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann. Rheum. Dis, 2007, 66: 34–45.
- Saag K. G., Teng G. G., Pather N. M. et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis // Arthritis Care & Research, 2008, 59, 762–784.
-
Agrawal S., Misra R., Aggarwal A. Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA // Clin. Rheumatol., 2007, 26: 201–204.
-
Ates A., Kinikli G., Turgay M., Akay G., Tokgoz G. Effects of rheumatoid factor isotypes on disease activity and severity in patients with rheumatoid arthritis: a comparative study // Clin Rheumatol., 2007, 26: 538–545.
- Emery P., Breedveld F. C., Dougados M. et al. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide // Ann. Rheum. Dis. 2002, 61: 290–297.
- Gossec L., Dougados M., Goupille P. et al. Prognostic factors for remission in early rheumatoid arthritis: a multiparameter prospective study // Ann. Rheum. Dis., 2004, 63: 675–680.
- Farr M., Waterhouse L., Johnson A. E. et al. A double-blind controlled study comparing sulphasalazine with placebo in rheumatoid factor (RF)-negative rheumatoid arthritis // Clin. Rheumatol., 1995, 14: 531–536.
- Boers M., Verhoeven A. C., Markusse H. M. et al. Randomised comparison of combined stepdown prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis // Lancet, 1997, 350: 309–318.
- O’Dell J. R., Leff R., Paulsen G. et al. Treatment of rheumatoid arthritis with methotrexate and hydroxychloroquine, methotrexate and sulfasalazine, or a combination of the three medications: results of a two-year, randomized, double-blind, placebo-controlled trial // Arthr. Rheum., 2002, 46: 1164–1170.
- Maillefert J. F., Combe B., Goupille P. et al. Long-term structural effects of combination therapy in patients with early rheumatoid arthritis: five-year follow up of a prospective double blind controlled study // Ann. Rheum. Dis., 2003, 62: 764–766.
- Goecor-Ruiterman Y. P., de Vries-Bouwstra J. K., Allaart C. F. et al. Clinical and radiographc outcomes of four differenet treatment strategies in pations with early rheumatoid arthritis (the BeST study): a randomised, controlled trial // Arthr. Rheum., 2005, 52: 3381–3390.
-
Mottonen T., Hannonen P., Leirisalo-Repo M. et al. Comparison of combination therapy with single drug in early rheumatoid arthritis: a randomised trial. FIN-RACo Group // Lancet, 1999, 353: 1568–1573.
-
Strand V., Cohen S., Schiff M. et al. and the Leflunomide Rheumatoid Arthritis Investigators Group. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch. Intern. Med., 1999, 159: 2542–2550.
- Boers M., Verhoeven A. C., Markusse H. M. et al. Randomised comparison of combined step-down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis [published erratum appears in Lancet, 1998; 351: 220] // Lancet, 1997, 350: 309–318.
- Kremer J. et al. Combination leflunomide and methotrexate therapy for patients with active rheumatoid arthritis failing methotrexate therapy: open label extension of a randomised, double-blind placebo controlled trial // J. Rheum., 2004, 31: 1521–1531.
- Haagsma C. J., van Riel P. L., de Jong A. J., van de Putte L. B. Combination of sulphasalazine and methotrexate versus the single components in early rheumatoid arthritis: a randomised, controlled, double-blind, 52 week clinical trial // Br. J. Rheum., 1997, 36: 1082–1088.
- Hurst S., Kallan M. J., Wolfe F. J. et al. Methotrexate, hydroxychloroquine, and intramuscular gold in rheumatoid arthritis: relative area under the curve effectiveness and sequence effects // J. Rheumatol., 2002, 29: 1639–1645.
- Kremer J. M. Methotrexate and Leflunomide: biochemical basis for combination therapy in the treatment of rheumatoid arthritis // Arthr. Rheum., 1999, 29: 14–26.
- Kalden J. R., Antoni C., Alvaro-Gracia J. M. et al. Use of combination of leflunomide with biological agents in treatment of rheumatoid arthritis // J. Rheum., 2005, 32: 1620–1631.
- Weinblatt M., Kremer J. M., Colyn J. S. Pharmacokinetics, safety, and efficacy of combination treatment with methotrexate and leflunomide in patients with active rheumatoid arthritis // Arthritis Rheum. 1999; 42: 1322.
- Kremer J. M., Genovese M., Cannon et al. Concomitant leflunomide therapy in patients with active rheumatoid arthritis despite stable doses of methotrexate, a randomised, double-blind, placebo-controlled trial // Ann. Int. Med., 2002, 137: 726–733.
- Kremer J. M., Genovese M., Cannon et al. Combination leflunomide and methotrexate (MTX) therapy for patients with active rheumatoid arthritis painful MTX monotherapy; open-label extension of a randomised, double-blind, placebo-controlled trial // J. Rheum., 2004, 31: 1521–1531.
- Kalden J., Smolen J., Emery P. Leflunomide in combination therapy // J. Rheum., 2004, 31: suppl. 71: 25–30.
- Dougados M., Emery P., Lemmel E. M. et al. When a DMARD fails, should patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? // Ann. Rheum. Dis., 2005, 64: 44–51.
- Singh G., Triadafilopoulos G. Epidemilogy of NSAID induced gastrointestinal complication // J. Rheum., 1999, 26 (Suppl. 56): 18–24.
- Насонов Е. Л. Перспективы комбинированной терапии ревматоидного артрита — лефлуномид и инфликсимаб // РМЖ, 2008, т. 16, № 10: 633–637.
- Kalden J. R., Antoni C., Alvaro-Gracia J. M. et al. Use of combination of leflunomide with biological agents in treatment of rheumatoid arthritis // J. Rheum., 2005, 32: 1620–1631.
- Bingham S. J., Buch M. H., Kerr M. A. et al. Induction of antinuclear antibodes in patients with rheumatoid arthritis treated with infliximab and leflunomide // Arthr. Rheum., 2004, 50: 4072–4073.
-
Van Riel P. Insights from Dutch DMARD and biological registries. In: Rheumatoid arthritis: optimizing management trough education. Abstr. Book, 17–18 March 2007, Vienna, Austria, p. 16–17.
- Smolen J. S. Practical management of rheumatoid arthritis patients treated with leflunomide. An international expert panel meeting // J. Rheum., 2004, Suppl. 71: 1–12.
- Kiely P. D., Johnson D. M. Infliximab and leflunomide combination therapy in rheumatoid arthritis: an open-label study // Rheum (Oxford), 2002, 41: 631–637
- Antoni C., Manger B. Treatment of rheumatoid arthritis with TNF alpha antagonist // Z. Rheum., 2003, 62: 35–39.
-
Van Riel P. Insights from Dutch DMARD and biological registries. In: Rheumatoid arthritis: optimizing management trough education. Abstr. Book, 17–18 March 2007, Vienna, Austria, p. 16–17.
- Furst D. E., Schiff M. H., Fleischmann R. M. et al. Adalimumab, a fully human anti tumor necrosis factor-alpha monoclonal antibody, and concomitant standard antirheumatic therapy for the treatment of rheumatoid arthritis: results of STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis) // J. Rheum., 2003, 30: 2563–2571.
-
Finckh A., Dehler S., Gabay C. Effectiveness of leflunomide as co-therapy of TNF inhibitors in rheumatoid arthritis. A population based study//Ann. Rheum. Dis., 2008, V. 69: 136–141.


