Дата публикации 1 сентября 2017 г.
Клинические и эпидемиологические исследования CONCEPT
Ch
ONdroitin versus
CElecoxib versus
Placebo
Trial
Расширенный отчет
Авторы: Jean-Yves Reginster
1, Jean Dudler
2, Tomasz Blicharski
3, Karel Pavelka
4
Автор членство
1 Department of Public Health, Epidemiology and Health Economics, Liège State University, Liège, Belgium
2 HFR Fribourg, Hôpital Cantonal, Fribourg, Switzerland
3 Lublin Medical University, Åšwidnik, Poland
4 Institute of Rheumatology, Charles University, Prague, Czech Republic
Для связи- Correspondence to Professor Jean-Yves Reginster, Department of Public Health, Epidemiology and Health Economics, Liège State University, Liège, Belgium, Quartier Hôpital – CHU B23, venue Hippocrate, 13, 4000 Liège, Belgium;
jyr.ch@bluewin.ch
Аннотация
Цели Хондроитин сульфат 800 мг/день Chondroitin sulfate (CS) фармацевтический класс в симптоматическая лечении коленного остеоартрита в соответствии с рекомендацией Европейского агентства лекарственных средств.
Методы Перспективные, рандомизированных, 6-месяц, 3-групповое, двойного слепого, испытание, контролируемое с помощью двух плацебо и целекоксиб (200 мг/сут)-контролированное исследование оценки изменений в боль на визуальный аналог шкале (VAS) и в Lequesne индекс (LI) как первичных конечных точек. Минимальный-клинически важные улучшения Minimal-Clinically Important Improvement (MCII), состояние пациента-приемлемым симптомы Patient-Acceptable Symptoms State (PASS) были использованы в качестве вторичных конечных точек.
Результаты 604 больных (гонартроз) диагноз по данным американского колледжа Rheumalogy (ACR) критериев, набранных в пяти европейских странах и за 182 дней. CS и Целекоксиб показали более значительное снижение боли и LI чем плацебо. При анализе в соответствии с исходно назначенным лечением
(при рандомизации) intention-to-treat (ITT) населения, боль сокращение боль VAS на день 182 в группе CS (−42.6 мм) и в Целекоксиб группа (−39.5 мм) был значительно больше, чем в группе плацебо (−33.3 мм) (p = 0,001 для CS и p = 0,009 Целекоксиб), хотя никакой разницы наблюдается между CS и Целекоксиб. Аналогичная тенденция для LI, как снижение в этот показатель в CS группы (−4.7) и Целекоксиб группы (−4.6) был значительно больше, чем в группе плацебо (−3.7) (p = 0,023 для CS и p = 0,015 Целекоксиб), было отмечено никакой разницы между CS и Целекоксиб. Обе вторичных конечных точек (MCII и PASS) на день 182 значительно улучшились в CS и Целекоксиб групп. Все процедуры продемонстрировал отличную безопасность профили.
Заключение 800 мг/день фармацевтического класса CS превосходит плацебо и подобен Целекоксиб в уменьшении боли и улучшения функции более 6 месяцев у больных симптоматическом остеоартрит (ОА) колена. Эта показание для CS следует рассматривать препаратов первой линии при лечении ОА колена.
Введение
Остеоартрит (ОА) является наиболее распространенным опорно-заболевание, которое поражает людей, важной причиной боли, потеря функции, инвалидности и проблемы общественного здравоохранения, который связан с значительное и все большее бремя на общества. ОА коленных и тазобедренных стремится создавать наибольшее влияние на население, как боль и скованности в эти крупные суставы нагружаемым весом часто приводят к необходимости медицинского вмешательства. Медицинское ведение коленного ОА включает фармакологических и нефармакологических методов и многочисленных научных обществ подготовили рекомендации для не хирургического лечения колена ОА. Хотя некоторые различия наблюдаются между этими руководящие принципы на основе доказательств, главным образом отражает неоднородность групп экспертов участвует, географические различия в доступности химических образований было, до недавнего времени, общий консенсус, что болеутоляющие средства, в том числе парацетамола и нестероидные противовоспалительные препараты (НПВП) продемонстрировали позитивные выгоды-риска, когда используется для лечения симптомов колена О.А. Однако последние публикации агрессивно оспаривали применение парацетамола для лечения симптоматических OA ввиду отсутствия эффективности и в значительной степени токсичности, особенно на верхней границе стандартной дозы обезболивающее. Аналогичным образом профили безопасности оральных НПВП остаются предметом озабоченности и осторожность рекомендуется перед выбором препарата и дозы для пациента. Таким образом, последние руководствах рекомендуется поддерживающая терапия проводится с симптоматическим замедленного действия препаратов для ОА symptomatic slow-acting drugs for OA (SYSADOAs), класс препаратов, у которых признается высокую степень безопасности и переносимости. Хотя расхождения можно найти в литературе относительно рекомендаций по SYSADOAs в лечении колена ОА., высшего качества доказательства, как представляется, быть предусмотрено патентом, рецепт формулы хондроитин сульфат (CS) и кристаллических глюкозамин сульфат glucosamine sulfate (GS).
Хондроитин сульфат (CS) является сульфатированных Гликозаминогликан, состоящий из цепочки чередующихся D-глюкуроновой кислоты и N-ацетил D-galactosamine. CS доступен как фармацевтический класс и класс нутрицевтиков продукции, последней демонстрирует поразительные различия в подготовке, композиция, чистоты, а также клинические эффекты. Эти различия могут объяснить, почему, в то время как фармацевтического класса CS (ie, 4 & 6isomer натрия CS) было показано, улучшить боли и функции и/или задержки структурных прогрессирования колена OA в нескольких хорошо проведенного исследования, эти результаты были не подтверждено, когда нижний класс формулировки были использованы. Действительно недавние систематического обзора, проведенного группы Кокрановского сотрудничества делает вывод о том, что CS, отдельно или в сочетании с GS, лучше, чем плацебо в улучшении боль в участников с ОА в краткосрочные исследования, с CS, имея более низкий риск серьезных неблагоприятных События по сравнению с контролем.
Еще одним потенциальным источником несоответствия в результатах предыдущих исследований SYSADOAs в колене ОА был своеобразный испытательный дизайн. По этой причине Европейское агентство лекарственных средств European Medicines Agency (EMA) подготовила руководство по клинической исследований из лекарственных продукция используется в лечение артроза Guideline on Clinical Investigation of Medicinal Products Used in the Treatment of Osteoarthritis (CPMP/EWP/784/97 Rev. 1), руководства, которая недавно была поддержана европейских экспертов консенсуса. Он рекомендует что эффективность химического формулы, используемых в лечении ОА симптоматическая испытываться по дизайн стандартного исследования со следующими основными параметрами: продолжительностью минимум 6-месячного исследования; Дизайн 3 АРМ исследования, включая плацебо и активный компаратор (ie, оральные НПВП); и две конечные точки совместно начальной оценки боли и функции, соответственно.
Здесь мы сообщать результаты исследования фармацевтического класса CS у пациентов с симптоматической колена О.А., которая, насколько нам известно, является первой когда-либо проводились в полном соответствии с вышеупомянутой рекомендацией EMA.
Материал и методы
Дизайн исследования и подбор больных
Исследование состоит из пациентов из Бельгии, Чешской Республики, Италии, Польши и Швейцарии, которые были зачислены между июня 2014 года и октября 2015 г. Критерии включения основных амбулаторных статус, возраст старше 50 лет и первичный колена OA медиальной или латеральной femorotibial отдел, диагноз согласно клинические и рентгенологические критерии американского колледжа ревматологии (ACR). Колено с большей симптоматикой (со счетом боль по крайней мере 50 мм на 0-100 мм Visual аналоговая шкала (VAS) для по крайней мере 3 месяца до включения) был определен как целевое колено target knee. Основные исключения критерии были те, которые перечислены в последней версии руководства по клинической расследование лекарственных препаратов, используемых в лечении остеоартрита, выпущенная EMA 2010 (CPMP/EWP/784/97 Rev. 1) и 4 класс радиографический OA согласно системе классификации, Келлгрен-Лоуренс Kellgren-Lawrence (K-L). Использование любых Внутрисуставных инъекций в целевые колена в течение последних 6 месяцев, SYSADOAs в течение последних 3 месяцев, НПВП в течение последних 5 дней и парацетамол в 10 часов, предшествующих заявок было также конкретно запрещено протоколом исследования. Там были две конечные точки совместно начальных, заранее предусмотренных руководящими принципами EMA: боль и Lequesne индекс (LI) оценки. Была получена санкция Комитета этики от всех участвующих центров и все пациенты дал их письменного информированного согласия на участие.
Это исследование был разработан для оценки симптоматический эффект CS. Костные и хрящевые маркеры не были цель в этом краткое исследование.
Назначение лечения
Пациентов были рандомизированы для одной из следующих трех групп: CS (1) группы: одна таблетка CS 800 мг и одна капсула Целекоксиб плацебо; (2) Целекоксиб группы: одна таблетка плацебо CS и одна капсула Целекоксиб 200 мг (Celebrex Pfizer); (3) группы плацебо: одна таблетка плацебо CS и одна капсула Целекоксиб плацебо. Для двойного слепого, с двумя плацебо дизайн использовались инкапсулированные таблетки Celebrex доступных на рынке. CS таблетки содержит высокоочищенные хондроитин 4 & 6 сульфат в концентрации не менее чем на 95% (европейские патенты E 1582214 и РД 1705192) (Condrosulf (другое название бренда: Chondrosulf, Condral) 800; IBSA Institut Biochimique SA; Pambio-Noranco, Швейцария). Лечение один раз в день, каждый вечер с стаканом воды, 6 месяцев. Для большей анальгезии, пациентам разрешалось принимать парацетамол 500 мг таблетки (максимальная доза 3 г/сут), и они записали использования его в дневник. Прежде чем проводилась оценки симптом при визитах в клинике необходимо соответствующего промежуток продолжительностью 10 часов. Никакие других фармакологических и нефармакологических вмешательств для ОА не было разрешено. Соблюдение процедур исследования был создан путем спрашивать пациентов о пропущенных дозы и путем подсчета неиспользованных исследования лекарств.
Оценка исходов
Там были две конечные точки совместно начальных, как это предусмотрено Директивой EMA, и оба были оценены как переход от базовой линии, то есть, разница между регистрацией и завершением исследования. Одна конечная точка была оценка пациента боли на 100 мм Visual аналоговая шкала (VAS). Вторая конечная точка была Lequesne индекс (LI), который интегрирует боли и функции и результаты в оценка от 0 до 24. Вторичных конечные точки включены доли больных, достигнув минимального клинически важные улучшения (MCII), определяется как малейшее изменение в измерение, которое обозначает важным улучшением в пациента симптом, и Patient Acceptable Symptom State (PASS), определяется как значение симптомы за какие пациенты считают себя хорошо. Пациента и исследователь глобальной оценки разбиты по 5-балльной шкале Likert ординарному счету (отлично, хорошо, удовлетворительно, слабо, нет). Были записаны все неблагоприятные события и результаты аномальные лабораторных испытаний.
Статистический анализ
Все статистические анализы с использованием программного обеспечения SAS (V. 9.4 и V. 8.2) в операционной системе Windows 7.
Мы рассчитали образца размером 600 пациентов, основанные на 9 мм оценкам разница CS и плацебо после 6 месяцев лечения, со стандартным отклонением (SD) 25 мм, мощность 90%, альфа-риска 5% и 15% отсева. Намерение to-treat (ITT) населения был определен как все рандомизированные пациенты, которые получили одну дозу препарата исследования. Анализ безопасности были проведены на всех рандомизированных пациентов.
VAS (боль в мм) и LI индекс от D1 D182 были сопоставлены между три группами лечения с помощью линейной смешанная модель, осуществляемой с помощью SAS СМЕШАННАЯ процедура с пациентом как случайный эффект, центр, группы лечения, момент времени, взаимодействие между лечение группы и время точки как категорическое коварианты (взаимодействие между группой лечения и центр, исключены из окончательной модели, потому что не является статистически значимым. p = 0.101 для VAS смешанная модель, p = 0,998 для ли Смешанная модель). Для этого анализа была выполнена замена не отсутствующих значений (LOCF, last observation carried forward последние наблюдения, перенесенные вперед или BOCF basal observation carried forward, базовые наблюдения переносятся). Доля больных, достигнув MCII, PASS и исходов в ревматологии Outcome Measures in Rheumatology (OMERACT-OARSI) критерии были сопоставлены с помощью хи-квадрат (χ2теста) χ2 test). Пациента и следователя глобальные оценки были проанализированы с помощью χ Mantel-Haenszel2 теста. Различия между группами частоте больных лечение возникающих нежелательных явлений treatment-emergent adverse events (TEAEs), серьезных побочных проявлений serious adverse events (SAEs), побочных реакций (adverse drug reactions (ADRs) и выбытия из исследования благодаря AEs были оценены с помощью χ2 испытания.
Результаты
656 пациентов, отобраны, 604 были рандомизированы и 603 подходили к ITT анализ (все пациенты, которые получили лекарства исследования). Из этих пациентов 199 получил CS, 199 получил Целекоксиб и 205 получил плацебо. Совокупное время распределение выхода был похож на три группы без значительных различий в причинах выхода (
рис. 1). Пациенты в трех группы имели аналогичные демографические и базовые характеристики (
Таблица 1). 1 до 3 стадии K-L были равномерно распределены между тремя группами, с примерно 50% из пациентов, представляя стадия 2 OA и 25%, соответствующий стадия 1 или 3 стадии в целом.
Таблица 1
Демографические и базовые характеристики пациентов
| CS
n = 199 |
Целекоксиб
n = 199 |
Плацебо
n = 205 |
| Возраст (лет) |
| Среднее (SD) |
65.5 (8.0) |
65.5 (7,8) |
64,9 (8.0) |
| Секс, n (%) |
| Девушки |
156 (78,4) |
160 (80,4) |
152 (74.1) |
| Высота (см) |
| Среднее (SD) |
163.3 (8,8) |
162.8 (9,4) |
164,6 (9,5) |
| Вес (кг) |
| Среднее (SD) |
80,4 (14,1) |
78,4 (13,9) |
82,9 (14,7) |
| ИМТ (кг/м2) |
| Среднее (SD) |
30,2 (4,7) |
29,5 (4.4) |
30,6 (5.0) |
| Время от диагностики колена ОА (месяцев) |
| Среднее (SD) |
72,3 (69.2) |
64,4 (63,4) |
69,2 (72,5) |
| KL стадия , n (%) |
| Стадия 1 |
48 (24,1) |
46 (23,1) |
53 (25,9) |
| 2 Стадия |
100 (50,3) |
101 (50,8) |
101 (49,3) |
| 3 Стадия |
50 (25.1) |
52 (26,1) |
51 (24,9) |
| 4 Стадия |
1 (0,5) |
0 (0.0) |
0 (0.0) |
| Продолжительность регулярных боль (месяцы) |
| Среднее (SD) |
41,7 (60,3) |
39,9 (56,5) |
47,8 (68.1) |
| Целевой колена (наиболее симптоматическая) |
| Слева, n (%) |
85 (42,7) |
95 (47,7) |
92 (44,9) |
| Целевой боль колена (VAS, мм) |
| Среднее (SD) |
70,9 (9,8) |
69,7 (10.2) |
70,0 (10,3) |
| Lequesne’s Algo-Functional Index (LI total score) |
| Среднее (SD) |
11,8 (2.9) |
11.6 (2.9) |
11,8 (3.1) |
BMI, body mass index; KL, Kellgren-Lawrence; LI, Lequesne Index; OA, osteoarthritis; VAS, Visual Analogue Scale.
BMI, индекс массы тела; KL, Келлгрен Лоуренс; ЛИ, Lequesne индекс; ОА., остеоартрита; СОСТС, визуальные аналоговая шкала.
Таблица 2
VAS и LI
| CS |
Целекоксиб |
Плацебо |
| n |
Среднее (SE) * |
p Value† |
n |
Среднее (SE) * |
p Value† |
n |
Среднее (SE) * |
p Value‡ |
| VAS |
| Базовый |
199 |
71.2 (0,8) |
195 |
70,0 (0,8) |
205 |
70.2 (0,8) |
| День 30 |
195 |
49.4 (1.5) |
0.869 |
195 |
46,9 (1.5) |
0.159 |
204 |
49.7 (1.4) |
0.309 |
| 91 день |
179 |
39,4 (1,7) |
0.429 |
182 |
38.3 (1,7) |
0,213 |
188 |
41.2 (1.6) |
0.450 |
| 182 дня |
160 |
28.6 (1,8) |
0.001 |
173 |
30.5 (1,7) |
0.009 |
172 |
36,8 (1,7) |
0,002 |
| LI |
| Базовый |
199 |
11,8 (0,2) |
195 |
11.6 (0,2) |
205 |
11,8 (0,2) |
| День 30 |
195 |
9.6 (0,3) |
0,714 |
195 |
9.1 (0,3) |
0.045 |
204 |
9.8 (0,3) |
0,105 |
| 91 день |
179 |
8.1 (0,3) |
0.050 |
182 |
8.0 (0,3) |
0,027 |
188 |
8.8 (0,3) |
0.052 |
| 182 дня |
160 |
7.1 (0,3) |
0.023 |
173 |
7.0 (0,3) |
0,015 |
172 |
8.0 (0,3) |
0,024 |
*Estimated mean and SE from a mixed-model analysis.
* Подсчитано среднее и SE от смешанная модель анализа.
†Compared с плацебо.
‡Comparing трех групп лечения.
ЛИ, Lequesne индекс; СОСТС, визуальные аналоговая шкала.
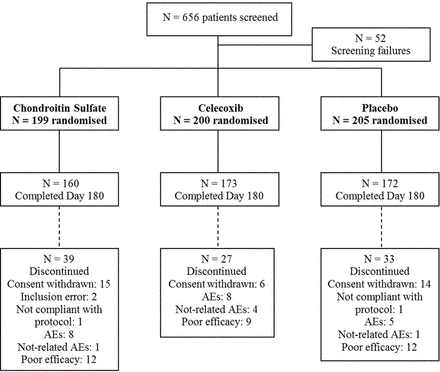 Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Анализ оценки боли в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями на день 30, 91 и 182 (все p < 0,001) (
рис. 2).Обе CS и Целекоксиб группы показали статистически более снижение боли, по сравнению с группой плацебо (p = 0,001 для CS и p = 0,009 Целекоксиб,
Таблица 2) после 6 месяцев без каких-либо существенных различий между двумя группами активных (p = 0,446).
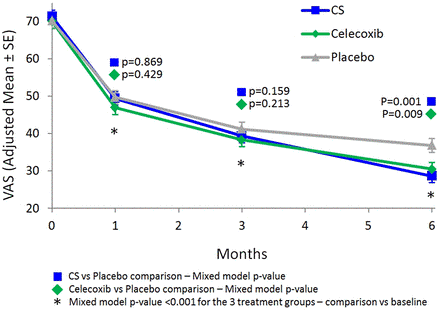 Рисунок 2
Визуального аналоговая шкала (VAS).
Рисунок 2
Визуального аналоговая шкала (VAS).
Анализ индекса LI в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями в день 30, 91 и 182 (все p < 0,001) (
рис. 3). В день 91 и 182, CS и Целекоксиб индуцированной значительно большее сокращение чем плацебо (p = 0.050 для CS и p = 0,027 Целекоксиб в день 91, p = 0,023 для CS и p = 0,015 для Целекоксиб в день 182) в то время, как было отмечено никакой разницы между CS и целекоксиб (p = 0,799 на день 91 и p = 0.890 в день 182,
Таблица 2). Снижение LI в группе Целекоксиб достигается на день 30 статистическую значимость по сравнению с группой плацебо (p = 0,045), в то время как в группе CS до дня 91 (p = 0,050) (
рис. 3).
 Рисунок 3
Индекс Lequesne (LI).
Рисунок 3
Индекс Lequesne (LI).
После 6 месяцев большая часть больных достиг MCII (20 мм VAS сокращения) в CS (68%) и Целекоксиб групп (69%), чем в группе плацебо (61%). Это различие не было значимым для сравнения CS-плацебо (p = 0.122), для сравнения Целекоксиб – плацебо (p = 0.098) и не существенные для CS-Целекоксиб сравнения (p = 0,914). Аналогичные результаты были получены для доли больных, достигнув PASS в CS (57%), целекоксиб (59%) и плацебо (49%). PASS данных были значимыми для сравнения Целекоксиб – плацебо (p = 0.047), не существенные для сравнения CS-плацебо (p = 0.130) и не существенные для CS-Целекоксиб сравнения (p = 0.611).
Значительные результаты были замечены при определении ответчиков пациентов с по крайней мере 40% или 50% улучшения в боль или LI баллы, и когда пациенты были классифицированы согласно OMERACT-OARSI (сценарий F). CS и Целекоксиб предоставило значительно большее количество респондентов, чем плацебо и никакой разницы было отмечено CS и целекоксиб (
Таблица 3).
Таблица 3
OMERACT-OARSI и MCII
| CS-n = 199 |
Целекоксиб n = 199 |
Плацебо n = 205 |
CS против плацебо χ2 Значение p |
Целекоксиб против плацебо χ2 Значение p |
| VAS-MCII 20 мм, n (%) |
| День 30 — Да (%) |
94 (47) |
99 (50) |
93 (45) |
0,706 |
0.378 |
| День 91 — Да (%) |
126 (63) |
128 (64) |
125 (61) |
0.628 |
0.487 |
| День 182 — Да (%) |
136 (68) |
137 (69) |
125 (61) |
0.122 |
0.098 |
| ПЕРЕВАЛ, n (%) |
| День 30 — Да (%) |
62 (31) |
80 (40) |
65 (32) |
0.905 |
0,075 |
| День 91 — Да (%) |
93 (47) |
108 (54) |
91 (44) |
0.636 |
0.047 |
| День 182 — Да (%) |
113 (57) |
118 (59) |
101 (49) |
0.130 |
0,043 |
| VAS-MCII 40%, n (%) |
| День 30 — Да (%) |
59 (30) |
78 (39) |
64 (31) |
0.731 |
0.093 |
| День 91 — Да (%) |
105 (53) |
103 (52) |
102 (50) |
0.545 |
0.687 |
| День 182 — Да (%) |
127 (64) |
116 (58) |
106 (52) |
0.014 |
0,184 |
| VAS-MCII 50%, n () |
| День 30 — Да (%) |
43 (22) |
50 (25) |
49 (24) |
0.582 |
0.775 |
| День 91 — Да (%) |
86 (43) |
83 (42) |
77 (38) |
0.247 |
0.394 |
| День 182 — Да (%) |
115 (58) |
103 (52) |
83 (40) |
0.005 |
0.023 |
| LI-MCII 40%, n (%) |
| День 30 — Да (%) |
34 (17) |
45 (23) |
27 (13) |
0,272 |
0.013 |
| День 91 — Да (%) |
71 (36) |
67 (34) |
56 (27) |
0,070 |
0.165 |
| День 182 — Да (%) |
94 (47) |
90 (45) |
72 (35) |
0.013 |
0,038 |
| LI – MCII 50%, n () |
| День 30 — Да (%) |
18 (9) |
27 (14) |
13 (6) |
0,307 |
0,015 |
| День 91 — Да (%) |
52 (26) |
44 (22) |
34 (17) |
0,019 |
0.159 |
| День 182 — Да (%) |
74 (37) |
70 (35) |
56 (27) |
0,034 |
0,088 |
| OMERACT-OARSI — сценарий F, n (%) |
| День 30 — Да (%) |
82 (41) |
89 (45) |
82 (40) |
0.805 |
0.337 |
| День 91 — Да (%) |
118 (59) |
119 (60) |
110 (54) |
0.253 |
0,213 |
| День 182 — Да (%) |
132 (66) |
133 (67) |
113 (55) |
0,021 |
0,016 |
Если мы используем результаты ITT2 населения для MCII (20 мм) сообщила в тексте публикации не являются правильными (против плацебо сравнения не являются статистически значимыми, см. таблицу выше).
ITT, intention-to-treat; LI, Lequesne Index; MCII, Minimal-Clinically Important Improvement; PASS, Patient-Acceptable Symptoms State; VAS, Visual Analogue Scale.
ITT, намерение to-treat; ЛИ, Lequesne индекс; MCII, минимальный клинически важные улучшения; PASS, пациент приемлемого симптомы состояния; VAS, визуальные аналоговая шкала.
В заключение изучения (день 182), значительно больше пациентов и больше исследовательских подсчетов глобальной оценки определены как отличные или хорошее в CS и Целекоксиб групп, по сравнению с плацебо (p = 0,027 для CS, p = 0,013 для Целекоксиб), в то время как нет никакой разницы между двумя активных группами (p = 0.774). Использование лекарства исследование было> 95% во всех группах, демонстрируя отличные соблюдения и отсутствие межгрупповые различия.
Наконец не было никакого существенного различия между CS, Целекоксиб или плацебо использования частоты TEAEs, SAEs, ADRs и выход, относящиеся к TEAEs. Боль/дискомфорт в животе был наиболее часто сообщалось ADR (2,5% в группе CS, 4,5% в группе Целекоксиб и 2,9% в группе плацебо). Обычные лабораторные испытания определены один случай лейкопении и один случай тромбоцитопения в группе плацебо, но без существенных отклонений в CS или Целекоксиб групп.
Обсуждение
В настоящем докладе, мы предоставляем данные из исследования CONCEPT, который, по нашему знанию, впервые документации, подтверждающей прочный терапевтический эффект SYSADOAs в колене OA клинических испытаний, что полностью согласуются с текущего руководства EMA. Мы продемонстрировали, что CS превосходит плацебо и подобен Целекоксиб через несколько исходов, включая уменьшение боли и LI (первичные конечные точки), а также доля пациентов, которые испытывают MCII (вторичный конечной точки) и пациента / исследователь глобальных оценок.
До CONCEPT, единственное исследование, оценку воздействия SYSADOA на колене OA в три групповом дизайн исследование эффективности было Glucosamine Unum-in-Die Efficacy (GUIDE), исследование, которое продемонстрировали что запатентованный кристаллический глюкозамина сульфата (GS) был превосходит плацебо и эквивалент ацетаминофен при уменьшении LI после 6 месяцев лечения. Однако, в настоящее исследование использованы Целекоксиб как активный компаратор, НПВП, который недавно был показан обеспечить значительно более клинический эффект чем ацетаминофен в колене ОА.
Все препараты, включая плацебо, показали статистически значимое улучшение от базовой линии по боли и функции уже к дню 30, и этот эффект сохраняется до конца исследования. Это не удивительно, как существенный эффект плацебо сообщалось ранее в исследованиях, оценке наркотиков в ОА. Однако оба активных групп (CS и Целекоксиб) предоставляют значительно больше уменьшение боли (VAS) и лучше, улучшение функции (LI) чем плацебо, после 6 месяцев и 3 месяца, соответственно. Что касается LI интересно отметить, что лечение Целекоксиб привело к статистически значимым изменениям в 30 день по сравнению с плацебо, в то время как CS нет. Хотя невозможно знать окончательно, это наблюдение может быть связаны с внутренние различия в механизме действия двух молекул.
Одним важным соображением в любое клиническое исследование, которое использует для оценки боли, как приравнивать статистической значимости с клинической выгоды. Действительно была поставлена под сомнение актуальность статистически значимые улучшения CS-зависимых в ОА симптомы в предыдущих испытаний. EMA 2010 Руководящий документ свидетельствует о том, что улучшение в боль наблюдается с тестом сустава должна быть клинически значима, но к сожалению руководство не указывает числового порога. Однако Группа европейских академических ученых и регуляторы недавно опубликовал эксперт консенсусное заявление, в котором они предполагают, что разница по крайней мере 5 мм на 100 мм VAS между плацебо и активных групп является клинически значимых порог для SYSADOAs. Эти рекомендации были частично основан на замечание, что большинство клинических испытаний опубликованные с SYSADOAs в колена или бедра OA показать симптоматическое улучшение в диапазоне 5 – 6 мм на 100 мм VAS. В нашем исследовании разница в уменьшение боли CS и плацебо-8,2 мм после 6 месяцев в ITT анализ. Эта разница превышает этот диапазон и сопоставим с предыдущих публикаций, отчетов положительное влияние SYSADOAs колена или бедра ОА.
Улучшения в боли и функции наблюдается в группе CS соответствует размер эффекта effect size (ES)
* стат. показатель количества отделяемых единиц стандартного отклонения от средней группы 0,35 для боли и 0,27 для LI, тогда как ES в группе Целекоксиб 0,27 для боли и 0,30 за LI. ES ≤0.2 обычно рассматривается как малые пока ES от 0,2 до 0,5 определен как средний. Значение ES 0,27 для боли в группе Целекоксиб согласуется с предыдущей публикации и обеспечивает таким образом внешние проверки концепции данных испытаний. Для CS ES 0,35 боли в соответствии с значимостью, сообщалось ранее для фармацевтического класса GS или CS, сравнивает с сообщений ES для большинства НПВП и в два раза выше, чем ES (0,14) часто встречающихся для ацетаминофен в колене ОА.
Хотя было показано, что ацетаминофен и НПВП быть эффективным в условиях колена OA, хроническое использование этих лекарств известен ассоциироваться с частых и серьезных побочных эффектов. В этой связи примечательно, что CS, в дополнение к надежной эффективности профиль, что сопоставимо с НПВП, также экспонаты профиля безопасности, который был похож на плацебо в этом исследовании и в других странах. Эта комбинация терапевтический эффект и документально безопасность и переносимость объяснить, почему последние рекомендации рекомендуем SYSADOAs, включая CS фармацевтического класса, в качестве первой линии лечения в решении колена О.А.
Помимо классической эффективности параметров, боль и LI регулирования и клинические руководящие принципы по-прежнему дополнительный акцент на пациента восприятие их клинического состояния, требующие использования дополнительных мер для оценки результатов лечения. Значительно выше доли больных, достигнув самооценке MCII и значительно большее количество пациентов, ранжирование их лечения как хорошие или отличные, по сравнению с группой плацебо, далее отражает важность клинические преимущества получены с использованием CS.
В заключение исследование CONCEPT представил доказательства того, что ежедневно назначение 800 мг 4&6 CS у пациентов с симптоматической колена OA приведет к улучшениям в боли и функции превосходит плацебо и подобен Целекоксиб НПВП. Кроме того, мы подтвердили безопасность профиль CS, что наблюдалось ранее другими. Это убедительные преимущества-рисков, в свете известных клинических рисков, связанных с хронической использования НПВП и парацетамол, подчеркивает потенциальную важность фармацевтического класса CS в решении колена ОА., особенно у пожилого населения требующие длительного лечения. В целом это исследование подтверждает необходимость для будущих клинических руководств по фармакологическим управлению колена OA дизайна исследования, а также состав и качество тестирования продукта, при оценке эффективности SYSADOAs.

 Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Анализ оценки боли в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями на день 30, 91 и 182 (все p < 0,001) (рис. 2).Обе CS и Целекоксиб группы показали статистически более снижение боли, по сравнению с группой плацебо (p = 0,001 для CS и p = 0,009 Целекоксиб, Таблица 2) после 6 месяцев без каких-либо существенных различий между двумя группами активных (p = 0,446).
Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Анализ оценки боли в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями на день 30, 91 и 182 (все p < 0,001) (рис. 2).Обе CS и Целекоксиб группы показали статистически более снижение боли, по сравнению с группой плацебо (p = 0,001 для CS и p = 0,009 Целекоксиб, Таблица 2) после 6 месяцев без каких-либо существенных различий между двумя группами активных (p = 0,446).
 Рисунок 2
Визуального аналоговая шкала (VAS).
Анализ индекса LI в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями в день 30, 91 и 182 (все p < 0,001) (рис. 3). В день 91 и 182, CS и Целекоксиб индуцированной значительно большее сокращение чем плацебо (p = 0.050 для CS и p = 0,027 Целекоксиб в день 91, p = 0,023 для CS и p = 0,015 для Целекоксиб в день 182) в то время, как было отмечено никакой разницы между CS и целекоксиб (p = 0,799 на день 91 и p = 0.890 в день 182, Таблица 2). Снижение LI в группе Целекоксиб достигается на день 30 статистическую значимость по сравнению с группой плацебо (p = 0,045), в то время как в группе CS до дня 91 (p = 0,050) (рис. 3).
Рисунок 2
Визуального аналоговая шкала (VAS).
Анализ индекса LI в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями в день 30, 91 и 182 (все p < 0,001) (рис. 3). В день 91 и 182, CS и Целекоксиб индуцированной значительно большее сокращение чем плацебо (p = 0.050 для CS и p = 0,027 Целекоксиб в день 91, p = 0,023 для CS и p = 0,015 для Целекоксиб в день 182) в то время, как было отмечено никакой разницы между CS и целекоксиб (p = 0,799 на день 91 и p = 0.890 в день 182, Таблица 2). Снижение LI в группе Целекоксиб достигается на день 30 статистическую значимость по сравнению с группой плацебо (p = 0,045), в то время как в группе CS до дня 91 (p = 0,050) (рис. 3).
 Рисунок 3
Индекс Lequesne (LI).
После 6 месяцев большая часть больных достиг MCII (20 мм VAS сокращения) в CS (68%) и Целекоксиб групп (69%), чем в группе плацебо (61%). Это различие не было значимым для сравнения CS-плацебо (p = 0.122), для сравнения Целекоксиб – плацебо (p = 0.098) и не существенные для CS-Целекоксиб сравнения (p = 0,914). Аналогичные результаты были получены для доли больных, достигнув PASS в CS (57%), целекоксиб (59%) и плацебо (49%). PASS данных были значимыми для сравнения Целекоксиб – плацебо (p = 0.047), не существенные для сравнения CS-плацебо (p = 0.130) и не существенные для CS-Целекоксиб сравнения (p = 0.611).
Значительные результаты были замечены при определении ответчиков пациентов с по крайней мере 40% или 50% улучшения в боль или LI баллы, и когда пациенты были классифицированы согласно OMERACT-OARSI (сценарий F). CS и Целекоксиб предоставило значительно большее количество респондентов, чем плацебо и никакой разницы было отмечено CS и целекоксиб (Таблица 3).
Таблица 3
OMERACT-OARSI и MCII
Рисунок 3
Индекс Lequesne (LI).
После 6 месяцев большая часть больных достиг MCII (20 мм VAS сокращения) в CS (68%) и Целекоксиб групп (69%), чем в группе плацебо (61%). Это различие не было значимым для сравнения CS-плацебо (p = 0.122), для сравнения Целекоксиб – плацебо (p = 0.098) и не существенные для CS-Целекоксиб сравнения (p = 0,914). Аналогичные результаты были получены для доли больных, достигнув PASS в CS (57%), целекоксиб (59%) и плацебо (49%). PASS данных были значимыми для сравнения Целекоксиб – плацебо (p = 0.047), не существенные для сравнения CS-плацебо (p = 0.130) и не существенные для CS-Целекоксиб сравнения (p = 0.611).
Значительные результаты были замечены при определении ответчиков пациентов с по крайней мере 40% или 50% улучшения в боль или LI баллы, и когда пациенты были классифицированы согласно OMERACT-OARSI (сценарий F). CS и Целекоксиб предоставило значительно большее количество респондентов, чем плацебо и никакой разницы было отмечено CS и целекоксиб (Таблица 3).
Таблица 3
OMERACT-OARSI и MCII

 Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Анализ оценки боли в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями на день 30, 91 и 182 (все p < 0,001) (рис. 2).Обе CS и Целекоксиб группы показали статистически более снижение боли, по сравнению с группой плацебо (p = 0,001 для CS и p = 0,009 Целекоксиб, Таблица 2) после 6 месяцев без каких-либо существенных различий между двумя группами активных (p = 0,446).
Рисунок 1
Мировосприятия пациентов. AE, неблагоприятные события.
Анализ оценки боли в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями на день 30, 91 и 182 (все p < 0,001) (рис. 2).Обе CS и Целекоксиб группы показали статистически более снижение боли, по сравнению с группой плацебо (p = 0,001 для CS и p = 0,009 Целекоксиб, Таблица 2) после 6 месяцев без каких-либо существенных различий между двумя группами активных (p = 0,446).
 Рисунок 2
Визуального аналоговая шкала (VAS).
Анализ индекса LI в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями в день 30, 91 и 182 (все p < 0,001) (рис. 3). В день 91 и 182, CS и Целекоксиб индуцированной значительно большее сокращение чем плацебо (p = 0.050 для CS и p = 0,027 Целекоксиб в день 91, p = 0,023 для CS и p = 0,015 для Целекоксиб в день 182) в то время, как было отмечено никакой разницы между CS и целекоксиб (p = 0,799 на день 91 и p = 0.890 в день 182, Таблица 2). Снижение LI в группе Целекоксиб достигается на день 30 статистическую значимость по сравнению с группой плацебо (p = 0,045), в то время как в группе CS до дня 91 (p = 0,050) (рис. 3).
Рисунок 2
Визуального аналоговая шкала (VAS).
Анализ индекса LI в ITT показал значительное улучшение во всех трех группах, по сравнению с базовыми показателями в день 30, 91 и 182 (все p < 0,001) (рис. 3). В день 91 и 182, CS и Целекоксиб индуцированной значительно большее сокращение чем плацебо (p = 0.050 для CS и p = 0,027 Целекоксиб в день 91, p = 0,023 для CS и p = 0,015 для Целекоксиб в день 182) в то время, как было отмечено никакой разницы между CS и целекоксиб (p = 0,799 на день 91 и p = 0.890 в день 182, Таблица 2). Снижение LI в группе Целекоксиб достигается на день 30 статистическую значимость по сравнению с группой плацебо (p = 0,045), в то время как в группе CS до дня 91 (p = 0,050) (рис. 3).
 Рисунок 3
Индекс Lequesne (LI).
После 6 месяцев большая часть больных достиг MCII (20 мм VAS сокращения) в CS (68%) и Целекоксиб групп (69%), чем в группе плацебо (61%). Это различие не было значимым для сравнения CS-плацебо (p = 0.122), для сравнения Целекоксиб – плацебо (p = 0.098) и не существенные для CS-Целекоксиб сравнения (p = 0,914). Аналогичные результаты были получены для доли больных, достигнув PASS в CS (57%), целекоксиб (59%) и плацебо (49%). PASS данных были значимыми для сравнения Целекоксиб – плацебо (p = 0.047), не существенные для сравнения CS-плацебо (p = 0.130) и не существенные для CS-Целекоксиб сравнения (p = 0.611).
Значительные результаты были замечены при определении ответчиков пациентов с по крайней мере 40% или 50% улучшения в боль или LI баллы, и когда пациенты были классифицированы согласно OMERACT-OARSI (сценарий F). CS и Целекоксиб предоставило значительно большее количество респондентов, чем плацебо и никакой разницы было отмечено CS и целекоксиб (Таблица 3).
Таблица 3
OMERACT-OARSI и MCII
Рисунок 3
Индекс Lequesne (LI).
После 6 месяцев большая часть больных достиг MCII (20 мм VAS сокращения) в CS (68%) и Целекоксиб групп (69%), чем в группе плацебо (61%). Это различие не было значимым для сравнения CS-плацебо (p = 0.122), для сравнения Целекоксиб – плацебо (p = 0.098) и не существенные для CS-Целекоксиб сравнения (p = 0,914). Аналогичные результаты были получены для доли больных, достигнув PASS в CS (57%), целекоксиб (59%) и плацебо (49%). PASS данных были значимыми для сравнения Целекоксиб – плацебо (p = 0.047), не существенные для сравнения CS-плацебо (p = 0.130) и не существенные для CS-Целекоксиб сравнения (p = 0.611).
Значительные результаты были замечены при определении ответчиков пациентов с по крайней мере 40% или 50% улучшения в боль или LI баллы, и когда пациенты были классифицированы согласно OMERACT-OARSI (сценарий F). CS и Целекоксиб предоставило значительно большее количество респондентов, чем плацебо и никакой разницы было отмечено CS и целекоксиб (Таблица 3).
Таблица 3
OMERACT-OARSI и MCII



