Клинические и эпидемиологические исследования
Расширенный отчет
Patient characteristics influence the choice of biological drug in RA, and will make non-TNFi biologics appear more harmful than TNFi biologics
Опубликовано декабрь 2017.
Авторы
Thomas Frisell1, Eva Baecklund2, Karin Bengtsson3, Daniela Di Giuseppe1, Helena Forsblad-d’Elia4, Johan Askling1,5 on behalf of the ARTIS Study group
Медицинские учреждения:
1.Clinical Epidemiology Unit, Department of Medicine Solna, Karolinska Institutet, Stockholm, Sweden
2.Rheumatology Unit, Department of Medical Sciences, Uppsala University, Uppsala, Sweden
3.Department of Rheumatology and Inflammation Research, Institute of Medicine, Sahlgrenska Academy at University of Gothenburg, Göteborg, Sweden
4.Department of Public Health and Clinical Medicine, Rheumatology, Umeå University, Umeå, Sweden
5.Department of Rheumatology, Karolinska University Hospital, Stockholm, Sweden
Для связи
Dr Thomas Frisell, Clinical Epidemiology Unit, Department of Medicine Solna, Karolinska Institutet, Stockholm 17176, Sweden; thomas.frisell@ki.se
Аннотация
Цели В связи с широким спектром биологических Болезнь модифицирующие противоревматические препаратов (bDMARDs) для лечения ревматоидного артрита (РА) и ограниченные доказательства для руководства по их выбору для отдельных пациентов, мы хотели бы оценить влияет ли характеристики пациента на выбор bDMARD в клинической практике и дать количественную оценку степени субьективности через прямые сопоставления результатов лечения.
Методы На основе регистров исследование всех шведских пациентов с РА, инициирование ингибитора фактора некроза (TNFi), Ритуксимаб, abatacept или tocilizumab в 2011 – 2015 годы как их первый bDMARD (n = 6481), или после переключения на TNFi как первый bDMARD (n = 2829). Группа различия в демографии, клинические характеристики и медицинской истории были оценены в многих переменных регрессионной модели. Прогнозируемые различия в безопасности и результаты лечения были рассчитаны как функция характеристик пациента, через регрессионного моделирования на основе наблюдаемых результатов среди пациентов с РА, начиная bDMARDs 2006 – 2010 годы.
Результаты Пациенты, начинавшие лечение не TNFi были старше, чем те, начиная TNFi, имели более низкий социально-экономический статус, более высокую активность заболевания и выше бремя заболеваний, включая злокачественности, серьезной инфекции и диабет. Различия были наиболее заметны при первом начале bDMARD. Эти факторы были связаны с исходами лечения независимо от терапии, уступая хуже очевидной безопасность и эффективность для не TNFi биопрепаратов, самых экстремальных для ритуксимаба. Стандартизация возраст/пол распределения TNFi группы значительно сократили различия.
Выводы Существовал значительное направление более старых и менее здоровых пациентов с РА для не TNFi bDMARDs, в частности, как первый bDMARD. Неясно, представляет ли этот отбор соотношении максимальная выгоды и риска. Если не учитываются различия в возрасте, истории болезни и активности болезни, они будут существенно опровергать не рандомизированные сравнительные исследования безопасности и эффективности имеющихся bDMARDs.
История вопроса (Введение)
После быстрое развитие за последние два десятилетия широкий спектр биологических Болезнь модифицирующие противоревматические препараты (bDMARDs) в настоящее время доступны для лечения ревматоидного артрита (РА). Во многих странах, включая Швеции, принципы лечения РА расширили рекомендованные параметры для первого bDMARD в последние годы, от препаратов исключительно ингибиторы (TNFi) фактор некроза для того, чтобы включить abatacept, tocilizumab и ритуксимаб, ранжируя препараты как сопоставимых по общей безопасность и эффективность. По историческим причинам, TNFi препараты остаются наиболее распространенными выбор в качестве первого bDMARD, но многие пациенты будут переключаться от их первоначального bDMARD, и похоже на первый взгляд, выбор следующего bDMARD (например, переход к другой TNFi или другой режим действий) редко строго регулируется. В клинической практике воспринимается или установленных различий между вариантами bDMARD приводят к неслучайному назначению лечения. Хотя многие клиницисты могут быть осведомлены о существовании такого выбора, его значимость (т.е., какие различные результаты лечения он будет вызывать) редко количественных, но необходимым для правильной оценки относительной эффективность и безопасность препаратов.
Во всех ситуациях с элементом предпочтений руководствуясь выбор терапии важно для мониторирования, какие пациенты получает какие терапии для по крайней мере по двум причинам. Во-первых, если врачей показывает предпочтение для конкретных препаратов для некоторых пациентов, должны быть приоритетные исследования чтобы сказать, это мотивировано повышением переносимости и эффективности в этой группе, или просто заблуждение о эффектах (побочных) лекарств, что потенциально ведет к несправедливости в терапии. Во-вторых, неслучайный выбор терапии будет препятствовать исследования РА терапии путем навязывания, смешанным с указанием, которое происходит, когда факторы, связанные с выбором терапии являются предикторами изучаемых результатов и как правило, это считается основным ограничением не рандомизированные сравнения терапии. В случае bDMARDs в РА иллюстрирует обе эти потребности.
Таким образом преследует цель этого документа. Во-первых, для описания базовых характеристик пациента при инициации различных bDMARDs в двух клинически различных и общих временных точек: (1) в первом bDMARD инициации, (2) на переключиться на второй bDMARD после использования TNFi как первого bDMARD. Во-вторых, для оценки наблюдаемых группировок отбора с возможностью опровергнуть сравнительные исследования безопасности и эффективности в РА.
Методы
Данные о клинические характеристики, демография и медицинской истории среди всех пациентов с РА в Швеции, кто инициировал первый или второй bDMARD терапии в 2011 – 2015 годы были определены путем связывания шведской ревматологии качества регистра Swedish Rheumatology Quality register (SRQ) с общенациональной Шведские здравоохранения регистра .
Источники данных
База данных, используемая для этого исследования была описана ранее. Вкратце SRQ является клинической регистр с продольным сбором данных о активности заболеваний и лечения при каждом посещении ревматологии, с национальным охватом для лечения bDMARD в РА 95%. Национальный регистр пациентов National Patient Register учитывает весь набор диагнозов в стационаре и не -первичных амбулаторных посещений; проверки медицинских записей показала для диагнозов в стационарной помощи высокую положительную прогностичность (85 – 95%). Регистр назначенных лекарств Prescribed Drug Register учитывает все отпущенные прописанные ЛС в Швеции начиная с июля 2005 года; Регистр имеет практически полный охват.
Шведском регистре рака The Swedish Cancer Register содержит клинические данные о всех раков с 1958 года; оцениваемое покрытие превышает 95%. Регистр по инфекционным заболеваниям Registers on communicable diseases, предоставляемых данные об подтвержденном туберкулезе, гепатита B и C. Общественно-экономической данные были доступны через регистры переписи.
Случайные величины (Ковариаты)
Мы рассмотрели исчерпывающий перечень базовых характеристик для захвата факторы, которые мы априори считаются может повлиять на выбор терапии, безопасности или исход лечения. Фон социодемографических переменных, включенных (высшее образование, страна рождения), РА конкретных клинических характеристик (ревматоидный фактор (РФ), продолжительность болезни, вопросник по оценке здоровья – индекса инвалидности (HAQ-DI), оценка активности болезни- 28 суставов (DAS28) с компонентами, визуальный аналог шкала (VAS) боли), лечение с нестероидные противовоспалительные препараты (НПВП), глюкокортикоидами, обычных синтетических DMARDs и медицинский анамнез. Активность заболевания и текущий терапии был извлечен при обращении в SRQ допустимые данные на каждую переменную ближе к началу лечения (в течение −90 + 14 дней, для увеличить доступность данных, избегая значения, от влияния эффекта лечения). Медицинские анамнез оценивался по диагнозам, которые был диагностирован с любой из ряда конкретных условий (определения в онлайн Дополнительная таблица s1), в течение 5 лет до начала лечения, за исключением серьезных инфекций (определяемой как «последние» в течение 1 года и «не последние» в течение 1-5 лет) и злокачественные опухоли («последние» в течение 5 лет и «не последние» более чем 5 лет ранее). Анализ индивидуальных характеристик проводился по комбинированной шкале сопутствующих(коморбидных) заболевания, поскольку последний будет маскировать ассоциации конкретных заболеваний и увеличить риск для остаточного искажения. Мы использовали три непрерывные показателя, предназначенные для оценки общего здоровья пациентов: (1) количество дней в больнице, (2) дней потеряли работу из-за болезни или инвалидности (только для лиц в возрасте 25-65 лет) и (3) общие медицинские расходы. Расходы на здравоохранение были рассчитаны путем суммирования расходов на лекарства и визиты в стационаре и не-первичных амбулаторных, по группам связанных заболеваний по ежегодным национальным тарифы, с коррекцией инфляция до 2012.
Дополнительный файл 1
Статистика
Чтобы оценить различия в характеристиках пациентов через биопрепараты, мы представлены средства и пропорции базового ковариат, с скорректированным различия для каждого TNFi bDMARD, по сравнению с TNFi, смоделированные в многомерный регрессионный анализ моделей с начальной CIs. Основная модель была скорректирована по полу, возрасту и географического региона, и дополнительные модели дополнительно скорректированы для страны рождения, образование уровня, РФ, болезнь продолжительность, СОЭ (ESR), DAS28 калькулятора с C – реактивный белок (DAS28-СРБ), недавние инфекции, последние злокачественности, операции на суставах, хронического заболевания легких, острый коронарный синдром. Выбор ковариат в модели 2 был основан на наблюдаемых различий и доступности данных.
Терапия после перехода от TNFi был определен как первый терапии bDMARD начатая в течение 1 года прекращения первоначальной TNFi как первый какого-либо bDMARD. Основные анализа сосредоточены на разнице между abatacept, Ритуксимаб, tocilizumab и класс TNFi (adalimumab, certolizumab pegol, этанерцепт, инфликсимаб и golimumab). Дополнительные анализы сравнение отдельных TNFi лекарств.
Ожидаемое влияние привходящих оценивали через серию моделей прогнозирования. Логистической регрессии были использованы для оценки ассоциаций пациентов характеристики и результаты лечения среди всех лиц с РА, начиная bDMARD (чтобы максимизировать размер когорты и точности, мы включили до третьего bDMARD) в период 2006 – 2010 годы (первичного для нашего исследования периода). Мы определили исходы безопасности как пропорции, которые испытывают следующие события в течение 5 лет после начала терапии: смерти (1), (2) серьезные инфекции, (3) основных острых сердечно-сосудистых событий major acute cardiovascular event (MACE), (4) не доброкачественные образования (определения в дополнительного Таблица s2). Аналогичным образом, мы определили исходы эффективности лечения как доля: (1) прекращение терапии до 1 года и (2) оставшиеся на терапию и достигнув хорошей ответа по критериям европейской лиги против ревматизма (EULAR) после 1 года. Отдельные модели были созданы для каждого результата, используя полный список ковариат. Чтобы разрешить некоторые отклонения от линейности, непрерывное переменные были введены как многочленов второй степени; только учет взаимодействие между возрастом и полом. Линия терапии был включен в переменную binary (биопрепаратов против наивные или нет). Потеря работы был исключен из модели построения, так как оно ограничено для лиц трудоспособного возраста. Коэффициенты от окончательной модели были использованы для расчета прогнозируемых вероятность каждого исхода, лечение, в нашей главной когорты. Поскольку конкретные bDMARDs не были включены в моделях прогнозирования, они предсказывали, что вероятности будут отражать пропорции, ожидать только от базовых характеристик, в среднем во всех bDMARDs. Для дальнейшей оценки, сколько предсказал разницы между лечениями будут удалены регулировки для возраста и пола, а не других характеристик пациента (например, история болезни), мы стандартизированного каждой группе лечения на возраст (в 10-летний категории) и распределение по полу в самую большую группу (TNFi как первый bDMARD).
Линейная регрессия с начальной СНГ было сделано с использованием пакета загрузки в R V.3.3.1. SAS V.9.4 был использован для всех других анализов.
Результаты
Характеристики пациентов старта первого bDMARD
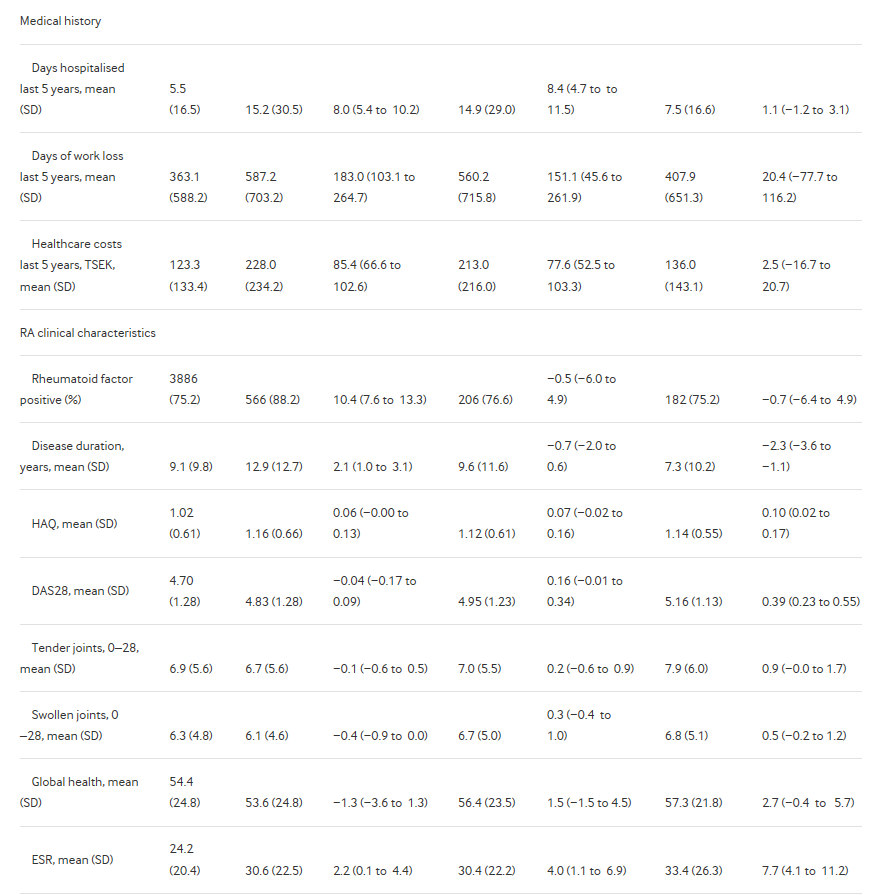
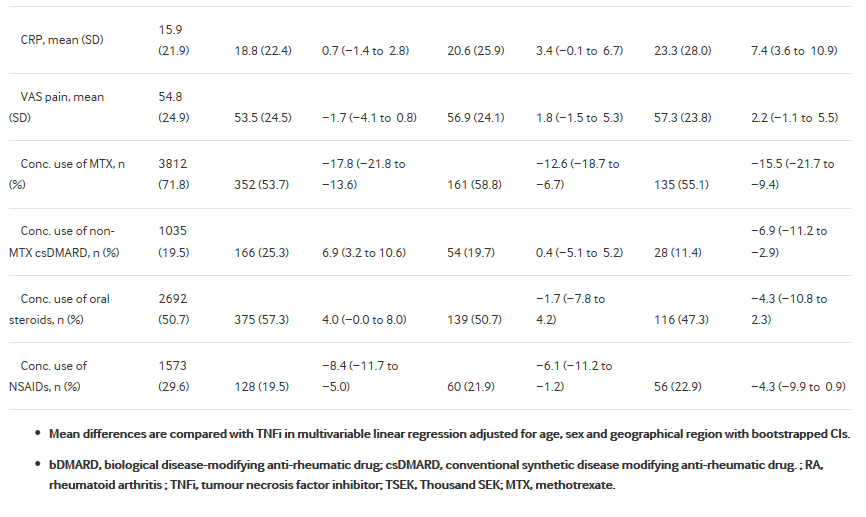
Мы определили 6481 пациентов с РА, начиная с первого bDMARD между 1 января 2011 и 31 декабря 2015 года. Большинство начали TNFi (n = 5307, 82%), с TNFi все имеющиеся в общем пользовании, начиная от этанерцепт (n = 1502, 28% всех TNFi) до golimumab (n = 745, 14%). Наиболее распространенными не TNFi был Ритуксимаб (n = 655, 10% всех первых bDMARD). Демографических и клинических характеристик приводятся в таблице 1. Начавшие с не -TNFi терапии были старше и менее хорошо образованными, чем те, кто начиная TNFi, с большой разницей для ритуксимаба. По сравнению с теми, кто, начиная TNFi, Ритуксимаб инициаторов также чаще были серопозитивными, имели длительность болезни и несколько более высокий ESR. Abatacept инициаторами были аналогичны группе TNFi, но высокий ESR. Tocilizumab инициаторами были наиболее экстремальные с точки зрения активности болезни, с значительно более высокий ESR и СРБ и пограничное выше счета болезненных суставов и HAQ. Инициаторы не TNFis реже использовали сопутствующий метотрексата.
Таблица 1
Пациент характеристики в начале терапии bDMARD, среди всех бионаивных ( bionaïve) шведских пациентов с РА, 2011 – 2015 гг.

|
TNFi |
Ритуксимаб |
Среднее различие по сравнению с TNFi (95% CI) |
Abatacept |
Среднее различие по сравнению с TNFi (95% CI) |
Tocilizumab |
Среднее различие по сравнению с TNFi (95% CI) |
| Пациенты, n |
5307 |
655 |
|
274 |
|
245 |
|
| Демография |
| Возраст, означает (SD) |
55.2 (14,1) |
65.1 (12,5) |
10.0 (9.0 для 11.1) |
61,4 (13,3) |
6.2 (4,7 до 7,8) |
58,5 (13,7) |
3.3 (1,7-5,1) |
| Женщины, n (%) |
3929 (74.0) |
471 (71,9) |
1.3 (−2.4 5.3) |
202 (73,7) |
1.7 (−3.4 до 7,2) |
190 (77,6) |
4.5 (−0.7 до 10,1) |
| Высшее образование, n (%) |
| 9 лет или менее |
908 (21,2) |
165 (33,0) |
5,7 (1.6 до 10,1) |
60 (29,0) |
4.2 (1,5 до 10,3) |
44 (25,1) |
2.0 (−4.8-8.5) |
| 10-12 лет |
2091 (48,9) |
219 (43,8) |
−2.6 (−7.4 до 1.9) |
102 (49,3) |
1.2 (−5.5 8.2) |
87 (49,7) |
2.0 (−5.5 до 9,9) |
| > 12 лет |
1279 (29.9) |
116 (23,2) |
−3.1 (−7.1 до 0,9) |
45 (21,7) |
−5.4 (−11.1 до 0,3) |
44 (25,1) |
−4.0 (−10.6 до 2.7) |
| Страна рождения, n (%) |
| Швеция |
485 (9.1) |
82 (12,5) |
−6.9 (−10.1 −3.3) |
21 (7,7) |
−1.6 (−5.8 до 2.7) |
27 (11,0) |
−1.6 (−6.3 до 3.1) |
| Скандинавия |
267 (5.0) |
54 (8.2) |
1.6 (−0.6 до 3.9) |
19 (6,9) |
1.1 (−2.2 до 4.1) |
13 (5.3) |
−0.3 (−3.3 2.4) |
| Другие |
4555 (85,8) |
519 (79,2) |
5.3 (2,5 до 7,8) |
234 (85.4) |
0,5 (−2.9 до 3.5) |
205 (83,7) |
1.9 (−2.3 до 5,7) |
| История болезни |
| Дни госпитализированных последние 5 лет, означает (SD) |
5.5 (16,5) |
15.2 (30,5) |
8.0 (5,4 до 10.2) |
14,9 (29,0) |
8.4 (4,7 до до 11,5) |
7.5 (16,6) |
1.1 (−1.2 до 3.1) |
| Дни потери работы последние 5 лет, означает (SD) |
363.1 (588.2) |
587.2 (703.2) |
183.0 (103,1 264.7) |
560.2 (715,8) |
151.1 (45,6 261.9) |
407,9 (651,3) |
20.4 (−77.7 до 116,2) |
| Расходы на здравоохранение последние 5 лет, TSEK, означает (SD) |
123.3 (133,4) |
228.0 (234.2) |
85.4 (66,6 102,6) |
213.0 (216.0) |
77,6 (52,5 на 103,3) |
136.0 (143.1) |
2.5 (−16.7 до 20,7) |
| Клинические характеристики РА |
| Положительный ревматоидный фактор (%) |
3886 (75.2) |
566 (88,2) |
10.4 (7,6 до 13,3) |
206 (76,6) |
0.5 (−6.0 до 4,9) |
182 (75.2) |
−0.7 (−6.4 до 4,9) |
| Продолжительность болезни, лет, означает (SD) |
9.1 (9,8) |
12,9 (12,7) |
2.1 (1.0 до 3.1) |
9.6 (11,6) |
−0.7 (−2.0 до 0,6) |
7.3 (10.2) |
−2.3 (−3.6 −1.1) |
| HAG, (SD) |
1.02 (0,61) |
1.16 (0,66) |
0,06 (−0.00 до 0,13) |
1.12 (0,61) |
0,07 (−0.02 до 0,16) |
1.14 (0.55) |
0,10 (0.02 до 0,17) |
| DAS28, |
4.70 (1,28) |
4.83 (1,28) |
−0.04 (−0.17 до 0,09) |
4.95 (1.23) |
0.16 (−0.01 до 0,34) |
5.16 (1.13) |
0.39 (0,23 до 0,55) |
| Болезненные суставы,0-28, mean (SD) |
6.9 (5,6) |
6.7 (5,6) |
−0.1 (−0.6 до 0.5) |
7.0 (5.5) |
0,2 (−0.6 до 0,9) |
7.9 (6.0) |
0.9 (−0.0 до 1.7) |
| Опухшие суставы,)0-28, mean (SD) |
6.3 (4,8) |
6.1 (4,6) |
−0.4 (-0.9 до 0.0) |
6.7 (5.0) |
0.3 (−0.4 1.0) |
6.8 (5.1) |
0,5 (−0.2 до 1,2) |
| Глобальная оценка здоровья, mean (SD) |
54,4 (24,8) |
53.6 (24,8) |
−1.3 (−3.6 до 1.3) |
56,4 (23,5) |
1.5 (1,5 до 4.5) |
57.3 (21,8) |
2.7 (−0.4 до 5,7) |
| СОЭ, mean (SD) |
24.2 (20,4) |
30,6 (22,5) |
2.2 (0.1 до 4.4) |
30,4 (22,2) |
4.0 (1.1-6.9) |
33,4 (26,3) |
7.7 (4.1 11.2) |
| CRP, mean (SD) |
15,9 (21,9) |
18,8 (22,4) |
0,7 (−1.4 до 2,8) |
20,6 (25,9) |
3.4 (−0.1 до 6,7) |
23.3 (28,0) |
7.4 (3.6-10.9) |
| ВАШ, mean (SD) |
54,8 (24,9) |
53,5 (24,5) |
−1.7 (−4.1 до 0,8) |
56,9 (24,1) |
1.8 (1,5 до 5.3) |
57.3 (23,8) |
2.2 (−1.1-5.5) |
| Высокодозированное использование MTX, n (%) |
3812 (71,8) |
352 (53,7) |
−17.8 (−21.8 −13.6) |
161 (58,8) |
−12.6 (−18.7 −6.7) |
135 (55.1) |
−15.5 (−21.7 −9.4) |
| Высоколозированноеиспользование не MTX csDMARD, n (%) |
1035 (19,5) |
166 (25,3) |
6.9 (3.2 до 10,6) |
54 (19,7) |
0,4 (−5.1 5.2) |
28 (11,4) |
−6.9 (−11.2 −2.9) |
| Высококодорированное использование оральных стероидов, n (%) |
2692 (50,7) |
375 (57,3) |
4.0 (−0.0 до 8.0) |
139 (50,7) |
−1.7 (−7.8 до 4.2) |
116 (47,3) |
−4.3 (−10.8 до 2.3) |
| Высокодозированное использование НПВП, n (%) |
1573 (29,6) |
128 (19,5) |
−8.4 (−11.7 −5.0) |
60 (21,9) |
−6.1 (−11.2 −1.2) |
56 (22,9) |
−4.3 (−9.9 до 0,9) |
Средняя различия сравниваются с TNFi в многомерный регрессионный анализ с учетом возраста, пола и географического региона с начальной СНГ.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; csDMARD, обычных синтетических болезни модифицирущие противоревматические препарат. ; РА, ревматоидный артрит; TNFi, ингибитор фактор некроза опухоли; TSEK Thousand SEK, тысяч SEK; MTX, метотрексат.
Существенные различия в базовых медицинской истории, с теми, кто, начиная ритуксимаба или abatacept, чаще всего имея историю анализируемых заболеваний, и потребляется больше ресурсов здравоохранения до начала лечения (Таблица 1 и Рисунок 1). Регулировка для возраста, пола и географического региона снизился эти различия, но оставалось большинство ассоциаций. То же самое было не имелось у tocilizumab, где базовой медицинской истории был больше похож на группе TNFi. Особо следует отметить, Ритуксимаб имел более высокую долю с недавно (в течение 5 лет) или не недавние (более 5 лет перед) злокачественности в начале лечения (8,1% с недавних злокачественности, по сравнению с 1,4% на TNFi) (рис. 1). Из-за низкого числа, не удалось оценить разницу в истории туберкулёза (n = 9 пациентов был туберкулез перед началом первого bDMARD), гепатит B (n <5), гепатит С (n = 6) или рассеянный склероз/демиелинизирующих события (n = 14). Для краткости этих условий и других воспалительных заболеваний представлены в онлайн Дополнительная таблица s3-s5.
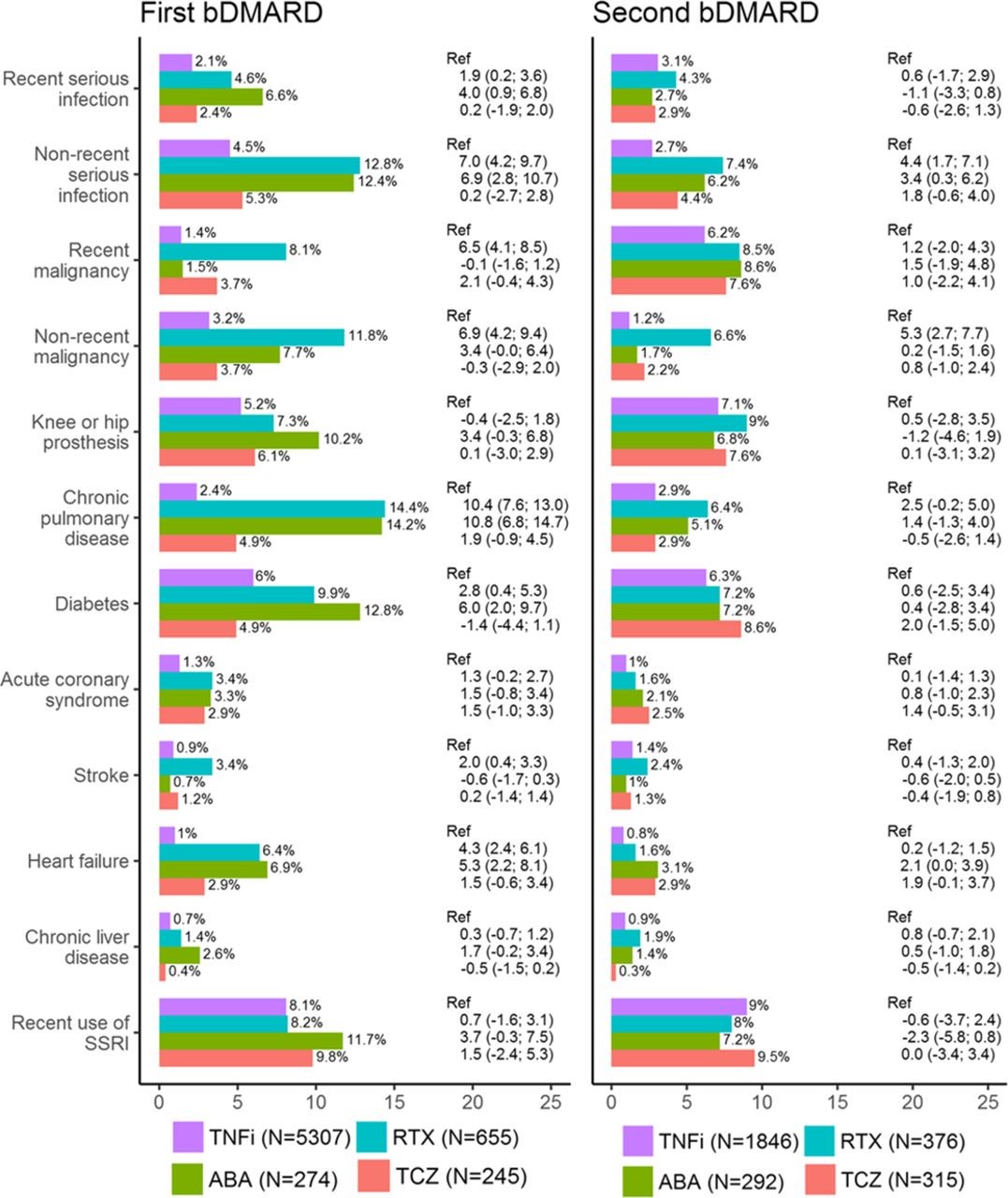 Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Рисунок 1
История болезни при лечении начало терапии bDMARD среди всех пациентов с ревматоидным артритом в SRQ, 2011 – 2015 гг. Различия в соотношении (с 95% CIs) со ссылкой на TNFi и скорректирована с учетом возраста, пола и географического региона.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; SRQ, Шведская ревматологии качества регистра; SSRI selective serotonin reuptake inhibitor, селективный ингибитор обратного захвата серотонина; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности, дальнейшие корректировки для демографии, активность заболевания и медицинской истории не существенно изменяет наблюдаемый характер различия в базовых характеристиках (онлайн Дополнительная таблица s3). Сравнение отдельных TNFis показали несколько отметить различия (онлайн Дополнительная таблица s4), но при начале инфликсимаба пациенты были немного старше и был немного выше активность заболевания по сравнению с другими, а те кто, начиная этанерцепт более часто были женщины и имели более высокие расходы на здравоохранение.
Характеристики пациентов при переходе с первого TNFi
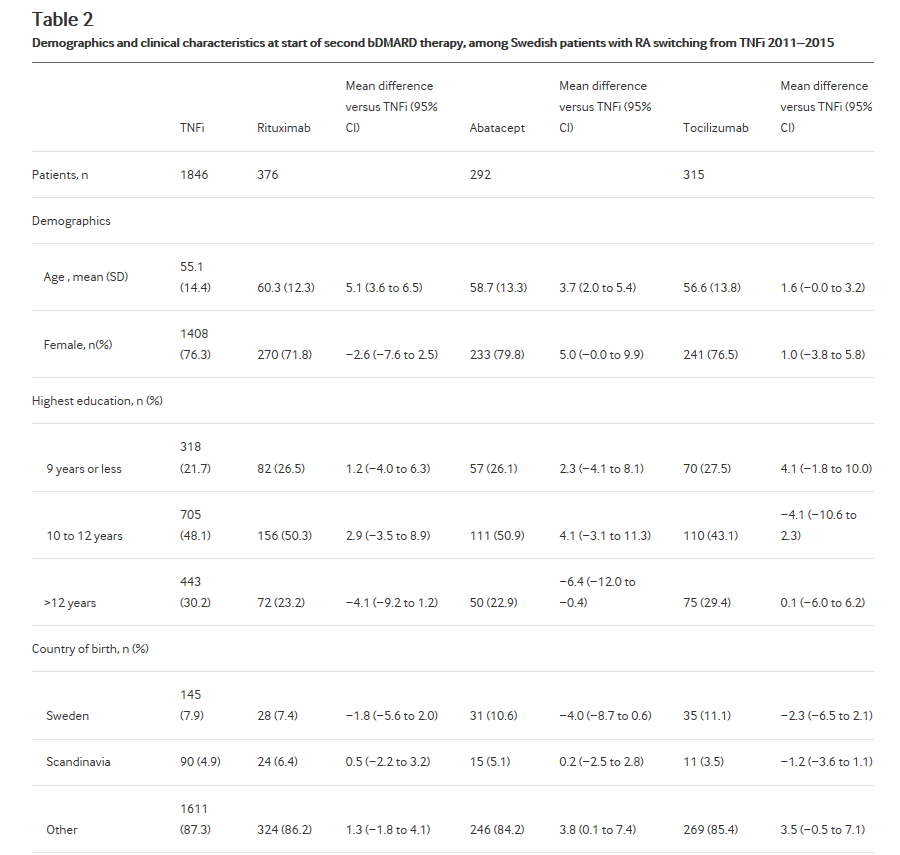
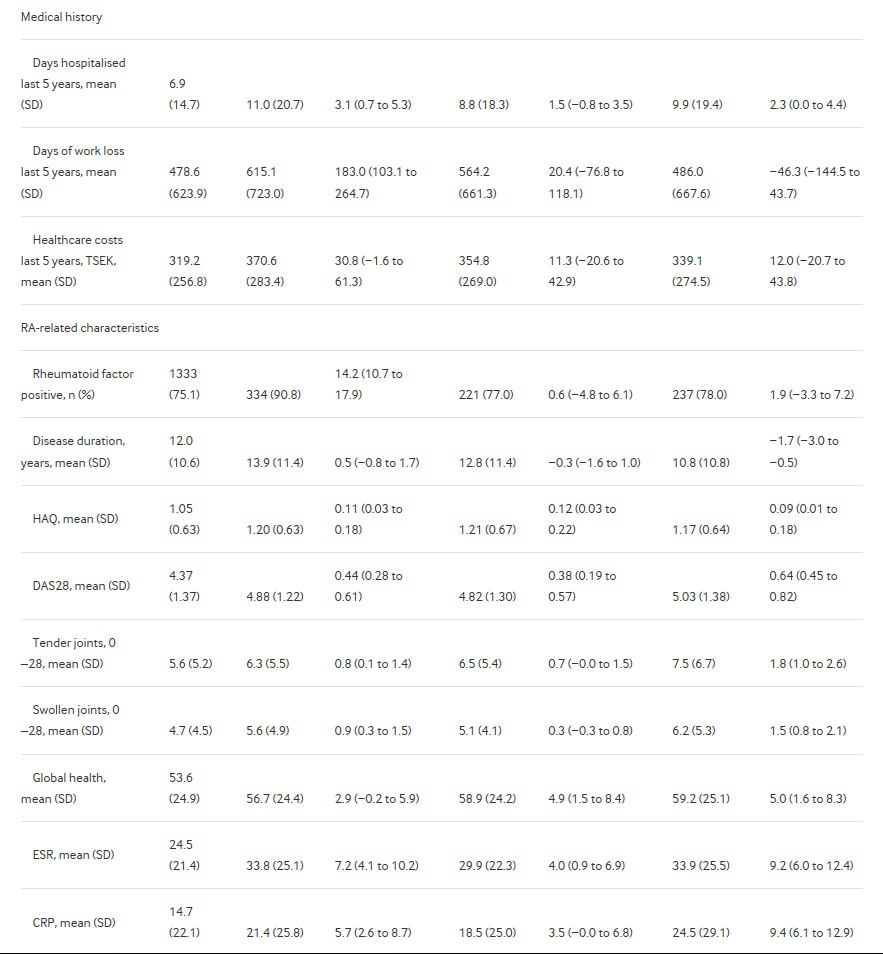
Мы определили 2829 пациентов с РА, который инициировал второй когда-либо bDMARD в течение 1 года отмены первого TNFi. (Для сравнения, за тот же период, 1144 пациентов прекращено первый TNFi без начала bDMARD в течение 1 года). Это было общим для начала второй TNFi (n = 1846, 65%), вне зависимости от указанных причина прерывания первый TNFi. Когорта переключения был более однородной, чем первый bDMARD когорта, с общей меньшие различия между терапии (Таблица 2 и Диаграмма 1). Пациентов, начиная ритуксимаба и abatacept были старше, чем те, начиная с TNFi и более высокую долю с недавних серьезных инфекций. Те, начиная ритуксимаба имели более высокую долю с недавних злокачественности и с серопозитивным РА. В отличие от направления на первый bDMARD, все не- TNFi группы имели более высокую активность заболевания при переключении, чем в TNFi. Tocilizumab был более распространено среди тех, кто прекращено первый TNFi из-за отсутствия эффекта; abatacept был более распространено среди тех прекращенные вследствие неблагоприятных событий.
Таблица 2
Демография и клинических характеристик на начало второго bDMARD терапии, среди шведских пациентов с РА, переход от TNFi 2011-2015

|
TNFi |
Ритуксимаб |
Среднее различие по сравнению с TNFi (95% CI) |
Abatacept |
Среднее различие по сравнению с TNFi (95% CI) |
Tocilizumab |
Среднее различие по сравнению с TNFi (95% CI) |
| Пациенты, n |
1846 |
376 |
|
292 |
|
315 |
|
| Демография |
| Возраст, означает (SD) |
55.1 (14,4) |
60,3 (12,3) |
5.1 (3,6 до 6,5) |
58,7 (13,3) |
3.7 (2.0 до 5.4) |
56,6 (13,8) |
1.6 (−0.0 3.2) |
| Женщины, n(%) |
1408 (76,3) |
270 (71,8) |
−2.6 (−7.6 до 2.5) |
233 (79,8) |
5.0 (−0.0 до 9,9) |
241 (76,5) |
1.0 (−3.8 до 5,8) |
| Высшее образование, n (%) |
| 9 лет или менее |
318 (21,7) |
82 (26,5) |
1.2 (−4.0 до 6.3) |
57 (26,1) |
2.3 (−4.1 до 8.1) |
70 (27,5) |
4.1 (−1.8 10.0) |
| 10-12 лет |
705 (48,1) |
156 (50,3) |
2.9 (−3.5 до 8,9) |
111 (50.9) |
4.1 (−3.1 до 11,3) |
110 (43,1) |
−4.1 (−10.6 до 2.3) |
| > 12 лет |
443 (30.2) |
72 (23,2) |
−4.1 (−9.2 до 1,2) |
50 (22,9) |
−6.4 (−12.0 −0.4) |
75 (29,4) |
0.1 (−6.0 6.2) |
| Страна рождения, n (%) |
| Швеция |
145 (7,9) |
28 (7,4) |
−1.8 (−5.6 2.0) |
31 (10,6) |
−4.0 (−8.7 до 0,6) |
35 (11,1) |
−2.3 (−6.5 до 2.1) |
| Скандинавия |
90 (4.9) |
24 (6,4) |
0,5 (−2.2 3.2) |
15 (5.1) |
0,2 (−2.5 до 2,8) |
11 (3.5) |
−1.2 (−3.6 1.1) |
| Другие |
1611 (87,3) |
324 (86,2) |
1.3 (−1.8 4.1) |
246 (84,2) |
3.8 (0.1-7,4) |
269 (85.4) |
3.5 (0.5 до 7.1) |
| История болезни |
| Дни госпитализированных последние 5 лет, означает (SD) |
6.9 (14,7) |
11.0 (20,7) |
3.1 (0,7 до 5.3) |
8.8 (18,3) |
1.5 (−0.8 до 3.5) |
9.9 (19,4) |
2.3 (0.0 до 4.4) |
| Дни потери работы последние 5 лет, означает (SD) |
478.6 (623.9) |
615.1 (723.0) |
183.0 (103,1 264.7) |
564.2 (661,3) |
20.4 (−76.8 до 118.1) |
486.0 (667.6) |
−46.3 (−144.5 до 43,7) |
| Расходы на здравоохранение последние 5 лет, TSEK, означает (SD) |
319.2 (256,8) |
370.6 (283.4) |
30,8 (−1.6 на 61,3) |
354.8 (269.0) |
11.3 (−20.6 до 42,9) |
339,1 (274,5) |
12,0 (−20.7 до 43,8) |
| Характеристики, связанные с РА |
| Ревматоидный фактор положительный, n (%) |
1333 (75,1) |
334 (90,8) |
14.2 (10,7 на 17,9) |
221 (77,0) |
0,6 (−4.8 6.1) |
237 (78,0) |
1.9 (−3.3 до 7,2) |
| Продолжительность болезни, лет, означает (SD) |
12,0 (10,6) |
13.9 (11,4) |
0,5 (−0.8 до 1.7) |
12,8 (11,4) |
−0.3 (−1.6 1.0) |
10.8 (10,8) |
−1.7 (−3.0 до 0.5) |
| HAQ, означает (SD) |
1.05 (0,63) |
1.20 (0,63) |
0,11 (0,03 до 0,18) |
1.21 (0,67) |
0.12 (0,03 до 0,22) |
1.17 (0.64) |
0,09 (0.01 до 0,18) |
| DAS28, значит (SD) |
4.37 (1.37) |
4.88 (1,22) |
0.44 (0.28 до 0,61) |
4.82 (1.30) |
0,38 (0,19 до 0,57) |
5.03 (1.38) |
0.64 (0,45 до 0,82) |
| Болезненность суставов, 0 – 28, означает (SD) |
5.6 (5.2) |
6.3 (5.5) |
0,8 (0.1-1.4) |
6.5 (5.4) |
0,7 (−0.0 до 1,5) |
7.5 (6,7) |
1.8 (1,0-2,6) |
| Припухшие суставы, 0 – 28, означает (SD) |
4.7 (4.5) |
5.6 (4.9) |
0.9 (от 0,3 до 1,5) |
5.1 (4.1) |
0.3 (−0.3 до 0,8) |
6.2 (5.3) |
1.5 (0,8 до 2.1) |
| Глобального оценка здоровья, означает (SD) |
53.6 (24,9) |
56,7 (24,4) |
2.9 (−0.2 до 5.9) |
58,9 (24,2) |
4.9 (1,5-8.4) |
59,2 (25.1) |
5.0 (1.6 до 8,3) |
| СОЭ, означает (SD) |
24.5 (21,4) |
33,8 (25.1) |
7.2 (4.1 до 10.2) |
29.9 (22,3) |
4.0 (0,9 до 6,9) |
33,9 (25,5) |
9.2 (6.0 до 12,4) |
| CRP, означает (SD) |
14.7 (22,1) |
21.4 (25,8) |
5,7 (2.6-8,7) |
18,5 (25.0) |
3.5 (−0.0 6.8) |
24.5 (29,1) |
9.4 (6.1 до 12,9) |
| ВАШ боль, значит (SD) |
53,8 (25,4) |
56,1 (25,3) |
2.1 (−1.2 5.2) |
59.3 (24,1) |
4.9 (1,5 до 8,3) |
59,8 (25.0) |
5.3 (от 1,8 до 8,5) |
| Высокодозовое использование MTX, n (%) |
1343 (72,8) |
292 (77,7) |
4.9 (0,4 до 9,6) |
220 (75.3) |
4.1 (−1.2 до 9,8) |
232 (73,7) |
1.2 (−4.1 до 6.5) |
| Высокодозовое использование не MTX csDMARD, n (%) |
409 (22,2) |
90 (23,9) |
2.0 (−2.9 до 6.3) |
58 (19,9) |
−1.8 (−7.0 до 3,3) |
51 (16,2) |
−5.5 (−10.1 −0.8) |
| Высокодозовое использование оральных стероидов, n (%) |
1106 (59,9) |
252 (67.0) |
7.4 (2,2 до 12,4) |
207 (70,9) |
10.5 (4,7 до 16,5) |
207 (65,7) |
7.0 (1.0 до 12,9) |
| Высокодозовоеиспользование НПВП, n (%) |
852 (46,2) |
166 (44,1) |
−0.1 (−5.7 до 5.4) |
115 (39,4) |
−4.6 (−10.9 до 1.4) |
145 (46.0) |
0,6 (−5.2 до 6.3) |
| Причина переключения, n (%) |
| Неблагоприятные явления |
374 (20,6) |
72 (19,5) |
1,5 (−6.0 до 3.0) |
67 (23,8) |
3.1 (−2.3 8.3) |
49 (15,8) |
−5.8 (−10.6 −1.4) |
| Отсутствие эффекта |
1170 (64,4) |
235 (63,7) |
−0.1 (−5.7 до 5.4) |
165 (58,7) |
−6.4 (−12.9 до 0,3) |
235 (75,6) |
10.9 (5,4 до 16,3) |
| Другие |
272 (15,0) |
62 (16,8) |
1.6 (−2.9 до 5,7) |
49 (17,4) |
3.4 (−1.6 до 8.1) |
27 (8,7) |
−5.1 (−8.6 −1.7) |
Средняя различия сравниваются с TNFi в многомерный регрессионный анализ с учетом возраста, пола и географического региона с начальной CIs.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; РА, ревматоидный артрит; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности конкретных TNFis отдельные препараты в целом были очень похожи, хотя некоторые различия достигнуто номинальное значение (онлайн Дополнительная таблица s5). Инфликсимаб инициаторами были ниже среднего образования (38% имели 9 лет или менее, против 20% в других группах), больше работыпотери и меньше псориаз/псориатический артрит (PsA). Существует также значительная разница в доли женщин, начиная от 69% на инфликсимаб до 81% для golimumab. Тех, кто начинает этанерцепт накопилась более низких затрат на здравоохранение.
Ожидаемые различия в безопасности и эффективности благодаря смешанным указаниям
Моделирование с помощью зарегистрированных исходы пациентов, начиная bDMARDs в 2006 – 2010 что несколько факторов, связанных с выбором терапии также были достоверными предикторами решений безопасности и лечения (ассоциации в онлайн дополнительных s6 таблица). Возраст и пол были сильные предикторы всех результатов за исключением приема лекарств менее чем 1 год. Компоненты исходной активности болезни были предиктором всех результатов, хотя и с различной значимостью (HAQ был связан с риском MACE; DAS28 и его компонентов с достижения хороших EULAR ответ). Сопутствующей терапии на исходном уровне также предсказатель большинство результатов, например, глюкокортикоидов на исходном уровне были прогнозирования неблагоприятных событий и снизилась доля с хорошим EULAR ответ. Медицинские истории также предсказал результаты лечения, например, история инфекции или сердечно-сосудистых заболеваний предсказал будущее инфекции и сердечно-сосудистых заболеваний, в то время как история злокачественности значительно предсказал фиксацию лекарств и (слабо) новые начала злокачественности.
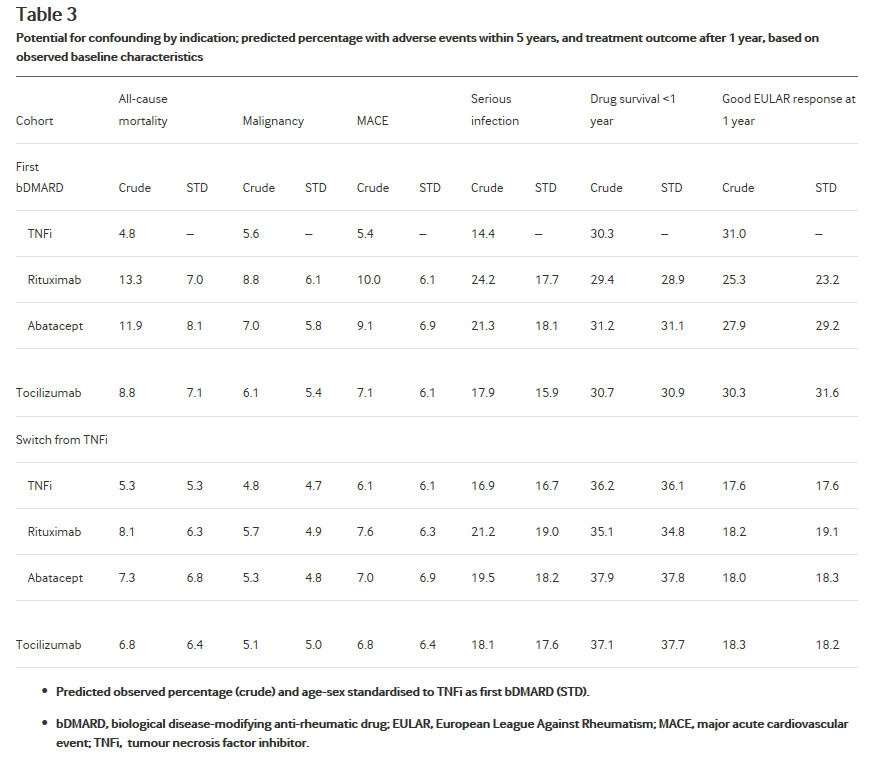
Взятые вместе, наблюдаемых базовых различия привели к существенные различия в прогнозируемый риск смертности от всех причин, MACE и серьезных инфекций; небольшие различия в риск малигнизации и достижения EULAR хороший ответ; и практически не ожидаемые различия в 1 год приема лекарств выживания (Таблица 3). В резюме сырой сравнение препаратов не TNFi с TNFi группой будет особенно предвзято против ритуксимаба и abatacept относительно безопасности и EULAR ответ. Предсказанное смещение было гораздо меньше при переходе от первого TNFi, отражающие большее сходство в группах пациентов.
Таблица 3
Вероятность запутывания по показаниям; прогнозируемый процент с неблагоприятные события в течение 5 лет и результат лечения после 1 года, на основе наблюдаемых базовых характеристик
| Когорта |
Смертность от всех причин |
Злокачественные новообразования |
МАСЕ |
Серьезная инфекция |
Лекарства выживания < 1 год |
Хороший ответ EULAR к 1 год |
| Первый bDMARD |
Crude* |
STD |
Crude |
STD |
Crude |
STD |
Crude |
STD |
Crude |
STD |
Crude |
STD |
| TNFi |
4.8 |
– |
5.6 |
– |
5.4 |
– |
14.4 |
– |
30.3 |
– |
31,0 |
– |
| Ритуксимаб |
13.3 |
7.0 |
8.8 |
6.1 |
10,0 |
6.1 |
24.2 |
17.7 |
29,4 |
28,9 |
25.3 |
23.2 |
| Abatacept |
11,9 |
8.1 |
7.0 |
5.8 |
9.1 |
6.9 |
21.3 |
18.1 |
31,2 |
31,1 |
27,9 |
29.2 |
| Tocilizumab |
8.8 |
7.1 |
6.1 |
5.4 |
7.1 |
6.1 |
17.9 |
15,9 |
30,7 |
30,9 |
30.3 |
31,6 |
| Переход от TNFi |
| TNFi |
5.3 |
5.3 |
4.8 |
4.7 |
6.1 |
6.1 |
16,9 |
16,7 |
36.2 |
36,1 |
17,6 |
17,6 |
| Ритуксимаб |
8.1 |
6.3 |
5.7 |
4.9 |
7.6 |
6.3 |
21.2 |
19,0 |
35.1 |
34,8 |
18.2 |
19,1 |
| Abatacept |
7.3 |
6.8 |
5.3 |
4.8 |
7.0 |
6.9 |
19.5 |
18.2 |
37,9 |
37,8 |
18,0 |
18.3 |
| Tocilizumab |
6.8 |
6.4 |
5.1 |
5.0 |
6.8 |
6.4 |
18.1 |
17,6 |
37,1 |
37,7 |
18.3 |
18.2 |
* Crude – необработанные данные
Предсказуемый наблюдаемый процент (Crude) и возрастно половой стандартизированных для TNFi как первый bDMARD (STD).
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; EULAR, Европейская Лига против ревматизма; MACE, major acute cardiovascular event большие острые сердечно-сосудистых события; TNFi, ингибитора фактора некроза опухоли.
Возраст и пол стандартизации значительно снижается предсказанное смещение, в частности по безопасности результатов (Таблица 3). Ожидаемые риски по-прежнему были завышены для всех безопасных результатов за исключением злокачественных опухолей, однако, и это стандартизации не уменьшить предвзятым разница в EULAR ответ, отражающий, что возраст не был сильным показателем этого результата, и что различия в пола были незначительными между препаратами.
Обсуждение
В этой большой, общенационального исследования современной шведской пациентов с РА мы нашли доказательства существенные различия в базовые характеристики среди пациентов, присвоенные различным bDMARDs. Многие предсказатели назначения лечения были также предикторами неблагоприятного лечения, и в количественной величины этой, мы показали, что прямое сравнение между терапии не даст точные оценки относительного эффекта лечения, но бы было предвзятым в пользу TNFi.
Те, не начинал со «стандартной» TNFi терапии были старше, имели более низкий социально-экономический статус и выше бремени других заболеваний. Там был похож, хотя легкие, показания на переход от первого любого TNFi, где более высокая активность заболевания РА был также прогнозировать получение не- TNFi. Хотя существуют ограниченные различия между теми, кто, начиная с индивидуальных TNFi, переход на и между не -TNFi bDMARD было существенным. Ритуксимаб инициаторы были старше, преимущественно RF-позитивных и высоким бремени других заболеваний (в частности злокачественности), а те, кто, начиная tocilizumab отличались от тех, кто начинает TNFi меньше с точки зрения медицинской истории, но имели значительно выше активность заболевания.
Эти различия частично ожидаются на основании предварительных рекомендаций в интересах выбора конкретных препарат для некоторых групп риска, где, например, американского колледжа ревматологии (ACR) руководящих принципов перечислил «очень низкий» доказательства в поддержку предпочтения Ритуксимаб над TNFi среди больных с историей злокачественности и abatacept над TNFi среди пациентов с серьезных инфекций и «умеренных до очень низкой» доказательств предпочитают не TNFi среди больных с застойной болезнь сердца. Представляется очевидным, что эти предварительные рекомендации выполнялись для некоторых, но не большинство пациентов.
Путем моделирования ожидаемый риск для нескольких результатов лечения, предоставленных наблюдаемых пациентов характеристики, мы показали, что даже если там нет истинной различия в лекарственном эффекте, смешанным с указанием будет сделать не- TNFi препараты являются менее безопасным и эффективным чем TNFi как первый bDMARD. Многие из предполагаемых различий простой регулировки для возраста и пола уменьшить это смешение резко. Остаточные сомнения, однако, ожидается дают более высокие ставки неблагоприятных событий и менее лечения ответ, таким образом, что сравнения должны быть скорректированы для медицинской истории и активности болезни, когда это возможно. Как и ожидалось, предсказал смещение был менее, при изучении тех, переходил от первоначального TNFi, отражающие уменьшение гетерогенности пациента в этой конкретной клинической ситуации.
Мы считаем, что интеллектуального моделирования подход полезен в сочетании множество наблюдаемых базовых различий в показателях сопоставимых по всей когорты, но следует отметить некоторые ограничения. Модели были основаны на исторических данных и будет неправильным, если сила ассоциации с каждым фактором риска изменился со временем календаря. Модели были также ограничены ковариатами которые мы были доступны, и нам не хватает данных о, например, индекс массы тела и курение. Если некоторые неизвестные предикторами работает в противоположном направлении, вполне вероятно, что мы недооцениваем предсказания предвзятости. Модели предсказания были предназначены как удобный способ иллюстрирующие риск смешанных по показаниям, а не как лучшая модель прогнозирования возможных для этих результатов. По этой причине мы использовали простую модель здания стратегии и не выполнить перекрестную проверку для оценки моделей общего прогностическая ценность или построить доверительные пределы на прогнозы. В других ограничений следует отметить, что мы сделали большое количество статистических сопоставлений и настоящего скорректированные различия между группами с стандартным CIs; некоторые существенные различия, вероятно отразить ложных срабатываний. Наконец эти данные являются по своей природе, отношение к шведским клиническим установкам, где врач вправе предписывать любой препарат по их выбору и государство (единого плательщика) сделало рекомендации (но не ограничения), основанный на стоимости терапии. Относительные затраты терапии и плательщика ограничений зависит от страны. Таким образом хотя характер использования (преимущественно TNFi как первый биологический) является обычным явлением и шведские национальные руководящие принципы схожи с руководящими EULAR и ACR, применимости в других странах могут отличаться.
Это исследование имеет несколько преимуществ. Через Шведские общенациональные регистры мы смогли описать пациентов медицинской истории и другие характеристики, перспективно использование собранных данных, избегая риска для отозвания предвзятости и с полноты, которая в противном случае было бы трудно. Мы также может включать все шведское население, избегая риска смещение выбора. Нашим основным ограничением является отсутствие данных о врача и пациента рассуждения о выборе лечения, который может среди других факторов, под влиянием маршрут и частота назначения.
В заключение мы обнаружили значительные направления пожилых и менее здоровых пациентов с РА на не- TNFi bDMARDs, и обоих как первый bDMARD, так и на переход с первого TNFi. Будущие исследования должны изучить ли этот ченнелинг является медицинским оправданным или, парадоксально, уменьшает общую эффективность и безопасность применения bDMARD терапии. Мы также продемонстрировали степень, к которому этот ченнелинг поставит под угрозу безопасность и эффективность профиль индивидуальных bDMARDs. Если различия в возрасте, истории болезни и РА болезнь деятельности принимаются во внимание в исследованиях относительной безопасности и эффективности bDMARDs, большинство результаты будут сильно запутаны.




 Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Рисунок 1
История болезни при лечении начало терапии bDMARD среди всех пациентов с ревматоидным артритом в SRQ, 2011 – 2015 гг. Различия в соотношении (с 95% CIs) со ссылкой на TNFi и скорректирована с учетом возраста, пола и географического региона.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; SRQ, Шведская ревматологии качества регистра; SSRI selective serotonin reuptake inhibitor, селективный ингибитор обратного захвата серотонина; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности, дальнейшие корректировки для демографии, активность заболевания и медицинской истории не существенно изменяет наблюдаемый характер различия в базовых характеристиках (онлайн Дополнительная таблица s3). Сравнение отдельных TNFis показали несколько отметить различия (онлайн Дополнительная таблица s4), но при начале инфликсимаба пациенты были немного старше и был немного выше активность заболевания по сравнению с другими, а те кто, начиная этанерцепт более часто были женщины и имели более высокие расходы на здравоохранение.
Характеристики пациентов при переходе с первого TNFi
Мы определили 2829 пациентов с РА, который инициировал второй когда-либо bDMARD в течение 1 года отмены первого TNFi. (Для сравнения, за тот же период, 1144 пациентов прекращено первый TNFi без начала bDMARD в течение 1 года). Это было общим для начала второй TNFi (n = 1846, 65%), вне зависимости от указанных причина прерывания первый TNFi. Когорта переключения был более однородной, чем первый bDMARD когорта, с общей меньшие различия между терапии (Таблица 2 и Диаграмма 1). Пациентов, начиная ритуксимаба и abatacept были старше, чем те, начиная с TNFi и более высокую долю с недавних серьезных инфекций. Те, начиная ритуксимаба имели более высокую долю с недавних злокачественности и с серопозитивным РА. В отличие от направления на первый bDMARD, все не- TNFi группы имели более высокую активность заболевания при переключении, чем в TNFi. Tocilizumab был более распространено среди тех, кто прекращено первый TNFi из-за отсутствия эффекта; abatacept был более распространено среди тех прекращенные вследствие неблагоприятных событий.
Таблица 2
Демография и клинических характеристик на начало второго bDMARD терапии, среди шведских пациентов с РА, переход от TNFi 2011-2015
Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Рисунок 1
История болезни при лечении начало терапии bDMARD среди всех пациентов с ревматоидным артритом в SRQ, 2011 – 2015 гг. Различия в соотношении (с 95% CIs) со ссылкой на TNFi и скорректирована с учетом возраста, пола и географического региона.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; SRQ, Шведская ревматологии качества регистра; SSRI selective serotonin reuptake inhibitor, селективный ингибитор обратного захвата серотонина; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности, дальнейшие корректировки для демографии, активность заболевания и медицинской истории не существенно изменяет наблюдаемый характер различия в базовых характеристиках (онлайн Дополнительная таблица s3). Сравнение отдельных TNFis показали несколько отметить различия (онлайн Дополнительная таблица s4), но при начале инфликсимаба пациенты были немного старше и был немного выше активность заболевания по сравнению с другими, а те кто, начиная этанерцепт более часто были женщины и имели более высокие расходы на здравоохранение.
Характеристики пациентов при переходе с первого TNFi
Мы определили 2829 пациентов с РА, который инициировал второй когда-либо bDMARD в течение 1 года отмены первого TNFi. (Для сравнения, за тот же период, 1144 пациентов прекращено первый TNFi без начала bDMARD в течение 1 года). Это было общим для начала второй TNFi (n = 1846, 65%), вне зависимости от указанных причина прерывания первый TNFi. Когорта переключения был более однородной, чем первый bDMARD когорта, с общей меньшие различия между терапии (Таблица 2 и Диаграмма 1). Пациентов, начиная ритуксимаба и abatacept были старше, чем те, начиная с TNFi и более высокую долю с недавних серьезных инфекций. Те, начиная ритуксимаба имели более высокую долю с недавних злокачественности и с серопозитивным РА. В отличие от направления на первый bDMARD, все не- TNFi группы имели более высокую активность заболевания при переключении, чем в TNFi. Tocilizumab был более распространено среди тех, кто прекращено первый TNFi из-за отсутствия эффекта; abatacept был более распространено среди тех прекращенные вследствие неблагоприятных событий.
Таблица 2
Демография и клинических характеристик на начало второго bDMARD терапии, среди шведских пациентов с РА, переход от TNFi 2011-2015








 Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Рисунок 1
История болезни при лечении начало терапии bDMARD среди всех пациентов с ревматоидным артритом в SRQ, 2011 – 2015 гг. Различия в соотношении (с 95% CIs) со ссылкой на TNFi и скорректирована с учетом возраста, пола и географического региона.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; SRQ, Шведская ревматологии качества регистра; SSRI selective serotonin reuptake inhibitor, селективный ингибитор обратного захвата серотонина; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности, дальнейшие корректировки для демографии, активность заболевания и медицинской истории не существенно изменяет наблюдаемый характер различия в базовых характеристиках (онлайн Дополнительная таблица s3). Сравнение отдельных TNFis показали несколько отметить различия (онлайн Дополнительная таблица s4), но при начале инфликсимаба пациенты были немного старше и был немного выше активность заболевания по сравнению с другими, а те кто, начиная этанерцепт более часто были женщины и имели более высокие расходы на здравоохранение.
Характеристики пациентов при переходе с первого TNFi
Мы определили 2829 пациентов с РА, который инициировал второй когда-либо bDMARD в течение 1 года отмены первого TNFi. (Для сравнения, за тот же период, 1144 пациентов прекращено первый TNFi без начала bDMARD в течение 1 года). Это было общим для начала второй TNFi (n = 1846, 65%), вне зависимости от указанных причина прерывания первый TNFi. Когорта переключения был более однородной, чем первый bDMARD когорта, с общей меньшие различия между терапии (Таблица 2 и Диаграмма 1). Пациентов, начиная ритуксимаба и abatacept были старше, чем те, начиная с TNFi и более высокую долю с недавних серьезных инфекций. Те, начиная ритуксимаба имели более высокую долю с недавних злокачественности и с серопозитивным РА. В отличие от направления на первый bDMARD, все не- TNFi группы имели более высокую активность заболевания при переключении, чем в TNFi. Tocilizumab был более распространено среди тех, кто прекращено первый TNFi из-за отсутствия эффекта; abatacept был более распространено среди тех прекращенные вследствие неблагоприятных событий.
Таблица 2
Демография и клинических характеристик на начало второго bDMARD терапии, среди шведских пациентов с РА, переход от TNFi 2011-2015
Figure 1
History of disease at treatment start of bDMARD therapy among all patients with rheumatoid arthritis in the SRQ, 2011–2015. Differences in proportion (with 95% CIs) are with reference to TNFi, and adjusted for age, sex and geographical region. bDMARD, biological disease-modifying anti-rheumatic drug; SRQ, Swedish Rheumatology Quality register; SSRI, selective serotonin reuptake inhibitor; TNFi, tumour necrosis factor inhibitor.
Рисунок 1
История болезни при лечении начало терапии bDMARD среди всех пациентов с ревматоидным артритом в SRQ, 2011 – 2015 гг. Различия в соотношении (с 95% CIs) со ссылкой на TNFi и скорректирована с учетом возраста, пола и географического региона.
bDMARD, биологические Болезнь модифицирующие противоревматические препарат; SRQ, Шведская ревматологии качества регистра; SSRI selective serotonin reuptake inhibitor, селективный ингибитор обратного захвата серотонина; TNFi, ингибитора фактора некроза опухоли.
В анализ чувствительности, дальнейшие корректировки для демографии, активность заболевания и медицинской истории не существенно изменяет наблюдаемый характер различия в базовых характеристиках (онлайн Дополнительная таблица s3). Сравнение отдельных TNFis показали несколько отметить различия (онлайн Дополнительная таблица s4), но при начале инфликсимаба пациенты были немного старше и был немного выше активность заболевания по сравнению с другими, а те кто, начиная этанерцепт более часто были женщины и имели более высокие расходы на здравоохранение.
Характеристики пациентов при переходе с первого TNFi
Мы определили 2829 пациентов с РА, который инициировал второй когда-либо bDMARD в течение 1 года отмены первого TNFi. (Для сравнения, за тот же период, 1144 пациентов прекращено первый TNFi без начала bDMARD в течение 1 года). Это было общим для начала второй TNFi (n = 1846, 65%), вне зависимости от указанных причина прерывания первый TNFi. Когорта переключения был более однородной, чем первый bDMARD когорта, с общей меньшие различия между терапии (Таблица 2 и Диаграмма 1). Пациентов, начиная ритуксимаба и abatacept были старше, чем те, начиная с TNFi и более высокую долю с недавних серьезных инфекций. Те, начиная ритуксимаба имели более высокую долю с недавних злокачественности и с серопозитивным РА. В отличие от направления на первый bDMARD, все не- TNFi группы имели более высокую активность заболевания при переключении, чем в TNFi. Tocilizumab был более распространено среди тех, кто прекращено первый TNFi из-за отсутствия эффекта; abatacept был более распространено среди тех прекращенные вследствие неблагоприятных событий.
Таблица 2
Демография и клинических характеристик на начало второго bDMARD терапии, среди шведских пациентов с РА, переход от TNFi 2011-2015







