2019 обновленные рекомендации EULAR по вакцинации взрослых пациентов с аутоиммунными воспалительными ревматическими заболеваниями
Авторы
Victoria Furer1,2, Christien Rondaan3,4, Marloes W Heijstek5, Nancy Agmon-Levin2,6, Sander van Assen7, Marc Bijl8, Ferry C Breedveld9, Raffaele D’Amelio10, Maxime Dougados11, Meliha Crnkic Kapetanovic12, Jacob M van Laar13, A de Thurah14, Robert BM Landewé15,16, Anna Molto11, Ulf Müller-Ladner17, Karen Schreiber18,19, Leo Smolar20, Jim Walker21, Klaus Warnatz22, Nico M Wulffraat23, Ori Elkayam1,2
Медицинские учреждения
Rheumatology, Tel Aviv Sourasky Medical Center, Tel Aviv, Israel
Tel Aviv University Sackler Faculty of Medicine, Tel Aviv, Israel
Medical Microbiology and Infection Prevention, University Medical Centre Groningen, Groningen, The Netherlands
Rheumatology and Clinical Immunology, University Medical Centre Groningen, Groningen, The Netherlands
Internal Medicine and Allergology, University Medical Center Utrecht, Utrecht, The Netherlands
Zabludowicz Center for Autoimmune Diseases, Chaim Sheba Medical Center, Tel HaShomer, Ramat Gan, Israel
Department of Internal Medicine (Infectious Diseases), Treant Care Group, Hoogeveen, The Netherlands
Rheumatology and Clinical Immunology, Martini Hospital Groningen, Groningen, The Netherlands
Leiden University Medical Center, Leiden, The Netherlands
Dipartimento di Medicina Clinica e Molecolare, Sapienza Università di Roma, Rome, Italy
Hopital Cochin, Rheumatology, Université Paris Descartes, Paris, France
Section of Rheumatology, Department of Clinical Sciences Lund, Lund, Sweden
Rheumatology & Clinical Immunology, University Medical Centre Utrecht and Utrecht University, Utrecht, The Netherlands
Rheumatology, Aarhus University Hospital, Aarhus, Denmark
Amsterdam Rheumatology Center, AMC, Amsterdam, The Netherlands
Rheumatology, Zuyderland MC, Heerlen, The Netherlands
Rheumatology and Clinical Immunology, Giessen University, Bad Nauheim, Germany
Department of Thrombosis and Haemophilia, Guy’s and St Thomas’ Hospital, London, UK
Department of Rheumatology, King Christian X’s Hospital for Rheumatology Diseases, Graasten, Denmark
Patient Research Partner, Tel Aviv, Israel
Patient Research Partner, Elgin, UK
Center for Chronic Immunodeficiency (CCI), University Medical Center Freiburg, Freiburg, Germany
Department of Pediatrics Immunology, Wilhelmina Children’s Hospital, University Medical Center Utrecht, Utrecht, The Netherlands
Для связи
Victoria Furer, Rheumatology, Tel Aviv Sourasky Medical Center, Tel Aviv 62431, Israel; furer.rheum@gmail.com
Аннотация
Обновить рекомендации Европейской лиги по борьбе с ревматизмом (EULAR) по вакцинации взрослых пациентов с аутоиммунными воспалительными ревматическими заболеваниями autoimmune inflammatory rheumatic diseases (AIIRD), опубликованные в 2011 году. Было проведено четыре систематических обзора литературы по заболеваемости / распространенности вакцинопрофилактируемых инфекций среди пациентов с ОРВИ; эффективности, иммуногенности и безопасности вакцин; влиянию противоревматических препаратов на реакцию на вакцины; влиянию вакцинации пациентов, находящихся дома, с ОРВИ. Впоследствии рекомендации были сформулированы на основе фактических данных и заключения экспертов. Обновленные рекомендации содержат шесть общих принципов и девять рекомендаций. Первые касаются необходимости проведения ежегодной оценки состояния вакцинации, совместного принятия решений и сроков вакцинации, способствуя вакцинации в период ремиссии заболевания, предпочтительно до начала иммуносупрессии. Неживые вакцины могут быть безопасно назначены пациентам с AIIRD независимо от основной терапии, в то время как живые аттенуированные вакцины могут применяться с осторожностью. Вакцинация против гриппа и пневмококка должна обязательно проводиться большинству пациентов с AIIRD. Вакцинация против столбнячного анатоксина и вируса папилломы человека должна проводиться больным AIIRD в соответствии с рекомендациями для населения в целом. Вакцинация от гепатита А, гепатита В и опоясывающего герпеса должна проводиться пациентам группы риска AIIRD. Иммунокомпетентные Immunocompetent члены семьи пациентов с AIIRD должны получать вакцины в соответствии с национальными рекомендациями, за исключением пероральной полиомиелитной вакцины. Живые аттенуированные вакцины следует избегать в течение первых 6 месяцев жизни у новорожденных матерей, получавших биологические препараты во второй половине беременности. Эти 2019 eular рекомендации обеспечивают актуальное руководство по ведению вакцинации у пациентов с AIIRD.
Введение
Пациенты с аутоиммунными воспалительными ревматическими заболеваниями (AIIRD) имеют повышенное риск инфекций, связанные с основному аутоиммунному заболеванию, сопутствующим заболеваниями иммуносупрессивной терапии, включая глюкокортикоиды glucocorticoids (GCs (ГКС), модифицирующие болезнь противоревматические препараты disease-modifying antirheumatic drugs (DMARDs );обычные синтетические conventional synthetic (csDMARDs), биологические biological (bDMARDs) и целевые синтетические targeted synthetic DMARDs (tsDMARDs). Поскольку принцип ” лечить до цели’ в настоящее время в основе интенсивной иммуносупрессивной терапией, направленной на ремиссию при большинстве ревматических заболеванийэти методы лечения, обычно применяются, особенно на ранних стадиях заболевания. Таким образом, профилактика инфекций имеет решающее значение в ведении пациентов с AIIRD.
Вакцинация предотвращает инфекции, вызывая и / или усиливая защитный иммунитет. Вакцинация особенно важна для пациентов с AIIRD, что может привести к снижению частоты госпитализаций из-за инфекций, посещений отделений неотложной помощи и частоты контагиозных инфекционных заболеваний. Тем не менее, популяция AIRD повсеместно страдает от неоптимального использования вакцинаций, отчасти из-за низкого уровня направления на вакцинацию ревматологами и другими лечащими врачами, что указывает на необходимость дальнейших усилий по повышения осведомленности о вакцинации среди ревматологического сообщества и привлеченных медицинских работников. Еще один важный фактор низкого уровня вакцинации связан с озабоченностью по поводу эффективности, иммуногенности и безопасности вакцинаций, что является важным вопросом, который должен быть решен на основе новых данных.
Наша цель состояла в том, чтобы обновить настоящие рекомендации Европейской лиги против ревматизма (EULAR) по вакцинации пациентов с AIIRD, опубликованные в 2011 году, и включить новые данные о частоте/распространенности вакцинопрофилактируемых инфекций (European League) среди пациентов с AIIRD, а также об эффективности, иммуногенности и безопасности вакцин, предоставляемых пациентам с AIIRD в рамках широкого спектра иммуносупрессивной терапии. Обновление проводилось в соответствии со стандартными операционными процедурами (SOP) EULAR, объединяя данные клинических исследований и заключения экспертов. Наши рекомендации ориентированы на всех медицинских работников, участвующих в уходе за пациентами с AIIRD.
Методы
Разработка рекомендаций
Настоящее обновление рекомендаций EULAR по вакцинации пациентов с AIIRD было объединенным проектом для взрослых и педиатрических популяций AIIRD. После обновленного в 2014 году СОП EULAR руководитель convenor (OE) сначала сформировал целевую группу с руководящим комитетом. Руководящий комитет включал организатора (OE), со-организатора co-convenor (ULM), методистов (JvL и RL), трех стипендиатов, которые проводили систематические обзоры литературы (SLR) (VF, CR, MH), одного эксперта-ревматолога (MB) и одного специалиста по инфекционным заболеваниям (SvA). Руководящий комитет определил исследовательские вопросы для SLR (Box 1) и организовал полуторачасовое совещание целевой группы. Участники совещания целевой группы для взрослых представляли семь европейских стран и Израиль, включая 10 взрослых ревматологов, четырех клинических иммунологов, одного специалиста по инфекционным заболеваниям, одного педиатра/ревматолога, двух делегатов Сети молодых ревматологов Eular Emerging Eular NETwork, одного медицинского работника в области ревматологии (HPR) и двух пациентов. Три сотрудника (VF, CR, MH), провели четыре SLRs, охватывающий доказательства VPI, эффективности, иммуногенности, безопасности вакцинации у пациентов с AIIRD, воздействие препаратами на прививку реакция и последствия вакцинации AIIRDs пациентов находящихся дома , включая новорожденных, по профилактике VPI и безопасности пациентов. Эти SLR были сосредоточены на исследованиях, опубликованных после даты блокировки SLR для предыдущего обновления, то есть в октябре 2009 года. MEDLINE (через PubMed), EMBASE и Cochrane были изучены с 1 октября 2009 года по 1 августа 2018 года. В качестве поисковых терминов были объединены заголовки медицинских тем (MESH) для определяемых AIIRD, иммуносупрессивных препаратов и вакцин (Box 2). Были включены только статьи на английском языке. Можно было бы добавить и другие документы, которые, по мнению экспертов, являются актуальными.

|
Вставка 1. Вопросы исследования. Какова частота или Распространенность вакцинопрофилактируемых инфекций у взрослых пациентов с аутоиммунными воспалительными ревматическими заболеваниями (AIIRD)? Какова эффективность, иммуногенность и безопасность доступных вакцин у взрослых пациентов с AIIRD? Являются ли вакцины эффективными и иммуногенными у взрослых пациентов с AIIRD, получающих лечение иммуносупрессивными средствами и модифицирующими болезнь противоревматическими препаратами? Каково влияние вакцинации больных с AIIRD, находящихся дома, в том числе новорожденных, на профилактику вакцинопрофилактических заболеваний и безопасность пациентов? |


|
Вставка 2. Определение аутоиммунных воспалительных ревматических заболеваний (AIIRD), иммуносупрессивных средств и вакцин, включенных в литературу поиск и рекомендации Аутоиммунные воспалительные ревматические заболевания · Ревматоидный артрит, ювенильный идиопатический артрит · Болезнь Стилла у взрослых · Системная красная волчанка, синдром Шегрена, антифосфолипидный синдром · Системный склероз, смешанное заболевание соединительной ткани · Полимиозит, дерматомиозит, антисинтетазный синдром, клинически амиопатический дерматомиозит, миозит тела включения, эозинофильный миозит, эозинофильный фасциит · Псориатический артрит, артрит · Ревматическая полимиалгия · Гигантоклеточный артериит, артериит Такаясу · Антинейтрофильные цитоплазматические антитела (АНЦА)-ассоциированные васкулиты: гранулематоз с полиангиитом, микроскопический полиангиит, эозинофильный гранулематоз с полиангиитом (синдром Черга-Стросса) · Узелковый полиартериит · Криоглобулинемический синдром · Анти — гломерулярное заболевание антитела базальной мембраны (GBM) (болезнь Гудпасчера) · Болезнь Бехчета · Рецидивирующий полихондрит · Периодические лихорадочные синдромы · семейная средиземноморская лихорадка Иммуносупрессивные препараты · Глюкокортикоиды · Синтетические антиревматические препараты, модифицирующие болезнь: метотрексат, лефлуномид, сульфасалазин, гидроксихлорохин, Азатиоприн · Препараты микофеноловой кислоты · Ингибиторы кальциневрина: циклоспорин, такролимус · Алкилирующий агент: циклофосфамид · Биологические препараты disease-modifyingantirheumatic drugs (DMARDs): инфликсимаб, Этанерцепт, Адалимумаб, цертолизумаб, голимумаб абатацепт, тоцилизумаб, ритуксимаб секукинумаб, иксекизумаб белимумаб анакинра, канакинумаб · Целевые синтетические препараты disease-modifyingantirheumatic drugs (DMARDs): тофацитиниб, baricitinib Инактивированные · Дифтерия, гепатит А, гепатит В, Гемофильная инфекция (тип b), вирус папилломы человека, грипп, Нейссерию менингитов, коклюша, полиомиелита, парентеральных, пневмококк (полисахаридные и конъюгированные), столбнячного анатоксина, клещевой энцефалит, парентеральные брюшной тиф Живые ослабленные (аттенуированные) вакцины · Корь, паротит, оральный полиомиелит, оральный брюшной тиф, ветряная оспа, желтая лихорадка |
В Первой части совещания приняли участие как взрослыми, так и педиатрическими членами целевой группы, в ходе которой были представлены предварительные результаты четырех SLRs. После презентации группа разделилась на две части, чтобы сформулировать отдельные обновленные рекомендации по вакцинации взрослых и детей с AIIRD. В группе взрослых руководитель convenor (OE) предложил формулировку каждой рекомендации. Каждая рекомендация обсуждалась в рамках группы, и формулировка изменялась до достижения согласия между членами. Во второй части совещания обе группы вновь рассмотрели оба набора рекомендаций, главным образом для того, чтобы убедиться в отсутствии между ними серьезных расхождений. После этого представления были внесены незначительные изменения, которые были одобрены всеми членами целевой группы. Затем было организовано второе совещание целевой группы, на котором были представлены обновленные SLRs, касающиеся взрослого населения, имеющего AIIRD. Результаты SLRs представлены в двух статьях, представленных для публикации в RMD Open. Каждая рекомендация обсуждалась и при необходимости изменялась, после чего все члены целевой группы проводили второй тур голосования.
Были сформулированы шесть всеобъемлющих принципов и девять рекомендаций (таблицы 1 и 2). Для каждого заявления были критически оценены имеющиеся доказательства, и сила рекомендаций (SoR) была определена в соответствии со стандартами Оксфордского центра доказательной медицины.
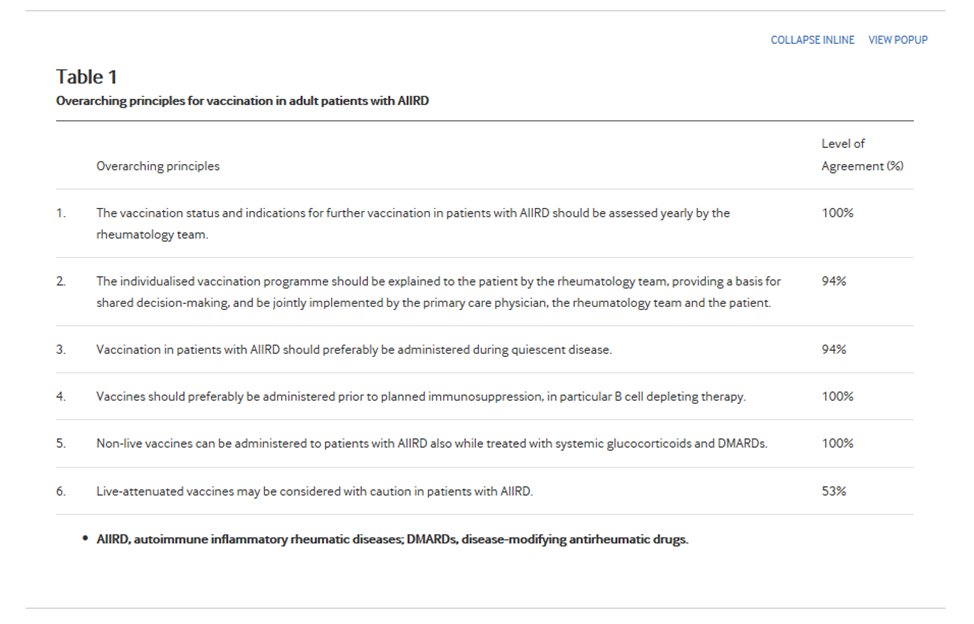
Таблица 1
Основополагающие принципы вакцинации взрослых пациентов с AIIRD
|
Всеобъемлющий принцип |
Уровень согласия (%) |
|
|
1. |
Состояние вакцинации и показания к дальнейшей вакцинации у пациентов с AIIRD должны ежегодно оцениваться ревматологической командой. |
100% |
|
2. |
Индивидуальная программа вакцинации должна быть разъяснена пациенту ревматологической командой, обеспечивая основу для совместного принятия решений, и совместно осуществляться врачом первичной медико-санитарной помощи, ревматологической командой и пациентом. |
94% |
|
3. |
Вакцинацию у пациентов с AIIRD предпочтительно проводить в период ремиссии заболевания. |
94% |
|
4. |
Вакцины предпочтительно вводить до планируемой иммуносупрессии, в частности терапии, истощающие В-клетки. |
100% |
|
5. |
Неживые вакцины могут быть назначены пациентам с AIIRD, а также при лечении системными глюкокортикоидами и DMARDs. |
100% |
|
6. |
Живые аттенуированные вакцины могут рассматриваться с осторожностью у пациентов с AIIRD. |
53% |
AIIRD, аутоиммунные воспалительные ревматические заболевания; DMARDs, болезнь-модифицирующие противоревматические препараты.
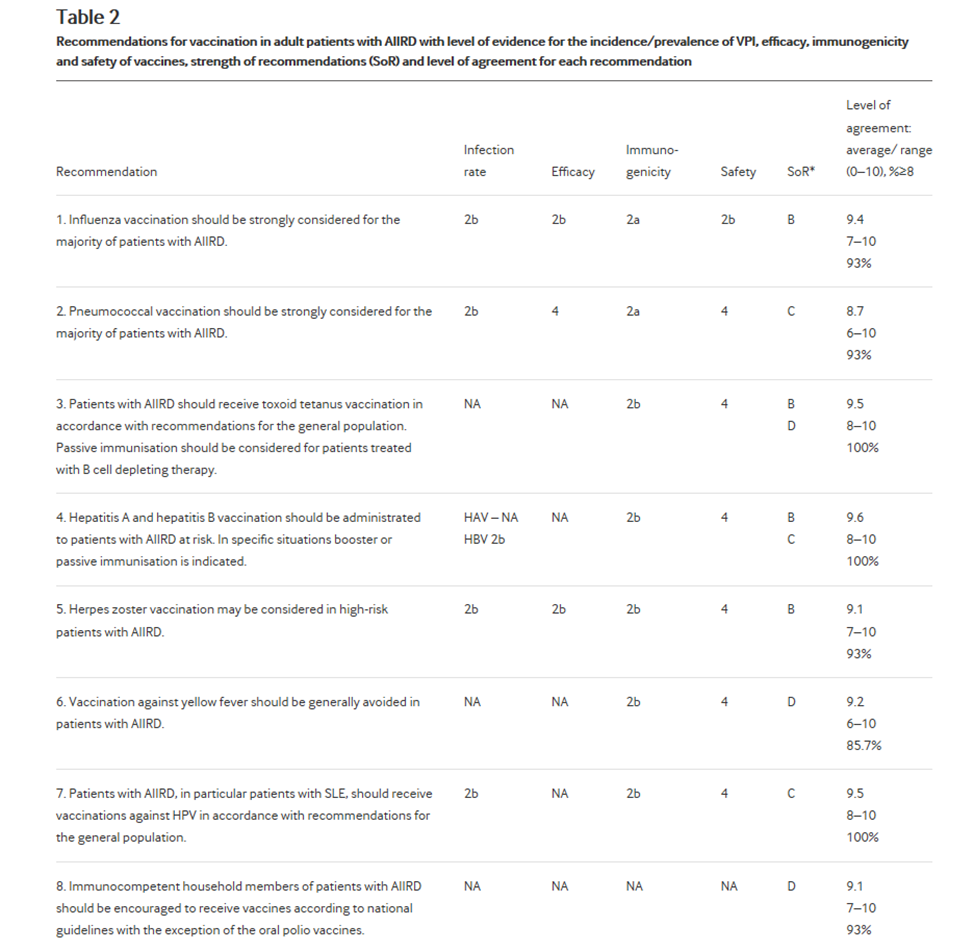

Таблица 2
|
Рекомендации по вакцинации взрослых пациентов с AIIRD с уровнем доказательности заболеваемости / распространенности VPI, эффективностью, иммуногенностью и безопасностью вакцин, силой рекомендаций (SoR) и уровнем согласия по каждой рекомендации |
||||||
|
Рекомендация |
Уровень инфекции |
Эффективность |
Иммуногенность |
Безопасность |
SoR* |
Уровень согласия: среднее / диапазон (0-10), %≥8 |
|
1. Вакцинация против гриппа должна быть решительно рассмотрена для большинства пациентов с AIIRD. |
2b |
2b |
2a |
2b |
B |
9.4 7–10 93% |
|
2. Пневмококковая вакцинация должна быть решительно рекомендована для большинства пациентов с AIIRD. |
2b |
4 |
2a |
4 |
С |
8.7 6–10 93% |
|
3. Больные с AIIRD должны получать вакцинацию против столбняка в соответствии с рекомендациями для населения в целом. Пассивная иммунизация должна быть рассмотрена для пациентов, получающих терапию, истощающие В-клетки. |
NA |
NA |
2b |
4 |
B D |
9.5 8–10 100% |
|
4. Вакцинацию от гепатита А и гепатита В следует проводить пациентам с AIIRD, находящимся в группе риска. В определенных ситуациях показана бустерная или пассивная иммунизация. |
HAV – NA HBV 2b
|
NA |
2b |
4 |
B C |
9.6 8–10 100% |
|
5. Вакцинация против опоясывающего герпеса может быть рассмотрена у пациентов высокого риска с AIIRD. |
2b |
2b |
2b |
4 |
B |
9.1 7–10 93% |
|
6. Вакцинации против желтой лихорадки следует вообще избегать у пациентов с AIIRD. |
NA |
NA |
2b |
4 |
D |
9.2 6-10 85.7% |
|
7. Пациенты с AIIRD, в частности больные СКВ, должны получать прививки против ВПЧ в соответствии с рекомендациями для общей популяции. |
2b |
NA |
2b |
4 |
С |
9.5 8-10 100% |
|
8. Иммунокомпетентные члены семьи пациентов с AIIRD должны поощряться к получению вакцин в соответствии с национальными руководящими принципами, за исключением пероральных полиовакцин. |
NA |
NA |
NA |
NA |
D |
9.1 7-10 93% |
|
9. Живые аттенуированные вакцины следует избегать в течение первых 6 месяцев жизни у новорожденных матерей, получавших биологические препараты во второй половине беременности. |
NA |
NA |
NA |
NA |
D |
9.5 8-10 100% |
|
* Сила рекомендации была в первую очередь основана на данных об эффективности. При отсутствии данных об эффективности в качестве основного результата использовали иммуногенность. Когда результаты иммуногенности не коррелировали напрямую с защитой, сила рекомендации была понижена. Немногие рекомендации были в основном основаны на безопасности (особенно живые аттенуированные вакцины), и здесь результаты безопасности определили силу рекомендации. *AIIRD, аутоиммунные воспалительные ревматические заболевания; HAV, вирус гепатита A; HBV, вирус гепатита B; ВПЧ, HPV вирус папилломы человека; NA, non-available не доступен; SLE, системная красная волчанка. |
||||||
После второго совещания окончательный вариант рекомендаций был распространен среди членов целевой группы, которые в электронной форме проголосовали за согласование каждого из принципов и рекомендаций. По каждому заявлению было проведено раздельное голосование, в результате которого была получена оценка от 0 (полное отсутствие согласия с предложенной рекомендацией) до 10 (максимально возможная поддержка рекомендации). Уровень согласия по каждой рекомендации определялся на основе среднего балла голосования.
Окончательный вариант рукописи был подготовлен после второго совещания целевой группы. Рукопись была структурирована в соответствии с оценкой руководящих принципов исследования и оценки II, рассмотрена, пересмотрена и одобрена всеми членами целевой группы, а затем окончательно рассмотрена и одобрена Исполнительным Комитетом EULAR до представления в журнал.
Определение
В области вакцинации важное значение имеют несколько мер по достижению результатов. Во-первых, способность прививок предотвращать инфекции, называемая’efficacy’ “эффективностью”. Часто гуморальные реакции на вакцины рассматриваются как суррогатные конечные точки эффективности, в частности для редких инфекций, которые в противном случае потребовали бы неосуществимых испытаний, требующих очень большого числа пациентов для доказательства эффективности вакцины. Способность вакцин индуцировать гуморальные и/или клеточные иммунные реакции называется ‘immunogenicity’”иммуногенностью”. Эти иммунные реакции могут коррелировать с клинической эффективностью некоторых вакцин, но не обязательно. Это следует учитывать при интерпретации имеющихся данных (в первую очередь об иммуногенности) для этих рекомендаций.
SoR был в первую очередь основан на уровне доказательств эффективности вакцинации. В исследованиях вакцин только с исходами иммуногенности SoR устанавливался на основе суррогатного исхода (иммуногенности). В случае отсутствия прямой корреляции между исходами иммуногенности и уровнем защиты SoR понижали.
Наконец, большое значение имеет безопасность вакцин. Безопасная вакцинация подразумевает, что вакцинация не имеет серьезных побочных эффектов и не усугубляет основное заболевание. Особенно для живых ослабленных вакцин, безопасность является серьезной проблемой. Для этих вакцин, исходы безопасности главным образом определили SoR. Уровень имеющихся доказательств эффективности, иммуногенности и безопасности при условии наличия данных представлен для каждой рекомендации.
Результаты
Всеобъемлющий принцип
Целевая группа одобрила представление шести общих принципов вакцинации пациентов с AIIRD в качестве всеобъемлющих (Таблица 1). Были сформулированы три новых всеобъемлющих принципа. Остальные три принципа вытекают из рекомендаций #2 – #4, опубликованных в версии 2011 года, и были включены в общие принципы в силу их важности и общего характера. уровень согласия по каждому всеобъемлющему принципу представлен в таблице 1.
Состояние вакцинации и показания к дальнейшей вакцинации у пациентов с AIIRD должны оцениваться ежегодно ревматологической командой
Исследовательская группа одобрила ежегодную оценку состояния вакцинации группой лечащих ревматологов в качестве центрального принципа, направляющего вакцинацию пациентов с AIIRD, что представляет собой всеобъемлющий принцип, а не рекомендацию. В версии 2011 года первая рекомендация касалась оценки состояния вакцинации пациентов с AIIRD на начальном этапе обследования, без определения ответственного поставщика медицинских услуг. В текущей версии подчеркивается необходимость ежегодной оценки, делегируя ответственность лечащему ревматологу или ревматологической бригаде. Команда ревматологов обладает обширными знаниями и опытом, охватывающими все аспекты AIIRD, включая соответствующие методы лечения, применяемые к отдельному пациенту. Для пациентов с AIIRD, лечащая команда ревматологии обыкновенно организует их медицинскую помощь, связывает с врачом первичной медико-санитарной помощи и координирует мультидисциплинарную сеть, когда требуется. Как указано в версии 2011 года, документирование истории вакцинации, побочных явлений и обострений основного AIIRD после более ранних прививок должна быть включена в оценку и превращена в стандарт ухода за пациентами с AIIRD.
Индивидуальная программа вакцинации должна быть разъяснена пациенту ревматологической бригадой, обеспечивая основу для совместного принятия решений, и совместно реализовываться врачом первичной медико-санитарной помощи, ревматологической бригадой и пациентом
Это новый сформулированный принцип, решительно поддержанный представителями пациентами целевой группы и поддержанный другими членами. Совместное принятие решений и учет потребностей, проблем и предпочтений пациентов получили наиболее заметное признание при лечении хронических заболеваний, что нашло отражение в обновленных рекомендациях EULAR. Выявление барьеров для иммунизации и устранение страхов и опасений пациентов в отношении побочных эффектов является важным шагом на пути к соблюдению любой программы иммунизации. Имея доступ к научно обоснованной информации о вакцинах и понимая риски и преимущества вакцинации, пациенты могут принять взвешенное решение относительно предлагаемой программы вакцинации. Ревматологическая бригада должна информировать пациентов о риске инфекций и показаниях к вакцинации, информировать пациентов о соотношении риска и пользы вакцин и поощрять пациентов придерживаться соответствующего графика вакцинации. Действительно, обследования среди пациентов с AIIRD показали, что улучшение знаний о вакцинации и рекомендации по вакцинации со стороны лечащего специалиста положительно связаны с улучшением усвоения вакцины. Связь между ревматологическими бригадами и бригадами первичной медико-санитарной помощи способствует дальнейшему реализации программы вакцинации. Большое обследование пациентов с ревматоидным артритом (РА) в Великобритании показало, что большинство вакцинаций проводилось в рамках первичной медико-санитарной помощи, поддерживая сотрудничество между первичной и вторичной медицинской помощью для максимального использования вакцины.
Вакцинацию у пациентов с AIIRD предпочтительно проводить в период ремиссии заболевания
Это заявление, перечисленное в качестве второй рекомендации в варианте 2011 года, было перенесено в третий всеобъемлющий принцип. Основанием для принятия этого решения послужило общее мнение большинства членов совета о том, что это важное послание было бы полезным в качестве основополагающего общего принципа. Действительно, большинство исследований вакцинации, проведенных в популяции AIIRD, включали пациентов с ремиссией заболеванием. Число исследований с участием пациентов с AIIRD, иммунизированных на активной стадии заболевания, слишком мало, чтобы сделать вывод о том, что вакцинация в активные фазы заболевания эффективна или безопасна. В одном исследовании непосредственно рассматривалось влияние активности основного заболевания на иммуногенность вакцинации. В данном исследовании пациенты с ювенильной системной красной волчанкой (СКВ)с высокой активностью СКВ имели сниженные показатели сероконверсии к вакцинации против гриппа A H1N1. Примечательно, что в исследовании 340 больных РА высокие уровни активности заболевания не препятствовали иммунному ответу на вакцинацию против гриппа A H1N1. Тем не менее, исходя из ограниченных знаний о безопасности и иммуногенности прививок у пациентов с активным заболеванием, согласно заключению экспертов, прививки предпочтительно назначаются в период ремиссии. У пациентов с активным заболеванием иммунизацию не следует исключать и рассматривать в индивидуальном порядке.
Вакцины предпочтительно вводить до планируемой иммуносупрессии, в частности терапии, разрушающей В-клетки
Эта важная концепция, основанная на четвертой рекомендации в версии 2011 года, была дополнительно расширена до инициирования csDMARDs, bDMARDs и tsDMARDs, что побуждает политику ранней вакцинации что гарантирует оптимальный ответ на вакцины. Тем не менее, важно подчеркнуть, что цель этого принципа заключается в том, чтобы не откладывать необходимое иммуносупрессивное лечение в тяжелых случаях. В таких случаях главным приоритетом является начало указанного иммуносупрессивного лечения, а не раннее введение вакцин.
Был достигнут четкий консенсус относительно супрессивного эффекта ритуксимаба (РТХ)на гуморальный ответ на вакцинацию против гриппа и пневмококка у пациентов с РА, спондилоартропатиями (SpA) и СКВ, объясняющий обоснование проведения вакцинации до введения ритуксимаба. Другие методы лечения bDMARD оказывают переменное влияние на ответ на иммунизацию в популяции AIIRD, причем большинство пациентов достигают удовлетворительного серологического ответа. Влияние конкретных DMARDs широко обсуждается в расширенном SLR (представленном для публикации в RMD Open).
Таким образом, вакцины должны в идеале вводиться до планируемой иммуносупрессии с упором на биологическую терапию, разрушающую в-клетки. В случае невосприимчивых пациентов, получающих в-клеточную терапию, вакцинацию следует проводить в следующие сроки: не менее чем через 6 месяцев после введения и за 4 недели до следующего курса в-клеточной терапии, исходя из состояния клинической практики. В тех случаях, когда это временное окно для иммунизации невозможно, вакцинацию можно рассматривать в рамках терапии, разрушающей в-клетки, принимая во внимание потенциальный субоптимальный ответ на вакцину.
Неживые вакцины могут быть назначены пациентам с AIIRD во время применения глюкокортикоидов и DMARDs.
Первоначально представленное в качестве четвертой рекомендации в версии 2011 года, это заявление было изменено и обновлено до всеобъемлющего принципа в свете убедительных доказательств общей адекватной эффективности и безопасности вакцинации при использовании GC и/или обоих csDMARDs, bDMARDs и tsDMARDs при различных ревматических заболеваниях. Накопленные за последние годы данные способствовали введению вакцин против гриппа, пневмококка, столбнячного анатоксина, вируса гепатита В (HBV), вируса гепатита А (HAV) и вируса папилломы человека (ВПЧ) пациентам с AIIRD в условиях иммуносупрессивной терапии. В большинстве исследований была достигнута адекватная иммунопротекция без каких-либо серьезных сигналов безопасности, хотя в большинстве исследований период наблюдения был коротким. Подробная информация о соответствующих исследованиях представлена в SLR от Rondaan, представленной для публикации в Open RMD.
Живые аттенуированные вакцины могут применяться с осторожностью у пациентов с AIIRD.
Применение живых аттенуированных вакцин у пациентов с AIIRD заслуживает особого внимания. В версии 2011 года третья рекомендация гласила, что живые аттенуированные вакцины следует по возможности избегать у иммуносупрессированных пациентов с AIIRD. В свете новых фактических данных и опыта применения некоторых живых аттенуированных вакцин у пациентов с AIIRD целевая группа подробно обсудила модификацию первоначального заявления с целью его формулирования в более разрешительном режиме. Было достигнуто согласие включить новые доказательства в обновленные рекомендации с подробным разъяснением обоснования и новых доказательств. В целом, живые аттенуированные вакцины следует избегать у пациентов, получающих иммуносупрессивную терапию, поскольку эти вакцины содержат живые аттенуированные микроорганизмы, которые теоретически могут вызывать инфекции в восприимчивой популяции AIIRD. Исходя из экспертного заключения, предпочтительным временным окном для вакцинации живыми вакцинами является 4 недели до начала лечения, исходя из состояния клинической практики. Однако прививки, такие как корь, паротит, краснуха measles, mumps, rubella (MMR) и живые аттенуированные вакцины против опоясывающего герпеса, могут быть исключены.
В соответствии с рекомендациями центров по контролю и профилактике заболеваний Centers for Disease Control and Prevention (CDC), определение “иммуносупрессивной терапии” включает использование ГК в течение ≥2 недель в дозах, эквивалентных преднизолону 20 мг/сут или 2 мг/кг массы тела, которые считаются иммуносупрессивными, как метотрексат (MTX) ≥0,4 мг/кг в неделю, Азатиоприн ≥3,0 мг/кг в день или 6-меркаптопурин ≥1,5 мг/кг в день, в то время как дозы ниже этих уровней могут рассматриваться как “низкодозовая” ‘low grade’ иммуносупрессия. Уровень иммуносупрессии при длительном лечении низкими дозами ГК требует дальнейшего изучения. В области ревматологии bDMARDs и tsDMARDs также определяются как иммуносупрессивная терапия.
Доказательства по MMR в основном получены из данных наблюдений в педиатрической популяции пациентов с AIIRD. Что касается иммуногенности, то в ретроспективном исследовании, проведенном в Нидерландах, сообщалось о длительной стойкой серопротекции кори у большой группы пациентов с ювенильным идиопатическим артритом (ЮИА). Применение ГКС или МТХ не влияло на концентрацию антиген-специфических антител или скорость серопротекции. Последовательно, подобный результат был сообщен в небольшом ретроспективном исследовании, выполненном в педиатрических пациентах СКВ в Бразилии. Проспективное исследование “случай-контроль” из Германии также сообщило о защитном гуморальном ответе через 6 месяцев после ревакцинации кори у 15 пациентов с ЮИА, получавших либо терапию МТХ в низких дозах самостоятельно, либо в комбинации с этанерцептом. Что касается безопасности, не наблюдалось увеличения активности заболевания, вспышки кори или тяжелых серьезных инфекций, в том числе у пациентов с ЮИА, использующих Этанерцепт. Рандомизированное, открытое исследование из Нидерландов подтвердило соответствующую иммуногенность и безопасность бустера MMR, предоставленного пациентам с ЮИА, включая 60 пациентов, использующих MTX, и небольшое количество пациентов, использующих bDMARDs. Исходя из этих данных о безопасности бустерной вакцинации MMR, бустерную вакцину против вируса кори (в отличие от нео-иммунизации) можно рассматривать у пациентов с низкой степенью иммуносупрессии, подверженных риску заражения корью (например, у путешественников).
* Бустерная вакцинация. Дополнительная доза вакцины, вводимая после первичного курса иммунизации для повышения иммунного ответа.
Что касается вакцинации против опоясывающего герпеса herpes zoster (HZ), то в двух исследованиях оценивалась безопасность живой аттенуированной опоясывающей вакцины у больных AIIRD с использованием иммуносупрессивных препаратов. Большое когортное исследование бенефициаров Medicare 60 лет и старше с AIIRD, получавших иммуносупрессивную терапию, в том числе bDMARDs, не показало увеличения заболеваемости опоясывающим герпесом в течение первых 42 дней после вакцинации. Живая аттенуированная вакцина HZ была безопасно предоставлена небольшой когорте пациентов с СКВ (n=10), за которыми следили в течение 12 недель. Основываясь на этих исследованиях, живая аттенуированная вакцина HZ может рассматриваться у пациентов группы риска. В настоящее время в некоторых странах имеется неживая вирусная вакцина. Обе вакцины обсуждаются в рекомендации № 5 ниже.
Таким образом, живых аттенуированных вакцин следует избегать вовремя иммуносупрессии, за возможным исключением осторожного использования MMR booster и Hz вакцины при особых обстоятельствах, как обсуждалось выше.
Рекомендации
Всего было сформулировано девять рекомендаций. Для каждой рекомендации был указан уровень доказательности заболеваемости/распространенности VPI у AIIRD, а также эффективность/иммуногенность/безопасность вакцинации, если таковые имеются, после чего следовали сила рекомендации и уровень согласия (Таблица 2). Шесть из этих рекомендаций, касающихся вакцинации против гриппа, пневмококка, столбнячного анатоксина, HAV, HBV, а также вакцинации против ВПЧ, взяты из рекомендаций 2011 года с некоторыми изменениями. Были исключены три рекомендации (прежние № 10, № 12 в версии 2011 года), касающиеся вакцинации гипоспленизмом/без селезенки пациентов с AIIRD, вакцинации БЦЖ и путешествующих пациентов с AIIRD. Целевая группа решила, что первые две темы стали неуместными в повседневной ревматологической практике. Рекомендация для путешествующих пациентов с AIIRD (бывший № 13) следовать национальным рекомендациям была опущена из-за ее неспецифичности. Были сформулированы две новые рекомендации (№8, № 9), охватывающие вакцинацию членов семьи, проживающих с пациентов с AIIRD и новорожденных, получавших биопрепараты во время беременности. По этим темам был проведен SLR, который не раскрыл никаких соответствующих документов. Таким образом, эти рекомендации были основаны на экспертном заключении.
Вакцинация против гриппа должна быть строго выполнена для большинства пациентов с AIIRD
Эта рекомендация, перечисленная №5 в версии 2011 года, осталась практически неизменной, за исключением замечания о том, что вакцина должна применяться для большинства пациентов, а не для всех пациентов. Пациенты с AIIRD имеют более высокий риск заражения гриппом по сравнению с общей популяцией. Руководство целевой группы подробно обсудила круг пациентов, которым следует рекомендовать вакцину. Поскольку в национальных руководящих принципах вакцинации против гриппа существует значительная вариабельность, начиная от вакцинации всего населения в США и заканчивая возрастной и риск-ориентированной вакцинацией в других странах, группа приняла во внимание различные эпидемиологические и клинические аспекты вакцинации против гриппа у пациентов с AIIRD. На сегодняшний день нет убедительных эпидемиологических доказательств, оправдывающих универсальную вакцинацию против гриппа для всей популяции больных AIIRD. Например, молодые пациенты с анкилозирующим спондилитом, получающие только нестероидные противовоспалительные препараты, не считаются иммуносупрессированными и, следовательно, не подвергаются повышенному риску заболеваемости гриппом. Тем не менее, большинство населения AIIRD, в частности пациенты, получающие иммуносупрессивную терапию, по-видимому, выигрывают от вакцины.
Что касается эффективности, сезонная трехвалентная субъединица вакцинации против гриппа показала снижение частоты и бактериальных осложнений гриппа, госпитализации и смертности от гриппа/пневмонии в AIIRD. Большинство исследований были сосредоточены на иммуногенности как суррогатном исходе для эффективности. Показано, что вакцинация против гриппа является иммуногенной у пациентов с РА, СКВ, АНЦА-ассоциированным васкулитом (ААВ), ССК и Пса, получающих лечение всеми классами DMARDs, за исключением ритуксимаба. Показано, что временная отмена МТХ улучшает иммуногенность вакцинации против сезонного гриппа у больных РА, причем наилучшие результаты наблюдаются при приостановке МТХ на 2 недели до и 2 недели после вакцинации. Однако в настоящее время не рекомендуется останавливать MTX до или после вакцинации против гриппа. Побочные явления вакцинации против гриппа у пациентов с AIIRD представляются сопоставимыми с таковыми в здоровых контрольных группах, хотя нет исследований, которые были бы достаточно эффективны в отношении безопасности.
Большинство исследований, посвященных изучению иммуногенности и безопасности пандемической одновалентной гриппозной вакцины, выявили снижение иммуногенности у пациентов с AIIRD (в основном РА и СКВ) и на большинстве иммуносупрессивных препаратов, хотя уровни защитных антител были достигнуты у большинства пациентов, за исключением тех, кто лечился ритуксимабом и абатацептом. Показано что вторая бустерная доза вакцины улучшает иммуногенность, ведущих к уровням серопротекции сопоставимы со здоровым контролем. Это также было показано у пациентов с СКВ, которые впервые получили вакцину против сезонного гриппа.
После вакцинации как сезонными, так и пандемическими противогриппозными вакцинами активность заболевания была стабильной в большинстве исследований, и сообщалось лишь о незначительных побочных явлениях, сопоставимых со здоровым контролем. На основании данных о повышенном риске и заболеваемости гриппозной инфекцией у больных AIIRD, в сочетании с исследованиями, показывающими снижение заболеваемости гриппом после вакцинации, и большого массива данных, подтверждающих хорошую иммуногенность и безопасность гриппозной вакцины у больных AIIRD, вакцинация против гриппа должна быть обязательно применяться для большинства пациентов.
Пневмококковая вакцинация должна быть обязательно применяться для большинства пациентов с AIIRD
Эта рекомендация, перечисленная №6 в версии 2011 года, была изменена, определяя круг кандидатов на пневмококковую вакцину как “большинство” пациентов с AIIRD, чтобы нацелить пациентов на риск пневмококковой болезни. Группа целевой группы подробно обсудила типы пневмококковой вакцины, сроки введения вакцины, круг пациентов, которые в основном выиграют от вакцинации, и экономическую эффективность вакцины для того, чтобы нацелить пациентов AIRD на риск пневмококковой болезни.
Риск легочной инфекции особенно высок у пациентов с AIIRD. В исследовании американских ветеранов с РА самый высокий уровень госпитализации по поводу инфекции был обусловлен пневмонией (37%).120 РА и СКВ были определены как имеющие дополнительные условия риска развития пневмококковой болезни. частота инвазивной пневмококковой инфекции у больных СКВ была в 13 раз выше по сравнению с общей популяцией голландцев.
В настоящее время имеются две пневмококковые вакцины: 23-валентная пневмококковая полисахаридная вакцина (PPSV23) и 13-валентная пневмококковая конъюгированная вакцина (PCV13). Что касается эффективности, рандомизированное двойное слепое исследование клинической эффективности PPSV23 в профилактике пневмонии у больных РА не продемонстрировало повышения эффективности вакцины по сравнению с плацебо.С другой стороны, ретроспективное исследование отдаленного эффекта PPSV23 у больных РА, получавших МТХ, показало относительный риск развития пневмонии у невакцинированных пациентов в размере от 9,7 до развития пневмониии у не вакцинированных пациентов. Гуморальная иммуногенность и безопасность PPSV23 была продемонстрирована при РА, СКВ, и в ограниченной степени при СпА и др. Долгосрочная иммуногенность PPSV23 была оценена в двух исследованиях, у пациентов с РА, получавших MTX124 и biologics, соответственно. Оба показали длительный срок действия защитных антител, до 7 лет. Иммуногенность и безопасность PCV13 были оценены в малых группах в составе пациенты с РА и найдены, что обеспечивают соотвествующий гуморальный ответ, хотя уменьшенный под MTX, при SLE и пациентов с системными васкулитами. Ни в одном из вышеперечисленных исследований не были подняты вопросы безопасности, за исключением пациентов с периодическими синдромами, связанными с криопирином (CAPS), у которых могут развиться тяжелые местные реакции и системные реакции на PPSV23.
Поэтапная пневмококковая вакцинация, бустерная стратегия PCV13 prime-PPSV23, с интервалом не менее 8 недель между двумя вакцинациями, в настоящее время рекомендуется на основе рекомендаций CDC и Европейского общества клинической микробиологии и инфекционных заболеваний (ESCMID) для маленьких детей, взрослых старше 65 лет и пациентов с риском развития пневмококковой болезни (Таблица 3). Это в основном основано на мнении экспертов. Данные исследований, проведенных в общей популяции и у пациентов с HIV, показали усиление иммуногенного ответа после комбинированной вакцинации. С другой стороны, доказательств эффективности комбинации PCV13 и PPSV23 у пациентов с AIIRD недостаточно. В рандомизированном контролируемом исследовании у больных РА оценивали серологический ответ на PCV13 с последующим PPSV23 через 16-24 недели. Исследование продемонстрировало адекватный ответ (87% и 94% у больных РА на bDMARDS и csDMARDS, соответственно), со значительно сниженным ответом у пациентов, получавших RTX. Стратегия prime boosting с PCV13 не улучшила реакцию. Однако долгосрочные последующие исследования, касающиеся персистенции гуморального ответа и иммунологической памяти, пока недоступны.
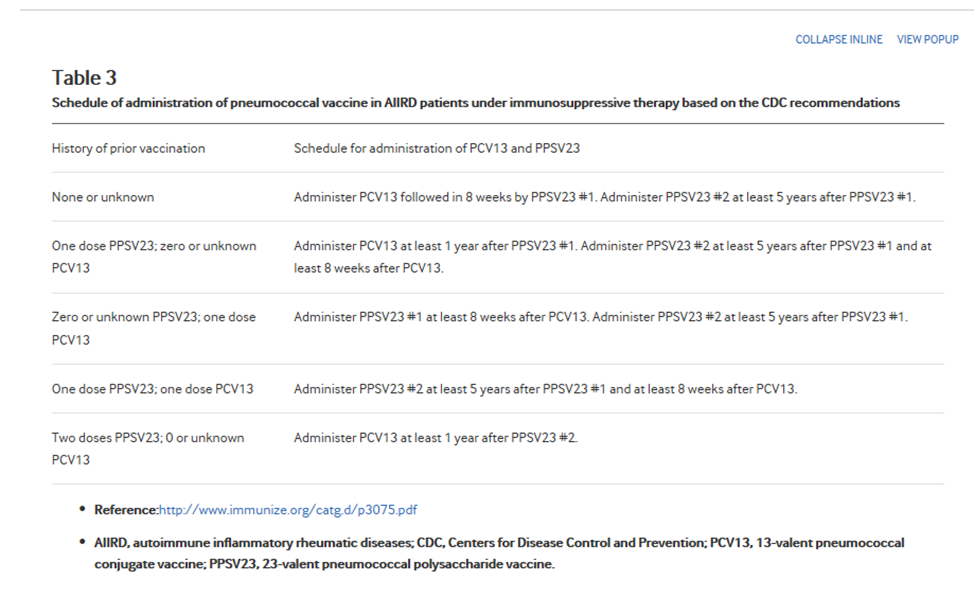
Таблица 3
График введения пневмококковой вакцины больным AIIRD в условиях иммуносупрессивной терапии на основании рекомендаций CDC
|
История предшествующей вакцинации |
График введения PCV13 и PPSV23 |
|
Нет или неизвестно |
Применение PCV13 с последующим через 8 недель PPSV23 #1. Применение PPSV23 #2 по крайней мере через 5 лет после PPSV23 #1. |
|
Одна доза PPSV23; ноль (zero) или неизвестная PCV13 |
Применение PCV13 по крайней мере через 1 год после PPSV23 #1. Применение PPSV23 #2 по крайней мере через 5 лет после PPSV23 #1 и по крайней мере через 8 недель после PCV13. |
|
Ноль или неизвестная PPSV23; одна доза PCV13 |
Применение PPSV23 #1 по крайней мере через 8 недель после PCV13. Применение PPSV23 #2 по крайней мере через 5 лет после PPSV23 #1. |
|
Одна доза PPSV23; одна доза ПКВ13 |
Применение PPSV23 #2 по крайней мере через 5 лет после PPSV23 #1 и по крайней мере через 8 недель после PCV13. |
|
Две дозы PPSV23; 0 или неизвестная PCV13 |
Применение PCV13 по крайней мере через 1 год после PPSV23 #2. |
|
· Ссылка:http:// www.immunize.org/catg.d/p3075.pdf
· AIIRD, аутоиммунные воспалительные ревматические заболевания; CDC, Centers for Disease Control and Prevention центры по контролю и профилактике заболеваний; PCV13, 13-валентная пневмококковая конъюгированная вакцина; PPSV23, 23-валентная пневмококковая полисахаридная вакцина.
|
|
Учитывая повышенный риск неинвазивных и инвазивных пневмококковых заболеваний у пациентов с AIIRD, наряду с хорошей эффективностью, иммуногенностью и благоприятным профилем безопасности пневмококковых вакцин в здоровом населении, а также в соответствии с настоящими рекомендациями CDC143 144 и ESCMID, следует настоятельно рассмотреть вопрос о проведении пневмококковой вакцинации для большинства пациентов с AIIRD. Пневмококковая вакцинация должна быть тщательно рассмотрена у пациентов с CAPS с учетом потенциального риска нежелательных явлений. Целевая группа не имеет оснований рекомендовать конкретную политику в отношении пневмококковых вакцин на основе имеющихся данных об эффективности, иммуногенности и безопасности имеющихся пневмококковых вакцин. Затраты на вакцины могут играть определенную роль в принятии решения о выборе вакцины.
Больные с AIIRD должны получать вакцинацию против столбняка в соответствии с рекомендациями для населения в целом. Пассивная иммунизация должна быть рассмотрена для пациентов, получающих терапию, разрушающую в-клетки.
Содержание этой рекомендации практически не изменилось (см. рекомендацию №7 в редакции 2011 года), за исключением перефразирования второго утверждения.
Ни в одном исследовании не оценивалась частота инфицирования столбняком после вакцинации. Гуморальный ответ на вакцинацию против столбняка тесно коррелирует с профилактикой заболевания и поэтому может использоваться в качестве показателя клинического исхода. В целом пациентам с AIIRD рекомендуется проводить вакцинацию против столбняка в соответствии с рекомендациями для населения в целом.
Пациенты с РА и СКВ демонстрируют удовлетворительную иммуногенность при вакцинации столбнячным анатоксином, сопоставимую со здоровым контролем. Это также справедливо для пациентов с РА на иммуносупрессивных препаратах, включая тех, кто лечился ритуксимабом 24 недели назад. Лечение белимумабом не влияло на способность пациентов с СКВ поддерживать титры антител к предыдущей иммунизации против столбняка. Несмотря на отсутствие данных об эффективности противостолбнячной анатоксиновой вакцины под влиянием терапии, разрушающей в-клетки, предполагается, что в этой ситуации эффективность снижается, на основе экстраполяции данных из других вакцин. Таким образом, пассивная иммунизация столбнячными иммуноглобулинами должна рассматриваться в случае высокого риска воздействия столбняка у пациентов, получающих в-клеточную терапию, согласно заключению экспертов.
Вакцины против гепатита А и гепатита В должны вводиться пациентам группы риска-в определенных ситуациях показана бустерная или пассивная иммунизация
Первоначальная рекомендация по вакцинации против HAV и HBV (№11 в версии 2011 года) была расширена в отношении показаний к бустерной или пассивной иммунизации в конкретных случаях. Данные о заболеваемости / распространенности HAV в AIIRD отсутствуют. Пациентам с AIIRD, подверженным риску заражения гепатитом А, рекомендуется проводить вакцинацию против гепатита А. К группе риска относятся пациенты с HAV-серонегативным синдромом, путешествующие в эндемичные страны или постоянно проживающие в них. Данные об эффективности вакцины отсутствуют, но существует сильная корреляция между концентрацией антител и серопротекцией против инфекции. Следует подчеркнуть, что, в отличие от сильной иммуногенности у здоровых людей, разовая доза вакцины HAV, по-видимому, не обеспечивает достаточной защиты у RA151 и пациентов, использующих иммуносупрессивные препараты. Поэтому рекомендуется повторная вакцинация против HAV через 6 месяцев и определение титров поствакцинальных антител. Если это невозможно, как в случае с путешественником в последний момент, следует знать, что пациент AIIRD не может быть защищен после однократной дозы вакцины HAV, и рассмотреть вопрос о пассивной иммунизации до конкретной поездки.
Исследования, проведенные в различных географических регионах по всему миру, показали переменную серологическую распространенность инфекции HBV среди пациентов AIIRD. Данные об эффективности вакцинации против гепатита В у больных AIIRD отсутствуют, однако считается, что концентрация антител хорошо коррелирует с защитой. Вакцинация против гепатита В была иммуногенной у большинства пациентов с AIIRD, хотя в двух небольших открытых исследованиях сообщалось о недостаточном гуморальном ответе на вакцину HBV у пациентов с AIIRD, получавших bDMARDs. Кроме того, высокодозная вакцинация против HBV не увеличила частоту гуморального ответа.
В соответствии с предыдущими рекомендациями вакцина против HBV должна вводиться только пациентам группы риска. К группе риска относятся пациенты с HBV-серонегативными заболеваниями, которые путешествуют или проживают в эндемичных странах, и пациенты с повышенным риском воздействия HBV (например, медицинский персонал, домашние контакты или сексуальные партнеры известных лиц с хронической инфекцией HBV, потребители внутривенных наркотиков, мужчины, имеющие половые контакты с мужчинами). В случае воздействия HBV (например, чрескожного (игольчатая палочка, разрыв, укус или пермукозальный) у невакцинированного пациента или пациента с недостаточным ответом на вакцину против HBV) в соответствии с рекомендациями CDC показана бустерная или пассивная иммунизация иммуноглобулином гепатита В.
Вакцинация против опоясывающего герпеса может быть рассмотрена у пациентов высокого риска с AIIRD.
Эта рекомендация осталась идентичной рекомендации №8 в версии 2011 года. Накопленные за последнее десятилетие фактические данные еще раз подтверждают эту рекомендацию.
Больные AIIRD имеют повышенный риск развития HZ по сравнению с общей популяцией, причем наибольший риск инфицирования отмечается у пациентов с воспалительным миозитом и СКВ всех возрастов. Живая аттенуированная вакцина HZ снизила риск HZ на 51% до 70% среди иммунокомпетентных лиц 50 лет и старше в двух рандомизированных слепых исследованиях. У пожилых пациентов с AIIRD, вакцинация вакциной HZ была связана со снижением частоты HZ в течение медианы наблюдения 2 лет, как сообщается в ретроспективном исследовании большой базы данных, включающем пациентов с иммунно-опосредованными заболеваниями (РА, пса, АС, псориаз, воспалительные заболевания кишечника (ВБК)). Этот эффект присутствует независимо от применения лекарств, в том числе bDMARDs. Вакцинация HZ обеспечивала защиту в течение примерно 5 лет среди пациентов с аутоиммунными заболеваниями. Кроме того, вакцина, по-видимому, была иммуногенной и безопасной в небольшой выборке SLE54 и у пациентов, получавших лечение ГК. Что касается безопасности, то вакцина была безопасной в течение 42 дней наблюдения, в том числе для пациентов, получавших биологические препараты. Введение вакцины HZ больным с активным РА ≥50 лет, получавшим МТХ, за 2-3 недели до начала приема тофациниба, было сообщено, что было безопасно и иммуногенно на 14 неделях следования. Отсутствуют крупных проспективных исследования, достаточно мощных для оценки безопасности этой живой аттенуированной вакцины.
На основании повышенных показателей инфицированности, эффективности в здоровом контроле и документально подтвержденной эффективности и безопасности в одном исследовании, включающем 463 541 пациента AIIRD, в том числе 633 пациента на bDMARDS (преимущественно блокаторы фактора некроза опухоли (ФНО)), живая аттенуированная вакцина HZ может быть рассмотрена у пациентов AIIRD. Эта вакцина предпочтительно вводится за 4 недели до начала bDMARDs или tsDMARDs, но не во время лечения bDMARDs или tsDMARDs. У пациентов с неопределенным воздействием ветряной оспы, оценка varicella zoster serostatus может быть рассмотрена до введения живой аттенуированной вакцины HZ для предотвращения первичной ветряной инфекции после вакцинации. Нет достаточного количества данных о долгосрочной защите и необходимости вакцинации бустера.
Важно отметить, что новая неживая рекомбинантная субъединица адъювантной опоясывающей вакцины под названием Shingrix была лицензирована в Европе с марта 2018 года и доступна в некоторых странах. Вакцина рекомендуется для взрослых в возрасте 50 лет и старше, включая пациентов с иммуносупрессией, и вводится в двух внутримышечных дозах с интервалом от 2 до 6 месяцев. Было показано, что Shingrix безопасен и более эффективен по сравнению с живой аттенуированной вакциной у пожилых людей. Безопасность и эффективность субъединицы опоясывающей вакцины еще не исследовались у больных AIIRD. Основываясь на том факте, что Shingrix является неживой вакциной, он может заменить живую аттенуированную вакцину у пациентов с AIIRD.
Вакцинации против желтой лихорадки следует вообще избегать у пациентов с AIIRD
Это новая формулировка рекомендации. Обоснованием для конкретного решения проблемы вакцинации против желтой лихорадки является тот факт, что поездки в эндемичный район для желтой лихорадки в Южной Америке и Африке стали популярными в европейских странах, и вопрос о вакцинации против желтой лихорадки у пациентов с AIIRD обычно поднимается. Была проведена дискуссия относительно сохранения рекомендации №12 от версии 2011 года, которая касалась путешествующих пациентов с AIIRD. Большинство членов группы согласились с тем, что предыдущая рекомендация № 12 носила слишком общий характер, рекомендуя вакцинировать пациентов с AIIRD в соответствии с общими правилами, за исключением отказа от живых аттенуированных вакцин. Добавление нового, хотя и ограниченного, опыта по введению вакцины пациентам с AIIRD привело к специальной рекомендации в отношении вакцины против желтой лихорадки.
Вакцина против желтой лихорадки — это живая аттенуированная вакцина. Разовая доза которого достаточна для обеспечения устойчивого иммунитета против желтой лихорадки. Первичные вакцины, как правило, развивают низкоуровневую виремию, которая уменьшается, поскольку антитела против желтого вируса иммуноглобулина M (IgM) развиваются от 4 до 7 дней после вакцинации и могут сохраняться в течение нескольких лет после вакцинации. Вакцина рекомендуется для людей, которые путешествуют или живут в районах, эндемичных по вирусу желтой лихорадки в Африке и Южной Америке.
В ходе совещания целевой группы было проведено обсуждение профиля безопасности первичной вакцинации против бустерной вакцинации. Примечательно, что бустерная вакцина была введена без осложнений 17 бразильским пациентам с РА, получавшим инфликсимаб и 31 бразильскому пациенту с AIIRD (РА, СКВ, ССК, АС), некоторые из которых получали bDMARDs с адекватной иммуногенностью в обоих исследованиях. Однако эти результаты не могут быть экстраполированы на лиц с ослабленным иммунитетом, впервые получающих вакцину против желтой лихорадки. Примечательно, что 34 французских путешественника с аутоиммунными заболеваниями, получавших ГКС (преднизолон или эквивалентная доза 7 мг / сут), были вакцинированы вакциной против желтой лихорадки с адекватной иммуногенностью через 6 месяцев после иммунизации, с более частыми умеренными или тяжелыми местными реакциями на вакцинацию, без серьезных побочных явлений.
Задача группы также обсудила возможность тестирования иммунитета к желтой лихорадке путем измерения серологических показателей (IgM и IgG, специфичных для желтой лихорадки) до запланированной вакцинации.
В заключение следует отметить, что пациенты с AIIRD в условиях иммуносупрессии должны избегать вакцинации против желтой лихорадки из-за риска индуцирования инфекции желтой лихорадки. Для пациентов с AIIRD, путешествующих в эндемичные страны, может быть рассмотрено отказ от иммуносупрессивной терапии, чтобы обеспечить безопасную вакцинацию или измерение серологии у ранее подвергшихся воздействию пациентов. Продолжительность удержания иммуносупрессивных средств должна быть основана на фармакокинетике каждого агента.
Пациенты с AIIRD, в частности больные СКВ, должны получать прививки против ВПЧ HPV в соответствии с рекомендациями для населения в целом
Рекомендация по вакцинации против ВПЧ (№9 в версии 2011 года) была изменена: вместо рассмотрения вакцины против ВПЧ для “отобранных” пациентов с AIIRD была изменена формулировка “пациенты с AIIRD, в частности пациенты с СКВ” и добавлена ссылка на общее руководство по населению. Основная причина такой модификации была основана на том, что основная масса данных по эпидемиологии ВПЧ у больных AIIRD базируется на исследованиях у пациенток с СКВ. Эта популяция особенно подвержена высокому риску заражения генитальной ВПЧ-инфекцией, включая серотипы высокого риска для дисплазии шейки матки. Несмотря на то, что до сих пор нет данных об эффективности вакцинации ВПЧ у больных СКВ, с 2010 года были опубликованы новые данные об иммуногенности вакцины у больных СКВ. В целом иммуногенность вакцины против ВПЧ была одинаковой у пациентов с СКВ и контрольной группой, без значимых сигналов о безопасности у пациентов с СКВ. В частности, озабоченность по поводу безопасности вакцины против ВПЧ была высказана на основе сообщений о случаях заболевания и серии случаев, связанных с возникновением аутоиммунных заболеваний после вакцинации против ВПЧ. Популяционные исследования последовательно показали, что квадривалентная вакцина против ВПЧ не была связана с увеличением частоты новых аутоиммунных заболеваний у девочек и женщин с уже существующими аутоиммунными заболеваниями. Поэтому, основываясь на настоящих данных, целевая группа согласилась с тем, что вакцинацию против ВПЧ следует поощрять для пациентов с AIIRD, уделяя особое внимание пациентам с СКВ, как это показано для населения в целом.
Иммунокомпетентные члены семьи пациентов с AIIRD должны поощряться к получению вакцин в соответствии с национальными рекомендациями за исключением пероральной полиовакцины
Эта рекомендация, в основном основанная на мнении экспертов, является новой и соответствует руководящим принципам международных обществ, таких как американское общество по инфекционным заболеваниям. Иммунокомпетентные лица, проживающие совместно с иммуносупрессивными пациентами, должны получать инактивированные вакцины, а также живые аттенуированные вакцины, такие как MMR, ротавирус, ветряная оспа и опоясывающий лишай, в соответствии с национальными руководящими принципами. Пероральной вакцины против полиомиелита следует избегать из-за риска передачи инфекции членам семьи с небольшим риском развития паралитического полиомиелита, ассоциированного с вакциной, у членов семьи с ослабленным иммунитетом. Пациенты с высоким уровнем иммунокомпетентности должны избегать использования подгузников младенцев, вакцинированных против ротавируса, по крайней мере в течение 4 недель после введения вакцины. Следует избегать контакта с лицами, у которых развиваются поражения кожи после вакцинации против ветряной оспы или опоясывающего лишая.
Живые аттенуированные вакцины следует избегать в течение первых 6 месяцев жизни у новорожденных от матерей, получавших биологические препараты во второй половине беременности
Поскольку IgG пересекает плаценту в течение третьего триместра, 190 анти-TNF биопрепаратов, кроме цертолизумаба пегола, обнаруживаются у новорожденных матерей, получавших биопрепараты до 6 месяцев после рождения. Исходя из этих данных, следует избегать применения живых аттенуированных вакцин в течение первых 6 месяцев жизни у новорожденных матерей, подвергшихся воздействию анти-ФНО-биопрепаратов во второй половине беременности. Несмотря на благоприятные данные об отсутствии переноса цертолизумаба в пуповинную кровь, она ограничена небольшим числом пациенток и нет опубликованных данных о живой вакцинации новорожденных матерей, получавших цертолизумаб во время беременности.
Смертельный случай диссеминированного туберкулеза у новорожденного, подвергшегося воздействию инфликсимаба и вакцинированного вакциной Bacillus Calmette–Guérin (BCG), подчеркивает важность недопущения живых аттенуированных вакцин, по крайней мере, в течение первых 6 месяцев жизни. В соответствии с пунктами EULAR, которые следует учитывать для использования противоревматических препаратов до беременности, а также во время беременности и лактации, дети, подвергшиеся воздействию биологических препаратов только до 22 недели, могут получать прививки по стандартным протоколам, включая живые вакцины. Дети, подвергшиеся воздействию биологических препаратов в конце второго и в течение третьего триместра, могут следовать программе вакцинации, но не должны получать живые вакцины в первые 6 месяцев жизни. Когда это возможно, измерение сывороточного уровня данного биологического вещества в организме ребенка может служить основой для принятия решения в пользу или против живой вакцины.
Обсуждение
В 2019 году обновление рекомендаций EULAR по вакцинации взрослых пациентов с AIIRD было разработано 21 экспертом, включая пациентов, ревматологов, иммунологов, специалиста по инфекционным заболеваниям и HPR, представляющих восемь стран. Первоначальный набор из 13 рекомендаций, опубликованных в 2011 году, был расширен и разделен на шесть всеобъемлющих принципов, за которыми последовали девять рекомендаций. Целевая группа EULAR определила всеобъемлющие принципы как универсальные для руководства вакцинацией в популяции AIIRD, причем первые два принципа сосредоточены на ответственности за оценку, обучение и осуществление индивидуальной программы вакцинации группой по лечению ревматологии, совместно с пациентами и с их согласия. В свете низкого уровня охвата вакцинацией населения AIIRD во всем мире, подчеркивая роль группы лечащих ревматологов в просвещении пациентов и других медицинских работников относительно преимуществ вакцин, следует улучшить охват вакцинацией. Следующие общие принципы были основаны на новых данных, касающихся эффективности, иммуногенности и безопасности вакцинации в условиях иммуносупрессивной терапии, в частности касающихся оптимальных сроков вакцинации, типа вакцины (неживая против живой аттенуированной) и активности основного заболевания на момент вакцинации. В соответствии с рекомендациями 2011 года, вакцинация должна быть в идеале проведена во время ремиссии заболевания, до запланированной иммуносупрессивной терапии. Неживые вакцины, по-видимому, являются безопасными и достаточно иммуногенными, когда они предоставляются в рамках большинства иммуносупрессивных методов лечения, за исключением истощения в-клеток и, вероятно, терапии CTLA4-Ig.
В отличие от предыдущей версии, в нынешних рекомендациях предлагается более гибкий подход к введению некоторых живых аттенуированных вакцин, то есть MMR и HZ. Новые, но ограниченные данные, полученные от педиатрических пациентов с ИИИРД в отношении ММР и взрослых пациентов с AIIRD в отношении HZ, показывают эффективность и иммуногенность обеих вакцин у пациентов, получавших лечение в рамках csDMARDs и bDMARDs.
Основной набор рекомендаций был частично изменен по сравнению с вариантом 2011 года, в то время как для большинства рекомендаций сила рекомендаций осталась неизменной, за исключением Гц. Как гриппозные, так и пневмококковые прививки в настоящее время рекомендуются большинству пациентов с AIIRD в отличие от всех пациентов, подчеркивая важность индивидуальной оценки риска инфицирования в каждом случае. Например, риск заболеть гриппом у молодого пациента с АС, получающего только нестероидный противовоспалительный препарат (НПВП), не эквивалентен пациенту с активной СКВ в условиях иммуносупрессии. Для пневмококковой вакцинации была представлена и обсуждена стратегия prime-boost (PCV13 с последующей вакцинацией PPSV23), новый подход, адаптированный CDC для иммуносупрессивных пациентов. Обсуждалось отсутствие данных о внедрении и эффективности данного режима у пациентов с AIIRD. Выбор и последовательность пневмококковой вакцинации должны соответствовать местным рекомендациям. Рекомендации, касающиеся столбняка, HAV и HBV, были расширены, чтобы включить пассивную иммунизацию для отдельных случаев. В случае вакцинации HZ достаточное количество новых качественных клинических данных, накопленных за последнее десятилетие, позволило обновить силу рекомендации до B С C-D в предыдущей версии. Кроме того, были добавлены и обсуждены новые пункты, касающиеся вакцинации окружающей среды пациента, включая членов семьи и новорожденных матерей, получавших биологические препараты во время беременности. Рекомендации относительно вакцины BCG, которая больше не рекомендуется пациентам с AIIRD, подход к гипоспленовым / аспленовым пациентам и путешественникам с AIIRD были опущены из настоящей версии. Вместо этого был добавлен отдельный пункт, касающийся вакцинации против желтой лихорадки у пациентов, путешествующих в эндемичные районы.
Целевая группа обсудила текущие противоречия в области вакцинации. В эпоху персонализированной медицины существует острая потребность в инструменте для оценки риска инфицирования на индивидуальной основе. Инструмент, предсказывающий вероятность заражения серьезными инфекциями в течение определенного периода времени, укажет пациентов, которые с наибольшей вероятностью выиграют от профилактических мер, и соответственно адаптирует соответствующую программу вакцинации и антимикробной профилактики. На сегодняшний день в области РА разработаны три системы оценки серьезного инфекционного риска, основанные на когорте Рочестера, крупных административных базах данных США и немецком регистре биологических препаратов. Возраст пациента, его функциональное состояние, тяжесть и активность заболевания, сопутствующие заболевания, предшествующие инфекции и лечение рассматривались как факторы, влияющие на будущий риск инфекций, причем каждая система подсчета баллов использовала различную модель оценки риска. Примечательно, что оценка Рочестера не включала лечение bDMARDs или небиологическими DMARDs в отличие от двух других оценок. Таким образом, учитывая различия в системах подсчета очков, прямое сравнение между ними невозможно. Тем не менее, эти оценки представляют собой важный шаг на пути к персонализированной медицине в отношении профилактики инфекционных заболеваний и предотвращения “ненужной” вакцинации у пациентов с низким риском инфицирования. Необходимы дальнейшие исследования для оптимизации индивидуальной стратификации риска, что позволит врачам в ближайшем будущем персонализировать рекомендации по вакцинации.
В ходе работы целевой группы были, в частности, обсуждены следующие темы: HZ вакцинация против СКВ среди молодежи и безопасность вакцины против ВПЧ. В настоящее время вакцина HZ одобрена Управлением по контролю за продуктами и лекарствами США (FDA) и Европейским агентством по лекарственным средствам (EMA) только для лиц в возрасте 50 лет и старше. Учитывая значительно повышенный риск инфицирования HZ и сопутствующих заболеваний, включая риск диссеминированного заболевания, в детской / молодой популяции СКВ, для оценки эффективности и безопасности вакцины в этой уязвимой популяции требуется клинических исследований. Эта тема может быть решена в будущем с введением неживой вакцины против HZ.
Обеспокоенность была выражена после публикации нескольких сообщений о случаях заболевания и серии сообщений о начале и обострении СКВ после вакцинации против ВПЧ и о частоте вспышек до 30% у вакцинированных пациентов с СКВ в открытом исследовании. С другой стороны, крупномасштабные исследования не показали увеличения заболеваемости аутоиммунными заболеваниями среди молодых женщин, вакцинированных против ВПЧ, а исследование контроля случаев вакцинации против ВПЧ у больных СКВ показало аналогичную частоту вспышек как в вакцинированных, так и в невакцинированных группах . Эти доклады привели целевую группу к выполнению настоящей рекомендации.
В заключение следует отметить, что за последние годы значительно возросли данные о безопасности, иммуногенности и эффективности вакцинации пациентов с AIIRD, что позволило скорректировать и усовершенствовать рекомендации и рекомендации врачей по применению прививок при AIIRD.


