Josef S Smolen1,2, Robert Landewé3,4, Johannes Bijlsma5, Gerd Burmester6, Katerina Chatzidionysiou7, Maxime Dougados8, Jackie Nam9, Sofia Ramiro10, Marieke Voshaar11, Ronald van Vollenhoven3,4, Daniel Aletaha1, Martin Aringer12, Maarten Boers13, Chris D Buckley14, Frank Buttgereit6, Vivian Bykerk15,16, Mario Cardiel17, Bernard Combe18, Maurizio Cutolo19, Yvonne van Eijk-Hustings20, Paul Emery10, Axel Finckh21, Cem Gabay21, Juan Gomez-Reino22, Laure Gossec23, Jacques-Eric Gottenberg24, Johanna M W Hazes25, Tom Huizinga11, Meghna Jani26, Dmitry Karateev27, Marios Kouloumas28,29, Tore Kvien30,Zhanguo Li31, Xavier Mariette32, Iain McInnes33, Eduardo Mysler34, Peter Nash35, Karel Pavelka36, Gyula Poór37, Christophe Richez38, Piet van Riel39, Andrea Rubbert-Roth40, Kenneth Saag41,Jose da Silva42,Tanja Stamm43, Tsutomu Takeuchi44, René Westhovens45,46, Maarten de Wit47, Désirée van der Heijde10
Данные об авторах
1Division of Rheumatology, Department of Medicine 3, Medical University of Vienna, Vienna, Austria
22nd Department of Medicine, Hietzing Hospital, Vienna, Austria
3Amsterdam Rheumatology & Immunology Center, Amsterdam, The Netherlands
4Zuyderland Medical Center, Heerlen, The Netherlands
5Department of Rheumatology and Clinical Immunology, University Medical Center Utrecht, Utrecht, The Netherlands
6Department of Rheumatology and Clinical Immunology, Charité—University Medicine Berlin, Free University and Humboldt University Berlin, Berlin, Germany
7Rheumatology Department, Karolinska Institute, Stockholm, Sweden
8Rhumatologie B, Hopital Cochin, Paris, France
9NIHR Leeds Musculoskeletal Biomedical Research Unit, Leeds Teaching Hospitals NHS Trust and Leeds Institute of Rheumatic and Musculoskeletal Medicine, University of Leeds, Leeds, UK
10Department of Rheumatology, Leiden University Medical Center, Leiden, The Netherlands
11Department of Psychology, Health and Technology, University of Twente, Enschede, The Netherlands
12Division of Rheumatology, Medizinische Klinik und Poliklinik III, Universitätsklinikum Carl Gustav Carus, Technische Universität Dresden, Dresden, Germany
13Department of Epidemiology and Biostatistics, VU University Medical Center, Amsterdam, The Netherlands
14Birmingham NIHR Wellcome Trust Clinical Research Facility, Rheumatology Research Group, Institute of Inflammation and Ageing (IIA), University of Birmingham, Queen Elizabeth Hospital, Birmingham, UK
15Department of Rheumatology, Hospital for Special Surgery, Weill Cornell Medical College, New York, New York, USA
16Rebecca McDonald Center for Arthritis & Autoimmune Disease, Mount Sinai Hospital, University of Toronto, Toronto, Ontario, Canada
17Centro de Investigación Clínica de Morelia SC, Michoacán, México
18Rheumatology Department, Lapeyronie Hospital, Montpellier University, UMR 5535, Montpellier, France
19Research Laboratory and Division of Clinical Rheumatology, University of Genoa, Genoa, Italy
20Department of Patient & Care and Department of Rheumatology, University of Maastricht, Maastricht, The Netherlands
21Division of Rheumatology, University Hospitals of Geneva, Geneva, Switzerland
22Fundación Ramón Dominguez, Hospital Clinico Universitario, Santiago, Spain
23Department of Rheumatology, Sorbonne Universités, Pitié Salpêtrière Hospital, Paris, France
24Institut de Biologie Moléculaire et Cellulaire, Immunopathologie, et Chimie Thérapeutique, Strasbourg University Hospital and University of Strasbourg, CNRS, Strasbourg, France
25Erasmus MC, University Medical Center Rotterdam, Rotterdam, The Netherlands
26Arthritis Research UK Centre for Epidemiology, Centre for Musculoskeletal Research, University of Manchester, Manchester, UK
27
V.A. Nasonova Research Institute of Rheumatology, Moscow, Russian Federation
28European League Against Rheumatism, Zurich, Switzerland
29Cyprus League against Rheumatism, Nicosia, Cyprus
30Department of Rheumatology, Diakonhjemmet Hospital, Oslo, Norway
31Department of Rheumatology and Immunology, Beijing University People’s Hospital, Beijing, China
32Assistance Publique-Hôpitaux de Paris, Hôpitaux Universitaires Paris-Sud, Université Paris-Sud, INSERM U1184, Center for Immunology of viral Infections and Autoimmune Diseases (IMVA), Le Kremlin Bicêtre, France
33Institute of Infection, Immunity and Inflammation, College of Medical, Veterinary and Life Sciences, University of Glasgow, Glasgow, UK
34Organización Médica de Investigación, Buenos Aires, Argentina
35Department of Medicine, University of Queensland, Queensland, Australia
36Institute of Rheumatology and Clinic of Rheumatology, Charles University, Prague, Czech Republic
37National Institute of Rheumatology and Physiotherapy, Semmelweis University, Budapest, Hungary
38Rheumatology Department, FHU ACRONIM, Pellegrin Hospital and UMR CNRS 5164, Bordeaux University, Bordeaux, France
39Department of Rheumatology, Bernhoven, Uden, The Netherlands
40University of Cologne, Cologne, Germany
41Division of Rheumatology, Department of Medicine, University of Alabama at Birmingham, Birmingham, Alabama, USA
42Serviço de Reumatologia, Centro Hospitalar e Universitário de Coimbra Praceta Mota Pinto, Coimbra, Portugal
43Section for Outcomes Research, Center for Medical Statistics, Informatics, and Intelligent Systems, Medical University of Vienna, Vienna, Austria
44Keio University School of Medicine, Keio University Hospital, Tokyo, Japan
45Department of Development and Regeneration, Skeletal Biology and Engineering Research Center, KU Leuven, Leuven, Belgium
46Department of Rheumatology, University Hospitals Leuven, Leuven, Belgium
47Department Medical Humanities, VU Medical Centre, Amsterdam, The Netherlands
Профессор Йозеф Smolen, Отдел ревматологии, Департамент медицины 3, медицинский университет Вены, Waehringer Guertel 18-20, A-1090 Вены, Австрия;
josef.smolen@wienkav.at,
josef.smolen@meduniwien.ac.at
Аннотация
Последние знания по ревматоидный артрит (РА) потребовали обновления рекомендаций управления Европейской лиги против ревматизма (EULAR) РА. Большой международной целевой группы на основе решений на доказательствах 3 систематических обзорах литературы, разработку 4 всеобъемлющих принципов и 12 рекомендаций (против 3 и 14, соответственно, в 2013 году). Эти рекомендации касаются обычных синтетических conventional synthetic (cs) болезнь модифицирующие противоревматические препараты disease-modifying antirheumatic drugs (DMARDs) (метотрексат (MTX), leflunomide, сульфасалазин); глюкокортикоидов (GC); биологические (b) DMARDs (фактор некроза опухоли (ФНО)-ингибиторы (adalimumab, certolizumab pegol, этанерцепт, golimumab, инфликсимаб), abatacept, Ритуксимаб, tocilizumab, clazakizumab, sarilumab и sirukumab и biosimilar (bs) DMARDs) и синтетические targeted synthetic (ts) DMARDs (Janus киназа Janus kinase (Jak) ингибиторы tofacitinib, baricitinib). Монотерапия, комбинированная терапии, стратегии лечения (treat-to-target) и целей устойчивой клинической ремиссии (как определено в Американский колледж из ревматологии-(ACR)-EULAR логическое или индекс критерии index criteria) или низкой активности болезни обсуждаются. Затратные аспекты были приняты во внимание. Как первая стратегия, Целевая группа рекомендует MTX (стремительной эскалации rapid escalation до 25 мг/неделю) плюс краткосрочные GC, направленный на > 50% улучшения в течение 3 и достижения цели в течение 6 месяцев. Если это не удается стратификация рекомендуется. Без неблагоприятных прогностических маркеров, переключение на — или добавление — другой csDMARDs (плюс краткосрочные GC) предлагается . При наличии неблагоприятных прогностических маркеров (аутоантител, высокая болезнь активность, ранние эрозий, провал 2 csDMARDs) любой bDMARD (нынешняя практика) или Як ингибитор следует добавить к csDMARD. Если это не удается, рекомендуется любой другой bDMARD или tsDMARD. Если пациент находится в устойчивой ремиссии, bDMARDs может быть tapered (конические, сведение на нет). Для каждой рекомендации предоставляются уровни доказательств и Целевой соглашения, оба главным образом очень высокий. Эти рекомендации намерены информирования ревматологов, пациентов, ревматологии национальных обществ, больница должностных лиц, учреждения социального обеспечения и регуляторы EULAR в самый последний консенсус по управлению РА, направленные на достижение лучших результатов.

За последние 30 лет резко(драматично) изменилась лечение ревматоидного артрита (РА). Тогда, только несколько терапевтических агентов существовали, которые были минимально или не являлись эффективными, из-за токсичности и тот факт, что оптимальной дозировки и начало действия были не еще выяснен для некоторых агентов. Доступные методы лечения применялись поздно, а не в начале течения заболевания. Сформировалась понятие клиники раннего артрита, и эти успехи подпитывали переоценку критериев классификации, которые актуальны так как сосредоточены главным образом на длительности болезни. Терапевтические цели еще не были определены, поскольку облегчение симптомов, как представляется, является наиболее важной целью и концепция направленна на положении о заболевании как ремиссии или низкой активности болезни была в лучшем случае желательна.
На сегодняшний день мы располагаем многочисленными эффективными агентами. Среди обычных синтетических (cs) болезнь модифицирующие противоревматические препараты (DMARDs), мы адоптировали метотрексат (MTX), на его оптимальные использования, как якорное лекарство (anchor drug); кроме того, целый ряд биологических (b) DMARDs были утверждены, совсем недавно последовало утверждения первых целевых синтетических (ts) DMARD, и новые которые разрабатываются (во многих странах). Сегодня, новые критерии классификации РА содействовать выявлению больных на ранней стадии в их течения болезни, чем до этого и рекомендации были разработаны для лечения пациентов с РА через стратегические алгоритмы для оптимального результата, независимо от типов доступных методов лечения.
Ограниченное количество мер оценить ответ в клинических испытаниях и исследовать активности болезни в клинической практике широко используется и американского колледжа ревматологии (ACR) и Европейской лиги против ревматизма (EULAR) совместно разработали новые определения для ремиссии, которые обеспечивают оптимальный клинических исходов и может быть достигнуто в значительной части пациентов в исследованиях и практике. Достижения ремиссии по этим критериям, на основе индекса или Boolean, предотвратит разрушение суставов или по крайней мере прогрессирования повреждения суставов независимо от остаточной субклинической формы изменения, оптимизировать физические функции, улучшить качество жизни и продуктивность работы и снизить риски сопутствующих заболеваний.
В связи с недавней эволюцией контроля результатов лечения, основанных на доказательствах интерес к чисто симптоматическим препаратам значительно снизилась сегодня и болезнь модификация disease modification стала ключевой атрибут всех современных препаратов и лечения. Тем не менее симптоматические средства, а также меры физической, психологической поддержки и хирургии могут и имеют место в общем лечении РА. Однако, болезнь модификация является основой лечения РА и представляет собой смесь характеристик: облегчение признаков и симптомов; нормализация — или по крайней мере важным улучшением — нарушение физические функции, качества жизни и социальных и трудовых возможностей; и — как главной отличительной чертой DMARDs по сравнению с симптомами агентов — ингибирование структурных повреждений хряща и кости. Таким образом регистрация ингибирования прогрессирования повреждения при рентгенографии остается ключевой результат для классификации препарата как DMARD, так как рентгенограммах можно отображать костные и повреждение хряща и доказали чувствительность обнаруживать изменения даже при краткосрочных интервалах и при очень низких уровнях общей прогрессии в популяции. Быстрое достижение целевой конечной точки теперь имеет решающее значение, и для достижения цели лечения ремиссии или наименее низкой активности болезни в сроки от 6 месяцев, по крайней мере 50% клинического улучшения в течение 3 месяцев желательно.
С повышением требованием к уходу и результатам, лечение РА становится все более сложной в течение последнего десятилетия. Несмотря на наличие многих эффективных агентов, стратегии лечения, которые были разработаны и результаты оценок, которые позволяют эффективной последующей деятельности высокая стоимость терапии ограничивают широкое использование этих терапевтических подходов, создавая в значительной степени неравенства. Таким образом рекомендации управления на подход в лечении пациентов с РА стали все более полезными в предоставлении врачей, пациентов, страховщиков, регулирующими органами и другими поставщиками медицинских научно обоснованных рекомендаций, поддержке мнения экспертов участвует во многих из этих новых событий. Действительно EULAR недавно обновлены стандартизированные оперативные процедуры по разработке рекомендаций, которые включают аспекты расходов помимо учета для оценки доказательств и мнение эксперт.
EULAR разработал первый набор рекомендаций по управлению РА с DMARDs в 2010 году и обновление их в 2013 году. Они первоначально были основаны на доказательства, представленные пятью (2010) и 3 (2013) систематической литературе обзоры systematic literature reviews (SLRs). EULAR рекомендации были широко использованы. Они были переданы национальной ревматологии обществ и региональных лиг сообщить в разработке их собственных рекомендаций (например, канадский, французский, немецкий, мексиканская, Азиатско Тихоокеанского лига ассоциаций ревматологии (APLAR), Пан американской лиги Ассоциации ревматологов (PANLAR)), а также регулирующих органов.
В соответствии с нашим подходом для предоставления рекомендаций, на основе последних свидетельств, мы продолжали оценивать литература на клинические испытания новых агентов, новую информацию об установленных лекарств, новых стратегических исследований, новые взгляды на результаты оценки и новые идеи, связанные с исследовательской повестки дня за последние 3 года. Обилие новой информации побудило нас сейчас дальнейшее обновление EULAR рекомендации для управления РА с DMARDs.
Методы
После утверждения Исполнительным комитетом EULAR, руководитель (JSS) и методиста (RL) приглашены Руководящий комитет и целевую группу для работы на этом обновлении EULAR рекомендации для управления РА. Рекомендации 2010 и их 2013 обновление оригинальной EULAR стандартизировали оперативные процедуры для дальнейшей разработки рекомендации; Обновление 2016 вслед за недавно измененный вариант соответствовал этим стандартам, которые также предполагают соблюдение руководящих Appraisal of Guidelines for Research & Evaluation (AGREE), содержащихся в его обновленной версии (AGREE II).
Руководящий комитет
Руководящий комитет включал семь ревматологов, один представитель пациента и трех стипендиатов. Эта группа изначально разработаны вопросы исследования для трех SLRs. Эти SLRs сосредоточены на (i) эффективности синтетических (s) DMARDs (в виде монотерапии или в комбинации терапии, включая csDMARDs и ts DMARDs) и глюкокортикоидов (GC); (ii) эффективность bDMARDs (как монотерапии или в сочетании с csDMARDs) и (iii) аспекты безопасности sDMARDs и биологических (b) DMARDs. С этой целью оригинальный SLRs полученные в 2013 году служил в качестве отправной точки и обновленную информацию о литературе, опубликованные в период между 2013 и 2016 была выполнена. Новая информация о стратегии лечения также оценивалась в настоящей SLRs. формальных экономических анализов не были выполнены, но стоимость аспекты рассматривались на протяжении всего процесса с учетом текущего состояния подходов к выработке рекомендаций, в EULAR предыдущих SLR по аспектам расходов в контексте DMARD терапии и появлением биосимиляров. Три стипендиатов ревматологии (KC, JN, SR) выполняется SLRs (и проверил работу друг друга) анализировали существующие публикации базы данных рандомизированных контролируемых испытаний для эффективности и данные реестра для обеспечения безопасности, а также оценки недавних EULAR и ACR тезисов конгресса. Резюме выводов Summary-of-findings (SoF) таблицы были созданы и уровни доказательств levels of evidence (LoE) были определены с использованием стандартов Оксфордский центр доказательной медицины. Три SLRs, информировали Целевую группы и подробное описание методов их публикуются отдельно.
SoFs SLRs были представлены Руководящему комитету, который сформулировал предложение для обновления рекомендаций, основываясь на этой информации. Данные SLR и предложения Руководящего комитета были впоследствии представлены для всей целевой группы для дальнейшего обсуждения и в конечном итоге развития обновленные рекомендации.
Целевая группа
Целевая группа состояла из 50 человек, включая членов Руководящего комитета. Среди целевой группы входили три пациента, двух специалистов в области здравоохранения и двух делегатов молодых ревматологов EULAR сети новых Eular сети (EMEUNET). Ревматологов были все опытные в лечении РА и наиболее часто участвовали в клинических испытаниях; Кроме того, некоторые из них имели опыт ведения реестров пациентов их стран или в различных аспектах результатов исследований. Клиницисты и организаторы здравоохранения все имели опыт в консенсусе мероприятий, как и большинство ревматологов. Поскольку мы также пожелал для работы Целевой группы быть информированы ревматологами из других регионов мира, помимо широкого представительства из 14 европейских стран, 2 коллеги из Азии, 1 из Австралии, 2 из Латинской Америки и 2 из Северной Америки были приглашены принять участие. Некоторые из них активно участвовала в разработке документов их региональных лиг и/или национальных обществ. Все члены Целевой группы объявил их потенциальные конфликты интересов перед началом процесса.
Целевая группа согласилась на нескольких основных соображений авансом. Во-первых, все рекомендации, которые необходимо обсудить в контексте новых доказательств; где было никаких новых доказательств, затем бывший доказательная база. Во-вторых, любой из предыдущих рекомендаций (4 Общие принципы и рекомендации 14) можно сохранить как они были представлены в версии 2013, поправками, смещается в последовательности или удалены. В третих, препараты, которые не являются (пока) одобрил в Европе, но используется в другом месте в мире, или препараты, которые еще не прошел оценки регулирования, но для которых доказательства от клинических испытаний был доступен, могут быть рассмотрены в рекомендациях для некоторых ожидается эффект в клинической практике, со всеми соответствующими оговорками. Наконец было достигнуто согласие, что все рекомендации 2013, которые были либо подкрепляется новых доказательств или по которым не хватало информации, должны быть включены как ранее сформулированы, если некоторые компоненты теперь считаются неуместными.
После представления результатов SLR и Руководящего комитета предложения о внесении поправок в рекомендации Целевая группа была разделена на четыре контактных групп. Одна группа рассмотрела bDMARDs, второй группы csDMARDs, третий tsDMARDs и четвертый GC; все группы предложил проект формулировок для всей целевой группы соответствующих рекомендаций. В каждом из этих контактных групп были рассмотрены аспекты безопасности.
Поиск консенсуса
Представители каждой прорывной группы сообщили результаты соответствующих обсуждений и представил предложения в отношении формулировки отдельных рекомендаций для всей целевой группы. После этого состоялся процесс голосования.
Общепрограммной принцип или рекомендации для заключительного документа без дальнейших изменений требуется большинство 75% голосов в первом туре. Если этот результат не был достигнут, соответствующих текст был изменен и подвергается второй тур голосования, для которой требовалось большинство в 67%. Если это голосование не было успешным, текстовые изменения были предложены дополнительные пока ≥50% не было достигнуто. Рекомендации представлены как наконец на голосование. Результаты соответствующих последнего голосования представлены как процент голосующих членов. Примечания по содержание обсуждений и рассуждение за каждое решение, должен быть представлен в комментарии, сопровождающие их отдельных элементов. По различным причинам не каждый член Целевой группы присутствовал в зале на протяжении всей встречи, и, следовательно, там были небольшие вариации в количестве голосов. Однако, в каждый момент времени> 90% членов участвовали в бюллетенях.
После очные встречи, рекомендаций, как это было согласовано Рабочей группой, были подвергнуты анонимный голосования (по электронной почте) на уровнях соглашения (LoA). Каждая рекомендация получил балл по шкале 0-10, 0 означает нет соглашение вообще и 10 абсолютный соглашения. В ходе этого процесса через несколько недель после совещания, один человек вышли из целевой группы, потому что включение csDMARD комбинированной терапии в рекомендации не нашли большинство во время процесса предыдущего голосования. Этот коллега присутствовал и проголосовали на протяжении очные встречи и соответствующих голосов по всем рекомендациям приходилось соответственно, но в конечном итоге лицо отказалось от авторства и голосование не учитывалось в LoA.
Проект манускрипта был направлен всем членам Целевой группы за их комментариями. После включения этих замечаний он был представлен EULAR Исполнительному комитету для рассмотрения и утверждения; в это время он был вновь направлен членам Целевой группы. Заключительные замечания были получены от членов Целевой группы и Исполнительного комитета и рассмотрены в рукописи, который был затем представлен с одобрения Исполнительным комитетом EULAR.
Результаты
Общие аспекты
Как прежде, 2016 обновление рекомендаций управления EULAR РА отражает баланс клинических, функциональные и структурные эффективность, безопасность, затраты и пациенты восприятие как воспринимаемо целевой группой. В общей формулировке рекомендаций были рассмотрены аспект лекарственной токсичности, но данные представлены только в безопасности SLR , поскольку предполагается, что назначают известно о безопасности информации, представленной в производителей вкладыши различных агентов. Кроме того, EULAR разработал серию документов, касающихся безопасности аспектов РА лекарств, и различных других изданий рассматривали эти аспекты. В частности, как это также было предложено безопасности SLR, основные риски и bDMARDs (также tsDMARDs) связано с инфекциями, и недавно были разработаны рекомендации по вакцинации, а также оценка, позволяющая рассчитать риск инфекции у больных подвержены bDMARDs. Для всех лекарств, обсуждаемые в этом документе, резюме документа характеристики продукта предоставляет ценную информацию о рисках, побочные эффекты и необходимость мониторинга. Приведенные здесь рекомендации никоим образом не должно толковаться как допускающее отступления от этой информации. В любом случае, когда токсичности является серьезной проблемой, конкретное предупреждение предоставляется в рамках соответствующей рекомендации или сопровождающие комментарии. Примечание, три SLRs, а также текст сопровождающие каждый элемент должны рассматриваться как неотъемлемая часть этой рекомендации. Индивидуальный ключевые точки представляют сокращенный выводы из обсуждений и, как таковой, не охватывают все аспекты, связанные с конкретной темы; напротив, такие аспекты освещены более подробно в соответствующих пояснительной части в разделе результаты.
При классификации DMARDs, Целевая группа придерживается ранее использовавшихся номенклатура как показано в
таблице 1. В таблице 1 также обеспечивает Глоссарий терминов, используемых в рекомендациях. Целевая группа не проводится различия между ранней и установленным РА относительно рекомендации виды лекарств, но скорее выделить этапы процесса лечения путем дифференциации между пациентами, которые «наивны» любой DMARD терапии, пациенты, которые имели недостаточный отклик insufficient response (IR) на первоначального курсы initial course(s) csDMARDs и тех, кто имел IR bDMARDs. Существует в настоящее время никаких доказательств для дифференциальных ответов, исключительно на основании продолжительности заболевания, когда различия основываются на оценке ущерба из-за задержки лечения. Действительно испытания на MTX-наивно пациентов с РА отобранных по различные болезни длительности, которая колеблется от нескольких месяцев до нескольких лет, без заметных различий по результатам на косвенные сравнения. Однако, Целевая группа проводит различие между ранним и установленным РА с точки зрения целевых результатов (см. рекомендацию 2). Целевая группа также учитывал прогностические факторы (
Таблица 1), которые имеют аналогичные прогностической силой независимо от длительности заболевания. В примечании, рекомендации по управлению ранней артрита, включая недифференцированные артрит, были недавно обновлены. Настоящие рекомендаций касаются лечению больных с РА от момента установления его диагноза и не доказанному РА или недифференцированному артритам.
Таблица 1
Словарь терминов и определений (Глоссарий и дефиниции)
| Термин |
определение |
| Слабые прогностические факторы |
▶ средняя (после csDMARD терапии) после высокой степени активности после комплексных мер▶Высокие уровни остро фазовых реагентов
▶Высокое число припухших суставов
▶ Присутствие РФ и/или АЦАТ, особенно высокого уровня
▶Комбинация указанного выше
▶Наличие ранних эрозий
▶Неэффективность двух или более csDMARDs |
| Низкие дозы глюкокортикоидов |
▶ ≤ 7,5 mg/day (эквивалент преднизолона) |
| Намерения к снижению терапииСнижение на нет(Tapering)
Перерыв, прекращение |
▶ Обычно снижение дозы лекарств или увеличение интервала между приемами(“spacing”)
▶Может включать прекращение (Тапперинг до 0), но потом только после медленного снижения
Прекращение приема специфических лекарств |
| Статус активности болезниРемиссия
Низкая активность болезни
Средняя, высокая активность болезни |
ACR-EULAR Boolean или дефиниция индекса ремиссии
Низкая активность статуса болезни в соответствии с утвержденными комплексными критериями активности болезни, включая суставной счет
Соответствующий статус активности болезни оцененный по комплексной активности болезни с суставным счетом |
| Терминология DMARDСинтетические DMARDs
Биологические DMARDs
|
▶ стандартные синтетические DMARDs (cs DMARDs)▶Таргетные синтетические DMARDs (ts DMARDs)
▶ Биологические оригинальные(авторские) DMARDs (bo DMARDs)
▶Биосимиляры DMARDs (bs DMARDs) |
Например, МТ, лефлюномид, сульфасалазин, гидрохлорохин
Например, тофацитиниб, баницитиниб |
ACPA, антицитрулиновые протеина антитела; ACR, американского коллегия ревматологии; DMARDs, Болезнь модифицирующие противоревматические препараты; EULAR, Европейская Лига против ревматизма; РФ, ревматоидный фактор.
Table 1
Glossary and definitions
 Общие принципы
Общие принципы
Как и в предыдущих версиях Целевая группа одобрила представление общих принципов для лечения больных с РА как общепрограммной (
Таблица 2). Их природа настолько универсален, что не было никаких основывать их на специфических поисках или LoE, но в то же время Группа считает, что важно сообщать о них как основы, на которых были основаны фактические рекомендации. Однако хотя все три бывших всеобъемлющих принципа были сохранены как было сформулировано в 2010 году, Целевая группа добавила четвертое как основополагающий принцип В.
- Лечение больных с РА должна быть направлена на лучшую заботу и должны основываться на общей решение между пациентом и ревматолог. Этот принцип остается неизменной, его текстовые данные и на его место в качестве пункта A, видное место в рамках рекомендаций. Совместного принятия решений между пациентом и ревматолог включает в себя все аспекты этого заболевания: информация о болезни и ее риски, методы оценки болезней, решения по терапевтической цели и потенциал средства для достижения цели, разработка плана лечения и обсуждение преимуществ и рисков индивидуальной терапии. Эти аспекты также детализированы в рекомендациях по стандартам медицинской помощи. Естественно, «лучший уход» ссылается на рекомендации, представленные здесь и по сути «разделяет решение» относится ко всех личным рекомендациям. С этой целью также качественные показатели были разработаны совсем недавно.
- Решения по лечению основаны на активности болезни и других пациентов факторов, таких как прогрессирование структурные повреждения, сопутствующих заболеваний и вопросы безопасности. Это новый принцип. Это вытекает из предыдущей рекомендации 14, последний пункт в 2013 версии, которая была сочтена текущей целевой группой для представления как центральным и самоочевидным правилом любого терапевтического подхода что он должен стать всеобъемлющим принципом, предпочтительней рекомендации. Действительно с учетом этих соображений, уровень доказательств этой рекомендации был довольно низким в 2013 году. Снятие этого пункта из рекомендаций вызвало некоторые дискуссии. Особенно у больных выдвинувших в окончательный перечень рекомендаций предпочтение перехода от элементов на факторы, связанные с пациента для перехода к пациент- предпочтениям и пациент- аспектам при лечении РА. Однако в надежде, что этот пункт даже выиграет больше от того что является общим принципом , чем рекомендация, которую вряд ли когда-либо изучить во всех его тонкости, преобладали до такой степени, что принцип B был единогласно принят (Таблица 2).
- Ревматологи являются специалистами, которые прежде всего должны заботиться о больных с РА. Первоначально представлен в качестве пункта B, формулировке этот принцип не был изменен. Интерес в 2010 году это был даже представлен как общепрограммный принцип А. Однако за последние годы, было признано, что совместного принятия решений и соображений пациента факторов должна получить признание. Позиционируемый как A, B или C, этот элемент подчеркивает, важность специального ухода за таким сложным заболеванием, как РА. Существует убедительные доказательства того, что находится на попечении ревматолога выгодно для пациентов с точки зрения раннего начала терапии, предотвращение ущерба и снижение хирургических процедур. Кроме того, ревматологи имеют самые глубокие опыт относительно использования csDMARDs и bDMARDs. Это включает в себя профили неблагоприятных событий этих препаратов, а также понимание и опыт работы с сопутствующими заболеваниями при РА. Таким образом ревматологов может обеспечить лучший уход в соответствии с пунктом A, в смысле целостного подхода. Аргументация термин «главным образом» подробно обсуждался в предыдущих версиях рекомендаций и касается соображений междисциплинарных ухода, включая специальности медсестры и тот факт, что в некоторых районах мира ревматологии не обучение достаточно и другие эксперты могут иметь опыт в управлении РА. Кроме того, некоторые коморбидные заболевания, таких как хронический гепатит или интерстициальный заболевания легких, может потребовать консультации и лечение, другие специалисты.
- РА требует высоких индивидуальных, медицинских и социальных затрат, все из которых следует рассматривать в его лечении лечащим врачом -ревматологом. Опять же этот принцип сформулирован точно так, как в прошлый раз, за исключением того, что это был пункт C, но также последний. Это означало, чтобы напомнить всем заинтересованным сторонам, что эффективная терапия РА — несмотря на прямые расходы — уменьшит экономическое бремя на отдельных пациентов, их семей и общества, которая включает в себя прямые медицинские расходы и косвенные расходы, такие как инвалидность и преждевременного выхода на пенсию. В этом контексте необходимо учитывать, что в прямые медицинские расходы начисляются помимо тех, которые приписываются непосредственно лечение явных проявлений РА и включают в себя расходы, вытекающие из сопутствующих заболеваний, связанных с воспалительным процессом. Однако, этот момент, также предназначен для того чтобы прозвучать, что экономически эффективным лечение подходы должны быть предпочтительными, до тех пор, пока безопасность и результаты схожи по сравнению с более дорогостоящим из них и они соответствуют терапевтической парадигме. В некоторых странах, высокая стоимость лечения является одним из важных факторов, ограничивающих наличие современной терапии (неравенство), и этот фактор должен учитываться при выборе стратегии лечения. В этом отношении, появлением биосимиляров обеспечивает потенциал для снижения давления на бюджеты здравоохранения. На данный момент, должно быть понимание, что многие пациенты до сих пор не достигли терапевтических целей, несмотря на все наши современные методы лечения и терапевтических стратегий. Кроме того любой из bDMARDs, если применяется после по крайней мере после одного из csDMARD и bDMARD, которые были неэффективны, приводит к только около 10% хороших результатов с точки зрения шкалы ACR70. Эти аспекты накладывают необходимость продолжать поиск новых методов лечения или стратегии.
Таблица 2
2016 EULAR обновленные рекомендации
| Всеобьемлющие принципы |
| А |
Лечение пациента с РА должно ставить целью обеспечение наилучшей помощью и должно основываться на согласованном решении между пациентом и ревматологом |
| В |
Терапевтическое решение основывается на активности болезни и других факторах пациента, таких как прогрессирование структурных повреждений, коморбидности и безопасности |
| С |
Ревматологи — это специалисты которые преимущественно лечат пациентов РА |
| D |
РА требует высоких индивидуальных, медицинских и социальных затрат, все из которых должны учитываться при его ведении во время лечения ревматологом |
| Рекомендации |
| 1. |
Терапия DMARDs должна быть начата как можно раньше после установления диагноза РА |
| 2. |
Терапия должна быть нацелена на достижения цели стойкой ремиссии или низкой активности болезни у каждого пациента |
| 3. |
Мониторинг должен быть как можно частым при активности болезни (каждые 1-3 месяца); если нет улучшения в первые 3 месяца после начала терапии или когда цель не была достигнута в течении 6 месяцев, терапия должна быть скорректированна |
| 4. |
МТ должен быть частью первой терапевтической стратегии |
| 5. |
У пациентов с противопоказаниями к МТ (или ранней непереносимости) , лефлюномид или сульфасалазин должен быть назначен как часть(первичная) терапевтической стратегии |
| 6. |
Короткий курс ГК должен быть начначен при инициации или смене csDMARDs, при различных дозовых режимах и курсовом лечении, но должно быть сведено на нет (тапперинг) так быстро как клинически возможно |
| 7. |
Если терапевтическая цельне достигнута при первисной csDMARDsстратегии, когда отсутствуют плохие прогностические факторы, другие csDMARDs должны быть назначены |
| 8. |
Если терапевтические цели не достигнуты при первичной csDMARDs стратегии, когда имеются неблагоприятные прогностические факторы, должны быть дополнительно назначены bDMARD или tsDMARD; современным подходом будет начало лечения bDMARD |
| 9. |
bDMARD и tsDMARD должны комбинироваться с csDMARDs; у пациентов кто не может использовать csDMARDs как основу, ИЛ-6 ингибиторы и tsDMARDмогут иметь преимущества в сравнении с другими bDMARD |
| 10. |
Если bDMARD или tsDMARD неэффективны, терапия другим bDMARD или tsDMARD должна быть назначена; если терапия одним TNF- ингибитором неэффективна, пациент может получить другой TNF- ингибитором или агентом с другим механизмом действия |
| 11. |
Если пациент в постоянной ремиссии после снижения до отмены ГК, возможна постепенное снижение bDMARD, особенно если лечение комбинируется с csDMARD |
| 12. |
Если пациент в постоянной ремиссии, постепенное снижение csDMARD может назначаться |
- Символы (*, §, #) указывают на различные уровни доказательств, которые соответственно предоставляются вместе с результатов голосования и уровнях соглашения в таблице 3.
- 1TNF-ингибиторы: adalimumab, certolizumab pegol, этанерцепт, golimumb, инфликсимаб boDMARDs или соответствующих EMA-утвержден/FDA утвержденных медицина.
- 2Abatacept, Ритуксимаб (как первый bDMARD при особых обстоятельствах — см. текст), или tocilizumab или соответствующих EMA-утвержден/FDA утвержденных медицина, а также ИЛ-6 пути ингибиторы, sarilumab или sirukumab, после их утверждения.
- 3Як ингибиторы (где утверждены).
- boDMARDs, биологические созданные (подлинные) DMARDs; bsDMARD, биосимиляр DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EULAR, Европейская Лига против ревматизма; Jak, Janus киназа; MTX, метотрексат; РА, ревматоидный артрит; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.

- The symbols (*, §, #) indicate different levels of evidence which are correspondingly provided together with voting results and levels of agreement in table 3.
- 1TNF-inhibitors: adalimumab, certolizumab pegol, etanercept, golimumb, infliximab boDMARDs or the respective EMA-approved/FDA-approved biosimilars.
- 2Abatacept, rituximab (as first bDMARD under special circumstances—see text), or tocilizumab or respective EMA-approved/FDA-approved biosimilars, as well as other IL-6 pathway inhibitors, sarilumab and/or sirukumab, once approved.
- 3Jak-inhibitors (where approved).
- boDMARDs, biological originator DMARDs; bsDMARD, biosimilar DMARDs; csDMARDs, conventional synthetic DMARDs; DMARDs, disease-modifying antirheumatic drugs; EULAR, European League Against Rheumatism; Jak, Janus kinase; MTX, methotrexate; RA, rheumatoid arthritis; TNF, tumour necrosis factor; tsDMARDs, targeted synthetic DMARDs.
Рекомендации
Общие аспекты
Совещательный процесс Целевой группа привел к 12 рекомендаций. Сокращение на две рекомендации, по сравнению с прошлом EULAR документом может вызвать удивление ввиду якобы увеличения замысловатость терапевтических методов и стратегий. Однако содержание рекомендации 14 был перенесен в общие принципы, как описано выше. Кроме того пункт 11 версии 2013, которая рассматривала использование tofacitinib, был удален как отдельный элемент, потому что Janus киназа (Як) ингибиторы как tsDMARDs теперь вступили в и расширили другие рекомендации; Это будет обсуждаться более подробно в контексте пунктов 8, 9 и 10. Также бывшая рекомендации 6, которая рассматривала использование комбинаций csDMARD, был удален целевой группой; Комбинированная терапия с csDMARDs и причин, чтобы удалить его из его предыдущих видное место в пределах списка рекомендаций и алгоритм будет рассматриваться в ходе обсуждения рекомендации 4 и 5. Хотя три из 2013 рекомендаций были удалены через включение в другие элементы или полного бездействия, бывший рекомендации 8, в которой рассмотрены отсутствие или наличие прогностических факторов риска была разделена на новые рекомендации 7 и 8; Ниже приводится подробное обоснование этого решения.
12 рекомендации образуют логическую последовательность. Они начинают с необходимости начать терапию сразу же после диагностики и требование установить цель лечения и оценивать болезнь на пути к этой цели, используя стратегию лечения treat-to-target. Такая стратегия сильно встроена в рекомендации после их первой версии в 2010 году. С этими предпосылками на уме, различные лекарства или комбинации агентов рекомендуется во время лечебных процедур с предлагаемые последовательным шагом, учетом прогностических факторов и всех доступных агентов. Они также отмечают некоторые потенциальные возможности агентов в будущем, даже несмотря на то, что еще не утвержденных международными регулирующими органами. Таким образом рекомендации также включают представление перспективных препараты, которые претерпели исследования III фазы и были доступны для оценки доказательств; очевидно их фактической применение будет зависеть от нормативного утверждения статуса в отдельных странах. Набор рекомендаций заключает с предложениями по сокращению терапии и даже вывода некоторых препаратов, когда нужный цель достигнута и поддерживается.
Индивидуальные рекомендации
- Терапия с DMARDs должен быть начата, как только диагноз РА установлен. Эта рекомендация остается неизменным по сравнению с 2013 года и является одним из оплотов любого лечения подхода к РА. Это означает (i) необходимость установить диагноз как можно раньше, как это также было отражено в 2010 ACR-EULAR классификации критерии и (ii) преимущество раннее начало лечения DMARD («как можно скорее») (‘as soon as possible’), которая позволяет предотвращения ущерба в значительной части пациентов. Учитывая общий характер этой ключевой точки Целевая группа не указывает тип DMARD здесь. Действительно, все DMARDs не могут обеспечить долгосрочный результат быстро, по сравнению с отдаленными результатами, и в последующих рекомендациях рассматривается последовательность типов DMARD терапии. Целевая группа не занимается пре- РА(pre-RA) или недифференцированные артрит и таким образом предполагается, что диагноз РА уже установлен. Однако он должен иметь в виду, что любой хронический артрит, даже если недифференцированный, требует соответствующего лечения, включая рассмотрение вопроса о DMARD терапии, потому что он обычно не стихают спонтанно, и обновление рекомендаций по управлению ранней артрита только что был представлен EULAR. 70 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis 2016; doi: 10.1136/annrheumdis-2016-210602. с LoA 9.9, эта рекомендация достигли высоких соглашения по всем пунктам (Таблица 2). LoA 1а; LoA 9,9.
- Лечение должно быть направлено на достижение цели устойчивой ремиссии или низкой активности болезни у каждого пациента. Эта рекомендация решает две цели лечения: ремиссии, особенно в DMARD-наивно пациентов и низкой болезни активности, преимущественно у больных, которых предыдущая терапия не имела успеха. Клиническая ремиссия или низкая активность болезни упоминаются как отдельная терапевтических целей, любые обострение болезни должно рассматриваться как неадекватный контроль заболевания, таким образом, предполагает изменения терапевтических подходов, очевидно если факторы больного не исключают этого. Общение с пациентом, чтобы уточнить и согласовать цели лечения и средства для достижения этой цели имеет первостепенное значение. Это позволяет согласовать пациента и провайдера соображений и целей и способствует приверженности лечению. В 2010 году понятие «как можно скорее» был также частью этот пункт и в ходе нынешней дискуссии было специально решил отметить, что лечение цели должны быть достигнуты быстро, а не в отдаленном будущем. Действительно, имеется достаточно свидетельств того, что большинство пациентов, которые не достигли значительного улучшения в течение 3 месяцев, или не достижения цели лечения в течение 6 месяцев, не достигнут желаемого государство впоследствии; исключения касаются тех пациентов, активность болезни которых была сокращена до уровня близко к цели лечения.
Что касается ремиссии EULAR и ACR согласились на Boolean и системе индекса на основе определений, последний основан на упрощенный или клинических индекс активности заболевания (SDAI, CDAI) Simplified or Clinical Disease Activity Index). Оба высоко соотносятся с отсутствием субклинической синовитана МРТ и сонографии и отсутствие прогрессирования повреждения суставов. Они могут даже надежно использоваться, когда применяются препараты, которые непосредственно вмешиваться в острой фазе ответ. Кроме того, недавние стратегические клинические испытания, которые сравнивали ориентации сонографические ремиссии с таргетингом на клинической ремиссии или низкой болезни активности привела к выводам, что направленный на визуализации ремиссии не имеет преимуществ над клиническими целями, но имеет экономические недостатки. Низкая активность болезни также быть должным образом определена и измерены. Измерение высокомолекулярного C реактивного белка или эритроцитов СОЭ (например, Оценка активности болезни (disease activity score (DAS)) 28) может не передать достаточно надежные результаты при использовании с агентами, которые мешают остро фазовому ответу, например, антицитокиновые агенты (особенно интерлейкина -6 (IL) ингибиторы) или Як ингибиторы.
Важно, чтобы положение, достигнутое целями должно быть устойчивым. Термин «стабильного» до сих пор точно не определена и различные исследования использовали различные определения, но некоторые голоса в Целевые группы предложили по крайней мере 6 месяцев как минимальные сроки. Это требует последующей деятельности и стратегии адаптации интенсивности терапии вверх или вниз, аспекты, которые рассматриваются в последующих рекомендациях. Однако интенсификация лечения должны учитывать факторы больного, особенно риски и сопутствующих заболеваний (общепрограммной принцип B). LoE 1а; LoE 9,6.
- Мониторинг должны быть частыми при активности болезни (каждые 1-3 месяца); Если нет улучшения, максимум через 3 месяца после начала лечения или не достигнут цели на 6 месяцев, следует скорректировать терапию. Эта рекомендация treat-to-target остается неизменной позиции в разработки версии 2013. Частоты последующих оценок должны корректироваться в соответствии с уровнем активности заболевания, а именно более часто, как ежемесячно, когда пациенты имеют высокие болезни активности и менее часто, как каждые 6 – 12 месяцев, когда цели лечения была достигнута и устойчивой. EULAR обычно рекомендует использовать комплексный показатель активности болезни, которая включает в себя суставной счет и ACR-EULAR определений для ремиссии Felson DT, Smolen JS, Wells G, et al. American college of rheumatology/European league against rheumatism provisional definition of remission in rheumatoid arthritis for clinical trials. Ann Rheum Dis 2011;70:404–13.
Aletaha D, Landewé R, Karonitsch T, et al Reporting disease activity in clinical trials of patients with rheumatoid arthritis: EULAR/ACR collaborative recommendations. Ann Rheum Dis 2008;67:1360–4 ;
Наблюдение в течении 3 месяца ссылается на тот факт, что если не будет достигнуто даже минимальное изменение, тогда есть низкая вероятность достижения цели лечения. Таким образом, улучшение состояние активности заболевания должно рассматриваться на протяжении 3 месяца или относительное улучшение положения, относящиеся к по крайней мере 50% улучшения состояния комплесной оценки, на тот момент во времени, чтобы иметь значительный шанс достижения целевого показателя. На заметку, корректировки терапии включает оптимизации MTX (или другие csDMARD) дозы или схемы лечения, или внутрисуставные инъекции ГК при наличии одного или нескольких остаточного активного суставов и относится к изменению лекарств, только если эти меры не увенчались успехом или не подходят. Кроме того, в отдельных пациентов целевого лечения может не достигнуты полностью и за 6 месяцев. Но если активность болезни близка к цели, можно подумать о продолжении эффективной терапии для несколько недель сделать окончательное решение, особенно поскольку значительная доля пациентов могут достичь цели на несколько более поздний момент времени чем за 6 месяцев. Следовательно, изменения в активности болезни от исходного уровня и ее снижение следует рассматривать при принятии решения о лечении. LoE 2b; LoE а 9.5.
- MTX должно быть частью первой стратегии лечения. По сравнению с 2013 года, когда этот пункт читался «MTX должно быть частью первой стратегии лечения больных с активной РА», рекомендациях слегка был сокращен. Целевая группа сочла, что указывать на активность болезни нет необходимости, поскольку EULAR рекомендации главным образом касаются пациентов с активной болезнью. Основываясь на его эффективности, безопасности (особенно при наличии фолиевая кислота), возможность индивидуализировать доза и способа как назначения, так и относительно низкие затраты, MTX продолжает быть якорь («первый») препарата для пациентов с РА как монотерапия, также, как и в комбинации с другими препаратами («стратегия лечения»; см. ниже). Кроме того, MTX, как представляется, снижает сопутствующих заболеваний и смертности при РА. В клинических испытаниях bDMARDs в начале больных артритом, монотерапия MTX был связан с 25% ACR70 ответов (которые приводит пациентов в диапазоне низкой активности болезни) в течение 6 месяцев, даже несмотря на то, что она не была объединена с de novo GC в этих испытаниях. Доза MTX должно быть быстро увеличена, обычно до 25 – 30 мг в неделю, подкожно или внутрь, с добавок фолиевой кислоты, и максимальная доза MTX, если переносится, должна поддерживаться в течение около 8-12 недель, чтобы судить MTX лечение реакции. Действительно когда MTX быстро доводился до 25 мг в неделю, число ответов может быть даже выше (∼40% низкий активности болезни). Конечно, противопоказания и потенциал раннего токсичности должны приниматься во внимание; Этот вопрос рассматривается в пункте 5. Дозы, упомянутые здесь не касаются азиатских пациентов. В Китае не рекомендуется превышать 20 мг/неделю и в Японии максимальная рекомендуемая доза для MTX-16 мг/неделю.
Следует отметить в этот момент Целевая группа решила удалить предыдущую рекомендацию 6 («DMARD-наивно больных, независимо от дополнения GC, csDMARD монотерапия или комбинированная терапия csDMARDs должны использоваться»). Включение или исключение комбинаций csDMARDs в пределах ключевых точек вызвало долгих дебатов в рамках, соответствующих прорыв группы и всей целевой группы (и вывода одного члена целевой группы).
Первый бюллетень целевой группы участвовали на выбор следующие две формулировки: () ‘ MTX должно быть частью первой стратегии лечения» и (b)» в DMARD-наивно пациентов, независимо от того GC, должны использоваться csDMARD монотерапия или комбинированная терапия csDMARDs» (идентичные с соответствующей рекомендацией 2013), с 23 голосами пользу (), 22 голосов пользу (b) и одном воздержавшемся. Таким образом дальнейшего обсуждения имели место. Защитники пользу включая комбинированной терапии упомянутых публикаций, предлагая его превосходной эффективности по сравнению с csDMARD монотерапия и аналогичные эффективности по сравнению с биологическими агентами; Кроме того, в некоторых странах, csDMARD комбинированной терапии рекомендуется национальных обществ предпочтительным начальной терапии.
Другие члены Целевой группы указали на клинические исследования, которые не показали реальную пользу комбинированной терапии (особенно при монотерапии csDMARD сочеталась с GC в руках компаратора); различия в GC совместном применении комбинации и монотерапия нацеленные в предыдущих испытаний; вопросы, касающиеся дизайна некоторых исследований, предлагая превосходство csDMARD комбинации; значительно выше частота ответы на сочетании с bDMARDs, по сравнению с в сочетании с csDMARD терапии после ИК MTX и более высокий уровень токсичности csDMARD комбинаций против монотерапия.
Утверждалось также, что выше распространенность неблагоприятных событий при использовании комбинированной терапии, хотя часто более мягких, могут воспрепятствовать эскалации терапии и результат, не доходя до полной дозы некоторых лекарственных препаратов. Кроме того, SLR на csDMARDs не показывать доказательства превосходства комбинаций csDMARD, по сравнению с csDMARD монотерапия. Кроме того, Комитет ACR по 2015 обновления ACR управления руководящего принципа, в отличие от этого в предыдущих версиях, сделал не сочетание csDMARD рекомендуется в качестве начальной терапии, но приоритетные MTX монотерапия. В линии, обновленные рекомендации EULAR для управления ранней артрита не отстаивалось использования комбинированной терапии csDMARD. Было также отмечено, что выбор (а) включен термин «стратегия лечения» и таким образом возможность использования комбинации csDMARD. Эти обсуждения привели к новому голосованию между двумя версиями для рекомендации 4: (‘a) MTX должно быть частью первой стратегии лечения» (см. выше) и (‘b) MTX должно быть первым csDMARD, или как монотерапии или в комбинации с другими csDMARDs». В этом втором голосовании большинство 71% проголосовали за версии (а). Таким образом csDMARD комбинированная терапия больше не представлена явно как предложение первоначального лечения в сокращенный список рекомендаций. Однако следует отметить, что тот простой факт, что csDMARD комбинированной терапии больше не входит в ключевую точку не исключает его использования. Это, очевидно, по усмотрению врача и пациента в свете все плюсы и минусы, которые были обсуждены («совместное (общее) решение»).
Эта рекомендация в конечном итоге достиг очень высоких LoA (9,8). Целевая группа была хорошо известно, что в некоторых странах, таких, как в Великобритании и Канаде, ревматологов обязаны использовать по крайней мере два csDMARDs перед применением bDMARDs одобренного страховщиками и что вместо двух csDMARD курсы принимаются комбинации из двух или трех csDMARDs. Однако по причинам, только что упомянул, Целевая группа не выступает за практику определения IR к комбинации csDMARDs как отказ двух или более csDMARDs (когда в действительности он представляет только один терапевтические стратегии) не исключают возможность утверждения использования bDMARD когда первый csDMARD неэффективна, и пациент имеет плохой прогностических маркеров (см. ниже пункт 8 и
Таблица 1). LoE 1а; LoA 9.8.
- У больных с противопоказанием к MTX (или ранней нетерпимости), leflunomide или сульфасалазин следует рассматривать как часть (первый) стратегии лечения. Содержание этой рекомендации были сохранены; Однако по сравнению с предыдущей версией пункта 5, «в случаях MTX противопоказания» был слегка исправлен, потому что это больные, имеющие противопоказания, а не «случаев». Целевая группа вновь напомнили об относительной безопасности MTX и также обсуждалась, что частые опасения больных после прочтения вкладыша должны решаться путем предоставления соответствующей информации (общепрограммной принцип A). Тем не менее есть случайные противопоказания (например, болезнь почки или печени) или непереносимости. В этих обстоятельствах leflunomide (дозированной по 20 мг/сутки без нагрузочной дозы) или сульфасалазин (увеличенной до 3 г/сут), рассматриваются как лучшие альтернативы. Старые исследования предполагали аналогичные эффективность обоих эти препараты, по сравнению с MTX, хотя MTX был использован при гораздо меньших дозах, чем рекомендуется сегодня. Однако, не было новых исследованиий опровергнуть предыдущие выводы. Среди всех выше перечисленных агентов только сульфасалазин имеет профиль приемлемого безопасности во время беременности. В некоторых странах, парентерально золото все еще используется, и, хотя бесспорным является клинической эффективности, существуют споры относительно его безопасности; в других странах золото соли больше не доступны. Напротив использование противомалярийные препараты, такие как Гидроксихлорохин и хлорохин, по-прежнему значительны, особенно в комбинации терапии или в качестве монотерапии у больных с заболеванием очень мягкий, особенно в Китае. Интересно, что противомалярийные препараты могут иметь значительное положительное влияние на метаболизм глюкозы и липидов и может уменьшить сердечно-сосудистого риска в РА. Однако, повреждения суставов не замедляется в подобные степени, как и в случае с другими csDMARDs. Эта рекомендации также использует термин «стратегия лечения», подразумевая, как и в случае с MTX, что leflunomide и сульфасалазин может использоваться как монотерапии или в комбинации с другими csDMARDs или биологических агентов. Действительно повышающая «step-up» комбинированной терапии часто работают, даже несмотря на то, что сравнение пошаговой комбинации с переключением csDMARD не выявили значительные различия в результатах. LoE 1a; LoA 9.0.
- Краткосрочные ГК следует рассматривать при инициировании или изменения csDMARDs, в разных дозовых схемах и способах назнач tapered ения, но должны снижаться tapered постепенно так быстро, как клинически это целесообразно. Повышение эффективности ГК в сочетании с csDMARDs хорошо известна. Действительно до сих пор все испытания, сравнивающие GC плюс csDMARD с bDMARDs плюс csDMARD показали аналогичные эффективности. В 2013 году, GC были рассмотрены в рекомендации 7, но формулировка отличается: «Низкодозированные GC следует рассматривать как часть стратегии первичного лечения (в комбинации с одним или более csDMARDs) на срок до 6 месяцев, но должны быть коническими снижены так быстро, как клинически это целесообразно». Нынешняя формулировка представляет собой компромисс, пытаться вместить большую озабоченность и предложения, высказанные в ходе прений целевой группы.
Термин «низкодозированные» ‘low-dose’ критически обсуждалась. Хотя все члены Целевой группы согласились с тем, что высокие дозы GC не должны использоваться в течение длительного периода времени, также стало ясно, что метка «низкодозированные» (что означает суточной дозе 7,5 мг или менее преднизолон в день), как предпочитали некоторые члены Целевой группы, не охватывает несколько текущие способы применения GC. Действительно, последние клинические испытания показали эффективность краткосрочных GC, но при дозах> 7,5 мг/сут, а именно per osна 30 мг, начальной с дозы, как однократной внутримышечной инъекции 120 мг метилпреднизолона или как единственной 250 мг внутривенно пульс терапии метилпреднизолона. Таким образом, термин «низкие дозы» был удален и заменен «краткосрочных», оставляя выбор о «дозы схем и способах введения» (еще один новый кусок формулировка этого пункта) для отдельных ревматолога и пациента. Действительно утверждалось, что одно введение внутримышечных или внутривенных влечет за собой гораздо меньше суммарной дозы, чем несколько недель пероральных низких доз терапии, но это мнение не разделяют все члены Целевой группы.
Еще другое изменение вовлечены замены фразы «частью стратегии первичного лечения», «при инициировании или изменении csDMARDs». Это изменение разъясняет намерение Целевой группы, в том, что GC следует назначать со всеми csDMARD при начале, либо как часть первой csDMARD терапии на момент постановки диагноза, или впоследствии, если первоначальная стратегия не удалось. Наконец тот факт, что csDMARDs упоминаются конкретно подразумевает, что GC обычно не нужны как бридж -терапия при использовании bDMARDs или tsDMARDs, как они, как правило, имеют быстро начало действия и может быть иметь потенцированные риск инфекции. Таким образом, важно вновь подтвердить, что Целевая группа рекомендует, используя GC в сочетании с csDMARDs прежде всего, как бридж терапии до тех пор, пока csDMARD достигает своего максимального эффекта, и это должно быть сделано с помощью одной из дозировок и коническим уменьшением, упомянутых выше, для которых соответствующие доказательства существуют. Чтобы отразить положение целевой группы, алгоритм, изображен на
рисунке 1 был изменен, чтобы показать «+» для использования GC в новой версии, вместо того, чтобы «±», как ранее.
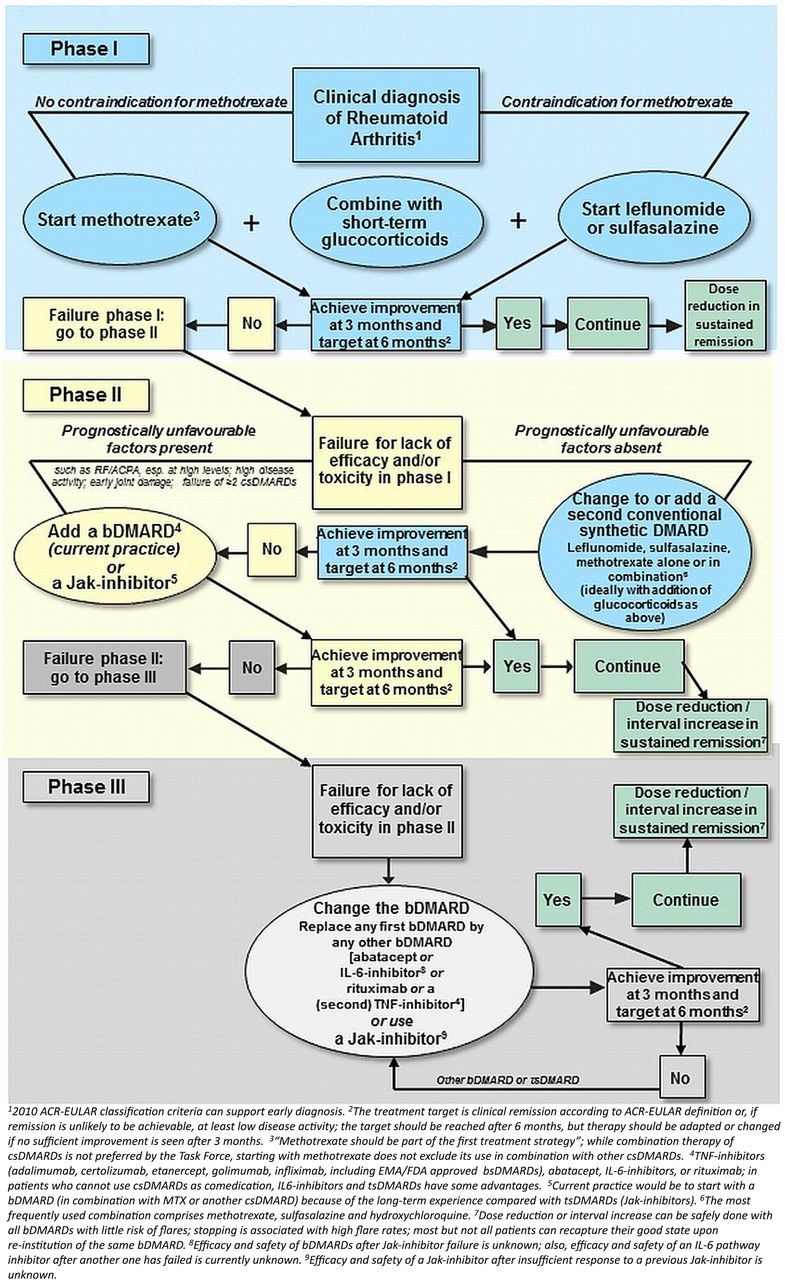 Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Заявив, ‘.. .tapered(
снижение на конус при заточке карандаша) как быстро как клинически возможно ‘, Целевая группа подчеркивает, что ГК следует постепенно уменьшается и в конечном итоге отменить, обычно в течение 3 месяцев от начала лечения и только в исключительных случаях на 6 месяцев. Длительное применение GC, особенно в дозах выше 5 мг/сут, следует избегать из-за многих потенциальных рисков, представленный в SLR (системный литературный обзор). В то время как некоторые из этих рисков может быть связано смешиваться с указанием на высоким болезни активности, доказательства для увеличения общей и сердечно-сосудистой смертности в дозе выше порога 7,5 мг/сут или суммарной дозы 40 g является значительным. Известно, что применение GC как единственного терапевтического средства в больных с IR при переходе к csDMARD терапии не передать хорошую эффективность и связан с значительные неблагоприятные события. Кроме того, если GC не могут быть отменены в течение сроков, упомянутых выше, DMARD терапии возможно будет неэффективной. Наконец внутрисуставное GC введение может рассматриваться в некоторых случаях, например, остаточно воспаленной или рецидив артрита.
Некоторые члены Целевой группы выступал за хроническое использование GC как возможность для некоторых пациентов; Однако это предложение не было одобрено большинством. В то время как ключевой точкой по GC был, как и в предыдущие годы, наиболее активно обсуждается, окончательная формулировка получил 98% большинством голосов. Однако, LoA был гораздо ниже (8,7), с учетом рекомендаций предыдущих версий. Это относительно низкая LoA, вероятно, объясняется тем, что многие члены Целевой группы считает, что этот пункт был слишком либеральным и использования GC должна быть более ограниченной, в то время как другие высказали мнение, что он был слишком ограничительный характер. LoЕ1а; LoA 8.7.
- Если цель лечения не достигается при первой csDMARD стратегии, в отсутствие неблагоприятные прогностических факторов, следует рассмотреть другие csDMARDs. Это предложение является первой частью предыдущей рекомендации 8. Это по существу сформулированы одинаковым образом, за исключением последней части, «переход на другой csDMARD стратегии должны рассматриваться», была изменена, как «следует рассматривать другие csDMARDs», с учетом того факта, что комбинация с GC в настоящее время было рекомендовано четко также для этого шага лечения алгоритм (пункт 6) и комбинации csDMARDs не рекомендуется специально как стратегия начального лечения больше вообще. В таблице 1 представлены неблагоприятные прогностические факторы. Целевая группа также обсудила что ранняя непереносимость csDMARD не должен рассматриваться как неэффективности лечения, который будет означать немедленный переход к следующему этапу алгоритма, но скорее требуют восстановления другой первичного csDMARD (замена). LoЕ 5; LoA 8.5.
- Если цель лечения не достигается с первого csDMARD терапии, при наличии неблагоприятные прогностические факторы, добавление bDMARD или tsDMARD * должны быть рассмотрены; Правильная практика бы начать с bDMARD. Разделение второй части предыдущей рекомендации 8 («при неблагоприятных прогностические факторы присутствуют, добавление bDMARD следует назнвачить») и новый пункт 7, отражают желание целевой группы дать стратификации прогностических факторы больше внимания. вDMARDs в настоящее время включают серию фактор некроза опухоли (ФНО)-ингибиторы (adalimumab, certolizumab, этанерцепт, golimumab и инфликсимаб); abatacept (ингибитор костимуляции); tocilizumab (блокатора рецепторов ИЛ-6, но в будущем также возможно другой ингибитор рецепторов ИЛ-6, sarilumab и IL-6 ингибиторы, такие как clazakizumab или sirukumab); Ритуксимаб (анти B-клеток агента); оба как biological originator (bo)DMARDs биологические оригиналы (bo) и Европейским агентством лекарственных средств EMA-утвержденного или продуктов питания и медикаментов FDA утвержденных biosimilar (bs) биосимиляры DMARDs.
Эта рекомендация была также расширена для включения tsDMARDs, а именно: Як ингибитор tofacitinib и далее Як ингибиторы, такие как baricitinib. В 2013 году обновление, tsDMARDs (тогда рекомендация 11) были рекомендованы для использования после того, как bDMARD не эффективны. С тех пор больше данных на tofacitinib, особенно в отношении долгосрочных аспектов безопасности и новые данные для baricitinib были опубликованы. Данные показывают, что baricitinib может быть более эффективным, чем TNF-ингибитор. В настоящее время, tsDMARDs термин относится только к Jak ингибирование. Tofacitinib утвержден во многих странах, таких, как в США, Латинской Америке и Азии, а также некоторых европейских странах, но во время разработки настоящих рекомендаций до сих пор не зарегистрирован в Европейском союзе; baricitinib завершил исследования III фазы и находится в нормативном обзоре, и filgotinib и другие Як ингибиторы проходят оценку в клинических испытаниях, (в то же время baricitinib утвержден в ЕС). Однако подобно 2010 рекомендации, в которых TNF-ингибиторы уделялось незначительное предпочтение над другими биопрепаратов из-за наличия долгосрочных данных реестра для бывшего, но не последний, предпочтение отдается здесь bDMARDs над Як ингибиторы по той же причине. Это понятие о текущей практике является экспертное заключение и не основывается на твердых доказательств. Эта ключевая точка до сих пор получил очень высокие голосования на заседании и высокой LoA.
Рекомендации по использованию этих агентов в пациентов, которые имеют плохие прогностические факторы (вместо тех, кто не имеет) также не основывается на твердые доказательства в литературе. Однако в большинстве исслкдований bDMARDs и tsDMARDs, существующие критерии включения, такие как высокая болезнь активность, наличие аутоантител и ранее существовавших повреждения суставов, обеспечено включение пациентов с плохим прогностические факторы. Тем не менее не существует формального испытания, сравнивающие использование любого из этих агентов у больных с и без плохой прогностических маркеров. С другой стороны, несколько post hoc анализы показали значение использования ингибиторов ФНО в больных с плохими прогностических маркеров (
Таблица 1) относительно без тех.
В сноске к bDMARDs упоминает, что все утвержденные bDMARDs могут быть использованы без иерархических позиционирования, и что EMA-утвержденные или одобренные FDA bsDMARDs имеют схожие эффективность и безопасность соответствующих boDMARDs и им следует отдать предпочтение, если они действительно заметно дешевле, чем оригинальные или другие bDMARDs или tsDMARDs. Начиная с 2013 года обновления, несколько bsDMARDs, ориентация ФНО были утверждены в Европе и в США. Среди bDMARDs нет никакой разницы в результатах, независимо от их точки приложения. Этот вывод основывается на испытаний head-to-head , мета анализ, результаты SLRs и косвенное сравнение (причем последний менее надежным и поэтому наименее информативными). Известно, SLR также включены данные клинических испытаний sarilumab, человеческие анти ИЛ-6 рецепторов антител и sirukumab, человеческих антител анти ИЛ-6, оба из которых не были утверждены в настоящее время; Основываясь на SLR, Целевая группа считается этих двух антител и tocilizumab в целом аналогичные эффективность и безопасность.
Хотя ритуксимаба одобрен для использования после того, как ФНО ингибиторы неэффективны, существует достаточно доказательств для его эффективность у bDMARD наивных пациентов и ранней РА. Поэтому часто используется после перехода IR к csDMARDs, особенно когда есть специфические противопоказания для других биологических агентов, таких как лимфомы в прошлом или демиелинизирующих заболеваний, учитывая его эффективность при этих заболеваний.
Разделение пунктов 7 и 8 также основывается на той причине, что предыдущий абзац входят две рекомендации и что разделение их даст стратификация прогностические факторы лучшей наглядности. Неблагоприятные прогностические факторы представлены в
таблице 1 и теперь также включают неэффективность двух csDMARDs; Если пациенты имеют недостаточные эффективность двух csDMARD курсы, далее csDMARD могут иметь только немного дополнительного воздействия.
Целевая группа также обсудила следует ли пересмотреть использование bDMARD в качестве первой линии терапии, как это было в случае с первоначальных рекомендаций 2010. Такое использование была протестирована в большое количество рандомизированных испытаний и последовательно было установлено статистически превосходить перед MTX монотерапия. Важно, однако, ни один из соответствующих фазы III используется сочетание с de novo ГК в помощь монотерапия MTX и несколько начаты исследования, которые сравнивали терапию первой линии bDMARDs плюс MTX с GC плюс MTX (или с помощью комбинации csDMARDs) не представила четких клинических или структурные преимущества раннего bDMARD терапии. Также, внедренные в рамках реагирования на начальной стадии лечения с bDMARDs + MTX дает хороший 20 – 25% ответ для изолированного MTX, ведущих к передозировке у этих пациентов. И наконец, было показано, что пациенты, которые перешли от IR к MTX, но затем быстро получил bDMARD ответил же степени, как те, которые начали с bDMARD плюс MTX. Таким образом, это предложение о начале использования bDMARDs не нашли большинством голосов.
Таблица 3
Уровни доказательств, голосование результаты и соглашения
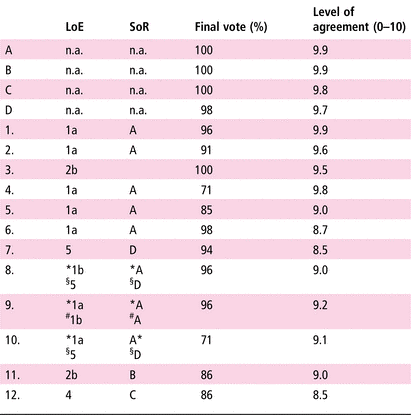
- (Символы*§, #) касаются соответствующие символы в рекомендациях (Таблица 2), показаны соответствующие LoE.
- LoE, уровни доказательств; n.a., не доступны; SoR, сила рекомендации.
Тем не менее по-прежнему предполагается, что схема индукции, а затем последующее прекращение bDMARD и продолжение csDMARD может стать ценным вариантом в будущем; Существует некоторая поддержка в литературе для такого подхода. Однако, это потребуется дальнейшее подтверждение в дополнительных испытаний прежде, чем она может быть введена в рекомендации, особенно потому, что количество первоначальных ответчиков у которых снижение возможно может не входить также большинство пациентов. Рекомендация, как сформулировано выше, получил 94% голосов членов Целевой группы. LoE * 1В, §5; LoА 9.0.
- 9. bDMARDs * и tsDMARDs# следует сочетать с csDMARD; у больных, которые не могут использовать csDMARDs как дополнительная медикаментация, ингибиторы ИЛ-6 и tsDMARDs могут иметь ряд преимуществ по сравнению с другими bDMARDs. Эта рекомендация заменяет бывший № 9 (‘ у больных реагировать недостаточно на MTX и/или другие csDMARD стратегии, с или без ГК, bDMARDs (ФНО ингибиторы, abatacept или tocilizumab и, при определенных обстоятельствах, Ритуксимаб) должно быть начато с MTX’). В то время как отдельные bDMARDs и tsDMARDs уже обсуждали выше, пункт 9 теперь ссылается на тот факт, что все bDMARDs имеют улучшенный эффективность в сочетании с MTX чем как монотерапия. По сравнению с обновлением 2013, больше доказательств теперь накопленные за сочетание, даже для tocilizumab. Также для baricitinib, комбинированной терапии больше конструктивна, хотя не клинических или функциональной эффективности, чем монотерапия нет. Однако, признаки и симптомы, физические функции и повреждения суставов, есть показания для несколько лучше эффективность монотерапии tocilizumab и более сильнее для Як ингибиторы по сравнению с MTX. Монотерапия другими биологическими агентов не было установлено клинически превосходит MTX монотерапия. MTX может использоваться на 7,5 – 10 мг для предоставления дополнительной эффективность к ФНО ингибиторы и нетереносимость при таких низких дозах, которая приводит к прекращению терапии, встречается очень редко. Кроме того, биопрепараты могут также эффективно сочетаться с другими csDMARDs.
Еще один аспект, а именно возникновение антилекарственных антител (иммуногенность), был обсужден, особенно в отношении вторичной не отвечания на терапию. В этом контексте рассматривался также отсутствие знаний о роли несоблюдения и кратковременности. Целевая группа обсудила регулярное тестирование антилекарственных антител и уровень препарата и полагают, что там было мало значения для них в клинической практике, поскольку хороший клинический ответ не приведет к прекращения терапии, даже в присутствии антилекарственных антитела, или низкий уровень препарата и наоборот. Следует отметить использование MTX в упомянутых выше дозах снижает выработку антилекарственных антител.
По всем этим причинам Целевая группа твердо полагает (96% большинство), bDMARDs (и tsDMARDs) следует прежде всего добавить, то есть, в сочетании с csDMARDs, таких как MTX или leflunomide, оставляя возможность монотерапия, с предпочтением для некоторых препаратов, как исключение в случае непереносимости или противопоказанием для всех csDMARDs. LoE * 1а, #1b; LOA 9.2.
- 10. Если bDMARD * или tsDMARD§ неэффективны , лечение с другим bDMARD или tsDMARD должны рассматриваться; если терапия одним TNF-ингибитор неэффективна, пациенты могут получить другой TNF-ингибитор или препарат с другой механизмом действия. Аналогичная рекомендация была представлена в 2013 году: «если первый bDMARD неэффективен, пациенты должны лечится другим bDMARD; Если терапии первым TNF-ингибитор неэффективна, пациенты могут получить другой TNF-ингибитор или биологический агента с другой механизмом действий». Действительно в исследованиях, опубликованные после разработки этих рекомендаций, даже основных не ответчиков к ФНО ингибитор были показали ответ на другой анти ФНО, что затрудняет выводы для последующего терапии по неэффективности при начальной , по сравнению с вторичной терапией блокаторы ФНО. Добавлением в первую части («или tsDMARD») частично необходима потому, что tsDMARDs (Як ингибирование) в настоящее время включены в предыдущие рекомендации 8 и 9; «Первый» был удален, потому что Целевая группа не решили проводить различие между неэффективности одного или нескольких bDMARDs. Однако, необходимо отметить, что в настоящее время не известно, если Jak ингибитор эффективна в первый раз и неэффективны в другой, не установлено, что второй ингибитор рецепторов ИЛ-6 или ингибиторов лиганд ИЛ-6 являются эффективными, если неэффективен tocilizumab — это по-прежнему частью исследовательской повестки дня. Мы также не имеем исследований, изучения если TNF-ингибиторы эффективной и безопасной, после неэффективности bDMARDs с другими механизмами деятельности, а также исследования, по переключения между различными механизмами действий. Несколько членов подняли вопрос, если использование csDMARDs следует учитывать также при bDMARDs неэффективны, но это предложение не получило большинства.
Целевая группа также было ясно о своей рекомендации, в которой любой bDMARD, в том числе другой TNF-ингибитор, может используется если TNF-ингибитор ранее неэффективен. Таким образом препараты с тем же или с другой механизмом действий рекомендуется в этой ситуации. Это было основано на данных клинических исследований, включая мета анализы и на тот факт, что в отличие от данных реестра, которые могут быть затронуты различные вмешивающиеся факторы, несколько новых перспективных исследований показывают, что нет никакой разницы между этими двумя подходами. В случае, когда второй TNF-ингибитор неэффективен, пациенты должны получать лекарство с другой механизмом действий. Однако, это очевидно (и поддерживается подавляющим большинством членов Целевой группы) что bsDMARD любого из boDMARDs ссылки, не должны использоваться, если соответствующие boDMARD (или другой bsDMARD той же молекулы) не показал достаточную эффективность или наоборот. LoE * 1а, §5; LoA 9.2
- Если пациент находится в постоянной ремиссии после постепенного снижения до полной отмены ГК, можно начать постепенное уменьшение bDMARDs, особенно если это лечение в сочетании с csDMARD. Этот пункт остается неизменным по сравнению с публикацией 2013. Были опубликованы новые данные которые оспаривают этот вывод. Сужающийся здесь означает снижение дозы или расширение интервала между введениями («spacing, дистанциирование»). Это не обязательно подразумевает прекращение bDMARD, которые могут привести к рецидиву болезни у большинства пациентов. Однако, даже если лечение будет остановлена и пациент «вспыхнет», большинство из них (> 80%) будет восстановить свои предыдущие хорошие результаты при возобновлении терапии (но у некоторых это не произойдет), и больные должны быть проинформированы соответственно. Существуют определенные прогностические факторы, в которых снижение будет скорее всего успешных, и они касаются главным образом раннего РА, глубины улучшения и продолжительность ремиссии; перспективные исследования, учитывая эти аспекты необходимо в будущем. Этот пункт также косвенно укрепляет рекомендации 9 о комбинированной терапии bDMARDs с усилителем MTX или другой csDMARD, поскольку он подразумевает, что bDMARDs следует прежде всего, если не только, будет постепенно уменьшено и возможно прекращено при сочетании с csDMARD, а уменьшение и прекращение монотерапии bDMARD был еще не изучала достаточно. LoE 2b; LoA 9.0.
- Если пациент находится в постоянной ремиссии, можно проводить постепенное уменьшение csDMARD. Версия 2013 соответствующие пункту 13 гласит: «В случае долгосрочной устойчивой ремиссии, осторожное снижение дозы csDMARD может считаться, общей решение между пациентом и врачом». Этот пункт вызвал значительные дискуссии, поскольку это будет означать, что оставляет пациентов с РА, или без каких-либо или с низкой дозой csDMARD. Но в целом, за последние годы было установлено никаких новых доказательств за или против этой точки зрения. В ходе обсуждения возникли противоречия. Было отмечено, что здесь, сужающийся означает, прежде всего снижение дозы и что прекращения csDMARDs может быть возможно только в исключительных случаях. Многие ревматологов на панели Целевой группы выразили мнение о том, что csDMARDs никогда не должна быть остановлена. Следовательно, этот пункт получил низкие LoA (8.5), хотя все еще довольно высокой, по шкале 0-10. Следует отметить часть сформулирована «как общие решения между пациентом и врачом» теперь был удален. По мнению Целевой группы, что упоминания общего решения для этого элемента среди всех 12 будет означать, что другие рекомендации не нужно привлекать пациента, или выделить эту конкретную рекомендацию по сравнению с все другие и таким образом компенсировать основополагающий принцип A. Очевидно, снятие этой фразы не означает, что общие решения с пациентами не важно, напротив: в соответствии с принципом A это крайне важное значение для этого и для всех других рекомендаций. LoE -4; LoA 8.5.
Эти обновленные рекомендации на рисунке 1изображены в сокращенном виде. Неотъемлемой частью этой фигуры являются соответствующие сноски, а также полный текст, представленные здесь.
Обсуждение
2016 обновление рекомендаций управления EULAR РА был разработан 50 экспертами, в том числе пациентов, ревматологов и других медицинских специалистов. Это был крупнейший Целевая группа когда-либо, созванной для разработки EULAR рекомендаций, как в отношении общего числа членов и количества европейских стран, и это также первый EULAR целевой группы с широкого международного представительства, поскольку ревматологов из нескольких других континентов приняли участие в этой деятельности. Это позволило нам также включить некоторые мнения от Азии и Латинской Америки и Северной Америки в разработке рекомендаций, ввод желаемой учитывая информацию, представленную в последних публикациях обновленный ACR и APLAR рекомендации.
Обновление 2016 представляет до сих пор «бережливые» EULAR рекомендации для управления РА. В то время как в 2010 году документ состоит из 3 общие принципы и рекомендации 15 и в 2013 году в нем 3 общие принципы и рекомендации 14, обновление 2016 получили 4 принципы и 12 рекомендаций. Несмотря на это сокращение, в свете постоянно растущей спектр терапевтических вариантов и новой информации о существующих агентов и терапевтические стратегии — это обновление включает более аспекты лечения и построен на базе доказательств лучше, чем когда-либо прежде. Это связано из-за наличия по крайней мере частичные ответы на несколько исследований вопросов, заданных в 2013 году, например, пункты 4, 6, 9 и 21,16 и многих новых данных по установленным и оригинальных лекарств, а также терапевтические стратегии.
Целевая группа придерживаться нескольких принципов, установленных в ходе разработки 2013 обновления и даже в 2010 году. Например, помимо доказательств на эффективность и безопасность, экономические аспекты обычно рассматриваются с учетом соответствующих общих спецификаций., Препараты, которые еще не были одобрены регулирующими органами, но были доступны, какие данные исследования III фазы были рассмотрены с той оговоркой, что их использование возможно только на такие утверждения. Это относится к bsDMARDs, для которых Целевая группа опирается на жесткости регулирования процессов EMA и FDA, для новых ингибиторов ИЛ-6 и Як ингибиторы, первый из которых был только лицензированные в некоторых частях мира в то время разработки этих рекомендаций, с увеличением доступности данных на других. Однако в то же время baricitinib был утвержден в Европейском союзе. Наконец Целевая группа вновь подтвердила свои предыдущие выводы о важности в стратификации по факторам риска неблагоприятного исхода РА, когда начальная терапия не удалась.
Следовательно, первых трех пунктов, которые были либо полностью оставил без изменений или были лишь незначительно изменены, связаны с точкой времени начала эффективной терапии (как только диагноз ставится и таким образом без потери времени); с определением цели лечения (устойчивой ремиссии или низкой болезни деятельности); и с контроль и необходимость достижения существенного улучшения деятельности болезни в течение 3 месяцев и достижения соответствующего цели в течение 6 месяцев. Предпочтительной инструментов для использования, когда после пациентов были определены в предыдущем EULAR предложениях, и включают комплексные меры, которые включают в себя суставной счет, например, CDAI, DAS28 и SDAI, а также определения ACR/EULAR ремиссии. Следует отметить инструменты, оценивающих острой фазы реакцию что может сильно преувеличивать ответных мер, особенно при ИЛ-6 или Як ингибиторов.
Цель лечения (строгие ремиссии или низкой активность болезни) продолжает определяется клинически, с учетом того что ультрасонографическая ремиссии не показал лучшие результаты по сравнению с таргетингом на клинического низкой активности заболевания или строгую ремиссии, но скорее индуцированных передозировкой и таким образом неэффективное использование ресурсов здравоохранения. Кроме того, не было стратегических исследования по доступны сравнивали применение серологические мультибиомаркеров активности болезнь тест (MBDA) multibiomarker disease activity (MBDA) с таргетингом на ремиссии, с использованием клинического оценки заболевания с клиническими комплексных мерой (с которым MBDA коррелирует так или иначе); следует отметить что MBDA тест сообщалось об улучшении в большей степени при использовании bDMARD, чем непосредственно назначение цитокина, по сравнению с одним что костимуляции цели Т-клеток, несмотря на аналогичные клинические, функциональные и рентгенографические результаты. Кроме того, следует предположить, что такие испытания ложно свидетельствуют о высокой болезни деятельности, когда имеет место инфекция. По всем этим причинам Целевая группа рекомендует следовать пациентов в клинической практике с помощью составного меру, которая включает в себя суставной счет и может включать в себя показатели острой фазы. Этот клинической оценки соответствующих каждый Лечебный этап (рис. 1).
Однако, последующие рекомендации, претерпели существенные изменения по сравнению с обновлением 2013. Хотя MTX (или присутствии нетерпимости других csDMARD) продолжает рассматриваться ключевой лекарство после того, как диагноз РА был достигнут (пункт 4), рекомендуется более решительно, чем прежде увеличивать MTX к дозе 25-30 мг еженедельно (с фолиевой кислоты), учитывая далее последние идеи о высокий результаты такой стратегии., Кроме того, сочетание csDMARDs, как монотерапия, с ГК более решительно предлагается чем в свете больше свидетельств того, что эта комбинация не уступает csDMARD комбинаций, даже если они применяются с GC, или bDMARDs плюс MTX с точки зрения эффективности и безопасности. В алгоритме обработки (рис. 1, этап I), это находит свое отражение соответствующие изменения от «±» на «+» для добавления GC к csDMARDs. Термин «низкодозированные» GC теперь были заменены «краткосрочных» GC, учитывая, что различные способы применения в разных дозах показали, чтобы быть эффективным. Кроме того, наиболее важных факторов снижения риска неблагоприятных событий, таких как сердечно-сосудистых событий, инфекции, диабет или гипертонии, считается признанным, для быстрого снижения к прекращению и низкой суммарной дозы GC. Это, действительно, в случае с этих альтернативных методов лечения GC.
В отличие от обновления 2013 csDMARD комбинированной терапии, с или без GC, больше не является явной частью рекомендаций. Этот вывод основан на появившихся доказательства что это комбинированной терапии csDMARD не может быть выше MTX монотерапия плюс GC, но могут быть связаны с увеличением числа неблагоприятных событий. A последние косвенные сравнение мета анализ предложил превосходство csDMARD комбинации против MTX монотерапия. Это исследование противоречит предыдущей прямого сравнения мета анализ, и с нашей собственной SLRs, и косвенных сравнений следует также рассматривать с оговоркой после их строгости и значение недостаточно для понимается на настоящее время. Интересно, что с помощью несколько иной подход и на основе независимой SLR, ACR руководство пришло к аналогичному выводу, как здесь представлены и рекомендует монотерапия MTX как первый DMARD в начале или установленным РА. Однако, использование комбинированной терапии csDMARD не исключается в новых рекомендациях, а это на усмотрение ревматолог, чтобы применить его в контексте рекомендации об использовании MTX как (первый) лечение «стратегия».
Если этапа I не смог достичь цели лечения, присутствии плохо прогностических маркеров или в отсутствие плохих прогностических маркеров после второй csDMARD стратегия неэффективна, Целевая группа рекомендует добавить любой bDMARD или, менее желательно, tsDMARD. Если в фаза II, как это показано в алгоритме, не достигнут цели лечение, другой bDMARD или tsDMARD должен применяться. Целевая группа подтвердила свою позицию, что, если TNF-ингибитор не эффективен, другой TNF-ингибитор — но не биосимиляр той же молекулы! — может быть столь же эффективным, как смена механизма действий. Наоборот эффективный биологический агент должен не должен переключаться на другой bDMARD по немедицинским причинам. Однако отсутствуют важные данные для некоторых лекарствам; например клинические испытания не рассматривал эффективность ингибитора ФНО после bDMARDs с другими механизмами действий или ингибитор Jak неэффективен. Аналогичные вопросы возникают для других агентов, а также для использования ингибиторов Ил 6R или ИЛ-6, например sarilumab или sirukumab, после tocilizumab не удалось (Вставка 1).
Вставка 1
Программа исследований
1.Как соотносится MTX монотерапия в сочетании с глюкокортикоидов при монотерапии сульфасалазин или leflunomide в сочетании с глюкокортикоидов, в дозах csDMARDs как используемые сегодня?
2.В какой пропорции больных индукционной терапии с bDMARD + MTX с последующим прекращением bDMARD эффективно в стимулировании устойчивой ремиссии?
3. Применение TNF-ингибитор после неудачного abatacept, tocilizumab, Ритуксимаб или ингибитор Jak, безопасным и эффективным?
4.Насколько безопасно и эффективно abatacept, tocilizumab и ритуксимаб после любого из других не ФНО ингибитор bDMARDs или tsDMARD не эффективны?
5.Как безопасно и эффективно использование ингибитора путь ИЛ-6, если другой путь ингибитор ИЛ-6 / ингибитор Як не эффективен?
6.Насколько безопасным и эффективным является использование Як ингибитор после другой ингибитор путь ИЛ-6 / другой Як ингибитор не эффективен?
7. Стратификация риска рекомендованного EULAR после неэффективности MTX улучшает результаты у лиц с факторами риска и не вредит тех, кто имеет плохие прогностические маркеры? У пациентов, которые не имеют плохой прогностические факторы получат пользу от перехода или добавление csDMARD как после добавления bDMARD?
8.Мы можем найти предикторы дифференциального реагирования на различные bDMARDs и tsDMARDs?
9.При запуске DMARD, как мы можем наилучшим предсказать кто, достигнет цели лечения (ремиссии или низкой болезни деятельности) и кто не?
10. Мы можем предсказать, кто будет поддерживать ремиссии после ухода bDMARD?
11. Мы сможем развивать точность (индивидуальный, стратифицированные) медицинских подходы при РА?
12. Тапперинг монотерапии bDMARD, где потенциально показана, сопоставима с bDMARD тапперинг в присутствии csDMARDs?
13. Будет РКИ по тапперинг по bDMARDs ориентируясь на предикторы для успешной отмены bDMARDs иметь результат?
14.Насколько хорошо пациенту присоединение к bDMARD или tsDMARD и может неприсоединение объяснять вторичные потери эффективности?
15. Это измерение в сыворотки содержания лекарств или уровни антител, полезные в клинической практике
16. Какие биомаркеры поможет найти лучшего предикторы плохой результат или ответа и которые потерпели неудачу в многочисленных клинических исследованиях, которые оценивали экспрессии генов и других биомаркеров?
17. Что такое эффект терапии csDMARD, tsDMARD и bDMARD на сердечно-сосудистые исходы и в какой степени потенциального воздействия зависит от клинического ответа?
18.Использование телемедицины или e- medicine электронной медицины эффективней чем прямой контакт в клинике для лечения до достижения цели стратегии?
Раннее лечение bDMARD, схема индукции ремиссии с последующей отменой bDMARDs, поддержанно в некоторые испытаний стратегии, было обсуждено, но не нашло большинства среди членов Целевой группы. Это решение было основано на отсутствие доказательств для превосходства такой терапии по сравнению с использованием MTX плюс GC. Кроме того, когда в контексте стратегии лечения цель, первоначального использования csDMARDs дает равные результаты в долгосрочной перспективе. Наконец эффективность терапии первой линии bDMARD, особенно в свете только что упомянутых причин очень мала.
2016 обновление рекомендаций EULAR основан на самые последние данные в области управления РА и на обсуждения в большой и широко международной целевой группы. Рекомендации синтезировать текущие мышления на подходе лечения РА в наборе общих принципов и рекомендаций. Они были составлены по SLRs на эффективность и безопасность лекарственных препаратов. Целевая группа убеждена что, придерживаясь этих рекомендаций, включая общие принятия решений, определения целевого лечения, оценки активности болезни регулярно соответствующими инструментами и применения последовательность лекарств как предлагается и в стратегию лечения цель, будет максимально общий результат в подавляющем большинстве больных с РА. Тем не менее значительная часть больных не достигнет цели несмотря на все усилия, и для этих пациентов будут необходимы новые препараты. Кроме того, новой информации от исследовательской деятельности на стратегии лечения, прогнозирования маркеры и другие аспекты станут доступны в ближайшем будущем и будет скорее всего потребует еще одно обновление рекомендаций в течении 3 лет; может быть у нас будет затем новые данные об исследованиях, которые повестки дня, включая точность медицины подходы в РА, которые позволяют прогнозировать, кто будет наилучшим образом отвечать на какой препарат на какой стадии заболевания. До этого мы надеемся, что 2016 обновление будет широко применяются в клинической практике и/или служить в качестве шаблона для национальных обществ для разработки местных рекомендаций.

 За последние 30 лет резко(драматично) изменилась лечение ревматоидного артрита (РА). Тогда, только несколько терапевтических агентов существовали, которые были минимально или не являлись эффективными, из-за токсичности и тот факт, что оптимальной дозировки и начало действия были не еще выяснен для некоторых агентов. Доступные методы лечения применялись поздно, а не в начале течения заболевания. Сформировалась понятие клиники раннего артрита, и эти успехи подпитывали переоценку критериев классификации, которые актуальны так как сосредоточены главным образом на длительности болезни. Терапевтические цели еще не были определены, поскольку облегчение симптомов, как представляется, является наиболее важной целью и концепция направленна на положении о заболевании как ремиссии или низкой активности болезни была в лучшем случае желательна.
На сегодняшний день мы располагаем многочисленными эффективными агентами. Среди обычных синтетических (cs) болезнь модифицирующие противоревматические препараты (DMARDs), мы адоптировали метотрексат (MTX), на его оптимальные использования, как якорное лекарство (anchor drug); кроме того, целый ряд биологических (b) DMARDs были утверждены, совсем недавно последовало утверждения первых целевых синтетических (ts) DMARD, и новые которые разрабатываются (во многих странах). Сегодня, новые критерии классификации РА содействовать выявлению больных на ранней стадии в их течения болезни, чем до этого и рекомендации были разработаны для лечения пациентов с РА через стратегические алгоритмы для оптимального результата, независимо от типов доступных методов лечения.
Ограниченное количество мер оценить ответ в клинических испытаниях и исследовать активности болезни в клинической практике широко используется и американского колледжа ревматологии (ACR) и Европейской лиги против ревматизма (EULAR) совместно разработали новые определения для ремиссии, которые обеспечивают оптимальный клинических исходов и может быть достигнуто в значительной части пациентов в исследованиях и практике. Достижения ремиссии по этим критериям, на основе индекса или Boolean, предотвратит разрушение суставов или по крайней мере прогрессирования повреждения суставов независимо от остаточной субклинической формы изменения, оптимизировать физические функции, улучшить качество жизни и продуктивность работы и снизить риски сопутствующих заболеваний.
В связи с недавней эволюцией контроля результатов лечения, основанных на доказательствах интерес к чисто симптоматическим препаратам значительно снизилась сегодня и болезнь модификация disease modification стала ключевой атрибут всех современных препаратов и лечения. Тем не менее симптоматические средства, а также меры физической, психологической поддержки и хирургии могут и имеют место в общем лечении РА. Однако, болезнь модификация является основой лечения РА и представляет собой смесь характеристик: облегчение признаков и симптомов; нормализация — или по крайней мере важным улучшением — нарушение физические функции, качества жизни и социальных и трудовых возможностей; и — как главной отличительной чертой DMARDs по сравнению с симптомами агентов — ингибирование структурных повреждений хряща и кости. Таким образом регистрация ингибирования прогрессирования повреждения при рентгенографии остается ключевой результат для классификации препарата как DMARD, так как рентгенограммах можно отображать костные и повреждение хряща и доказали чувствительность обнаруживать изменения даже при краткосрочных интервалах и при очень низких уровнях общей прогрессии в популяции. Быстрое достижение целевой конечной точки теперь имеет решающее значение, и для достижения цели лечения ремиссии или наименее низкой активности болезни в сроки от 6 месяцев, по крайней мере 50% клинического улучшения в течение 3 месяцев желательно.
С повышением требованием к уходу и результатам, лечение РА становится все более сложной в течение последнего десятилетия. Несмотря на наличие многих эффективных агентов, стратегии лечения, которые были разработаны и результаты оценок, которые позволяют эффективной последующей деятельности высокая стоимость терапии ограничивают широкое использование этих терапевтических подходов, создавая в значительной степени неравенства. Таким образом рекомендации управления на подход в лечении пациентов с РА стали все более полезными в предоставлении врачей, пациентов, страховщиков, регулирующими органами и другими поставщиками медицинских научно обоснованных рекомендаций, поддержке мнения экспертов участвует во многих из этих новых событий. Действительно EULAR недавно обновлены стандартизированные оперативные процедуры по разработке рекомендаций, которые включают аспекты расходов помимо учета для оценки доказательств и мнение эксперт.
EULAR разработал первый набор рекомендаций по управлению РА с DMARDs в 2010 году и обновление их в 2013 году. Они первоначально были основаны на доказательства, представленные пятью (2010) и 3 (2013) систематической литературе обзоры systematic literature reviews (SLRs). EULAR рекомендации были широко использованы. Они были переданы национальной ревматологии обществ и региональных лиг сообщить в разработке их собственных рекомендаций (например, канадский, французский, немецкий, мексиканская, Азиатско Тихоокеанского лига ассоциаций ревматологии (APLAR), Пан американской лиги Ассоциации ревматологов (PANLAR)), а также регулирующих органов.
В соответствии с нашим подходом для предоставления рекомендаций, на основе последних свидетельств, мы продолжали оценивать литература на клинические испытания новых агентов, новую информацию об установленных лекарств, новых стратегических исследований, новые взгляды на результаты оценки и новые идеи, связанные с исследовательской повестки дня за последние 3 года. Обилие новой информации побудило нас сейчас дальнейшее обновление EULAR рекомендации для управления РА с DMARDs.
Методы
После утверждения Исполнительным комитетом EULAR, руководитель (JSS) и методиста (RL) приглашены Руководящий комитет и целевую группу для работы на этом обновлении EULAR рекомендации для управления РА. Рекомендации 2010 и их 2013 обновление оригинальной EULAR стандартизировали оперативные процедуры для дальнейшей разработки рекомендации; Обновление 2016 вслед за недавно измененный вариант соответствовал этим стандартам, которые также предполагают соблюдение руководящих Appraisal of Guidelines for Research & Evaluation (AGREE), содержащихся в его обновленной версии (AGREE II).
Руководящий комитет
Руководящий комитет включал семь ревматологов, один представитель пациента и трех стипендиатов. Эта группа изначально разработаны вопросы исследования для трех SLRs. Эти SLRs сосредоточены на (i) эффективности синтетических (s) DMARDs (в виде монотерапии или в комбинации терапии, включая csDMARDs и ts DMARDs) и глюкокортикоидов (GC); (ii) эффективность bDMARDs (как монотерапии или в сочетании с csDMARDs) и (iii) аспекты безопасности sDMARDs и биологических (b) DMARDs. С этой целью оригинальный SLRs полученные в 2013 году служил в качестве отправной точки и обновленную информацию о литературе, опубликованные в период между 2013 и 2016 была выполнена. Новая информация о стратегии лечения также оценивалась в настоящей SLRs. формальных экономических анализов не были выполнены, но стоимость аспекты рассматривались на протяжении всего процесса с учетом текущего состояния подходов к выработке рекомендаций, в EULAR предыдущих SLR по аспектам расходов в контексте DMARD терапии и появлением биосимиляров. Три стипендиатов ревматологии (KC, JN, SR) выполняется SLRs (и проверил работу друг друга) анализировали существующие публикации базы данных рандомизированных контролируемых испытаний для эффективности и данные реестра для обеспечения безопасности, а также оценки недавних EULAR и ACR тезисов конгресса. Резюме выводов Summary-of-findings (SoF) таблицы были созданы и уровни доказательств levels of evidence (LoE) были определены с использованием стандартов Оксфордский центр доказательной медицины. Три SLRs, информировали Целевую группы и подробное описание методов их публикуются отдельно.
SoFs SLRs были представлены Руководящему комитету, который сформулировал предложение для обновления рекомендаций, основываясь на этой информации. Данные SLR и предложения Руководящего комитета были впоследствии представлены для всей целевой группы для дальнейшего обсуждения и в конечном итоге развития обновленные рекомендации.
Целевая группа
Целевая группа состояла из 50 человек, включая членов Руководящего комитета. Среди целевой группы входили три пациента, двух специалистов в области здравоохранения и двух делегатов молодых ревматологов EULAR сети новых Eular сети (EMEUNET). Ревматологов были все опытные в лечении РА и наиболее часто участвовали в клинических испытаниях; Кроме того, некоторые из них имели опыт ведения реестров пациентов их стран или в различных аспектах результатов исследований. Клиницисты и организаторы здравоохранения все имели опыт в консенсусе мероприятий, как и большинство ревматологов. Поскольку мы также пожелал для работы Целевой группы быть информированы ревматологами из других регионов мира, помимо широкого представительства из 14 европейских стран, 2 коллеги из Азии, 1 из Австралии, 2 из Латинской Америки и 2 из Северной Америки были приглашены принять участие. Некоторые из них активно участвовала в разработке документов их региональных лиг и/или национальных обществ. Все члены Целевой группы объявил их потенциальные конфликты интересов перед началом процесса.
Целевая группа согласилась на нескольких основных соображений авансом. Во-первых, все рекомендации, которые необходимо обсудить в контексте новых доказательств; где было никаких новых доказательств, затем бывший доказательная база. Во-вторых, любой из предыдущих рекомендаций (4 Общие принципы и рекомендации 14) можно сохранить как они были представлены в версии 2013, поправками, смещается в последовательности или удалены. В третих, препараты, которые не являются (пока) одобрил в Европе, но используется в другом месте в мире, или препараты, которые еще не прошел оценки регулирования, но для которых доказательства от клинических испытаний был доступен, могут быть рассмотрены в рекомендациях для некоторых ожидается эффект в клинической практике, со всеми соответствующими оговорками. Наконец было достигнуто согласие, что все рекомендации 2013, которые были либо подкрепляется новых доказательств или по которым не хватало информации, должны быть включены как ранее сформулированы, если некоторые компоненты теперь считаются неуместными.
После представления результатов SLR и Руководящего комитета предложения о внесении поправок в рекомендации Целевая группа была разделена на четыре контактных групп. Одна группа рассмотрела bDMARDs, второй группы csDMARDs, третий tsDMARDs и четвертый GC; все группы предложил проект формулировок для всей целевой группы соответствующих рекомендаций. В каждом из этих контактных групп были рассмотрены аспекты безопасности.
Поиск консенсуса
Представители каждой прорывной группы сообщили результаты соответствующих обсуждений и представил предложения в отношении формулировки отдельных рекомендаций для всей целевой группы. После этого состоялся процесс голосования.
Общепрограммной принцип или рекомендации для заключительного документа без дальнейших изменений требуется большинство 75% голосов в первом туре. Если этот результат не был достигнут, соответствующих текст был изменен и подвергается второй тур голосования, для которой требовалось большинство в 67%. Если это голосование не было успешным, текстовые изменения были предложены дополнительные пока ≥50% не было достигнуто. Рекомендации представлены как наконец на голосование. Результаты соответствующих последнего голосования представлены как процент голосующих членов. Примечания по содержание обсуждений и рассуждение за каждое решение, должен быть представлен в комментарии, сопровождающие их отдельных элементов. По различным причинам не каждый член Целевой группы присутствовал в зале на протяжении всей встречи, и, следовательно, там были небольшие вариации в количестве голосов. Однако, в каждый момент времени> 90% членов участвовали в бюллетенях.
После очные встречи, рекомендаций, как это было согласовано Рабочей группой, были подвергнуты анонимный голосования (по электронной почте) на уровнях соглашения (LoA). Каждая рекомендация получил балл по шкале 0-10, 0 означает нет соглашение вообще и 10 абсолютный соглашения. В ходе этого процесса через несколько недель после совещания, один человек вышли из целевой группы, потому что включение csDMARD комбинированной терапии в рекомендации не нашли большинство во время процесса предыдущего голосования. Этот коллега присутствовал и проголосовали на протяжении очные встречи и соответствующих голосов по всем рекомендациям приходилось соответственно, но в конечном итоге лицо отказалось от авторства и голосование не учитывалось в LoA.
Проект манускрипта был направлен всем членам Целевой группы за их комментариями. После включения этих замечаний он был представлен EULAR Исполнительному комитету для рассмотрения и утверждения; в это время он был вновь направлен членам Целевой группы. Заключительные замечания были получены от членов Целевой группы и Исполнительного комитета и рассмотрены в рукописи, который был затем представлен с одобрения Исполнительным комитетом EULAR.
Результаты
Общие аспекты
Как прежде, 2016 обновление рекомендаций управления EULAR РА отражает баланс клинических, функциональные и структурные эффективность, безопасность, затраты и пациенты восприятие как воспринимаемо целевой группой. В общей формулировке рекомендаций были рассмотрены аспект лекарственной токсичности, но данные представлены только в безопасности SLR , поскольку предполагается, что назначают известно о безопасности информации, представленной в производителей вкладыши различных агентов. Кроме того, EULAR разработал серию документов, касающихся безопасности аспектов РА лекарств, и различных других изданий рассматривали эти аспекты. В частности, как это также было предложено безопасности SLR, основные риски и bDMARDs (также tsDMARDs) связано с инфекциями, и недавно были разработаны рекомендации по вакцинации, а также оценка, позволяющая рассчитать риск инфекции у больных подвержены bDMARDs. Для всех лекарств, обсуждаемые в этом документе, резюме документа характеристики продукта предоставляет ценную информацию о рисках, побочные эффекты и необходимость мониторинга. Приведенные здесь рекомендации никоим образом не должно толковаться как допускающее отступления от этой информации. В любом случае, когда токсичности является серьезной проблемой, конкретное предупреждение предоставляется в рамках соответствующей рекомендации или сопровождающие комментарии. Примечание, три SLRs, а также текст сопровождающие каждый элемент должны рассматриваться как неотъемлемая часть этой рекомендации. Индивидуальный ключевые точки представляют сокращенный выводы из обсуждений и, как таковой, не охватывают все аспекты, связанные с конкретной темы; напротив, такие аспекты освещены более подробно в соответствующих пояснительной части в разделе результаты.
При классификации DMARDs, Целевая группа придерживается ранее использовавшихся номенклатура как показано в таблице 1. В таблице 1 также обеспечивает Глоссарий терминов, используемых в рекомендациях. Целевая группа не проводится различия между ранней и установленным РА относительно рекомендации виды лекарств, но скорее выделить этапы процесса лечения путем дифференциации между пациентами, которые «наивны» любой DMARD терапии, пациенты, которые имели недостаточный отклик insufficient response (IR) на первоначального курсы initial course(s) csDMARDs и тех, кто имел IR bDMARDs. Существует в настоящее время никаких доказательств для дифференциальных ответов, исключительно на основании продолжительности заболевания, когда различия основываются на оценке ущерба из-за задержки лечения. Действительно испытания на MTX-наивно пациентов с РА отобранных по различные болезни длительности, которая колеблется от нескольких месяцев до нескольких лет, без заметных различий по результатам на косвенные сравнения. Однако, Целевая группа проводит различие между ранним и установленным РА с точки зрения целевых результатов (см. рекомендацию 2). Целевая группа также учитывал прогностические факторы (Таблица 1), которые имеют аналогичные прогностической силой независимо от длительности заболевания. В примечании, рекомендации по управлению ранней артрита, включая недифференцированные артрит, были недавно обновлены. Настоящие рекомендаций касаются лечению больных с РА от момента установления его диагноза и не доказанному РА или недифференцированному артритам.
Таблица 1
Словарь терминов и определений (Глоссарий и дефиниции)
За последние 30 лет резко(драматично) изменилась лечение ревматоидного артрита (РА). Тогда, только несколько терапевтических агентов существовали, которые были минимально или не являлись эффективными, из-за токсичности и тот факт, что оптимальной дозировки и начало действия были не еще выяснен для некоторых агентов. Доступные методы лечения применялись поздно, а не в начале течения заболевания. Сформировалась понятие клиники раннего артрита, и эти успехи подпитывали переоценку критериев классификации, которые актуальны так как сосредоточены главным образом на длительности болезни. Терапевтические цели еще не были определены, поскольку облегчение симптомов, как представляется, является наиболее важной целью и концепция направленна на положении о заболевании как ремиссии или низкой активности болезни была в лучшем случае желательна.
На сегодняшний день мы располагаем многочисленными эффективными агентами. Среди обычных синтетических (cs) болезнь модифицирующие противоревматические препараты (DMARDs), мы адоптировали метотрексат (MTX), на его оптимальные использования, как якорное лекарство (anchor drug); кроме того, целый ряд биологических (b) DMARDs были утверждены, совсем недавно последовало утверждения первых целевых синтетических (ts) DMARD, и новые которые разрабатываются (во многих странах). Сегодня, новые критерии классификации РА содействовать выявлению больных на ранней стадии в их течения болезни, чем до этого и рекомендации были разработаны для лечения пациентов с РА через стратегические алгоритмы для оптимального результата, независимо от типов доступных методов лечения.
Ограниченное количество мер оценить ответ в клинических испытаниях и исследовать активности болезни в клинической практике широко используется и американского колледжа ревматологии (ACR) и Европейской лиги против ревматизма (EULAR) совместно разработали новые определения для ремиссии, которые обеспечивают оптимальный клинических исходов и может быть достигнуто в значительной части пациентов в исследованиях и практике. Достижения ремиссии по этим критериям, на основе индекса или Boolean, предотвратит разрушение суставов или по крайней мере прогрессирования повреждения суставов независимо от остаточной субклинической формы изменения, оптимизировать физические функции, улучшить качество жизни и продуктивность работы и снизить риски сопутствующих заболеваний.
В связи с недавней эволюцией контроля результатов лечения, основанных на доказательствах интерес к чисто симптоматическим препаратам значительно снизилась сегодня и болезнь модификация disease modification стала ключевой атрибут всех современных препаратов и лечения. Тем не менее симптоматические средства, а также меры физической, психологической поддержки и хирургии могут и имеют место в общем лечении РА. Однако, болезнь модификация является основой лечения РА и представляет собой смесь характеристик: облегчение признаков и симптомов; нормализация — или по крайней мере важным улучшением — нарушение физические функции, качества жизни и социальных и трудовых возможностей; и — как главной отличительной чертой DMARDs по сравнению с симптомами агентов — ингибирование структурных повреждений хряща и кости. Таким образом регистрация ингибирования прогрессирования повреждения при рентгенографии остается ключевой результат для классификации препарата как DMARD, так как рентгенограммах можно отображать костные и повреждение хряща и доказали чувствительность обнаруживать изменения даже при краткосрочных интервалах и при очень низких уровнях общей прогрессии в популяции. Быстрое достижение целевой конечной точки теперь имеет решающее значение, и для достижения цели лечения ремиссии или наименее низкой активности болезни в сроки от 6 месяцев, по крайней мере 50% клинического улучшения в течение 3 месяцев желательно.
С повышением требованием к уходу и результатам, лечение РА становится все более сложной в течение последнего десятилетия. Несмотря на наличие многих эффективных агентов, стратегии лечения, которые были разработаны и результаты оценок, которые позволяют эффективной последующей деятельности высокая стоимость терапии ограничивают широкое использование этих терапевтических подходов, создавая в значительной степени неравенства. Таким образом рекомендации управления на подход в лечении пациентов с РА стали все более полезными в предоставлении врачей, пациентов, страховщиков, регулирующими органами и другими поставщиками медицинских научно обоснованных рекомендаций, поддержке мнения экспертов участвует во многих из этих новых событий. Действительно EULAR недавно обновлены стандартизированные оперативные процедуры по разработке рекомендаций, которые включают аспекты расходов помимо учета для оценки доказательств и мнение эксперт.
EULAR разработал первый набор рекомендаций по управлению РА с DMARDs в 2010 году и обновление их в 2013 году. Они первоначально были основаны на доказательства, представленные пятью (2010) и 3 (2013) систематической литературе обзоры systematic literature reviews (SLRs). EULAR рекомендации были широко использованы. Они были переданы национальной ревматологии обществ и региональных лиг сообщить в разработке их собственных рекомендаций (например, канадский, французский, немецкий, мексиканская, Азиатско Тихоокеанского лига ассоциаций ревматологии (APLAR), Пан американской лиги Ассоциации ревматологов (PANLAR)), а также регулирующих органов.
В соответствии с нашим подходом для предоставления рекомендаций, на основе последних свидетельств, мы продолжали оценивать литература на клинические испытания новых агентов, новую информацию об установленных лекарств, новых стратегических исследований, новые взгляды на результаты оценки и новые идеи, связанные с исследовательской повестки дня за последние 3 года. Обилие новой информации побудило нас сейчас дальнейшее обновление EULAR рекомендации для управления РА с DMARDs.
Методы
После утверждения Исполнительным комитетом EULAR, руководитель (JSS) и методиста (RL) приглашены Руководящий комитет и целевую группу для работы на этом обновлении EULAR рекомендации для управления РА. Рекомендации 2010 и их 2013 обновление оригинальной EULAR стандартизировали оперативные процедуры для дальнейшей разработки рекомендации; Обновление 2016 вслед за недавно измененный вариант соответствовал этим стандартам, которые также предполагают соблюдение руководящих Appraisal of Guidelines for Research & Evaluation (AGREE), содержащихся в его обновленной версии (AGREE II).
Руководящий комитет
Руководящий комитет включал семь ревматологов, один представитель пациента и трех стипендиатов. Эта группа изначально разработаны вопросы исследования для трех SLRs. Эти SLRs сосредоточены на (i) эффективности синтетических (s) DMARDs (в виде монотерапии или в комбинации терапии, включая csDMARDs и ts DMARDs) и глюкокортикоидов (GC); (ii) эффективность bDMARDs (как монотерапии или в сочетании с csDMARDs) и (iii) аспекты безопасности sDMARDs и биологических (b) DMARDs. С этой целью оригинальный SLRs полученные в 2013 году служил в качестве отправной точки и обновленную информацию о литературе, опубликованные в период между 2013 и 2016 была выполнена. Новая информация о стратегии лечения также оценивалась в настоящей SLRs. формальных экономических анализов не были выполнены, но стоимость аспекты рассматривались на протяжении всего процесса с учетом текущего состояния подходов к выработке рекомендаций, в EULAR предыдущих SLR по аспектам расходов в контексте DMARD терапии и появлением биосимиляров. Три стипендиатов ревматологии (KC, JN, SR) выполняется SLRs (и проверил работу друг друга) анализировали существующие публикации базы данных рандомизированных контролируемых испытаний для эффективности и данные реестра для обеспечения безопасности, а также оценки недавних EULAR и ACR тезисов конгресса. Резюме выводов Summary-of-findings (SoF) таблицы были созданы и уровни доказательств levels of evidence (LoE) были определены с использованием стандартов Оксфордский центр доказательной медицины. Три SLRs, информировали Целевую группы и подробное описание методов их публикуются отдельно.
SoFs SLRs были представлены Руководящему комитету, который сформулировал предложение для обновления рекомендаций, основываясь на этой информации. Данные SLR и предложения Руководящего комитета были впоследствии представлены для всей целевой группы для дальнейшего обсуждения и в конечном итоге развития обновленные рекомендации.
Целевая группа
Целевая группа состояла из 50 человек, включая членов Руководящего комитета. Среди целевой группы входили три пациента, двух специалистов в области здравоохранения и двух делегатов молодых ревматологов EULAR сети новых Eular сети (EMEUNET). Ревматологов были все опытные в лечении РА и наиболее часто участвовали в клинических испытаниях; Кроме того, некоторые из них имели опыт ведения реестров пациентов их стран или в различных аспектах результатов исследований. Клиницисты и организаторы здравоохранения все имели опыт в консенсусе мероприятий, как и большинство ревматологов. Поскольку мы также пожелал для работы Целевой группы быть информированы ревматологами из других регионов мира, помимо широкого представительства из 14 европейских стран, 2 коллеги из Азии, 1 из Австралии, 2 из Латинской Америки и 2 из Северной Америки были приглашены принять участие. Некоторые из них активно участвовала в разработке документов их региональных лиг и/или национальных обществ. Все члены Целевой группы объявил их потенциальные конфликты интересов перед началом процесса.
Целевая группа согласилась на нескольких основных соображений авансом. Во-первых, все рекомендации, которые необходимо обсудить в контексте новых доказательств; где было никаких новых доказательств, затем бывший доказательная база. Во-вторых, любой из предыдущих рекомендаций (4 Общие принципы и рекомендации 14) можно сохранить как они были представлены в версии 2013, поправками, смещается в последовательности или удалены. В третих, препараты, которые не являются (пока) одобрил в Европе, но используется в другом месте в мире, или препараты, которые еще не прошел оценки регулирования, но для которых доказательства от клинических испытаний был доступен, могут быть рассмотрены в рекомендациях для некоторых ожидается эффект в клинической практике, со всеми соответствующими оговорками. Наконец было достигнуто согласие, что все рекомендации 2013, которые были либо подкрепляется новых доказательств или по которым не хватало информации, должны быть включены как ранее сформулированы, если некоторые компоненты теперь считаются неуместными.
После представления результатов SLR и Руководящего комитета предложения о внесении поправок в рекомендации Целевая группа была разделена на четыре контактных групп. Одна группа рассмотрела bDMARDs, второй группы csDMARDs, третий tsDMARDs и четвертый GC; все группы предложил проект формулировок для всей целевой группы соответствующих рекомендаций. В каждом из этих контактных групп были рассмотрены аспекты безопасности.
Поиск консенсуса
Представители каждой прорывной группы сообщили результаты соответствующих обсуждений и представил предложения в отношении формулировки отдельных рекомендаций для всей целевой группы. После этого состоялся процесс голосования.
Общепрограммной принцип или рекомендации для заключительного документа без дальнейших изменений требуется большинство 75% голосов в первом туре. Если этот результат не был достигнут, соответствующих текст был изменен и подвергается второй тур голосования, для которой требовалось большинство в 67%. Если это голосование не было успешным, текстовые изменения были предложены дополнительные пока ≥50% не было достигнуто. Рекомендации представлены как наконец на голосование. Результаты соответствующих последнего голосования представлены как процент голосующих членов. Примечания по содержание обсуждений и рассуждение за каждое решение, должен быть представлен в комментарии, сопровождающие их отдельных элементов. По различным причинам не каждый член Целевой группы присутствовал в зале на протяжении всей встречи, и, следовательно, там были небольшие вариации в количестве голосов. Однако, в каждый момент времени> 90% членов участвовали в бюллетенях.
После очные встречи, рекомендаций, как это было согласовано Рабочей группой, были подвергнуты анонимный голосования (по электронной почте) на уровнях соглашения (LoA). Каждая рекомендация получил балл по шкале 0-10, 0 означает нет соглашение вообще и 10 абсолютный соглашения. В ходе этого процесса через несколько недель после совещания, один человек вышли из целевой группы, потому что включение csDMARD комбинированной терапии в рекомендации не нашли большинство во время процесса предыдущего голосования. Этот коллега присутствовал и проголосовали на протяжении очные встречи и соответствующих голосов по всем рекомендациям приходилось соответственно, но в конечном итоге лицо отказалось от авторства и голосование не учитывалось в LoA.
Проект манускрипта был направлен всем членам Целевой группы за их комментариями. После включения этих замечаний он был представлен EULAR Исполнительному комитету для рассмотрения и утверждения; в это время он был вновь направлен членам Целевой группы. Заключительные замечания были получены от членов Целевой группы и Исполнительного комитета и рассмотрены в рукописи, который был затем представлен с одобрения Исполнительным комитетом EULAR.
Результаты
Общие аспекты
Как прежде, 2016 обновление рекомендаций управления EULAR РА отражает баланс клинических, функциональные и структурные эффективность, безопасность, затраты и пациенты восприятие как воспринимаемо целевой группой. В общей формулировке рекомендаций были рассмотрены аспект лекарственной токсичности, но данные представлены только в безопасности SLR , поскольку предполагается, что назначают известно о безопасности информации, представленной в производителей вкладыши различных агентов. Кроме того, EULAR разработал серию документов, касающихся безопасности аспектов РА лекарств, и различных других изданий рассматривали эти аспекты. В частности, как это также было предложено безопасности SLR, основные риски и bDMARDs (также tsDMARDs) связано с инфекциями, и недавно были разработаны рекомендации по вакцинации, а также оценка, позволяющая рассчитать риск инфекции у больных подвержены bDMARDs. Для всех лекарств, обсуждаемые в этом документе, резюме документа характеристики продукта предоставляет ценную информацию о рисках, побочные эффекты и необходимость мониторинга. Приведенные здесь рекомендации никоим образом не должно толковаться как допускающее отступления от этой информации. В любом случае, когда токсичности является серьезной проблемой, конкретное предупреждение предоставляется в рамках соответствующей рекомендации или сопровождающие комментарии. Примечание, три SLRs, а также текст сопровождающие каждый элемент должны рассматриваться как неотъемлемая часть этой рекомендации. Индивидуальный ключевые точки представляют сокращенный выводы из обсуждений и, как таковой, не охватывают все аспекты, связанные с конкретной темы; напротив, такие аспекты освещены более подробно в соответствующих пояснительной части в разделе результаты.
При классификации DMARDs, Целевая группа придерживается ранее использовавшихся номенклатура как показано в таблице 1. В таблице 1 также обеспечивает Глоссарий терминов, используемых в рекомендациях. Целевая группа не проводится различия между ранней и установленным РА относительно рекомендации виды лекарств, но скорее выделить этапы процесса лечения путем дифференциации между пациентами, которые «наивны» любой DMARD терапии, пациенты, которые имели недостаточный отклик insufficient response (IR) на первоначального курсы initial course(s) csDMARDs и тех, кто имел IR bDMARDs. Существует в настоящее время никаких доказательств для дифференциальных ответов, исключительно на основании продолжительности заболевания, когда различия основываются на оценке ущерба из-за задержки лечения. Действительно испытания на MTX-наивно пациентов с РА отобранных по различные болезни длительности, которая колеблется от нескольких месяцев до нескольких лет, без заметных различий по результатам на косвенные сравнения. Однако, Целевая группа проводит различие между ранним и установленным РА с точки зрения целевых результатов (см. рекомендацию 2). Целевая группа также учитывал прогностические факторы (Таблица 1), которые имеют аналогичные прогностической силой независимо от длительности заболевания. В примечании, рекомендации по управлению ранней артрита, включая недифференцированные артрит, были недавно обновлены. Настоящие рекомендаций касаются лечению больных с РА от момента установления его диагноза и не доказанному РА или недифференцированному артритам.
Таблица 1
Словарь терминов и определений (Глоссарий и дефиниции)
 Общие принципы
Как и в предыдущих версиях Целевая группа одобрила представление общих принципов для лечения больных с РА как общепрограммной (Таблица 2). Их природа настолько универсален, что не было никаких основывать их на специфических поисках или LoE, но в то же время Группа считает, что важно сообщать о них как основы, на которых были основаны фактические рекомендации. Однако хотя все три бывших всеобъемлющих принципа были сохранены как было сформулировано в 2010 году, Целевая группа добавила четвертое как основополагающий принцип В.
Общие принципы
Как и в предыдущих версиях Целевая группа одобрила представление общих принципов для лечения больных с РА как общепрограммной (Таблица 2). Их природа настолько универсален, что не было никаких основывать их на специфических поисках или LoE, но в то же время Группа считает, что важно сообщать о них как основы, на которых были основаны фактические рекомендации. Однако хотя все три бывших всеобъемлющих принципа были сохранены как было сформулировано в 2010 году, Целевая группа добавила четвертое как основополагающий принцип В.

 Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Заявив, ‘.. .tapered(снижение на конус при заточке карандаша) как быстро как клинически возможно ‘, Целевая группа подчеркивает, что ГК следует постепенно уменьшается и в конечном итоге отменить, обычно в течение 3 месяцев от начала лечения и только в исключительных случаях на 6 месяцев. Длительное применение GC, особенно в дозах выше 5 мг/сут, следует избегать из-за многих потенциальных рисков, представленный в SLR (системный литературный обзор). В то время как некоторые из этих рисков может быть связано смешиваться с указанием на высоким болезни активности, доказательства для увеличения общей и сердечно-сосудистой смертности в дозе выше порога 7,5 мг/сут или суммарной дозы 40 g является значительным. Известно, что применение GC как единственного терапевтического средства в больных с IR при переходе к csDMARD терапии не передать хорошую эффективность и связан с значительные неблагоприятные события. Кроме того, если GC не могут быть отменены в течение сроков, упомянутых выше, DMARD терапии возможно будет неэффективной. Наконец внутрисуставное GC введение может рассматриваться в некоторых случаях, например, остаточно воспаленной или рецидив артрита.
Некоторые члены Целевой группы выступал за хроническое использование GC как возможность для некоторых пациентов; Однако это предложение не было одобрено большинством. В то время как ключевой точкой по GC был, как и в предыдущие годы, наиболее активно обсуждается, окончательная формулировка получил 98% большинством голосов. Однако, LoA был гораздо ниже (8,7), с учетом рекомендаций предыдущих версий. Это относительно низкая LoA, вероятно, объясняется тем, что многие члены Целевой группы считает, что этот пункт был слишком либеральным и использования GC должна быть более ограниченной, в то время как другие высказали мнение, что он был слишком ограничительный характер. LoЕ1а; LoA 8.7.
Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Заявив, ‘.. .tapered(снижение на конус при заточке карандаша) как быстро как клинически возможно ‘, Целевая группа подчеркивает, что ГК следует постепенно уменьшается и в конечном итоге отменить, обычно в течение 3 месяцев от начала лечения и только в исключительных случаях на 6 месяцев. Длительное применение GC, особенно в дозах выше 5 мг/сут, следует избегать из-за многих потенциальных рисков, представленный в SLR (системный литературный обзор). В то время как некоторые из этих рисков может быть связано смешиваться с указанием на высоким болезни активности, доказательства для увеличения общей и сердечно-сосудистой смертности в дозе выше порога 7,5 мг/сут или суммарной дозы 40 g является значительным. Известно, что применение GC как единственного терапевтического средства в больных с IR при переходе к csDMARD терапии не передать хорошую эффективность и связан с значительные неблагоприятные события. Кроме того, если GC не могут быть отменены в течение сроков, упомянутых выше, DMARD терапии возможно будет неэффективной. Наконец внутрисуставное GC введение может рассматриваться в некоторых случаях, например, остаточно воспаленной или рецидив артрита.
Некоторые члены Целевой группы выступал за хроническое использование GC как возможность для некоторых пациентов; Однако это предложение не было одобрено большинством. В то время как ключевой точкой по GC был, как и в предыдущие годы, наиболее активно обсуждается, окончательная формулировка получил 98% большинством голосов. Однако, LoA был гораздо ниже (8,7), с учетом рекомендаций предыдущих версий. Это относительно низкая LoA, вероятно, объясняется тем, что многие члены Целевой группы считает, что этот пункт был слишком либеральным и использования GC должна быть более ограниченной, в то время как другие высказали мнение, что он был слишком ограничительный характер. LoЕ1а; LoA 8.7.


 За последние 30 лет резко(драматично) изменилась лечение ревматоидного артрита (РА). Тогда, только несколько терапевтических агентов существовали, которые были минимально или не являлись эффективными, из-за токсичности и тот факт, что оптимальной дозировки и начало действия были не еще выяснен для некоторых агентов. Доступные методы лечения применялись поздно, а не в начале течения заболевания. Сформировалась понятие клиники раннего артрита, и эти успехи подпитывали переоценку критериев классификации, которые актуальны так как сосредоточены главным образом на длительности болезни. Терапевтические цели еще не были определены, поскольку облегчение симптомов, как представляется, является наиболее важной целью и концепция направленна на положении о заболевании как ремиссии или низкой активности болезни была в лучшем случае желательна.
На сегодняшний день мы располагаем многочисленными эффективными агентами. Среди обычных синтетических (cs) болезнь модифицирующие противоревматические препараты (DMARDs), мы адоптировали метотрексат (MTX), на его оптимальные использования, как якорное лекарство (anchor drug); кроме того, целый ряд биологических (b) DMARDs были утверждены, совсем недавно последовало утверждения первых целевых синтетических (ts) DMARD, и новые которые разрабатываются (во многих странах). Сегодня, новые критерии классификации РА содействовать выявлению больных на ранней стадии в их течения болезни, чем до этого и рекомендации были разработаны для лечения пациентов с РА через стратегические алгоритмы для оптимального результата, независимо от типов доступных методов лечения.
Ограниченное количество мер оценить ответ в клинических испытаниях и исследовать активности болезни в клинической практике широко используется и американского колледжа ревматологии (ACR) и Европейской лиги против ревматизма (EULAR) совместно разработали новые определения для ремиссии, которые обеспечивают оптимальный клинических исходов и может быть достигнуто в значительной части пациентов в исследованиях и практике. Достижения ремиссии по этим критериям, на основе индекса или Boolean, предотвратит разрушение суставов или по крайней мере прогрессирования повреждения суставов независимо от остаточной субклинической формы изменения, оптимизировать физические функции, улучшить качество жизни и продуктивность работы и снизить риски сопутствующих заболеваний.
В связи с недавней эволюцией контроля результатов лечения, основанных на доказательствах интерес к чисто симптоматическим препаратам значительно снизилась сегодня и болезнь модификация disease modification стала ключевой атрибут всех современных препаратов и лечения. Тем не менее симптоматические средства, а также меры физической, психологической поддержки и хирургии могут и имеют место в общем лечении РА. Однако, болезнь модификация является основой лечения РА и представляет собой смесь характеристик: облегчение признаков и симптомов; нормализация — или по крайней мере важным улучшением — нарушение физические функции, качества жизни и социальных и трудовых возможностей; и — как главной отличительной чертой DMARDs по сравнению с симптомами агентов — ингибирование структурных повреждений хряща и кости. Таким образом регистрация ингибирования прогрессирования повреждения при рентгенографии остается ключевой результат для классификации препарата как DMARD, так как рентгенограммах можно отображать костные и повреждение хряща и доказали чувствительность обнаруживать изменения даже при краткосрочных интервалах и при очень низких уровнях общей прогрессии в популяции. Быстрое достижение целевой конечной точки теперь имеет решающее значение, и для достижения цели лечения ремиссии или наименее низкой активности болезни в сроки от 6 месяцев, по крайней мере 50% клинического улучшения в течение 3 месяцев желательно.
С повышением требованием к уходу и результатам, лечение РА становится все более сложной в течение последнего десятилетия. Несмотря на наличие многих эффективных агентов, стратегии лечения, которые были разработаны и результаты оценок, которые позволяют эффективной последующей деятельности высокая стоимость терапии ограничивают широкое использование этих терапевтических подходов, создавая в значительной степени неравенства. Таким образом рекомендации управления на подход в лечении пациентов с РА стали все более полезными в предоставлении врачей, пациентов, страховщиков, регулирующими органами и другими поставщиками медицинских научно обоснованных рекомендаций, поддержке мнения экспертов участвует во многих из этих новых событий. Действительно EULAR недавно обновлены стандартизированные оперативные процедуры по разработке рекомендаций, которые включают аспекты расходов помимо учета для оценки доказательств и мнение эксперт.
EULAR разработал первый набор рекомендаций по управлению РА с DMARDs в 2010 году и обновление их в 2013 году. Они первоначально были основаны на доказательства, представленные пятью (2010) и 3 (2013) систематической литературе обзоры systematic literature reviews (SLRs). EULAR рекомендации были широко использованы. Они были переданы национальной ревматологии обществ и региональных лиг сообщить в разработке их собственных рекомендаций (например, канадский, французский, немецкий, мексиканская, Азиатско Тихоокеанского лига ассоциаций ревматологии (APLAR), Пан американской лиги Ассоциации ревматологов (PANLAR)), а также регулирующих органов.
В соответствии с нашим подходом для предоставления рекомендаций, на основе последних свидетельств, мы продолжали оценивать литература на клинические испытания новых агентов, новую информацию об установленных лекарств, новых стратегических исследований, новые взгляды на результаты оценки и новые идеи, связанные с исследовательской повестки дня за последние 3 года. Обилие новой информации побудило нас сейчас дальнейшее обновление EULAR рекомендации для управления РА с DMARDs.
Методы
После утверждения Исполнительным комитетом EULAR, руководитель (JSS) и методиста (RL) приглашены Руководящий комитет и целевую группу для работы на этом обновлении EULAR рекомендации для управления РА. Рекомендации 2010 и их 2013 обновление оригинальной EULAR стандартизировали оперативные процедуры для дальнейшей разработки рекомендации; Обновление 2016 вслед за недавно измененный вариант соответствовал этим стандартам, которые также предполагают соблюдение руководящих Appraisal of Guidelines for Research & Evaluation (AGREE), содержащихся в его обновленной версии (AGREE II).
Руководящий комитет
Руководящий комитет включал семь ревматологов, один представитель пациента и трех стипендиатов. Эта группа изначально разработаны вопросы исследования для трех SLRs. Эти SLRs сосредоточены на (i) эффективности синтетических (s) DMARDs (в виде монотерапии или в комбинации терапии, включая csDMARDs и ts DMARDs) и глюкокортикоидов (GC); (ii) эффективность bDMARDs (как монотерапии или в сочетании с csDMARDs) и (iii) аспекты безопасности sDMARDs и биологических (b) DMARDs. С этой целью оригинальный SLRs полученные в 2013 году служил в качестве отправной точки и обновленную информацию о литературе, опубликованные в период между 2013 и 2016 была выполнена. Новая информация о стратегии лечения также оценивалась в настоящей SLRs. формальных экономических анализов не были выполнены, но стоимость аспекты рассматривались на протяжении всего процесса с учетом текущего состояния подходов к выработке рекомендаций, в EULAR предыдущих SLR по аспектам расходов в контексте DMARD терапии и появлением биосимиляров. Три стипендиатов ревматологии (KC, JN, SR) выполняется SLRs (и проверил работу друг друга) анализировали существующие публикации базы данных рандомизированных контролируемых испытаний для эффективности и данные реестра для обеспечения безопасности, а также оценки недавних EULAR и ACR тезисов конгресса. Резюме выводов Summary-of-findings (SoF) таблицы были созданы и уровни доказательств levels of evidence (LoE) были определены с использованием стандартов Оксфордский центр доказательной медицины. Три SLRs, информировали Целевую группы и подробное описание методов их публикуются отдельно.
SoFs SLRs были представлены Руководящему комитету, который сформулировал предложение для обновления рекомендаций, основываясь на этой информации. Данные SLR и предложения Руководящего комитета были впоследствии представлены для всей целевой группы для дальнейшего обсуждения и в конечном итоге развития обновленные рекомендации.
Целевая группа
Целевая группа состояла из 50 человек, включая членов Руководящего комитета. Среди целевой группы входили три пациента, двух специалистов в области здравоохранения и двух делегатов молодых ревматологов EULAR сети новых Eular сети (EMEUNET). Ревматологов были все опытные в лечении РА и наиболее часто участвовали в клинических испытаниях; Кроме того, некоторые из них имели опыт ведения реестров пациентов их стран или в различных аспектах результатов исследований. Клиницисты и организаторы здравоохранения все имели опыт в консенсусе мероприятий, как и большинство ревматологов. Поскольку мы также пожелал для работы Целевой группы быть информированы ревматологами из других регионов мира, помимо широкого представительства из 14 европейских стран, 2 коллеги из Азии, 1 из Австралии, 2 из Латинской Америки и 2 из Северной Америки были приглашены принять участие. Некоторые из них активно участвовала в разработке документов их региональных лиг и/или национальных обществ. Все члены Целевой группы объявил их потенциальные конфликты интересов перед началом процесса.
Целевая группа согласилась на нескольких основных соображений авансом. Во-первых, все рекомендации, которые необходимо обсудить в контексте новых доказательств; где было никаких новых доказательств, затем бывший доказательная база. Во-вторых, любой из предыдущих рекомендаций (4 Общие принципы и рекомендации 14) можно сохранить как они были представлены в версии 2013, поправками, смещается в последовательности или удалены. В третих, препараты, которые не являются (пока) одобрил в Европе, но используется в другом месте в мире, или препараты, которые еще не прошел оценки регулирования, но для которых доказательства от клинических испытаний был доступен, могут быть рассмотрены в рекомендациях для некоторых ожидается эффект в клинической практике, со всеми соответствующими оговорками. Наконец было достигнуто согласие, что все рекомендации 2013, которые были либо подкрепляется новых доказательств или по которым не хватало информации, должны быть включены как ранее сформулированы, если некоторые компоненты теперь считаются неуместными.
После представления результатов SLR и Руководящего комитета предложения о внесении поправок в рекомендации Целевая группа была разделена на четыре контактных групп. Одна группа рассмотрела bDMARDs, второй группы csDMARDs, третий tsDMARDs и четвертый GC; все группы предложил проект формулировок для всей целевой группы соответствующих рекомендаций. В каждом из этих контактных групп были рассмотрены аспекты безопасности.
Поиск консенсуса
Представители каждой прорывной группы сообщили результаты соответствующих обсуждений и представил предложения в отношении формулировки отдельных рекомендаций для всей целевой группы. После этого состоялся процесс голосования.
Общепрограммной принцип или рекомендации для заключительного документа без дальнейших изменений требуется большинство 75% голосов в первом туре. Если этот результат не был достигнут, соответствующих текст был изменен и подвергается второй тур голосования, для которой требовалось большинство в 67%. Если это голосование не было успешным, текстовые изменения были предложены дополнительные пока ≥50% не было достигнуто. Рекомендации представлены как наконец на голосование. Результаты соответствующих последнего голосования представлены как процент голосующих членов. Примечания по содержание обсуждений и рассуждение за каждое решение, должен быть представлен в комментарии, сопровождающие их отдельных элементов. По различным причинам не каждый член Целевой группы присутствовал в зале на протяжении всей встречи, и, следовательно, там были небольшие вариации в количестве голосов. Однако, в каждый момент времени> 90% членов участвовали в бюллетенях.
После очные встречи, рекомендаций, как это было согласовано Рабочей группой, были подвергнуты анонимный голосования (по электронной почте) на уровнях соглашения (LoA). Каждая рекомендация получил балл по шкале 0-10, 0 означает нет соглашение вообще и 10 абсолютный соглашения. В ходе этого процесса через несколько недель после совещания, один человек вышли из целевой группы, потому что включение csDMARD комбинированной терапии в рекомендации не нашли большинство во время процесса предыдущего голосования. Этот коллега присутствовал и проголосовали на протяжении очные встречи и соответствующих голосов по всем рекомендациям приходилось соответственно, но в конечном итоге лицо отказалось от авторства и голосование не учитывалось в LoA.
Проект манускрипта был направлен всем членам Целевой группы за их комментариями. После включения этих замечаний он был представлен EULAR Исполнительному комитету для рассмотрения и утверждения; в это время он был вновь направлен членам Целевой группы. Заключительные замечания были получены от членов Целевой группы и Исполнительного комитета и рассмотрены в рукописи, который был затем представлен с одобрения Исполнительным комитетом EULAR.
Результаты
Общие аспекты
Как прежде, 2016 обновление рекомендаций управления EULAR РА отражает баланс клинических, функциональные и структурные эффективность, безопасность, затраты и пациенты восприятие как воспринимаемо целевой группой. В общей формулировке рекомендаций были рассмотрены аспект лекарственной токсичности, но данные представлены только в безопасности SLR , поскольку предполагается, что назначают известно о безопасности информации, представленной в производителей вкладыши различных агентов. Кроме того, EULAR разработал серию документов, касающихся безопасности аспектов РА лекарств, и различных других изданий рассматривали эти аспекты. В частности, как это также было предложено безопасности SLR, основные риски и bDMARDs (также tsDMARDs) связано с инфекциями, и недавно были разработаны рекомендации по вакцинации, а также оценка, позволяющая рассчитать риск инфекции у больных подвержены bDMARDs. Для всех лекарств, обсуждаемые в этом документе, резюме документа характеристики продукта предоставляет ценную информацию о рисках, побочные эффекты и необходимость мониторинга. Приведенные здесь рекомендации никоим образом не должно толковаться как допускающее отступления от этой информации. В любом случае, когда токсичности является серьезной проблемой, конкретное предупреждение предоставляется в рамках соответствующей рекомендации или сопровождающие комментарии. Примечание, три SLRs, а также текст сопровождающие каждый элемент должны рассматриваться как неотъемлемая часть этой рекомендации. Индивидуальный ключевые точки представляют сокращенный выводы из обсуждений и, как таковой, не охватывают все аспекты, связанные с конкретной темы; напротив, такие аспекты освещены более подробно в соответствующих пояснительной части в разделе результаты.
При классификации DMARDs, Целевая группа придерживается ранее использовавшихся номенклатура как показано в таблице 1. В таблице 1 также обеспечивает Глоссарий терминов, используемых в рекомендациях. Целевая группа не проводится различия между ранней и установленным РА относительно рекомендации виды лекарств, но скорее выделить этапы процесса лечения путем дифференциации между пациентами, которые «наивны» любой DMARD терапии, пациенты, которые имели недостаточный отклик insufficient response (IR) на первоначального курсы initial course(s) csDMARDs и тех, кто имел IR bDMARDs. Существует в настоящее время никаких доказательств для дифференциальных ответов, исключительно на основании продолжительности заболевания, когда различия основываются на оценке ущерба из-за задержки лечения. Действительно испытания на MTX-наивно пациентов с РА отобранных по различные болезни длительности, которая колеблется от нескольких месяцев до нескольких лет, без заметных различий по результатам на косвенные сравнения. Однако, Целевая группа проводит различие между ранним и установленным РА с точки зрения целевых результатов (см. рекомендацию 2). Целевая группа также учитывал прогностические факторы (Таблица 1), которые имеют аналогичные прогностической силой независимо от длительности заболевания. В примечании, рекомендации по управлению ранней артрита, включая недифференцированные артрит, были недавно обновлены. Настоящие рекомендаций касаются лечению больных с РА от момента установления его диагноза и не доказанному РА или недифференцированному артритам.
Таблица 1
Словарь терминов и определений (Глоссарий и дефиниции)
За последние 30 лет резко(драматично) изменилась лечение ревматоидного артрита (РА). Тогда, только несколько терапевтических агентов существовали, которые были минимально или не являлись эффективными, из-за токсичности и тот факт, что оптимальной дозировки и начало действия были не еще выяснен для некоторых агентов. Доступные методы лечения применялись поздно, а не в начале течения заболевания. Сформировалась понятие клиники раннего артрита, и эти успехи подпитывали переоценку критериев классификации, которые актуальны так как сосредоточены главным образом на длительности болезни. Терапевтические цели еще не были определены, поскольку облегчение симптомов, как представляется, является наиболее важной целью и концепция направленна на положении о заболевании как ремиссии или низкой активности болезни была в лучшем случае желательна.
На сегодняшний день мы располагаем многочисленными эффективными агентами. Среди обычных синтетических (cs) болезнь модифицирующие противоревматические препараты (DMARDs), мы адоптировали метотрексат (MTX), на его оптимальные использования, как якорное лекарство (anchor drug); кроме того, целый ряд биологических (b) DMARDs были утверждены, совсем недавно последовало утверждения первых целевых синтетических (ts) DMARD, и новые которые разрабатываются (во многих странах). Сегодня, новые критерии классификации РА содействовать выявлению больных на ранней стадии в их течения болезни, чем до этого и рекомендации были разработаны для лечения пациентов с РА через стратегические алгоритмы для оптимального результата, независимо от типов доступных методов лечения.
Ограниченное количество мер оценить ответ в клинических испытаниях и исследовать активности болезни в клинической практике широко используется и американского колледжа ревматологии (ACR) и Европейской лиги против ревматизма (EULAR) совместно разработали новые определения для ремиссии, которые обеспечивают оптимальный клинических исходов и может быть достигнуто в значительной части пациентов в исследованиях и практике. Достижения ремиссии по этим критериям, на основе индекса или Boolean, предотвратит разрушение суставов или по крайней мере прогрессирования повреждения суставов независимо от остаточной субклинической формы изменения, оптимизировать физические функции, улучшить качество жизни и продуктивность работы и снизить риски сопутствующих заболеваний.
В связи с недавней эволюцией контроля результатов лечения, основанных на доказательствах интерес к чисто симптоматическим препаратам значительно снизилась сегодня и болезнь модификация disease modification стала ключевой атрибут всех современных препаратов и лечения. Тем не менее симптоматические средства, а также меры физической, психологической поддержки и хирургии могут и имеют место в общем лечении РА. Однако, болезнь модификация является основой лечения РА и представляет собой смесь характеристик: облегчение признаков и симптомов; нормализация — или по крайней мере важным улучшением — нарушение физические функции, качества жизни и социальных и трудовых возможностей; и — как главной отличительной чертой DMARDs по сравнению с симптомами агентов — ингибирование структурных повреждений хряща и кости. Таким образом регистрация ингибирования прогрессирования повреждения при рентгенографии остается ключевой результат для классификации препарата как DMARD, так как рентгенограммах можно отображать костные и повреждение хряща и доказали чувствительность обнаруживать изменения даже при краткосрочных интервалах и при очень низких уровнях общей прогрессии в популяции. Быстрое достижение целевой конечной точки теперь имеет решающее значение, и для достижения цели лечения ремиссии или наименее низкой активности болезни в сроки от 6 месяцев, по крайней мере 50% клинического улучшения в течение 3 месяцев желательно.
С повышением требованием к уходу и результатам, лечение РА становится все более сложной в течение последнего десятилетия. Несмотря на наличие многих эффективных агентов, стратегии лечения, которые были разработаны и результаты оценок, которые позволяют эффективной последующей деятельности высокая стоимость терапии ограничивают широкое использование этих терапевтических подходов, создавая в значительной степени неравенства. Таким образом рекомендации управления на подход в лечении пациентов с РА стали все более полезными в предоставлении врачей, пациентов, страховщиков, регулирующими органами и другими поставщиками медицинских научно обоснованных рекомендаций, поддержке мнения экспертов участвует во многих из этих новых событий. Действительно EULAR недавно обновлены стандартизированные оперативные процедуры по разработке рекомендаций, которые включают аспекты расходов помимо учета для оценки доказательств и мнение эксперт.
EULAR разработал первый набор рекомендаций по управлению РА с DMARDs в 2010 году и обновление их в 2013 году. Они первоначально были основаны на доказательства, представленные пятью (2010) и 3 (2013) систематической литературе обзоры systematic literature reviews (SLRs). EULAR рекомендации были широко использованы. Они были переданы национальной ревматологии обществ и региональных лиг сообщить в разработке их собственных рекомендаций (например, канадский, французский, немецкий, мексиканская, Азиатско Тихоокеанского лига ассоциаций ревматологии (APLAR), Пан американской лиги Ассоциации ревматологов (PANLAR)), а также регулирующих органов.
В соответствии с нашим подходом для предоставления рекомендаций, на основе последних свидетельств, мы продолжали оценивать литература на клинические испытания новых агентов, новую информацию об установленных лекарств, новых стратегических исследований, новые взгляды на результаты оценки и новые идеи, связанные с исследовательской повестки дня за последние 3 года. Обилие новой информации побудило нас сейчас дальнейшее обновление EULAR рекомендации для управления РА с DMARDs.
Методы
После утверждения Исполнительным комитетом EULAR, руководитель (JSS) и методиста (RL) приглашены Руководящий комитет и целевую группу для работы на этом обновлении EULAR рекомендации для управления РА. Рекомендации 2010 и их 2013 обновление оригинальной EULAR стандартизировали оперативные процедуры для дальнейшей разработки рекомендации; Обновление 2016 вслед за недавно измененный вариант соответствовал этим стандартам, которые также предполагают соблюдение руководящих Appraisal of Guidelines for Research & Evaluation (AGREE), содержащихся в его обновленной версии (AGREE II).
Руководящий комитет
Руководящий комитет включал семь ревматологов, один представитель пациента и трех стипендиатов. Эта группа изначально разработаны вопросы исследования для трех SLRs. Эти SLRs сосредоточены на (i) эффективности синтетических (s) DMARDs (в виде монотерапии или в комбинации терапии, включая csDMARDs и ts DMARDs) и глюкокортикоидов (GC); (ii) эффективность bDMARDs (как монотерапии или в сочетании с csDMARDs) и (iii) аспекты безопасности sDMARDs и биологических (b) DMARDs. С этой целью оригинальный SLRs полученные в 2013 году служил в качестве отправной точки и обновленную информацию о литературе, опубликованные в период между 2013 и 2016 была выполнена. Новая информация о стратегии лечения также оценивалась в настоящей SLRs. формальных экономических анализов не были выполнены, но стоимость аспекты рассматривались на протяжении всего процесса с учетом текущего состояния подходов к выработке рекомендаций, в EULAR предыдущих SLR по аспектам расходов в контексте DMARD терапии и появлением биосимиляров. Три стипендиатов ревматологии (KC, JN, SR) выполняется SLRs (и проверил работу друг друга) анализировали существующие публикации базы данных рандомизированных контролируемых испытаний для эффективности и данные реестра для обеспечения безопасности, а также оценки недавних EULAR и ACR тезисов конгресса. Резюме выводов Summary-of-findings (SoF) таблицы были созданы и уровни доказательств levels of evidence (LoE) были определены с использованием стандартов Оксфордский центр доказательной медицины. Три SLRs, информировали Целевую группы и подробное описание методов их публикуются отдельно.
SoFs SLRs были представлены Руководящему комитету, который сформулировал предложение для обновления рекомендаций, основываясь на этой информации. Данные SLR и предложения Руководящего комитета были впоследствии представлены для всей целевой группы для дальнейшего обсуждения и в конечном итоге развития обновленные рекомендации.
Целевая группа
Целевая группа состояла из 50 человек, включая членов Руководящего комитета. Среди целевой группы входили три пациента, двух специалистов в области здравоохранения и двух делегатов молодых ревматологов EULAR сети новых Eular сети (EMEUNET). Ревматологов были все опытные в лечении РА и наиболее часто участвовали в клинических испытаниях; Кроме того, некоторые из них имели опыт ведения реестров пациентов их стран или в различных аспектах результатов исследований. Клиницисты и организаторы здравоохранения все имели опыт в консенсусе мероприятий, как и большинство ревматологов. Поскольку мы также пожелал для работы Целевой группы быть информированы ревматологами из других регионов мира, помимо широкого представительства из 14 европейских стран, 2 коллеги из Азии, 1 из Австралии, 2 из Латинской Америки и 2 из Северной Америки были приглашены принять участие. Некоторые из них активно участвовала в разработке документов их региональных лиг и/или национальных обществ. Все члены Целевой группы объявил их потенциальные конфликты интересов перед началом процесса.
Целевая группа согласилась на нескольких основных соображений авансом. Во-первых, все рекомендации, которые необходимо обсудить в контексте новых доказательств; где было никаких новых доказательств, затем бывший доказательная база. Во-вторых, любой из предыдущих рекомендаций (4 Общие принципы и рекомендации 14) можно сохранить как они были представлены в версии 2013, поправками, смещается в последовательности или удалены. В третих, препараты, которые не являются (пока) одобрил в Европе, но используется в другом месте в мире, или препараты, которые еще не прошел оценки регулирования, но для которых доказательства от клинических испытаний был доступен, могут быть рассмотрены в рекомендациях для некоторых ожидается эффект в клинической практике, со всеми соответствующими оговорками. Наконец было достигнуто согласие, что все рекомендации 2013, которые были либо подкрепляется новых доказательств или по которым не хватало информации, должны быть включены как ранее сформулированы, если некоторые компоненты теперь считаются неуместными.
После представления результатов SLR и Руководящего комитета предложения о внесении поправок в рекомендации Целевая группа была разделена на четыре контактных групп. Одна группа рассмотрела bDMARDs, второй группы csDMARDs, третий tsDMARDs и четвертый GC; все группы предложил проект формулировок для всей целевой группы соответствующих рекомендаций. В каждом из этих контактных групп были рассмотрены аспекты безопасности.
Поиск консенсуса
Представители каждой прорывной группы сообщили результаты соответствующих обсуждений и представил предложения в отношении формулировки отдельных рекомендаций для всей целевой группы. После этого состоялся процесс голосования.
Общепрограммной принцип или рекомендации для заключительного документа без дальнейших изменений требуется большинство 75% голосов в первом туре. Если этот результат не был достигнут, соответствующих текст был изменен и подвергается второй тур голосования, для которой требовалось большинство в 67%. Если это голосование не было успешным, текстовые изменения были предложены дополнительные пока ≥50% не было достигнуто. Рекомендации представлены как наконец на голосование. Результаты соответствующих последнего голосования представлены как процент голосующих членов. Примечания по содержание обсуждений и рассуждение за каждое решение, должен быть представлен в комментарии, сопровождающие их отдельных элементов. По различным причинам не каждый член Целевой группы присутствовал в зале на протяжении всей встречи, и, следовательно, там были небольшие вариации в количестве голосов. Однако, в каждый момент времени> 90% членов участвовали в бюллетенях.
После очные встречи, рекомендаций, как это было согласовано Рабочей группой, были подвергнуты анонимный голосования (по электронной почте) на уровнях соглашения (LoA). Каждая рекомендация получил балл по шкале 0-10, 0 означает нет соглашение вообще и 10 абсолютный соглашения. В ходе этого процесса через несколько недель после совещания, один человек вышли из целевой группы, потому что включение csDMARD комбинированной терапии в рекомендации не нашли большинство во время процесса предыдущего голосования. Этот коллега присутствовал и проголосовали на протяжении очные встречи и соответствующих голосов по всем рекомендациям приходилось соответственно, но в конечном итоге лицо отказалось от авторства и голосование не учитывалось в LoA.
Проект манускрипта был направлен всем членам Целевой группы за их комментариями. После включения этих замечаний он был представлен EULAR Исполнительному комитету для рассмотрения и утверждения; в это время он был вновь направлен членам Целевой группы. Заключительные замечания были получены от членов Целевой группы и Исполнительного комитета и рассмотрены в рукописи, который был затем представлен с одобрения Исполнительным комитетом EULAR.
Результаты
Общие аспекты
Как прежде, 2016 обновление рекомендаций управления EULAR РА отражает баланс клинических, функциональные и структурные эффективность, безопасность, затраты и пациенты восприятие как воспринимаемо целевой группой. В общей формулировке рекомендаций были рассмотрены аспект лекарственной токсичности, но данные представлены только в безопасности SLR , поскольку предполагается, что назначают известно о безопасности информации, представленной в производителей вкладыши различных агентов. Кроме того, EULAR разработал серию документов, касающихся безопасности аспектов РА лекарств, и различных других изданий рассматривали эти аспекты. В частности, как это также было предложено безопасности SLR, основные риски и bDMARDs (также tsDMARDs) связано с инфекциями, и недавно были разработаны рекомендации по вакцинации, а также оценка, позволяющая рассчитать риск инфекции у больных подвержены bDMARDs. Для всех лекарств, обсуждаемые в этом документе, резюме документа характеристики продукта предоставляет ценную информацию о рисках, побочные эффекты и необходимость мониторинга. Приведенные здесь рекомендации никоим образом не должно толковаться как допускающее отступления от этой информации. В любом случае, когда токсичности является серьезной проблемой, конкретное предупреждение предоставляется в рамках соответствующей рекомендации или сопровождающие комментарии. Примечание, три SLRs, а также текст сопровождающие каждый элемент должны рассматриваться как неотъемлемая часть этой рекомендации. Индивидуальный ключевые точки представляют сокращенный выводы из обсуждений и, как таковой, не охватывают все аспекты, связанные с конкретной темы; напротив, такие аспекты освещены более подробно в соответствующих пояснительной части в разделе результаты.
При классификации DMARDs, Целевая группа придерживается ранее использовавшихся номенклатура как показано в таблице 1. В таблице 1 также обеспечивает Глоссарий терминов, используемых в рекомендациях. Целевая группа не проводится различия между ранней и установленным РА относительно рекомендации виды лекарств, но скорее выделить этапы процесса лечения путем дифференциации между пациентами, которые «наивны» любой DMARD терапии, пациенты, которые имели недостаточный отклик insufficient response (IR) на первоначального курсы initial course(s) csDMARDs и тех, кто имел IR bDMARDs. Существует в настоящее время никаких доказательств для дифференциальных ответов, исключительно на основании продолжительности заболевания, когда различия основываются на оценке ущерба из-за задержки лечения. Действительно испытания на MTX-наивно пациентов с РА отобранных по различные болезни длительности, которая колеблется от нескольких месяцев до нескольких лет, без заметных различий по результатам на косвенные сравнения. Однако, Целевая группа проводит различие между ранним и установленным РА с точки зрения целевых результатов (см. рекомендацию 2). Целевая группа также учитывал прогностические факторы (Таблица 1), которые имеют аналогичные прогностической силой независимо от длительности заболевания. В примечании, рекомендации по управлению ранней артрита, включая недифференцированные артрит, были недавно обновлены. Настоящие рекомендаций касаются лечению больных с РА от момента установления его диагноза и не доказанному РА или недифференцированному артритам.
Таблица 1
Словарь терминов и определений (Глоссарий и дефиниции)
 Общие принципы
Как и в предыдущих версиях Целевая группа одобрила представление общих принципов для лечения больных с РА как общепрограммной (Таблица 2). Их природа настолько универсален, что не было никаких основывать их на специфических поисках или LoE, но в то же время Группа считает, что важно сообщать о них как основы, на которых были основаны фактические рекомендации. Однако хотя все три бывших всеобъемлющих принципа были сохранены как было сформулировано в 2010 году, Целевая группа добавила четвертое как основополагающий принцип В.
Общие принципы
Как и в предыдущих версиях Целевая группа одобрила представление общих принципов для лечения больных с РА как общепрограммной (Таблица 2). Их природа настолько универсален, что не было никаких основывать их на специфических поисках или LoE, но в то же время Группа считает, что важно сообщать о них как основы, на которых были основаны фактические рекомендации. Однако хотя все три бывших всеобъемлющих принципа были сохранены как было сформулировано в 2010 году, Целевая группа добавила четвертое как основополагающий принцип В.

 Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Заявив, ‘.. .tapered(снижение на конус при заточке карандаша) как быстро как клинически возможно ‘, Целевая группа подчеркивает, что ГК следует постепенно уменьшается и в конечном итоге отменить, обычно в течение 3 месяцев от начала лечения и только в исключительных случаях на 6 месяцев. Длительное применение GC, особенно в дозах выше 5 мг/сут, следует избегать из-за многих потенциальных рисков, представленный в SLR (системный литературный обзор). В то время как некоторые из этих рисков может быть связано смешиваться с указанием на высоким болезни активности, доказательства для увеличения общей и сердечно-сосудистой смертности в дозе выше порога 7,5 мг/сут или суммарной дозы 40 g является значительным. Известно, что применение GC как единственного терапевтического средства в больных с IR при переходе к csDMARD терапии не передать хорошую эффективность и связан с значительные неблагоприятные события. Кроме того, если GC не могут быть отменены в течение сроков, упомянутых выше, DMARD терапии возможно будет неэффективной. Наконец внутрисуставное GC введение может рассматриваться в некоторых случаях, например, остаточно воспаленной или рецидив артрита.
Некоторые члены Целевой группы выступал за хроническое использование GC как возможность для некоторых пациентов; Однако это предложение не было одобрено большинством. В то время как ключевой точкой по GC был, как и в предыдущие годы, наиболее активно обсуждается, окончательная формулировка получил 98% большинством голосов. Однако, LoA был гораздо ниже (8,7), с учетом рекомендаций предыдущих версий. Это относительно низкая LoA, вероятно, объясняется тем, что многие члены Целевой группы считает, что этот пункт был слишком либеральным и использования GC должна быть более ограниченной, в то время как другие высказали мнение, что он был слишком ограничительный характер. LoЕ1а; LoA 8.7.
Рисунок 1
Алгоритм на основе рекомендаций Европейской лиги против ревматизма (EULAR) 2016 по ведению ревматоидный артрит (РА). ACPA, anticitrullinated протеина антитела; ACR, американского колледжа ревматологии; bDMARD, биологические DMARD; bsDMARD, biosimilar биосимилярные DMARDs; csDMARDs, обычных синтетических DMARDs; DMARDs, Болезнь модифицирующие противоревматические препараты; EMA, Европейское агентство лекарственных средств; FDA, FDA (U.S. Food and Drug Administration) – Управление по санитарному надзору над качеством пищевых продуктов и медикаментов – агентство при Министерстве здравоохранения и социальных служб США. FDA осуществляет контроль над качеством лекарственных препаратов и пищевых продуктов, наблюдает за выполнением норм законодательства и отраслевых стандартов.; IL, интерлейкинов; MTX, метотрексата; РФ, ревматоидного фактора; ФНО, фактора некроза опухоли; tsDMARDs, целевые синтетических DMARDs.
Заявив, ‘.. .tapered(снижение на конус при заточке карандаша) как быстро как клинически возможно ‘, Целевая группа подчеркивает, что ГК следует постепенно уменьшается и в конечном итоге отменить, обычно в течение 3 месяцев от начала лечения и только в исключительных случаях на 6 месяцев. Длительное применение GC, особенно в дозах выше 5 мг/сут, следует избегать из-за многих потенциальных рисков, представленный в SLR (системный литературный обзор). В то время как некоторые из этих рисков может быть связано смешиваться с указанием на высоким болезни активности, доказательства для увеличения общей и сердечно-сосудистой смертности в дозе выше порога 7,5 мг/сут или суммарной дозы 40 g является значительным. Известно, что применение GC как единственного терапевтического средства в больных с IR при переходе к csDMARD терапии не передать хорошую эффективность и связан с значительные неблагоприятные события. Кроме того, если GC не могут быть отменены в течение сроков, упомянутых выше, DMARD терапии возможно будет неэффективной. Наконец внутрисуставное GC введение может рассматриваться в некоторых случаях, например, остаточно воспаленной или рецидив артрита.
Некоторые члены Целевой группы выступал за хроническое использование GC как возможность для некоторых пациентов; Однако это предложение не было одобрено большинством. В то время как ключевой точкой по GC был, как и в предыдущие годы, наиболее активно обсуждается, окончательная формулировка получил 98% большинством голосов. Однако, LoA был гораздо ниже (8,7), с учетом рекомендаций предыдущих версий. Это относительно низкая LoA, вероятно, объясняется тем, что многие члены Целевой группы считает, что этот пункт был слишком либеральным и использования GC должна быть более ограниченной, в то время как другие высказали мнение, что он был слишком ограничительный характер. LoЕ1а; LoA 8.7.




