Рекомендации EULAR по ведению псориатического артрита с фармакологической терапией: обновление 2019
Аннотация
Впервые опубликовано 20 мая 2020 года.
Цель обновления Рекомендации Европейской лиги против ревматизма (EULAR) для фармакологического лечения псориатического артрита (ПсА) psoriatic arthritis (PsA).
Методы в соответствии с стандартизированными операционными процедурами EULAR, систематический обзор литературы последовал консенсус-совещание по разработке этого обновления с участием 28 международных членов целевой группы в мае 2019 года. Были определены уровни фактических данных и сила рекомендаций.
Результаты Обновленные рекомендации включают 6 общих принципов и 12 рекомендаций. Общие принципы касаются природы ПсА и разнообразия как опорно-двигательного аппарата, так и внескелетных проявлений; подчеркивается необходимость совместного ведения и совместного принятия решений. Рекомендации обеспечивают стратегию лечения фармакологических методов лечения. В качестве начальной терапии предлагается нестероидные противовоспалительные препараты и местные глюкокортикоидные инъекции; для пациентов с артритом и плохими прогностическими факторами, такими как полиартрит или моноартрит/олигоартрит, сопровождаемый такими факторами, как дактилит или повреждение суставов, рекомендуется быстрое начало обычными синтетических антиревматических препаратов. Если цель лечения не будет достигнута с помощью этой стратегии, следует инициировать биологические антиревматические препараты (bDMARDs), нацеленные на фактор некроза опухоли (TNF), интерлейкин (IL)-17A или IL-12/23 с учетом участия кожи, если это уместно. Если преобладает осевое заболевание, ингибитор TNF или ингибитор IL-17A следует начать как препарат, изменяющий болезнь первой линии. Использование ингибиторов Янус киназы Janus kinase рассматривается в первую очередь после отсутствия эффекта bDMARD. Фосфодиэстераза-4 ингибирование предлагается для пациентов, у которых эти другие препараты являются противопоказанными, как правило, в контексте легкой болезни. Проблемы с переключением лекарств и постепенной отмены при устойчивой ремиссии.
Вывод Эти рекомендации предоставляют заинтересованным сторонам обновленный консенсус в отношении фармакологического управления ПСА, основанный на сочетании фактических данных и экспертного заключения.
http://creativecommons.org/licenses/by-nc/4.0/
Это открытый доступ статьи, распространяемой в соответствии с Creative Commons Атрибуция Non Commercial (CC BY-NC 4.0) лицензии, которая позволяет другим распространять, ремиксы, адаптировать, опираться на эту работу некоммерчески, и лицензировать их производные произведения на различных условиях, при условии, что оригинальная работа должным образом цитируется, соответствующие ссылки даются, любые изменения, указанные, и использование является некоммерческим. Смотрите: http://creativecommons.org/licenses/by-nc/4.0/.
Введение
Псориатический артрит (ПсА) является заболеванием с неоднородными проявлениями у пациентов, которые имеют явный или скрытый псориаз. Она включает в себя как опорно-двигательное аппарата, так и вне-мышечно-скелетные проявления non-musculoskeletal; последние особенно включают кожу и ногти, но и потенциально кишечника (воспалительные заболевания кишечника) или глаза (увеит). Активный хронический ПсА также ассоциируется с сердечно-сосудистыми, психологическими и метаболическими сопутствующими заболеваниями, которые вместе с проявлениями опорно-двигательного аппарата накладывают на пациента значительное бремя, влияющим на качество жизни, а также с ускоренной смертностью.
Повседневное ведение пациентов с ПсА включает в себя нефармакологические, а также фармакологические вмешательства. Число болезнь-модифицирующих антиревматических препаратов (disease-modifying antirheumatic drugs (DMARDs), показанных для ПсА, увеличилось за последнее десятилетие. В состав арсенала теперь входят не только обычные синтетические DMARDs (csDMARD), такие как метотрексат (MTX), сульфасалазин и лемлюномид и ингибиторы фактора некроза опухоли (TNFi), но и другие целевые биологические агенты (bDMARD), направленные на различные цитокины, такие как TNF, интерлейкин (IL)-12/23 и IL-17A, а также целевые синтетические DMARDs (tsDMARDs), которые подавляют фосфодиэстеразы-4 (PDE4) или Янус киназы (JAKs). Эти несколько новых препаратов были исследованы хорошо в краткосрочных, рандомизированных контролируемых испытаний с использованием в качестве компаратора для оснований для назначения лекарств. Однако сравнительные исследования различных препаратов, важных для клинической практики, довольно редки, и клиницисты нуждаются в некотором руководстве в принятии решений.
Европейская лига против ревматизма (EULAR) разработала рекомендации по фармакологическому менеджменту ПсА в 2011 году и обновила их в 2015 году. Эти рекомендации были их основное внимание на опорно-двигательного аппарата аспекты заболевания и рассматриваются весь спектр ПсА тяжести, поскольку они относятся к пациентам с очень легкой и очень тяжелой PsA. В этой быстро развивающейся области дальнейшее обновление 2015 рекомендации стали необходимыми для размещения вновь полученных доказательств и идей. Поэтому цель этой целевой группы заключалась в обновлении рекомендаций EULAR по управлению ПсА с помощью non-topical, фармакологических методов лечения.
Методы
Были применены обновленные стандартизированные операционные процедуры EULAR.21 В октябре 2018 года руководящая группа, состоящая из пяти ревматологов, стипендиата, партнера по исследованию пациентов и медицинского работника, определила вопросы, которые должны были быть решены с помощью систематического обзора литературы (SLR). SLR была выполнена в период с октября 2018 года по май 2019 года, за 2015-2018 годы, и проанализировала эффективность как в опорно-двигательного аппарата, так и в коже и ногтях у пациентов с PsA.1 На заметку, SLR не была сосредоточена на исследованиях псориаза кожи, и эти испытания не рассматриваются систематически или систематически ссылаются на систематические здесь. В тех случаях, когда они имеют отношение и основываются на экспертном заключении, данные, полученные после окончания SLR, также интегрируются. В мае 2019 года руководящая группа, а также целевая группа провели заседание для интеграции имеющейся информации по вопросам управления болезнями в ПсА в практические рекомендации. Целевая группа состояла из 28 человек из 15 европейских стран с 15 различными системами здравоохранения: 21 ревматологов, 2 человека, страдавших ПсА, 1 медицинский работник, 1 дерматолог и 3 ревматологии стипендиатов / стажеров. По сравнению с 2015 годом целевая группа насчитывала более 30% новых членов.
SLR проинформировал рекомендации. Тем не менее, этот процесс был не только на основе фактических данных, но и на основе опыта и консенсуса, в соответствии с трехуровневыми принципами доказательной медицины, которые включают клиническую науку (испытания), восприятие и ожидания пациентов, а также опыт врачей. При обсуждении приоритетов лекарственных средств учитывались коэффициенты выгоды к стоимости, поскольку новые эффективные методы лечения ложатся значительным бременем на бюджеты здравоохранения стран EULAR и стран, не EULAR. Поэтому руководство по лечению должно включать не только соображения о безопасности и эффективности, но и сосредоточить внимание на стоимости лечения, в частности, когда различные методы лечения имеют сходные данные об эффективности и безопасности.
Результаты работы SLR были представлены целевой группе в ходе личного совещания в мае 2019 года наряду с рекомендациями и предложениями 2015 года об изменениях в этих рекомендациях, подготовленными руководящим комитетом. Каждая рекомендация подробно обсуждалась как в небольших (прорывных) группах, так и на пленарных заседаниях до достижения консенсуса. Для внесения изменений в существующие рекомендации, против которых после последнего обновления не было получено никаких новых доказательств, было поручено 75% голосов целевой группы, с тем чтобы не допустить реформирования новых целевых групп без каких-либо серьезных рассуждений того, что ранее было разработано на основе представленных на тот момент доказательств. Если это большинство не было достигнуто, рекомендация не была изменена. Были сформулированы новые рекомендации, а затем приняты, если 75% членов согласились; если это соглашение не было достигнуто, рекомендация была изменена и подверглась повторному голосованию, для которого требовалось большинство в 67%. Если это не было достигнуто, формулировка прошла следующий раунд обсуждения, и новая формулировка была одобрена, если >50% членов целевой группы проголосовали за него.
После очного заседания членам целевой группы была предоставлена категория доказательств и оценка рекомендации по каждому пункту, основанная на категоризации Оксфордской доказательной медицины, в соответствии с процедурами EULAR. Затем анонимное, основанное на электронной почте голосование по уровню согласия между членами целевой группы было проведено по шкале 0-10 (с 10-й смыслом полного соглашения), позволяющей вычислить средние уровни.
Результаты
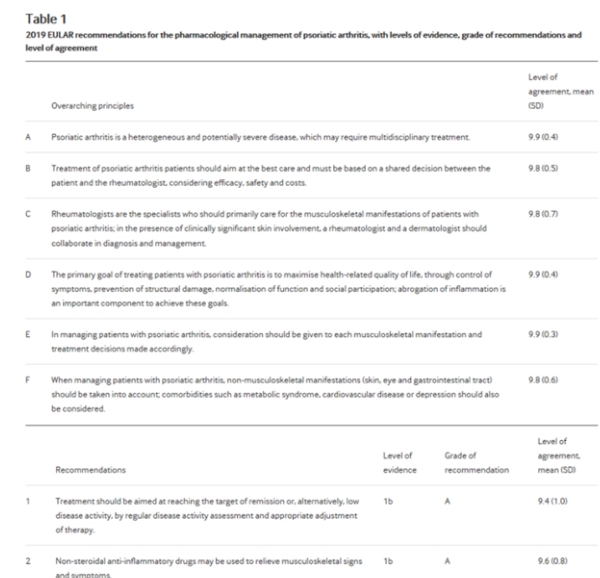
Рекомендации отображаются в таблице 1, а изменения по сравнению с предыдущими рекомендациями отображаются в таблице 2. Эти рекомендации касаются non-topical фармакологического лечения с основным акцентом на проявлениях опорно-двигательного аппарата. Как и прежде, обновленные рекомендации ориентированы на различные заинтересованные стороны, такие как (1) эксперты, занимающиеся уходом за пациентами с ПсА, особенно ревматологи и другие медицинские работники (такие как ревматологические медсестры), а также врачи общей практики, дерматологи и другие специалисты; (2) люди с ПсА, которые могут использовать эти рекомендации для получения информации о текущих методах лечения, стратегиях лечения и возможностях; и (3) другие заинтересованные стороны, в число которых входят должностные лица правительства и больниц, организации пациентов, регулирующие органы и учреждения по возмещению ущерба.
Таблица 1
2019 EULAR рекомендации для фармакологического ведения псориатического артрита, с уровнями доказательств, класс рекомендаций и уровень согласия
|
|
Общие принципы |
Уровень согласия, средний (SD) |
|
A |
Псориатический артрит является неоднородным и потенциально тяжелым заболеванием, которое может потребовать междисциплинарного лечения. |
9.9 (0.4) |
|
B |
Лечение больных псориатическим артритом должны быть направлены на лучший уход и должны быть основаны на совместном решении между пациентом и ревматологом, учитывая эффективность, безопасность и расходы. |
9.8 (0.5) |
|
C |
Ревматологи – это специалисты, которые должны в первую очередь следить за опорно-двигательным аппаратом больных псориатическим артритом; при наличии клинически значимого вовлечения кожи, ревматолог и дерматолог должны сотрудничать в диагностике и управлении. |
9.8 (0.7) |
|
D |
Основная цель лечения пациентов с псориатическим артритом заключается в максимизации качества жизни, связанного со здоровьем, путем контроля симптомов, профилактики структурных повреждений, нормализации функции и социального участия; подавление воспаления является важным компонентом для достижения этих целей. |
9.9 (0.4) |
|
Е |
При лечении пациентов с псориатическим артритом, следует учитывать каждое проявление поражение опорно-двигательного аппарата и принимать решения о лечении, соответствующим образом. |
9.9 (0.3) |
|
F |
При работе с больными псориатическим артритом следует учитывать вне-мышечно-клеатные проявления (кожи, глаза и желудочно-кишечного тракта); сопутствующих заболеваний, таких как метаболический синдром, сердечно-сосудистые заболевания или депрессия также должны быть рассмотрены. |
9.8 (0.6) |
|
|
Рекомендации |
Уровень доказательств |
Оценка рекомендаций |
Уровень согласия, средний (SD) |
|
1 |
Лечение должно быть направлено на достижение цели ремиссии или, в качестве альтернативы, низкой активности заболеваний, путем регулярной оценки активности заболеваний и надлежащей корректировки терапии. |
1b |
A |
9.4 (1.0) |
|
2 |
Нестероидные противовоспалительные препараты могут быть использованы для облегчения опорно-двигательного аппарата признаки и симптомы. |
1b |
A |
9.6 (0.8) |
|
3 |
Локальные инъекции глюкокортикодов следует рассматривать как вспомогательную терапию при псориатическом артрите*; системные глюкокортикоиды можно использовать с осторожностью при самой низкой эффективной дозе†. |
3b* 4† |
C |
9.5 (1.1) |
|
4 |
У пациентов с полиартритом csDMARD следует начать* быстро†, с метотрексата предпочтительно у тех, с вовлечением кожи*. |
1b* 5† |
B |
9.5 (0.8) |
|
5 |
У пациентов с моноартритом или олигоартритом, особенно с плохими прогностическими факторами, такими как структурные повреждения, высокая скорость осаждения эритроцитов/С реактивный белок, дактилит или поражение ногтей, следует назначать csDMARD. |
4 |
C |
9.3 (1.0) |
|
6 |
У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD, терапия с bDMARD должны быть начаты; при наличии соответствующего вовлечения кожи может быть предпочтительнее ингибитор IL-17 или ингибитор IL-12/23. |
1b |
B |
9.4 (1.1) |
|
7 |
У пациентов с периферическим артритом и неадекватной реакцией, по крайней мере, на один csDMARD и по крайней мере один bDMARD, или когда bDMARD не подходит, ингибитор JAK может быть рассмотрен. |
1b |
B |
9.2 (1.3) |
|
8 |
У пациентов с легким заболеванием* и неадекватной реакцией по крайней мере на один csDMARD†, у которых не является целесообразным ни bDMARD, ни ингибитор JAK*, может быть рассмотрен ингибитор PDE4. |
5* 1b† |
B |
8.5 (1.9) |
|
9 |
У пациентов с однозначным энтезитом и недостаточной реакцией на НПВС или локальные глюкокортиковидные инъекции следует рассмотреть вопрос о терапии с помощью bDMARD. 1b |
1b |
B |
9.3 (0.9) |
|
10 |
У пациентов с преимущественно осевым заболеванием, которое является активным и не имеет достаточной реакции на НПВП, следует рассмотреть терапию с bDMARD, которая в соответствии с текущей практикой является ингибитором TNF; при наличии соответствующего участия кожи, ингибитор IL-17 может быть предпочтительным. |
1b |
B |
9.7 (0.6) |
|
11 |
У пациентов, которые не реагируют адекватно, или непереносят bDMARD, переход на другой bDMARD или tsDMARD следует рассматривать*, в том числе один раз переключения в классе†. |
1b* 4† |
C |
9.5 (1.2) |
|
12 |
У пациентов с устойчивой ремиссией может рассматриваться тапперинг DMARDs. |
4 |
C |
9.5 (0.9) |
- Уровень соглашения был рассчитан по шкале 0-10.
- csDMARDs включают метотрексат, сульфасалазин или лефлуномид; bDMARDs включают ингибиторы TNF (как оригинальные, так и биоаналоги) и препараты, нацеленные на пути ИЛ-17 и IL-12/23.
- bDMARDs, biological disease-modifying antirheumatic drugs биологические болезни- модифицирующие антиревматические препараты; csDMARDs conventional synthetic disease-modifying antirheumatic drugs, обычные синтетические болезнь модифицируещие антиревматические препараты; DMARD s, disease-modifying antirheumatic drugs, болезнь модифицирующие противоревматических препаратов; EULAR, European League Against Rheumatism Лига Европы против ревматизма; IL, interleukin ИЛ, интерлейкин; JAK, Janus kinase Янус киназы; NSAIDs, non-steroidal anti-inflammatory drugs НПВП, нестероидные противовоспалительные препараты; PDE4, phosphodiesterase-4 фосфодиэстеразы-4; TNF, tumour necrosis factor фактор некроза опухоли.
Таблица 2
Сравнение рекомендаций на 2015 и 2019 годы
|
Версия 2019 (текущая) |
Выполненные изменения |
Версия 2015 года |
|
|
Основополагающие принципы |
|||
|
A |
Псориатический артрит является неоднородным и потенциально тяжелым заболеванием, которое может потребовать междисциплинарного лечения. |
Неизменён |
Псориатический артрит является неоднородным и потенциально тяжелым заболеванием, которое может потребовать междисциплинарного лечения. |
|
B |
Лечение больных псориатическим артритом должны быть направлены на лучший уход и должны быть основаны на совместном решении между пациентом и ревматологом, учитывая эффективность, безопасность и расходы. |
Неизменён |
Лечение больных псориатическим артритом должны быть направлены на лучший уход и должны быть основаны на совместном решении между пациентом и ревматологом, учитывая эффективность, безопасность и расходы. |
|
C |
Ревматологи – это специалисты, которые должны в первую очередь лечить опорно-двигательный аппарат больных псориатическим артритом; при наличии клинически значимого вовлечения кожи, ревматолог и дерматолог должны сотрудничать в диагностике и наблюдении. |
Неизменён |
Ревматологи – это специалисты, которые должны в первую очередь лечить опорно-двигательный аппарат больных псориатическим артритом; при наличии клинически значимого вовлечения кожи, ревматолог и дерматолог должны сотрудничать в диагностике и наблюдении. |
|
D |
Основная цель лечения пациентов с псориатическим артритом заключается в максимизации качества жизни, связанного со здоровьем, путем контроля симптомов, профилактики структурных повреждений, нормализации функции и социального участия; подавление воспаления является важным компонентом для достижения этих целей. |
Неизменён |
Основная цель лечения пациентов с псориатическим артритом заключается в максимизации качества жизни, связанного со здоровьем, путем контроля симптомов, профилактики структурных повреждений, нормализации функции и социального участия; подавление воспаления является важным компонентом для достижения этих целей. |
|
Е |
При лечении пациентов с псориатическим артритом, следует учитывать каждое проявление поражения опорно-двигательного аппарата и решения о лечении, принимается соответствующим образом. |
новое |
Неприменимо. |
|
F |
При работе с больными псориатическим артритом следует учитывать вне мышечно-скелетные проявления (кожи, глаза и желудочно-кишечного тракта); сопутствующих заболеваний, такие как метаболический синдром, сердечно-сосудистые заболевания или депрессия также должны быть рассмотрены. |
Перефразированно |
При работе с больными псориатическим артритом, экстра-артикулярные проявления, метаболический синдром, сердечно-сосудистые заболевания и другие сопутствующие заболеваниями следует учитывать. |
|
Рекомендации |
|||
|
1 |
Лечение должно быть направлено на достижение цели ремиссии или, в качестве альтернативы, низкой активности заболеваний, путем регулярной оценки активности заболеваний и надлежащей корректировки терапии. |
Перефразированно |
Лечение должно быть направлено на достижение цели ремиссии или, в качестве альтернативы, минимальной/низкой активности заболеваний путем регулярного мониторинга и надлежащей корректировки терапии. |
|
2 |
Нестероидные противовоспалительные препараты могут быть использованы для облегчения признаков и симптомов опорно-двигательного аппарата. |
Перефразированно |
У пациентов с псориатическим артритом, нестероидные противовоспалительные препараты могут быть использованы для облегчения признаков и симптомов опорно-двигательного аппарата. |
|
3 |
Местные инъекции глюкокортикоидов следует рассматривать как вспомогательную терапию при псориатическом артрите; системные глюкокортикоиды можно использовать с осторожностью при самой низкой эффективной дозе. |
Перенумерованы |
Местные инъекции глюкокортикоидов следует рассматривать как вспомогательную терапию при псориатическом артрите; системные глюкокортикоиды можно использовать с осторожностью при самой низкой эффективной дозе. |
|
4 |
У пациентов с полиартритом CSDMARD следует начать быстро, с метотрексата предпочтительно у тех, с соответствующим вовлечением кожи. |
Изменено |
У пациентов с периферическим артритом, особенно у людей с большим количеством опухших суставов, структурные повреждения при наличии воспаления, высокий СОЭ/CRP и/или клинически значимые экстра-артикулярные проявления, csDMARDs следует рассматривать на ранней стадии, с метотрексата , предпочтительно у тех, у кого есть соответствующее вовлечение кожи. |
|
5 |
У пациентов с моноартритом или олигоартритом, особенно с плохими прогностическими факторами, такими как структурные повреждения, высокая скорость осаждения эритроцитов/С реактивный белок, дактилит или поражение ногтей, следует назначать csDMARD. |
Новое |
Неприменимы, но частично включены в рекомендации выше. |
|
6 |
У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD, терапия с bDMARD должны быть начаты; при наличии соответствующего вовлечения кожи может быть предпочтительнее ингибитор IL-17 или ингибитор IL-12/23. |
Изменено и объединено |
У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD, терапия с bDMARD, как правило, ингибитор TNF, должны быть начаты. У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD, у которых ингибиторы TNF не подходят, bDMARDs направлены IL-12/23 или IL-17 пути могут быть рассмотрены. |
|
7 |
У пациентов с периферическим артритом и неадекватной реакцией, по крайней мере, на один csDMARD и по крайней мере один bDMARD, или когда bDMARD не подходит, ингибитор JAK может быть назначен. |
Новое |
Неприменимы. |
|
8 |
У пациентов с легким заболеванием и неадекватной реакцией по крайней мере на один csDMARD, у которых не подходит ни bDMARD, ни ингибитор JAK, может быть назначен ингибитор PDE4. |
Изменено |
У пациентов с периферическим артритом и неадекватной реакцией, по крайней мере, на один csDMARD, у которых bDMARDs не подходят, целевой синтетический DMARD, такие как ингибитор PDE4 может быть рассмотрен. |
|
9 |
У пациентов с однозначным энтезитом и недостаточной реакцией на НПВС или локальные глюкокортиковидные инъекции следует рассмотреть вопрос о терапии с помощью bDMARD. |
Изменено |
У пациентов с активным энтезитом и/или дактилитом и недостаточным ответом на НПВП или локальные глюкокортиковидные инъекции следует назначить терапию bDMARD., которая в соответствии с текущей практикой является ингибитором TNF. |
|
10 |
У пациентов с преимущественно осевым заболеванием, которое является активным и не имеет недостаточной реакции на НПВП, следует рассмотреть терапию с bDMARD, которая в соответствии с текущей практикой является ингибитором TNF; при наличии соответствующего вовлечения кожи, ингибитор IL-17 может быть предпочтительным. |
Изменено |
У пациентов с преимущественно осевым заболеванием, которое является активным и не имеет недостаточной ответа на НПВП, следует рассмотреть терапию с bDMARD, которая в соответствии с текущей практикой является ингибитором TNF. |
|
11 |
У пациентов, которые не реагируют адекватно, или непереносят bDMARD, переход на другой bDMARD или tsDMARD следует рассматривать, в том числе одно переключение в классе†. |
Изменено |
У пациентов, которые не реагируют должным образом на bDMARD, переход на другой bDMARD следует рассмотреть, в том числе переключение между ингибиторами TNF. |
|
12 |
У пациентов с устойчивой ремиссией может рассматриваться осторожное снижение (до полной отмены) DMARDs. |
Новое |
Неприменимы. |
- csDMARDs включают метотрексат, сульфасалазин или лефлуномид; bDMARDs включают здесь ингибиторы TNF (как оригинальные, так и биоаналоги) и препараты, нацеленные на пути ИЛ-17 и IL-12/23.
- bDMARDs, биологические болезни- модифицирующие антиревматические препараты; CRP, C реактивный белок; csDMARDs, обычные синтетические болезни, изменяющие антиревматические препараты; DMARDs, болезнь модифицирующие противоревматические препараты ; ESR, скорость осаждения эритроцитов; ИЛ, интерлейкин; JAK, Янус киназы; НПВ НПВ, нестероидные противовоспалительные препараты; PDE4, фосфодиэстеразы-4; TNF, фактор некроза опухоли; tsDMARDs, целевые синтетические болезни модификацирующие антиревматические препараты.
Основополагающие принципы
Они относятся к принципам общего характера (таблица 1). Обратите внимание, что оптимальное управление пациентами с ПсА также требует нефармакологических стратегий, таких как обучение пациентов и регулярные физические упражнения, а также может потребовать местных лекарств (в частности, для кожи псориаза). В настоящем документе не рассматриваются несистемные и нефармакологические методы лечения.
Общие принципы остались в основном неизменными по сравнению с 2015 годом (таблица 2). Принцип А относится к неоднородной и потенциально тяжелой природе ПсА, а принцип B рассматривает важность совместного принятия решений с пациентом, но также и затрат. Действительно, хотя эффективность и безопасность считаются ключевыми факторами процесса принятия решений, Комитет отметил, что следует также принимать во внимание стоимость лечения. Современные DMARD являются дорогостоящими и недоступными для многих пациентов в менее богатых странах, но и в богатых странах системы социального обеспечения могут препятствовать предоставлению определенных лекарств значительной части пациентов, или запросить клинически неприемлемые условия (такие как высокая активность болезней или ограничение важных признаков до максимального числа) по причинам стоимости. Тем не менее, EULAR провозглашает, что все пациенты с активными и / или тяжелой (не обязательно высокой активности) PsA должны иметь право на предписание лечения, необходимое для оптимизации качества их жизни. Следует отметить, что в последнее время стоимость некоторых лекарств значительно снизилась за счет доступа к биоаналогам и bio-originator био- originator, однако эти преимущества передаются не во всех странах.
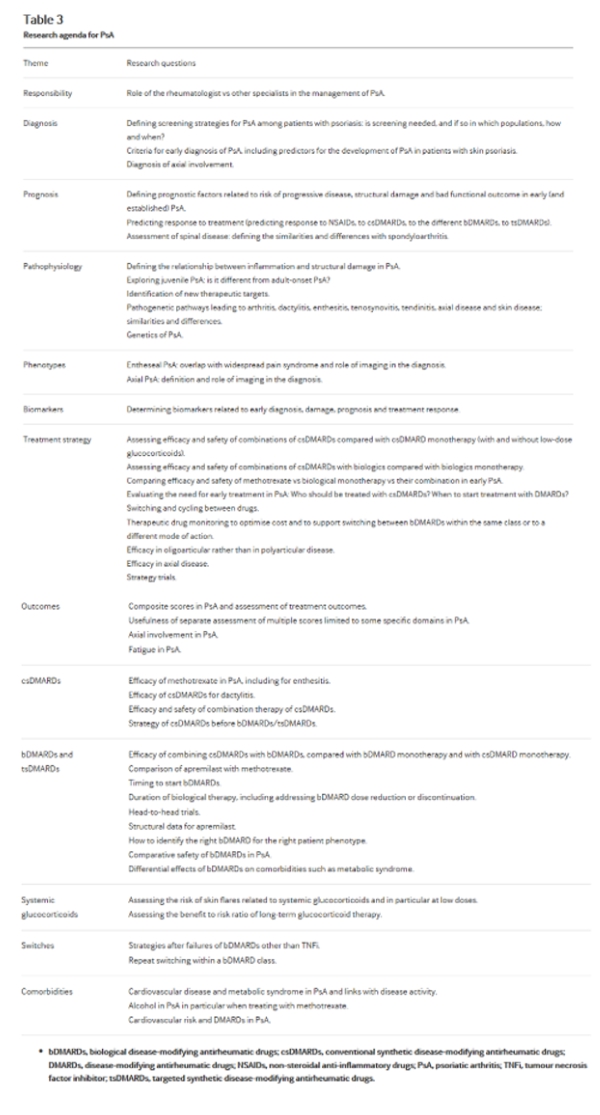
Ключевой статус ревматолога как основного попечителя для людей с ПсА рассматривается в принципе C. Ревматологи обладают оптимальной глубиной и широтой опыта в отношении использования всех типов DMARDs, включая результаты эффективности, оценку риска и знание сопутствующих заболевания. Целевая группа рассмотрела роль медсестер и других медицинских работников в управлении ПсА в отношении принципов А и В. В то время как ревматологи являются основными врачами в уходе за ПсА, в некоторых странах ревматологические медсестры могут назначать лекарства и являются основными медицинскими работниками для пациентов. С другой стороны, в некоторых районах мира, ревматологические подготовки не является достаточно доступным, и другие специалисты могут заботиться о пациентах с ПсА, следуя, термину “первичный”. В тех случаях, когда имеется нехватка ревматологов, целевая группа признала вклад других врачей с соответствующим ревматологическим опытом и добавила этот момент также в повестку дня исследований (таблица 3).
Таблица 3
Повестка дня исследования для PsA
|
Тема |
Вопросы исследования |
|
Ответственность |
Роль ревматолога и других специалистов в управлении ПсА. |
|
Диагноз |
Определение стратегий скрининга для ПсА среди пациентов с псориазом: необходим ли скрининг, и если да, то в каких популяциях, как и когда? Критерии ранней диагностики ПсА, в том числе предикторы для развития ПсА у пациентов с кожным псориазом. Диагноз осевого поражения. |
|
Прогноз |
Определение прогностических факторов, связанных с риском прогрессирующих заболеваний, структурных повреждений и плохой функциональный исход в начале (и установленных) ПсА. Прогнозирование реакции на лечение (прогнозирование реакции на НПВС, на csDMARDs, на различные bDMARDs, на tsDMARDs). Оценка заболеваний позвоночника: определение сходства и различий со спондилоартритом. |
|
Патофизиология |
Определение взаимосвязи между воспалением и структурным повреждением в ПсА. Изучение несовершеннолетних PsA: что отличается от взрослых начала PsA? Выявление новых терапевтических целей. Патогенетические пути, ведущие к артриту, дактилиту, энтезиту, теносиновиту, тендиниту, осевому заболеванию и кожным заболеваниям; сходства и различия. Генетика ПсА. |
|
Фенотипы |
Энтезисный PsA: перекрест с широко распространенным болевым синдромом и ролью визуализации в диагностике. Аксиальный ПсА: определение и роль визуализации в диагностике. |
|
Биомаркеры |
Определение биомаркеров, связанных с ранней диагностикой, повреждением, прогнозом и реакцией на лечение. |
|
Стратегия лечения |
Оценка эффективности и безопасности комбинаций csDMARDs по сравнению с монотерапией csDMARD (с и без низкодозных глюкокортикодов). Оценка эффективности и безопасности комбинаций csDMARDs с биопрепаратов по сравнению с биопрепараты монотерапии. Сравнение эффективности и безопасности метотрексата против биологической монотерапии против их комбинации в ранней PsA. Оценка необходимости раннего лечения в ПСА: Кто должен лечиться с помощью csDMARDs? Когда начать лечение DMARDs? Переключение и ротация между лекарствами. Терапевтический мониторинг лекарственных средств для оптимизации стоимости и поддержки переключения между bDMARDs в пределах одного класса или в другой способом действия. Эффективность при олигоартикулярной, а не при полиартикулярной болезни. Эффективность при аксиальном заболевании. Стратегические исследования. |
|
Результаты |
Составные оценки в ПсА и оценка результатов лечения. Полезность отдельной оценки нескольких баллов ограничивается некоторыми конкретными доменами в PsA. Аксиальное вовлечение при ПСА. Усталость при PsA. |
|
csDMARDs |
Эффективность метотрексата в ПсА, в том числе при энтезите. Эффективность csDMARDs для дактилита. Эффективность и безопасность комбинированной терапии csDMARDs. Стратегия csDMARDs до bDMARDs/tsDMARDs. |
|
bDMARDs и tsDMARDs |
Эффективность сочетания csDMARDs с bDMARDs, по сравнению с монотерапией bDMARD и с монотерапией csDMARD. Сравнение апремиласта с метотрексатом. Сроки начала bDMARDs. Продолжительность биологической терапии, в том числе решение bDMARD снижение дозы или прекращение. Испытания Head-to-head (прямое сравнение препаратов). Структурные данные по апремиласту. Как определить правильный bDMARD для правильного фенотипа пациента. Сравнительная безопасность bDMARDs в PsA. Дифференциальное воздействие bDMARDs на коморбидность, такие как метаболический синдром. |
|
Системные глюкокортикоиды |
Оценка риска обострения кожи, связанных с системными глюкокортикоидами и, в частности, при низких дозах. Оценка соотношения пользы и риска длительной глюкокортикоидной терапии. |
|
Переключения |
Стратегии после неудач bDMARDs, кроме TNFi. Повторите переключение в классе bDMARD. |
|
Коморбидность |
Сердечно-сосудистые заболевания и метаболический синдром при ПсА, и связи с активностью заболеваний. Алкоголь при ПсА, в частности, при лечении метотрексатом. Сердечно-сосудистый риск и DMARDs при ПсА. |
bDMARDs, biological disease–modifying antirheumatic drugs биологические болезни- модифицирующие антиревматические препараты; csDMARDs, conventional synthetic disease–modifying antirheumatic drugs обычные синтетические болезни, болезньмодифицирующие антиревматические препараты; DMARDs, disease–modifying antirheumatic drugs болезньмодифицирующие противоревматические препаратов; NSAIDs, non–steroidal anti–inflammatory drugs; PsA, psoriatic arthritis; TNFi, tumour necrosis factor inhibitor; tsDMARDs, targeted synthetic disease–modifying antirheumatic drugs, целевые синтетические болезнь модифицирующие антиревматические препараты.
Целью лечения является устранение воспаления и оптимизация качества жизни (принцип D) (см. таблицу 1 и обновление 2015 года для получения подробной информации). Была также подчеркнута важность повышенной утомляемости.
Последние два всеобъемлющих принципа относятся к стратегии лечения и были изменены. Принцип Е является новым всеобъемлющим принципом, который подтверждает важность всех проявлений опорно-двигательного аппарата у пациентов с ПсА: это относится не только к периферическому артриту, но и к энтезиту, теносинвиту, тендиниту, дактилиниту и воспалительным аксиальным заболеваниям.
Принцип F (который в 2015 году был принципом Е) теперь включает в себя термин ‘non-musculoskeletal’ «вне-мышечноскелетные », заменяя термин ‘extra-articular’ «экстра -артикулярные» проявления, и относится к вовлечению органов, связанных с ПсА, а именно псориазу, увеиту и воспалительным заболеваниям кишечника. Термин ‘extra-articular manifestations’ «экстра-артикулярные проявления» считался неясным – для некоторых он включает осевые или энтезиальные симптомы, которые не были предназначены в этом контексте. Хотя все вне-мышечноскелетные проявления должны быть приняты во внимание, псориаз, конечно, является наиболее частым. Ссылаясь на сопутствующие заболевания, помимо сердечно-сосудистых заболеваний, депрессия явно упоминается из-за ее частоты и воздействия на пациента. Список сопутствующих заболеваний не должен быть исчерпывающим и другие сопутствующие заболевания также должны быть рассмотрены.
Рекомендации
Было сформулировано или обновлено 12 рекомендаций (таблицы 1 и 2) и легли в основу алгоритма управления (рисунок 1). В таблице 1 приводится категория фактических данных, оценка рекомендации и уровень согласия по каждому из пунктов. Следует иметь в виду, что индивидуальные характеристики заболевания в соответствии с многомерным характером ПсА могут по-разному реагировать на конкретные методы лечения и, таким образом, требуют использования различных инструментов оценки для каждого проявления. Эта изменчивость, а также противопоказаний и рисков должны быть приняты во внимание, и, таким образом, баланс между эффективностью и безопасностью всегда зависит от характеристик отдельного пациента. В таблице 1 и диаграмме 1 содержатся рекомендации сокращенно, а в сопроводительном тексте содержится более подробная информация о фактических данных и процессе обсуждения, и его следует рассматривать как неотъемлемую часть рекомендаций.
Рисунок 1
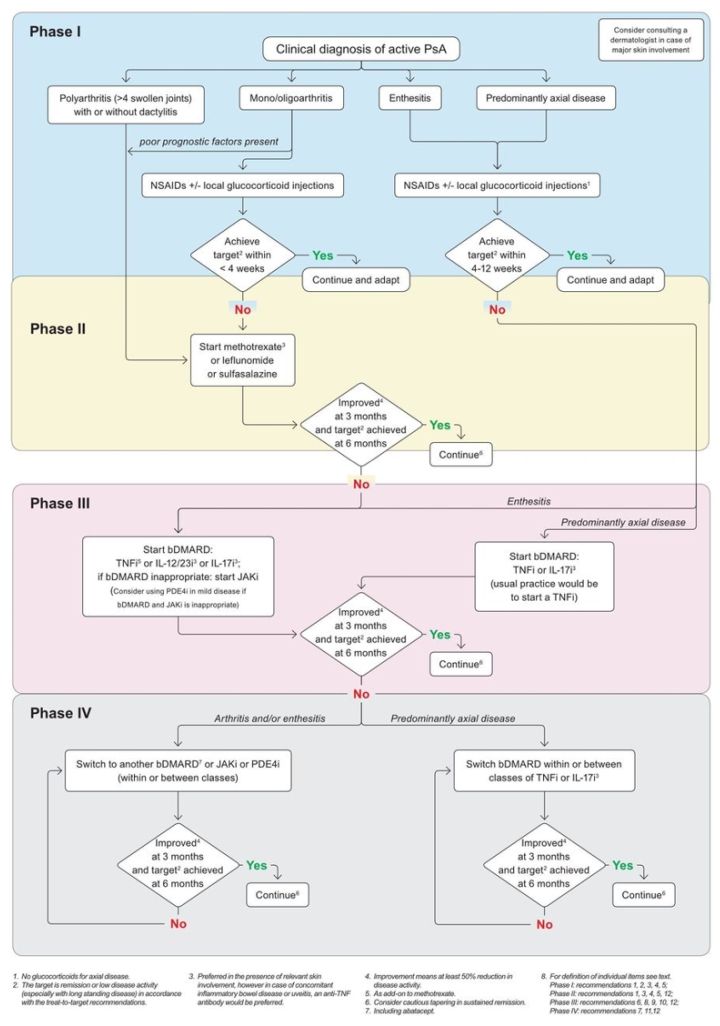
Алгоритм EULAR 2019 для лечения ПсА с фармакологическими не- топическими методами лечения.
bDMARDs, биологические болезни- модифицирующие антиревматические препараты; EULAR, Лига Европы против ревматизма; ингибитор ИЛ-12/23и, ингибитор интерлейкина-12/23; IL-17i, ингибитор интерлейкина-17; JAKi, ингибитор Янус киназы; НПВП, нестероидные противовоспалительные препараты; PDE4i, ингибитор фосфодиэстеразы-4; ПсА, псориатический артрит; TNFi, ингибитор фактора некроза опухоли.
Рекомендация 1: Лечение должно быть направлено на достижение цели ремиссии или, в качестве альтернативы, низкой активности заболеваний, путем регулярной оценки активности заболеваний и надлежащей корректировки терапии.
В этой рекомендации выдвигается важность подхода “лечение к цели” (T2T). Стратегия T2T, которая включает в себя определение отдельной цели, а также соблюдение правил мониторинга и терапевтической корректировки, хорошо проверена особенно при ревматоидном артрите. Рекомендации T2T для PsA были обновлены недавно. В соответствии с этими рекомендациями этот момент был слегка перефразирован и теперь четко заявляет, что ремиссия или низкая активность болезни должны быть целенаправленными в последнее время. В соответствии с этими рекомендациями этот момент был слегка перефразирован и теперь четко заявляет, что ремиссия или низкая активность болезни должны быть целенаправленными, с удалением ранее заявленного термина минимальной активности болезни (которая относится к баллу, позволяющему оценить низкую активность болезни, а не к цели). Ремиссия при ПсА трудно определить. Ремиссия следует рассматривать как подавление воспаления.
Рекомендация 2: Нестероидные противовоспалительные препараты могут быть использованы для облегчения опорно–двигательного аппарата признаков и симптомов.
Как и в предыдущих версиях целевая группа продолжает рекомендовать использование нестероидных противовоспалительных препаратов (НПВП) для облегчения симптомов. Преимущество и соотношение риска НПВП всегда должны быть тщательно рассмотрены, особенно в этой популяции с частыми сердечно-сосудистых сопутствующих заболеваний.
Целевая группа отметила, что, в отличие от ревматоидного артрита, при легком синовите при ПсА или при non-synovial не-синовальных проявлениях, включая осевые симптомы, одного НПВП может быть достаточно для контроля симптомов, особенно при местных глюкокортикоидных инъекциях (см. рекомендацию 3). Есть мало данных об эффективности НПВС при энтезите. У пациентов с периферическим артритом НПВС должны быть объединены быстро с DMARDs, если это необходимо (см. также рекомендации 4 и 5). НПВС не показали никакой эффективности при псориазе кожи. Когда периферический артрит присутствует, монотерапия НПВС без DMARDs не должна превышать 1 месяц, если активность заболевания сохраняется, и другие возможности лечения должны быть рассмотрены. Когда осевое или энтезиальное вовлечение доминирует в клинической картине, продолжительность терапии НПВС может быть продлен до 12 недель, при условии, что они уже индуцировали облегчение за 4 недели. Если цель лечения не достигнута, другие методы лечения должны быть предписаны, как подробно описано в последующих рекомендациях.
Рекомендация 3: Местные инъекции глюкокортикоидов следует рассматривать как вспомогательную терапию при псориатическом артрите; системные глюкокортикоиды можно использовать с осторожностью при самой низкой эффективной дозе.
Эта рекомендация остается неизменной по сравнению с 2015 годом, но была переупорядочена, чтобы лучше соответствовать различным фазам лечения (рисунок 1). Следует также отметить, что глюкокортикоидная терапия должна использоваться только в течение короткого периода времени. Целевая группа не рекомендует использовать системные глюкокортикоиды при осевом заболевании.
Рекомендация 4: У пациентов с полиартритом, csDMARD следует начать быстро, с метотрексатом предпочтительным в тех, с преобладающим вовлечением кожи.
Основным изменением в рекомендациях 4 и 5 (вместе рекомендации 3 в 2015 году) является разделение полиартикулярного от олигоартикулярного вовлечения суставов для обеспечения того, чтобы более худший прогностический характер полиартрита был более сильно подчеркнут , чем это было сделано раньше. Целевая группа определила полиартикулярное заболевание как пять или более активных (опухших) суставов. Пациенты с полиартикулярными заболеваниями должны получать CSDMARD либо как препарат первой линии или после короткого курса НПВП. “Быстрый” подразумевает скорейшее начало csDMARD, соизмеримый с тяжестью клинического представления или сопутствующих состояний; задержки не должны превышать 2 недель. Таким образом, хотя рекомендация 4 была недавно добавлена, она уже состояла из прежней рекомендации 3, где “многие опухшие суставы” был упомянут как плохой прогностический маркер, требующий быстрого (‘раннего’) применения DMARDs.
Эта рекомендация, а также рекомендация 5, помещает использование csDMARDs в ведении PsA в качестве первой линии DMARDs. Непрерывная приоритетность csDMARD отражает консенсусное экспертное мнение в рамках целевой группы, которая выступает за выгоду для баланса риска csDMARDs и, в частности, MTX над биологическими, а также их более низкой стоимости. Данные, подтверждающие использование MTX в PsA являются скудными и включают в себя только небольшие или неубедительные клинические испытания, а также косвенные доказательства, вытекающие из исследования TICOPA и доказательства из наблюдательных исследований. Однако, исследование SEAM-PsA, которое было частью SLR и тем временем было опубликовано в полном объеме, показало, что MTX имеет эффективность аналогичной в подсчете суставов, вовлечения кожи, энтезит, дактилит и физическая функция, как этанерцепт или даже etanercept плюс MTX. Учитывая это сходство эффективности, и различия в расходах, это исследование дополнительно поддерживает решение целевой группы поместить MTX и другие csDMARDs в верхней части терапевтического алгоритма (рисунок 1).
Целевая группа признала, что пациенты могут иметь нежелание принимать MTX и могут испытывать неблагоприятные последствия. Насколько нам известно, данные, доказывающие, что MTX менее хорошо переносится при ПсА, чем при ревматоидном артрите, отсутствуют, но последствия и общий долгосрочный опыт работы с MTX должны быть частью информации, предоставленной пациенту в процессе совместного принятия решений. До сих пор, MTX остается широко используемым в повседневной практике, как сообщается в реестрах, имеет высокое содержание лечения с течением времени и кажется эффективным средством клинических испытаний, в котором борьба с болезнями с помощью монотерапии MTX представляется удовлетворительной.
MTX выделяется среди csDMARDs, в частности, для пациентов с ‘relevant’ “соответствующим” вовлечением кожи: “соответствующие” определяется как либо обширные (участие поверхности тела >10%), или как важно для пациента: более ограниченный псориаз, ведущих к значительному влиянию на качество жизни (например, лицо / рука / ноги / генитальные участки). Это определение будет соответствовать, в других дерматологических терминах, к умеренной до тяжелой псориаза. MTX доказал эффективность при псориазе кожи, рекомендуется в рекомендациях по лечению псориаза и стал стандартным csDMARD для псориаза кожи во многих странах.
С другой стороны, MTX приводит к гепатотоксичности, и данные о благотворном воздействии MTX на сердечно-сосудистые заболевания в PsA являются противоречивыми. Принимая во внимание все эти элементы, целевая группа предложила постепенный подход к активизации лечения ПсА наиболее подходящим и предложил csDMARD (обычно MTX) в качестве первого DMARD. MTX следует назначать, пытаясь достичь 25 мг в неделю в качестве оптимальной дозы и с фолатами добавок. Другие csDMARDs показали эффективность в PsA, а также и может быть рассмотрен на данном этапе (хотя и с меньшей эффективностью для кожи): они включают лефлуномид и сульфасалазин. Ciclosporin не рекомендуется для ПсА.
Если улучшение не превышает 50% от исходной меры для ПсА в течение 3 месяцев или цель лечения не достигается в течение 6 месяцев, такая терапия csDMARD не должна проводиться дальше (рисунок 1). В свете нехватки хороших клинических данных поиск лучших доказательств эффективности csDMARDs как монотерапия или как комбинированная терапия была приоритетом на повестке дня исследований.
Рекомендация 5: У пациентов с моноартритом или олигоартритом, особенно с плохими прогностическими факторами, такими как структурные повреждения, высокая скорость оседания эритроцитов/С реактивный белок, дактилит или поражения ногтей, следует назначать csDMARD.
В этой рекомендации подчеркивается, что пациенты с олигоартикулярным заболеванием должны (по аналогии с полиартикулярными пациентами) быстро получать csDMARD при наличии плохих прогностических факторов (см. текст рекомендации). Что касается факторов, связанных с плохим прогнозом (здесь определяется как радиографическая тяжесть), SLR определила поражение ногтей в дополнение к тем факторам, представленным в 2011 и 2015 годах, и этот элемент был соответственно добавлен в формулировку рекомендации 5.
Дактилит ранее рассматривался вместе с энтезитом (см. рекомендацию 9 в 2015 году). Однако в настоящее время эти проявления разделены. Целевая группа посчитала, что дактилит отличается с точки зрения физиопатологии, диагностики и прогноза, так как это связано с радиографическими изменениями при ПсА, в то время как энтезит нет. Кроме того, хотя есть отсутствие качественных данных, последние исследования показывают, по крайней мере некоторые эффективности MTX при dactylitis. Таким образом, дактилит теперь следует рассматривать аналогично артриту, и, если связан с полиартикулярной болезнью следует лечить как полиартрит. Следует отметить, что НПВП не продемонстрировали эффективность при дактилите.
Учитывая отсутствие достоверных данных олигоартикулярной ПсА, эта рекомендация была основана скорее на экспертном мнении, чем на достоверных данных (уровень фактических данных, 4; класс рекомендаций: C).
Рекомендация 6: У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD, терапия с bDMARD должны быть начаты; при наличии соответствующего вовлечения кожи может быть предпочтительнее ингибитор IL-17 или ингибитор IL-12/23.
Эта рекомендация касается пациентов с периферическим артритом, после отсутствия эффекта или непереносимости, по крайней мере одного CSDMARD. У этих пациентов целевая группа рекомендует bDMARD. У некоторых пациентов, особенно без плохих прогностических факторов или у пациентов с легкой активностью, можно указано, что они переходят на второй csDMARD перед началом bDMARD, как это было ранее изложено в рекомендациях 2015 года.
Целевая группа широко обсудила легитимность bDMARD в качестве первой стратегии DMARD; дискуссия была сосредоточена на эффективности и безопасности, а также на расходах. Целевая группа имела мнение, что многие пациенты реагируют удовлетворительно MTX, в то время как переносимость препарата хорошая. Эти пациенты могут быть перелечены overtreatment, если начать bDMARD немедленно, а не ждать в течение 3 месяцев, чтобы определить, если ответ на MTX проявляется (см. рекомендации 9 и 10). Хороший пример показан в исследовании SEAM-PsA. Однако, если преобладает энтезиальное или осевое воспалительное поражение, предлагается более раннее использование bDMARDs, поскольку CSDMARDs неэффективны в этих условиях (см. рекомендации 9 и 10).
В то время как в рекомендации 2015 года говорится, что начало TNFi по сравнению с другими BDMARDs является «обычной практикой», то текущее обновление больше не проводит различия между ингибитором TNFi, IL-12/23 (IL-12/23i) и IL-17 (ингибитор IL-17i). SLR подтвердил эффективность TNFi в PsA, и в настоящее время обнадеживает долгосрочные данные о безопасности с этими препаратами, в том числе данные о том, что заболеваемость злокачественных новообразований не увеличивается. Препараты ориентированные IL-12/23 и IL-17 также последовательно эффективным по сравнению с плацебо и долгосрочной безопасности кажется благоприятным. В дополнение к secukiab, кроме secukiab, второй Ил-17и, ixekizumab, был утвержден с 2015 рекомендаций, показывая аналогичную эффективность и безопасность профиля, который еще больше убедил целевую группу. Важно, прямые испытания ixekizumab по сравнению с TNFi adalimumab показал аналогичную эффективность ixekizumab и adalimumab для поражения опорно-двигательного аппарата.
Следует отметить, что эффективность для суставов оказалась численно меньше для ИЛ-12/23i ustekinumab; однако данные наблюдений указывают на аналогичные масштабы реагирования по сравнению с TNFi, и в настоящее время не проводится прямого сравнения. Кроме того, Целевая группа отметила, что недавние исследования с биологическими объектами, ориентированными на ИЛ-23-p19 (guselkumab, risankizumab, tildrakizumab), представляются обнадеживающими, и что таргетинг на этот путь показал отличную эффективность в псориазе. Таким образом, предлагаемый порядок между различными целевыми путями намеренно не дается в этой рекомендации.
Общая картина безопасности этих трех категорий bDMARDs оказалась приемлемой в нашем SLR. Риски TNFi хорошо известны из крупных реестров для долгосрочной безопасности, включая эти препараты. IL-17i может увеличить заболеваемость (мягким) локализованным кандидозом, и мониторинг возможного повышенного риска воспалительных заболеваний кишечника все еще продолжается. В любом случае безопасность всегда должна быть тщательно рассмотрена у каждого пациента; более полная информация об аспектах безопасности bDMARDs предоставляется в инструкциях упаковки лекарств.
Принимая вместе данные об эффективности и безопасности, в отношении лечения артрита в ПсА, целевая группа не нашла оснований в настоящее время приоритеты одного из этих bDMARDs над другими (как показано также в рисунке 1); следует также принимать во внимание расходы, которые могут варьироваться на уровне стран.
В отличие от il-12/23i и IL-17i показали большую эффективность для кожи, чем TNFi, в испытаний head-to-head псориаза и PsA; это доказательство оправдывает вторую половину рекомендации, которая поощряет использование IL-12/23i или IL-17i у пациентов с ‘relevant’ соответствующим поражением кожи, где “соответствующие” определяется (как выше) как обширные или как важно для пациента.
При выборе первого bDMARD, дифференцированное воздействие на определенные опорно-двигательного аппарата и не-мышечноскелетных проявления, а также сопутствующие заболевания, такие как метаболический синдром должен быть рассмотрен. Хотя важное участие кожи уже упоминалось, IL-12/23 ингибирование не может быть эффективным для осевого поражения ; Ингибирование IL-17 может не подходить пациентам с сопутствующими воспалительными заболеваниями кишечника, для которых одобрены моноклональные антитела к ингибиторам ТНФ и ИЛ-12/23; и при наличии увеита моноклональное антитело к ФНО может быть предпочтительным первым и вторым bDMARD из-за соответствующего утверждения. С другой стороны, в отношении сопутствующих заболеваний, нехватка соответствующих данных исключает твердые рекомендации в настоящее время; это было добавлено в повестку дня исследований.
Обсуждался вопрос монотерапии с bDMARDs против комбинированной терапии с csDMARD. Текущая рекомендация заключается в продолжении MTX с bDMARD (используя последнюю в качестве дополнительной стратегии) у пациентов, уже принимающих этот препарат и переносящих его хорошо, но целевая группа признала, что на сегодняшний день нет четких доказательств того, что комбинированная терапия является более эффективной, чем монотерапиальная , помимо небольшого снижения иммуногенности, которая имеет сомнительную клиническую значимость. Мы предполагаем, что доза MTX может быть снижена у испытуемых, показывающих хороший ответ на биологический препарата, особенно когда есть опасения по поводу токсичности MTX. Тем не менее, необходимы дополнительные данные, и этот момент был включен в повестку дня исследований.
Рекомендация 7: У пациентов с периферическим артритом и неадекватной реакцией по крайней мере на один csDMARD и по крайней мере один bDMARD, или когда bDMARD не подходит, ингибитор JAK может быть рассмотрен.
На данный момент единственным ингибитором JAK (JAKi), одобренным для ПсА, является тофацитиниб. Наши SLR указал tofacitinib может иметь аналогичную эффективность, как TNFi adalimumab для поражения суставов, но численно более низкую эффективность при кожном псориазе. Там также, как представляется, удовлетворительная эффективность tofacitinib в TNFi недостаточно отвечающей популяции. По утверждению Европейского агентства лекарственных средств, tofacitinib должны назначаться с MTX. Сигналы безопасности существуют для некоторых инфекций, особенно опоясывающий лишай герпеса, а также недавний сигнал для тромбоза глубоких вен, особенно с высокой дозой тофацитиниба, который не одобрен для ПсА, но и обычные 5 мг в два раза в день, обычны при сердечно-сосудистых факторах риска и пожилых пациентов.
На сегодняшний день два других JAKis находятся в стадии разработки для PsA. Филготиниб показал многообещающую эффективность в фазе II испытания и upadacitinib был одобрен для использования при ревматоидном артрите вскоре после разработки этих рекомендаций, а также показал обнадеживающие результаты в PsA.
Принимая во внимание эти данные, а также общий принцип предпочтительного выбора лекарств с надежными долгосрочными данными по безопасности, целевая группа предложила JAKi либо после неадекватного реагирования или непереносимости по крайней мере один bDMARD, или когда bDMARD считается нецелесообразным. ‘Not appropriate’ “Неподходящие”, например, несоблюдение правил инъекций или сильное предпочтение пациента для перорального препарата (в соответствии с общим принципом А, касающиеся “совместного принятия решений”). Вместе с тем группа согласилась с тем, что, как правило, поэтапным подходом будет csDMARD, за которым последует bDMARD, а затем еще один bDMARD или JAKi.
По мере поступления новых данных текущее позиционирование JAKis может меняться; это оправдывает обновление рекомендаций, если это необходимо.
Рекомендация 8: У пациентов с легким заболеванием и неадекватной реакцией по крайней мере на один csDMARD, у которых не подходит ни bDMARD, ни ингибитор JAK, может быть рассмотрен ингибитор PDE4.
Как и в обновленном обновлении 2015 года, эта рекомендация оставляет за собой особое место для апремиластов: она должна применяться только в тех случае, если терапия csDMARD провалилась, а bDMARDs и JAKi не подходят; однако целевая группа сочла, что значение апремистрада может быть обнаружено при лечении пациентов с относительно легким заболеванием или пациентов с относительно легким заболеванием или пациентов с противопоказанием других агентов, например у пациентов с хроническими инфекциями. Легкая болезнь определяется здесь, как поражение нескольких суставов (четыре или менее, таким образом, олигоартикулярное заболевание), снижение активности заболевания по составным баллам и / или ограниченное участие кожи. Причина для предложения использования апремиластов в первую очередь для легкой болезни является хорошие результаты, такие, как Amercian колледж ревматологии 70% (ACR70), которые редко можно увидеть в клинических испытаниях с apremilast и иногда не отличаются от плацебо. Кроме того, радиографические данные, обеспечивающие болезнь-модифицирующий потенциал препарата по-прежнему не хватает для apremilast, и поэтому этот препарат не может быть подходящим для пациентов с плохими прогностическими факторами. Рандомизированное контролируемое исследование с апремиатором при олигоартиликулярной болезни в настоящее время ведется.
Уровень согласия с этой рекомендацией был ниже, чем для других, предлагая различные мнения экспертов о месте этого препарата.
Рекомендация 9: У пациентов с однозначным энтезитом и недостаточным ответом на НПВП или локальные глюкокортиковидные инъекции следует рассмотреть вопрос о терапии bDMARD.
По сравнению с рекомендацией 8 версии 2015 года, «активный энтезит» был заменен «однозначным энтезитом» ‘unequivocal enthesitis’, а последняя часть о том, что «текущая практика заключается в использовании ингибитора TNF», была опущена. У пациентов с энтезитом, НПВП и местных глюкокортикоидов являются первой линии лечения; в случае недостаточной реакции, непереносимости или противопоказаний к НПВП, и учитывая, что csDMARDs не являются эффективными для энтезита, bDMARD (таргетинг TNF, IL-17 или IL-12/23) могут быть использованы. “Энтезит” здесь относится к воспалению, а не энтезиальной боли, и термин “однозначный ” в настоящее время был добавлен, чтобы избежать перелечивания overtreating триггерной точки боль, которая имеет другие основные причины (такие, как сопутствующие широко распространенные болевые синдромы). Хотя сонография или МРТ может лежать в основе подтверждения энтезита, клиническое обследование должно быть в принципе достаточно, и количество и паттерн(асимметричный) болезненных энтезисов, а также наличие клинического отека, должны направлять врача и позволить отличить от широко распространенных болевых синдромов. Энтезиальная болезнь является сложным вопросом в PsA, а также был добавлен в повестку дня исследований.
Что касается bDMARDs, целевая группа в настоящее время рассматривает все bDMARDs как имеющие эффективность аналогичного масштаба для энтезита и, следовательно, предпочтение TNFi был удален.
Рекомендация 10: У пациентов с преимущественно осевой болезнью, которая активна и не имеет достаточной реакции на НПВП, следует рассмотреть вопрос о терапии с bDMARD, который в соответствии с текущей практикой является ингибитором TNF; при наличии соответствующего поражения кожи, ингибитор IL-17 может быть предпочтительным.
В 2015 году преобладающее (или весьма значительное) осевое участие рассматривалось в рекомендации 9. Формулировка нынешней рекомендации была частично согласована с Оценкой Международного общества Спондилоартрита (ASAS)/EULAR в отношении осевого спондилоартрита (axSpA), за исключением того, что они еще не учитывают использование Ил-17. В нем также говорится о том, что в ситуации преимущественно осевого заболевания, TNFi по-прежнему будет представлять собой первый bDMARD обычной практикой. Целевая группа обсудила, что secukinumab продемонстрировал эффективность в axSpA, и недавно продемонстрировал эффективность у пациентов считается преобладающим осевой PsA. Однако, опыт с IL-17 ингибирование с точки зрения долгосрочной эффективности и безопасности в axSpA и аксиальном PsA ограничен.
В преимущественно осевом PsA, в присутствии соответствующих поражения кожи (как определено в тексте ниже рекомендации 4), IL-17i будет предпочтительным по сравнению с TNFi, учитывая большую эффективность IL-17i для кожи. Важно, однако, в случае сопутствующего заболевания кишечника или увеита, TNFi (моноклональные антитела) предпочтительнее.
Примечательно, что препараты ил-12/23 не продемонстрировали эффективность при axSpA. Таким образом, в свете отсутствия четкой эффективности препараты, нацеленные на ИЛ-12/23 и абатацепт (см. также рекомендацию 11), не указаны для пациентов с преимущественно осевым заболеванием.
Рекомендация 11: У пациентов, которые не реагируют адекватно, или непереносят bDMARD, переход на другой bDMARD или tsDMARD должны быть рассмотрены, в том числе с одним переключением в классе.
Эта рекомендация, незначительное расширение рекомендации, ранее нумерованной как 10, касается первого отсутствия эффекта или непереносимости bDMARD. Здесь мы предлагаем перейти либо к другому bDMARD или к tsDMARD, особенно JAKi. Новые данные о переключениях switches ограничены, и только одно такое новое исследование, найденное в ходе SLR. Испытания, выполненные у недостаточных ответчиков TNFi продемонстрировали эффективность bDMARDs с другим способом действия, когда TNFi эффект отсутствовал. Однако, другой TNFi также может быть использован, так как прямые исследования препаратов не доступны, которые предлагают, что переключение между классами отличается переключение в классе. Наконец, целевая группа согласилась с тем, что, хотя переключение в классе является целесообразным вариантом, было бы логично изменить класс после второго отсутствия эффекта в пределах данного класса (экспертное мнение). Исследования, посвященные наилучшей возможной стратегии после неудачи (ы) bDMARDs, кроме TNFi не хватает на сегодняшний день, и эта тема была добавлена в исследовательскую повестку дня.
Целевая группа обсудила место абатацепта, который был одобрен для использования в PsA, и считает, что место абатацепта в текущем алгоритме должно быть ограничено потенциальным использованием после того, как другие bDMARD не эффективны, учитывая его относительно низкую эффективность.
Рекомендация 12: У пациентов с устойчивой ремиссией может быть рассмотрено осторожное tapering постепенное снижение DMARDs.
Это новая рекомендация, основанная главным образом на широком консенсусе экспертов в отношении отсутствия надежных данных о ходе испытаний. Sparse данные свидетельствуют о определенном риске рецидива (либо для суставов или кожи), при tapering тапперинге . Тем не менее, целевая группа решила предложить руководство по tapering, так как это чувствовалось важным аспектом современного управления, особенно когда устойчивая ремиссия была достигнута, чтобы смягчить связанные с лечением риски, чтобы удовлетворить желания и требования пациентов, а также снизить стоимость лечения.
Tapering было сочтено целесообразным только в контексте устойчивой ремиссии, определяемой здесь как полная ремиссия (а не низкая активность болезни) в течение по крайней мере шести месяцев подряд.
Этот момент был намеренно сформулирован предварительно, с рекомендацией снижаться с большой осторожностью, как следствие совместного принятия решений, основанных на всеобъемлющей информации о пациентах. Рекомендация не имеет намерения подтолкнуть клиницистов к прекращению лечения, а попытаться найти наименьшую эффективную дозу, либо через сокращение дозы или интервал удлинения. В качестве одного из пунктов повестки дня исследований были также добавлены наилучшие возможные стратегии tapering (таблица 3).
Обсуждения
С момента последнего обновления этих рекомендаций новая информация накопилась об эффективности и безопасности установленных препаратов и стратегий лечения, но и о новых агентов, таких как IL-17is и IL-12/23is, а также JAKis. Таким образом, в то время как эти обновленные рекомендации продолжают интегрировать установленные, а также новую информацию, они также продолжают пытаться охватить широкий спектр тяжести заболевания, что лучше всего отражает клиническую практику, для того, чтобы направлять клиницистов и других заинтересованных сторон, участвующих в лечении пациентов с PsA с простым алгоритмом и набором рекомендаций, которые могут быть легко переведены в повседневную клиническую практику. Важно отметить, что вся эта информация основана на тщательном SLR и на выводах экспертного комитета, который в основном использовал доказательства для получения своих рекомендаций, а также мнения специалистов, где доказательств не было или было недостаточно.
Эти рекомендации были существенно изменены по сравнению с обновлением 2015 года, поскольку на рынок поступили новые лекарства и накоплено больше данных о существующих лекарствах (таблица 2). В частности, стали доступны данные о долгосрочной безопасности, которые, что, что еще более важно, повышает надежность фактических данных. В целом это обновление соответствует прежней структуре этих рекомендаций во всех отношениях. (1) Мы продолжаем отделять этот руководящий документ на всеобъемлющие (общие) подходы к лечению и индивидуальные терапевтические рекомендации. (2) Мы по-прежнему рекомендуем таргетировать клиническую ремиссию (прежде всего на ранние заболевания) или, в качестве альтернативы, низкую активность заболеваний (для установленного заболевания); в этом свете, умеренное, не говоря уже о состоянии высокой активности болезни является неприемлемым, если сопутствующие заболевания или другие факторы пациента исключают лечение достижений. (3) Мы по-прежнему рекомендуем стратегию T2T; рекомендации T2T были недавно обновлены и предлагают по крайней мере 50% улучшение составной меры в течение 3 месяцев и достижение цели в течение 6 месяцев с начала лечения, таким образом, требуя использования непрерывного измерения активности болезни следовать пациентов продольно, а также отражают восприятие пациента. (4) Как и прежде, мы структурировать путь к успешному результату в четыре этапа, начальная фаза, которая может быть достаточно в очень легкой болезни или требуют продвижения к одному из следующих двух этапов; второй этап, посвященный использованию csDMARD; третья фаза для пациентов, которые не смогли достичь цели в фазе II и/или фазе I при демонстрации преобладающей осевой или энтезиальной болезни; и четвертый этап для тех, у кого отсутствовал результат фазу III.
Кроме того, мы предоставляем количественную, а не только качественную оценку доказательств, имеющихся в распоряжении всех агентов, – не каждому одобренному препарату должен быть присвоен одинаковый уровень применимости, если база данных предполагает различия, даже если исследования, в основном, отсутствуют. На наш взгляд, задача экспертных комитетов судить и квалифицировать имеющиеся данные в меру своих знаний для наилучших результатов пациентов путем интерпретации релевантности имеющиеся данные после тщательного обсуждения и процесса принятия решений. Таким образом, мы взвесили доказательства, представленные SLR в ходе обсуждения и голосования. Мы стремились и стремились предоставить рекомендации, которые были бы не только правдивыми, но и имели валидность и, следовательно, полезность.
При подготовке рекомендаций целевая группа придерживалась оперативных процедур EULAR по разработке рекомендаций и оценивала уровни фактических данных в соответствии с подходом Оксфордской доказательной медицины. Наконец, основное внимание этой целевой группы было сосредоточено на проявлениях поражения опорно-двигательного аппарата и, упомянув при этом необходимость консультаций с другими специалистами, эти рекомендации, в соответствии с составом целевой группы, в первую очередь направлены на ревматологов и их пациентов с ПсА. Рекомендации для других специалистов следует искать в соответствующей специальности литературы.
В отличие от других организаций, которые также выпустили рекомендации по лечению для PsA, EULAR решила не проводить Град оценки рекомендаций оценки, развития и оценки (GRADE) методологии для приоритетов доступных методов лечения. В то время как методология GRADE широко используется и высоко ценится за правильное оценку качества имеющихся данных, эксперты в EULAR считают, что GRADE уделяет слишком много внимания самой методологии и имеет тенденцию преуменьшать распространенные, но плохо исследованные клинические сценарии, для которых врачи все еще ищут руководства. Хорошим примером последнего является место MTX в качестве первой линии лечения: в то время как мы признаем отсутствие хороших клинических доказательств для MTX в качестве первой линии DMARD, мы по-прежнему рекомендуем его как таковой, в силу долгосрочного положительного клинического опыта, в том числе данные из реестров, а также последние обнадеживающие результаты, такие как в TICOPA и SEAM-PsA испытаний, долгосрочного положительного клинического опыта , широко распространенная известность и низкая стоимость лечения. Мы считаем, что этот набор практических рекомендаций, который был разработан в соответствии с общими принципами доказательной медицины, поможет ревматологам в выборе наиболее подходящего и экономически эффективного лекарственного лечения для каждого пациента с ПсА и в каждом клиническом случаи, даже если база научных доказательств может отставать во многих аспектах заболевания. Мы признаем, что области, в которых фактические данные являются редкими или отсутствуют, имеют решающее значение, и они составляют повестку дня исследований. Мы надеемся, что клинические исследователи будут находиться под влиянием и оценить клинические вопросы, обобщенные в повестке дня исследований, и дизайн экспериментов или испытаний, направленных на обеспечение решения этих вопросов исследования.
Все эти аспекты позволили нам обеспечить то, что целевая группа считает правильным местом для различных классов препаратов в алгоритме лечения. Тем не менее, рекомендации EULAR PsA сохранили свой первоначальный характер, который они разделяют с другими наборами рекомендаций EULAR для различных воспалительных заболеваний. Важными элементами этого являются поэтапный подход в пользу хорошо известных csDMARDs в качестве препаратов первой линии и позволяет переход к bDMARDs, когда это необходимо; предпочитая лекарства с установленным долгосрочным послужным списком безопасности по сравнению с теми, которые недавно были одобрены; и внимание к tapering и прекращения лечения, если это возможно.
Как и прежде, рекомендации четко указать, что один препарат не подходит всем и оговаривают роль фенотипов и характеристик пациента в процессе принятия решений о начале и прекращении лечения. Совместное принятие решений стало неотъемлемой частью управления пациентами с PsA. Существует также больше внимания для “прогностического профилирования”, уделяя больше дань клинической реальности; в то время как спектр пациентов с ПсА включены в испытаниях отмечает перекос в сторону пациентов с прогностически неблагоприятные полиартикулярной PsA, этот тип PsA является относительно редким условием в клинической практике, особенно в ситуации первоначальных ранних проявлений болезни в современной практике ревматологии. Таким образом, рекомендации должны также дать руководство о том, как поступать с пациентами с легким олигоартикулярным или моноартикулярным заболеванием.
Решения лечения также должны принимать во внимание экстрамышечноскелетные проявления болезни, такие как воспалительные заболевания кишечника или увеит, помимо участия кожи, которые требуют различных методов лечения (анти-TNF моноклональные антитела для увеита, анти-TNF моноклональных антител или IL-12/23i для воспалительных заболеваний кишечника в отсутствие осевого поражения) только так же, как они требуют четкой клинической оценки. Важно отметить, что эти новые части информации только возникла из информации, которая была получена в ходе клинических испытаний различных установленных и новых соединений.
Как и прежде, обновленные рекомендации были обобщены в алгоритме. Алгоритм EULAR (рисунок 1) по-прежнему учитывает разнообразие мышечноскелетных проявлений ПсА и должен быть легко выполняться; где новые методы лечения особенно эффективны в отношении участия кожи, специальная записка предоставляется в алгоритме (см. также соответствующие сноски), что позволяет следовать этим рекомендациям управления прямо на протяжении всей эволюции болезни.
Таким образом, обновленные рекомендации по лечению для пациентов с ПсА, проживающих во многих странах, под влиянием очень разных систем здравоохранения, поддерживают принятие решений для управления ПсА и адресуется к всему спектру заболевания. Обновление будет необходимо в течение 2-4 лет, как новые данные появяться для PsA.
Авторы
Laure Gossec1,2,
Xenofon Baraliakos3,
Andreas Kerschbaumer4Maarten de Wit5, Iain McInnes6, Maxime Dougados7, Jette Primdahl8,9, Dennis G McGonagle10,11, Daniel Aletaha12, Andra Balanescu13, Peter V Balint14, Heidi Bertheussen15, Wolf-Henning Boehncke16, Gerd R Burmester17, Juan D Canete18, Nemanja S Damjanov19, Tue Wenzel Kragstrup20,21, Tore K Kvien22, Robert B M Landewé23,24, Rik Jozef Urbain Lories25,26, Helena Marzo-Ortega10,11, Denis Poddubnyy27,28, Santiago Andres Rodrigues Manica29,30, Georg Schett31, Douglas J Veale32, Filip E Van den Bosch33, Désirée van der Heijde22,34, Josef S Smolen35,36
Медицинские учреждения:
Institut Pierre Louis d’Epidémiologie et de Santé Publique, INSERM, Sorbonne Universite, Paris, France
APHP.Sorbonne Universite, Rheumatology Department, Hopital Universitaire Pitie Salpetriere, Paris, France
Ruhr-Universität Bochum, Rheumazentrum Ruhrgebiet, Herne, Germany
Division of Rheumatology, Department of Medicine 3; 2nd Department of Medicine, Hietzing Hospital, Medical University of Vienna, Vienna, Austria
EULAR, Zurich, Switzerland
Institute of Infection, Immunity and Inflammation, University of Glasgow, Glasgow, UK
Hopital Cochin, Rheumatology, Université Paris Descartes, Paris, France
Danish Hospital for Rheumatic Diseases, University Hospital of Southern Denmark, Sønderborg, Denmark
Department of Regional Health Research, University of Southern Denmark, Odense, Denmark
LTHT, Leeds NIHR Biomedical Research Centre, Leeds, UK
Leeds Institute of Rheumatic and Musculoskeletal Medicine, University of Leeds, Leeds, UK
Division of Rheumatology, Department of Medicine 3, Medical University of Vienna, Vienna, Austria
Research Center of Rheumatic Diseases, Sf Maria Hospital, Carol Davila University of Medicine and Pharmacy, Bucharest, Romania
3rd Department of Rheumatology, National Institute of Rheumatology and Physiotherapy, Budapest, Hungary
Patient Research Partner, EULAR, Oslo, Norway
Dermatology, University Hospitals of Geneva, Geneva, Switzerland
Rheumatology and Clinical Immunology, Charite University Hospital Berlin, Berlin, Germany
Arthritis Unit, Department of Rheumatology and IDIBAPS, Hospital Clinic, Barcelona, Spain
Institute of Rheumatology, Belgrade University School of Medicine, Belgrade, Serbia
Department of Biomedicine, Aarhus University, Aarhus C, Denmark
Department of Rheumatology, Aarhus Universitetshospital, Aarhus, Denmark
Rheumatology, Diakonhjemmet Hospital, Oslo, Norway
Amsterdam Rheumatology Center, AMC, Amsterdam, The Netherlands
Rheumatology, Zuyderland MC, Heerlen, The Netherlands
Laboratory of Tissue Homeostasis and Disease, Skeletal Biology and Engineering Research Center, KU Leuven, Leuven, Flanders, Belgium
Rheumatology, KU Leuven University Hospitals Leuven, Leuven, Flanders, Belgium
Department of Rheumatology, Infectious Diseases and Rheumatology, Charité Universitätsmedizin Berlin, Berlin, Germany
Epidemiology, German Rheumatism Research Center Berlin, Berlin, Germany
Rheumatology, Hospital de Egas Moniz, Lisboa, Portugal
Universidade Nova de Lisboa Centro de Estudos de Doencas Cronicas, Lisboa, Portugal
Internal Medicine, University of Erlangen-Nuremberg, Erlangen, Germany
Centre for Arthritis and Rheumatic Disease, Dublin Academic Medical Centre, St Vincent’s University Hospital, Dublin, Ireland
Department of Internal Medicine and Pediatrics, VIB Center for Inflammation Research, Ghent University, Gent, Belgium
Rheumatology, Leiden University Medical Center, Leiden, The Netherlands
Division of Rheumatology, Department of Medicine 3, Medical University of Vienna, Vienna, Wien, Austria
2nd Department of Medicine, Hietzing Hospital, Vienna, Wien, Austria
Для связи:
Professor Laure Gossec, Institut Pierre Louis d’Epidémiologie et de Santé Publique, INSERM, Sorbonne Universite, Paris 75013, France; laure.gossec@gmail.com


