Review article: small intestinal bacterial overgrowth – prevalence, clinical features, current and developing diagnostic tests, and treatment (2013)
Авторы
- Grace,
- Nutrition and Dietetics, The Royal Marsden NHS Foundation Trust, London, UK
- Diabetes and Nutritional Sciences Division, King’s College London, London, UK
- Shaw,
- Nutrition and Dietetics, The Royal Marsden NHS Foundation Trust, London, UK
- Whelan,
- Diabetes and Nutritional Sciences Division, King’s College London, London, UK
- J. N. Andreyev
- The GI Unit, Department of Medicine, The Royal Marsden NHS Foundation Trust, London, UK
- Nutrition and Dietetics, The Royal Marsden NHS Foundation Trust, London, UK
Впервые опубликовано: 19 августа 2013 года
Для связи:
Dr H. J. N. Andreyev, The GI Unit, Department of Medicine, The Royal Marsden NHS Foundation Trust, London, UK.
E-mail:
j@andreyev.demon.co.uk
Резюме
Справочная информация
Симптомы и признаки тонкокишечный избыточный бактериальный рост small intestinal bacterial overgrowth (SIBO) часто идентичны для различных заболеваний и может привести к путанице в диагностике.
Цели
Обзор диагностических параметров СИБР и нынешних новых исследовательских подходов для заболевания.
Методы
MEDLINE, EMBASE и Web науки был проведен поиск литературы для английских статей и тезисов. Условия поиска включены, свободный текст слова и комбинации следующих терминов «тонко кишечной бактериальной разрастание» ‘small intestinal bacterial overgrowth’, «тонкого кишечника бактериальной разрастание» small bowel bacterial overgrowth’, «диагностика» diagnostic tests’, «лечение» ‘treatment’, «антибиотики» ‘antibiotics’, «пробиотики» , ‘probiotics’, «метабономический», , ‘metabonomics’ «Протон ЯМР спектроскопии» ‘proton nuclear magnetic resonance spectroscopy’, «электронный анализатор запаха» ‘electronic nose’ и «поле асимметричной ионной подвижности спектрометрии» ‘field asymmetric ion mobility spectrometry’.
Результаты
Все доступные методы для проверки SIBO имеют недостатки, присущие и диагностический тест не существует «золотой стандарт» для заболевания. Точный диагноз SIBO требует идентификации видов бактерий, неправильно растущих в тонкой кишке и симптом ответа на антибиотики. Спектроскопии протонного ядерного магнитного резонанса, электронный анализатор запаха технологии или области асимметричной Ион мобильности спектрометрии может представлять лучшие возможности изучения этого состояния.
Выводы
Оригинальные диагностические подходы, необходимые для дополнения или замены доступные тесты.
Введение
В здорового человека-хозяина есть внутренние механизмы, определяющие количество и состав микробиоты в различных регионах желудочно-кишечного тракта (ЖКТ). Желудочной кислоты разрушает многие бактерии, прежде чем они покинут желудка. Одновременно в тонком кишечнике, желчных и поджелудочной железы секреции ограничить рост бактерий; антеградная перистальтики в тонкой кишке снижает потенциал роста в просвете кишечника; слой кишечной слизи является ловушкой бактерий и илеоцекальный клапан препятствует ретроградная транслокации бактерий из толстой кишки в подвздошные кишки. Клинические условия, связанные с избыточным бактериальным ростом в тонком кишечнике (SIBO) приведены в таблице
1.
Таблица 1. Распространенность избыточного бактериальной роста в тонкой кишке в здоровой популяции и при заболеваниях
| |
Распространенность СИБО (ссылки) |
| Нормальный населения |
| Здоровое исследованию контрольная группа |
0 – 20% |
[4-12] |
| Нарушение моторики/ повреждение стенки кишечника |
| Целиакия |
9 – 67% |
[13-15] |
| Заболевания соединительной ткани, например, склеродермия |
43-55% |
[16, 17] |
| Болезнь Крона |
25-88% |
[18-20] |
| Сахарный диабет |
8 – 44% |
[10, 21] |
| Гипотиреоз |
54% |
[22] |
| Неспецифические нарушение моторики |
76% |
[23] |
| Радиационня энтеропатия |
26% |
[24] |
| Язвенный колит |
81% |
[25] |
| Прочее |
| Синдром хронической усталости |
81% |
[20] |
| Хронический панкреатит |
34-92% |
[26, 27] |
| Лекарственно индуцированные ингибирование секреции кислоты |
26 – 75% |
[4, 23, 28] |
| Терминальная стадия почечной недостаточности |
36% |
[29] |
| Фибромиалгия |
93% |
[20] |
| Синдром раздраженного кишечника |
4 – 78% |
[6, 11, 30-33] |
| Синдромы иммунодефицита |
30 – 50% |
[34, 35] |
| Цирроз печени |
17 – 36% |
[36, 37] |
| Ожирение |
17 – 41% |
[5, 38] |
| Парентеральное питание |
70% |
[39] |
| Розацеа |
46% |
[40] |
| Нервно-мышечные заболевания |
| Мышечная дистрофия |
65% |
[41] |
| Болезнь Паркинсона |
54% |
[42] |
| Хирургия |
| Абдоминальная хирургия |
82% |
[43] |
| Двусторонние стволовая ваготомия |
93% |
[44] |
| Резекция желудка |
63-78% |
[45, 46] |
| Илеоцикальный клапан резекция |
32% |
[19] |
| Реконструкция Ру ан Y (после одноствольной или двуствольной стомы) |
86% |
[47] |
Нет консенсуса относительно определения SIBO. В результате его истинной распространенности и отношения с другими клинических расстройств остаются неопределенными. Наиболее часто цитируется определение количественных: 10
5 или более Колониеобразующая единица, КОЕ/мл (colony forming unit, (CFU/mL)) [лат.
colonia — поселение] —
стандартный показатель, указывающий на число бактерий, образующих колонии в 1 мл среды. в мл (кое/мл) бактерий, вырастающих из небольшого кишечных аспирата. Однако, многие пациенты с широкий спектр заболеваний GI и симптомы имеют повышенное количество бактериальных колоний в тонкой кишке, по сравнению с здоровым населением и более старшего возраста также коррелирует с ростом количества малых кишечника строгий анаэробов, хотя общее бактериальная колоний в целом остаются ниже 10
5 КОЕ/мл.
Некоторые авторы полагают, что наличие верхних дыхательных бактерий в SIBO клинически значимым, но присутствие этих организмов не является четко ассоциируется с аномальные симптомы GI. На сегодняшний день, это только повышенное кишечные разрастание микрофлору, которая обычно колонизировать толстой кишки (преимущественно грамотрицательных, строгих анаэробов и энтерококк), четко связанный с патологического состояния, характеризующиеся аномальные симптомы GI. Если эти бактерии будут ликвидированы антибиотиком, то симптомы уходят.
Существует три общих подхода к диагностике состояния: во-первых, традиционный подход классификации в количественном выражении в условиях микробиологической; Во-вторых, дыхание тестирования с использованием углеводородов (глюкозу и лактулозой); Третья использует симптоматической ответ на пробу антибиотиков. Для более надежного подхода часто комбинируются два или три из этих методов.
Поиск литературы
Был проведен поиск литературы с использованием баз данных MEDLINE, EMBASE и Web науки. Поиск не был ограничен Дата, но был ограничен тезисов и статей, опубликованных на английском языке. Условия поиска включены, свободный текст слова и комбинации следующих терминов «маленький кишечной бактериальной разрастание», «тонкого кишечника бактериальной разрастание», «диагностика», «лечение», «антибиотики», «пробиотики», «метабономический», «Протон ЯМР спектроскопии», «электронный анализатор» и «поле асимметричной ионной подвижности спектрометрии» ‘small intestinal bacterial overgrowth’, ‘small bowel bacterial overgrowth’, ‘diagnostic tests’, ‘treatment’, ‘antibiotics’, ‘probiotics’, ‘metabonomics’, ‘proton nuclear magnetic resonance spectroscopy’.‘electronic nose’ and ‘field asymmetric ion mobility spectrometry’.
Клинические особенности течения SIBO
Пациенты с SIBO может быть клинически бессимптомно или имеют симптомы, которые соответствуют диагностические критерии синдрома раздраженного кишечника (СРК). Есть несколько исследований, которые были сосредоточены на определении преобладающего клинических симптомов у больных с SIBO. Те, которые имеют, показывают, что наиболее распространенным симптомом, вызванные SIBO диареи, а затем боли в животе и затем вздутие живота (таблица
2).
Таблица 2. Исследования, которые выявлены симптомы, связанные бактериальной разрастание в тонкой кишке.
| Ссылка |
Исследовательская и пациентов группа |
Размер выборки |
Тесты для SIBO |
GI симптомы оцениваемые |
У больных с положительный тест на SIBO |
| Количество |
% Пациентов с симптомами |
Значение Pb |
- GI, желудочно-кишечного тракта; G-O, гастро пищевода; IBS, синдром раздраженного кишечника; PPI, ингибиторы протонного насоса; N/A, не применяется; СИБО, малые кишечной бактериальной разрастание.
- a
Целиакия с стойкими симптомами, несмотря на приверженность больных безглютеновой диеты для > 6 месяцев.
- b
Значение P ссылается на значение симптомов у больных с положительный тест для SIBO против тех, кто имеет отрицательный тест. |
| [28] |
Случае серия, G-O рефлюкс на PPIs |
n = 42 |
Глюкозо водородный дыхательный тест |
n = 7 |
n = 11 |
Вздутие живота (59%) |
< 0,001 |
|
|
|
|
|
|
Диарея (50%) |
< 0,001 |
|
|
|
|
|
|
Метеоризм (55%) |
< 0,001 |
|
|
|
|
|
|
Боль (50%) |
< 0,001 |
| [4] |
Проспективные, G-O рефлюкс на больных PPIs и IBS |
n = 450 |
Глюкозоводородный дыхательный тест |
n = 5 |
n = 152 |
Вздутие живота (50%) |
N/A |
|
|
|
|
|
|
Запор (10%) |
N/A |
|
|
|
|
|
|
Диарея (30%) |
N/A |
|
|
|
|
|
|
Боль (10%) |
N/A |
| [58] |
Случаи, пожилых |
n = 5 |
14C-Гликохолевая кислота выдох |
Не описаны |
n = 5 |
Диарея (60%) |
N/A |
|
|
|
|
|
|
Потеря веса (100%) |
N/A |
| [59] |
Случаи, дети |
n = 9 |
Проверка на выдох лактулоза аспирата и культуры |
Не описаны |
n = 9 |
Диарея (89%) |
N/A |
|
|
|
|
|
|
Боль (11%) |
N/A |
| [16] |
Серия случаев, системной склеродермии |
n = 51 |
Дыхание метана водород глюкометра |
n = 11 |
n = 22 |
Вздутие живота (86%) |
< 0,001 |
|
|
|
|
|
|
Запор (77%) |
0.02 |
|
|
|
|
|
|
Диарея (59%) |
< 0,001 |
|
|
|
|
|
|
Лихорадка (18%) |
0,03 |
|
|
|
|
|
|
Боль (50%) |
0.003 |
|
|
|
|
|
|
Нежность (55%) |
0.003 |
| [60] |
Серия случаев, гастропареза |
n = 740 |
Лактулоза выдох |
n = 20 |
n = 79 |
Вздутие живота (13%) |
N/A |
|
|
|
|
|
|
Запор (13%) |
N/A |
|
|
|
|
|
|
Диарея (13%) |
N/A |
|
|
|
|
|
|
Тошнота (27%) |
N/A |
|
|
|
|
|
|
Боль (20%) |
N/A |
| [19] |
Серия случаев, болезнь Крона |
n = 150 |
Глюкометра водорода дыхание |
n = 1 |
n = 38 |
Частый стул> 6/день (29%) |
0,012 |
| [30] |
Проспективные, IBS |
n = 202 |
Лактулоза выдох |
n = 8 |
n = 157 |
Диарея (37%) |
N/A |
|
|
|
|
|
|
Боль (47%) |
N/A |
| [61] |
Ретроспективно, смешанные пациентов |
n = 675 |
Аспирационная и культура |
n = 6 |
n = 54 |
Стеаторея (11%) |
N/A |
| [15] |
Проспективное, Целиакия |
n = 15 |
Лактулоза выдох |
n = 4 |
n = 10 |
Застой желудка (20%) |
N/A |
|
|
|
|
|
|
Диарея (30%) |
N/A |
|
|
|
|
|
|
Боль (50%) |
N/A |
Хотя многие другие симптомы были описаны при SIBO, значимость этих симптомов трудно, учитывать, что большинство исследований не использовали валидные вопросники симптомов. Кроме того, некоторые исследования описывают пациенты с одним из симптомов, где другие описывают больных до 20 ненормальные симптомы. Были также определены другие особенности SIBO, а именно признаки питательных мальабсорбции: потеря веса, жирорастворимый витамин дефицит и недостатки витамина B12, железа, сыворотке крови желчных кислот и красных клеток крови фолиевой кислоты.
Потеря веса
Потеря веса в результате SIBO были описаны. Мальабсорбции жиров, белков и углеводов может привести к сокращению доступности питательных веществ для массы и последующего похудения. Стеаторея (жира мальабсорбции) может быть результатом SIBO и главным образом из-за бактериальной Деконъюгация желчных кислот и последующего дефицит внутрипросветная конъюгированных желчных кислот. Было постулировано, что в SIBO, Микробиота отвечают за дезаминирования пищевых белков в просвете желудочно-Кишечного тракта. Как следствие есть утечка диетических азота в формировании мочевины, в результате, что она становится недоступной для анаболизма белка для массы человека.
Всасывания углеводов может быть результатом SIBO за счет снижения disaccharidase функции и увеличение внутрипросветная углеводов деградации бактериями. Это макро мальабсорбции, в сочетании с хронической GI симптомы, которые часто включают вздутие живота, спазмы и диарею, может привести к сокращению рациона вторичных связанных с болезнь анорексия и последующего похудения.
Жирорастворимых витаминов
С дефицитом витамина D остеомаляция или гипокальциемия может произойти и остеопороз является признанным осложнением SIBO. Сообщалось снижение у пациентов с SIBO, чем в популяции минеральной плотности костной ткани в бедренной кости шеи и поясничного отдела позвоночника.
Сообщалось о синдроме дефицита витамина Е (нейропатии, аномалии Т-клеток) при SIBO и один доклад о ночной слепоте, вызванные дефицитом витамина А вторичные к SIBO. Уровни витамина K, однако, обычно являются нормальной или повышены в контексте SIBO результате бактериальный синтез менахинон (Витамин K2).
Дефицит железа и витамина B12
Мегалобластическая, макроцитарная анемия может появиться в SIBO и из-за дефицита витамина B12 (кобаламин). Полинейропатия в результате дефицита витамина B12 также была описана и обьясняется значительным снижением абсорбции обоих как как свободного, так и внутреннего связанного фактора витамина B12. Показано, что факультативное грамотрицательных аэробов и анаэробов быть конкурентоспособным использовании витамина B12.
Железодефицитная анемия может иметь место при SIBO. Хотя точный механизм не известно, это скорее всего из-за травмы слизистой оболочки, вызванных бактериальными токсинами, короткими цепочками жирных кислот и/или неконъюгированной желчных кислот. Такие повреждения могут тормозить всасывание железа.
Изменение иммунологических параметров
Иммунная система играет роль в высокой распространенности SIBO у пациентов, которые имеют иммунодефицит. Иммуноциты двенадцатиперстной кишки и тощей кишки иммуноглобулина A было показано, значительно возросла в слизистой оболочке больных SIBO.
Тонкокишечные бактериальной разрастание и IBS
Во многих условиях это может быть трудно оценить ли SIBO является причиной для GI симптомы или мальабсорбция или ли они происходят вследствие основного заболевания и SIBO является только эпифеномен. В этой связи SIBO как этиологический или как сторонний фактор в IBS получила наибольшее внимание. Существует определенное дублирование между симптомами, которые определяют IBS и те, которые являются типичными SIBO (например, боли в животе, вздутие живота, метеоризм, диарея или запор).
Систематический обзор и мета анализ исследований, исследования частота SIBO в IBS обнаружил, что распространенность SIBO в случаях, отвечающим диагностические критерии для IBS была от 4% до 64%. Различия в частоте распространенности зависит от типа теста используется и критерии, используемые для определения положительный результат теста. В 12 анализированных исследованиях было обнаружено от три до пятикратного увеличения вероятность положительного результата тестирования лиц с IBS. Однако это не достигали статистической значимости, когда были использованы критерии, которые дал низкая распространенность положительный тест. Кроме того, было показано быть значительная неоднородность между исследованиями, небольшое исследование эффектов и систематической ошибки публикации, ведущих к вероятно завышенной оценке распространенности положительный тест для SIBO. Авторы пришли к выводу, что нет достаточных доказательств для обоснования обычные исключения SIBO у людей с IBS. Это вновь подтверждает выводы предыдущих доклада консенсуса Рима.
Еще недавно систематический обзор и мета анализ исследований случай контроль у больных IBS с ненормальное дыхание испытаний, авторы пришли к иному выводу – «этот мета анализ показывает, что тест дыхание действительный и важным катализатором в развитии бактериальные гипотезы для IBS». Вес их аргумент (отношение шансов 9,64 для испытания ненормальное дыхание в IBS против контроля) был основан на трех исследований, которые использованы элементы управления соответствием возраста и пола. Однако два из этих исследований используются педиатрической предметов. Кроме того, было продемонстрировано значительное между исследование гетерогенности и там был большой дисбаланс между размером случаев и контрольными группами в обзор исследованиях.
Продолжение споры вокруг последствия SIBO в патогенезе IBS из-за отсутствия уверенности в проверке дыхание тестирования. Это будет оставаться проблемой, пока не достигнут надежный определений того, что представляет значимой для SIBO. Это не произойдет до тех пор, пока не будут определены объективные диагностические критерии.
Диагностические трудности в SIBO
Традиционно многие авторы рассматривали прямую аспирацию и культуры содержимого двенадцатиперстной кишки как «золотой стандарт» подхода для диагностики SIBO. Однако применив критерии Рид
и др. для разработки и применения диагностического теста на имеющихся в настоящее время подходы для диагностики SIBO в их систематический обзор Khoshini
и др. пришли к выводу, что не существует диагностический теста золотого стандарт для SIBO. Все часто используемые методы диагностики SIBO имеют присущие ограничения; Клиницисты должны быть осторожны при интерпретации результатов таких испытаний (таблица
3).
Таблица 3. Ограничения, связанные с общими техниками(методиками) диагностики
- H2, водорода; CH4, метана; SIBO, тонко кишечный избыточный бактериальной рост.
|
| Аспирации из тонкого кишечника и посев культуры |
| Инвазивные и громоздкой |
| Длительным и дорогостоящим |
| Технические трудности с транспортом и культуры аспирата |
| Отсутствие консенсуса по пробам и микробиологические методы |
| Надлежащее использование анаэробных методов необходимо |
| Представление образца неизвестна |
| бактерии полости рта могут загрязнить аспират |
| Отсутствие консенсуса для определения в количественном выражении SIBO |
| SIBO, происходящий более дистально в тонком кишечнике могут быть пропущены |
| Ложно отрицательные результаты могут произойти где разрастание вызвана облигатных анаэробов |
| Отбор образца и объём жидкого аспирата может быть переменной |
| Методика контроля дыхания |
| Низким волоконной диеты необходимо за 24 часа до проведения испытания |
| Курение, сон и физических упражнений может повлиять на точность теста |
| Антибиотики и слабительных средств необходимо избегать перед испытанием |
| Отсутствие консенсуса в отношении определения положительный тест (независимо от субстрата используется) |
| Частота дискретизации дыхание очень переменной |
| Оба газа H2 и CH4 следует измерять |
| Просветная рН влияет на метаболизм углеводов |
| Нарушение всасывания углеводов может привести к ложно положительным результатам |
| Учет бактерий ротоглотки |
| Время быстрого транзита может дать ложно положительных результатов |
| Задержка транзита желудка опорожнение/медленно может дать ложно отрицательные результаты |
| Несоответствия в определении «ранний пик» при тестировании дыхание лактулоза |
| Терапевтический исследовательские подходы |
| Решений может быть затруднено |
| Не стандартизированный подход к типу, дозы или продолжительности схемы антибиотикотерапии |
| Отсутствие консенсуса по смыслу клинической реакции на антибиотики |
| Чрезмерно прописывания антибиотиков |
| Риск серьезных побочных эффектов от лечения антибиотиками |
| Трудности в выявлении пациентов без SIBO против тех с SIBO, вызванные организма устойчивых к антибиотикам |
С точки зрения количественной оценки микробиологического компонента, является отсутствие ясности о отсечки, определяющие позитивность культуры и технические трудности, связанные с транспортировкой и культивирования аспирата. Подходы, основанные на аспирации, также страдают от инвазивных, дорогостоящих и потенциально рискованным для пациента. Кроме того, микробиоты, по сравнению с геномными методами культивирования выявляют лишь часть (примерно 20%).
В последние годы, в противовес прямой аспирации и техник культивирования, косвенные тесты были разработаны и в настоящее время часто используются альтернативно. Дыхание тесты имеют преимущества перед метода прямого культивирования, в том, что они являются простыми в использовании, дешевые и неинвазивные. Однако нет специальных дыхательных тестов для диагностики SIBO. Тесты на основе водорода дыхание в настоящее время являются наиболее популярных и основываются на предположении что единственным источником водорода (H
2) производство в организме является от ферментации углеводов, GI микробиоты.
Наиболее часто используемых субстратов в дыхание тесты являются глюкозы и лактулозой, которая, имеет более диагностическая точность чем последний. По сравнению с методом прямого аспирации, глюкоза H
2 выдох имеет чувствительность 62,5% и специфичность 81,7%. Для этого испытания, он считается положительным, если существует четко узнаваемых H
2 пик, превышающий 10 – 20 частей на миллион. Лактулоза H
2 выдох имеет чувствительность 52,4% и специфичность 85,7% по сравнению с методом прямого аспирации.
Исходное определение позитивных лактулоза H
2 выдох в выявлении SIBO был впоследствии пересмотрен, с тем чтобы свести к минимуму ложно положительных результатов. Изменение критериев положительный тест являются следующие: увеличение дыхание H
2 из > 10 частей на миллион (в результате небольших кишечной бактериальной ферментации) выше базальной что происходит > 15 мин до продолжительного пик (получаемой от ферментации толстой кишки ) и также в течение 20 мин приема пищи лактулозой.
Однако 8 – 27% из людей не имеют обнаружению H
2 производство от их GI микробиоты, но вместо этого производства метана (CH
4) газ. К примеру
золотистый стафилококк,
стрептококк зеленящие, энтерококки, Serratia и Pseudomonas видов не производят H
2. Поэтому если H
2 анализируется в изоляции, тест может пропустить разрастание-H
2-производство бактерий, ведущих к ложноотрицательным результатам.
Опять же есть отсутствие консенсуса, как определять аномальные выдох. Не существует ни соглашение по оптимальной продолжительности испытаний, дыхание, ни на уровнях проведения, которые определяют положительный результат. В конечном счете есть теоретические и практические проблемы, лежащие в основе использование дыхание тестов, которые ограничивают их потенциал для существенного улучшения диагностики SIBO.
Третий подход для диагностики SIBO это лечение, когда симптомы или неинвазивная суррогатных маркеров клинически предполагающие SIBO (таблица
4) и использовать клинической реакции на антибиотики как подтверждение SIBO причиной жалоб пациента – так называемые ‘therapeutic trial’ «пробная терапевтическая терапия». В связи с проблемами, связанными с культурой и дыхание методы тестирования, неудивительно, что Khoshini
и др. нашли что почти одна треть исследований используется пробную терапию для диагностических целей. Не существует, однако, стандартизированный подход к типу, дозам или продолжительности антибиотиков и частота сообщаемые клинические отчеты колеблются от 35% до 100%.
Таблица 4. Неинвазивная суррогатных маркеров избыточного бактериального роста в тонком кишечнике
| Ссылка |
Группе пациентов |
Размер выборки |
Маркер |
Данные в пользу маркер |
Данные не пользу маркер |
- HB, гемоглобина; g/dL, грамм на децилитр; GI, желудочно-кишечного тракта; NASH, неалкогольный стеатогепатит; SIBO, тонкокишечной бактериальной разрастание.
- Hb, haemoglobin; g/dL, grams per decilitre; GI, gastrointestinal; NASH, non-alcoholic steatohepatitis; SIBO, small intestinal bacterial overgrowth.
|
| [16] |
Больных системной склеродермии |
n = 51 |
HB |
Пациентов с SIBO был значительно ниже медианный уровень Hb (12,25 против 13,9 г/дл), P = 0,002 |
– |
| [16] |
Больных системной склеродермии |
n = 51 |
Витамин B12 |
– |
Нет значение разницы между больных с и без SIBO, P = 0.133 |
| [82] |
NASH |
n = 45 |
Кишечную проходимость |
– |
Никакого существенного различия между кишечную проницаемость NASH пациентов с SIBO, по сравнению с теми у которых ее нет, измеряемой лактулоза рамноза lactulose-rhamnose кишечную проницаемость тест |
| [7] |
У больных с SIBO и группа контроля |
n = 33 |
Фолиевой кислоты в сыворотке крови |
– |
Никакого существенного различия в фолиевой кислоты в сыворотке между двумя группами |
| [47] |
Тотальная гастрэктомия у пациентов |
n = 43 |
HB |
Крови Hb концентрации, как правило, ниже у пациентов с максимальной водорода концентрации в глюкозодыхательном тесте, P = 0,056 |
– |
| [47] |
Тотальная гастрэктомия у пациентов |
n = 43 |
Вес |
В дыхание глюкометра, было отмечено отрицательная корреляция между концентрацией максимальная водорода и прибавка/потеря веса, P = 0,034 |
– |
| [62] |
гипохлоргидрия у пожилых |
n = 17 |
Кишечную проходимость |
– |
Никакого существенного различия между пациентами с SIBO и контрольной группой для проницаемость как измеряется лактулоза и экскреции маннитола |
| [62] |
Гипохлогидрия у пожилых |
n = 17 |
Фолиевой кислоты в сыворотке крови |
– |
Нормальные значения для параметра во всех случаях с SIBO |
| [62] |
Гипохлогидрия у пожилых |
n = 17 |
Витамин B12 |
Два субъекта имели значения ниже нормального диапазона для витамина B12, два субъекта уже получают инъекции витамина B12 |
– |
| [83] |
Пожилые |
n = 16 |
HB |
10 из 16 больных с SIBO имели уровень Hb < 12 г/дл |
– |
| [83] |
Пожилые |
n = 16 |
Витамин B12 |
4 из 16 больных с SIBO были субнормальных витамина B12 в сыворотке |
– |
| [84] |
Пациентов с SIBO и контрольная группа здоровых |
n = 22 |
Неконъюгированной желчных кисло сыворотке концентрацию т |
Девять пациентов с SIBO, 2-часовая постпрандиальной сыворотки выраженной неконъюгированной желчные кислоты концентрации были подняты в n = 7 |
– |
| [85] |
Пациент с «застойные петля»‘stagnant loop’ |
n = 1 |
концентрацию Неконъюгированной желчных кислот сыворотке |
Пациенты явно повышенный неконъюгированной желчные кислоты в сыворотке в течение дня |
– |
| [86] |
Пациентам с заболеваниями GI |
n = 35 |
Витамин B12 |
– |
Не значение разница в уровнях витамина B12 больных с и без SIBO |
Пробное лечение может также использоваться совместно с другими диагностические тесты, т.е. все из следующих может приниматься во внимание, с тем чтобы подтвердить наличие SIBO: аномальные симптомы/неинвазивные суррогатных маркеров GI, Аномальные тестов (например, выдох и/или аспирата и культуры) и клинической реакции на антибиотики. Измерения реакции требует оценки изменения симптомов систематически, а также анализ аномальных параметров, таких как низкая сыворотке витамина В12 или повышение веса.
Как SIBO часто является проявлением других GI расстройств, пока не существует типичного пациента. Часто трудно установить уверенно диагноз SIBO у больных с распространенными симптомами GI является отсутствие стандартизированных исследовательских инструмент.
Лечение для SIBO
Основная цель терапии в SIBO должно быть лечение основного заболевания или структурных дефектов, хотя для многих условий, это не может быть достигнуто. Ведение должен включать исправления каких-либо питательных дефицитов, где это присутствует. Это может включать нутритивной поддержки и/или дополнительные жирорастворимые витамины, витамин B12 и минералов. Использование прокинетический агентов могут рассматриваться для пациентов с гастропареза или кишечных лисмоторики. Однако еще не доказана эффективность этих агентов.
Лечение для SIBO стремится изменить GI микробиоты, обычно с помощью антибиотиков, таким образом, что приведет к симптоматическому улучшению. Из-за ограничений, связанных с качественной и количественной бактериологического исследования и потому, что загрязняющие бактериальных популяций являются довольно многочисленными, выбор антибиотика остается главным образом эмпирической. Эффективное лечение обычно включает в себя один или более препаратов с активностью в отношении аэробных и анаэробных энтеробактерий.
Много различных схем антибиотикотерапии выступали для использования в SIBO, включая ципрофлоксацин, метронидазол, неомицин, Норфлоксацин и доксициклина. Не существует консенсуса по наиболее эффективной дозы или продолжительности лечения. В одном исследовании 70% больных с SIBO показал хороший ответ к ципрофлоксацину, во время режима амоксициллин – клавулановой кислоты и Цефокситин искоренена более чем 90% штаммов, выделенных от SIBO пациентов.
Имеется растущий интерес к использованию rifaximin (аналог рифамицин не всасывается) в управлении SIBO, особенно у больных с IBS ИБС. Систематический обзор продемонстрировал эффективность и краткосрочных безопасность rifaximin для больных IBS.] Хотя точные механизмы, которые rifaximin улучшает симптомы IBS остаются неполно определенными, rifaximin улучшает симптомы у больных IBS, вероятно, по крайней мере частично, из-за изменения количества, местонахождения и/или качество микробиоты GI хозяина.
Систематический обзор использования rifaximin в больных, тестирование позитивные для SIBO еще не опубликованы. Хотя опубликованные данные о его использовании в этот параметр направлены на благо препарата в глобальном улучшении симптомов, связанных с SIBO, дальнейшие доказательства в пользу rifaximin необходимо быть раскрыты.
Учитывая высокую распространенность первичного и приобретенных бактериальной резистентности, стоимость лечения, скорее всего, эффект плацебо и возможных побочных эффектах лечения решения по лечению антибиотикам должно быть приспособлено к индивидууму как можно ближе.
Пробиотики – это еще один потенциальный лечения SIBO; Однако есть только экспериментальные исследования, касающиеся их использования. Одно открытое, пилотного экспериментального исследования оценить эффект
Lactobacillus casei Широта на пациентов, СИБО, где SIBO была продемонстрирована ранним увеличение дыхание H
2 после лактулозы. После 6-недельный вмешательства (65 миллиардов бактерий/день), 64% больных уже не было положительных дыхание теста, но не было никакого существенного улучшения абдоминальными симптомы.
В другом экспериментального исследования пациентов были рандомизированы для получать либо пробиотик или метронидазол лечения SIBO. Пробиотик содержится
Lactobacillus casei,
Lactobacillus plantarum,
Streptococcus faecalis и
бифидобактерии brevis. Статистически значимой разницы в симптоматической ответ выступали за использование пробиотик над антибиотиком (
P = 0,036). Пробиотики могут иметь положительный эффект в этой обстановке, но двойное слепое, рандомизированное, плацебо контролируемые испытания необходимо продемонстрировать их дозы эффекты и клинической значимости.
Потенциал для новых диагностических тестов для SIBO
Изменения или дисбиоза микробиоты GI в SIBO трудно характеризовать в клинической практике. Хотя достижения в области геномной технологии позволяют филогенетический анализ и введя в параметре исследований, такие методы трудоемким, дорогие и не подходит для рутинных клинических приложений. Более доступные средства получения знаний о дисбактериоз, связанные с SIBO включают метаболические профили биожидкостей с использованием метабономический технологии, использование электронный нос или поле асимметричной ионной подвижности спектрометрии (FAIMS) для определения летучих органических соединений (volatile organic compounds (VOCs)) из газов просветленного происхождения.
Метабономика с использованием спектроскопии протонного ядерного магнитного резонанса
Характеристика содержания микробов кишечника — это концепция, которая может оказаться полезной в определении нового метода диагностики для SIBO. Микробиота GI совместно эволюционировали с людьми и метабономический технологии, когда на основе протонного ядерного магнитного резонанса (
1H-NMR) спектроскопия, могут использовать этот коэволюции. Он имеет потенциал для выявления биомаркеров и прогностические факторы и поэтому могли бы повысить клинический диагноз SIBO. Каждая субьект имеет свои собственные метаболически отпечатки, что изменяется в ответ на болезни, экологические или генетических возмущений. Эта концепция может применяться к СИБО, путем оценки и сравнения метаболических отпечатки субъектов здорового и больного.
Спектроскопии протонного ядерного магнитного резонанса основан на применении радиочастотных импульсов ядерной источника помещены в магнитном поле и наблюдая за ответ после продолжительности импульса. Параллельное применение других аналитических платформ, например, газовая хроматография масс-спектрометрии позволяет всеобъемлющее исследование метаболом (количественные дополнения всех молекул низкомолекулярного присутствует в биологическом образце) (рис.
1).
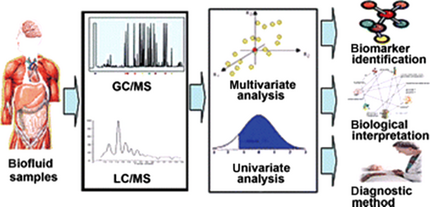 Рисунок 1.
Рисунок 1.
Масса спектрометрии на основе метабономический. ГХ/МС, газовая хроматография массового спектрометрирования; LC/MS, массовым спектрометрированием жидкостной хроматографии.
Mass spectrometry-based metabonomics. GC/MS, gas chromatography mass spectrometry; LC/MS, liquid chromatography mass spectrometry.
Это обеспечивает надежный, эффективный, воспроизводимые и сравнительно недорогие подход для высокопроизводительного метаболического скрининга биожидкостей крови, мочи, тонко кишечной жидкости и фекальные воды. Объединив
1H-NMR спектроскопия с методологии многомерного анализа, существует все больше доказательств предположить, что метаболические профиль биожидкостей указывает на группировку отдельных компонентов у больных людей.
В исследование метабономический содержание аспираты из верхнего отдела тонкой кишки у больных с синдромом мальабсорбции, у тех с синдромом имелось значительно выше средний количества желчных кислот/холестерин, ацетат, лактат и формате чем в контроле. У тех с синдромом мальабсорбции и SIBO, значительно большее количество ацетат, лактат, формиат и неконъюгированной желчных кислот были найдены по сравнению с контролем (
P <0.01 для всех), подразумевая, что SIBO сам может выявить конкретные, потенциально диагностические metabonomic подписи.
В другом исследовании с помощью фекальных пробах пациентов с воспалительным заболеванием кишечника inflammatory bowel disease (IBD) (
n = 10 крона болезни, Crohn’s disease CD и
n = 10 язвенный колит, ulcerative colitis UC) и здорового контроля (
n = 13), метабономический подход был использован для помощи с диагнозом. Исследователи сообщили, что фекальных проб, полученных от больных с CD и UC проявляется подобные глобальные различия в метаболические профили, по сравнению с здоровых испытуемых. Обеднение короткими цепочками жирных кислот, в том числе ацетат и бутират, была характерной чертой CD пациентов по сравнению с здоровых испытуемых. Кроме того, высокая концентрация глицерин был найден в фекалиях больных CD по сравнению с UC пациентов. Более высокие концентрации аминокислот также были обнаружены в фекалиях больных с CD и UC по сравнению с здорового контроля. Это может быть следствием мальабсорбции, вызванные воспалением.
Хронические воспалительные клетки в lamina propria были зарегистрированы в крыс с SIBO вторичных экспериментальный слепых петли. Кроме того, данные в организме человека указывают, что местные lamina propria антитела клетки плазмы и интраэпителиальных лимфоцитов графов увеличиваются в SIBO. Как было показано, что условие привести в микроскопических воспаление слизистых оболочек, это правдоподобным считают, что общие различия в метаболические профили SIBO пациентов и контроля могут быть найдены. Также, как считается, что дисбактериоз GI микробиоты участвует в IBD, в инициировании его либо в поддержании его, и как SIBO также связано с дисбактериозом, это может быть, что после успешного применения метабономический в IBD, он также окажется в SIBO.
Иногда один маркер молекулы обеспечит адекватные определение болезни. Однако в действительности, большинство человеческих заболеваний полиэтиологичны по происхождению и условно связано с экологических воздействий. Таким образом, это более вероятно, что потребуется несколько маркер молекулы. Исследования показали, что такие собственные факторы, как пол, возраст, циркадные ритмы и внешние факторы, такие как диета, физическая активность, стресс и лекарства можно модулировать metabonomic профилей. Порядок сбора, хранения и подготовки также должны рассматриваться в качестве источников вариации в профилях.
Электронный аэрозольный анализатор и поле асимметричной ион мобильности спектрометрии
Концепция использования обнаружения летучие молекулы в качестве средства для диагностики SIBO не является новой. Газовая хроматография содержимого тощей кишки ранее использовалось для обнаружения и идентификации летучих жирных кислот (короткими цепочками жирных кислот) в результате ферментации органического материала не образующих споры анаэробных микроорганизмов. В одном исследовании, увеличение концентрации жирных кислот, ацетат и пропионат, был показан в содержимое тощей кишки больных с stagnant loop syndrome синдромом приводящей петли.
В другой серии больных полагают, SIBO был проведен полный анализ микробиологической аспиратов тощей кишки. Результаты от этого затем сравнивались с другие методы тестирования, включая газ Хроматографическое определение летучих жирных кислот в аспиратах. Газохроматографическим методом было установлено чувствительность 56% и специфичность в 100%. Факторы объяснить низкая чувствительность этого метода включают преобладание факультативные грамотрицательные над анаэробных бактерий в группе исследования и требуется 12-h быстро предварительно интубации, которое привело бы к отсутствию сбраживаемых субстрат для бактерий.
Газовая хроматография, наряду с масс-спектрометрии до сих пор считается золотым стандартом анализа проб. Эти традиционные подходы представить информацию об отдельные химические компоненты в рамках выборки, в отличие от электронного анализатора, который анализирует образец в целом производить «Химический отпечаток пальца».
Электронный анализатор был впервые разработан в 1980-х как способ копирования биологических обонятельной системы и используется для выявления VOCs от человеческих образцов, например, дыхания, пота, крови, мочи или фекальных проб. VOCs являются важным компонентом метаболом и включают спирты, альдегиды, фуранов, кетоны, пирролов, терпенов и др. Электронный анализатор не пытается измерить одного конкретного соединения, но возможность измерить коллекцию из нескольких молекул маркер. Толстокишечная ферментации создает несколько химических веществ, включая VOCs, которые могут оказаться важными для GI гомеостаза. Электронный анализатор включает массив металла газовых сенсоров, чьи сопротивление модулируется присутствии целевого газа/пара, например, VOCs. Каждый датчик отличается в некотором роде, (обычно широко настроены для химической группы) и поэтому взаимодействие между образцом и каждый датчик является уникальным.
«Химических отпечатков пальцев», производимых этим методом было показано, быть разрозненных групп различных заболеваний вследствие относительного изменения в пропорциях VOCs, выдыхаемыми больными людьми. Исследование фекальных VOCs может быть перспективным способом диагностики SIBO, потому что человека фекальных образцы представляют собой пищевые конечных продуктов, вытекающие из процессов пищеварительной и выделительной и кишечных бактериальных метаболизм. В SIBO наличие анаэробных бактерий в тонкие кишки эффективно приводит к ферментации, происходящих в тонкие кишки в дополнение к толстой кишки, т.е. кишечной бактериальной обмен веществ. Этот обмен веществ имеет потенциал, чтобы быть идентифицированы с помощью метода электронный анализатора.
Электронный анализатор еще не опробован в больных с подозрением SIBO. Это, однако, оказался успешным в диапазоне GI, метаболические и инфекционных заболеваний. A экспериментального исследования определили собственный шаблон VOCs в фекалиях больных с UC,
Clostridium difficile и
Campylobacter jejuni, который наводит на мысль что конкретные изменения происходят в структуре VOCs в GI болезни. в другом исследовании этой группой, анализ VOCs с калом бангладешских пациентов, пострадавших от холеры показал, что меньше VOCs были обнаружены в пробах холеры в отличие от здорового контроля.
Электронный анализатор недавно была объединена с новой технологией, FAIMS. Это техника, которая способна обнаружить VOCs, которые вытекают из биологического материала в режиме реального времени. Он действует путем введения ионизированной пробы (состоящий из ионов различной формы, заряда и размеров) между двумя металлическими пластинами. Асинхронных высоковольтных сигналов применяется между пластинами и создает условия, согласно которому некоторые ионы дрейфа и удар пластины, в то время как другие остаются между пластинами. С помощью различных напряжений, сложная смесь газов могут быть разделены различия в мобильности через пластины (рис.
2).
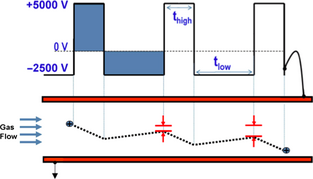 Рисунок 2.
Рисунок 2.
Illustration of the FAIMS effect (parallel plate example), showing ion drift. V, volts;
t, time. Source: Thermo Fisher Scientific, 2013.
Иллюстрация FAIMS эффекта (например, параллельные пластины), показаны Ионный дрейф. Вольт;
t, время. Источник:, Thermo Fisher Scientific 2013.
Экспериментальное исследование используется электронный анализатор и FAIMS технологии вместе для исследования, если они могут выявить различия в фекальные газы между пациентами, у которых развивается высокой токсичности и низкой токсичности при тазовой радиотерапии. Фекальных пробах 23 больных были проанализированы (11 в группе низкой токсичности) и 12 в группе высокой токсичности. Анализ компонентов принцип был применен к данных электронный анализатора и Фишер дискриминантного анализа данных FAIMS. Это показало, что, возможно, было невозможно разделить пациентов после лечения по их уровни токсичности. Однако явные различия в двух группах были также выявлены в их предварительные обработки образцов, предполагая, что выраженность побочных эффектов может быть предсказано.
Сочетание электронный анализатора и FAIMS технологий были использованы для тестирования их потенциальную полезность в дифференциации IBD объектов и контроль с помощью мочи. Во-вторых, методы способность различать между активной IBD, по сравнению с теми в клинической ремиссии оценивали. Из 62 взрослых включены, были три группы: 24 пациентов с UC, 24 с 14 элементов управления и CD. Первые две группы были разделены в тех с рецидивом или в стадии ремиссии.
Когда электронный анализатор образцы были проанализированы с использованием функции дискриминантного анализа, существует четкое разделение групп. Классификации чисто по группам заболеваний или управления привели к точности до 88%. Это различие было подтверждено, повторив анализ с помощью FAIMS технологии, которая дала точность превышает 75% (
P <0,001) по сравнению с случайных классификации. Результаты также показали, что существует фундаментальное различие в VOCs, излучаемый мочи между группами в стадии ремиссии и тех, кто с рецидивом.
Как при тазовой радиотерапии и IBD пациентов, это правдоподобным думать, что явные различия в структурах VOC будет наблюдаться между SIBO больных и здоровых контролем. Возможность использования электронных анализаторов для обнаружения SIBO особенно привлекателен из-за его неинвазивный характер, его переносимости и потенциал, чтобы использовать эту технологию в амбулаторных условиях. Он может эксплуатироваться при комнатной температуре и давлении. Это дешевые, менее длительным и сложным, чем газовой хроматографии с масс-спектрометрии. Многие из преимуществ электронный анализатора также применимы к FAIMS и объединения двух инструментов может оказаться мощный метод для будущего развития диагностический инструмент для SIBO.
Заключение
Избыточный бактериальной рост в тонком кишечнике является значительный клиническая проблема, которая трудно диагностировать точно и для которых не определены оптимальный терапевтический параметры. Концепция определения оригинальные биомаркеров в биожидкостях или VOCs от биологических образцов для помощи с диагнозом SIBO является привлекательным. Преимущества этих методов многообразны: быстрое, неинвазивная и требующих минимальной преданализной пробоподготовки. Конечно является одним из основных препятствий в обоих случаях – отсутствие «золотой стандарт» диагностический тест для SIBO. Это усложняет интерпретации данных.
Для проверки возможной полезности любого из этих методов при SIBO, диагноз потребует использования тщательно определенных групп пациентов. Должен быть потенциал для определения весьма деликатного и конкретных тест, который может революционизировать диагноз и, следовательно, ведение, SIBO. Кроме того, методы, описанные может идентифицировать оригинальные биомаркеров, потенциально позволяя пациента стратификации для облегчения более персонализированный подход к подбору лечения антибиотиками для индивидуума. Таким образом это уменьшило повреждение симбиотические микробиоты GI, вызванных назначением ненужных антибиотиков.
Эти техники предназначены для обнаружения всех биохимических метаболитов, присутствующих одновременно в одном измерении, вполне вероятно, что один или больше покажут свое превосходство в имеющихся в настоящее время методы диагностики для SIBO. Доказательства этой гипотезы могут открыть новые возможности в гастроэнтерологии практики и исследований.

 Рисунок 1.
Масса спектрометрии на основе метабономический. ГХ/МС, газовая хроматография массового спектрометрирования; LC/MS, массовым спектрометрированием жидкостной хроматографии.
Mass spectrometry-based metabonomics. GC/MS, gas chromatography mass spectrometry; LC/MS, liquid chromatography mass spectrometry.
Это обеспечивает надежный, эффективный, воспроизводимые и сравнительно недорогие подход для высокопроизводительного метаболического скрининга биожидкостей крови, мочи, тонко кишечной жидкости и фекальные воды. Объединив 1H-NMR спектроскопия с методологии многомерного анализа, существует все больше доказательств предположить, что метаболические профиль биожидкостей указывает на группировку отдельных компонентов у больных людей.
В исследование метабономический содержание аспираты из верхнего отдела тонкой кишки у больных с синдромом мальабсорбции, у тех с синдромом имелось значительно выше средний количества желчных кислот/холестерин, ацетат, лактат и формате чем в контроле. У тех с синдромом мальабсорбции и SIBO, значительно большее количество ацетат, лактат, формиат и неконъюгированной желчных кислот были найдены по сравнению с контролем (P <0.01 для всех), подразумевая, что SIBO сам может выявить конкретные, потенциально диагностические metabonomic подписи.
В другом исследовании с помощью фекальных пробах пациентов с воспалительным заболеванием кишечника inflammatory bowel disease (IBD) (n = 10 крона болезни, Crohn’s disease CD и n = 10 язвенный колит, ulcerative colitis UC) и здорового контроля (n = 13), метабономический подход был использован для помощи с диагнозом. Исследователи сообщили, что фекальных проб, полученных от больных с CD и UC проявляется подобные глобальные различия в метаболические профили, по сравнению с здоровых испытуемых. Обеднение короткими цепочками жирных кислот, в том числе ацетат и бутират, была характерной чертой CD пациентов по сравнению с здоровых испытуемых. Кроме того, высокая концентрация глицерин был найден в фекалиях больных CD по сравнению с UC пациентов. Более высокие концентрации аминокислот также были обнаружены в фекалиях больных с CD и UC по сравнению с здорового контроля. Это может быть следствием мальабсорбции, вызванные воспалением.
Хронические воспалительные клетки в lamina propria были зарегистрированы в крыс с SIBO вторичных экспериментальный слепых петли. Кроме того, данные в организме человека указывают, что местные lamina propria антитела клетки плазмы и интраэпителиальных лимфоцитов графов увеличиваются в SIBO. Как было показано, что условие привести в микроскопических воспаление слизистых оболочек, это правдоподобным считают, что общие различия в метаболические профили SIBO пациентов и контроля могут быть найдены. Также, как считается, что дисбактериоз GI микробиоты участвует в IBD, в инициировании его либо в поддержании его, и как SIBO также связано с дисбактериозом, это может быть, что после успешного применения метабономический в IBD, он также окажется в SIBO.
Иногда один маркер молекулы обеспечит адекватные определение болезни. Однако в действительности, большинство человеческих заболеваний полиэтиологичны по происхождению и условно связано с экологических воздействий. Таким образом, это более вероятно, что потребуется несколько маркер молекулы. Исследования показали, что такие собственные факторы, как пол, возраст, циркадные ритмы и внешние факторы, такие как диета, физическая активность, стресс и лекарства можно модулировать metabonomic профилей. Порядок сбора, хранения и подготовки также должны рассматриваться в качестве источников вариации в профилях.
Электронный аэрозольный анализатор и поле асимметричной ион мобильности спектрометрии
Концепция использования обнаружения летучие молекулы в качестве средства для диагностики SIBO не является новой. Газовая хроматография содержимого тощей кишки ранее использовалось для обнаружения и идентификации летучих жирных кислот (короткими цепочками жирных кислот) в результате ферментации органического материала не образующих споры анаэробных микроорганизмов. В одном исследовании, увеличение концентрации жирных кислот, ацетат и пропионат, был показан в содержимое тощей кишки больных с stagnant loop syndrome синдромом приводящей петли.
В другой серии больных полагают, SIBO был проведен полный анализ микробиологической аспиратов тощей кишки. Результаты от этого затем сравнивались с другие методы тестирования, включая газ Хроматографическое определение летучих жирных кислот в аспиратах. Газохроматографическим методом было установлено чувствительность 56% и специфичность в 100%. Факторы объяснить низкая чувствительность этого метода включают преобладание факультативные грамотрицательные над анаэробных бактерий в группе исследования и требуется 12-h быстро предварительно интубации, которое привело бы к отсутствию сбраживаемых субстрат для бактерий.
Газовая хроматография, наряду с масс-спектрометрии до сих пор считается золотым стандартом анализа проб. Эти традиционные подходы представить информацию об отдельные химические компоненты в рамках выборки, в отличие от электронного анализатора, который анализирует образец в целом производить «Химический отпечаток пальца».
Электронный анализатор был впервые разработан в 1980-х как способ копирования биологических обонятельной системы и используется для выявления VOCs от человеческих образцов, например, дыхания, пота, крови, мочи или фекальных проб. VOCs являются важным компонентом метаболом и включают спирты, альдегиды, фуранов, кетоны, пирролов, терпенов и др. Электронный анализатор не пытается измерить одного конкретного соединения, но возможность измерить коллекцию из нескольких молекул маркер. Толстокишечная ферментации создает несколько химических веществ, включая VOCs, которые могут оказаться важными для GI гомеостаза. Электронный анализатор включает массив металла газовых сенсоров, чьи сопротивление модулируется присутствии целевого газа/пара, например, VOCs. Каждый датчик отличается в некотором роде, (обычно широко настроены для химической группы) и поэтому взаимодействие между образцом и каждый датчик является уникальным.
«Химических отпечатков пальцев», производимых этим методом было показано, быть разрозненных групп различных заболеваний вследствие относительного изменения в пропорциях VOCs, выдыхаемыми больными людьми. Исследование фекальных VOCs может быть перспективным способом диагностики SIBO, потому что человека фекальных образцы представляют собой пищевые конечных продуктов, вытекающие из процессов пищеварительной и выделительной и кишечных бактериальных метаболизм. В SIBO наличие анаэробных бактерий в тонкие кишки эффективно приводит к ферментации, происходящих в тонкие кишки в дополнение к толстой кишки, т.е. кишечной бактериальной обмен веществ. Этот обмен веществ имеет потенциал, чтобы быть идентифицированы с помощью метода электронный анализатора.
Электронный анализатор еще не опробован в больных с подозрением SIBO. Это, однако, оказался успешным в диапазоне GI, метаболические и инфекционных заболеваний. A экспериментального исследования определили собственный шаблон VOCs в фекалиях больных с UC, Clostridium difficile и Campylobacter jejuni, который наводит на мысль что конкретные изменения происходят в структуре VOCs в GI болезни. в другом исследовании этой группой, анализ VOCs с калом бангладешских пациентов, пострадавших от холеры показал, что меньше VOCs были обнаружены в пробах холеры в отличие от здорового контроля.
Электронный анализатор недавно была объединена с новой технологией, FAIMS. Это техника, которая способна обнаружить VOCs, которые вытекают из биологического материала в режиме реального времени. Он действует путем введения ионизированной пробы (состоящий из ионов различной формы, заряда и размеров) между двумя металлическими пластинами. Асинхронных высоковольтных сигналов применяется между пластинами и создает условия, согласно которому некоторые ионы дрейфа и удар пластины, в то время как другие остаются между пластинами. С помощью различных напряжений, сложная смесь газов могут быть разделены различия в мобильности через пластины (рис. 2).
Рисунок 1.
Масса спектрометрии на основе метабономический. ГХ/МС, газовая хроматография массового спектрометрирования; LC/MS, массовым спектрометрированием жидкостной хроматографии.
Mass spectrometry-based metabonomics. GC/MS, gas chromatography mass spectrometry; LC/MS, liquid chromatography mass spectrometry.
Это обеспечивает надежный, эффективный, воспроизводимые и сравнительно недорогие подход для высокопроизводительного метаболического скрининга биожидкостей крови, мочи, тонко кишечной жидкости и фекальные воды. Объединив 1H-NMR спектроскопия с методологии многомерного анализа, существует все больше доказательств предположить, что метаболические профиль биожидкостей указывает на группировку отдельных компонентов у больных людей.
В исследование метабономический содержание аспираты из верхнего отдела тонкой кишки у больных с синдромом мальабсорбции, у тех с синдромом имелось значительно выше средний количества желчных кислот/холестерин, ацетат, лактат и формате чем в контроле. У тех с синдромом мальабсорбции и SIBO, значительно большее количество ацетат, лактат, формиат и неконъюгированной желчных кислот были найдены по сравнению с контролем (P <0.01 для всех), подразумевая, что SIBO сам может выявить конкретные, потенциально диагностические metabonomic подписи.
В другом исследовании с помощью фекальных пробах пациентов с воспалительным заболеванием кишечника inflammatory bowel disease (IBD) (n = 10 крона болезни, Crohn’s disease CD и n = 10 язвенный колит, ulcerative colitis UC) и здорового контроля (n = 13), метабономический подход был использован для помощи с диагнозом. Исследователи сообщили, что фекальных проб, полученных от больных с CD и UC проявляется подобные глобальные различия в метаболические профили, по сравнению с здоровых испытуемых. Обеднение короткими цепочками жирных кислот, в том числе ацетат и бутират, была характерной чертой CD пациентов по сравнению с здоровых испытуемых. Кроме того, высокая концентрация глицерин был найден в фекалиях больных CD по сравнению с UC пациентов. Более высокие концентрации аминокислот также были обнаружены в фекалиях больных с CD и UC по сравнению с здорового контроля. Это может быть следствием мальабсорбции, вызванные воспалением.
Хронические воспалительные клетки в lamina propria были зарегистрированы в крыс с SIBO вторичных экспериментальный слепых петли. Кроме того, данные в организме человека указывают, что местные lamina propria антитела клетки плазмы и интраэпителиальных лимфоцитов графов увеличиваются в SIBO. Как было показано, что условие привести в микроскопических воспаление слизистых оболочек, это правдоподобным считают, что общие различия в метаболические профили SIBO пациентов и контроля могут быть найдены. Также, как считается, что дисбактериоз GI микробиоты участвует в IBD, в инициировании его либо в поддержании его, и как SIBO также связано с дисбактериозом, это может быть, что после успешного применения метабономический в IBD, он также окажется в SIBO.
Иногда один маркер молекулы обеспечит адекватные определение болезни. Однако в действительности, большинство человеческих заболеваний полиэтиологичны по происхождению и условно связано с экологических воздействий. Таким образом, это более вероятно, что потребуется несколько маркер молекулы. Исследования показали, что такие собственные факторы, как пол, возраст, циркадные ритмы и внешние факторы, такие как диета, физическая активность, стресс и лекарства можно модулировать metabonomic профилей. Порядок сбора, хранения и подготовки также должны рассматриваться в качестве источников вариации в профилях.
Электронный аэрозольный анализатор и поле асимметричной ион мобильности спектрометрии
Концепция использования обнаружения летучие молекулы в качестве средства для диагностики SIBO не является новой. Газовая хроматография содержимого тощей кишки ранее использовалось для обнаружения и идентификации летучих жирных кислот (короткими цепочками жирных кислот) в результате ферментации органического материала не образующих споры анаэробных микроорганизмов. В одном исследовании, увеличение концентрации жирных кислот, ацетат и пропионат, был показан в содержимое тощей кишки больных с stagnant loop syndrome синдромом приводящей петли.
В другой серии больных полагают, SIBO был проведен полный анализ микробиологической аспиратов тощей кишки. Результаты от этого затем сравнивались с другие методы тестирования, включая газ Хроматографическое определение летучих жирных кислот в аспиратах. Газохроматографическим методом было установлено чувствительность 56% и специфичность в 100%. Факторы объяснить низкая чувствительность этого метода включают преобладание факультативные грамотрицательные над анаэробных бактерий в группе исследования и требуется 12-h быстро предварительно интубации, которое привело бы к отсутствию сбраживаемых субстрат для бактерий.
Газовая хроматография, наряду с масс-спектрометрии до сих пор считается золотым стандартом анализа проб. Эти традиционные подходы представить информацию об отдельные химические компоненты в рамках выборки, в отличие от электронного анализатора, который анализирует образец в целом производить «Химический отпечаток пальца».
Электронный анализатор был впервые разработан в 1980-х как способ копирования биологических обонятельной системы и используется для выявления VOCs от человеческих образцов, например, дыхания, пота, крови, мочи или фекальных проб. VOCs являются важным компонентом метаболом и включают спирты, альдегиды, фуранов, кетоны, пирролов, терпенов и др. Электронный анализатор не пытается измерить одного конкретного соединения, но возможность измерить коллекцию из нескольких молекул маркер. Толстокишечная ферментации создает несколько химических веществ, включая VOCs, которые могут оказаться важными для GI гомеостаза. Электронный анализатор включает массив металла газовых сенсоров, чьи сопротивление модулируется присутствии целевого газа/пара, например, VOCs. Каждый датчик отличается в некотором роде, (обычно широко настроены для химической группы) и поэтому взаимодействие между образцом и каждый датчик является уникальным.
«Химических отпечатков пальцев», производимых этим методом было показано, быть разрозненных групп различных заболеваний вследствие относительного изменения в пропорциях VOCs, выдыхаемыми больными людьми. Исследование фекальных VOCs может быть перспективным способом диагностики SIBO, потому что человека фекальных образцы представляют собой пищевые конечных продуктов, вытекающие из процессов пищеварительной и выделительной и кишечных бактериальных метаболизм. В SIBO наличие анаэробных бактерий в тонкие кишки эффективно приводит к ферментации, происходящих в тонкие кишки в дополнение к толстой кишки, т.е. кишечной бактериальной обмен веществ. Этот обмен веществ имеет потенциал, чтобы быть идентифицированы с помощью метода электронный анализатора.
Электронный анализатор еще не опробован в больных с подозрением SIBO. Это, однако, оказался успешным в диапазоне GI, метаболические и инфекционных заболеваний. A экспериментального исследования определили собственный шаблон VOCs в фекалиях больных с UC, Clostridium difficile и Campylobacter jejuni, который наводит на мысль что конкретные изменения происходят в структуре VOCs в GI болезни. в другом исследовании этой группой, анализ VOCs с калом бангладешских пациентов, пострадавших от холеры показал, что меньше VOCs были обнаружены в пробах холеры в отличие от здорового контроля.
Электронный анализатор недавно была объединена с новой технологией, FAIMS. Это техника, которая способна обнаружить VOCs, которые вытекают из биологического материала в режиме реального времени. Он действует путем введения ионизированной пробы (состоящий из ионов различной формы, заряда и размеров) между двумя металлическими пластинами. Асинхронных высоковольтных сигналов применяется между пластинами и создает условия, согласно которому некоторые ионы дрейфа и удар пластины, в то время как другие остаются между пластинами. С помощью различных напряжений, сложная смесь газов могут быть разделены различия в мобильности через пластины (рис. 2).
 Рисунок 2.
Illustration of the FAIMS effect (parallel plate example), showing ion drift. V, volts; t, time. Source: Thermo Fisher Scientific, 2013.
Иллюстрация FAIMS эффекта (например, параллельные пластины), показаны Ионный дрейф. Вольт; t, время. Источник:, Thermo Fisher Scientific 2013.
Экспериментальное исследование используется электронный анализатор и FAIMS технологии вместе для исследования, если они могут выявить различия в фекальные газы между пациентами, у которых развивается высокой токсичности и низкой токсичности при тазовой радиотерапии. Фекальных пробах 23 больных были проанализированы (11 в группе низкой токсичности) и 12 в группе высокой токсичности. Анализ компонентов принцип был применен к данных электронный анализатора и Фишер дискриминантного анализа данных FAIMS. Это показало, что, возможно, было невозможно разделить пациентов после лечения по их уровни токсичности. Однако явные различия в двух группах были также выявлены в их предварительные обработки образцов, предполагая, что выраженность побочных эффектов может быть предсказано.
Сочетание электронный анализатора и FAIMS технологий были использованы для тестирования их потенциальную полезность в дифференциации IBD объектов и контроль с помощью мочи. Во-вторых, методы способность различать между активной IBD, по сравнению с теми в клинической ремиссии оценивали. Из 62 взрослых включены, были три группы: 24 пациентов с UC, 24 с 14 элементов управления и CD. Первые две группы были разделены в тех с рецидивом или в стадии ремиссии.
Когда электронный анализатор образцы были проанализированы с использованием функции дискриминантного анализа, существует четкое разделение групп. Классификации чисто по группам заболеваний или управления привели к точности до 88%. Это различие было подтверждено, повторив анализ с помощью FAIMS технологии, которая дала точность превышает 75% (P <0,001) по сравнению с случайных классификации. Результаты также показали, что существует фундаментальное различие в VOCs, излучаемый мочи между группами в стадии ремиссии и тех, кто с рецидивом.
Как при тазовой радиотерапии и IBD пациентов, это правдоподобным думать, что явные различия в структурах VOC будет наблюдаться между SIBO больных и здоровых контролем. Возможность использования электронных анализаторов для обнаружения SIBO особенно привлекателен из-за его неинвазивный характер, его переносимости и потенциал, чтобы использовать эту технологию в амбулаторных условиях. Он может эксплуатироваться при комнатной температуре и давлении. Это дешевые, менее длительным и сложным, чем газовой хроматографии с масс-спектрометрии. Многие из преимуществ электронный анализатора также применимы к FAIMS и объединения двух инструментов может оказаться мощный метод для будущего развития диагностический инструмент для SIBO.
Заключение
Избыточный бактериальной рост в тонком кишечнике является значительный клиническая проблема, которая трудно диагностировать точно и для которых не определены оптимальный терапевтический параметры. Концепция определения оригинальные биомаркеров в биожидкостях или VOCs от биологических образцов для помощи с диагнозом SIBO является привлекательным. Преимущества этих методов многообразны: быстрое, неинвазивная и требующих минимальной преданализной пробоподготовки. Конечно является одним из основных препятствий в обоих случаях – отсутствие «золотой стандарт» диагностический тест для SIBO. Это усложняет интерпретации данных.
Для проверки возможной полезности любого из этих методов при SIBO, диагноз потребует использования тщательно определенных групп пациентов. Должен быть потенциал для определения весьма деликатного и конкретных тест, который может революционизировать диагноз и, следовательно, ведение, SIBO. Кроме того, методы, описанные может идентифицировать оригинальные биомаркеров, потенциально позволяя пациента стратификации для облегчения более персонализированный подход к подбору лечения антибиотиками для индивидуума. Таким образом это уменьшило повреждение симбиотические микробиоты GI, вызванных назначением ненужных антибиотиков.
Эти техники предназначены для обнаружения всех биохимических метаболитов, присутствующих одновременно в одном измерении, вполне вероятно, что один или больше покажут свое превосходство в имеющихся в настоящее время методы диагностики для SIBO. Доказательства этой гипотезы могут открыть новые возможности в гастроэнтерологии практики и исследований.
Рисунок 2.
Illustration of the FAIMS effect (parallel plate example), showing ion drift. V, volts; t, time. Source: Thermo Fisher Scientific, 2013.
Иллюстрация FAIMS эффекта (например, параллельные пластины), показаны Ионный дрейф. Вольт; t, время. Источник:, Thermo Fisher Scientific 2013.
Экспериментальное исследование используется электронный анализатор и FAIMS технологии вместе для исследования, если они могут выявить различия в фекальные газы между пациентами, у которых развивается высокой токсичности и низкой токсичности при тазовой радиотерапии. Фекальных пробах 23 больных были проанализированы (11 в группе низкой токсичности) и 12 в группе высокой токсичности. Анализ компонентов принцип был применен к данных электронный анализатора и Фишер дискриминантного анализа данных FAIMS. Это показало, что, возможно, было невозможно разделить пациентов после лечения по их уровни токсичности. Однако явные различия в двух группах были также выявлены в их предварительные обработки образцов, предполагая, что выраженность побочных эффектов может быть предсказано.
Сочетание электронный анализатора и FAIMS технологий были использованы для тестирования их потенциальную полезность в дифференциации IBD объектов и контроль с помощью мочи. Во-вторых, методы способность различать между активной IBD, по сравнению с теми в клинической ремиссии оценивали. Из 62 взрослых включены, были три группы: 24 пациентов с UC, 24 с 14 элементов управления и CD. Первые две группы были разделены в тех с рецидивом или в стадии ремиссии.
Когда электронный анализатор образцы были проанализированы с использованием функции дискриминантного анализа, существует четкое разделение групп. Классификации чисто по группам заболеваний или управления привели к точности до 88%. Это различие было подтверждено, повторив анализ с помощью FAIMS технологии, которая дала точность превышает 75% (P <0,001) по сравнению с случайных классификации. Результаты также показали, что существует фундаментальное различие в VOCs, излучаемый мочи между группами в стадии ремиссии и тех, кто с рецидивом.
Как при тазовой радиотерапии и IBD пациентов, это правдоподобным думать, что явные различия в структурах VOC будет наблюдаться между SIBO больных и здоровых контролем. Возможность использования электронных анализаторов для обнаружения SIBO особенно привлекателен из-за его неинвазивный характер, его переносимости и потенциал, чтобы использовать эту технологию в амбулаторных условиях. Он может эксплуатироваться при комнатной температуре и давлении. Это дешевые, менее длительным и сложным, чем газовой хроматографии с масс-спектрометрии. Многие из преимуществ электронный анализатора также применимы к FAIMS и объединения двух инструментов может оказаться мощный метод для будущего развития диагностический инструмент для SIBO.
Заключение
Избыточный бактериальной рост в тонком кишечнике является значительный клиническая проблема, которая трудно диагностировать точно и для которых не определены оптимальный терапевтический параметры. Концепция определения оригинальные биомаркеров в биожидкостях или VOCs от биологических образцов для помощи с диагнозом SIBO является привлекательным. Преимущества этих методов многообразны: быстрое, неинвазивная и требующих минимальной преданализной пробоподготовки. Конечно является одним из основных препятствий в обоих случаях – отсутствие «золотой стандарт» диагностический тест для SIBO. Это усложняет интерпретации данных.
Для проверки возможной полезности любого из этих методов при SIBO, диагноз потребует использования тщательно определенных групп пациентов. Должен быть потенциал для определения весьма деликатного и конкретных тест, который может революционизировать диагноз и, следовательно, ведение, SIBO. Кроме того, методы, описанные может идентифицировать оригинальные биомаркеров, потенциально позволяя пациента стратификации для облегчения более персонализированный подход к подбору лечения антибиотиками для индивидуума. Таким образом это уменьшило повреждение симбиотические микробиоты GI, вызванных назначением ненужных антибиотиков.
Эти техники предназначены для обнаружения всех биохимических метаболитов, присутствующих одновременно в одном измерении, вполне вероятно, что один или больше покажут свое превосходство в имеющихся в настоящее время методы диагностики для SIBO. Доказательства этой гипотезы могут открыть новые возможности в гастроэнтерологии практики и исследований.

 Рисунок 1.
Масса спектрометрии на основе метабономический. ГХ/МС, газовая хроматография массового спектрометрирования; LC/MS, массовым спектрометрированием жидкостной хроматографии.
Mass spectrometry-based metabonomics. GC/MS, gas chromatography mass spectrometry; LC/MS, liquid chromatography mass spectrometry.
Это обеспечивает надежный, эффективный, воспроизводимые и сравнительно недорогие подход для высокопроизводительного метаболического скрининга биожидкостей крови, мочи, тонко кишечной жидкости и фекальные воды. Объединив 1H-NMR спектроскопия с методологии многомерного анализа, существует все больше доказательств предположить, что метаболические профиль биожидкостей указывает на группировку отдельных компонентов у больных людей.
В исследование метабономический содержание аспираты из верхнего отдела тонкой кишки у больных с синдромом мальабсорбции, у тех с синдромом имелось значительно выше средний количества желчных кислот/холестерин, ацетат, лактат и формате чем в контроле. У тех с синдромом мальабсорбции и SIBO, значительно большее количество ацетат, лактат, формиат и неконъюгированной желчных кислот были найдены по сравнению с контролем (P <0.01 для всех), подразумевая, что SIBO сам может выявить конкретные, потенциально диагностические metabonomic подписи.
В другом исследовании с помощью фекальных пробах пациентов с воспалительным заболеванием кишечника inflammatory bowel disease (IBD) (n = 10 крона болезни, Crohn’s disease CD и n = 10 язвенный колит, ulcerative colitis UC) и здорового контроля (n = 13), метабономический подход был использован для помощи с диагнозом. Исследователи сообщили, что фекальных проб, полученных от больных с CD и UC проявляется подобные глобальные различия в метаболические профили, по сравнению с здоровых испытуемых. Обеднение короткими цепочками жирных кислот, в том числе ацетат и бутират, была характерной чертой CD пациентов по сравнению с здоровых испытуемых. Кроме того, высокая концентрация глицерин был найден в фекалиях больных CD по сравнению с UC пациентов. Более высокие концентрации аминокислот также были обнаружены в фекалиях больных с CD и UC по сравнению с здорового контроля. Это может быть следствием мальабсорбции, вызванные воспалением.
Хронические воспалительные клетки в lamina propria были зарегистрированы в крыс с SIBO вторичных экспериментальный слепых петли. Кроме того, данные в организме человека указывают, что местные lamina propria антитела клетки плазмы и интраэпителиальных лимфоцитов графов увеличиваются в SIBO. Как было показано, что условие привести в микроскопических воспаление слизистых оболочек, это правдоподобным считают, что общие различия в метаболические профили SIBO пациентов и контроля могут быть найдены. Также, как считается, что дисбактериоз GI микробиоты участвует в IBD, в инициировании его либо в поддержании его, и как SIBO также связано с дисбактериозом, это может быть, что после успешного применения метабономический в IBD, он также окажется в SIBO.
Иногда один маркер молекулы обеспечит адекватные определение болезни. Однако в действительности, большинство человеческих заболеваний полиэтиологичны по происхождению и условно связано с экологических воздействий. Таким образом, это более вероятно, что потребуется несколько маркер молекулы. Исследования показали, что такие собственные факторы, как пол, возраст, циркадные ритмы и внешние факторы, такие как диета, физическая активность, стресс и лекарства можно модулировать metabonomic профилей. Порядок сбора, хранения и подготовки также должны рассматриваться в качестве источников вариации в профилях.
Электронный аэрозольный анализатор и поле асимметричной ион мобильности спектрометрии
Концепция использования обнаружения летучие молекулы в качестве средства для диагностики SIBO не является новой. Газовая хроматография содержимого тощей кишки ранее использовалось для обнаружения и идентификации летучих жирных кислот (короткими цепочками жирных кислот) в результате ферментации органического материала не образующих споры анаэробных микроорганизмов. В одном исследовании, увеличение концентрации жирных кислот, ацетат и пропионат, был показан в содержимое тощей кишки больных с stagnant loop syndrome синдромом приводящей петли.
В другой серии больных полагают, SIBO был проведен полный анализ микробиологической аспиратов тощей кишки. Результаты от этого затем сравнивались с другие методы тестирования, включая газ Хроматографическое определение летучих жирных кислот в аспиратах. Газохроматографическим методом было установлено чувствительность 56% и специфичность в 100%. Факторы объяснить низкая чувствительность этого метода включают преобладание факультативные грамотрицательные над анаэробных бактерий в группе исследования и требуется 12-h быстро предварительно интубации, которое привело бы к отсутствию сбраживаемых субстрат для бактерий.
Газовая хроматография, наряду с масс-спектрометрии до сих пор считается золотым стандартом анализа проб. Эти традиционные подходы представить информацию об отдельные химические компоненты в рамках выборки, в отличие от электронного анализатора, который анализирует образец в целом производить «Химический отпечаток пальца».
Электронный анализатор был впервые разработан в 1980-х как способ копирования биологических обонятельной системы и используется для выявления VOCs от человеческих образцов, например, дыхания, пота, крови, мочи или фекальных проб. VOCs являются важным компонентом метаболом и включают спирты, альдегиды, фуранов, кетоны, пирролов, терпенов и др. Электронный анализатор не пытается измерить одного конкретного соединения, но возможность измерить коллекцию из нескольких молекул маркер. Толстокишечная ферментации создает несколько химических веществ, включая VOCs, которые могут оказаться важными для GI гомеостаза. Электронный анализатор включает массив металла газовых сенсоров, чьи сопротивление модулируется присутствии целевого газа/пара, например, VOCs. Каждый датчик отличается в некотором роде, (обычно широко настроены для химической группы) и поэтому взаимодействие между образцом и каждый датчик является уникальным.
«Химических отпечатков пальцев», производимых этим методом было показано, быть разрозненных групп различных заболеваний вследствие относительного изменения в пропорциях VOCs, выдыхаемыми больными людьми. Исследование фекальных VOCs может быть перспективным способом диагностики SIBO, потому что человека фекальных образцы представляют собой пищевые конечных продуктов, вытекающие из процессов пищеварительной и выделительной и кишечных бактериальных метаболизм. В SIBO наличие анаэробных бактерий в тонкие кишки эффективно приводит к ферментации, происходящих в тонкие кишки в дополнение к толстой кишки, т.е. кишечной бактериальной обмен веществ. Этот обмен веществ имеет потенциал, чтобы быть идентифицированы с помощью метода электронный анализатора.
Электронный анализатор еще не опробован в больных с подозрением SIBO. Это, однако, оказался успешным в диапазоне GI, метаболические и инфекционных заболеваний. A экспериментального исследования определили собственный шаблон VOCs в фекалиях больных с UC, Clostridium difficile и Campylobacter jejuni, который наводит на мысль что конкретные изменения происходят в структуре VOCs в GI болезни. в другом исследовании этой группой, анализ VOCs с калом бангладешских пациентов, пострадавших от холеры показал, что меньше VOCs были обнаружены в пробах холеры в отличие от здорового контроля.
Электронный анализатор недавно была объединена с новой технологией, FAIMS. Это техника, которая способна обнаружить VOCs, которые вытекают из биологического материала в режиме реального времени. Он действует путем введения ионизированной пробы (состоящий из ионов различной формы, заряда и размеров) между двумя металлическими пластинами. Асинхронных высоковольтных сигналов применяется между пластинами и создает условия, согласно которому некоторые ионы дрейфа и удар пластины, в то время как другие остаются между пластинами. С помощью различных напряжений, сложная смесь газов могут быть разделены различия в мобильности через пластины (рис. 2).
Рисунок 1.
Масса спектрометрии на основе метабономический. ГХ/МС, газовая хроматография массового спектрометрирования; LC/MS, массовым спектрометрированием жидкостной хроматографии.
Mass spectrometry-based metabonomics. GC/MS, gas chromatography mass spectrometry; LC/MS, liquid chromatography mass spectrometry.
Это обеспечивает надежный, эффективный, воспроизводимые и сравнительно недорогие подход для высокопроизводительного метаболического скрининга биожидкостей крови, мочи, тонко кишечной жидкости и фекальные воды. Объединив 1H-NMR спектроскопия с методологии многомерного анализа, существует все больше доказательств предположить, что метаболические профиль биожидкостей указывает на группировку отдельных компонентов у больных людей.
В исследование метабономический содержание аспираты из верхнего отдела тонкой кишки у больных с синдромом мальабсорбции, у тех с синдромом имелось значительно выше средний количества желчных кислот/холестерин, ацетат, лактат и формате чем в контроле. У тех с синдромом мальабсорбции и SIBO, значительно большее количество ацетат, лактат, формиат и неконъюгированной желчных кислот были найдены по сравнению с контролем (P <0.01 для всех), подразумевая, что SIBO сам может выявить конкретные, потенциально диагностические metabonomic подписи.
В другом исследовании с помощью фекальных пробах пациентов с воспалительным заболеванием кишечника inflammatory bowel disease (IBD) (n = 10 крона болезни, Crohn’s disease CD и n = 10 язвенный колит, ulcerative colitis UC) и здорового контроля (n = 13), метабономический подход был использован для помощи с диагнозом. Исследователи сообщили, что фекальных проб, полученных от больных с CD и UC проявляется подобные глобальные различия в метаболические профили, по сравнению с здоровых испытуемых. Обеднение короткими цепочками жирных кислот, в том числе ацетат и бутират, была характерной чертой CD пациентов по сравнению с здоровых испытуемых. Кроме того, высокая концентрация глицерин был найден в фекалиях больных CD по сравнению с UC пациентов. Более высокие концентрации аминокислот также были обнаружены в фекалиях больных с CD и UC по сравнению с здорового контроля. Это может быть следствием мальабсорбции, вызванные воспалением.
Хронические воспалительные клетки в lamina propria были зарегистрированы в крыс с SIBO вторичных экспериментальный слепых петли. Кроме того, данные в организме человека указывают, что местные lamina propria антитела клетки плазмы и интраэпителиальных лимфоцитов графов увеличиваются в SIBO. Как было показано, что условие привести в микроскопических воспаление слизистых оболочек, это правдоподобным считают, что общие различия в метаболические профили SIBO пациентов и контроля могут быть найдены. Также, как считается, что дисбактериоз GI микробиоты участвует в IBD, в инициировании его либо в поддержании его, и как SIBO также связано с дисбактериозом, это может быть, что после успешного применения метабономический в IBD, он также окажется в SIBO.
Иногда один маркер молекулы обеспечит адекватные определение болезни. Однако в действительности, большинство человеческих заболеваний полиэтиологичны по происхождению и условно связано с экологических воздействий. Таким образом, это более вероятно, что потребуется несколько маркер молекулы. Исследования показали, что такие собственные факторы, как пол, возраст, циркадные ритмы и внешние факторы, такие как диета, физическая активность, стресс и лекарства можно модулировать metabonomic профилей. Порядок сбора, хранения и подготовки также должны рассматриваться в качестве источников вариации в профилях.
Электронный аэрозольный анализатор и поле асимметричной ион мобильности спектрометрии
Концепция использования обнаружения летучие молекулы в качестве средства для диагностики SIBO не является новой. Газовая хроматография содержимого тощей кишки ранее использовалось для обнаружения и идентификации летучих жирных кислот (короткими цепочками жирных кислот) в результате ферментации органического материала не образующих споры анаэробных микроорганизмов. В одном исследовании, увеличение концентрации жирных кислот, ацетат и пропионат, был показан в содержимое тощей кишки больных с stagnant loop syndrome синдромом приводящей петли.
В другой серии больных полагают, SIBO был проведен полный анализ микробиологической аспиратов тощей кишки. Результаты от этого затем сравнивались с другие методы тестирования, включая газ Хроматографическое определение летучих жирных кислот в аспиратах. Газохроматографическим методом было установлено чувствительность 56% и специфичность в 100%. Факторы объяснить низкая чувствительность этого метода включают преобладание факультативные грамотрицательные над анаэробных бактерий в группе исследования и требуется 12-h быстро предварительно интубации, которое привело бы к отсутствию сбраживаемых субстрат для бактерий.
Газовая хроматография, наряду с масс-спектрометрии до сих пор считается золотым стандартом анализа проб. Эти традиционные подходы представить информацию об отдельные химические компоненты в рамках выборки, в отличие от электронного анализатора, который анализирует образец в целом производить «Химический отпечаток пальца».
Электронный анализатор был впервые разработан в 1980-х как способ копирования биологических обонятельной системы и используется для выявления VOCs от человеческих образцов, например, дыхания, пота, крови, мочи или фекальных проб. VOCs являются важным компонентом метаболом и включают спирты, альдегиды, фуранов, кетоны, пирролов, терпенов и др. Электронный анализатор не пытается измерить одного конкретного соединения, но возможность измерить коллекцию из нескольких молекул маркер. Толстокишечная ферментации создает несколько химических веществ, включая VOCs, которые могут оказаться важными для GI гомеостаза. Электронный анализатор включает массив металла газовых сенсоров, чьи сопротивление модулируется присутствии целевого газа/пара, например, VOCs. Каждый датчик отличается в некотором роде, (обычно широко настроены для химической группы) и поэтому взаимодействие между образцом и каждый датчик является уникальным.
«Химических отпечатков пальцев», производимых этим методом было показано, быть разрозненных групп различных заболеваний вследствие относительного изменения в пропорциях VOCs, выдыхаемыми больными людьми. Исследование фекальных VOCs может быть перспективным способом диагностики SIBO, потому что человека фекальных образцы представляют собой пищевые конечных продуктов, вытекающие из процессов пищеварительной и выделительной и кишечных бактериальных метаболизм. В SIBO наличие анаэробных бактерий в тонкие кишки эффективно приводит к ферментации, происходящих в тонкие кишки в дополнение к толстой кишки, т.е. кишечной бактериальной обмен веществ. Этот обмен веществ имеет потенциал, чтобы быть идентифицированы с помощью метода электронный анализатора.
Электронный анализатор еще не опробован в больных с подозрением SIBO. Это, однако, оказался успешным в диапазоне GI, метаболические и инфекционных заболеваний. A экспериментального исследования определили собственный шаблон VOCs в фекалиях больных с UC, Clostridium difficile и Campylobacter jejuni, который наводит на мысль что конкретные изменения происходят в структуре VOCs в GI болезни. в другом исследовании этой группой, анализ VOCs с калом бангладешских пациентов, пострадавших от холеры показал, что меньше VOCs были обнаружены в пробах холеры в отличие от здорового контроля.
Электронный анализатор недавно была объединена с новой технологией, FAIMS. Это техника, которая способна обнаружить VOCs, которые вытекают из биологического материала в режиме реального времени. Он действует путем введения ионизированной пробы (состоящий из ионов различной формы, заряда и размеров) между двумя металлическими пластинами. Асинхронных высоковольтных сигналов применяется между пластинами и создает условия, согласно которому некоторые ионы дрейфа и удар пластины, в то время как другие остаются между пластинами. С помощью различных напряжений, сложная смесь газов могут быть разделены различия в мобильности через пластины (рис. 2).
 Рисунок 2.
Illustration of the FAIMS effect (parallel plate example), showing ion drift. V, volts; t, time. Source: Thermo Fisher Scientific, 2013.
Иллюстрация FAIMS эффекта (например, параллельные пластины), показаны Ионный дрейф. Вольт; t, время. Источник:, Thermo Fisher Scientific 2013.
Экспериментальное исследование используется электронный анализатор и FAIMS технологии вместе для исследования, если они могут выявить различия в фекальные газы между пациентами, у которых развивается высокой токсичности и низкой токсичности при тазовой радиотерапии. Фекальных пробах 23 больных были проанализированы (11 в группе низкой токсичности) и 12 в группе высокой токсичности. Анализ компонентов принцип был применен к данных электронный анализатора и Фишер дискриминантного анализа данных FAIMS. Это показало, что, возможно, было невозможно разделить пациентов после лечения по их уровни токсичности. Однако явные различия в двух группах были также выявлены в их предварительные обработки образцов, предполагая, что выраженность побочных эффектов может быть предсказано.
Сочетание электронный анализатора и FAIMS технологий были использованы для тестирования их потенциальную полезность в дифференциации IBD объектов и контроль с помощью мочи. Во-вторых, методы способность различать между активной IBD, по сравнению с теми в клинической ремиссии оценивали. Из 62 взрослых включены, были три группы: 24 пациентов с UC, 24 с 14 элементов управления и CD. Первые две группы были разделены в тех с рецидивом или в стадии ремиссии.
Когда электронный анализатор образцы были проанализированы с использованием функции дискриминантного анализа, существует четкое разделение групп. Классификации чисто по группам заболеваний или управления привели к точности до 88%. Это различие было подтверждено, повторив анализ с помощью FAIMS технологии, которая дала точность превышает 75% (P <0,001) по сравнению с случайных классификации. Результаты также показали, что существует фундаментальное различие в VOCs, излучаемый мочи между группами в стадии ремиссии и тех, кто с рецидивом.
Как при тазовой радиотерапии и IBD пациентов, это правдоподобным думать, что явные различия в структурах VOC будет наблюдаться между SIBO больных и здоровых контролем. Возможность использования электронных анализаторов для обнаружения SIBO особенно привлекателен из-за его неинвазивный характер, его переносимости и потенциал, чтобы использовать эту технологию в амбулаторных условиях. Он может эксплуатироваться при комнатной температуре и давлении. Это дешевые, менее длительным и сложным, чем газовой хроматографии с масс-спектрометрии. Многие из преимуществ электронный анализатора также применимы к FAIMS и объединения двух инструментов может оказаться мощный метод для будущего развития диагностический инструмент для SIBO.
Заключение
Избыточный бактериальной рост в тонком кишечнике является значительный клиническая проблема, которая трудно диагностировать точно и для которых не определены оптимальный терапевтический параметры. Концепция определения оригинальные биомаркеров в биожидкостях или VOCs от биологических образцов для помощи с диагнозом SIBO является привлекательным. Преимущества этих методов многообразны: быстрое, неинвазивная и требующих минимальной преданализной пробоподготовки. Конечно является одним из основных препятствий в обоих случаях – отсутствие «золотой стандарт» диагностический тест для SIBO. Это усложняет интерпретации данных.
Для проверки возможной полезности любого из этих методов при SIBO, диагноз потребует использования тщательно определенных групп пациентов. Должен быть потенциал для определения весьма деликатного и конкретных тест, который может революционизировать диагноз и, следовательно, ведение, SIBO. Кроме того, методы, описанные может идентифицировать оригинальные биомаркеров, потенциально позволяя пациента стратификации для облегчения более персонализированный подход к подбору лечения антибиотиками для индивидуума. Таким образом это уменьшило повреждение симбиотические микробиоты GI, вызванных назначением ненужных антибиотиков.
Эти техники предназначены для обнаружения всех биохимических метаболитов, присутствующих одновременно в одном измерении, вполне вероятно, что один или больше покажут свое превосходство в имеющихся в настоящее время методы диагностики для SIBO. Доказательства этой гипотезы могут открыть новые возможности в гастроэнтерологии практики и исследований.
Рисунок 2.
Illustration of the FAIMS effect (parallel plate example), showing ion drift. V, volts; t, time. Source: Thermo Fisher Scientific, 2013.
Иллюстрация FAIMS эффекта (например, параллельные пластины), показаны Ионный дрейф. Вольт; t, время. Источник:, Thermo Fisher Scientific 2013.
Экспериментальное исследование используется электронный анализатор и FAIMS технологии вместе для исследования, если они могут выявить различия в фекальные газы между пациентами, у которых развивается высокой токсичности и низкой токсичности при тазовой радиотерапии. Фекальных пробах 23 больных были проанализированы (11 в группе низкой токсичности) и 12 в группе высокой токсичности. Анализ компонентов принцип был применен к данных электронный анализатора и Фишер дискриминантного анализа данных FAIMS. Это показало, что, возможно, было невозможно разделить пациентов после лечения по их уровни токсичности. Однако явные различия в двух группах были также выявлены в их предварительные обработки образцов, предполагая, что выраженность побочных эффектов может быть предсказано.
Сочетание электронный анализатора и FAIMS технологий были использованы для тестирования их потенциальную полезность в дифференциации IBD объектов и контроль с помощью мочи. Во-вторых, методы способность различать между активной IBD, по сравнению с теми в клинической ремиссии оценивали. Из 62 взрослых включены, были три группы: 24 пациентов с UC, 24 с 14 элементов управления и CD. Первые две группы были разделены в тех с рецидивом или в стадии ремиссии.
Когда электронный анализатор образцы были проанализированы с использованием функции дискриминантного анализа, существует четкое разделение групп. Классификации чисто по группам заболеваний или управления привели к точности до 88%. Это различие было подтверждено, повторив анализ с помощью FAIMS технологии, которая дала точность превышает 75% (P <0,001) по сравнению с случайных классификации. Результаты также показали, что существует фундаментальное различие в VOCs, излучаемый мочи между группами в стадии ремиссии и тех, кто с рецидивом.
Как при тазовой радиотерапии и IBD пациентов, это правдоподобным думать, что явные различия в структурах VOC будет наблюдаться между SIBO больных и здоровых контролем. Возможность использования электронных анализаторов для обнаружения SIBO особенно привлекателен из-за его неинвазивный характер, его переносимости и потенциал, чтобы использовать эту технологию в амбулаторных условиях. Он может эксплуатироваться при комнатной температуре и давлении. Это дешевые, менее длительным и сложным, чем газовой хроматографии с масс-спектрометрии. Многие из преимуществ электронный анализатора также применимы к FAIMS и объединения двух инструментов может оказаться мощный метод для будущего развития диагностический инструмент для SIBO.
Заключение
Избыточный бактериальной рост в тонком кишечнике является значительный клиническая проблема, которая трудно диагностировать точно и для которых не определены оптимальный терапевтический параметры. Концепция определения оригинальные биомаркеров в биожидкостях или VOCs от биологических образцов для помощи с диагнозом SIBO является привлекательным. Преимущества этих методов многообразны: быстрое, неинвазивная и требующих минимальной преданализной пробоподготовки. Конечно является одним из основных препятствий в обоих случаях – отсутствие «золотой стандарт» диагностический тест для SIBO. Это усложняет интерпретации данных.
Для проверки возможной полезности любого из этих методов при SIBO, диагноз потребует использования тщательно определенных групп пациентов. Должен быть потенциал для определения весьма деликатного и конкретных тест, который может революционизировать диагноз и, следовательно, ведение, SIBO. Кроме того, методы, описанные может идентифицировать оригинальные биомаркеров, потенциально позволяя пациента стратификации для облегчения более персонализированный подход к подбору лечения антибиотиками для индивидуума. Таким образом это уменьшило повреждение симбиотические микробиоты GI, вызванных назначением ненужных антибиотиков.
Эти техники предназначены для обнаружения всех биохимических метаболитов, присутствующих одновременно в одном измерении, вполне вероятно, что один или больше покажут свое превосходство в имеющихся в настоящее время методы диагностики для SIBO. Доказательства этой гипотезы могут открыть новые возможности в гастроэнтерологии практики и исследований.



