Клинические и эпидемиологические исследования
Adalimumab long-term safety: infections, vaccination response and pregnancy outcomes in patients with rheumatoid arthritis
Gerd R Burmester1,
Robert Landewé2,
Mark C Genovese3,
Alan W Friedman4,
Nathan D Pfeifer5,
Nupun A Varothai6,
Ana P Lacerda4
+ Данные Об Авторах
- 1Department of Rheumatology and Clinical Immunology, Charité–University Medicine Berlin, Free University and Humboldt University of Berlin, Berlin, Germany
- 2Clinical Immunology and Rheumatology, Academic Medical Centre, University of Amsterdam, Amsterdam, The Netherlands
- 3Division of Immunology and Rheumatology, Stanford University, Palo Alto, California, USA
- 4Immunology Clinical Development, AbbVie, North Chicago, Illinois, USA
- 5Clinical Pharmacology and Pharmacometrics, AbbVie, North Chicago, Illinois, USA
- 6Data and Statistical Sciences, AbbVie, North Chicago, Illinois, USA
Для связи: Dr Gerd R Burmester, Department of Rheumatology and Clinical Immunology, Charité–University Medicine Berlin, Charitéplatz 1, Berlin 10017, Germany;
gerd.burmester@charite.de
Опубликовано онлайн 23 Июня 2016 Года
Аннотация
Справочная информация Адалимумаб был использован у пациентов при умеренной до тяжелой активности ревматоидного артритом (РА) на протяжении более 10 лет и имеет хорошо установленный профиль безопасности по нескольким признакам.
Цель Целенаправленно уточнить нежелательных явлений (НЯ) adverse events (AEs) в глобальных клинических испытаний адалимумаба у пациентов с РА.
Методы Данный анализ включает в себя 15 132 пациентов, подвергшихся адалимумаба в глобальных клинических испытаниях РА. НЯ включают инфекции, отклонения лабораторных показателей и AEs, связанные с вакцинацией против гриппа. Исходы беременности были собраны по данным регистра Адалимумаб беременности.
Результаты Серьезные инфекции и туберкулез произошло в размере 4,7 и 0,3 события/100 пациенто-лет, соответственно. Два пациента испытали реактивации гепатита. Незначительные отклонения лабораторных показателей были зарегистрированы адалимумабом и метотрексатом по сравнению с плацебо плюс Метотрексат. Связанных с гриппом НЯ произошла у 5% вакцинированных пациентов по сравнению с 14% пациентов, не вакцинированных в ходе исследования. Относительный риск крупных врожденных пороков развития и спонтанных абортов в адалимумаб-подвергнутым женщинам были похожи между неэкспонированных женщин с РА и здоровых женщин.
Выводы. Этот анализ подтверждает и расширяет известный профиль безопасности адалимумаба и не сообщает о никаких дополнительных рисков безопасности лаборатории патологии, гепатита В реактивация и исходы беременности, включая самопроизвольные аборты и врожденные дефекты. Преимущества вакцинации против гриппа подкреплены.
Регистрационные номера исследований NCT00195663, NCT00195702, NCT00448383, NCT00049751, NCT00234845, NCT00650390, NCT00235859, NCT00647920, NCT00649545, NCT00647491, NCT00649922, NCT00538902, NCT00420927, NCT00870467, NCT00650156, NCT00647270, NCT01185288, NCT01185301.
Введение
Ингибиторы фактора некроза опухоли (анти-TNFs) способствовало улучшению клинических исходов при ревматоидном артрите (РА), но безопасность была одна точка относительного беспокойства. Риски серьезных инфекционных событий (СИС) Serious infectious event (SIE) увеличены у пациентов использующих биопрепаратов, а также мероприятия по минимизации рисков, такие как прививки и латентного туберкулеза
(latent tuberculosis (TB)) инфекции
infection (LTBI (ЛТБИ), скрининг и профилактика может снизить риск инфекции. Последнее время, другие неблагоприятные события (AEs) стали центром внимания: вирусные реактивации, ответ на вакцинацию, лабораторное нарушения и исходы беременности.
Этот анализ фокусируется на этих возникших событиях, используя комплексные данные из глобальных адалимумаб клинических испытаниях в РА.
Пациенты и методы
Источники данных
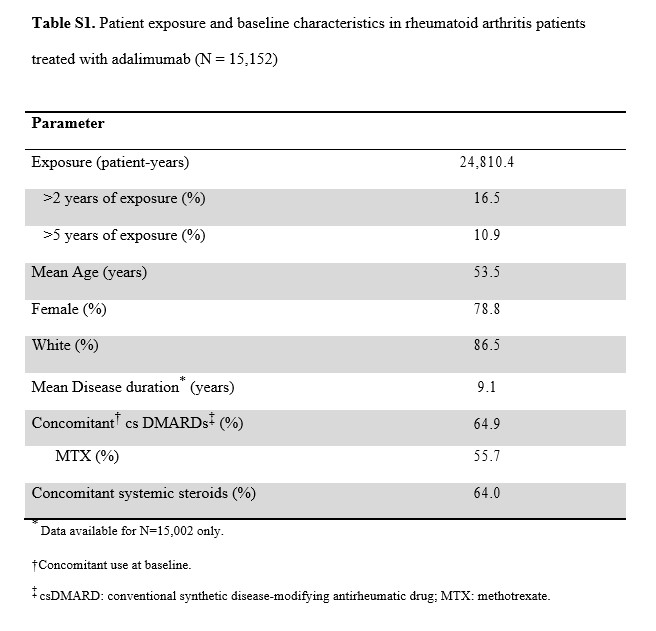
НЯ данные были выведены из 28 глобальных клинических исследованиях (см. онлайн Дополнительная Таблица S1) с адалимумаба у пациентов с РА.
В регистр беременностей, получивших Адалимумаб (Adalimumab Pregnancy Exposure Registry (APER)) продолжается проспективное, обсервационное, экспозиция когортного исследования, проведенного в Северной Америке, чтобы контролировать исход беременности у женщин с РА получивших адалимумаба во время беременности по сравнению с болезнью-отобранных групп женщин с РА, которые не использовали адалимумаба во время беременности и в когорте здоровых беременных женщин. Это когортное исследование проводится организацией специалистов по Тератологии (Organization of Teratology Information Specialists (OTIS). Данные собираются с 1 февраля 2004 года по 5 ноября 2013 года.
Дополнительные данные*
Оценки безопасности и статистические анализы
Безопасности населения состоит в наблюдении пациентов с любым использованием адалимумаба от первой дозы через 70 дней (пять периодов полураспада) после последнего наблюдаемой дозы. Серьезные НЯ (Serious AE (SAE)) определяется как фатальные или непосредственно угрожающие жизни; требует госпитализации или длительной госпитализации; привело к стойкой или выраженной нетрудоспособности/инвалидности, врожденной аномалии или требует медицинского, или хирургического вмешательства для предотвращения серьезных последствий. НЯ были обобщены в качестве событий/100 пациенто-лет (Е/100 PY) воздействия адалимумаб, используя предпочтительные термины из медицинского словаря для регуляторной деятельности (MedDRA) Regulatory Activities (MedDRA) V.15.1 (http://www.meddra.org).
AEs интересов включены SIEs, туберкулез, оппортунистические инфекции, опоясывающего лишая (herpes zoster (HZ)) и гепатита В реактивация.
Процент пациентов, у которых развилась анемия в течение первых 6 месяцев терапии адалимумабом были определены в двух исследованиях у пациентов с ранним (<1 года), и одна с давнего РА (>1 года). Среднее изменение от исходного уровня в сыворотке до приема пищи концентрация липидов (общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП) и липопротеинов низкой плотности (ЛПНП)) и гемоглобина (HB) сравнивались между адалимумабом и метотрексатом (mtx) и плацебо плюс Метотрексат (Метотрексат-монотерапия) на 26 неделе в исследовании OPTIMA с помощью различий в анализах путем дисперсионного анализа.
Риски НЯ связанные с гриппом после вакцинации против гриппа были оценены в адалимумаба у пациентов с РА на 10 лет. НЯ, связанных с вирусной инфекцией гриппа (в течение 270 дней от вакцинации) были сведены в таблицу, используя предопределенный запрос MedDRA.
Все беременности зачислены в реестре OTIS беременности, который достиг исхода беременности, к ноябрю 2013 года были включены. Исходы беременности включали живорождений, большие и малые врожденные пороки развития, самопроизвольные аборты, преждевременные роды (<37 недель) и средний гестационный возраст во время родов. Беременность открытыми для mtx были исключены, из-за известных тератогенности. Материнской характеристики сравнивались между когортами, используя χ2-тесты за независимость. По сообщенным исходам беременности с живорождением, основные дефекты рождения и ≥3 мелкие дефекты рождения, точечной оценке относительного риска (ОР) и 95% ДИ для адалимумаб-облученной группе по сравнению с контрольная группа была вычислена. Основным результатом серьезных врожденных дефектов оценивали всех беременностей заканчивается по крайней мере одного живого ребенка, а во вторую очередь всех беременностей с известным исходом. Детей с ≥3 малые аномалии были оценены, чтобы идентифицировать любые случаи с теми же тремя конкретных аномалий в пределах каждой группы. Для оценки кумулятивной вероятности спонтанного аборта, были использованы для Каплана–Мейера (Kaplan–Meier (KM) анализ только женщинам, которые зарегистрированы с <20 недель беременности. Модели пропорциональных рисков были использованы для оценки HRs и 95% Cis
Результаты
Пациенты
До 31 декабря 2012 года, адалимумаб вводили 15 152 пациентов в исследованиях RA, что составляет 24 810 PYs воздействия адалимумаба. Показатели заболеваемости представлены в таблице 1, включают показатели как серьезных, так и несерьезных НЯ.
Таблица 1
Частота неблагоприятных событий у пациентов с ревматоидным артритом пролеченных адалимумабом (п=15 152; 24,810.4 PYs)
Incidence rates of adverse events of interest in patients with rheumatoid arthritis treated with adalimumab (N=15 152; 24,810.4 PYs)
| НЯ Adverse events |
E (E/100 PYs) |
| Серьезные инфекции Serious infections |
1154 (4.7) |
| Активный туберкулез Active tuberculosis (TB) |
63 (0.3) |
| Оппортунистические Opportunistic |
14 (<0.1) |
| опоясывающий лишай Zoster |
19 (<0.1) |
| Несерьезные инфекции Non-serious infections |
| Оппортунистические инфекции, включая оральный кандидоз, герпес зостер и туберкулез Opportunistic infections, excluding oral candidiasis, herpes zoster and TB |
26 (0.1) |
| герпес зостер Herpes zoster |
424 (1.7) |
| Реактивация гепатита В Reactivation of hepatitis B* |
3 (<0.1) |
- *Два пациента испытали три события реактивации вирусного гепатита В: хронический гепатит B, гепатита B и вирусному гепатиту носитель.
- Е, количество событий; Е/100 PYs, события на 100 пациенто-лет
- *Two patients experienced three events of hepatitis B reactivation: chronic hepatitis B, hepatitis B and viral hepatitis carrier.
- E, number of events; E/100 PYs, events per 100 patient-years.
Инфекции
SIEs были наиболее часто сообщалось SAEs, в том числе пневмонии (0.7 Е/100 PYs), флегмоны (0.3 Е/100 PYs), бактериальный артрит и сепсис (0,2 Е/100 PYs каждого). Остальные SIEs докладывались на ≤0.1 Е/100 PYs.
При скрининге, 1272 (13.5%) пациентов были диагностированы с LTBI положительная туберкулиновая кожная проба. В течение периода наблюдения 18 пациентов преобразованы в LTBI статус (<0.01 Е/100 PYs). Шестьдесят три активные события туберкулез отмечены у 59 пациентов (0.3 Е/100 PYs).
Во всех исследованиях РА, 40 оппортунистических инфекций, исключая кандидоз полости рта, Hz и ТБ были зарегистрированы у 35 пациентов в размере 0,2 Е/100 PYs. Наиболее часто сообщаемым оппортунистическими инфекциями были кандидоз пищевода (<0.1 Е/100 PYs) и coccidiomycosis, цитомегаловирусной инфекции и микобактерий avium комплексная инфекцией (<0.1 Е/100 PYs).
Вакцинация против гриппа
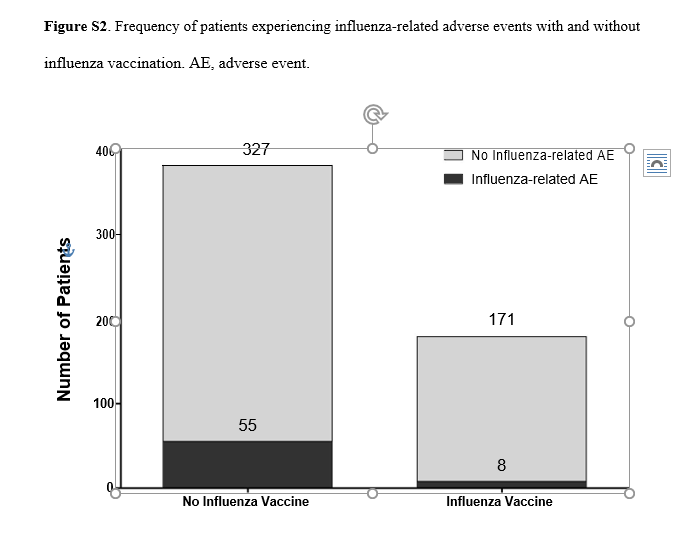
В Post hoc-анализе, использование 7 вакцин было оценена в 553 пациентов с РА, получавших ≥1 дозы адалимумаба на срок до 10 лет (в среднем 5,6 лет). Сто восемьдесят пациентов (32.5%) получили прививки по усмотрению исследователя (средняя Длительность заболевания 14 лет при первой вакцинации). Из них 171 (30.9%) получили хотя бы одну вакцинацию против гриппа, в общей сложности 351 прививка от гриппа проведены. Связанных с гриппом AEs произошла в 5% (8/171) вакцинированных пациентов по сравнению с 14% (55/382) пациентов, не вакцинированных в ходе исследования (см. в интернете дополнительный рисунок S2).
 Лабораторные показатели
Гематология
Лабораторные показатели
Гематология
После 6 месяцев лечения, заболеваемость умеренной анемия (HB 8,0 до <10 г/л) была достоверно меньше у пациентов, получавших адалимумаб и Метотрексат как для раннего (р<0,05) и давнего РА (р<0,05). Значимое повышение уровня гемоглобина было выше у пациентов, получавших адалимумаб и Метотрексат при раннем (р<0,05) и давнем РА (р<0,05) (Таблица 2).
Таблица 2
Частота и средние изменения от исходного значения НВ за 6 месяцев лечения в двух исследованиях у пациентов с ранним РА, и одном у пациентов с давним РА
Table 2
Frequency and mean change from baseline in Hb values at 6 months of treatment in two studies in patients with early RA,4 5 and one in long-standing patients with RA6
| Early RA |
Long-standing RA |
| Placebo-plus-MTX
N=774 |
Adalimumab-plus-MTX
N=783 |
Placebo-plus-MTX
N=200 |
Adalimumab-plus-MTX
N=207 |
| Anaemia |
| Hb<10.0–8.0 g/dL |
55 (7.1) |
28 (3.6) * |
11 (5.5) |
3 (1.4) * |
| Hb<8.0–6.5 g/dL |
4 (0.5) |
2 (0.3) |
0 |
0 |
| Hb decreased |
| Hb decrease 1.0–3.0 g/dL |
263 (34.0) |
176 (22.5) * |
71 (35.5) |
45 (21.7) * |
| Hb decrease >3.0 g/dL |
3 (0.4) |
0 |
1 (0.5) |
2 (1.0) |
| Hb, mean change (g/dL) |
−0.24 |
+0.45* |
−0.18 |
+0.44* |
- Значения указаны как n (%), если не указано иное.
- *p <0,05 для адалимумаб-плюс-mtx в сравнении с МТХ-монотерапия. тест χ2 по частоте.
- • НВ, гемоглобина; МТ, Метотрексат; РА, ревматоидный артрит
- Values are listed as n (%) unless otherwise indicated.
- *p<0.05 for adalimumab-plus-MTX versus MTX-monotherapy. χ2 test for frequency rates.
- Hb, haemoglobin; MTX, methotrexate; RA, rheumatoid arthritis.
Метаболические
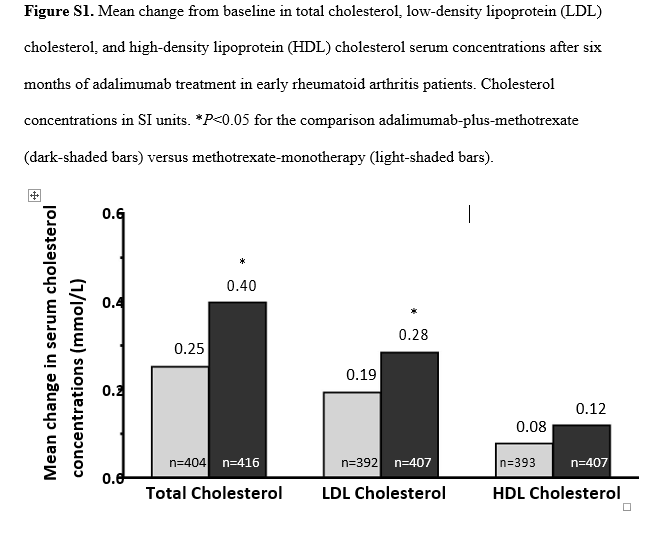
На базовом уровне, имею в виду до приема пищи ОХС, ЛПНП и ЛПВП были 4.974 ммоль/л (192 мг/дл), 2.851 ммоль/л (110 мг/дл) и 1.423 ммоль/л (55 мг/дл), соответственно, в адалимумаба и метотрексата в дозе группу и 5.337 ммоль/л (206 мг/дл), 3.146 ммоль/л (121 мг/дл) и 1.562 ммоль/л (60 мг/дл), соответственно, в МТХ-монотерапия группы. После 6 месяцев, имеются изменения в ТК и ЛПНП которые были выше у пациентов, получавших адалимумаб и Метотрексат по сравнению с МТХ-монотерапия (см. в интернете дополнительный рисунок S1).
Это значит, что ЛПВП не отличается в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия. Повышение в ТС и LDL концентрации в обеих группах были незначительными и клинически не значимо. На базовом уровне, имеется в виду Apo A-1, Apo B и липопротеина были 131, 81 и 20 мг/дл, соответственно, в адалимумаб-плюс-МТХ группы и 131, 81 и 21 мг/дл, соответственно, в МТХ-монотерапия группы. Значит, Apo A-1, Apo B и ХС липопротеидов изменения не различались в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия.
Облучение во время беременности
В общей сложности 154 женщин (74 подвержены адалимумаб, 80 С РА не получавших адалимумаб) зачислены в регистр OTIS. Средний гестационный возраст на момент родов живых детей был одинаков между двумя группами (38.5 против 38.2 недели, р=0.30). Из 74 беременных женщин, подвергшихся воздействию адалимумаб, примерно 40%, 16% и 44% используют адалимумаб только в первом триместре, в течение двух триместров и на протяжении всей беременности, соответственно. В соответствии с протоколом, МТХ не разрешается использовать одновременно с адалимумабом в регистре OTIS беременности. Тем не менее, было пять пациентов, используя адалимумаб и Метотрексат при включении в регистр OTIS и никто не получал mtx в контроле населения РА.
Частоты и RR основных врожденных дефектов (Таблица 3) не отличались между адалимумаб-леченными(экспонированным) женщинами, неэкспонированные женщин с РА и здоровых женщин. Среди специфических дефектов рождения в когорте адалимумаба, ни одного закономерности не было очевиден. Конкретных большие врожденных дефектов в адалимумаб-экспонированной когорты были дефект межжелудочковой перегородки (разрешен. resolved), микроцефалия и неопустившееся яичко. В когорте РА, дефект межжелудочковой перегородки (разрешен), микроцефалия, эквиноварусная косолапость, катаракта (не указано иное (not otherwise specified (NOS)) и хромосомные аномалии NOS наблюдалось. Кроме того, уровень ≥3 малые врожденные дефекты были одинаковы между тремя когортами, без двух младенцев в адалимумаб-облученной группы, имеющие те же три незначительные аномалии.
Таблица 3
Исходы беременностей у женщин с РА подвергнутых терапии адалимумабом по сравнению с беременными женщинами с РА не подвергавшимся терапии адалимумабом и беременных женщин без аутоиммунных заболеваний
Table 3
Outcomes of pregnant women with RA exposed to adalimumab compared with pregnant women with RA not exposed to adalimumab and to pregnant women without autoimmune disease
| Adalimumab-exposed cohort
N=74
n (%) |
RA Comparison cohort
N=80
n (%) |
RR (95% CI) |
Healthy cohort
N=219
n (%) |
RR (95% CI) |
| Live births(живорожденные) |
65 (87.8) |
74 (92.5) |
0.95 (0.85 to 1.05) |
198 (90.4) |
0.97 (0.88 to 1.07) |
| Major birth defects among live births (большие врожденные дефекты среди живорожденных) |
3/65 (4.6) |
4/74 (5.4) |
0.75* (0.13 to 3.61) |
10/198 (5.1) |
0.91 (0.26 to 3.22) |
| Major birth defects among all pregnancies (большие врожденные дефекты среди всех беременностей) |
3/72 (4.2) |
5/77 (6.5) |
0.72* (0.14 to 3.50) |
10/202 (5.0) |
0.77 (0.22 to 2.67) |
| ≥3 Minor malformations† (малые марфрльмации) |
12/45 (26.7) |
18/64 (28.1) |
1.15‡ (0.43 to 3.08) |
31/123 (25.2) |
1.06 § (0.41 to 2.53) |
- *С поправкой на тяжесть заболевания РА (ухудшение) мера; отрегулировать или и 95% ДИ определяется как оценка скорректированного ОР и 95% ДИ.
- †Отражает количество с доказательством мелких пороков развития у детей, получающих дисморфологическую экспертизы.
- ‡Поправкой на уровень образования матерей, мер тяжести заболевания РА (нарушение зрения, боль) и пол ребенка; скорректировать или и 95% ДИ представлены как оценки скорректированный ОР и 95% ДИ.
- § Скорректированы для применения преднизолон; отрегулировать ОР или и 95% ДИ представлены как оценки скорректированный ОР и 95% ДИ.
- РА, ревматоидный артрит; ОР относительный риск.
- *Adjusted for RA disease severity (impairment) measure; adjusted OR and 95% CI is reported as an estimate of the adjusted RR and 95% CI.
- †Reflects the number with pattern of minor malformations among infants receiving dysmorphological examination.
- ‡Adjusted for maternal education, RA disease severity measures (impairment, pain) and sex of infant; adjusted OR and 95% CI are reported as estimates of the adjusted RR and 95% CI.
- §Adjusted for prednisone use; adjusted OR and 95% CI are reported as estimates of the adjusted RR and 95% CI.
- RA, rheumatoid arthritis; RR, relative risk.
Скорректированный HR для самопроизвольного аборта в адалимумаб-экспонированной когорте по отношению к группе сравнения РА не был значительно повышен (скорректированное HR =2.06, 95% ДИ от 0,53 до 7.98), однако количество событий был мал (N=10). О мертворождениях, в адалимумаб-экспонированной когорты не сообщалось. Преждевременные роды произошли при аналогичных показателях между адалимумаб-экспонированными и группами сравнения РА (скорректированное HR =1.08, 95% ДИ 0.41 до 2,83).
Обсуждение
Анти-ФНО терапии связано с повышенным риском инфекций. Спектр инфекций, зарегистрированных здесь похож на те, о которых сообщалось с другими анти-TNFs в обоих рандомизированных клинических исследований и регистров, и видах инфекций, не изменяются с течением времени.
Оппортунистических инфекций, хотя и редко, могут быть сложные с диагностической точки зрения, учитывая различные возможные бактериальные, микобактериальные, грибковые, вирусные и паразитарные агенты. В последнее время наблюдается большой интерес к HZ. Общий уровень при адалимумабом была низким и аналогичной распространенности в реестрах и большом количестве датабаз. Это говорит о том, что применение анти-ФНО терапии не может поставить пациентов на более высоком риске HZ, но риск: выгода от вакцинации до начала биологической терапии остается убедительным.
В целом, влияние адалимумаба на HB и показателей липидов не предлагает никаких новых сигналов безопасности в отношении МТХ-монотерапия, при раннем и давнем РА. Мониторинг изменений липидного обмена имеет особое значение, поскольку риск развития сердечно-сосудистых событий может быть увеличен в РА.
Плановая вакцинация пациентов с РА с Non-живые агенты, даже в условиях продолжающейся анти-ФНО терапии, рекомендован Консультативным Комитетом по практике иммунизации. Однако, осознание этого представляется низкой, поскольку меньшинство пациентов с РА при начале терапии адалимумабом в наших исследованиях получили вакцинацию против гриппа. Пациенты, которые получили эту вакцину четко представлены с меньшим количеством связанных с гриппом AEs в среднем 5,6 лет последующем наблюдении, по сравнению с пациентов, не получавших вакцину.
Как и другие анти-TNFs, адалимумаб классифицируется FDA (US Food and Drug Administration) при беременности в категория B (без документальной токсичности человека) в США. Исследование репродуктивных животных не выявлено никаких свидетельств вреда плода из-за адалимумаб, но только небольшое количество адалимумаб-воздействии человека беременность были опубликованы на сегодняшний день. Регистр OTIS не сообщали, ни определенной специфических дефектов в адалимумаб-младенцев в период внутриутробного развития и неблагоприятных исходах беременности.
Сильные стороны и ограничения
Сила анализа безопасности адалимумаба включают в себя количество пациентов, длительность воздействия адалимумаб и тщательный мониторинг в клинических испытаниях по сравнению с постмаркетингового наблюдения или неинтервенционных исследований. Наш акцент был сделан на аспекты безопасности, которые не были широко опубликованы по адалимумабу или других анти-TNFs.
Ограничение этого анализа клинических исследований не могут в полной мере отражать клиническую практику, из-за предвзятости отбора групп населения, выживания участников и сопутствующих заболеваний. Сравнение с другими методами лечения ограничены из-за отсутствия контрольной группы с каким -либо активным лечением.
Выводы
Анализ этой большой базы данных клинических исследований у пациентов с умеренным и тяжелым РА обновляет и подтверждает известный профиль безопасности адалимумаба в отношении инфекций, лабораторной патологии, реактивации гепатита В и неблагоприятных исходы беременности. Наконец, польза вакцинации против гриппа у пациентов с РА усилена.

 В регистр беременностей, получивших Адалимумаб (Adalimumab Pregnancy Exposure Registry (APER)) продолжается проспективное, обсервационное, экспозиция когортного исследования, проведенного в Северной Америке, чтобы контролировать исход беременности у женщин с РА получивших адалимумаба во время беременности по сравнению с болезнью-отобранных групп женщин с РА, которые не использовали адалимумаба во время беременности и в когорте здоровых беременных женщин. Это когортное исследование проводится организацией специалистов по Тератологии (Organization of Teratology Information Specialists (OTIS). Данные собираются с 1 февраля 2004 года по 5 ноября 2013 года.
Дополнительные данные*
Оценки безопасности и статистические анализы
Безопасности населения состоит в наблюдении пациентов с любым использованием адалимумаба от первой дозы через 70 дней (пять периодов полураспада) после последнего наблюдаемой дозы. Серьезные НЯ (Serious AE (SAE)) определяется как фатальные или непосредственно угрожающие жизни; требует госпитализации или длительной госпитализации; привело к стойкой или выраженной нетрудоспособности/инвалидности, врожденной аномалии или требует медицинского, или хирургического вмешательства для предотвращения серьезных последствий. НЯ были обобщены в качестве событий/100 пациенто-лет (Е/100 PY) воздействия адалимумаб, используя предпочтительные термины из медицинского словаря для регуляторной деятельности (MedDRA) Regulatory Activities (MedDRA) V.15.1 (http://www.meddra.org).
В регистр беременностей, получивших Адалимумаб (Adalimumab Pregnancy Exposure Registry (APER)) продолжается проспективное, обсервационное, экспозиция когортного исследования, проведенного в Северной Америке, чтобы контролировать исход беременности у женщин с РА получивших адалимумаба во время беременности по сравнению с болезнью-отобранных групп женщин с РА, которые не использовали адалимумаба во время беременности и в когорте здоровых беременных женщин. Это когортное исследование проводится организацией специалистов по Тератологии (Organization of Teratology Information Specialists (OTIS). Данные собираются с 1 февраля 2004 года по 5 ноября 2013 года.
Дополнительные данные*
Оценки безопасности и статистические анализы
Безопасности населения состоит в наблюдении пациентов с любым использованием адалимумаба от первой дозы через 70 дней (пять периодов полураспада) после последнего наблюдаемой дозы. Серьезные НЯ (Serious AE (SAE)) определяется как фатальные или непосредственно угрожающие жизни; требует госпитализации или длительной госпитализации; привело к стойкой или выраженной нетрудоспособности/инвалидности, врожденной аномалии или требует медицинского, или хирургического вмешательства для предотвращения серьезных последствий. НЯ были обобщены в качестве событий/100 пациенто-лет (Е/100 PY) воздействия адалимумаб, используя предпочтительные термины из медицинского словаря для регуляторной деятельности (MedDRA) Regulatory Activities (MedDRA) V.15.1 (http://www.meddra.org).
 AEs интересов включены SIEs, туберкулез, оппортунистические инфекции, опоясывающего лишая (herpes zoster (HZ)) и гепатита В реактивация.
Процент пациентов, у которых развилась анемия в течение первых 6 месяцев терапии адалимумабом были определены в двух исследованиях у пациентов с ранним (<1 года), и одна с давнего РА (>1 года). Среднее изменение от исходного уровня в сыворотке до приема пищи концентрация липидов (общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП) и липопротеинов низкой плотности (ЛПНП)) и гемоглобина (HB) сравнивались между адалимумабом и метотрексатом (mtx) и плацебо плюс Метотрексат (Метотрексат-монотерапия) на 26 неделе в исследовании OPTIMA с помощью различий в анализах путем дисперсионного анализа.
Риски НЯ связанные с гриппом после вакцинации против гриппа были оценены в адалимумаба у пациентов с РА на 10 лет. НЯ, связанных с вирусной инфекцией гриппа (в течение 270 дней от вакцинации) были сведены в таблицу, используя предопределенный запрос MedDRA.
Все беременности зачислены в реестре OTIS беременности, который достиг исхода беременности, к ноябрю 2013 года были включены. Исходы беременности включали живорождений, большие и малые врожденные пороки развития, самопроизвольные аборты, преждевременные роды (<37 недель) и средний гестационный возраст во время родов. Беременность открытыми для mtx были исключены, из-за известных тератогенности. Материнской характеристики сравнивались между когортами, используя χ2-тесты за независимость. По сообщенным исходам беременности с живорождением, основные дефекты рождения и ≥3 мелкие дефекты рождения, точечной оценке относительного риска (ОР) и 95% ДИ для адалимумаб-облученной группе по сравнению с контрольная группа была вычислена. Основным результатом серьезных врожденных дефектов оценивали всех беременностей заканчивается по крайней мере одного живого ребенка, а во вторую очередь всех беременностей с известным исходом. Детей с ≥3 малые аномалии были оценены, чтобы идентифицировать любые случаи с теми же тремя конкретных аномалий в пределах каждой группы. Для оценки кумулятивной вероятности спонтанного аборта, были использованы для Каплана–Мейера (Kaplan–Meier (KM) анализ только женщинам, которые зарегистрированы с <20 недель беременности. Модели пропорциональных рисков были использованы для оценки HRs и 95% Cis
Результаты
Пациенты
До 31 декабря 2012 года, адалимумаб вводили 15 152 пациентов в исследованиях RA, что составляет 24 810 PYs воздействия адалимумаба. Показатели заболеваемости представлены в таблице 1, включают показатели как серьезных, так и несерьезных НЯ.
Таблица 1
Частота неблагоприятных событий у пациентов с ревматоидным артритом пролеченных адалимумабом (п=15 152; 24,810.4 PYs)
Incidence rates of adverse events of interest in patients with rheumatoid arthritis treated with adalimumab (N=15 152; 24,810.4 PYs)
AEs интересов включены SIEs, туберкулез, оппортунистические инфекции, опоясывающего лишая (herpes zoster (HZ)) и гепатита В реактивация.
Процент пациентов, у которых развилась анемия в течение первых 6 месяцев терапии адалимумабом были определены в двух исследованиях у пациентов с ранним (<1 года), и одна с давнего РА (>1 года). Среднее изменение от исходного уровня в сыворотке до приема пищи концентрация липидов (общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП) и липопротеинов низкой плотности (ЛПНП)) и гемоглобина (HB) сравнивались между адалимумабом и метотрексатом (mtx) и плацебо плюс Метотрексат (Метотрексат-монотерапия) на 26 неделе в исследовании OPTIMA с помощью различий в анализах путем дисперсионного анализа.
Риски НЯ связанные с гриппом после вакцинации против гриппа были оценены в адалимумаба у пациентов с РА на 10 лет. НЯ, связанных с вирусной инфекцией гриппа (в течение 270 дней от вакцинации) были сведены в таблицу, используя предопределенный запрос MedDRA.
Все беременности зачислены в реестре OTIS беременности, который достиг исхода беременности, к ноябрю 2013 года были включены. Исходы беременности включали живорождений, большие и малые врожденные пороки развития, самопроизвольные аборты, преждевременные роды (<37 недель) и средний гестационный возраст во время родов. Беременность открытыми для mtx были исключены, из-за известных тератогенности. Материнской характеристики сравнивались между когортами, используя χ2-тесты за независимость. По сообщенным исходам беременности с живорождением, основные дефекты рождения и ≥3 мелкие дефекты рождения, точечной оценке относительного риска (ОР) и 95% ДИ для адалимумаб-облученной группе по сравнению с контрольная группа была вычислена. Основным результатом серьезных врожденных дефектов оценивали всех беременностей заканчивается по крайней мере одного живого ребенка, а во вторую очередь всех беременностей с известным исходом. Детей с ≥3 малые аномалии были оценены, чтобы идентифицировать любые случаи с теми же тремя конкретных аномалий в пределах каждой группы. Для оценки кумулятивной вероятности спонтанного аборта, были использованы для Каплана–Мейера (Kaplan–Meier (KM) анализ только женщинам, которые зарегистрированы с <20 недель беременности. Модели пропорциональных рисков были использованы для оценки HRs и 95% Cis
Результаты
Пациенты
До 31 декабря 2012 года, адалимумаб вводили 15 152 пациентов в исследованиях RA, что составляет 24 810 PYs воздействия адалимумаба. Показатели заболеваемости представлены в таблице 1, включают показатели как серьезных, так и несерьезных НЯ.
Таблица 1
Частота неблагоприятных событий у пациентов с ревматоидным артритом пролеченных адалимумабом (п=15 152; 24,810.4 PYs)
Incidence rates of adverse events of interest in patients with rheumatoid arthritis treated with adalimumab (N=15 152; 24,810.4 PYs)
 Лабораторные показатели
Гематология
После 6 месяцев лечения, заболеваемость умеренной анемия (HB 8,0 до <10 г/л) была достоверно меньше у пациентов, получавших адалимумаб и Метотрексат как для раннего (р<0,05) и давнего РА (р<0,05). Значимое повышение уровня гемоглобина было выше у пациентов, получавших адалимумаб и Метотрексат при раннем (р<0,05) и давнем РА (р<0,05) (Таблица 2).
Таблица 2
Частота и средние изменения от исходного значения НВ за 6 месяцев лечения в двух исследованиях у пациентов с ранним РА, и одном у пациентов с давним РА
Table 2
Frequency and mean change from baseline in Hb values at 6 months of treatment in two studies in patients with early RA,4 5 and one in long-standing patients with RA6
Лабораторные показатели
Гематология
После 6 месяцев лечения, заболеваемость умеренной анемия (HB 8,0 до <10 г/л) была достоверно меньше у пациентов, получавших адалимумаб и Метотрексат как для раннего (р<0,05) и давнего РА (р<0,05). Значимое повышение уровня гемоглобина было выше у пациентов, получавших адалимумаб и Метотрексат при раннем (р<0,05) и давнем РА (р<0,05) (Таблица 2).
Таблица 2
Частота и средние изменения от исходного значения НВ за 6 месяцев лечения в двух исследованиях у пациентов с ранним РА, и одном у пациентов с давним РА
Table 2
Frequency and mean change from baseline in Hb values at 6 months of treatment in two studies in patients with early RA,4 5 and one in long-standing patients with RA6
 Это значит, что ЛПВП не отличается в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия. Повышение в ТС и LDL концентрации в обеих группах были незначительными и клинически не значимо. На базовом уровне, имеется в виду Apo A-1, Apo B и липопротеина были 131, 81 и 20 мг/дл, соответственно, в адалимумаб-плюс-МТХ группы и 131, 81 и 21 мг/дл, соответственно, в МТХ-монотерапия группы. Значит, Apo A-1, Apo B и ХС липопротеидов изменения не различались в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия.
Облучение во время беременности
В общей сложности 154 женщин (74 подвержены адалимумаб, 80 С РА не получавших адалимумаб) зачислены в регистр OTIS. Средний гестационный возраст на момент родов живых детей был одинаков между двумя группами (38.5 против 38.2 недели, р=0.30). Из 74 беременных женщин, подвергшихся воздействию адалимумаб, примерно 40%, 16% и 44% используют адалимумаб только в первом триместре, в течение двух триместров и на протяжении всей беременности, соответственно. В соответствии с протоколом, МТХ не разрешается использовать одновременно с адалимумабом в регистре OTIS беременности. Тем не менее, было пять пациентов, используя адалимумаб и Метотрексат при включении в регистр OTIS и никто не получал mtx в контроле населения РА.
Частоты и RR основных врожденных дефектов (Таблица 3) не отличались между адалимумаб-леченными(экспонированным) женщинами, неэкспонированные женщин с РА и здоровых женщин. Среди специфических дефектов рождения в когорте адалимумаба, ни одного закономерности не было очевиден. Конкретных большие врожденных дефектов в адалимумаб-экспонированной когорты были дефект межжелудочковой перегородки (разрешен. resolved), микроцефалия и неопустившееся яичко. В когорте РА, дефект межжелудочковой перегородки (разрешен), микроцефалия, эквиноварусная косолапость, катаракта (не указано иное (not otherwise specified (NOS)) и хромосомные аномалии NOS наблюдалось. Кроме того, уровень ≥3 малые врожденные дефекты были одинаковы между тремя когортами, без двух младенцев в адалимумаб-облученной группы, имеющие те же три незначительные аномалии.
Таблица 3
Исходы беременностей у женщин с РА подвергнутых терапии адалимумабом по сравнению с беременными женщинами с РА не подвергавшимся терапии адалимумабом и беременных женщин без аутоиммунных заболеваний
Table 3
Outcomes of pregnant women with RA exposed to adalimumab compared with pregnant women with RA not exposed to adalimumab and to pregnant women without autoimmune disease
Это значит, что ЛПВП не отличается в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия. Повышение в ТС и LDL концентрации в обеих группах были незначительными и клинически не значимо. На базовом уровне, имеется в виду Apo A-1, Apo B и липопротеина были 131, 81 и 20 мг/дл, соответственно, в адалимумаб-плюс-МТХ группы и 131, 81 и 21 мг/дл, соответственно, в МТХ-монотерапия группы. Значит, Apo A-1, Apo B и ХС липопротеидов изменения не различались в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия.
Облучение во время беременности
В общей сложности 154 женщин (74 подвержены адалимумаб, 80 С РА не получавших адалимумаб) зачислены в регистр OTIS. Средний гестационный возраст на момент родов живых детей был одинаков между двумя группами (38.5 против 38.2 недели, р=0.30). Из 74 беременных женщин, подвергшихся воздействию адалимумаб, примерно 40%, 16% и 44% используют адалимумаб только в первом триместре, в течение двух триместров и на протяжении всей беременности, соответственно. В соответствии с протоколом, МТХ не разрешается использовать одновременно с адалимумабом в регистре OTIS беременности. Тем не менее, было пять пациентов, используя адалимумаб и Метотрексат при включении в регистр OTIS и никто не получал mtx в контроле населения РА.
Частоты и RR основных врожденных дефектов (Таблица 3) не отличались между адалимумаб-леченными(экспонированным) женщинами, неэкспонированные женщин с РА и здоровых женщин. Среди специфических дефектов рождения в когорте адалимумаба, ни одного закономерности не было очевиден. Конкретных большие врожденных дефектов в адалимумаб-экспонированной когорты были дефект межжелудочковой перегородки (разрешен. resolved), микроцефалия и неопустившееся яичко. В когорте РА, дефект межжелудочковой перегородки (разрешен), микроцефалия, эквиноварусная косолапость, катаракта (не указано иное (not otherwise specified (NOS)) и хромосомные аномалии NOS наблюдалось. Кроме того, уровень ≥3 малые врожденные дефекты были одинаковы между тремя когортами, без двух младенцев в адалимумаб-облученной группы, имеющие те же три незначительные аномалии.
Таблица 3
Исходы беременностей у женщин с РА подвергнутых терапии адалимумабом по сравнению с беременными женщинами с РА не подвергавшимся терапии адалимумабом и беременных женщин без аутоиммунных заболеваний
Table 3
Outcomes of pregnant women with RA exposed to adalimumab compared with pregnant women with RA not exposed to adalimumab and to pregnant women without autoimmune disease

 В регистр беременностей, получивших Адалимумаб (Adalimumab Pregnancy Exposure Registry (APER)) продолжается проспективное, обсервационное, экспозиция когортного исследования, проведенного в Северной Америке, чтобы контролировать исход беременности у женщин с РА получивших адалимумаба во время беременности по сравнению с болезнью-отобранных групп женщин с РА, которые не использовали адалимумаба во время беременности и в когорте здоровых беременных женщин. Это когортное исследование проводится организацией специалистов по Тератологии (Organization of Teratology Information Specialists (OTIS). Данные собираются с 1 февраля 2004 года по 5 ноября 2013 года.
Дополнительные данные*
Оценки безопасности и статистические анализы
Безопасности населения состоит в наблюдении пациентов с любым использованием адалимумаба от первой дозы через 70 дней (пять периодов полураспада) после последнего наблюдаемой дозы. Серьезные НЯ (Serious AE (SAE)) определяется как фатальные или непосредственно угрожающие жизни; требует госпитализации или длительной госпитализации; привело к стойкой или выраженной нетрудоспособности/инвалидности, врожденной аномалии или требует медицинского, или хирургического вмешательства для предотвращения серьезных последствий. НЯ были обобщены в качестве событий/100 пациенто-лет (Е/100 PY) воздействия адалимумаб, используя предпочтительные термины из медицинского словаря для регуляторной деятельности (MedDRA) Regulatory Activities (MedDRA) V.15.1 (http://www.meddra.org).
В регистр беременностей, получивших Адалимумаб (Adalimumab Pregnancy Exposure Registry (APER)) продолжается проспективное, обсервационное, экспозиция когортного исследования, проведенного в Северной Америке, чтобы контролировать исход беременности у женщин с РА получивших адалимумаба во время беременности по сравнению с болезнью-отобранных групп женщин с РА, которые не использовали адалимумаба во время беременности и в когорте здоровых беременных женщин. Это когортное исследование проводится организацией специалистов по Тератологии (Organization of Teratology Information Specialists (OTIS). Данные собираются с 1 февраля 2004 года по 5 ноября 2013 года.
Дополнительные данные*
Оценки безопасности и статистические анализы
Безопасности населения состоит в наблюдении пациентов с любым использованием адалимумаба от первой дозы через 70 дней (пять периодов полураспада) после последнего наблюдаемой дозы. Серьезные НЯ (Serious AE (SAE)) определяется как фатальные или непосредственно угрожающие жизни; требует госпитализации или длительной госпитализации; привело к стойкой или выраженной нетрудоспособности/инвалидности, врожденной аномалии или требует медицинского, или хирургического вмешательства для предотвращения серьезных последствий. НЯ были обобщены в качестве событий/100 пациенто-лет (Е/100 PY) воздействия адалимумаб, используя предпочтительные термины из медицинского словаря для регуляторной деятельности (MedDRA) Regulatory Activities (MedDRA) V.15.1 (http://www.meddra.org).
 AEs интересов включены SIEs, туберкулез, оппортунистические инфекции, опоясывающего лишая (herpes zoster (HZ)) и гепатита В реактивация.
Процент пациентов, у которых развилась анемия в течение первых 6 месяцев терапии адалимумабом были определены в двух исследованиях у пациентов с ранним (<1 года), и одна с давнего РА (>1 года). Среднее изменение от исходного уровня в сыворотке до приема пищи концентрация липидов (общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП) и липопротеинов низкой плотности (ЛПНП)) и гемоглобина (HB) сравнивались между адалимумабом и метотрексатом (mtx) и плацебо плюс Метотрексат (Метотрексат-монотерапия) на 26 неделе в исследовании OPTIMA с помощью различий в анализах путем дисперсионного анализа.
Риски НЯ связанные с гриппом после вакцинации против гриппа были оценены в адалимумаба у пациентов с РА на 10 лет. НЯ, связанных с вирусной инфекцией гриппа (в течение 270 дней от вакцинации) были сведены в таблицу, используя предопределенный запрос MedDRA.
Все беременности зачислены в реестре OTIS беременности, который достиг исхода беременности, к ноябрю 2013 года были включены. Исходы беременности включали живорождений, большие и малые врожденные пороки развития, самопроизвольные аборты, преждевременные роды (<37 недель) и средний гестационный возраст во время родов. Беременность открытыми для mtx были исключены, из-за известных тератогенности. Материнской характеристики сравнивались между когортами, используя χ2-тесты за независимость. По сообщенным исходам беременности с живорождением, основные дефекты рождения и ≥3 мелкие дефекты рождения, точечной оценке относительного риска (ОР) и 95% ДИ для адалимумаб-облученной группе по сравнению с контрольная группа была вычислена. Основным результатом серьезных врожденных дефектов оценивали всех беременностей заканчивается по крайней мере одного живого ребенка, а во вторую очередь всех беременностей с известным исходом. Детей с ≥3 малые аномалии были оценены, чтобы идентифицировать любые случаи с теми же тремя конкретных аномалий в пределах каждой группы. Для оценки кумулятивной вероятности спонтанного аборта, были использованы для Каплана–Мейера (Kaplan–Meier (KM) анализ только женщинам, которые зарегистрированы с <20 недель беременности. Модели пропорциональных рисков были использованы для оценки HRs и 95% Cis
Результаты
Пациенты
До 31 декабря 2012 года, адалимумаб вводили 15 152 пациентов в исследованиях RA, что составляет 24 810 PYs воздействия адалимумаба. Показатели заболеваемости представлены в таблице 1, включают показатели как серьезных, так и несерьезных НЯ.
Таблица 1
Частота неблагоприятных событий у пациентов с ревматоидным артритом пролеченных адалимумабом (п=15 152; 24,810.4 PYs)
Incidence rates of adverse events of interest in patients with rheumatoid arthritis treated with adalimumab (N=15 152; 24,810.4 PYs)
AEs интересов включены SIEs, туберкулез, оппортунистические инфекции, опоясывающего лишая (herpes zoster (HZ)) и гепатита В реактивация.
Процент пациентов, у которых развилась анемия в течение первых 6 месяцев терапии адалимумабом были определены в двух исследованиях у пациентов с ранним (<1 года), и одна с давнего РА (>1 года). Среднее изменение от исходного уровня в сыворотке до приема пищи концентрация липидов (общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП) и липопротеинов низкой плотности (ЛПНП)) и гемоглобина (HB) сравнивались между адалимумабом и метотрексатом (mtx) и плацебо плюс Метотрексат (Метотрексат-монотерапия) на 26 неделе в исследовании OPTIMA с помощью различий в анализах путем дисперсионного анализа.
Риски НЯ связанные с гриппом после вакцинации против гриппа были оценены в адалимумаба у пациентов с РА на 10 лет. НЯ, связанных с вирусной инфекцией гриппа (в течение 270 дней от вакцинации) были сведены в таблицу, используя предопределенный запрос MedDRA.
Все беременности зачислены в реестре OTIS беременности, который достиг исхода беременности, к ноябрю 2013 года были включены. Исходы беременности включали живорождений, большие и малые врожденные пороки развития, самопроизвольные аборты, преждевременные роды (<37 недель) и средний гестационный возраст во время родов. Беременность открытыми для mtx были исключены, из-за известных тератогенности. Материнской характеристики сравнивались между когортами, используя χ2-тесты за независимость. По сообщенным исходам беременности с живорождением, основные дефекты рождения и ≥3 мелкие дефекты рождения, точечной оценке относительного риска (ОР) и 95% ДИ для адалимумаб-облученной группе по сравнению с контрольная группа была вычислена. Основным результатом серьезных врожденных дефектов оценивали всех беременностей заканчивается по крайней мере одного живого ребенка, а во вторую очередь всех беременностей с известным исходом. Детей с ≥3 малые аномалии были оценены, чтобы идентифицировать любые случаи с теми же тремя конкретных аномалий в пределах каждой группы. Для оценки кумулятивной вероятности спонтанного аборта, были использованы для Каплана–Мейера (Kaplan–Meier (KM) анализ только женщинам, которые зарегистрированы с <20 недель беременности. Модели пропорциональных рисков были использованы для оценки HRs и 95% Cis
Результаты
Пациенты
До 31 декабря 2012 года, адалимумаб вводили 15 152 пациентов в исследованиях RA, что составляет 24 810 PYs воздействия адалимумаба. Показатели заболеваемости представлены в таблице 1, включают показатели как серьезных, так и несерьезных НЯ.
Таблица 1
Частота неблагоприятных событий у пациентов с ревматоидным артритом пролеченных адалимумабом (п=15 152; 24,810.4 PYs)
Incidence rates of adverse events of interest in patients with rheumatoid arthritis treated with adalimumab (N=15 152; 24,810.4 PYs)
 Лабораторные показатели
Гематология
После 6 месяцев лечения, заболеваемость умеренной анемия (HB 8,0 до <10 г/л) была достоверно меньше у пациентов, получавших адалимумаб и Метотрексат как для раннего (р<0,05) и давнего РА (р<0,05). Значимое повышение уровня гемоглобина было выше у пациентов, получавших адалимумаб и Метотрексат при раннем (р<0,05) и давнем РА (р<0,05) (Таблица 2).
Таблица 2
Частота и средние изменения от исходного значения НВ за 6 месяцев лечения в двух исследованиях у пациентов с ранним РА, и одном у пациентов с давним РА
Table 2
Frequency and mean change from baseline in Hb values at 6 months of treatment in two studies in patients with early RA,4 5 and one in long-standing patients with RA6
Лабораторные показатели
Гематология
После 6 месяцев лечения, заболеваемость умеренной анемия (HB 8,0 до <10 г/л) была достоверно меньше у пациентов, получавших адалимумаб и Метотрексат как для раннего (р<0,05) и давнего РА (р<0,05). Значимое повышение уровня гемоглобина было выше у пациентов, получавших адалимумаб и Метотрексат при раннем (р<0,05) и давнем РА (р<0,05) (Таблица 2).
Таблица 2
Частота и средние изменения от исходного значения НВ за 6 месяцев лечения в двух исследованиях у пациентов с ранним РА, и одном у пациентов с давним РА
Table 2
Frequency and mean change from baseline in Hb values at 6 months of treatment in two studies in patients with early RA,4 5 and one in long-standing patients with RA6
 Это значит, что ЛПВП не отличается в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия. Повышение в ТС и LDL концентрации в обеих группах были незначительными и клинически не значимо. На базовом уровне, имеется в виду Apo A-1, Apo B и липопротеина были 131, 81 и 20 мг/дл, соответственно, в адалимумаб-плюс-МТХ группы и 131, 81 и 21 мг/дл, соответственно, в МТХ-монотерапия группы. Значит, Apo A-1, Apo B и ХС липопротеидов изменения не различались в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия.
Облучение во время беременности
В общей сложности 154 женщин (74 подвержены адалимумаб, 80 С РА не получавших адалимумаб) зачислены в регистр OTIS. Средний гестационный возраст на момент родов живых детей был одинаков между двумя группами (38.5 против 38.2 недели, р=0.30). Из 74 беременных женщин, подвергшихся воздействию адалимумаб, примерно 40%, 16% и 44% используют адалимумаб только в первом триместре, в течение двух триместров и на протяжении всей беременности, соответственно. В соответствии с протоколом, МТХ не разрешается использовать одновременно с адалимумабом в регистре OTIS беременности. Тем не менее, было пять пациентов, используя адалимумаб и Метотрексат при включении в регистр OTIS и никто не получал mtx в контроле населения РА.
Частоты и RR основных врожденных дефектов (Таблица 3) не отличались между адалимумаб-леченными(экспонированным) женщинами, неэкспонированные женщин с РА и здоровых женщин. Среди специфических дефектов рождения в когорте адалимумаба, ни одного закономерности не было очевиден. Конкретных большие врожденных дефектов в адалимумаб-экспонированной когорты были дефект межжелудочковой перегородки (разрешен. resolved), микроцефалия и неопустившееся яичко. В когорте РА, дефект межжелудочковой перегородки (разрешен), микроцефалия, эквиноварусная косолапость, катаракта (не указано иное (not otherwise specified (NOS)) и хромосомные аномалии NOS наблюдалось. Кроме того, уровень ≥3 малые врожденные дефекты были одинаковы между тремя когортами, без двух младенцев в адалимумаб-облученной группы, имеющие те же три незначительные аномалии.
Таблица 3
Исходы беременностей у женщин с РА подвергнутых терапии адалимумабом по сравнению с беременными женщинами с РА не подвергавшимся терапии адалимумабом и беременных женщин без аутоиммунных заболеваний
Table 3
Outcomes of pregnant women with RA exposed to adalimumab compared with pregnant women with RA not exposed to adalimumab and to pregnant women without autoimmune disease
Это значит, что ЛПВП не отличается в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия. Повышение в ТС и LDL концентрации в обеих группах были незначительными и клинически не значимо. На базовом уровне, имеется в виду Apo A-1, Apo B и липопротеина были 131, 81 и 20 мг/дл, соответственно, в адалимумаб-плюс-МТХ группы и 131, 81 и 21 мг/дл, соответственно, в МТХ-монотерапия группы. Значит, Apo A-1, Apo B и ХС липопротеидов изменения не различались в адалимумаб-плюс-МТХ группы по сравнению с МТХ-монотерапия.
Облучение во время беременности
В общей сложности 154 женщин (74 подвержены адалимумаб, 80 С РА не получавших адалимумаб) зачислены в регистр OTIS. Средний гестационный возраст на момент родов живых детей был одинаков между двумя группами (38.5 против 38.2 недели, р=0.30). Из 74 беременных женщин, подвергшихся воздействию адалимумаб, примерно 40%, 16% и 44% используют адалимумаб только в первом триместре, в течение двух триместров и на протяжении всей беременности, соответственно. В соответствии с протоколом, МТХ не разрешается использовать одновременно с адалимумабом в регистре OTIS беременности. Тем не менее, было пять пациентов, используя адалимумаб и Метотрексат при включении в регистр OTIS и никто не получал mtx в контроле населения РА.
Частоты и RR основных врожденных дефектов (Таблица 3) не отличались между адалимумаб-леченными(экспонированным) женщинами, неэкспонированные женщин с РА и здоровых женщин. Среди специфических дефектов рождения в когорте адалимумаба, ни одного закономерности не было очевиден. Конкретных большие врожденных дефектов в адалимумаб-экспонированной когорты были дефект межжелудочковой перегородки (разрешен. resolved), микроцефалия и неопустившееся яичко. В когорте РА, дефект межжелудочковой перегородки (разрешен), микроцефалия, эквиноварусная косолапость, катаракта (не указано иное (not otherwise specified (NOS)) и хромосомные аномалии NOS наблюдалось. Кроме того, уровень ≥3 малые врожденные дефекты были одинаковы между тремя когортами, без двух младенцев в адалимумаб-облученной группы, имеющие те же три незначительные аномалии.
Таблица 3
Исходы беременностей у женщин с РА подвергнутых терапии адалимумабом по сравнению с беременными женщинами с РА не подвергавшимся терапии адалимумабом и беременных женщин без аутоиммунных заболеваний
Table 3
Outcomes of pregnant women with RA exposed to adalimumab compared with pregnant women with RA not exposed to adalimumab and to pregnant women without autoimmune disease



