Разработка и проверка оценки риска серьезной инфекции у пациентов с ревматоидным артритом
|
Краткое содержание и практическое применение результатов статьи «Разработка и проверка оценки риска серьезной инфекции у пациентов с ревматоидным артритом». (Development and validation of a risk score for serious infection in patients with rheumatoid arthritis) Arthritis Rheum2012;64:2847–55.doi:10.1002/art.34530 Риск инфицирования повышается у пациентов с ревматоидным артритом (РА). Точная оценка риска инфекции может служить основой для принятия клинических решений и формировать стратегию по сокращению и предотвращению возникновения этих инфекций. Это исследование было проведено для разработки и проверки оценка для прогнозирования 1-летнего риска серьезной инфекции у пациентов с РА. В течение 1955-1994, до января 2000 г наблюдалась по медицинской документации, когорта больных РА одного из штатов США. В состав валидации входили жители со случаем РА, который был установлен в 1995-2007 годах. Измерение исхода включало все серьезные инфекции (требующие госпитализации или внутривенные антибиотики). Потенциальные предикторов были рассмотрены с использованием многовариантных моделей Кокса. Оценка риска оценивалась непосредственно по многовариантной модели, а производительность оценивалась в когорте проверки с использованием статистики C Харрелла. Среди 584 пациентов РА в первоначальной когорте (72% женщин; средний возраст 57,5 лет), за которыми наблюдали в среднем 9,9 лет, 252 имели 1 серьезную инфекцию (646 случаев инфекции). Компоненты оценки риска включали возраст, предыдущую серьезную инфекцию, использование кортикостероидов, повышенную СОЭ, внеартикулярные проявления РА и сопутствующие заболевания (ишемическая болезнь сердца, сердечная недостаточность, периферические сосудистые заболевания, хронические заболевания легких, сахарный диабет, алкоголизм). У пациентов с ревматоидным артритом (РА) увеличена возрастно-скорректированная смертность от всех причин. Высокая частота оппортунистических и распространенных инфекций осложняет РА и частично способствует увеличению смертности. И другие потенциальные факторы риска инфекции, такие как лимфопения и нейтропения, которые обычно происходят в течение длительного течения болезни, до этого не были оценены при РА. Первоначальная когорта состояла из ранее собранной когорты Рочестера cohort of Rochester, штат Миннесота, жителей ≥ 18 лет, которые соответствовали 1987 Американский колледж ревматологии (ACR) критериям РА (применялись ретроспективно). Эта когорта была собрана с использованием ресурсов Рочестерского проекта эпидемиологии Rochester Epidemiology Project, который является медицинской системы связи записей, которая позволяет получить доступ к полной стационарной и амбулаторной медицинской документации испытуемых от всех поставщиков медицинских услуг. Для целей развития оценки риска инфекции были исключены пациенты при диагностике рака и с раком, а также несколько пациентов, которые получили биологические агенты. Лейкопения была определена как количество белых кровяных телец в размере <3.5 × 109/л, лимфопения в качестве лимфоцита кол-во от <0.9 × 109/л, и нейтропении в качестве нейтрофилов в виде нейтрофилов в размере <1.7 × 109/л в 2 и более случаях. Список потенциальных предикторов, рассматриваемых при разработке оценки риска для серьезной инфекции представлен в Таблице 1. Указаны критерии отбора сопутствующих заболеваний и данные по эпизодам инфекции. Незначительные инфекции верхних дыхательных путей и неосложнение инфекций мочевыводящих путей не включались. Серьезные инфекции были определены как инфекции, требующие госпитализации и/или внутривенного лечения антибиотиками. Объективно подтвержденные инфекции были определены как инфекции с положительными результатами микробиологической культуры и/или радиологической визуализации. Характеристики 994 пациентов со случаем РА, диагностированными между 1955 и 2007 годами представлены в Таблице 2. Многовариантные модели для оценки 1-летнего риска серьезной инфекции у пациентов с РА представлены в таблице 3. Эта модель, которая определяет балл риска для серьезной инфекции. Повышение возраста было связано с высоким риском инфицирования. Наибольший риск, выявлен в возрастных группах ≥80 лет по сравнению с пациентами в возрасте <60 лет). Предыдущая серьезная инфекция в прошлом году признанным сильным предиктором риска инфицирования. Повышенная СОЭ был также связана с риском заражения, с наибольшим риском, выявленным в тех, с СОЭ >50 мм/час. Использование кортикостероидов было зависимо от дозы, связанное с более высоким риском серьезной инфекции. Использование кортикостероидов в дозах до 10 мг в день повышает риск инфекций по сравнению с пациентами, не принимающими кортикостероиды. А ежедневная дозами> 10 мг повышает риск инфекций еще почти в 2 раза по сравнению с теми, кто не принимает кортикостероиды. Коэффициент риска hazard ratio (HR) по сопутствующих заболеваний, связанных с риском серьезной инфекции, составил: хронические заболевания легких HR= 1,56 сахарный диабет=HR 1,35 алкоголизм =HR 1,50 -2,16 ишемическая болезнь сердца HR= 1.47 сердечная недостаточность HR= 1.70 периферическая сосудистая болезнь HR= 1.50 *Для упрощения модели, сопутствующие коморбиды были объединены и моделируются как отсутствие сопутствующих состояний, 1 сопутствующих состояний, или >1 коорбидность. Наличие 1 коморбидности было связано с повышенным риском инфекции HR= 1,96 когда было >1 сопутствующих HR =2,79. Предварительное тестирование предсказало более высокий риск инфицирования, чем наблюдалось, рис 1. Была проведена перекалибровка когорт, которая улучшила оценки рисков, рис 2. При этом были получены данные о нескольких дополнительных факторах риска (лейкопении, лимфопении, нейтропении, уровня CRP и использования биологических агентов). Каждый из этих потенциальных предикторов был оценен путем добавления его в перекалиброванный рейтинг риска. Риск инфицирования был увеличен на 20-80% при наличии лейкопении HR= 1,23 (95% ДИ 0,34-лимфопенииHR =1,45 и нейтропения HR= 1,76. Повышенные уровни CRP не были существенно связаны с риском серьезной инфекции, HR= 1.04. Биологическое лечение не было связано с риском серьезных инфекций HR= 1.27 по сравнению с теми, кто не получил биологического лечения. Для расчета % риска используются суммирование коэффициентов, чтобы получить балл для отдельного пациента: счет 1,53 = 5% риска; счет 2,25 = 10% риска; счет 2,69 = 15% риска; счет 3,00 = 20% риска. В таблице 4 перечислены коэффициенты оценки риска. ПРИМЕР: 70-летняя женщина с РА, которая имеет СОЭ 35 мм/час, имеет диабет, принимает преднизон на 15 мг/день, и не было предыдущей серьезной инфекции имеет оценку риска 2,54, что соответствует 10-15% риск развития инфекции в следующем году. Если ее доза преднизона будет снижена до 5 мг/день, ее оценка риска будет 1,81, что соответствует 5-10% риск серьезной инфекции в течение следующего года. Практическая значимость шкалы риска серьезной инфекции на основе Rochester cohort (когорта Рочестер) в том, что в настоящее время существуют руководящие принципы иммунизации, но нет руководящих принципов для идентификации пациентов РА, у которых профилактика может быть полезной. |
ПОЛНЫЙ ТЕКСТ
Development and validation of a risk score for serious infection in patients with rheumatoid arthritis
Cynthia S. Crowson Deana D. Hoganson Patrick D. Fitz‐Gibbon Eric L. Matteson
Впервые опубликовано: 10 Май 2012 Arthritis Rheum2012;64:2847–55.doi:10.1002/art.34530
Аннотация
Цель
Риск инфицирования повышается у пациентов с ревматоидным артритом (РА), и точная оценка риска инфекции может служить основой для принятия клинических решений. Это исследование было проведено для разработки и проверки оценка для прогнозирования 1-летнего риска серьезной инфекции у пациентов с РА.
Методы
Мы изучили популяционную когорту округа Олмстед, штат Миннесота, со случаем РА, который был установлен в 1955-1994 годах, и длительно наблюдались, с помощью полной медицинской документации, до января 2000 года. В состав валидации входили жители со случаем РА, который был установлен в 1995-2007 годах. Измерение исхода включало все серьезные инфекции (требующие госпитализации или внутривенные антибиотики). Потенциальные предикторов были рассмотрены с использованием многовариантных моделей Кокса. Оценка риска оценивалась непосредственно по многовариантной модели, а производительность оценивалась в когорте проверки с использованием статистики C Харрелла.
Результаты
Среди 584 пациентов РА в первоначальной когорте (72% женщин; средний возраст 57,5 лет), за которыми наблюдали в среднем 9,9 лет, 252 имели 1 серьезную инфекцию (646 случаев инфекции). Компоненты оценки риска включали возраст, предыдущую серьезную инфекцию, использование кортикостероидов, повышенную скорость оседания эритроцитов, внеартикулярные проявления РА и сопутствующие заболевания (ишемическая болезнь сердца, сердечная недостаточность, периферические сосудистые заболевания, хронические заболевания легких, сахарный диабет, алкоголизм). Анализ валидации выявил хорошую дискриминацию (c статистика 0.80).
Заключение
Характеристики заболевания РА и сопутствующие заболевания могут быть использованы для точной оценки риска серьезной инфекции у пациентов с РА. Знание риска серьезной инфекции у пациентов РА может повлиять на принятие клинических решений и информировать стратегии по сокращению и предотвращению возникновения этих инфекций.
У пациентов с ревматоидным артритом (РА) увеличилась возрастно-скорректированная смертность от всех причин. Кроме того, высокая частота оппортунистических и распространенных инфекций усложняет РА и частично способствует увеличению смертности. Потенциальные предикторы инфекции в РА, включающие сопутствующие заболевания, симптомы болезни РА и лекарства, были исследованы в предыдущих исследованиях . Однако, другие потенциальные факторы риска инфекции, такие как лимфопения и нейтропения, которые происходят обычно в течение длительного течения болезни, не были оценены в РА. Риск заражения увеличивается за счет группы сопутствующих заболеваний и в дальнейшем зависит от характеристик и лечения заболеваний РА . Оценка риска, которая точно предсказывает риск заражения среди пациентов с РА было бы полезно. Целью данного исследования было разработать и утвердить шкалу для прогнозирования годового риска серьезной инфекции среди пациентов с РА.
Пациенты и методы
Изучение популяции.
Первоначальная когорта состояла из ранее собранной когорты Рочестера cohort of Rochester , штат Миннесота, жителей ≥ 18 лет, которые соответствовали 1987 Американский колледж ревматологии (ACR) критериям РА (применяется ретроспективно, в соответствии с соответствующим) в период с 1 января 1955 года по 31 декабря 1994 года и были продолжены до 1 января 2000 года .Эта когорта была собрана с использованием ресурсов Рочестерский проект эпидемиологии Rochester Epidemiology Project, который является медицинской системы связи записей, которая позволяет получить доступ к полной стационарной и амбулаторной медицинской документации испытуемых от всех поставщиков медицинских услуг в Олмстед Каунти, штат Миннесота, в том числе клиники Майо, Олмстед медицинский центр, их аффилированных больниц, и другие . Для целей развития оценки риска инфекции пациенты были исключены при диагностике рака и пациентов с раком до заболеваемости РА были исключены, в результате чего в общей сложности 584 РА пациентов остались в исследовательской группе. Из-за очень небольшого числа и короткого наблюдения (через 1 января 2000 года), несколько пациентов, которые получили биологические агенты были также были исключены для этого анализа во время начала биологического лечения.
Для проверки оценки риска использовалась вторая когорта. Когорта проверки состояла из 464 жителей округа Олмстед, которые выполнили критерии ACR для РА в период с 1 января 1995 года по 31 декабря 2007 года и были продолжены до 31 декабря 2008 года или до момента миграции из округа Олмстед или смерти, если до 31 декабря 2008 года. Пациенты в этой когорте были также исключены при диагностике рака, и после исключения пациентов с раком до заболеваемости РА, когорты проверки состояли в общей сложности 410 пациентов РА. Эти пациенты не подвергались исключению при начале биологического лечения.
Сбор данных.
В первоначальной когорте полные медицинские записи всех тех, кто РА были ранее рассмотрены обученных медсестры-референты. В когорте проверки сбор данных осуществлялся теми же референтами с использованием тех же определений переменных, которые использовались в исходной когорте. Данные были собраны из полной (стационарной и амбулаторной) медицинской документации. Собранные данные включали демографические характеристики, сопутствующие заболевания, связанные с болезнями переменные и лечение (использование кортикостероидов и болезнь-модифицирующих противоревматических препаратов (DMARDs), перечисленных в таблице 1, и ежедневная доза кортикостероидов). В первоначальной когорте, сбор лабораторных данных включал все измеренные значения частоты скорость оседания эритроцита (ESR), первое появление лейкопении (определяется как количество белых кровяных телец <4,000/ml в 2 и более случаях), и первое появление лимфопения (определяется как количество лимфоцитов в размере <1500/мл в 2 или более случаях). В когорту проверки лабораторные данные включали все измеренные значения ESR, C-реактивного белка (CRP) и лейкоцитов, лимфоцитов и нейтрофилов; были также собраны данные об использовании биологических агентов. Лейкопения была определена как количество белых кровяных телец в размере <3.5 × 109/liter, лимфопения в качестве лимфоцита кол-во от <0.9 × 109/liter, и нейтропении в качестве нейтрофилов в виде нейтрофилов в размере <1.7 × 109/liter. Все показатели клеток крови были выполнены в ходе клинической помощи, в основном для мониторинга лекарствения эффекты, активность болезни, и другие условия (например, анемия). Кроме того, в когорте проверки не требовалось аномальных значений более чем 1 случай, и лейкопения, лимфопения и нейтропения были определены на основе последних значений теста в каждом моменте на протяжении всего последующего наблюдения.
Таблица 1. Потенциальные предикторов, рассматриваемых при разработке оценки риска для серьезной инфекции
|
Этап процесса разработки |
Признанные потенциальные предикторов |
|
Предикторы, включенные в модель серьезного риска заражения, предложенная Doran MF, Crowson CS, Pond GR, O’Fallon WM, Gabriel SE. Predictors of infection in rheumatoid arthritis. Arthritis Rheum 2002; 46: 2294–300. |
Возраст, секс, алкоголизм, история лейкопении, деменции/болезни Альцгеймера, сахарный диабет, хроническое заболевание легких, внеартикулярные проявления ревматоидного артрита (включая амилоидоз, синдром Фелти, ревматоидный васкулит и ревматоидный заболевания легких), ревматоидный фактор, функциональная способность, использование кортикостероидов, взаимодействие между возрастом и сахарным диабетом |
|
Дополнительные предикторы, включенные в модель Доран и соавт. объективно подтверждающие инфекции |
Скорость оседания эритроцитов, ревматоидные узелки |
|
Другие предикторы, рассмотренные Доран и соавт. |
Статус курения, индекс массы тела, лечение болезнь-модифицирующими антиревматическими препаратом (метотрексат, азатиоприн, гидроксихлорохин, сульфасазин, внутримышечное золото, перольное золото, Д-пенилламямин, лефлуномид и циклофосфамид) |
|
Дополнительные предикторы, рассмотренные в первоначальной когорте |
Ишемическая болезнь сердца, сердечная недостаточность, периферических сосудистых заболеваний, наличие большого отека суставов, эрозии / разрушительные изменения визуализирумых радиографией, операции на суставах, продолжительность ревматоидного артрита, календарный год, и предыдущие серьезные инфекции |
|
Дополнительные предикторов, рассмотренные в когорте контроля |
Лейкоциты, лимфоциты, нейтрофилы, уровень с-реактивного белка, биологическое лечение |

В анализ были включены сопутствующие заболевания, такие как хронические заболевания легких и алкоголизм на основе диагностики врача. Ишемическая болезнь сердца определялась как инфаркт миокарда или реваскуляризацию (т. е. шунтирование, чрезкожное коронарное вмешательство). Инфаркты миокарда были классифицированы как определенные или вероятные, на основе наличия сердечной боли, значения биомаркеров, и миннесота электрокардиограммы системы кодирования. Сердечная недостаточность была определена в соответствии с критериями Framingham . Сахарный диабет был определен как по крайней мере 2 измерения глюкозы плазмы натощак в размере 126 мг/дл или 2-часовой плазменный глюкозный значение в размере 200 мг/дл, или четко документированную историю сахарного диабета или лечения гипогликемическими агентами. Оценивались внеартикулярные проявления РА, т.е. амилоидоз, синдром Фельти, ревматоидный васкулит и ревматоидная болезнь легких.
Были собраны данные по всем задокументированным эпизодам инфекции, происходящим после даты заболеваемости РА, как описано ранее. Не были включены незначительные инфекции верхних дыхательных путей и неосложнение инфекций мочевыводящих путей. По каждому эпизоду инфекции была собрана информация о сопровождающей лихорадке, лейкоцитозах и результатах соответствующих исследований, включая микробиологическая культуру и радиологические находки. Также было зарегистрировано, требуется ли инфекция для лечения внутривенными антибиотиками или госпитализации, а также продолжительность пребывания в больнице. Серьезные инфекции были определены как инфекции, требующие госпитализации и/или внутривенного лечения антибиотиками. Объективно подтвержденные инфекции были определены как инфекции с положительными результатами микробиологической культуры и/или радиологической визуализации.
Статистический анализ.
Для обобщения данных использовались описательные статистические данные (средства, пропорции и т.д.). Характеристики, которые были разработаны в ходе последующей деятельности, были обобщены как “всегда” только для описательных целей. Результатом интереса стала серьезная инфекция. Были также обследованы объективно подтвержденные инфекции, однако эти результаты не были зарегистрированы, поскольку большинство серьезных инфекций также были объективно подтверждены, а модели риска этих двух исходов существенно не отличались.
Поскольку нашей целью было предсказать риск заражения в следующем году среди пациентов с РА в любой момент в течение курса болезни, время наблюдения каждого пациента было разделено на интервалы в 1 год. Ковариатные значения оценивались в начале каждого годового интервала. Результатом является по крайней мере 1 серьезное заражение в этом году. Последующие инфекции в том же году не были включены. Использовались модели Андерсен-Гилл Andersen‐Gill, которые являются вариацией моделей Cox, позволяющих включить несколько событий в одного и того же пациента, были использованы. Модель Андерсен-Гилл представляет собой маргинальную модель, в которой предполагается, что общие эффекты для каждого ковариата, а не субъективные эффекты, представляют интерес, и тогда надежная дисперсия исправляет изменчивость учета возможных корреляций внутри пациентов. В этой модели предполагается, что события, происходящие у одного и того же пациента, являются независимыми, то есть базовый риск возникновения последующего события не изменяется, когда у пациента есть событие. В случае инфекции наличие инфекции может увеличить восприимчивость к последующим инфекциям. Для решения этой проблемы мы включили ковариаты для предыдущих инфекций в течение последних 1-3 лет, чтобы обеспечить этот повышенный риск, и мы исключили несколько инфекций, происходящих в том же году, чтобы свести к минимуму эту проблему. Кроме того, были оценены типовые предположения, такие, как предположение о пропорциональных опасностях, и никаких нарушений обнаружено не было.
Построение модели началось с многопеременной модели серьезных инфекций, которую Доран и др.ранее определили с помощью этой когорты (таблица 1). Поскольку результаты объективно подтверждены, и серьезная инфекция были очень похожи, мы рассмотрели предикторов, которые ранее были включены в любой модели, но другие переменные, ранее оцененные в процессе моделирования Дорана, как предполагается, незначительными и не были пересмотрены, чтобы избежать введения предвзятости.
Каждый из дополнительных потенциальных предикторов оценивался индивидуально, чтобы определить, будет ли он значительно добавить (P <0.05) к ранее установленной многовариантной модели (таблица 1). Кроме того, была оценена суточная доза кортикостероидов. Возраст, продолжительность РА, и ESR были также моделированы, используя сглаживание кривых, чтобы нелинейные эффекты, и эти анализы были использованы для информирования выбор точек сокращения для возраста и СОЭ. Оценивались также двусторонние взаимодействия между предикторами в модели. В частности, были проведены оценки взаимодействия с предыдущими инфекциями для определения того, были ли оправданы отдельные модели для прогнозирования риска инфицирования среди пациентов с ранее инфицированными и без предыдущих инфекций, однако существенных взаимодействий обнаружено не было. Общая формула получения оценки риска от модели Кокса
![]()
где S0(t) является базовым уровнем инфекции и свободной в время последующего t т (здесь, т t= 1 год), βi является расчетным коэффициентом регрессии, Xi является значением фактора риска, и р является число факторов риска.
Анализ валидации проводился путем оценки эффективности оценки риска в когорте проверки. Дискриминация, которая заключается в способности точно ранжировать уровни риска для того, чтобы отличить низкий риск от высокого риска, была оценена с использованием статистических данных о соответствии. Для двоичного результата статистика C аналогична области под характеристикой кривой работы приемника. Статистика C колеблется от 0,5 до 1, при этом 0,5 указывает на то, что оценка риска является неинформативной. Этот метод был расширен Harrell для использования в моделях Cox. Калибровка — это способность точно предсказать абсолютный уровень риска. Для оценки калибровки когорта была разделена на децилы deciles, а оценки рисков были составлены рядом с оценками Каплана-Мейера, с тем чтобы можно было визуализировать согласие. Кроме того, для оценки общей калибровки использовались стандартизированные коэффициенты заболеваемости (SIRs), которые представляют собой соотношение наблюдаемых к прогнозируемым событиям. Девяносто пять процентов доверительных интервалов (95% CIS) для SIRs были вычислены исходя из предположения, что наблюдаемое количество событий следует за распределением Пуассона.
Перекалибровка часто необходима, когда оценка риска переводится от одной популяции к другой. Наш рейтинг риска был разработан в один период времени и подтвержден в другом период времени. Поскольку основные риски первой и последующей серьезной инфекции со временем менялись, прогнозируемые риски систематически превышали наблюдаемые риски. Оценка риска была перекалибрована в новую когорту путем изменения базовой скорости инфекции, т.е. S0(t) в уравнении оценки риска выше, и коэффициентов для предыдущих инфекций. Коэффициенты всех других факторов в модели риска были зафиксированы при оценке перекалиброванных коэффициентов.
После перекалибровки в когорте проверки (таблица 1) были оценены несколько потенциальных предикторов, по которым информация отсутствовала в первоначальной когорте. Для каждого ежегодного интервала использовалось самое недавно измеренное значение, и каждый потенциальный предиктор был добавлен к ранее разработанной модели оценки рисков индивидуально для оценки ее потенциальной значимости. Нелинейные эффекты непрерывных переменных были также изучены с помощью сглаживания кривых.
Результаты
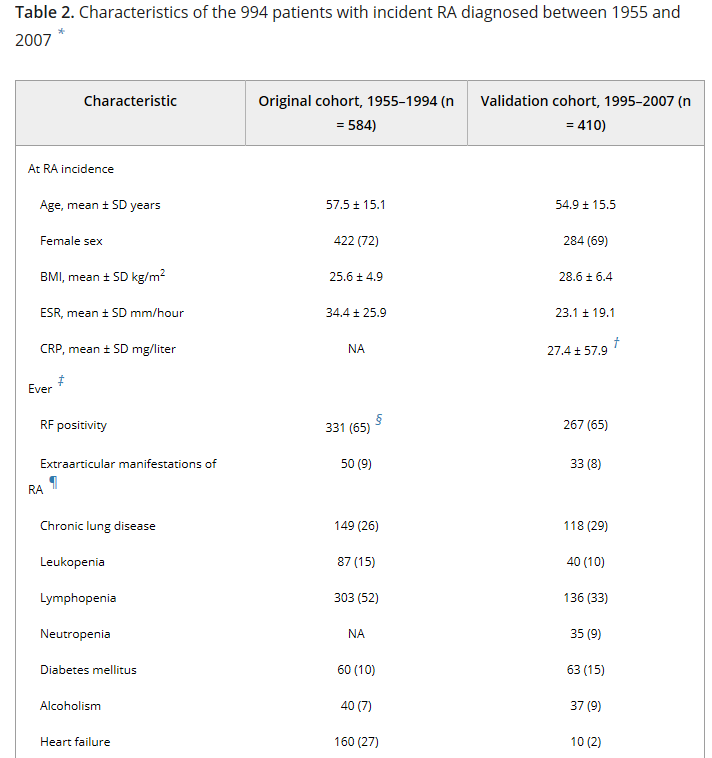
Из 584 пациентов РА в первоначальной когорте (пациенты с диагнозом в 1955-1994 годах) средний возраст составил 57,5 лет, и большинство пациентов (72%) женщины (таблица 2). Средняя продолжительность наблюдения составила 9,9 года (7096 человеко-лет), в течение которых 252 пациента имели 1 серьезную инфекцию (всего 646 инфекций, 491 из которых были использованы в моделях, которые включали только 1 инфекцию на одного пациента в год). В когорты проверки (пациенты с диагнозом в 1995-2007 годах) средний возраст составил 54,9 года, а 69% – женщины. Средняя продолжительность наблюдения составила 5,2 года (2, 292 общего человеко-лет), в течение которых 55 пациентов имели 1 серьезную инфекцию (всего 166 случаев инфицирования; 103 были первой инфекцией в данном году). Характеристики обеих когорт показаны в таблице 2. Из-за разницы в продолжительности наблюдения между когортами, официальные сравнения характеристик не были выполнены.
Таблица 2. Характеристики 994 пациентов со случаем РА, диагностированными между 1955 и 2007 годами.
|
Характеристики |
Оригинальная когорта, 1955-1994 (n = 584) |
Когорта валидации, 1995-2007 (n = 410) |
|
Случаи РА |
||
|
Возраст, средний ± SD лет |
57,5 ± 15,1 |
54,9 ± 15,5 |
|
Женский пол |
422 (72) |
284 (69) |
|
ИМТ, средний± SD кг/м2 |
25,6 ± 4,9 |
28,6 ± 6,4 |
|
СОЭ, среднее ± SD мм/час |
34,4 ± 25,9 |
23.1 ± 19.1 |
|
CRP, среднее ±SD мг/литр |
Na |
27,4 ± 57,9† |
|
Прочие‡ |
||
|
Rf позитивность |
331 (65)§ |
267 (65) |
|
Экстраартикулярные проявления РА¶ |
50 (9) |
33 (8) |
|
Хронические заболевания легких |
149 (26) |
118 (29) |
|
Лейкопения |
87 (15) |
40 (10) |
|
Лимфопения |
303 (52) |
136 (33) |
|
Нейтропения |
Na |
35 (9) |
|
Сахарный диабет |
60 (10) |
63 (15) |
|
Алкоголизм |
40 (7) |
37 (9) |
|
Сердечная недостаточность |
160 (27) |
10 (2) |
|
Заболевания периферических сосудов |
91 (16) |
36 (9) |
|
Ишемическая болезнь сердца |
57 (10) |
25 (6) |
|
Когда-либо применение лекарств‡ |
||
|
Метотрексат |
122 (21) |
263 (64) |
|
Гидроксихлорохин |
214 (37) |
259 (63) |
|
Другие DMARD |
211 (36) |
92 (22) |
|
Кортикостероиды |
250 (43) |
323 (79) |
|
Биологические агенты |
Na |
83 (20) |
|
Продолжительность последующего наблюдения, средняя и SD лет |
14,2 ± 9,5 |
5,6 ± 9,5 |
*За исключением случаев, когда указано в противном случае, значения являются числом (%). ИМТ и индекс массы тела; ESR – скорость оседания эритроцитов; CRP – C-реактивный белок; NA = недоступны или не применимы; RF – ревматоидный фактор; DMARDs = болезнь -модифицирующие антиревматические препараты.
†Данные доступны в 366 (89%) пациентов в когорте проверки.
‡Во время ревматоидного артрита (РА) заболеваемости или во время последующего наблюдения.
- Данные доступны не для всех пациентов.
¶ Амилоидоз, синдром Фелти, ревматоидный васкулит и ревматоидная болезнь легких.
Общий уровень серьезной инфекции в когорте проверки (7,2 на 100 человеко-лет) был значительно ниже, чем в первоначальной когорте (9,1 на 100 человеко-лет) (коэффициент 0,80 (коэффициент 0,80 (95% ДИ 0,69-0,93), P < 0,001), что отражает общее снижение госпитализации, которые произошли в течение этого длительного периода времени. Аналогичным образом, коэффициент первой инфекции был ниже в когорте проверки (2,6 на 100 человеко-лет), чем в первоначальной когорте (3,9 на 100 человеко-лет) (P <0.001). Однако среди тех, кто пережил первую инфекцию, уровень второй инфекции был выше в когорте проверки (36,5 на 100 человеко-лет), чем в первоначальной когорте (13,6 на 100 человеко-лет) (P <0,001).
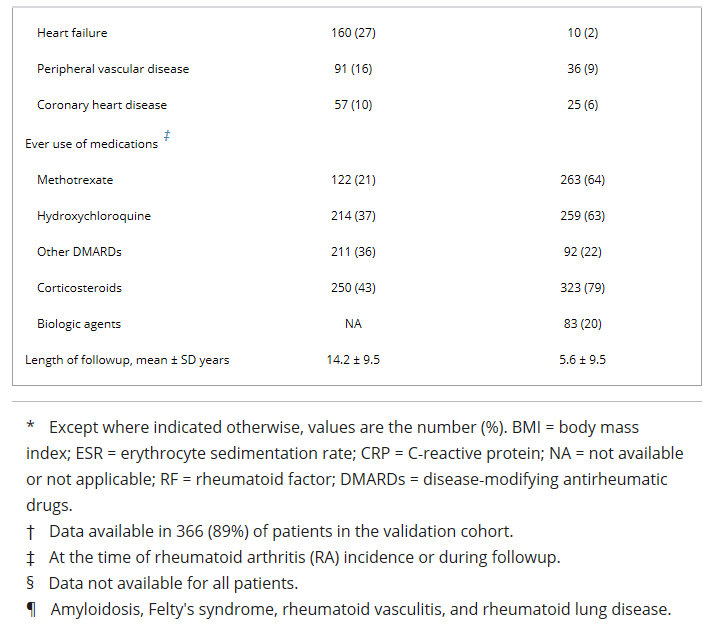
Многолиневая модель для серьезных инфекций была разработана с использованием первоначальной когорты, как описано выше. Эта модель, которая определяет наш балл риска для серьезной инфекции, показана в таблице 3. Повышение возраста было связано с высоким риском инфицирования, с наибольшим риском, выявленным в этих возрастных группах 80 лет (коэффициент опасности (коэффициент риска »HR» 2.36 (95% ДИ 1,71-3,24) по сравнению с пациентами в возрасте <60 лет). Еще одним фактором, признанным сильным предиктором риска инфицирования, была предыдущая серьезная инфекция в прошлом году, с HR 3,48 (95% ДИ 2,67-4,54). Повышенный ESR был также связан с риском заражения, с наибольшим риском, выявленным в тех, с ESR из >50 мм/час (HR 1,84 (95% ДИ 1,45-2,34″). Использование кортикостероидов было зависимо от дозы, связанное с более высоким риском серьезной инфекции. Для использования кортикостероидов в дозах до 10 мг в день эквиваленты преднизону, HR был 1,74 (95% ДИ 1,35-2,24) по сравнению с пациентами, не принимающими кортикостероиды. С ежедневными дозами> 10 мг, HR по сравнению с теми, кто не принимает кортикостероиды увеличилось до 3,60 (95% ДИ 1,90-6,82).
Таблица 3. Многовариантные модели, разработанные в оригинальной когорте и оцениваемые в когорте проверки, для 1-летнего риска серьезной инфекции у пациентов с РА*
|
Предиктор, уровень |
Модель, разработанная в оригинальной когорте, HR (95% CI) |
Модель оценивается в когорте проверки, HR (95% CI) |
|
Возраст |
||
|
6 years |
Референт |
Референт |
|
60 to <80 years |
1.50 (1.15–1.95) |
1.53 (0.98–2.40) |
|
≥80 years |
2.36 (1.71–3.24) |
2.18 (1.21–3.91) |
|
Предыдущая серьезная инфекция |
||
|
Никогда или >3 лет назад |
Референт |
Референт |
|
В прошлом году |
3.48 (2.67–4.54) |
10.13 (6.00–17.12) |
|
За последние 2–3 года |
1.95 (1.45–2.63) |
5.59 (2.69–11.64) |
|
Внеартикулярное проявление РА† |
1.86 (1.33–2.60) |
1.59 (0.88–2.87) |
|
СОЭ |
||
|
<30 мм/ч |
Референт |
Референт |
|
от 30 до≤ 50 мм/час |
1.20 (0.93–1.55) |
1.50 (0.98–2.32) |
|
>50 мм/ч |
1.84 (1.45–2.34) |
1.05 (0.54–2.03) |
|
Доза кортикостероидов |
||
|
Нет |
Референт |
Референт |
|
≤10 мг/день |
1.74 (1.35–2.24) |
2.14 (1.42–3.23) |
|
>10 мг/день |
3.60 (1.90–6.82) |
3.97 (1.79–8.82) |
|
Коморбидность‡ |
||
|
Нет |
Референт |
Референт |
|
1 |
1.96 (1.55–2.49) |
1.25 (0.77–2.05) |
|
1 |
2.79 (2.17–3.58) |
2.67 (1.45–4.90) |
* РА – ревматоидный артрит; HR = hazard ratio коэффициент риска Коэффициент HR; 95% CI = 95% CI = 95% confidence interval доверительный интервал; ESR СОЭ.
†Амилоидоз, синдром Фелти, ревматоидный васкулит и ревматоидные заболевания легких.
‡Сахарный диабет, хронические заболевания легких, алкоголизм, ишемическая болезнь сердца, сердечная недостаточность и периферических сосудистых заболеваний.

Несколько сопутствующих заболеваний были связаны с риском серьезной инфекции, в том числе хронических заболеваний легких (HR 1,56 (95% ДИ 1,24-1,95), с поправкой на все другие предикторы в оценке риска), сахарный диабет (HR 1,35 (HR 1,35/ CI 1,01-1,81), алкоголизм (HR 1,50 -2,16), ишемическая болезнь сердца (HR 1.47 (95% ДИ 1.08-2.01), сердечная недостаточность (HR 1.70 (95% ДИ 1,34–2,16) и периферическая сосудистая болезнь (HR 1.50 (95% ДИ 1.13-2.10). Для упрощения модели, сопутствующие коморбиды были объединены и моделируются как отсутствие сопутствующих состояний, 1 сопутствующих состояний, или >1 коорбидность; Статистика C не изменилась с этим упрощением. Наличие 1 коморбидности было связано с повышенным риском инфекции (HR 1,96; 95% ДИ 1,55, 2,49), с дальнейшим риском, когда было >1 сопутствующих (HR 2,79 »95% ДИ 2,17-3,58).
Когда оценка риска, разработанная с использованием первоначальной когорты, была протестирована в когорте проверки, она показала отличную дискриминацию (C статистика 0,80 (95% ДИ 0,74-0,85). На рисунке 1 показано, что наблюдаемый риск увеличивается по мере увеличения прогнозируемого риска. Однако калибровка оценки риска была плохой в том, что оценка риска предсказала более высокий риск инфицирования, чем наблюдалось, из-за более низкого уровня событий в когорте проверки (103 наблюдаемых серьезных инфекций против 148,0 прогнозируемых инфекций; СЭР 0,70 (95% CI 0,57-0,84″).
Рисунок 1
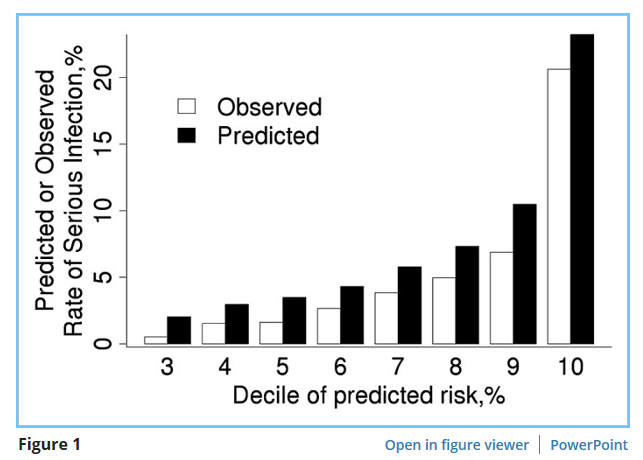
Сравнение прогнозируемого и наблюдаемого 1-летнего риска серьезной инфекции в валидации когорты ревматоидного артрита в соответствии с дециль (Дециль — это числовая характеристика случайной величины, характеризующая десятую часть совокупности)прогнозируемого риска, полученного от нашего риска оценка для серьезных инфекций, разработанных в первоначальной когорты. Наблюдаемые данные о рисках были получены с использованием методов Каплан-Мейер. Прогнозируемый риск был идентичен для пациентов в децилях 1-3; таким образом, бары, показанные для дециля 3 включают все 3 из этих децилей.
Калибровка была дополнительно исследована путем переоборудования модели из первоначальной когорты в когорте проверки (таблица 3). В большинстве случаев коэффициенты в модели, вписанные в когорту проверки, были близки к коэффициентам в первоначальной когорте (т.е. находились в пределах 95% CI в первоначальной модели). Однако некоторые коэффициенты не были статистически значимыми в когорте проверки (например, возраст от 60 до 80 лет, внеартикулярные проявления РА, ESR от 30 до 50 мм/час, и наличие 1 коморбидности) размер или более короткий последующей деятельности этой когорты, которая несколько ограничила статистическую мощность. Были отмечены поразительные различия в коэффициентах для предыдущей инфекции в связи с повышенным риском последующей инфицирования в когорте проверки. Перекалибровка, которая включала замену 1-летней базовой скорости инфекции от первоначальной когорты, т.е. S0(1) и 0,980, с тем из когорты проверки, т.е. S0(1) и 0,989, и изменение коэффициента для предыдущих инфекций, улучшило калибровка оценки риска (SIR 0.96 (95% ДИ 0.78-1.16) и оказала незначительное влияние на дискриминацию (C статистика 0.81 (C статистика 0.85% CI 0.75-0.86)) (рисунок 2).
Рисунок 2
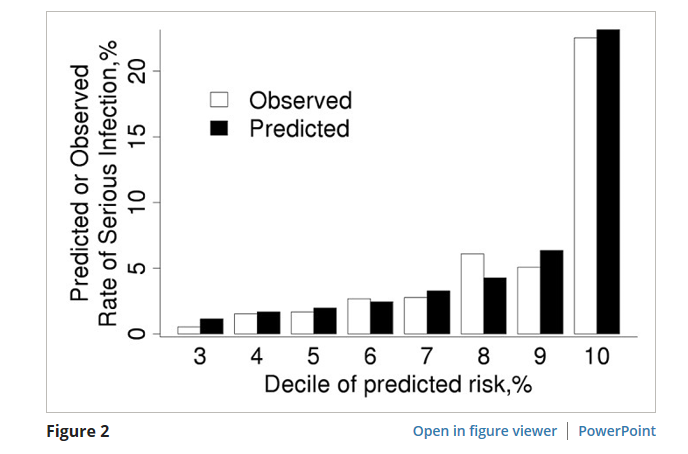
Сравнение прогнозируемого и наблюдаемого 1-летнего риска серьезной инфекции в валидативной когорты ревматоидного артрита в соответствии с децильпрогнозируемого риска, полученного от нашего перекалиброванных баллов для серьезных инфекций. Наблюдаемые данные о рисках были получены с использованием методов Каплан-Мейер. Прогнозируемый риск был идентичен для пациентов в децилях 1-3; таким образом, бары, показанные для дециля 3 включают все 3 из этих децилей.
В когорте проверки были получены данные о нескольких дополнительных факторах риска (напротив, лейкопении, лимфопении, нейтропении, уровня CRP и использования биологических агентов). Каждый из этих потенциальных предикторов был оценен путем добавления его в перекалиброванный рейтинг риска. Риск инфицирования был увеличен на 20-80% при наличии лейкопении (HR 1,23 (95% ДИ 0,34-4,47), лимфопении (HR 1,45 (95% ДИ 0,86-2,43) и нейтропения (HR 1,76 (95% ДИ 0,42-7,37). Однако это увеличение не достигло статистической значимости, вероятно, из-за низкой распространенности аномалий, а также включения предыдущих инфекций в модели оценки риска. Анализ уровня лейкопении, лимфопении и нейтропении, а также нелинейных эффектов не выявил улучшенных связей с риском серьезной инфекции. Аномальные уровни CRP не были существенно связаны с риском серьезной инфекции (HR 1.04 (95% ДИ 0,64-1,67). Аналогичные результаты были замечены для непрерывных (линейных и нелинейных) и лог‐трансформированных значений CRP.
В когорте проверки 20% пациентов лечились биологическими агентами. Большинство (95%) биологических агентов, используемых были антагонисты фактора некроза опухоли. Биологическое лечение не было связано с риском серьезных инфекций (HR 1.27 (95% ДИ 0,76-2,12) по сравнению с теми, кто не получил биологического лечения).
В таблице 4 перечислены коэффициенты оценки риска, которые включают перекалиброванные коэффициенты для предыдущих инфекций и коэффициенты модели, разработанной в первоначальной когорте для всех других факторов риска. Поскольку все пункты в партитуре либо присутствуют, либо отсутствуют, коэффициенты просто добавляются вместе, чтобы получить балл в отдельном пациенте. Чтобы преобразовать балл в процент риска, можно использовать отсечения, указанные в сноске таблицы 4. Например, 70-летняя женщина с РА, которая имеет СОЭ 35 мм/час, имеет диабет, принимает преднизон на 15 мг/день, и не было предыдущей серьезной инфекции имеет оценку риска 2,54, что соответствует 10-15% риск развития инфекции в следующем году. Если ее доза преднизона была снижена до 5 мг/день, ее оценка риска будет 1,81, что соответствует 5-10% риск серьезной инфекции в течение следующего года.
Таблица 4. Оценка риска для 1-летнего риска серьезной инфекции у пациентов с ревматоидным артритом
|
Предиктор, уровень |
Коэффициент |
|
Возраст |
|
|
<60 лет |
0 |
|
От 60 до <80 лет |
0.404 |
|
≥80 лет |
0.857 |
|
Предыдущая серьезная инфекция |
|
|
Никогда или >3 лет назад |
0 |
|
В прошлом году |
2.138 |
|
За последние 2–3 года |
1.670 |
|
Внеартикулярное проявление РА |
0.620 |
|
СОЭ |
|
|
<30 мм/ч |
0 |
|
от 30 до ≤50 мм/час |
0.180 |
|
>50 мм/ч |
0.611 |
|
Доза кортикостероидов |
|
|
Нет |
0 |
|
≤10 мг/день |
0.553 |
|
>10 мг/день |
1.281 |
|
Коморбидность |
|
|
Нет |
0 |
|
1 |
0.675 |
|
1 |
1.024 |
* – годовой риск серьезной инфекции (%) =1-0,989 (exp[A])]) – 100%, где а 0,404 (если возраст от 60 до <80 лет) + 0,857 (если возраст ≥80 лет) +2,138 (если серьезная инфекция в прошлом году) +1,670 (если серьезная инфекция за последние 2-3 года) +0,620 (если экстраартикулярная РА) + 0,180 (если СОЭ от 30 до≤ 50 мм/час) +0,611 (если СОЭ>50 мм/час) + 0,553 (если кортикостероиды≤ 10 мг/ день) +1,281 (если кортикостероиды>10 мг/день) + 0,675 (если 1 коморбидность) + 1,024 (если >1 сопутствующих). Чтобы использовать оценку риска, добавьте коэффициенты для соответствующих элементов, а затем обратитесь к следующим отсечениям: счет 1,53 = 5% риска; счет 2,25 = 10% риска; счет 2,69 = 15% риска; счет 3,00 = 20% риска.


Обсуждения
В этом исследовании мы разработали оценку риска для серьезных инфекций у пациентов с РА, которая включает в себя возраст, сопутствующие заболевания, меры тяжести заболевания РА (например, экстраартикулярной РА) и активность болезни (например, увеличение СОЭ), кортикостероидное лечение, и предыдущие инфекции. Мы расширили знания о факторах риска инфекции, которые были определены ранее в этой когорте РА (8) и показали, что сердечно-сосудистые сопутствующие заболевания также повышают риск инфицирования. Мы подтвердили оценку риска с помощью пациентов, у которых РА разрвился совсем недавно (с 1995 года), и показали, что дискриминация оценки риска была хорошая в когорте проверки.
Хотя признано, что РА связан с повышенным риском заражения, есть несколько оценок риска, чтобы помочь врачам оценить этот риск. Franklin et al создали счет, используя популяцию пациентов с впервые развившимся полиартритом; однако, эта стратегия не может точно предсказать риск у пациентов с заболеванием более длительного времени. Кроме того, оценка риска была основана на многовариантной модели с ограниченным набором предикторов (т.е. история курения, наличие ревматоидного фактора (RF) и использования кортикостероидов), который был менее всеобъемлющим, чем у нас.
В дополнение к характеристикам пациента и заболевания, включенным в наш счет риска, мы изучили влияние лекарств, используемых в лечении РА. В нашем анализе только использование кортикостероидов было связано с повышенным риском инфекции, как было сообщено в нашей и других группах.
Существует противоречивая информация о повышенном риске заражения при традиционной DMARD терапии. В ходе нынешнего исследования были оценены традиционные DMARD, которые не были в значительной степени связаны с риском инфицирования. В нашей первоначальной когорте использование метотрексата не было связано с повышенным риском, в соответствии с результатами других исследований. В отличие от этого Smitten et al обнаружили снижение риска инфицирования, и другие исследователи обнаружили повышенный риск заражения, связанный с использованием метотрексата. В нашей первоначальной когорте цитотоксические препараты (например, циклофосфамид, азатиоприн) были оценены и, как представляется, придают повышенный риск заражения, но эти ассоциации не достигли статистической значимости из-за низкой распространенности использования этих лекарства.
Мы не нашли никаких доказательств повышенного риска серьезной инфекции, связанной с биологической терапией, что согласуется с выводами некоторых авторов. Тем не менее другие авторы отметили повышенный риск серьезной инфекции у пациентов, получающих биологические агенты, однако. Недавняя оценка риска инфекции, выполненная с использованием немецкого регистра биопрепаратов RABBIT (немецкая аббревиатура ревматоидного артрита -Наблюдение биологической терапии) помогла разобраться в этих противоречивых отчетах. Был продемонстрирован повышенный риск инфицирования в течение первого года лечения биологическими агентами, с последующим снижением риска инфицирования в связи с уменьшением активности заболеваний, сокращением сопутствующей использования кортикостероидов и прекращением биологического лечения среди пациентов с высоким риском инфицирования. Низкая распространенность биологического лечения в нашей когорте не позволяла нам проводить детальное обследование отбора пациентов и различных временных эффектов этого лечения; однако выводы, касающиеся воздействия других факторов риска, были схожи между нынешним исследованием и исследованием с использованием.
Другая цель настоящего исследования заключалась в выявлении предсказателей инфекции, которые не были учтены в предыдущем исследовании Doran et al. Лимфопения отмечалась у 80% пациентов в нашей первоначальной когорте в течение периода наблюдения (средний 14 лет), и, возможно, была полезным показателем повышенного риска инфицирования. Однако, лимфопения также может быть связано с предыдущей инфекции или использования кортикостероидов. В то время как лимфопения была умеренно связана с риском серьезной инфекции после корректировки для других предсказателей в нашем оценке риска, ассоциация не достигла статистической значимости. Наше открытие относительно слабой связи между лимфопенией и риском инфекции согласуется с предварительным анализом заболеваемости и смертности в небольшой когорте из 53 пациентов с РА, которые лечились с лимфоцитотоксическим моноклональным антителом alemtuzumab, приводит к длительной терапии индуцированной лимфопении. Данные о результатах, полученные за 12 лет из этой когорты, не выявили увеличения смертности, связанной с инфекцией, или избыточной смертности по сравнению с соответствующими мерами контроля с долгосрочным наблюдением. Возможные объяснения этого отсутствия ассоциации включают иммуносупрессию в других местах (например, лимфатические узлы) или сохранившуюся иммунологическую память.
Несмотря на то, что у нас не было данных о оценках активности болезней (например, DAS28)) , мы смогли оценить меры, отражающие тяжесть РА (например, положительность РФ, ревматоидные узелки, экстраартикулярные проявления РА и ограничение функционального статуса) и маркеров воспаления (например, СОЭ и CRP) в качестве предикторов инфекции. Кроме того, мы смогли продемонстрировать, что сердечно-сосудистые сопутствующие заболевания, которые также были связаны с оценкой тяжести заболевания, связаны с повышенным риском инфицирования. Другие исследователи также сообщили повышенный риск инфекции сердечно-сосудистых сопутствующих заболеваний и с повышенной активностью заболеваний на основе индекса клинической активности болезни и DAS28, у РА пациентов из консорциума ревматологии Исследователи Реестр Северной Америки.
Применение нашего оценки риска в клинике может предупредить врачей о повышенном риске заражения, вызывая повышенную бдительность с последующим наблюдением, обучение ментальных мер по инфекции, а также возможное изменение решений о лечении. На самом деле, количественное увеличение риска инфицирования может помочь в принятии решений в отношении антимикробной профилактики. В настоящее время существуют руководящие принципы иммунизации, но нет руководящих принципов для идентификации пациентов РА, у которых профилактика может быть полезной. Необходимы дальнейшие исследования для определения уровня риска инфицирования, при котором пациенты получают наибольшую пользу от профилактики, и как формальная оценка риска инфекции может повлиять на выбор DMARD, включая биологическая терапия, при РА.
Ограничение в первоначальной когорте было то, что исследуемые пациенты не отражали текущие модели лечения РА, поскольку последующее наблюдение продолжалось только до 2000 года. Когорта проверки включала пациентов с более поздним диагнозом РА, но путаница по показаниям в этом обсервационном исследовании все еще может повлиять на нашу способность делать выводы о влиянии лекарств на риск инфекции. Еще одним ограничением является то, что потенциальные факторы риска с низкой распространенностью ((<5%) будет иметь меньшую вероятность включения в оценку риска из-за ограниченной статистической мощности для выявления связи с инфекцией. Продолжительность наблюдения была короче в нашей когорте проверки, чем в первоначальной когорте. Хотя мы не обнаружили, что продолжительность заболевания связана с риском серьезной инфекции в первоначальной когорте, более короткая продолжительность заболевания в когорте проверки ограничивает время для развития сопутствующих заболеваний, а более низкая распространенность сопутствующих заболеваний может повлиять на нашу способность оценить их влияние в проверке.
Еще одним потенциальным ограничением является ретроспективный характер исследования. Наше определение серьезной инфекции требует госпитализации или внутривенных антибиотиков, и маловероятно, что мы не смогли захватить любой из этих инфекций из-за всеобъемлющего характера ресурсов Рочестерского проекта эпидемиологии. В отличие от этого, некоторые из факторов риска, таких как лимфопения, возможно, были упущены, так как вполне возможно, что некоторые из них, возможно, не обращались за медицинской помощи. Мы считаем, однако, что большинство клинически значимых факторов риска были бы оценены клинически и, следовательно, будут отражены в нашем обширном обзоре медицинских записей. Наконец, большинство населения округа Олмстед белые, что может ограничить обобщаемость результатов исследования.
В заключении, наш счет риска для серьезной инфекции имеет потенциальную клиническую полезность для прогнозирования возникновения инфекции в течение следующего года у пациентов с РА. Проверка этого показателя риска у пациентов с диагнозом РА с 1995 года повысила понимание риска инфицирования у этих пациентов и продемонстрировала отличную эффективность оценки риска. Оценка риска серьезной инфекции у пациентов с РА может повлиять на принятие клинических решений и информировать стратегии по сокращению и предотвращению возникновения этих инфекций.


